3M MDA2LIS96 User manual

Product Instructions
MDA2LIS96
EN FR DE IT ES NL SV DA NO FI PT EL PL RU TR JA ZH ZH TH KO ID
Molecular Detection Assay 2 - Listeria
Kit de détection moléculaire Listeria sp version 2 Molekulare Detektion 2 – Listerien Nachweis Analisi molecolare per il rilevamento della Listeria Ensayo de Detección Molecular 2 para Listeria Moleculair detectie assay 2 Listeria
Molecular Detection Assay 2 - Listeria Molekylær Detektions Analyse 2 Listeria Molekylær deteksjonstest 2 for Listeria Molekyläärinen testisetti 2 - Listeria
Ensaio para Detecção Molecular de Listeria 2
Δοκιμασία Μοριακής Ανίχνευσης Listeria 2
Molekularny test do wykrywania 2 – Listeria
Молекулярный анализ 2 - Listeria
MolekülerTayinTesti Listeri-2
2 -
2 - (Simplified)2 - (Traditional)
2
2 -
Deteksi Molekuler untuk Pengujian Listeria 2
2
Listeria

EN (English)
3 |
Issue Date: 2020-12 |
|
|
|
|
|
|
Product Instructions |
|
Molecular Detection Assay 2 - Listeria |
|
Product Description and Intended Use
3M™ Molecular Detection Assay 2 - Listeria is used with the 3M™ Molecular Detection System for the rapid and specific detection of Listeria species in enriched food and environmental samples.
The 3M™ Molecular Detection Assays use loop-mediated isothermal amplification to rapidly amplify nucleic acid sequences with high specificity and sensitivity, combined with bioluminescence to detect the amplification. Presumptive positive results are reported in real-time while negative results are displayed after the assay is completed. Presumptive positive results should be confirmed using your preferred method or as specified by local regulations(1, 2, 3).
The 3M Molecular Detection Assay 2 - Listeria is intended for use in a laboratory environment by professionals trained in laboratory techniques. 3M has not documented the use of this product in industries other than food or beverage. For
example, 3M has not documented this product for testing water, pharmaceutical, cosmetics, clinical or veterinary samples. The 3M Molecular Detection Assay 2 - Listeria has not been evaluated with all possible testing protocols or with all possible strains of bacteria.
As with all test methods, the source, formulation and qualityof enrichment medium can influence the results. Factors such as sampling methods, testing protocols, sample preparation, handling, and laboratory technique may also influence results. 3M recommends evaluation of the method including enrichment medium, in the user’s environment using a sufficient number of samples with particular foods and/or environmental samples and microbial challenges to ensure that the method meets the user’s criteria. 3M has evaluated the 3M Molecular Detection Assay 2 - Listeria with Demi-Fraser Broth and Fraser Broth containing Ferric Ammonium Citrate. A typical formulation of these media follows below.
Demi-Fraser Broth Base Typical Formula |
(g/L) |
Fraser Broth Base Typical Formula |
(g/L) |
Sodium Chloride |
20 g |
Sodium Chloride |
20 g |
Sodium Phosphate, dibasic, anhydrous* |
9.6 g |
Sodium Phosphate, dibasic, anhydrous* |
9.6 g |
Beef Extract |
5.0 g |
Beef Extract |
5.0 g |
Pancreatic Digest of Casein |
5.0 g |
Pancreatic Digest of Casein |
5.0 g |
Peptic Digest of Animal Tissue |
5.0 g |
Peptic Digest of Animal Tissue |
5.0 g |
Yeast Extract |
5.0 g |
Yeast Extract |
5.0 g |
Lithium Chloride |
3.0 g |
Lithium Chloride |
3.0 g |
Potassium Phosphate, monobasic |
1.35 g |
Potassium Phosphate, monobasic |
1.35 g |
Esculin |
1.0 g |
Esculin |
1.0 g |
Acriflavin HCl |
0.0125 g |
Acriflavin HCl |
0.025 g |
Nalidixic Acid |
0.01 g |
Nalidixic Acid |
0.02 g |
* Substitute: Sodium Phosphate, dibasic, dihydrate |
12.0 g |
|
|
Fraser Broth Supplement
(Ingredients per 10 mL vial. One vial is added to one liter of basal medium.)
Ferric Ammonium Citrate |
0.5 g/10 mL |
Final pH 7.2 ± 0.2 at 25°C |
|
The 3M™ Molecular Detection Instrument is intended for use with samples that have undergone heat treatment during the assay lysis step, which is designed to destroy organisms present in the sample. Samples that have not been properly heat treated during the assay lysis step may be considered a potential biohazard and should NOT be inserted into the 3M Molecular Detection Instrument.
3M Food Safety is certified to ISO (International Organization for Standardization) 9001 for design and manufacturing. The 3M Molecular Detection Assay 2 - Listeria test kit contains 96 tests, described in Table 1.
2

|
|
|
EN |
(English) |
|
Table 1. 3M Molecular Detection Assay Kit Components |
|
|
|||
|
|
|
|
|
|
Item |
Identification |
Quantity |
Contents |
Comments |
|
3M™ Lysis Solution |
Pink solution in clear |
96 (12 strips of |
580 μL of LS per tube |
Racked and ready |
|
(LS) |
tubes |
8 tubes) |
to use |
||
|
|||||
3M™ Molecular |
|
96 (12 strips of |
Lyophilized specific |
|
|
Detection Assay 2 |
Blue tubes |
amplification and |
Ready to use |
||
8 tubes) |
|||||
Listeria Reagent Tubes |
|
detection mix |
|
||
|
|
|
|||
Extra caps |
Blue caps |
96 (12 strips of 8 caps) |
|
Ready to use |
|
|
|
|
|
|
|
3M™ Reagent Control |
|
16 (2 pouches of |
Lyophilized control |
|
|
Clear flip-top tubes |
DNA, amplification |
Ready to use |
|||
(RC) |
|
8 individual tubes) |
and detection mix |
|
|
|
|
|
|
||
|
|
|
|
|
|
Quick Start Guide |
|
1 |
|
|
|
|
|
|
|
|
|
The Negative Control, not provided in the kit, is sterile enrichment medium, e.g., Demi-Fraser Broth. Do not use water as a Negative Control.
Safety
The user should read, understand and follow all safety information in the instructions for the 3M Molecular Detection System and the 3M Molecular Detection Assay 2 - Listeria. Retain the safety instructions for future reference.
 WARNING: Indicates a hazardous situation, which, if not avoided, could result in death or serious injury and/or property damage.
WARNING: Indicates a hazardous situation, which, if not avoided, could result in death or serious injury and/or property damage.
NOTICE: Indicates a potentially hazardous situation which, if not avoided, could result in property damage.
WWARNING
Do not use the 3M Molecular Detection Assay 2 - Listeria in the diagnosis of conditions in humans or animals.
The 3M Molecular Detection Assay 2 - Listeria method may generate Listeria monocytogenes to levels sufficient to cause stillbirths and fatalities in pregnant women and the immunocompromised, if exposed.
The user must train its personnel in current proper testing techniques: for example, Good Laboratory Practices, ISO/IEC 17025(4), or ISO 7218(5).
To reduce the risks associated with a false-negative result leading to the release of contaminated product:
•Follow the protocol and perform the tests exactly as stated in the product instructions.
•Store the 3M Molecular Detection Assay 2 - Listeria as indicated on the package and in the product instructions.
•Always use the 3M Molecular Detection Assay 2 - Listeria by the expiration date.
•Use the 3M Molecular Detection Assay 2 - Listeria for food and environmental samples that have been validated internally or by a third party.
•Use the 3M Molecular Detection Assay 2 - Listeria only for surfaces, sanitizers, protocols and bacterial strains that have been validated internally or by a third party.
•For an environmental sample containing Neutralizing Buffer with aryl sulfonate complex, perform a 1:2 dilution before testing (1 part sample into 1 part sterile enrichment broth). Another option is to transfer 10 µL of the NB enrichment into the 3M Lysis Solution tubes. 3M™ Sample Collection products which include Neutralizing Buffer with aryl sulfonate complex: BPPFV10NB, RS96010NB, RS9604NB, SSL10NB, SSL10NB2G, HS10NB, HS10NB2G and HS2410NB2G.
To reduce the risks associated with exposure to chemicals and biohazards:
•It is strongly recommended that female laboratory staff be informed of the risk to a developing fetus resulting from infection of the mother through exposure to Listeria monocytogenes.
•Perform pathogen testing in a properly equipped laboratory under the control of trained personnel. Incubated enrichment media and equipment or surfaces that have come into contact with incubated enrichment media may contain pathogens at levels sufficient to cause risk to human health.
•Always follow standard laboratory safety practices, including wearing appropriate protective apparel and eye protection while handling reagents and contaminated samples.
•Avoid contact with the contents of the enrichment media and reagent tubes after amplification.
3

EN (English)
•Dispose of enriched samples according to current industry standards.
•Samples that have not been properly heat treated during the assay lysis step may be considered a potential biohazard and should NOT be inserted into the 3M Molecular Detection Instrument.
To reduce the risks associated with cross-contamination while preparing the assay:
• Always wear gloves (to protect the user and prevent introduction of nucleases).
To reduce the risks associated with environmental contamination:
• Follow current industry standards for disposal of contaminated waste.
To reduce the risks associated with exposure to hot liquids:
•Do not exceed the recommended temperature setting on heater.
•Do not exceed the recommended heating time.
•Use an appropriate, calibrated thermometer to verify the 3M™ Molecular Detection Heat Block Insert temperature (e.g., a partial immersion thermometer or digital thermocouple thermometer, not a total immersion thermometer.) The thermometer must be placed in the designated location in the 3M Molecular Detection Heat Block Insert.
NOTICE
To reduce the risks associated with cross-contamination while preparing the assay:
•Change gloves prior to reagent pellet hydration.
•Use of sterile, aerosol barrier (filtered), molecular biology grade pipette tips is recommended.
•Use a new pipette tip for each sample transfer.
•Use Good Laboratory Practices to transfer the sample from the enrichment to the lysis tube. To avoid pipettor contamination, the user may choose to add an intermediate transfer step. For example, the user can transfer each enriched sample into a sterile tube.
•Use a molecular biology workstation containing germicidal lamp where available. Periodically decontaminate laboratory benches and equipment (pipettes, cap/decap tools, etc.) with a 1- 5% (v:v in water) household bleach solution or DNA removal solution.
To reduce the risks associated with a false-positive result:
•Never open reagent tubes post amplification.
•Always dispose of the contaminated tubes by soaking in a 1-5% (v:v in water) household bleach solution or equivalent solution for 1 hour and away from the assay preparation area.
•Never autoclave reagent tubes post amplification.
Consult the Safety Data Sheet for additional information and local regulations for disposal.
If you have questions about specific applications or procedures, please visit our website at www.3M.com/foodsafety or contact your local 3M representative or distributor.
User Responsibility
Users are responsible for familiarizing themselves with product instructions and information. Visit our website at www.3M.com/foodsafety, or contact your local 3M representative or distributor for more information.
When selecting a test method, it is important to recognize that external factors such as sampling methods, testing protocols, sample preparation, handling, and laboratory technique may influence results.
It is the user’s responsibility in selecting any test method or product to evaluate a sufficient number of samples with the appropriate matrices and microbial challenges to satisfy the user that the chosen test method meets the user’s criteria.
It is also the user’s responsibility to determine that any test methods and results meet its customers’ and suppliers’ requirements.
As with any test method, results obtained from use of any 3M Food Safety product do not constitute a guarantee of the quality of the matrices or processes tested.
To help customers evaluate the method for various food matrices, 3M has developed the 3M™ Molecular Detection Matrix Control kit. When needed, use the Matrix Control (MC) to determine if the matrix has the ability to impact the 3M Molecular Detection Assay 2 - Listeria results. Test several samples representative of the matrix, i.e., samples obtained from different origin, during any validation period when adopting the 3M method or when testing new or unknown matrices or matrices that have undergone raw material or process changes.
4

EN (English)
A matrix can be defined as a type of product with intrinsic properties such as composition and process. Differences between matrices may be as simple as the effects caused by differences in their processing or presentation for example, raw vs. pasteurized; fresh vs. dried, etc.
Limitation of Warranties / Limited Remedy
EXCEPT AS EXPRESSLY STATED IN A LIMITED WARRANTY SECTION OF INDIVIDUAL PRODUCT PACKAGING, 3M DISCLAIMS ALL EXPRESS AND IMPLIED WARRANTIES, INCLUDING BUT NOT LIMITED TO, ANY WARRANTIES OF MERCHANTABILITY OR FITNESS FOR A PARTICULAR USE. If any 3M Food Safety Product is defective, 3M or its authorized distributor will, at its option, replace or refund the purchase price of the product. These are your exclusive remedies. You must promptly notify 3M within sixty days of discovery of any suspected defects in a product and return it to 3M. Please call Customer Service (1-800-328-1671 in the U.S.) or your official 3M Food Safety representative for a Returned Goods Authorization.
Limitation of 3M Liability
3M WILL NOT BE LIABLE FOR ANY LOSS OR DAMAGES, WHETHER DIRECT, INDIRECT, SPECIAL, INCIDENTAL OR CONSEQUENTIAL DAMAGES, INCLUDING BUT NOT LIMITED TO LOST PROFITS. In no event shall 3M’s liability under any legal theory exceed the purchase price of the product alleged to be defective.
Storage and Disposal
Store the 3M Molecular Detection Assay 2 - Listeria at 2-8°C. Do not freeze. Keep kit away from light during storage. After opening the kit, check that the foil pouch is undamaged. If the pouch is damaged, do not use. After opening, unused reagent tubes should always be stored in the re-sealable pouch with the desiccant inside to maintain stability of the lyophilized reagents. Store resealed pouches at 2-8°C for no longer than 60 days.
Do not use 3M Molecular Detection Assay 2 - Listeria past the expiration date. Expiration date and lot number are noted on the outside label of the box. After use, the enrichment medium and the 3M Molecular Detection Assay 2 - Listeria tubes can potentially contain pathogenic materials. When testing is complete, follow current industry standards for the disposal of contaminated waste. Consult the Safety Data Sheet for additional information and local regulations for disposal.
Instructions for Use
Follow all instructions carefully. Failure to do so may lead to inaccurate results.
Periodically decontaminate laboratory benches and equipment (pipettes, cap/decap tools, etc.) with a 1- 5% (v:v in water) household bleach solution or DNA removal solution.
The user should complete the 3M Molecular Detection System operator qualification training, as described in the “Installation Qualification (IQ) / Operational Qualification (OQ) Protocols and Instructions for 3M Molecular Detection System” document(6).
See Section “Specific Instructions for validated methods” for specific requirements:
Table 3 for enrichment protocols according to AOAC® Official Method ofAnalysisSM 2016.07 and AOAC® Performance Tested MethodSM Certificate #111501.
Table 4 for enrichment protocols according to NF Validation certificate 3M 01/14-05/16.
Sample Enrichment
Tables 2, 3 or 4 present guidance for the enrichment of food and environmental samples. It is the user’s responsibility to validate alternative sampling protocols or dilution ratios to ensure this test method meets the user’s criteria.
Foods
1.Allow the Demi-Fraser Broth enrichment medium (includes ferric ammonium citrate) to equilibrate to ambient laboratory temperature.
2.Aseptically combine the enrichment medium and sample according to Tables 2, 3 or 4. For all meat and highly particulate samples, the use of filter bags is recommended.
3.Homogenize thoroughly by blending, stomaching, hand mixing for 2 ± 0.2 minutes. Incubate at 37 ± 1°C according to Tables 2, 3 or 4.
4.For raw dairy products (see Tables 2 or 4), transfer 0.1 mL of the primary enrichment into 10 mL of Fraser Broth. Incubate at 37 ± 1°C for 20-24 hours.
5
EN (English)
Environmental Samples
Sample collection devices can be a sponge hydrated with a neutralizing solution to inactivate the effects of the sanitizers. 3M recommends the use of a biocide-free cellulose sponge. Neutralizing solution can be Dey-Engley (D/E) Neutralizing Broth or Letheen Broth. It is recommended to sanitize the area after sampling.
WARNING: Should you select to use Neutralizing Buffer (NB) that contains aryl sulfonate complex as the hydrating solution for the sponge, it is required to perform a 1:2 dilution (1 part sample into 1 part sterile enrichment broth) of the enriched environmental sample before testing in order to reduce the risks associated with a false-negative result leading to the release of contaminated product. Another option is to transfer 10 μL of the neutralizing buffer enrichment into the 3M Lysis Solution tubes.
The recommended size of the sampling area to verify the presence or absence of the pathogen on the surface is at least 100 cm2 (10 cm x 10 cm or 4"x4"). When sampling with a sponge, cover the entire area going in two directions (left to right then up and down) or collect environmental samples following your current sampling protocol or according to the FDA BAM(1), USDA FSIS MLG(2) or ISO 18593(7) guidelines.
1.Allow the Demi-Fraser Broth enrichment medium (includes ferric ammonium citrate) to equilibrate to ambient laboratory temperature.
2.Aseptically combine the enrichment medium and sample according to Tables 2, 3 or 4.
3.Homogenize thoroughly by blending, stomaching, hand mixing or vortexing for 2 ± 0.2 minutes. Incubate at 37 ± 1°C for 24-30 hours according to Tables 2, 3 or 4.
Table 2: General enrichment protocols at 37 ± 1°C using Demi-Fraser Broth(a) and Fraser Broth(a) as needed.
|
|
Enrichment |
Enrichment |
Enrichment |
|
Sample |
Sample |
Broth |
|||
Temperature |
Time |
||||
Matrix |
Size |
Volume |
|||
(± 1°C) |
(hours) |
||||
|
|
(mL) |
|||
|
|
|
|
Heatprocessed, cooked, cured meats, poultry, seafood and fish
Heat- |
|
|
|
|
processed / |
25 g |
225 |
37 |
24-30 |
pasteurized |
||||
dairy products |
|
|
|
|
Produce and |
|
|
|
|
vegetables |
|
|
|
|
Multi- |
|
|
|
|
component |
|
|
|
|
foods |
|
|
|
|
Environmental |
1 sponge |
100 or 225 |
37 |
24-30 |
samples |
1 swab |
10 |
37 |
24-30 |
|
|
|
|
|
Raw meat, |
|
|
|
|
poultry, |
25 g |
475 |
37 |
28-32 |
seafood, fish |
|
|
|
|
6

|
|
|
|
|
|
EN |
(English) |
|
|
|
|
|
|
|
|
|
|
|
|
|
PrimaryEnrichment (Demi-FraserBroth)(a) |
Secondary Enrichment |
|
||||||
|
|
(Fraser Broth)(a) |
|
||||||
|
|
|
|
|
|
Sample |
|||
Sample |
|
|
|
|
|
|
|
||
|
Enrichment |
Enrichment |
Enrichment |
|
Enrichment |
Enrichment |
Analysis |
||
Matrix |
|
|
|||||||
Sample |
Broth |
Sample |
|||||||
|
Temperature |
Time |
Temperature |
Time |
Volume(b) |
||||
|
Size |
Volume |
Size |
|
|||||
|
(± 1°C) |
(hours) |
(± 1°C) |
(hours) |
|
||||
|
|
(mL) |
|
|
|||||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
Transfer |
|
|
|
|
|
|
|
|
|
0.1 mL |
|
|
|
|
Raw dairy |
25 g |
225 |
37 |
20-24 |
into |
37 |
20-24 |
10 μL |
|
products |
10 mL |
||||||||
|
|
|
|
|
|
|
|||
|
|
|
|
|
Fraser |
|
|
|
|
|
|
|
|
|
Broth |
|
|
|
|
(a)Demi-Fraser and Fraser Broth should always be supplemented with Fraser Broth Supplement (ferric ammonium citrate) during primary or secondary enrichment.
(b)Volume of enriched sample transferred to the 3M Lysis Solution tubes. Refer to Step 4.6 of Lysis section.
Specific Instructions forValidated Methods
AOAC® Official MethodSM 2016.07
AOAC® Performance Tested MethodSM #111501
In AOAC Research Institute OMASM and PTMSM programs, the 3M Molecular Detection Assay 2 – Listeria was found to be an effective method for the detection of Listeria species. The matrices tested in the study are shown in Table 3.
Table 3. Enrichment protocols using Demi-Fraser Broth(a) at 37 ± 1 °C according to AOAC OMASM 2016.07 and AOAC PTMSM Certificate #111501.
Sample Matrix
Beef hot dogs, queso fresco, vanilla ice cream, 4% milk fat cottage cheese, 3% chocolate whole milk, romaine lettuce, bagged raw spinach, cold smoked salmon
Raw chicken
Deli turkey
Cantaloupe(b)
| <![if ! IE]> <![endif]>Environmental samples: |
Stainless steel |
|
Sealed concrete |
||
|
||
|
Plastic(c) |
|
|
|
Sample Size |
Enrichment BrothVolume (mL) |
Enrichment Time |
|
(hours) |
|||
|
|
||
25 g |
225 |
24-30 |
|
25 g |
475 |
28-32 |
|
125 g |
1125 |
24-30 |
|
Whole melon |
Enough volume to allow melon to float |
26-30 |
|
1 sponge |
225 |
24-30 |
|
1 sponge |
100 |
24-30 |
|
1 swab |
10 |
24-30 |
|
|
|
|
All samples for the AOAC validation were homogenized by stomaching unless otherwise noted.
(a)Demi-Fraser and Fraser Broth should always be supplemented with Fraser Broth Supplement (ferric ammonium citrate) during primary or secondary enrichment.
(b)Homogenize sample by hand mixing.
(c)Homogenize sample by vortexing.
7

EN (English)
NFValidation byAFNOR Certification
3M 01/14-05/16
ALTERNATIVE ANALYTICAL METHODS FOR AGRIBUSINESS http://nf-validation.afnor.org/en
For more information about end of validity, please refer to NF VALIDATION certificate available on the website mentioned above.
NFVALIDATION certified method in compliance with ISO 16140-2(8) in comparison to ISO 11290-1(3)
Scope of the validation: All human food and environmental samples (excluding primary production samples) Sample preparation: Samples should be prepared according to ISO 11290-1(3) and ISO 6887(9)
Software version: See certificate
Table 4. Enrichment protocols according to NF VALIDATION certified method 3M 01/14-05/16 at 37 ± 1 °C using Demi-Fraser Broth(a) and Fraser Broth(a) as needed.
General |
Sample |
Enrichment |
Enrichment |
Enrichment |
Sample |
|
Accepted |
|
Broth |
Temperature |
Time |
Analysis |
Interruption |
||||
Protocol |
Size |
Volume |
||||||
(± 1°C) |
(hours) |
Volume(b) |
|
Point |
||||
|
|
(mL) |
|
|||||
|
|
|
|
|
|
|
||
All food |
|
|
|
|
|
• |
Demi- |
|
samples |
|
|
|
|
|
|
Fraser |
|
(excepted |
|
|
|
|
|
|
Broth |
|
raw |
|
|
|
|
|
|
up to 72 |
|
meats, |
25 g |
225 |
37 |
24-30 |
20 µL |
|
hours |
|
raw |
• |
Lysate at |
||||||
|
|
|
|
|
||||
seafood |
|
|
|
|
|
|
-20°C |
|
and raw |
|
|
|
|
|
• |
Lysate at |
|
dairy |
|
|
|
|
|
|
4°C up to |
|
products) |
|
|
|
|
|
|
72 hours |
|
Environ- |
25 g, 1 |
|
|
|
|
|
|
|
swab, |
|
|
|
|
• |
Lysate at |
||
mental |
225 |
37 |
24-30 |
20 µL |
||||
or 1 |
|
-20°C |
||||||
samples |
|
|
|
|
|
|||
wipe |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
Specific |
|
Enrichment |
Enrichment |
Enrichment |
Sample |
|
Accepted |
|
Protocol |
Sample |
Broth |
Temperature |
Time |
Analysis |
Interruption |
||
1 |
Size |
Volume |
(± 1°C) |
(hours) |
Volume(b) |
|
Point |
|
|
(mL) |
|
||||||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
• |
Demi- |
|
|
|
|
|
|
|
|
Fraser |
|
|
|
|
|
|
|
|
Broth |
|
Raw |
|
|
|
|
|
|
up to 72 |
|
meats |
25 g |
475 |
37 |
28-32 |
20 µL |
|
hours |
|
and raw |
• |
Lysate at |
||||||
|
|
|
|
|
||||
seafood |
|
|
|
|
|
|
-20°C |
|
|
|
|
|
|
|
• |
Lysate at |
|
|
|
|
|
|
|
|
4°C up to |
|
|
|
|
|
|
|
|
72 hours |
|
8

|
|
|
|
|
|
|
EN |
(English) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
PrimaryEnrichment(Demi-FraserBroth)(a) |
SecondaryEnrichment (FraserBroth)(a) |
|
|
||||||
Specific |
|
|
|
|
|
|
|
|
Accepted |
|
|
Enrichment |
Enrichment |
Enrichment |
|
Enrichment |
Enrichment |
Sample |
|||
Protocol |
|
|
Interrup- |
|||||||
Sample |
Broth |
Sample |
Analysis |
|||||||
2 |
Size |
Volume |
Temperature |
Time |
Size |
Temperature |
Time |
Volume(b) |
tion Point |
|
(± 1°C) |
(hours) |
(± 1°C) |
(hours) |
|||||||
|
|
(mL) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
• |
Fraser |
|
|
|
|
|
Transfer |
|
|
|
|
Broth |
Raw |
|
|
|
|
0.1 mL |
|
|
|
|
up |
|
|
|
|
into |
|
|
|
|
to 72 |
|
dairy |
25 g |
225 |
37 |
20-24 |
37 |
20-24 |
10 µL |
|
||
10 mL |
|
hours |
||||||||
products |
|
|
|
|
|
|
|
|
||
|
|
|
|
Fraser |
|
|
|
• |
Lysate |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
Broth |
|
|
|
|
at |
|
|
|
|
|
|
|
|
|
|
-20°C |
|
|
|
|
|
|
|
|
|
|
|
(a)Demi-Fraser and Fraser Broth should always be supplemented with Fraser Broth Supplement (ferric ammonium citrate) during primary or secondary enrichment.
(b)Volume of enriched sample transferred to the 3M Lysis Solution tubes. Refer to Step 4.6 of Lysis section.
Note: Samples larger than 25 g have not been tested in the NF validation study.
Preparation of the 3M™ Molecular Detection Speed Loader Tray
1.Wet a cloth with a 1-5% (v:v in water) household bleach solution or equivalent solution and wipe the 3M™ Molecular Detection Speed Loader Tray.
2.Rinse the 3M Molecular Detection Speed Loader Tray with water.
3.Use a disposable towel to wipe the 3M Molecular Detection Speed Loader Tray dry.
4.Ensure the 3M Molecular Detection Speed Loader Tray is dry before use.
Preparation of the 3M™ Molecular Detection Chill Block Insert
Place the 3M™ Molecular Detection Chill Block directly on the laboratory bench. Use the chill block at ambient laboratory temperature (20-25°C).
Preparation of the 3M™ Molecular Detection Heat Block Insert
Place the 3M™ Molecular Detection Heat Block Insert in a dry double block heater unit. Turn on the dry block heater unit and set the temperature to allow the 3M Molecular Detection Heat Block Insert to reach and maintain a temperature of 100 ± 1°C.
Note: Depending on the heater unit, allow approximately 30 minutes for the 3M Molecular Detection Heat Block Insert to reach temperature. Using an appropriate, calibrated thermometer (e.g., a partial immersion thermometer or digital thermocouple thermometer, not a total immersion thermometer) placed in the designated location, verify that the 3M Molecular Detection Heat Block Insert is at 100 ± 1°C.
Preparation of the 3M™ Molecular Detection Instrument
1.Launch the 3M™ Molecular Detection System Software and log in. Contact your 3M Food Safety representative to ensure you have the most updated version of the software.
2.Turn on the 3M Molecular Detection Instrument.
3.Create or edit a run with data for each sample. Refer to the 3M Molecular Detection System User Manual for details.
Note: The 3M Molecular Detection Instrument must reach Ready State before inserting the 3M Molecular Detection Speed Loader Tray with reaction tubes. This heating step takes approximately 20 minutes and is indicated by an ORANGE light on the instrument’s status bar. When the instrument is ready to start a run, the status bar will turn GREEN.
Lysis
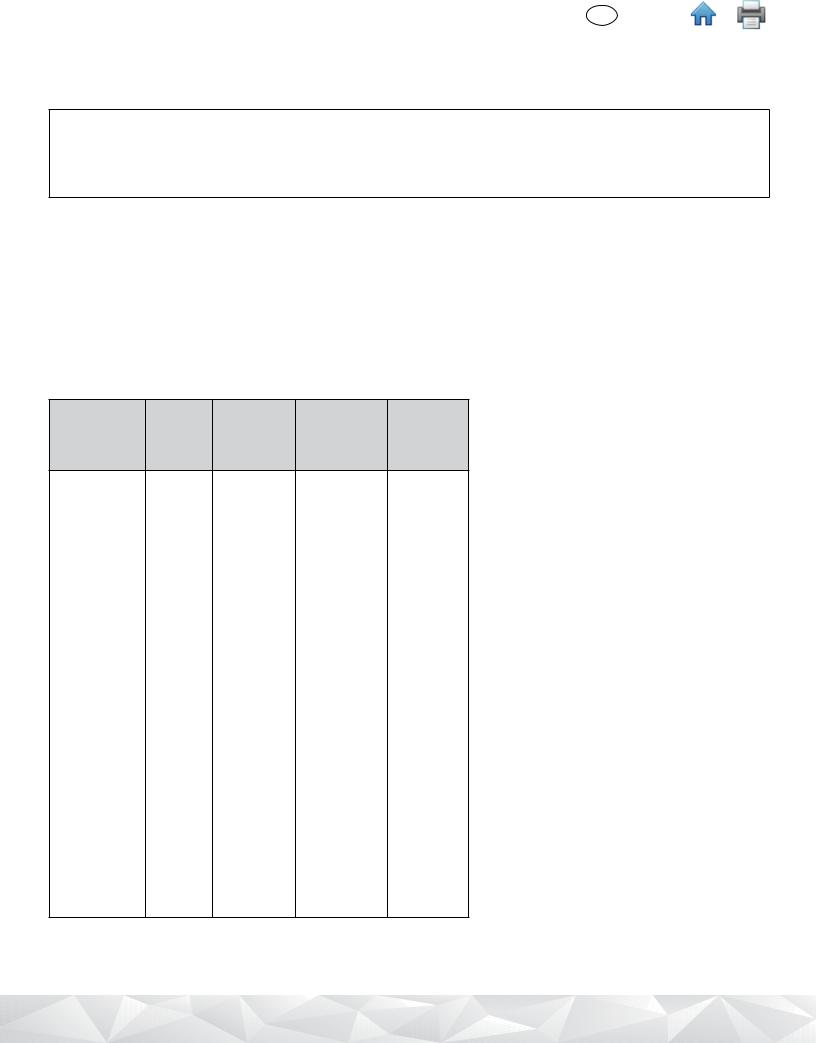
Remove the bottom of 3M Lysis Solution Rack with a screwdriver or spatula before placing in the 3M Molecular Detection Heat Block Insert.
9
EN (English)
1.Allow the 3M Lysis Solution tubes to warm up by setting the rack at room temperature (20-25°C) overnight (16-18 hours). Alternatives to equilibrate the 3M Lysis Solution tubes to room temperature are to set the 3M Lysis Solution tubes on the laboratory bench for at least 2 hours, incubate the 3M Lysis Solution tubes in a 37 ± 1°C incubator for 1 hour or place them in a dry double block heater for 30 seconds at 100 ± 1°C.
2.Invert the capped tubes to mix. Proceed to next step within 4 hours.
3.Remove the enrichment broth from the incubator.
4.One 3M Lysis Solution tube is required for each sample and the Negative Control (NC) sample (sterile enrichment medium).
4.13M Lysis Solution tube strips can be cut to desired 3M Lysis Solution tube number. Select the number of individual 3M Lysis Solution tubes or 8-tube strips needed. Place the 3M Lysis Solution tubes in an empty rack.
4.2To avoid cross-contamination, decap one 3M Lysis Solution tube strip at a time and use a new pipette tip for each transfer step.
4.3Transfer enriched sample to 3M Lysis Solution tubes as described below:
Transfer each enriched sample into an individual 3M Lysis Solution tube first. Transfer the NC last.
4.4Use the 3M™ Molecular Detection Cap/Decap Tool-Lysis to decap one 3M Lysis Solution tube strip - one strip at a time.
4.5Discard the 3M Lysis Solution tube cap – if lysate will be retained for retest, place the caps into a clean container for re-application after lysis.
4.5.1 For processing of retained lysate, see Appendix A.
4.6Transfer 20 µL of sample into a 3M Lysis Solution tube unless otherwise indicated in protocols from Tables 2, 3 or 4 (e.g., raw dairy products or when using environmental samples with neutralizing buffer use 10 µL).
20 µl
5.Repeat step 4.4 to 4.6 until each individual sample has been added to a corresponding 3M Lysis Solution tube in the strip.
6.When all samples have been transferred, transfer 20 µL of NC (sterile enrichment medium, e.g., Demi-Fraser Broth) into a 3M Lysis Solution tube. Do not use water as a NC.
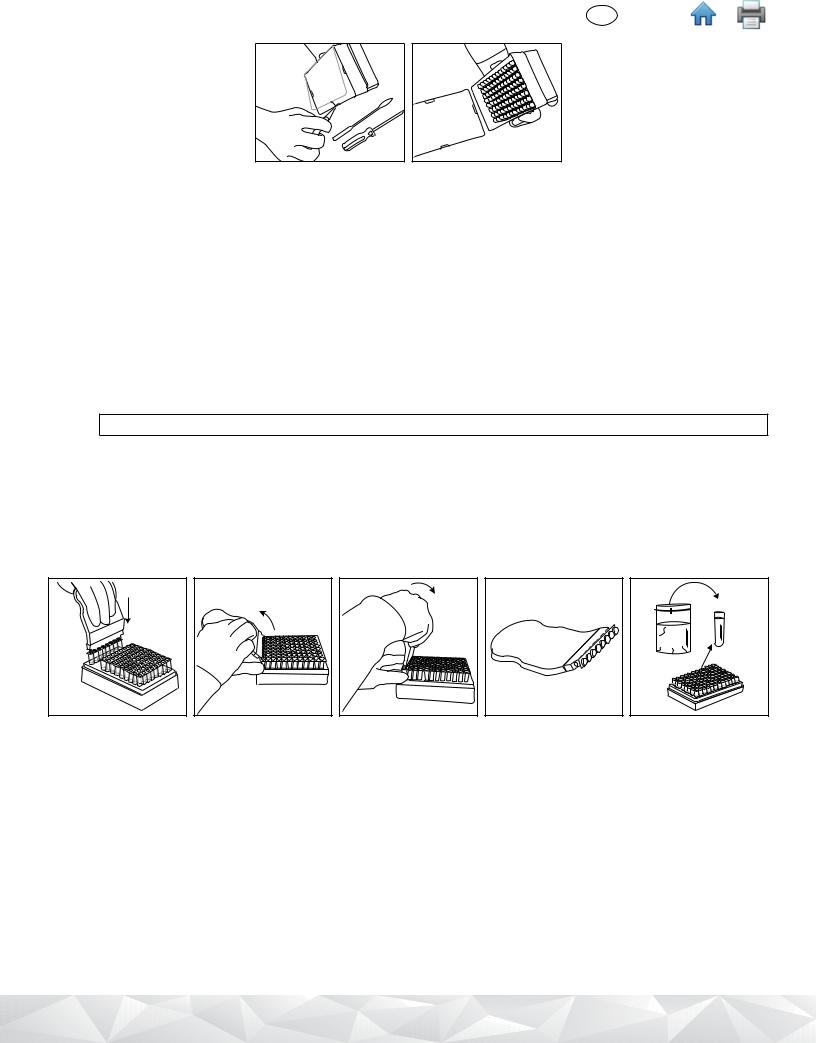
7.Verify that the temperature of the 3M Molecular Detection Heat Block Insert is at 100 ± 1°C.
8.Place the uncovered rack of 3M Lysis Solution tubes in the 3M Molecular Detection Heat Block Insert and heat for 15 ± 1 minutes. During heating, the 3M Lysis Solution will change from pink (cool) to yellow (hot).
8.1Samples that have not been properly heat treated during the assay lysis step may be considered a potential biohazard and should NOT be inserted into the 3M Molecular Detection Instrument.
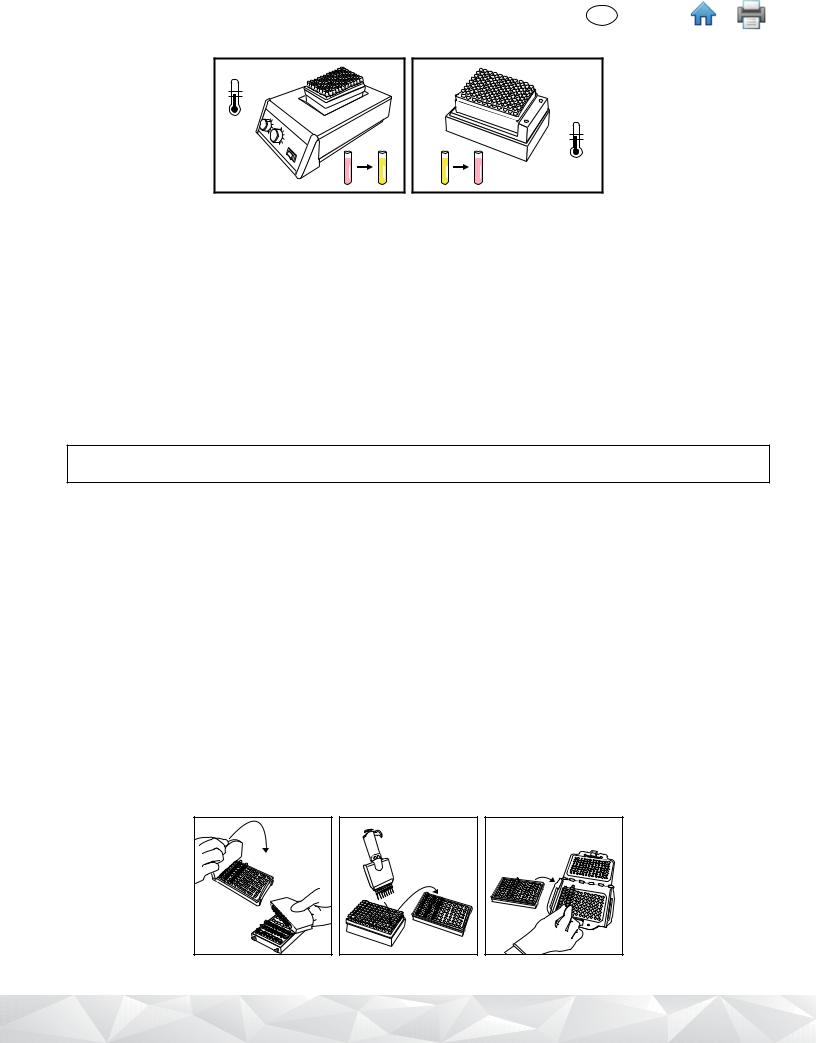
9.Remove the uncovered rack of 3M Lysis Solution tubes from the heating block and allow to cool in the 3M Molecular Detection Chill Block Insert at least 5 minutes and a maximum of 10 minutes. The 3M Molecular Detection Chill Block Insert used at ambient temperature should sit directly on the laboratory bench. When cool, the lysis solution will revert to a pink color.
10
EN (English)
10. Remove the rack of 3M Lysis Solution tubes from the 3M Molecular Detection Chill Block Insert.
00:15:00 |
99-101ºC |
20-25ºC
00:05:00
Amplification
1.One 3M Molecular Detection Assay 2 – Listeria Reagent Tube is required for each sample and the NC.
1.1Reagent tube strips can be cut to desired tube number. Select the number of individual 3M Molecular Detection Assay 2 – Listeria Reagent Tubes or 8-tube strips needed.
1.2Place 3M Molecular Detection Assay 2 – Listeria Reagent Tubes in an empty rack.
1.3Avoid disturbing the reagent pellets from the bottom of the tubes.
2.Select one 3M Reagent Control (RC) tube and place in rack.
3.To avoid cross-contamination, decap one 3M Molecular Detection Assay 2 – Listeria Reagent Tube strip at a time and use a new pipette tip for each transfer step.
4.Transfer lysate to 3M Molecular Detection Assay 2 – Listeria Reagent Tubes and 3M Reagent Control tube as described below:
Transfer each sample lysate into individual 3M Molecular Detection Assay 2 – Listeria Reagent Tubes first followed by the NC. Hydrate the RC tube last.
5.Use the 3M™ Molecular Detection Cap/Decap Tool-Reagent to decap the 3M Molecular Detection Assay 2 – Listeria Reagent Tubes –one Reagent tube strip at a time. Discard cap.
5.1Transfer 20 µLof sample lysate from the upper 1/2 ofthe liquid (avoid precipitate) in the 3M Lysis Solution tube into corresponding 3M Molecular Detection Assay 2 – Listeria ReagentTube. Dispense at an angle to avoid disturbing the pellets. Mix bygentlypipetting up and down 5 times.
5.2Repeat step 5.1 until individual sample lysate has been added to a corresponding 3M Molecular Detection Assay 2 – Listeria Reagent Tube in the strip.
5.3Cover the 3M Molecular Detection Assay 2 – Listeria Reagent Tubes with the provided extra caps and use the rounded side of the 3M Molecular Detection Cap/Decap Tool-Reagent to apply pressure in a back and forth motion ensuring that the cap is tightly applied.
5.4Repeat steps 5.1 and 5.3 as needed, for the number of samples to be tested.
5.5When all sample lysates have been transferred, repeat steps 5.1 and 5.3 to transfer 20 µL of NC lysate into a 3M Molecular Detection Assay 2 – Listeria Reagent Tube.
5.6Transfer 20 µL of NC lysate into a 3M Reagent Control tube. Dispense at an angle to avoid disturbing the pellets. Mix by gently pipetting up and down 5 times.
6.Load capped tubes into a clean and decontaminated 3M Molecular Detection Speed Loader Tray. Close and latch the 3M Molecular Detection Speed Loader Tray lid.
20 µL |
11

EN (English)
7.Review and confirm the configured run in the 3M Molecular Detection System Software.
8.Click the Start button in the software and select instrument for use. The selected instrument’s lid automatically opens.
9.Place the 3M Molecular Detection Speed Loader Tray into the 3M Molecular Detection Instrument and close the lid to start the assay. Results are provided within 75 minutes, although positives may be detected sooner.
10.After the assay is complete, remove the 3M Molecular Detection Speed Loader Tray from the 3M Molecular Detection Instrument and dispose of the tubes by soaking in a 1-5% (v:v in water) household bleach solution or equivalent solution for 1 hour and away from the assay preparation area.
NOTICE: To minimize the risk of false positives due to cross-contamination, never open 3M Molecular Detection Assay 2 – Listeria Reagent Tubes containing amplified DNA. This includes 3M Molecular Detection Assay 2 – Listeria Reagent Tubes, 3M Reagent Control and 3M Molecular Detection Matrix Control tubes. Always dispose of sealed reagent tubes by soaking in a 1-5% (v:v in water) household bleach solution or equivalent solution for 1 hour and away from the assay preparation area.
Results and Interpretation
An algorithm interprets the light output curve resulting from the detection of the nucleic acid amplification. Results are analyzed automatically by the software and are color-coded based on the result. A Positive or Negative result is determined by analysis of a number of unique curve parameters. Presumptive positive results are reported in real-time while Negative and Inspect results will be displayed after the run is completed.
Presumptive positive samples should be confirmed as per the laboratory standard operating procedures or by following the appropriate reference method confirmation(1, 2, 3), beginning with transfer from the primary enrichment to secondary enrichment broth (if applicable), followed by subsequent plating and confirmation of isolates using appropriate biochemical and serological methods.
NOTE: Even a negative sample will not give a zero reading as the system and 3M Molecular Detection Assay 2 - Listeria amplification reagents have a “background” relative light unit (RLU) reading.
In the rare event of any unusual light output, the algorithm labels this as “Inspect.” 3M recommends the user to repeat the assay for any Inspect samples. If the result continues to be Inspect, proceed to confirmation test using your preferred method or as specified by local regulations.
Table 5: Result symbols for samples and interpretation as provided by the 3M Molecular Detection System Software.
Well Type |
Well Result Symbol |
Result |
Interpretation |
||
Sample |
|
|
|
Positive |
The sample is presumptive positive for the target pathogen. |
|
|
|
|
||
|
|
|
|
|
|
Sample |
|
|
|
Negative |
The sample is negative for the target pathogen. |
|
|
|
|
||
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
The sample matrix was inhibitory to the assay. A re-test may be |
Sample |
|
|
|
Inhibited |
required. Refer to the troubleshooting section and the assay kit |
|
|
|
|
|
Product Instructions for more information. |
|
|
|
|
|
The presence or absence of the target pathogen was indeterminate. |
Sample |
|
|
|
Inspect |
A re-test may be required. Refer to the troubleshooting section and |
|
|
|
|
|
the assay kit Product Instructions for more information. |
|
|
|
|
|
No bioluminescence was detected. A re-test may be required. |
Sample |
|
|
|
Error |
Refer to the troubleshooting section and the assay kit Product |
|
|
|
|
|
Instructions for more information. |
Confirmation of ResultsAccording to the NFVALIDATION Certified Method
In the context of the NF VALIDATION, all samples identified as positive by the 3M Molecular Detection Assay 2 - Listeria must be confirmed by one of the following tests:
Option 1: Using the ISO 11290-1(3) standard starting from Demi-Fraser enrichment.
Option 2: By isolation on PALCAM agar or on chromogenic agar forming part of a NF VALIDATION certified method for detection of the Listeria genus. The presence of characteristic colonies is sufficient to confirm the presence of Listeria spp.
Option 3: Using nucleic acid probes as described in ISO 7218(5) standard, performed on isolated colonies, from selective agar (see Options 1 or 2).
12

EN (English)
Option 4: Using any other method certified NF VALIDATION, the principle of which must be different from 3M Molecular Detection Assay 2 – Listeria. The complete protocol described for this second validated method must be used. All steps prior to the start of confirmation must be common to both methods.
In the event of discordant results (presumptive positive with the 3M Molecular Detection Assay 2 – Listeria, non-confirmed by one of the means described above) the laboratory must follow the necessary steps to ensure the validity of the results obtained.
If you have questions about specific applications or procedures, please visit our website at www.3M.com/foodsafety or contact your local 3M representative or distributor.
AppendixA. Protocol Interruption: Storage and re-testing ofheat-treated lysates.The storage oflysates at 2to 8°C for 72 hours does not applyto dairyand environmental samples.
1.To store a heat-treated lysate, re-cap the lysis tube with a clean cap (see “LYSIS”, 4.5)
2.Store at 2 to 8°C for up to 72 hours.
3.Prepare a stored sample for amplification by inverting 2-3 times to mix.
4.Decap the tubes.
5.Place the mixed lysate tubes on 3M Molecular Detection Heat Block Insert and heat at 100 ± 1°C for 5 ± 1 minutes.
6.Remove the rack of 3M Lysis Solution tubes from the heating block and allow to cool in the 3M Molecular Detection Chill Block Insert at least 5 minutes and a maximum of 10 minutes.
7.Continue the protocol at the ‘Amplification’ section detailed above.
References:
1.US Food and Drug Administration Bacteriological Analytical Manual. Chapter 10: Detection of Listeria monocytogenes in foods and environmental samples, and enumeration of Listeria monocytogenes in foods. October 31, 2017.
2.US Department of Agriculture (USDA) FSIS Microbiology Laboratory Guidebook 8.11. Isolation and identification of Listeria monocytogenes from red meat, poultry, ready-to-eat siluriformes (fish) and egg products, and environmental samples. January 2, 2019.
3.NF EN ISO 11290-1. Microbiology of the food chain – Horizontal method for the detection and enumeration of Listeria monocytogenes and of Listeria spp. – Part 1: Detection method.
4.NF EN ISO/IEC 17025. General requirements for the competence of testing and calibration laboratories.
5.NF EN ISO 7218. Microbiology of food and animal feeding stuffs – General requirements and guidance for microbiological examinations.
6.3M Installation Qualification (IQ) / Operational Qualification (OQ) Protocols and Instructions for 3M Molecular Detection System.
7.NF EN ISO 18593. Microbiology of the food chain – Horizontal methods for surface sampling.
8.NF EN ISO 16140-2 Microbiology of the food chain – Method validation – Part 2: Protocol for the validation of alternative (proprietary) methods against a reference method.
9.NF EN ISO 6887. Microbiology of the food chain – Preparation of test samples, initial suspension and decimal dilutions for microbiological examination.
Explanation of Product Label Symbols
www.3M.com/foodsafety/symbols
13

3M Food Safety
3M United States |
3M Europe and MEA |
3MAsiaPacific |
3M Center |
3M Deutschland GmbH |
No 1, Yishun Avenue 7 |
Bldg. 275-5W-05 |
Carl-Schurz - Strasse 1 |
Singapore, 768923 |
St. Paul, MN 55144-1000 |
D41453 Neuss/Germany |
65-64508869 |
USA |
+49-2131-14-3000 |
3M Japan |
1-800-328-6553 |
3M United Kingdom PLC |
|
|
3M Health Care Limited |
|
3M Canada |
Morley Street, |
6-7-29, Kita-Shinagawa |
Post Office Box 5757 |
Loughborough |
Shinagawa-ku, Tokyo |
London, Ontario N6A 4T1 |
Leicestershire |
141-8684 Japan |
Canada |
LE11 1EP |
81-570-011-321 |
1-800-563-2921 |
United Kingdom |
|
|
+(44) 1509 611 611 |
3M Australia |
3M Latin America |
3M Österreich GmbH |
Bldg A, 1 Rivett Road |
3M Center |
North Ryde, NSW 2113 |
|
Bldg. 275-5W-05 |
Euro Plaza |
Australia |
St. Paul, MN 55144-1000 |
Gebäude J, A-1120 Wien |
61 1300 363 878 |
USA |
Kranichberggasse 4 |
|
1-954-340-8263 |
Austria |
|
+(43) 1 86 686-0 |
|
|
|
|
|
3M is a trademark of 3M. Used under license in Canada. |
|
© 2020, 3M. Unauthorized use prohibited. All rights reserved. |
3M Company |
3M est une marque de commerce de la Compagnie 3M. |
2510 Conway Ave |
Utilisées sous licence au Canada. © 2020, 3M. Toute utilisation non |
St. Paul, MN 55144 USA |
autorisée est interdite. Tous droits réservés. |
www.3M.com/foodsafety |
34-8726-1409-3 |

FR (Français)
3 |
Date de parution : 2020-12 |
|
|
|
|
|
|
Instructions relatives au produit |
|
Kit de détection moléculaire Listeria sp version 2 |
|
Description et utilisation du produit
Le Kit de détection moléculaire Listeria sp 3M™ version 2 s’utilise avec le Système de détection moléculaire
3M™ afin de détecter de manière rapide et spécifique la présence d’espèces de Listeria dans les aliments enrichis et les échantillons environnementaux.
Les Kits de détection moléculaire 3M™ utilisent la technique LAMP (loop-mediated isothermal amplification – amplification isotherme médiée par des boucles) afin d’amplifier rapidement les séquences d’acide nucléique de façon extrêmement spécifique et sensible, associée à la bioluminescence pour détecter l’amplification. Les résultats présumés positifs sont visibles en temps réel tandis que les résultats négatifs sont affichés à la fin de l’essai. Les résultats présumés positifs doivent être confirmés par la méthode de votre choix ou en utilisant une méthode conforme aux réglementations locales(1, 2, 3).
Le Kit de détection moléculaire Listeria sp 3M version 2 est destiné à être utilisé au sein de laboratoires, par des professionnels formés aux techniques s’y rapportant. 3M n’a pas étudié l’utilisation de ce produit dans des secteurs autres que l’alimentaire et les boissons. Par exemple, 3M n’a pas étudié ce produit dans le cadre de tests sur des échantillons d’eau, pharmaceutiques, cosmétiques, cliniques ou vétérinaires. Le Kit de détection moléculaire Listeria sp 3M version 2 n’a pas été évalué en utilisant tous les protocoles de test ou toutes les souches de bactéries possibles.
Comme avec toutes les méthodes de test, la source, la formulation et la qualité du milieu d’enrichissement peuvent influencer les résultats. Des facteurs tels que les méthodes d’échantillonnage, les protocoles de test, la préparation des échantillons, la manipulation et les techniques de laboratoires peuvent également influencer les résultats.
3M recommande l’évaluation de la méthode comprenant le milieu d’enrichissement, dans l’environnement de l’utilisateur en utilisant un nombre suffisant d’échantillons avec des aliments spécifiques et/ou des échantillons environnementaux et des épreuves microbiennes afin de garantir que la méthode répond aux critères de l’utilisateur. 3M a évalué le Kit de détection moléculaire Listeria sp 3M version 2 avec un Bouillon demi-Fraser et un Bouillon Fraser contenant du citrate de fer ammoniacal. Une formulation type de ces milieux est indiquée ci-dessous.
Formule type de la base du bouillon demi-Fraser |
(g/L) |
Formule typique de la basse du bouillon Fraser |
(g/L) |
|
Chlorure de sodium |
|
20 g |
Chlorure de sodium |
20 g |
Phosphate de sodium dibasique anhydre* |
|
9,6 g |
Phosphate de sodium dibasique anhydre* |
9,6 g |
Extrait de bœuf |
|
5,0 g |
Extrait de bœuf |
5,0 g |
Digestat pancréatique de caséine |
|
5,0 g |
Digestat pancréatique de caséine |
5,0 g |
Digestat peptique de tissu animal |
|
5,0 g |
Digestat peptique de tissu animal |
5,0 g |
Extrait de levure |
|
5,0 g |
Extrait de levure |
5,0 g |
Chlorure de lithium |
|
3,0 g |
Chlorure de lithium |
3,0 g |
Phosphate de potassium, monobasique |
|
1,35 g |
Phosphate de potassium, monobasique |
1,35 g |
Esculine |
|
1,0 g |
Esculine |
1,0 g |
Hydrochlorure d’acriflavine |
|
0,0125 g |
Hydrochlorure d’acriflavine |
0,025 g |
Acide nalidixique |
|
0,01 g |
Acide nalidixique |
0,02 g |
* Élément de substitution : phosphate de sodium |
|
|
|
|
dibasique dihydraté |
|
12,0 g |
|
|
Complément de bouillon Fraser |
|
|
|
|
(Ingrédients par flacon de 10 mL. Ajout d’un flacon par litre de milieu basal.) |
|
|||
Citrate de fer ammoniacal |
0,5 g/10 mL |
|
|
|
pH final 7,2 ± 0,2 à 25 °C |
|
|
|
|
15

FR (Français)
L’instrument de détection moléculaire 3M™ est conçu pour être utilisé avec des échantillons traités thermiquement pendant l’étape de lyse, procédé qui détruit les organismes présents dans l’échantillon. Les échantillons qui n’ont pas été soumis à un traitement thermique adéquat pendant l’étape de lyse peuvent être considérés comme potentiellement dangereux et ne doivent PAS être insérés dans l’instrument de détection moléculaire 3M.
3M Sécurité Alimentaire respecte la norme ISO (International Organization for Standardization) 9001 en matière de conception et de fabrication.
Le Kit de détection moléculaire Listeria sp 3M version 2 contient 96 tests, décrits dans le tableau 1. Tableau 1. Composants du Kit de détection moléculaire 3M
Élément |
Identification |
Quantité |
Contenu |
Commentaires |
|
Solution de lyse (LS) 3M™ |
Solution rose en |
96 (12 barrettes de |
580 µL de LS |
Placé sur portoir et |
|
tubes transparents |
8 tubes) |
par tube |
prêt à l’emploi |
||
|
|||||
|
|
|
|
|
|
Tubes de réactifs |
|
|
Mélange spécifique |
|
|
du Kit de détection |
Tubes bleus |
96 (12 barrettes de |
lyophilisé pour |
Prêts à l’emploi |
|
moléculaire Listeria sp 3M™ |
8 tubes) |
l’amplification et |
|||
|
|
||||
version 2 |
|
|
la détection |
|
|
|
|
|
|
|
|
Bouchons supplémentaires |
Bouchons bleus |
96 (12 barrettes de |
|
Prêts à l’emploi |
|
8 bouchons) |
|
||||
|
|
|
|
||
|
|
|
|
|
|
|
|
|
ADN témoin |
|
|
Contrôle de réactif |
Tubes « Flip-Top » |
16 (2 poches de |
lyophilisé, mélange |
Prêts à l’emploi |
|
3M™ (RC) |
transparents |
8 tubes individuels) |
pour l’amplification |
||
|
|||||
|
|
|
et la détection |
|
|
|
|
|
|
|
|
Guide de démarrage rapide |
|
1 |
|
|
|
|
|
|
|
|
Le témoin négatif, non fourni dans le kit, est un milieu d’enrichissement stérile, par exemple du bouillon demi-Fraser. Ne pas utiliser d’eau comme témoin négatif.
Sécurité
L’utilisateur doit lire, comprendre et suivre toutes les informations de sécurité mentionnées dans les instructions relatives au Système de détection moléculaire 3M et au Kit de détection moléculaire Listeria sp 3M version 2. Conserver ces consignes de sécurité pour référence ultérieure.
 AVERTISSEMENT : indique une situation dangereuse qui, si elle n’est pas évitée, pourrait entraîner un décès, des blessures graves et/ou des dommages matériels.
AVERTISSEMENT : indique une situation dangereuse qui, si elle n’est pas évitée, pourrait entraîner un décès, des blessures graves et/ou des dommages matériels.
AVIS : indique une situation potentiellement dangereuse qui, si elle n’est pas évitée, pourrait entraîner des dommages matériels.
WAVERTISSEMENT
Ne pas utiliser le Kit de détection moléculaire Listeria sp 3Mversion 2 pour diagnostiquer des pathologies chez les humains ou les animaux.
La méthode du Kit de détection moléculaire Listeria sp 3M version 2 peut générer des taux de Listeria monocytogenes suffisamment élevés pour provoquer la mise au monde d’un enfant mort-né ou le décès de femmes enceintes ou de personnes immunocompromises, si ces dernièresysont exposées.
L’utilisateur doit former son personnel aux techniques d’analyse actuelles appropriées, par exemple : les bonnes pratiques de laboratoire, la norme ISO/CEI 17025(4) ou la norme ISO 7218(5).
Afin de réduire les risques associés aux faux négatifs, qui peuvent entraîner la diffusion de produits contaminés :
•Se conformer au protocole et effectuer les tests en suivant exactement les instructions relatives au produit.
•Conserver le Kit de détection moléculaire Listeria sp 3M version 2 conformément aux indications sur l’emballage et aux instructions relatives au produit.
•Toujours utiliser le Kit de détection moléculaire Listeria sp 3M version 2 avant la date de péremption.
•Utiliser le Kit de détection moléculaire Listeria sp 3M version 2 pour des aliments et des échantillons environnementaux ayant été validés en interne ou par une tierce partie.
16

FR (Français)
•N’utiliser le Kit de détection moléculaire Listeria sp 3M version 2 que pour des surfaces, des désinfectants, des protocoles et des souches bactériennes ayant été validés en interne ou par une tierce partie.
•En cas d’échantillon environnemental contenant un tampon neutralisant avec un composé d’aryle sulfonate, diluer l’échantillon dans un bouillon d’enrichissement stérile 1:2 avant l’analyse (1 volume d’échantillon pour 1 volume de bouillon). Une autre possibilité consiste à transférer 10 µL d’enrichissement de tampon neutralisant dans les tubes de solution de lyse 3M. Produits pour le recueil des échantillons 3M™ comprenant un tampon neutralisant contenant un complexe d’aryle sulfonate : BPPFV10NB, RS96010NB, RS9604NB, SSL10NB, SSL10NB2G, HS10NB, HS10NB2G et HS2410NB2G.
Afin de réduire les risques associés à l’exposition aux produits chimiques et aux dangers biologiques :
•Le personnel féminin du laboratoire doit être informé des risques sur le fœtus en développement dus à l’infection de la mère suite à une exposition à Listeria monocytogenes.
•Effectuer les analyses bactériologiques dans un laboratoire correctement équipé et sous la supervision de professionnels qualifiés. Les milieux et les équipements d’enrichissement incubés ou les surfaces ayant été en contact avec des milieux d’enrichissement incubés peuvent contenir des agents pathogènes à des niveaux suffisamment élevés pour entraîner des risques pour la santé humaine.
•Toujours respecter les consignes de sécurité courantes du laboratoire, porter des tenues et lunettes de protection adaptées lors de la manipulation de réactifs et d’échantillons contaminés.
•Éviter tout contact avec le contenu du milieu d’enrichissement et les tubes de réactifs après l’amplification.
•Éliminer les échantillons enrichis conformément aux normes du secteur actuelles.
•Les échantillons qui n’ont pas été soumis à un traitement thermique adéquat pendant l’étape de lyse peuvent être considérés comme potentiellement dangereux et ne doivent PAS être insérés dans l’instrument de détection moléculaire 3M.
Afin de réduire les risques associés à la contamination croisée lors de la préparation de l’analyse :
• Toujours porter des gants (afin de protéger l’utilisateur et de prévenir l’introduction de nucléases).
Pourréduirelesrisquesassociésàlacontaminationenvironnementale :
• Respecter les normes en vigueur concernant l’élimination des déchets contaminés.
Afin de réduire les risques associés à l’exposition à des liquides très chauds :
•Ne pas dépasser le paramètre de température recommandé sur le dispositif de chauffe.
•Ne pas dépasser le temps de chauffe recommandé.
•Utiliser un thermomètre étalonné adapté pour vérifier la température du support de bloc chauffant pour système de détection moléculaire 3M™ (p. ex. thermomètre à immersion partielle ou thermomètre à thermocouple numérique et non un thermomètre à immersion totale). Le thermomètre doit être placé à l’endroit indiqué du support de bloc chauffant pour système de détection moléculaire 3M.
AVIS
Afin de réduire les risques associés à la contamination croisée lors de la préparation de l’analyse :
•Changer de gants avant l’hydratation des pastilles réactives.
•Utiliser de préférence des pipettes de qualité conforme à la biologie moléculaire, stériles et munies d’embouts à filtre.
•Utiliser un nouvel embout de pipette pour chaque transfert d’échantillon.
•Utiliser les bonnes pratiques de laboratoire pour transférer l’échantillon de l’enrichissement vers le tube de lyse. Pour éviter toute contamination des pipettes, l’utilisateur peut choisir d’ajouter une étape de transfert intermédiaire. Par exemple, l’utilisateur peut transférer chaque échantillon enrichi dans un tube stérile.
•Utiliser un poste de travail de biologie moléculaire disposant si possible d’une lampe germicide. Décontaminer régulièrement les plans de travail et le matériel du laboratoire (pipettes, outils d’ouverture/de fermeture, etc.) avec une solution d’eau de Javel à 1 et 5 % (v:v dans de l’eau) ou avec une solution pour l’élimination de l’ADN.
Afin de réduire les risques associés à un résultat faux positif :
•Ne jamais ouvrir les tubes de réactif après amplification.
•Toujours éliminer les tubes contaminés en les faisant tremper dans une solution d’eau de Javel concentrée à 1 et 5 % (v:v dans l’eau) ou une solution équivalente pendant 1 heure. Effectuer cette procédure à distance de la zone de préparation de l’analyse.
•Ne jamais stériliser à l’autoclave les tubes de réactifs après amplification.
17

FR (Français)
Consulter la fiche de données de sécurité pour obtenir des informations supplémentaires et connaître la réglementation locale relative à la mise au rebut.
Pour toute question concernant des applications ou procédures spécifiques, consulter notre site Internet à l’adresse www.3M.com/foodsafety ou contacter votre représentant ou distributeur 3M local.
Responsabilité de l’utilisateur
Il incombe aux utilisateurs de prendre connaissance des instructions et des informations relatives au produit. Consulter notre site Web www.3M.com/foodsafety ou contacter votre représentant ou distributeur 3M local pour obtenir de plus amples informations.
Lors du choix d’une méthode de test, il est important d’admettre que des facteurs externes comme les méthodes d’échantillonnage, les protocoles d’analyse, la préparation des échantillons, la manipulation et les techniques de laboratoire peuvent influencer les résultats.
Il incombe à l’utilisateur de sélectionner une méthode ou un produit d’analyse adapté pour évaluer un nombre suffisant d’échantillons avec les matrices et les souches microbiennes appropriées, afin de garantir que la méthode d’analyse est conforme à ses critères.
Il incombe également à l’utilisateur de déterminer si une méthode d’analyse et ses résultats répondent aux exigences de ses clients ou fournisseurs.
Comme pour toute méthode d’analyse, les résultats obtenus avec un produit 3M Sécurité Alimentaire ne constituent pas une garantie de la qualité des matrices ou des processus testés.
Dans le but d’aider les clients à évaluer la méthode pour différentes matrices alimentaires, 3M a élaboré le kit de contrôle de matrice pour système de détection moléculaire 3M™. Lorsque cela est nécessaire, utiliser le contrôle de matrice (MC) pour déterminer si la matrice peut avoir un impact sur les résultats du Kit de détection moléculaire Listeria sp 3M version 2. Tester plusieurs échantillons représentatifs de la matrice, c.-à-d. des échantillons d’origines différentes, au cours de toute période de validation lors de l’adoption de la méthode 3M ou dans le cadre d’analyses de matrices nouvelles, inconnues ou ayant subi des modifications de matières premières ou de processus.
Une matrice peut être définie comme un type de produit présentant des propriétés intrinsèques, telles que la composition et le processus. Les différences entre les matrices peuvent être aussi simples que les effets causés par leurs différences de traitement ou de présentation, par exemple, cru/pasteurisé, frais/sec, etc.
Limitations de garanties/Limites de recours
SAUF SI EXPRESSÉMENT ÉTABLI DANS LA SECTION DE GARANTIE LIMITÉE D’UN EMBALLAGE DE PRODUIT INDIVIDUEL, 3M RENONCE À TOUTE GARANTIE EXPLICITE ET IMPLICITE, Y COMPRIS, MAIS SANS S’Y LIMITER, TOUTE GARANTIE DE COMMERCIALISATION OU D’ADAPTATION POUR UN USAGE SPÉCIFIQUE. En cas de défaut de tout produit 3M Sécurité Alimentaire, 3M ou son distributeur agréé s’engage, à son entière discrétion, au remplacement ou au remboursement du prix d’achat du produit. Il s’agit de vos recours exclusifs. Tout défaut supposé du produit devra être notifié à 3M dans un délai de soixante jours et le produit renvoyé à 3M. Appeler le Service clientèle (1-800-328-1671 aux États-Unis) ou votre représentant officiel 3M Sécurité Alimentaire pour obtenir une autorisation de renvoi.
Limitation de responsabilité de 3M
3M NE SERA PAS TENUE RESPONSABLE DES PERTES OU DES DOMMAGES ÉVENTUELS, QU’ILS SOIENT DIRECTS, INDIRECTS, SPÉCIFIQUES, ACCIDENTELS OU CONSÉCUTIFS, Y COMPRIS, MAIS SANS S’Y LIMITER, LES PERTES DE PROFITS. En aucun cas et en aucune manière, la responsabilité de 3M ne sera engagée au-delà du prix d’achat du produit prétendu défectueux.
Stockage et mise au rebut
Conserver le Kit de détection moléculaire Listeria sp 3M version 2 à une température comprise entre 2 et 8 °C. Ne pas congeler. Conserver à l’abri de la lumière. Une fois le kit ouvert, vérifier que le sachet en aluminium est intact. Si ce sachet est endommagé, ne pas utiliser le kit. Après ouverture, les tubes de réactif non utilisés doivent toujours être conservés dans le sachet refermable, en laissant l’agent déshydratant à l’intérieur afin de maintenir la stabilité des réactifs lyophilisés. Conserver les poches refermées à une température comprise entre 2 et 8 °C. Ne pas conserver plus de 60 jours.
18

FR (Français)
Ne pas utiliser le Kit de détection moléculaire Listeria sp 3M version 2 après la date de péremption. La date de péremption et le numéro de lot sont inscrits sur l’étiquette extérieure de la boîte. Après utilisation, il est possible que les tubes de milieu d’enrichissement et du Kit de détection moléculaire Listeria sp 3M version 2 contiennent des éléments pathogènes. Lorsque l’analyse est terminée, suivre les normes actuelles du secteur pour l’élimination des déchets contaminés. Consulter la fiche de données de sécurité pour obtenir des informations supplémentaires et connaître la réglementation locale relative à la mise au rebut.
Instructions d’utilisation
Suivre attentivement toutes les instructions. Dans le cas contraire, les résultats obtenus risquent d’être inexacts.
Décontaminer régulièrement les plans de travail et le matériel du laboratoire (pipettes, outils d’ouverture/de fermeture, etc.) avec une solution d’eau de Javel à 1 et 5 % (v:v dans de l’eau) ou avec une solution pour l’élimination de l’ADN.
L’utilisateur doit suivre la formation de qualification de l’opérateur du système de détection moléculaire 3M, comme décrit dans le document intitulé « Protocoles et instructions relatifs à la qualification d’installation (IQ)/qualification opérationnelle (OQ) pour le système de détection moléculaire 3M »(6).
Se référer à la section « Instructions spécifiques pour méthodes validées » pour connaître les exigences spécifiques :
Voir le tableau 3 pour les protocoles d’enrichissement selon l’AOAC® Official Method ofAnalysisSM 2016.07 et l’AOAC® PerformanceTested MethodSM Certificat nº 111501.
Voir le tableau 4 pour les protocoles d’enrichissement selon la méthode de certification NF Validation 3M 01/14-05/16.
Enrichissement des échantillons
Les tableaux 2, 3 et 4 fournissent des indications pour l’enrichissement des échantillons d’aliments et environnementaux. Il incombe à l’utilisateur de valider des protocoles d’échantillonnage ou des proportions de dilution différents pour garantir que cette méthode d’analyse est conforme à ses critères.
Aliments
1.Laisser le milieu d’enrichissement bouillon demi-Fraser (contenant du citrate ferrique d’ammonium) s’équilibrer à la température ambiante du laboratoire.
2.Mélanger de manière aseptique le milieu d’enrichissement et l’échantillon conformément au tableau 2, 3 ou 4. Pour tous les échantillons de viande et à forte teneur en particules, il est recommandé d’utiliser des sacs avec filtre.
3.Homogénéiser soigneusement par mélange, par digestion ou à la main pendant 2 ± 0,2 minutes. Incuber à 37 ± 1 °C conformément aux tableaux 2, 3 ou 4.
4.Pour les produits laitiers crus (voir les tableaux 2 ou 4), transférer 0,1 mL du premier enrichissement dans 10 mL de bouillon Fraser. Incuber à 37 ± 1 °C pendant 20 à 24 heures.
Échantillons environnementaux
Le dispositif de prélèvement d’échantillons peut être une éponge hydratée avec une solution neutralisante pour désactiver les effets des désinfectants. 3M recommande d’utiliser une éponge en cellulose sans biocide. La solution neutralisante peut être un bouillon neutralisant Dey-Engley (D/E) ou un bouillon Letheen. Il est recommandé de désinfecter la zone après l’échantillonnage.
AVERTISSEMENT : si vous choisissez d’utiliser un tampon neutralisant (NB) contenant un complexe d’aryle sulfonate comme solution hydratante pour l’éponge, il sera nécessaire d’effectuer une dilution de 1:2 (1 volume d’échantillon pour 1 volume de bouillon d’enrichissement stérile) avant l’analyse, afin de réduire les risques associés aux résultats faux négatifs pouvant conduire à la libération de produit contaminé. Une autre possibilité consiste à transférer 10 µL d’enrichissement de tampon neutralisant dans les tubes de solution de lyse 3M.
La taille minimale recommandée pour la zone d’échantillonnage destinée à vérifier l’absence ou la présence du pathogène à la surface est de 100 cm2 (10 cm x 10 cm ou 4 po x 4 po). Lors de l’échantillonnage avec une éponge, couvrir toutes la zone dans les deux directions (de gauche à droite puis de haut en bas) ou prélever des échantillons environnementaux
en suivant votre protocole d’échantillonnage actuel ou selon les directives de la FDA BAM(1), USDA FSIS MLG(2) ou ISO 18593(7).
1.Laisser le milieu d’enrichissement bouillon demi-Fraser (contenant du citrate ferrique d’ammonium) s’équilibrer à la température ambiante du laboratoire.
19
FR (Français)
2.Mélanger de manière aseptique le milieu d’enrichissement et l’échantillon conformément au tableau 2, 3 ou 4.
3.Homogénéiser soigneusement par mélange, par digestion, à la main ou au vortex pendant 2 ± 0,2 minutes. Incuber à 37 ± 1 °C pendant 24 à 30 heures, conformément aux tableaux 2, 3 ou 4.
Tableau 2 : Protocoles d’enrichissement généraux à 37 ± 1 °C avec Bouillon demi-Fraser(a) et Bouillon Fraser(a) selon les besoins.
|
|
Volume du |
|
|
|
Matrice de |
Taille de |
bouillon |
Température |
Durée |
|
l’échan- |
d’enrichis- |
d’enrichisse- |
d’enrichis- |
||
l’échantillon |
|||||
tillon |
sement |
ment (± 1 °C) |
sement (h) |
||
|
|||||
|
|
(mL) |
|
|
Viandes, volaille et poisson transformés par la chaleur, cuits ou séchés
Produits |
|
|
|
|
|
laitiers |
25 g |
225 |
37 |
24-30 |
|
transformés |
|||||
par la chaleur |
|
|
|
|
|
ou pasteurisés |
|
|
|
|
|
Fruits |
|
|
|
|
|
et légumes |
|
|
|
|
|
Aliments |
|
|
|
|
|
multi- |
|
|
|
|
|
composants |
|
|
|
|
|
|
|
|
|
|
|
Échantillons |
1 éponge |
100 ou 225 |
37 |
24-30 |
|
environne- |
|
|
|
|
|
1 tampon |
10 |
37 |
24-30 |
||
mentaux |
|||||
|
|
|
|
||
|
|
|
|
|
|
Viande, |
|
|
|
|
|
volaille, |
25 g |
475 |
37 |
28-32 |
|
fruits de mer, |
|||||
|
|
|
|
||
poissons crus |
|
|
|
|
20

|
|
|
|
|
|
FR |
(Français) |
|
|
|
|
|
|
|
|
|
|
|
|
|
Enrichissement primaire (bouillon demi-Fraser)(a) |
Enrichissement secondaire |
|
||||||
|
(bouillon Fraser)(a) |
|
|||||||
|
|
|
|
|
Volume |
||||
Matrice de |
|
Volume du |
|
|
|
Tempé- |
Durée |
d’échan- |
|
l’échantillon |
Taille de |
bouillon |
Température |
Durée |
Taille de |
rature |
tillon |
||
d’enri- |
|||||||||
|
l’échan- |
d’enrichis- |
d’enrichisse- |
d’enrichis- |
l’échan- |
d’enrichis- |
d’analyse(b) |
||
|
chisse- |
||||||||
|
tillon |
sement |
ment (± 1 °C) |
sement (h) |
tillon |
sement |
|
||
|
ment (h) |
|
|||||||
|
|
(mL) |
|
|
|
(± 1 °C) |
|
||
|
|
|
|
|
|
|
|||
|
|
|
|
|
Transférer |
|
|
|
|
|
|
|
|
|
0,1 mL |
|
|
|
|
Produits |
25 g |
225 |
37 |
20-24 |
dans |
37 |
20-24 |
10 μL |
|
laitiers crus |
10 mL de |
||||||||
|
|
|
|
|
|
|
|||
|
|
|
|
|
bouillon |
|
|
|
|
|
|
|
|
|
Fraser |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(a)Les Bouillons demi-Fraser et Fraser doivent toujours être complétés par un supplément de Bouillon Fraser (citrate de fer ammoniacal) lors du premier ou du second enrichissement.
(b)Volume d’échantillon enrichi transféré dans les tubes de solution de lyse 3M. Consulter l’étape 4.6 de la section Lyse.
Instructions spécifiques pour méthodesvalidées
AOAC® Official MethodsSM 2016.07
AOAC® Performance Tested MethodSM #111501
Dans les programmes OMASM et PTMSM de l’Institut de recherche de l’AOAC, il a été démontré que le Kit de détection moléculaire Listeria sp 3M version 2 était une méthode efficace de détection d’espèces de Listeria. Les matrices testées au cours de l’étude sont répertoriées dans le tableau 3.
21

FR (Français)
Tableau 3. Protocoles d’enrichissement au moyen d’un enrichissement avec Bouillon demi-Fraser(a) à 37 ± 1 °C conformément à l’AOAC OMASM 2016.07 et au certificat AOAC PTMSM nº 111501.
Matrice de l’échantillon
Hot dogs de bœuf, fromage frais, glace à la vanille, fromage blanc au lait à 4 % de matières grasses, lait entier au chocolat 3 %, laitue romaine, épinards crus en sachet, saumon fumé froid
Poulet cru
Dinde préparée
Melon(b)
Acier inoxydable Échantillons - : environne mentaux Béton verni
Plastique(c)
Taille de |
Volume du bouillon |
Durée |
|
l’échantillon |
d’enrichissement (mL) |
d’enrichissement (h) |
|
25 g |
225 |
24-30 |
|
25 g |
475 |
28-32 |
|
125 g |
1125 |
24-30 |
|
Melon entier |
Assez de volume pour permettre au |
26-30 |
|
melon de flotter |
|||
|
|
||
1 éponge |
225 |
24-30 |
|
1 éponge |
100 |
24-30 |
|
1 tampon |
10 |
24-30 |
|
|
|
|
Tous les échantillons pour la validation AOAC ont été homogénéisés par homogénéisation mécanique sauf indication contraire.
(a)Les Bouillons demi-Fraser et Fraser doivent toujours être complétés par un supplément de Bouillon Fraser (citrate de fer ammoniacal) lors du premier ou du second enrichissement.
(b)Homogénéiser l’échantillon en mélangeant à la main.
(c)Homogénéiser l’échantillon au vortex.
NFValidation parAFNOR Certification
3M 01/14-05/16
MÉTHODES ALTERNATIVES D’ANALYSE POUR L’AGROALIMENTAIRE http://nf-validation.afnor.org/en
Pour plus d’information sur l’expiration de la validité, se reporter au certificat NF VALIDATION disponible sur le site Internet cité ci-dessus.
Méthode de certification NFVALIDATION, conformément à la norme ISO 16140-2(8) par rapport à la norme ISO 11290-1(3)
Portéedelavalidation :tous aliments pour l’alimentation humaine et échantillons environnementaux (sauf échantillons de production primaire)
Préparation de l’échantillon : les échantillons doivent être préparés conformément aux normes ISO 11290-1(3) et ISO 6887(9)
Version de logiciel : voir le certificat
22

FR (Français)
Tableau 4. Protocoles d’enrichissement selon la méthode de certification NF VALIDATION certifiée 3M 01/14-05/16 à 37 ± 1 °C utilisant du bouillon demi-Fraser(a) et du bouillon Fraser(a) selon les besoins.
|
|
Volume |
|
|
|
|
|
|
|
|
du |
Tempé- |
Durée |
Volume |
|
|
|
Pro- |
Taille de |
bouillon |
rature |
Point d’in- |
||||
d’enri- |
d’échan- |
|||||||
tocole |
l’échan- |
d’enri- |
d’enrichis- |
terruption |
||||
chisse- |
tillon |
|||||||
général |
tillon |
chisse- |
sement |
|
accepté |
|||
ment (h) |
d’analyse(b) |
|
||||||
|
|
ment |
(± 1 °C) |
|
|
|||
|
|
|
|
|
|
|||
|
|
(mL) |
|
|
|
|
|
|
Tous les |
|
|
|
|
|
|
|
|
échan- |
|
|
|
|
|
• |
Bouillon |
|
tillons |
|
|
|
|
|
|||
|
|
|
|
|
|
demi- |
||
alimen- |
|
|
|
|
|
|
||
|
|
|
|
|
|
Fraser |
||
taires |
|
|
|
|
|
|
||
|
|
|
|
|
|
jusqu’à |
||
(sauf les |
|
|
|
|
|
|
||
|
|
|
|
|
|
72 heures |
||
viandes |
|
|
|
|
|
|
||
25 g |
225 |
37 |
24-30 |
20 µL |
• |
Lysat à |
||
crues, les |
||||||||
|
|
|
|
|
|
-20 °C |
||
fruits de |
|
|
|
|
|
|
||
|
|
|
|
|
• |
Lysat |
||
mer crus |
|
|
|
|
|
|||
|
|
|
|
|
|
à 4 °C |
||
et les |
|
|
|
|
|
|
||
|
|
|
|
|
|
jusqu’à |
||
produits |
|
|
|
|
|
|
||
|
|
|
|
|
|
72 heures |
||
laitiers |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
crus) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Échantil- |
25 g, |
|
|
|
|
|
|
|
lons envi- |
1 écou- |
225 |
37 |
24-30 |
20 µL |
• |
Lysat |
|
ronne- |
villon ou |
|
à -20 °C |
|||||
|
|
|
|
|
||||
mentaux |
1 lingette |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Volume |
|
|
|
|
|
|
|
|
du |
Tempé- |
Durée |
Volume |
|
|
|
Proto- |
Taille de |
bouillon |
rature |
Point d’in- |
||||
d’enri- |
d’échan- |
|||||||
cole spé- |
l’échan- |
d’enri- |
d’enrichis- |
terruption |
||||
chisse- |
tillon |
|||||||
cifique 1 |
tillon |
chisse- |
sement |
|
accepté |
|||
ment (h) |
d’analyse(b) |
|
||||||
|
|
ment |
(± 1 °C) |
|
|
|||
|
|
|
|
|
|
|||
|
|
(mL) |
|
|
|
|
|
|
|
|
|
|
|
|
• |
Bouillon |
|
|
|
|
|
|
|
|
demi- |
|
|
|
|
|
|
|
|
Fraser |
|
Viandes |
|
|
|
|
|
|
jusqu’à |
|
|
|
|
|
|
|
72 heures |
||
crues et |
|
|
|
|
|
|
||
25 g |
475 |
37 |
28-32 |
20 µL |
• |
Lysat à |
||
fruits de |
||||||||
|
|
|
|
|
|
-20 °C |
||
mer crus |
|
|
|
|
|
|
||
|
|
|
|
|
• |
Lysat |
||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
à 4 °C |
|
|
|
|
|
|
|
|
jusqu’à |
|
|
|
|
|
|
|
|
72 heures |
|
|
|
|
|
|
|
|
|
|
23

|
|
|
|
|
|
|
FR |
(Français) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Enrichissement primaire |
Enrichissement secondaire |
|
|
|||||
|
|
(bouillon demi-Fraser)(a) |
|
(bouillon Fraser)(a) |
|
|
|
|||
Proto- |
|
Volume |
|
|
|
|
|
|
|
Point d’in- |
|
du |
Tempé- |
|
|
Tempé- |
Durée |
Volume |
|
||
cole spé- |
Taille de |
bouillon |
rature |
Durée |
Taille de |
rature |
|
terruption |
||
d’enri- |
d’échan- |
|
||||||||
cifique 2 |
l’échan- |
d’enri- |
d’enrichis- |
d’enrichis- |
l’échan- |
d’enrichis- |
|
accepté |
||
chisse- |
tillon |
|
||||||||
|
tillon |
chisse- |
sement |
sement (h) |
tillon |
sement |
|
|
||
|
ment (h) |
d’analyse(b) |
|
|
||||||
|
|
ment |
(± 1 °C) |
|
|
(± 1 °C) |
|
|
||
|
|
(mL) |
|
|
|
|
|
|
|
|
|
|
|
|
|
Transférer |
|
|
|
• |
Bouillon |
Produits |
|
|
|
|
0,1 mL |
|
|
|
|
Fraser |
|
|
|
|
dans |
|
|
|
|
jusqu’à |
|
laitiers |
25 g |
225 |
37 |
20-24 |
37 |
20-24 |
10 µL |
|
||
10 mL de |
|
72 heures |
||||||||
crus |
|
|
|
|
|
|
|
|
||
|
|
|
|
bouillon |
|
|
|
• |
Lysat à |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
Fraser |
|
|
|
|
-20 °C |
|
|
|
|
|
|
|
|
|
|
|
(a)Les Bouillons demi-Fraser et Fraser doivent toujours être complétés par un supplément de Bouillon Fraser (citrate de fer ammoniacal) lors du premier ou du second enrichissement.
(b)Volume d’échantillon enrichi transféré dans les tubes de solution de lyse 3M. Consulter l’étape 4.6 de la section Lyse.
Remarque : les échantillons supérieurs à 25 g n’ont pas été testés dans le cadre de l’étude NF Validation.
Préparation du plateau de chargement rapide poursystème de détection moléculaire 3M™
1.Humidifier un chiffon à l’aide d’une solution de 1 et 5 % d’eau de Javel (v:v dans de l’eau) ou une solution équivalente et nettoyer le plateau de chargement rapide pour système de détection moléculaire 3M™.
2.Rincer le plateau de chargement rapide pour système de détection moléculaire 3M à l’eau.
3.Utiliser un chiffon jetable pour sécher le plateau de chargement rapide pour système de détection moléculaire 3M.
4.S’assurer que le plateau de chargement rapide pour système de détection moléculaire 3M est sec avant toute utilisation.
Préparation du support de bloc refroidissant poursystème de détection moléculaire 3M™
Placer le bloc refroidissant pour système de détection moléculaire 3M™ sur le plan de travail du laboratoire. Utiliser le bloc refroidissant à la température ambiante du laboratoire (20 et 25 °C).
Préparation du support de bloc chauffant poursystème de détection moléculaire 3M™
Placer le support de bloc chauffant pour système de détection moléculaire 3M™ dans une unité de traitement thermique à sec double bloc. Allumer l’unité de traitement thermique à sec et régler la température afin que le support de bloc chauffant pour système de détection moléculaire 3M atteigne et conserve une température de 100 ± 1 °C.
Remarque : selon l’unité de traitement thermique utilisée, le support de bloc chauffant pour système de détection moléculaire 3M atteint la température souhaitée en 30 minutes environ. Utiliser un thermomètre étalonné adapté (p. ex., un thermomètre à immersion partielle ou un thermomètre à thermocouple numérique, et non un thermomètre à immersion totale) placé à l’endroit indiqué du support de bloc chauffant pour système de détection moléculaire 3M afin de vérifier que sa température est de 100 ± 1 °C.
Préparation de l’instrument de détection moléculaire 3M™
1.Lancer le logiciel du Système de détection moléculaire 3M™ et ouvrir une session. Contacter votre représentant 3M Sécurité Alimentaire pour vous assurer d’avoir la version la plus récente du logiciel.
2.Mettre l’instrument de détection moléculaire 3M sous tension.
3.Créer ou modifier une analyse en saisissant les données pour chaque échantillon. Pour plus de précisions, consulter le manuel d’utilisation du système de détection moléculaire 3M.
Remarque : l’instrument de détection moléculaire 3M doit être prêt avant l’insertion du plateau de chargement rapide pour système de détection moléculaire 3M, dans lequel sont placés les tubes de réactif. Cette étape de chauffage prend environ 20 minutes ; pendant ce processus, un voyant lumineux ORANGE s’allume sur la barre d’état de l’instrument. Lorsque l’instrument est prêt pour l’analyse, la barre d’état passe au VERT.
24
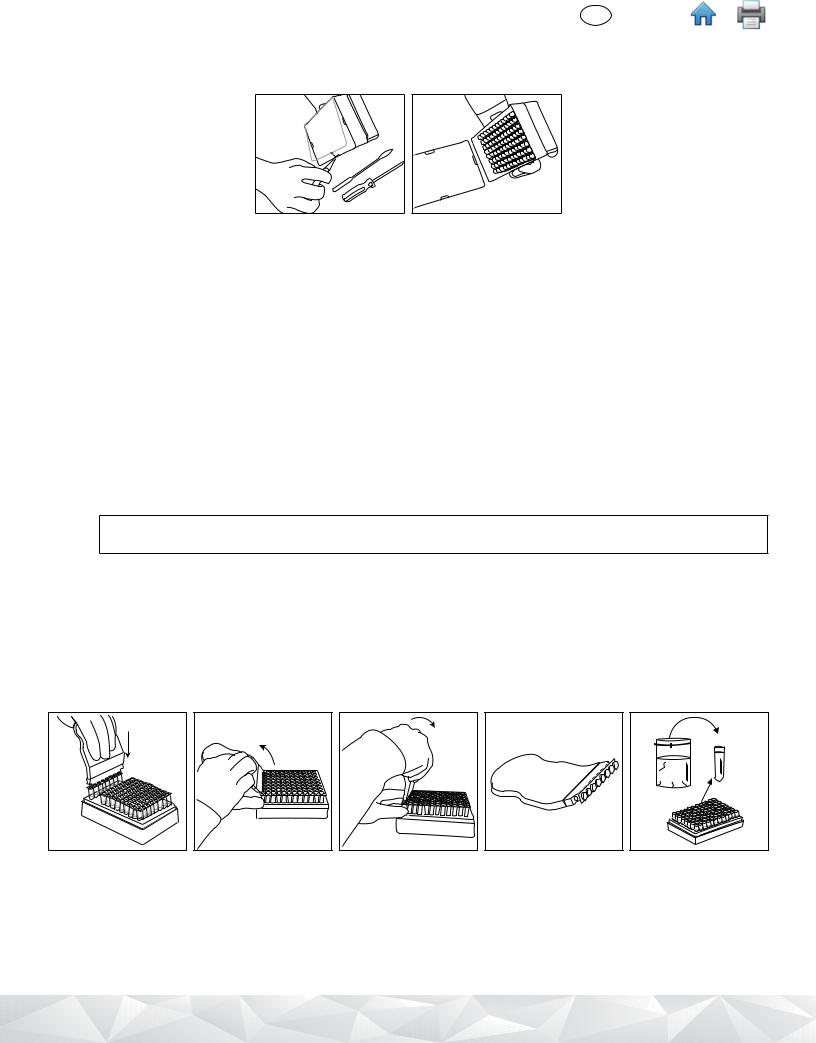
FR (Français)
Lyse
Retirer le portoir pour tubes de solution de lyse 3M avec un tournevis ou une spatule avant de le placer dans le support de bloc chauffant pour système de détection moléculaire 3M.
1.Laisser les tubes de solution de lyse 3M se réchauffer en plaçant le support à température ambiante (20 et 25 °C) pendant une nuit (16 à 18 heures). Il est également possible d’amener les tubes de solution de lyse 3M à température ambiante en les plaçant sur le plan de travail du laboratoire pendant au moins 2 heures, en incubant les tubes de solution de lyse 3M dans un incubateur à 37 ± 1 °C pendant 1 heure ou en les plaçant dans une unité de traitement thermique à sec double bloc pendant 30 secondes à 100 ± 1 °C.
2.Retourner les tubes recouverts d’un bouchon pour les mélanger. Passer à l’étape suivante dans un délai de 4 heures.
3.Retirer le bouillon d’enrichissement de l’incubateur.
4.Un tube de solution de lyse 3M est nécessaire pour chaque échantillon et pour le témoin négatif (NC) (milieu d’enrichissement stérile).
4.1Les barrettes de tubes de solution de lyse 3M peuvent être coupées de manière à obtenir le nombre de tubes de solution de lyse 3M souhaité. Sélectionner le nombre de tubes de solution de lyse 3M ou de barrettes de 8 tubes nécessaire. Placer les tubes de solution de lyse 3M dans un portoir vide.
4.2Pour éviter toute contamination croisée, ouvrir une barrette de tube de solution de lyse 3M à la fois et utiliser un nouvel embout de pipette pour chaque étape de transfert.
4.3Transférer l’échantillon enrichi dans les tubes de solution de lyse 3M comme indiqué ci-dessous :
Transférer tout d’abord chaque échantillon enrichi dans des tubes de solution de lyse 3M individuels. Transférer le NC en dernier.
4.4Ouvrir les barrettes de tubes de solution de lyse 3M une à une à l’aide de l’outil d’ouverture/fermeture pour système de détection moléculaire 3M™ - Lyse.
4.5Jeter le bouchon du tube de solution de lyse 3M. Si le lysat doit être soumis à un nouveau test, placer les bouchons dans un récipient propre pour réapplication après la lyse.
4.5.1 Pour le traitement du lysat conservé, voir l’annexe A.
4.6Transférer 20 µL d’échantillon dans un tube de solution de lyse 3M, sauf indication contraire dans les tableaux de protocole 2, 3 et 4 (exemple : utiliser 10 µL avec les produits laitiers crus ou les échantillons environnementaux avec tampon neutralisant).
20 µl
5.Répéter les étapes 4.4 et 4.6 jusqu’à ce que chaque échantillon individuel soit ajouté à un tube de solution de lyse 3M correspondant sur la barrette.
6.Une fois tous les échantillons transférés, transférer 20 µL de NC (milieu d’enrichissement stérile, p. ex. bouillon demiFraser) dans un tube de solution de lyse 3M. Ne pas utiliser d’eau comme NC.
7.Vérifier que la température du support de bloc chauffant pour système de détection moléculaire 3M est de 100 ± 1 °C.
25

FR (Français)
8.Placer le portoir non couvert de tubes de solution de lyse 3M dans le support de bloc chauffant pour système de détection moléculaire 3M et chauffer pendant 15 ± 1 minutes. Lors du chauffage, la solution de lyse 3M passera de rose (froide) à jaune (chaude).
8.1Les échantillons qui n’ont pas été soumis à un traitement thermique adéquat pendant l’étape de lyse peuvent être considérés comme potentiellement dangereux et ne doivent PAS être insérés dans l’Instrument de détection moléculaire 3M.
9.Retirer le portoir non couvert de tubes de solution de lyse 3M du bloc chauffant et laisser refroidir dans le support de bloc refroidissant pour système de détection moléculaire 3M pendant une durée comprise entre 5 et 10 minutes. Le support de bloc refroidissant pour système de détection moléculaire 3M utilisé à température ambiante doit être posé directement sur le plan de travail du laboratoire. Une fois froide, la solution de lyse retrouvera une couleur rose.
10.Retirer le couvercle des tubes de solution de lyse 3M du support de bloc refroidissant pour système de détection moléculaire 3M.
00:15:00 |
99-101ºC |
20-25ºC
00:05:00
Amplification
1.Il est nécessaire d’utiliser un tube de réactif du Kit de détection moléculaire Listeria sp 3M version 2 pour chaque échantillon et pour le NC.
1.1Les barrettes de tubes de réactifs peuvent être coupées de manière à obtenir le nombre de tubes souhaité. Sélectionner le nombre de tubes de réactif du Kit de détection moléculaire Listeria sp 3M version 2 ou de barrettes de 8 tubes nécessaire.
1.2Placer les tubes de réactifs du Kit de détection moléculaire Listeria sp 3M version 2 dans un portoir vide.
1.3Éviter d’agiter les pastilles réactives se trouvant au fond des tubes.
2.Sélectionner un tube de Contrôle de réactif (RC) 3M et le placer dans le portoir.
3.Afin d’éviter toute contamination croisée, ouvrir une barrette de tubes de réactif du Kit de détection moléculaire Listeria sp 3M version 2 à la fois et utiliser un nouvel embout de pipette pour chaque étape de transfert.
4.Transférer le lysat dans des tubes de réactif du Kit de détection moléculaire Listeria sp 3M version 2 et dans un tube de Contrôle de réactif 3M comme décrit ci-dessous :
Transférer d’abord chaque lysat d’échantillon dans les tubes de réactif du Kit de détection moléculaire Listeria sp 3M version 2, puis faire de même avec le NC. Hydrater en dernier le tube de RC.
5.Ouvrir les barrettes de tubes de réactif du Kit de détection moléculaire Listeria sp 3M version 2 une à une à l’aide de l’Outil d’ouverture/fermeture pour système de détection moléculaire 3M™ – Réactif. Jeter le bouchon.
5.1Transférer 20 μLde lysat d’échantillon prélevé au niveau de la moitié (½) supérieure du liquide (éviter le précipité) dans le tube de solution de lyse 3M du Kit de détection moléculaire Listeria sp 3Mversion 2 correspondant. Incliner la pipette pour ne pas toucher les pastilles. Mélanger en effectuant 5 cycles d’aspiration/de refoulement avec la pipette.
5.2Répéter l’étape 5.1 jusqu’à ce que chaque lysat d’échantillon individuel ait été ajouté au tube de réactif du Kit de détection moléculaire Listeria sp 3M version 2 correspondant dans la barrette.
5.3Placer la capsule supplémentaire prévue à cet effet sur les tubes de réactif du Kit de détection moléculaire Listeria sp 3M version 2, puis prendre le bord arrondi de l’Outil d’ouverture/fermeture pour système de détection moléculaire 3M – Réactif et appuyer dans un mouvement de va-et-vient afin de s’assurer que la capsule est fermement insérée sur le tube.
5.4Répéter les étapes 5.1 et 5.3 pour tous les échantillons à analyser.
26

FR (Français)
5.5Lorsque tous les lysats d’échantillons ont été transférés, répéter les étapes 5.1 et 5.3 afin de transférer 20 µL de lysat de NC dans un tube de réactif du Kit de détection moléculaire Listeria sp 3M version 2.
5.6Transférer 20 µLde lysat de NC dans un tube de contrôle de réactif 3M. Incliner la pipette pour ne pas toucher les pastilles. Mélanger en effectuant 5 cycles d’aspiration/de refoulement avec la pipette.
6.Charger les tubes recouverts d’un bouchon dans un plateau de chargement rapide pour système de détection moléculaire 3M propre et décontaminé. Fermer et verrouiller le couvercle du plateau de chargement rapide pour système de détection moléculaire 3M.
20 µL |
7.Examiner et confirmer l’analyse configurée sur le logiciel du système de détection moléculaire 3M.
8.Cliquer sur l’icône « Démarrer » du logiciel et sélectionner l’instrument à utiliser. Le couvercle de l’appareil sélectionné s’ouvre automatiquement.
9.Placer le plateau de chargement rapide pour système de détection moléculaire 3M dans l’instrument de détection moléculaire 3M et fermer le couvercle pour lancer l’essai. Les résultats sont obtenus en 75 minutes ; toutefois, les résultats positifs peuvent être détectés plus tôt.
10.Une fois l’analyse terminée, retirer le plateau de chargement rapide pour système de détection moléculaire 3M de l’instrument de détection moléculaire 3M et tremper les tubes dans une solution d’eau de Javel à 1-5 % (v:v dans de l’eau) ou une solution équivalente pendant 1 heure, et ce, à l’écart de la zone de préparation des analyses.
AVIS : pour réduire le risque de résultats faux positifs dus à une contamination croisée, ne jamais ouvrir les tubes de réactifs du Kit de détection moléculaire Listeria sp 3M version 2 contenant de l’ADN amplifié. Ceci comprend les tubes de réactif du Kit de détection moléculaire Listeria sp 3M version 2, les tubes de Contrôle de réactif 3M et les tubes
de contrôle de matrice pour système de détection moléculaire 3M. Toujours éliminer les tubes de réactif fermés en les faisant tremper dans une solution d’eau de Javel concentrée à 1 et 5 % (v:v dans l’eau) ou une solution équivalente pendant 1 heure. Effectuer cette procédure à distance de la zone de préparation de l’analyse.
Résultats et interprétation
Un algorithme interprète la courbe de résultats provenant de la détection de l’amplification de l’acide nucléique par bioluminescence. Les résultats sont automatiquement analysés par le logiciel et sont codés par couleur en fonction du résultat. Un résultat positif ou négatif est déterminé par l’analyse d’un nombre de paramètres des courbes individuelles. Les résultats présumés positifs sont rapportés en temps réel, tandis que les résultats négatifs ou à vérifier sont affichés à la fin de l’analyse.
Les résultats présumés positifs doivent être confirmés selon les procédures standard des laboratoires ou en suivant la confirmation de la méthode de référence appropriée(1, 2, 3), en commençant par effectuer un transfert du bouillon
d’enrichissement primaire vers le ou les bouillons d’enrichissement secondaires (si applicable), puis en effectuant la mise en culture et la confirmation des isolats à l’aide des méthodes biochimiques et sérologiques appropriées.
REMARQUE : même un échantillon négatif ne donnera pas de résultat égal à zéro, car le système et les réactifs d’amplification du Kit de détection moléculaire Listeria sp 3M version 2 effectuent une lecture d’unité relative de lumière (RLU) « de base ».
Dans le cas peu probable d’un résultat lumineux inhabituel, l’algorithme considérera l’échantillon comme « À vérifier ». 3M recommande à l’utilisateur de recommencer l’essai pour tout échantillon considéré comme « À vérifier ». Si le résultat continue à être « À vérifier », passer au test de confirmation en utilisant la méthode de votre choix ou en utilisant une méthode conforme aux réglementations locales.
27

FR (Français)
Tableau 5 : Symboles des résultats des échantillons et interprétation fournis par le logiciel du Système de détection moléculaire 3M.
Type |
Symbole du résultat |
Résultat |
Interprétation |
||
de puits |
du puits |
|
|
||
Échantillon |
|
|
|
Positif |
L’échantillon est présumé positif pour le pathogène cible. |
|
|
|
|
||
|
|
|
|
|
|
Échantillon |
|
|
|
Négatif |
L’échantillon est négatif pour le pathogène cible. |
|
|
|
|
||
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
La matrice de l’échantillon est inhibitrice pour le test. Un second |
Échantillon |
|
|
|
Inhibé |
test peut être nécessaire. Consulter la section de dépannage |
|
|
|
et les instructions relatives au produit du kit de détection pour |
||
|
|
|
|
|
|
|
|
|
|
|
obtenir plus de renseignements. |
|
|
|
|
|
|
|
|
|
|
|
La présence ou l’absence du pathogène cible est indéterminée. |
Échantillon |
|
|
|
À vérifier |
Un second test peut être nécessaire. Consulter la section de |
|
|
|
dépannage et les instructions relatives au produit du kit de |
||
|
|
|
|
|
|
|
|
|
|
|
détection pour obtenir plus de renseignements. |
|
|
|
|
|
Aucune bioluminescence n’a été détectée. Un second test |
Échantillon |
|
|
|
Erreur |
peut être nécessaire. Consulter la section de dépannage et les |
|
|
|
instructions relatives au produit du kit de détection pour obtenir |
||
|
|
|
|
|
|
|
|
|
|
|
plus de renseignements. |
|
|
|
|
|
|
Confirmation des résultats selon la méthode de certification NFVALIDATION
Dans le cadre de la NF VALIDATION, tous les échantillons identifiés comme positifs par le Kit de détection moléculaire Listeria sp 3M version 2 doivent être confirmés par l’un des tests suivants :
Option 1 : utilisation de la norme ISO 11290-1(3) en commençant par l’enrichissement demi-Fraser.
Option 2 : par isolement sur une gélose PALCAM ou une gélose chromogène certifiée dans le cadre d’une méthode
NF VALIDATION pour la détection du genre Listeria. La présence de colonies caractéristiques est suffisante pour confirmer la présence du ssp Listeria.
Option 3 : utilisation de sondes nucléiques tel que décrit dans la norme ISO 7218(5), à partir de colonies isolées provenant de gélose sélective (voir option 1 ou 2).
Option 4 : utilisation de n’importe quelle autre méthode certifiée NF VALIDATION, dont le principe doit être différent du Kit de détection moléculaire Listeria sp 3M version 2. Il convient d’utiliser l’intégralité du protocole décrit pour cette seconde méthode de validation. Toutes les étapes précédant le début de la confirmation doivent être communes aux deux méthodes.
En cas de résultats contradictoires (positif présumé avec le Kit de détection moléculaire Listeria sp 3M version 2, non confirmé par l’un des moyens décrits ci-dessus), le laboratoire doit suivre les procédures nécessaires pour garantir la validité des résultats obtenus.
Pour toute question concernant des applications ou procédures spécifiques, consulter notre site Internet à l’adresse www.3M.com/foodsafety ou contacter votre représentant ou distributeur 3M local.
Annexe A. Interruption du protocole : stockage et nouveau test des lysats soumis à un traitement thermique. Le stockage de lysats entre 2 et 8 °C pendant 72 heures ne s’applique pas aux produits laitiers et aux échantillons environnementaux.
1.Pour conserver un lysat soumis à un traitement thermique, refermer le tube de lyse avec un bouchon propre (voir « Lyse », 4.5).
2.Stocker à une température comprise entre 2 et 8 °C jusqu’à 72 heures.
3.Préparer un échantillon conservé pour amplification en retournant 2 à 3 fois pour mélanger.
4.Ouvrir les tubes.
5.Placer les tubes pour lysats mélangés dans le support de bloc chauffant pour système de détection moléculaire 3M et chauffer à 100 ± 1 °C pendant 5 ± 1 minutes.
6.Retirer le portoir de tubes de solution de lyse 3M du bloc chauffant et laisser refroidir dans le support de bloc refroidissant pour système de détection moléculaire 3M pendant une durée comprise entre 5 et 10 minutes.
7.Poursuivre le protocole à la section « Amplification » détaillée ci-dessus.
28

FR (Français)
Références :
1.US Food and Drug Administration Bacteriological Analytical Manual. Chapter 10: Detection of Listeria monocytogenes in foods and environmental samples, and enumeration of Listeria monocytogenes in foods. October 31, 2017.
2.US Department of Agriculture (USDA) FSIS Microbiology Laboratory Guidebook 8.11. Isolation and identification of Listeria monocytogenes from red meat, poultry, ready-to-eat siluriformes (fish) and egg products, and environmental samples. January 2, 2019.
3.NF EN ISO 11290-1. Microbiology of the food chain – Horizontal method for the detection and enumeration of Listeria monocytogenes and of Listeria spp. – Part 1: Detection method.
4.NF EN ISO/IEC 17025. General requirements for the competence of testing and calibration laboratories.
5.NF EN ISO 7218. Microbiology of food and animal feeding stuffs – General requirements and guidance for microbiological examinations.
6.3M Installation Qualification (IQ) / Operational Qualification (OQ) Protocols and Instructions for 3M Molecular Detection System.
7.NF EN ISO 18593. Microbiology of the food chain – Horizontal methods for surface sampling.
8.NF EN ISO 16140-2 Microbiology of the food chain – Method validation – Part 2: Protocol for the validation of alternative (proprietary) methods against a reference method.
9.NF EN ISO 6887. Microbiology of the food chain – Preparation of test samples, initial suspension and decimal dilutions for microbiological examination.
Explication des symboles des étiquettes de produit
www.3M.com/foodsafety/symbols
29

3M Food Safety
3M United States |
3M Europe and MEA |
3MAsiaPacific |
3M Center |
3M Deutschland GmbH |
No 1, Yishun Avenue 7 |
Bldg. 275-5W-05 |
Carl-Schurz - Strasse 1 |
Singapore, 768923 |
St. Paul, MN 55144-1000 |
D41453 Neuss/Germany |
65-64508869 |
USA |
+49-2131-14-3000 |
3M Japan |
1-800-328-6553 |
3M United Kingdom PLC |
|
|
3M Health Care Limited |
|
3M Canada |
Morley Street, |
6-7-29, Kita-Shinagawa |
Post Office Box 5757 |
Loughborough |
Shinagawa-ku, Tokyo |
London, Ontario N6A 4T1 |
Leicestershire |
141-8684 Japan |
Canada |
LE11 1EP |
81-570-011-321 |
1-800-563-2921 |
United Kingdom |
|
|
+(44) 1509 611 611 |
3M Australia |
3M Latin America |
3M Österreich GmbH |
Bldg A, 1 Rivett Road |
3M Center |
North Ryde, NSW 2113 |
|
Bldg. 275-5W-05 |
Euro Plaza |
Australia |
St. Paul, MN 55144-1000 |
Gebäude J, A-1120 Wien |
61 1300 363 878 |
USA |
Kranichberggasse 4 |
|
1-954-340-8263 |
Austria |
|
+(43) 1 86 686-0 |
|
|
|
|
|
3M is a trademark of 3M. Used under license in Canada. |
|
© 2020, 3M. Unauthorized use prohibited. All rights reserved. |
3M Company |
3M est une marque de commerce de la Compagnie 3M. |
2510 Conway Ave |
Utilisées sous licence au Canada. © 2020, 3M. Toute utilisation non |
St. Paul, MN 55144 USA |
autorisée est interdite. Tous droits réservés. |
www.3M.com/foodsafety |
34-8726-1409-3 |
 Loading...
Loading...