Page 1

Wizard® Plus SV
小量制备 DNA 纯化系统
原英文技术手册号码:TB225
本说明书用于产品 A1270,A1330, A1340, A1460 和 A1470。
所有的技术文献均可从公司网站 www.promega.com.得到
请访问公司网站以证实您所使用的技术手册为最新版本
介绍…………………………………………………………………………………
I.
2
II. 产品组成 …………………………………………………………………………
III. 操作方法……………………………………………………………………………
A. E. Coli 的制备………………………………………………………………
B. 澄清裂解液产物……………………………………………………………
C 质粒 DNA 的分离及纯化操作方法………………………………………
IV. 补充信息……………………………………………………………………………
A. 质粒及 E. Coli 菌株的选择及制备…………………………………………
B. 挑选菌株……………………………………………………………………
C. 碱性蛋白酶的使用…………………………………………………………
D. 用于荧光自动测序的有关注意事项………………………………………
V. 问题及解决方法……………………………………………………………………
VI. 溶液及缓冲液的组成………………………………………………………………
VII. 相关产品……………………………………………………………………………
3
4
4
5
5
6
6
7
8
8
9
10
11
VIII. 参考文献……………………………………………………………………………
注意:本中文操作手册仅供实验参考,在实际使用中请详细对照原英文技术手册 TB225。如遇到问题请与
Promega 公司北京办事处联系,免费电话: 8008108133;E-mail: promega@promega.com.cn 技术手册号码:CTB225
第 1 页 共 11 页
11
Page 2
I.
介绍
®
Wizard
Plus SV 小量制备 DNA 纯化系统为快速分离质粒 DNA 提供了简单
可靠的方法。整个过程所用时间取决于处理样品的数量,一般在 30 分钟或更短的
时间之内即可完成。该系统能够分离 E. Coli 宿主中的各种质粒,但当质粒小于
20,000bp 时最有效。纯化的质粒不需后续处理即可用于 DNA 荧光自动测序及其
它标准的分子生物学操作。当用于体外转录实验时,需配合核糖核酸酶抑制剂使
用,如:重组 RNasin
本手册提供的方法用于从 E. Coli 中分离质粒 DNA。使用 Wizard
®
核糖核酸酶抑制剂(Cat.#N2511)。
®
Plus SV 小
量制备 DNA 纯化系统,可以从 1-10ml 过夜培养的 E. Coli 中纯化质粒 DNA。许
多因素都能够影响质粒的产量,包括细菌培养液的体积,质粒的拷贝数,培养基
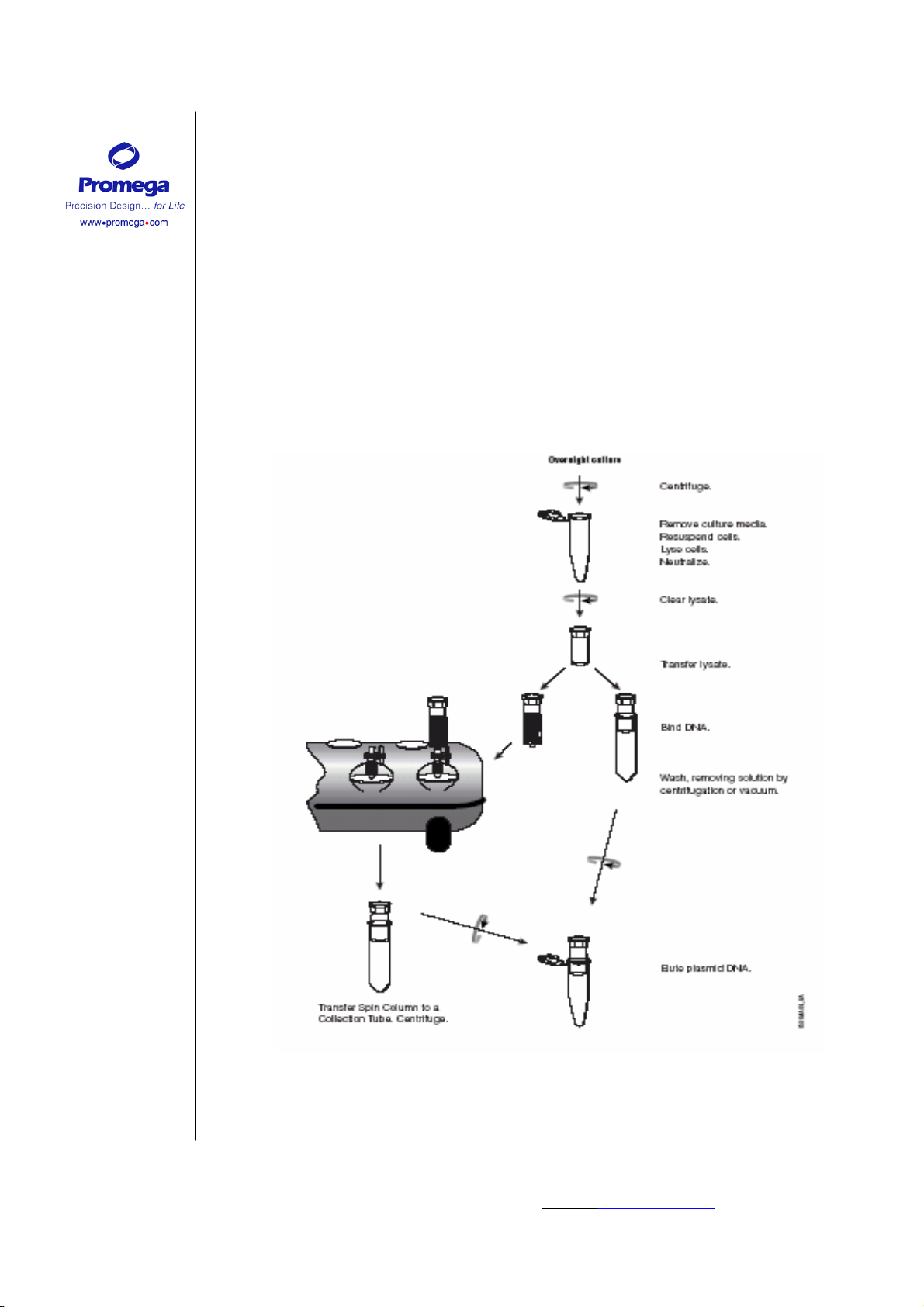
的种类及所使用的菌株。图 1 是使用 Wizard
®
Plus SV 小量制备 DNA 纯化系统分
离及纯化质粒 DNA 的示意图。
图 1. 使用 Wizard
注意:本中文操作手册仅供实验参考,在实际使用中请详细对照原英文技术手册 TB225。如遇到问题请与
Promega 公司北京办事处联系,免费电话: 8008108133;E-mail: promega@promega.com.cn 技术手册号码:CTB225
图。
®
Plus SV 小量制备 DNA 纯化系统分离及纯化质粒 DNA 流程
第 2 页 共 11 页
Page 3

II.
产品组成
产品
Wizard
®
Plus SV 小量制备 DNA 纯化系统
包装
50 次制备
目录号
A1340
(带真空转接器)
实验室使用。每个系统提供足够进行 50 次分离所需的试剂,每次分离可处理 1-10ml
培液。包括:
•
•
•
•
20ml
20ml
30ml
20ml
•
•
•
•
550µl
13ml
•
•
Wizard
Wizard
Wizard
Wizard
50
Wizard
50
收集管(2ml)
碱性蛋白酶溶液
无核酸酶纯水
20
真空转接器
1
技术手册
®
Plus SV 细胞悬浮液
®
Plus SV 细胞裂解液
®
Plus SV 中和溶液
®
Plus SV 柱清洗液
®
SV 微量柱
产品
Wizard
®
Plus SV 小量制备 DNA 纯化系统
包装
250 次制备
目录号
A1470
(带真空转接器)
实验室使用。每个系统提供足够进行 250 次分离所需的试剂,每次分离可处理
1-10ml 培液。包括:
•
•
•
•
75ml
75ml
100ml
100ml
•
•
•
•
2,700µl
25ml
•
•
Wizard
Wizard
Wizard
Wizard
250
Wizard
250
收集管(2ml)
碱性蛋白酶溶液
无核酸酶纯水
20
真空转接器
1
技术手册
®
Plus SV 细胞悬浮液
®
Plus SV 细胞裂解液
®
Plus SV 中和溶液
®
Plus SV 柱清洗液
®
SV 微量柱
产品
Wizard
®
Plus SV 小量制备 DNA 纯化系统
包装
50 次制备
250 次制备
目录号
A1330
A1460
实验室使用。
产品
Wizard
®
Plus SV 小量制备 DNA 纯化系统(试用装)
包装
10 次制备
目录号
A1270
实验室使用。每个系统提供足够进行 10 次分离所需的试剂,每次分离可处理 1-10ml
培液。包括:
注意:不要用其它
Wizard® Plus 系
统中的任何组分
替代 Wizard
Plus SV 小量制
备 DNA 纯化系统
中的组分。
Wizard
Wizard
®
Plus 和
®
Plus SV
系统中的组分不
能互换。
注意:产品 A1330
和 A1460 不包括
真空转接器。
®
注意:本中文操作手册仅供实验参考,在实际使用中请详细对照原英文技术手册 TB225。如遇到问题请与
Promega 公司北京办事处联系,免费电话: 8008108133;E-mail: promega@promega.com.cn 技术手册号码:CTB225
第 3 页 共 11 页
Page 4

注意:当 A
600
达到
2.0-4.0 时,细菌就
达到了适于收获
并分离 DNA 的生
长密度。
Wizard
•
•
•
•
•
•
•
•
•
•
3ml
3ml
4ml
4ml
10
10
550µl
1ml
Wizard
Wizard
Wizard
Wizard
收集管(2ml)
碱性蛋白酶溶液
无核酸酶纯水
5
真空转接器
1
技术手册
®
Plus SV 细胞悬浮液
®
Plus SV 细胞裂解液
®
Plus SV 中和溶液
®
Plus SV 柱清洗液
®
SV 微量柱
储存及稳定性:所有 Wizard® Plus SV 小量制备组分都应存放于 22-25 oC。试剂的
有效期标注于产品标签上。
III.
操作方法
由用户准备的材料
(溶液组成见章节 VI.)
•
含抗生素的 LB 琼脂平板
•
含抗生素的 LB 培养液
•
酒精(95%)
•
能够达到 14,000 x g 的微量离心机
•
1.5ml 消毒离心管
•
能够达到 10,000 x g 的离心机
在使用 Wizard
®
Plus SV 小量制备 DNA 纯化系统前,按照下述方法稀释 Wizard®
Plus SV 柱清洗液:
对于 10 次制备系统(Cat.#A1270):加入 7ml 95%酒精至终体积为 11ml。
对于 50 次制备系统(Cat.#A1330 和 A1340):加入 35ml 95%酒精至终体积为 55ml。
对于 250 次制备系统(Cat.#A1460 和 A1470):加入 170ml 95%酒精至终体积为
270ml。
大肠杆菌的制备
A.
1.
2.
从新鲜的 LB 琼脂平板(含抗生素)上挑出一个单个并容易分离的克
隆放入 1-10ml LB 培养液(含相同的抗生素)进行培养。我们推荐使
用 LB 培养液。富含营养的培养液,如 Terrific Broth, 会导致细胞浓度
过高,这样会使 DNA 纯化系统过载。
o
于 37
C 摇床中培养过夜(12-16 小时)。对于确定体积的培养液,培
养时间可以优化以提高质粒 DNA 的产量。但是曾经观察到培养时间
过长会导致质粒 DNA 的产量下降,这是由于培养液中的细胞死亡及
裂解造成的。
对于高拷贝数的质粒,我们推荐处理的细菌培养物不要超过 5ml。如果处理
的细菌培养物超过 5ml,就会超出 Wizard
提高质粒 DNA 的产量。
®
SV 微量柱的处理范围因而不会
注意:本中文操作手册仅供实验参考,在实际使用中请详细对照原英文技术手册 TB225。如遇到问题请与
Promega 公司北京办事处联系,免费电话: 8008108133;E-mail: promega@promega.com.cn 技术手册号码:CTB225
第 4 页 共 11 页
Page 5

对于低拷贝数的质粒,有必要处理较大体积的细菌培养物(多至 10ml)以
得到足够的质粒 DNA。处理量如果超过 10ml 则会导致细菌裂解液无法充
分澄清并因此增加质粒 DNA 的污染。
获得澄清的裂解液
B.
将 1-5ml (高拷贝数的质粒)或 10ml(低拷贝数的质粒)的细菌培养物
1.
用台式离心机 10,000 x g 离心 5 分钟。弃去上清并将试管倒置于纸巾
上吸去剩余的培养液。
加入 250µl 细胞悬浮液并旋涡震荡或吹打以充分悬浮细胞。充分悬浮
2.
细胞非常关键。如果不在离心管中,将悬浮的细胞转移至 1.5ml 消毒
离心管中。
加入 250µl 细胞裂解液并颠倒离心管4 次以充分混合(不要旋涡震荡)。
3.
孵育至细胞悬浮液澄清,大约需要 1-5 分钟。
注意:加入碱性蛋白酶溶液(第 4 步)之前观察裂解液部分澄清非常
重要;但是孵育时间不要超过 5 分钟。
加入 10µl 碱性蛋白酶溶液并颠倒离心管 4 次以充分混合。于室温孵育
4.
5 分钟。
5.
6.
质粒 DNA 的分离及纯化操作方法
C.
小量制备 DNA 纯化系统时,可以对质粒 DNA 的纯化方法进行选择。可以
利用离心细菌裂解液使得澄清裂解液流过 Wizard
DNA 的方法来纯化质粒 DNA。或者利用真空使得裂解液流过离心柱并清洗
质粒 DNA。纯化质粒 DNA 时可以利用真空转接器连接真空接头及真空源。
离心方法
质粒 DNA 纯化单元的准备:对
于每一个样品将一个离心柱插
入一个 2ml 收集管中。
碱性蛋白酶能够灭活核酸酶及其它在细菌裂解过程中释放出的能够影
响分离质粒质量的蛋白。
加入 350µl Wizard
混合(不要旋涡震荡)。
于室温将细胞裂解液以最大速度(约 14,000 x g)离心 10 分钟。
同时购买了真空转接器(Cat.#1340, A1470)的用户使用Wizard
®
Plus SV 中和溶液并迅速颠倒离心管 4 次以充分
®
SV 微量柱并清洗质粒
真空方法
将一个带有 LuerLok
器与接头(例如:Vac-Man
真空接头)的一个出口相连。将一
个离心柱插入真空转接器并紧密贴
合。
®
®
Plus SV
的真空转接
®
实验室
注意:第二步以
后,不要旋涡震荡
以避免切断染色
体 DNA。
注意:第四步用碱
性蛋白酶孵育时,
不要超过 5 分钟,
否则质粒 DNA 会
出现缺口。
注意:本中文操作手册仅供实验参考,在实际使用中请详细对照原英文技术手册 TB225。如遇到问题请与
Promega 公司北京办事处联系,免费电话: 8008108133;E-mail: promega@promega.com.cn 技术手册号码:CTB225
第 5 页 共 11 页
Page 6

注意:如果不小心
将白色沉淀转移
到了离心柱中,将
离心柱中的内含
物重新转入一个
1.5ml 消毒离心管
中并以最大速度
离心 5-10 分钟。将
离心后的上清液
转移至先前使用
的离心柱中。离心
柱中可以重复使
用,但仅限于同一
样品。
英寸汞柱与其它
压力度量单位的
比较。
15 英寸汞柱
50.8kPa
381 Torr
0.501atm
7.37psi
38.1cm Hg
508mbar
注意:如果 DNA
将用于自动荧光
测序,在第十一步
不要向 DNA 中加
入 TE 缓冲液。
将澄清裂解液(大约 850µl, 章节
1.
III.B, 第 6 步)转移至准备好的离心
柱中。不要搅动或将任何白色沉淀
与上清液一同转移。
于室温用离心机以最大速度离心上
2.
清液 1 分钟。从收集管中取出离心
管并弃去收集管中的液体。将离心
柱重新插入收集管中。
加入 750µl 先前用 95%酒精稀释过
3.
的柱清洗液。
于室温用离心机以最大速度离心 1
4.
分钟。从收集管中取出离心管并弃
去收集管中的液体。将离心柱重新
插入收集管中。
用 250µl 柱清洗液重复清洗步骤。
5.
于室温用离心机以最大速度离心 2
6.
分钟。
将离心柱转移至一个新的 1.5ml 消
7.
毒离心管中,操作时需小心,不要
将任何一点柱清洗液与离心柱一同
转移。如果离心柱上粘有柱清洗液,
则重新以最大速度离心 1 分钟。
将澄清裂解液(大约 850µl, 章
1.
节 III.B, 第 6 步)转移至准备好
的离心柱中。不要搅动或将任何
白色沉淀与上清液一同转移。
使用最少 15 英寸汞柱的真空将
2.
液体从离心柱吸出。当所有的液
体被吸出后,释放真空。
加入 750µl 先前用95%酒精稀释
3.
过的柱清洗液。
用真空将柱清洗液从离心柱吸
4.
出。当所有的液体被吸出后,释
放真空。
用 250µl 柱清洗液重复清洗步
5.
骤。用真空将液体从离心柱吸
出。
继续使用真空 10 分钟以吸干离
6.
心柱。
关闭真空并将离心柱转移至一
7.
个 2ml 收集管中。以最大速度离
心 2 分钟以除去残留的柱清洗
液。弃去 2ml 收集管及 本步收
集的所有液体。
将离心柱转移至一个新的 1.5ml 消毒离心管中。
8.
将 100µl 无核酸酶的水加入离心柱以洗脱质粒 DNA。于室温用离心机以最
9.
大速度离心 1 分钟。
洗脱质粒 DNA 后,将离心柱从 1.5ml 消毒离心管中取出并弃去离心柱。
10.
o
C 及以下是稳定的。TE 缓冲液中的 DNA
o
C 或以下。
IV.
不加缓冲液的 DNA 水溶液在-20
11.
o
在 4
12.
C 是稳定的。如果需要将 DNA 存放于 TE 缓冲液中,将 11µl 10XTE 缓
冲液 加入 100µl 洗脱的 DNA 中。
将离心管盖好并将纯化后的质粒 DNA 存放于-20
补充信息
质粒及 E. Coli 菌株的选择及制备
A.
可以利用 Wizard
®
Plus SV 小量制备 DNA 纯化系统从过夜培养的 E.
Coli 中纯化质粒 DNA。质粒的产量与许多因素有关,包括质粒的拷贝数,
细菌培养液中细胞的密度,培养基的种类及所使用的菌株。
质粒的拷贝数是影响质粒 DNA 产量的重要因素。质粒的拷贝数主要取
决于并包括复制起始区在内的 DNA 周围区域。这一区域通常被称为复制子,
有细菌的酶复合体控制质粒 DNA 复制。如果将某些 DNA 插入某一特定的
质粒,将会干扰质粒的复制而降低其拷贝数。
注意:本中文操作手册仅供实验参考,在实际使用中请详细对照原英文技术手册 TB225。如遇到问题请与
Promega 公司北京办事处联系,免费电话: 8008108133;E-mail: promega@promega.com.cn 技术手册号码:CTB225
第 6 页 共 11 页
Page 7

隆放入 1-10ml LB 培养液(也含抗生素)进行培养。培养物应于 37
床中培养过夜(12-16 小时)。对于高拷贝数的质粒而言,当 A
时,细菌就达到了适于收获并分离 DNA 的生长密度。
B.
挑选菌株
蛋白有 endA 基因编码。基因型为 endA1 的 E. Coli 在野生型的 endA 基因
中引入了一个突变,导致其产生没有活性的内切酶。具有这种突变的 E.
Coli 被命名为 EndA
表 1 是 EndA
表 1. EndA
EndA
BJ5183
DH1
DH20
DH21
DH5α
JM103
JM105
JM106
JM107
JM108
JM109
MM294
Select96
SK1590
SK1592
SK2267
SRB
TOP10
XL1-Blue
XLO
生型基因,它表达具有活性的核酸内切酶 I。野生型表示为 EndA
Wizard
Coli 菌株中获得高质量的 DNA。但 是 EndA
存在问题。一般而言,我们推荐尽可能使用 EndA
自动荧光测序一类的应用。
化产量及质粒质量。若要得到适宜的荧光 DNA 测序结果,质粒扩增时应
使用高拷贝数质粒及 EndA
注意:本中文操作手册仅供实验参考,在实际使用中请详细对照原英文技术手册 TB225。如遇到问题请与
Promega 公司北京办事处联系,免费电话: 8008108133;E-mail: promega@promega.com.cn 技术手册号码:CTB225
从新鲜的 LB 琼脂平板(含抗生素)上挑出一个单个并容易分离的克
o
C 摇
达到 2.0-4.0
600
核酸内切酶 I 是一种 12k Da 的胞周蛋白,它可以降解双链 DNA。该
-
。
-
-
和 EndA
-
和 EndA
+
E. Coli 菌株的列表。
+
E. Coli 菌株
+
EndA
BL21(DE3)
CJ236
HB101
JM83
TM
JM101
JM110
LE392
MC1061
NM522(所有的 NM 系列菌株均为 EndA
+
)
NM554
P2392
+
)
TM
PR700(所有的 PR 系列菌株均为 EndA
Q358
RR1
TB1
TG1
Y1088(所有的 Y10 系列菌株均为 EndA
+
)
BMH 71-18
ES1301
如果 E. Coli 菌株的基因型中缺少 endA1(或 endA)则意味着存在野
+
。利用
®
Plus SV 小量制备 DNA 纯化系统可以轻易地从EndA-和 EndA
+
E. Coli 菌株对于许多应用都
-
菌株,特别是对于诸如
+
E.
对于诸如自动荧光测序一类的应用,应特别注意选择质粒及菌株以优
-
菌株。
第 7 页 共 11 页
Page 8

注意:为了得到适
宜的自动荧光测
序结果,一般使用
高拷贝数质粒及
-
EndA
E.coli. 菌
株。
碱性蛋白酶的使用
C.
D.
为了提高从 EndA
Wizard
®
Plus SV 小量制备 DNA 纯化系统包含了碱性蛋白酶溶液。碱性
蛋白酶,最初被命名为 subtilisin Carlsberg,是从 Bacillus licheniformis 细
菌中分离到的(1)。在制备澄清细菌裂解液以灭活核酸内切酶的过程中,
于裂解步骤的最后向每个样品中加入大约 250µg 碱性蛋白酶。碱性蛋白酶
也可以非特异性地降解蛋白,这样就降低了澄清细菌裂解液中蛋白污染的
整体水平(2,3)。
碱性蛋白酶在本步骤中非常有用,因为它的最适 PH 为 9 或以上,能
够在裂解步骤的环境中保持活性。当裂解液被中和后,碱性蛋白酶活性也
随着降低(4,5)。
本方法制备的 DNA 已经被广泛的分子生物学应用所验证,包括荧光
测序,内切酶消化及克隆。
用于自动荧光测序时的有关注意事项
对于自动荧光测序应用,应特别注意选择质粒种类及大肠杆菌菌株以
优化产量及质粒质量。
纯化的质粒 DNA 必须在适于自动循环测序的浓度范围内(理想浓度
为 0.2µg/µl 而不要低于 0.1µg/µl)。当操作低拷贝质粒时,我们强烈推荐:
在任何应用之前,应使用琼脂糖凝胶/溴乙啶方法确定质粒 DNA 的浓度
(6)。用分光光度计对 DNA 定量容易导致误差而且需要大量的样品。
当使用 pGEM
Plus SV 小量制备 DNA 纯化系统的常规质粒 DNA 产量为 3.5-5.0µg。对
于低拷贝数质粒,需要较大体积的培养液以得到足够用于测序的 DNA。
当使用 pALTER
时,典型低拷贝数质粒 DNA 产量为 1.5-3.0µg。
使用 BigDye
®
试剂测序时的特别注意事项
用 Wizard
®
Plus SV 小量制备 DNA 纯化系统纯化的模板适用于许多
荧光染色测序方法,包括 ABI PRISM
(Perkin-Elmer Cat.#4303149, 4303150, 4303151)。
当稀释 BigDye
-
和 EndA
®
载体及 1.5ml LB 培养液中的DH5αTM细胞时,Wizard®
®
-1 载体(安卞抗性)及 10ml LB 培养液中的 DH5αTM细胞
®
终止反应混合物时必须使用合适的稀释缓冲液(250
mM Tris-HCl [PH 9.0], 10mM MgCl
+
E. Coli 菌株分离的质粒 DNA 质量,
®
BigDye® 末端终止反应
)。
2
当使用高拷贝数质粒并将终止反应混合物稀释 6 倍时,可以得到超过 500
碱基的可读序列。
表 2 概括了为得到 BigDye
®
终止反应混合物的合适稀释度而需要的
终止反应混合物和稀释缓冲液的量。如需了解这些反应的详细信息,请参
考 BigDye
的试剂加入到单独的试管中。
®
末端终止系统提供的操作手册。对于每一反应,应将表 2 中
注意:本中文操作手册仅供实验参考,在实际使用中请详细对照原英文技术手册 TB225。如遇到问题请与
Promega 公司北京办事处联系,免费电话: 8008108133;E-mail: promega@promega.com.cn 技术手册号码:CTB225
第 8 页 共 11 页
Page 9

表 2. BigDye® 末端终止反应的合适稀释度
组分
终止反应混合物*
双链质粒 DNA
模板
引物
稀释缓冲液**
加入无核酸酶纯
水使终体积为:
*终止反应混合物是 2.5X 溶液。
**稀释缓冲液是 5X 溶液。
VI.
问题及解决方法
问题
细胞裂解不好
无纯化的质粒
DNA
质粒 DNA 产
量低
质粒 DNA 有
缺口
200-500ng
可能原因
培养液中的细菌细胞
太多
沉淀的细菌细胞悬浮
不好
柱清洗液中未加入酒
精
质粒 DNA 定量不准
确
在凝胶定量上样时
DNA 漂出加样孔
使用了低拷贝数质粒
细菌培养液中未转化
细胞过度生长
细菌培养时间过长
使用了低拷贝数质粒
质粒 DNA 定量不准
确
碱水解过程中孵育时
间过长
量
不稀释
8.0µl
200-500ng
3.2pmol
0µl
20µl
1:2
4.0µl
3.2pmol
2.0µl
20µl
1:4
2.0µl
200-500ng
3.2pmol
3.0µl
20µl
200-500ng
3.2pmol
评论
使用 A
为 2.0-4.0 的细菌培养液。所有培
600
养液应含有抗生素。对于低或高拷贝数质粒使
用推荐的培养体积(低拷贝数最多 10ml,高 拷
贝数最多 5ml)。
在裂解细胞前充分悬浮细胞。旋涡震荡或吹打
细胞悬浮液。悬浮后应看不到细胞团块。
操作前按照章节 III 介绍的方法准备柱清
洗液。
使用琼脂糖凝胶/溴乙啶电泳方法确定质粒
DNA 的产量。
最后一步清洗后,确保干燥 10 分钟(真空方
法),让剩余的酒精挥发掉。提高上样染料的
浓度。
使用高拷贝数质粒。
确认所有的液体及固体培养基中均使用了抗
生素。
从新鲜的过夜培养的平板上挑选一个克隆加
入含有抗生素的培养基。于 37
o
C 培养 12-16
小时。
了解所使用质粒的拷贝数;我们推荐使用高拷
贝数质粒。
使用琼脂糖凝胶/溴乙啶电泳方法确定质粒
DNA 的产量。不要依赖分光光度计定量的准
确性。
当细胞悬液中加入裂解液及碱性蛋白酶孵育
时,每一步不要超过 5 分钟。
1:6
1.3µl
3.4µl
20µl
对未标于此处的
问题,请与您当
地的 Promega 办
事处或分公司联
系。进一步的资
料可登陆网页
www.promega.co
m。
E-mail:
techserv@prome
ga.com.
注意:本中文操作手册仅供实验参考,在实际使用中请详细对照原英文技术手册 TB225。如遇到问题请与
Promega 公司北京办事处联系,免费电话: 8008108133;E-mail: promega@promega.com.cn 技术手册号码:CTB225
第 9 页 共 11 页
Page 10

自动荧光测序结
果不好
内切酶无法消化
染色体 DNA 污
染
凝胶上的 DNA
产量看起来低于
分光光度计的读
数
测序反应时加入的
DNA 太少
DNA 洗脱时使用了 TE
缓冲液
质粒 DNA 的浓度定量
不准确
提高内切酶的浓度,延
长消化时间
旋涡震荡或过度混合会
造成染色体 DNA 污染
使用了错误的试剂
洗脱的 DNA 中存在的
痕量污染会导致分光光
度计的读数升高
VI.
缓冲液及溶液的组成
使用新挑选的 E. coli 克隆并用新鲜的 LB
培养基 进行培养。纯化质粒并用琼脂糖凝
胶/溴乙啶电泳方法确定质粒 DNA 的产量。
重新纯化质粒 DNA 并用无核酸酶的水洗脱
DNA。
必须使用琼脂糖凝胶/溴乙啶电泳方法确定
质粒 DNA 的产量。
增加内切酶的用量或延长孵育时间。使用建
议温度及适合所用内切酶的缓冲液进行消
化。用乙醇沉淀质粒 DNA 以除去残留的盐。
样品中加入裂解液后不要旋涡震荡以避免
切断染色体 DNA。
确认在使用前用酒精稀释柱清洗液。
注意:Wizard
®
Plus 和 Wizard® Plus SV 组
分不能互换。
用苯酚:氯仿抽提并用乙醇沉淀 DNA,并在
重复分光光度计读数前用 70% 乙醇清洗
DNA 沉淀。用琼脂糖凝胶/溴乙啶电泳方法
以得到最准确的定量结果。
5X 稀释缓冲液
250mM
10mM
10X TE 缓冲液
100mM
10mM
LB 培养基
溶解于 1L 双蒸水中。高压并冷却
o
到 55
Wizard
Tris-HCl (PH 9.0)
MgCl
2
Tris-HCl (PH 7.5)
EDTA
10g
酪蛋白胨
5g
酵母提取物
5g
NaCl
15g
琼脂(仅用于平板)
C 后加入抗生素。
®
Plus SV 细胞裂解液
0.2M
1%
NaOH
SDS
Wizard
®
Plus SV 细胞悬浮液
50mM
10mM
100µg/ml
Tris-HCl (PH 7.5)
EDTA
Rnase A
Wizard
®
Plus SV 中和溶液
4.09M
0.759M
2.12M
盐酸胍
醋酸钾
冰醋酸
最终 PH 约为 4.2。
Wizard
®
Plus SV 柱清洗液
168.2 mM
22.6mM
0.109mM
醋酸钾
Tris-HCl (PH 7.5)
EDTA (PH 8.0)
如章节 III 所述对于 50 次制备系统加入
35ml 95%酒精(对于 250 次制备系统加
入 170ml 95%酒精,对于 10 次制备系统
加入 7ml 95%酒精)。终浓度约为:60%
酒精,60mM 醋酸钾,8.3mM Tris-HCl
及 0.04mM EDTA。
注意:本中文操作手册仅供实验参考,在实际使用中请详细对照原英文技术手册 TB225。如遇到问题请与
Promega 公司北京办事处联系,免费电话: 8008108133;E-mail: promega@promega.com.cn 技术手册号码:CTB225
第 10 页 共 11 页
Page 11

相关产品
VII.
产品
Wizard
®
SV 96 质粒 DNA 纯化系统*
Wizard
Wizard
Wizard
Wizard
Wizard
Wizard
Wizard
®
SV 9600 质粒 DNA 纯化系统
®
SV 96细胞悬浮液*
®
SV 96细胞裂解液*
®
SV 96中和溶液*
®
SV清洗液*
®
SV 96 结合板*
®
SV 96 裂解物清除板*
Vac-Man 实验室真空接头
Vac-Man 96真空接头
真空转接器
SV总RNA分离系统*
Bright-Glo
TM
*实验室使用。
参考文献
VIII.
Guntelberg, A.V. and Otteson, M. (1954) Compt. Rend. Trav. Lab. Carlsberg 29, 36.
1.
Aehle, W. et al. (1993) Rational protein engineering and industrial application:
2.
Structure prediction by homology and rational design of protein-variants with improved
‘washing performance’-the alkaline protease from Bacillus alcalophilus. J. Biotechnol.
28, 31.
Van der Osten, C. et al. (1993) Protein engineering of subtilisins to improve stability in
3.
detergent formulations. J. Biotechnol. 28, 55.
Vetter, R. et al. (1994) Highly alkaline proteases. U.S. Pat. No. 5,352,603. (October 4,
4.
1994).
Shetty, J. K., Patel, C. P. and Nicholson, M. A. (1995) Method of preparation of purified
5.
alkaline proteases. U.S. Pat. No.5,439,817. (August 8, 1995).
Kahn, M. et al. (1979) Plasmid cloning vehicles derived from plasmids Co/E1, F, R6K,
6.
and RK2. Meth. Enzymol. 68, 268.
萤光素酶检测系统
包装
1x96 次制备
5x96 次制备
100x96 次制备
500ml
500ml
500ml
185ml
10包
10包
20-样品容量
2-样品容量
96-孔容量
20
50次制备
10次制备
目录号
A2250
A2255
A2258
A7113
A7123
A1481
A1311
A2271
A2241
A7231
A7660
A2291
A1331
Z3100
Z3101
注意:本中文操作手册仅供实验参考,在实际使用中请详细对照原英文技术手册 TB225。如遇到问题请与
Promega 公司北京办事处联系,免费电话: 8008108133;E-mail: promega@promega.com.cn 技术手册号码:CTB225
第 11 页 共 11 页
 Loading...
Loading...