Page 1

Powerlink® 系统及 IntuiTrak® 输送系统
用于腹主动脉瘤 (AAA)
(两肢型覆膜支架型号及辅助型号)
请在开始使用任何 Endologix Powerlink 系统前认真阅读本手册所含全部说明。
小心:(美国)联邦法律仅限医师出售或订购该设备。
Endologix Powerlink 系统在灭菌后提供,并仅供一次性使用。因此,请在使用前仔细检查包装。如果产品已打开、损坏或标签字迹不可识
别,请不要使用此设备。
*美国专利:6,077,296 6,090,128 6,156,063 6,187,036 6,197,049 6,210,422 6,261,316 6,331,190 6,660,030
其他美国和海外专利申请
Irvine, CA 92618-2013
+1 (949) 595-7200
如欲索取多国语言使用说明,请造访 Endologix 网站 (www.endologix.com
或欲索取光碟,请致电客服 (800) 983-2284 或 +1 (949) 595-7200。
使用说明
重要须知:
Endologix, Inc.
11 Studebaker
U.S.A
(800) 983-2284
EMERGO EUROPE
Molenstraat 15
2513 BH, The Hague
The Netherlands
电话: +31 (0)70 345 8570
传真: +31 (0)70 346 7299
),
1
Page 2

1.0 设备介绍 3
2.0 用途 5
3.0 禁忌症 6
4.0 警告和警示信息 6
4.1 概述 6
4.2 患者选择、治疗和随访 6
4.3 植入程序 7
4.4 MRI(核磁共振成像)的安全性和兼容性 7
5.0 不良事件 7
5.1 观察到的不良事件 7
5.2 潜在不良事件 7
5.3 设备相关不良事件的报告 8
6.0 临床研究摘要 8
6.1 目的 8
6.2 研究设计 8
6.3 患者责任和随访 9
6.4 人口统计信息和基线病史数据 11
6.5 基线动脉瘤数据 13
6.6 植入的设备
6.7 研究结果 15
6.8 安全性 15
6.9 效力 19
6.10 急性手术数据 23
7.0 患者选择和治疗 23
7.1 治疗的个体化 23
8.0 患者告知信息 23
9.0 供应方式 24
10.0 临床使用信息 27
10.1 医师培训计划 27
10.2 使用前的检查 27
10.3 要求的材料 27
10.4 设备直径的确定原则 27
11.0 使用说明 29
11.1 一般使用说明 29
11.2 植入前决定因素 29
11.3 患者准备 30
11.4 设备准备 30
11.5 步骤
11.6 步骤
– 两肢型覆膜支架的输送 30
– 延长覆膜支架的输送 32
12.0 成像指导原则和术后随访 34
12.1 概述 34
12.2 造影和无造影
12.3 腹部
X 光片 35
CT 推荐 35
12.4 超声 35
12.5 MRI
安全性和兼容性 36
12.6 额外监控和治疗 36
13.0 设备追踪信息 36
14.0 图例 37
15.0 退货 37
目录
15
2
Page 3
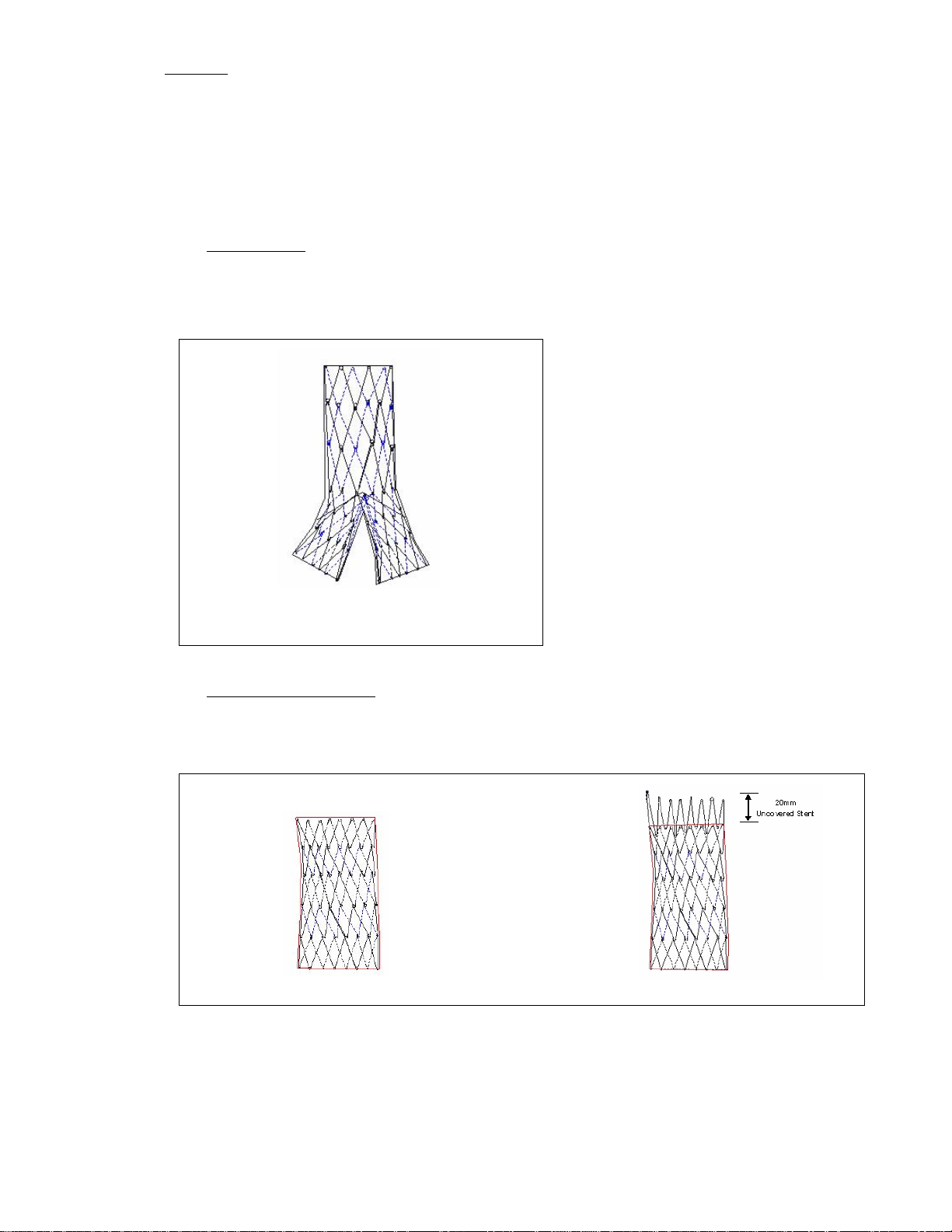
1.0 设备介绍
用于 AAA 的 Powerlink 覆膜支架系统由两部分组成: 一个可植入覆膜支架和一个一次性输送导管。 预先装
配的覆膜支架通过股动脉或髂动脉由导丝经腔内插入,并在部署和回缩输送系统时扩张到额定直径。 在部署
和扩张中,覆膜支架旨在形成一个包围动脉瘤所在位置的近端和远端密封区域。
Powerlink 覆膜支架由一个钴铬合金自扩张支架笼组成,并含一个在近端和远端通过聚丙烯缝合物连接到支架
笼的薄壁、低孔隙率 ePTFE 覆膜层。 Powerlink 系统由一个整体两肢型覆膜支架组成,其近端延长套和肢端
延长辅助覆膜支架可按需适应患者的具体解剖结构需要或解决内漏。 各组件会被单独引入患者的脉管系统
中。
1.1 设备组件
两肢型覆膜支架
两肢型组件(图 1)是插入患者动脉的主要组件。 所有两肢型覆膜支架都含一个整体配置(一个动脉
主体和两个连接的骼支脚)。 主体和各骼支脚由单个网线构成。 其主体的制造规格在 22 毫米到 28
毫米范围内。 所有规格两肢型覆膜支架的骼支脚直径均为 13 毫米至 16 毫米。
图 1. Powerlink 两肢型覆膜支架
22、25 和 28 毫米肾下两肢型覆膜支架
近端和骼肢端延长覆膜支架
近端和骼肢端延长覆膜支架组件(图 2 和 图 3)用于根据患者的解剖结构按需延长植入两肢型组件的
长度。
图 2. Powerlink 近端延长覆膜支架
肾下近端延长
肾上近端延长
3
Page 4
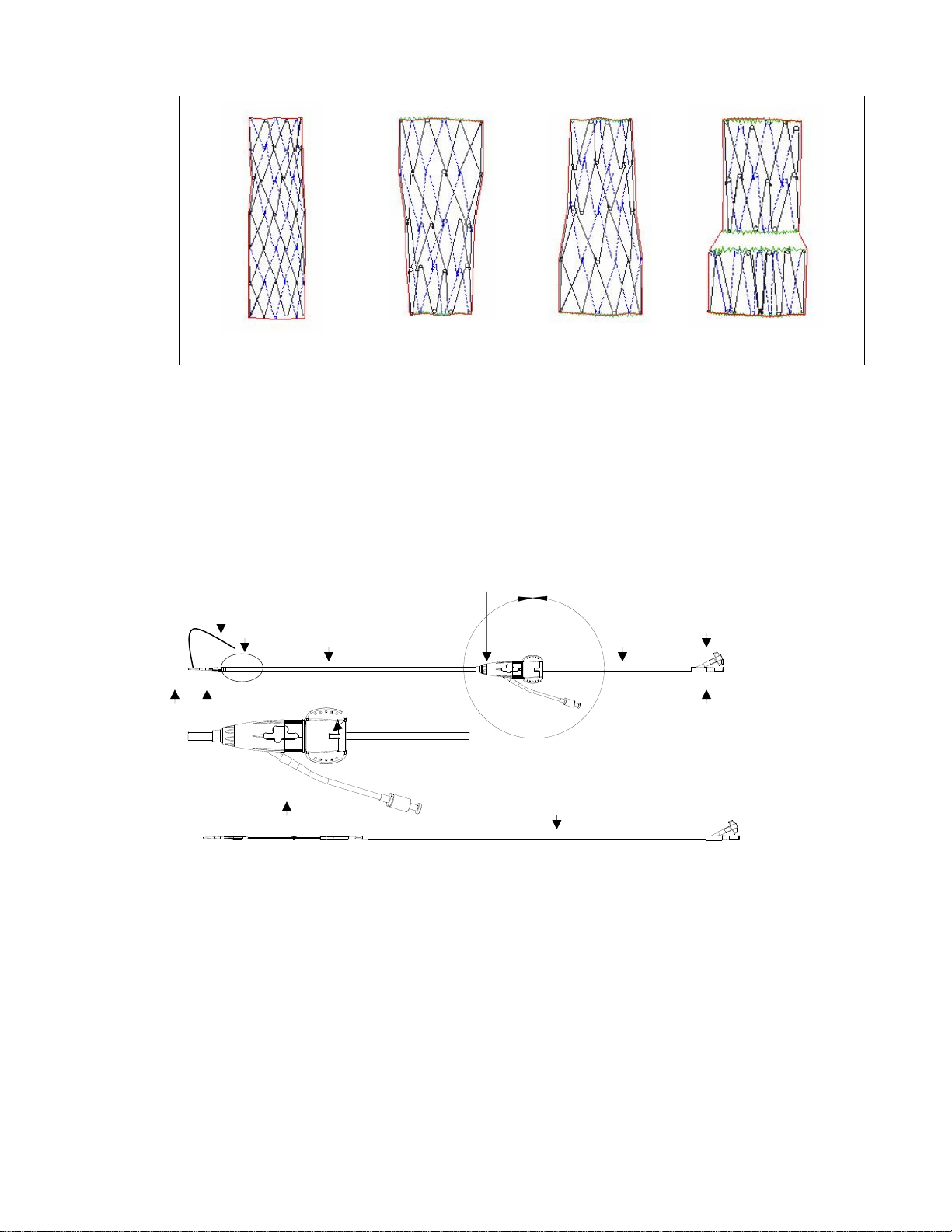
图 3. 骼肢端延长覆膜支架
直型、锥状、扩口状和阶梯状骼肢端延长
输送系统
IntuiTrak 输送系统是一个一次性可丢弃系统,用于部署两肢型和辅助覆膜支架配置。
两肢型输送系统(图 4)采用内主体和肢端套以及导管鞘的集成设计,导管鞘可在压缩状态下约束自
扩张覆膜支架。 主体和肢端套包含覆膜支架体和肢端。 随着导管鞘的回缩,含覆膜支架的主体和肢
端套会被暴露出来。 在部署控制线缆回缩且限制作用消失时,自扩张覆膜支架可在植入医师的精确控
制下在血管内扩张。 导管可与 0.035 英寸导丝配套使用。
图 4. 用于 Powerlink 两肢型覆膜支架的 IntuiTrak 输送系统
5
3
11
2 1
4
9
6
10
6
8
7
1) 不透射线尖端 2) 不透射线标志(导管鞘上)
SurePass 对侧肢端导丝
3)
(连接到对侧肢端套上)
5) 回缩接头 6) 内核心组件
7)
中央空腔 8) 控制线缆手柄
止血阀 10) 带冲洗阀的侧口
9)
11)
两肢型覆膜支架(预装配) 12) 扩张器(未显示)
用于直径在 28 毫米及以下的辅助覆膜支架的输送系统(图 5)采用同轴设计,其外鞘在压缩状态下约
束辅助覆膜支架。 在外鞘回缩时,约束力消失,自扩张辅助覆膜支架即可在血管内扩张。 其输送系
统含一个接头和用于冲洗的侧口。 根据覆膜支架的类型,提供的导管规格为 17 或 19Fr 外形,并可与
0.035 英寸导丝配套使用。 此输送系统可在两肢型覆膜支架部署后经由两肢型导管鞘插入,也可在无
导管鞘时使用。
4)
4
导管鞘
Page 5

3
图 5. 用于 Powerlink 延长覆膜支架(17 和 19Fr)的 IntuiTrak 输送系统
1 2 4 3
1 核心组件 3 覆膜支架
2 外鞘
还提供了用于辅助近端延长支架的两个 21Fr 输送系统。 21Fr IntuiTrak 快速输送系统(图 6)可用于
在两肢型覆膜支架部署后经由两肢型导管鞘输入辅助近端延长支架。 它采用同轴设计,由外鞘约束压
缩状态下的辅助覆膜支架。 随着核心组件的前进,辅助覆膜支架被推过两肢型导管鞘,到达目的位
置。 在两肢型导管鞘回缩时,约束力消失,自扩张辅助覆膜支架即可在血管内扩张。 其输送系统含
一个接头和用于冲洗的侧口。 导管可与 0.035 英寸导丝配套使用。
图 6. 用于 Powerlink 延长覆膜支架 (21Fr) 的 IntuiTrak 快速覆膜支架输送系统
4
2
1 核心组件 3 手柄
2 带覆膜支架的外鞘
21Fr IntuiTrak 独立输送系统(图 7)也可用于某些辅助近端延长支架的输送。 它采用同轴设计,由外
亲水涂膜鞘约束压缩状态下的辅助覆膜支架。 在外鞘回缩时,约束力消失,自扩张辅助覆膜支架即可
在血管内扩张。 其输送系统含一个接头和用于冲洗的侧口。 导管可与 0.035 英寸导丝配套使用。
图 7. 用于 Powerlink 延长覆膜支架 (21Fr) 的 IntuiTrak 覆膜支架输送系统
(连接到手柄) 4 不透射线尖端
3
1
(连接到手柄) 4 不透射线尖端
4 2
1
1 核心组件 3 回缩接头
2 带覆膜支架的外鞘
(连接到手柄) 4 不透射线尖端
2.0 用途
Powerlink 系统两肢型覆膜支架和延长覆膜支架附件旨在用于 AAA 患者的血管内治疗。 这些设备适用于其血
管瘤形态适于进行血管内修复的患者,包括:
与要求的输送系统相兼容的足够骼/股动脉入口(直径 7 毫米)
肾动脉和动脉瘤之间为无动脉瘤的动脉颈部:
长度 15 毫米
直径 18 毫米且 32 毫米
到动脉瘤体的颈角 60°。
动脉长度长出所选两肢型型号主体部分 1.0 厘米。
髂总动脉远端固定部位:
远端固定长度 15 毫米
具有保留至少一条下腹动脉的能力
直径 10 毫米且 23 毫米
到主动脉杈的骼角 90°。
延长覆膜支架必须能够与两肢型覆膜支架重叠 15 到 20 毫米。
5
Page 6

3.0 禁忌症
Powerlink 系统禁忌用于:
存在覆膜支架感染威胁状况的患者
对设备材料敏感或过敏的患者
4.0 警告和警示信息
4.1 概述
请认真阅读所有说明。 不正确遵从说明、警告和警示信息可导致严重后果或使患者受伤。
用于 AAA 的 Powerlink 系统只能由接受过血管干预技术和此设备使用培训的医师和小组使用。 具体
的培训预期将在第 10.1 部分“医师培训计划”中描述。
在植入或再干预手术中始终应保持一个血管手术小组待命,以防必要时转为开放手术修复。
4.2 患者选择、治疗和随访
用于 AAA 的 Powerlink 系统不推荐在不能接受或不遵从必要的术前和术后成像和植入研究的患者中,
如第 12.0 部分“成像指导原则和术后随访”所述。
用于 AAA 的 Powerlink 系统不推荐在不能耐受术中和术后随访成像所必需的造影剂的患者中使用。
可能影响成功动脉瘤隔离的关键解剖要素包括严重的近端动脉颈部成角(肾下颈部到动脉瘤体轴间角
度 > 60°);近端动脉颈部短(< 15 毫米);以及动脉植入部位发生血栓和/或钙化,特别是在近端动
脉颈部和远端骼动脉交界处。 不规则的钙化和/或斑块可能影响植入部位的固定和密封。 呈现这些关
键解剖要素的动脉颈部可能更易于覆膜移动。
入口血管直径和形态(最小扭曲、阻塞疾病和/或钙化)应与 21Fr 规格的血管介入技术和输送系统相
符。 用于 AAA 的 Powerlink 系统不通过血管导管鞘输送。 明显钙化、阻塞、扭曲或栓塞的血管可能
不允许放置腔内覆膜和/或可能提高血栓形成的风险。
若不能保持至少一条内骼动脉的开放或阻塞一条绝对必要的肠系膜动脉,可能提高盆腔/肠缺血的风
险。
多条大型开放腰椎动脉、附壁血栓和一条开放肠系膜动脉都易引起患者出现 II 型内漏。 有未治愈凝
血病的患者也可出现 II 型内漏或出血并发症风险的提高。
用于 AAA 的 Powerlink 系统的安全性和效力尚未在以下患者人群中评估:
年龄在 18 岁以下
怀孕或哺乳的女性
外伤性动脉损伤
真菌性动脉瘤
未治愈凝血病
绝对必要的肠系膜动脉
渗漏、即将破裂或已破裂的动脉瘤
上次植入物放置导致的假动脉瘤
上次放置的腔内植入物的修正
遗传性结缔组织疾病(例如 Marfan 综合症或 Ehlers-Danlos 综合症)
并发胸动脉或胸腹动脉瘤
当时全身感染的患者
腔内植入物的长期性能尚未确立。 应告知所有患者腔内治疗要求终身定期随访,以评估其健康状况和
腔内植入物的性能。 出现具体临床结果(例如内漏、动脉瘤增大或腔内植入物结构或位置的改变)的
患者应接受更强化的随访。 具体随访指导原则见第 12.0 部分“成像指导原则和术后随访”。
在腔内植入物放置后,应定期监控患者的植入物周围血流、动脉瘤生长或腔内植入物结构或位置的改
变。 至少要求每年成像一次,包括: 1) 腹部 X 光片,用于检查设备的完整性(支架破裂、两肢型设
备和近端套或肢端延长之间的分隔(如适用));和 2) 造影和非造影 CT,用于检查动脉瘤的改变、
植入物周围血流、开放程度、扭曲度和渐进性疾病。 如果肾并发症或其他因素导致不能使用成像造影
剂,腹部 X 光片和多普勒超声也能提供相近的信息。
对于动脉瘤增大、固定长度(血管和组件重叠)不可接受地缩短和/或内漏的患者,应在首次腔内修复
后考虑额外腔内干预或转为标准开放式手术修复。 动脉瘤大小增加和/或持续内漏可导致动脉瘤破
裂。
对于出现植入肢体血流下降和/或内漏的患者,可能要求进行辅助干预或手术。
6
Page 7

4.3 植入程序
Powerlink 系统设计为仅供单独一名患者使用。请勿重复使用或重复灭菌。重复使用、重复处理或
重复灭菌会损害装置的结构完整性和/或造成装置失效,从而可能导致患者受伤、患病或死亡。
重复使用、重复处理或重复灭菌还会产生装置污染的风险和/或造成患者感染或交叉感染,包括
但不限于传染性疾病由一名患者传播至另一名患者。装置污染会导致患者受伤、患病或死亡。
使用后,请按照医院、管理机构和/或当地政府的规定处理产品和包装。
根据医院和医师的首选治疗方案,应在植入程序中使用全身抗凝血治疗。 如果禁忌使用肝素,则
应考虑使用替代抗凝血剂。
用于 AAA 的 Powerlink 系统要求使用血管内造影剂。 先存肾功能不全的患者术后的肾衰竭风险
可能提高。 应注意限制术中使用的造影剂的数量。
在准备和插入过程中最大程度降低压缩状态覆膜支架的接触,以降低覆膜支架污染和感染的风
险。
在输送系统的插入过程中保持主导丝和对侧肢端导丝的位置。
不要弯曲或扭曲输送系统。 这样做可能会损坏输送系统和 Powerlink 系统覆膜支架。
如果外鞘在插入过程中扭曲,请不要尝试部署。 请使用新的 Powerlink 系统替代。
不要使用任何其他导管鞘推进快速输送系统。 这样做可能会损坏输送系统和 Powerlink 系统覆膜
支架。
设备肢体导丝的过多回缩可过早部署对侧肢端。
血管内放置不准确、固定不足和/或 Powerlink 系统覆膜支架密封不足可导致内漏、移动或肾或内
骼动脉偶然阻塞的风险升高。 必须保持肾动脉的开放以防止/降低肾衰和后续并发症的风险。 覆
膜支架的不正确部署或移动可能要求进行手术干预。
导管的前进应在荧光镜指导下完成。 在遇到阻力时不要使用过大力量推进或回缩导管。否则可能
损坏血管或导管。 在狭窄、血管内血栓或钙化和/或弯曲血管区域应格外小心。
除非医疗上需要,否则不得在可能阻塞为器官或肢体输送血流的必要动脉的位置部署 Powerlink
系统覆膜支架。 不要让覆膜支架遮盖重要的肾或肠系膜动脉(除非是下肠系膜动脉)或两条下腹
部动脉。 否则可阻塞血管。 在临床研究中,此设备并未在有两条内骼动脉阻塞的患者中进行研
究。
在动脉瘤内操作导管、导丝和鞘时应格外小心。 较大的干扰会使血栓碎片脱离从而可导致远端栓
塞。
Powerlink 输送系统回缩过程中必须使用荧光镜目视监控以保证其不会移动覆膜支架。 回缩中遇
到的任何阻力都必须实施认真监控。
在放置延长覆膜支架时,延长覆膜支架必须与两肢型覆膜支架重叠 15 到 20 毫米。
在放置延长覆膜支架时,应注意不要在必要的支架重新调整时损坏两肢型覆膜支架或干扰植入后
的支架位置。
在放置延长覆膜支架时,应在部署开始时和部署过程中注意目视监控定位和正确的位置。
在膨胀覆膜支架时,如果球囊未完全处于覆膜支架的 ePTFE 覆盖部分,血管损伤和/或破裂以及
可能的患者死亡的风险将会升高。
不要超出制造商推荐的最大膨胀直径。 否则球囊可能破裂。 请遵从本手册中所述的球囊膨胀参
数。 过度膨胀可导致血管壁损伤和/或血管破裂,或者损坏覆膜支架。
4.4 MRI(核磁共振成像)的安全性和兼容性
非临床测试证实 Powerlink 覆膜支架应在核磁共振环境下有条件地使用。 详情见第 12.5 部分。
5.0 不良事件
5.1 观察到的不良事件
共进行了四项美国多中心前瞻性研究:
肾下两肢型研究
者。 对照组中包含其血管解剖结构可能不适于腔内 AAA 修复的患者。 此研究中观察到的主要不良事件
见第 6.7 部分。
肾上两肢型研究
于参加肾下两肢型研究的患者。 此研究中观察到的主要不良事件见第 6.7 部分。
34
毫米近端延长研究
中观察到的主要不良事件见第 6.7 部分。
肾上近端延长研究
察到的主要不良事件见第 6.7 部分。
5.2 潜在不良事件
可能发生和/或要求干预的不良事件包括但不限于:
截肢
麻醉并发症和后续的附带问题(例如吸出)
动脉瘤增大
: 一项在 15 个中心进行的美国多中心前瞻性研究调查了 192 名受试患者和 66 名对照患
: 一项在 17 个中心进行的美国多中心前瞻性研究调查了 153 名受试患者。 对照组来源
: 一项在 10 个中心进行的美国多中心前瞻性研究调查了 60 名受试患者。 此研究
: 一项在 8 个中心进行的美国多中心前瞻性研究调查了 44 名受试患者。 此研究中观
7
Page 8

动脉瘤破裂和死亡
动脉损伤,包括穿孔、裂开、出血、破裂和死亡
动脉或静脉栓塞和/或假动脉瘤
动静脉瘘
出血、血肿或凝血病
肠道并发症(例如梗阻、暂时性缺血、梗塞、坏死)
心脏并发症和后续附带问题(例如心律不齐、心肌梗塞、充血性心衰、低血压、高血压)
跛行(例如臀部、下肢)
死亡
水肿
栓塞(微型和大型)伴随暂时或永久性缺血或梗塞
内漏
覆膜支架: 组件位置错误;组件部署不完整;组件移动;缝合线断裂;阻塞;感染;支架破裂;
覆膜材料磨损;扩张;糜烂;穿孔和外周血流
发热和局部发炎
泌尿生殖器并发症和后续附带问题(例如缺血、糜烂、瘘管、失禁、血尿、感染)
肝衰竭
阳痿
设备介入部位动脉瘤感染,包括形成脓肿、暂时性发热和疼痛。
淋巴系统并发症和后续的附带问题(例如淋巴瘘管)
局部或全身神经系统并发症和后续的附带问题(例如中风、暂时性缺血性心脏病、截瘫、下肢轻
瘫、瘫痪)
设备或原生血管阻塞。
肺/呼吸系统并发症和后续的附带问题(例如肺炎、呼吸衰竭、插管时间延长)
肾并发症和后续的附带问题(例如动脉阻塞、造影剂毒性、肾功能不全、衰竭)
手术转为开放修复
血管介入部位并发症,包括感染、疼痛、血肿、假动脉瘤、动静脉瘘
血管损伤
伤口并发症和后续的附带问题(例如裂开、感染)
血管痉挛或血管外伤(例如髂股血管裂开、出血、破裂、死亡)
5.3 设备相关不良事件的报告
若发生任何涉及 Powerlink 系统覆膜支架的不良事件(临床事故),应立即向 Endologix, Inc. 报告。请
致电 800-983-2284(24 小时消息服务)客户服务部门以报告所发生事件。
6.0 临床研究摘要
6.1 目的
各临床研究的目的是证实 Powerlink 系统在腹主动脉或主动脉骼动脉瘤的主要治疗中替代开放式手术
修复的安全性和效力。
6.2 研究设计
肾下研究:
旨在比较其解剖结构适于使用 Powerlink 肾下覆膜支架的标准风险腔内患者与标准风险手术患者对照
组。 总共有 192 名受试患者和 66 名对照患者参加。 临床和随访评估计划在出院前、术后一个月、六
个月、一年时和五年内每年一次进行。 一家独立的核心实验室研究了 CT 扫描片和腹部 X 光片,以评
估动脉瘤的改变、设备位置和完整性以及内漏。 安全性由数据安全监控委员会监控。
肾上研究:
旨在比较其解剖结构适于使用 Powerlink 肾上覆膜支架的标准风险腔内患者与标准风险手术患者历史
对照组。 总共 153 名受试患者参加。 共有 66 名对照患者参加了上述第一项 Powerlink 肾下两肢型研
究。 临床和随访评估计划在出院前、术后一个月、六个月、一年时和五年内每年一次进行。 一家独
立的核心实验室研究了 CT 扫描片和腹部 X 光片,以评估动脉瘤的改变、设备位置和完整性以及内
漏。 安全性由数据安全监控委员会监控。
这些分析的主要安全性终点是与手术对照组相比在一年内出现主要不良事件 (MAE) 患者的比例。
要效力分析包括一些终点,这些终点从原始临床试验用医疗器材管制 (investigational device exemption,
IDE) 批准治疗方案中定义的终点修改到与最新文献和其他 EVAR 临床研究一致的终点和其他标准。
这些分析的主要效力终点是动脉瘤的成功治疗。
34
毫米近端延长研究
端动脉颈部内径(最大 32 毫米)的患者中评估使用 34 毫米近端延长支架增强 28 毫米肾下两肢型覆
此临床研究是一项在 15 个地点进行的前瞻性、多中心、非随机、同时手术对照的研究,
此临床研究是一项在 17 个地点进行的前瞻性、多中心、非随机、历史手术对照的研究,
1
2
: 此临床研究是一项前瞻性、多中心、单臂研究,用于在治疗较大非动脉瘤近
1
MAE 是一个复合终点,其包括: 各种原因导致的死亡;动脉瘤破裂;转为开放修复;心肌梗塞;冠状动脉干预;肾衰竭;呼吸系统衰竭;内漏的
辅助干预;以及中风。
2
动脉瘤的成功治疗是一个复合终点,其包括技术上成功(即 Powerlink 肾上覆膜支架成功输送和部署);无需转为开放修复;动脉瘤破裂;链接部
位支架破裂;核心实验室判断移动;核心实验室判断术后 I 型或 III 型内漏超过 30 天(II 型内漏一般被视为与设备无关);或因动脉瘤增大而干
预。
8
主
Page 9

膜支架的效果。 共有 60 名受试患者在 10 个地点参加。 临床和随访评估计划在出院前、术后一个
月、六个月、一年时和五年内每年一次进行。 一家独立的核心实验室研究了 CT 扫描片和腹部 X 光
片,以评估动脉瘤的改变、设备位置和完整性以及内漏。 安全性由数据安全监控委员会监控。
其主要研究终点是一年内近端 I 型内漏。 安全性分析将报告一年内出现主要不良事件 (MAE) 患者的
3
比例。
肾上近端延长研究
: 此临床研究是一项前瞻性、多中心、单臂研究,在治疗较大非动脉瘤近端动脉颈
部内径(最大 26 毫米)的患者中评估使用 25 或 28 毫米近端延长支架增强 25 或 28 毫米肾下两肢型
覆膜支架的效果。 共有 44 名受试患者在 8 个地点参加。 临床和随访评估计划在出院前、术后一个
月、六个月和一年时进行。 一家独立的核心实验室研究了 CT 扫描片和腹部 X 光片,以评估动脉瘤的
改变、设备位置和完整性以及内漏。 安全性由数据安全监控委员会监控。
其主要研究终点是 30 天时近端 I 型内漏。 安全性分析将报告 30 天内出现主要不良事件 (MAE) 患者
的比例。
3
6.3 患者责任和随访
肾下研究
[2],共有 190 名患者接受了一个月随访。 在这 190 名患者中,98% (186/190) 接受临床和中心 CT 随
访;68% (129/190) 接受中心 X 光片随访;121/190 (64%) 接受核心实验室 CT 成像随访。
在六个月随访时,总共 180 名患者接受随访。 在这 180 名患者中,95% (171/180) 接受临床和中心 CT
成像随访;66% (118/180) 接受中心 X 光片随访;117/180 (65%) 接受核心实验室 CT 成像随访。 在 12
个月随访时,总共 173 名患者接受随访。 在这 173 名患者中,91% (157/173) 接受临床和中心 CT 成像
随访;83% (144/173) 接受核心实验室 CT 成像随访。
患者随访和责任详情见表 1(受试患者)。
共有 66 名手术对照患者参加。 患者随访和责任详情见表 2。在 1 个月随访时,共有 62 名患者符合资
格且 100% (62/62) 接受临床随访。 在 6 个月随访时,共有 59 名患者符合资格且 100% (59/59) 接受临
床随访。 在 12 个月随访时,共有 48 名患者符合资格且 100% (48/48) 接受临床随访。
表 1. 患者和成像责任 – 肾下研究受试组
: 对于受试组来说,15 个中心合计有 192 名患者参加。 除两名患者在一个月就诊之前死亡
患者随访 核心实验室成
1
像的患者
核心实验室成像足以评估参数
的患者
下一次就诊前发生的事件 间隔
2
内漏
合格
临床随访
最初登记
植入后 1 个月就诊前事件
1 个月(±2 周)
1 个月随访后 6 个月就诊前事件
6 个月(±2 个月)
6 个月随访后 12 个月就诊前事件
12 个月(±2 个月)
1
数据分析样本大小差异来自患者能否接受随访以及供评估的具体时间点影像的数量和质量。
2
在参加的 192 名患者中,4 名被视为技术上失败,原因为: 术中转换为开放修复 [n=3];因介入问题而植入非研究设备 [n=1]。 患者继续接受随访。
在某个时间点的成像数据不可用时,使用后续时间点的成像数据。
192
3 2 0
190 186 186 121 129 101 110 106 115
1 6 3
180 171 171 117 118 78 101 101 110
0 5 2
173 157 157 144 146 91 128 136 140
CT 成像
成像随访
KUB 成像
动脉瘤大小
移动
完整性
技术失败
转换
死亡
退出/失去联系
3
MAE 是一个复合终点,其包括: 各种原因导致的死亡;动脉瘤破裂;转为开放修复;心肌梗塞;冠状动脉干预;肾衰竭;呼吸系统衰竭;近端 I
型内漏的辅助干预;以及中风。
9
Page 10
表 2. 患者责任 – 对照组
患者随访 下一次就诊前发生的事件 间隔
最初登记
植入后 1 个月就诊前事件
1 个月(±2 周)
1 个月随访后 6 个月就诊前事件
6 个月(±2 个月)
6 个月随访后 12 个月就诊前事件
12 个月(±2 个月)
肾上研究
: 对于受试组来说,17 个中心合计有 153 名患者参加。 根据接受治疗的意愿,所有患者均
被包含在可使用其数据的所有分析中。 30 天内出现两例死亡事件。 一名接受商用设备而不是试验性
设备的患者和另一名在手术开始时转为开放修复的患者拒绝进一步随访并退出研究。
一个月时,总共 149 名患者接受随访。 在这 149 名患者中,97% (144/149) 接受临床随访;95%
(141/149) 接受中心 CT 成像随访;138/149 (93%) 接受核心实验室 CT 成像随访。
在六个月随访时,总共 140 名患者接受随访。 在这 140 名患者中,87% (122/140) 接受临床随访;84%
(118/140) 接受中心 CT 成像随访;115/140 (82%) 接受核心实验室 CT 成像随访。
在 12 个月随访时,总共 131 名患者接受随访。 在这 131 名患者中,94% (123/131) 接受临床随访;
92% (121/131) 接受中心 CT 成像随访;114/131 (87%) 接受核心实验室 CT 成像随访。
患者随访和责任详情见表 3(受试患者)。 对照患者随访详情见表 2。
34
毫米近端延长研究
: 总共 60 名受试患者在 10 个地点参加。 根据接受治疗的意愿,所有患者均被
包含在可使用其数据的所有分析中。 30 天内未出现死亡事件。
一个月时,总共 60 名患者接受随访。 在这 60 名患者中,100% (60/60) 接受临床随访;98% (59/60) 接
受中心 CT 成像随访;56/60 (93%) 接受核心实验室 CT 成像随访。
在六个月随访时,总共 58 名患者接受随访。 在这 58 名患者中,93% (54/58) 接受临床随访;93%
(54/58) 接受中心 CT 成像随访;54/58 (93%) 接受核心实验室 CT 成像随访。
在一年随访时,总共 55 名患者接受随访。 在这 55 名患者中,91% (50/55) 接受临床随访;91% (50/55)
接受中心 CT 成像随访;50/55 (91%) 接受核心实验室 CT 成像随访。
患者随访和责任详情见表 4。
肾上近端延长研究
: 总共 44 名受试患者在 8 个地点参加。 根据接受治疗的意愿,所有患者均被包含
在可使用其数据的所有分析中。 30 天内未出现死亡事件。 两名患者拒绝在 30 天内随访并退出研究。
一个月时,总共 42 名患者接受随访。 在这 42 名患者中,100% (42/42) 接受临床随访;100% (42/42)
接受中心 CT 成像随访;41/42 (98%) 接受核心实验室 CT 成像随访。 患者随访和责任详情见表 5。
表 3. 患者和成像责任 – 肾上研究受试组
患者随访 核心实验室成
合格
66
4 0
62 62
1 2
59 59
4 7
48 48
临床随访
死亡
退出/失去联系
1
像的患者
核心实验室成像足以评估参数
的患者
下一次就诊前发生的事件 间隔
2
内漏
合格
临床随访
最初登记
植入后 1 个月就诊前事件
1 个月(±2 周)
1 个月随访后 6 个月就诊前事件
6 个月(±1 个月)
6 个月随访后 12 个月就诊前事件
12 个月(±2 个月)
1
数据分析样本大小差异来自患者能否接受随访以及供评估的具体时间点影像的数量和质量。
2
在参加的 153 名患者中,3 名被视为技术上失败,原因为: 术中转换为开放修复 [n=1];因介入问题而植入非研究设备 [n=1];以及术中死亡 [n=1]。
3
一个月时“退出/失去联系包括一名术中转为开放修复的患者和一名接受非试验性(商用)设备的患者。” 两名患者拒绝接受一个月时的就诊并自愿退
出。
4
两名患者尚未到接受六个月随访之时。
5
五名患者尚未到接受 1 年随访之时。 包括两名尚未到接受六个月随访之时的患者。
在某个时间点的成像数据不可用时,使用后续时间点的成像数据。
3
5
153
0 2 2
149 144 141 138 131 136 138 124 134
4
1 5 1
140 122 118 115 124 114 115 113 113
5
0 4 2
131 123 121 114 121 113 114 110 110
CT 成像
成像随访
10
KUB 成像
动脉瘤大小
移动
完整性
技术失败
转换
死亡
退出/失去联系
Page 11

像的患者
CT 成像
像的患者
CT 成像
核心实验室成像足以评估参数
KUB 成像
核心实验室成像足以评估参数
内漏
动脉瘤大小
KUB 成像
内漏
动脉瘤大小
的患者
的患者
移动
移动
1
表 4. 患者和成像责任 – 34 毫米近端延长研究
患者随访 核心实验室成
合格
临床随访
最初登记
植入后 1 个月就诊前事件
1 个月(±2 周)
> 1 个月但 < 6 个月就诊事件
6 个月(±1 个月)
> 6 个月但 < 12 个月就诊事件
12 个月(±2 个月)
1
数据分析样本大小差异来自患者能否接受随访以及供评估的具体时间点影像的数量和质量。
在某个时间点的成像数据不可用时,使用后续时间点的成像数据。
60
0 0 0
60 59 59 56 53 56 56 56 56
0 2 0
58 54 54 54 53 54 54 54 54
0 2 1
55 50 50 50 46 50 50 50 50
表 5. 患者和成像责任 – 肾上近端延长研究
患者随访 核心实验室成
合格
临床随访
最初登记
植入后 1 个月就诊前事件
1 个月(±2 周)
1
数据分析样本大小差异来自患者能否接受随访以及供评估的具体时间点影像的数量和质量。
*包括 1 名在 1 个月就诊时未进行 CT 扫描但在后续就诊中进行内漏评估 CT 扫描的患者
44
0 0 2
42 42 42 41 38 41 42* 41 41
成像随访
1
成像随访
6.4 人口统计信息和基线病史数据
表 6、表 7、表 9 和表 10 比较了 Powerlink 肾下或肾上患者与开放手术对照患者的人口统计信息和基
线病史特征。 在两项研究中,Powerlink 患者年龄均大于对照患者。 Powerlink 肾上患者与对照患者相
比有心律不齐病史人数较多。 表 8 和表 11 给出了 Powerlink 34 毫米或 Powerlink 肾上近端延长患者的
人口统计信息和基线病史特征。
表 6. 患者人口统计信息,Powerlink 肾下受试组和对照组
参数
年龄(岁,平均值 ± SD)
男性
表 7. 患者人口统计信息,Powerlink 肾上受试组和对照组
参数
年龄(岁,平均值 ± SD)
男性
表 8. 患者人口统计信息,Powerlink 近端延长研究
参数
年龄(岁,平均值 ± SD)
男性
Powerlink
n/N (%)
170/192 (89%) 57/66 (86%) 0.663
73 ± 7.0 70 ± 7.9 <0.001
Powerlink
n/N (%)
138/153 (90%) 57/66 (86%) 0.480
34 毫米
n/N (%)
54/60 (90%) 39/44 (89%)
74 ± 8.1 70 ± 7.9 <0.001
74 ± 8.2 70 ± 10
完整性
完整性
技术失败
技术失败
对照
n/N (%)
对照
n/N (%)
肾上
n/N (%)
下一次就诊前发生的事件 间隔
转换
死亡
退出/失去联系
下一次就诊前发生的事件 间隔
转换
死亡
退出/失去联系
p-值
p-值
11
Page 12
表 9. 基线病史,Powerlink 肾下受试组和对照组
参数
绞痛
心律不齐
脑血管疾病
凝血病
充血性心力衰竭
冠状动脉疾病
COPD 61/192 (32%) 16/66 (24%) 0.278
糖尿病
AAA 家族病史
高血压
肝病
外周动脉阻塞
先前腹部手术
先前心肌梗塞(>6 个月)
先前心肌梗塞(≤6 个月)
先前冠状动脉干预 (CABG)
先前冠状动脉干预(PTCA/支架)
肾衰竭
吸烟(曾)
瓣膜疾病
瓣膜更换
表 10. 基线病史,Powerlink 肾上受试组和对照组
参数
绞痛
心律不齐
癌症
脑血管疾病
凝血病
充血性心力衰竭
冠状动脉疾病
COPD 47/151 (31%) 16/66 (24%) 0.333
糖尿病
AAA 家族病史
高血压
肝病
外周动脉阻塞
先前腹部手术
先前心肌梗塞(>6 个月)
先前心肌梗塞(≤6 个月)
先前冠状动脉干预 (CABG)
先前冠状动脉干预(PTCA/支架)
肾衰竭
吸烟(曾)
瓣膜疾病
瓣膜更换
1
Powerlink 肾上组中两名患者无完整临床病史记
Powerlink
n/N (%)
25/192 (13%) 8/66 (12%) 1.000
31/192 (16%) 5/66 (7.6%) 0.100
38/192 (20%) 10/66 (15%) 0.467
2/192 (1.0%) 0/66 (0.0%) 1.000
13/192 (6.8%) 2/66 (3.0%) 0.368
88/192 (46%) 39/66 (59%) 0.066
25/191 (13%) 12/66 (18%) 0.314
26/189 (14%) 12/66 (18%) 0.423
122/191 (64%) 46/66 (70%) 0.454
8/192 (4.2%) 1/66 (1.5%) 0.455
32/192 (17%) 10/66 (15%) 0.849
91/192 (47%) 25/66 (38%) 0.199
47/192 (25%) 19/66 (29%) 0.515
4/192 (2.1%) 3/66 (4.6%) 0.377
54/192 (28%) 20/66 (30%) 0.754
25/192 (13%) 12/66 (18%) 0.313
5/192 (2.6%) 1/66 (1.5%) 1.000
159/192 (83%) 57/66 (86%) 0.915
7/192 (3.7%) 5/66 (7.6%) 0.191
5/192 (2.6%) 1/66 (1.5%) 1.000
Powerlink1
n/N (%)
22/151 (15%) 8/66 (12%) 0.831
32/151 (21%) 5/66 (7.6%) 0.018
36/151 (24%) 18/66 (27%) 0.867
36/151 (24%) 10/66 (15%) 0.206
1/151 (0.7%) 0/66 (0.0%) 1.000
14/151 (9.3%) 2/66 (3.0%) 0.157
78/151 (52%) 39/66 (59%) 0.375
33/151 (22%) 12/66 (18%) 0.590
19/151 (13%) 12/66 (18%) 0.260
111/151 (74%) 46/66 (70%) 0.621
1/151 (0.7%) 1/66 (1.5%) 0.519
29/151 (19%) 10/66 (15%) 0.566
72/151 (48%) 25/66 (38%) 0.235
38/151 (25%) 19/66 (29%) 0.616
5/151 (3.3%) 3/66 (4.6%) 0.702
36/151 (24%) 20/66 (30%) 0.318
24/151 (16%) 12/66 (18%) 0.838
6/151 (4.0%) 1/66 (1.5%) 0.678
135/151 (89%) 57/66 (86%) 0.498
12/151 (8.0%) 5/66 (7.6%) 1.000
4/151 (2.7%) 1/66 (1.5%) 1.000
对照
n/N (%)
对照
n/N (%)
p-值
p-值
12
Page 13

表 11. 基线病史,近端延长研究
参数
绞痛
心律不齐
癌症
脑血管疾病
凝血病
充血性心力衰竭
冠状动脉疾病
COPD 23/60 (43%) 18/44 (41%)
糖尿病
AAA 家族病史
胃肠道异常
高血压
高胆甾醇血
肝病
外周动脉阻塞
先前腹部手术
先前心肌梗塞(>6 个月)
先前心肌梗塞(≤6 个月)
先前冠状动脉干预 (CABG)
先前冠状动脉干预(PTCA/支架)
肾衰竭
吸烟(曾)
瓣膜疾病
瓣膜更换
34 毫米
n/N (%)
13/60 (22%) 4/44 (9.1%)
14/60 (23%) 8/44 (18%)
19/60 (32%) 13/44 (30%)
11/60 (18%) 6/44 (14%)
3/60 (5.0%) 1/44 (2.3%)
13/60 (22%) 2/44 (4.5%)
37/60 (62%) 21/44 (48%)
16/60 (27%) 8/44 (18%)
6/59 (10%) 8/44 (18%)
25/60 (42%) 20/44 (45%)
48/60 (80%) 38/44 (86%)
40/60 (67%) 29/44 (66%)
3/60 (5.0%) 2/44 (4.5%)
18/60 (30%) 11/44 (25%)
26/60 (43%) 21/44 (48%)
20/60 (33%) 9/44 (21%)
3/60 (5.0%) 0/44 (0.0%)
19/60 (32%) 8/44 (18%)
14/60 (23%) 10/44 (23%)
1/60 (1.7%) 1/44 (2.3%)
48/60 (80%) 37/43 (86%)
7/60 (12%) 1/44 (2.3%)
1/60 (1.7%) 0/44 (0.0%)
肾上
n/N (%)
6.5 基线动脉瘤数据
表 12 到表 15 比较了 Powerlink 受试患者和开放手术对照患者的基线动脉瘤直径和血管特性。
表 12. 动脉瘤直径,Powerlink 受试组和对照组
动脉瘤直径范围
Powerlink
肾下1
n/N (%)
< 30 毫米
30-39 毫米
40-49 毫米
50-59 毫米
60-69 毫米
70-79 毫米
80-89 毫米
> 89 毫米
1
四名 Powerlink 肾下患者、一名 Powerlink 肾上患者和八名对照患者术前未报告动脉瘤直径。
1/188 (0.5%) 0/152 (0.0%) 0/58 (0.0%) 0/60 (0.0%) 0/44 (0.0%)
0/188 (0.0%) 3/152 (2.0%) 1/58 (1.7%) 0/60 (0.0%) 0/44 (0.0%)
76/188 (40%) 48/152 (32%) 10/58 (17%) 12/60 (20%) 11/44 (25%)
92/188 (49%) 71/152 (47%) 23/58 (40%) 22/60 (37%) 16/44 (36%)
18/188 (9.6%) 23/152 (15%) 15/58 (26%) 18/60 (30%) 13/44 (60%)
1/188 (0.5%) 5/152 (3.3%) 7/58 (12%) 7/60 (12%) 3/44 (6.8%)
0/188 (0.0%) 2/152 (1.3%) 0/58 (0.0%) 1/60 (1.7%) 1/44 (2.2%)
0/188 (0.0%) 0/152 (0.0%) 2/58 (3.5%) 0/60 (0.0%) 0/44 (0.0%)
Powerlink
肾上1
n/N (%)
对照1
n/N (%)
34 毫米
近端延长
n/N (%)
肾上
近端延长
n/N (%)
13
Page 14

表 13. 基线动脉瘤特性,Powerlink 肾下受试组和对照组
特点
N
动脉瘤体积(立方毫米)
最大动脉瘤直径(毫米)
非动脉瘤近端动脉颈部直径
(毫米)
非动脉瘤远端动脉颈部直径
(毫米)
近端密封区域长度(毫米)
远端动脉直径(毫米)
远端非动脉瘤右骼动脉直径
(毫米)
远端非动脉瘤左骼动脉直径
(毫米)
N 表示其 CT 可供核心实验室使用和解读的患者数。
†
动脉瘤体积为可选测量项目。
*此值已输入至 CRF,但具体测量值未记录。
†
64 133 ± 44 125
188 51 ± 6.6 50
188 22 ± 2.3 22
184 24 ± 2.8 24
184 29 ± 11 27
173 22 ± 6.3 22
186 12 ± 2.3 12
184 12 ± 1.8 12
表 14. 基线动脉瘤特性,Powerlink 肾上受试组和对照组
特点
N
动脉瘤体积(立方毫米)
最大动脉瘤直径(毫米)
非动脉瘤近端动脉颈部直径
(毫米)
非动脉瘤远端动脉颈部直径
(毫米)
近端密封区域长度(毫米)
远端动脉直径(毫米)
远端非动脉瘤右骼动脉直径
(毫米)
远端非动脉瘤左骼动脉直径
(毫米)
N 表示其 CT 可供核心实验室使用和解读的患者数。
†
动脉瘤体积为可选测量项目。
*此值已输入至 CRF,但具体测量值未记录。
†
42 167 ± 70 158
150 53 ± 8.7 51
150 24 ± 3.1 24
150 26 ± 3.7 25
150 28 ± 11 27
146 27 ± 8.2 25
147 13 ± 3.3 13
150 13 ± 2.4 13
Powerlink 肾下 对照
平均值 ± SD 中值
Powerlink 肾上 对照
平均值 ± SD 中值
最小,最大
49, 256
40, 74
18, 26
17, 42
7.9, 70
0.0*, 48
8.0, 25
8.0, 18
最小,最大
0.0*, 336
32, 88
18, 32
18, 32
5.0, 54
12, 60
7.0, 36
7.0, 25
N
平均值 ± SD 中值
25 176 ± 89 155
58 58 ± 12 55
55 26 ± 4.7 26
51 27 ± 4.7 27
49 18 ± 20 14
46 30 ± 20 25
50 19 ± 26 13
49 16 ± 14 14
N
平均值 ± SD 中值
25 176 ± 89 155
58 58 ± 12 55
55 26 ± 4.7 26
51 27 ± 4.7 27
49 18 ± 20 14
46 30 ± 20 25
50 19 ± 26 13
49 16 ± 14 14
最小,最大
95, 479
33, 98
17, 40
18, 40
0.0*, 127
0.0*, 146
1.4, 169
1.7, 105
最小,最大
95, 479
33, 98
17, 40
18, 40
0.0*, 127
0.0*, 146
1.4, 169
1.7, 105
p-值
0.134
<0.001
<0.001
<0.001
<0.001
<0.001
0.001
<0.001
p-值
0.628
0.003
0.006
0.022
0.003
0.344
0.119
0.090
表 15. 基线动脉瘤测量,近端延长研究
特点
最大动脉瘤直径(毫米)
非动脉瘤近端动脉颈部直径(毫米)
非动脉瘤远端动脉颈部直径(毫米)
近端密封区域长度(毫米)
远端非动脉瘤右骼动脉直径(毫米)
远端非动脉瘤左骼动脉直径(毫米)
34 毫米
N
平均值 ±
SD
60 58 ± 9.0 55
59 28 ± 2.4 28
60 31 ± 2.0 31
59 30 ± 14 26
59 14 ± 3.3 14
60 14 ± 3.5 14
14
肾上
中值
最小,最大
44, 82
22, 32
22, 32
15, 75
10, 30
10, 27
N
平均值 ± SD 中值
最小,最大
44 56 ± 8.9 54
44 23 ± 2.4 23
44 24 ± 1.6 25
44 24 ± 9.4 21
44 15 ± 7.2 13
44 13± 2.3 13
40, 84
18, 26
21, 26
15, 50
10, 50
9, 20
Page 15

6.6 植入的设备
各研究中植入设备的数目见表 16。
表 16. 首次植入 Powerlink 设备的总数
植入设备总数
1
肾下研究
% (n/N)
1 53% (100/188) 47% (70/150) 0.0% (0/60) 0.0% (0/44)
2 36% (68/188) 33% (49/150) 60% (35/60) 68% (30/44)
3 6.9% (13/188) 14% (21/150) 25% (15/60) 27% (12/44)
4 3.2% (6/188) 6.0% ( 9/150) 10% (6/60) 2.3% (1/44)
5 0.5% (1/188) 0.0% (0/150) 5.0% (3/60) 0.0% (0/44)
1
所有患者接受 Powerlink 两肢型覆膜支架。 植入设备总数包括两肢型覆膜支架、近端延长覆膜支架和肢端延长覆膜支架。
2
分母 N 是 188 名 Powerlink 肾下两肢型植入患者。
3
分母 N 是 150 名 Powerlink 肾上两肢型植入患者。
4
分母 N 是 60 名 Powerlink 34 毫米近端延长植入患者。
5
分母 N 是 44 名 Powerlink 25 或 28 毫米近端延长植入患者。
6 0.0% (0/188) 0.7% (1/150) 0.0% (0/60) 2.3% (1/44)
2
肾上研究
% (n/N)
3
34 毫米近端
延长研究
% (n/N)
4
肾上近端
延长研究
% (n/N)
5
6.7 研究结果
Powerlink 覆膜支架的主要安全性和效力结果见下面的第 6.8 和 6.9 部分。
6.8 安全性
主要安全性终点: 一年内的主要不良事件 (MAE)
肾下研究
在一年内接受 Powerlink 肾下覆膜支架治疗的患者(表 17)出现的 MAE 少于接受开放手术治疗的对
照患者。 根据精确(二项式)测试,Powerlink 肾下 12 个月 MAE 发生率不低于对照组的观察值
(p<0.001)。
表 17. 主要安全性终点: MAE,Powerlink 肾下受试组和对照组
参数
≥1 MAE 患者
所有原因死亡
AAA 破裂
转换/取出
冠状动脉干预
心肌梗塞
肾衰竭
呼吸衰竭
辅助手术
中风
1
Powerlink: N=192;对照: N=66。结果 (n)显示为出现至少一个事件的患者人数(占组内患者的 %)。 有些患者可能出现一个以上的事件。
2
0-30 天组中的事件包括术中以及直到和包括术后整 30 天内的所有事件。 0 天-1 年组中的事件包括术中和直到术后 14 个月内的所有事件。
3
30 天内的所有死亡被视为与 AAA 和手术相关。 在晚期的 Powerlink 死亡中(31 天到 1 年),一例被视为与 AAA 和手术相关。
4
在 30 天内: 包括一名未接受研究设备 [第 1 天] 的患者和一名因植入物阻塞 [第 28 天] 而接受辅助手术的患者。 四个额外的肾衰竭事件(定义为
血清肌酸酐相对基线增幅 >50%)见于术后一年内的四名患者中。
5
总共 19 名患者在一年内接受 21 次干预。 详情见表 18。
3
4
5
肾上研究
在一年内接受 Powerlink 肾上覆膜支架治疗的患者(表 18)出现的 MAE 少于接受开放手术治疗的对
照患者。
:
1
0-30 天
Powerlink
n [%]
12 [6.3%] 15 [23%] 46 [24%] 22 [33%]
2 (1.0%) 4 (6.1%) 13 (6.8%) 9 (14%)
0 (0.0%) --- 0 (0.0%) --3 (1.6%) --- 4 (2.1%) --0 (0.0%) 0 (0.0%) 3 (1.6%) 0 (0.0%)
3 (1.6%) 5 (7.6%) 7 (3.7%) 6 (9.1%)
2 (1.0%) 6 (9.1%) 6 (3.1%) 7 (11%)
2 (1.0%) 5 (7.6%) 4 (2.1%) 5 (7.6%)
6 (3.1%) 2 (3.0%) 19 (9.9%) 2 (3.0%)
0 (0.0%) 1 (1.5%) 5 (2.6%) 2 (3.0%)
2
0 天-1 年2
对照
n [%]
Powerlink
n [%]
对照
n [%]
15
Page 16

表 18. 主要安全性终点: MAE,肾上受试组和对照组
参数
≥1 MAE 患者
所有原因死亡
AAA 破裂
转换/取出
冠状动脉干预
心肌梗塞
肾衰竭
呼吸衰竭
辅助手术
中风
1
Powerlink: N=153;对照: N=66。结果 (n)显示为出现至少一个事件的患者人数(占组内患者的 %)。 有些患者可能出现一个以上的事件。
2
0-30 天组中的事件包括术中以及直到和包括术后整 30 天内的所有事件。 0 天-1 年组中的事件包括术中和直到术后 14 个月内的所有事件。
3
30 天内的所有死亡被视为与 AAA 和手术相关。 在晚期的 Powerlink 死亡中(31 天到 1 年),一例被视为与 AAA 和手术相关。
4
在 30 天内,术中转为开放修复的受试患者也在此时出现肾衰竭。 两个额外的肾衰竭事件(定义为血清肌酸酐相对基线增幅 >50%)见于术后一年
内的两名患者中。 一个事件出现在第 33 天,但在直到最近的随访中未继续观察到;第二个事件出现在第 404 天。后者也接受 II 型内漏的干预;
相同的肌酸酐水平第 2 年在此患者中可见,但在后续随访中未见。
5
总共 12 名患者在一年内接受 17 次干预。 详情见表 19。
3
4
5
Powerlink
n [%]
8 [5.2%] 15 [23%] 30 [20%] 22 [33%]
2 (1.3%) 4 (6.1%) 11 (7.2%) 9 (14%)
0 (0.0%) --- 0 (0.0%) --1 (0.7%) --- 2 (1.3%) --0 (0.0%) 0 (0.0%) 5 (3.3%) 0 (0.0%)
0 (0.0%) 5 (7.6%) 1 (0.7%) 6 (9.1%)
1 (0.7%) 6 (9.1%) 3 (2.0%) 7 (11%)
3 (2.0%) 5 (7.6%) 3 (2.0%) 5 (7.6%)
3 (2.0%) 2 (3.0%) 12 (7.8%) 2 (3.0%)
0 (0.0%) 1 (1.5%) 1 (0.7%) 2 (3.0%)
0-30 天
2
0 天-1 年2
Powerlink 肾下受试组、Powerlink 肾上受试组和手术对照组的 Kaplan-Meier 图见图 8(1 年无 MAE)。
对照
n [%]
1
Powerlink
n [%]
对照
n [%]
图 8. 1 年无 MAE,Powerlink 肾下、Powerlink 肾上和手术对照
注:阴影代表曲线的
95%
置信区间
参数
风险人数
生存率 %
95% CI 0.90, 0.97 0.79, 0.90 0.73, 0.85 0.91, 0.98 0.84, 0.94 0.75, 0.87 0.67, 0.87 0.65, 0.86 0.58, 0.81
Powerlink 肾下 Powerlink 肾上 手术对照
1 个月 6 个月 1 年 1 个月 6 个月 1 年 1 个月 6 个月 1 年
180 160 148 142 129 103 51 49 42
0.94 0.84 0.79 0.95 0.89 0.82 0.77 0.76 0.69
主要安全性终点: 主要不良事件 (MAE) – 近端延长研究
Powerlink 34 毫米近端延长覆膜支架治疗患者的 MAE 发生率(1 年内)或肾上近端延长覆膜支架治疗患者
的 MAE 发生率(30 天内)见表 19。
16
Page 17

表 19. 安全性分析: MAE,近端延长研究
参数
≥1 MAE 患者
所有原因死亡
AAA 破裂
转换/取出
冠状动脉干预
心肌梗塞
肾衰竭
呼吸衰竭
辅助手术
中风
1
N=60。结果显示为组中事件数目 [患者人数] 和患者的 %。 有些患者可能出现一个以上的事件。
2
N=44。结果显示为组中事件数目 [患者人数] 和患者的 %。 有些患者可能出现一个以上的事件。
3
0-30 天组中的事件包括术中以及直到和包括术后整 30 天内的所有事件。 0 天-1 年组中的事件包括术中和直到术后 14 个月内的所有事件。
4
30 天内的所有死亡被视为与 AAA 和手术相关。 在晚期的 Powerlink 死亡中(31 天到 12 个月),没有被视为与 AAA 和手术相关的事件。
4
0 [0] 0.0% 4 [4] 6.7% 0 [0] 0.0%
0 [0] 0.0% 0 [0] 0.0% 0 [0] 0.0%
0 [0] 0.0% 0 [0] 0.0% 0 [0] 0.0%
0 [0] 0.0% 0 [0] 0.0% 0 [0] 0.0%
0 [0] 0.0% 1 [1] 1.7% 0 [0] 0.0%
0 [0] 0.0% 2 [2] 3.3% 1 [1] 2.3%
1 [1] 1.7% 2 [2] 3.3% 1 [1] 2.3%
0 [0] 0.0% 1 [1] 1.7% 0 [0] 0.0%
0 [0] 0.0% 3 [2] 3.3% 0 [0] 0.0%
34 毫米近端延长研究
0-30 天
3
0 天-1 年(合计)3 0-30 天(合计)3
1 (1.7%) 9 (15%) 1 (2.3%)
1
肾上近端延长研究2
其他安全性终点
:
30 天内所有原因死亡
30 天内观察到的死亡率如下:
Powerlink 肾下:1.6% (3/192)
Powerlink 肾上: 2.0% (3/153)
对照: 6.1% (4/66)
Powerlink 34 毫米近端延长: 0.0% (0/60)
Powerlink 肾上近端延长: 0.0% (0/44)
1 年内所有原因和动脉瘤相关的死亡率
1 年内观察到的死亡率如下:
所有原因死亡率: Powerlink 肾下:6.8% (13/192);
Powerlink 肾上: 7.2% (11/153);
对照: 14% (9/66)
Powerlink 34 毫米近端延长: 6.7% (4/60)
动脉瘤相关死亡率:† Powerlink 肾下:2.1% (4/192);
Powerlink 肾上:2.0% (3/153);
对照:6.1% (4/66)
Powerlink 34 毫米近端延长: 0.0% (0/60)
Powerlink 肾下受试组、Powerlink 肾上受试组和手术对照组的 Kaplan-Meier 图见图 9(1 年内无所有原因死
亡率)和图 10(1 年内无动脉瘤相关死亡率)。
†
动脉瘤相关死亡率包括术后 30 天内因任何原因的死亡、因 AAA 破裂导致的死亡以及任何旨在治疗 AAA 的手术后的死亡。
17
Page 18

图 9. 1 年无所有原因死亡率,Powerlink 肾下、Powerlink 肾上和手术对照
注:阴影代表曲线的
95%
置信区间
参数
风险人数
生存率 %
95% CI 0.98, 1.00 0.93, 0.99 0.91, 0.98 0.97, 1.00 0.95, 1.00 0.89, 0.97 0.88, 1.00 0.86, 0.99 0.79, 0.96
Powerlink 肾下 Powerlink 肾上 手术对照
1 个月 6 个月 1 年 1 个月 6 个月 1 年 1 个月 6 个月 1 年
190 180 175 148 138 114 62 59 53
0.99 0.96 0.94 0.99 0.97 0.93 0.94 0.92 0.88
18
Page 19

图 10. 1 年无动脉瘤相关死亡率,Powerlink 肾下、Powerlink 肾上和手术对照
注:阴影代表曲线的
组的最近事件在
95%
置信区间。 肾下受试组的最近事件在
<30
天内发生。
421
天时发生;肾上受试组的最近事件在
42
天时发生;对照
参数
风险人数
生存率 %
95% CI 0.98, 1.00 0.97, 1.00 0.97, 1.00 0.98, 0.99 0.96, 1.00 0.96, 1.00 0.88, 1.00 0.88, 1.00 0.88, 1.00
Powerlink 肾下 Powerlink 肾上 手术对照
1 个月 6 个月 1 年 1 个月 6 个月 1 年 1 个月 6 个月 1 年
190 180 175 148 139 115 62 59 54
0.99 0.98 0.98 0.99 0.98 0.98 0.94 0.94 0.94
6.9 效力
主要效力终点:1 年时动脉瘤成功治愈
动脉瘤的成功治愈定义为患者取得技术成功(首次手术中成功输送和部署 Powerlink 覆膜支架)、维
持覆膜支架的开放,并且未发生以下情况: 动脉瘤破裂;转为开放修复;支架或连接部位破裂;术后
I 型远端或近端内漏超过 30 天;III 型内漏(II 型内漏一般视为与设备无关);或因动脉瘤增大而进行
术后干预。
肾下研究
者未到达动脉瘤成功治愈终点。
肾上研究
者未到达动脉瘤成功治愈终点。
: Powerlink 肾下覆膜支架的动脉瘤成功治愈率为 92.7% (178/192)。 如表 20 所示,14 名患
: Powerlink 肾上覆膜支架的动脉瘤成功治愈率为 92.2% (141/153)。 如表 20 所示,12 名患
19
Page 20

表 20. 一年时动脉瘤成功治愈
动脉瘤治疗不成功的患者 Powerlink 肾下
不成功的(失败)动脉瘤治疗
技术失败
覆膜支架未开放
动脉瘤破裂
转为开放修复
支架或连接部位破裂
移动
I 型远端内漏 >30 天
I 型近端内漏 >30 天
III 型内漏
因动脉瘤增大而进行术后干预
1
肾下研究: 四例技术失败原因为: 介入困难和植入商用设备 [n=1];转为开放修复 [n=3]。 肾上研究: 三例技术失败原因为: 介入困难和植入
商用设备 [n=1];术中患者因心脏原因死亡 [n=1];主骼动脉穿孔和转为开放修复 [n=1]。
2
肾下研究: 包括三例术中转换(见“技术失败”);一例因 II 型内漏在 30 天后转换。 肾上研究: 包括一例术中转换(见“技术失败”);一
例因 II 型内漏在 30 天后转换。
3
定义为核心实验室认定设备相对原始植入位置移动 >10 毫米。 所有移动均未报告结局。
4
包括 30 天后和一年内由核心实验室确认和/或进行干预的 I 型内漏。 肾下研究: 四名患者在一年内接受干预。 一名患者在一年就诊时被核心实
验室确认为内漏。 肾上研究: 四名患者在一年内接受干预。 六名患者在一年就诊时被核心实验室确认为内漏,其中 2 名因内漏接受干预。
5
定义为动脉瘤囊直径相对术前测量增幅 >5 毫米而进行干预。 肾下研究: 包括 1 例接受近端延长植入的 I 型近端内漏患者和一名接受栓塞的 II 型
内漏患者。 该 I 型内漏患者被归入“I 型近端内漏 >30 天”组内。 肾上研究: 包括 1 例接受近端延长植入的 I 型近端内漏患者以及一名 I 型远端
内漏及接受膨胀和栓塞的 II 型内漏的患者。 两名患者均被归入“I 型近端(远端)内漏 >30 天”组。
1
2
3
4
4
5
% (n/N)
7.3% (14/192) 7.8% (12/153)
2.1% (4/192) 2.0% (3/153)
0.0% (0/192) 0.0% (0/153)
0.0% (0/192) 0.0% (0/153)
2.1% (4/192) 1.3% (2/153)
0.0% (0/192) 0.0% (0/153)
1.6% (3/192) 0.0% (0/153)
1.0% (2/192) 2.6% (4/153)
1.6% (3/192) 2.6% (4/153)
0.0% (0/192) 0.0% (0/153)
1.0% (2/192) 1.3% (2/153)
Powerlink 肾上
% (n/N)
主要效力终点,Powerlink 34 毫米近端延长研究:一年时 I 型近端内漏
术后一年内两名患者出现近端 I 型内漏。根据研究主要终点分析,经精确二项式分布检验,拒绝零研
究假设 (p<0.005)。 因此已到达研究终点。
主要效力终点,Powerlink 肾上近端延长研究:30 天时 I 型近端内漏
术后 30 天内两名患者出现近端 I 型内漏。根据研究主要终点分析,经精确二项式分布检验,拒绝零研
究假设 (p=0.006)。因此已到达研究终点。
其他效力数据
核心实验室对植入覆膜支架性能的评估(支架破裂的腹部 X 光评估;覆膜支架移动、开放和完整性的
CT 扫描评估)总结于表 21 到表 24。
表 21. 核心实验室对一年内设备性能的评估,Powerlink 肾下研究
时间点
1 个月
6 个月
1 年
†
移动定义为覆膜支架相对原始植入位置移动 >10 毫米。 核心实验室判定三名患者出现设备移动。 所有移动均未报告结局。
‡
开放定义为血流不受阻碍地穿过植入物。
¥
设备完整性丧失定义为覆膜支架破裂、扭曲、任何类型的阻塞或者覆膜破洞或撕裂。无患者被确认为出现支架破裂或覆膜破洞或撕裂。
注:1 个月:一名患者在一个月时被确认为支架略微扭曲,但在一年时或后续随访中未见。
支架破裂
n/N (%)
0/129 [0.0%] 0/106 [0.0%] 115/115 [100%] 1/115 [0.9%]
0/118 [0.0%] 2/101 [2.0%] 110/110 [100%] 0/110 [0.0%]
0/146 [0.0%] 1/136 [0.7%] 140/140 [100%] 0/140 [0.0%]
覆膜支架移动†
n/N (%)
覆膜支架开放‡
n/N (%)
设备完整性丧失
n/N (%)
表 22. 核心实验室对一年内设备性能的评估,Powerlink 肾上研究
时间点
1 个月
6 个月
1 年
†
移动定义为覆膜支架相对原始植入位置移动 >10 毫米。
‡
开放定义为血流不受阻碍地穿过植入物。
¥
设备完整性丧失定义为覆膜支架破裂、扭曲、任何类型的阻塞或者覆膜破洞或撕裂。无患者被确认为出现支架破裂或覆膜破洞或撕裂。
注: 1 个月:一名患者出现左骼肢端支架略微扭曲,但在一年时随访或直到最近随访中未见。1 年:一名患者在术后几周接受股动脉到股动脉旁路
以解决与设备无关的淋巴漏。 另一名患者在一年时可能因成像伪影而出现非特定的设备完整性丧失。 核心实验室在第 2 和 3 年(当前)随访
中未给出进一步的报告。
支架破裂
n/N (%)
0/131 [0.0%] 0/124 [0.0%] 134/134 [100%] 1/134 [0.7%]
0/124 [0.0%] 0/113 [0.0%] 113/113 [100%] 0/113 [0.0%]
0/121 [0.0%] 0/110 [0.0%] 110/110 [100%] 2/110 [1.8%]
覆膜支架移动†
n/N (%)
覆膜支架开放‡
n/N (%)
设备完整性丧失
n/N (%)
表 23. 核心实验室对一年内设备性能的评估,Powerlink 34 毫米近端延长研究
时间点
1 个月
6 个月
1 年
†
移动定义为覆膜支架相对原始植入位置移动 >10 毫米。
‡
开放定义为血流不受阻碍地穿过植入物。
¥
设备完整性丧失定义为覆膜支架破裂、扭曲、任何类型的阻塞或者覆膜破洞或撕裂。无患者被确认为出现支架破裂或覆膜破洞或撕裂。初次手术中
接受股动脉到股动脉旁路的一名患者在一个月时被核心实验室确认为左肢端完整性丧失。此结果未得到进一步报告。
支架破裂
n/N (%)
0/53 [0.0%] 0/56 [0.0%] 56/56 [100%] 1/56 [1.8%]
0/53 [0.0%] 0/54 [0.0%] 54/54 [100%] 0/54 [0.0%]
0/46 [0.0%] 0/50 [0.0%] 50/50 [100%] 0/50 [0.0%]
覆膜支架移动†
n/N (%)
覆膜支架开放‡
n/N (%)
设备完整性丧失
n/N (%)
¥
¥
¥
20
Page 21

表 24. 核心实验室对 30 天时设备性能的评估,Powerlink 肾上近端延长研究
时间点
1 个月
†
移动定义为覆膜支架相对原始植入位置移动 >10 毫米。
‡
开放定义为血流不受阻碍地穿过植入物。
¥
设备完整性丧失定义为覆膜支架破裂、扭曲、任何类型的阻塞或者覆膜破洞或撕裂。无患者被确认为出现支架破裂或覆膜破洞或撕裂。
支架破裂
n/N (%)
0/34 [0.0%] 0/40 [0.0%] 40/40 [100%] 0/40 [0.0%]
覆膜支架移动†
n/N (%)
覆膜支架开放‡
n/N (%)
设备完整性丧失
n/N (%)
¥
在一年内进行的辅助手术总结于表 25 到表 28。
表 25. 一年内的辅助手术,Powerlink 肾下研究
时间点
1 个月
6 个月
1 年
注: 1 个月时 N=186: 三名患者术中转为开放修复;一名患者未接受试验性设备并退出;两名患者在 1 个月随访前死亡。
†
四名患者在术后第 2、9、239 和 403 天为解决近端 I 型内漏而接受近端延长套。所有修复都很成功,但最后一名除外,因该患者出现血管损伤而不成
功地转为开放修复。 此例死亡被认为与动脉瘤相关。
‡
两名患者在术后第 46 和 383 天为解决远端 I 型内漏而接受肢端延长。修复均成功。
¥
六名患者在第 26、56、66、71、183 和 416 天因肢端支架阻塞而接受血栓切除术和/或血管重建术。修复均成功。
€
六名患者在第 27、42、139、199、236 和 371 天因 II 型内漏而接受栓塞。修复均成功。
§
三名患者接受原生血管干预(第 0 天,外骼动脉支架;第 7 天,浅表股静脉血栓切除术;以及第 57 天,右腿多血栓切除术)。
I 型近端内漏†
2/186 [1.1%] 0/186 [0.0%] 1/186 [0.6%] 1/186 [0.6%] 2/186 [1.1%]
1/171 [0.6%] 1/171 [0.6%] 4/171 [2.3%] 3/171 [1.8%] 1/171 [0.6%]
1/157 [0.6%] 1/157 [0.6%] 1/157 [0.7%] 2/157 [1.2%] 0/157 [0.0%]
n/N (%)
I 型远端内漏‡
n/N (%)
植入物阻塞¥
n/N (%)
II 型内漏€
n/N (%)
其他干预§
n/N (%)
表 26. 一年内的辅助手术,Powerlink 肾上研究
时间点
1 个月
6 个月
1 年
†
一名患者在第 276 天接受近端动脉颈部折襞;一名患者在第 305 天接受近端延长套。修复均成功。
‡
两名患者在术后第 55 天(患者 1)以及第 64 和 140 天(患者 2)接受肢端延长。 修复均成功。
¥
两名患者分别在第 2 和 17 天因肢端阻塞而结束血栓切除术。一名患者在第 54 天因原生血管/肢端血栓而接受支架/PTA。
€
一名患者在第 19 天因 II 型内漏接受球囊膨胀。四名患者在第 159 天(患者 1)、第 210 和 229 天(患者 2)、第 235 和 287 天(患者 3)以及第 273
天(患者 4)接受栓塞。 所有修复均成功,但以下情况除外: 一名在第 210 和 229 天接受栓塞的患者拒绝进一步栓塞并在第 925 天取出植入物并成
功转为开放修复以解决伴随动脉瘤囊增大的 II 型内漏。 另一名在第 235 和 287 天接受两次栓塞的患者在一年后通过凝血酶注射而接受两次额外的栓
塞尝试(第 858 和 872 天)但最终在第 1176 天取出植入物并成功转为开放修复以解决伴随动脉瘤囊增大的 II 型内漏。 独立的取出物病理学分析均
未在两个取出设备中发现覆膜支架出现破裂、断开、扭曲或其他异常。
§
一名患者在第 21 天接受股-股动脉旁路手术以解决淋巴漏。一名患者在第 78 天接受肢端延长以解决覆膜支架对齐问题(无内漏)。修复均成功。
I 型近端内漏†
0/149 [0.0%] 0/149 [0.0%] 2/149 [1.3%] 1/149 [0.7%] 1/149 [0.7%]
0/140 [0.0%] 2/140 [1.4%] 1/140 [0.7%] 2/140 [1.4%] 1/140 [0.7%]
2/131 [1.5%] 0/131 [0.0%] 0/131 [0.0%] 3/131 [2.3%] 0/131 [0.0%]
n/N (%)
I 型远端内漏‡
n/N (%)
肢端阻塞¥
n/N (%)
II 型内漏€
n/N (%)
其他干预§
n/N (%)
表 27. 一年内的辅助手术,Powerlink 34 毫米近端延长研究
时间点
1 个月
6 个月
1 年
†
一名患者在术后第 393 天接受额外近端延长。修复成功。
‡
一名患者在术后第 51 天接受肢端延长(左骼动脉)和血管重建术(右骼动脉)。修复成功。
€
一名患者因怀疑 II 型内漏在第 176、194 和 375 天接受尝试栓塞。该患者随后在第 2 年随访时被确诊为近端 I 型内漏,并在第 768 天接受额外近端设
备。内漏问题就此解决。
I 型近端内漏†
0/60 [0.0%] 0/60 [0.0%] 0/60 [0.0%] 0/60 [0.0%] 0/60 [0.0%]
0/58 [0.0%] 1/58 [1.7%] 0/58 [0.0%] 1/58 [1.7%] 0/58 [0.0%]
1/55 [1.7%] 0/55 [0.0%] 0/55 [0.0%] 1/55 [1.7%] 0/55 [0.0%]
n/N (%)
I 型远端内漏‡
n/N (%)
肢端阻塞
n/N (%)
II 型内漏€
n/N (%)
其他干预
n/N (%)
表 28. 30 天内的辅助手术,Powerlink 肾上近端延长研究
时间点
1 个月
I 型近端内漏
0/44 [0.0%] 0/44 [0.0%] 0/44 [0.0%] 0/44 [0.0%] 0/44 [0.0%]
n/N (%)
I 型远端内漏
n/N (%)
肢端阻塞
n/N (%)
II 型内漏
n/N (%)
其他干预
n/N (%)
21
Page 22

在一年内出现的内漏总结于表 29 到表 31。
表 29. 1 个月和 1 年时所有内漏的摘要,肾下研究受试组 [核心实验室]
12 个月时内漏
所有内漏类型
I 型
II 型
III 型
IV 型
未定
†
内漏报告数目并非累计,而是代表各时间点时出现的内漏数目。据报告,四名患者在一个月时和两名患者在一年时出现一种以上的内漏类型。
1 个月时报告
n/N (%)
25/110 [23%] 18/128 [14%]
3/110 [2.7%] 1/128 [0.8%]
24/110 [22%] 17/128 [13%]
0/110 [0.0%] 0/128 [0.0%]
0/110 [0.0%] 0/128 [0.0%]
2/110 [1.8%] 2/128 [1.6%]
†
1 年时报告†
n/N (%)
表 30. 1 个月和 1 年时所有内漏的摘要,肾上研究受试组 [核心实验室]
内漏类型
所有内漏类型
I 型
II 型
III 型
IV 型
未定
†
内漏报告数目并非累计,而是代表各时间点时出现的内漏数目。请注意,在 1 个月和一年时,报告四名患者同时出现 I 型和 II 型内漏并同时包含在
两行内。
1 个月时报告†
56/138 [41%] 33/114 [29%]
6/138 [4.3%] 6/114 [5.3%]
47/138 [34%] 28/114 [25%]
0/138 [0.0%] 0/114 [0.0%]
0/138 [0.0%] 0/114 [0.0%]
7/138 [0.7%] 3/114 [2.6%]
n/N (%)
1 年时报告†
n/N (%)
表 31. 1 个月和 1 年时所有内漏的摘要,近端延长研究组 [核心实验室]
内漏类型
所有内漏类型
I 型近端
I 型远端
II 型
III 型
IV 型
未定
†
‡
内漏报告数目并非累计,而是代表各时间点时出现的内漏数目。 请注意,在一个月和一年时,报告一名 34 毫米近端研究患者同时出现远端 I 型和 II
型内漏并同时包含在两行内。
内漏报告数目并非累计,而是代表各时间点时出现的内漏数目。请注意,报告两名肾上近端延长研究患者同时出现 I 型和 II 型内漏并同时包含在两
行内。
1 个月时报告†
16/56 [29%] 10/50 [20%] 7/40 [18%]
0/56 [0.0%] 1/50 [2.0%] 2/40 [5.0%]
1/56 [1.8%] 1/50 [2.0%] 0/40 [0.0%]
13/56 [23%] 9/50 [18%] 6/40 [15%]
0/56 [0.0%] 0/50 [0.0%] 0/40 [0.0%]
0/56 [0.0%] 0/50 [0.0%] 0/40 [0.0%]
3/56 [5.4%] 0/50 [0.0%] 1/40 [2.5%]
34 毫米近端延长 肾上近端延长
n/N (%)
1 年时报告†
n/N (%)
1 个月时报告‡
n/N (%)
从基线到一年的动脉瘤大小变化在表 32 中总结。
表 32. 从基线到一年的动脉瘤大小变化 [核心实验室]
从基线到 12 个月的变化 Powerlink 肾下
增大
‡
稳定
减小
‡
稳定动脉瘤最大直径是指没有大于 5 毫米的变化(增大或减小)。
1
在 1 年时被核心实验室判定动脉瘤囊直径增大的 Powerlink 肾下患者接受如下诊断/治疗:
I 型近端内漏 [n=1]: 该患者在第 403 天接受额外近端延长支架放置治疗。该患者因介入血管损伤而不成功地转为开放修复。 此例死亡被认为与
动脉瘤相关。
I 型远端和 II 型内漏 [n=1]: 该患者在第 46 天接受肢端延长治疗,且在第 42 天接受栓塞。
2
在 1 年时被核心实验室判定动脉瘤囊直径增大的 Powerlink 肾上患者接受如下诊断/治疗:
II 型内漏 [n=5]: 一名患者在一年内接受栓塞。 两名患者在一年后取出植入物并转为开放修复(见表 19 脚注)。 两名患者在第 2 年接受尝试栓
塞并最终取出植入物,并且在第 561 和 568 天转为开放修复以解决伴随囊增大的 II 型内漏。 独立的取出物病理学分析未在取出设备中发现覆膜支
架出现破裂、断开、扭曲或其他异常。
I 型近端内漏 [n=1]: 该患者在第 305 天于二次干预中接受近端延长,最终解决了内漏。
未定内漏 [n=1]: 该患者在第 2 年随访时接受球囊扩张,并在第 3 和第 4 年接受两次后续栓塞。据报告,内漏(看起来为 II 型)已解决。
I 型远端和 II 型内漏 [n=1]: 截止目前未报告干预。 医师表示患者将被监控到下一次随访。
无内漏 [n=3]:患者正被监控(截止目前未干预)。 核心实验室报告 CT 切片(>3 毫米切片)可能影响读数。
3
在 1 年时被核心实验室判定动脉瘤囊直径增大的 Powerlink 34 毫米近端延长患者接受如下诊断/治疗:
一名患者在一个月时被诊断为 II 型内漏。该内漏在六个月就诊时未检测到,并报告为自发解决。
一名患者在一个月时被诊断为 II 型内漏。该内漏在一年的每次随访中均可检测到。截止目前未报告干预。
n/N (%)
2/91 [2.2%] 11/113 [9.7%] 2/50 [4.0%]
55/91 [60%] 75/113 [66%] 33/50 [66%]
34/91 [37%] 27/113 [24%] 15/50 [30%]
1
Powerlink 肾上2
n/N (%)
Powerlink 34 毫米近端延长3
n/N (%)
22
Page 23

6.10 急性手术数据
如下表 33 所示,Powerlink 肾下和 Powerlink 肾上覆膜支架的临床功效在麻醉时间、手术时间、失血
数量、麻醉类型以及 ICU 住院时间方面与对照组相比得到改善。
表 33. 按研究和治疗组划分的急性手术结果
参数
麻醉时间(分)
手术时间(分)
失血量(毫升)
麻醉类型:
局部
硬膜外/部位
概述
ICU 时间(天)
住院时间(天)
1
结果报告为平均值 ± SD 或 n/N(占组中患者 %)。nr: 未报告
Powerlink
1
肾下
185 ± 82 201 ± 71
136 ± 66 150 ± 63
341 ± 413 496 ± 632
41/192 (21%)
22/192 (12%)
129/192 (67%)
0.8 ± 1.5
3.3 ± 3.4
Powerlink
26/153 (17%)
32/153 (21%)
95/153 (62%)
0.4 ± 0.6
2.2 ± 2.1
7.0 患者选择和治疗
(见第
4.0 部分 –
警告和警示信息)
7.1 治疗的个体化
Endologix 推荐按照表 36 的描述选择系统覆膜支架组件的直径。Powerlink 系统覆膜支架覆膜部分的长
度应从最低的肾动脉延伸到内骼(腹动脉)动脉起点之上。Powerlink 延长覆膜支架的长度应从最低的
肾动脉或肢端内侧延伸到与所选两肢型覆膜支架型号内部重叠 15-20 毫米。 完成手术所必要的所有设
备长度和直径均应向医师提供,特别是在术前规划测量(治疗直径/长度)不确定时。 此方法允许术
中更大的灵活性以取得最佳手术结果。 在为 AAA 使用 Powerlink 系统前,应为每一患者认真考虑第
6.0
部分“临床研究摘要”
描述的风险和优势。患者选择时的额外考虑包括但不限于:
患者年龄和寿命预期
并发症(例如术前心脏、肺或肾功能不全、病态肥胖)
患者适于开放手术修复的程度
患者解剖结构适于腔内修复的程度
与 Powerlink 系统治疗 AAA 的风险相比,动脉瘤破裂的风险。
耐受全身、部位或局部麻醉的能力
髂股介入血管大小和形态(最小血栓、钙化和/或扭曲)应与 21Fr 或更小输送导管的血管介入技
术相兼容。 用于 AAA 的 Powerlink 系统不通过单独的血管导管鞘输送。
与要求输送系统相兼容的足够骼/股动脉入口(直径 7 毫米)。
肾动脉和动脉瘤之间为无动脉瘤的动脉颈部:
长度 15 毫米
直径 18 毫米且 32 毫米
到动脉瘤体的颈角 60°。
动脉长度长出所选两肢型型号主体部分 1.0 厘米。
髂总动脉远端固定部位:
远端固定长度 15 毫米
具有保留至少一条下腹动脉的能力
直径 10 毫米且 23 毫米(肢端)
到主动脉杈的骼角 90°。
无阻碍血流通过血管植入物的主要股/骼动脉阻塞疾病。
最终治疗决定由医师和患者共同判断。
8.0 患者告知信息
肾上
1
对照
1
66/66 (100%)
34 毫米近端延长1 肾上近端延长1
294 ± 112 nr nr
222 ± 100 129 ± 70 130 ± 55
1583 ± 1609 338 ± 286 361 ± 240
0/66 (0.0%)
0/66 (0.0%)
4.1 ± 8.4 nr nr
9.5 ± 7.7
8/60 (14%)
14/60 (23%)
38/60 (63%)
0/44 (0.0%)
4/44 (9.1%)
40/44 (91%)
2.1 ± 1.8 2.2 ± 1.9
医师和患者(和/或家人)应在讨论此腔内设备和手术时了解其风险和好处,包括:
腔内修复和手术修复的风险和区别
传统开放手术修复的潜在优势
腔内修复的潜在优势
在首次腔内修复后可能要求动脉瘤的后续干预或开放手术修复。
除了腔内修复的风险和好处外,医师应评估患者对术后必要随访的承诺和践约以确保持续安全和有效的结
果。 下面是在腔内修复术后期望方面与患者讨论的额外主题。
23
Page 24

腔内植入物的长期性能尚未确立。 应告知所有患者腔内治疗要求终身定期随访,以评估其健康状况和腔内植
入物的性能。 出现具体临床结果(例如内漏、动脉瘤增大或腔内植入物结构或位置的改变)的患者应接受更
强化的随访。 具体随访指导原则见第 12.0
应告知患者在术后第一年中以及之后每年一次遵守随访计划的重要性。 应告知患者定期和坚持接受随访是保
证 AAA 腔内治疗持续安全性和效力的关键。 至少应要求每年成像一次和遵守常规术后随访要求,并应考虑
终身承诺以保证患者的健康和幸福。
医师必须告知所有患者如果其出现肢端阻塞、动脉瘤增大或破裂迹象,则及时就医相当重要。 植入物肢端阻
塞的迹象包括髋部或腿在行走中或休息时疼痛或者腿部皮肤褪色或冰冷。 动脉瘤破裂可能无症状,但一般表
现为: 疼痛;麻木;腿部虚弱;后背、胸部、腹部或腹股沟疼痛;眩晕;昏厥;心跳快速或突然衰弱。
部分“成像指导原则和术后随访”
。
医师应指导患者参阅
经、肠和出血并发症。 设备相关风险包括阻塞、内漏、动脉瘤增大、破裂、再干预和开放手术的可能、动脉
瘤破裂和死亡(见第 6.0
带。 患者在其他健康从业者处就诊时应参考此卡片,特别是任何其他诊断程序(例如 MRI)。
《患者手册》
以了解设备植入中或植入后存在的风险。 手术相关风险包括心脏、肺、神
部分“临床研究摘要”
)。 医师应填写
患者植入物卡片
并交给患者以便其随身携
9.0 供应方式
用于 AAA 的 Powerlink 系统在两层剥开式包装内灭菌密封供应,其中一层包装密封在另一层中。 表 34 列出
了供应的两肢型覆膜支架;表 35 列出了供应的近端和肢端延长覆膜支架。
此设备仅供一次性使用。 请不要对设备重复灭菌。
请检查设备和包装以确认运输过程未导致设备损坏。 如果此设备损坏或无菌包装损坏或破裂,请不要使用。
如果设备损坏,请不要使用并退回给 Endologix, Inc.。
请在使用前核对设备和医师为具体患者开出的订单,确认是否提供了正确的设备(数量和规格)。
请不要在标签上印刷的“使用截止 (Use By)”(失效)日期后使用。
请在干燥凉爽的地点储存。
设备包装包括一个具有可剥离不干胶的标签,其中含设备型号和批号。 这些不干胶旨在用于随附的《设备追
踪表》。 请参阅第 13.0 部分了解关于《患者植入物卡片》和《设备追踪表》的信息。
24
Page 25

表 34. 两肢型覆膜支架
型号
22-13-100BL 22 60 13 40 21
22-13-120BL 22 80 13 40 21
22-13-140BL 22 100 13 40 21
22-16-100BLs 22 70 16 30 21
22-16-100BL 22 60 16 40 21
22-16-120BLs 22 90 16 30 21
22-16-120BL 22 80 16 40 21
22-16-140BL 22 100 16 40 21
25-13-100BL 25 60 13 40 21
25-13-120BL 25 80 13 40 21
25-13-140BL 25 100 13 40 21
25-16-100BLs 25 70 16 30 21
25-16-100BL 25 60 16 40 21
25-16-120BLs 25 90 16 30 21
25-16-120BL 25 80 16 40 21
25-16-135BL 25 80 16 55 21
25-16-140BL 25 100 16 40 21
25-16-155BL 25 100 16 55 21
28-13-100BL 28 60 13 40 21
28-13-120BL 28 80 13 40 21
28-13-140BL 28 100 13 40 21
28-16-100BLs 28 70 16 30 21
28-16-100BL 28 60 16 40 21
28-16-120BLs 28 90 16 30 21
28-16-120BL 28 80 16 40 21
28-16-135BL 28 80 16 55 21
28-16-140BL 28 100 16 40 21
28-16-155BL 28 100 16 55 21
*集成导管鞘腔为 19Fr 且额定总长度为 66 厘米。
主体直径
(毫米)
PTFE 覆膜主体长
度(毫米)
肢端直径(毫
米)
肢端长度(毫
米)
输送系统
外径 Fr*
25
Page 26

表 35. 延长覆膜支架
型号†
22-22-55L 22 x 22 55 0 19
22-22-75L 22 x 22 75 0 19
25-25-55L 25 x 25 55 0 19
25-25-75L 25 x 25 75 0 19
25-25-95L 25 x 25 95 0 19
28-28-55L 28 x 28 55 0 19
28-28-75L 28 x 28 75 0 19
28-28-95L 28 x 28 95 0 19
28-28-95DS 28 x 28 0 95 19
28-28-190DS 28 x 28 0 190 19
31-31-80L 31 x 31 80 0 21
31-31-80LE 31 x 31 80 0 21
34-34-80L 34 x 34 80 0 21
34-34-80LE 34 x 34 80 0 21
34-34-100L 34 x 34 100 0 21
34-34-100LE 34 x 34 100 0 21
34-34-100DS 34 x 34 0 100 19
34-34-200DS 34 x 34 0 200 19
22-22-75RL 22 x 22 55 20 19
22-22-95RL 22 x 22 75 20 19
25-25-75RL 25 x 25 55 20 19
25-25-75RLE 25 x 25 55 20 21
25-25-95RL 25 x 25 75 20 19
25-25-95RLE 25 x 25 75 20 21
25-25-115RL 25 x 25 95 20 19
25-25-115RLE 25 x 25 95 20 21
28-28-75RL 28 x 28 55 20 19
28-28-75RLE 28 x 28 55 20 21
28-28-95RL 28 x 28 75 20 19
28-28-95RLE 28 x 28 75 20 21
28-28-115RL 28 x 28 95 20 19
28-28-115RLE 28 x 28 95 20 21
31-31-100RL 31 x 31 80 20 21
31-31-100RLE 31 x 31 80 20 21
34-34-100RL 34 x 34 80 20 21
34-34-100RLE 34 x 34 80 20 21
34-34-120RL 34 x 34 100 20 21
34-34-120RLE 34 x 34 100 20 21
16-16-55L 16 x 16 55 0 17
16-16-55FL 16 x 16 55 0 17
16-16-88L 16 x 16 88 0 17
20-13-70FL 20 x 13 70 0 17
20-13-88FL 20 x 13 88 0 17
20-20-55L 20 x 20 55 0 17
20-20-55FL 20 x 20 55 0 17
20-25-55S 20 x 25 55 0 19
20-25-65F 20 x 25 65 0 19
20-25-65S 20 x 25 65 0 19
†
“LE” 和 “RLE” 表示 IntuiTrak 快速输送系统,用于通过两肢型导管鞘连接和输送。31 毫米和 34 毫米 “L” 和 “RL” 型号使用 IntuiTrak 21Fr 输送系统,用于单独使
用。所有其他型号可单独使用或配合两肢型导管鞘使用。
延长直径(近端 x 远
端,毫米)
PTFE 覆膜延长长度(毫
米)
肾下近端延长
肾上近端延长
肢端延长
未覆盖延长长度(毫米)
输送系统
Fr
26
Page 27

10.0 临床使用信息
小心:
在植入或再干预手术中始终应保持一个血管手术小组待命,以防必要时转为开放手术修复。
小心:
用于
AAA 的 POWERLINK
于使用用于
10.1 医师培训计划
患者选择:
了解腹主动脉瘤 (AAA) 的自发病史和与 AAA 修复相关的并发症。
了解 X 光片影像的解读、设备选择和规格确定。
拥有以下综合手术经验的多学科小组:
股动脉切开、动脉切开术和修复
经皮介入和缝合技术
非选择性和选择性导丝和导管技术
荧光镜和血管造影术影像的解读
栓塞
血管重建术
腔内支架放置
勒除技术
放射成像造影剂的适当使用
最大程度降低放射照射的技术
必要患者随访模态的专业知识
10.2 使用前的检查
请检查设备和包装以确认运输过程未导致设备损坏。 如果设备损坏或无菌包装损坏或破裂,请不要使
用。 如果设备损坏,请退回给 Endologix, Inc.。请在使用前核对设备和医师为具体患者开出的订单,
确认是否提供了正确的设备(数量和规格)。
10.3 要求的材料
为让植入物良好适合患者的解剖结构或修复任何内漏,可能要求各种长度和直径的 Powerlink 近端延
长套或肢端延长。
荧光镜成像和记录所有影像的能力。
Endologix 双腔导管
各种长度足够的 0.035 英寸标准导丝(用于双腔导管)
用于荧光镜染料研究的高压注射器。
推荐最小刻度为毫米的不透射线(尺)。
肝素化溶液和灭菌生理盐水。
足够长度的坚硬 0.035 英寸导丝(用于放置到 IntuiTrak 输送系统中央腔内)
各种用于通过扭曲血管的导管,包括血管重建术导管(用于在输送导管通过前扩张窄血管)。
12 或 12.5Fr 剥离式导管鞘(用于在输送系统介入前控制导丝)
9Fr 导管鞘(用于对侧肢端部署)
勒除器
不透射线造影剂
足够长度的标准 0.014 英寸导丝(用于可选对侧肢端介入)
系统只能由接受过血管干预技术和此设备使用培训的医师和小组使用。 对
AAA 的 POWERLINK
系统的医师,其推荐技能/知识要求概括如下
:
10.4 设备直径的确定原则
直径过小或过大均可导致密封不完全或影响血流。
27
Page 28

表 36. 肾下两肢型覆膜支架规格
目标动脉血管直径
18-20 毫米
18-23 毫米
20-26 毫米
*外径。 集成导管鞘腔规格为 19Fr。
肾动脉到
主动脉杈
长度
70 毫米 110 毫米 60 毫米
90 毫米 130 毫米 80 毫米
110 毫米 150 毫米
80 毫米 110 毫米 70 毫米 30 毫米
70 毫米 110 毫米 60 毫米 40 毫米
100 毫米 130 毫米 90 毫米 30 毫米
90 毫米 130 毫米 80 毫米
110 毫米 150 毫米
70 毫米 110 毫米 60 毫米
90 毫米 130 毫米 80 毫米
110 毫米 150 毫米
80 毫米 110 毫米 70 毫米 30 毫米
70 毫米 110 毫米 60 毫米 40 毫米
100 毫米 130 毫米 90 毫米 30 毫米
90 毫米 130 毫米 80 毫米 40 毫米
90 毫米 145 毫米 80 毫米 55 毫米
110 毫米 150 毫米 100 毫米 40 毫米
110 毫米 165 毫米
70 毫米 110 毫米 60 毫米
90 毫米 130 毫米 80 毫米
110 毫米 150 毫米
80 毫米 110 毫米 70 毫米 30 毫米
70 毫米 110 毫米 60 毫米 40 毫米
100 毫米 130 毫米 90 毫米 30 毫米
90 毫米 130 毫米 80 毫米 40 毫米
90 毫米 145 毫米 80 毫米 55 毫米
110 毫米 150 毫米 100 毫米 40 毫米
110 毫米 165 毫米
肾动脉到腹动
脉长度
目标骼血
管直径
10-11 毫
米
10-14 毫
米
10-11 毫
米
10-14 毫
米
10-11 毫
米
10-14 毫
米
表 37. 28 毫米两肢型与 34 毫米近端延长覆膜支架规格
两肢型覆膜支架主体长度(毫
米)
60
70
80
90
100
目标主动脉血管直径(毫米) 肾动脉到主动脉杈长度(毫米)
20 至 26
26 至 28
28 至 30
30 至 32
20 至 26
26 至 28
28 至 30
30 至 32
20 至 26
26 至 28
28 至 30
30 至 32
20 至 26
26 至 28
28 至 30
30 至 32
20 至 26
26 至 28
28 至 30
30 至 32
主体直径
22 毫米
25 毫米
28 毫米
主体覆膜
长度
100 毫米
100 毫米
100 毫米
100 毫米
100 毫米
100 毫米
>75 >15
>85 >25
>90 >30
>95 >35
>85 >15
>95 >25
>100 >30
>105 >35
>95 >15
>105 >25
>110 >30
>115 >35
>105 >15
>115 >25
>120 >30
>125 >35
>115 >15
>125 >25
>130 >30
>135 >35
肢端直径
13 毫米 40 毫米
16 毫米
13 毫米 40 毫米
16 毫米
13 毫米 40 毫米
16 毫米
肢端长度 输送导管 Fr 规
格*
21
40 毫米
21
55 毫米
21
55 毫米
植入两肢型覆膜支架后,肾动脉到
近端两肢型覆膜支架的长度(毫
米)
28
Page 29

小心:
植入
22
毫米或
25
毫米两肢型覆膜支架与
34
毫米近端延长支架的安全性和效果尚未确定。
表 38. 延长覆膜支架规格
目标血管直径 延长直径1 延长总长度 延长覆膜长度 输送导管 Fr 规格
肾下近端延长
55 毫米 55 毫米 18-20 毫米 22 毫米 x 22 毫米
75 毫米 75 毫米
18-23 毫米 25 毫米 x 25 毫米
20-26 毫米
23-29 毫米 31 毫米 x 31 毫米 80 毫米 80 毫米
23-32 毫米 34 毫米 x 34 毫米
18-23 毫米
20-26 毫米
23-29 毫米 31 毫米 x 31 毫米 100 毫米 80 毫米
14-18 毫米 20 毫米 x 20 毫米 55 毫米 55 毫米
1
尺寸显示为近端直径 x 远端直径。
2
肾下放置时近端存在一个 20 毫米长的开放支架导线部分。
28 毫米 x 28 毫米
25 毫米 x 25 毫米
28 毫米 x 28 毫米
16 毫米 x 16 毫米
20 毫米 x 25 毫米
55 毫米 55 毫米
75 毫米 75 毫米
95 毫米 95 毫米
55 毫米 55 毫米
75 毫米 75 毫米
95 毫米 95 毫米
95 毫米 0 毫米
190 毫米 0 毫米
80 毫米 80 毫米
100 毫米 100 毫米
100 毫米 0 毫米
200 毫米 0 毫米
肾上近端延长2
75 毫米 55 毫米 18-20 毫米 22 毫米 x 22 毫米
95 毫米 75 毫米
75 毫米 55 毫米
75 毫米 55 毫米
95 毫米 75 毫米
95 毫米 75 毫米
115 毫米 95 毫米
115 毫米 95 毫米
75 毫米 55 毫米
75 毫米 55 毫米
95 毫米 75 毫米
95 毫米 75 毫米
115 毫米 95 毫米
115 毫米 95 毫米
100 毫米 80 毫米 23-32 毫米 34 毫米 x 34 毫米
120 毫米 100 毫米
肢端延长
55 毫米 55 毫米 10-14 毫米
88 毫米 88 毫米
70 毫米 70 毫米 10-11 毫米 20 毫米 x 13 毫米
88 毫米 88 毫米
55 毫米 55 毫米 14-23 毫米
65 毫米 65 毫米
11.0 使用说明
在使用用于 AAA 的 Endologix Powerlink 系统前,请阅读本
基本指导原则。必要时可修改以下步骤。这些说明旨在用于指导医师,不可替代医师的判断。
《使用说明》
手册。以下说明给出了设备放置的
11.1 一般使用说明
1. 用于 AAA 的 Powerlink 系统的使用过程中应采用放置动脉介入鞘、引导导管、血管造影导管和导
丝的标准技术。用于 AAA 的 Powerlink 系统与直径 0.035 英寸的导丝兼容。
小心:
根据医院和医师的首选治疗方案,应在植入程序中使用全身抗凝血治疗。如果禁忌使用肝素,则应考
虑使用替代抗凝血剂
.
11.2 植入前决定因素
在植入前规划中核实是否选择了正确的设备。决定因素包括:
1. Powerlink 系统可通过两条骼动脉中的任意一条导入。 也可考虑股总动脉介入和动脉瘤囊定向。
如果一条骼动脉扭曲更大、有动脉瘤或存在疾病,则此侧可首选作为输送导管介入动脉,因此侧
血管允许更多操作和控制。
2. 动脉颈部、动脉瘤和骼动脉的角度。
3. 动脉颈部的质量。
29
19
19
19
21
21
19
19
19
21
19
21
19
21
19
21
19
21
19
21
21
21
17
17
17
19
Page 30

4. 肾下主动脉颈部和远端骼动脉的直径。
5. 从肾动脉到主动脉杈的距离。
6. 从主动脉杈到内骼动脉/连接部位的长度。
7. 延伸进入骼动脉的动脉瘤可能在选择适当覆膜/动脉接口部位时要求特别考虑。
8. 骼动脉的预扩张可使部署程序更加简单。
警告: 用于 AAA 的 POWERLINK 系统要求使用血管内造影剂。 先存肾功能不全的患者术后的肾衰竭风险
可能提高。 应注意限制术中使用的造影剂的数量。
警告: 除非医疗上需要,否则不得在可能阻塞为器官或肢体输送血流的必要动脉的位置部署 POWERLINK
系统覆膜支架。 不要让覆膜支架遮盖重要的肾或肠系膜动脉(除非是下肠系膜动脉)或两条下腹部动
脉。 否则可阻塞血管。 在临床研究中,此设备并未在有两条内骼动脉阻塞的患者中进行研究。
11.3 患者准备
1. 请参照医院关于麻醉、抗凝血和监控生命体征的方案。
2. 将患者定位于成像台上可进行从主动脉弓到股动脉杈的荧光镜目测检查。
3. 使用标准手术技术在选择的介入侧暴露股总动脉。
4. 对手术暴露的股动脉进行充分的近端和远端血管控制。
5. 在对侧进行标准经皮血管介入。
11.4 设备准备
警告: POWERLINK 系统设计为仅供一次性使用。请勿重复使用或重复灭菌。
小心:
在准备和插入过程中最大程度降低压缩状态覆膜支架的接触,以降低覆膜支架污染和感染的风险。
小心:
不要过度弯曲或扭曲输送系统。这样做可能会损坏输送系统和
POWERLINK
系统覆膜支架。
1. 顺时针旋转拧紧止血阀。
2. 用灭菌生理盐水冲洗输送系统的腔和侧口。
11.5 步骤 – 两肢型覆膜支架的输送
1. 使用标准手术技术切开介入血管。
2. 在切开部位远端和近端放置血管环进行止血控制。
3. 将一个 12 到 12.5Fr 的剥离式导管鞘插入到其中将导入 Powerlink 的肢端,并将一个 9Fr 导管鞘插
入到对侧肢端。
4. 插入猪尾形导管进行血管造影。 标记肾动脉并固定 C 臂。
5. 确认要求的 Powerlink 系统的长度和直径。 Endologix 建议覆膜支架直径至少大于正常主动脉内径
2 毫米(例如,25 毫米覆膜支架不应部署在内径 >23 毫米的正常主动脉内)。 参阅第 10.4
“设备直径的确定原则”
6. 在为了部署覆膜支架而放置输送系统时,必须通过同侧 9Fr 鞘经股静脉输送 SurePass 对侧肢端导
丝。同时,必须将输送系统装载到坚硬的导丝以进入主动脉。可以利用双腔导管,根据其使用说
明完成导丝的处理。
。
部分
小心:
如果双腔导管的方向在最初放置时不正确,则取出双腔导管并重新定向,然后再继续。
小心:
如果确认导丝分离,则可根据医生的判断考虑使用其他方法处理导丝。
注: SurePass 同侧肢端导丝的中空腔允许在双腔导管回缩后放置一条 0.014 英寸的导丝。 如果要求
对侧预插管,则这是一种可选做法。
注: 如果存在任何血管内径问题,可将连续扩张器送到股总动脉和外骼动脉以确保输送导管的成功
通过。 使用规格合适的球囊预扩张也会便于输送导管的前进。 预扩张会“提起”主动脉杈和
扩张 CT 或动脉 X 光片未识别的狭窄或钙化部位。 如果不确定血管直径,请选择小于血管直径
的球囊以保证安全。
7. 用灭菌生理盐水湿润输送导管引导鞘,以活化亲水涂层。
8. 将输送导管装载到坚硬的导丝上。在保持止血控制的同时回缩剥离式导管,锁闭止血阀并剥离
鞘。
警告: 使用松软导丝会限制设备通过扭曲解剖结构的可追踪性。 应注意仅使用一根长度足够的坚硬导丝。
小心:
在输送系统的插入过程中保持导丝位置。
30
Page 31

9. 在荧光镜下沿导丝推进输送系统通过动脉切开处,直到主动脉中。 将覆膜支架肢端的远端置于动
脉杈上方,并确认指示对侧肢端鞘远端的可见不透射线条出现在侧面。 确保输送导管的侧口定位
朝向对侧。
小心:
在输送系统的插入过程中保持导丝位置。 确保对侧肢端导丝在推进前并未偶然裹在输送系统上。
10. 在荧光镜下目测最低肾动脉时应考虑头管角度。 一般来说,10 到 15 的角度应让射线束在通过
从肾上主动脉部分到腹主动脉部分时垂直于腹主动脉前角。 此角度有助于降低视差和透视效果,
并辅助主动脉颈部长度和主动脉杈位置的目测以便更准确地植入。
警告: 导管的前进应在荧光镜指导下完成。在遇到阻力时不要使用过大力量推进或回缩导管。否则可能损坏
血管或导管。在狭窄、血管内血栓或钙化和/或弯曲血管区域应格外小心。
小心:
血管内放置不准确、固定不足和/或
POWERLINK
系统覆膜支架密封不足可导致内漏、移动或偶然阻
塞肾或内骼动脉的风险升高。 必须保持肾动脉的开放以防止/降低肾衰和后续并发症的风险。覆膜支
架的不正确部署或移动可能要求进行手术干预。
小心:
不能持续监控覆膜支架的部署可导致扭转、扭曲或对准问题。
小心:
在动脉瘤内操作导管、导丝和鞘时应格外小心。 较大的干扰会使血栓碎片脱离从而可导致远端栓塞。
11. 保持回缩接头,回缩导管鞘以暴露覆盖的覆膜支架。 继续回缩直到不透射线标志在主动脉杈下约
1 厘米处。 将覆盖的肢端放入相应的骼动脉。 轻轻牵引 SurePass 对侧肢端导丝以消除导丝中的松
弛部分。
12. 如果使用 0.014 英寸对侧导丝,此时应完全推进。
13. 为保证正确的覆膜支架部署、减小输送导管中的张力和角度以及确保主动脉中的正确放置,请将
手从输送导管上拿开以便让设备找到正确的方位。
14. 在继续前,目视检查以确认两肢型覆膜支架近端未覆盖最低的肾动脉。
小心:
过度牵引设备肢端导丝会过早部署对侧肢端。
15. 抓住控制线缆手柄旋转,直到其从 Y 形接头上释放。
16. 抓住输送系统静止不动,在荧光镜下观察的同时轻拉控制线缆以完全部署覆膜支架的主体。 进一
步回缩控制线缆直到遇到阻力。
17. 使用以下方法之一部署覆膜支架肢端:
部署对侧肢端后部署同侧肢端:
抓住输送系统静止不动,并保持导管鞘的位置,拉动 SurePass 对侧肢端导丝,直到不透射线标志
带与肢端远端衔接。继续拉动对侧肢端导丝,以部署对侧肢端。如果使用 0.014 英寸对侧导丝,
则在部署对侧肢端时保持导丝位置不变。
整体取出 SurePass 对侧肢端导丝及主体盖和对侧肢端盖。
小心回缩导管鞘,直到不透射线标志位于已部署同侧肢端远端约 1 厘米处。 缓慢牵引核心组件,
直到不透射线尖端的底部刚好位于主骼动脉杈上方。这个动作将部署同侧肢端。继续拉动核心组
件通过导管鞘。在完全取出(包括内核和尖)后拧紧止血阀。
将扩张器完全插入导管鞘。推进导管鞘和扩张器,直到导管鞘末端的不透射线标志位于大部分尾
肾动脉水平。
部署同侧肢端后部署对侧肢端:
抓住输送系统静止不动并保持导管鞘的位置,缓慢牵引核心组件,直到不透射线尖端的底部刚好
位于主骼动脉杈上方。 这个动作将部署同侧肢端。 小心回缩导管鞘,直到不透射线标志位于已
部署同侧肢端远端约 1 厘米处。 继续拉动核心组件通过导管鞘。 在完全取出(包括内核和尖)
后拧紧止血阀。
保持对侧肢端导丝的位置。 将扩张器完全插入导管鞘。 推进导管鞘和扩张器,直到导管鞘末端
的不透射线标志位于大部分尾肾动脉水平。
拉动 SurePass 对侧肢端导丝,直到不透射线标志带与肢端远端衔接。 抓住导管鞘组件静止不动,
继续拉动对侧肢端导丝,以部署对侧肢端。 如果使用 0.014 英寸对侧导丝,则在部署对侧肢端时
保持导丝位置不变。
整体取出 SurePass 对侧肢端导丝及主体盖和对侧肢端盖。
小心:
POWERLINK
到的任何阻力都必须实施认真监控。
输送导管回缩过程中必须使用荧光镜目视监控以确保其不会移动覆膜支架。 回缩中遇
31
Page 32

18. 保持导管鞘位置以利用其导入 Powerlink 辅助覆膜支架或其他辅助设备。 完成时进行血管造影以
检测是否存在内漏。 如果检测到内漏,可选择大小合适的球囊进行球囊血管重建术,或者可部署
Powerlink 近端延长或肢端延长(第 11.6 部分)。
表 39. 球囊推荐
球囊直径
(毫米)
20.0 4.0 12 8.0 4.0 100 0.035/0.889
22.0 4.0 12 9.0 3.0 100 0.035/0.889
25.0 4.0 12 9.0 3.0 100 0.035/0.889
28.0 4.0 12 9.0 1.5 120 0.035/0.889
30.0 4.0 14 9.0 1.5 120 0.035/0.889
33.0 4.0 16 11.0 1.5 100 0.035/0.889
* IntuiTrak 导管鞘腔规格为 19Fr 且额定总长度为 66 厘米。
球囊长度
(厘米)
推荐导管
(Fr)*
轴规格
(Fr)
额定破裂压力
(大气压)
轴可用长度
(厘米)
推荐导丝直径
(英寸/毫米)
11.6 步骤 – 延长覆膜支架的输送
1. 如果要求辅助手术,则使用标准手术技术切开介入血管。
2. 如果需要,可在切开部位远端和近端放置血管环进行止血控制。
3. 在荧光镜的指导下通过现有两肢型覆膜支架将 0.035 英寸坚硬的“J 形尖”导丝插入到脉管系统。
在跨植入部位保持导丝位置,直到手术完成。注意如不小心,则有导丝与现有覆膜支架的支架笼
缠结的可能性。
4. 现在应完成和记录血管造影术和路线图。标记适当的解剖地标并固定 C 臂。这样可使延长覆膜支
架得到准确部署。
5. 确认要求的 Powerlink 延长覆膜支架的长度和直径。 Endologix 推荐覆膜支架直径至少大于血管直
径 2 毫米。
小心:
小心:
在输送系统的插入过程中保持导丝位置。
6.
对于通过两肢型导管鞘输送的
a. 如果辅助设备在两肢型设备的相同手术中植入: 保持导管鞘位置以利用其导入辅助覆膜支架
或其他辅助设备。 完全插入扩张器,然后推进导管鞘直到导管鞘一端的不透射线标志刚好高
于所需位置。
在荧光镜下完全插入扩张器并慢慢重新推进导管鞘以确保植入的两肢型覆膜支架不会被偶然移动。
b. 必要时取出扩张器并关闭止血阀。 沿坚硬的导丝推进辅助输送导管进入导管鞘的止血阀(图
12)。
图 12. 将辅助输送系统鞘插入到导管鞘止血阀中
17Fr 或 19Fr
辅助覆膜支架
:
c. 继续推进输送系统直到其手柄锁定到导管鞘的止血阀中。 确认覆膜支架的近端是否刚好位于
目标部署部位上方。
d. 保持辅助输送系统核心组件静止,同时轻轻回缩导管鞘开始部署覆膜支架。
e. 保持核心组件静止,拉动回缩接头以部署覆膜支架的前 1-2 厘米。 在荧光镜下目测覆膜支架
位置,按需调整,然后继续轻轻回缩接头以便在适当的植入部位放置覆膜支架。 肾上近端延
长套: 要确定无覆膜部分的起点(即肾上部分),可在设备压缩于导管中时找到位于设备近
端的远端第二行连接或“黑点”。 一旦到位,则完全部署覆膜支架的其余部分(图 13)。
32
Page 33

图 13. 近端延长覆膜支架的部署
肾下近端延长设备的部署
肾上近端延长设备的部署
f. 保持回缩接头静止,同时回缩核心组件直到不透射线尖端位于导管鞘中。 拧紧辅助输送系统
的止血阀。
g. 挤压/压缩辅助输送系统手柄的远端以使其从导管鞘上解锁下来。 回缩辅助输送系统以便从
导管鞘上完全取下。 拧紧导管鞘的止血阀。
h. 如果覆膜支架扭曲或未完全展开,则进行球囊扩张或手术移除。
i. 进行血管造影以检测是否存在内漏。如果检测到内漏,可选择大小合适的球囊进行球囊血管
重建术(表 38),或者可部署 Powerlink 延长覆膜支架。也可部署延长支架以延长两肢型覆
膜支架的长度或将其正确定位。
j. 完成部署后,应完全回缩和取出导管鞘。
表 40. 球囊推荐
球囊
长度
(厘米)
球囊直径
(毫米)
12.0 4.0 9 7.0 5.0 100 0.035/0.889
14.0 4.0 9 7.0 5.0 100 0.035/0.889
16.0 4.0 9 7.0 5.0 100 0.035/0.889
20.0 4.0 12 8.0 4.0 100 0.035/0.889
22.0 4.0 12 9.0 3.0 100 0.035/0.889
25.0 4.0 12 9.0 3.0 100 0.035/0.889
28.0 4.0 12 9.0 1.5 120 0.035/0.889
30.0 4.0 14 9.0 1.5 120 0.035/0.889
33.0 4.0 16 11.0 1.5 100 0.035/0.889
* IntuiTrak 导管鞘腔规格为 19Fr 且额定总长度为 66 厘米。
7.
对于无两肢型导管鞘时输送
a) 沿坚硬的导丝推进辅助输送导管到血管内。
小心:
在荧光镜下缓慢推进导管鞘以确保植入的两肢型覆膜支架不会被偶然移动。
b) 继续轻轻推进输送系统,直到覆膜支架的近端刚好位于目标部署部位上方。
c) 保持核心组件静止,回缩外鞘以部署覆膜支架的前 1-2 厘米。 在荧光镜下目测覆膜支架位
置,按需调整,然后继续轻轻回缩接头/手柄以便在适当的植入部位放置覆膜支架。 肾上近
端延长套: 要确定无覆膜部分的起点(即肾上部分),可在设备压缩于导管中时找到位于设
备近端的远端第二行连接或“黑点”。 一旦到位,则完全部署覆膜支架的其余部分(见图
13)。
d) 保持回缩接头/手柄静止,同时回缩核心组件直到不透射线尖端位于外鞘中。 拧紧辅助输送
系统的止血阀。
注: 21Fr 辅助输送系统的外鞘可用作导入其他辅助设备的导管鞘。 要实现此用途,应完全
取出核心组件并拧紧止血阀。
e) 回缩辅助输送系统以便从血管中完全取出。
f) 如果覆膜支架扭曲或未完全展开,则进行球囊扩张或手术移除。
g) 进行血管造影以检测是否存在内漏。如果检测到内漏,可选择大小合适的球囊进行球囊血管
重建术(表 36),或者可部署 Powerlink 延长覆膜支架。也可部署延长支架以延长两肢型覆
膜支架的长度或将其正确定位。
推荐
轴
规格
(Fr)
额定破裂压力
导管
(Fr)*
17Fr、19Fr 或 21Fr
(大气压)
轴可用长度
(厘米)
辅助设备
:
推荐
导丝直径
(英寸/毫米)
33
Page 34

警告: 血管内放置不准确、固定不足和/或 POWERLINK 系统覆膜支架密封不足可导致内漏、移动或偶然阻
塞肾动脉的风险升高。 必须保持肾动脉的开放以防止/降低肾衰和后续并发症的风险。 覆膜支架的不
正确部署或移动可能要求进行手术干预。
警告: 导管的前进应在荧光镜指导下完成。 在遇到阻力时不要使用过大力量推进或回缩导管。在狭窄、血管
内血栓或钙化和/或弯曲血管区域应格外小心。
小心:
如果外鞘在插入过程中扭曲,请不要尝试部署。使用新的
8.
对于通过两肢型导管鞘的
位置以利用其导入辅助覆膜支架或其他辅助设备。
小心:
警告: 应小心确认快速输送系统手柄是否完全与导管鞘的止血阀锁死。 不完全连接可能会阻止覆膜支架的前
小心:
小心:
a) 完全插入扩张器,然后推进导管鞘直到导管鞘一端的不透射线标志刚好高于所需位置。
在荧光镜下完全插入扩张器并慢慢重新推进导管鞘以确保植入的两肢型覆膜支架不会被偶然移动。
b) 必要时取出扩张器并关闭止血阀。 沿坚硬的导丝推进辅助输送导管进入导管鞘的止血阀。
c) 继续推进输送系统直到其手柄锁定到导管鞘的止血阀中。
进和部署。
d) 推进 IntuiTrak 快速输送系统的核心组件以移动辅助覆膜支架通过导管鞘,直到不透射线尖底
部与导管鞘上的不透射线标志对齐。 确认覆膜支架的近端是否刚好位于目标部署部位上方。
如果覆膜支架不能前进,则不得继续尝试部署。用全新
鞘,并按上述第
7
步说明操作。
继续推进覆膜支架使其超过导管鞘的不透射线标志会导致过早部署。 应小心确保覆膜支架在到达正确
位置前保持在导管鞘中。
e) 保持核心组件静止,拉动回缩接头以部署覆膜支架的前 1-2 厘米。 在荧光镜下目测覆膜支架
位置,按需调整,然后继续轻轻回缩接头以便在适当的植入部位放置覆膜支架。 肾上近端延
长套: 要确定无覆膜部分的起点(即肾上部分),可在设备压缩于导管中时找到位于设备近
端的远端第二行连接或“黑点”。 一旦到位,则完全部署覆膜支架的其余部分(见图
13)。
f) 保持回缩接头静止,同时回缩核心组件直到其上的蓝带退出辅助输送系统手柄。 拧紧辅助输
送系统的止血阀。
g) 挤压/压缩辅助输送系统手柄的远端以使其从导管鞘上解锁下来。 回缩辅助输送系统以便从
导管鞘上完全取下。 拧紧导管鞘的止血阀。
h) 如果覆膜支架扭曲或未完全展开,则进行球囊扩张或手术移除。
i) 进行血管造影以检测是否存在内漏。如果检测到内漏,可选择大小合适的球囊进行球囊血管
重建术(表 36),或者可部署 Powerlink 延长覆膜支架。也可部署延长支架以延长两肢型覆
膜支架的长度或将其正确定位。
j) 完成部署后,应完全回缩和取出导管鞘。
小心:
小心:
警告: POWERLINK 系统设计为仅供单独一名患者使用。请勿重复使用或重复灭菌。重复使用、重复处理
使用后,请按照医院、管理机构和/或当地政府的规定处理产品和包装。
不能持续监控覆膜支架的部署可导致扭曲或对准问题。
在动脉瘤内操作导管、导丝和鞘时应格外小心。 较大的干扰会使血栓碎片脱离从而可导致远端栓塞。
或重复灭菌会损害装置的结构完整性和/或造成装置失效,从而可能导致患者受伤、患病或死亡。重
复使用、重复处理或重复灭菌还会产生装置污染的风险和/或造成患者感染或交叉感染,包括但不限
于传染性疾病由一名患者传播至另一名患者。装置污染会导致患者受伤、患病或死亡。
21Fr IntuiTrak
快速辅助输送
POWERLINK
: 在两肢型覆膜支架部署后,保持导管鞘
21FR
标准辅助输送系统更换整个系统/导管
系统替代。
12.0 成像指导原则和术后随访
12.1 概述
腔内植入物的长期性能尚未确立。 应告知所有患者腔内治疗要求终身定期随访,以评估其健康状况和
腔内植入物的性能。 出现具体临床结果(例如内漏、动脉瘤增大或腔内植入物结构或位置的改变)的
患者应接受额外的随访。 应告知患者在术后第一年中以及之后每年一次遵守随访计划的重要性。 应
告知患者定期和坚持接受随访是保证 AAA 腔内治疗持续安全性和效力的关键。
医师应根据个体情况评估患者,并相对于各患者的需求和情况制订随访计划。 推荐的成像计划见表
30。该计划仍然是患者随访的最低要求,即使缺乏临床症状(例如疼痛、麻木、虚弱)并应得到遵
守。 出现具体临床结果(例如内漏、动脉瘤增大或覆膜支架结构或位置的改变)的患者应更频繁地接
受随访。
34
Page 35

年度成像随访应包括腹部 X 光片以及造影和无造影 CT 检查。 如果肾并发症或其他因素导致不能使用
成像造影剂,也可使用腹部 X 光片、无造影 CT 和多普勒超声。
造影和无造影 CT 成像的组合使用能提供关于动脉瘤直径改变、内漏、开放、扭曲、渐进性疾病、固
定长度和其他形态改变的信息。
腹部 X 光片提供关于设备完整性(组件间距离和支架破裂情况)的信息。
多普勒超声成像能提供关于动脉瘤直径改变、内漏、开放、扭曲和渐进性疾病的信息。 在此情况下,
应联合超声使用无造影 CT。 与 CT 相比,超声可能是不太可靠和较为敏感的诊断方法。
表 40 列出了使用 Powerlink 系统覆膜支架的患者对于成像随访的最低要求。 要求增强随访的患者应接
受临时评估。
表 41. 腔内植入患者的推荐成像计划
血管造影
术前
术中
出院前(7 天内)或 1 个月
3 个月
6 个月
12 个月(之后每年)
1
成像应在术前 6 个月内进行。
2
多普勒超声可用于出现肾衰的患者或另外不能接受造影增强 CT 扫描的患者。 在进行超声检查时,仍推荐无造影 CT。
3
如果存在 I 或 III 型内漏,则推荐即时干预和额外的随访后干预。见第 12.6 部分“额外监控和治疗”。
4
如果在出院前或 1 个月时出现内漏,则推荐此方法。
1
X
X1
X
X
X
X
X
CT 扫描
(造影和
无造影)
2,3
X
2,3,4
2,3
X
2,3
X
12.2 造影和无造影 CT 推荐
胶片组应包括尽可能小的切片厚度( 3 毫米)的所有顺序影像。 不要采用较大切片厚度(> 3 毫米)
和/或遗漏连续 CT 影像/胶片组,因其会妨碍长时间的精确解剖结果和设备比较。
所有影像均应包括各胶片/影像的刻度。 若使用胶片,影像应在 14 x 17 英寸版面上不低于 20:1 排列。
要求无造影和造影两种方式,且手术台位置必须匹配或对应。
预造影及造影切片厚度和间隔必须相符。
在使用无造影和造影两种方式时,不要改变患者方向或重新标记患者。
无造影和造影增强基线和随访成像对实现最佳患者监控来说非常重要。 在 CT 检查中遵从可接受的成
像方案也很重要。 表 41 列出了可接受的成像方案的示例。
腹部 X 光片
表 42. 可接受的成像方案
静脉造影 否 是
可接受的设备 > 40 秒的螺旋 CT > 40 秒的螺旋 CT
注射量 不适用 150 毫升
注射速度 不适用 > 2.5 毫升/秒
注射模式 不适用 高压
推注时机 不适用 推注测试: SmartPrep、
范围 – 起点 隔膜 腹轴上 1 厘米
范围 – 终点 近端股动脉 股深动脉起点
准直 < 3 毫米 < 3 毫米
重建 全部 2.5 毫米 – 软算法 全部 2.5 毫米 – 软算法
轴 DFOV 32 厘米 32 厘米
注射后运行 无 无
12.3 腹部 X 光片
要求以下视角:
四张胶片: 仰卧正面 (AP)、水平线束侧位、以脐为中心的 30 度 LPO 和 30 度 LPO 视角。
记录台面到胶片距离,并在各后续检查中使用相同距离。
确保整个设备可在每个单影像格式上纵向捕捉。
如果对设备完整性有任何疑问(例如扭曲、支架破裂、移动),推荐使用放大视图。 出诊医师应
使用 2-4 倍放大辅助设备评估胶片上的设备完整性(包括组件在内的整个设备长度)。
12.4 超声
超声成像可在因患者因素而导致不能使用成像造影剂的情况下代替造影 CT。 超声成像可与无造影 CT
配合使用。完整的主动脉多普勒超声应进行视频录像以评估最大动脉瘤直径、内漏、支架开放和狭
窄。 视频录像中应包括以下概述信息:
造影
无造影
C.A.R.E. 或相当
35
Page 36

横向和纵向成像应从近端主动脉水平获得,显示肠系膜和肾动脉到骼动脉杈部分,以利用彩色血流和
彩色能量血管造影(如可介入)确定是否存在内漏。
应对所有可疑的内漏进行光谱分析确认。
应获得最大动脉瘤的横向和纵向成像。
12.5 MRI 安全性和兼容性
非临床测试证实 Powerlink 覆膜支架应在核磁共振环境下有条件地使用。
植入此覆膜支架的患者可在以下条件下安全地进行扫描:
1.5 和 3.0 特斯拉的静态磁场
750 高斯/厘米或以下的空间梯度磁场
正常工作模式或最大全身平均比吸收率 (SAR) 2.0W/kg 下,1.5 或 3.0 特斯拉 MR 扫描仪核磁共振
扫描 15 分钟。
MRI 相关的加热
在非临床试验中,1.5 特斯拉(1.5 特斯拉/64MHz,Magnetom,软件版本 Numaris/4,Syngo MR
2002B DHHS,Siemens Medical Solutions,Malvern,PA)和 3.0 特斯拉(3.0 特斯拉/128MHz,
Excite,软件 G3.0-052B,General Electric Healthcare,Milwaukee,WI)核磁共振系统中进行 15 分钟
MRI 成像后,Powerlink 覆膜支架的温度会出现如下增幅:
最高温度增幅
3.6 1.5 特斯拉/64MHz
2.3 3.0 特斯拉/128MHz
因此,1.5 和 3.0 特斯拉下在核磁共振系统使用传输/接受 RF 体线圈时,Powerlink 覆膜支架的 MRI
相关加热试验报告全身平均比吸收率 (SAR) 分别为 2.9 W/kg(即与热量测定值 2.1 W/kg 相关)和 3.0
W/kg(即与热量测定值 2.8 W/kg 相关),表明与这些具体条件相关的最大加热量低于或等于 3.6°C。
成像伪影
在 3.0 特斯拉核磁共振系统中使用 T1 加权自旋回波和梯度回波脉冲顺序的非临床试验中扫描时,成像
伪影一般在设备腔内外延伸出约 10-20 毫米。
核磁共振影像上出现的伪影显示为局部信号空白(即信号丢失),其大小相对于植入物的大小和形状
来说适度。 对 Powerlink 覆膜支架来说,梯度回波脉冲顺序产生的伪影比 T1 加权自旋回波更大。如
果感兴趣区域就是覆膜支架所在区域或相对接近,则核磁共振成像的质量可能会受到影响。因此,可
能有必要优化核磁共振成像参数以补偿此植入物的存在。
(°C) MRI
(1.5 和 3.0 特斯拉核磁共振系统)
条件
12.6 额外监控和治疗
对于以下情况,推荐进行额外监控和可能的治疗:
I 型内漏动脉瘤
III 型内漏动脉瘤
动脉瘤增大,最大直径增幅 5 毫米(无论是否内漏)
移动
密封长度不足
考虑再干预或转为开放修复时应包括主治医师对患者个体并发症和寿命预期的评估以及患者个人的选
择。 在放置内植入物后应告知患者可能进行后续再干预,包括使用导管和转为开放手术。
13.0 设备追踪信息
联邦法律(美国)要求所有腹主动脉瘤覆膜支架必须按照《美国联邦法规第 21 部分》第 821 节进行追踪。
该追踪包括一张在出院时交给患者的《患者植入物卡片》和一份将邮寄或传真给制造商 (Endologix, Inc.) 的
《设备追踪表》。
根据上述法规,最终销售者(定义为拥有此设备的人或机构)必须向制造商报告此信息。 医生或医院被视为
最终销售者,因此其有责任将该信息转发给制造商。请尽可能填写《设备追踪表》上的信息,并邮寄或传真
给 Endologix, Inc.。传真号码是 (800) 995-4021。有关对医疗机构要求的详细信息,请浏览美国食品和药品管
理局网站 www.fda.gov
除了这里的使用说明外,用于 AAA 的 Powerlink 系统包装内还有一张《设备追踪表》,要求医院职员填写和
转发给 Endologix, Inc.,以便追踪所有接受 Powerlink 系统覆膜支架的患者(按照美国联邦法规的要求)。
。
36
Page 37

14.0 图例
符号 描述
产品失效日期,“在失效日期前使用产品”
产品的序列号。
内含物已灭菌,除非包装已打开或损坏。由环氧乙烷灭菌。
小心,请参阅随附文档。
设备在核磁共振环境下有条件地使用。
设备仅供一次性使用。 不得重复使用或重新灭菌。
参阅使用说明
保持干燥
如果包装破损,请勿使用
远离阳光照射
商品目录编号
欧洲共同体的授权代表
制造商
15.0 退货
如果因任何原因必须退回一个未经使用的设备,请将用于 AAA 的 Powerlink 系统放入原始包装和运输箱内。
请致电 800-983-2284 或 +1 (949) 595-7200 联系客户服务部门,以获得退货授权编号 (RGA),并将设备运输到
客户服务部门指定的地址。
© 2010 版权所有。保留所有权利。
部件编号 C00237 Rev. J
37
 Loading...
Loading...