
EN - Instructions for use, pages 3 to 9
FR - Instructions d’utilisation, pages 11 à 17
DE - Bedienungsanweisungen, Seiten 19 bis 25
IT - Istruzioni per l’uso, pagine da 27 a 33
ES - Instrucciones de funcionamiento, páginas 35 a 41
SK - Návod na použitie, strany 43 až 49
PL - Instrukcja użytkowania, strony od 51 do 57
PT - Instruções de utilização, páginas 59 a 65
RO - Instrucţiuni de utilizare, paginile 67 până la 73
NL - Gebruiksinstructies, pagina’s 75 tot 81
TR - Kullanım talimatları, sayfa 83 ila 89
EL - Οδηγίες χρήσης, σελίδες 91 έως 97
RU - Инструкции по применению, стр. 99 - 105

2

CONTENTS
1. DESCRIPTION ................................................................................................................. 4
Model Name ............................................................................................................ 4
Commercial Identication ........................................................................................ 4
Device Description .................................................................................................. 4
2. PACKAGE CONTENTS .................................................................................................... 4
3. LIST OF COMPATIBLE ACCESSORIES ......................................................................... 4
4. SYMBOLS AND MEANINGS ........................................................................................... 4
5. INDICATIONS ................................................................................................................... 4
6. MEDICAL CONTRAINDICATIONS .................................................................................. 5
7. ADVERSE SIDE EFFECTS .............................................................................................. 5
8. PRECAUTIONS ................................................................................................................ 5
9. CAUTION, INTERACTION WITH CLINICAL TREATMENTS AND INVESTIGATIONS ......... 6
Caution .................................................................................................................... 6
High-Energy Electrical Field .................................................................................... 6
Electrotherapy ................................................................................................... 6
Electrosurgery ................................................................................................... 6
Electroshock Therapy and Debrillation ........................................................... 6
Medical Diathermy ................................................................................................... 6
Diagnostic Tests and Treatment with Ultrasound .................................................... 6
Radiation Therapy with Ionizing Radiation .............................................................. 6
Non-Ionizing Electromagnetic Radiation ................................................................. 6
10. INSTRUCTIONS FOR USE ............................................................................................ 7
11. EXPLANTATION ............................................................................................................ 9
12. TECHNICAL SPECIFICATIONS OF THE DIGISONIC® SP IMPLANT .......................... 9
13. PERFORMANCE CHARACTERISTICS ........................................................................ 9
14. SPECIFICATIONS AND CHARACTERISTICS OF THE ELECTRODE-ARRAY ........... 9
MRI (Magnetic Resonance Imaging) ................................................................ 6
Electrosurgery ......................................................................................................... 7
Preoperative Management ...................................................................................... 7
Intraoperative Management .................................................................................... 7
Placing the Incision and Positioning the Receiver ............................................ 7
Handling the Implant ......................................................................................... 7
Orientating the Implant ...................................................................................... 7
Attaching the Implant ........................................................................................ 8
Inserting the Electrode-Array ............................................................................ 8
Positioning the Reference Electrode ................................................................. 8
Conrming Functioning of the Implant .............................................................. 8
3

1. DEVICE DESCRIPTION
• Model Name
®
Digisonic
SP Cochlear Implant
• Commercial Identication
I-SP-SD
• Device Description
The Digisonic
to profound perceptive deafness. This transcutaneous cochlear implant functions with a behind the ear external
processor (DIGI SP/ SAPHYR
By means of electromagnetic coupling, an external antenna transmits the acoustic signal processed by the
processor to the Digisonic
Le Digisonic
®
SP is a multi-channel cochlear implant intended to rehabilitate bilateral severe (second degree)
®
SP) or with a micro-behind the ear processor with remote battery (DIGI SP’K).
®
®
SP includes an electrode-array with 20 electrodes that is inserted into the cochlea (inner ear). Each
SP implant implanted under the skin behind the auricle of the ear.
electrode stimulates a dierent set of auditory nerve bers and is associated with a frequency band of the sound
signal that is processed by the external processor. The implant and the external antenna contain a magnet; the
external antenna is thus kept in place relative to the implant by magnetic attraction. The Digisonic
not contain its own electric power source; it receives the energy necessary for functioning by electromagnetic
coupling. Consequently, when the external antenna is not correctly positioned relative to the Digisonic
®
SP does
®
SP, the
implant is passive.
2. PACKAGE CONTENTS
1 Digisonic
®
SP (I-SP-SD) implant, 1 silicone implant template, 1 attachment system, 1 wearer-ID card, and
accompanying documents.
3. LIST OF COMPATIBLE ACCESSORIES
The implant is supplied with the following accessories:
• 1 silicone implant gauge used during the surgery to verify the correct positioning of the implant under the
skin.
• 2 self-tapping screws used to x the implant in position; these do not require any pre-drilling.
4. SYMBOLS AND MEANINGS
Catalog reference
Sterilization method: ethylene oxide
Product delivered sterile
Important. Read the accompanying
documentation
Maintain humidity level between 15%
and 75%.
Single-use device, do not reuse Manufacturing date
STORAGE: store in a cool dry place.
Storage temperature between -20° C
and +50° C.
Batch code
Fragile; handle with care Use by date
Do not use if package is damaged Serial number
Do not re-sterilize Manufacturer
Waste electrical and electronic equipment
(WEEE)
5. INDICATIONS
The multi-channel Digisonic
®
SP cochlear implant is designed to rehabilitate patients who have 2nd degree
Instructions for use
severe to total bilateral hearing loss with a speech intelligibility level of less than 50% at 60 dB HL in open-set
format with the use of a hearing aid (professional medical opinion required).
4

6. MEDICAL CONTRAINDICATIONS
The Digisonic
®
SP cochlear implant is not indicated in patients with perceptive hearing loss accompanied by
signicant lesions of the cochlea (major cochlear malformation, fracture of the petrous part of the temporal bone,
signicant ossication in the cochlea), auditory nerve (axonal neuropathy, tumor near or on the auditory nerve
such as a neurinoma, complete destruction of both auditory nerves), a severe anomaly of the auditory pathways,
acute or chronic middle ear conditions (including tympanic membrane perforation), is psychologically unstable
or has a contact allergy to implant materials (silicone, platinum iridium, titanium). Other types of implants may
be recommended.
7. ADVERSE SIDE EFFECTS
For patients who meet the indications, implantation has typical risks associated with surgery (eects from
general anesthesia, infections, etc.) which is independent of the product itself. However, there is also a risk
that the patient’s body may reject the implant or a part of the implant; this risk has been reduced by using
biocompatible materials in the design.
Complications associated with the cochlear implant operating technique (temporary or permanent facial
paralysis, risk of meningeal irritation syndrome, changes in taste, dizziness, tinnitus, etc.) are rare, but should
be considered carefully. It is important to inform every cochlear implant candidate about these potential risks.
Specic information should be given to the patient regarding the symptoms and the initial signs of meningeal
irritation syndrome. According to current recommendations, pneumococcal vaccination is also strongly
recommended.
Once the implant is in place, there remain certain risks that may result in explantation. Explantation requires
another surgical intervention under general anesthesia. Explantation may occur in the following cases:
- Medical complication
- Implant malfunction
- Displacement of the device as a result of trauma
- Extrusion of the implant
These potential problems were evaluated during product design and the materials and design of the implant
have been chosen to minimize these risks.
Finally, the long-term eects from trauma associated with the insertion of electrodes and chronic electrical
stimulation are unknown at the present time. These eects may include cochlear ossication or degeneration
of the nerve bers, and may require replacement of the implant or lead to a reduced response to stimulation.
8. PRECAUTIONS
Information to give the Patient
- Inform the patient of the benets of a cochlear implant, and also the adverse side eects which could occur
(see §7).
- The supplied identication card must be fully completed and given to the wearer.
- Inform the patient that they must present the identication card prior to any medical examination or treatment.
- Advise the patient to carefully read the user instructions supplied with his/her external processor, in particular
the section relating to the warnings for use.
- Tell the patient to contact the implantation center In case of failure or malfunction of the cochlear implant
system.
- Contact sports (rugby, boxing, etc.) are strongly discouraged, since strong impacts to the area of the implant
can damage it.
5

- Scuba diving: Recreational scuba diving is not recommended at depths below 20m. Excess pressure can
damage the implant. Moreover, engaging in professional deep-sea diving activities is strongly discouraged,
since the implant is not guaranteed against repeated high pressure stresses.
- Access to restricted areas: Please consult a physician before entering restricted access areas (MRI exam
room, walk-through metal detectors, 3D scanning booths, etc.).
9. CAUTION, INTERACTION WITH CLINICAL TREATMENTS AND INVESTIGATIONS
- Caution: Implantable device parts should not be reused if they have been previously implanted in another
patient.
- High-energy electrical eld:
- Electrotherapy: Electrotherapy may send currents of varying strengths. The use of high-voltage electric-
current electrotherapy techniques is prohibited due to the risk of damage to the implant system. However,
low-voltage electrotherapy may be considered only if the electrodes are not placed in areas of the head or
neck.
- Electrosurgery: Avoid the use of monopolar electrosurgical instruments. These instruments can create
radio-frequency elds with electrical voltages that could create coupling between the tip of the instrument
and the electrode-array. Induced currents could damage the cochlear tissue or produce permanent damage
to the implant. As soon as a cochlear implant is removed from its packaging in the operating room, any
monopolar scalpel should be turned o to avoid any damage to the implant. However, bipolar electric
scalpels may be used as long as it is not near or in direct contact with the cochlear implant.
- Electroshock therapy and debrillation: Sending several thousand volt electrical shocks through the body
is not advised in a patient wearing a cochlear implant. Electrical shocks can cause tissue damage in the
cochlea or permanently damage the implant.
In a life-threatening situation, only the medical team is in a position to make a decision. If the situation is not
life-threatening for the patient, please contact Neurelec.
- Medical diathermy: Electromagnetic diathermy cannot be used on patients with implants containing metal.
This may cause irreversible damage to tissue (burning of the cochlea) or the implant. However, ultrasonic
diathermy may be considered on areas of the body that do not touch the head or neck.
- Diagnostic tests and treatment with ultrasound: The implant should not be exposed to therapeutic levels of
ultrasonic energy. The device may inadvertently concentrate the ultrasound and be damaged.
- Radiation therapy with ionizing radiation: During radiation therapy sessions, we strongly advise against
direct irradiation of the implant area. Direct, massive exposure of the implant to radiation could lead to partial or
total loss of implant functions. This damage is not necessarily immediately noticeable.
- Non-ionizing electromagnetic radiation:
- MRI (Magnetic Resonance Imaging): The Digisonic
®
SP implant contains a permanent magnet. An
MRI exam or the application of an intense magnetic eld in the area of the implant could lead to damage
totheimplant and/or the patient. It is however possible to perform an MRI exam at 1.5 Tesla by following
therecommendations. In this case, the radiologist should ll out an exam form available from the website
www.neurelec.com.
Refer to the processor’s user manual for more information.
6

10. INSTRUCTIONS FOR USE
Please note!
Electrosurgery: Once the implant is put into place, the rest of the surgical procedure should not include the
use of any monopolar electrosurgical instruments. These instruments can create radio-frequency elds with
electrical voltages that could damage the implant. Bipolar electric scalpels can be used as long as they are
not used near or in contact with the cochlear implant.
Preoperative management
- Before performing the rst Digisonic
technical specications of the Digisonic
®
SP implantation, the operator should become familiar with the particular
®
SP cochlear implant and the associated surgical technique.
- Before implantation, patients should be informed of the benets of a cochlear implant and its possible
secondary risks (see §7).
Intraoperative management
- Placing the incision and positioning the receiver: Before making the incision for the skin ap, determining
the optimal site of the implanted system is recommended. In doing so, the location of the incision should account
for the fact that the implant should not be placed below the auricle but at a large enough distance for the patient
to wear the processor behind the ear without conicting with the position of external antenna. In addition, the
incision line should be far enough away from the implant to prevent the risk of postoperative extrusion or infection.
Using a sterile skin pencil to draw the retroauricular incision line oset about 1cm from the retroauricular crease
and the receiver’s position about 2 cm away from the auricle of the ear is therefore recommended. These
locations can be determined by using the implant template and the processor template (supplied separately
upon request) placed in position over the ear.
After making the incision, use the implant template to prepare the location necessary for the proper positioning
of the receiver. The surface of the bone should be checked to make sure it is at enough to subsequently attach
the receiver in place easily with screws.
- Handling the implant: Remove the implant from the sales packaging only after completing the standard
surgical procedures up to starting the cochleostomy. Open the outer packaging making sure the implant is not
damaged. After carefully cutting the suture threads holding the implant in place, gently remove the implant from
its sterile holder. Avoid touching and/or bending the electrode array. Do not use sharp surgical instruments that
could damage the electrode-array.
®
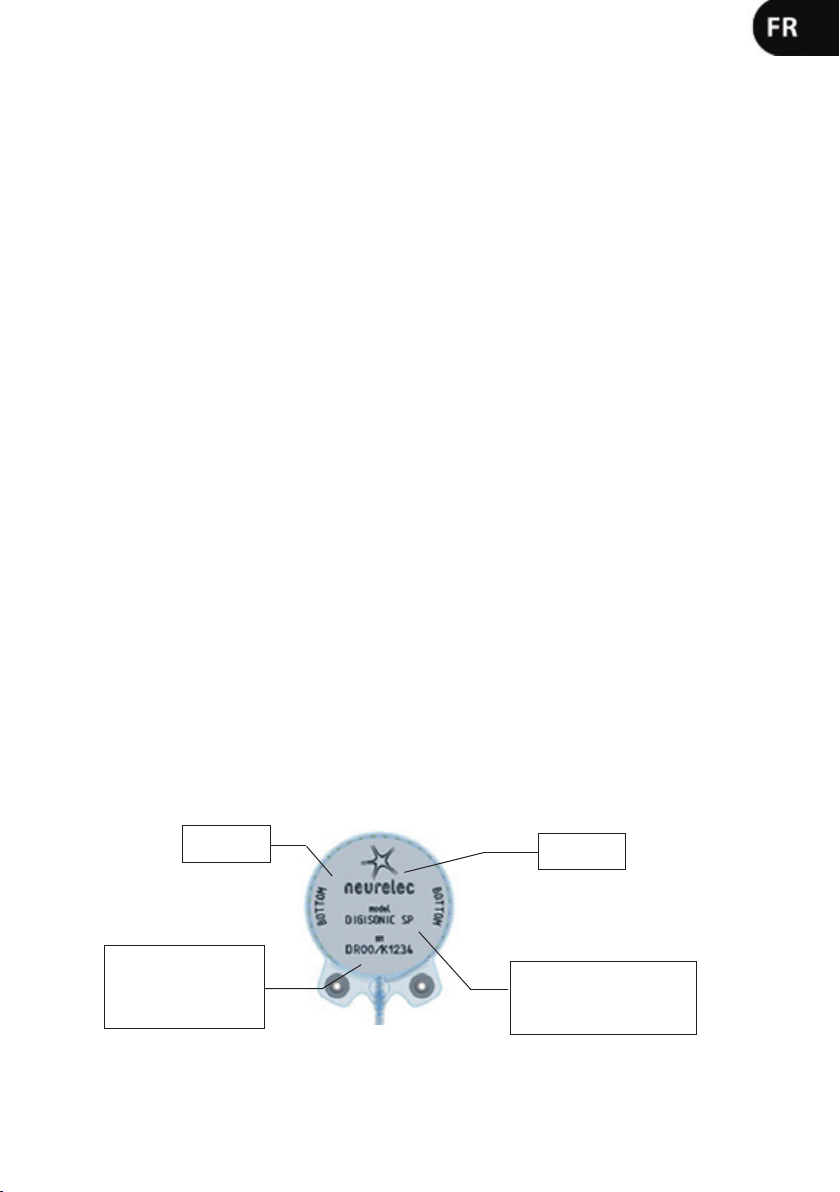
- Orientating the implant: The engraved surface of the Digisonic
SP implant (NEURELEC, BOTTOM) should
not be visible in conguration for use and should therefore be turned toward the skull. This titanium metal-plate
contains, as follows, important information with which to identify the implant:
Information
bone-side
surface
Serial number (SN):
DR: Digisonic Receiver
00: year of manufacture
K : SP version
1234: incremental number
Manufacturer
name
Implant type (model): The
Digisonic® SP implant
is identied by the
DIGISONIC® SP inscription
7

- Attaching the implant: No milling of the bone is needed for the implant bed. Simply slide the receiver under
the temporal muscle into the location prepared using the silicone template. Conrm that the implant is positioned
properly and cannot rock with application of nger pressure. Only access to the implant’s mounting tabs is
required for attaching the system. The implanted receiver has to be stabilized
to prevent any possible displacement, which could create tension and lead to
possible damage to the electrode wires. It is therefore recommended to secure
it in place with the two self-tapping screws provided in the packaging, and prepositioned in the implant holder. Follow the steps below to remove the screws from
the holder:
• Insert the screwdriver (provided with the initial surgical kit) into the screw
using rm axial pressure.
• Unscrew the screw while slowly withdrawing it from the holder.
• The screw is now attached to the screwdriver and can be used.
Gently position the rst screw into one of the xation system’s titanium inserts. It is recommended to hold the
screwdriver vertical to the implant’s axis to make attachment easier. Tighten the screw until feeling resistance,
then progressively free the screwdriver by applying a slight circular motion to it. Check that it is secure, then
repeat the same procedure for the second screw.
Note: Neither the surgeon nor any person not authorized by Neurelec may make changes to the implant (such
as to the xation system).
- Inserting the electrode-array: Orient the electrode-array so as to insert following the cochlear spiral. Guide
the end of the electrode-array towards the base of the scala tympani using the insertion claw or small forceps,
then progressively insert the electrode-array forcing as little as possible. Finish the insertion by pressing down
on the silicone extracochlear push rings. Once insertion is complete, the rings should block the cochleostomy.
The electrode array may be attached to prevent the risk of migration. The attachment method and attachment
points will depend on the surgical access and the surgeon’s preferences.
- Positioning the reference electrode: Place the extracochlear reference ball electrode against the bone under
the temporal muscle.
- Conrming functioning of the implant: Impedance measurements, before or after closing the incision, can
conrm the proper functioning of the implanted device.
11. EXPLANTATION
If malfunction of the Digisonic
®
SP implant is suspected, an expert review of the system must be done with
the help of Neurelec clinical support. If malfunction of the implant is conrmed and the medical team decides
to explant, it is important to contact Neurelec, who will inform you of the explantation procedure to follow. It is
especially important to request an explantation kit from Neurelec so that the explanted system may be sent back,
and thus the expert review of the device may be performed.
8
12. TECHNICAL SPECIFICATIONS OF THE DIGISONIC® SP IMPLANT
Primary function Cochlear implant
Stimulation mode Balanced biphasic stimulation
Stimulation rate 24,000 pps maximum (pps: pulses per second)
- Impedance measurement
- Measurement of the implant’s power
Other available functions
- Integrity test*
- EABR (Evoked Auditory Brainstem Response)*
- Stapedius reex
Psychoacoustic tests (gap test, etc.)*
* With associated equipment
Weight 10.5 g
Dimensions
Diameter 30.2 mm – Thickness: ranging from
4.9 (edge) to 5.75 mm (center)
Volume 4 cm3
- LSR 40 shore A silicone
- Silicone HCR 35 shore A and HCR 50 shore A
Material in direct contact with human tissue
- Silicone adhesive
- Platinum iridium 10%
- Titanium grade 2
- Titanium grade 5
13. PERFORMANCE CHARACTERISTICS
Characteristics of the output signal
(on resistance of 1 kΩ)
Max 2V -255µs
V: 0 to 4V
I: 10 µA to 2 mA
Δt: 10 µs to 255 µs
Impedance measurement Yes: Normal values: 500Ω – 5kΩ
MRI safety level
Recommended methods for determining the proper
functioning of the system
Compatible with 1.5 Tesla. Refer to the
recommendations
Yes. Impedance measurement and integrity test
(with collection equipment)
14. SPECIFICATIONS AND CHARACTERISTICS OF THE ELECTRODE-ARRAY
Monopolar electrical congurations Common ground
Number of independent active electrodes 20
Reduced cochleostomy size 1 mm diameter
General shape Straight with shape memory
Shape at apex Soft tip
Shape at the base Two 1.5 mm diameter push rings
Constituent materials
- Connecting wire: Platinum iridium 10%
- Stimulation electrodes: Platinum iridium 10%
Insulation PEI (polyesterimide)
- Length: 26mm
- Diameter at the base and at the apex: 1.07 mm and
0.5 mm
Dimensions
- Minimum and maximum surface area of the
stimulation electrodes: 0.39 mm² and 0.77 mm²
- Distance between electrodes: 0.7 mm
- Maximum distance between proximal and distal
electrodes: 22.3 mm
- In case of doubt about the specied performance, please contact Neurelec customer service for your safety.
- Should you have any comments or if the information provided is incomplete, please contact your manufacturer
or your local distributor.
Digisonic
®
SP is a registered trademark of Neurelec-France
9

10

SOMMAIRE
1. DESCRIPTION 4
Désignation du modèle 4
Identication commerciale 4
Descriptif du dispositif 4
2. CONTENU DE L’EMBALLAGE 4
3. LISTE DES ACCESSOIRES COMPATIBLES 4
4. SYMBOLES ET SIGNIFICATIONS 4
5. INDICATIONS 4
6. CONTRE-INDICATIONS MEDICALES 5
7. EFFETS SECONDAIRES INDESIRABLES 5
8. PRECAUTIONS D’UTILISATION 5
9. MISE EN GARDE, INTERACTION AVEC LES THERAPIES ET INVESTIGATIONS
CLINIQUES 6
Mise en garde 6
Champ électrique de haute énergie 6
Electrothérapie 6
Electrochirurgie 6
Electrochocs, débrilation 6
Diathermie médicale 6
Diagnostic et traitement aux ultrasons 6
Rayonnements ionisants thérapeutiques (Radiothérapie) 6
Rayonnements électromanétiques non ionisants 6
10. MODE D’EMPLOI 7
11. EXPLANTATION 9
12. SPECIFICATIONS TECHNIQUES DE L’IMPLANT DIGISONIC® SP 9
13. CARACTERISTIQUES DE PERFORMANCES 9
14. SPECIFICATIONS ET CARACTERISTIQUES DU RESEAU D’ELECTRODES 9
IRM (Imagerie par Résonnance Magnétique) 6
Electro-chirurgie 7
Pré-opératoires 7
Per-opératoires 7
Repérage de l’incision et de la position du récepteur 7
Manipulation de l’implant 7
Orientation de l’implant 7
Fixation de l’implant 8
Insertion du porte-électrodes 8
Positionnement de l’électrode de référence 8
Vérication du fonctionnement de l’implant 8
11
1. DESCRIPTION DU DISPOSITIF
• Désignation du modèle
Implant cochléaire Digisonic
®
SP
• Identication commerciale
I-SP-SD
• Descriptif du dispositif
Le Digisonic
bilatérales sévères (2ème degré) à profondes. Cet implant cochléaire, de type transcutané, fonctionne avec un
processeur externe de type contour d’oreille (DIGI SP/ SAPHYR
batterie déportée (DIGI SP’K). Une antenne externe transmet par couplage électromagnétique le signal acoustique traité par le processeur, à l’implant Digisonic
Le Digisonic
®
SP est un implant cochléaire multicanaux destiné à la réhabilitation des surdités de perception
®
SP) ou de type micro-contour d’oreille avec
®
®
SP comprend un porte-électrodes de 20 électrodes qui est inséré dans la cochlée (oreille interne).
SP implanté sous la peau derrière le pavillon de l’oreille.
Chaque électrode stimule diérents contingents de bres nerveuses auditives et est associée à une bande
de fréquences du signal sonore traité par le processeur externe. L’implant et l’antenne externe contiennent un
aimant, l’antenne externe est ainsi maintenue en regard de l’implant par attraction magnétique. Le Digisonic
SP ne contient pas d’alimentation électrique propre, il reçoit l’énergie nécessaire à son fonctionnement par
couplage électromagnétique. Ainsi lorsque l’antenne externe n’est pas positionnée en regard du Digisonic
®
SP,
l’implant est passif.
2. CONTENU DE L’EMBALLAGE
1 implant Digisonic
®
SP (I-SP-SD), 1 gabarit d’implant en silicone, 1 système de xation, 1 carte de porteur,
lesdocuments d’accompagnement.
3. LISTE DES ACCESSOIRES COMPATIBLES
L’implant est fourni avec les accessoires suivants :
• 1 gabarit d’implant en silicone utilisé pendant la chirurgie pour vérier le bon positionnement de l’implant
sous la peau.
• 2 vis auto-taraudeuses utilisées pour la xation de l’implant en position ; elles ne nécessitent pas de perçage
préalable.
4. SYMBOLES ET SIGNIFICATIONS
Référence catalogue
Méthode de stérilisation : oxyde d’éthylène
Produit livré stérile
Attention. Il est nécessaire de consulter
les documents d’accompagnement
Limitation d’humidité comprise entre
15% et 75%.
Dispositif à usage unique, ne pas réutiliser Date de fabrication
Condition de STOCKAGE : stocker dans
un endroit sec et frais Température de
stockage de -20° C à +50° C.
Code de lot
®
Fragile ; manipuler avec soin Date limite d’utilisation
Ne pas utiliser si l’emballage est
endommagé
Numéro de série
Ne pas re-stériliser Fabricant
Déchets d’équipement d’appareils
électriques et électroniques (DEEE)
5. INDICATIONS
L’implant cochléaire multicanaux Digisonic
®
SP est destiné à la réhabilitation des surdités sévères de 2eme
Instructions de fonctionnement
degré à totales bilatérales avec une intelligibilité inférieure à 50% à 60dBHL en champ libre avec prothèses
auditives (avis médical indispensable).
12

6. CONTRE-INDICATIONS MEDICALES
L’implant cochléaire Digisonic
®
SP n’est pas indiqué pour les personnes sourant de surdité de perception
accompagnée d’importantes lésions de la cochlée (malformation cochléaire majeure, fracture du rocher,
ossication importante dans la cochlée), du nerf auditif (neuropathie axonale, tumeur à proximité ou sur le
nerf auditif comme les neurinomes, destruction complète des deux nerfs auditifs), d’une atteinte sévère des
voies auditives, de maladies de l’oreille moyenne aigües ou chroniques (incluant la perforation de la membrane
tympanique), d’une condition psychologique fragile ou d’une allergie au contact des matériaux de l’implant
(silicone, platine iridium, titane). D’autres types d’implants pourront être proposés.
7. EFFETS SECONDAIRES INDÉSIRABLES
Pour les patients répondant aux indications, l’implantation présente tout d’abord les risques classiques liés à
l’opération chirurgicale (suites de l’anesthésie générale, infections…) pour lesquels le produit en lui-même n’est
pas responsable. Il existe cependant un risque de rejet de l’implant ou d’une partie de l’implant par l’organisme
du patient : ce risque a été diminué en proposant des matériaux biocompatibles lors de la conception.
Les risques de complications associés à la technique opératoire de l’implant cochléaire (paralysie faciale
transitoire ou dénitive, risque méningé, modication du goût, vertiges, acouphènes, etc.) sont rares mais
doivent cependant être considérés avec attention. Il est donc important d’informer tout candidat à l’implantation
cochléaire sur ces risques potentiels. Une information particulière doit être formulée au patient concernant
les symptômes et premiers signes de méningite. Selon les recommandations en vigueur, la vaccination
antipneumococcique est par ailleurs vivement recommandée.
Une fois l’implant posé, il demeure des risques pouvant entraîner une explantation, avec pour conséquence un
nouvel acte chirurgical avec anesthésie générale. L’explantation peut avoir lieu dans plusieurs cas :
- Complication médicale
- Dysfonctionnement de l’implant
- Déplacement du dispositif après un choc traumatique
- Extrusion de l’implant
Ces cas ont été évalués au cours de la conception du produit. Aussi, des choix technologiques ont orienté sa
conception dans le but de les limiter.
Enn, les eets à long terme résultant des traumatismes liés à l’insertion des électrodes et à la stimulation
électrique chronique sont inconnus à ce jour. Ces eets pourraient être une ossication cochléaire ou une
dégénérescence des bres nerveuses, et pourraient avoir pour conséquence le remplacement de l’implant, ou
une dégradation de la réponse à la stimulation.
8. PRÉCAUTIONS D’UTILISATION
Informations à donner au Patient :
- L’informer des bénéces de l’implant cochléaire, et de ses eets secondaires indésirables éventuels (cf §7).
- La carte de porteur, qui lui est remise, doit être dûment complétée.
- Lui indiquer qu’il est impératif de présenter la carte-porteur pour tout examen ou traitement médical.
- Lui recommander de lire attentivement la notice d’utilisation remise avec son processeur externe et notamment
le paragraphe concernant les précautions d’emploi.
- En cas de défaillance ou de modication du fonctionnement du système d’implant cochléaire, lui indiquer de
contacter son centre d’implantation.
- Les sports de contact (ex : rugby, boxe...) devront être vivement déconseillés, un choc violent dans la région
de l’implant pourrait l’endommager.
13

- Plongée sous-marine : La pratique occasionnelle de la plongée autonome n’est pas conseillée en dessous
de 20m de profondeur. En eet, une surpression pourrait endommager l’implant. D’autre part, il est fortement
déconseillé de pratiquer une activité professionnelle de plongée sous-marine ; l’implant n’étant pas garanti pour
des sollicitations répétées de surpression.
- Accès aux zones protégées : Prendre l’avis du médecin avant de pénétrer dans des zones d’accès protégées
(salle d’examen IRM, portique de détection, cabine de scanner 3D…).
9. MISES EN GARDE, INTERACTION AVEC LES THÉRAPIES ET INVESTIGATIONS CLINIQUES
- Mise en garde : Les parties implantables du dispositif ne doivent pas être réutilisées si celles-ci ont été
préalablement implantées chez un autre patient.
- Champ électrique de haute énergie :
- Electrothérapie : L’électrothérapie peut envoyer des courants plus ou moins forts. Le recours aux techniques
d’électrothérapie à courants électriques de haut voltage est interdit pour risque de dommages sur le système
d’implant. Cependant, l’électrothérapie à faible voltage peut être envisagée à la seule condition que les
électrodes ne soient pas posées sur les zones de la tête et du cou.
- Electrochirurgie : Eviter l’utilisation d’instruments électro-chirurgicaux monopolaires. Ces instruments
peuvent produire des champs radio-fréquence avec des tensions électriques susceptibles de créer un
couplage entre l’extrémité de l’instrument et le porte-électrodes. Des courants induits pourraient endommager
les tissus cochléaires ou générer des dégâts permanents à l’implant. Ainsi, au bloc opératoire, dès qu’un
implant cochléaire est sorti de son emballage, tout bistouri monopolaire se doit d’être éteint pour éviter tout
dommage à l’implant. Cependant, l’emploi de bistouris électriques bipolaires est autorisé tant qu’il n’est
pas au voisinage ou en contact direct avec l’implant cochléaire.
- Electrochocs, débrillation : L’envoi de chocs électriques de plusieurs milliers de volts parcourant le
corps est déconseillé sur un patient porteur d’implant cochléaire. Les électrochocs peuvent causer des
dégâts tissulaires dans la cochlée ou générer des dommages permanents à l’implant.
Dans le cas où une situation est vitale, seule l’équipe médicale est en mesure de prendre une décision. Dans
le cas où la situation n’est pas vitale pour le patient, merci de prendre contact avec Neurelec
- Diathermie médicale : Il est interdit d’utiliser la diathermie par rayons électromagnétiques sur un patient
porteur d’éléments implantés contenant du métal. Celle-ci peut causer des dommages irréversibles sur les
tissus (brûlure de la cochlée) et sur l’implant. Cependant, la diathermie par ultrasons peut être envisagée sur
les zones corporelles ne touchant pas celles de la tête et du cou.
- Diagnostic et traitement aux ultrasons : L’implant ne doit pas être exposé à des niveaux thérapeutiques
d’énergie ultrasonique. En eet, le dispositif peut par inadvertance concentrer le champ ultrasonique et subir
des dommages.
- Rayonnements ionisants thérapeutiques (radiothérapie) : Lors des séances de radiothérapie, il est
fortement déconseillé d’irradier directement la zone de l’implant. Une exposition massive et directe de l’implant
aux rayons pourrait entraîner une perte partielle, voire totale, des fonctionnalités de l’implant. Les dommages ne
sont pas forcément manifestes.
- Rayonnements électromagnétiques non ionisants :
- IRM (Imagerie par Résonance Magnétique) : L’implant Digisonic
®
SP contient un aimant permanent. Un
examen IRM ou l’application d’un champ magnétique intense au voisinage de l’implant pourrait occasionner
des dommages à l’implant et/ou au patient. Il est cependant possible d’eectuer un examen IRM à 1,5
Tesla en respectant les recommandations. Dans ce cas, le radiologue doit remplir un formulaire d’examen
disponible sur le site www.neurelec.com.
Se référer au manuel utilisateur du processeur pour obtenir des informations complémentaires.
14
10. MODE D’EMPLOI
Attention !
Electrochirurgie : Dès la mise en place de l’implant, la suite du geste chirurgical ne doit plus s’eectuer à
l’aide d’instruments électro-chirurgicaux monopolaires. Ces instruments peuvent produire des champs radio-
fréquence avec des tensions électriques susceptibles d’endommager l’implant. L’emploi du bistouri électrique
bipolaire est autorisé tant qu’il n’est pas au voisinage ou en contact direct avec l’implant cochléaire.
Pré-opératoires
- Avant d’eectuer sa première implantation de Digisonic
techniques particulières de l’implant cochléaire Digisonic
®
SP, l’opérateur doit s’informer des spécications
®
SP et de la technique chirurgicale associée.
- Avant l’implantation, les patients doivent être informés des bénéces de l’implant cochléaire et de ses risques
éventuels secondaires (voir §7).
Per-opératoires
- Repérage de l’incision et de la position du récepteur : Avant de procéder à l’incision du lambeau cutané, il
est conseillé de repérer la position du système implanté. Ainsi, la détermination de l’incision doit considérer le
fait que l’implant ne doit pas être positionné sous le pavillon mais à une distance susamment importante pour
permettre au patient de porter le processeur contour d’oreille sans conit avec la position de l’antenne externe.
D’autre part, la ligne d’incision doit être située à une distance susante de l’implant an d’éviter tout risque
d’extrusion ou d’infection post-opératoire. Il est donc conseillé de marquer avec un crayon dermographique stérile
la ligne d’incision rétro-auriculaire décalée d’environ un centimètre du sillon rétro-auriclaire, ainsi que la position
du récepteur à environ 2cm du pavillon de l’oreille, dont la localisation est déterminée grâce à l’emploi du gabarit
d’implant et du gabarit de processeur (fourni séparément sur demande) à placer en position sur l’oreille.
Lorsque l’incision est réalisée, utiliser le gabarit d’implant pour préparer l’emplacement nécessaire au bon
positionnement du récepteur. Il est recommandé de vérier que la surface osseuse est susamment plane pour
faciliter la xation ultérieure du récepteur à l’aide des vis.
- Manipulation de l’implant : Retirer l’implant de la boite commerciale uniquement après avoir réalisé les étapes
chirurgicales classiques jusqu’à l’abord de la cochléostomie. Ouvrir alors l’emballage externe en s’assurant que
l’implant n’est pas endommagé. Retirer ensuite délicatement l’implant de son support stérile après avoir coupé
avec précaution les ls de suture de maintien. Eviter de toucher et/ou de plier le porte-électrodes, et ne pas
utiliser d’instruments chirurgicaux coupants qui pourraient endommager le porte-électrodes.
®
- Orientation de l’implant : La face gravée de l’implant Digisonic
SP (NEURELEC, BOTTOM) ne doit pas
être visible en conguration d’utilisation et donc orientée du côté du crâne. Cette plaque métallique en titane
comporte certaines informations importantes permettant l’identication de l’implant qui sont détaillées ci-après :
Indication
face côté os
Numéro de série (sn) :
DR : Digisonic Receiver
00 : année de fabrication
K : version SP
1234 : n° incrémental
Nom
du fabricant
Type d’implant (model) :
L’implant Digisonic® SP est
identié par l’inscription
DIGISONIC® SP
15

- Fixation de l’implant : Aucun fraisage osseux pour le lit d’implant n’étant nécessaire, il sut de faire glisser le
récepteur sous le muscle temporal, dans l’emplacement préparé à l’aide du gabarit en silicone. S’assurer que
l'implant est bien placé et ne peut basculer sous la pression des doigts. Seul l’accès aux ailettes de l’implant est
nécessaire pour permettre la xation du système. Le récepteur implanté doit être
impérativement stabilisé an d’éviter des déplacements éventuels pouvant créer
des tensions et engendrer un dommage potentiel au niveau des ls d’électrodes. Il
est donc recommandé de le maintenir en place par les deux vis auto-taraudantes
fournies dans le packaging, pré-positionnées sur le support de l’implant. Pour
retirer les vis de leur support respectez-la procédure suivante:
• Introduire le tournevis dans la vis en exerçant une ferme pression axiale.
• Dévisser la vis en retirant lentement la vis du support.
• La vis est maintenant xée sur le tournevis et peut être utilisée.
Venir délicatement positionner la première vis dans l’un des inserts en titane du système de xation. Il est
recommandé de maintenir le tournevis en position verticale en rapport avec l’axe de l’implant pour faciliter
la xation. Visser jusqu’à ressentir un blocage, puis dégager progressivement le tournevis en appliquant un
petit mouvement circulaire sur celui-ci. Vérier la bonne tenue puis recommencer la même procédure avec la
deuxième vis.
Attention : Aucune modication ne peut être apportée sur l’implant (ex : système de xation) par le chirurgien ou
toute autre personne non habilitée par Neurelec.
- Insertion du porte-électrodes : Orienter le porte-électrodes de façon à procéder à une insertion qui suive
la spirale cochléaire. Guider l’extrémité du porte-électrodes vers le fond de la rampe tympanique à l’aide de la
fourchette d’insertion ou d’une ne pince puis insérer progressivement le porte-électrodes en forçant le moins
possible. Finaliser l’insertion en prenant appui sur les anneaux de poussée extra-cochléaires en silicone. A la
n de l’insertion, les anneaux doivent obstruer la cochléostomie. Le porte-électrodes peut être xé an d’éviter
tout risque de migration. La méthode utilisée ainsi que les points de xation dépendent de l’accès chirurgical et
des préférences du chirurgien.
- Positionnement de l’électrode de référence : Placer l’électrode de référence boule extra-cochléaire contre
l’os sous le muscle temporal.
- Vérication du fonctionnement de l’implant : La réalisation de mesures d’impédances, avant ou après la
fermeture de l’incision, permet de s’assurer du bon fonctionnement du dispositif implanté.
11. EXPLANTATION
En cas de suspicion de dysfonctionnement de l’implant Digisonic
®
SP, il est nécessaire de mener une expertise
du système avec la collaboration du référent clinique Neurelec. Dans le cas où le dysfonctionnement de l’implant
serait conrmé et que la décision de l’équipe médicale amène au choix d’une désimplantation, il est important
de contacter Neurelec qui vous informera de la procédure d’explantation à suivre. Notamment, il est nécessaire
de demander auprès de Neurelec le kit d’explantation qui permettra de réacheminer le système désimplanté et
ainsi mener l’expertise du dispositif
16
12. SPÉCIFICATIONS TECHNIQUES DE L’IMPLANT DIGISONIC® SP
Fonction principale Implant cochléaire
Mode de stimulation Stimulation biphasique équilibrée
Vitesse de stimulation 24000 pps maximum (pps : pulsation par seconde)
- Mesure d’impédance
- Mesure d’alimentation de l’implant
Autres fonctions disponibles
- Test d’intégrité*
- PEA (Potentiels Evoqués Auditifs)*
- Réexe stapédien
Tests psycho-acoustiques (gap test, etc.)*
* avec équipements associés
Masse 10.5 g
Dimensions
Diamètre 30.2mm – Epaisseur : de 4.9mm (bord)
à 5.75mm (centre)
Volume 4 cm3
- Silicone LSR 40 shore A
- Silicone HCR 35 shore A et HCR 50 shore A
Matériaux en contact direct avec les tissus humains
- Silicone adhésif
- Platine iridium 10%
- Titane grade 2
- Titane grade 5
13. CARACTÉRISTIQUES DE PERFORMANCES
Caractéristiques du signal de sortie
(sur résistance de 1 kΩ)
Max 2V -255µs
U : 0 à 4V
I : 10 µA à 2 mA
Δt : 10 µs à 255 µs
Mesure d’impédance Oui : Valeurs usuelles : 500Ω – 5kΩ
Niveau de sécurité IRM
Méthodes recommandées pour déterminer
le bon fonctionnement du système
Compatible 1.5 Tesla. Se référer aux
recommandations
Oui. Mesure d’impédance, et test d’intégrité
(avec équipement de recueil)
14. SPÉCIFICATIONS ET CARACTÉRISTIQUES DU RÉSEAU D’ÉLECTRODES
Congurations électriques monopolaires Common ground
Nombre d’électrodes actives indépendantes 20
Cochléostomie réduite Diamètre 1mm
Forme générale Droit avec mémoire de forme
Forme à l’apex Extrémité anée
Forme à la base 2 anneaux de poussée de diamètre 1.5mm
Matériaux constituant
- Fil de liaison : Platine iridium 10%
- Electrodes de stimulation : Platine iridium 10%
Isolant PEI (polyester imide)
- Longueur : 26mm
- Diamètre à la base et à l’apex : 1.07mm et 0.5mm
Dimensions
- Surface min. et max. des électrodes de stimulation :
0.39mm² et 0,77 mm²
- Distance entre chaque électrode : 0.7mm
- Distance maxi entre électrode proximale et distale :
22.3mm
- En cas de doute sur les performances indiquées, pour votre sécurité, veuillez contacter le Service Client de
Neurelec.
- Pour toute remarque ou si vous constatez que les informations fournies restent incomplètes, merci de contacter
votre fabriquant ou votre distributeur local.
Digisonic
®
SP est une marque déposée de Neurelec-France
17

18

INHALTSVERZEICHNIS
1. BESCHREIBUNG ............................................................................................................. 20
Name des Modells ................................................................................................... 20
Handelsbezeichnung .............................................................................................. 20
Gerätebeschreibung ............................................................................................... 20
2. PACKUNGSINHALT ......................................................................................................... 20
3. LISTE KOMPATIBLER ZUBEHÖRTEILE ........................................................................ 20
4. SYMBOLE UND DEREN BEDEUTUNG .......................................................................... 20
5. INDIKATIONEN ................................................................................................................ 20
6. MEDIZINISCHE GEGENANZEIGEN ............................................................................... 21
7. NACHTEILIGE NEBENWIRKUNGEN ............................................................................. 21
8. VORSICHTSMASSNAHMEN ........................................................................................... 21
9. ACHTUNG: WECHSELWIRKUNG MIT KLINISCHEN BEHANDLUNGEN UND
UNTERSUCHUNGEN ...................................................................................................... 22
Achtung ................................................................................................................... 22
Starkes elektrisches Feld ......................................................................................... 22
Elektrotherapie .................................................................................................. 22
Elektrochirurgie ................................................................................................. 22
Elektroschock-Therapie und Debrillation ........................................................ 22
Medizinische Diathermie ......................................................................................... 22
Diagnostische Untersuchungen und Behandlungen mit Ultraschall ......................... 22
Bestrahlungstherapie mit ionisierender Strahlung................................................... 22
Nichtionisierende elektromagnetische Strahlung .................................................... 22
10. GEBRAUCHSANWEISUNG .......................................................................................... 23
11. EXPLANTATION ............................................................................................................ 25
12. TECHNISCHE DATEN DES DIGISONIC® SP IMPLANTATS ......................................... 25
13. LEISTUNGSDATEN ....................................................................................................... 25
14. TECHNISCHE DATEN UND MERKMALE DER ELEKTRODENANORDNUNG ........... 25
MRT (Magnetresonanztomographie) ................................................................ 22
Elektrochirurgie ........................................................................................................ 23
Präoperatives Management .................................................................................... 23
Intraoperatives Management ................................................................................... 23
Setzen des Einschnitts und Positionierung des Empfängers ........................... 23
Handhabung des Implantats ............................................................................ 23
Ausrichten des Implantats ................................................................................ 23
Befestigung des Implantats .............................................................................. 24
Einführen der Elektrodenanordnung ................................................................. 24
Positionierung der Referenzelektrode ............................................................... 24
Bestätigen der Funktionsweise des Implantats ................................................ 24
19

1. GERÄTEBESCHREIBUNG
• Name des Modells
®
Digisonic
SP Cochlea-Implantat
• Handelsbezeichnung
I-SP-SD
• Gerätebeschreibung
Das Digisonic
an Taubheit grenzenden Hörverlustes bestimmt ist. Dieses transkutane Cochlea-Implantat arbeitet mit einem
externen HdO-Prozessor (DIGI SP/ SAPHYR
(DIGI SP’K). Mit Hilfe der elektromagnetischen Induktion übermittelt eine externe Antenne das akustische Signal,
das vom Prozessor verarbeitet wird, an das Digisonic
Haut implantiert wurde.
Das Digisonic
®
SP ist ein Multikanal-Cochlea-Implantat, das für die Rehabilitation eines hochgradigen oder
®
SP) oder mit einem Mikro-HdO-Prozessor mit externem Batterieteil
®
SP Implantat, das direkt hinter der Ohrmuschel unter der
®
SP beinhaltet eine Elektrodenanordnung mit 20 Elektroden, die in die Cochlea (Innenohr)
eingeführt wird. Jede Elektrode stimuliert eine unterschiedliche Anzahl von Hörnervenfasern und ist mit dem
Frequenzband des Schallsignals assoziiert, das vom externen Prozessor verarbeitet wird. Das Implantat
sowie die externe Antenne beinhalten einen Magneten. Damit wird die externe Antenne durch Magnetkraft
in ihrer relativen Position zum Implantat gehalten. Das Digisonic
Energiequelle. Es erhält die für seinen Betrieb erforderliche Energie durch die elektromagnetische Kopplung.
Infolgedessen bleibt das Implantat inaktiv, wenn die externe Antenne nicht korrekt zum Digisonic
®
SP-Implantat hat keine eigene elektrische
®
SP positioniert
ist.
2. PACKUNGSINHALT
1 Digisonic
®
SP (I-SP-SD) Implantat, 1 Silikon-Implantatmodell, 1 Befestigungssystem, 1 Implantatträger-
Ausweiskarte sowie die beigefügte Dokumentation.
3. LISTE KOMPATIBLER ZUBEHÖRTEILE
Das Implantat wird mit folgenden Zubehörteilen geliefert:
• 1 Silikonimplantat-Modell, das während des Eingris benutzt wird, um die korrekte Position des Implantats
unter der Haut zu überprüfen.
• 2 selbstschneidende Schrauben, um das Implantat in Position zu halten. Ein Vorbohrenist nicht erforderlich.
4. SYMBOLE UND DEREN BEDEUTUNG
Katalogreferenz
Sterilisationsmethode: Ethylenoxid, Produkt wird steril geliefert
Wichtig. Bitte lesen Sie die beigefügte
Dokumentation.
Feuchtigkeitspegel zwischen 15 % und
75 % halten.
Einmal-Gerät, nicht erneut verwenden. Herstellungsdatum
LAGERUNG: kühl und trocken lagern.
Lagertemperatur zwischen -20 °C und
+50 °C.
Chargen-Code
Zerbrechlich; vorsichtig handhaben Haltbarkeitsdatum
Nicht verwenden, wenn die Verpackung
beschädigt ist
Seriennummer
Nicht erneut sterilisieren Hersteller
Elektrischer und elektronischer Abfall
(WEEE)
Gebrauchsanweisung
5. INDIKATIONEN
Das Digisonic® SP Multikanal-Cochlea-Implantat ist für die Versorgung von Patienten konzipiert, die unter einem
hochgradigen bis an Taubheit grenzenden Hörverlust (2. Grades) leiden und eine Sprachverständlichkeit in
einem Sprachtest von weniger als 50% bei 60 dB HL mit einem Hörgerät erreichen (dazu ist eine fachliche
Empfehlung erforderlich).
20

6. MEDIZINISCHE GEGENANZEIGEN
Das Digisonic® SP Cochlea-Implantat ist nicht indiziert bei Patienten mit Hörverlust und gleichzeitigen starken
Läsionen in der Hörschnecke (erhebliche Missbildung, Bruch der Felsenbeinpyramide, starke Verknöcherung der
Cochlea), Veränderungen am Hörnerv (axonale Neuropathie, Tumor am Hörnerv oder in dessen Nähe, wie z. B. ein
Akustikusneurinom, eine vollständige Zerstörung beider Hörnerven), eine schwere Anomalie der Hörnervenbahnen,
akute oder chronische Mittelohrerkrankungen (einschließlich einer Perforation des Trommelfells) und die
psychologisch instabil sind oder unter einer Kontaktallergie gegenüber den Implantat-Werkstoen (Silikon, Platin-
Iridium, Titan), leiden. Hier können andere Implantat-Typen empfohlen werden.
7. NACHTEILIGE NEBENWIRKUNGEN
Patienten, die den Indikationen für eine Implantation entsprechen, müssen die mit dem chirurgischen Eingri
verbundenen Risiken akzeptieren (Nachwirkungen einer Allgemeinnarkose, Infektionen, etc.), die produktunabhängig
sind. Allerdings besteht auch ein Risiko, dass der Körper des Patienten das Implantat oder Teile des Implantats
abstößt. Dieses Risiko ist durch die Verwendung von biokompatiblen Materialien minimiert worden.
Komplikationen in Verbindung mit der operativen Technik der Cochlea-Implantation (temporäre oder permanente
Gesichtslähmung, Gefahr eines meningealen Irritationssyndroms, Geschmacksveränderungen, Schwindel,
Tinnitus, etc.) sind selten, sollten aber sorgfältig berücksichtigt werden. Es ist wichtig, jeden möglichen
Implantat-Empfänger über diese potenziellen Risiken zu informieren Der Patient sollte spezische Informationen
bezüglich der Symptome und der ersten Zeichen eines meningealen Irritationssyndroms erhalten. Gemäß den
aktuellen Empfehlungen wird eine Pneumokokken-Impfung nachdrücklich empfohlen.
Wenn das Implantat eingesetzt ist, verbleiben bestimmte Risiken, die zu einer Explantation führen können.
DieExplantation macht einen zusätzlichen Eingri unter Allgemeinnarkose erforderlich. Eine Explantation kann
in folgenden Fällen vorkommen:
- Medizinische Komplikationen
- Fehlfunktion des Implantats
- Eine Verschiebung des Geräts auf Grund eines Traumas
- Ausstoßung des Implantats
Diese potenziellen Probleme wurden während der Produktkonzipierung bewertet und die Materialien sowie das
Design des Implantats wurden so gewählt, um diese Risiken zu minimieren.
Die Langzeitauswirkungen des Traumas durch das Einführen von Elektroden und der ständigen elektrischen
Stimulation sind heute noch nicht bekannt. Diese Auswirkungen können eine Verknöcherung der Cochlea oder
eine Degeneration der Nervenfasern beinhalten und einen Austausch des Implantats erforderlich machen oder
zu einer verminderten Antwort auf die Stimulation führen.
8. VORSICHTSMASSNAHMEN
Informationen, die dem Patienten bereitzustellen sind:
- Der Patient muss über die Vorteile eines Cochlea-Implantats und über die nachteiligen Nebenwirkungen, die
auftreten könnten, informiert werden (siehe §7).
- Die mitgelieferte Identikationskarte muss sorgfältig ausgefüllt und an den Implantatträger ausgehändigt
werden.
- Der Patient muss informiert werden, dass er die Identikationskarte vor jeder medizinischen Untersuchung oder
Behandlung vorzeigen muss.
- Raten Sie dem Patienten, die seinem externen Prozessor beigefügte Gebrauchsanweisung sorgfältig
durchzulesen, insbesondere den Abschnitt mit den Warnhinweisen, die bei der Benutzung zu beachten sind.
- Informieren Sie den Patienten, sich im Falle eines Ausfalls oder einer Störung des Cochlea-Implantat-Systems
an das Implantationszentrum zu wenden.
- Von Kampfsportarten (Rugby, Boxen, etc.) wird nachdrücklich abgeraten, da starke Stöße auf diesen Bereich
das Implantat beschädigen können.
21

- Tauchen: Freizeit-Gerätetauchen in Tiefen von mehr als 20 m ist nicht empfohlen. Übermäßiger Druck kann das
Implantat beschädigen. Des Weiteren wird von professionellem Tiefseetauchen nachdrücklich abgeraten, da
das Implantat nicht für wiederholte Druckbelastungen geeignet ist.
- Zugang zu eingeschränkten Bereichen: Wenden Sie sich an einen Arzt, bevor Sie Bereiche mit eingeschränktem
Zugang betreten (MRT-Untersuchungsraum, Durchlaufen von Metalldetektoren, 3D-Scan-Kabinen, etc.).
9. ACHTUNG: WECHSELWIRKUNG MIT KLINISCHEN BEHANDLUNGEN UND UNTERSUCHUNGEN
- Achtung: Implantierbare Geräteteile sollten nicht wiederverwendet werden, wenn sie vorher bereits einem
Patienten implantiert wurden.
- Starkes elektrisches Feld:
- Elektrotherapie: Die Elektrotherapie kann Ströme unterschiedlicher Stärke aussenden. Die Anwendung
von Hochspannungstherapie-Techniken mit starken Strömen ist auf Grund des Beschädigungsrisikos des
Implantat-Systems untersagt. Allerdings kann die Niederspannungs-Elektrotherapie in Betracht gezogen
werden, wenn die Elektroden nicht im Bereich des Kopfes oder des Nackens platziert werden.
- Elektrochirurgie: Die Anwendung von monopolaren elektrochirurgischen Instrumenten ist zu vermeiden.
Diese Instrumente können Hochfrequenzfelder mit elektrischen Spannungen erzeugen, was zu einer
Wechselwirkung zwischen der Instrumentenspitze und der Elektrodenanordnung führen kann. Induzierte
Ströme könnten das Cochlea-Gewebe schädigen oder zu einer permanenten Beschädigung des Implantats
führen. Sobald das Cochlea-Implantat im OP aus seiner Verpackung entnommen wird, sollte jedes monopolare
Skalpell abgeschaltet werden, um eine Beschädigung des Implantats zu vermeiden. Allerdings können
bipolare elektrische Skalpelle eingesetzt werden, solange sie nicht in der Nähe des Cochlea-Implantats
oder mit diesem in direktem Kontakt benden.
- Elektroschock-Therapie und Debrillation: Bei Patienten, die Träger eines Cochlea-Implantats sind, wird
von Stromstößen von mehreren Tausend Volt durch den Körper abgeraten. Elektrische Stromstöße können
das Gewebe in der Hörschnecke schädigen oder zu einer permanenten Beschädigung des Implantats führen.
In einer lebensbedrohlichen Situation ist nur das Ärzteteam in der Lage, eine Entscheidung zu treen. Falls
die Situation für den Patienten nicht lebensbedrohlich ist, wenden Sie sich bitte an Neurelec.
- Medizinische Diathermie: Die medizinische Diathermie kann bei Patienten mit Implantaten, die Metall
enthalten, nicht eingesetzt werden. Dadurch können irreversible Schäden am Gewebe (Verbrennungen an
der Hörschnecke) oder am Implantat verursacht werden. Trotzdem kann die Diathermie mit Ultraschall für
Körperregionen in Betracht gezogen werden, die nicht die Bereiche des Kopfes oder des Halses betreen.
- Diagnostische Untersuchungen und Behandlungen mit Ultraschall: Das Implantat sollte den therapeutischen
Energiepegeln des Ultraschalls nicht ausgesetzt werden. Das Gerät könnte unabsichtlich den Ultraschall
konzentrieren und beschädigt werden.
- Bestrahlungstherapie mit ionisierender Strahlung: Während der Bestrahlungstherapie-Sitzung wird von einer
direkten Bestrahlung des Implantatbereichs nachdrücklich abgeraten. Die direkte und massive Bestrahlung des
Implantats könnte zu einem partiellen oder völligen Verlust der Implantatfunktionen führen. Diese Beschädigung ist
nicht notwendigerweise direkt erkennbar.
- Nichtionisierende elektromagnetische Strahlung:
- MRT (Magnetresonanztomographie): Das Digisonic
®
SP Implantat enthält einen Permanentmagneten. Eine
MRT-Untersuchung oder die Anwendung eines starken Magnetfelds im Bereich des Implantats könnte zu einer
Beschädigung des Implantats und/oder einer Verletzung des Patienten führen. Eine MRT-Untersuchung mit 1,5
Tesla kann allerdings durchgeführt werden, wenn die Empfehlungen befolgt werden. In diesem Fall sollte der
Radiologe ein Untersuchungsformblatt ausfüllen, das auf der Webseite www.neurelec.com zur Verfügung steht.
Weiterführende Informationen sind in der Bedienungsanleitung des Prozessors enthalten.
22

10. GEBRAUCHSANWEISUNG
Bitte beachten!
Elektrochirurgie: Sobald das Implantat eingesetzt ist, sollten die nachfolgenden chirurgischen Verfahren
keine Anwendung von monopolaren elektrochirurgischen Instrumenten beinhalten. Diese Instrumente können
Hochfrequenzfelder mit elektrischen Spannungen verursachen, die das Implantat beschädigen könnten.
Bipolare elektrochirurgische Skalpelle können eingesetzt werden, solange diese nicht in der Nähe des
Cochlea-Implantats benutzt oder mit diesem in Kontakt kommen.
Präoperatives Management
- Vor der Durchführung der ersten Digisonic
Daten des Digisonic
®
SP Cochlea-Implantats und der damit verbundenen chirurgischen Technik vertraut machen.
®
SP Implantation sollte sich der Arzt mit den besonderen technischen
- Der Patient sollte vor der Implantation über die Vorteile eines Cochlea-Implantats und über die möglichen
Begleitrisiken informiert werden (siehe §7).
Intraoperatives Management
- Setzen des Einschnitts und Positionierung des Empfängers: Bevor der Einschnitt für den Hautlappen
durchgeführt wird, wird empfohlen, die optimale Stelle für das Implantat-System zu bestimmen. Dadurch wird
die Tatsache berücksichtigt, dass das Implantat nicht in unmittelbarer Nähe der Ohrmuschel, sondern weit
genug von dieser entfernt platziert wird, damit der Patient den Prozessor hinter dem Ohr tragen kann, ohne
dass die Position der externen Antenne beeinträchtigt wird. Außerdem sollte der Einschnitt weit genug vom
Implantat entfernt sein, um die Gefahr einer postoperativen Ausstoßung oder Infektion zu vermeiden. Daher wird
die Verwendung eines sterilen Hautstiftes empfohlen, um die retroaurikulare Einschnittslinie etwa 1 cm entfernt
von der retroaurikularen Hautfalte und die Position des Empfängers etwa 2 cm von der Ohrmuschel entfernt
anzuzeichnen. Diese Positionen können mit Hilfe des Implantatmodells und des Prozessormodells (auf Anfrage
getrennt geliefert) durch Platzieren über dem Ohr bestimmt werden.
Verwenden Sie nach der Ausführung des Einschnitts das Implantatmodell für die Vorbereitung der für die korrekte
Platzierung des Empfängers erforderlichen Stelle. Die Knochenoberäche sollte überprüft werden um sicherzustellen,
dass diese ach genug ist, um anschließend den Empfänger mit Schrauben an Ort und Stelle zu befestigen.
- Handhabung des Implantats: Nehmen Sie das Implantat nur aus der Verkaufsverpackung, wenn die chirurgischen
Standardverfahren bis zur Cochleostomie abgeschlossen sind. Entfernen Sie die äußere Verpackung und stellen
Sie sicher, dass das Implantat nicht beschädigt ist. Durchtrennen Sie vorsichtig die Nahtfäden, die das Implantat in
Position halten, und nehmen Sie es aus dem sterilen Implantat-Halter. Vermeiden Sie ein Berühren oder Verbiegen
der Elektrodenanordnung. Verwenden Sie keine scharfen chirurgischen Instrumente, die die Elektrodenanordnung
beschädigen könnten.
®
- Ausrichten des Implantats: Die gravierte Oberäche des Digisonic
SP-Implantats (NEURELEC, BOTTOM)
sollte in der Einsatzkonguration nicht sichtbar sein und deshalb in Richtung Schädel zeigen. Diese metallene
Titanplatte enthält wichtige Informationen und identiziert das Implantat wie folgt:
Informationen auf
der zum Knochen
zeigenden Oberäche
Name des
Herstellers
Seriennummer (SN):
DR: Digisonic-Empfänger
00: Herstellungsjahr
K: SP-Version
1234: Fortlaufende
Nummer
Implantat-Typ (Modell): Das
Digisonic® SP-Implantat
wird durch die Inschrift
DIGISONIC® SP identiziert.
23

- Befestigung des Implantats: Ein Fräsen des Knochens für das Implantationsbett ist nicht erforderlich. Schieben
Sie den Empfänger einfach an die mit Hilfe des Silikonmodells vorbereitete Stelle unter den Temporalmuskel.
Vergewissern Sie sich, dass das Implantat korrekt platziert ist und sich nicht bewegt, wenn mit dem Finger
Druck ausgeübt wird. Nur der Zugang zu den Befestigungslaschen des Implantats
ist zur Befestigung des Systems erforderlich. Der implantierte Empfänger muss
stabilisiert werden, um ein mögliches Wandern zu verhindern, was eine Belastung
und eine mögliche Beschädigung der Elektrodenkabel verursachen könnte.
Eswird empfohlen, das Implantat mit den beiden selbstschneidenden Schrauben
vor Ort zu befestigen, die in der Verpackung enthalten und im Implantathalter
vorpositioniert sind. Befolgen Sie die nachfolgenden Schritte, um die Schrauben
aus dem Halter zu entnehmen:
• Setzen Sie den (mit der chirurgischen Erstausstattung mitgelieferten)
Schraubendreher mit festem Axialdruck in die Schraube.
• Lösen Sie die Schraube langsam und ziehen Sie sie aus dem Halter.
• Die Schraube ist jetzt am Schraubendreher befestigt und kann verwendet werden.
Positionieren Sie die erste Schraube vorsichtig in einer der Titan-Einsätze des Befestigungssystems. Es wird
empfohlen, den Schraubendreher senkrecht zur Implantatachse zu halten, um die Befestigung zu erleichtern.
Ziehen Sie die Schraube fest, bis ein Widerstand spürbar ist und nehmen Sie den Schraubendreher schrittweise
mit einer leichten Kreisbewegung ab. Prüfen Sie die Schraube auf festen Sitz und wiederholen Sie das gleiche
Verfahren für die zweite Schraube.
Anmerkung: Weder der Arzt noch eine andere, von Neurelec autorisierte Person darf Änderungen am Implantat
vornehmen (wie zum Beispiel am Befestigungssystem).
- Einführen der Elektrodenanordnung: Führen Sie die Elektroden-Anordnung so ein, dass diese der
Hörschneckebeim Einführen folgt. Führen Sie das Ende der Elektroden-Anordnung mit Hilfe der Einsetzkralle oder
der kleinen Zange in Richtung Basis der Scala Tympani. Führen Sie dann die Elektroden-Anordnung mit minimaler
Kraft schrittweise ein. Beenden Sie das Einführen, in dem Sie auf die extrakochleären Drückringe drücken. Wenn
das Einführen abgeschlossen ist, sollten die Ringe die Cochleostomie blockieren. Die Elektrodenanordnung
kann befestigt werden, um die Gefahr des Wanderns zu vermeiden. Die Befestigungsmethode und die
Befestigungspunkte hängen vom chirurgischen Zugang und den Vorlieben des Arztes ab.
- Positionierung der Referenzelektrode: Platzieren Sie die extrakochleäre Kugelreferenzelektrode auf den
Knochen unter dem Temporalmuskel.
- Bestätigen der Funktionsweise des Implantats: Eine Impedanzmessung vor dem Schließen des Einschnitts
kann die korrekte Funktionsweise des implantierten Geräts bestätigen.
11. EXPLANTATION
Falls eine Fehlfunktion des Digisonic
®
SP-Implantats vermutet wird, muss das System mit Hilfe der klinischen
Untersuchung der Firma Neurelec fachmännisch überprüft werden. Falls eine Fehlfunktion des Implantats
bestätigt wird und das Ärzteteam sich für dessen Explantation entscheidet, so ist die Kontaktaufnahme mit der
Firma Neurelec wichtig, die Sie über das zu befolgende Explantationsverfahren informieren wird. Es ist besonders
wichtig, ein Explantationskit von Neurelec anzufordern, so dass das explantierte System zurückgeschickt und
dadurch eine fachmännische Überprüfung des Geräts ermöglicht werden kann.
24
12. TECHNISCHE DATEN DES DIGISONIC® SP-IMPLANTATS
Primärfunktion Cochlea-Implantat
Stimulationsmodus Ausgewogene Zweiphasen-Stimulation
Stimulationsrate Maximal 24.000 pps (pps: Impulse pro Sekunde)
- Impedanzmessung
- Messung der Implantatleistung
Andere, zur Verfügung stehende Funktionen
- Integritätstest*
- EABR (Evozierte Hirnstamm-Antwort)*
- Stapedius-Reex
Psychoakustische Tests (gap test, etc.)*
* mit entsprechender Ausrüstung
Gewicht 10,5 g
Abmessungen
Durchmesser 30,2 mm – Dicke: zwischen 4,9 mm
(Kante) bis 5,75 mm (Mitte)
Lautstärke 4 cm3
- LSR 40 Shore A Silikon
Material in direktem Kontakt mit menschlichem
Gewebe
- Silikon HCR 35 Shore A und HCR 50 Shore A
- Silikonkleber
- Platin-Iridium 10%
- Titan Güte 2
- Titan Güte 5
13. LEISTUNGSDATEN
Leistungsmerkmale des Ausgangssignals
(beieinem Widerstand von 1 kΩ)
2 V -255 µs maximal
V: 0 bis 4 V
I: 10 µA bis 2 mA
Δt: 10 µs bis 255 µs
Impedanzmessung Ja: Normale Werte: 500 Ω – 5 kΩ
MRT Sicherheitsstufe Kompatible mit 1,5 Tesla. Siehe Empfehlungen
Empfohlene Methoden zur Überprüfung der
korrekten Funktionsweise des Systems
Ja. Impedanzmessung und Integritätstest
(mit der Schnittstellenausrüstung)
14. TECHNISCHE DATEN UND MERKMALE DER ELEKTRODENANORDNUNG
Monopolare elektrische Konguration Allgemeine Erdung
Anzahl unabhängiger aktiver Elektroden 20
Reduzierte Cochleostomiegröße 1 mm Durchmesser
Allgemeine Form Gerade mit Formgedächtnis
Apexform Weiche Spitze
Basisform Zwei Drückringe mit 1,5 mm Durchmesser
Werkstoe
- Verbindungskabel: - Platin-Iridium 10%
- Stimulationselektroden: - Platin-Iridium 10%
Isolierung PEI (Polyesterimid)
- Länge: 26 mm
- Durchmesser an der Basis und am Apex: 1,07 mm
und 0,5 mm.
Abmessungen
- Mindest- und maximaler Oberächenbereich der
Stimulationselektroden: 0,39 mm² und 0,77 mm²
- Abstand zwischen den Elektroden: 0,7 mm
- Maximaler Abstand zwischen den proximalen und
distalen Elektroden: 22,3 mm
- Falls Zweifel bei den angegebenen Leistungen bestehen, wenden Sie sich zu Ihrer Sicherheit bitte an Ihren
Neurelec-Kundendienst.
- Möchten Sie Anmerkungen dazu machen oder sollten die bereitgestellten Informationen unvollständig sein, so
wenden Sie sich bitte an Ihren Hersteller oder an Ihren Händler vor Ort.
Digisonic
®
SP ist ein eingetragenes Warenzeichen der Firma Neurelec-Frankreich
25

26

SOMMARIO
1. DESCRIZIONE DEL DISPOSITIVO ................................................................................. 28
Nome del modello ................................................................................................... 28
Identicazione commerciale .................................................................................... 28
Descrizione del dispositivo ...................................................................................... 28
2. CONTENUTO DELLA CONFEZIONE ............................................................................. 28
3. ELENCO DEGLI ACCESSORI COMPATIBILI ................................................................. 28
4. SIMBOLI E SIGNIFICATI ................................................................................................. 28
5. INDICAZIONI .................................................................................................................... 28
6. CONTROINDICAZIONI MEDICHE ................................................................................... 29
7. EFFETTI AVVERSI INDESIDERATI................................................................................. 29
8. PRECAUZIONI ................................................................................................................. 29
9. ATTENZIONE, L’INTERAZIONE CON I TRATTAMENTI E GLI ESAMI CLINICI ........... 30
Attenzione ................................................................................................................ 30
Campo elettrico ad alta tensione ............................................................................. 30
Elettroterapia ..................................................................................................... 30
Elettrochirurgia .................................................................................................. 30
Terapia con elettroshock e debrillazione ......................................................... 30
Diatermia medica .................................................................................................... 30
Test diagnostici e trattamenti agli ultrasuoni ........................................................... 30
Radioterapia con irradiazione ionizzante ................................................................ 30
Irradiazione elettromagnetica non ionizzante .......................................................... 30
10. ISTRUZIONI PER L’USO ............................................................................................... 31
11. ESPIANTO ..................................................................................................................... 33
12. SPECIFICHE TECNICHE DELL’IMPIANTO DIGISONIC® SP ........................................ 33
13. CARATTERISTICHE DELLE PRESTAZIONI ................................................................ 33
14. SPECIFICHE E CARATTERISTICHE DEL PORTAELETTRODI ................................... 33
RMI (Risonanza Magnetica per Immagini) ........................................................ 30
Elettrochirurgia ........................................................................................................ 31
Gestione preoperatoria ............................................................................................ 31
Gestione intraoperatoria .......................................................................................... 31
Determinazione del punto di incisione e della posizione del ricevitore ............ 31
Gestione dell’impianto ....................................................................................... 31
Orientamento dell’impianto ............................................................................... 31
Fissaggio dell’impianto ..................................................................................... 32
Inserimento del portaelettrodi ........................................................................... 32
Posizionamento dell’elettrodo di riferimento ..................................................... 32
Conferma del funzionamento dell’impianto ....................................................... 32
27

1. DESCRIZIONE DEL DISPOSITIVO
• Nome del modello
Impianto cocleare Digisonic
®
SP
• Identicazione commerciale
I-SP-SD
• Descrizione del dispositivo
®
Digisonic
gravi (secondo grado) a totali. Questo impianto cocleare, di tipo transcutaneo, funziona con un processore
esterno di tipo auricolare (DIGI SP/ SAPHYR
Un’antenna esterna trasmette, tramite accoppiamento elettromagnetico, il segnale acustico elaborato dal
processore all’impianto Digisonic
Digisonic
SP è un impianto cocleare multicanale destinato alla riabilitazione di sordità percettive bilaterali da
®
SP) o un microauricolare con batteria separata (DIGI SP’K).
®
®
SP comprende un portaelettrodi con 20 elettrodi che viene inserito nella coclea (orecchio interno).
SP inserito sotto cute dietro al padiglione auricolare.
Ciascun elettrodo stimola diversi gruppi di bre nervose acustiche ed è associato a una banda di frequenza
del segnale sonoro elaborato dal processore esterno. L’impianto e l’antenna esterna contengono un magnete,
l’antenna esterna rimane infatti ssata in corrispondenza dell’impianto per attrazione magnetica. Digisonic
SP non dispone di alimentazione elettrica autonoma, riceve l’energia necessaria al proprio funzionamento per
accoppiamento elettromagnetico. Pertanto, quando l’antenna esterna non è posizionata in corrispondenza di
®
Digisonic
SP, l’impianto è passivo.
®
2. CONTENUTO DELLA CONFEZIONE
1 Impianto Digisonic
®
SP (I-SP-SD), 1 sagoma dell’impianto in silicone, 1 sistema di ssaggio, 1 tesserino di
portatore, i documenti di accompagnamento.
3. ELENCO DEGLI ACCESSORI COMPATIBILI
L’impianto è dotato dei seguenti accessori:
• 1 sagoma dell’impianto utilizzato durante l’intervento per vericare il corretto posizionamento dell’impianto
sotto la cute.
• 2 viti autolettanti utilizzate per ssare l’impianto in posizione; queste non necessitano di prealloggiamento.
4. SIMBOLI E SIGNIFICATI
Riferimento catalogo
Metodo di sterilizzazione: ossido di etilene
Prodotto consegnato sterile
Importante! È necessario consultare la
documentazione di accompagnamento.
Limite di umidità compreso tra il 15%
e il 75%.
Dispositivo monouso, non riutilizzare Data di fabbricazione
CONSERVAZIONE: conservare in un
luogo fresco ed asciutto. Temperatura
diconservazione tra -20° C e +50° C.
Codice del lotto
Fragile; maneggiare con cura Uso entro la data
Non utilizzare se la confezione
è danneggiata
Numero di serie
Non risterilizzare Produttore
Riuti di apparecchiature elettriche
edelettroniche (WEEE)
Istruzioni per il funzionamento
5. INDICAZIONI
Digisonic® SP è un impianto cocleare multicanale destinato alla riabilitazione dei pazienti aetti da sordità
bilaterale di 2° grado da severa a profonda con livello di intelligibilità del parlato inferiore al 50% a 60 dB HL in
formato open-set con l’uso di una protesi uditiva (parere medico professionale richiesto).
28

6. CONTROINDICAZIONI MEDICHE
L’impianto cocleare Digisonic® SP non è indicato in pazienti con ipoacusia percettiva accompagnata da vaste
lesioni della coclea (malformazione importante della coclea, frattura della parte petrosa dell’osso temporale,
signicativa ossicazione della coclea), del nervo uditivo (neuropatia assonale, tumore del nervo uditivo o in sua
prossimità quale un neurinoma, distruzione completa di entrambi i nervi uditivi) o da grave anomalia dei percorsi
uditivi, condizioni dell’orecchio medio acute o croniche (inclusa la perforazione della membrana timpanica),
psicologicamente instabili o con allergia da contatto ai materiali dell’impianto (silicone, platino iridio, titanio).
Possono essere consigliabili altri tipi di impianti.
7. EFFETTI AVVERSI INDESIDERATI
I pazienti che soddisfano le indicazioni di impianto devono accettare i tipici rischi associati a un intervento
chirurgico (eetti dell’anestesia generale, infezioni, ecc.) indipendenti dal prodotto. Tuttavia, sussiste anche
il rischio che l’organismo del paziente possa rigettare l’impianto o una parte di esso. Il rischio è stato ridotto
utilizzando materiali biocompatibili nella progettazione.
Le complicazioni associate alla tecnica operatoria dell’impianto cocleare (paralisi facciale transitoria o denitiva,
rischio di sindrome da irritazione meningeale, alterazione del gusto, vertigini, acufeni, ecc.) sono rari ma devono
essere presi in considerazione con attenzione. È importante informare qualsiasi candidato all’impianto cocleare
di tali rischi potenziali. È necessario inoltre dare speciali informazioni al paziente in merito ai sintomi e ai primi
segni di sindrome da irritazione meningeale. Secondo le linee guida in vigore è peraltro vivamente consigliata
la vaccinazione anti pneumococco.
Una volta inserito l’impianto, sussistono alcuni rischi che potrebbero essere causa di espianto. L’espianto
richiede un ulteriore intervento chirurgico in anestesia generale. L’espianto può vericarsi nei seguenti casi:
- Complicazioni mediche
- Malfunzionamento dell’impianto
- Spostamento del dispositivo in seguito a trauma
- Estrusione dell’impianto
Questi potenziali problemi sono stati presi in considerazione durante la progettazione del prodotto e sono stati
scelti un design e dei materiali in grado di ridurre questi rischi.
Inne, gli eetti a lungo termine di un trauma associato all’inserimento di elettrodi e stimolazione elettrica cronica
non sono attualmente noti. Tali eetti potrebbero comprendere l’ossicazione cocleare o la degenerazione
delle bre nervose e potrebbero richiedere la sostituzione dell’impianto o provocare una risposta ridotta alla
stimolazione.
8. PRECAUZIONI
Informazioni da fornire al paziente:
- Il paziente deve essere informato dei beneci dell’impianto cocleare, ma anche dei possibili eetti secondari
indesiderati (vedere §7).
- Il tesserino di identicazione fornito deve essere completato e fornito al portatore.
- Informare il paziente che deve presentare il tesserino di identicazione prima di qualsiasi esame o trattamento
medico.
- Raccomandare al paziente di leggere attentamente le istruzioni per l’uso consegnate con il processore esterno
e in particolare il paragrafo relativo alle avvertenze per l’impiego.
- Spiegare al paziente di contattare il centro d’impianto in caso di problemi o malfunzionamenti del sistema di
impianto cocleare.
- Gli sport da contatto (rugby, boxe, ecc.) sono fortemente sconsigliati in quanto forti impatti possono danneggiare
l’area dell’impianto.
29

- Immersioni subacquee: le immersione a scopo ricreativo sono sconsigliate a profondità oltre i 20 m.
Un’eccessiva pressione può infatti danneggiare l’impianto. D’altra parte è vivamente sconsigliato praticare
un’attività professionale di immersione sottomarina dal momento che l’impianto non è garantito nei confronti di
ripetute sollecitazioni ad una pressione eccessiva.
- Accesso alle zone protette: attenersi alle raccomandazioni del medico prima di accedere a zone protette (sale
per esami di RMI, porte di rilevamento, scanner 3D, ecc …).
9. ATTENZIONE, L’INTERAZIONE CON I TRATTAMENTI E GLI ESAMI CLINICI
- Attenzione: Le parti impiantabili del dispositivo non devono essere riutilizzate se precedentemente impiantate
in un altro paziente.
- Campo elettrico ad alta tensione:
- Elettroterapia: L’elettroterapia può rilasciare correnti più o meno forti. Il ricorso a tecniche di elettroterapia
a corrente elettrica a tensione elevata è vietato a causa dei possibili danni che può provocare all’impianto.
Tuttavia, è possibile prendere in considerazione l’elettroterapia a bassa tensione alla sola condizione che gli
elettrodi non siano posizionati sulle zone della testa e del collo.
- Elettrochirurgia: Evitare l’uso di strumenti chirurgici monopolari. Questi strumenti possono creare campi
in radiofrequenza con tensioni elettriche che possono causare un’interazione tra la punta dello strumento e il
portaelettrodi. Le correnti indotte possono danneggiare il tessuto cocleare o provocare un danno permanente
all’impianto. Non appena l’impianto cocleare viene rimosso dalla confezione in sala operatoria si deve
spegnere qualsiasi elettrobisturi per evitare danni all’impianto. Tuttavia, è possibile utilizzare elettrobisturi
bipolari purché non in prossimità e non a contatto diretto con l’impianto cocleare.
- Terapia con elettroshock e debrillazione: L’invio di shock elettrici di diverse migliaia di volt che
percorrono il corpo è sconsigliato su un paziente portatore di impianto cocleare. Gli elettroshock possono
provocare danni tissulari nella coclea o generare danni permanenti all’impianto.
Nel caso di una situazione di importanza vitale, solo l’equipe medica è in grado di prendere una decisione.
Nel caso in cui la situazione non sia vitale per il paziente, si prega di contattare Neurelec.
- Diatermia medica: La diatremia elettromagnetica è vietata su un paziente portatore di elementi impiantati
contenenti metallo. Essa può causare danni irreversibili ai tessuti (bruciatura della coclea) e all’impianto.
Tuttavia, è possibile prendere in considerazione la diatermia a ultrasuoni in zone dell’organismo lontane
dalla testa e dal collo.
- Test diagnostici e trattamenti agli ultrasuoni: L’impianto non deve essere esposto a livelli terapeutici di
energia ultrasonica. Il dispositivo può infatti inavvertitamente concentrare gli ultrasuoni e subire dei danni.
- Radioterapia con irradiazione ionizzante: In caso di sedute di radioterapia, si sconsiglia vivamente di irradiare
direttamente la zona dell’impianto. Un’esposizione massiccia e diretta dell’impianto ai raggi potrebbe provocare
una perdita parziale o totale delle funzionalità dell’impianto. I danni non sono necessariamente manifesti.
- Irradiazione elettromagnetica non ionizzante:
- RMI (Risonanza magnetica per immagini): l’impianto Digisonic
®
contiene un magnete permanente.
Un esame di RMI o l’applicazione di un campo magnetico intenso in prossimità dell’impianto potrebbe
provocare danni all’impianto e/o al paziente. È tuttavia possibile eettuare un esame di RMI a 1,5 Tesla
rispettando le raccomandazioni. In tal caso il radiologo deve compilare un modulo d’ esame disponibile sul
sito www.neurelec.com.
Per ulteriori informazioni consultare il manuale per l’utente del processore.
30

10. ISTRUZIONI PER L’USO
Attenzione!
Elettrochirurgia: Una volta inserito l’impianto, il resto dell’intervento chirurgico non deve comprendere l’uso
di strumenti elettrochirurgici monopolari. Questi strumenti possono creare campi di radiofrequenza generando
tensioni elettriche che possono danneggiare l’impianto. Tuttavia, è possibile utilizzare elettrobisturi bipolari
purché non in prossimità e non a contatto diretto con l’impianto cocleare.
Gestione preoperatoria
- Prima di eettuare il primo impianto di Digisonic
tecniche dell’impianto cocleare Digisonic
®
®
SP, il chirurgo deve informarsi sulle particolari speciche
SP e sulla tecnica chirurgica associata.
- Prima dell’impianto, i pazienti devono essere informati dei beneci dell’impianto cocleare e degli eventuali
rischi secondari (vedere §7).
Gestione intraoperatoria
- Determinazione del punto di incisione e della posizione del ricevitore: Prima di eettuare l’incisione del
lembo di cute si consiglia di determinare il sito ottimale di impianto del sistema. Il punto di incisione deve tenere
conto del fatto che l’impianto non deve essere posizionato al di sotto del padiglione auricolare, ma a una distanza
suciente per lasciare spazio al processore retroauricolare senza che interferisca con l’antenna esterna. Inoltre,
la linea di incisione deve essere abbastanza lontana dall’impianto da evitare il rischio di estrusione o infezione
postoperatoria. Si consiglia pertanto di utilizzare un evidenziatore per la cute sterile per tracciare la linea di
incisione retroauricolare a 1 cm dalla piega retroauricolare e di tracciare la posizione del ricevitore a circa 2cm
dal padiglione auricolare. Questi punti possono essere determinati utilizzando la sagoma dell’impianto e del
processore (fornita separatamente su richiesta) posizionata sopra l’orecchio.
Dopo aver eettuato l’incisione, utilizzare la sagoma dell’impianto per preparare il sito necessario per il corretto
posizionamento del ricevitore. Vericare la supercie dell’osso per garantire che sia sucientemente piatta da
mantenere facilmente in posizione il ricevitore con le viti.
- Gestione dell’impianto: Rimuovere l’impianto dalla confezione di vendita solo dopo avere completato
le procedure chirurgiche standard no alla cocleostomia. Rimuovere la confezione esterna e vericare che
l’impianto non sia danneggiato. Tagliare con cura i li di sutura che ssano l’impianto e rimuoverlo dal supporto
sterile. Evitare di toccare e/o piegare il portaelettrodi. Non utilizzare strumenti chirurgici alati che possano
danneggiare il portaelettrodi.
®
- Orientamento dell’impianto: La supercie incisa dell’impianto Digisonic
SP (NEURELEC, BOTTOM) non
deve essere visibile nella congurazione per l’uso e quindi deve essere rivolta sul lato del cranio. Questa placca
metallica in titanio riporta, come segue, informazioni importanti che consentono l’identicazione dell’impianto:
Informazione
su supercie
lato osseo
Numero di serie (NS):
DR: Ricevitore Digisonic
00: anno di fabbricazione
K: versione SP
1234: n° incrementale
Nome
produttore
Tipo di impianto (modello):
l’impianto Digisonic® SP è
identicato dall’iscrizione
DIGISONIC® SP
31

- Fissaggio dell’impianto: Non è necessaria la fresatura dell’osso per il letto dell’impianto. Fare semplicemente
scivolare il ricevitore sotto il muscolo temporale nel sito preparato mediante la sagoma in silicone. Vericare
che l’impianto sia posizionato correttamente e che non oscilli facendo pressione con un dito. Per il ssaggio
del sistema è richiesto semplicemente l’uso delle alette di ssaggio. Il ricevitore
impiantato deve essere ssato per evitare qualsiasi possibile dislocazione che
potrebbe causare tensioni e possibili danni ai li degli elettrodi. Si consiglia sempre
di ssarlo con le due viti autolettanti fornite in dotazione e preposizionate nel
supporto dell’impianto. Seguire i passaggi elencati di seguito per rimuovere le viti
dal supporto:
• Inserire il cacciavite (fornito con il kit chirurgico iniziale) nella vite applicando
una ferma pressione assiale.
• Svitare la vite estraendola lentamente dal supporto.
• La vite è ora ssata sul cacciavite e può essere utilizzata.
Posizionare delicatamente la prima vite in uno degli inserti in titanio del sistema di ssaggio. Per facilitare il
ssaggio si consiglia di mantenere il cacciavite in posizione verticale rispetto all’asse dell’impianto. Serrare
la vite no a sentire resistenza, quindi estrarre gradualmente il cacciavite applicando un leggero movimento
circolare. Vericare che sia ssata, quindi ripetere la stessa procedura per la seconda vite.
Nota: Né il chirurgo, né altra persona autorizzata da Neurelec può apportare modiche all’impianto (ad esempio
al sistema di ssaggio).
- Inserimento del portaelettrodi: Orientare ilportaelettrodi in modo che segua la spirale cocleare una volta
inserito. Guidare la punta del portaelettrodi verso la base della scala timpanica utilizzando la gria di inserimento
o la micropinza. Quindi far avanzare gradualmente il portaelettrodiutilizzando una forza minima. Terminare
l’inserimento utilizzando come riferimento gli anelli di supporto extracocleare in silicone. Una volta completato
l’inserimento, gli anelli devono bloccare la cocleostomia. Il portaelettrodipuò essere ssato per evitare il rischio di
migrazione. Il metodo di ssaggio e i punti di ssaggio dipenderanno dall’accesso chirurgico e dalle preferenze
del chirurgo.
- Posizionamento dell’elettrodo di riferimento: Sistemare l’elettrodo di riferimento extracocleare contro l’osso
sul muscolo temporale.
- Conferma del funzionamento dell’impianto: Le misurazioni di impedenza, prima o dopo la sutura
dell’incisione, consentono di vericare il corretto funzionamento del dispositivo impiantato.
11. ESPIANTO
Se si sospetta un malfunzionamento dell’impianto Digisonic
®
SP, il sistema deve essere esaminato con l’aiuto
dell’assistenza clinica di Neurelec. Se il malfunzionamento dell’impianto è confermato e l’equipe medica decide
di espiantare, è importante contattare Neurelec per avere informazioni sulla procedura di espianto da seguire.
È particolarmente importante richiedere un kit di espianto a Neurelec in modo che il sistema espiantato possa
essere restituito per poterlo esaminare.
32

12. SPECIFICHE TECNICHE DELL’IMPIANTO DIGISONIC® SP
Funzione primaria Impianto cocleare
Modalità di stimolazione Stimolazione bifasica bilanciata
Frequenza di stimolazione 24.000 pps massimo (impulsi al secondo)
- Misurazione dell’impedenza
- Misurazione della potenza dell’impianto
Altre funzioni disponibili
- Test di integrità*
- PEA (Potenziali Evocati Uditivi)*
- Riesso stapediale
Test psico-acustici (gap test, ecc.)*
* con apparecchiature associate
Massa 10,5 g
Dimensioni
Diametro 30,2 mm – Spessore: da 4,9 mm (bordo) a
5,75 mm (centro)
Volume 4 cm3
- Silicone LSR 40 shore A
- Silicone HCR 35 shore A e HCR 50 shore A
Materiali in contatto diretto con tessuti umani
- Silicone adesivo
- Platino iridio 10%
- Titanio grado 2
- Titanio grado 5
13. CARATTERISTICHE DELLE PRESTAZIONI
Caratteristiche del segnale di uscita
(su resistenza di 1 kΩ)
Max 2V -255 µs
V: da 0 a 4 V
I: da 10 µA a 2 mA
Δt: da 10 µs a 255 µs
Misurazione dell’impedenza Sì: valori normali: 500 Ω – 5 kΩ
Livello di sicurezza RMI
Metodi consigliati per determinare il corretto
funzionamento del sistema
Compatibile a 1,5 Tesla.
Consultare le raccomandazioni
Sì. Misurazione dell’impedenza e test di integrità
(con apparecchiatura di rilevamento)
14. SPECIFICHE E CARATTERISTICHE DEL PORTAELETTRODI
Congurazioni elettriche monopolari Messa a terra comune
Numero di elettrodi attivi indipendenti 20
Cocleostomia ridotta Diametro da 1 mm
Forma generale Diritto con memoria della forma
Forma all’apice Estremità appuntita
Forma alla base Due anelli di supporto diametro 1,5 mm
Materiali costituenti
- Filo di collegamento: platino iridio 10%
- Elettrodi di stimolazione: platino iridio 10%
Isolamento PEI (polyesterimide)
- Lunghezza: 26 mm
- Diametro alla base e all’apice: 1.07 mm e 0,5 mm
Dimensioni
- Supercie minima e massima degli elettrodi di
stimolazione: 0,39 mm² e 0,77 mm²
- Distanza tra ciascun elettrodo: 0,7 mm
- Distanza massima tra ciascun elettrodo prossimale
e distale: 22,3 mm
- In caso di dubbio sulle prestazioni specicate, contattare per sicurezza l’assistenza clienti di Neurelec.
- Per lasciare un feedback o se le informazioni fornite fossero incomplete, contattare il produttore o il distributore
locale.
Digisonic
®
SP è un marchio registrato di Neurelec-Francia
33

34

INTRODUCCIÓN
1. DESCRIPCIÓN ................................................................................................................. 36
Nombre del modelo ................................................................................................. 36
Identicación comercial .......................................................................................... 36
Descripción del dispositivo ..................................................................................... 36
2. CONTENIDO DEL PAQUETE .......................................................................................... 36
3. LISTA DE ACCESORIOS COMPATIBLES ...................................................................... 36
4. SÍMBOLOS Y SIGNIFICADOS ......................................................................................... 36
5. INDICACIONES ................................................................................................................ 36
6. CONTRAINDICACIONES MÉDICAS ............................................................................... 37
7. EFECTOS SECUNDARIOS ............................................................................................. 37
8. PRECAUCIONES ............................................................................................................. 37
9. PRECAUCIÓN, INTERACCIÓN CON TRATAMIENTOS
E INVESTIGACIONES CLÍNICAS ....................................................................................... 38
Precaución ............................................................................................................... 38
Campo eléctrico de alta tensión .............................................................................. 38
Electroterapia .................................................................................................... 38
Electrocirugía .................................................................................................... 38
Terapia de electrochoque y desbrilación ........................................................ 38
Diatermia médica .................................................................................................... 38
Pruebas de diagnóstico y tratamiento con ultrasonidos ......................................... 38
Radioterapia con radiación ionizante ...................................................................... 38
Radiación electromagnética no ionizante ............................................................... 38
10. INSTRUCCIONES DE FUNCIONAMIENTO .................................................................. 39
11. EXPLANTACIÓN ............................................................................................................ 41
12. ESPECIFICACIONES TÉCNICAS DEL IMPLANTE DIGISONIC® SP ........................... 41
13. CARACTERÍSTICAS DE RENDIMIENTO ..................................................................... 41
14. ESPECIFICACIONES Y CARACTERÍSTICAS DEL CONJUNTO DE ELECTRODOS ......
Resonancia magnética (IRM) ............................................................................ 38
Electrocirugía ........................................................................................................... 39
Gestión preoperatoria .............................................................................................. 39
Gestión intraoperatoria ............................................................................................ 39
Ubicación de la incisión y colocación del receptor .......................................... 39
Manipulación del implante ................................................................................ 39
Orientación del implante ................................................................................... 39
Fijación del implante ......................................................................................... 40
Colocación del conjunto de electrodos ............................................................ 40
Colocación del electrodo de referencia ............................................................ 40
Conrmación del funcionamiento del implante ................................................. 40
41
35

1. DESCRIPCIÓN DEL DISPOSITIVO
• Nombre del modelo
Implante coclear Digisonic
®
SP
• Identicación comercial
I-SP-SD
• Descripción del dispositivo
®
Digisonic
perceptiva bilateral de grave (de segundo grado) a profunda. Este implante coclear transcutáneo funciona
con un procesador retroauricular externo (DIGI SP/ SAPHYR
batería externa (DIGI SP’K). Mediante un acoplamiento electromagnético, una antena externa transmite la señal
acústica que procesa el procesador al implante Digisonic
auditivo.
Digisonic
SP es un implante coclear multicanal diseñado para rehabilitar a pacientes con una pérdida auditiva
®
SP) o con un microprocesador retroauricular con
®
SP colocado bajo la piel justo detrás del pabellón
®
SP incluye una matriz de electrodos con 20 electrodos que se inserta en la cóclea (oído interno).
Cada electrodo estimula un grupo diferente de bras nerviosas auditivas y está asociado con una banda de
frecuencia distinta de la señal sonora que después procesa el procesador externo. El implante y la antena
externa contienen un imán, de este modo, mediante una atracción magnética, la antena externa queda ja en
su sitio en relación al implante. Digisonic
necesaria para su funcionamiento mediante un acoplamiento electromagnético. Por consiguiente, cuando la
antena externa no está bien colocada en relación al Digisonic
®
SP no tiene una fuente de alimentación propia, y recibe la energía
®
SP, el implante no funciona.
2. CONTENIDO DEL PAQUETE
1 implante Digisonic® SP (I-SP-SD), 1 plantilla de implante de silicona, 1 sistema de sujeción, 1 tarjeta de
identicación del paciente y documentación necesaria.
3. LISTA DE ACCESORIOS COMPATIBLES
El implante se suministra con los siguientes accesorios:
• 1 manómetro de implante de silicona que se utiliza durante la cirugía para comprobar la posición correcta
del implante bajo la piel.
• 2 tornillos de rosca cortante utilizados para jar el implante en su lugar; no requieren perforar previamente.
4. SÍMBOLOS Y SIGNIFICADOS
Referencia del catálogo
Método de esterilización: óxido de etileno.
El producto se suministra estéril.
Importante. Lea la documentación
adjunta
Mantenga el nivel de humedad entre
el 15 % y 75 %.
Dispositivo de un solo uso; no reutilizar Fecha de fabricación
ALMACENAMIENTO: almacenar en un
lugar seco y fresco. Almacenar a una
temperatura entre -20 °C y +50 °C
Código de lote
Frágil; manipular con cuidado Usar antes de la fecha de caducidad
No usar si el paquete está dañado Número de serie
No reesterilizar Fabricante
Residuos procedentes de aparatos
eléctricos y electrónicos (RAEE)
Instrucciones de funcionamiento
5. INDICACIONES
El implante coclear multicanal Digisonic® SP está diseñado para rehabilitar a pacientes con una pérdida
auditiva bilateral de 2º grado de grave a bilateral total con un nivel de inteligibilidad del habla menor del 50% a
60 dB HL en contexto formato ajuste abierto con el uso de una prótesis auditivas (se requiere evaluación médica
profesional es necesaria la opinión de un profesional médico).
36

6. CONTRAINDICACIONES MÉDICAS
El implante coclear Digisonic® SP no está indicado en para pacientes con pérdida auditiva perceptiva
acompañada de grandes lesiones en la cóclea (malformación coclear importante, fractura de la porción petrosa
del hueso temporal, osicación signicativa de la cóclea), el nervio auditivo (neuropatía axonal, tumor en el
nervio auditivo o cerca de él, como un neurinoma, destrucción completa de los nervios auditivos), una anomalía
grave en de los conductos auditivos, enfermedad aguda o crónica del oído medio (incluyendo perforación en
la membrana timpánica del tímpano), tenga inestabilidad psicológica o alergia de contacto a los materiales del
implante (silicona, platino iridio, titanio). En estas situaciones, se recomiendan otros tipos de implante.
7. EFECTOS SECUNDARIOS
En los pacientes que cumplen las indicaciones, la implantación tiene los riesgos típicos asociados con la cirugía
(efectos de la anestesia general, infecciones, etc.) que son independientes del producto en sí. Sin embargo,
también existe el riesgo de que el cuerpo del paciente pueda rechazar el implante o parte de él. Este riesgo se
ha reducido al utilizar materiales de diseño biocompatibles.
Son raras las complicaciones asociadas con la cirugía de implante coclear (parálisis facial temporal o
permanente, riesgo de síndrome de irritación meningítica, cambios en el sabor, mareos, acufenos, etc.), pero
deben considerarse atentamente. Es importante informar a cada candidato a implante de estos posibles
riesgos. Debe facilitarse información concreta al paciente sobre los síntomas y signos iniciales del síndrome
de irritación meningítica. Según las recomendaciones actuales, también se recomienda encarecidamente la
vacuna contra los neumococos.
Una vez colocado el implante, puede seguir habiendo ciertos riesgos que pueden suponer la explantación.
La explantación requiere una intervención quirúrgica adicional con anestesia general. La explantación puede
ocurrir en los siguientes casos:
- Complicación médica
- Fallo de funcionamiento del implante
- Desplazamiento del dispositivo por traumatismo
- Extrusión del implante
Se evaluaron estos posibles problemas durante el diseño del producto, y los materiales y el diseño del implante
se han elegido para minimizar estos riesgos.
Por último, por el momento no se conocen efectos a largo plazo de traumatismos asociados con la introducción
de electrodos y estimulación eléctrica crónica. Estos efectos pueden incluir la osicación coclear o la
degeneración de las bras nerviosas y puede requerir sustituir el implante o conllevar menor respuesta a la
estimulación.
8. PRECAUCIONES
Información que se facilitará al paciente:
- Informe al paciente de las ventajas de un implante coclear, pero también de sus posibles efectos secundarios
adversos (consulte §7).
- Debe rellenar la tarjeta de identicación suministrada y entregársela al portador.
- Informe al paciente de que debe presentar la tarjeta de identicación antes de cualquier examen o tratamiento
médico.
- Aconseje al paciente que lea atentamente las instrucciones de funcionamiento suministradas con su
procesador externo, en concreto la sección sobre las advertencias de uso.
- Dígale al paciente que, en caso de fallo o mal funcionamiento del sistema de implante coclear, debe ponerse
en contacto con su centro de implantes.
- Se desaconsejan encarecidamente los deportes de contacto (rugby, boxeo, etc.), ya que, si el área del
implante recibe un golpe fuerte, se puede dañar.
37

- Buceo: El buceo recreativo no se recomienda a profundidades por debajo de 20 m. El exceso de presión
puede dañar el implante. Además, se desaconseja encarecidamente practicar actividades profesionales de
buceo en aguas profundas, ya que el implante no tiene garantía contra grandes fuerzas de presión
- Acceso a zonas restringidas: Consulte a un médico antes de entrar en zonas de acceso restringido (sala de
resonancia magnética, pasar por detectores de metal, cabinas de exploración 3D, etc.).
9. PRECAUCIÓN, INTERACCIÓN CON TRATAMIENTOS E INVESTIGACIONES CLÍNICAS
- Precaución: No deben reutilizarse piezas del dispositivo implantable si previamente se han implantado en
otro paciente.
- Campo eléctrico de alta tensión:
Electroterapia: La electroterapia puede enviar corrientes de distinta intensidad. El uso de técnicas
electroterapéuticas de alta tensión está prohibido por el riesgo de daños al sistema de implante. Sin embargo,
la electroterapia de baja tensión puede considerarse solo si no se colocan los electrodos en zonas cerca de
la cabeza o del cuello.
- Electrocirugía: Evite el uso de instrumentos electroquirúrgicos monopolares. Este tipo de instrumentos
puede crear campos de radiofrecuencia por tensión eléctrica que podrían interaccionar con la punta del
instrumento y la matriz de electrodos. Las corrientes inducidas podrían lesionar el tejido coclear o provocar
daños permanentes en el implante. En cuanto se saque un implante coclear de su envase en el quirófano,
debe apagar cualquier escalpelo monopolar para evitar dañar el implante. Sin embargo, pueden utilizarse
escalpelos eléctricos bipolares, siempre que no sea cerca del implante coclear ni entren en contacto
directo con él.
- Terapia de electrochoque y desbrilación: No se aconseja transmitir choques eléctricos de varios miles
de voltios por el cuerpo de un paciente que lleve un implante coclear. Las descargas eléctricas pueden
lesionar el tejido de la cóclea o provocar averías permanentes en el implante.
En una situación en la que peligre la vida, solo el equipo médico puede tomar una decisión. Si la vida del
paciente no corre peligro, póngase en contacto con Neurelec.
- Diatermia médica: Se prohíbe utilizar la diatermia por rayos electromagnéticos en pacientes que lleven
elementos implantados que contengan algún metal. Esto puede provocar daños irreversibles en los tejidos
(quemaduras en la cóclea) y en el implante. Sin embargo, puede considerar el uso de la diatermia por
ultrasonidos en partes del cuerpo que no sean la cabeza ni el cuello.
- Pruebas de diagnóstico y tratamiento con ultrasonidos: No debe exponer el implante a niveles terapéuticos
de energía ultrasónica. El dispositivo puede concentrar accidentalmente los ultrasonidos y resultar dañado.
- Radioterapia con radiación ionizante: Durante las sesiones de radioterapia, se desaconseja enérgicamente
irradiar directamente el área del implante. Una exposición masiva y directa del implante a dichas radiaciones
podría suponer una pérdida parcial, o total, de las funciones del implante. Estos daños no son forzosamente
observables.
- Radiación electromagnética no ionizante:
- Resonancia magnética (IRM): El implante Digisonic
®
SP contiene un imán permanente. Una exploración de
resonancia magnética o la aplicación de un fuerte campo magnético en el área del implante, puede dañarlo o
provocar lesiones en el paciente. Sin embargo, es posible realizar una exploración de resonancia magnética
de 1,5 Tesla si se siguen estas recomendaciones. En este caso, el radiólogo debe rellenar un formulario de
exploración, disponible en el sitio Web www.neurelec.com.
Consulte el manual de funcionamiento del procesador para obtener información adicional.
38

10. INSTRUCCIONES DE FUNCIONAMIENTO
¡Atención!
Electrocirugía: Una vez colocado el implante en su sitio, el resto de la intervención quirúrgica no debe incluir
el uso de instrumentos quirúrgicos monopolares. Estos instrumentos pueden crear campos de radiofrecuencia
de gran tensión eléctrica que podrían dañar el implante Se pueden emplear escalpelos eléctricos bipolares
mientras no se usen cerca del implante coclear ni entren en contacto con el mismo.
Gestión preoperatoria
- Antes de realizar el primer implante de Digisonic
técnicas del implante coclear Digisonic
®
SP y con su técnica quirúrgica.
®
, el cirujano debe familiarizarse con las especicaciones
- Antes de la implantación, debe informar a los pacientes de las ventajas de un implante coclear y de sus
posibles riesgos (ver §7).
Gestión intraoperatoria
- Ubicación de la incisión y colocación del receptor: Antes de realizar la incisión en el colgajo cutáneo, se
recomienda determinar el sitio óptimo del sistema implantado. Para ello, la ubicación de la incisión debe tener
en cuenta el hecho de que el implante no debe colocarse por debajo del pabellón auditivo salvo a una distancia
suciente del mismo como para que el paciente pueda llevar el procesador retroauricular sin que existan
conictos con la antena externa. Además, la línea de incisión debe estar lo sucientemente lejos del implante
como para evitar una extrusión o una infección posoperatoria. Se recomienda usar un lápiz dermográco estéril
para dibujar la línea de incisión retroauricular aproximadamente a 1 cm de la hendidura retroauricular y a unos
2 cm del pabellón auditivo. Estas ubicaciones pueden determinarse utilizando la plantilla del implante y la
plantilla del procesador (suministrados aparte mediante pedido) situadas sobre la oreja.
Tras realizar la incisión, use la plantilla del implante para preparar la ubicación necesaria para la correcta
colocación del receptor. Debe comprobar que la supercie del hueso sea sucientemente plana para alojar
después el receptor en su sitio con facilidad mediante los tornillos.
- Manipulación del implante: Extraiga el implante del envase solo tras completar los procedimientos
quirúrgicos estándares para iniciar la cocleostomía. Abra el envase externo asegurándose de no dañar el
implante. Después, corte los hilos de sutura sujetando el implante en su lugar y retírelo con cuidado del soporte
de implante estéril. Evite tocar o doblar el conjunto de electrodos. No utilice instrumentos quirúrgicos alados
que puedan dañar el conjunto de electrodos.
®
- Orientación del implante: El lado grabado del implante Digisonic
SP (NEURELEC, ABAJO) no se debe ver
en conguración de uso y por lo tanto debe girarse mirando hacia el cráneo. Esta placa de titanio contiene
información importante que identica el implante de este modo:
Información de
la supercie del
lado del hueso
Número de serie (SN):
DR: receptor Digisonic
00: año de fabricación
K: versión SP
1234: número incremental
Nombre del
fabricante
Tipo de implante (modelo):
El implante Digisonic® SP
se identica mediante la
inscripción DIGISONIC® SP
39

- Fijación del implante: No se requiere perforar el hueso para hacer el lecho del implante. Deslice el receptor
bajo el músculo temporal en la ubicación preparada utilizando la plantilla de silicona. Verique que el implante
está bien colocado y que no se mueve al apretar con el dedo. Solo hay que acceder a las aletas de montaje
del implante para jar el sistema. El receptor implantado debe estabilizarse para
evitar cualquier desplazamiento que podría crear tensiones y dañar los cables del
electrodo. Por lo tanto, se recomienda jarlo siempre con los dos tornillos de rosca
cortante del paquete y previamente situados en el soporte del implante. Siga estos
pasos para extraer los tornillos del soporte:
• Inserte el destornillador (suministrado con el kit quirúrgico inicial) en el tornillo
con presión axial rme.
• Desatornille el tornillo mientras lo extrae lentamente del soporte.
• Ahora el tornillo estará acoplado al destornillador y podrá utilizarse.
Coloque con cuidado el primer tornillo en uno de los insertos de titanio del sistema de jación. Se recomienda
sujetar el destornillador vertical al eje del implante para poder jarlo de manera más sencilla. Apriete bien
el tornillo hasta que note algo de resistencia y después retire gradualmente el destornillador con un ligero
movimiento circular. Compruebe que está apretado y repita el mismo procedimiento para el segundo tornillo.
Nota: Ni el cirujano ni otra persona no autorizada por Neurelec puede realizar cambios en el implante (como al
sistema de jación).
- Inserción del conjunto de electrodos: Oriente la matriz de electrodos-de modo que siga la espiral coclear
cuando se inserte. Guíe el extremo de la matriz de electrodos-hacia la base de la rampa timpánica utilizando la
pinza de inserción o unas pinzas pequeñas, a continuación, inserte gradualmente la matriz de electrodoscon la
mínima fuerza posible. Termine la inserción presionando las anillas de empuje extracoclear de silicona. Unavez
terminada la inserción, las anillas deben bloquear la cocleostomía. Puede jar la matriz de electrodospara evitar
el riesgo de migración. El método de jación y los puntos de jación dependerán del acceso quirúrgico y de la
preferencia del cirujano.
- Colocación del electrodo de referencia: Coloque el electrodo bola de referencia extracoclear contra el hueso
bajo el músculo temporal.
- Conrmación del funcionamiento del implante: Si mide la impedancia, antes o después de cerrar la incisión,
puede asegurarse de que el dispositivo implantado funciona correctamente.
11. EXPLANTACIÓN
Si sospecha que el implante Digisonic
®
SP funciona mal, un experto debe examinar el sistema con la ayuda del
soporte clínico de Neurelec. Si se conrma que el implante funciona mal y el equipo médico decide explantarlo,
es importante contactar con Neurelec, que le informará del procedimiento de explantación que debe seguir.
Esmuy importante solicitar un kit de explantación de Neurelec para poder devolver el sistema explantado y que
así el experto pueda examinar el dispositivo.
40

12. ESPECIFICACIONES TÉCNICAS DEL IMPLANTE DIGISONIC® SP
Función principal Implante coclear
Modo de estimulación Estimulación bifásica equilibrada
Velocidad de estimulación 24.000 pps máximo (pps: pulsos por segundo)
- Medición de la impedancia
- Medición de la potencia del implante
- Prueba de integridad*
Otras funciones disponibles
- EABR (Respuesta auditiva provocada del tronco
encefálico)*
- Reejo estapedial
Pruebas psicoacústicas (prueba de gap, etc.)*
* Con equipo asociado
Peso 10,5 g
Dimensiones
Diámetro 30,2 mm - Ancho: de 4,9 (borde) a 5,75
mm (centro)
Volumen 4 cm3
- Silicona LSR 40 shore A
- Silicona HCR 35 shore A y HCR 50 shore A
Material en contacto directo con el tejido humano
- Adhesivo de silicona
- Platino iridio 10%
- Titanio grado 2
- Titanio grado 5
13. CARACTERÍSTICAS DE RENDIMIENTO
Características de la señal de salida
(con resistencia de 1 kΩ)
Máx. 2 V -255 µs
V: de 0 a 4 V
I: de 10 µA a 2 mA
Δt: de 10 µs a 255 µs
Medición de impedancia Sí: valores normales: 500 Ω – 5k Ω
Nivel de seguridad IRM
Métodos recomendados para determinar
el funcionamiento correcto del sistema
Compatible con 1,5 Tesla. Consulte las recomendaciones
Sí. Medición de impedancia y prueba de integridad
(con equipo de recogida)
14. ESPECIFICACIONES Y CARACTERÍSTICAS DEL CONJUNTO DE ELECTRODOS
Conguraciones eléctricas monopolares Retorno común
Número de electrodos activos independientes 20
Tamaño reducido de cocleostomía 1 mm de diámetro
Forma general Rectilíneo con memoria de forma
Forma en el ápice Punta blanda
Forma en la base Dos anillas de empuje de 1,5 mm de diámetro
Materiales de los componentes
- Cable de conexión: platino iridio 10 %
- Electrodos de estimulación: platino iridio 10 %
Aislamiento PEI (poliesterimida)
- Longitud: 26 mm
- Diámetro en la base y en el ápice: 1,07 mm y 0,5 mm
Dimensiones
- Área de la supercie mínima y máxima de los
electrodos de estimulación: 0,39 mm² y 0,77 mm²
- Distancia entre electrodos: 0,7 mm
- Distancia máxima entre los electrodos proximal
y distal: 22,3 mm
- En caso de duda del rendimiento especicado, póngase en contacto con el servicio de atención al cliente de
Neurelec por su seguridad.
- Si tiene comentarios o si la información facilitada es incompleta, póngase en contacto con su fabricante o
distribuidor local.
Digisonic
®
SP es una marca registrada de Neurelec-Francia
41

42

OBSAH
1. POPIS ZARIADENIA .................................................................................................................. 44
Názov modelu ............................................................................................................................................... 44
Komerčná identikácia............................................................................................................................... 44
Popis zariadenia ............................................................................................................................................ 44
2. OBSAH BALENIA ...................................................................................................................... 44
3. ZOZNAM KOMPATIBILNÉHO PRÍSLUŠENSTVA ...................................................................... 44
4. SYMBOLY A ICH VÝZNAM ........................................................................................................ 44
5. INDIKÁCIE ................................................................................................................................. 44
6. ZDRAVOTNÉ KONTRAINDIKÁCIE ............................................................................................ 45
7. NEŽIADUCE VEDĽAJŠIE ÚČINKY ............................................................................................. 45
8. PREVENTÍVNE OPATRENIA ...................................................................................................... 45
9. UPOZORNENIE, INTERAKCIA S LIEČBOU A KLINICKÝMI VYŠETRENIAMI ............................ 46
Upozornenie .................................................................................................................................................. 46
Vysokoenergetické elektrické pole ........................................................................................................ 46
Elektroterapia ........................................................................................................................................ 46
Elektrochirurgia .................................................................................................................................... 46
Liečba elektrošokmi a debrilácia ................................................................................................. 46
Liečebná diatermia ...................................................................................................................................... 46
Diagnostické vyšetrenia a liečba pomocou ultrazvuku ................................................................. 46
Radiačná terapia s ionizačným žiarením .............................................................................................. 46
Neionizačné elektromagnetické žiarenie ............................................................................................ 46
10. NÁVOD NA POUŽITIE ............................................................................................................. 47
11. EXPLANTÁCIA......................................................................................................................... 49
12. TECHNICKÉ ŠPECIFIKÁCIE IMPLANTÁTU DIGISONIC® SP .................................................... 49
13. VÝKONNOSTNÉ CHARAKTERISTIKY ..................................................................................... 49
14. ŠPECIFIKÁCIE A CHARAKTERISTIKA ELEKTRÓDOVÉHO POĽA ........................................... 49
NMR (zobrazovanie nukleárnou magnetickou rezonanciou) .............................................. 46
Elektrochirurgia ............................................................................................................................................. 47
Predoperačný manažment ....................................................................................................................... 47
Intraoperačný manažment ....................................................................................................................... 47
Umiestnenie rezu a nastavenie polohy prijímača.................................................................... 47
Manipulácia s implantátom ............................................................................................................. 47
Orientácia implantátu ........................................................................................................................ 47
Pripojenie implantátu ........................................................................................................................ 48
Vloženie elektródového poľa .......................................................................................................... 48
Umiestnenie referenčnej elektródy .............................................................................................. 48
Overenie fungovania implantátu................................................................................................... 48
43

1. POPIS ZARIADENIA
• Názov modelu
Kochleárny implantát Digisonic® SP
• Komerčná identikácia
I-SP-SD
• Popis zariadenia
Digisonic® SP je viackanálový kochleárny implantát určený na rehabilitáciu pacientov s bilaterálnou závažnou (druhého stupňa)
až ťažkou percepčnou stratou sluchu. Tento transdermálny kochleárny implantát pracuje v spolupráci so záušným externým
procesorom (DIGI SP/SAPHYR®
SP) alebo so záušným mikroprocesorom s diaľkovou batériou (DIGI SP’K). Prostredníctvom
elektromagnetickej indukčnej väzby prenáša externá anténa akustický signál spracovaný procesorom do implantátu Digisonic®
SP implantovaného pod kožu za ušným lalokom.
Digisonic® SP obsahuje elektródové pole s 20 elektródami, ktoré je zasunuté do kochley (vnútorné ucho). Každá elektróda
stimuluje inú skupinu vlákien sluchového nervu a je pridružená k určitému frekvenčnému pásmu zvukového signálu, ktorý
spracováva externý procesor. Implantát a externá anténa obsahujú magnet; externá anténa sa preto udržiava na mieste
vzhľadom na implantát prostredníctvom magnetickej príťažlivej sily. Digisonic® SP neobsahuje svoj vlastný elektrický napájací
zdroj; energiu potrebnú na svoje fungovanie prijíma prostredníctvom elektromagnetickej indukčnej väzby. Preto, ak externá
anténa nie je umiestnená správne vzhľadom na implantát Digisonic® SP, implantát je pasívny.
2. OBSAH BALENIA
1 implantát Digisonic® SP (I-SP-SD), 1 silikónová šablóna implantátu, 1 prípojný systém, 1 identikačná karta nositeľa
asprievodná dokumentácia.
3. ZOZNAM KOMPATIBILNÉHO PRÍSLUŠENSTVA
Implantát sa dodáva s nasledujúcim príslušenstvom:
• 1 silikónová šablóna implantátu, ktorá sa používa počas chirurgického zákroku na overenie správneho umiestnenia
implantátu pod kožou.
• 2 samorezné skrutky určené na xáciu implantátu na mieste. Nevyžadujú žiadne predvŕtanie.
4. SYMBOLY A ICH VÝZNAM
Katalógová referencia
Metóda sterilizácie: etylénoxid. Výrobok sa
dodáva sterilný.
Zariadenie na jedno použitie, nepoužívajte
opakovane.
SKLADOVANIE: skladujte na chladnom
a suchom mieste. Skladovacia teplota
od –20°C do+50°C.
Dôležité. Prečítajte si sprievodnú dokumentáciu.
Udržujte vlhkosť na úrovni od 15% do 75%.
Dátum výroby
Kód šarže
Krehké; manipulujte opatrne Dátum spotreby
Nepoužívajte, ak je poškodené balenie Sériové číslo
Nesterilizujte opakovane Výrobca
Odpadové elektrické a elektronické zariadenia
(OEEZ)
Návod na použitie
5. INDIKÁCIE
Viackanálový kochleárny implantát Digisonic® SP je určený na rehabilitáciu pacientov s ťažkou (2.stupňa) až úplnou
obojstrannou stratou sluchu s rečovou diskrimináciou menšou ako 50% pri 60dB HL vo voľnom poli s použitím načúvacieho
aparátu (vyžadujúcich profesionálne vyjadrenie lekára).
44

6. ZDRAVOTNÉ KONTRAINDIKÁCIE
Kochleárny implantát Digisonic® SP je kontraindikovaný u pacientov s percepčnou stratou sluchu sprevádzanou rozsiahlymi
léziami v slimáku (závažná deformácia slimáka, zlomenina skalnej časti spánkovej kosti, rozsiahla osikácia slimáka),
nasluchovom nerve (axonálna neuropatia, nádor v blízkosti sluchového nervu alebo na ňom, ako napríklad neurinóm, úplne
poškodenie obidvoch sluchových nervov), závažnými anomáliami sluchovej dráhy, akútnymi alebo chronickými ťažkosťami
stredného ucha (vrátane perforácie bubienka), u psychicky nestabilných pacientov a pacientov alergických na materiály,
zktorých je implantát vyrobený (silikón, platina-irídium, titán). Môžu byť odporučené iné typy implantátov..
7. NEŽIADUCE VEDĽAJŠIE ÚČINKY
Pre pacientov spĺňajúcich indikácie predstavuje implantácia obvyklé riziká spojené s chirurgickým zákrokom (účinky celkovej
anestézie, infekcie atď.), ktoré sú nezávislé od samotného výrobku. Existuje však aj riziko, že telo pacienta odmietne implantát
alebo jeho súčasť; toto riziko bolo znížené použitím biologicky kompatibilných materiálov v jeho konštrukcii.
Komplikácie spojené s operačným zavedením kochleárneho implantátu (dočasná alebo trvalá paralýza tváre, riziko
meningeálneho dráždivého syndrómu, zmeny chuti, závrat, ušný šelest atď.) sú zriedkavé, ale je nutné ich pozorne zvážiť.
Jedôležité informovať každého kandidáta na implantáciu kochleárneho implantátu o týchto potenciálnych rizikách. Pacientom
treba poskytnúť špecické informácie o symptómoch a počiatočných príznakoch meningeálneho dráždivého syndrómu.
Vsúlade so súčasnými odporúčaniami sa dôrazne odporúča aj očkovanie proti pneumokokom.
Po umiestnení implantátu pretrvávajú niektoré riziká, ktoré môžu viesť k explantácii. Explantácia si vyžaduje ďalší chirurgický
zákrok pri celkovej anestézii. Explantácia môže byť nutná v nasledujúcich prípadoch:
- Zdravotné komplikácie
- Porucha implantátu
- Posunutie zariadenia v dôsledku úrazu
- Vytlačenie implantátu
Tieto potenciálne problémy sa vyhodnocovali počas vývoja výrobku a materiály a konštrukcia implantátu boli zvolené tak, aby
sa minimalizovali tieto riziká.
V súčasnosti nie sú známe dlhodobé účinky v dôsledku traumy spojenej s vložením elektród a chronickou elektrickou
stimuláciou. Tieto účinky môžu zahŕňať osikáciu kochley a degeneráciu nervových vlákien a môžu si vyžadovať výmenu
implantátu alebo viesť k zníženiu odozvy na stimuláciu.
8. PREVENTÍVNE OPATRENIA
Informácie, ktoré treba poskytnúť pacientovi:
- Informujte pacienta o prínosoch kochleárneho implantátu a tiež o nežiaducich vedľajších účinkoch, ktoré sa môžu vyskytnúť
(pozrite si §7).
- Je nutné vyplniť celú priloženú identikačnú kartu a dať ju nositeľovi.
- Informujte pacienta, že pred akýmkoľvek lekárskym vyšetrením či liečbou musí predložiť identikačnú kartu.
- Poraďte pacientovi, aby si pozorne prečítal pokyny pre používateľov priložené k externému procesoru, najmä časť súvisiacu
s výstrahami týkajúcimi sa používania.
- Povedzte pacientovi, aby v prípade zlyhania alebo poruchy systému kochleárneho implantátu kontaktoval implantačné
centrum.
- Kontaktné športy (rugby, box a podobne) rozhodne neodporúčame, keďže silné nárazy do tejto oblasti s implantátom môžu
poškodiť implantát.
45

- Potápanie s potápačským prístrojom: Rekreačné potápanie s potápačským prístrojom sa neodporúča do hĺbky väčšej ako
20 metrov. Nadmerný tlak môže poškodiť implantát. Rozhodne sa neodporúča ani profesionálne hĺbkové potápanie v mori,
pretože na implantát sa neposkytuje záruka pri opakovanom vystavení vysokému tlaku.
- Priestory s obmedzeným prístupom: Pred vstupom do priestorov s obmedzeným prístupom (miestnosť na vyšetrenie
nukleárnou magnetickou rezonanciou, prechodové detektory kovov, 3D skenovacie kabínky a podobne) sa poraďte s lekárom.
9. UPOZORNENIE, INTERAKCIA S LIEČBOU A KLINICKÝMI VYŠETRENIAMI
- Upozornenie: Súčasti implantovateľných zariadení by sa nemali znova používať, ak už boli predtým implantované inému
pacientovi.
- Vysokoenergetické elektrické pole:
- Elektroterapia: Pri elektroterapii sa môžu aplikovať prúdy s rôznou intenzitou. Používanie elektroterapeutických techník
využívajúcich vysokonapäťové elektrické prúdy je zakázané z dôvodu rizika poškodenia systému implantátu. Môže sa zvážiť
nízkonapäťová elektroterapia, ale iba v prípade, ak elektródy nie sú umiestnené v oblastiach hlavy alebo krku.
- Elektrochirurgia: Nepoužívajte jednopólové elektrochirurgické inštrumenty. Tieto inštrumenty môžu vytvárať
rádiofrekvenčné polia s elektrickými napätiami, ktoré môžu vytvoriť väzbu medzi hrotom inštrumentu a elektródovým
poľom. Indukované prúdy môžu poškodiť kochleárne tkanivo alebo spôsobiť trvalé poškodenie implantátu. Hneď po
vybratí kochleárneho implantátu z obalu v operačnej sále sa musia vypnúť všetky jednopólové skalpely, aby sa zabránilo
poškodeniu implantátu. Bipolárne elektrické skalpely sa však môžu používať, pokiaľ nie sú v blízkosti kochleárneho
implantátu ani v priamom kontakte s ním.
- Liečba elektrošokmi a debrilácia: U pacientov s kochleárnym implantátom sa neodporúča aplikácia elektrických
šokov s napätím niekoľko tisíc voltov cez telo. Elektrické šoky môžu spôsobiť poškodenie tkaniva v kochley alebo trvalé
poškodenie implantátu.
V situácii s ohrozením života môže urobiť rozhodnutie len zdravotnícky tím. Ak situácia neohrozuje život pacienta,
kontaktujte spoločnosť Neurelec.
- Liečebná diatermia: U pacientov s implantátmi obsahujúcimi kov sa nemôže používať elektromagnetická diatermia. Môže
to spôsobiť nezvratné poškodenie tkaniva (popálenie kochley) alebo implantátu. Na oblastiach tela, ktoré sa nedotýkajú
hlavy ani krku, je však možné zvážiť použitie ultrazvukovej diatermie.
- Diagnostické vyšetrenia a liečba pomocou ultrazvuku: Tento implantát nesmie byť vystavený terapeutickým úrovniam
ultrazvukovej energie. V tomto zariadení sa môže nevhodne sústrediť ultrazvuk a poškodiť ho.
- Radiačná terapia s ionizačným žiarením: Počas liečby žiarením dôrazne odporúčame, aby oblasť s implantátom nebola
priamo ožarovaná. Priame, masívne vystavenie implantátu žiareniu by mohlo spôsobiť čiastočnú alebo úplnú stratu funkčnosti
implantátu. Toto poškodenie nemusí byť okamžite pozorovateľné.
- Neionizujúce elektromagnetické žiarenie:
- NMR (zobrazovanie nukleárnou magnetickou rezonanciou): Implantát Digisonic® SP obsahuje permanentný magnet.
Vyšetrenie pomocou NMR alebo silné magnetické pole aplikované v blízkosti implantátu môže poškodiť implantát a/alebo
poraniť pacienta. Ak sa však dodržia odporúčania, je možné vykonať vyšetrenie pomocou NMR s intenzitou 1,5 Tesla. Vtakomto
prípade musí rádiológ vyplniť formulár o vyšetrení, ktorý je k dispozícii na webovej stránke www.neurelec.com.
Ďalšie informácie nájdete v návode na použitie procesora.
46

10. NÁVOD NA POUŽITIE
Pozor!
Elektrochirurgia: Keď sa implantát uloží na svoje miesto, po zvyšok chirurgického zákroku sa nesmú použiť žiadne
jednopólové elektrochirurgické inštrumenty. Tieto inštrumenty môžu vytvárať rádiofrekvenčné polia s elektrickými napätiami,
ktoré by mohli poškodiť implantát. Bipolárne elektrické skalpely sa môžu používať, ak nie sú v blízkosti kochleárneho
implantátu ani s ním neprichádzajú do kontaktu.
Predoperačný manažment
- Pred vykonaním prvej implantácie zariadenia Digisonic® SP sa chirurg musí oboznámiť s konkrétnymi technickými
špecikáciami kochleárneho implantátu Digisonic® SP a príslušnou chirurgickou technikou.
- Pred implantáciou treba pacientov informovať o prínosoch kochleárneho implantátu a jeho možných sekundárnych rizikách
(pozrite si §7).
Intraoperačný manažment
- Umiestnenie rezu a nastavenie polohy prijímača: Pred narezaním kože sa odporúča určiť optimálne miesto pre
implantovaný systém. Umiestnenie rezu by tak malo zohľadňovať fakt, že implantát by nemal byť pod ušným lalokom, ale
v dostatočnej vzdialenosti, aby pacient mohol nosiť procesor za uchom bez koniktu s polohou externej antény. Okrem
toho musí byť línia rezu dostatočne ďaleko od implantátu, aby sa zabránilo riziku pooperačného vytlačenia alebo infekcie.
Preto sa odporúča použitím sterilného kožného značkovača vyznačiť odstup línie retroaurikulárneho rezu približne 1cm od
retroaurikulárneho záhybu a polohu prijímača približne 2 cm od ušného laloku. Tieto miesta možno určiť pomocou šablóny
implantátu a šablóny procesora (dodávajú sa zvlášť na požiadanie), ktoré sa nasadia na ucho.
Po vykonaní rezu pripravte pomocou šablóny implantátu miesto potrebné na správne umiestnenie prijímača. Treba
skontrolovať povrch kosti, aby sa zabezpečilo, že je dostatočne plochá na následné pripevnenie prijímača pomocou skrutiek.
- Manipulácia s implantátom: Implantát vyberte z predajného obalu až po dokončení štandardných chirurgických postupov
až po kochleostómiu. Otvorte vonkajší obal a skontrolujte, či implantát nie je poškodený. Po opatrnom narezaní nití stehov,
ktoré držia implantát na mieste, opatrne vyberte implantát z jeho sterilného držiaka. Nedotýkajte sa elektródového poľa ani ho
neohýbajte. Nepoužívajte ostré chirurgické inštrumenty, ktoré by mohli poškodiť elektródové pole.
Orientácia implantátu: Gravírovaný povrch implantátu Digisonic® SP (NEURELEC, BOTTOM) nemá byť viditeľný v použitej
kongurácii, a preto má byť otočený smerom k lebke. Táto kovová titánová doštička obsahuje nasledujúce dôležité informácie,
ktoré identikujú implantát:
Povrch na strane s
kosťou obsahujúci
informácie
Sériové číslo (SN):
DR: Digisonic Receiver
(prijímač Digisonic)
00: rok výroby
K: verzia SP
1234: prírastkové číslo
47
Názov výrobcu
Typ implantátu (model):
Implantát Digisonic® SP
je označený nápisom
DIGISONIC® SP

- Nasadenie implantátu: Pre lôžko implantátu nie je potrebné vŕtať do kosti. Jednoducho zasuňte prijímač pod spánkový sval
do pripraveného miesta pomocou silikónovej šablóny. Zabezpečte, aby bol implantát správne umiestnený a neposúval sa, keď
zatlačíte prstom. Na upevnenie systému sa vyžaduje iba prístup k montážnym jazýčkom implantátu. Implantovaný prijímač
je nutné stabilizovať, aby sa zabránilo možnej dislokácii, ktorá by mohla vytvoriť pnutie a
viesť k možnému poškodeniu drôtov elektród. Preto sa odporúča zaistiť ho na svojom mieste
pomocou dvoch samorezných skrutiek, ktoré sú súčasťou balenia a nachádzajú sa pripravené
v držiaku implantátu. Podľa doleuvedených krokov vyberte skrutky z držiaka:
• Skrutkovač (dodaný s pôvodnou chirurgickou súpravou) vložte do skrutky, pričom
aplikujte pevný axiálny tlak.
• Skrutku odskrutkujte a súčasne ju pomaly vyťahujte z držiaka.
• Skrutka je teraz pripevnená k skrutkovaču a možno ju použiť.
Zľahka vložte prvú skrutku do jednej z titánových vložiek xačného systému. Pri upevňovaní sa odporúča držať skrutkovač
kolmo na os implantátu, aby sa uľahčilo nasadenie. Dotiahnite skrutku, až kým nebudete cítiť odpor, a potom postupne
uvoľňujte skrutkovač jeho miernym otáčaním. Skontrolujte, či je zaistená a potom zopakujte rovnaký postup s druhou skrutkou.
Poznámka: Chirurg ani iná osoba, ktorá nebola oprávnená spoločnosťou Neurelec, nesmie vykonávať úpravy implantátu
(napríklad na xačnom systéme).
- Vloženie elektródového poľa: Orientujte elektródové pole tak, aby sa vložilo pozdĺž kochleárnej špirály. Veďte koniec
elektródového poľa smerom k základni scala tympani pomocou zasúvacej pinzety alebo malých klieští a potom postupne
zasuňte zväzok elektród s vynaložením čo najmenšej sily. Zavedenie dokončite zatlačením na silikónové extrakochleárne
prítlačné krúžky. Po dokončení vloženia by mali krúžky zablokovať kochleostómiu. Na zabránenie rizika posunutia možno
zväzok elektród pripevniť. Spôsob pripevnenia a pripevňovacie body budú závisieť od chirurgického prístupu a preferencií
chirurga.
- Umiestnenie referenčnej elektródy: Extrakochleárnu referenčnú guľovú elektródu umiestnite oproti kosti pod spánkovým
svalom.
- Overenie fungovania implantátu: Správne fungovanie implantovaného zariadenia možno overiť meraniami impedancie
pred uzavretím rezu alebo po ňom.
11. EXPLANTÁCIA
Ak existuje podozrenie na poruchu implantátu Digisonic® SP, systém musí preskúmať odborník za pomoci klinickej
podpory spoločnosti Neurelec. Ak sa potvrdí porucha implantátu a lekársky tím sa rozhodne zariadenie explantovať, je
dôležité kontaktovať spoločnosť Neurelec. Tá vás bude informovať o postupe explantácie, ktorý treba dodržať. Dôležité je
predovšetkým vyžiadať si od spoločnosti Neurelec explantačnú súpravu, aby bolo možné zaslať späť explantovaný systém a
umožniť tak jeho odborné preskúmanie.
48

12. TECHNICKÉ ŠPECIFIKÁCIE IMPLANTÁTU DIGISONIC® SP
Primárna funkcia Kochleárny implantát
Stimulačný režim Vyvážená dvojfázová stimulácia
Rýchlosť stimulácie maximálne 24000 p/s (p/s: impulzov za sekundu)
- Meranie impedancie
- Meranie výkonu implantátu
- Test integrity*
Ďalšie dostupné funkcie
- EABR (Evoked Auditory Brainstem Response, vyvolaná
sluchová odpoveď mozgového kmeňa)*
- Stapediový reex
Psychoakustické testy (gap test a podobne)*
* so súvisiacim zariadením
Hmotnosť 10,5 g
Rozmery
Priemer 30,2 mm – hrúbka: v rozsahu od 4,9 (okraj)
po 5,75 mm (stred)
Objem 4 cm3
- Silikón LSR 40 typu A
- Silikónová podpera HCR 35 A a HCR 50 A
Materiál v priamom kontakte s ľudským tkanivom
- Silikónové lepidlo
- zliatina platiny a irídia 10%
- Titán, trieda 2
- Titán, trieda 5
13. VÝKONNOSTNÉ CHARAKTERISTIKY
Charakteristiky výstupného signálu (pri odpore 1 kΩ) Max. 2V–255µs
V: 0 až 4V
I: 10µA až 2mA
Δt: 10µs až 255µs
Meranie impedancie Áno: Normálne hodnoty: 500Ω – 5kΩ
Bezpečná úroveň NMR Kompatibilné do intenzity 1,5 Tesla. Pozrite si odporúčania
Odporúčané metódy na určenie správneho fungovania
systému
Áno. Meranie impedancie a test integrity
(so zberným zariadením)
14. ŠPECIFIKÁCIE A CHARAKTERISTIKA ELEKTRÓDOVÉHO POĽA
Jednopólové elektrické kongurácie Spoločné uzemnenie
Počet nezávislých aktívnych elektród 20
Znížená veľkosť kochleostómie Priemer 1 mm
Všeobecný tvar Rovný s tvarovou pamäťou
Tvar pri hrote Mäkká špička
Tvar pri základni Dva prítlačné krúžky s priemerom 1,5 mm
Konštrukčné materiály
- Spojovací drôt: zliatina platiny a irídia 10%
- Stimulačné elektródy: zliatina platiny a irídia 10%
Izolácia PEI (polyesterimid)
- Dĺžka: 26mm
- Priemer pri základni a pri hrote: 1,07 mm a 0,5 mm
Rozmery
- Minimálna a maximálna plocha povrchu stimulačných
elektród: 0,39 mm² a 0,77 mm²
- Vzdialenosť medzi elektródami: 0,7 mm
- Maximálna vzdialenosť medzi proximálnou a distálnou
elektródou: 22,3 mm
- V prípade pochybností o špecikovaných parametroch kontaktujte z dôvodu vlastnej bezpečnosti zákaznícky servis
spoločnosti Neurelec.
- Ak chcete poskytnúť nejaký komentár alebo ak sú poskytnuté informácie neúplné, kontaktujte výrobcu alebo miestneho
distribútora.
Digisonic®
SP je registrovaná ochranná známka spoločnosti Neurelec-France
49

50

SPIS TREŚCI
1. OPIS URZADZENIA ................................................................................................................... 52
Nazwa modelu .............................................................................................................................................. 52
Identykacja handlowa .............................................................................................................................. 52
Opis urządzenia ............................................................................................................................................ 52
2. ZAWARTOŚĆ OPAKOWANIA .................................................................................................... 52
3. WYKAZ KOMPATYBILNYCH AKCESORIÓW ............................................................................. 52
4. SYMBOLE I ICH ZNACZENIE ..................................................................................................... 52
5. WSKAZANIA ............................................................................................................................. 52
6. PRZECIWWSKAZANIA MEDYCZNE .......................................................................................... 53
7. SKUTKI UBOCZNE .................................................................................................................... 53
8. ŚRODKI OSTROŻNOŚCI ............................................................................................................ 53
9. UWAGA, ODDZIAŁYWANIE NA ZABIEGI I BADANIA KLINICZNE .......................................... 54
Uwaga .............................................................................................................................................................. 54
Wysokoenergetyczne pole elektryczne ............................................................................................... 54
Elektroterapia ........................................................................................................................................ 54
Elektrochirurgia .................................................................................................................................... 54
Terapia elektrowstrząsami i debrylacja ..................................................................................... 54
Diatermia medyczna ................................................................................................................................... 54
Testy diagnostyczne i leczenie z wykorzystaniem ultradźwięków ............................................ 54
Radioterapia promieniowaniem jonizującym ................................................................................... 54
Elektromagnetyczne promieniowanie niejonizujące ..................................................................... 54
10. INSTRUKCJA UŻYTKOWANIA ................................................................................................ 55
11. EKSPLANTACJA ...................................................................................................................... 57
12. SPECYFIKACJE TECHNICZNE IMPLANTU DIGISONIC® SP .................................................... 57
13. CHARAKTERYSTYKA WYDAJNOŚCI ...................................................................................... 57
14. SPECYFIKACJE I CHARAKTERYSTYKA NOŚNIKA ELEKTROD .............................................. 57
MRI (Obrazowanie za pomocą rezonansu magnetycznego) ............................................... 54
Elektrochirurgia ............................................................................................................................................. 55
Postępowanie przedoperacyjne ............................................................................................................. 55
Postępowanie śródoperacyjne ................................................................................................................ 55
Ustalanie miejsce nacięcia i pozycjonowanie odbiornika .................................................... 55
Otwieranie opakowania z implantem .......................................................................................... 55
Położenie implantu ............................................................................................................................. 55
Mocowanie implantu ......................................................................................................................... 56
Wprowadzanie nośnika elektrod ................................................................................................... 56
Pozycjonowanie elektrody odniesienia ....................................................................................... 56
Potwierdzenie prawidłowego funkcjonowania implantu .................................................... 56
51

1. OPIS URZADZENIA
• Nazwa modelu
Implant ślimakowy Digisonic® SP
• Identykacja handlowa
I-SP-SD
• Opis urządzenia
Wielokanałowy implant ślimakowy Digisonic® SP przeznaczony jest do rehabilitacji pacjentów z obustronną, ciężką (drugiego
stopnia) i głęboką utratą słuchu typu odbiorczego. Ten przezskórny implant ślimakowy działa w połączeniu z zausznym
procesorem zewnętrznym (DIGI SP/ SAPHYR®
SP) lub z zausznym procesorem typu mikro z baterią przenośną (DIGI SP’K).
Poprzez sprzężenie elektromagnetyczne, antena zewnętrzna przenosi sygnał akustyczny przetwarzany przez procesor do
implantu Digisonic® SP wszczepionego pod skórą, za małżowiną uszną.
Implant Digisonic® SP zawiera nośnik 20 elektrod, który wprowadzany jest do ślimaka (ucha wewnętrznego). Każda elektroda
stymuluje inną wiązkę włókien nerwowych nerwu słuchowego i przypisany jest jej odpowiedni zakres częstotliwości sygnału
dźwiękowego, który jest przetwarzany przez procesor zewnętrzny. Implant i antena zewnętrzna zawierają magnes; antena
zewnętrzna jest więc utrzymywana w odpowiednim miejscu względem implantu dzięki przyciąganiu magnetycznemu.
Implant Digisonic® SP nie posiada własnego źródła zasilania elektrycznego; energię niezbędną do działania otrzymuje poprzez
sprzężenie elektromagnetyczne. Zatem jeśli antena zewnętrzna jest ustawiona nieprawidłowo w stosunku do implantu
Digisonic® SP, implant jest nieaktywny.
2. ZAWARTOŚĆ OPAKOWANIA
1 Implant Digisonic® SP (I-SP-SD), 1 fantom implantu wykonany z silikonu, 1 system mocowania, 1 karta identykacyjna
pacjenta z implantem ślimakowym oraz dokumentacja towarzysząca.
3. WYKAZ KOMPATYBILNYCH AKCESORIÓW
Implant dostarczany jest z następującymi akcesoriami:
• 1 silikonowy fantom implantu, stosowany podczas operacji do werykacji prawidłowego pozycjonowania implantu pod
skórą.
• 2 samogwintujące wkręty stosowane do mocowania implantu we właściwej pozycji; nie wymagają żadnego nawiercania.
4. SYMBOLE I ZNACZENIA
Nr katalogowy Ważne. Przeczytać załączoną dokumentację
Metoda sterylizacji: tlenek etylenu.
Produkt dostarczany sterylny
Urządzenie jednorazowego użytku, nie używać
ponownie
PRZECHOWYWANIE: przechowywać w suchym
i chłodnym miejscu. Temperatura
przechowywania od -20°C do +50°C.
Utrzymać poziom wilgotności pomiędzy
15% i 75%.
Data produkcji
Kod partii
Delikatny; obchodzić się ostrożnie Data ważności
Nie używać, jeśli opakowanie jest uszkodzone Numer seryjny
Nie sterylizować ponownie Producent
Traktować jak odpady elektryczne
i elektroniczne (WEEE)
Instrukcja użytkowania
5. WSKAZANIA
Wielokanałowy implant ślimakowy Digisonic® SP przeznaczony jest do rehabilitacji pacjentów z obustronną, ciężką (2-giego
stopnia) i całkowitą utratą słuchu oraz rozumieniem mowy w stopniu niższym niż 50% przy 60 dB HL, w otwartej przestrzeni z
zastosowaniem aparatu słuchowego (niezbędna jest specjalistyczna opinia lekarska).
52

6. PRZECIWWSKAZANIA MEDYCZNE
IImplant ślimakowy Digisonic® SP nie jest wskazany u pacjentów z niedosłuchem odbiorczym, któremu towarzyszy znaczne
uszkodzenie ślimaka (poważne wady rozwojowe ślimaka, złamanie części skalistej kości skroniowej, znaczące kostnienie
ślimaka), nerwu słuchowego (neuropatia aksonalna, nowotwór w pobliżu nerwu lub na nerwie słuchowym np. nerwiak
osłonkowy, całkowite uszkodzenie obu nerwów słuchowych) poważne anomalie dróg słuchowych, ostre lub przewlekłe
stany chorobowe ucha środkowego (w tym perforacja błony bębenkowej), a także u pacjentów niestabilnych psychicznie lub
mających alergię kontaktową na implantowane materiały (silikon, platyna, iryd, tytan). W takich przypadkach, zalecane są inne
rodzaje implantów.
7. SKUTKI UBOCZNE
Pacjenci, którzy spełniają kryteria kwalikacji do implantacji muszą zaakceptować standardowe ryzyko związane z operacją
(skutki działania znieczulenia ogólnego, infekcje itp.), które jest niezależne od zastosowanego produktu. Istnieje również
ryzyko, iż organizm pacjenta odrzuci implant lub część implantu. Ryzyko to zmniejszono dzięki zastosowaniu w konstrukcji
materiałów biokompatybilnych.
Powikłania związane z techniką operacyjną wszczepienia implantu ślimakowego (czasowe lub stałe porażenie nerwu
twarzowego, zespół podrażnienia opon mózgowo-rdzeniowych, zmiany smaku, zawroty głowy, szum w uszach itp.) występują
rzadko, jednak należy je dokładnie rozważyć. Ważne jest, aby poinformować o tych zagrożeniach każdego potencjalnego
kandydata do otrzymania implantu. Należy przekazać pacjentowi szczegółowe informacje odnośnie objawów i pierwszych
oznak zespołu podrażnienia opon mózgowo-rdzeniowych. Zgodnie z aktualnymi zaleceniami, powinno się również wykonać
szczepienie przeciwko pneumokokom.
Gdy implant jest wszczepiony, nadal istnieją zagrożenia, które mogą doprowadzić do eksplantacji. Eksplantacja wymaga
kolejnej interwencji chirurgicznej w znieczuleniu ogólnym. Do eksplantacji może dojść w poniższych przypadkach:
– Powikłanie medyczne
– Wadliwe funkcjonowanie implantu
– Przemieszczenie urządzenia w wyniku urazu
– Odrzucenie implantu
Te potencjalne problemy poddawano analizie na etapie projektowania produktu, a materiały i projekt implantu zostały
wybrane tak, by zminimalizować ryzyko.
Długoterminowe skutki urazu związanego z wprowadzeniem elektrod oraz przewlekłej stymulacji elektrycznej nie są znane w
chwili obecnej. Skutki te mogą obejmować kostnienie ślimaka lub zwyrodnienie włókien nerwowych i konieczność wymiany
implantu lub doprowadzić mogą do zmniejszenia odpowiedzi na stymulację.
8. ŚRODKI OSTROŻNOŚCI
Informacje, które należy przekazać pacjentowi:
- Należy poinformować pacjenta o korzyściach wynikających z wszczepienia implantu oraz o możliwości wystąpienia działań
ubocznych (patrz rozdz.7).
- Dostarczona karta identykacyjna musi zostać w całości wypełniona i przekazana pacjentowi z implantem ślimakowym.
- Należy poinformować pacjenta, że powinien okazać kartę identykacyjną przed każdym badaniem lekarskim lub zabiegiem.
- Zalecić pacjentowi, aby dokładnie zapoznał się z instrukcją obsługi dostarczoną z zewnętrznym procesorem, w szczególności
z częścią omawiającą ostrzeżenia dotyczące użytkowania.
- Należy poinformować pacjenta, aby skontaktował się z ośrodkiem implantacji, w przypadku usterki lub nieprawidłowego
działania systemu implantu ślimakowego.
- Zdecydowanie odradza się uprawianie sportów kontaktowych (rugby, boks itp.), ponieważ silne uderzenia w okolice
implantu mogą uszkodzić implant.
53

- Nurkowanie z akwalungiem: Nie zaleca się rekreacyjnego nurkowania z akwalungiem na głębokości poniżej 20 m. Nadmierne
ciśnienie może uszkodzić implant. Poza tym, zdecydowanie odradzane jest uprawianie profesjonalnego nurkowania
głębokowodnego. Implant nie jest objęty gwarancją w przypadku wielokrotnych obciążeń związanych z wysokim ciśnieniem.
- Dostęp do stref zastrzeżonych: Należy skonsultować się z lekarzem przed wejściem do pomieszczeń o ograniczonym
dostępie (pokój badań MRI, bramka z wykrywaczami metalu, pomieszczenia, gdzie wykonuje się skanowanie 3D itp.).
9. UWAGA, ODDZIAŁYWANIE NA ZABIEGI I BADANIA KLINICZNE
- Uwaga: Wszczepialne części urządzenia nie mogą być użyte ponownie, jeżeli zostały wcześniej implantowane innemu
pacjentowi.
- Wysokoenergetyczne pole elektryczne:
- Elektroterapia: W elektroterapii można przesyłać prąd o różnej mocy. Stosowanie technik terapii prądem o wysokim
napięciu jest zabronione, ze względu na ryzyko uszkodzenia systemu implantu. Elektroterapia niskonapięciowa może być
stosowana tylko wtedy, gdy elektrody nie są umieszczone w pobliżu głowy lub szyi.
- Elektrochirurgia: Należy unikać korzystania z jednobiegunowych narzędzi elektrochirurgicznych. Narzędzia te mogą
wytwarzać pola elektromagnetyczne o częstotliwości radiowej z napięciami elektrycznymi, które mogą powodować
sprzężenie między końcówką przyrządu a nośnikiem elektrod. Indukowane prądy mogą uszkodzić tkanki ślimaka lub
spowodować trwałe uszkodzenie implantu. Zaraz po wyjęciu implantu ślimakowego z opakowania na sali operacyjnej,
należy wyłączyć wszelkie jednobiegunowe skalpele, aby uniknąć uszkodzenia implantu. Dopuszcza się stosowanie
dwubiegunowych skalpelów elektrycznych pod warunkiem, że nie będzie się to odbywać w pobliżu, ani w
bezpośrednim kontakcie z implantem ślimakowym.
- Terapia elektrowstrząsami i debrylacja: Nie zaleca się przesyłania impulsów elektrycznych o napięciu kilku tysięcy
woltów przez ciało pacjentów noszących implant ślimakowy. Elektrowstrząsy mogą spowodować uszkodzenie tkanek
ślimaka lub trwałe uszkodzenie implantu.
W sytuacji zagrożenia życia, decyzję może podjąć wyłącznie zespół medyczny. Jeżeli sytuacja nie stanowi zagrożenia dla
życia pacjenta, należy skontaktować się z rmą Neurelec.
- Diatermia medyczna: Diatermii elektromagnetycznej nie można stosować w przypadku pacjentów z implantami
zawierającymi metal. Może to spowodować nieodwracalne uszkodzenie tkanek (oparzenie ślimaka) lub implantu. Można
jednak rozważyć zastosowanie diatermii ultradźwiękowej na części ciała, które nie stykają się z głową lub szyją.
- Badania diagnostyczne i leczenie z wykorzystaniem ultradźwięków: Implantu nie należy wystawiać na działanie
ultradźwięków w zastosowaniach terapeutycznych. Urządzenie może w sposób niezamierzony, skupiać fale ultradźwiękowe
i ulec uszkodzeniu.
- Radioterapia przy użyciu promieniowania jonizującego: Podczas sesji radioterapii, zdecydowanie odradza się
bezpośrednie napromienianie obszaru implantu. Bezpośrednia, masywna ekspozycja implantu na promieniowanie mogłaby
doprowadzić do częściowej lub całkowitej utraty funkcji implantu. Uszkodzenie to nie musi być natychmiast zauważalne.
- Elektromagnetyczne promieniowanie niejonizujące:
- MRI (Obrazowanie za pomocą rezonansu magnetycznego): Implant Digisonic® SP zawiera magnes trwały. Badanie
MRI lub zastosowanie silnego pola magnetycznego w obszarze implantu może spowodować uszkodzenie implantu i/lub
uraz u pacjenta. Dopuszcza się jednak wykonanie badania MRI przy natężeniu pola 1,5 Tesli, przestrzegając zaleceń. W takim
przypadku, radiolog powinien wypełnić formularz badania, który jest dostępny na stronie www.neurelec.com.
Więcej informacji zamieszczono w instrukcji obsługi procesora.
54

10. INSTRUKCJA UŻYTKOWANIA
Proszę pamiętać!
Elektrochirurgia: Po wszczepieniu implantu, pozostała część zabiegu chirurgicznego nie powinna obejmować stosowania
jakichkolwiek jednobiegunowych narzędzi elektrochirurgicznych. Narzędzia te mogą tworzyć pola elektromagnetyczne o
częstotliwości radiowej, z napięciami elektrycznymi, które mogą uszkodzić implant. Dwubiegunowe skalpele elektryczne
mogą być stosowane pod warunkiem, że nie są używane w pobliżu implantu, ani nie mają kontaktu z implantem ślimakowym.
Postępowanie przedoperacyjne
- Przed wykonaniem wszczepienia implantu Digisonic® SP po raz pierwszy, operator powinien zapoznać się ze szczególnymi
specykacjami technicznymi implantu ślimakowego Digisonic® SP oraz ze związaną z nim techniką operacyjną.
- Przed implantacją, pacjenci powinni być poinformowani o korzyściach wynikających z zastosowania implantu ślimakowego
jak również o potencjalnych działaniach ubocznych (patrz rozdz.7).
Postępowanie śródoperacyjne
- Ustalanie miejsce nacięcia i pozycjonowanie odbiornika: Przed wykonaniem nacięcia płata skóry zaleca się
wyznaczenie optymalnego miejsca do wszczepienia systemu. Przy doborze lokalizacji nacięcia należy uwzględniać fakt, że
implant nie powinien być umieszczony pod małżowiną uszną, ale w wystarczająco dużej odległości, by pacjent mógł nosić
procesor za uchem, bez zakłócania pracy anteny zewnętrznej. Ponadto, linia nacięcia powinna być na tyle oddalona od
implantu, aby zapobiec ryzyku wypchnięcia lub wystąpienia infekcji pooperacyjnej. Zaleca się użycie jałowego ołówka do
skóry, w celu zaznaczenia zausznej linii nacięcia oddalonej o około1 cm od bruzdy zausznej, a także zaznaczenie położenia
odbiornika mniej więcej 2 cm od małżowiny ucha. Lokalizacje te można wyznaczyć używając fantomu implantu oraz fantomu
procesora (dostarczanych oddzielnie na życzenie) umieszczonych na uchu.
Po wykonaniu nacięcia, użyć fantom implantu, aby przygotować miejsce niezbędne do prawidłowego umieszczenia
odbiornika. Należy zbadać powierzchnię kości, aby upewnić się, że jest wystarczająco płaska, by później łatwiej umocować
odbiornik na miejscu przy pomocy wkrętów.
- Otwieranie opakowania z implantem: Wyjąć implant z opakowaniu handlowego dopiero po zakończeniu standardowych
procedur chirurgicznych, aż do rozpoczęcia kochleostomii. Otworzyć opakowanie zewnętrzne i upewnić się, że implant nie
jest uszkodzony. Po starannym przecięciu nitek szwów utrzymujących implant, delikatnie wyjąć implant z jałowego uchwytu.
Unikać dotykania i/lub zginania nośnika elektrod. Nie używać ostrych narzędzi chirurgicznych, które mogłyby uszkodzić nośnik
elektrod.
- Położenie implantu: Grawerowana strona implantu Digisonic® SP (NEURELEC, BOTTOM) nie powinna być widoczna w
konguracji do użycia i powinna być skierowana w stronę czaszki. Ta płytka tytanowa zawiera następujące, ważne informacje,
które identykują implant :
Informacja na
powierzchni od
strony kości
Numer seryjny (SN):
DR: Odbiornik Digisonic
00: rok produkcji
K: wersja SP
1234: numer przyrostowy
Nazwa
producenta
Typ implantu (model):
Implant Digisonic®
SP jest
identykowany na podstawie
napisu DIGISONIC® SP.
55

- Mocowanie implantu: Przy przygotowywaniu łoża implantu nie wymaga się frezowania kości. Wystarczy wsunąć odbiornik
pod mięsień skroniowy do miejsca przygotowanego przy pomocy fantomu implantu. Należy upewnić się, że implant jest
właściwie umiejscowiony i nie kołysze się po naciśnięciu palcem. Do zamocowania systemu wymaga się wyłącznie dostępu
do płytek montażowych implantu. Należy zamocować wszczepiony odbiornik, aby zapobiec
ewentualnym przemieszczeniom, które mogłyby wywołać naprężenie i doprowadzić do
uszkodzenia przewodów elektrod. Zaleca się więc umocowanie implantu za pomocą dwóch
wkrętów samogwintujących dostarczonych w opakowaniu i wstępnie umieszczonych w
uchwycie implantu. Aby wyjąć wkręty z uchwytu, należy wykonać poniższe czynności:
• Włożyć wkrętak (dostarczony wraz z początkowym zestawem chirurgicznym) do
wkrętu, stosując mocny nacisk osiowy.
• Odkręcić wkręt, wycofując go jednocześnie powoli z uchwytu.
• Wkręt jest teraz dołączony do wkrętaka i może zostać użyty.
Delikatnie umieścić pierwszy wkręt w jednej z tytanowych wkładek systemu mocowania. Aby ułatwić zamocowanie, zaleca się,
aby trzymać wkrętak pionowo względem osi implantu. Dokręcać wkręt do momentu wyczucia oporu, a następnie stopniowo
uwalniać wkrętak, lekkim ruchem okrężnym. Upewnić się, że wkręt jest stabilnie zamocowany, a następnie powtórzyć tę samą
procedurę z drugim wkrętem.
Uwaga: Chirurg, ani jakakolwiek inna osoba nie może dokonywać żadnych modykacji implantu bez upoważnienia rmy
Neurelec (na przykład zmiana systemu mocowania).
- Wprowadzanie nośnika elektrod: Skierować nośnik elektrod tak, by wprowadzić ją wzdłuż spirali ślimaka. Skierować
końcówkę nośnika elektrod w stronę podstawy schodów bębenka, stosując kleszcze do wprowadzania lub małe kleszczyki.
Następnie stopniowo wprowadzać nośnik elektrod, używając jak najmniejszej siły. Zakończyć wprowadzanie naciskając
na pozaślimakowe, silikonowe pierścienie nakładkowe. Po zakończeniu wprowadzania, pierścienie powinny blokować
kochleostomię. Można zamocować nośnik elektrod, aby zapobiec przemieszczeniu. Metoda mocowania oraz punkty
mocowania będą zależeć od dostępu chirurgicznego i preferencji chirurga.
- Pozycjonowanie elektrody odniesienia: Umieścić pozaślimakową, kulkową elektrodę odniesienia przy kości, pod
mięśniem skroniowym.
- Potwierdzenie prawidłowego funkcjonowania implantu: Pomiary impedancji, przed lub po zamknięciu nacięcia, mogą
potwierdzić prawidłowe działanie wszczepionego urządzenia.
11. EKSPLANTACJA
Jeżeli podejrzewa się wadliwe działanie implantu Digisonic® SP, system powinien być zbadany przez specjalistę, z pomocą
zespołu wsparcia klinicznego rmy Neurelec. Jeżeli nieprawidłowe działanie implantu zostanie potwierdzone, a zespół
medyczny zdecyduje się na przeprowadzenie eksplantacji, należy skontaktować się z rmą Neurelec, która poinformuje
Państwa o szczegółach procedury eksplantacji. Należy zwrócić się do rmy Neurelec z prośbą o dostarczenie zestawu do
eksplantacji, aby móc odesłać eksplantowany system i zapewnić możliwość zbadania urządzenia przez specjalistę.
56

12. SPECYFIKACJE TECHNICZNE IMPLANTU DIGISONIC® SP
Funkcja podstawowa Implant ślimakowy
Tryb stymulacji Zrównoważona stymulacja dwufazowa
Szybkość stymulacji Maksymalnie 24,000 pns (pns: pulsów na sekundę)
– Pomiar impedancji
– Pomiar mocy implantu
Inne dostępne funkcje
– Test integracyjny*
– EABR (wywołane elektrycznie potencjały z pnia mózgu)*
– Odruch strzemiączkowy
Testy psychoakustyczne (test rozróżniania przerw, itp.)*
* z urządzeniami towarzyszącymi
Ciężar 10,5 g
Wymiary
Średnica 30,2 mm – Grubość: w zakresie od 4,9 (krawędź)
do 5,75 mm (środek)
Objętość 4 cm3
- Silikon LSR o twardości Shore A 40
- Silikon HCR o twardości shore A 35 i HCR o twardości
Materiał pozostający w bezpośrednim kontakcie
z ludzką tkanką
shore A 50
- Klej silikonowy
- Stop platynowo-irydowy 10%
- Tytan klasy 2
- Tytan klasy 5
13. CHARAKTERYSTYKA DZIAŁANIA
Charakterystyka sygnału wyjściowego
(przy rezystancji 1 kΩ)
Maks. 2 V – 255 µs
V: 0 do 4 V
I: 10 µA do 2 mA
Δt: 10 µs do 255 µs
Pomiar impedancji TAK: Normalne wartości: 500 Ω – 5 kΩ
Poziom bezpieczeństwa MRI
Zalecane metody określania właściwego funkcjonowania
systemu
Kompatybilny z natężeniem 1,5 Tesli. Należy zapoznać się
z zaleceniami
Tak. Pomiar impedancji i test integracyjnyi
(z dodatkowym sprzętem)
14. SPECYFIKACJE I CHARAKTERYSTYKA NOŚNIKA ELEKTROD
Jednobiegunowe konguracje elektryczne Masa wspólna
Liczba niezależnych aktywnych elektrod 20
Zmniejszony rozmiar kochleostomii Średnica 1 mm
Kształt ogólny Prosty z pamięcią kształtu
Kształt wierzchołka Miękka końcówka
Kształt podstawy 2 pierścienie nakładkowe o średnicy 1,5 mm
Zastosowane materiały
- Przewód wyprowadzeniowy: stop platynowo-irydowy 10%
- Elektrody stymulujące: stop platynowo-irydowy 10%
Izolacja PEI (poliestroimid)
- Długość: 26 mm
- Średnica podstawy i średnica u szczytu: 1,07 mm oraz 0,5 mm
Wymiary
- Minimalne i maksymalne pole powierzchni elektrod
stymulacyjnych: 0,39 mm² oraz 0,77 mm²
- Odległość pomiędzy elektrodami: 0,7 mm
- Maksymalna odległość między elektrodą proksymalną
i dystalną: 22,3 mm
– Z uwagi na Państwa bezpieczeństwo, w przypadku wątpliwości co do opisanego działania, prosimy o kontakt z działem
obsługi klienta rmy Neurelec,
– Jeżeli mają Państwo jakieś uwagi lub jeśli przekazane informacje są niekompletne, prosimy o kontakt z producentem lub
lokalnym dystrybutorem.
Digisonic®
SP to zastrzeżony znak towarowy Neurelec-France
57

58

ÍNDICE
1. DESCRIÇÃO DO DISPOSITIVO ...................................................................................... 60
Nome do modelo ..................................................................................................... 60
Identicação comercial ........................................................................................... 60
Descrição do dispositivo ......................................................................................... 60
2. CONTEÚDO DA EMBALAGEM ....................................................................................... 60
3. LISTA DE ACESSÓRIOS COMPATÍVEIS ........................................................................ 60
4. SÍMBOLOS E SIGNIFICADOS ........................................................................................ 60
5. INDICAÇÕES ................................................................................................................... 60
6. CONTRAINDICAÇÕES MÉDICAS .................................................................................. 61
7. EFEITOS SECUNDÁRIOS ADVERSOS .......................................................................... 61
8. PRECAUÇÕES ................................................................................................................ 61
9. CUIDADO, INTERAÇÃO COM TRATAMENTOS E EXAMES CLÍNICOS ...................... 62
Cuidado ................................................................................................................... 62
Campo elétrico de alta energia ............................................................................... 62
Eletroterapia ...................................................................................................... 62
Eletrocirurgia ..................................................................................................... 62
Terapêutica de eletrochoques e desbrilhação ................................................ 62
Diatermia médica .................................................................................................... 62
Exames de diagnóstico e tratamentos com ultrassons ........................................... 62
Radioterapia com radiação ionizante ...................................................................... 62
Radiação eletromagnética não ionizante ................................................................ 62
10. INSTRUÇÕES DE UTILIZAÇÃO .................................................................................... 63
11. EXPLANTAÇÃO ............................................................................................................. 65
12. ESPECIFICAÇÕES TÉCNICAS DO IMPLANTE DIGISONIC® SP ................................ 65
13. CARACTERÍSTICAS DE DESEMPENHO ..................................................................... 65
14. ESPECIFICAÇÕES E CARACTERÍSTICAS DO PORTA-ELÉTRODOS ...................... 65
RM (Ressonância Magnética) ........................................................................... 62
Eletrocirurgia ........................................................................................................... 63
Orientação pré-operatória ....................................................................................... 63
Orientação intraoperatória ....................................................................................... 63
Fazer a incisão e posicionar o recetor .............................................................. 63
Manusear o implante ......................................................................................... 63
Orientar o implante ............................................................................................ 63
Fixar o implante ................................................................................................. 64
Inserir o porta-elétrodos .................................................................................... 64
Posicionamento do elétrodo de referência ....................................................... 64
Conrmar o funcionamento do implante ........................................................... 64
59

1. DESCRIÇÃO DO DISPOSITIVO
• Nome do modelo
Implante Coclear Digisonic
®
SP
• Identicação comercial
I-SP-SD
• Descrição do dispositivo
®
O Digisonic
(segundo grau) a profunda. Este implante coclear transcutâneo funciona em conjunto com um processador
retroauricular externo (DIGI SP/ SAPHYR
SP’K). Através de acoplamento eletromagnético, uma antena externa transmite o sinal acústico processado pelo
processador ao implante Digisonic
O Digisonic
SP é um implante coclear multicanal destinado a reabilitar a surdez percetiva bilateral grave
®
SP) ou um microprocessador retroauricular com bateria remota (DIGI
®
®
SP inclui um porta-elétrodos com 20 elétrodos que é inserido na cóclea (ouvido interno). Cada
SP implantado subcutaneamente atrás da orelha.
elétrodo estimula um conjunto diferente de bras nervosas auditivas e está associado a uma banda de frequência
do sinal sonoro que é processada pelo processador externo. O implante e a antena externa contêm um íman;
a antena externa é assim mantida no lugar relativo ao implante por atração magnética. O Digisonic
®
SP não
contém a sua própria fonte de energia elétrica; recebe a energia necessária para funcionar por acoplamento
eletromagnético. Consequentemente, quando a antena externa não está corretamente posicionada em relação
ao Digisonic
®
SP, o implante é passivo.
2. CONTEÚDO DA EMBALAGEM
1 implante Digisonic
®
SP (I-SP-SD), 1 modelo de implante em silicone, 1 sistema de xação, 1 cartão de
identicação do portador e documentos de acompanhamento.
3. LISTA DE ACESSÓRIOS COMPATÍVEIS
O implante é fornecido com os seguintes acessórios:
• 1 calibrador de implante em silicone usado durante a cirurgia para vericar o posicionamento correto do
implante sob a pele.
• 2 parafusos autorroscantes usados para xar o implante em posição; estes dispensam qualquer furação
prévia.
4. SÍMBOLOS E SIGNIFICADOS
Referência do catálogo
Método de esterilização: óxido de etileno
Produto fornecido estéril
Dispositivo para uma única utilização, não
reutilizar
CONSERVAÇÃO: conservar em local seco
e fresco. Conservar a uma temperatura
entre -20° C e +50° C.
Importante Ler a documentação que
acompanha o dispositivo
Manter o nível de humidade entre 15%
e 75%.
Data de fabrico
Código do lote
Frágil, manusear com cuidado Usar até
Não usar se a embalagem estiver
danicada
Número de série
Não reesterilizar. Fabricante
Eliminação de equipamentos elétricos
e eletrónicos (WEEE)
Instruções de utilização
5. INDICAÇÕES
O implante coclear Digisonic® SP foi desenvolvido para reabilitar pacientes com perda auditiva neurossensorial
de grau severo e/ou profundo bilateral, com nível de inteligibilidade de fala em open-set inferior a 50% a 60 dB
HL, com a utilização de prótese auditiva (necessária opinião médica prossional).
60

6. CONTRAINDICAÇÕES MÉDICAS
O implante coclear Digisonic® SP não está indicado para pacientes com perda auditiva neurossensorial
acompanhada de lesões extensas na cóclea (malformação coclear importante, fratura da parte pétrea do osso
temporal, ossicação signicativa da cóclea), no nervo auditivo (neuropatia axonal, tumor no ou próximo do
nervo auditivo, como um neurinoma do acústico, destruição completa de ambos os nervos auditivos), anomalia
grave das vias auditivas, perturbações agudas ou crônicas da orelha média(incluindo perfuração do tímpano),
pacientes que sejam psicologicamente instáveis ou tenham alergia de contato a materiais de implante (silicone,
platina iridiada, titânio). Poderão estar recomendados outros tipos de implantes.
7. EFEITOS SECUNDÁRIOS ADVERSOS
Em pacientes que cumprem as indicações, a implantação implica riscos típicos associados à cirurgia (efeitos
da anestesia geral, infeções, etc.) que são independentes do produto em si. No entanto, também existe um
risco de que o organismo do paciente rejeite o implante ou uma parte do implante; este risco foi reduzido
usando materiais biocompatíveis na sua conceção.
Complicações associadas com a técnica cirúrgica do implante coclear (paralisia facial temporária ou
permanente, risco de síndrome de irritação meníngea, alterações do paladar, tonturas, tinidos, etc.) são raras,
mas devem ser cuidadosamente consideradas. É importante informar qualquer possível candidato a um
implante destes riscos potenciais. Deverão ser fornecidas ao paciente informações especícas relativas aos
sintomas e aos sinais iniciais de síndrome de irritação meníngea. De acordo com as recomendações atuais,
também é vivamente recomendada a vacinação pneumocócica.
Uma vez colocado o implante, permanecem certos riscos que podem resultar em explantação. A explantação
requer uma intervenção cirúrgica adicional sob anestesia geral. Pode ocorrer uma explantação nos seguintes casos:
- Complicação médica
- Mau funcionamento do implante
- Deslocação do dispositivo resultante de um traumatismo
- Extrusão do implante
Estes potenciais problemas foram avaliados durante a conceção do produto e os materiais e a conceção do
implante foram selecionados para minimizar tais riscos.
Por m, os efeitos a longo prazo dos traumatismos associados à inserção de elétrodos e à estimulação elétrica
crónica são ainda desconhecidos. Tais efeitos poderão incluir ossicação coclear ou degeneração das bras
nervosas, e poderão obrigar à substituição do implante ou levar a uma diminuição da resposta à estimulação.
8. PRECAUÇÕES
Informações a prestar ao paciente:
- Informar o paciente dos benefícios de um implante coclear, assim como dos possíveis efeitos secundários
adversos (ver §7).
- O cartão de identicação fornecido deve ser totalmente preenchido e dado ao portador.
- Informar o paciente de que tem de apresentar o cartão de identicação antes de qualquer exame ou tratamento
médico.
- Aconselhar o paciente a ler cuidadosamente as instruções ao utilizador fornecidas com o seu processador
externo, em especial a secção relativa às advertências para a utilização.
- Dizer ao paciente que contacte o centro de implantação em caso de avaria ou mau funcionamento do sistema
de implante coclear.
- Desportos de contacto (râguebi, boxe, etc.) são fortemente desaconselhados, uma vez que impactos fortes na
área do implante poderão danicar o mesmo.
61

- Mergulho: O mergulho recreativo não é recomendado a profundidades abaixo dos 20 m. A pressão excessiva
pode danicar o implante. Além disso, é fortemente desaconselhado a participar em atividades de mergulho no
alto mar. O implante não tem garantia contra esforços de alta pressão.
- Acesso a áreas restritas: Por favor consulte um médico antes de entrar em áreas de acesso restrito (sala de
exames de RM, detetores de metais de passagem, cabines de exames de imagem 3D, etc.).
9. CUIDADO, INTERAÇÃO COM TRATAMENTOS E EXAMES CLÍNICOS
- Cuidado: As peças implantáveis do dispositivo não devem ser reutilizadas se tiverem sido previamente
implantadas noutro paciente.
- Campo elétrico de alta energia:
- Eletroterapia: A eletroterapia pode emitir correntes de intensidade variável. A utilização de técnicas
de eletroterapia de corrente elétrica de alta tensão é proibida devido ao risco de danos no sistema de
implante. No entanto, pode ser considerada a eletroterapia de baixa tensão apenas se os elétrodos não
forem colocados em áreas da cabeça ou do pescoço.
- Eletrocirurgia: Evitar o uso de instrumentos eletrocirúrgicos monopolares. Estes instrumentos poderão
criar campos de radiofrequência com tensões elétricas que poderiam causar acoplamento entre a ponta
do instrumento e o porta-elétrodos. As correntes induzidas poderiam danicar o tecido coclear ou produzir
danos permanentes no implante. Assim que o implante coclear for removido da sua embalagem na sala
de operações, qualquer bisturi monopolar deve ser desligado para evitar quaisquer danos no implante.
Noentanto, bisturis elétricos bipolares podem ser usados desde que não estejam próximos nem entrem
em contacto direto com o implante coclear.
- Terapêutica de eletrochoque e desbrilhação: Não é aconselhável enviar choques elétricos de vários
milhares de volts através do corpo num paciente que utiliza um implante coclear. Os choques elétricos
poderão causar danos nos tecidos da cóclea ou danicar permanentemente o implante.
Numa situação de risco de vida, só a equipa médica está em posição de tomar uma decisão. Se a situação
não apresentar risco de vida para o paciente, por favor contacte a Neurelec.
- Diatermia médica: É proibido utilizar a diatermia eletromagnética em pacientes com implantes que contenham
metal. Esta pode causar danos irreversíveis nos tecidos (queimadura da cóclea) e no implante. No entanto,
adiatermia por ultrassons pode ser considerada em zonas do corpo que não atinjam a cabeça ou o pescoço.
- Exames de diagnóstico e tratamentos com ultrassons: O implante não deve ser exposto a níveis
terapêuticos de energia ultrassónica. O dispositivo poderá inadvertidamente concentrar o campo de ultrassons
e car danicado.
- Radioterapia com radiação ionizante: Em sessões de radioterapia, desaconselhamos vivamente a radiação
direta na zona do implante. Uma exposição extensa e direta do implante à radiação poderia causar perda parcial
ou mesmo total das funcionalidades do implante. Estes danos não serão forçosamente visíveis de imediato.
- Radiação eletromagnética não ionizante:
- RM (Ressonância Magnética): O implante Digisonic
®
SP contém um íman permanente. Um exame de
RM ou a aplicação de um campo magnético intenso na área do implante pode causar danos ao implante
e/ou ao paciente. No entanto, é possível realizar um exame de RM a 1,5 Tesla seguindo as recomendações.
Neste caso, o radiologista deve preencher um formulário de exame, que está disponível no website
www.neurelec.com.
Consultar o manual do utilizador do processador para mais informações.
62

10. INSTRUÇÕES DE UTILIZAÇÃO
Note bem!
Eletrocirurgia: Depois de o implante estar colocado, o restante procedimento cirúrgico não deve incluir
autilização de quaisquer instrumentos eletrocirúrgicos monopolares. Estes instrumentos podem criar campos
de radiofrequência com tensões elétricas que poderiam danicar o implante. Bisturis elétricos bipolares
podem ser usados desde que não sejam usados perto do implante coclear nem em contacto com o mesmo.
Orientação pré-operatória
- Antes de implantar o Digisonic
técnicas particulares do implante coclear Digisonic
®
SP pela primeira vez, o cirurgião deve estar familiarizado com as especicações
®
SP e da técnica cirúrgica associada.
- Antes da implantação, os pacientes devem ser informados dos benefícios de um implante coclear e dos seus
possíveis riscos secundários (ver §7).
Orientação intraoperatória
- Fazer a incisão e posicionar o recetor: Antes de fazer a incisão para o enxerto de pele, recomenda-se
determinar o melhor local para o sistema implantado. Ao fazê-lo, o local da incisão deve ter em conta o facto de
que o implante não deve ser colocado sob a orelha, mas a uma distância suciente para que o paciente possa
usar o processador retroauricular sem interferir com a posição da antena externa. Além disso, a linha de incisão
deve estar a uma distância suciente do implante para evitar o risco de extrusão ou infeção pós-operatória.
Assim, recomenda-se a utilização de um lápis de pele estéril para desenhar a linha de incisão retroauricular
a uma distância de aproximadamente 1 cm do sulco retroauricular e a posição do recetor a cerca de 2 cm
da orelha. Estes locais podem ser determinados usando o modelo do implante e o modelo do processador
(fornecidos separadamente a pedido) colocados em posição sobre o ouvido.
Após ter feito a incisão, usar o modelo do implante para preparar o local necessário para o correto posicionamento
do recetor. A superfície do osso deve ser vericada para assegurar que é plana o suciente para a seguir xar
facilmente o recetor no lugar com parafusos.
- Manusear o implante: Remover o implante da embalagem comercializada apenas depois de completar os
procedimentos cirúrgicos padrão até iniciar a cocleostomia. Abrir a embalagem exterior, assegurando-se de
que o implante não está danicado. Depois de cortar cuidadosamente os os de sutura que seguram o implante
no lugar, retirar suavemente o implante do suporte estéril. Evitar tocar e/ou dobrar o porta-elétrodos. Não usar
instrumentos cirúrgicos aados que possam danicar o porta-elétrodos.
®
- Orientar o implante: A superfície gravada do implante Digisonic
SP (NEURELEC, FUNDO) não deve car
visível na conguração para utilização e como tal deve car voltada para o crânio. A placa de metal de titânio
contém, como poderá ver adiante, informações relevantes que permitem identicar o implante :
Superfície de
informação do
lado do osso
Número de série (SN):
DR: Recetor do Digisonic
00: ano de fabrico
K: Versão SP
1234: número incremental
Nome do
fabricante
Tipo de implante (modelo):
O implante Digisonic® SP é
identicado pela inscrição
DIGISONIC® SP
63

- Fixar o implante: Não é necessário furar o osso para formar o leito do implante. Basta deslizar o recetor
sob o músculo temporal até ao local preparado usando o modelo de silicone. Conrmar que o implante está
corretamente posicionado e que não balança quando é aplicada pressão com os dedos. Para xar o sistema só
é necessário o acesso às placas de montagem. O recetor implantado tem de ser
estabilizado para evitar qualquer deslocação possível, o que poderia criar tensão
e originar danos nos os dos elétrodos. Por conseguinte, é recomendado xá-
lo no lugar com os dois parafusos autorroscantes fornecidos na embalagem e
preposicionados no suporte do implante. Seguir os passos abaixo descritos para
remover os parafusos do suporte:
• Inserir a chave de parafusos (fornecida com o kit cirúrgico) no parafuso
usando pressão axial rme.
• Desaperte o parafuso retirando-o lentamente do suporte.
• O parafuso está agora preso à chave de parafusos e pode ser usado.
Posicionar suavemente o primeiro parafuso numa das inserções de titânio do sistema de xação. Recomendase que a chave de parafusos seja mantida vertical relativamente ao eixo do implante para facilitar a xação.
Apertar o parafuso até sentir resistência, depois libertar gradualmente a chave de parafusos aplicando um
ligeiro movimento circular. Vericar se está seguro, depois repetir o mesmo procedimento para o segundo
parafuso.
Nota: Nem o cirurgião nem qualquer pessoa não autorizada pela Neurelec podem fazer alterações ao implante
(tais como ao sistema de xação).
- Inserir o porta-elétrodos: Orientar o porta-elétrodos de modo a inseri-lo acompanhando a espiral coclear.
Conduzir a extremidade do porta-elétrodos através da base da membrana timpânica usando a pinça de
inserção ou um fórceps pequeno, depois inserir progressivamente o porta-elétrodos, usando a mínima força
possível. Terminar a inserção pressionando para baixo os anéis de inserção extracoclear de silicone. Uma
vez concluída a inserção, os anéis deverão bloquear a cocleostomia. O porta-elétrodos pode ser xado para
impedir o risco de migração. O método e os pontos de xação irão depender do acesso cirúrgico e das
preferências do cirurgião.
- Posicionar o elétrodo de referência: Colocar o elétrodo extracoclear esférico de referência contra o osso,
sob o músculo temporal.
- Conrmar o funcionamento do implante: Medições de impedância, antes ou depois de fechar a incisão,
podem conrmar o funcionamento do dispositivo implantado.
11. EXPLANTAÇÃO
Em caso de suspeita de mau funcionamento do implante Digisonic
®
SP, deve ser feita uma análise especializada
do sistema com a ajuda da assistência clínica da Neurelec. Caso se conrme o mau funcionamento do implante
e a equipa médica decidir efetuar a explantação, é importante contactar a Neurelec, que poderá informá-lo do
procedimento de explantação a seguir. É especialmente importante solicitar um kit de explantação da Neurelec
para que o sistema explantado possa ser devolvido e assim realizada uma análise especializada do dispositivo.
64

12. ESPECIFICAÇÕES TÉCNICAS DO IMPLANTE DIGISONIC® SP
Função principal Implante coclear
Modo de estimulação Estimulação bifásica equilibrada
Frequência de estimulação máximo 24.000 pps (pps: impulsos por segundo)
- Medição da impedância
- Medição da potência do implante
- Teste de integridade*
Outras funções disponíveis
- EABR (Resposta Auditiva Evocada do Tronco
Cerebral)*
- Reexo estapédico
Testes psicoacústicos (teste gap, etc.)*
* com equipamento associado
Peso 10,5 g
Dimensões
Diâmetro 30,2 mm – Espessura: de 4,9
(extremidade) a 5,75 mm (centro)
Volume 4 cm3
- Silicone LSR 40 dureza A
- Silicone HCR 35 dureza A e HCR 50 dureza A
Material em contacto direto com tecido humano
- Silicone adesiva
- Platina iridiada 10%
- Titânio de grau 2
- Titânio de grau 5
13. CARACTERÍSTICAS DE DESEMPENHO
Características do sinal enviado
(mediante resistência de1 kΩ)
Máx. 2V -255µs
V: 0 a 4V
I: 10 µA a 2 mA
Δt: 10 µs a 255 µs
Medição da impedância Sim: Valores normais: 500Ω – 5kΩ
Nível de segurança de RM
Métodos recomendados para determinar o correto
funcionamento do sistema
Compatível com 1,5 Tesla. Consultar as recomendações
Sim. Medição da impedância e teste de integridade
(com equipamento de recolha)
14. ESPECIFICAÇÕES E CARACTERÍSTICAS DO PORTA-ELÉTRODOS
Congurações elétricas monopolares Plano comum
Número de elétrodos ativos independentes 20
Tamanho de cocleostomia reduzido Diâmetro 1 mm
Formato geral Reto com memória de forma
Forma no vértice Ponta macia
Forma na base Dois anéis de inserção com 1,5 mm de diâmetro
Materiais constituintes
- Fio de ligação: Platina iridiada 10%
- Elétrodos de estimulação: Platina iridiada 10%
Isolamento PEI (poliesterimida)
- Comprimento; 26 mm
- Diâmetro na base e no vértice: 1,07 mm e 0,5 mm
Dimensões
- Área de superfície mínima e máxima dos elétrodos
de estimulação: 0,39 mm² e 0,77 mm².
- Distância entre elétrodos: 0,7 mm
- Distância máxima entre os elétrodos proximal e distal:
22,3 mm
- Em caso de dúvida sobre o desempenho especicado, por favor contacte o serviço de apoio ao cliente
Neurelec, para sua segurança.
- Caso tenha algum comentário ou se as informações fornecidas estiverem incompletas, por favor contacte o
seu fabricante ou o distribuidor local da sua área.
Digisonic
®
SP é uma marca registada da Neurelec-France
65

66

CUPRINS
1. DESCRIERE DISPOZITIVULUI ................................................................................................... 68
Numele modelului ....................................................................................................................................... 68
Identicatorul comercial ........................................................................................................................... 68
Descrierea dispozitivului ........................................................................................................................... 68
2. CONŢINUTUL AMBALAJULUI .................................................................................................. 68
3. LISTA ACCESORIILOR COMPATIBILE ....................................................................................... 68
4. SIMBOLURI ŞI SEMNIFICAŢII ................................................................................................... 68
5. INDICAŢII .................................................................................................................................. 68
6. CONTRAINDICAŢII MEDICALE ................................................................................................ 69
7. EFECTE SECUNDARE ................................................................................................................ 69
8. PRECAUŢII ................................................................................................................................ 69
9. ATENŢIONARE, INTERACŢIUNE CU TRATAMENTELE ŞI INVESTIGAŢIILE CLINICE............... 70
Atenţie .............................................................................................................................................................. 70
Câmp electric de înaltă energie .............................................................................................................. 70
Electroterapie ........................................................................................................................................ 70
Electrochirurgie .................................................................................................................................... 70
Terapie cu electroşocuri şi debrilare ........................................................................................... 70
Diatermie medicală ..................................................................................................................................... 70
Teste de diagnosticare care sau tratament cu ultrasunete ........................................................... 70
Terapie cu radiaţii ionizante ..................................................................................................................... 70
Radiaţii electromagnetice neionizante ................................................................................................ 70
10. INSTRUCŢIUNI DE UTILIZARE ............................................................................................... 71
11. EXPLANTAREA ....................................................................................................................... 73
12. SPECIFICAŢIILE TEHNICE ALE IMPLANTULUI DIGISONIC® SP ............................................. 73
13. CARACTERISTICILE DE PERFORMANŢĂ ................................................................................ 73
14. SPECIFICAŢIILE ŞI CARACTERISTICILE MATRICEI DE ELECTROZI ........................................ 73
IRM (imagistică prin rezonanţă magnetică) ............................................................................... 70
Electrochirurgie............................................................................................................................................. 71
Gestionarea preoperatorie........................................................................................................................ 71
Gestionarea intraoperatorie ..................................................................................................................... 71
Stabilirea locului inciziei şi poziţionarea receptorului............................................................ 71
Manevrarea implantului .................................................................................................................... 71
Orientarea implantului ...................................................................................................................... 71
Ataşarea implantului .......................................................................................................................... 72
Introducerea seriei de electrozi ...................................................................................................... 72
Poziţionarea electrodului de referinţă ......................................................................................... 72
Conrmarea funcţionării implantului........................................................................................... 72
67

1. DESCRIEREA DISPOZITIVULUI
• Numele modelului
Implant cohlear Digisonic® SP
• Identicatorul comercial
I-SP-SD
• Descrierea dispozitivului
Digisonic® SP este un implant cohlear cu mai multe canale destinat reabilitării hipoacuzia bilaterală severă (de gradul doi) până
la hipoacuzia perceptivă profundă. Acest implant cohlear transcutanat funcţionează în asociere cu un procesor retroauricular
extern (DIGI SP/ SAPHYR®
SP) sau cu un micro-procesor retroauricular cu baterie la distanţă (DIGI SP’K). Prin cuplaj magnetic, o
antenă externă transmite semnalul acustic procesat de procesor către implantul Digisonic® SP implantat sub piele în spatele
auriculei urechii.
Digisonic® SP include o matrice de electrozi cu 20 de electrozi care este introdusă în cohlee (urechea internă). Fiecare electrod
stimulează un set diferit de bre ale nervului auditiv şi este asociat cu o bandă de frecvenţă a semnalului acustic care este
procesat de procesorul extern. Implantul şi antena externă conţin un magnet; prin urmare, antena externă rămâne xată
într-o anumită poziţie relativă faţă de implant prin atracţie magnetică. Digisonic® SP nu are propria sa sursă de energie;
acesta primeşte energia necesară funcţionării prin cuplaj electromagnetic. Prin urmare, atunci când antena externă nu este
poziţionată corect relativ faţă de Digisonic® SP, implantul este pasiv.
2. CONŢINUTUL AMBALAJULUI
1 implant Digisonic® SP (I-SP-SD), 1 mulaj de implant din silicon, 1 sistem de ataşare, 1 port-card de ID şi documentele
însoţitoare.
3. LISTA ACCESORIILOR COMPATIBILE
Implantul este furnizat cu următoarele accesorii:
• 1 mulaj de implant din silicon utilizat în timpul intervenţiei chirurgicale pentru a verica poziţionarea corectă a implantului
sub piele.
• 2 şuruburi auto-letante utilizate pentru xarea implantului în poziţie; acestea nu necesită nicio perforare anterioară.
4. SIMBOLURILE ŞI SEMNIFICAŢIILE
Trimitere la catalog Important. Citiţi documentaţia însoţitoare
Metoda de sterilizare: oxid de etilenă. Produs
livrat steril
Menţineţi umiditatea între 15% şi 75%.
Dispozitiv de unică folosinţă; a nu se reutiliza Data de fabricare
DEPOZITARE: a se depozita într-un loc uscat şi
răcoros. Temperatura de depozitare se situează
între -20 °C şi +50 °C.
Codul de lot
Fragil; a se manevra cu atenţie A se utiliza până la data
A nu se utiliza dacă ambalajul este deteriorat Numărul de serie
A nu se resteriliza Producător
Deşeuri ale echipamentelor electrice şi electronice (DEEE)
Instrucţiuni de utilizare
5. INDICAŢII
Implantul cohlear cu mai multe canale Digisonic® SP este destinat reabilitării pacienţilor cu hipoacuzie bilaterală de gradul 2
până la severă cu un nivel de inteligibilitate al vorbirii sub 50% la 60 dB HL în format deschis cu utilizarea unei proteze auditive
(este necesară o opinie medicală).
68

6. CONTRAINDICAŢIILE MEDICALE
Implantul cohlear Digisonic® SP nu este indicat pentru pacienţii cu hipoacuzie perceptivă însoţită de leziuni mari ale cohleei
(malformaţii majore ale cohleei, fractura părţii pietricate a osului temporal, osicarea semnicativă a cohleei), ale nervului
auditiv (neuropatia axonală, tumoare în apropierea sau la nivelul nervului auditiv, cum ar neuromul, distrugerea completă
a ambilor nervi auditivi), o anomalie gravă a căilor auditive, afecţiuni acute sau cronice ale urechii medii (inclusiv perforarea
membranei timpanului), nu este psihologic stabil sau prezintă o alergie de contact la materialele implantului (silicon,
platiniridium, titan). Se recomandă alte tipuri de implanturi.
7. EFECTE SECUNDARE
Pacienţii care satisfac indicaţiile privind implantul trebuie să accepte riscurile uzuale asociate intervenţiei chirurgicale (efectele
anesteziei generale, infecţiile etc.) care sunt independente de produsul în sine. Cu toate acestea, există şi un risc ca pacientul să
respingă implantul sau o parte a acestuia; acest risc a fost redus utilizând pentru fabricaţie materiale biocompatibile.
Complicaţiile asociate tehnicii intervenţiei chirurgicale de implant cohlear (paralizia facială temporară sau permanentă,
riscul de sindrom de iritaţie meningială, modicarea gustului, ameţeala, acufene etc.) sunt rare, dar trebuie să e luate în
consideraţie cu atenţie. Este important să informaţi ecare candidat prospectiv la implant privind aceste riscuri potenţiale.
Informaţii specice trebuie să e oferite pacientului în ceea ce priveşte simptomele şi semnele iniţiale ale sindromului de
iritaţie meningială. Conform recomandărilor actuale, se recomandă cu fermitate vaccinarea pneumococică.
După poziţionarea implantului, rămân anumite riscuri care pot duce la explantare. Explantarea necesită o altă intervenţie
chirurgicală suplimentară în condiţii de anestezie. Explantarea poate apărea în următoarele cazuri:
- Complicaţii medicale
- Funcţionarea defectuoasă a implantului
- Deplasarea dispozitivului ca urmare a unei traume
- Extrudarea implantului
Aceste probleme potenţiale au fost evaluate în timpul proiectării produsului, iar materialele şi designul implantului au fost
alese pentru a reduce aceste riscuri.
În nal, efectele pe termen lung ale traumei asociate introducerii electrozilor şi stimulării electrice cronice sunt necunoscute
în acest moment. Aceste efecte pot include osicarea cohleară sau degenerarea brelor nervoase şi pot necesita înlocuirea
implantului sau pot duce la un răspuns redus la stimulare.
8. PRECAUŢII
Informaţii care trebuie să e oferite pacientului:
- Informaţi pacientul de beneciile unui implant cohlear şi, de asemenea, privind efectele adverse care pot apărea (consultaţi §7).
- Cardul de identicare furnizat trebuie complet integral şi oferit purtătorului.
- Informaţi pacientul că trebuie să prezinte cardul de identicare înainte de orice examinare sau tratament medical.
- Recomandaţi pacientului să citească cu atenţie instrucţiunile de utilizare furnizate cu procesorul său extern, în special
secţiunea referitoare la avertizările privind utilizarea.
- Comunicaţi pacientului să contacteze centrul de implant în cazul eşecului sau a funcţionării greşite a sistemului de implant
cohlear.
- Sporturile de contact (rugby, box etc.) nu sunt recomandate întrucât impacturile puternice în zona implantului îl pot deteriora.
69

- Scufundările: Scufundările recreative nu se recomandă la adâncimi mai mari de 20 m. Presiunea în exces poate deteriora
implantul. Mai mult, nu este recomandată angajarea în activităţi profesionale de scufundare la mari adâncimi întrucât
implantul nu este garantat în cazul supunerii repetate la presiuni mari.
- Accesul în zonele cu restricţii: Vă rugăm să vă consultaţi cu medicul dvs. înainte de a intra în zone cu acces restricţionat
(camera de examinare IRM; detectoarele de metale, cabinele de scanare 3D etc.).
9. ATENŢIONARE, INTERACŢIUNE CU TRATAMENTELE ŞI INVESTIGAŢIILE CLINICE
- Atenţie: Piesele dispozitivului implantat nu ar trebui să e reutilizate dacă au fost implantate anterior într-un alt pacient.
- Câmp electric de înaltă energie:
- Electroterapie: Electroterapia poate transmite curenţi de putere variabilă. Utilizarea tehnicilor de electroterapie cu
curent de înaltă tensiune este interzisă datorită riscului de deteriorare a sistemului de implant. Totuşi, electroterapia de
joasă tensiune poate luată în consideraţie numai dacă electrozii nu sunt poziţionaţi în zonele din apropierea capului sau
a gâtului.
- Electrochirurgie: Evitaţi utilizarea instrumentelor electrochirurgicale monopolare. Aceste instrumente pot crea câmpuri
de radiofrecvenţă prin tensiunile electrice care pot crea un cuplaj între vârful instrumentului şi matricea de electrozi.
Curenţii induşi ar putea să deterioreze ţesutul cohlear sau să producă deteriorarea permanentă a implantului. Imediat după
scoaterea implantului din ambalajul său în sala de operaţii, orice bisturiu chirurgical monopolar ar trebui să e oprit pentru
a evita deteriorarea implantului. Totuşi, bisturiele electrochirurgicale bipolare se pot utiliza atât timp cât nu se aă în
apropierea implantului cohlear şi nu intră în contact direct cu acesta.
- Terapie cu electroşocuri şi debrilare: Transmiterea şocurilor electrice de mii de volţi prin corp nu este recomandată
unui pacient care are un implant cohlear. Şocurile electrice pot provoca deteriorarea ţesutului cohlear sau deteriorarea
permanentă a implantului.
Într-o situaţie potenţial letală, numai echipa medicală este în poziţia de a lua o decizie. Dacă situaţia nu este letală pentru
pacient, vă rugăm să contactaţi Neurelec.
- Diatermie medicală: Diatermia electromagnetică nu se poate utiliza la pacienţii cu implanturile care conţin metal. Acest
lucru poate duce la deteriorarea ireversibilă a ţesutului (arsura cohleei) sau a implantului. Totuşi, diatermia ultrasonică
poate luată în consideraţie pentru zone ale corpului care nu intră în contact cu capul sau gâtul.
- Teste de diagnostic care sau tratamente cu ultrasunete: Implantul nu ar trebui să e expus nivelurilor terapeutice de
energie ultrasonică. Dispozitivul poate concentra accidental câmpul ultrasonic şi poate deteriorat.
- Terapie cu radiaţii ionizante: În timpul şedinţelor de radioterapie, vă recomandăm ferm să nu utilizaţi iradierea directă
a zonei implantului. Expunerea directă, masivă a implantului la raze ar putea duce la o pierdere parţială sau totală a funcţiilor
implantului. Această deteriorare nu se observă neapărat imediat.
- Radiaţii electromagnetice neionizante:
- IRM (imagistica prin rezonanţă magnetică): Implantul Digisonic® SP conţine un magnet permanent. O examinare
IRM sau un câmp magnetic puternic aplicat în apropierea implantului poate duce la deteriorarea implantului şi/
sau lezarea pacientului. Cu toate acestea, este posibilă efectuarea unei examinări IRM la 1,5 Tesla dacă se respectă
următoarele recomandări. În acest caz, radiologul trebuie să completeze un formular de examinare disponibil pagina web
www.neurelec.com.
Pentru mai multe informaţii, consultaţi manualul de utilizare al procesorului.
70

10. INSTRUCŢIUNI DE UTILIZARE
Reţineţi!
Electrochirurgie: După poziţionarea implantului, restul procedurii chirurgicale nu ar trebui să includă utilizarea niciunui
instrument electrochirurgical monopolar. Aceste instrumente pot crea câmpuri de radiofrecvenţă prin generarea sarcinilor
electrice care ar putea deteriora implantul. Bisturiele electrochirurgicale bipolare se pot utiliza atât timp cât nu se
utilizează în apropierea implantului cohlear şi nu vin în contact cu acesta.
Gestionarea preoperatorie
- Înainte de implantarea Digisonic® SP pentru prima oară, chirurgul ar trebui să se familiarizeze cu specicaţiile tehnice speciale
ale implantului cohlear Digisonic® SP şi tehnica chirurgicală asociată.
- Înainte de implantare, pacienţii ar trebui să e informaţi privind avantajele unui implant cohlear şi privind potenţialele sale
riscuri secundare (consultaţi §7).
Gestionarea intraoperatorie
- Stabilirea locului inciziei şi poziţionarea receptorului: Înainte de a realiza incizia pentru lamboul cutanat, se recomandă
determinarea locului optim în vederea implantării sistemului. Astfel, locul inciziei are importanţă pentru faptul că implantul nu
trebuie amplasat mai jos de auriculă, dar la o distanţă sucient de mare pentru ca pacientul să poarte procesorul retroauricular
fără a interfera cu antena externă. În plus, linia inciziei ar trebui să e la distanţă de implant pentru a preveni riscul extruziunii
sau al infecţiei postoperatorii. Prin urmare se recomandă utilizarea unui marker cutanat pentru a desena linia de incizie
retroauriculară situată la o distanţă de aproximativ 1 cm de pliul retroauricular şi de a desena poziţia receptorului la aproximativ
2 cm de auricula urechii. Aceste locuri se pot stabili utilizând mulajul implantului şi al procesorului (furnizate separat la cerere)
amplasate peste ureche.
După efectuarea inciziei, utilizaţi mulajul implantului pentru pregătirea locului necesar pentru poziţionarea corectă a
receptorului. Suprafaţa osului ar trebui să e vericată pentru a garanta faptul că este destul de plană încât receptorul să e
xat cu şuruburi cu uşurinţă.
- Manevrarea implantului: Scoateţi implantul din ambalajul de vânzare numai după nalizarea procedurilor chirurgicale
standard până la iniţierea cohleostomiei. Deschideţi ambalajul exterior şi asiguraţi-vă că implantul nu este deteriorat. După ce
tăiaţi cu atenţie suturile care securizează implantul, scoateţi-l uşor din suportul său steril. Evitaţi atingerea şi/sau îndoirea seriei
de electrozi. Nu utilizaţi instrumente chirurgicale ascuţite care ar putea deteriora seria de electrozi.
- Orientarea implantului: Suprafaţa gravată a implantului Digisonic® SP (NEURELEC, JOS) nu trebuie să e vizibilă în
conguraţia pentru utilizare şi, prin urmare, trebuie întoarsă către craniu. Această placă de metal din titan conţine, după cum
urmează, informaţii importante cu ajutorul cărora se identică implantul:
Suprafaţă cu
informaţii spre
partea osoasă
Numărul de serie (SN):
DR: receptor Digisonic
00: anul fabricării
K: Versiune SP
1234: numere crescătoare
71
Numele
producătorului
Tipul implantului (modelul):
implantul Digisonic® SP este
identicat cu ajutorul inscripţiei
DIGISONIC® SP

- Ataşarea implantului: Nu este necesară perforarea osului pentru realizarea patului implantului. Pur şi simplu glisaţi
receptorul sub muşchiul temporal în locul pregătit utilizând mulajul siliconic. Conrmaţi că implantul este poziţionat
corespunzător şi că nu se mişcă la aplicarea presiunii cu degetul. Singurul acces la butonierele de montare ale implantului este
necesar pentru ataşarea sistemului. Receptorul implantat trebuie să e stabilizat cu şuruburile
furnizate pentru a preveni orice deplasare posibilă care ar putea crea o tensiune şi duce la
posibila deteriorare a relor electrodului. Prin urmare, se recomandă întotdeauna xarea cu
cele două şuruburi auto-letante furnizate în ambalaj şi pre-poziţionarea în suportul de xare
a implantului. Respectaţi următorii paşi pentru a scoate şuruburile din suport:
• Introduceţi şurubelniţa (furnizată în trusa chirurgicală iniţială) în şurub aplicând presiune
axială fermă.
• Deşurubaţi şurubul în timp ce îl scoateţi uşor din suport.
• Şurubul este acum ataşat la şurubelniţă şi poate utilizat.
Poziţionaţi uşor primul şurub într-unul din inserţiile de titan pentru xarea sistemului. Se recomandă menţinerea şurubelniţei
în poziţie verticală pe axa implantului pentru facilitarea ataşării. Strângeţi şurubul complet până întâmpinaţi rezistenţă, apoi
eliberaţi treptat şurubelniţa aplicând mişcări uşor circulare. Vericaţi dacă este xată, apoi repetaţi aceeaşi procedură pentru
cel de-al doilea şurub.
Notă: Nici chirurgul, nici o altă persoană care nu este autorizată de Neurelec nu poate efectua modicări asupra implantului
(cum ar la sistemul de xare).
- Introducerea seriei de electrozi: Orientaţi matriceadeelectrozi, astfel încât să urmeze spirala cohleară la introducere. Ghidaţi
vârful matriceideelectrozi spre baza scalei timpanului utilizând cleştele de introducere sau forcepsurile mici, apoi introduceţi
treptat matricea de electrozi utilizând cât mai puţină forţă posibil. Finalizaţi inserţia împingând inelele extracohleare din silicon.
După nalizarea introducerii, inelele ar trebui să blocheze cohleostomia. Matricea de electrozi poate ataşată pentru a preveni
riscul de deplasare. Metoda de ataşare şi ataşarea vor depinde de accesul chirurgical şi de preferinţele chirurgului.
- Poziţionarea electrodului de referinţă: Amplasaţi bila electrodului de referinţă extracohlear pe sub muşchiul temporal.
- Conrmarea funcţionarea implantului: Măsurătorile impedanţei, înainte şi după închiderea inciziei, pot conrma
funcţionarea adecvată a dispozitivului implantat.
11. EXPLANTAREA
Dacă implantul Digisonic® SP este suspectat că funcţionează defectuos, sistemul trebuie să e examinat cu ajutorul expertizei
departamentului de asistenţă tehnică al Neurelec. Dacă funcţionarea defectuoasă a implantului este conrmată, iar echipa
medicală decide explantarea, este important să contactaţi Neurelec care vă va informa cu privire la procedura de explantare
corespunzătoare. Este important în mod special să solicitaţi o trusă de explantare de la Neurelec, astfel încât sistemul explantat
să poată trimis înapoi, facilitând examinarea cu expertiză a dispozitivului.
72

12. SPECIFICAŢIILE TEHNICE ALE IMPLANTULUI DIGISONIC® SP
Funcţie primară Implant cohlear
Mod de stimulare Stimulare bifazică echilibrată
Rată de stimulare 24.000 pps maxim (pps: impulsuri pe secundă)
- Măsurarea impedanţei
- Măsurarea puterii implantului
Alte funcţii disponibile
Greutate 10,5 g
Dimensiuni
Volum 4 cm3
Material în contact direct cu ţesutul uman
13. CARACTERISTICILE DE PERFORMANŢĂ
Caracteristicile semnalului ieşit (la rezistenţă de 1 kΩ) Max 2V -255 µs
Măsurare a impedanţei Da: valori normale: 500 Ω – 5 kΩ
Nivel de siguranţă IRM Compatibil cu 1,5 Tesla. Consultaţi recomandările
Metode recomandate pentru stabilirea funcţionării
adecvate a sistemului
14. SPECIFICAŢIILE ŞI CARACTERISTICILE SERIEI DE ELECTROZI
Conguraţii electrice monopolare Condiţii comune
Număr de electrozi activi independenţi 20
Dimensiune redusă a cohleostomiei 1 mm diametru
Formă generală Drept cu memorie de formă
Formă la vârf Vârf moale
Formă la bază Doi 1,5 mm - diametru al inelelor de împingere
Materiale din compoziţie
Izolare PEI (poliesterimidă)
Dimensiuni
- Testul de integritate*
- EABR (răspuns evocat al trunchiului auditiv)*
- Reexul stapedian
Testele psihoacustice (testul pauzei etc.)*
* cu echipament asociat
Diametru 30,2 mm – Grosime: variabilă de la 4,9 (marginal)
la 5,75 mm (centru)
- LSR siliconic 40 shore A
- HCR siliconic 35 shore A şi HCR 50 shore A
- Adeziv siliconic
- Iridium platină 10 %
- Titan clasa 2
- Titan clasa 5
T: 0 la 4 V
I: 10 µA la 2 mA
Δt: 10 µs la 255 µs
Da. Măsurarea impedanţei şi testul de integritate
(cu echipamentul de citire)
- Fir conector: Platiniridium 10 %
- Electrozi de stimulare: Platiniridium 10 %
- Lungime; 26 mm
- Diametru la bază şi la vârf: 0,5 mm şi 1,07 mm
- Suprafaţa minimă şi maximă a zonei electrozilor de stimulare:
0,39 mm² şi 0,77 mm²
- Distanţa între electrozi: 0,7 mm
- Distanţa maximă între electrozii proximali şi distali: 22,3 mm
- Dacă aveţi îndoieli privind performanţele specicate, contactaţi departamentul serviciului de clienţi al Neurelec pentru
siguranţa dvs.
- Dacă aveţi comentarii sau dacă informaţiile furnizate sunt incomplete, contactaţi producătorul sau distribuitorul dvs. local.
Digisonic® SP este o marcă înregistrată a Neurelec France
73

74

INHOUD
1. BESCHRIJVING ............................................................................................................... 76
Modelnaam .............................................................................................................. 76
Commerciële identicatie ........................................................................................ 76
Beschrijving van het toestel ..................................................................................... 76
2. INHOUD VAN DE VERPAKKING ..................................................................................... 76
3. LIJST VAN COMPATIBELE ACCESSOIRES .................................................................. 76
4. SYMBOLEN EN BETEKENISSEN .................................................................................. 76
5. INDICATIES ...................................................................................................................... 76
6. MEDISCHE CONTRA-INDICATIES ................................................................................. 77
7. BIJWERKINGEN .............................................................................................................. 77
8. VOORZORGSMAATREGELEN ....................................................................................... 77
9. WAARSCHUWING, INTERACTIE MET KLINISCHE BEHANDELINGEN
EN ONDERZOEKEN ............................................................................................................ 78
Waarschuwing ......................................................................................................... 78
Hoog-energetisch elektrisch veld ............................................................................ 78
Elektrotherapie .................................................................................................. 78
Elektrochirurgie ................................................................................................. 78
Elektroshock therapie en debrillatie ................................................................ 78
Medische diathermie ............................................................................................... 78
Diagnostische tests en behandelingen met echograe .......................................... 78
Bestralingstherapie met ioniserende bestraling ...................................................... 78
Niet-ioniserende elektromagnetische bestraling ..................................................... 78
10. GEBRUIKSINSTRUCTIES ............................................................................................. 79
11. EXPLANTATIE ............................................................................................................... 81
12. TECHNISCHE SPECIFICATIES VAN HET DIGISONIC® SP IMPLANTAAT .................. 81
13. PRESTATIEKENMERKEN ............................................................................................. 81
14. SPECIFICATIES EN KENMERKEN VAN DE ELEKTRODENBUNDEL ........................ 81
MRI (Magnetische Resonantie beeldvorming) .................................................. 78
Elektrochirurgie ........................................................................................................ 79
Preoperatieve behandeling ..................................................................................... 79
Intraoperatieve behandeling ................................................................................... 79
De plaats bepalen van de insnede en de positie van de ontvanger ................ 79
Het implantaat hanteren .................................................................................... 79
Het implantaat oriënteren .................................................................................. 79
Bevestiging van het implantaat ......................................................................... 80
De elektrodenbundel inbrengen ....................................................................... 80
De referentie-elektrode positioneren ................................................................. 80
Bevestigen van de werking van het implantaat ................................................ 80
75

1. BESCHRIJVING VAN HET TOESTEL
• Modelnaam
®
Digisonic
SP Cochleair implantaat
• Commerciële identicatie
I-SP-SD
• Beschrijving van het toestel
De Digisonic® SP is een meerkanaals cochleair implantaat bedoeld voor de revalidatie van patiënten met een
bilaterale ernstige (tweedegraads) tot volledige perceptieve doofheid. Dit transcutane cochleair implantaat
functioneert met een achter-het-oor processor (DIGI SP/ SAPHYR
processor met afzonderlijke batterij (DIGI SP’K). Door middel van elektromagnetische inductie zendt een externe
antenne het geluidssignaal dat verwerkt wordt door de processor naar het Digisonic
de oorschelp onder de huid wordt geïmplanteerd.
De Digisonic
®
SP heeft een elektrodenbundel met 20 elektroden die wordt ingebracht in de cochlea (binnenoor).
®
SP) of met een micro-achter-het-oor
®
SP implantaat die achter
Elke elektrode stimuleert andere gehoorzenuwvezels overeenkomstig met de frequentieband van het
geluidssignaal, die wordt verwerkt door de processor. Het implantaat en de externe antenne bevatten een
magneet; de externe antenne wordt met behulp van een magneet op zijn juiste plaats ten opzichte van het
implantaat gehouden. De Digisonic
wordt verkregen door elektromagnetische inductie. Daardoor is het implantaat inactief als de externe antenne
niet correct geplaatst is ten opzichte van de Digisonic
®
SP bevat geen eigen elektronische krachtbron; de energie voor de werking
®
SP.
2. INHOUD VAN DE VERPAKKING
1 Digisonic
®
SP (I-SP-SD) implantaat, 1 silicone implantaatmal, 1 bevestigingssysteem, 1 ID-kaart voor de
drager, en bijbehorende documenten.
3. LIJST VAN COMPATIBELE ACCESSOIRES
Het implantaat wordt geleverd met de volgende accessoires:
• 1 silicone implantaatmal die tijdens de operatie wordt gebruikt om de correcte positie van het implantaat
onder de huid te veriëren.
• 2 schroefjes om het implantaat in zijn positie te bevestigen; vooraf boren is niet nodig.
4. SYMBOLEN EN BETEKENISSEN
Catalogusverwijzing
Sterilisatiemethode: ethyleenoxide
Product wordt steriel geleverd.
Toestel voor eenmalig gebruik, niet
opnieuw gebruiken
BEWAARCONDITIES: bewaren op een
koele, droge plek. Opslagtemperatuur
tussen -20 °C en +50 °C.
Belangrijk. Lees de begeleidende
documentatie.
Houd de vochtigheidsgraad tussen
15% en 75%.
Productiedatum
Lotcode
Breekbaar; voorzichtig behandelen Gebruiken voor datum
Niet gebruiken als de verpakking is
beschadigd
Serienummer
Niet opnieuw steriliseren Fabrikant
Afval van elektrische en elektronische
apparaten (DEEE)
Werkingsinstructies
5. INDICATIES
Het meerkanalige Digisonic® SP cochleair implantaat is ontwikkeld voor de revalidatie van patiënten met een
ernstig tot volledig gehoorverlies van de 2e graad en een niveau van spraakverstaanbaarheid van minder dan
50% bij 60 dB HL in een open-set gebruik makend van een hoorapparaat (professioneel medisch advies vereist).
76

6. MEDISCHE CONTRA-INDICATIES
Het Digisonic® SP cochleair implantaat is niet geïndiceerd bij patiënten met een perceptief gehoorverlies dat gepaard
gaat met aanzienlijke letsels aan de cochlea (ernstige misvorming van de cochlea, fractuur van het rotsbeen,
signicante ossicatie van de cochlea), de gehoorzenuw (axonale neuropathie, tumor nabij of op de gehoorzenuw
zoals een akoestisch neuroma, volledige beschadiging van beide gehoorzenuwen), een ernstige anomalie van
de gehoorbanen, acute of chronische aandoeningen van het middenoor (waaronder trommelvliesperforatie), of bij
patiënten die geestelijk labiel zijn of een contactallergie hebben voor implantaatmaterialen (silicone, platina-iridium,
titanium). Andere implantaattypes kunnen dan worden aanbevolen.
7. BIJWERKINGEN
Patiënten die voldoen aan de indicaties voor implantatie moeten de risico’s aanvaarden die gepaard gaan met
chirurgie (eecten van algemene verdoving, infecties, enz.) die onafhankelijk zijn van het product. Er bestaat
echter ook een risico dat het lichaam van de patiënt het implantaat of een deel ervan afstoot. Dit risico wordt
beperkt door het gebruik van biocompatibele materialen in het ontwerp.
Complicaties die gepaard gaan met chirurgie van een cochleair implantaat (tijdelijke of permanente
gezichtsverlamming, risico op herenvliesontsteking, verandering in de smaakzin, duizeligheid, tinnitus, enz.)
komen zelden voor maar moeten wel zorgvuldig worden overwogen. Het is belangrijk dat elke potentiële
kandidaat voor een implantaat informatie krijgt over deze risico’s. De patiënt dient ook specieke informatie te
verkrijgen over de symptomen en eerste tekenen van hersenvliesontsteking. Volgens de huidige aanbevelingen
is vaccinatie tegen pneumococcen ook sterk aangeraden.
Als het implantaat eenmaal is geplaatst, blijven er bepaalde risico’s bestaan die tot explantatie kunnen leiden.
Voor explantatie is opnieuw een chirurgische ingreep onder algemene verdoving nodig. Explantatie kan nodig
zijn in de volgende gevallen:
- Medische complicatie
- Slechte werking van het implantaat
- Verplaatsing van het toestel als gevolg van een trauma
- Uitstoting van het implantaat
Deze mogelijke problemen werden geëvalueerd tijdens de ontwikkeling van het product en de materialen.
Hetimplantaat is zodanig ontworpen dat deze risico’s tot een minimum beperkt blijven.
De eecten op lange termijn door trauma geassocieerd met de inplanting van elektroden en chronische
elektrische stimulatie zijn tot op heden niet bekend. Deze eecten kunnen bestaan uit ossicatie van de cochlea
of beschadiging van de zenuwvezels en kunnen aanleiding geven tot het vervangen van het implantaat of leiden
tot een verminderde reactie op stimulatie.
8. VOORZORGSMAATREGELEN
Informatie voor de patiënt:
- Informeer de patiënt over de voordelen van een cochleair implantaat, en ook over de bijwerkingen die kunnen
optreden (zie §7).
- De bijgeleverde identicatiekaart moet volledig worden ingevuld en aan de drager worden gegeven.
- Vertel de patiënt dat hij/zij de identicatiekaart moet tonen voordat hij/zij een medisch onderzoek of behandeling
ondergaat.
- Raad de patiënt aan om de gebruiksinstructies bij de externe processor zorgvuldig te lezen, vooral het
hoofdstuk over de waarschuwingen voor gebruik.
- Vertel de patiënt dat hij contact moet opnemen met het implantatiecentrum in geval van storingen of defecten
van het cochleair implantaat.
- Contactsporten (rugby, boksen, enz.) zijn sterk afgeraden omdat krachtige stoten op de regio rond het
implantaat, dit kunnen beschadigen.
77

- Diepzeeduiken: recreatief diepzeeduiken dieper dan 20 m is niet aangeraden. Bovenmatige druk kan het
implantaat beschadigen. Het wordt bovendien ten stelligste afgeraden om aan professionele duikactiviteiten
deel te nemen. Herhaalde blootstelling aan bovenmatige druk valt niet onder de garantie van het apparaat.
- Toegang tot zones met beperkte toegang: gelieve een arts te raadplegen voordat u zones met beperkte
toegang binnengaat (MRI onderzoekskamer, doorgang door metaaldetectors, 3D-scancabines, enz.).
9. WAARSCHUWING, INTERACTIE MET KLINISCHE BEHANDELINGEN EN ONDERZOEKEN
- Waarschuwing: implanteerbare toestelonderdelen mogen niet opnieuw worden gebruikt als ze voordien al bij
een andere patiënt waren geïmplanteerd.
- Hoog-energetisch elektrisch veld
- Elektrotherapie: Elektrotherapie kan stromen van verschillende sterktes sturen. Het gebruik van elektrotherapie
met hoge spanning is verboden vanwege het risico op beschadiging van het implantaatsysteem. Elektrotherapie
met lage spanning kan echter worden overwogen als de elektroden niet in de nabijheid van het hoofd of de nek
worden geplaatst.
- Elektrochirurgie: Vermijd het gebruik van monopolaire elektrochirurgische instrumenten. Deze instrumenten
kunnen radiofrequentiegebieden opwekken via elektrische ladingen waardoor interactie kan ontstaan tussen
de tip van het instrument en de elektrodenbundel. Gegenereerde stromen kunnen het cochleaire weefsel
beschadigen of blijvende schade aan het implantaat veroorzaken. Zodra een cochleair implantaat in de
operatiekamer uit zijn verpakking wordt gehaald, moeten alle monopolaire scalpels worden uitgeschakeld om
schade aan het implantaat te voorkomen. Bipolaire elektrische scalpels kunnen nog wel worden gebruikt
als ze niet te dichtbij zijn en niet in direct in contact komen met het cochleaire implantaat.
- Elektroshock therapie en debrillatie: Elektrische schokken van verschillende duizenden volt door het
lichaam geleiden, is niet aangeraden bij een patiënt met een cochleair implantaat. Elektrische schokken
kunnen weefselbeschadiging in de cochlea veroorzaken of het implantaat blijvend beschadigen.
In een levensbedreigende situatie kan alleen het medische personeel een beslissing nemen. Gelieve contact
op te nemen met Neurelec als de situatie niet levensbedreigend is voor de patiënt.
- Medische diathermie: Elektromagnetische diathermie mag niet worden gebruikt bij patiënten met een
implantaat dat metaal bevat. Dat kan onherstelbare schade veroorzaken aan het weefsel (verbranden van de
cochlea) of het implantaat. Ultrasone diathermie kan worden overwogen op lichaamszones die het hoofd of
de nek niet raken.
- Diagnostische tests en behandelingen met echograe: Het implantaat mag niet worden blootgesteld aan
therapeutische niveaus van ultrasone energie. Het toestel kan onbedoeld het ultrasone veld concentreren en
beschadigd raken.
- Bestralingstherapie met ioniserende bestraling: Tijdens sessies met radiotherapie raden we directe bestraling
van de implantaatzone sterk af. Directe, massale blootstelling van het implantaat aan röntgenstraling kan gedeeltelijk
of volledig verlies veroorzaken van de implantaatfuncties. Deze schade is niet altijd onmiddellijk merkbaar.
- Niet-ioniserende elektromagnetische bestraling:
- MRI (Magnetische Resonantie beeldvorming): het Digisonic
®
SP implantaat bevat een permanente
magneet. Een MRI-onderzoek of sterk magnetisch veld nabij het implantaat kan het implantaat en/of de patiënt
schade toebrengen. Het is wel mogelijk om een MRI-onderzoek uit te voeren van 1,5 Tesla als de instructies
worden gevolgd. In dat geval dient de radioloog een onderzoeksformulier in te vullen, dat beschikbaar is op
de website, www.neurelec.com.
Raadpleeg de gebruikershandleiding van de processor voor meer informatie.
78

10. GEBRUIKSINSTRUCTIES
Let op!
Elektrochirurgie: Als het implantaat eenmaal op zijn plaats zit, mogen voor de rest van de chirurgische ingreep
geen monopolaire elektrochirurgische instrumenten worden gebruikt. Ze kunnen radiofrequentievelden veroorzaken
door elektrische ladingen te genereren die het implantaat kunnen beschadigen. Bipolaire elektrische scalpels
kunnen worden gebruikt zolang ze niet in de nabijheid van of in contact met het cochleaire implantaat komen.
Preoperatieve behandeling
- Voordat de Digisonic
bijzondere technische specicaties van het Digisonic
®
SP voor de eerste maal wordt geïmplanteerd, moet de chirurg vertrouwd geraken met de
®
SP cochleair implantaat en de bijbehorende chirurgische
techniek.
- Voor de implantatie moeten patiënten op de hoogte worden gebracht van de voordelen van een cochleair
implantaat, maar ook van de mogelijke secundaire risico’s (zie §7).
Intraoperatieve behandeling
- De plaats bepalen van de insnede en de positie van de ontvanger: Vooraleer een insnede te maken voor de
huidap is het aangeraden om de optimale plaats voor het systeem te bepalen. De plaats van de insnede moet
rekening houden met het feit dat het implantaat niet onder de oorschelp moet worden geplaatst, maar er ver
genoeg vanaf zodat er plaats blijft voor de achter-het-oorprocessor zonder dat deze interfereert met de externe
antenne. Bovendien moet de insnedelijn ver genoeg liggen van het implantaat om het risico op postoperatieve
extrusie of infectie te voorkomen. Het is daarom aangeraden om een steriele huidmarker te gebruiken om de
retroauriculaire insnedelijn te tekenen op ongeveer 1 cm afstand van de retroauriculaire plooi, en om de positie van
de ontvanger op ongeveer 2 cm afstand te tekenen van de oorschelp. Deze plaatsen kunnen worden bepaald met
behulp van de implantaat- en processormal (afzonderlijk geleverd op verzoek) die over het oor worden geplaatst.
Nadat de insnede is gemaakt, gebruikt u de implantaatmal om de plaats voor te bereiden zodat de ontvanger
correct wordt gepositioneerd. Het botoppervlak moet worden gecontroleerd omdat het vlak genoeg moet zijn
om de ontvanger op zijn plaats te houden met schroefjes.
- Het implantaat hanteren: Verwijder het implantaat uit de verpakking nadat de standaard operatieprocedures
tot aan de cochleostomie zijn uitgevoerd. Open de buitenverpakking en zorg ervoor dat het implantaat niet
beschadigd raakt. Knip de hechtdraden voorzichtig door terwijl u het implantaat op zijn plaats houdt en neem
het uit de steriele implantaathouder. Vermijd aanraking met en/of ombuiging van de elektrodenbundel. Gebruik
geen scherpe chirurgische instrumenten die de elektrodenbundel kunnen beschadigen.
®
- Het implantaat oriënteren: Het gegraveerde oppervlak van het Digisonic
SP implantaat (NEURELEC,
BOTTOM) dient niet zichtbaar te zijn in de conguratie voor gebruik en dient daarom naar de schedel toe
gedraaid te zijn. Deze plaat van titanium bevat, zoals hieronder genoemd, belangrijke informatie waarmee het
implantaat kan worden geïdenticeerd :
Informatie op
het oppervlak
aan de botkant
Naam van de
fabrikant
Serienummer (SN):
DR: Digisonic ontvanger
00: jaar van fabricage
K : SP versie
1234: volgnummer
Implantaattype (model): Het
Digisonic® SP implantaat
wordt geïdenticeerd met de
inscriptie DIGISONIC® SP.
79

- Bevestiging van het implantaat: voor het implantaatbed is vooraf boren niet nodig. Schuif de ontvanger
gewoon onder de slaapspier in de voorbereide zone met behulp van de silicone mal. Zorg ervoor dat het
implantaat correct is gepositioneerd en niet beweegt als er met de vinger op wordt geduwd. Voor de bevestiging
van het systeem dienen enkel de xatievleugeltjes van het implantaat gebruikt te
worden. De geïmplanteerde ontvanger moet worden gestabiliseerd om mogelijke
verschuiving te voorkomen, want dat kan spanning en mogelijk schade aan de
elektrodedraden veroorzaken. Het wordt daarom altijd aangeraden om het op zijn
plaats te bevestigen met de beide schroefjes die in de verpakking zijn meegeleverd
en in de implantaathouder geprepositioneerd zijn. Volg onderstaande stappen om
de schroeven uit de houder te halen:
• Zet de schroevendraaier (geleverd bij de oorspronkelijke operatiekit) op de
schroef met een stevige axiale kracht.
• Draai de schroef los terwijl u hem geleidelijk uit de houder trekt.
• De schroef zit nu vast op de schroevendraaier en kan worden gebruikt.
Plaats de eerste schroef voorzichtig in één van de titanium inzetstukken van het bevestigingssysteem. Het wordt
aangeraden om de schroevendraaier verticaal op de implantaatas te houden zodat de bevestiging gemakkelijker
verloopt. Draai de schroef vast tot er weerstand gevoeld wordt en trek dan geleidelijk de schroevendraaier terug
met een lichte cirkelbeweging. Controleer of hij vast zit en herhaal dezelfde procedure voor de tweede schroef.
Opmerking: Noch de chirurg noch een persoon die niet door Neurelec is aangesteld mag veranderingen
aanbrengen aan het implantaat (bijvoorbeeld aan het bevestigingssysteem).
- De elektrodenbundel inbrengen: Breng de elektrodenreeks zodanig in dat die daarna de cochleaire kromming
volgt. Leid de tip van de elektrodenbundel naar de basis van de scala tympani met behulp van de inbrengklem
of micro-juwelentang. Schuif daarna geleidelijk de elektrodenbundel naar voren met minimale kracht. Voltooi de
insertie door op de silicone extracochleaire drukringen te duwen. Na voltooiing van de insertie moeten de ringen
de cochleostomie blokkeren. De elektrodenbundel kan vastgemaakt worden om verschuiving te voorkomen.
Debevestigingsmethode en -punten hangen af van de operatieve toegang en de voorkeur van de chirurg.
- De referentie-elektrode positioneren: Plaats de kop van de extracochleaire referentie-elektrode tegen het
bot onder de slaapspier.
- Bevestigen van de werking van het implantaat: Impedantiemetingen, voor of na het hechten van de insnede,
kunnen de juiste werking van het implantaat bevestigen.
11. EXPLANTATIE
Wanneer een slechte werking van het Digisonic
®
SP implantaat wordt vermoed, moet het systeem worden
onderzocht met behulp van de klinische ondersteuning van Neurelec. Als de slechte werking van het implantaat
wordt bevestigd en het medische team besluit om te explanteren, is het belangrijk om contact op te nemen met
Neurelec. U krijgt dan informatie over de te volgen explantatieprocedure. Het is vooral belangrijk om Neurelec
te verzoeken om een explantatiekit, zodat het geëxplanteerde systeem kan worden teruggestuurd en het toestel
kan worden onderzocht door experts.
80

12. TECHNISCHE SPECIFICATIES VAN HET DIGISONIC® SP IMPLANTAAT
Primaire werking Cochleair implantaat
Wijze van stimuleren Gebalanceerde bifasische stimulatie
Stimulatiefrequentie 24.000 pps maximum (pps: pulsen per seconde)
- Impedantiemeting
- Meting van de voeding van het implantaat
Andere beschikbare functies
- Integriteitstest*
- EABR (Evoked Auditory Brainstem Response)*
- Stapediusreex
Psychoakoestische tests (gap test, enz.)*
* met bijhorende uitrusting
Gewicht 10,5 g
Afmetingen
Diameter 30,2 mm – Dikte: van 4,9 (rand) tot 5,75 mm
(midden)
Volume 4 cm3
- LSR 40 shore A silicone
- Silicone HCR 35 shore A en HCR 50 shore A
Materiaal in direct contact met menselijk weefsel
- Siliconenlijm
Platina/iridium 10%
- Titanium graad 2
- Titanium graad 5
13. PRESTATIEKENMERKEN
Kenmerken van het uitgangssignaal (bij weerstand
van 1 kΩ)
Max. 2V -255 µs
V: 0 tot 4V
I: 10 µA tot 2 mA
Δt: 10 µs tot 255 µs
Impedantiemeting Ja: normale waarden: 500Ω – 5kΩ
MRI-veiligheidsniveau
Aanbevolen methoden om te bepalen of het systeem
correct functioneert
Compatibel met 1,5 Tesla. Raadpleeg de
aanbevelingen
Ja. Impedantiemeting en integriteitstest
(metapparatuur)
14. SPECIFICATIES EN KENMERKEN VAN DE ELEKTRODENREEKS
Monopolaire elektrische conguraties Common ground
Aantal onafhankelijke actieve elektroden 20
Beperkte grootte van cochleostomie Diameter 1 mm
Algemene vorm Recht met vormgeheugen
Vorm bij apex Soepele tip
Vorm bij basis 2 drukringen met diameter 1,5 mm
Materialen
- Aansluitsnoer: platinum/iridium 10%
- Stimulatie-elektroden: platinum/iridium 10%
Isolering PEI (polyesterimide)
- Lengte: 26 mm
- Diameter aan de basis en bij de apex: 1,07 mm en
0,5 mm
Afmetingen
- Minimale en maximale oppervlakte van de stimulatieelektroden: 0,39 mm² en 0,77 mm²
- Afstand tussen elektroden: 0,7 mm
- Maximale afstand tussen proximale en distale
elektroden: 22,3 mm
- Neem voor de zekerheid contact op met de klantendienst van Neurelec in geval van twijfel over de vermelde
prestatie.
- Gelieve contact op te nemen met uw fabrikant of uw lokale distributeur als u opmerkingen hebt of als de
geboden informatie onvolledig is.
Digisonic
®
SP is een geregistreerd handelsmerk van Neurelec-Frankrijk
81

82

İÇİNDEKİLER
1. CİHAZ TANIM ............................................................................................................................ 84
Model Adı ........................................................................................................................................................ 84
Ticari Tanımlama .......................................................................................................................................... 84
Cihaz Tanımı ................................................................................................................................................... 84
2. PAKET İÇERİĞİ .......................................................................................................................... 84
3. UYUMLU AKSESUARLARIN LİSTESİ ........................................................................................ 84
4. SEMBOLLER VE ANLAMLARI ................................................................................................... 84
5. ENDİKASYONLAR ..................................................................................................................... 84
6. TIBBİ KONTRENDİKASYONLAR ............................................................................................... 85
7. İSTENMEYEN YAN ETKİLER ...................................................................................................... 85
8. ÖNLEMLER ................................................................................................................................ 85
9. DİKKAT, KLİNİK TEDAVİLER VE ARAŞTIRMALARLA ETKİLEŞİM ........................................... 86
Uyarı .................................................................................................................................................................. 86
Yüksek gerilimli elektrik alanı ................................................................................................................... 86
Elektroterapi .......................................................................................................................................... 86
Elektrocerrahi ........................................................................................................................................ 86
Elektroşok tedavisi ve debrilasyon .............................................................................................. 86
Cerrahi diyatermi .......................................................................................................................................... 86
Ultrason kullanılarak tanı testleri veya tedavi .................................................................................... 86
İyonlaştırıcı radyasyon ile radyasyon terapisi .................................................................................... 86
İyonlaştırıcı özelliği olmayan elektromanyetik radyasyon ............................................................ 86
10. KULLANMA TALİMATLARI ..................................................................................................... 87
11. EKSPLANTASYON ................................................................................................................... 89
12. DIGISONIC® SP İMPLANTIN TEKNİK ÖZELLİKLERİ ............................................................... 89
13. PERFORMANS ÖZELLİKLERİ .................................................................................................. 89
14. ELEKTROT DİZİNİNİN ÖZELLİKLERİ ...................................................................................... 89
MRI (Manyetik Rezonans Görüntüleme) ...................................................................................... 86
Elektrocerrahi ................................................................................................................................................. 87
Ameliyat öncesi yönetim ........................................................................................................................... 87
Ameliyat süreci yönetimi ........................................................................................................................... 87
İnsizyonu yerleştirme ve alıcıyı konumladırma......................................................................... 87
İmplantı taşıma ..................................................................................................................................... 87
İmplantı yönlendirme ........................................................................................................................ 87
İmplantı takma ..................................................................................................................................... 88
Elektrot dizinini yerleştirme ............................................................................................................. 88
Referans elektrotun yerleştirilmesi ................................................................................................ 88
İmplantın çalışıp çalışmadığını doğrulama ................................................................................ 88
83

1. CİHAZ TANIMI
• Model Adı
Digisonic® SP Koklear İmplant
• Ticari Tanımlama
I-SP-SD
• Cihaz tanımı
Digisonic® SP bilateral ileri (ikinci derece) ila çok ileri derece işitme kaybını tedavi etmek için tasarlanmış olan çok kanallı bir
koklear implanttır. Deri içinden geçen bu koklear implant, harici bir kulak arkası işlemci (DIGI SP/ SAPHYR®
SP) veya uzaktan
çalışan pile sahip, mikro bir kulak arkası işlemci (DIGI SP’K) ile birlikte çalışır. Elektromanyetik bağlantı sayesinde harici aktarıcı,
işlemci tarafından işlenen akustik sinyali kulak kepçesinin arkasındaki deriye implante edilmiş Digisonic® SP implanta iletir.
Le Digisonic® SP, kokleaya (iç kulak) yerleştirilen, 20 elektrotlu bir elektrot dizini içerir. Her elektrot, ayrı bir işitme siniri lini
uyarmakta olup harici işlemci tarafından işlenen ses sinyalinin frekans bandı ile ilişkilidir. İmplant ve harici aktarıcı, bir mıknatıs
içerir; böylece harici aktarıcı manyetik çekim ile implanta göre yerinde tutulur. Digisonic® SP’nin kendine ait bir elektrik güç
kaynağı bulunmamaktadır; çalışmak için gereken enerjiyi elektromanyetik bağlantı ile alır. Bunun sonucunda harici aktarıcı
Digisonic® SP’ye göre doğru bir biçimde konumlandırılmadığında, implant pasiftir.
2. PAKET İÇERİĞİ
1 Digisonic® SP (I-SP-SD) implant, 1 silikon implant kalıbı, 1 eklenti sistemi, 1 kullanıcı kimlik kartı ve beraberindeki belgeler.
3. UYUMLU AKSESUARLARIN LİSTESİ
İmplant aşağıdaki aksesuarlarla birlikte temin edilir:
• İmplantın deri altındaki konumunun doğruluğunu onaylamak için ameliyat sırasında kullanılan 1 silikon implant ölçme
aleti.
• İmplantı yerine sabitlemek için 2 adet kendinden oturan vida; bunlar herhangi bir ön delme işlemi gerektirmez.
4. SEMBOLLER VE ANLAMLARI
Katalog referansı Önemli. Birlikte gelen belgeleri okuyun
Sterilizasyon yöntemi: etilen oksit. Ürün steril
olarak temin edilmektedir
Nem seviyesini, %15 ila %75 arasında tutun.
Tek kullanımlık cihaz, tekrar kullanmayın Üretim tarihi
SAKLAMA: Serin ve kuru bir yerde saklayın.
Saklama sıcaklığı, -20° C ile +50° C arasındadır.
Parti kodu
Kırılabilir, dikkatli olun Son kullanma tarihi
Paket hasar görmüşse kullanmayın Seri numarası
Yeniden sterilize etmeyin Üretici
Atık elektrikli ve elektronik donanım (WEEE) Kullanma talimatları
5. ENDİKASYONLAR
Çok kanallı Digisonic® SP koklear implant, bir işitme cihazı kullanıldığında açık set formatında 60 dB HL’de konuşma
anlaşılabilirliği seviyesi %50’nin altında olan ciddi (2. derece) ila total bilateral işitme kaybı bulunan hastaların rehabilitasyonu
için tasarlanmıştır (bir tıp uzmanına danışılmalıdır).
84

6. TIBBİ KONTRENDİKASYONLAR
Digisonic® SP koklear implant, kokleasındaki (majör koklear malformasyon, temporal kemiğin petröz kısmında çatlak, ciddi
koklea osikasyonu), işitme sinirindeki (aksonal nöropati, nörinöma gibi işitme siniri yakınında ya da üzerinde bulunan tümör,
her iki işitme sinirinin tamamen hasar görmesi) ciddi lezyonlar sonucunda algısal işitme kaybı olan, işitme yollarında ileri
derecede anomali bulunan, akut veya kronik orta kulak koşullarına sahip olan (kulak zarı perforasyonu dahil), psikolojik olarak
dengesiz veya implant malzemelerine (silikon, platin iridyum, titanyum) temasla ilişkili alerjisi olan hastalarda endike değildir.
Diğer türdeki implantlar önerilebilir.
7. İSTENMEYEN YAN ETKİLER
Endikasyonlara uyan hastalar için implantasyon, üründen bağımsız olan, ameliyatla ilişkili tipik risklere (genel anestezi,
enfeksiyon vb. kaynaklı etkiler) sahiptir. Ancak, hastanın vücudunun implantı veya implantın bir bölümünü kabul etmeme riski
de vardır; bu risk, tasarımda biyolojik olarak uyumlu malzemeler kullanılarak azaltılmıştır.
Koklear implant ameliyat tekniği ile ilişkili komplikasyonlar (geçici veya kalıcı yüz felci, menenjial irritasyon sendorumu riski, tat
almada farklılıklar, baş dönmesi, kulak çınlaması vb.) nadiren görülür fakat dikkatle göz önünde bulundurulmaları gerekir. Tüm
implant adaylarını bu olası riskler hakkında bilgilendirmek önemlidir. Menenjial irritasyon sendromu semptomları ve başlangıç
belirtilerine ilişkin hastaya özel bilgi verilmelidir. Mevcut önerilere göre, pnömokok aşısı da özellikle önerilmektedir.
İmplant yerine yerleştirildiğinde, eksplantasyonla sonuçlanabilen belli riskler mevcuttur. Eksplantasyon, genel anestezi altında
başka bir cerrahi müdahale gerektirir. Eksplantasyon aşağıdaki durumlarda oluşabilir:
- Tıbbi komplikasyon
- İmplantın yanlış çalışması
- Travma sonucu cihazın yerinden oynaması
- İmplantın çıkarılması
Bu olası sorunlar, ürün tasarımı sırasında değerlendirilmiştir ve implantın malzemeleri ile tasarımı bu riskleri en aza indirecek
şekilde seçilmiştir.
Sonuç olarak, elektrotların yerleştirilmesine ve kronik elektriksel uyarıma ilişkin travmadan kaynaklı uzun süreli etkiler henüz
bilinmemektedir. Bu etkiler, koklea osikasyonu veya sinir lierinin bozulmasını içerebilir ve implantın değiştirilmesini
gerektirebilir ya da uyarıma daha az tepki verilmesine yol açabilir.
8. ÖNLEMLER
Hastaya verilmesi gereken bilgiler:
- Hastayı koklear implantın faydaları hakkında ve ayrıca meydana gelebilecek istenmeyen yan etkiler hakkında bilgilendirin
(bkz. §7).
- Verilen kimlik kartı tamamen doldurulmalı ve kullanacak kişiye verilmelidir.
- Hastayı, herhangi bir tıbbi inceleme veya tedavi öncesinde kimlik kartını göstermesi gerektiği konusunda bilgilendirin.
- Hastaya, özellikle kullanım uyarıları bölümü olmak üzere harici işlemci ile birlikte verilen kullanıcı talimatlarını dikkatle
okumasını tavsiye edin.
- Hastaya koklear implant sisteminin hata vermesi veya yanlış çalışması halinde implantasyon merkezi ile iletişime geçmesini
söyleyin.
- Temas sporları (ragbi, boks, vb.) özellikle tavsiye edilmez, çünkü ilgili implant alanına gelecek güçlü darbeler implanta zarar
verebilir.
85

- Sualtı dalışı: Rekreasyonal sualtı dalışı, 20 m’nin altındaki derinliklerde önerilmez. Aşırı basınç implanta zarar verebilir. Ayrıca,
implantın yinelenen yüksek basınçlara karşı garantili olmaması nedeniyle profesyonel derin dalış aktiviteleri de özellikle
önerilmez.
- Sınırlı alanlara erişim: Erişimi kısıtlanan alanlara (MRI inceleme odası, metal detektörlerden geçme, 3D tarama makinesi vb.)
girmeden önce lütfen doktorunuza danışın.
9. DİKKAT, KLİNİK TEDAVİLER VE ARAŞTIRMALARLA ETKİLEŞİM
- Uyarı: Daha öncesinde başka bir hastaya uygulanmış ise, implante edilebilir cihaz parçalarının yeniden kullanılmaması gerekir.
- Yüksek enerjili elektrik alanı:
- Elektroterapi: Elektroterapi, çeşitli güçlerde akımlar gönderebilir. Yüksek gerilimli elektrik akımına sahip elektroterapi
tekniklerinin kullanılması, implant sistemine hasar verme riskinden dolayı yasaklanmıştır. Ancak, düşük gerilimli elektroterapi,
yalnızca, elektrotlar baş veya boyun bölgesine yakın yerleştirilmemişse düşünülebilir.
- Elektrocerrahi: Tek kutuplu elektrocerrahi aletlerini kullanmaktan kaçının. Bu aletler, alet ucu ve elektrot dizini arasında
bağlantıya neden olabilen elektrik gerilimleri aracılığıyla radyo frekans alanları oluşturabilirler. İndüklenen akımlar, koklear
dokuya zarar verebilir veya implantta kalıcı bir hasara neden olabilir. İmplantın zarar görmesini önlemek için, koklear implant,
ameliyat odasında paketinden çıkarılır çıkarılmaz her türlü tek kutuplu neşterin kapatılması gerekir. Yine de, çift kutuplu
elektrikli neşterler, koklear implanta yakın olmadığı ve implantla doğrudan temasta bulunmadığı sürece kullanılabilir.
- Elektroşok tedavisi ve debrilasyon: Binlerce voltluk elektrik şokunu vücuda göndermek, koklear implant takan bir
hastada önerilmez. Elektrik şokları, kokleada doku hasarlarına veya implantta kalıcı hasara neden olabilir.
Hayati tehlike olan bir durumda, karar verme yetkisine sadece tıbbi ekip sahiptir. Durum hasta için hayati bir risk taşımıyorsa,
lütfen Neurelec ile iletişime geçin.
- Cerrahi diyatermi: Elektromanyetik diyatermi, metal içeren implantları olan hastalarda kullanılamaz. Bu, dokunun (kokleanın
yanması) veya implantın düzeltilemeyecek şekilde hasar görmesine neden olabilir. Yine de, ultrasonik diyaterminin, vücudun
başa veya boyuna değmeyen bölümlerinde kullanılması düşünülebilir.
- Ultrason kullanılarak tanı testleri veya tedavi: İmplantın, terapötik seviyelerdeki ultrason enerjisine maruz kalmaması
gerekir. Cihaz, farkında olmadan ultrasona konsantre olabilir ve zarar görebilir.
- İyonlaştırıcı radyasyon ile radyasyon terapisi: Radyasyon terapi seansları boyunca, implant bölgesinin doğrudan
radyasyona maruz kalmamasını özellikle öneriyoruz. İmplantın doğrudan aşırı ışın maruziyeti altında olması, implant
fonksiyonlarının kısmen ya da tamamen kaybolmasına neden olabilir. Bu hasar hemen anlaşılamayabilir.
- İyonlaştırıcı özelliği olmayan elektromanyetik radyasyon:
- MRI (Manyetik Rezonans Görüntüleme): Digisonic® SP implantı, kalıcı bir mıknatısa sahiptir. İmplantın yakınına
uygulanan bir MRI veya yoğun bir manyetik alan, implanta ve/veya hastaya zarar verebilir. Yine de, öneriler uygulandığı
sürece 1,5 Tesla’da MRI gerçekleştirmek mümkündür. Bu durumda, radyologun tavsiyelere uygun biçimde bir inceleme
formu doldurması gerekir, bu forma şuradan ulaşılabilirsiniz: www.neurelec.com.
Daha fazla bilgi için işlemci kullanma kılavuzuna bakın.
86

10. KULLANMA TALİMATLARI
Lütfen dikkat!
Elektrocerrahi: İmplant yerine yerleştirildikten sonra, cerrahi prosedürün geri kalan kısmında herhangi bir tek kutuplu
elektrocerrahi aletinin kullanılmaması gerekir. Bu aletler, implanta zarar verebilecek elektriksel gerilimler üreterek radyo frekansı
alanları oluşturabilirler. Çift kutuplu elektrikli neşterler, koklear implantın yakınında olmadığı veya implant ile temasa
girmediği sürece kullanılabilirler.
Ameliyat öncesi yönetim
- Digisonic® implantasyonunu ilk kez gerçekleştirmeden önce, operatörün Digisonic® SP koklear implantının özel teknik
özelliklerine ve ilişkili cerrahi tekniğe dair bilgisinin olması gerekir.
- İmplantasyondan önce, hastalar koklear implantın faydaları ve olası ikincil riskleri hakkında bilgilendirilmelidir. (bkz. §7).
Ameliyat süreci yönetimi
- İnsizyonu yerleştirme ve alıcıyı konumlandırma: Cilt apı için insizyonu gerçekleştirmeden önce, implante edilen
sistemin optimum alanının belirlenmesi önerilir. Bunu yaparken implantın, harici aktarıcıya müdahale edilmeksizin işlemciyi
takan hastaya yer bırakmak amacıyla, kulak kepçesinin aşağısında olmadan yeterli uzaklıkta bir alana yerleştirilmesi gerektiği
göz önünde bulundurularak, insizyon lokasyonunun belirlenmesi gerekir. Ayrıca, çıkmasını ve ameliyat sonrası enfeksiyon
riskini önlemek için insizyonun, implanttan yeterli uzaklıkta olması gerekir. Retrooriküler insizyon hattı açıklığını retroauriküler
kıvrımdan yaklaşık olarak 1 cm uzakta ve alıcının konumunu kulak kepçesinden yaklaşık olarak 2 cm uzakta çizmek için steril
bir cilt kalemi kullanılması önerilir. Bu lokasyonlar, kulağın üzerinde bulunan implant kalıbı ve işlemci (talep üzerine ayrı olarak
temin edilir) kullanılarak belirlenebilirler.
İnsizyonu gerçekleştirdikten sonra, alıcının düzgün şekilde konumlandırılması için gereken lokasyonu hazırlamak üzere implant
kalıbını kullanın. Kemik yüzeyin, akabinde alıcıyı, vidalarla kolayca takacak kadar düz olup olmadığından emin olmak için kontrol
edilmesi gerekir.
- İmplantı taşıma: İmplantı, kokleostominin başlangıcına kadarki tüm standart cerrahi prosedürleri tamamladıktan sonra
paketinden çıkarın. İmplantın zarar görmediğinden emin olarak dış ambalajı açın. İmplantı yerinde tutan birleşme dişlerini
dikkatlice kestikten sonra implantı steril implant tutucusundan çıkarın. Elektrot dizinine dokunmaktan veya dizini bükmekten
kaçının. Elektrot dizinine zarar verebilecek keskin cerrahi aletler kullanmayın.
- İmplantı yönlendirme: Digisonic® SP implantın (NEURELEC, BOTTOM) desenli yüzü, kullanım için konumlandırmada
görünür olmamalıdır ve bu nedenle kafatasına doğru çevrilmelidir. Bu titanyum metal plaka üzerinde, aşağıda belirtildiği üzere,
implantı belirlemek için önemli bilgiler yer almaktadır:
Kemik tarafı
yüzeydeki
Üreticinin adı
bilgiler
Seri numarası (SN):
DA: Digisonic Alıcı
00: üretim yılı
K: SP sürümü
1234: artımsal numara
İmplant tipi (model): Digisonic®
SP implant, DIGISONIC® SP
yazısı ile tanımlanır
87

- İmplantı takma: İmplant yatağı için hiçbir kemiğin delinmesine gerek yoktur. Sadece alıcıyı, silikon kalıbı kullanarak hazırlanan
lokasyona, temporal kasın altına doğru kaydırın. İmplantın gerekli şekilde yerleştiğinden ve parmakla baskı uygulandığında
hareket edemediğinden emin olun. İmplantın montaj tırnaklarına sadece sistemi takmak için erişim gereklidir. İmplante edilen
alıcının, gerginlik oluşturabilecek ve elektrot tellerine zarar verebilecek olası herhangi bir
kaymayı önlemek için verilen vidalarla sabitlenmesi gerekir. Bu nedenle her zaman, pakette
verilen akıllı vidalarla yerine sabitlenmesi ve implant alanına önceden yerleştirilmesi önerilir.
Tutucudan vidaları sökmek için aşağıdaki adımları uygulayın:
• Kuvvetli eksenel basınç uygulayarak tornavidayı (başlangıç cerrahi kitinde verilen) vidaya
yerleştirin.
• Tutucudan yavaşça geri çekerek vidayı sökün.
• Vida artık tornavidaya bağlıdır ve kullanılabilir.
İlk vidayı haf bir şekilde ksasyon sisteminin titanyum girişlerinden birine yerleştirin. Bağlantıyı daha kolay bir şekilde yapmak
için tornavidayı, dikey olarak tutmanız önerilir. Direnç hissedene kadar vidayı sıkın, ardından tornavidayı, ufak dairesel bir hareket
yaparak kademeli olarak geri çekin. Sabit olup olmadığını kontrol edin, ardından aynı prosedürü ikinci vida için de tekrarlayın.
Not: Neurelec tarafından yetkili olmayan cerrah ya da herhangi biri, implantta değişiklik yapamaz (ksasyon sisteminde olduğu gibi).
- Elektrot dizininin yerleştirilmesi: Elektrot-dizinini takıldıktan sonra, koklear sarmalı takip edebilecek şekilde yönlendirin.
Elektrot-dizininin ucunu yerleştirme kıskacını veya küçük pensleri kullanarak scala tympaninin tabanına doğru ilerletin,
ardından elektrot dizinini, mümkün olan en düşük kuvvetle kademeli olarak yerleştirin. Referans olarak silikon ekstrakoklear
itme halkalarını aşağı doğru bastırarak yerleştirmeyi tamamlayın. Yerleştirme tamamlandığında, halkaların kokleostomiyi
engellemesi gerekir. Elektrot dizini, kayma riskini önlemek için takılabilir. Takma yöntemi ve takma noktaları, cerrahi erişime ve
cerrahın tercihlerine bağlı olacaktır.
- Referans elektrotun yerleştirilmesi: Ekstrakoklear referans bilye tipi elektrotu, temporal kasın altında bulunan kemiğe
karşı yerleştirin.
- İmplantın çalışıp çalışmadığını doğrulama: Empedans ölçümleri, insizyondan önce veya sonra, implante edilen cihazın
çalışıp çalışmadığını doğrulayabilir.
11. EKSPLANTASYON
Digisonic® SP implantın doğru şekilde çalışmadığından şüphelenilirse, sistemin Neurelec klinik desteğinin yardımıyla bir
uzman tarafından incelenmesi gerekir. İmplantın doğru çalışmadığı onaylanırsa ve tıbbi ekip çıkarma kararı alırsa, izlenecek
eksplantasyon prosedürlerine dair sizi bilgilendirecek olan Neurelec ile iletişime geçmeniz önemlidir. Neurelec’ten özellikle bir
eksplantasyon kiti talep etmeniz önemlidir, bu sayede çıkarılan sistem geri gönderilebilir, böylece cihaz bir uzman tarafından
incelenebilir.
88

12. DIGISONIC® SP İMPLANTIN TEKNİK ÖZELLİKLERİ
Birincil fonksiyon Koklear implant
Uyarım modu Dengeli bifazik uyarım
Uyarım oranı 24,000 pps maksimum (pps: saniyedeki sinyal)
- Empedans ölçümü
- İmplantın gücünün ölçülmesi
Mevcut diğer fonksiyonlar
- Bütünlük testi*
- EABR (Uyarılmış İşitsel Beyinsapı Cevabı)*
- Stapes reeksi
Psikoakustik testler (gap testi, vb.)*
* İlgili ekipmanla birlikte
Ağırlık 10,5 g
Boyutlar Çap 30,2 mm – Kalınlık: 4,9 (kenar) ila 5,75 mm (orta)
Hacim 4 cm3
- LSR 40 shore A silikon
- Silikon HCR 35 shore A ve HCR 50 shore A
İnsan dokusuyla doğrudan teması olan malzeme
- Yapışkan silikon
- Platin iridyum %10
- Titanyum derecesi 2
- Titanyum derecesi 5
13. PERFORMANS ÖZELLİKLERİ
Çıkış sinyalinin özellikleri (1 kΩ’luk dirençte) Maks 2 V -255 µs
U: 0 ila 4V
I: 10 µA ila 2 m A
Δt: 10 µs ila 255 µs
Empedans ölçümü Evet: Normal değerler: 500 Ω ila 5 kΩ
MRI güvenlik seviyesi 1,5 Tesla ile uyumludur. Tavsiyelere bakın
Sistemin gerektiği şekilde çalışıp çalışmadığının
belirlenmesi için tavsiye edilen yöntemler
Evet. Empedans ölçümü ve bütünlük testi
(derleme ekipmanı ile birlikte)
14. ELEKTROT DİZİNİNİN ÖZELLİKLERİ
Tek kutuplu elektriksel kongürasyonlar Ortak topraklama
Bağımsız aktif elektrotların sayısı 20
Azaltılmış kokleostomi boyutu 1 mm çap
Genel şekil Biçim belleği ile orantılı
Apeksteki şekil Yumuşak uç
Bazaldaki şekil 1,5 mm çapta iki itme halkası
Bileşen malzemeleri
- Bağlama teli: Platin iridyum %10
- Uyarım elektrotları: Platin iridyum %10
Yalıtım PEI (polyesterimid)
- Uzunluk: 26mm
- Bazal ve apeksteki çap: 1,07 mm ve 0,5 mm
Boyutlar
- Uyarım elektrotlarının minimum ve maksimum yüzey alanı:
0,39 mm² ve 0,77 mm²
- Elektrotlar arasındaki mesafe: 0,7 mm
- Proksimal ve distal elektrotlar arasındaki maksimum mesafe:
22,3 mm
- Belirtilen performans konusunda tereddüt olması durumunda, güvenliğiniz için lütfen Neurelec müşteri hizmetleri ile
iletişime geçin.
- Herhangi bir yorumunuz varsa veya sağlanan bilgiler yetersizse, lütfen üreticinizle ya da yerel distribütörünüzle iletişime
geçin.
Digisonic®
SP, Neurelec-Fransa’nın tescilli ticari markasıdır
89

90

ΠΕΡΙΕΧΟΜΕΝΑ
1. ΠΕΡΙΓΡΑΦΗ ΣΥΣΚΕΥΗΣ ........................................................................................................... 92
Όνομα μοντέλου .......................................................................................................................................... 92
Εμπορική αναγνώριση ............................................................................................................................... 92
Περιγραφή συσκευής ................................................................................................................................. 92
2. ΠΕΡΙΕΧΟΜΕΝΑ ΣΥΣΚΕΥΑΣΙΑΣ ................................................................................................. 92
3. ΛΙΣΤΑ ΣΥΜΒΑΤΩΝ ΕΞΑΡΤΗΜΑΤΩΝ ........................................................................................ 92
4. ΣΥΜΒΟΛΑ ΚΑΙ ΣΗΜΑΣΙΑ ......................................................................................................... 92
5. ΕΝΔΕΙΞΕΙΣ ................................................................................................................................. 92
6. ΙΑΤΡΙΚΕΣ ΑΝΤΕΝΔΕΙΞΕΙΣ ......................................................................................................... 93
7. ΑΝΕΠΙΘΥΜΗΤΕΣ ΠΑΡΕΝΕΡΓΕΙΕΣ ............................................................................................ 93
8. ΠΡΟΦΥΛΑΞΕΙΣ .......................................................................................................................... 93
9. ΠΡΟΣΟΧΗ, ΑΛΛΗΛΕΠΙΔΡΑΣΗ ΜΕ ΚΛΙΝΙΚΕΣ ΘΕΡΑΠΕΙΕΣ ΚΑΙ ΜΕΛΕΤΕΣ.............................. 94
Προσοχή .......................................................................................................................................................... 94
Ηλεκτρικό πεδίο υψηλής ενέργειας ....................................................................................................... 94
Ηλεκτροθεραπεία ................................................................................................................................ 94
Ηλεκτροχειρουργική .......................................................................................................................... 94
Ηλεκτροσυσπαστική θεραπεία και απινίδωση ......................................................................... 94
Ιατρική διαθερμία ........................................................................................................................................ 94
Διαγνωστικές εξετάσεις και θεραπεία με υπερήχους ...................................................................... 94
Ακτινοθεραπεία με ιονίζουσα ακτινοβολία ........................................................................................ 94
Μη ιονίζουσα ηλεκτρομαγνητική ακτινοβολία ................................................................................. 94
10. ΟΔΗΓΙΕΣ ΧΡΗΣΗΣ .................................................................................................................. 95
11. ΑΦΑΙΡΕΣΗ .............................................................................................................................. 97
12. ΤΕΧΝΙΚΕΣ ΠΡΟΔΙΑΓΡΑΦΕΣ ΤΟΥ ΕΜΦΥΤΕΥΜΑΤΟΣ DIGISONIC® SP.................................... 97
13. ΧΑΡΑΚΤΗΡΙΣΤΙΚΑ ΑΠΟΔΟΣΗΣ ............................................................................................. 97
14. ΠΡΟΔΙΑΓΡΑΦΕΣ ΚΑΙ ΧΑΡΑΚΤΗΡΙΣΤΙΚΑ ΤΗΣ ΔΙΑΤΑΞΗΣ ΗΛΕΚΤΡΟΔΙΩΝ ........................... 97
MRI (Απεικόνιση μαγνητικού συντονισμού) ............................................................................... 94
Ηλεκτροχειρουργική ................................................................................................................................... 95
Προεγχειρητική διαχείριση ....................................................................................................................... 95
Διεγχειρητική διαχείριση ........................................................................................................................... 95
Προσδιορισμός του σημείου της τομής και τοποθέτηση του δέκτη ................................ 95
Χειρισμός του εμφυτεύματος .......................................................................................................... 95
Προσανατολισμός του εμφυτεύματος ......................................................................................... 95
Στερέωση του εμφυτεύματος ......................................................................................................... 96
Εισαγωγή της διάταξης ηλεκτροδίων ........................................................................................... 96
Τοποθέτηση του ηλεκτροδίου αναφοράς .................................................................................. 96
Επαλήθευση της λειτουργίας του εμφυτεύματος .................................................................... 96
91

1. ΠΕΡΙΓΡΑΦΗ ΣΥΣΚΕΥΗΣ
• Όνομα μοντέλου
Κοχλιακό εμφύτευμα Digisonic® SP
• Εμπορική αναγνώριση
I-SP-SD
• Περιγραφή συσκευής
Το Digisonic® SP είναι ένα πολυκάναλο κοχλιακό εμφύτευμα που προορίζεται για την αποκατάσταση σοβαρής (δευτέρου
βαθμού) έως πολύ σοβαρής αμφοτερόπλευρης αντιληπτικής κώφωσης. Αυτό το διαδερμικό κοχλιακό εμφύτευμα λειτουργεί
με έναν εξωτερικό οπισθοωτιαίο επεξεργαστή (DIGI SP/ SAPHYR®
SP) ή με έναν οπισθοωτιαίο μικρο-επεξεργαστή με
απομακρυσμένη μπαταρία (DIGI SP’K). Μέσω της ηλεκτρομαγνητικής σύζευξης, μια εξωτερική κεραία μεταδίδει το ακουστικό
σήμα που επεξεργάζεται ο επεξεργαστής στο εμφύτευμα Digisonic® SP που είναι εμφυτευμένο κάτω από το δέρμα πίσω από
το πτερύγιο του αυτιού.
Το Digisonic® SP διαθέτει μια διάταξη ηλεκτροδίων με 20 ηλεκτρόδια που εισάγεται στον κοχλία (εσωτερικό αυτί). Κάθε
ηλεκτρόδιο διεγείρει ένα διαφορετικό σύνολο ακουστικών νευρικών ινών και αντιστοιχεί σε ένα εύρος συχνοτήτων του
ηχητικού σήματος που επεξεργάζεται ο εξωτερικός επεξεργαστής. Το εμφύτευμα και η εξωτερική κεραία περιέχουν
ένα μαγνήτη. Ηεξωτερική κεραία μένει στη θέση της σε σχέση με το εμφύτευμα μέσω μαγνητικής έλξης. Το Digisonic®
SP δεν περιέχει δική του πηγή ηλεκτρικής τροφοδοσίας. Λαμβάνει την ενέργεια που απαιτείται για τη λειτουργία από την
ηλεκτρομαγνητική σύζευξη. Συνεπώς, όταν η εξωτερική κεραία δεν βρίσκεται στη σωστή θέση σε σχέση με το Digisonic® SP,
το εμφύτευμα δεν είναι ενεργό
2. ΠΕΡΙΕΧΟΜΕΝΑ ΣΥΣΚΕΥΑΣΙΑΣ
1 εμφύτευμα Digisonic® SP (I-SP-SD), 1 πρότυπο εμφυτεύματος από σιλικόνη, 1 σύστημα στερέωσης, 1 αναγνωριστική κάρτα
χρήστη και συνοδευτικά έγγραφα.
3. ΛΙΣΤΑ ΣΥΜΒΑΤΩΝ ΕΞΑΡΤΗΜΑΤΩΝ
Το εμφύτευμα παρέχεται με τα παρακάτω εξαρτήματα:
• 1 μετρητή εμφυτεύματος από σιλικόνη που χρησιμοποιείται κατά τη διάρκεια του χειρουργείου για να επαληθευτεί η
σωστή τοποθέτηση του εμφυτεύματος κάτω από το δέρμα.
• 2 αυτοδιάτρητες βίδες που χρησιμοποιούνται για τη στερέωση του εμφυτεύματος στη θέση του. Δεν απαιτείται διάνοιξη
οπής εκ των προτέρων.
4. ΣΥΜΒΟΛΑ ΚΑΙ ΣΗΜΑΣΙΑ
Κωδικός καταλόγου
Μέθοδος αποστείρωσης: οξείδιο
του αιθυλενίου Το προϊόν παρέχεται
αποστειρωμένο
Σημαντικό. Διαβάστε τη συνοδευτική
τεκμηρίωση
Διατήρηση του επιπέδου υγρασίας μεταξύ
15% και 75%.
Συσκευή μιας χρήσης, μην επαναχρησιμοποιείτε Ημερομηνία κατασκευής
ΣΥΝΘΗΚΕΣ ΦΥΛΑΞΗΣ: φυλάσσεται σε δροσερό,
ξηρό μέρος. Θερμοκρασία φύλαξης μεταξύ
-20° C και +50° C.
Κωδικός παρτίδας
Εύθραυστο, χειριστείτε με προσοχή Ημερομηνία λήξης
Μη χρησιμοποιείτε σε περίπτωση που έχει
προκληθεί φθορά στη συσκευασία
Κωδικός αριθμός
Μην αποστειρώνετε εκ νέου Κατασκευαστής
Απόβλητα ηλεκτρικού και ηλεκτρονικού
εξοπλισμού (WEEE)
Οδηγίες χρήσης
5. ΕΝΔΕΙΞΕΙΣ
Το πολυκάναλο κοχλιακό εμφύτευμα Digisonic® SP έχει σχεδιαστεί για την αποκατάσταση ασθενών με 2ου βαθμού σοβαρή
έως ολική αμφοτερόπλευρη απώλεια ακοής με επίπεδο καταληπτότητας της ομιλίας μικρότερο από 50% στα 60 dB HL σε
ανοικτή μορφή με τη χρήση ακουστικού βοηθήματος (απαιτείται επαγγελματική ιατρική γνωμάτευση).
92

6. ΙΑΤΡΙΚΕΣ ΑΝΤΕΝΔΕΙΞΕΙΣ
Το κοχλιακό εμφύτευμα Digisonic® SP δεν ενδείκνυται για ασθενείς με αντιληπτική απώλεια ακοής που συνοδεύεται από
σημαντικές αλλοιώσεις στον κοχλία (σοβαρή κοχλιακή δυσπλασία, κάταγμα λιθοειδούς τμήματος του κροταφικού οστού,
σημαντική οστεοποίηση του κοχλία), στο ακουστικό νεύρο (νευραξονική νευροπάθεια, όγκος κοντά ή στο ακουστικό νεύρο
όπως νεύρωμα, πλήρης καταστροφή και των δύο ακουστικών νεύρων), σοβαρή ανωμαλία των ακουστικών οδών, οξείες ή
χρόνιες παθήσεις του μέσου αυτιού (συμπεριλαμβανομένης της διάτρησης του τυμπανικού υμένα), που είναι ψυχολογικά
ασταθείς ή έχουν αλλεργία εξ επαφής στα υλικά του εμφυτεύματος (σιλικόνη, ιρίδιο πλατίνας, τιτάνιο). Mπορεί να προταθούν
άλλοι τύποι εμφυτευμάτων.
7. ΑΝΕΠΙΘΥΜΗΤΕΣ ΠΑΡΕΝΕΡΓΕΙΕΣ
Για ασθενείς που πληρούν τις ενδείξεις, η εμφύτευση ενέχει τους τυπικούς κινδύνους που σχετίζονται με τις χειρουργικές
επεμβάσεις (επιπτώσεις από τη γενική αναισθησία, μολύνσεις, κ.λπ.) και οι οποίοι είναι ανεξάρτητοι από το ίδιο το προϊόν.
Ωστόσο, υπάρχει επίσης κίνδυνος το σώμα του ασθενή να απορρίψει το εμφύτευμα ή μέρος του εμφυτεύματος. Ο κίνδυνος
αυτός έχει μειωθεί με τη χρήση βιοσυμβατικών υλικών στο σχεδιασμό.
Οι επιπλοκές που σχετίζονται με τη χειρουργική τεχνική του κοχλιακού εμφυτεύματος (προσωρινή ή μόνιμη παράλυση του
προσώπου, κίνδυνος συνδρόμου μηνιγγικού ερεθισμού, αλλαγές στη γεύση, ζαλάδα, εμβοή, κ.λπ.) είναι σπάνιες, αλλά πρέπει
να λαμβάνονται υπόψη προσεκτικά. Είναι σημαντικό να ενημερώνετε κάθε υποψήφιο κοχλιακού εμφυτεύματος σχετικά με
αυτούς τους πιθανούς κινδύνους. Πρέπει να παρέχονται συγκεκριμένες πληροφορίες στον ασθενή σχετικά με τα συμπτώματα
και τα αρχικά σημάδια του συνδρόμου μηνιγγικού ερεθισμού. Σύμφωνα με τις τρέχουσες συστάσεις, συνιστάται επίσης
ιδιαίτερα το εμβόλιο πνευμονιόκοκκου.
Μόλις το εμφύτευμα τοποθετηθεί στη θέση του, υφίστανται ορισμένοι κίνδυνοι που μπορεί να προκαλέσουν την αφαίρεση.
Ηαφαίρεση απαιτεί μια ακόμα χειρουργική επέμβαση υπό γενική αναισθησία. Η αφαίρεση μπορεί να προκύψει στις παρακάτω
περιπτώσεις:
- Ιατρική επιπλοκή
- Δυσλειτουργία εμφυτεύματος
- Μετατόπιση της συσκευής ως αποτέλεσμα τραυματισμού
- Εξώθηση του εμφυτεύματος
Αυτά τα πιθανά προβλήματα αξιολογήθηκαν κατά τη διάρκεια του σχεδιασμού του προϊόντος και τα υλικά και ο σχεδιασμός
του εμφυτεύματος έχουν επιλεγεί για την ελαχιστοποίηση αυτών των κινδύνων.
Τέλος, οι μακροπρόθεσμες επιπτώσεις από το τραύμα που σχετίζεται με την εισαγωγή των ηλεκτροδίων και τη χρόνια
ηλεκτρική διέγερση δεν είναι γνωστές αυτή τη στιγμή. Οι επιπτώσεις αυτές μπορεί να περιλαμβάνουν την οστεοποίηση του
κοχλία ή την εκφύλιση των νευρικών ινών και ενδέχεται να απαιτείται αντικατάσταση του εμφυτεύματος ή να προκληθεί
μειωμένη απόκριση στη διέγερση.
8. ΠΡΟΦΥΛΑΞΕΙΣ
Πληροφορίες που πρέπει να παρέχονται στον ασθενή:
- Ενημερώστε τον ασθενή σχετικά με τα οφέλη ενός κοχλιακού εμφυτεύματος, αλλά και για τις ανεπιθύμητες παρενέργειες που
μπορεί να παρουσιαστούν (βλ. §7).
- Η παρεχόμενη κάρτα αναγνώρισης πρέπει να συμπληρωθεί και να δοθεί στο χρήστη.
- Ενημερώστε τον ασθενή ότι πρέπει να παρουσιάζει την κάρτα αναγνώρισης πριν από οποιαδήποτε ιατρική εξέταση ή
θεραπεία.
- Συστήστε στον ασθενή να διαβάσει προσεκτικά τις οδηγίες χρήσης που παρέχονται με τον εξωτερικό επεξεργαστή του,
ιδιαίτερα την ενότητα που σχετίζεται με τις προειδοποιήσεις κατά τη χρήση.
- Συστήστε στον ασθενή να επικοινωνήσει με το κέντρο εμφύτευσης σε περίπτωση βλάβης ή δυσλειτουργίας του συστήματος
κοχλιακού εμφυτεύματος.
- Τα αθλήματα επαφής (ράγκμπι, μποξ, κ.λπ.) δεν συνιστώνται καθόλου, καθώς τυχόν δυνατές προσκρούσεις στην περιοχή του
εμφυτεύματος μπορεί να του προκαλέσουν βλάβη.
93

- Καταδύσεις: Οι ερασιτεχνικές καταδύσεις δεν συνιστώνται σε βάθος μεγαλύτερο των 20m. Η υπερβολική πίεση μπορεί να
καταστρέψει το εμφύτευμα. Επίσης, δεν συνιστάται καθόλου η ενασχόληση με επαγγελματικές δραστηριότητες κατάδυσης
ανοιχτής θάλασσας, καθώς το εμφύτευμα δεν καλύπτεται με εγγύηση για επανειλημμένη καταπόνηση από υψηλή πίεση.
- Χώροι ελεγχόμενης πρόσβασης: Συμβουλευτείτε έναν ιατρό πριν εισέλθετε σε χώρους ελεγχόμενης πρόσβασης (αίθουσα
εξέτασης MRI, πύλες ανίχνευσης μεταλλικών αντικειμένων, θάλαμοι σάρωσης 3D, κ.λπ.).
9. ΠΡΟΣΟΧΗ, ΑΛΛΗΛΕΠΙΔΡΑΣΗ ΜΕ ΚΛΙΝΙΚΕΣ ΘΕΡΑΠΕΙΕΣ ΚΑΙ ΜΕΛΕΤΕΣ
- Προσοχή: Τα εμφυτεύσιμα μέρη της συσκευής δεν πρέπει να επαναχρησιμοποιούνται αν έχουν προηγουμένως εμφυτευτεί
σε άλλο ασθενή.
- Ηλεκτρικό πεδίο υψηλής ενέργειας:
- Ηλεκτροθεραπεία: Η ηλεκτροθεραπεία μπορεί να χρησιμοποιεί ρεύμα διάφορων εντάσεων. Η χρήση τεχνικών
ηλεκτροθεραπείας ηλεκτρικού ρεύματος υψηλής τάσης απαγορεύεται λόγω του κινδύνου πρόκλησης βλάβης στο
σύστημα εμφυτεύματος. Ωστόσο, η χρήση ηλεκτροθεραπείας χαμηλής τάσης μπορεί να εξεταστεί μόνο αν τα ηλεκτρόδια
δεν τοποθετούνται σε περιοχές κοντά στο κεφάλι ή το λαιμό.
- Ηλεκτροχειρουργική: Αποφύγετε τη χρήση μονοπολικών ηλεκτροχειρουργικών εργαλείων. Τα εργαλεία αυτά μπορεί
να δημιουργήσουν πεδία ραδιοσυχνοτήτων με ηλεκτρική τάση που θα μπορούσε να δημιουργήσει σύζευξη μεταξύ του
άκρου του εργαλείου και της διάταξης ηλεκτροδίων. Το ρεύμα εξ επαγωγής μπορεί να προκαλέσει βλάβη στον κοχλιακό
ιστό ή μόνιμη βλάβη στο εμφύτευμα. Μόλις το κοχλιακό εμφύτευμα αφαιρεθεί από τη συσκευασία του στο χειρουργείο,
τυχόν μονοπολικά νυστέρια πρέπει να απενεργοποιηθούν για την αποφυγή πρόκλησης βλάβης στο εμφύτευμα. Ωστόσο,
τα διπολικά ηλεκτρικά νυστέρια μπορούν να χρησιμοποιηθούν εφόσον δεν είναι κοντά και δεν έρθουν σε άμεση επαφή
με το κοχλιακό εμφύτευμα.
- Ηλεκτροσυσπαστική θεραπεία και απινίδωση: Η μετάδοση ηλεκτρικών σοκ πολλών χιλιάδων volt μέσω του σώματος
δεν συνιστάται σε ασθενείς που φέρουν κοχλιακό εμφύτευμα. Τα ηλεκτρικά σοκ μπορεί να προκαλέσουν βλάβη στον ιστό
του κοχλία ή να προκαλέσουν μόνιμη βλάβη στο εμφύτευμα.
Σε απειλητική για τη ζωή κατάσταση, μόνο η ιατρική ομάδα είναι σε θέση να λάβει μια απόφαση. Αν η κατάσταση δεν είναι
απειλητική για τη ζωή του ασθενή, επικοινωνήστε με τη Neurelec.
- Ιατρική διαθερμία: Η ηλεκτρομαγνητική διαθερμία δεν μπορεί να χρησιμοποιηθεί σε ασθενείς με εμφυτεύματα που
περιέχουν μέταλλο. Μπορεί να προκληθεί µη αναστρέψιµη βλάβη στον ιστό (κάψιμο του κοχλία) ή στο εμφύτευμα. Ωστόσο,
η χρήση της υπερηχητικής διαθερμίας μπορεί να εξεταστεί για περιοχές του σώματος που δεν ακουμπούν το κεφάλι
ή το λαιμό.
- Διαγνωστικές εξετάσεις και θεραπείες με υπερήχους: Το εμφύτευμα δεν πρέπει να εκτίθεται σε θεραπευτικά επίπεδα
υπερηχητικής ενέργειας. Η συσκευή μπορεί κατά λάθος να συγκεντρώσει τους υπερήχους και να υποστεί βλάβη.
- Ακτινοθεραπεία με ιονίζουσα ακτινοβολία: Κατά τη διάρκεια συνεδριών ακτινοθεραπείας, δεν συνιστάται η απευθείας
ακτινοβολία της περιοχής του εμφυτεύματος. Η απευθείας, μαζική έκθεση του εμφυτεύματος στην ακτινοβολία μπορεί
να προκαλέσει μερική ή ολική απώλεια των λειτουργιών του εμφυτεύματος. Η βλάβη αυτή δεν είναι απαραιτήτως άμεσα
παρατηρήσιμη.
- Μη ιονίζουσα ηλεκτρομαγνητική ακτινοβολία:
- MRI (Απεικόνιση μαγνητικού συντονισμού): Το εμφύτευμα Digisonic® SP περιέχει έναν μόνιμο μαγνήτη. Μια
εξέταση MRI ή η εφαρμογή ισχυρού μαγνητικού πεδίου στην περιοχή του εμφυτεύματος μπορεί να προκαλέσει βλάβη
στο εμφύτευμα ή/και στον ασθενή. Ωστόσο, είναι εφικτή η πραγματοποίηση εξέτασης MRI στα 1,5 Tesla ακολουθώντας
τις συστάσεις. Σε αυτήν την περίπτωση, ο ακτινολόγος θα πρέπει να συμπληρώσει το έντυπο εξέτασης που είναι διαθέσιμο
στον διαδικτυακό τόπο www.neurelec.com.
Ανατρέξτε στο εγχειρίδιο χρήσης του επεξεργαστή για περισσότερες πληροφορίες.
94

10. ΟΔΗΓΙΕΣ ΧΡΗΣΗΣ
Επισήμανση!
Ηλεκτροχειρουργική: Μόλις το εμφύτευμα τοποθετηθεί στη θέση του, η υπόλοιπη χειρουργική επέμβαση δεν πρέπει
να περιλαμβάνει τη χρήση μονοπολικών ηλεκτροχειρουργικών εργαλείων. Τα εργαλεία αυτά μπορεί να δημιουργήσουν
πεδία ραδιοσυχνοτήτων με ηλεκτρική τάση που θα μπορούσε να προκαλέσει βλάβη στο εμφύτευμα. Διπολικά ηλεκτρικά
νυστέρια μπορούν να χρησιμοποιηθούν εφόσον δεν χρησιμοποιηθούν κοντά και δεν έρθουν σε επαφή με το κοχλιακό
εμφύτευμα.
Προεγχειρητική διαχείριση
- Πριν από την εκτέλεση της πρώτης εμφύτευσης του Digisonic® SP, ο χειρουργός θα πρέπει να εξοικειωθεί με τις συγκεκριμένες
τεχνικές προδιαγραφές του κοχλιακού εμφυτεύματος Digisonic® SP και της σχετικής χειρουργικής τεχνικής.
- Πριν από την εμφύτευση, οι ασθενείς πρέπει να ενημερώνονται σχετικά με τα οφέλη του κοχλιακού εμφυτεύματος και για
τους πιθανούς δευτερεύοντες κινδύνους (βλ. §7).
Διεγχειρητική διαχείριση
- Προσδιορισμός του σημείου της τομής και τοποθέτηση του δέκτη: Πριν από την πραγματοποίηση της τομής για
τον κρημνό δέρματος, συνιστάται ο προσδιορισμός της βέλτιστης τοποθεσίας για το εμφυτευμένο σύστημα. Έτσι, για τον
προσδιορισμό του σημείου της τομής θα πρέπει να λαμβάνεται υπόψη ότι το εμφύτευμα δεν πρέπει να τοποθετηθεί κάτω από
το πτερύγιο αλλά αρκετά μακριά ώστε ο ασθενής να μπορεί να φοράει τον οπισθοωτιαίο επεξεργαστή χωρίς να ενοχλείται
από τη θέση της εξωτερικής κεραίας. Επιπλέον, η γραμμή της τομής πρέπει να βρίσκεται αρκετά μακριά από το εμφύτευμα
ώστε να αποφεύγεται ο κίνδυνος μετεγχειρητικής εξώθησης ή μόλυνσης. Συνεπώς, συνιστάται η χρήση ενός αποστειρωμένου
μολυβιού δέρματος για το σχεδιασμό της οπισθοωτιαίας γραμμής της τομής περίπου 1cm μακριά από την οπισθοωτιαία
πτυχή και της θέσης του δέκτη περίπου 2 cm μακριά από το πτερύγιο του αυτιού. Οι θέσεις αυτές μπορούν να καθοριστούν
τοποθετώντας το πρότυπο εμφυτεύματος και το πρότυπο επεξεργαστή (παρέχονται ξεχωριστά εφόσον ζητηθούν) στο αυτί.
Μετά από την πραγματοποίηση της τομής, χρησιμοποιήστε το πρότυπο εμφυτεύματος για την προετοιμασία της τοποθεσίας
ώστε ο δέκτης να τοποθετηθεί σωστά. Πρέπει να ελεγχθεί η επιφάνεια του οστού για να επαληθευτεί ότι είναι αρκετά επίπεδη
ώστε, στη συνέχεια, να στερεωθεί με ευκολία ο δέκτης στη θέση του με βίδες.
- Χειρισμός του εμφυτεύματος: Αφαιρέστε το εμφύτευμα από τη συσκευασία μόνο αφού ολοκληρωθούν οι τυπικές
χειρουργικές διαδικασίες έως και την έναρξη της κοχλιοστομίας. Ανοίξτε την εξωτερική συσκευασία και βεβαιωθείτε ότι το
εμφύτευμα δεν έχει υποστεί φθορά. Αφού κόψετε προσεκτικά τα νήματα ράμματος που συγκρατούν το εμφύτευμα στη θέση
του, αφαιρέστε απαλά το εμφύτευμα από την αποστειρωμένη θήκη του. Αποφύγετε να ακουμπήσετε ή/και να λυγίσετε τη
διάταξη ηλεκτροδίων. Μη χρησιμοποιείτε αιχμηρά χειρουργικά εργαλεία που μπορεί να προκαλέσουν βλάβη στη διάταξη
ηλεκτροδίων.
- Προσανατολισμός του εμφυτεύματος: Η χαραγμένη πλευρά του εμφυτεύματος Digisonic® SP (NEURELEC, BOTTOM) δεν
πρέπει να είναι ορατή στη διαμόρφωση για χρήση και συνεπώς πρέπει να είναι στραμμένη προς το κρανίο. Αυτή η πλάκα από
μέταλλο τιτανίου περιέχει σημαντικές πληροφορίες που ταυτοποιούν το εμφύτευμα ως εξής:
Πληροφορίες στην
επιφάνεια που είναι
στραμμένη προς το οστό
Κωδικός αριθμός (SN):
DR: Δέκτης Digisonic
00: έτος κατασκευής
K: έκδοση SP
1234: αύξων αριθμός
95
Όνομα
κατασκευαστή
Τύπος εμφυτεύματος (μοντέλο):
Το εμφύτευμα Digisonic®
SP αναγνωρίζεται από την
επιγραφή DIGISONIC® SP

- Στερέωση του εμφυτεύματος: Δεν απαιτείται η δημιουργία οπής με φρέζα στο οστό για την υποδοχή του εμφυτεύματος.
Απλώς ολισθήστε το δέκτη κάτω από τον κροταφικό μυ στην προετοιμασμένη θέση χρησιμοποιώντας το πρότυπο σιλικόνης.
Επαληθεύστε ότι το εμφύτευμα είναι τοποθετημένο σωστά και δεν μπορεί να μετακινηθεί εφαρμόζοντας πίεση με το δάκτυλο.
Για τη στερέωση του συστήματος, απαιτείται πρόσβαση μόνο στις προεξοχές στήριξης
του εμφυτεύματος. Ο εμφυτευμένος δέκτης πρέπει να στερεωθεί για την αποφυγή τυχόν
μετατόπισης, που θα προκαλούσε τάση και πιθανή βλάβη στα καλώδια των ηλεκτροδίων.
Συνιστάται, συνεπώς, η στερέωσή του στη θέση του με τις δύο αυτοδιάτρητες βίδες που
παρέχονται στη συσκευασία και είναι προτοποθετημένες στη θήκη του εμφυτεύματος.
Ακολουθήστε τα παρακάτω βήματα για να αφαιρέσετε τις βίδες από τη θήκη:
• Εισάγετε το κατσαβίδι (παρέχεται με το αρχικό χειρουργικό κιτ) στη βίδα
χρησιμοποιώντας σταθερή αξονική πίεση.
• Ξεβιδώστε τη βίδα αφαιρώντας την αργά από τη θήκη.
• Η βίδα είναι τώρα συνδεδεμένη στο κατσαβίδι και μπορεί να χρησιμοποιηθεί.
Τοποθετήστε απαλά την πρώτη βίδα σε μια από τις υποδοχές τιτανίου του συστήματος στερέωσης. Συνιστάται να κρατάτε
το κατσαβίδι κάθετα προς τον άξονα του εμφυτεύματος για να είναι ευκολότερη η στερέωση. Σφίξτε τη βίδα έως ότου
νιώσετε αντίσταση και, στη συνέχεια, απομακρύνετε βαθμιαία το κατσαβίδι με μια ελαφριά κυκλική κίνηση. Ελέγξτε ότι είναι
στερεωμένη και επαναλάβετε την ίδια διαδικασία για τη δεύτερη βίδα.
Σημείωση: Ούτε ο χειρουργός ούτε οποιοδήποτε άτομο που δεν είναι εξουσιοδοτημένο από τη Neurelec μπορεί να
πραγματοποιήσει αλλαγές στο εμφύτευμα (όπως στο σύστημα στερέωσης).
- Εισαγωγή της διάταξης ηλεκτροδίων: Κατευθύνετε τη διάταξη ηλεκτροδίων με τέτοιο τρόπο ώστε να εισαχθεί
ακολουθώντας την έλικα του κοχλία. Καθοδηγήστε το άκρο της διάταξης ηλεκτροδίων προς τη βάση της τυμπανικής κλίμακας
χρησιμοποιώντας την αρπάγη εισαγωγής ή μικρή λαβίδα και εισάγετε σταδιακά τη διάταξη ηλεκτροδίων, ασκώντας όσο το
δυνατόν λιγότερη δύναμη. Ολοκληρώστε την εισαγωγή πιέζοντας προς τα κάτω τους εξωκοχλιακούς δακτυλίους ώθησης από
σιλικόνη. Μόλις ολοκληρωθεί η εισαγωγή, οι δακτύλιοι πρέπει να φράζουν την κοχλιοστομία. Η διάταξη ηλεκτροδίων μπορεί
να στερεωθεί για την αποφυγή του κινδύνου μετατόπισης. Η μέθοδος στερέωσης και τα σημεία στερέωσης εξαρτώνται από τη
χειρουργική πρόσβαση και τις προτιμήσεις του χειρουργού.
- Τοποθέτηση του ηλεκτροδίου αναφοράς: Τοποθετήστε την κεφαλή του εξωκοχλιακού σφαιρικού ηλεκτροδίου
αναφοράς πάνω στο οστό κάτω από τον κροταφικό μυ.
- Επαλήθευση της λειτουργίας του εμφυτεύματος: Οι μετρήσεις σύνθετης αντίστασης, πριν ή μετά από το κλείσιμο της
τομής, μπορούν να επιβεβαιώσουν τη σωστή λειτουργία της εμφυτευμένης συσκευής.
11. ΑΦΑΙΡΕΣΗ
Αν υπάρχει υποψία δυσλειτουργίας του εμφυτεύματος Digisonic® SP, το σύστημα πρέπει να ελεγχθεί από ειδικό με τη βοήθεια
της κλινικής υποστήριξης της Neurelec. Αν επιβεβαιωθεί δυσλειτουργία του εμφυτεύματος και η ιατρική ομάδα αποφασίσει
την αφαίρεσή του, πρέπει να επικοινωνήσετε με τη Neurelec, η οποία θα σας ενημερώσει σχετικά με τη διαδικασία αφαίρεσης
που πρέπει να ακολουθηθεί. Είναι ιδιαίτερα σημαντικό να ζητηθεί ένα κιτ αφαίρεσης από τη Neurelec ώστε το αφαιρεθέν
σύστημα να επιστραφεί, καθιστώντας εφικτή την εξέταση της συσκευής από ειδικό.
96

12. ΤΕΧΝΙΚΕΣ ΠΡΟΔΙΑΓΡΑΦΕΣ ΤΟΥ ΕΜΦΥΤΕΥΜΑΤΟΣ DIGISONIC® SP
Κύρια λειτουργία Κοχλιακό εμφύτευμα
Τρόπος διέγερσης Ισορροπημένη διφασική διέγερση
Ρυθμός διέγερσης 24.000 pps μέγ. (pps: σφυγμοί ανά δευτερόλεπτο)
- Μέτρηση σύνθετης αντίστασης
- Μέτρηση της ισχύος του εμφυτεύματος
- Δοκιμή ακεραιότητας*
Άλλες διαθέσιμες λειτουργίες
- EABR (Evoked Auditory Brainstem Response-Ακουστικά
Προκλητά Δυναμικά Εγκεφαλικού Στελέχους)*
- Ακουστικό αντανακλαστικό
Ψυχοακουστικές δοκιμές (δοκιμή κενού, κ.λπ.)*
* Με σχετικό εξοπλισμό
Βάρος 10,5 g
Διαστάσεις
Διάμετρος 30,2 mm – Πάχος: κυμαίνεται από 4,9 (άκρο) έως
5,75 mm (κέντρο)
Όγκος 4 cm3
- Σιλικόνη LSR 40 shore A
- Σιλικόνη HCR 35 shore A και HCR 50 shore A
Υλικό σε απευθείας επαφή με τον ανθρώπινο ιστό
- Συγκολλητική σιλικόνη
- Ιριδίου πλατίνας 10%
- Τιτάνιο βαθμού 2
- Τιτάνιο βαθμού 5
13. ΧΑΡΑΚΤΗΡΙΣΤΙΚΑ ΑΠΟΔΟΣΗΣ
Χαρακτηριστικά του σήματος εξόδου (με αντίσταση 1 kΩ) Μέγ. 2V -255µs
V: 0 έως 4V
I: 10 µA έως 2 mA
Δt: 10 µs έως 255 µs
Μέτρηση σύνθετης αντίστασης Ναι: Φυσιολογικές τιμές: 500Ω – 5kΩ
Επίπεδο ασφαλείας απεικόνισης μαγνητικού συντονισμού (MRI)
Συνιστώμενες μέθοδοι για τον καθορισμό της σωστής
λειτουργίας του συστήματος
Συμβατό με 1,5 Tesla. Ανατρέξτε στις συστάσεις
Ναι. Μέτρηση σύνθετης αντίστασης και δοκιμή
ακεραιότητας (με εξοπλισμό συλλογής)
14. ΠΡΟΔΙΑΓΡΑΦΕΣ ΚΑΙ ΧΑΡΑΚΤΗΡΙΣΤΙΚΑ ΤΗΣ ΔΙΑΤΑΞΗΣ ΗΛΕΚΤΡΟΔΙΩΝ
Μονοπολικές ηλεκτρικές διατάξεις Κοινή γείωση
Αριθμός ανεξάρτητων ενεργών ηλεκτροδίων 20
Μειωμένο μέγεθος κοχλιοστομίας Διάμετρος 1 mm
Γενικό σχήμα Ίσιο με μνήμη σχήματος
Σχήμα στην κορυφή Μαλακό άκρο
Σχήμα στη βάση Δύο δακτύλιοι ώθησης διαμέτρου 1,5 mm
Υλικά συστατικών στοιχείων
- Σύρμα σύνδεσης: Ιριδίου πλατίνας 10%
- Ηλεκτρόδια διέγερσης: Ιριδίου πλατίνας 10%
Μόνωση PEI (πολυεστεριμίδιο)
- Μήκος: 26mm
- Διάμετρος στη βάση και την κορυφή: 1,07 mm και 0,5 mm
Διαστάσεις
- Ελάχιστη και μέγιστη έκταση επιφάνειας των ηλεκτροδίων
διέγερσης: 0,39 mm² και 0,77 mm²
- Απόσταση μεταξύ των ηλεκτροδίων: 0,7 mm
- Μέγιστη απόσταση μεταξύ των εγγύς και άπω ηλεκτροδίων:
22,3 mm
- Σε περίπτωση αμφιβολιών σχετικά με την καθορισμένη απόδοση, επικοινωνήστε με το τμήμα εξυπηρέτησης πελατών της
Neurelec για την ασφάλειά σας.
- Αν έχετε σχόλια ή αν οι πληροφορίες που παρέχονται δεν είναι πλήρεις, επικοινωνήστε με τον κατασκευαστή ή τον τοπικό
αντιπρόσωπο.
Η επωνυμία Digisonic®
SP είναι εμπορικό σήμα κατατεθέν της Neurelec-France
97

98

СОДЕРЖАНИЕ
1. ОПИСАНИЕ УСТРОЙСТВА ...................................................................................................... 100
Наименование модели ............................................................................................................................ 100
Коммерческое обозначение ................................................................................................................. 100
Описание устройства ............................................................................................................................... 100
2. СОДЕРЖИМОЕ УПАКОВКИ .................................................................................................... 100
3. СПИСОК СОВМЕСТИМЫХ АКСЕССУАРОВ ............................................................................ 100
4. ОБОЗНАЧЕНИЯ И ЗНАЧЕНИЯ................................................................................................. 100
5. ПОКАЗАНИЯ ............................................................................................................................ 100
6. МЕДИЦИНСКИЕ ПРОТИВОПОКАЗАНИЯ .............................................................................. 101
7. НЕБЛАГОПРИЯТНЫЕ ПОБОЧНЫЕ ЭФФЕКТЫ ...................................................................... 101
8. МЕРЫ ПРЕДОСТОРОЖНОСТИ ............................................................................................... 101
9. ВНИМАНИЕ, ВЗАИМОДЕЙСТВИЕ С КЛИНИЧЕСКИМ ЛЕЧЕНИЕМ И ИССЛЕДОВАНИЯМИ .... 102
Внимание ....................................................................................................................................................... 102
Электрическое поле высокой интенсивности .............................................................................. 102
Электротерапия ................................................................................................................................. 102
Электрохирургия ............................................................................................................................... 102
Электрошоковая терапия и дефибрилляция ........................................................................ 102
Медицинская диатермия ........................................................................................................................ 102
Диагностические исследования и лечение с использованием ультразвука ................. 102
Радиационная терапия с ионизирующим излучением ............................................................ 102
Неионизирующая электромагнитная радиация.......................................................................... 102
МРТ (магнитно-резонансная томография)............................................................................. 102
10. ИНСТРУКЦИЯ ПО ПРИМЕНЕНИЮ ....................................................................................... 103
Электрохирургия ........................................................................................................................................ 103
Предоперационные действия .............................................................................................................. 103
Действия во время операции ............................................................................................................... 103
Определение места разреза и расположение приемника ............................................ 103
Обращение с имплантатом ........................................................................................................... 103
Ориентирование имплантата ...................................................................................................... 103
Крепление имплантата .................................................................................................................... 104
Установка комплекта электродов .............................................................................................. 104
Крепление референтного электрода ....................................................................................... 104
Подтверждение функционирования импланта ................................................................... 104
11. ИЗВЛЕЧЕНИЕ ИМПЛАНТАТА ................................................................................................ 105
12. ТЕХНИЧЕСКИЕ ХАРАКТЕРИСТИКИ ИМПЛАНТАТА DIGISONIC® SP .................................. 105
13. РАБОЧИЕ ХАРАКТЕРИСТИКИ .............................................................................................. 105
14. СПЕЦИФИКАЦИИ И ХАРАКТЕРИСТИКИ КОМПЛЕКТА ЭЛЕКТРОДОВ ............................. 105
99

1. ОПИСАНИЕ УСТРОЙСТВА
• Наименование модели
Кохлеарный имплантат Digisonic® SP
• Коммерческое обозначение
I-SP-SD
• Описание устройства
Digisonic® SP – многоканальный кохлеарный имплантат, предназначенный для реабилитации двусторонней тяжелой
(второй степени) и глубокой перцептивной глухоты. Этот чрезкожный кохлеарный имплантат работает совместно с
заушным внешним процессором (DIGI SP/ SAPHYR®
SP) или заушным микропроцессором с удаленной батарейкой
(DIGI SP’K). С помощью электромагнитной связи внешняя антенна передает обработанный процессором акустический
сигнал в имплантат Digisonic® SP, имплантированный под кожу позади ушной раковины.
Digisonic® SP содержит массив электродов, состоящий из 20 электродов, вставленных в улитку (внутреннее ухо). Каждый
электрод стимулирует свой комплект звуковых нервных волокон и связан с частотным диапазоном звукового сигнала,
обработанного процессором. Имплантат и внешняя антенна содержат магнит и внешняя антенна, таким образом,
удерживается на месте относительно имплантата благодаря магнитному притяжению. У Digisonic® SP нет собственного
источника питания, он получает необходимую для функционирования энергию благодаря электромагнитной связи.
Следовательно, когда внешняя антенна неправильно расположена относительно Digisonic® SP, имплантат пассивен
2. СОДЕРЖИМОЕ УПАКОВКИ
1 имплантат Digisonic® SP (I-SP-SD), 1 силиконовый шаблон имплантата, 1 система крепления, 1 идентификационная
карточка пользователя и сопроводительная документация.
3. СПИСОК СОВМЕСТИМЫХ АКСЕССУАРОВ
Имплантат поставляется со следующими аксессуарами:
• 1 силиконовый шаблон имплантата, используемый во время операции для проверки правильности расположения
имплантата под кожей.
• 2 самонарезных винта для крепления имплантата в месте установки; они не требуют предварительного сверления.
4. ОБОЗНАЧЕНИЯ И ЗНАЧЕНИЯ
Каталожная ссылка
Метод стерилизации: этиленоксид Изделие
поставляется стерильным
Устройство для одноразового
использования, не использовать повторно
ХРАНЕНИЕ: хранить в сухом прохладном
месте. Хранить при температуре от -20° C
до +50° C.
Важно. Ознакомьтесь с сопроводительной
документацией
Поддерживайте влажность в диапазоне
15% - 75%.
Дата изготовления
Номер партии
Хрупкое изделие; обращаться осторожно Использовать до даты
Не использовать, если упаковка повреждена Серийный номер
Не стерилизовать повторно Изготовитель
Утилизация электрического и электронного
оборудования (WEEE)
Инструкция по применению
5. ПОКАЗАНИЯ
Многоканальный кохлеарный имплантат Digisonic® SP предназначен для реабилитации пациентов с потерей слуха
от 2-й тяжелой степени до полной двусторонней потери слуха с уровнем разборчивости речи менее 50% при 60
дБ HL в формате открытой системы с использованием слухового аппарата (необходимо профессиональное мнение
медицинского специалиста).
100
 Loading...
Loading...