Page 1

Model 5212 Instruction Manual
Page 2

Assembled in the United States of America
SpinalStim Device Patent No.
U.S. 5,743,844
U.S. 6,132,362
U.S. 6,261,221
Page 3

The SpinalStim™ Device Instruction Manual
Table of Contents
Prescription Information .............................................................................
• Indications ............................................................................................
• Contraindication ...................................................................................
• Warnings ..............................................................................................
• Precautions ...........................................................................................
• Adverse Effects .....................................................................................
Device Information ......................................................................................
• Device Description ................................................................................
• How the SpinalStim Device Works ........................................................
• Device Life ............................................................................................
Device Operation .........................................................................................
• Turning the Device On and Off.............................................................
• Treatment Instructions .........................................................................
• Timing of Treatment Sessions ...............................................................
• Charging the Battery ............................................................................
• Visual and Audio Indicators ..................................................................
• Wearing the Device ..............................................................................
• Sizing the Device ..................................................................................
Device Accessories .....................................................................................
Device Use and Care .................................................................................
• Care and Cleaning ..............................................................................
• Storage ...............................................................................................
• Travel ..................................................................................................
• Disposal ..............................................................................................
• Service ................................................................................................
Clinical Information ...................................................................................
• Clinical Data Summary .......................................................................
• Adjunct Clinical Trial ...........................................................................
• Failed Fusion Clinical Trial ...................................................................
Equipment Classification ...........................................................................
SpinalStim Device Classifications ...............................................................
Compliance Statements ............................................................................
Warranty ...................................................................................................
1
1
1
1
1
1
2
2
2
2
3
3
4
4
4
6
7
9
11
11
11
12
12
13
13
14
14
14
15
16
17
17
19
Device Box Components
1 – SpinalStim Device
1 – Power Supply
1 – Literature Pack
Orthofix Patient Services: 800-535-4492 or 214-937-2718
To learn more about Orthofix, please visit our website at www.orthofix.com.
Page 4

Prescription Information
Indications
The SpinalStim device is a noninvasive electromagnetic bone growth stimulator
indicated as a spinal fusion adjunct to increase the probability of fusion success
and as a nonoperative treatment of salvage of failed spinal fusion, where a
minimum of nine months has elapsed since the last surgery.
Contraindication
Cardiac pacemakers may be adversely affected by exposure to PEMF. Use of
this device is contraindicated where the individual has an implanted cardiac
pacemaker.
Warnings
• Although animal teratological studies performed with the device
demonstrated no adverse findings, the safety of use of this device
during pregnancy and nursing in humans has not been established.
• The safety and effectiveness of the use of this device on individuals
lacking skeletal maturity have not been established.
• Animal studies conducted to date do not suggest any long-term adverse
effects from the use of a similar device. However, long-term effects in
humans are unknown.
Precautions
• This device should not be used if there are mental or physical conditions
which preclude compliance with the physician and device instructions.
• This device has not been evaluated in treating patients with the
following conditions: osseous or ligamentous spinal trauma, spondylitis,
Paget’s disease, moderate to severe osteoporosis, metastatic cancer, renal
disease, and uncontrolled diabetes mellitus.
• The results of premarketing data from the randomized double-masked
cohort indicate that inconsistent users (defined as those patients that used
the device for less than an average of two hours per day) had
success rates similar to those in the placebo group. Therefore, the use of
the device for less than the minimum recommended usage may result in
lower success rates.
Adverse Effects
Rare instances of reversible minor discomfort have been reported. These
were: cumbersome or uncomfortable, minor tingling or pain, minor skin rash,
insomnia, fainting, nausea/diarrhea, and polymenorrhea.
Please refer to the Compliance Statements section of the manual for
compatibility information regarding implantable medical devices.
1
Page 5

Device Information
Device Description
The SpinalStim device is an external unit that generates a Pulsed
Electromagnetic Field (PEMF) as a nonsurgical, prescription treatment
to increase the chances of a successful fusion. The device is lightweight,
adjustable, and portable, including a rechargeable battery that allows
freedom of movement during treatment. A Liquid Crystal Display (LCD) and
audible indicators provide important feedback during treatment. See “Device
Operation” for more information.
Front
Treatment
Coil
LCD
1:59
Back Treatment Coil
Control
Unit
Model 5212
How the SpinalStim Device Works?
To enhance bone healing after a fusion surgery, PEMF therapy activates
and augments the body’s natural healing process that may be impaired in
some people.
The SpinalStim device contains a Control Unit and Treatment Coils in one
integrated device. A micro-processor generates the SpinalStim device’s electrical
signal, which is a highly uniform, low-energy electromagnetic field sent from
the treatment coils. When the coils are centered over the treatment area, the
therapeutic SpinalStim device PEMF signal is delivered through clothing and skin
directly to the fusion site.
To learn more about bone growth stimulation, please visit our patient website
at www.BoneGrowthTherapy.com.
Device Life
The SpinalStim device provides daily treatments for up to 365 days. The
physician determines the overall length of treatment (months/weeks) on an
individual basis according to fusion healing progress.
2
Page 6

Device Operation
Turning the Device On and Off
The SpinalStim device can be turned on by pressing the On/Off Button on
the Control Unit of the device until it beeps.
When the device is turned on, a status screen will display the number
of days since the first use, the treatment status, and the
compliance percentage.
The LCD will show the prescribed treatment time remaining and the
battery status.
The flashing colon on the LCD screen and On/Off button indicate that the
device is on and delivering treatment.
The SpinalStim device can be turned off by pressing and holding the On/
Off Button on the Control Unit of the device until it beeps.
The On/Off Button on the Control Unit doubles as a Backlight to light up
the LCD. In low light, press the On/Off Button to light up the LCD.
Control Unit
LCD Treatment Indicator
Charging Port
1:59
On/Off Button
3
Page 7

Treatment Instructions
• The SpinalStim device should be worn each day for the number of hours
prescribed by a physician (a minimum of 2 hours/day).
• The SpinalStim device may be used at any time of day that is most
convenient for the patient.
• The device is programmed to reset the treatment clock daily at midnight
Central Standard Time, unless adjusted by a physician or Orthofix
representative for a different time zone.
• Hours worn prior to the reset time will be logged and stored in the device
for monitoring daily use compliance.
• The overall treatment duration (number of months/weeks) will vary based
on specific patient conditions as determined by a physician.
• Because the SpinalStim device is lightweight and portable, treatment
can be received while sitting, walking, reclining, sleeping, etc. However,
since each patient is unique, the overall activity level should be based on
physician instructions.
Timing of Treatment Sessions
• The SpinalStim device tracks the treatment time; this tracking (or timing)
begins when the device is turned on and at least one minute of
treatment is complete.
• The LCD shows a countdown of the daily treatment time remaining.
•
To stop treatment at any point, simply press and hold the On/Off Button
until you hear a beep.
• To resume treatment, press the On/Off button again.
• The countdown will resume at the remaining treatment time.
• When daily treatment is completed, the device will automatically
turn off.
Charging the Battery
The SpinalStim device is powered by a rechargeable lithium-ion battery pack.
The battery pack will provide at least one full treatment before needing to be
recharged. A power supply to charge the battery is provided with the device.
Use only the Orthofix power supply to charge the battery (Part no. Orthofix
20110412, 20114794, WR9QA1200U23KIT(R6B), or 20123808).
To ensure that the device is functioning properly, the SpinalStim device
constantly monitors battery voltage and the electrical signal. The LCD will
display a battery capacity symbol and the device will beep to alert the patient
when the battery is low and will soon need to be recharged.
The SpinalStim device should be charged before the first use and every day
after completing treatment. Do not wear the device while charging. The device
will not deliver treatment while charging.
4
Page 8

Follow these steps to recharge the battery:
1. Open the Charging Port Cover.
2. Plug the Charging Connector into the Charging Port located on the
Control Unit.
3. Plug the power supply into any standard AC Wall Outlet. Do not plug in
the power supply for the SpinalStim device where it will be difficult to
unplug.
4. The Control Unit LCD will display a battery symbol filling to verify that
the device is charging. When the battery reaches a complete charge,
a check mark symbol will be displayed next to the battery symbol. In
addition, the device will beep once to alert the patient.
5. If the battery is fully depleted, it may require up to 4 hours to charge
completely.
6. After charging is complete, remove the Charging Connector and replace
the Charging Port Cover.
Angled Corners
AC Power Supply
AC Charging Connector
Charging Port Cover
5
Page 9

Visual and Audio Indicators
The LCD and audible beeps are designed to provide helpful information
to the user. The screens, symbols, and beeps are explained below.
Compliance Screen
170/185 = 91.9%
Treatment Screen
1:59
Treatment Complete
Charging Screen
Charging Complete
Low Battery Warning Screen
1:59
Battery must be charged
to turn on
Compliance Screen – Displays a compliance percentage
which is calculated by the number of full treatments days
completed over the number of available treatment days.
u
The treatments days available begin once the device has
been delivered to the patient and a minute of treatment
time has been established.
Treatment Screen – displays the treatment time remaining
in hours and minutes. The timer counts down to zero until
u
daily treatment is complete.
Daily Prescribed Treatment complete
u
Battery Charging – Battery symbol filling repeatedly
u
verifies that the device is charging.
Charging Complete – Indicates when the battery is
u
fully charged.
Low Battery – Displays along with three fast beeps
u
when recharging is recommended.
E12345678
E12345678
Device Expired
Exception Screen
E123
1-800-535-4492
Battery Empty – Indicates that the battery must be
u
charged before treatment may continue.
Device Expired – Display of a closed lock indicates the
u
device has been available for treatment for 365 days
and will no longer provide treatment.
Exception Codes – Display of ERROR, any E codes
(e.g., E01, E02), along with three slow beeps. Contact
u
Patient Services at 800-535-4492 or 214-937-2718.
6
Page 10

Wearing the Device
The SpinalStim device can be worn over bracing and clothing. Proper
treatment does not require direct contact with the body. However, the coils
must be centered around the fusion site to be effective. Users can gently bend
and shape the treatment coils to fit more comfortably around the body.
7
Page 11
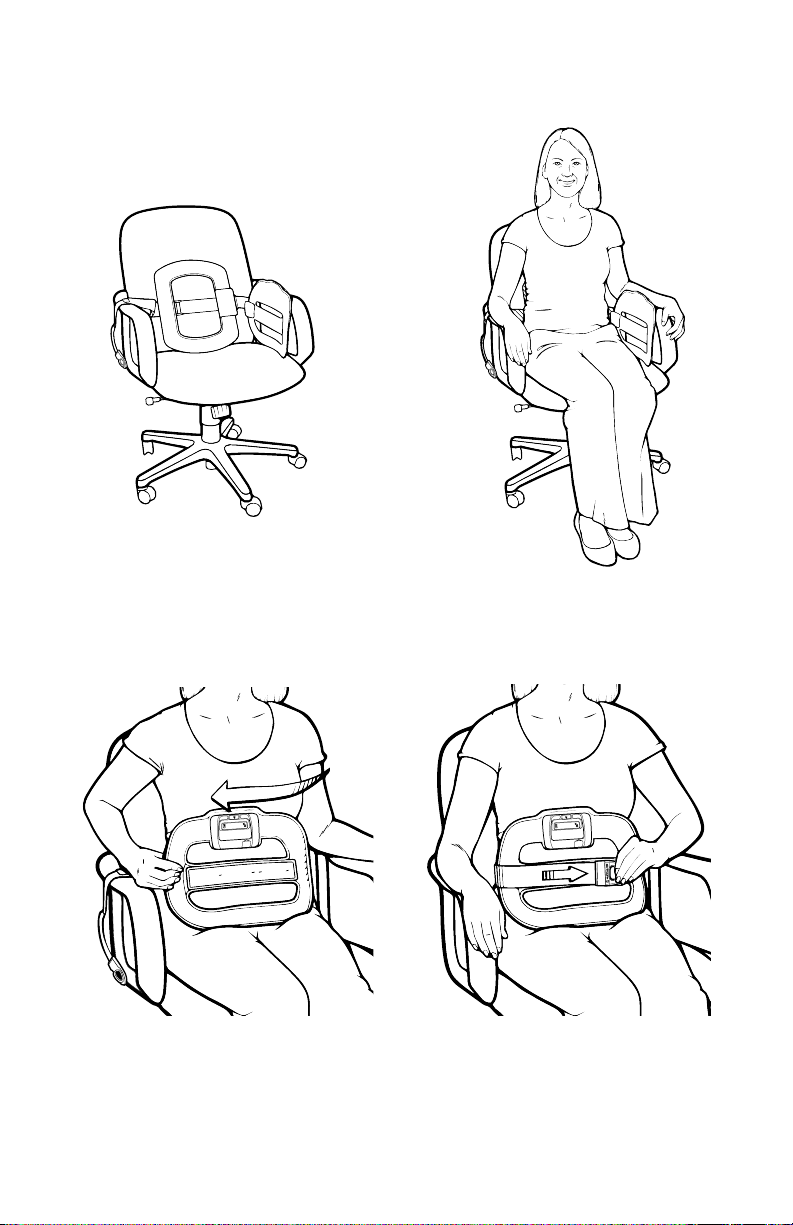
The following is the suggested method for
placing the SpinalStim device:
1. Rest the Back Coil of the device
against the back of a chair and
the Front Coil against the left arm
®
of the chair. Let the Velcro
Strap
hang over the right arm of the chair.
2:00
3. Pull the Front Coil toward you and
let it rest on top of your legs.
2. Sit in the chair.
2:00
4. Locate the Velcro Strap and pull
it snugly across your body and
attach it to the Velcro Panel
on the Front Coil.
8
Page 12
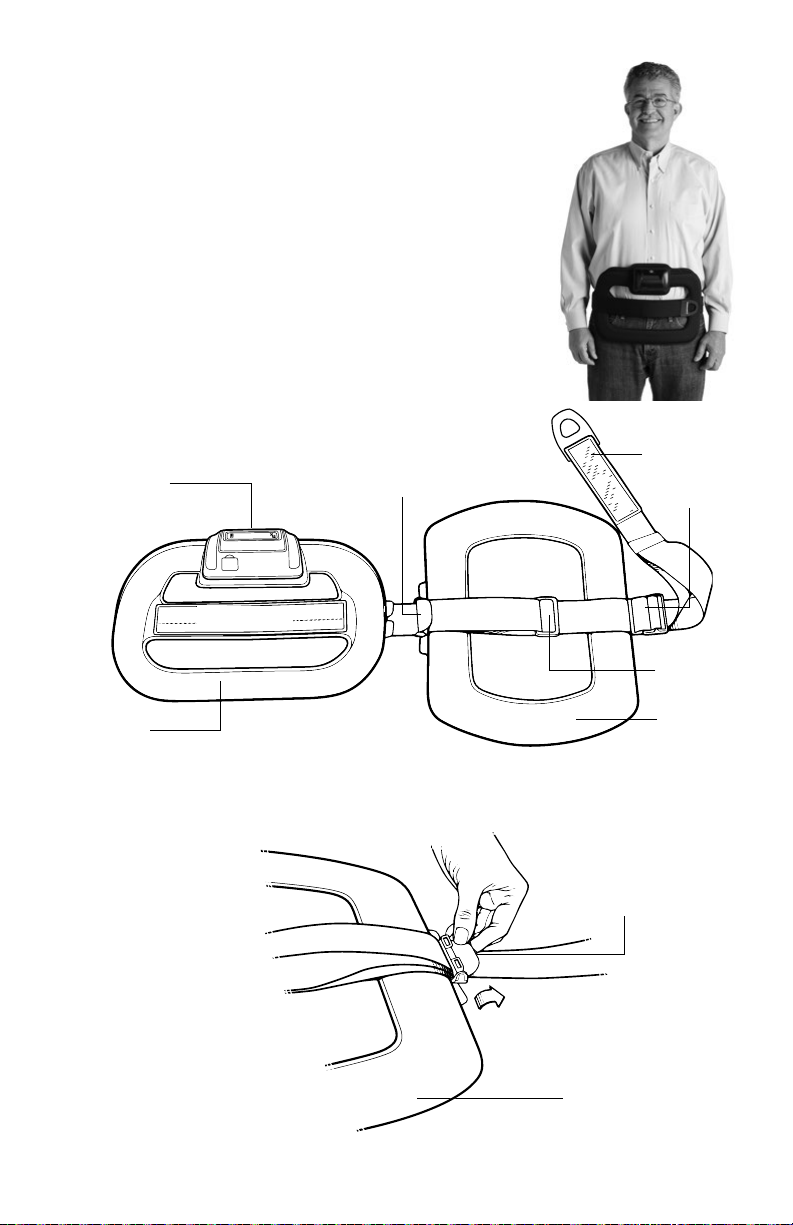
Sizing the Device
For minor size adjustments, adjust the placement of the
front Velcro Strap. For further adjustments, follow the
steps below.
1. Place the SpinalStim device around the body to determine
how much adjustment is needed.
• Note: when properly adjusted, the coils should be
centered on the body. The Control Unit should be
in front, LCD facing up.
2. If a significant size adjustment is needed, lay the unit flat
with the outside of the device Velcro Panel facing up.
Control Unit
2:00
Velcro Panel
Strap Lock
Velcro Strap
Side Clip
Back Clip
Front Coil
3. To adjust the Back Coil, open the Strap Lock.
9
Back Coil
Strap Lock
Back Coil
Page 13
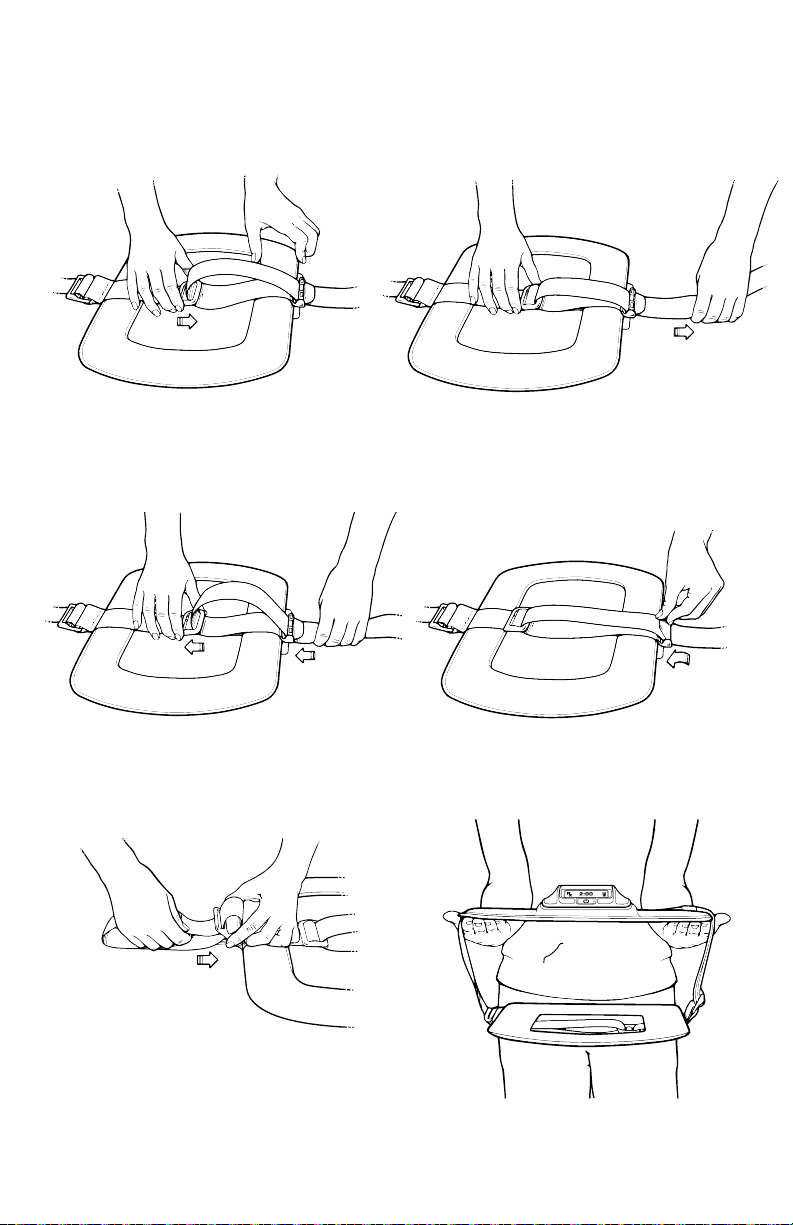
4. If more strap length is needed to make the device bigger, slide the Back Clip
toward the Strap Lock. Pull the excess strap through the Strap Lock.
5. If less strap length is needed to
make the device smaller, push the
desired amount of strap through
the Strap Lock. Slide the Back Clip
7. On the back coil, adjust the
Velcro Strap by pulling more or
less elastic strap through the
Side Clip.
away from the Strap Lock to
tighten the excess strap.
6. Close the Strap Lock.
8. When properly adjusted, the SpinalStim
device straps will be approximately the
same length on each side.
10
Page 14

Device Accessories
Certain body types may benefit from the use of suspenders with the SpinalStim
device. Please contact Patient Services at 800-535-4492 or 214-937-2718 to
order suspenders.
An accessory available to the patient is a user friendly mobile application which
allows the patient to easily monitor their device use. This may be downloaded
to the patient’s smartphone. Reference the User Guide for the STIM onTrack
Mobile App.
Device Use and Care
• The SpinalStim device is for a single patient use.
• The SpinalStim device is a technologically advanced electronic device
and should be handled with care. Dropping or other mishandling of the
SpinalStim device may damage the device and it may stop working.
• For safe usage, follow manufacturer instructions when using the SpinalStim
device. You (the patient) are the intended operator of this device.
• Use of the device in any other manner could have harmful effects and/or
void the warranty.
• The use of accessories other than those specified may result in increased
emissions or decreased immunity of the device.
• Inspect the device prior to each use for wear, deterioration or damage.
• Do not use or charge the device if it does not appear to be in suitable
condition, displays an error or stops working. Contact Patient Services if
any of these occur.
• WARNING: Do not modify this equipment as this may make it unsafe to use.
Do not attempt to open or disassemble the SpinalStim device as there are
no user serviceable parts inside.
• CAUTION: STRANGULATION HAZARD – Keep the Power Supply cord out of
the reach of children.
Care and Cleaning
When cleaning the SpinalStim device, follow these instructions:
• WARNING: Do not clean the device during treatment or charging.
• Clean the device by wiping surfaces with a damp, soft cloth
(wet with water only).
• Do not sterilize the SpinalStim device.
• DO NOT expose the SpinalStim device to excessive moisture.
• DO NOT use solvents or alcohol-based liquids (anti-bacterial cleaners, hand
sanitizers, perfume, etc.) to clean the SpinalStim device.
11
Page 15

Storage
When moving the SpinalStim device from very cold or very hot storage areas (like
your car), wait at least an hour to use or charge the device. The device requires
time to return to operating temperature.
Unpacked Storage:
Temperature Range:
• -25°C to 5°C
• 5°C to 35°C at up to 90% relative humidity, non-condensing
• 35°C to 60°C at a water vapor pressure up to 50 hPa
Packed Storage, Shipping and Transport:
Temperature Range: within -40°C to 60°C
• Between 10-100% relative humidity
• Including condensation at pressures between 500 hPa and 1060 hPa
Operating Environment:
Temperature Range: within 5°C to 40°C
• 15-90% relative humidity, non-condensing but not requiring a water
vapor pressure greater than 50 hPa
• 700-1060 hPa
The SpinalStim device is designed for a storage life of twelve months plus one
year of usage.
Travel
When traveling by air, it is recommended to pack the SpinalStim device with
checked luggage. If taken onboard the airplane, it should be turned off when
passing through security screening equipment, as the device could be damaged.
The SpinalStim device instruction manual should be taken with you to quickly
and easily identify the device for security personnel. Do not wear or operate the
SpinalStim device while onboard the airplane.
12
Page 16

Disposal
After treatment is complete and a physician advises you to discontinue use,
you may dispose of the device according to your local governing ordinances or
recycling plans. Contact your local authorities to determine the proper method
for disposal since this is electronic equipment containing a lithium-ion battery.
You may also contact Orthofix Patient Services regarding recycling.
The SpinalStim device is a Class III medical device (prescription only) that
cannot be sanitized or used by another person.
Dispose of the device properly to prevent injury.
DO NOT dispose of the SpinalStim device in an incinerator. This
device contains lithium batteries.
Service
If you have questions concerning the device or require any assistance, please
call 800-535-4492 (U.S. only) or 214-937-2718. There are no user serviceable
parts. Notify Orthofix for any servicing needs.
13
Page 17

Clinical Information
Adjunct Clinical Trial
The SpinalStim device has been tested in a clinical study involving 54 surgeons
at 31 centers. This clinical investigation contained a prospective randomized
double-masked trial of PEMF efficacy. The SpinalStim device was tested as a
surgical adjunct in patients undergoing a first attempt at lumbar fusion. At
one year postoperative, patients using active devices on a consistent daily
regimen (an average of at least two hours per day) developed solid fusion
in 92.2% of the cases.
developed solid fusion in 67.9% of the cases. This 35% increase in treatment
effect is statistically significant, and is realized regardless of:
• Number of levels • Vertebral level
• Graft type • Smoking
• Internal fixation • Age
• Gender
The success rate for patients in the randomized double-masked phase for
whom success or failure status is known at four years after treatment with the
SpinalStim device for all subjects (consistent and inconsistent users combined)
was 63% (n=88) as compared with 83% in this phase of the clinical trial (i.e.,
one year postoperative).
1
Patients consistently using placebo (inactive) devices
Adjunct Clinical Trial: Overall Success Rate
100
80
60
40
% Patients Fused
20
0
92%
68%
Active Placebo
14
Page 18

Consistent users (n=64) of the device in this phase had an initial success
rate of 92.2% with a success rate of 70% after four years (a 24% reduction).
Inconsistent users (n=34) and the entire placebo group (n=97) had an initial
success rate of 65% with a success rate of 50% after four years (again, a 24%
reduction). Long-term follow-up data indicates the success rate differentials
between active and placebo units are maintained over time. Long-term,
consistent SpinalStim device users benefit with a 40% increase in fusion
success, when compared to inconsistent and placebo device users. Based on
this analysis, the reduction in long-term success rates appears unrelated to
treatment with the SpinalStim device. During this four year period, 10% of the
original patients in the randomized double-masked phase were lost to
follow-up and are not reflected in these success rates.
Failed Fusion Clinical Trial
The SpinalStim device was also tested for nonoperative salvage in patients
presenting with established pseudarthrosis of lumbar fusion in an open trial.
Without concomitant regrafting, 67% of these cases reached a successful
fusion with consistent (an average of at least 2 hours per day) PEMF
treatment.
2
The four year success rates for these patients in the open trial, non-operative
salvage phase for all subjects (consistent and inconsistent users combined)
was 39% (n=119) as compared with 57% in this phase of the original clinical
trial (i.e., one year postoperative). Consistent users (n=93) of the device in this
phase had a success rate of 44% after four years. Inconsistent users (n=26) of
the device in this phase had a success rate of 19% after four years.
The reduction in success rates from the time of commercial marketing
compared with those at four years showed a similar percentage decrease
(31%) to those in the randomized double-masked trial. During this four year
period, 6% of the original patients in the open phase were lost to follow-up
and are not reflected in these success rates.
1
Mooney, V., “A Randomized Double-Blind Prospective Study of the Efficacy of Pulsed Electromagnetic
Field for Interbody Lumbar Fusions”, SPINE, Vol. 15, No. 7, P708, 1990.
2
Simmons, JW, Hayes, MA, Christensen, KD, Dwyer, AP, Koulisis, CW, Kimmich, SJ: “The Effect of
Postoperative Pulsed Electromagnetic Fields on Lumbar Fusion: Open Trial Study”. Presented at the
Annual Meeting of the North American Spine Society, Quebec City, Canada, 2 July 1989.
15
Page 19

Equipment Classification
REF
SN
Device Symbol Descriptions
Symbol Meaning Symbol Location
On/Off
Year of Manufacture for Active Device Device and Device Box
Not for General Waste Device and Device Box
Keep Dry
Storage Humidity Limits Device and Device Box
Attention – Refer to Instruction Manual Device and Device Box
Type BF Applied Part
Prescription Only
Storage Temperature Range
Manufacturer
FCC Mark
CE Mark
Atmospheric Pressure Limitations
EU Authorized Representative
Catalog Number
Device and Device Box
Device
Device
Device Box
Instruction Manual
Device and Device Box
Device and Device Box
Device and Device Box
Device Box
Instruction Manual
Device and Device Box
Serial Number Device and Device Box
RCM - Regulatory Compliance Mark
(Australia)
16
Device
Page 20

SpinalStim Device Classifications
• Product Family Name: Orthofix PEMF Device
• Internally powered equipment
• The service life of the non-replaceable lithium-ion battery is 2.5 years.
• This device generates a non-ionizing pulsed electromagnetic field with an intensity
of approximately 2 Gauss and frequency components in the 1Hz-50KHz range. This
field is distributed within and near the treatment coil.
• Type BF applied part. The applied part is the treatment coil with
integrated control unit.
• IEC 60529 enclosure rating: IP22. IP22 means the enclosure provides protection from
solid objects > 12.5mm and dripping liquids when tilted 15° from normal use. It is
recommended you keep the unit dry.
• Shelf life for equipment: 1 year
• Mode of operation: intermittent operation
• This device is non-sterile. It does not require sterilization.
• Equipment not suitable for use in the presence of a flammable
anesthetic mixture with air or nitrous oxide.
• The power supply is considered double insulated with Class II
construction throughout.
• Power supply ratings:
Orthofix # 20110412:
Input: 100-240VAC, 50-60Hz, 200mA
Output Voltage: 5VDC, 1.3A
Orthofix#: 20123808: Orthofix#: WR9QA1200U23KIT(R6B):
Input: 100-240VAC, 50-60Hz, 0.6-0.3A Input: 100-240VAC, 50-60Hz, 0.6A
Output Voltage: 5VDC, 1.2A Output Voltage: 5VDC, 1.2A
Orthofix # 20114794:
Input: 100-240VAC, 50-60Hz, 150-350mA
Output Voltage: 5VDC, 2.4A
17
Page 21

Compliance Statements
This device complies with part 15 of the FCC Rules. Operation is subject to the
following two conditions: (1) This device may not cause harmful interference, and
(2) this device must accept any interference received, including interference that may
cause undesired operation.
IMPORTANT! Changes or modifications not expressly approved by Orthofix, Inc. could
void the user’s authority to operate the equipment.
NOTE: This equipment has been tested and found to comply with the limits for a Class
B digital device, pursuant to part 15 of the FCC Rules. These limits are designed to
provide reasonable protection against harmful interference in a residential installation.
This equipment generates, uses and can radiate radio frequency energy and, if not
installed and used in accordance with the instructions, may cause harmful interference
to radio communications. However, there is no guarantee that interference will not
occur in a particular installation. If this equipment does cause harmful interference to
radio or television reception, which can be determined by turning the equipment off
and on, the user is encouraged to try to correct the interference by one or more of the
following measures:
• Reorient or relocate the receiving antenna.
• Increase the separation between the equipment and receiver.
• Connect the equipment into an outlet on a circuit different from that to which
the receiver is connected.
• Consult the dealer or an experienced radio/TV technician for help.
Information regarding Electromagnetic Compatibility and Immunity
The SpinalStim device complies with IEC 60601-1-2 for electromagnetic compatibility
(EMC).
The SpinalStim device needs special precautions regarding EMC and
needs to be used in accordance with the EMC information provided in this
manual. Wireless communications equipment such as home network devices,
mobile phones, cordless telephones and their base stations, and walkie-talkies
can affect the SpinalStim device. These types of equipment should be kept at
least 0.198 m (7.8 in) away from the SpinalStim device.
The SpinalStim device has not been evaluated with regard to use with specific
implantable electronic medical devices. Please consult your physician prior to use
of the SpinalStim device with implantable electronic medical devices.
18
Page 22

Warranty
Orthofix Inc. warrants the SpinalStim device to be free from defects in
materials and workmanship for one year from the date of first use. Provided
that all terms and conditions of this Limited Warranty are complied with,
Orthofix Inc. will replace defective components.
This Limited Warranty applies to the product only under normal use and does
not cover any damage or defect caused by accident, misuse, abuse, fire, flood,
and acts of God, or by any alteration, tampering, repair, or attempted repair
by anyone other than Orthofix Inc. This warranty only applies to the patient
for whom the product is prescribed and is not assignable or transferable.
Defective products covered by this Limited Warranty must be returned to
Orthofix Inc., Attention: Orthofix Returns. You must call a Patient Services
representative or your local distributor to obtain the Return Authorization
number and address prior to returning the product.
Except as specifically required by applicable law, the foregoing warranty is in
lieu of all other warranties, expressed or implied, and Orthofix Inc. specifically
disclaims any and all warranties of merchantability or fitness for a particular
purpose. Under no circumstances shall Orthofix Inc., its authorized
representative, affiliated, or subsidiary companies be liable for special,
consequential, or incidental damages. The sole remedy with respect to any
defective product shall be limited to replacement.
This Limited Warranty may not be extended or modified except in writing by
Orthofix Inc. No sales person, representative, distributor or physician is
authorized to make or consent to any extension or modification of the terms
of this Limited Warranty.
For additional information and/or device assistance, contact Orthofix
Patient Services at 800-535-4492 or 214-937-2718.
19
Page 23

Spanish/Español
Modelo 5212 Manual de instrucciones
Page 24

Ensamblado en los Estados Unidos de América
SpinalStim, patente de dispositivo n.º
U.S. 5,743,844
U.S. 6,132,362
U.S. 6,261,221
Page 25

Spanish/Español
Manual de instrucciones del dispositivo SpinalStim
Índice
Información sobre la prescripción .............................................................
• Indicaciones ........................................................................................
• Contraindicaciones .............................................................................
• Advertencias .......................................................................................
• Precauciones .......................................................................................
• Eventos adversos ................................................................................
Información del dispositivo .......................................................................
• Descripción del dispositivo .................................................................
• Funcionamiento del dispositivo SpinalStim ........................................
• Vida útil del dispositivo ......................................................................
Funcionamiento del dispositivo .................................................................
• Encendido y apagado del dispositivo .................................................
• Instrucciones del tratamiento .............................................................
• Control del tiempo de las sesiones de tratamiento ............................
• Carga de la batería .............................................................................
• Indicadores visuales y audibles ...........................................................
• Transporte del dispositivo ..................................................................
• Ajuste del tamaño del dispositivo ......................................................
Accesorios del dispositivo .........................................................................
Utilización y cuidado del dispositivo .........................................................
• Cuidado y limpieza .............................................................................
• Almacenamiento ................................................................................
• Viajes ..................................................................................................
• Eliminación .........................................................................................
• Mantenimiento ...................................................................................
Información clínica ....................................................................................
• Resumen de los datos clínicos ............................................................
• Ensayo clínico complementario ..........................................................
• Ensayo clínico de fusiones fallidas ......................................................
Clasificación del equipo ............................................................................
Clasificaciones del dispositivo SpinalStim ..................................................
Declaraciones de cumplimiento ................................................................
Garantía ....................................................................................................
™
1
1
1
1
1
1
2
2
2
2
3
3
4
4
4
6
7
9
11
11
11
11
12
12
13
13
13
13
14
16
17
17
19
Componentes de la caja del dispositivo
1 Dispositivo SpinalStim
1 fuente de alimentación
1 paquete de documentación
Atención al paciente de Orthofix: +1 800-535-4492 o +1 214-937-2718
Para obtener más información sobre Orthofix, visite nuestro sitio web en
www.orthofix.com.
Page 26

Información sobre la prescripción
Indicaciones
El dispositivo SpinalStim es un estimulador electromagnético no invasivo
del crecimiento óseo indicado como coadyuvante de la fusión espinal para
aumentar las probabilidades de éxito en la fusión y como tratamiento no
quirúrgico de rescate de la fusión espinal fallida, cuando ha transcurrido un
mínimo de nueve meses desde la última intervención.
Contraindicaciones
Los marcapasos pueden verse afectados negativamente por la exposición
al CEMP. El uso de este dispositivo está contraindicado cuando el individuo
presenta un marcapasos implantado.
Advertencias
• Aunque los estudios teratológicos en animales realizados con el
dispositivo no mostraron hallazgos adversos, no se ha establecido la
seguridad del uso de este dispositivo durante el embarazo y la lactancia
en los humanos.
• No se ha establecido la seguridad ni la efectividad del uso de este
dispositivo en individuos que no presentan madurez esquelética.
• Los estudios en animales realizados hasta la fecha no sugieren ningún
evento adverso a largo plazo por el uso de un dispositivo similar. Sin
embargo, se desconocen los efectos a largo plazo en humanos.
Precauciones
• Este dispositivo no deberá utilizarse si existen enfermedades mentales o
físicas que impidan el cumplimiento de las instrucciones del médico y del
dispositivo.
• Este dispositivo no se ha evaluado en el tratamiento de pacientes con
las siguientes enfermedades: traumatismo espinal ligamentoso u óseo,
espondilitis, enfermedad de Paget, osteoporosis de moderada a grave,
cáncer metastásico, enfermedad renal y diabetes mellitus no controlada.
• Los resultados de los datos antes de la comercialización obtenidos de la
cohorte aleatorizada a doble ciego indican que los usuarios inconstantes
(definidos como los pacientes que usaron el dispositivo durante menos
de un promedio de dos horas al día) alcanzaron tasas de éxito similares
a las del grupo que recibió el placebo. Por lo tanto, el uso del dispositivo
durante menos tiempo que el mínimo recomendado podría dar como
resultado tasas de éxito más bajas.
Eventos adversos
En raras ocasiones, se han reportado molestias menores reversibles. Estas
fueron: incomodidad o molestias, hormigueo o dolor leves, erupción cutánea
leve, insomnio, desmayo, náuseas o diarrea y polimenorrea.
Consulte la sección Declaraciones de cumplimiento del manual para
obtener información de la compatibilidad con respecto a dispositivos
médicos implantables.
1
Page 27

Información del dispositivo
Descripción del dispositivo
El dispositivo SpinalStim es una unidad externa que genera un campo
electromagnético pulsado (CEMP) como tratamiento no quirúrgico que se receta
para aumentar las probabilidades de una fusión exitosa. El dispositivo es ligero,
ajustable y portátil, e incluye una batería recargable que permite la libertad de
movimientos durante el tratamiento. Una pantalla de cristal líquido (LCD) y sus
indicadores audibles proporcionan información importante durante el tratamiento.
Consulte “Funcionamiento del dispositivo” para obtener más información.
LCD
Transductor
de tratamiento
delantera
1:59
Transductor de
tratamiento trasera
Unidad de
control
Spanish/Español
Modelo 5212
Funcionamiento del dispositivo SpinalStim
Para mejorar la curación del hueso después de la cirugía de fusión, el
tratamiento con CEMP activa y acelera el proceso natural de curación del
cuerpo que puede estar afectado en algunas personas.
El dispositivo SpinalStim incluye una unidad de control y transductores de
tratamiento en un dispositivo integrado. Un microprocesador genera la señal
eléctrica del dispositivo SpinalStim, que es un campo electromagnético de baja
energía altamente uniforme enviado desde los transductores de tratamiento.
Cuando los transductores están centrados sobre el área de tratamiento, la señal
terapéutica del CEMP del dispositivo SpinalStim se administra a través de la
ropa y la piel directamente al lugar de la fusión.
Para obtener más información sobre la estimulación del crecimiento óseo, visite
nuestro sitio web para pacientes en www.BoneGrowthTherapy.com.
Vida útil del dispositivo
El dispositivo SpinalStim proporciona tratamientos diarios durante hasta
365 días. El médico determinará la duración total del tratamiento (meses o
semanas) de forma individual dependiendo del proceso de curación de la fusión.
2
Page 28

Funcionamiento del dispositivo
Encendido y apagado del dispositivo
El dispositivo SpinalStim puede encenderse manteniendo oprimido el
botón de Encendido/Apagado de la unidad de control del dispositivo hasta
que emita un pitido.
Cuando el dispositivo se encienda, se mostrará una pantalla de estado
con el número de días desde el primer uso, el estado del tratamiento y el
porcentaje de cumplimiento.
La LCD mostrará el tiempo de tratamiento prescrito restante y el estado de
la batería.
Los dos puntos parpadeantes de la pantalla LCD y del botón de Encendido/
Apagado indican que el dispositivo está encendido y aplicando el
tratamiento.
El dispositivo SpinalStim puede apagarse manteniendo oprimido el botón
de Encendido/Apagado de la unidad de control del dispositivo hasta que
emita un pitido.
El botón de Encendido/Apagado de la unidad de control también sirve
como retroiluminación para iluminar la LCD. Cuando la luz esté baja,
oprima el botón de Encendido/Apagado para encender la LCD.
Unidad de control
1:59
Indicador de tratamiento
Puerto de carga
Botón de Encendido/Apagado
3
Page 29

Instrucciones del tratamiento
• El dispositivo SpinalStim deberá llevarse puesto todos los días durante la
cantidad de horas prescrita por el médico (un mínimo de 2 horas al día).
• El dispositivo SpinalStim podrá utilizarse en el momento del día que sea
más cómodo para el paciente.
• El dispositivo está programado para reiniciar el reloj de tratamiento a
diario a media noche en el horario estándar del centro de EE. UU., a
menos que un médico o un representante de Orthofix lo ajuste para una
zona horaria diferente.
• Las horas que se haya llevado puesto antes de la hora de reinicio
quedarán registradas y almacenadas en el dispositivo para monitorear el
cumplimiento del uso diario.
• La duración total del tratamiento (cantidad de meses o semanas) variará
dependiendo de las enfermedades específicas del paciente según lo
determine el médico.
• El dispositivo SpinalStim es ligero y portátil, de modo que el tratamiento
puede recibirse mientras se está sentado, andando, recostado, dormido,
etc. Sin embargo, debido a que cada paciente es único, la actividad total
deberá basarse en las instrucciones del médico.
Control del tiempo de las sesiones de tratamiento
• El dispositivo SpinalStim realiza un seguimiento del tiempo de tratamiento;
este seguimiento (o control del tiempo) comienza cuando el dispositivo se
enciende y se completa por lo menos un minuto de tratamiento.
• La LCD muestra una cuenta regresiva del tiempo restante de tratamiento
diario.
• Para detener el tratamiento en cualquier momento, solo tiene que mantener
oprimido el botón de Encendido/Apagado hasta que escuche un pitido.
• Para reanudar el tratamiento, oprima de nuevo el botón de Encendido/
Apagado.
• La cuenta regresiva se reanudará en el tiempo de tratamiento restante.
• Cuando haya completado el tratamiento diario, el dispositivo se apagará
automáticamente.
Spanish/Español
Carga de la batería
El dispositivo SpinalStim recibe alimentación de una batería recargable de
ion de litio. La batería suministrará un mínimo de un tratamiento completo
antes de necesitar recargarse. Junto con el dispositivo, se incluye una fuente
de alimentación para cargar la batería. Utilice únicamente la fuente de
alimentación de Orthofix para cargar la batería (n.º de referencia Orthofix
20110412, 20114794, WR9QA1200U23KIT(R6B), o 20123808).
Para asegurarse de que el dispositivo funciona correctamente, el dispositivo
SpinalStim monitorea constantemente el voltaje de la batería y la señal
eléctrica. La LCD mostrará un símbolo de capacidad de la batería y el
dispositivo pitará para avisarle al paciente cuando la batería esté baja y
próxima a necesitar una recarga.
El dispositivo SpinalStim deberá cargarse antes del primer uso y cada día
después de completar el tratamiento. No lleve el dispositivo mientras se carga.
El dispositivo no aplicará el tratamiento mientras esté cargándose.
4
Page 30

Siga estos pasos para recargar la batería:
1. Abra la cubierta del puerto de carga.
2. Enchufe el conector de carga en el puerto de carga de la unidad de control.
3. Enchufe la fuente de alimentación a cualquier tomacorriente de pared
de CA estándar. No enchufe la fuente de alimentación del dispositivo
SpinalStim en sitios en los que sea difícil desenchufarla.
4. La LCD de la unidad de control mostrará un símbolo de una batería
llenándose para verificar que el dispositivo se está cargando. Cuando la
batería alcance la carga completa, se mostrará un símbolo de marca de
comprobación junto al símbolo de la batería. Además, el dispositivo pitará
una vez para avisarle al paciente.
5. Si la batería está completamente descargada, es posible que necesite
hasta 4 horas para cargarse por completo.
6. Una vez completada la carga, retire el conector de carga y vuelva a
colocar la cubierta del puerto de carga.
Esquinas en
ángulo
Fuente de alimentación de CA
Conector de carga de CA
Cubierta del puerto
de carga
5
Page 31

Indicadores visuales y audibles
La LCD y los pitidos están diseñados para proporcionarle información útil al
usuario. A continuación se explican las pantallas, los símbolos y los pitidos.
Spanish/Español
Pantalla de cumplimiento
170/185 = 91.9%
Pantalla de tratamiento
1:59
Tratamiento completo
Pantalla de carga
Carga completa
Pantalla de advertencia
de batería baja
1:59
La batería debe estar
cargada para encender
el dispositivo
Pantalla de cumplimiento: muestra un porcentaje de
cumplimiento que se calcula con el número de días completos
de tratamientos finalizados entre la cantidad de días de
tratamiento disponibles. Los días de tratamiento disponibles
comienzan una vez que el dispositivo se le entrega al paciente
y se establece un minuto de tiempo de tratamiento.
Pantalla de tratamiento: muestra el tiempo restante de
tratamiento en horas y minutos. El temporizador lleva
una cuenta regresiva a cero hasta que se completa el
tratamiento diario.
Tratamiento diario prescrito completado
Batería cargando: el símbolo de una batería llenándose de
forma repetitiva indica que el dispositivo se está cargando.
Carga completa: indica cuando la batería está
completamente cargada.
Batería baja: se muestra junto con tres pitidos rápidos
cuando se recomienda la recarga.
E12345678
E12345678
Dispositivo vencido
Pantalla de excepciones
E123
1-800-535-4492
Batería vacía: indica que la batería debe cargarse antes de
que el tratamiento pueda continuar.
Dispositivo vencido: se muestra un candado cerrado
que indica que el dispositivo ha estado disponible para
el tratamiento durante 365 días y ya no administrará
tratamiento.
Códigos de excepción: visualización de ERROR, cualquier
código E (por ejemplo, E01, E02), junto con tres pitidos
lentos. Comuníquese con Atención a pacientes al
+1 800-535-4492 o al +1 214-937-2718.
6
Page 32

Transporte del dispositivo
El dispositivo SpinalStim puede llevarse puesto sobre el aparato ortopédico
y la ropa. Un tratamiento adecuado no requiere un contacto directo con el
cuerpo. Sin embargo, para ser efectivos, los transductores deben centrarse
alrededor del lugar de la fusión. Los usuarios pueden doblar y darles forma
con cuidado a los transductores de tratamiento para que se ajusten con mayor
comodidad alrededor del cuerpo.
7
Page 33

El siguiente es el método sugerido para llevar puesto el
dispositivo SpinalStim:
Spanish/Español
1. Apoye el transductor trasero del
dispositivo contra el respaldo de
una silla y el transductor delantero
contra el brazo izquierdo de la silla.
®
Deje que la cinta de Velcro
cuelgue
sobre el brazo derecho de la silla.
2:00
3. Jale el transductor frontal hacia
usted y déjelo descansar sobre las
piernas.
2. Siéntese en la
silla.
2:00
4. Localice la cinta de Velcro, jálela
con firmeza a través del cuerpo y
conéctela al panel de Velcro del
transductor delantero.
8
Page 34

Ajuste del tamaño del dispositivo
Para ajustes menores de tamaño, ajuste la colocación de la
cinta de Velcro delantera. Para otros ajustes, siga los pasos
que se indican a continuación.
1. Colóquese el dispositivo SpinalStim alrededor del cuerpo
para determinar el ajuste necesario.
• Nota: cuando estén bien ajustados, los transductores
deberán quedar centrados sobre el cuerpo. La unidad
de control deberá estar al frente, con la LCD mirando
hacia arriba.
2. Si necesita un ajuste importante de tamaño, apoye
la unidad en plano con la parte exterior del panel de
Velcro del dispositivo mirando hacia arriba.
Unidad de control
2:00
Panel de Velcro
Cierre de la cinta
Cinta de Velcro
Clip lateral
Clip trasero
Transductor
delantero
3. Para ajustar el transductor trasero, abra el cierre de la cinta.
9
Transductor
trasero
Cierre de la cinta
Transductor
trasero
Page 35

4. Si necesita una mayor longitud de cinta para aumentar el tamaño del
dispositivo, deslice el clip trasero hacia el cierre de la cinta. Jale el exceso de
cinta a través del cierre de la cinta.
Spanish/Español
5. Si necesita una menor longitud
de cinta para reducir el tamaño
del dispositivo, empuje la
cantidad deseada de cinta a
través del cierre de la cinta.
7.
En el transductor trasero, ajuste
la cinta de V
o menos cinta elástica a través
del clip lateral.
elcro tirando de más
Deslice el clip trasero en dirección
contraria al cierre de la cinta para
tensar el exceso de cinta.
6. Cierre el cierre de la cinta.
8.
Cuando estén bien ajustadas, las cintas
del dispositivo SpinalStim tendrán
aproximadamente la misma longitud en
cada lado.
10
Page 36

Accesorios del dispositivo
Algunos tipos de cuerpos pueden beneficiarse del uso de tirantes con el
dispositivo SpinalStim. Comuníquese con Atención a pacientes al
+1 800-535-4492 o al +1 214-937-2718 para solicitar tirantes.
El paciente dispone de un accesorio que es una aplicación móvil fácil de usar y
que le permite controlar fácilmente el uso del dispositivo. Esta aplicación puede
descargarse en el smartphone del paciente. Consulte la guía del usuario de la
aplicación STIM onTrack.
Utilización y cuidado del dispositivo
• El dispositivo SpinalStim debe utilizarse en un único paciente.
• El dispositivo SpinalStim es un dispositivo electrónico tecnológicamente
avanzado y deberá manejarse con cuidado. Si el dispositivo SpinalStim se le
cae o lo maneja de forma incorrecta, esto podría dañar el dispositivo y hacer
que deje de funcionar.
• Para un uso seguro, siga las instrucciones del fabricante cuando utilice el
dispositivo SpinalStim. Usted (el paciente) es el usuario previsto de este
dispositivo.
• El uso del dispositivo de cualquier otra forma podría tener efectos dañinos o
anular la garantía.
• El uso de accesorios que no sean los especificados puede aumentar las
emisiones o disminuir la inmunidad del dispositivo.
• Inspeccione el dispositivo antes de cada uso en busca de signos de desgaste
o deterioro.
• No utilice ni cargue el dispositivo si no parece estar en una situación apta,
muestra un error o deja de funcionar. Póngase en contacto con Atención al
paciente si se da alguno de estos casos.
• ADVERTENCIA: No modifique este equipo, ya que su uso podría dejar de ser
seguro. No intente abrir ni desarmar el dispositivo SpinalStim, ya que no
contiene ninguna pieza que el usuario pueda reparar.
• PRECAUCIÓN: PELIGRO DE ESTRANGULAMIENTO: mantenga el cable de la
fuente de alimentación alejado del alcance de los niños.
Cuidado y limpieza
Cuando limpie el dispositivo SpinalStim, siga estas instrucciones:
• ADVERTENCIA: No limpie el dispositivo durante el tratamiento o la carga.
• Limpie las superficies del dispositivo con un paño suave y húmedo
(humedézcalo solo con agua).
• No esterilice el dispositivo SpinalStim.
• NO exponga el dispositivo SpinalStim a una humedad excesiva.
• NO utilice disolventes ni líquidos basados en alcohol (limpiadores
antibacterianos, geles antisépticos de manos, perfumes, etc.) para limpiar el
dispositivo SpinalStim.
11
Page 37

Almacenamiento
Cuando mueva el dispositivo SpinalStim de un área de almacenamiento muy
fría a una muy caliente (como el coche), espere al menos una hora para
usar o cargar el dispositivo. El dispositivo necesita tiempo para volver a la
temperatura de funcionamiento.
Almacenamiento desempacado:
Intervalo de temperatura:
• De -25 a 5 °C.
• De 5 a 35 °C con una humedad relativa de hasta el 90 %, sin
condensación.
• De 35 a 60 °C con una presión de vapor de agua de hasta 50 hPa.
Almacenamiento, envío y transporte empacado:
Intervalo de temperatura: entre -40 y 60 °C.
• De 10 a 100 % de humedad relativa.
• Incluye condensación a presiones de entre 500 hPa y 1060 hPa.
Ambiente de funcionamiento:
Intervalo de temperatura: entre 5 y 40 °C.
• Del 15 al 90 % de humedad relativa sin condensación, pero sin requerir
una presión de vapor de agua mayor que 50 hPa.
• 700 a 1060 hPa.
Spanish/Español
El dispositivo SpinalStim está diseñado para una vida de almacenamiento de
doce meses más un año de uso.
Viajes
Cuando viaje por aire, le recomendamos que empaque el dispositivo
SpinalStim en el equipaje facturado. Si lo lleva en cabina, deberá apagarlo al
pasar por el equipo de control de seguridad, ya que podría resultar dañado.
Deberá llevar el manual de instrucciones del dispositivo SpinalStim con usted
para que el personal de seguridad identifique el dispositivo de forma rápida y
sencilla. No lleve ni utilice el dispositivo SpinalStim a bordo del avión.
Eliminación
Una vez que complete el tratamiento y un médico le indique que deje de usarlo,
deberá desechar el dispositivo de acuerdo con las ordenanzas o planes de
reciclaje locales. Póngase en contacto con las autoridades locales con el fin de
determinar el método adecuado para desecharlo, ya que este equipo electrónico
12
Page 38

contiene una batería de ion de litio. También puede comunicarse con Atención
a pacientes de Orthofix para obtener información sobre el reciclaje.
El dispositivo SpinalStim es un dispositivo médico de clase III (solo bajo
prescripción) que no se puede esterilizar ni utilizar para otra persona.
Deseche el dispositivo de forma adecuada para evitar lesiones.
NO deseche el dispositivo SpinalStim en un incinerador. Este
dispositivo contiene baterías de litio.
Mantenimiento
Si tiene preguntas sobre el dispositivo o necesita ayuda, llame al
+1 800-535-4492 (solo EE. UU.) o al +1 214-937-2718. No contiene piezas
que el usuario pueda reparar. Notifique a Orthofix sobre cualquier necesidad
de mantenimiento.
Información clínica
Ensayo clínico complementario
El dispositivo SpinalStim se probó en un estudio clínico que incluyó a 54
cirujanos de 31 centros. Esta investigación clínica incluyó un ensayo de doble
ciego, aleatorizado y prospectivo de la eficacia del CEMP. El dispositivo
SpinalStim se probó como complemento quirúrgico en pacientes sometidos
a un primer intento de fusión lumbar. Después de un año de la operación,
los pacientes que utilizaron dispositivos activos para un tratamiento diario
continuo (una media de dos horas al día como mínimo) desarrollaron
una fusión sólida en el 92.2 % de los casos.
dispositivos placebo (inactivos) de forma continua desarrollaron una fusión
sólida en el 67.9 % de los casos. Este aumento del 35 % en el efecto del
tratamiento es estadísticamente significativo y se realiza sin importar lo
siguiente:
• Cantidad de niveles • Nivel vertebral
• Tipo de injerto • Tabaquismo
• Fijación interna • Edad
• Sexo
La tasa de éxito de los pacientes en la fase aleatorizada de doble ciego cuyo
éxito o fracaso se conoce a los cuatro años del tratamiento con el dispositivo
SpinalStim entre todos los sujetos (usuarios que siguieron las indicaciones
y que no lo hicieron combinados) fue del 63 % (n = 88) en comparación
con el 83 % en esta fase del ensayo clínico (es decir, un año después de la
intervención).
1
Los pacientes que utilizaron
13
Page 39

Ensayo clínico complementario: Tasa total de éxito
92 %
68 %
% de pacientes fusionados
Activo Placebo
Los usuarios del dispositivo que siguieron las indicaciones (n = 64) en esta fase
presentaron una tasa inicial de éxito del 92.2 %, con una tasa de éxito del 70 %
después de cuatro años (una reducción del 24 %). Los usuarios que no siguieron
las indicaciones (n = 34) y todo el grupo de placebo (n = 97) presentaron una
tasa inicial de éxito del 65 %, con una tasa de éxito del 50 % después de cuatro
años (de nuevo, una reducción del 24 %). Los datos de seguimiento a largo
plazo indican que los diferenciales en la tasa de éxito entre las unidades activas
y el placebo se mantienen a lo largo del tiempo. Los usuarios a largo plazo
del dispositivo SpinalStim que siguieron las indicaciones se beneficiaron de un
aumento del 40 % en el éxito de la fusión, en comparación con los usuarios del
dispositivo placebo y que no siguieron las indicaciones. De acuerdo con este
análisis, la reducción en las tasas de éxito a largo plazo no parece relacionada
con el tratamiento con el dispositivo SpinalStim. Durante este período de cuatro
años, el 10 % de los pacientes originales en la fase de doble ciego aleatorizada
se perdió para el seguimiento y no se refleja en estas tasas de éxito.
Spanish/Español
Ensayo clínico de fusiones fallidas
El dispositivo SpinalStim también se probó para la recuperación no quirúrgica
en pacientes con una pseudoartrosis establecida de fusión lumbar en un
ensayo abierto. Sin reinjertos concomitantes, el 67 % de estos casos alcanzaron
una fusión correcta con un tratamiento con CEMP continuo (una media de 2
horas al día como mínimo).
2
14
Page 40

Las tasas de éxito a los cuatro años de estos pacientes en la fase de
recuperación no quirúrgica del ensayo abierto para todos los sujetos (usuarios
combinados que siguieron las indicaciones y que no lo hicieron) fue del 39 %
(n = 119) en comparación con el 57 % en esta fase del ensayo clínico original
(es decir, un año después de la intervención). Los usuarios del dispositivo
que siguieron las indicaciones (n = 93) en esta fase presentaron una tasa de
éxito del 44 % después de cuatro años. Los usuarios del dispositivo que no
siguieron las indicaciones (n = 26) en esta fase presentaron una tasa de éxito
del 19 % después de cuatro años.
La reducción en las tasas de éxito desde el momento de la comercialización
en comparación con las obtenidas después de cuatro años mostró una
disminución porcentual similar (31 %) a la del ensayo aleatorizado de doble
ciego. Durante este período de cuatro años, el 6 % de los pacientes originales
de la fase abierta se perdió para el seguimiento y no se refleja en estas tasas
de éxito.
1
Mooney, V., “A Randomized Double-Blind Prospective Study of the Efficacy of Pulsed Electromagnetic
Field for Interbody Lumbar Fusions”, SPINE, Vol. 15, No. 7, P708, 1990.
2
Simmons, JW, Hayes, MA, Christensen, KD, Dwyer, AP, Koulisis, CW, Kimmich, SJ: “The Effect of
Postoperative Pulsed Electromagnetic Fields on Lumbar Fusion: Open Trial Study”. Presentado en
la reunión anual de la Sociedad Norteamericana para la Columna Vertebral (North American Spine
Society) celebrada en Quebec (Canadá) el 2 de julio de 1989.
15
Page 41

Clasificación del equipo
10%
100%
500
REF
SN
Descripciones de los símbolos del dispositivo
Spanish/Español
Símbolo Significado
Atención: consulte el manual de
instrucciones
Parte aplicada tipo BF
Encendido/Apagado Dispositivo
Solo con receta médica Dispositivo
Intervalo de temperatura de
almacenamiento
Año de fabricación del dispositivo activo
Fabricante Manual de instrucciones
No debe desecharse en la basura general
Manténgase seco
Marca FCC
Marca CE
Límites de humedad de almacenamiento
1060
Límites de presión atmosférica Caja del dispositivo
Ubicación del
símbolo
Dispositivo y caja del
dispositivo
Dispositivo y caja del
dispositivo
Caja del dispositivo
Dispositivo y caja del
dispositivo
Dispositivo y caja del
dispositivo
Dispositivo y caja del
dispositivo
Dispositivo y caja del
dispositivo
Dispositivo y caja del
dispositivo
Dispositivo y caja del
dispositivo
Representante autorizado en la UE Manual de instrucciones
Número de catálogo
Número de serie
RCM - Marca de cumplimiento
normativo (Australia)
Dispositivo y caja del
dispositivo
Dispositivo y caja del
dispositivo
Dispositivo
16
Page 42

Clasificaciones del dispositivo SpinalStim
• Nombre de la familia de productos: Dispositivo de CEMP Orthofix
• Equipo alimentado internamente
• La vida útil de la batería de ion de litio no reemplazable es de 2.5 años.
• Este dispositivo genera un campo electromagnético pulsado no ionizante con
una intensidad de aproximadamente 2 gauss y componentes de frecuencia
en el intervalo 1 Hz-50 KHz. Este campo se distribuye dentro y cerca del
transductor de tratamiento.
• Pieza aplicada tipo BF. La pieza aplicada es el transductor de tratamiento con
unidad de control integrada.
• Grado de protección de la IEC 60529: IP22. IP22 significa que la carcasa
proporciona una protección frente a objetos sólidos > 12.5 mm y el goteo
de líquidos cuando se inclina 15° con respecto al uso normal. Se recomienda
mantener seca la unidad.
• Vida útil del equipo: 1 año
• Modo de funcionamiento: funcionamiento intermitente
• Este dispositivo no es estéril. No requiere esterilización.
• El equipo no debe utilizarse en presencia de una mezcla anestésica
inflamable con aire u óxido nitroso.
• La fuente de alimentación se considera doblemente aislada con una
construcción clase II en toda la fuente.
• Clasificaciones de la fuente de alimentación:
Orthofix n.º 20110412:
Entrada: 100-240 V CA, 50-60 Hz,
200
mA
Voltaje de salida: 5 V CC, 1,3 A
Orthofix n.º 20123808: Orthofix n.º WR9QA1200U23KIT(R6B):
Entrada: 100-240VAC, 50-60Hz, Entrada: 100-240VAC, 50-60Hz, 0.6A
0.6-0.3A
Voltaje de salida: 5VDC, 1.2A Voltaje de salida: 5VDC, 1.2A
Orthofix n.º 20114794:
Entrada: 100-240 V CA, 50-60 Hz,
150-350
Voltaje de salida: 5 V CC, 2,4 A
mA
17
Page 43

Declaraciones de cumplimiento
Este dispositivo cumple con la sección 15 de las normas de la FCC. El funcionamiento
está sujeto a las dos condiciones siguientes: (1) Este dispositivo no provocará
interferencias perjudiciales y (2) este dispositivo debe aceptar cualquier interferencia
recibida, incluidas las interferencias que podrían provocar un funcionamiento
indeseable.
¡IMPORTANTE! Los cambios o las modificaciones no aprobadas expresamente por
Orthofix, Inc. podrían anular la autoridad del usuario para utilizar el equipo.
NOTA: Este equipo fue probado y se declaró que cumple con los límites de los
dispositivos digitales de clase B, de conformidad con la sección 15 de las normas de la
FCC. Estos límites están diseñados para proporcionar una protección razonable contra
las interferencias perjudiciales en instalaciones residenciales. Este equipo genera,
utiliza y puede irradiar energía de RF y, si no se instala y utiliza de acuerdo con las
instrucciones, podría producir interferencias perjudiciales en las comunicaciones por
radio. Sin embargo, no existen garantías de que no se produzcan interferencias en una
instalación específica.
Si este equipo causa interferencias perjudiciales en la recepción de radio o televisión,
las cuales pueden determinarse apagando y encendiendo el equipo, el usuario deberá
intentar corregir la interferencia mediante una o más de las siguientes medidas:
• Reoriente o reubique la antena receptora.
• Aumente la separación entre el equipo y el receptor.
• Conecte el equipo a un tomacorriente de un circuito diferente al circuito
donde está conectado el receptor.
• Consulte al proveedor o a un técnico de radio/TV con experiencia para
obtener ayuda.
Información sobre inmunidad y compatibilidad electromagnéticas
El dispositivo SpinalStim cumple con la IEC 60601-1-2 sobre compatibilidad
electromagnética (CEM). El dispositivo SpinalStim
precauciones especiales con respecto a la CEM y debe utilizarse de acuerdo
con la información de CEM proporcionada en este manual. Los equipos de
comunicaciones inalámbricas, como los dispositivos de redes residenciales, los
teléfonos celulares, los teléfonos inalámbricos y sus estaciones base, y los walkietalkies pueden afectar al dispositivo SpinalStim. Estos tipos de equipos deberán
mantenerse a un mínimo de 0.198 m (7.8 pulg.) del dispositivo SpinalStim.
requiere la aplicación de
Spanish/Español
El uso del dispositivo SpinalStim con dispositivos médicos electrónicos
implantables específicos no ha sido evaluado. Consulte a su médico antes
de utilizar el dispositivo SpinalStim con dispositivos médicos electrónicos
implantables.
18
Page 44

Garantía
Orthofix Inc. garantiza que el dispositivo SpinalStim no presentará defectos en
los materiales ni en la mano de obra durante un año a partir de la fecha del
primer uso. Siempre y cuando se cumplan todos los términos y condiciones de
esta garantía limitada, Orthofix Inc. sustituirá los componentes defectuosos.
Esta garantía limitada se aplica al producto solo en caso de un uso normal y
no cubre ningún daño o defecto provocado por accidentes, uso incorrecto,
uso indebido, incendios, inundaciones y fuerza mayor, ni ninguna alteración,
falsificación, reparación o intento de reparación por parte de alguien ajeno a
Orthofix Inc. Esta garantía solo se aplica al paciente para el que se recetó el
producto y no puede asignarse ni transferirse.
Los productos defectuosos cubiertos por esta garantía limitada deberán
devolverse a Orthofix Inc. a la atención de: Orthofix Returns. Deberá llamar
a un representante de Atención a pacientes o a su distribuidor local para
obtener el número de autorización de la devolución y la dirección antes de
devolver el producto.
Excepto que las leyes correspondientes lo requieran específicamente, la
garantía anterior sustituye cualquier otra garantía, expresa o implícita,
y Orthofix Inc. renuncia específicamente a todas las garantías de
comerciabilidad o adecuación para fines específicos. En ningún caso, Orthofix
Inc., su representante autorizado, filiales o empresas subsidiarias serán
responsables de los daños especiales, consecuentes o incidentales. El único
remedio con respecto a cualquier producto defectuoso estará limitado al
reemplazo.
Esta garantía limitada no se ampliará ni modificará, excepto mediante
un escrito de Orthofix Inc. Ningún vendedor, representante, distribuidor
ni médico está autorizado a realizar o aceptar ninguna ampliación o
modificación de los términos de esta garantía limitada.
Para obtener información adicional o ayuda con el dispositivo, comuníquese
con Atención a pacientes de Orthofix en el +1 800-535-4492 o al
+1 214-937-2718.
19
Page 45

Page 46

Page 47

Page 48

Caution: Federal law (USA) restricts this device to sale
by or on the order of a physician.
Orthofix Inc.
3451 Plano Parkway
Lewisville, Texas 75056
Tel 214-937-2718
Patient Services
800-535-4492 toll free
orthofix.com
BoneGrowthTherapy.com
P/N 20115189 Rev.AE 2018-09-05
SS-1804-US © Orthofix Holdings, Inc.
 Loading...
Loading...