Page 1

Medical
BioSphere
®
Instructions for use English 2
Instructions d'utilisation Français (French) 9
Instruções de utilização Português (Portuguese) 16
Instrucciones de utilización Español (Spanish) 24
使用说明 中文 (Chinese) 32
Z 1760 rev D 06/12
730060002/A
Page 2

ENGLISH
CAUTION:
use by or on the order of a licensed physician.
INTENDED USE:
EmbosphereMicrospheres are indicated for use in embolization of
arteriovenous malformations, hypervascular tumors, and
symptomatic uterine fibroids.
CLINICAL APPLICATIONS FOR UTERINE FIBROIDS:
Uterine fibroid embolization (UFE) is an alternative treatment for
women requiring treatment for relief of symptoms attributed to
uterine fibroids including heavy menstrual bleeding, pelvic pain or
pressure, and/or urinary dysfunction.
DEVICE DESCRIPTION:
EmbosphereMicrospheres arepartof a family ofembolic materials
based onBioSphere Medical’s proprietary microsphere technology.
These spheres are designed to offer controlled, targeted
embolization.
Embosphere Microspheres are biocompatible, hydrophilic, nonresorbable, microspheres produced from an acrylic polymer and
impregnated with porcine gelatin. Embosphere Microspheres are
available in a range of calibrated spheresizes.
DEVICE PACKAGING:
• Embosphere Microspheres are contained in a sterile, 5.0 mL
glass vial with a Screw-top cap, packaged in a peel-away tray,
available in 5 vials per package.
• Each vial contains either 1.0 mL or 2.0 mL of Embosphere
Microspheres in pyrogen-free, sterile, physiological saline. Total
volume of saline and Microspheres is 5 mL.
____________________________________________________
The following contraindications, warnings, precautions, and
instructionsfor use are organized to present information applicable
to all indications (i.e., hypervascular tumors, arteriovenous
malformations, and uterine fibroids) first, followed by indicationspecific information (i.e., UFE and neurological).
CONTRAINDICATIONS:
All indications
• Patients intolerant to occlusion procedures
• Vascular anatomy or blood flow that precludes catheter
placement or embolic agentinjection
• Presence or likely onset of vasospasm
• Presence or likely onset of hemorrhage
• Presence of severe atheromatous disease
• Presence of feeding arteries smaller than distal branches from
which they emerge
• Presence of arteries supplying the lesion not large enough to
accept EmbosphereMicrospheres
• Presence of collateral vessel pathways potentially endangering
normal territories during embolization
• Vascular resistance peripheral to the feeding arteries precluding
passage of Embosphere Microspheres into the lesion
• Inlarge diameter arteriovenous shunts(i.e. where the blooddoes
Embosphere®Microspheres in a Sterile Vial - For Embolization
Federal (U.S.A.) law restricts this device to
ot pass throughanarterial/capillary/venous transition but directly
n
from an artery to a vein)
• In the pulmonary vasculature
UFE Specific Contraindications
• Pregnant women
• Suspected pelvic inflammatory disease or anyotheractive pelvic
infection
• Anymalignancy of the pelvic region
• Endometrial neoplasia or hyperplasia
• Presence of one or more submucosal fibroid(s) with more than
50% growth into the uterine cavity
• Presence of pedunculated serosal fibroid as the dominant
fibroid(s)
• Fibroids with significant collateral feeding by vessels other than
the uterine arteries
NeurologicalSpecific Contraindications
• Presence of patent extra-to-intracranial anastomoses or shunts
• Presence of end arteries leading directly to cranial nerves
• In any vasculature where Embosphere Microspheres could pass
directly into the internalcarotid artery, vertebral artery,intracranial
vasculature or the above listedvessels
WARNINGS:
All Indications
• Embosphere Microspheres contain gelatin of porcine origin, and
therefore, could cause an immune reaction in patients who are
hypersensitive to collagen or gelatin. Careful consideration should
be given prior to using this product in patients who are suspected
to be allergic to injections containing gelatin stabilizers.
• Studies have shown thatEmbosphere Microspheres do not form
aggregates, and, as a result, penetrate deeper into the vasculature
as compared to similarly sized PVA particles. Care must be taken
to chooselarger sized Embosphere Microspheres whenembolizing
arteriovenous malformations with largeshunts to avoid passage of
the spheres into the pulmonary or coronary circulation.
• Some of the Embosphere Microspheres may be slightly outside
of the range,sothe physicianshould be sure tocarefully selectthe
size of Embosphere Microspheres according to the size of the
target vessels at the desired level of occlusion in the vasculature
and after consideration of the arteriovenous angiographic
appearance. EmboSphereMicrospheressize shouldbeselected to
prevent passage from artery to vein.
• Because of the significant complications of misembolization,
extreme caution should be used for any procedures involving the
extracranial circulation encompassing the head and neck, and the
physician should carefully weigh the potential benefits of using
embolization against the risks and potential complications of the
procedure. These complications can include blindness, hearing
loss, loss of smell, paralysis and death
• Serious radiation induced skin injury may occur to the patient
due to long periods of fluoroscopic exposure, large patient
diameter, angled x-ray projections, and multiple image recording
runs or radiographs. Refer to your facility’s clinical protocol to
ensure theproper radiation doseisapplied for each specific typeof
procedureperformed. Physiciansshould monitor patients thatmay
be at risk.
• Onset of radiation-induced injury to the patient may be delayed.
2
Page 3

Patientsshould becounseledonpotential radiationside effects and
hom they should contact if they show symptoms.
w
• Pay careful attention for signs of mistargeted embolization.
During injection carefully monitor patient vital signs to include
AO2 (e.g. hypoxia, CNS changes). Consider terminating the
S
procedure, investigating for possible shunting, or increasing
microsphere size if any signs of mistargeting occur or patient
symptoms develop.
• Consider upsizing the microspheres if angiographic evidence of
embolization does not quickly appear evident during injection of
the microspheres.
UFE Specific Warnings
Warnings about UFE and Pregnancy
• Theeffects of UFE on the ability to become pregnant and carry a
fetus to term, and on the development of the fetus, have not been
determined. Therefore, this procedure should only be performed
on women who do not intend future pregnancy.
• Women who become pregnant following UFE may be at
increased risk for postpartum hemorrhage, preterm delivery,
cesarean delivery, and malpresentation.
• Devascularization of the uterine myometrium resulting from UFE
may theoretically put women who become pregnant following UFE
at increased risk of uterine rupture.
Other UFE Warnings
• When using Embosphere Microspheres for uterine fibroid
embolization, do not use microspheres smaller than 500 microns.
• An appropriate gynecologic work-up should be performed on all
patients presenting for embolization of uterine fibroids (e.g.
gynecologic history, fibroid imaging, endometrial sampling to rule
out carcinoma in patientswithabnormal menstrual bleeding).
• The diagnosis of uterine sarcoma could be delayed by taking a
non-surgical approach (such as UFE) to treating fibroids. It is
importantto pay close attention towarning signsfor sarcoma (e.g.,
rapid tumor growth, postmenopausal with new uterine
enlargement,MRI findings) and toconduct a morethorough workup of such patients prior to recommending UFE. Recurrent or
continued tumor growth following UFE should be considered a
potential warning sign for sarcoma and surgery should be
considered.
Warnings about use of small
• Careful consideration should be given whenever use is
contemplated of embolic agents that are smaller in diameter than
the resolutioncapability of your imagingequipment. The presence
of arteriovenous anastomoses, branch vessels leading away from
the target area or emergent vessels not evident prior to
embolization can lead to mistargeted embolization and severe
complications.
• Microspheres smaller than 100 microns will generally migrate
distal to anastomotic feeders and therefore are more likely to
terminate circulation to distal tissue. Greater potential of ischemic
injury results from use of smaller sized microspheres and
consideration must begiven to theconsequenceofthis injury prior
to embolization. The potential consequences include, swelling,
necrosis, paralysis, abscess and/or stronger post embolization
syndrome.
• Post embolization swelling may result in ischemia to tissue
adjacent to target area. Care must be given to avoid ischemia
intolerant, nontargeted tissue such as nervous tissue.
microspheres
PRECAUTIONS:
ll Indications
A
• Patients with known allergy to contrast medium may require
corticosteroids prior to embolization.
Additional evaluations or precautions may be necessary in
•
managing periprocedural care for patients with the following
conditions:
- Bleeding diathesis or hypercoagulative state
- Immunocompromise
• Do not use if the vial, screw cap, or tray package appears
damaged.
• For single patient use only - Contents supplied sterile - Never
reuse, reprocess, or resterilize the contents of a vial that has been
opened. Reusing, reprocessing or resterilizing may compromise
the structural integrity of the device and or lead to device failure,
which in turnmay result inpatient injury, illnessordeath. Reusing,
reprocessing or resterilizing may also create a risk of
contamination of the device andorcause patient infection or cross
infection including, but not limited to, the transmission of
infectiousdisease(s) from one patient to another. Contaminationof
the device may lead to injury, illness or death of the patient. All
procedures must be performed according to accepted aseptic
technique.
• Select the size and quantity of Embosphere Microspheres
appropriate for the pathology to be treated.
• Embolization with Embosphere Microspheres should only be
performed by physicians who have received appropriate
interventionalembolization trainingin the regionto be treated.
UFE Specific Precautions
• There is an increased chance of retro-migration of Embosphere
microspheresintounintended blood vessels as uterine artery flow
diminishes. Embolization should be stopped when the vasculature
surrounding the fibroid can no longer be visualized but before
complete stasis in the uterine artery.
• UFE should only be performed by Interventional Radiologists
who have received appropriate training for treatment of uterine
leiomyomata (fibroids).
• Theclinical study dataonEmbosphere Microspheres is limitedto
6 monthsoffollow-up. TheUFE patients in this studywill continue
to be followedannually for at least threeyears, and theinformation
will be updated as necessary to reflect any changes in the longterm outcome followingUFE.
POTENTIAL COMPLICATIONS:
All Indications
Vascularembolizationisa high-risk procedure. Complications may
occur at any time during or after the procedure, and may include,
but are not limited to, the following:
• Paralysis resulting from untargeted embolization or ischemic
injury from adjacent tissue edema.
• Undesirable reflux or passageof Embosphere Microspheres into
normalarteries adjacent to thetargeted lesionorthrough the lesion
into other arteries or arterial beds, such as the internal carotid
artery, pulmonary, or coronary circulations
• Pulmonary embolism due to arterial venousshunting
• Ischemia at an undesirable location, including ischemic stroke,
ischemic infarction (including myocardial infarction), and tissue
necrosis
• Capillary bed occlusion and tissue damage
• Vessel or lesion rupture and hemorrhage
• Vasospasm
3
Page 4

• Recanalization
Foreign body reactionsnecessitating medicalintervention
•
• Infection necessitating medical intervention
• Complications related to catheterization (e.g., hematoma at the
ite of entry, clot formation at the tip of the catheter and
s
subsequent dislodgment, and nerve and/or circulatory injuries,
which may result in leg injury)
• Allergic reaction to medications (e.g. analgesics)
• Allergic reaction to contrastmediaor embolic material
• Painand/or rash, possibly delayed from the timeofembolization
• Death
• Blindness, hearing loss, loss of smell, and/or paralysis
• Additional information is found in the Warnings section
UFE Specific PotentialComplications
• The most frequently anticipated post procedure complications
are abdominal pain, discomfort, fever and/or nausea, collectively
known as“Post-embolization Syndrome.” Somepatients mayalso
experience constipation. This is generally managed with
prescriptionor over the countermedications.
• Premature ovarian failure(i.e. Menopause)
• Amenorrhea
• Infection of the pelvic region
• Uterine/ovariannecrosis
• Phlebitis
• Deepvein thrombosis with or without pulmonary embolism
• Vaginal discharge
• Tissue passage, fibroidsloughing, or fibroid expulsionpostUFE
• Post-UFE interventionto removenecrotic fibroid tissue
• Vagal reaction
• Transient hypertensive episode
• Hysterectomy
• As of November 2002, four known deaths have occurred in
approximately 25,000 to 30,000 women treated by UFE world
wide, for a death rate of 0.01 to 0.02 percent.
NeurologicalSpecific Potential Complications
• Ischemic stroke or ischemic infarction
• Neurological deficits, including cranial nerve palsies
STORAGE AND STERILITY:
• EmbosphereMicrospheresmust be stored ina cool, dry anddark
place in their original vial and packaging.
• Useby the date indicated on the vial label.
• Do not freeze.
• Do not resterilize.
INSTRUCTIONSFORUSE:
Inspect packaging prior to use to ensure seal integrity for
maintenance of sterility.
• Carefully evaluate thevascular network associatedwith the lesion
using high resolution imaging prior to beginning the embolization
procedure.
• Embosphere Microspheres are available in a range of sizes.
Because of the potential for misembolization and the inherent
variabilityinsphere sizes, the physician should be sure to carefully
select the size of Embosphere Microspheres according to the size
of the target vessels at the desired level of occlusion in the
vasculature.
• When embolizing arteriovenous malformations (AVM), choose
an Embosphere Microsphere size that will occlude the nidus
without passing through the AVM.
When embolizing uterine fibroids, choose an Embosphere
•
Microsphere size of 500 micronsor greater.
• Choose a delivery catheter based on the size of the target vessel
nd the microsphere size being used. Embosphere Microspheres
a
can tolerate temporary compression of up to 33% in order to
facilitate passage through the delivery catheter.
• Introduce the delivery catheterintothetarget vessel according to
standard techniques. Position the catheter tip as close as possible
to the treatment site to avoid inadvertent occlusion of normal
vessels.
• Embosphere Microspheres are not radiopaque. It is
recommended that the embolization be monitored using
fluoroscopic visualization by adding the appropriate amount of
contrast medium to the physiologic suspension fluid.
• To deliver Embosphere Microspheres:
After gentlyagitating the vialcontainingEmbosphereMicrospheres,
dilute Embosphere Microspheres with contrast medium either into
a small sterile cup or directly into a large, mixing syringe. It is
recommended that 50% contrast and 50% physiological saline be
used for best suspension. To ensure proper suspension, gently
agitate the mixture of Embosphere Microspheres and contrast and
wait 2-3 minutes after mixing, prior to injection. Draw the
Embosphere Microspheres/contrast solution into a 1 mL or 3 mL
injection syringe and attach the syringe to the delivery catheter.
Inject the Embosphere Microspheres/contrast solution into the
delivery catheter under fluoroscopic visualization using a slow
pulsatile injection while observing thecontrast flow rate. If there is
no effecton the flow rate,repeat the deliveryprocess withadditional
injections of the Embosphere Microspheres/contrast solution.
Consider using larger sized Embosphere Microspheres if the initial
injections do not alter the contrast flow rate. Exercise conservative
judgment in determining the embolization endpoint.
• Femoral puncture can result in arterial spasm. This may
predisposetofemoral thrombosis (e.g.leg injury). Femoral patency
should be re-assessed priorto finalcatheter removal.
• Upon completion of the treatment, remove the catheter while
maintaining gentle suction so as not to dislodge Embosphere
Microspheresstill within the catheter lumen.
• Apply pressure to the puncture site until hemostasis is complete.
• Discard any open, unused EmbosphereMicrospheres.
Additional UFE specific instructions:
• At the discretion of the physician, pneumatic compression
devices may be used for patients currently taking hormone
therapy, uterine volume >1000cc, and patients that are overweight
to lower the risk of deep vein thrombosis.
• Embolization should be stopped when the vasculature
surrounding the fibroid can no longer be visualized but before
complete stasis in the uterine artery. There is an increased chance
of retro-migration of Embosphere Microsphere into unintended
blood vessels as uterine artery flow diminishes.
UFE PATIENT COUNSELING INFORMATION:
• Patients should have a clear understanding prior to embolization
of who will provide their post procedure care and whom to contact
in case of an emergency after embolization. Patient information
brochures are available and distributed by BioSphere Medical, Inc.
• UFE candidates should have an understanding of the potential
benefits, risks, and adverse events associated with UFE. In
particular patients should understand that there is a chance their
fibroid-related symptoms will not improve following UFE.
4
Page 5
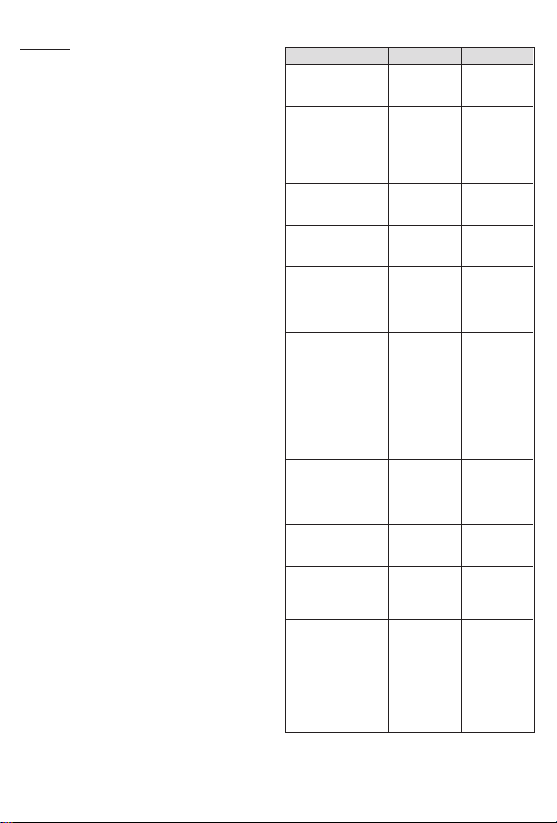
UFE CLINICAL STUDY SUMMARY:
tudy Design
S
A prospective multi-center trial was conducted to study UFE using
Embosphere Microspheres for treatment of symptomatic uterine
ibroids. Atotalof 132 women who desired tokeeptheir uterus and
f
avoid surgery were treated by UFE in the study: 30 in an initial
feasibility study and 102 in the pivotal study. A concurrent, nonrandomized group of 50 patients undergoing hysterectomy was
also included for comparison of safety to the UFE group. Eleven
investigational sites participated in the study: seven of which
performed UFEs and six of which performed hysterectomies.
The study was designed to determine whether UFE using
Embosphere Microspheres could reduce symptoms associated
with the symptomatic fibroids, such as abnormal bleeding, pain,
discomfort, and urinaryproblems.
Primary study endpointsincluded:
• Reduction in menstrualbleeding from baseline to 6 months postUFE as measured using a Pictorial Bleeding Assessment Chart
(PBLAC)
• Improvement in bulk symptoms (pelvic pain, pelvic
discomfort/bloating, and urinary dysfunction) as measured using a
patient symptom questionnaire
• Improvementinquality of life asmeasured usingthe SF-12 Health
Status Questionnaire
Secondary endpointsincluded:
• Other measures of changes in menstrual bleeding
• Reduction of uterus and fibroid size
• Hospitalization time
• Time to return to normal activities
• Evaluations of patient satisfaction with the procedure
Adverse eventsandcomplications were also evaluatedwith respect
to type, rate, and severity.
Eligibility criteria included age between 30 and 50 years, inclusive,
infertileornoplans to become pregnant, one or more symptomatic
uterine fibroids, uterinevolume ≥ 250 cc or fibroid volume ≥ 4 cc,
and baselinePBLAC ≥ 150. Women were excluded from the study
if they were pregnant,had a history of pelvic inflammatory disease,
submucosal fibroid(s) with more than 50% growth into the uterine
cavity, pedunculated serosal fibroid(s) as the dominant fibroid(s),
significant collateral feeding by vessels other than uterine artery,
adenomyosis as the dominant cause of symptoms, endometrial or
pre-malignant hyperplasia,any malignancy of the pelvicregion, any
active infectionof the pelvic region, known allergyto IV contrast or
gelatin, bleeding diathesis, immunocompromised, postmenopausalorbaseline FSH > 40 mIU/mL, ortreatment withGnRH
agonist within the previous3 months.
Pre-treatment evaluationsincluded routine gynecological examand
testing, standard laboratory testing, ultrasound or MRI, menstrual
bleeding record (UFE group), and self-assessment questionnaires
relating to overall health (SF-12), menstrual bleeding, and fibroid
symptoms. Patients were evaluated at 1-3 weeks, 3 months, 6
months and 12 months. PBLAC scores were obtained at 3 and 6
months.
Table 1 - PatientDemographics
UFE
30-50
Hysterectomy
1.6 (5.3)
4
31-50
2 (4%)
9 (18%)
8 (16%)
31 (62%)
0 (0%)
161.8 (10.1)
132-178
75.1 (21.5)
50-146
14 (28%)
2 (4%)
33 (66%)
1 (2%)
35 (70%)
2 (4%)
5 (10%)
5 (10%)
4 (8%)
1 (2%)
2 (4%)
3 (6%)
20 (40%)
19 (38%)
10 (20%)
1 (2%)
389.2 (521.2)
91.8-3415.1
90.6 (354.8)
3.2-2322.3
32 (64%)
8 (16%)
13 (26%)
1 (2%)
4 (8%)
AGE IN YEARS
ean (SD)
M
Range
THNIC ORIGIN
E
Asian/Pacific Island
African American
Hispanic
Caucasian
Other
HEIGHT (cm)
Mean (S.D.)
Range
WEIGHT (kg)
Mean (S.D.)
Range
MENSTRUAL STATUS
Frequent
Infrequent
Regular
Unknown
PRIOR FIBROID
TREATMENT
None
GnRH agonist
Oral contraceptive
Other hormonal
Myomectomy
D & C
Hysteroscopy
Other invasive
NUMBER OF FIBROIDS
1
2
≥ 3
no response
UTERINE VOLUME (cc)
Mean (SD)
Range
DOMINANT FIBROID
VOLUME (cc)
Mean (SD)
Range
FIBROID TYPE
Intramural
Subserosal
Submucosal
Transmural
Pedunculated
More than one type
indicated for some
patients
*Eighty-fourpercent of the UFE patients and 98% of the hysterectomy
patients had baseline uterine volumes of 1000 cc or less.
5
159.9 (10.5)
72.7 (16.2)
*
692.4 (462.8)
185.6-3076.3
147.4 (154.3)
2.4 (4.2)
4
1 (1%)
67 (59%)
7 (6%)
35 (31%)
3 (3%)
131-186
46-123
8 (8%)
1 (1%)
93 (91%)
0 (0%)
53 (52%)
9 (9%)
25 (25%)
9 (9%)
20 (20%)
17 (17%)
13 (13%)
9 (9%)
28 (25%)
37 (33%)
48 (42%)
0 (0%)
5.1-776.8
69 (61%)
20 (18%)
18 (16%)
11 (10%)
2 (2%)
Page 6
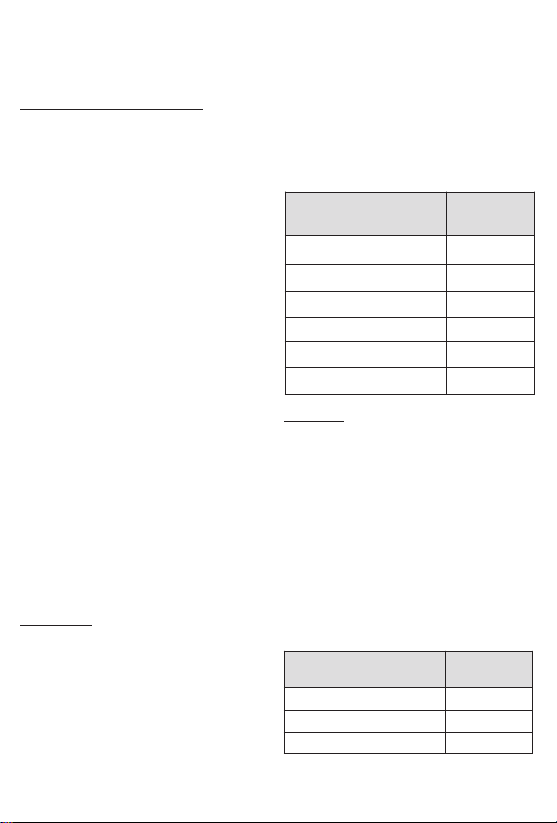
Study Results
he study results are presented below for 107 patients
T
considered to be in the Phase II UFE study cohort, which
consisted of 11 UFE Phase I patients who met the Phase II
ligibility criteria and 96 evaluable UFE Phase II patients.
e
Procedure, Discharge, and Recovery Information
All UFE procedures were technically successful with no
intraoperative complications that prevented completion of the
procedure. The majority (77%) of the UFE procedures were
performed using a 5Fr catheter with either a 4 Fr (19%) or 3 Fr
(3%) in the remainder. Seventy-two patients were treated with
500-700 micron spheres, 66 patients with 700-900 micron
spheres and 18 patients with 900-1200 micron spheres. Many
of the patients were treated with more than one sphere size.
The most common treatment approach was to start with a
smaller sphere size and then to increase the size if necessary.
The volume of spheres required varied inversely with the sphere
size as an average of 7.2 cc of 500-700 micron spheres was
used as compared to 6 cc of 700-900 micron spheres and 4.1
cc of 900-1200 micron spheres.
The majority of UFE patients underwent the procedure while
under conscious sedation with a local anesthetic given at the
puncture site. No UFE procedures were performed under
general anesthesia. The average UFE procedure time from first
arterial puncture to final catheter removal was 58 ± 28 minutes
(range 10-140 minutes). By comparison, all of the
hysterectomy surgeries were performed under general
anesthesia, regardless of the type of hysterectomy performed,
and the average surgery time from skin incision to skin closure
was 93 ± 38 minutes (range 35-171 minutes) (p<0.001). The
majority of the hysterectomy procedures were done
abdominally (76%).
Eighty-seven percent of the UFE patients were discharged from
the hospital on the day following the embolization procedure
and 12% on the same day as the procedure. Hysterectomy
patients spent a significantly longer time in the hospital
(p<0.001), with an average stay of 2.3 days as compared to 0.9
days for the UFE patients. UFE patients were back to work in an
average of 10.7 days, however, this took an average of 30.7
days for the hysterectomy patients (p<0.001). Similarly, the
UFE patients returned to normal daily activities more than three
times quicker than the hysterectomy patients (mean 10.9 days
for UFE versus 37.4 days for hysterectomy, p<0.001).
Primary Efficacy Endpoints
Menstrual Bleeding
To be eligible for UFE in this study, patients were required to
have abnormally heavy menstrual bleeding, with a baseline
score of
≥
150 on the Pictorial Bleeding Assessment Chart
(PBLAC) of Janssen et al. (1995). Success was defined as
≥
50% reduction in PBLAC score by the 6-month follow-up
evaluation. Additional measures were also used to assess
changes in menstrual bleeding, including patient selfassessment of their bleeding level and a menorrhagia
questionnaire.
Changes in menstrual bleeding generally occurred quickly
following UFE, with 92% of the patients showing some
improvement by 3 months. Table 2 presents the menstrual
leeding success rates at 6 months in the intent-to-treat
b
population. The data in Table 2 reflects completed PBLACsfrom
90 of the 107 Phase II UFE patients (84%). Six patients (6%)
id not complete a 6-month PBLAC because they were either
d
lost to follow-up (n=4) or had a hysterectomy (n=2) prior to this
evaluation period. The eleven remaining patients (10%) without
6-month PBLAC scores had sufficient information from the
other menstrual bleeding assessments to determine their level
of success on this endpoint.
Table 2 - Efficacy: Menstrual Bleeding Success Rates in Intentto-Treat Population
% Reduction From Baseline
≥ 50%
30-49%
0-29%
< 0%
Lost to Follow-up
Hysterectomy prior to 6 months
Bulk Symptoms
A fibroid-specific symptom questionnaire was used to assess
changes in three fibroid-related symptoms, pelvic pain, pelvic
discomfort, and urinary dysfunction. Success was defined as a
moderate or significant improvement for patients who entered
the study with moderate or severe symptoms, and/or no
worsening for patients who entered the study with no or mild
symptoms. Ninety-four of the 107 patients (88%) completed
the bulk symptom questionnaire at 6 months post-treatment.
All 13 patients with missing symptom data at 6 months for any
reason were counted as failures. Table 3 demonstrates that the
majority of UFE patients met the study criteria for success on all
three bulk-related symptoms. This success was generally
achieved by 3 months. Eighty-four percent of the women met
the success criterion for at least one bulk symptom by 6
months.
Table 3 - Efficacy: Bulk Symptom Success Rates In Intent-totreat Population
Symptoms
Pelvic Pain
Pelvic Discomfort
Urinary Dysfunction
6
6 Months
N/107 (%)
69 (65%)
15 (14%)
7 (7%)
10 (9%)
4 (4%)
2 (2%)
6 Months
N/107 (%)
83 (78%)
80 (75%)
75 (71%)
Page 7

Quality of Life
Event Description
Time to Event
# Patient
Complaints*
# Events
Procedure
In Hospit
al
<1 Month
1-3
Mo
nths
3-6 Months
>6
Mon
ths
Hysterectomy following UFE
44
88
6
67
7
77 17 11551
5
5
22
2
2
2
2
2
2
22
2
1
1111
1
1
1
11
11199
3
33
3
3
44
4
4
4
4
Allergic reaction/Rash
Fibroid/Tissue passage or removal
Pain related adverse events
Catheter/puncture site related injury
Urinary tract infection/Cystitis
Vaginal infection/Vaginitis
Vaginal Irritation/Burning/Discharge
Other
Total
he SF-12 Health Status questionnaire was used to assess
T
changes in general physical and mental health status following
treatment. The goal of thisendpointwasto demonstrateat least
moderate improvement in the overall quality of life by the 6-
a
month evaluation. Pre-treatment average scores for the UFE
group were 44.4 ± 8.5 and 45.1 ± 11.9 for the physical and
mental components, respectively, putting this group at slightly
better than the 25th percentile (44.32) of normalized scores
published for the U.S. population of females in general. By 6
months, the average scores for both the physical and mental
questionnaires had increased significantly to 52.2 ± 6.7 and
52.4 ± 8.8, respectively, putting the UFE group at the 50th
percentile (52.76) of normalized SF-12scores(p<0.001for both
measures).
Secondary Efficacy Endpoints
Fibroid and Uterine Volume
UFE patients underwent uterine imaging by MRI or ultrasound
at baseline and follow-up. Uterine and fibroid volumes were
calculated using the formula for the volume of a prolate ellipse
(LxWxDx0.52). Significant decreases in both uterine volume
(measured as including the cervix) and uterine fibroid volume
were recorded for the UFE group by the 3-month evaluation,
with further improvements seen at 6 months (p<0.001 at both
time periods as compared to baseline). Table 4 summarizes the
percent changes in uterine and fibroid volumes at 6 months
following treatment. This table includes uterine volume data
from 91 of the 108 UFE Phase II patients (84%) and fibroid
volume data from 83 of these patients (77%) who had complete
and evaluable imaging reports at baseline, and at 3 months and
6 months following UFE treatment.Increases in uterinevolumes
were reported for 11 patients (12%) and increases in fibroid
volumes for 8 patients (8%) by the 6-month evaluation.
Table 4 - Percent Change in Uterine and Fibroid Volumes From
Baseline
% Decrease at
6 Months
91
33.2% (30.5%)
-93.6% to 82.0%
83
50.9% (41.7%)
-173.4% to 99.7%
Uterine Volume (cc)
N
mean (SD)
range
Fibroid Volume
N
mean (SD)
range
A positive percent change indicates a decreasein volume, while
a negative percent change indicates an increase in volume.
Patient Satisfaction
Both study groups showed a high level of satisfaction with the
outcome of their procedures at both 3 and 6 months. Ninetytwo of 100 UFE patients (92%) and 46 of 47 hysterectomy
patients (98%) who completed the patient satisfaction
questionnaire at 6 months were slightly, moderately or very
atisfied with the outcome of their procedure, with the majority
s
in both groups being very satisfied.
DVERSE EVENTS:
A
Adverse event data is reported for all 132 patients treated by
UFE in both Phases I and II. There were no unanticipated
adverse device effects or unanticipated adverse events reported
in this study. Table 5 presents fifty-one adverse events judged
to be probably or possibly associated with the procedure, which
occurred in 37 of the 132UFEpatients (28%). Seven of the51
events (14%) occurred during the UFE procedure, five (10%)
between the procedure and hospital discharge, 17 (33%) from
hospital discharge to 1-month post-procedure, 11 (22%) from
1 to 3 months post-procedure, 4 (8%) from 3 to 6 months postprocedure, and 7 (14%) greater than6 months post-procedure.
The most common adverse event was an allergic reaction or
rash, which occurred in 8 of the 132 patients (6%), and which
were generally judged by the treating physician to be related to
the drugs or contrast agent used during the procedure. All
reactions resolved spontaneously or with treatment. Four
patients had hysterectomies following UFE, for an overall
hysterectomy rate of 3%. One hysterectomy was performed at
2 months post-UFE due to sustained fever/possible infection.
The other three were elective hysterectomies due to
dissatisfaction with UFE outcome, which occurred at 2, 10, and
11 months post-UFE. One patient (<1%) had a repeat UFE after
her uterine arteries were found to be patent.
Table 5 - Timing and Type of Probably or Possibly UFE-Related
Adverse events
total of 34 out of 132 patients (26%) experienced one or more
adverse event in this study. The number of patients in this
column reflects the fact that some patients experienced more
than one adverse event.
REFERENCES:
UFE Specific
1. Spies J et al., Initial experience with use of tris-acryl gelatin
microspheres for uterine artery embolization for leiomyomata, J
Vasc IntervRadiol, 12:1059-1063, 2001.
2. SpiesJ et al., Complicationsafter uterineartery embolizationfor
leiomyomas. Obstet Gynecol, 100:873-80, 2002.
3. Goldberg J, Pereira L, andBerghella V: Pregnancy After Uterine
Artery Embolization. ObstetGynecol, 100(5):869-872, 2002.
4. Scialli A: Alternatives to hysterectomy for benign conditions.
Int J Fert & Women'sMed, 43(4):186-91, 1998.
5. Nikolic B, Spies JB, Campbell L, et al.: Uterine artery
embolization: reduced radiation with refined technique. J Vasc
7
Page 8

Interv Radiol, 12(1):39-44, Jan 2001.
STERILIZE
2
2
STERILE
Worthington-Kirsch R, G Popky, F Hutchins: Uterine arterial
6
embolization for the management of leiomyomas: Quality-of-life
assessment and clinicalresponse. Radiol, 208: 625-629, 1998.
.PelageJP, LeDref O, SoyerP,et al.: Fibroid-related menorrhagia:
7
Treatment with superselective embolization of the uterine arteries
and mid-termfollow-up.Radiology, 215(2):428-431.May 2000.
All Indications
1.Bendszus M, Klein R, Burger R, et al.: Efficacy of trisacryl
gelatin microspheres versus polyvinyl alcohol particles in the
preoperative embolization of meningiomas. AJNR, 21(2): 25561, Feb 2000.
2. Deveikis JP: Endovascular therapy of intracranial
arteriovenous malformations: materials and techniques.
Neuroimaging Clin of N Am, 8(2):401-424, 1998.
3.Frizzel RT, Fisher WS: Cure, morbidity, and mortality
associated with embolization of brain arteriovenous
malformations: A review of 1246 patients in 32 series over a
35-year period. Neurosurg, 37(6):1031-1040, Dec 1995.
4.Gomes, A: Embolization therapy of congenital arteriovenous
malformations: Use of alternative approaches. Radiology,
190:191-8, Jan 1994.
5.Terada, T; Kinoshita, Y; Yokote, H; Tsuura, M; Itakura, T;
Komai, N; Nakamura, Y; Tanaka, S; Kuriyama, T: Preoperative
embolization of meningiomas fed by ophthalmic branch
arteries. Surg Neurol, 45:161-6, 1996.
Information on packaging:
Symbol Designation
Manufacturer: Name & Address
Use by date: year-month
LOT
Batch code
REF
Catalogue number
Do not resterilize
Do not use if package is damaged
Keep away from sunlight
Keep dry
Do not re-use
Caution - Refer to Instructions For Use
Non-pyrogenic
Sterilized using steam
Lower limit of temperature
0°C
Distributed in USA by:
erit Medical Systems, Inc.
M
Customer Service 1-800-356-3748
Patent Information
US 5,635,215 and other patent(s) issued and pending.
Embosphere Microspheres is a registered trademark of
BioSphere Medical.
All serious or life-threatening adverse events or deaths
associated with use of Embosphere Microspheres should
be reported to the U.S. Food and Drug Administration
under the MedWatch program and to the device
manufacturer. Information about the MedWatch
program and forms for reporting adverse events can be
obtained at
www.fda.gov/safety/medwatch/howtoreport/ucm053074.htm
or by calling toll free 888-463-6332. Reports to
BioSphere Medical, Inc. can be made by calling toll free
800-394-0295.
781-681-7900
8
Page 9

FRANÇAIS
MISES EN GARDE : La loi fédérale américaine limite
l’utilisation de ce dispositif aux médecins autorisés ou
sur prescription de ces médecins.
USAGE RECOMMANDÉ :
Les Microsphères Embosphere sont indiquées pour
l’embolisation de malformations artério-veineuses, de tumeurs
hypervascularisées et de fibromes utérins symptomatiques.
APPLICATIONS CLINIQUES POUR LES FIBROMES UTÉRINS :
L’embolisationd’unfibrome utérin(EFU) est une autre option de
traitement pour les femmes atteintes de fibrome utérin, dont les
symptômes peuvent être notamment les suivants : règles
abondantes, douleur ou pression pelvienne, et/ou dysfonction
urinaire.
DESCRIPTION DU DISPOSITIF :
Les Microsphères Embosphere font partie d’une famille de
matériaux emboliques, issus de la technologie brevetée de
microsphères de BioSphere Medical. Ces sphères sontconçues
pour permettre une embolisation contrôlée et ciblée.
Les Microsphères Embosphere sont des microsphères
biocompatibles, hydrophiles, non résorbables, en polymère
acrylique et imprégnées de gélatine porcine. Les Microsphères
Embosphere sont disponibles dans une gamme de tailles de
sphère.
CONDITIONNEMENT DU DISPOSITIF :
• Les Microsphères Embosphere sont contenues dans un
flacon en verre stérile de 5,0 ml muni d’un capuchon à vis,
conditionné dans un plateau operculé, contenant 5 flacons.
•
Chaque flacon contient 1,0 ml ou 2,0 ml de Microsphères
Embosphere dans du sérum physiologique stérileapyrogène.Le
volume total de sérum physiologique et de microsphères est de
5 ml.
____________________________________________________
Les contre-indications, avertissements, mises en garde et
instructions d’utilisation suivants sont présentés de façon à
indiquer d’abord les informations qui s’appliquent à toutes les
indications (c.-à-d. tumeurs hypervascularisées, malformations
artérioveineuses et fibromes utérins), puis les informations
spécifiques à chaque indication (c.-à-d. EFU et neurologique).
CONTRE-INDICATIONS :
Toutes indications
• Patients intolérants aux procédures d’occlusion
• Anatomie vasculaire ou flux sanguin empêchant la mise en
place d’un cathéter ou l’injection d’un agent embolique
• Présence ou risque de vasospasme
• Présence ou risque d’hémorragie
• Présence d’une athérosclérose grave
• Présence d’artères d’irrigation plus petites que les branches
distales dont elles émergent
• Présence d’artères alimentant la lésion trop petites pour
recevoir les Microsphères Embosphere
• Présence de voies vasculaires collatérales susceptibles de
Microsphères Embosphere®en flacon stérile - Pour embolisation
ompromettre des zones normales lors de l’embolisation
c
• Résistance vasculaire à la périphérie des artères d’irrigation
empêchant le passage des Microsphères Embosphere dans la
lésion
• Dans les shunts artério-veineux de grand diamètre (c’est-àdire où le sang passe directement de l’artère à la veine sans
transiter par des artères/capillaires/veines)
• Dans le système vasculaire pulmonaire
Contre-indications spécifiques de l’EFU
• Femmes enceintes
• Suspicion d’affection inflammatoire pelvienne ou de toute
autre infection pelvienne active
• Toute tumeur maligne de la région pelvienne
• Néoplasie ou hyperplasie endométriale
• Présence d’un ou plusieurs fibromes sous-muqueux avec
plus de 50 % de croissance dans la cavité utérine
• Présence de fibrome séreux pédiculé comme fibrome(s)
dominant(s)
• Fibromes avec irrigation collatérale significative par des
vaisseaux autres que les artères utérines
Contre-indications neurologiques spécifiques
• Présence d’anastomoses extra-intracrâniennes perméables
ou de shunts
• Présence d’artères terminales conduisant directement aux
nerfs crâniens
• Dans tout système vasculaire dans lequel les Microsphères
Embosphere pourraient passer directement dans l’artère
carotide interne, une artère vertébrale, le système vasculaire
intracrânien ou les vaisseaux indiqués ci-dessus
AVERTISSEMENT :
Toutes indications
• Les Microsphères Embosphere contiennent de la gélatine
d’origine porcine et peuvent, par conséquent, entraîner une
réaction immunitaire chez les patients hypersensibles au
collagène ou à la gélatine. Une mûre réflexion est nécessaire
avant d’utiliser ce produit chez lespatients pour qui on suspecte
une allergie aux injections contenant des stabilisants en gélatine.
• Des études ont montré que les Microsphères Embosphere ne
forment pas d’agrégats et pénètrent donc plus profondément
dans le système vasculaire que des particules de PVA de taille
similaire. Veiller à choisir des Microsphères Embosphere de plus
grande taille pour l’embolisation de malformations artérioveineuses avec de grands shunts pour éviter le passage des
sphères dans la circulation pulmonaire ou coronaire.
• Il est possible que certaines Microsphères Embosphere soit
légèrement hors de la gamme de taille, par conséquent, le
médecin devra s'assurer de sélectionner avec soin la taille des
microsphères Embosphere, en fonction de la taille des vaisseaux
au niveau désiré d’occlusion dans le systèmevasculaire et après
considération de l'aspect angiographique artério-veineux. La
taille des Microsphères Embosphere doit être choisie de façon à
éviter leur passage de l’artère à la veine.
• Du fait des complications importantes liées à une mauvaise
embolisation, une prudence extrême doit être appliquée pour de
quelconques interventions impliquant une circulation
extracrânienne englobant la tête et le cou et le médecin doit
9
Page 10

sérieusement peser les bienfaits potentiels du recours à
'embolisation par rapport aux risques et aux complications
l
potentiels de la procédure. Ces complications peuvent inclure
cécité, perte auditive, perte de l'odorat, paralysie et décès.
Le patient peut développer de graves lésions cutanées
•
inhérentes à l’irradiation du fait de longues périodes
d'exposition à l'angiographie, de patients de forte corpulence,
d’incidences obliques, de séries répétées d'enregistrement
d'images ou de radiographies multiples. Se reporter au
protocole clinique de votre établissement pourvousassurerque
la dose d'irradiation correcte est utilisée pour chaque type de
procédure réalisée. Les médecinsdoivent surveiller les patients
qui peuvent présenter un risque.
• L’apparition de lésions par irradiation chez lepatient peut être
retardée. Les patients doivent être informés des effetspotentiels
des rayons, de ce qu'il faut rechercher et de la personne à
contacter en cas d'apparition de symptômes.
• Apporter une attention particulière aux signes d'embolisation
mal ciblée. Durant l'injection, suivre attentivement les signes
vitaux du patient, tels que le SaO2 (par ex. l'hypoxie, les
changements du SNC). Envisager d'arrêter la procédure, en
cherchant un shunt éventuel, ou s'orienter vers une taille de
microsphères supérieure si de quelconques signes de mauvais
ciblage se produisent ou que les symptômes du patient
s'aggravent.
• Envisager d'utiliser une taille des microsphères supérieure si
l'angiographie ne démontre pas rapidement une embolisation
évidente pendant l'injection des microsphères.
Avertissements spécifiques à l’EFU
Avertissements concernant l’EFU et la grossesse
• Les effets de l’EFU sur la capacité à tomber enceinte et à
porter un fœtus à terme, et sur le développement du fœtus n’ont
pas été déterminés. Par conséquent, cette procédure ne doit
être pratiquée que chez les femmes n’ayant aucun projet de
grossesse.
• Les femmesqui tombent enceintes après une EFU présentent
un risque plus important d’hémorragie post-partum,
d’accouchement prématuré, d’accouchement par césarienne et
de présentation anormale du bébé.
• La dévascularisationdu myomètre résultant de l’EFU peut, en
théorie, entraîner un risque accru de rupture utérine pour les
femmes qui tombent enceintes après une EFU.
Autres avertissements concernant l’EFU
• Lors de l’utilisation des Microsphères Embosphere pour une
embolisation de fibrome utérin, ne pas utiliser des
microsphères de taille inférieure à 500 microns.
• Un bilan gynécologique approprié doit être pratiqué pour
toutes les patientes se présentant pour une embolisation de
fibrome utérin (c.-à-d. antécédents gynécologiques, imagerie
du ou des fibrome(s), prélèvement endométrial afin d’exclure
un carcinome chez les patientes présentant des saignements
menstruels anormaux).
• Le recours à une approche non chirurgicale (telle que l’EFU)
pour le traitement de fibromes peut différer le diagnostic de
sarcome utérin. Il est important de contrôler attentivement la
présence de signes de sarcome (par ex. croissance tumorale
rapide, ménopause avec augmentation de la taille de l’utérus,
anomalies à l’IRM) et de pratiquer un bilan plus approfondi chez
ces patientes avant derecommander une EFU. La récidive ou la
poursuite de la croissance tumorale après une EFU doit être
considérée comme un signe potentiel de sarcome, et une
ntervention chirurgicale doit être envisagée.
i
Avertissements relatifs à l’utilisation des petites microsphères
Une attention toute particulière doit être apportée lorsque les
•
emboles ont un diamètre inférieur àla capacité de résolution de
votre équipement d'imagerie. La présence d'anastomoses
artério-veineuses, de vaisseaux ramifiés conduisant hors de la
zone cible ou de vaisseaux émergents non évidents, peuvent
conduire à une embolisation mal ciblée et à des complications
graves.
• Des microsphères de moins de 100 microns effectueront
généralement une migration distale vers les sources
anastomotiques et sont ainsi susceptibles d'emboliser un tissu
distal. L'utilisation de microsphères de taille plus petite peut
conduire à un risque plus élevé de lésion ischémique et les
conséquences de cette lésion doivent être prises en compte
avant l'embolisation. Les conséquences potentielles
comprennent le gonflement, la nécrose, la paralysie, un abcès
et/ou un syndrome post-embolisation plus fort.
• Un gonflement post embolisation peut conduire à une
ischémie du tissu adjacent à la zone cible. Il faut prendre soin
d'éviter l'ischémie d'un tissu intolérant, non ciblé tel que le tissu
nerveux.
Toutes indications
• Les patients présentant des allergies connues auxproduits de
contraste non ioniques peuvent nécessiter une administration
de corticostéroïdes avant l'embolisation.
• D’autres évaluations ou précautions peuvent être nécessaires
dans la prise en charge périopératoire des patients présentant
les affections suivantes :
- Diathèse hémorragique ou état d’hypercoagulation
- Patients immunodéprimés
• Ne pas utiliser si le flacon, le bouchon à vis ou le blister est
endommagé.
• Pour un usage unique. Contenu fourni stérile. Ne jamais
réutiliser, retraiter ou restériliser le contenu d'un flacon qui a été
ouvert. La réutilisation, le retraitement ou la restérilisation
peuvent compromettre l'intégrité structurelle du dispositifet/ou
conduire à une défaillance du dispositif, pouvant entraîner une
lésion, une maladie ou le décès du patient. La réutilisation, le
retraitement ou la restérilisation risquent également de générer
une contamination du dispositif et/ou decauseruneinfection ou
une infection croisée chez le patient, y compris notamment, la
transmission de maladies infectieuses d'un patient à l'autre. La
contamination du dispositif peut entraîner une lésion, une
maladie ou le décèsdu patient. Toutes les interventions doivent
être effectuées en utilisant une technique aseptique approuvée.
• Choisir la taille et la quantité appropriées d’Microsphères
Embosphere pour la pathologie à traiter.
• Seul un médecin formé aux procédures d’embolisation
interventionnelle dans la région à emboliser peut procéder à une
embolisation avec les Microsphères Embosphere.
Précautions spécifiques pour l’EFU
• Il existeun risque accru de rétro-migration des Microsphères
Embosphere vers des vaisseaux sanguins non souhaités à
mesure que le flux dans l’artère utérine diminue. L’embolisation
doit être arrêtée lorsque le système vasculaire entourant le
fibrome ne peut plus être visualisé, mais avant une stase
complète dans l’artère utérine.
10
Page 11

• L’EFU doit être pratiquée uniquement par des radiologues
nterventionnels ayant reçu une formation adéquate au
i
traitement des léiomyomes (fibromes) utérins.
• Les données de l’étude clinique sur les Microsphères
mbosphere sont limitées à 6 mois de suivi. Les patientes
E
subissant une EFU dans cette étude seront suivies annuellement
pendant au moins trois ans, et les informations seront
actualisées pour prendre en compte les éventuels changements
des résultats à long terme après l’EFU.
COMPLICATIONS POTENTIELLES :
L’embolisation vasculaire est une intervention à haut risque. Des
complications peuvent survenir à tout moment, pendant ou après
l’intervention, et peuvent inclure, sans y être limitées, les
complications suivantes :
Toutes indications
• Paralysie résultant d’une embolisation mal ciblée ou d’une
lésion ischémique due à un œdème des tissus adjacents
• Reflux indésirable ou passagedes MicrosphèresEmbosphere
dans des artères normales adjacentes à la lésion ciblée ou au
travers de la lésion dans d’autres artères ou lits artériels, tels
que l’artère carotide interne ou les circulations pulmonaires ou
coronaires
• Embolie pulmonaire due à un shunt artério-veineux
• Ischémie à un endroit non souhaité, y compris accident
ischémique cérébral, infarctus ischémique (dont l’infarctus du
myocarde), et nécrose tissulaire
• Occlusion du lit capillaire et lésions tissulaires
• Rupture d’un vaisseau ou de la lésion et hémorragie
• Vasospasme
• Recanalisation
• Réactions au corps étranger nécessitant une intervention
médicale
• Infection nécessitant une intervention médicale
• Complications liées au cathétérisme (par ex. hématome au
site d’entrée, formation de caillots à l’extrémité du cathéter et
délogement consécutif de celui-ci, et lésion nerveuses et/ou
circulatoires pouvant entraîner des lésions aux jambes)
• Réaction allergique à des médicaments (par ex. analgésiques)
• Réaction allergique au produit de contraste ou au matériau
embolique
• Douleur et/ou éruption cutanée, pouvant être différée par
rapport au moment de l’embolisation
• Décès
• Cécité, perte auditive, perte de l’odorat et/ou paralysie
• Informations supplémentaires disponibles dans la section
Avertissements
Complications potentielles spécifiques à l’EFU
• Les complications post-procédure les plus fréquentes
anticipées sont les suivantes : douleurs abdominales, gêne,
fièvre et/ou nausées, collectivement appelées «syndromepostembolisation ». Certaines patientes peuvent également souffrir
de constipation. Cela est généralement pris en charge par des
médicaments sur ordonnance ou en vente libre.
• Insuffisance ovarienne précoce (c.-à-d. ménopause)
• Aménorrhée
• Infection de la région pelvienne
• Nécrose utérine/ovarienne
• Phlébite
• Thrombose veineuse profonde avec ou sans embolie
pulmonaire
• Leucorrhée
Passage dans du tissu, délitement du fibrome ou expulsion
•
du fibrome post-EFU
• Ré-intervention post-EFU pour retirer du tissu fibromateux
écrotique
n
• Réaction vagale
• Épisode d’hypertension transitoire
• Hystérectomie
• Depuis novembre 2002, quatre décès connus se sont
produits chez environ 25 000 à 30 000 patientes traitées par
EFU dans le monde, soit un taux de mortalité de 0,01 à 0,02 %.
Complications neurologiques spécifiques potentielles
• Accident vasculaire cérébral ischémique ou infarctus
ischémique
• Déficience neurologique, notamment paralysie des nerfs
crâniens
STOCKAGE ET STÉRILITÉ :
• Les Microsphères Embosphere doivent être conservées dans
un endroit sec, à l’abri de la lumière et de la chaleur, dans leur
flacon et leur emballage d’origine.
• Utiliser avant la date indiquée sur l’étiquette du flacon.
• Ne pas congeler.
• Ne pas restériliser.
INSTRUCTIONS D’UTILISATION :
Vérifier l’emballage avant l’utilisation pour vérifier l’intégrité
du scellage afin de s’assurer de la stérilité.
• Évaluer soigneusement le réseau vasculaire associé à la
lésion avec une imagerie à haute résolution avant de
commencer la procédure d’embolisation.
• Les Microsphères Embosphere sont disponibles dans
différentes tailles. Du fait du risque de mauvaise embolisation et
de la variabilité inhérente aux tailles des sphères, le médecin
doit s’assurer qu’il sélectionne avec soin la taille des
Microsphères Embosphere en fonction de la taille des vaisseaux
ciblés au niveau souhaité de l’occlusion du système vasculaire.
• Pour l’embolisation de malformations artério-veineuses
(MAV), choisir une taille de Microsphères Embosphere qui
permettra l’occlusion du nidus sans franchir la MAV.
• Pour l’embolisation de fibromes utérins, choisir des
Microsphères Embosphere de taille égale ou supérieure à 500
microns.
• Choisir un cathéterd’administrationen fonction de la taille du
vaisseau cible et de la taille des microsphères utilisées. Les
Microsphères Embosphere peuvent tolérer une compression
temporaire allant jusqu’à 33 % afin de faciliter le passage dans
le cathéter d’administration.
• Introduire le cathéter d’administration dans le vaisseau cible
conformément aux techniques standard. Placer l’extrémité du
cathéter le plus près possible du site de traitement afin d’éviter
l’occlusion accidentelle de vaisseaux sains.
• Les Microsphères Embosphere ne sont pas radio-opaques. Il
est recommandé de pratiquer l’embolisation sous visualisation
angiographique en ajoutant la quantité appropriéedeproduit de
contraste au liquide physiologique de suspension.
• Pour injecter les Microsphères Embosphere :
Après avoir agité délicatement le flacon contenant les
Microsphères Embosphere, diluer les Microsphères
Embosphere avec le produit de contraste dans une petite
11
Page 12

coupelle stérile ou directement dans une grande seringue de
élange. Il est recommandé d’utiliser 50 % de produit de
m
contraste et 50 % de sérum physiologique, pour une
suspension optimale. Pour garantir une mise en suspension
déquate, agiter délicatement le mélange Microsphères
a
Embosphere/produit de contraste et attendre 2 à 3 minutes
après le mélange, avant de pratiquer l’injection. Prélever la
solution de Microsphères Embosphere/produit de contraste
dans une seringue d’injection de 1 ml ou de 3 ml et monter la
seringue sur le cathéter d’administration. Injecter la solution
de Microsphères Embosphere/produit de contraste dans le
cathéter d’administration sous visualisation angiographique
par une injection lente et intermittente, tout en observant le
débit du produit de contraste. S’il n’y a aucun d’effet sur le
débit, répéter l’administration avec des injections
supplémentaires de solution Microsphères
Embosphere/produit de contraste. Envisager l’utilisation de
Microsphères Embosphere de plus grande taille si les
injections initiales n’altèrent pas le débit du produit de
contraste. Il convient d’être prudent pour la détermination du
résultat de l’embolisation.
• Une ponction fémorale peut entraîner un spasme artériel.
Cela peut prédisposer à une thrombose fémorale (c.-à-d. une
lésion de la jambe). La perméabilité fémorale doit être
réévaluée avant le retrait final du cathéter.
• Une fois le traitement terminé, retirer le cathéter tout en
maintenant une légère aspiration afin de ne pas déloger les
Microsphères Embosphere encore présentes dans la lumière
du cathéter.
• Appuyer sur le site de ponction jusqu’à une hémostase
complète.
• Eliminer les Microsphères Embosphere ouvertes non
utilisées.
Instructions supplémentaires spécifiques à l’EFU :
• À la discrétion du médecin, des dispositifs de compression
pneumatiques peuvent être utilisés pour les patientes sous
traitement hormonal, les patientes dont le volume utérin est >
1000 ml, et les patientes ensurpoids, afin de réduire le risque
de thrombose veineuse profonde.
• L’embolisation doit être arrêtée lorsque le système
vasculaire entourant le fibrome ne peut plus être visualisé,
mais avant une stase complète dans l’artère utérine. Il existe
un risque accru de rétro-migration des Microsphères
Embosphere vers des vaisseaux sanguins non souhaités à
mesure que le flux dans l’artère utérine diminue.
INFORMATIONS ET CONSEILS POUR LES PATIENTES
TRAITÉES PAR EFU :
• Avant la procédure d’embolisation, les patientes doivent
savoir qui leur prodiguera les soins post-procédure et qui
contacter en cas d’urgence après l’intervention. Des
brochures d’information des patientes sont disponibles et
sont distribuées par BioSphere Medical, Inc.
• Les candidates à une EFU doivent comprendre les
bénéfices, les risques et les événements indésirables
potentiels liés à l’EFU. Plus particulièrement, les patientes
doivent comprendre qu’il existe un risque queles symptômes
liés au fibrome persistent après l’EFU.
RÉSUMÉ DE L’ÉTUDE CLINIQUE SUR L’EFU :
Schéma de l’étude
Un essai prospectif multicentrique a été mené pour étudier
’EFU avec des Microsphères Embosphere dans le traitement
l
des fibromes utérins symptomatiques. Au total, 132 femmes
qui souhaitaient conserver leur utérus et ne pas subir
’intervention chirurgicale ont été traitées par EFU dans le
d
cadre de l’étude. Trente dans une étude initiale de faisabilitéet
102 dans l’étude pivot. Un groupe concomitant de 50
patientes non randomisées ayant subi une hystérectomie a
également été recruté pour comparer l’innocuité à celle du
groupe EFU. Onze centres d’étude ont participé à cette étude,
dont 7 ont pratiqué des EFU et 6 ont pratiqué des
hystérectomies.
L’étude a été conçue pour déterminer si l’EFU avec les
Microsphères Embosphere pouvait réduire les symptômes
associés aux fibromes symptomatiques, tels que les
saignements anormaux, les douleurs, les gênes et les troubles
urinaires.
Les critères d’évaluation principaux de l’étude étaient
notamment les suivants :
• Diminution des saignements menstruels à 6 mois post-EFU
par rapport à la référence, mesurée à l’aide d’une échelle
d’évaluation des hémorragies utérines (Pictorial Bleeding
Assessment Chart, PBLAC)
• Amélioration des symptômes de compression (douleurs
pelviennes, gêne/ballonnements pelviens et troubles
urinaires), mesurée à l’aide d’un questionnaire de satisfaction
des patientes
• Amélioration de la qualité de vie, mesurée à l’aide du
questionnaire sur l’état de santé SF-12
Les critères d’évaluation secondaires étaient notamment les
suivants :
• Autres mesures de l’évolution des saignements menstruels
• Réduction de la taille de l’utérus et du/des fibrome(s)
• Durée d’hospitalisation
• Délai avant le retour aux activités normales
• Évaluations de la satisfaction des patientes quant à la
procédure
Les événements indésirables et les complications ont
également été évalués en termes de type, de fréquence et de
sévérité.
Les critères d’éligibilité étaient les suivants : âge de 30 à 50
ans inclus, infertilité ou absence de projet de grossesse,
présence d’un ou plusieurs fibromes utérins symptomatiques,
volume utérin ≥ 250 ml ou volume du/des fibrome(s) ≥ 4 ml,
et score PBLAC à la référence ≥ 150. Les femmes n’ont pas
été admises à l’étude si elles étaient enceintes, avaient des
antécédents d’inflammation pelviennne, un/des fibrome(s)
sous-muqueux avec plus de 50 % de croissance dans la cavité
utérine, un/des fibrome(s) séreux pédiculé(s) comme
fibrome(s) dominant(s), irrigation collatérale significative par
des vaisseaux autres que l’artère utérine, adénomyose comme
cause principale des symptômes, hyperplasie endométriale ou
prémaligne, toute tumeur maligne dans la région pelvienne,
toute infection active de la région pelvienne, allergie connue à
un produit de contraste IV ou à la gélatine, diathèse
hémorragique, immunodépression, ménopause ou FSH à la
référence > 40 mUI/ml, ou traitement par un agoniste de la
GnRH dans les 3 mois précédents.
Les évaluations prétraitement étaient notamment les
12
Page 13

suivantes : examen et tests gynécologiques classiques,
xamens biologiques classiques, échographie ou IRM, relevé
e
des saignements menstruels (groupe EFU), et questionnaires
d’auto-évaluation concernant l’état de santé général (SF 12),
es saignements menstruels et les symptômes defibrome.Les
l
patientes ont été évaluées à 1-3 semaines, 3 mois, 6 mois et
12 mois. Les scores PBLAC ont été obtenus à 3 et 6 mois.
Tableau 1 - Caractéristiques démographiques des patientes
UFE
ÂGE (ANNÉES)
Moyenne (écart-type)
Plage
ORIGINE ETHNIQUE
Asie/Îles du Pacifique
Afro-américaine
Hispanique
Caucasienne
Autre
TAILLE (cm)
Moyenne (écart-type)
Plage
POIDS (kg)
Moyenne (écart-type)
Plage
ÉTAT MENSTRUEL
Règles fréquentes
Règles peu fréquentes
Règles régulières
Inconnu
TRAITEMENT ANTÉRIEUR
DE FIBROME
Aucun
Agoniste de la GnRH
Contraceptif oral
Autre traitement hormonal
Myomectomie
Dilatation et curetage
Hystéroscopie
Autresprocédure invasive
NOMBRE DE FIBROMES
1
2
≥ 3
Aucune réponse
VOLUME UTÉRIN (ml)*
Moyenne (écart-type)
Plage
VOLUME DU FIBROME
DOMINANT (ml)
Moyenne (écart-type)
Plage
TYPE DE FIBROME
Intramural
Sous-séreux
Sous-muqueux
Transmural
Pédiculé
Plusieurs types indiqués
pour certaines patientes
159.9 (10.5)
72.7 (16.2)
692.4 (462.8)
185.6-3076.3
147.4 (154.3)
42.4 (4.2)
30-50
1 (1%)
67 (59%)
7 (6%)
35 (31%)
3 (3%)
131-186
46-123
8 (8%)
1 (1%)
93 (91%)
0 (0%)
53 (52%)
9 (9%)
25 (25%)
9 (9%)
20 (20%)
17 (17%)
13 (13%)
9 (9%)
28 (25%)
37 (33%)
48 (42%)
0 (0%)
5.1-776.8
69 (61%)
20 (18%)
18 (16%)
11 (10%)
2 (2%)
Hystérectomie
41.6 (5.3)
31-50
2 (4%)
9 (18%)
8 (16%)
31 (62%)
0 (0%)
161.8 (10.1)
132-178
75.1 (21.5)
50-146
14 (28%)
2 (4%)
33 (66%)
1 (2%)
35 (70%)
2 (4%)
5 (10%)
5 (10%)
4 (8%)
1 (2%)
2 (4%)
3 (6%)
20 (40%)
19 (38%)
10 (20%)
1 (2%)
389.2 (521.2)
91.8-3415.1
90.6 (354.8)
3.2-2322.3
32 (64%)
8 (16%)
13 (26%)
1 (2%)
4 (8%)
*Quatre-vingt quatre pourcent des patientes EFU et 98 % des
atientes hystérectomisées avaient un volume utérin à la
p
référence de 1000 ml.
ésultatsdel’étude
R
Les résultats de l’étude sont présentés ci-dessous pour les 107
patientes considérées comme étant dans la cohorte de l’étude de
phase II sur l’EFU, qui se composaitde11patientes EFUen phase I
qui remplissaient les critères d’éligibilité de phase II et de 96
patientes EFU évaluables en phase II.
Informations concernant la procédure, la sortie de l’hôpital et le
rétablissement
Toutes les procédures d’EFU étaient des succès techniques, sans
aucune complication périopératoire empêchant de terminer la
procédure.La majorité(77 %) desprocéduresd’EFUont étépratiquées
à l’aided’uncathéter 5F, et4 F (19%) ou3 F (3 %)dans lesautres cas.
Soixante-douzepatientes ont ététraitées avecdes sphèresde 500-700
microns, 66 patientes avec des sphères de 700-900 microns et 18
patientes avec des sphères de 900-1200 microns. De nombreuses
patientes ont ététraitées avec plusieurstaillesdesphères. L’approche
thérapeutique la plus fréquente consistait à commencer avec des
sphères depetitetaille etd’augmenterla taille sinécessaire. Levolume
de sphères nécessaire variait de façon inversement proportionnelle à la
taille des sphères : une moyenne de 7,2 ml de sphères de 500-700
microns aété utilisée contre6 ml de sphèresde 700-900 micronset 4,1
ml de sphèresde900-1200 microns.
La majorité des patientes EFU ont subi la procédure sous sédation
consciente, etavec unanesthésiquelocaladministréau sitede ponction.
Aucune procédured’EFU n’a été pratiquéesous anesthésiegénérale. La
duréemoyenne des procédures d’EFU delapremièreponctionartérielle
jusqu’au retrait final du cathéterétait de 58 ± 28 minutes(plagede10140 minutes). Par comparaison, toutes les hystérectomies ont été
pratiquées sous anesthésie générale, quel que soit le type
d’hystérectomie pratiqué, et la durée moyenne de l’opération, de
l’incision cutanée à la fermeture de la peau, était de 93 ± 38 minutes
(plage de 35-171 minutes) (p<0,001). La majorité des procédures
d’hystérectomieont été pratiquée parvoie abdominale (76 %).
Quatre-vingt sept pourcentdes patientes traitées par EFUsont sorties
de l’hôpitallelendemain dela procédured’embolisationet 12%le jourmême de l’intervention. La durée d’hospitalisation pour les patientes
traitées par hystérectomie était significativement plus longue
(p<0,001),avec un séjour moyen de2,3 jours, contre 0,9 jourpour les
patientestraitéespar EFU. Lespatientestraitéespar EFUont reprisleur
activité professionnelle après en moyenne 10,7 jours ; pour les
patientes traitées par hystérectomie, par contre, le délai était en
moyenne de 30,7 jours (p<0,001). De même, les patientes EFU ont
retrouvé leurs activités quotidiennes normales plus de trois fois plus
viteque les patientes hystérectomisées(10,9 jours enmoyennepour le
groupe EFU, contre 37,4 jours en moyenne pour le groupe
hystérectomie,p<0,001).
Critèresd’évaluation principaux de l’efficacité
Saignements menstruels
Pour être éligible pour une EFU dans cette étude, les patientes
devaient avoir des saignements menstruels anormalement
abondants, avecunscore à la référence de ≥ 150points sur l’échelle
PBLAC de Janssen et al. (1995). Le succès de l’intervention était
défini comme une réduction de ≥ 50 % du score PBLAC lors de
l’évaluation de suivi à 6 mois. D’autres mesures ont également été
utilisées pour évaluer l’évolution des saignements menstruels,
13
Page 14

notamment l’auto-évaluation par la patiente de son niveau de
aignementetunquestionnaire sur la ménorragie.
s
Dans l’ensemble, l’évolution des saignements menstruels est
urvenue rapidement après l’EFU, avec 92 % des patientes
s
présentant uneamélioration à 3 mois. Le Tableau2 présente lestaux
de succès en termes de saignements menstruels à 6 mois dans la
population en intention detraiter. Lesdonnées duTableau 2 reflètent
les scoresPBLAC obtenus chez90 des 107 patientes (84 %)EFUde
la phase II. Six patientes (6 %) n’avaient pas de score PBLAC à 6
moiscarle contacta été perduetle suivin’apas pu êtreassuré (n=4)
ou ont subi une hystérectomie (n=2) avant la fin de cette période
d’évaluation.Pour les11 patientesrestantes(10%) qui n’avaientpas
de score PBLAC à 6 mois, on disposait de suffisamment
d’informations issues des autres évaluations des saignements
menstruels pour déterminer leur niveau de succès pour ce critère.
Tableau 2 - Efficacité : taux de succès en termes de saignements
menstruels dans la population en intention de traiter
% deréductionpar rapport
à laréférence
≥ 50%
30-49%
0-29%
< 0%
Suivi perdu
Suivi perdu
Symptômes de compression
Un questionnaire sur les symptômes spécifiques de fibrome a été
utilisé pour évaluer l’évolution de trois symptômes spécifiques du
fibrome : douleurs pelviennes, gêne pelvienne et troubles urinaires.
Le succès était défini comme une amélioration modérée ou
significative chez les patientes ayant intégré l’étude avec des
symptômes modérésousévères,et/ou aucuneaggravationpour les
patientes ayant intégré l’étude avec aucun symptôme ou des
symptômes légers. Quatre-vingt quatorze des 107 patientes (88 %)
ont rempli le questionnairesur les symptômesdecompression, à 6
mois post-traitement. Les 13 patientes pour qui il manquait des
donnéesà 6 mois, pour quelque raison quecesoit, ont étéclassées
comme échec thérapeutique. Le Tableau 3 montre que la majorité
des patientes traitées par EFU ont rempli les critères de succès de
l’étude pourlestrois symptômesliés à la compression.De manière
générale,ce succèsétait obtenu dansles 3 mois.Quatre-vingtquatre
pourcent des femmes ont rempli les critères de succès pour au
moins un symptôme de compression, à 6 mois.
Tableau 3 - Efficacité : taux de succès en termes de symptômes de
compression dans la population en intention de traiter
Symptômes
Douleurs pelviennes
Gêne pelvienne
Troubles urinaires
6 mois
N/107 (%)
69 (65%)
15 (14%)
7 (7%)
10 (9%)
4 (4%)
2 (2%)
6 mois
N/107 (%)
83 (78%)
80 (75%)
75 (71%)
Qualité de vie
e questionnaire d’auto-évaluation de l’état de santé SF-12 a été
L
utilisé pourévaluer l’évolution de l’étatdesanté général physique et
mental après le traitement. L’objectif de ce critère d’évaluation était
e démontrer au moins une amélioration modérée de la qualité de
d
vie globale lors de l’évaluation à 6 mois. Les scores moyens prétraitement pourle groupe EFU étaient de44,4 ± 8,5etde 45,1 ± 11,9
pour les composantes physiques et mentales, respectivement,
plaçant ce groupe légèrement au-dessus du 25ème centile (44,32)
des scores normalisés publiés pour la population de femmes
américaines, en général. À 6 mois, les scores moyens aux
questionnaires physiques et mentaux avaient augmenté de manière
significative à 52,2 ± 6,7 et 52,4 ± 8,8, respectivement, plaçant le
groupe EFU au 50ème centile (52,76) des scores SF-12 normalisés
(p<0,001pour les deux mesures).
Critèresd’évaluation secondaires de l’efficacité
Volume du/des fibrome(s) et volume utérin
Les patientesEFUont subi un examen d’imagerieutérinepar IRMou
échographie à la référence et lors du suivi. Le volume utérin et le
volume des fibromes ont été calculés à l’aide de la formule pour le
volume d’une ellipse allongée (L x l x P x 0,52). Une diminution
significativeduvolume utérin(col inclus)et du volume desfibromes
utérins a été observée dans le groupe EFU lors de l’évaluation à 3
mois, et d’autres améliorations à 6 mois (p<0,001 pour les deux
périodes, par rapport à la référence). Le Tableau 4 récapitule les
pourcentages d’évolution du volume utérin et du volume des
fibromes 6 mois après le traitement. Ce tableau comprend les
données sur le volume utérin de 91 des 108 patientes EFU de la
phase II (84%)et les donnéessur le volumedesfibromes de 83 de
ces patientes (77%) pour qui l’on disposait de rapports d’imagerie
complets et évaluables à la visite de ligne de base, et à 3 mois et 6
mois après le traitement par EFU. Une augmentation du volume
utérin a été observée chez 11 patientes (12 %) et uneaugmentation
du volume des fibromes chez 8 patientes (8 %) lors de l’évaluation
à 6 mois.
Tableau 4 - Évolution enpourcentage du volume utérinetdu volume
du/des fibrome(s) par rapport à la référence
VOLUME UTÉRIN (ml)
N
Moyenne (écart-type)
Plage
Volume du ou des fibrome(s)
N
Moyenne (écart-type)
Plage
Un pourcentage d’évolution positif indique une diminution du
volume, tandis qu’un pourcentage d’évolution négatif indique une
augmentation du volume.
Satisfactiondes patientes
Les deux groupes de l’étude ont montré un haut niveau de
satisfaction quant au résultat de leurs procédures à 3 et 6 mois.
Quatre-vingt douze des 100 patientes EFU (92 %) et 46 des 47
patientes hystérectomisées (98%) qui ontremplilequestionnairede
satisfaction des patientes à 6 mois étaient légèrement, modérément
14
% de diminution
à 6 mois
91
33.2% (30.5%)
de -93.6% à 82.0%
83
50.9% (41.7%)
de -173.4% à 99.7%
Page 15

ou très satisfaites du résultat de l’intervention, la majorité dans les deux
Moment de l’évènement
Description del’évènement
Nb
deplaintes
de
!
patientes*
Nbd’évènements
Pr
océ
dure
Àl
’hôpit
al
<1 mois
1-3
moi
s
3-6
mois
>6
mois
Hystérectomie suiteà l’EFU 4 4 2 2
Réaction allergique ou éruption 8 8 2 3 3
Passage ou perte de tissu fibromateux 5 6 2 3 1
Évènements indésirables liés à ladouleur 4 4 3 1
Lésion liéeau cathéter ou au site de ponction 6 7 1 2 4
Infection des voies urinaires ou cystite 3 4 1 1 1 1
Infection vaginaleou vaginite 5 7 2 1 2 2
Irritation, brûlure ou écoulement au niveau du
vagin
22 11
Autre994 1211
Total 51 7 5 17 11 4 7
STERILIZE
2
2
STERILE
roupes étanttrès satisfaite.
g
ÉVÉNEMENTSINDÉSIRABLES :
es données sur les événements indésirables concernent l’ensemble des
L
132 patientes traitées par EFU enphase I eten phaseII. Dans cetteétude,
aucun effet indésirable inattendu dû au dispositif ni aucun événement
indésirable inattendun’a été observé.Le Tableau 5indique 51 événements
indésirables jugés probablement ou potentiellement associés à la
procédure,survenus chez37 des 132 patientesEFU (28%). Sept des51
événements (14 %) se sont produits pendant la procédure d’EFU, cinq
(10 %)entre laprocédure et lasortiedel’hôpital,17 (33 %) dans le mois
suivant la sortie de l’hôpital, 11 (22 %) de 1 à 3 mois post-procédure,
4 (8%)de 3 à6mois post-procédure,et 7 (14%) au-delà de6 mois postprocédure. L’événement indésirable le plus fréquent était une réaction
allergique ou une éruption cutanée, survenue chez 8 des 132 patientes
(6 %),et quiagénéralementété jugéepar lemédecintraitant commeétant
liée aux médicaments ou au produit de contraste utilisés pendant la
procédure.Toutes lesréactions sesont résoluesspontanémentouavec un
traitement. Quatre patientes ont subi une hystérectomie après l’EFU, soit
un tauxd’hystérectomie global de 3 %.Une hystérectomiea été pratiquée
2 mois aprèslaprocédure d’EFUen raisond’une fièvreprolongée/possible
infection.Les troisautresétaientdes hystérectomiesprogramméesdues à
un résultat insatisfaisant de l’EFU, et ont été pratiquées 2, 10 et 11 mois
aprèsl’EFU. Unepatiente (<1%) a subiune deuxième EFUaprèsque l’on
a découvertque ses artèresutérines étaient perméables.
Tableau 5 - Moment et type d’événements indésirables probablement ou
potentiellementassociés à l’EFU
*En tout, 34 des 132 patientes (26 %) ont présenté un ou plusieurs
événements indésirables dans cette étude. Le nombre de patientes dans
cette colonne reflète le faitque certaines patientes ont présenté plusieurs
événementsindésirables.
RÉFÉRENCES:
Spécifiques à l’EFU
1. Spies J et al., Initial experience with use of tris-acryl gelatin
microspheres for uterine artery embolization for leiomyomata, J Vasc
IntervRadiol, 12:1059-1063,2001.
2. Spies J et al., Complications after uterine artery embolization for
leiomyomas. Obstet Gynecol, 100:873-80,2002.
3. Goldberg J, Pereira L, and Berghella V: Pregnancy After Uterine Artery
Embolization. Obstet Gynecol,100(5):869-872, 2002.
4. ScialliA: Alternativesto hysterectomyfor benignconditions. IntJ Fert &
Women’sMed, 43(4):186-91,1998.
5. Nikolic B, Spies JB, Campbell L, et al.: Uterine artery embolization:
reduced radiation with refined technique. J Vasc Interv Radiol, 12(1):3944, Jan2001.
6. Worthington-Kirsch R, G Popky, F Hutchins: Uterine arterial
embolization for the management of leiomyomas: Quality-of-life
ssessmentand clinical response. Radiol, 208: 625-629, 1998.
a
7. Pelage JP, Le Dref O, Soyer P, et al.: Fibroid-related menorrhagia:
Treatment with superselective embolizationof the uterinearteriesand mid-
erm follow-up. Radiology, 215(2):428-431. May 2000.
t
Toutes indications
1. Bendszus M, Klein R, Burger R, et al.: Efficacy of trisacryl gelatin
microspheres versus polyvinyl alcohol particles in the preoperative
embolization of meningiomas. AJNR, 21(2): 255-61, Feb 2000.
2. Deveikis JP: Endovascular therapy of intracranial arteriovenous
malformations: materials and techniques. Neuroimaging Clin of N Am,
8(2):401-424, 1998.
3. Frizzel RT, Fisher WS: Cure, morbidity, and mortality associated with
embolizationofbrain arteriovenous malformations: Areview of1246 patientsin
32 series overa 35-year period. Neurosurg, 37(6):1031-1040, Dec 1995.
4. Gomes,A:Embolization therapy of congenital arteriovenous malformations:
Use ofalternativeapproaches. Radiology,190:191-8,Jan 1994.
5. Terada,T; Kinoshita,Y; Yokote, H; Tsuura,M; Itakura, T;Komai,N;Nakamura,
Y; Tanaka, S; Kuriyama, T: Preoperative embolization of meningiomas fed by
ophthalmicbranch arteries.Surg Neurol, 45:161-6, 1996.
Informationssur l’emballage :
Symbol Désignation
Fabricant : Nom et adresse
Date limite d'utilisation : année-mois
LOT
Numéro de lot
REF
Référence catalogue
Ne pas restériliser
Ne pas utiliser si l’emballage est endommagé
Conserver à l’abri de la lumière du soleil
Tenir au sec
Ne pas réutiliser
Attention - Consulter la notice d’instructions
Apyrogène
Stérilisé à la vapeur
Limite inférieure de température
0°C
Distribué aux États-Unis par :
Merit Medical Systems, Inc.
Service clientèle 1-800-356-3748
Informationssur les brevets
Brevet US 5,635,215 et autre(s) brevet(s) accordé(s)etencours.
Microsphères Embosphere est une marque déposée de
BioSphere Medical.
781-681-7900
15
Page 16

PORTUGUÊS
ATENÇÃO
: A lei federal dos EUA restringe a venda
deste dispositivo a um médico ou mediante
prescrição médica
UTILIZAÇÃO PREVISTA:
As Microesferas Embosphere são indicadas para utilização na
embolização das malformações arteriovenosas, tumores
hipervasculares e fibróides uterinos sintomáticos.
APLICAÇÕES CLÍNICAS PARA FIBRÓIDES UTERINOS:
A embolização de fibróides uterinos (UFE - uterine fibroid
embolization) constitui um tratamento alternativo para
mulheres que necessitam de alíviodos sintomas atribuídos aos
fibróides uterinos, incluindo hemorragia menstrual intensa, dor
ou pressão pélvica e/ou disfunção urinária.
DESCRIÇÃO DO DISPOSITIVO:
As Microesferas Embosphere fazem parte de uma família de
materiais embólicos baseados na tecnologia de microesferas
patenteada de BioSphere Medical. Estas esferas são
concebidas para oferecer uma embolização controlada e
direccionada.
As Microesferas Embosphere são microesferas biocompatíveis,
hidrófilas e não-reabsorvíveis, fabricadas a partir de um
polímero acrílico e impregnadas com gelatina de origem suína.
As Microesferas Embosphere estão disponíveis numa gama de
tamanhos de esferas calibrados.
ACONDICIONAMENTO DO DISPOSITIVO:
• As Microesferas Embosphere estão contidas num frasco de
vidro estéril de 5,0 ml, com uma tampa de rosca,
acondicionado num tabuleiro de película amovível, disponível
em 5 frascos por embalagem.
• Cada frasco contém 1,0 ml ou 2,0 ml de Microesferas
Embosphere em soro fisiológico estéril e apirogénico. O
volume total de soro fisiológico e microesferas é de 5 ml.
____________________________________________________
As seguintes contra-indicações, advertências, precauções e
instruções de utilização estão organizadas para apresentar
primeiro as informações aplicáveis a todas as indicações (ou
seja, tumores hipervasculares, malformações arteriovenosas e
fibróides uterinos), seguidas por informações específicas da
indicação (ou seja, UFE e neurológicas).
CONTRA-INDICAÇÕES:
Todasas indicações
• Doentes intolerantes a procedimentos de oclusão
• Anatomia vascular ou fluxo sanguíneo que impede a
colocação do cateter ou a injecção de um agente embólico
• Presença ou início provável de vasoespasmo
• Presença ou início provável de hemorragia
• Presença de doença ateromatosa grave
• Presença de artérias aferentes mais pequenas do que as
ramificações distais das quais emergem
• Presença de artérias que irrigam a lesão com tamanho
insuficiente para aceitarem Microesferas Embosphere
• Presença de vias dos vasos colaterais que coloquem
Microesferas Embosphere®num frasco estéril - Para embolização
otencialmente em perigo os territórios normais durante a
p
embolização
• Resistência vascular periférica às artérias aferentes que
impede a passagem das Microesferas Embospherepara a lesão
• Nos shunts arteriovenosos de diâmetro maior (ou seja,
quando o sangue não passa através de uma transição
arterial/capilar/venosa mas directamente de uma artéria para
uma veia)
• Na vasculatura pulmonar
Contra-indicações específicasda UFE
• Mulheres grávidas
• Suspeita de doença inflamatória pélvica ou de qualquer outra
infecção pélvica activa
• Qualquer tumor maligno da região pélvica
• Neoplasia ou hiperplasia do endométrio
• Presença de um ou mais fibróide(s) submucosal(ais) com
mais de 50% de crescimento para dentro da cavidade uterina
• Presença de fibróide seroso pedunculado como fibróide(s)
dominante(s)
• Fibróides com suprimento sanguíneo colateral significativo
por vasos diferentes das artérias uterinas
Contra-indicações específicasde procedimento neurológico
• Presença de anastomoses ou shunts extra a intracranianos
patentes
• Presença de artérias finais que conduzem directamente aos
nervos cranianos
• Em qualquer vasculatura na qual as Microesferas
Embosphere podem passar directamente paraaartéria carótida
interna, artéria vertebral, vasculatura intracraniana ou os vasos
supra-indicados
ADVERTÊNCIAS:
Todasas indicações
• As Microesferas Embosphere contêm gelatina de origem
suína e, portanto, podem provocar uma reacção imune em
doentes que sejam hipersensíveis ao colagénio ou à gelatina.
Deve prestar-se uma especial atenção antes de se utilizar este
produto em doentes com suspeita de serem alérgicos a
injecções que contenham estabilizadores de gelatina.
• Estudos demonstraram que as Microesferas Embosphere
não formam agregados e, por conseguinte, penetram com
maior profundidade na vasculatura comparativamente a
partículas em PVA de tamanho semelhante. Deve ter-se cuidado
na escolha de Microesferas Embosphere com tamanho
superior quando se efectua a embolização de malformações
arteriovenosas com shunts grandes de modo a evitar a
passagem de esferas para a circulação pulmonar ou coronária.
• Algumas das Microesferas Embosphere podem estar
ligeiramente fora do intervalo. Como tal, o médico deve
escolher cuidadosamente o tamanho das Microesferas
Embosphere de acordo com otamanho dos vasos alvo no nível
de oclusão pretendido na vasculatura e após consideração do
aspecto angiográfico arteriovenoso. O tamanho das
Microesferas Embosphere deve ser seleccionado de modo a
impedir a passagem da artéria para a veia.
• Devido às complicações significativas de falha na
embolização, deve ter-se extrema cautela em qualquer
procedimento que envolva a circulação extracraniana incluindo
16
Page 17

a cabeça e o pescoço, e o médico deve ponderar
cuidadosamente as potenciais vantagens de utilizar a
embolização comparativamente aos riscos e potenciais
complicações do procedimento. Estas complicações podem
incluir cegueira, perda de audição, perda de olfacto, paralisia e
morte.
• Pode ocorrer lesão grave na pele do doente induzida por
radiação devido a longos períodos de exposição fluoroscópica,
diâmetro grande do doente, projecções angulares de raio-x e
diversas séries de registo de imagens ou radiografias. Consulte
o protocolo clínicoda sua instituição para garantirqueé aplicada
a dose correcta de radiação para cada tipo específico de
procedimento executado. Os médicos devem monitorizar os
doentes que possam estar em risco.
• O início da lesão induzida por radiação no doente pode ser
atrasado. Os doentes devem ser aconselhados sobre os
potenciais efeitos secundários da radiação e sobre quem devem
contactar caso apresentem sintomas.
• Preste especial atenção a sinais de embolização mal
direccionada. Durante a injecção monitorize cuidadosamente os
sinais vitais do doente de modo a incluir SAO2 (por ex., hipoxia,
alterações no SNC). Considere terminar o procedimento,
investigar a possibilidade de existir um shunt ou aumentar o
tamanho de microesferas caso ocorram sinais de mau
direccionamento ou se desenvolvam sintomas no doente.
• Considere aumentar o tamanho das microesferas caso os
sinais angiográficos de embolização não apareçam rapidamente
evidentes durante a injecção das microesferas.
Advertênciasespecíficas da UFE
Advertênciasrelativas à UFE e à gravidez
• Ainda estão por determinar os efeitos da UFE tanto na
capacidade de engravidar e manter a gestação até ao termo
como no desenvolvimento do feto. Por conseguinte, este
procedimento só deve ser realizado em mulheres que não
planeiam vir a engravidar no futuro.
• As mulheres que engravidam depois de serem submetidas à
UFE apresentam um risco aumentado de hemorragia pós-parto,
parto pré-termo, parto por cesariana e apresentação incorrecta.
• Em teoria, a desvascularização do miométrio uterino
resultante da UFE pode colocar as mulheres que engravidam
depois de uma UFE numa situação de risco aumentado de
ruptura uterina.
Outras advertências relacionadas com a UFE
• Durante a utilização de Microesferas Embosphere para a
embolização de fibróides uterinos, não utilize microesferas
inferiores a 500 mícrones.
• Deve ser realizada uma avaliação ginecológica adequada em
todas as doentes indicadas para embolização de fibróides
uterinos (por ex., antecedentes ginecológicos, imagens de
fibróides, colheita de amostras do endométrio, para excluir a
possibilidade de carcinoma nas doentes com hemorragia
menstrual anormal).
• O diagnóstico de sarcoma uterino pode ser retardado ao
seguir uma abordagem não cirúrgica (como a UFE) para o
tratamento de fibróides. É importante prestar uma atenção
especial aos sinais de aviso de sarcoma (por ex., crescimento
rápido do tumor, pós-menopáusica com nova dilatação uterina,
achados em RMN) e realizar uma avaliação mais meticulosa de
tais doentes antesdarecomendação de uma UFE. O crescimento
recorrente ou continuado do tumor após a UFE deve ser visto
como um potencial sinal de aviso para a ocorrência de sarcoma,
devendo ser ponderada a realização de cirurgia.
Advertências quanto à utilização de microesferas pequenas
• Deve prestar-se particular atenção sempre que for
considerada a utilização de agentes embólicos cujo diâmetro
seja inferior ao da capacidade de resolução do equipamento de
imagiologia. A presença de anastomoses arteriovenosas,
ramificações de vasos sanguíneos que se afastem da área alvo
ou vasos emergentes não evidentes antes da embolização,
podem originar uma embolização mal direccionada e
complicações graves.
• Microesferas com tamanho inferior a 100 mícrones irão
geralmente migrar de forma distal para vasos responsáveis pela
alimentação a anastomóticos e, portanto, têm maior
probabilidade de terminar a circulação ao tecido distal. Um
maior potencial para lesões isquémicas resulta da utilização de
microesferas detamanhomais pequeno e deve ser dada atenção
à consequência desta lesão antes da embolização. As possíveis
consequências incluem tumefacção, necrose, paralisia, abcesso
e/ou síndrome pós-embolização mais acentuado.
• A tumefacção pós-embolização pode resultar em isquemia no
tecido adjacente à área alvo. Deve ter-se cuidado a fim de evitar
tecido não tolerante a isquemia e não definido como alvo, tal
como o tecido nervoso.
PRECAUÇÕES:
Todasas indicações
• Doentes com alergia conhecida ao meio de contraste podem
necessitar de corticosteróides antes da embolização.
• Podem ser necessárias avaliações ou precauções adicionais
no controlo dos cuidados peri-procedimentos nos doentes com
os seguintes estados:
- Diátese hemorrágica ou estado hipercoagulativo
- Doentes imunocomprometidas
• Não utilize se o frasco, a tampa de rosca ou a embalagem do
tabuleiro se encontrarem danificados.
• Para utilização numa única doente – Conteúdo fornecido
estéril – Nunca reutilize, reprocesse nem reesterilize o conteúdo
de um frasco que tenha sido aberto. A reutilização,
reprocessamento ou reesterilização podem comprometer a
integridade estrutural do dispositivo e/ou resultar na falha do
mesmo, o que, por sua vez, pode resultar em lesão, doença ou
morte do doente. A reutilização, reprocessamento ou
reesterilização podem também originar risco de contaminação
do dispositivo e/ou provocar infecção do doente ou infecção
cruzada, incluindo, entre outras, a transmissão de doença(s)
infecciosa(s) de um doente para outro. A contaminação do
dispositivo pode provocar lesão, doença ou morte do doente.
Todos os procedimentos devem ser efectuados de acordo com
uma técnica asséptica aceite.
• Seleccione o tamanho e a quantidade das Microesferas
Embosphere adequados para a patologia a ser tratada.
• A embolização com Microesferas Embosphere só deve ser
realizada por médicos que tenham recebido formação adequada
em termos de embolização de intervenção na região a ser
tratada.
Precauções específicas da UFE
• Existe uma possibilidade aumentada de retromigração de
microesferas Embosphere para vasos sanguíneos imprevistos,
à medida que o fluxo da artéria uterina diminui. A embolização
deve ser parada quando deixa de ser possível visualizar a
vasculatura que rodeia o fibróide, mas antes da estase
17
Page 18

completa na artéria uterina.
• A UFE só deve ser realizada por radiologistas de intervenção
que receberam formação adequada para o tratamento do
leiomioma uterino (fibróides).
• Os dados do estudo clínico sobre as Microesferas
Embosphere limitam-se a 6 meses de seguimento. As doentes
submetidas a UFE neste estudo continuarão a ser seguidas
anualmente, durante pelo menos três anos, e as informações
serão actualizadas conforme necessário para reflectirem
eventuais alterações no resultado a longo prazo após a UFE.
POSSÍVEIS COMPLICAÇÕES:
Todasas indicações
A embolização vascular é um procedimento de alto risco. Podem
ocorrer complicações em qualquer altura durante ou após o
procedimento e podem incluir as seguintes, sem limitação:
• Paralisia resultante de embolização não-direccionada ou
lesão isquémica por edema do tecido adjacente
• Refluxo ou passagem indesejados de Microesferas
Embosphere para artérias normais adjacentes à lesão-alvo ou
através da lesão para dentro de outras artérias ou leitos
arteriais, como a artéria carótida interna ou as circulações
pulmonar ou coronária
• Embolia pulmonar causada por shunting venoso arterial
• Isquemia numa localização indesejada, incluindo acidente
vascular isquémico, enfarte isquémico (incluindo enfarte do
miocárdio) e necrose tecidular
• Oclusão do leito capilar e lesão tecidular
• Ruptura e hemorragia de vaso ou lesão
• Vasoespasmo
• Recanalização
• Reacções a corpo estranho que implicam intervenção
médica
• Infecção que implica intervenção médica
• Complicações relacionadas com a cateterização (por ex.,
hematoma no local de entrada, formação de coágulo na ponta
do cateter e subsequente deslocação e lesões nervosas e/ou
circulatórias, que podem resultar em ferimento na perna)
• Reacção alérgica a medicações (por ex., analgésicos)
• Reacção alérgica a meios de contraste ou material embólico
• Dor e/ou exantema cutâneo, possivelmente retardadosdesde
o momento da embolização
• Morte
• Cegueira, perda de audição, perda de olfacto e/ou paralisia
• Pode consultar informações adicionais na secção
Advertências
Potenciais complicações específicas da UFE
• As complicações pós-procedimento previstas com mais
frequência incluem dor abdominal, desconforto, febre e/ou
náuseas, colectivamente designadas de “síndrome pósembolização”. Algumas doentes podem também sofrer de
obstipação. Regra geral, esta reacção é tratada com
medicamentos sujeitos a receita médica ou de venda livre.
• Falha ovárica prematura (ou seja, menopausa)
• Amenorreia
• Infecção na região pélvica
• Necrose uterina/ovárica
• Flebite
• Trombose venosa profunda com ou sem embolia pulmonar
• Corrimento vaginal
• Passagem tecidular, libertação do fibróide ou expulsão do
fibróide pós-UFE
• Intervenção pós-UFE para remoção de tecido fibróide
necrótico
• Reacção vagal
• Episódio hipertensor transitório
• Histerectomia
• À data de Novembro de 2002, ocorreram quatro mortes
conhecidas em cerca de 25.000 a 30.000 mulheres tratadas
com a UFE no mundo inteiro, para uma taxa de mortalidade de
0,01% a 0,02%.
Potenciais comp licações es pecíficas d o procedimento
neurológico
• Acidente vascular isquémico ou enfarte isquémico
• Défices neurológicos, incluindo paralisias do nervo craniano
CONSERVAÇÃO E ESTERILIDADE:
• As Microesferas Embosphere devem ser conservadas num
local fresco, seco e escuro no respectivo frasco e embalagem
originais.
• A utilizar até à data indicada no rótulo do frasco.
• Não congele.
• Não reesterilizar.
INSTRUÇÕES DE UTILIZAÇÃO:
Inspeccione a embalagem antes da utilização para garantir a
integridade da selagem e, deste modo, garantir a
manutenção da esterilidade.
• Avalie cuidadosament e a rede vascular associada à lesão,
utili zando exames imagioló gicos de alta resolução antes do
iníci o do procedimento de embolização.
• As Mic roesferas Embosphere estão disponíveis numa
diver sidade de tamanhos. Devido ao potencial de falha da
embol ização e à inerente variabilidade dos tamanhos das
esfer as, o médico deve ter a certeza de que selecciona
cuida dosamente o tama nho das Microesferas Embosphere
de acordo com o tamanho dos vasos visados, no nível
desej ado de oclusão na vasculatura.
• Ao efectuar a emboli zação de malf ormações
art eriov enosas (MAV ), escolha um tamanho de
Micro esferas Embosphere que ocluda o núcleo sem passar
pelas MAV.
• Ao efectuar a embolização de fibróides uterinos, escolha
um tam anho de Mi croesfera s E mbosphere ig ual ou
super ior a 500 mícrones.
• Escolha um cateter de adminis tração b aseado n o
taman ho do vaso-alvo e no tamanho da microesfera a ser
utili zada. As Microesferas Embosphere podem tolerar uma
com pressão tempo rária de até 33% para facili tar a
passa gem através do cateter de administração.
• Introduza o cateter d e administração no vaso-alvo de
acord o com as técnicas padrão. Posi cione a pon ta do
catet er o mais próxi mo possível do local do tratamento de
modo a ev itar a oclusão acidental dos vasos normais .
• As Microesferas Em bosphere não sã o radiop acas.
Rec omenda-se que a emboliza ção seja mo nitorizad a
uti lizando visuali zação fluoroscó pica por ad ição d a
qua ntidade adequa da do mei o de cont raste ao soro
fisio lógico em suspensão.
• Para administrar Microe sferas Embosphere:
Depoi s de agitar cuidadosamente o frasco que contém as
Mic roesferas Embo sphere, dilua as Micr oesferas
18
Page 19

Embos phere com o meio de contraste para um pequeno
recip iente estéril ou directamente para uma seringa grande
de mistura. Recomenda-se a utilizaç ão de contraste a 50%
e de soro fi siológico a 50% para obter a melhor suspensão.
Para gara ntir uma suspensão adequada, agite suavemente
a mistura de Microesferas Embosphere e contraste e
aguar de entre 2 a 3 minutos após a mistura, antes da
inj ecção. E xtraia a solução de Mic roesferas
Embos phere/contraste para uma seringa de injecção de 1
ml ou 3 ml e fixe a seringa ao cateter de administração.
Injec te a solução de Microesferas Emb osphere/contraste
no cat eter de ad ministraç ão, sob visualizaçã o
flu oroscópica, utilizando uma injecção puls átil lent a,
enqua nto observa o débito do contraste. Caso não observe
qua lquer efeito no débito, repita o proces so de
admin istração com injecções adicionais de solução de
Microesferas Embosphere/contraste. Considere utilizar
Microesferas Embosphere de t amanho superior se as
injec ções iniciais não alterarem o débito do contraste. Seja
ponderado e cauteloso ao determinar o objectiv o da
embol ização.
• Um punção femoral pode resultar num esp asmo arterial.
Isto pode predispor para a oco rrência de trombose femoral
(por ex ., lesão na perna). A permeabilidade femoral deve
ser reavaliada antes da remoção final do cateter.
• No final do tratamento, remov a o ca teter enquant o
manté m uma aspiração ligeira de modo a não de slocar as
Micro esferas Embosphere ain da presentes no lúmen do
catet er.
• Exer ça pressão no local da punção até a hemóstase estar
terminada.
• Desc arte quaisquer Microesferas Embosphere abertas e
não utilizadas.
Instruções adicionais específicas da UFE:
• De acordo c om o critério do médi co, podem ser
utili zados dispositivos de compressão pneumática para as
doent es medicadas com terapia hormonal, com um volume
uteri no > 1000 ml ou com excesso de peso, de modo a
dimin uir o risco de trombose venosa profunda.
• A embolização deve ser parada quando de ixa de ser
possí vel visualizar a vasculatura que rodeia o fibróide, mas
antes da estase completa na artér ia uterina. Existe uma
possi bilidade aumentada de retromigração de Microesferas
Embos phere para vasos sanguíneos imprevistos, à medida
que o flu xo da artéria uterina diminui.
INFORMAÇÕES DE ACONSELHAMENTO PARA DOENTES
SUBMETIDAS A UFE:
• As doente s devem saber clar amente ante s da
emb olização quem irá for necer os cuidados pós pro cedimento e q uem devem con tactar em cas o de
emerg ência pós-embolização. As brochuras de informação
das doentes estão disponíveis e são distribuídas pela
BioSp here Medical, Inc.
• As candidatas a UFE devem compreender os potenciais
benef ícios, r iscos e eventos adversos associados à UFE.
Mais especifica mente, as doentes devem estar cientes de
que existe a hipótese de que os sintomas relacionados com
o fibróide não melhore m após a realização da UFE.
RESUMO DO ESTUDO CLÍNICO DA UFE:
Concepção do estudo
Foi realizado um ensaio prospectivo multicêntrico para
estud ar a UFE utilizando Microesferas Embosphere para o
tratamento de fibróides uterinos sintomáticos. Um total de
132 mulheres que desejava manter o útero e evitar a
cirur gia foram tratadas por UFE no estudo: 30 num estudo
de praticabilidade inicial e 102 no estudo essencial. Um
grupo concomitante e não-aleatorizado de 50 doentes
subm etidas a histerectomia foi também incluí do para
compa ração de segurança com o grupo UFE. Onze centros
de investigação participaram no estudo: sete rea lizaram
UFE e sei s realizaram histerectomias.
O e studo foi concebido para dete rminar se a UFE com
Micro esferas Embosphere reduzia os sintomas associados
aos fibróides sintomático s, tais como hemorragia anormal,
dor, desconforto e problemas urinários .
Os critérios principais de avaliação do estudo incluíram:
• Redu ção da hemorragia menstrual desde o nível ini cial
até 6 meses pós-UFE, conforme medida com a ferramenta
PBLAC (Pictorial Bleeding Assessment Chart – Diag rama
Pictó rico de Avaliação da Hemorragia)
• Melh oria do s sintomas relacionados com volume (dor
pélvi ca, desconforto pélvico/inchaço e disfunção urinária ),
confo rme medida utilizando um questionário de sintomas
da doente
• Melhori a d a q ualidade de vida, conforme me dida
utili zando o Questionário do Estado de Saúde SF-12
Os critérios secundários de avaliação incluíram:
• Outras med idas de alterações na hemorragia menstrual
• Redu ção do tamanho do útero e do fibróide
• Dura ção do internamento
• Tempo até ao regresso às actividades normais
• Avaliações da satisfação da doente com o proc edimento
Os eventos adversos e as compli cações foram também
avali ados em termos de tipo, nível e gravidade.
Os cr itérios de el egibilida de incluíra m idades
comp reendidas entre os 30 e os 50 an os de idade ,
inclu sive, infertilidade ou sem planos para engrav idar, um
ou mais fibróides uterinos sintomáticos, volume uterino
≥
250 ml ou volume fibróide≥4 ml e PBLAC inicial≥150.
As mulheres foram excluídas do estudo se existia suspeita
de que e stavam grávidas, tinham um historial d e doença
infla matória pélvica, fibróide(s) submucosal(ais) com mais
de 50% d e crescimento para dentro da cavidade uterina,
fibróide(s) seroso(s) peduncula do(s) como fibróide(s)
domin ante(s), suprimento sanguíneo co lateral signi ficativo
por outros vasos que n ão a artéria uterina, adenomiose
enqua nto causa dominante dos sintomas, hiperplasia do
endom étrio ou pré-maligna, qualquer tumor maligno da
regiã o pélvica, qualquer infecção activa da região pélvic a,
aler gia conhecida a contraste IV ou gelatin a, diátese
hemo rrágica, do entes imuno compro metidas, FS H pósmenop áusica ou inicial > 40 mUI/ml ou tratamento com
agoni sta GnRH nos 3 meses anteriores.
As avaliações pré-tratamento incl uíram exames e testes
ginecológicos de rotina, análises labora toriais padrão,
ecogr afia ou RMN, registo da hemorragia menstrual (grupo
UFE) e questionários de auto-avaliação relacionados com a
saúde global (SF-12), hemorragia menstrual e sintomas de
19
Page 20

fibró ides. As doentes foram avaliadas às 1-3 semanas, 3
meses , 6 meses e 12 meses. As pontuações PBLAC foram
obtid as aos 3 e 6 meses.
Tabela 1 - Dados demográficos das doentes
UFE
30-50
1 (1%)
67 (59%)
7 (6%)
35 (31%)
3 (3%)
131-186
46-123
8 (8%)
1 (1%)
93 (91%)
0 (0%)
53 (52%)
9 (9%)
25 (25%)
9 (9%)
20 (20%)
17 (17%)
13 (13%)
9 (9%)
28 (25%)
37 (33%)
48 (42%)
0 (0%)
5.1-776.8
69 (61%)
20 (18%)
18 (16%)
11 (10%)
2 (2%)
Histerectomia
41.6 (5.3)
31-50
2 (4%)
9 (18%)
8 (16%)
31 (62%)
0 (0%)
161.8 (10.1)
132-178
75.1 (21.5)
50-146
14 (28%)
2 (4%)
33 (66%)
1 (2%)
35 (70%)
2 (4%)
5 (10%)
5 (10%)
4 (8%)
1 (2%)
2 (4%)
3 (6%)
20 (40%)
19 (38%)
10 (20%)
1 (2%)
389.2 (521.2)
91.8-3415.1
90.6 (354.8)
3.2-2322.3
32 (64%)
8 (16%)
13 (26%)
1 (2%)
4 (8%)
DADE EM ANOS
I
Média (DP)
Intervalo
ORIGEM ÉTNICA
Asiática/Ilhas do Pacífico
Afro-americana
Hispânica
Caucasiana
Outra
ALTURA (cm)
Média (DP)
Intervalo
PESO (kg)
Média (DP)
Intervalo
ESTADO MENSTRUAL
Frequente
Infrequente
Regular
Desconhecido
ANTES DO TRATAMENTO
DOS FIBRÓIDES
Nenhum
Agonista GnRH
Contraceptivo oral
Outro hormonal
Miomectomia
Raspagem
Histeroscopia
Outro invasivo
NÚMERO DE FIBRÓIDES
1
2
≥
3
sem resposta
VOLUMEUTERINO(ml)*
Média (DP)
Intervalo
VOLUME FIBRÓIDE
DOMINANTE (ml)
Média (DP)
Intervalo
TIPO DE FIBRÓIDE
Intramural
Subseroso
Submucosal
Transmural
Pedunculado
Mais de um tipo
indicado para algumas
doentes
42.4 (4.2)
159.9 (10.5)
72.7 (16.2)
692.4 (462.8)
185.6-3076.3
147.4 (154.3)
*Oitenta e quatro por cento das doentes submetidas a UFE e
98% das doentes submetidas a histerectomia apresentaram
volumes uterinos iniciais de 1000 ml ou menos.
Resultados do estudo
Os resultado s do estudo são apresentados de segu ida
para 107 doen tes consideradas com o fazendo p arte da
coorte do estudo UFE de Fase II, co nstit uída por 11
doentes UFE de F ase I q ue sat isfiz eram os critérios de
elegibilidade de Fase II e 9 6 doen tes UF E avaliáveis de
Fase II.
Info rmações relativas ao procedi mento, à alta e à
recuperação
Todos os procedimentos UFE foram t ecnic ament e bem
sucedi dos, sem q uai sque r c omplica ções intra operat órias que p revenir am a final ização do
procedimento. A maioria (77%) dos procedimentos UFE
foi re aliza da utilizando um catete r 5 Fr e, nos rest antes ,
um cateter 4 Fr (19% ) ou 3 Fr (3% ). Setenta e duas
doe ntes for am t ratadas com esfe ras de 5 00 a 700
mícrones, 66 doente s com esfe ras de 700 a 900 mícr ones
e 18 d oente s com esferas de 9 00 a 1200 mícr ones.
Muitas das doent es foram trat adas com mais de um
tamanho de es fera. A ab ordag em ma is frequente ao
tratamento con sisti u em c omeça r com um t amanh o de
esf era mais pe quen o e, se nec essá rio, aumentar o
tamanho de segu ida. O v olume das esferas neces sária s
variou inver samente com o tamanho da esfera: utilizaouse uma média d e esf eras de 7,2 ml de 500 a 70 0
mícrones, em compa ração com as esferas de 6 ml de 700
a 900 mícrones e com as esferas de 4,1 ml de 900 a 1200
mícrones.
A ma ioria da s doe ntes UFE foi submet ida a o
proced imento sob sed ação conscie nte, com u m
anesté sico local ad ministr ado no local da pun ção.
Nenhum p roced imento UFE fo i realizado sob ane stesi a
geral. O tempo méd io do pr ocedi mento UFE desde a
primeira punção ar terial até à remoção final do cate ter foi
de 58 ± 28 minuto s (intervalo de 10 a 140 minutos). Em
comparação, todas as ciru rgias com his terec tomia for am
realizadas sob a neste sia geral, independentemente d o
tipo de hi stere ctomi a realiz ada, ten do o tempo médio da
cirurgia desde a incisão da pele até à sutura da pele sido
de 93 ± 38 minutos (intervalo de 35 171 minutos) (p <
0,001). A maioria dos procedimentos de histerecto mia foi
realizada a nível ab domin al (76%).
Oitenta e sete por ce nto das doentes submetidas a UFE
recebe ram a lta h ospital ar no dia s eguinte ao do
procedimento de embolização e 12 % no próprio d ia do
procedimento. As do entes s ubmet idas a hi stere ctomi a
passaram sign ifica tivam ente mais tempo no hos pital (p <
0,001), co m u m internamento méd io de 2, 3 dias e m
comparação com 0,9 dia s para as doentes submetidas a
UFE. As doentes submetida s a UFE regressar am ao
trabalho dec orridos, em m édia, cerca de 10,7 di as;
contudo, foram necessários, em médi a, cerca de 30,7
dias par a as doe ntes submetidas a histerectomia (p <
0,001). Do mesmo mod o, as doe ntes submetidas a UFE
regres saram à s a ctivida des diá ria s norma is a uma
veloci dade três vezes maior do que a s do entes
histerectomizadas (média de 10,9 dias p ara UFE versu s
20
Page 21

37,4 dias para histe rectomia, p < 0,001).
Critérios primários de avaliação da eficácia
Hemorragia menstrual
Para serem el egíve is pa ra a UFE neste estudo, as doentes
tinham de apr ese ntar um a hemor ragia m enstrua l
anormalmente in tensa , c om uma p ontua ção inicial d e
≥ 150 n a fer ramenta P BLAC (Pictor ial B leed ing
Assessment Chart ) de Janssen et al. (1995) . O êxito foi
definido c omo uma reduç ão de ≥ 50% d a classificação
PBLAC na avaliação de seguim ento aos 6 meses. Fo ram
igualmente empregues medidas adicionais para ava liar as
alterações em termo s de hemorragia menstrual, incluindo
auto-avaliação pela doe nte d o nível hemorrágico e u m
questionário sobre a meno rragi a.
Regra ge ral, a s alteraç ões a ní vel da h emo rrag ia
menstrual oc orrer am rapidamente ap ós a UFE, com 92%
das d oente s a mostrarem algum a melhoria ao fim de 3
mes es. A Tab ela 2 ap resenta as t axas de êxit o da
hemorragia menstrual ao s 6 mese s na pop ulaçã o com
intenção de tra tar. Os dad os na Tabel a 2 refl ectem as
PBLAC preenchidas de 9 0 das 107 doentes de Fase II
submet idas a UF E (84% ). Sei s doen tes (6 %) não
preencheram uma PBLAC a os 6 mes es porque for am
perdidas no seguimento (n = 4) ou fora m subme tidas a
uma histerectomia (n = 2) antes d este per íodo de
avalia ção. As onze d oentes r estante s (10 %) sem
pontuações PBL AC ao s 6 meses t inham info rmaçõ es
sufici entes d erivada s das o utra s avali ações d a
hemorragia men strua l para determinar o n ível de êxito
neste critério de avaliação.
Tabe la 2 - Ef icácia: taxas de êxi to da hemo rra gia
menstrual na população co m in tençã o de tra tar
% deredução desde o nível inicial
≥ 50%
30-49%
0-29%
< 0%
Perda no seguimento
Histerectomia antes dos 6 meses
Sintomas relacionados com volume
Foi utilizado um questionário dos sintomas específicos dos
fibróides para avaliar as alterações em três sintomas
relacionados com o fibróide: dor pélvica, desconforto
pélvico e disfunção urinária. O êxito foi definido como uma
melhoria moderada ou significativa para doentes que
entraram no estudo com sintomas moderados ou graves
e/ou sem agravamento para doentes que entraram no
estudo sem sintomas oucom sintomas ligeiros. Noventa e
quatro das 107 doentes (88%) preencheram o questionário
relativo aos sintomas relacionados com o volume aos 6
meses após o tratamento. Todas as 13 doentes com dados
de sintomas em falta aos 6 meses, por qualquer motivo,
foram contadas como falhas. A Tabela 3 demonstra que a
6 meses
N/107 (%)
69 (65%)
15 (14%)
7 (7%)
10 (9%)
4 (4%)
2 (2%)
maioria das doentes submetidas a UFE satisfez os critérios
do estudo para êxito em todos os três sintomas
relacionados com volume. Este êxito foi, de um modo
geral, alcançado aos 3 meses. Oitenta e quatro por cento
das mulheres satisfizeram o critério de êxito para pelo
menos um sintoma relacionado com volume aos 6 meses.
Tabela 3 - Eficácia: taxas de êxito dos sintomas
relacionados com volume na população com intenção de
tratar
Sintomas
Dor pélvica
Desconforto pélvico
Disfunção urinária
Qualidade de vida
O questionário do Estado de Saúde SF-12 foi empregue
para avaliar alterações a nível do estado de saúde físico e
mental geral após otratamento. O objectivo deste critério
de avaliação consistia em demonstrar pelo menos uma
melhoria moderada da qualidade de vida global na
avaliação aos 6 meses. As pontuações médias prétratamento para o grupo UFE corresponderam a 44,4 ±
8,5 e 45,1 ± 11,9 para os componentes físicos ementais,
respectivamente, colocando este grupo num nível
ligeiramente melhor do que o percentil 25 (44,32) das
pontuações normalizadas publicadas para a população
norte-americana de indivíduos do sexo feminino em
geral. Aos 6 meses, as pontuações médias para os
questionários, tanto físicos como mentais, aumentaram
significativamente para 52,2 ± 6,7 e 52,4 ± 8,8,
respectivamente, colocando o grupo UFE no percentil 50
(52,76) de pontuações SF-12 normalizadas (p < 0,001
para ambas as medidas).
Critérios secundários de avaliação da eficácia
Volume fibróidee uterino
As doentes submetidas a UFE realizaram exames
imagiológicos uterinos por RMN ou ecografia no nível
inicial e seguimento. Os volumes uterino e fibróide foram
calculados utilizando a fórmula para o volume de uma
elipse prolata (C x L x P x 0,52). Registaram-se
diminuições significativas tanto do volume uterino
(medido com a inclusão do colo do útero) como do
volume do fibróide uterino para o grupo UFE na avaliação
aos 3 meses, com melhorias adicionais observadas aos 6
meses (p < 0,001 em ambos os períodos de tempo em
comparação com o nível inicial). A Tabela 4 resume as
alterações percentuais observadas nos volumes uterino e
fibróide aos 6 meses após o tratamento.Estatabela inclui
dados do volume uterino de 91 das 108 doentes de Fase
II submetidas a UFE (84%) e dados do volumefibróide de
83 destas doentes (77%) que possuíam relatórios
imagiológicos completos e avaliáveis no nível inicial e
aos 3 e 6 meses após o tratamento de UFE. Foram
notificados aumentos dos volumes uterinos para 11
doentes (12%) e aumentos dos volumes fibróides para 8
doentes (8%) na avaliação dos 6 meses.
6 meses
N/107 (%)
83 (78%)
80 (75%)
75 (71%)
21
Page 22

Tabela 4 - Alteração percentual dos volumes uterino e
Tempodo evento
D
escrição do evento
N.º
de
qu
eix
asd
o
doente
*
N.º
de
ev
ent
os
Proce
dim
ent
o
No
hospi
tal
<1
mês
1-3
me
ses
3-6
mes
es
>6
m
eses
Histerectomia após UFE 4 4 2 2
Reacção alérgica/exantema cutâneo 8 8 2 3 3
Passagem ou remoção de fibróide/tecido 56 23 1
Eventos adversos relacionados com!ador
4 4 3 1
Lesão relacionada com o local do
cateter/punção
6 7 1 2 4
I
nfecção do aparelhourinário/cistite 3 4 1 1 1 1
Infecção vaginal/vaginite 5 7 2 1 2 2
I
rritação/ardor/corrimentovaginal22 11
Outro994 1211
Total 51 7 5 17 11 4 7
ibróide desde o nível inicial
f
% diminuição aos
VOLUME UTERINO (ml)
N
Média (DP)
Intervalo
Volume fibróide
N
Média (DP)
Intervalo
Uma alteração percentual positiva indica uma diminuição
do volume, ao passo que uma alteração percentual negativa
indica um aumento do volume.
Satisfação da doente
Ambos os grupos do estudo mostraram um elevado nível
de satisfação com o resultado dos procedimentos aos 3 e
aos 6 meses. Noventa e duas das 100 doentes submetidas
a UFE (92%) e 46 das 47 doentes histerectomizadas (98%)
que preencheram o questionário de satisfação da doente
aos 6 meses mostraram-se ligeiramente, moderadamente
ou muito satisfeitas com o resultado do seu procedimento,
com a maioria em ambos os grupos muito satisfeita.
EVENTOS ADVERSOS:
Os dados dos eventos adversos são reportados para todos
os 132 doentes tratados por UFE nas Fases I e II. Neste
estudo, não foram no tificados efeito s adversos do
dispositivo não-previstos nem eventos adversos nãoprevisos. A Tabela 5 apresenta cinquenta e um eventos
adversos co nsiderados co mo estando provável ou
possivelmente associados ao procedimento, que ocorreram
em 37 das 132 doentes submetidas a UFE (28%). Sete dos
51 eventos (14%) ocorreram durante o procedimento UFE,
cinco (10%) entre o procedimento e a alta hospitalar, 17
(33%) desde a alta hospitalar até 1 mês pós-procedimento,
11 (22%) de 1 a 3 meses pós-procedimento, 4 (8%) de 3 a
6 meses pós-procedimento e 7 (14%) superior a 6 meses
pós-procedimento. O evento adverso mais frequente foi
uma reacção alérgica ou um exantema cutâneo, que
ocorreu em 8 das 132 doentes (6%), e que foram
geralmente considerados pelo médico responsável pelo
tratamento como estando relacionados com os fármacos
ou o agente de contraste utilizados durante o
procedimento. Todas as reacções desapareceram
espontaneamente ou com o tratamento. Quatro doentes
foram submetidas a uma histerectomia pós-UFE, para uma
taxa global de histerectomia de 3%. Uma histerectomia foi
realizada aos 2 meses pós-UFE devido a febre
sustentada/infecção possível. As três outras foram
histerectomias electivas devido à insatisfação com o
resultado da UFE, tendo sido realizadas aos 2, 10, e 11
meses pós-UFE. Uma doente (< 1%) foi submetida a uma
UFE de repetição depois de as artérias uterinas terem sido
consideradas patentes.
6 meses
33.2% (30.5%)
-93.6% a 82.0%
50.9% (41.7%)
-173.4% a 99.7%
Tabela 5 - Tempo e tipo de eventos adversos provável ou
ossivelmente relacionados com a UFE
p
91
83
*Um total de 34 em 132 doentes (26%) sofreu um ou mais
eventos adversos neste estudo. O número de doentes nesta
coluna reflecte o facto de algumas doentes terem sofrido
mais de um evento adverso.
BIBLIOGRAFIA:
Específicas da UFE
1. Spies J et al., Initial experience with use of tris-acryl gelatin
microspheres for uterine artery embolization for
leiomyomata, J Vasc Interv Radiol, 12:1059-1063, 2001.
2. Spies J et al., Complications after uterine artery
embolization for leiomyomas. Obstet Gynecol, 100:873-80,
2002.
3. Goldberg J, Pereira L, and Berghella V: Pregnancy After
Uterine Artery Embolization. Obstet Gynecol, 100(5):869-872,
2002.
4. Scialli A: Alternatives to hysterectomy for benign
conditions. Int J Fert & Women's Med, 43(4):186-91, 1998.
5. Nikolic B, Spies JB, Campbell L, et al.: Uterine artery
embolization: reduced radiation with refined technique. J asc
Interv Radiol, 12(1):39-44, Jan 2001.
6. Worthington-Kirsch R, G Popky, F Hutchins: Uterinearterial
embolization for the management of leiomyomas: Quality-oflife assessment and clinical response. Radiol, 208: 625-629,
1998.
7. Pelage JP, Le Dref O, Soyer P, et al.: Fibroid-related
menorrhagia: Treatment with superselective embolization of
the uterine arteries and mid-term follow-up. Radiology,
215(2):428-431. May 2000.
Todasas indicações
1. Bendszus M, Klein R, Burger R, et al.: Efficacy of trisacryl
gelatin microspheres versus polyvinyl alcohol particles in the
preoperative embolization of meningiomas. AJNR, 21(2):
255-61, Feb 2000.
2. Deveikis JP: Endovascular therapy of intracranial
arteriovenous malformations: materials and techniques.
Neuroimaging Clin of N Am, 8(2):401-424, 1998.
3. Frizzel RT, Fisher WS: Cure, morbidity, and mortality
associated with embolization of brain arteriovenous
malformations: A review of 1246 patients in 32 series over a
35-year period. Neurosurg, 37(6):1031-1040, Dec 1995.
4. Gomes, A: Embolization therapy of congenital
arteriovenous malformations: Use of alternative approaches.
Radiology, 190:191-8, Jan 1994.
5. Terada, T; Kinoshita, Y; Yokote, H; Tsuura, M; Itakura, T;
22
Page 23

Komai, N; Nakamura, Y; Tanaka, S; Kuriyama, T: Preoperative
S
TERILIZE
2
2
STERILE
mbolization of meningiomas fed by ophthalmic branch
e
arteries. Surg Neurol, 45:161-6, 1996.
nformação na embalagem:
I
Símbolo Designação
Fabricante: nome e morada
Prazo de validade: ano-mês
LOT
Código do lote
REF
Número de catálogo
Não reesterilizar
Não utilizar sea embalagem estiver danificada
Manter afastado da luz solar
Manter seco
Não reutilizar
Atenção – Consultar as Instruções de
utilização
Apirogénico
Esterilizado utilizando vapor
Limite de temperatura inferior
0°C
Distribuído nos EUA por:
Merit Medical Systems, Inc.
Serviço de apoio ao cliente 1-800-356-3748
Informações sobrea patente
US 5,635,215 e outra(s) patente(s) emitida(s) e pendente(s).
Microesferas Embosphere é uma marca comercial registada
da BioSphere Medical.
781-681-7900
23
Page 24

ESPAÑOL
AVISO:
restringen el uso de este dispositivo a médicos o por
rescripción facultativa.
p
USO PREVISTO:
Las Microesferas Embosphere están indicadas para su uso en
embolización de malformaciones arteriovenosas, tumores
hipervasculares y miomas uterinos sintomáticos.
APLICACIONES CLÍNICAS PARA MIOMAS UTERINOS:
La embolización del mioma uterino (EMU) es un tratamiento
alternativo para mujeres que necesitan tratamiento para aliviar
los síntomas atribuidos a miomas uterinos que incluyen
sangrado menstrual abundante, dolor o presión pélvica y/o
disfunción urinaria.
DESCRIPCIÓN DEL DISPOSITIVO:
Las Microesferas Embosphere forman parte de la gama de
materiales embólicos basados en la tecnología de microesferas
patentada de BioSphere Medical. Estas esferas se han
diseñado para ofrecer una embolización controlada y dirigida.
Las Microesferas Embosphere son microesferas
biocompatibles, hidrofílicas y no reabsorbibles producidas a
partir de polímero acrílico e impregnadas con gelatina porcina.
Las Microesferas Embosphere están disponibles en una amplia
gama de tamaños de esferas calibradas.
ENVASE DEL DISPOSITIVO:
• Las Microesferas Embosphere están incluidas en un frasco
de vidrio de 5,0 ml, estéril, con un tapón con rosca, envasado
en una bandeja despegable, disponibles en 5 frascos por
paquete.
• Cada frasco contiene 1,0 ml o bien 2,0 ml de Microesferas
Embosphere en solución salina fisiológica, estéril libre de
pirógenos. El volumen total de solución salina y microesferas
es de 5 ml.
____________________________________________________
Las siguientes contraindicaciones, advertencias, precauciones
e instrucciones de uso se han organizado para presentar la
información aplicable a todas las indicaciones (esto es,
tumores hipervasculares, malformaciones arteriovenosas y
miomas uterinos) primero, seguida de información específica
de la indicación (esto es, EMU y neurológico).
CONTRAINDICACIONES:
Todaslas indicaciones
• Pacientes con intolerancia a los procedimientos de oclusión
• La anatomía vascular o flujo sanguíneo que descarta la
colocación de catéter o inyección de agente embólico
• Presencia o probabilidad de aparición de vasoespasmo
• Presencia o probabilidad de aparición de hemorragia
• Presencia de enfermedad ateromatosa grave
• Presencia de arterias nutricias menores que las ramas
distales de donde salen
• Presencia de arterias que irrigan la lesión que no son
suficientemente grandes para alojar las Microesferas
Embosphere
• Presencia de vías vasculares colaterales que potencialmente
Microesferas Embosphere®en un frasco estéril - Para embolización
Las leyes federales estadounidenses
onen en peligro áreas normales durante la embolización
p
• Resistencia vascular periférica a las arterias nutricias que
impide el paso de las Microesferas Embosphere a la lesión
En fístulas arteriovenosas degran tamaño (esto es, donde la
•
sangre no pasa por una unión arterial/capilar/venosa sino
directamente de una arteria a una vena)
• En la vasculatura pulmonar
Contraindicaciones específicas de EMU
• Mujeres embarazadas
• Sospecha de enfermedad inflamatoria pélvica o cualquier
otra infección pélvica activa
• Cualquier tumor en la región pélvica
• Neoplasia endometrial o hiperplasia
• Presencia de uno o másmioma/s submucoso/s con más del
50% de crecimiento en la cavidad uterina
• Presencia de mioma seroso pediculado como mioma/s
dominante/s
• Miomas con nutrición colateral significativa por vasos
distintos de las arterias uterinas
Contraindicaciones específicas neurológicas
• Presencia de anastomosis extra a intracraneal o fístulas
evidentes
• Presencia de arterias terminales que conducen directamente
a los nervios craneales
• En cualquier vasculatura donde las Microesferas
Embosphere podrían pasar directamente a la arteria carótida
interna, arteria vertebral, vasculatura intracraneal o los vasos
enumerados arriba
ADVERTENCIAS:
Todaslas indicaciones
• Las Microesferas Embosphere contienen gelatina de origen
porcino y, por lo tanto, podrían provocar una reacción
inmunitaria en pacientes con hipersensibilidad al colágeno o la
gelatina. Debe considerarse previa y detenidamente el uso de
este producto en pacientes que se sospeche que son alérgicos
a inyecciones que contienen estabilizantes de gelatina.
• Estudios realizados han mostrado que las Microesferas
Embosphere no forman agregados y, por consiguiente,
penetran más profundamente en la vasculatura en comparación
con partículas de alcohol polivinílico (PVA) de tamaño parecido.
Debe tenerse cuidado para elegir Microesferas Embosphere de
mayor tamaño al embolizar malformaciones arteriovenosas con
fístulas grandes para evitar el paso de las esferas a la
circulación pulmonar o coronaria.
• Algunas de las Microesferas Embosphere podrían estar
ligeramente fuera del rango. Por consiguiente, tras considerar
la apariencia angiográfica arteriovenosa, el médico debe
asegurarse de seleccionar cuidadosamente el tamaño de las
Microesferas Embosphere de acuerdo con el tamaño de los
vasos diana y el nivel deoclusión deseado en la vasculatura. El
tamaño de las Microesferas Embosphere debeseleccionarse de
modo que se impida el paso de la arteria a la vena.
• Debido a las importantes complicaciones de una
embolización, se debe proceder con sumo cuidado en los
procedimientos que implican circulación extracraneal que
abarca la cabeza y el cuello, y el médico debe sopesar
detenidamente los beneficios potenciales de aplicar
24
Page 25

embolización frente a losriesgos y las posibles complicaciones
del procedimiento. Estas complicaciones pueden incluir
eguera, pérdida auditiva, pérdida delolfato, parálisis y muerte.
c
• El paciente puede sufrir una lesión cutánea grave inducida
por la radiación como consecuencia de largos períodos de
xposición radioscópica, por tratarse de unpacienteobeso, por
e
royecciones radiográficas en ángulo y por varias series de
p
registro de imágenes o radiografías. Consulte el protocolo
clínico de su centro para asegurar que se aplique la dosis de
radiación correcta a cada tipo específico de procedimiento
realizado. Los médicos deben monitorizar a los pacientes que
puedan correr riesgo.
• La lesión inducida por radiación en el paciente podría ser de
aparición diferida. Debe advertirse a los pacientes de los
posibles efectos secundarios de la radiación e indicarles a
quién deben contactar si presentan síntomas.
• Preste mucha atención a los signos de una embolización de
regiones no diana. Durante la inyección, monitorice
cuidadosamente las constantes vitales del paciente, incluido la
SAO2 (por ejemplo, hipoxia, cambios en el sistema nervioso
central). Si haysignos de embolización de regiones no diana o
si el paciente presenta síntomas, considere terminar el
procedimiento, investigar la presencia de posibles fístulas o
aumentar el tamaño de las microesferas.
• Si durante la inyección de las microesferas no aparecen
clara y rápidamente señales angiográficas de embolización,
considere aumentar el tamaño de las microesferas.
Advertencias específicas sobre la embolización de miomas
uterinos
Advertencias sobre la embolización de miomas uterinos y
embarazo
• No se han determinado los efectos de la embolización de
miomas uterinos sobre la capacidad para quedarse embarazada
y llevar el embarazo a término y sobre el desarrollo del feto.
Por tanto, este procedimiento sólo se debe realizar en mujeres
que no pretenden quedarse embarazadas en el futuro.
• Las mujeres que se quedan embarazadas tras la EMU
pueden tener un mayor riesgo de hemorragia posparto, parto
prematuro, cesárea y presentación fetal anómala.
• La desvascularización del miometrio uterino que resulta de
la EMU podría poner, en teoría, a las mujeres que se quedan
embarazadas tras el EMU en mayor riesgo de rotura uterina.
Otras advertencias de la EMU
• Cuando se usan las Microesferas Embosphere para la
embolización del mioma uterino, no utilizar microesferas
menores de 500 micras.
• Se debe realizar un examen ginecológico adecuado en todas
las pacientes que se presenten parala embolización de miomas
uterinos (p. ej. historia ginecológica, radiografía del mioma,
muestreo endometrial para descartar carcinoma en pacientes
con sangrado menstrual anómalo).
• El diagnóstico de sarcoma uterino podría retrasarse por la
adopción de un método no quirúrgico (tal como la EMU) para
tratar los miomas. Es importante prestar especial atenciónalos
signos de advertencia para el sarcoma (p. ej. crecimiento
rápido del tumor, postmenopausia con nuevo aumento de
tamaño uterino, hallazgos de RM) y realizar un examen aún
más exhaustivo para dichas pacientes antes de recomendar la
EMU. El crecimiento tumoral recurrente o continuado tras la
embolización del mioma uterino debe considerarse un posible
signo de advertencia de sarcoma y debe considerarse la cirugía.
Advertenciassobre el uso de pequeñas microesferas
• Siempre que se contemple el uso de medios embólicos de
n diámetro más pequeño que la capacidad de resolución del
u
equipo de imágenes, deberá considerarse detenidamente dicha
opción. La presencia de anastomosis arteriovenosas, vasos
amificados hacia fuera del área diana o vasos emergentes no
r
videntes antes de la embolización puede derivar en una
e
embolización de regiones no diana y complicaciones graves.
• Las microesferas de tamaño inferior a 100 micras
generalmente migran distalmente a las tributarias
anastomóticas y, por lo tanto, tienen más probabilidad de
interrumpir la circulación al tejido distal. Existe una mayor
probabilidad de lesión isquémica conel uso de microesferas de
tamaño más pequeño, y deben considerarse las consecuencias
de esta lesión antes de la embolización. Las posibles
consecuencias incluyen: hinchazón, necrosis, parálisis,
absceso y/o síndrome posembolización más intenso.
• La hinchazón posembolización podría provocar isquemia en
el tejido adyacente al área diana. Deben tomarse precauciones
para evitar el tejido no diana que no tolerelaisquemia, como es
el caso del tejido nervioso.
PRECAUCIONES:
Todaslas indicaciones
• Las pacientes con alergia conocida al medio de contraste
pueden necesitar corticoides antes de la embolización.
• Pueden ser necesarias evaluaciones u otras precauciones
adicionales en la gestión de la asistencia periprocedimiento
para pacientes con las siguientes afecciones:
- Diatesis hemorrágica o estado hipercoagulativo
- Inmunodepresión
• No utilice este producto, si el frasco, el tapón con rosca o la
bandeja del envase parecen estar dañados.
• Para uso en un solo paciente – Contenido suministrado
estéril – No reutilizar nunca, reprocesar ni reesterilizar los
contenidos de un frasco que ya se haya abierto. Su
reutilización, reprocesamiento o reesterilización podrían afectar
a la integridad estructural del dispositivo y/o provocar su fallo,
lo que a su vez podría ocasionar lesión, enfermedad ola muerte
del paciente. Su reutilización, reprocesamiento o
reesterilización podrían constituir también un riesgo de
contaminación del dispositivo o causar infección en el paciente
o infección cruzada, incluida, entre otras cosas, la transmisión
de enfermedad/es infecciosa/s de un paciente a otro. La
contaminación del dispositivo puede provocar lesión,
enfermedad o la muerte del paciente.Todos los procedimientos
deben realizarse de acuerdo con una técnica aséptica aceptada.
• Seleccione el tamaño y la cantidad de Microesferas
Embosphere apropiadas para la patología que se va a tratar.
• La embolización con Microesferas Embosphere sólo debe
ser realizada por médicos que hayan recibido la formación de
embolización intervencionista apropiada en la región en la que
se va a tratar.
Precaucionesespecíficas de la EMU
• Hay una mayor posibilidad de retromigración de las
microesferas Embosphere en vasos sanguíneos no diana ya
que se reduce el flujo de la arteria uterina. Se debe detener la
embolización cuando la vasculatura que rodea el mioma deje de
poder visualizarse, pero antes de la estasis completa en la
arteria uterina.
• La embolización de mioma uterino sólo debe ser realizada
25
Page 26

por radiólogos intervencionistas que hayan recibido la
formación adecuada para el tratamiento de leiomioma uterino.
Los datos del estudio clínico sobre las Microesferas
•
Embosphere se limitan a 6 meses de seguimiento. Las
pacientes de embolización de mioma uterino de este estudio
ontinuarán teniendo un seguimiento anual durante al menos
c
res años, y la información se actualizará según sea necesario
t
para reflejar cualquier cambio en el resultado a largo plazo del
seguimiento de la embolización de mioma uterino.
POSIBLES COMPLICACIONES:
Todaslas indicaciones
La embolización vascular es un procedimiento de alto riesgo.
Las complicaciones pueden producirse en cualquier momento,
durante o después, del procedimiento, y puede incluir, entre
otros, lo siguientes:
• Parálisis que resulta de una embolización no focalizada o
lesión isquémica de edema del tejido adyacente.
• El reflujo no deseado o paso de Microesferas Embosphere a
las arterias normales adyacentes a la lesión diana o por la
lesión en otras arterias o lechos arteriales, tal como la arteria
carótida interna, pulmonar o circulaciones coronarias.
• Embolismo pulmonar debido a fístula venosa arterial
• Isquemia en una ubicación no deseada, incluido el ictus
isquémico, infarto isquémico (incluido infarto de miocardio) y
necrosis tisular
• Oclusión de lecho capilar y daño tisular
• Rotura vascular o lesión y hemorragia
• Vasoespasmo
• Recanalización
• Reacciones a cuerpos extraños que requieren intervención
médica
• Infección que requiere intervención médica
• Complicaciones relacionadas con el cateterismo (p. ej.
hematoma en el punto de entrada, formación de coágulo en la
punta del catéter y posterior desplazamiento, y lesiones
nerviosas y/o circulatorias, que pueden tener como resultado
lesión de pierna)
• Reacción alérgica a los medicamentos (p. ej. analgésicos)
• Reacción alérgica a medio de contraste o material embólico
• Dolor y/o erupción cutánea, posiblemente demorada desde
el momento de la embolización
• Muerte
• Ceguera, pérdida auditiva, pérdida del olfatoy/o parálisis
• La información adicional se encuentra en la sección
Advertencias
Potenciales complicaciones específicas de EMU
• Las complicaciones anticipadas del posprocedimiento más
frecuentes son dolor abdominal, molestias, fiebre y/o náuseas,
conocidas en conjunto como el «síndrome posembolización».
Algunas pacientes también experimentan estreñimiento.
Generalmente se trata con medicamentos con o sin receta.
• Insuficiencia ovárica prematura (esto es, menopausia)
• Amenorrea
• Infección de la región pélvica
• Necrosis uterina/ovárica
• Flebitis
• Trombosis venosa profunda con o sin embolismo pulmonar
• Flujo vaginal
• Paso de tejido, desprendimiento o expulsión del mioma tras
la EMU
• Intervención posembolización del mioma uterino para
eliminar tejido necrótico del mioma
• Reacción vagal
Episodio hipertensivo transitorio
•
• Histerectomía
• Hasta noviembre de 2002, se habían producido cuatro
uertes conocidas en aproximadamente de 25.000 a 30.000
m
ujeres tratadas por EMU en todo el mundo, una tasa de
m
muerte del 0,01 al 0,02%.
Potenciales complicaciones específicas neurológicas
• Ictus isquémico o infarto isquémico
• Déficits neurológicos, incluidas parálisis de los nervios
craneales
ALMACENAMIENTO Y ESTERILIDAD:
• Las Microesferas Embosphere deben almacenarse en un
lugar fresco, seco y oscuro, en su frasco y envase originales.
• Utilizar antes de la fecha indicada en la etiqueta del frasco.
• No congelar.
• No reesterilizar.
INSTRUCCIONES DE USO:
Inspeccione el envase antes de su uso para garantizar la
integridad del precinto para el mantenimiento de la
esterilidad.
• Evalúe cuidadosamente la red vascular asociada con la
lesión usando imagen de alta resolución antes de iniciar el
procedimiento de embolización.
• Las Microesferas Embosphere están disponibles en una
amplia gama de tamaños. Debido al potencial de embolización
fallida y la variabilidad inherente de los tamaños de las esferas,
el médico debe asegurarse de seleccionar cuidadosamente el
tamaño de las Microesferas Embosphere según el tamaño de
los vasos diana en el nivel deseado de oclusión en la
vasculatura.
• Al embolizar malformaciones arteriovenosas (MAV), elija el
tamaño de las Microesferas Embosphere que ocluyan el nido
sin atravesar la MAV.
• Al embolizar miomas uterinos, elija el tamaño de
Microesferas Embosphere de 500 micras o mayor.
• Elija un catéter portador basándose en el tamaño del vaso
diana y en el tamaño de microesfera que se está usando. Las
Microesferas Embosphere pueden tolerar una compresión
transitoria de hasta el 33% para facilitar el paso a través del
catéter portador.
• Introduzca el catéter portador en el vaso diana según las
técnicas estándar. Coloque la punta del catéter tan cerca como
sea posible del lugar de tratamiento para evitar una oclusión
accidental de los vasos normales.
• Las Microesferas Embosphere no son radiopacas. Se
recomienda que se monitorice la embolización con
visualización radioscópica añadiendo la cantidad apropiada de
medio de contraste al líquido fisiológico en suspensión.
• Para administrar Microesferas Embosphere:
Después de agitar suavemente el frasco que contiene las
Microesferas Embosphere, diluir las Microesferas Embosphere
con medio de contraste ya sea en una copa pequeña estéril o
directamente en una jeringa de mezcla grande. Se recomienda
usar 50% de contraste y 50% de suero salino fisiológico para
una mejor suspensión. Para asegurar la suspensión correcta,
agite suavemente la mezcla de Microesferas Embosphere y el
contraste y espere de 2 a 3 minutos después de mezclarlos,
26
Page 27

antes de inyectarlos. Introduzca la solución de Microesferas
Embosphere/contraste en una jeringa de inyección de 1 ml a
ml y acople la jeringa al catéter portador. Inyecte la
3
solución de Microesferas Embosphere/contraste en el catéter
portador bajo visualización radioscópica usando una
nyección pulsátil lenta mientras observa el flujo del
i
ontraste. Si no hay efecto sobre el flujo, repita el proceso
c
de administración con inyecciones adicionales de solución
de Microesferas Embosphere y contraste. Considere el
uso de Microesferas Embosphere de mayor tamaño si las
inyecciones iniciales no modifican el flujo del contraste.
Ejerza un criterio conservador para determinar el final de
la embolización.
• La punción femoral puede tener como resultado un
espasmo arterial. Esto puede predisponer a la trombosis
femoral (p. ej. lesión en la pierna). Antes de la retirada
final del catéter se debe volver a evaluar la permeabilidad
femoral.
• Al completar el tratamiento, retire el catéter mientras
mantiene una suave aspiración de modo que no se
desplacen las Microesferas Embosphere que continúen
dentro de la luz del catéter.
• Aplique presión al punto de punción hasta que se
complete la hemostasia.
• Descarte cualquier Microesferas Embosphere abierta,
no utilizada.
Instrucciones adicionales específicas de la EMU:
• Se pueden utilizar dispo sitivos de c ompresión
neumática, a criterio del médico, para pacientes que
actualmente toman terapia hormonal, volumen uterino >
1000 ml, y pacientes con sobrepeso para reducir el riesgo
de trombosis venosa profunda.
• Se debe detener la embolización cuando la vasculatura
que rodea el mioma deje de poder visualizarse, pero antes
de la estasis completa en la arteria uterina. Existe una
mayor posibilidad de retromigración de Microesferas
Embosphere a vasos sanguíneos no previstos a medida
que se reduce el flujo de la arteria uterina.
INFORMACIÓN DE ASESORAMIENTO DE LA PACIENTE DE
EMU:
• Antes de la embolización, las pacientes deben entender
bien quién les proporcionará l a atención
posprocedimiento y con quién ponerse en contacto en
caso de emergencia después de la embol ización.
BioSphere Medical, Inc. tiene a su disposición y distribuye
los folletos de información del paciente.
• Las candidatas a la embolización del mioma uterino
deben haber entendido los beneficios, riesgos y episodios
adversos potenciales asociados con la EMU. Las pacientes
deben entender sobre todo que existe la posibilidad de que
sus síntomas relacionados con el mioma no mejoren tras
la embolización de mioma uterino.
RESUMEN DEL ESTUDIO CLÍNICO DE EMU:
Diseño del estudio
Se realizó un estudio prospectivo, multicéntrico, para
estud iar la embolización del mioma uterino usando
Microesferas Embosphere para el tratamiento de miomas
uterinos sintomáticos. En el estudio se trató mediante
EMU a un total de 132 mujeres que deseaban conservar su
útero y evitar la cirugía: 30 en un estudio inicial de
viabilidad y 102 en el estudio fundamental. Un grupo
simultáneo, no aleatorizado, de 50 pacientes sometidas a
isterectomí a fue incluido para la comparación de
h
seguridad con el grup o de embolización de mioma
uterino. En el estudio participaron once centros de
nvestigación: siete de los cuales realizaron embolización
i
e mioma u terino y seis de los cuales real izaron
d
histerectomías.
El estudio fue diseñado para determinar si la embolización
del mioma uterino con las Microesferas Embosphere
podría reducir los síntomas asociados con los miomas
sintomáticos, como por ejemplo, sangrados anómalos,
dolor, molestias y problemas urinarios.
Los criterios principales de valoración del estudio fueron:
• Reducción en el sangrado menstrual desde el inicio a
los 6 meses posembolización de mioma uterino, medida
usando el diagrama gráfico de evaluación de sangrado
(PBLAC)
• Mejora en los síntomas de ma sa (dolor pélvico,
molestia/
hinchazón pélvica y disfunción urinaria), medida con un
cuestionario sobre síntomas de pacientes
• Mejora en la calidad de vida, medida con el cuestionario
de estado de salud SF-12
Los criterios de valoración secundarios fueron:
• Otras medidas de cambios en el sangrado menstrual
• Reducción del tamaño del útero y del mioma
• Tiempo de hospitalización
• Tiempo hasta la vuelta a las actividades normales
• Evaluaciones de satisfacción del paciente con el
procedimiento
También se evaluaron los episodios adversos y las
complicaciones con respecto al tipo, ritmo y gravedad.
Los criterios de idoneidad incluían edad entre 30 y 50
años, ambos incluidos, infértil o sin planes de quedarse
embarazada, uno o más síntomas de miomas uterinos,
volumen uterino
PBLAC inicial
estudio si estaban embarazadas, tenían una historia de
enfermedad inflamatoria pélvica, mioma/s submucoso/s
con más del 50% de crecimiento dentro de la cavidad
uterina, mioma/s seroso/s pediculado/s como mioma/s
dominante/s, nutrición colateral importante por vasos
distintos de la arteria uterina, adenomiosis como causa
dominante de los síntomas, hiperplasia endometrial o
hiperplasia premaligna, cualquier cáncer de la región
pélvica, cualquier infección activa de la región pélvica,
alergia conocida al contraste o gelatina IV, diatesis
hemorrágica, inmunodeprimido, FSH postmenopáusica o
basal > 40mUI/ml o tratamiento con agonistas de la GnRH
en los 3 últimos meses.
Las evaluaciones pretratamiento fueron reconocimiento y
prueba ginecológica corrientes, análisis de laboratorio
estándar, ecografía o RM, registro de sangrado menstrual
(grupo EMU) y cuesti onarios de autoevaluación
relac ionados con la salud global (SF-12), sangrado
menstrual y síntomas del mioma. Las pacientes fueron
evaluadas en las semanas 1-3, a los 3 meses, 6 meses y
27
≥
250 ml o volumen de mioma≥4 ml, o
≥
150. Las mujeres fueron excluidas del
Page 28

12 meses. Las puntuaciones de PBLAC fueron obtenidas
a los 3 y 6 meses.
Tabla 1 - Datos demográficos de pacientes
UFE
30-50
1 (1%)
7 (6%)
3 (3%)
131-186
46-123
8 (8%)
1 (1%)
0 (0%)
9 (9%)
9 (9%)
9 (9%)
0 (0%)
2 (2%)
Histerectomía
41.6 (5.3)
31-50
2 (4%)
9 (18%)
8 (16%)
31 (62%)
0 (0%)
161.8 (10.1)
132-178
75.1 (21.5)
50-146
14 (28%)
2 (4%)
33 (66%)
1 (2%)
35 (70%)
2 (4%)
5 (10%)
5 (10%)
4 (8%)
1 (2%)
2 (4%)
3 (6%)
20 (40%)
19 (38%)
10 (20%)
1 (2%)
389.2 (521.2)
91.8-3415.1
90.6 (354.8)
3.2-2322.3
32 (64%)
8 (16%)
13 (26%)
1 (2%)
4 (8%)
EDAD EN AÑOS
Media (DE)
Rango
ORIGEN ÉTNICO
Asiático/isla Pacífico
Afroamericano
Hispano
Caucásico
Otros
ALTURA (cm)
Media (DE)
Rango
PESO (kg)
Media (DE)
Rango
ESTADO MENSTRUAL
Frecuente
Poco frecuente
Regular
Desconocido
TRATAMIENTO MIOMA
PREVIO
Ninguno
Agonista GnRH
Anticonceptivos orales
Otras hormonas
Miomectomía
Legrado
Histeroscopia
Otros métodos invasivos
NÚMERO DE MIOMAS
1
2
≥
3
Sin respuesta
VOLUMEN UTERINO (ml)*
Media (DE)
Rango
VOLUMEN MIOMA
DOMINANTE (ml)
Media (DE)
Rango
TIPO MIOMA
Intramural
Subseroso
Submucosa
Transmural
Pediculado
Más de un tipo indicado
para algunas pacientes
42.4 (4.2)
67 (59%)
35 (31%)
159.9 (10.5)
72.7 (16.2)
93 (91%)
53 (52%)
25 (25%)
20 (20%)
17 (17%)
13 (13%)
28 (25%)
37 (33%)
48 (42%)
692.4 (462.8)
185.6-3076.3
147.4 (154.3)
5.1-776.8
69 (61%)
20 (18%)
18 (16%)
11 (10%)
*El 84% de las pacientes de EMU yel98%de las pacientes con
histerectomía presentaban volúmenes uterinos iniciales de
000 ml o menos.
1
Resultados del estudio
Los resultados del estudio se presentan abajo para 107
acientes consideradas en la cohorte de estudio EMU Fase II,
p
ue consistía consistían en 11 pacientes EMU Fase I que
q
cumplían los criterios de idoneidad Fase II y 96 pacientes
Fase II EMU evaluables.
Información del procedimiento, alta y recuperación
Todos los procedimientos de embolización de mioma uterino
tuvieron éxito técnicam ente sin complicaciones
intraoperat orias que evitaran la terminación del
procedimiento. La mayoría (77%) de los procedimientos de
embolización de mioma uterino fue realizada utilizando un
catéter de 5 Fr con o bien un catéter de 4 Fr (19%) o 3 Fr
(3%) en el resto. Setenta y dos pacientes fueron tratadas con
esferas de 500-700 micras, 66 pacientes con esferas de 700900 micras y 18 pacientes con esferas de 900-1200 micras.
Muchas de las pacientes fueron tratadas con más de un
tamaño de esfera. El método de tratamiento más común fue
empezar con un tamaño de esfera más pequeño y, a
continuación, aumentar el tamaño si era necesario. El
volumen de las esferas necesarias variaba inversamente al
tamaño de la esfera ya que se utilizó un promedio de 7,2 ml
de esferas de 500-700 micras en comparación con 6 ml de
esferas de 700-900 micras y 4,1 ml de esferas de 900-1200
micras.
La mayoría de las pacientes de embolización de mioma
uterino se sometieron al procedimiento mientras estaban
sedadas conscientes con un anestésico local administrado en
el lugar de la punción. Ninguno de los procedimientos de
embolización de mioma uterino se realizó con anestesia
general. El tiempo promedio del procedim iento de
embolización de mioma uterino desde la punción arterial
hasta la retirada final del catéter fue de 58 ± 28 minutos
(rango 10-140 mi nutos). En c omparación, todas las
intervenciones de histerect omía fueron realizadas con
anestesia general, sin tener en cuenta el tipo de histerectomía
realizada, y el tiempo promedio de la cirugía desde la incisión
en la piel al cierre de la misma fue de 93 ± 38 minutos (rango
35-171 minutos) (p<0,001 ). La mayoría de los
procedimien tos de hister ectomía se realizaron por vía
abdominal (76%).
El 87% de las pacientes de embolización de mioma uterino
fueron dadas de alta del hospital al día siguiente de la
embolización y el 12% el mismo día del procedimiento. Las
pacientes de h isterectomía pasaron un tiempo
significativamente más prolongado en el hospital (p<0,001),
con una estancia promedio de 2,3 días en comparación con
0,9 días para las pacientes de embolización de mioma
uterino. Las pacientes de EMU volvieron al trabajo en un
promedio de 10,7 días; no obstante, para las pacientes de
histerectomía esto duró un promedio de 30,7 días (p<0,001).
Asimismo, las pacientes de la embolización de mioma uterino
volvieron a sus actividades diarias normales más de tres
veces antes que las pacientes de histerectomía (media 10,9
días para EMU frente a 37,4 días para hist erectomía,
p<0,001).
28
Page 29

Criterios de valoración principal de eficacia
Sangrado menstrual
Para cum plir los requisitos de la emboli zació n de mioma
uterino d e est e estudio, se requería que las paci entes
tuvieran sang rado menstrual anormalmente abundante,
on un a puntuación in icial de
c
gráfico de ev aluac ión de sangrado (PBLAC ) de Janssen
et al. (1995). El éx ito se definió como el
reducción en la punt uació n del PBL AC en la evaluación
de seg uimie nto a los 6 meses. También se utilizaron
medidas a dicio nales para evaluar lo s cambios e n el
sangrado menstrual, que incluían la ev aluac ión de la
propia pac iente d e su niv el d e sa ngr ado y un
cuestionario sobre la men orrag ia.
Los cambios en el sangrado menstrual generalmente se
producían rápidamente tras la em boliz ación del m ioma
uterino, co n el 92% de la s pacientes mos trand o alguna
mejoría a los 3 meses. La tabla 2 presenta los índices de
éxi to d e sa ngrado menstr ual a lo s 6 mese s en la
población por intención de trat ar. Los datos de la tabla 2
reflejan PBLAC completados de 90 de las 107 paci entes
de EMU en Fase II ( 84%). Seis paci entes (6%) no
comple taron u n PBLAC a los 6 mese s p orque s e
perdieron en el seguimiento (n=4) o se había n sometid o
a una h ister ectom ía (n= 2) ant es de e ste pe riodo de
evaluación. L as restantes once pacientes (10% ) sin
puntuaciones PBLAC a los 6 m eses te nían suficiente
inform ación de ot ras evaluac iones d e sa ngrados
menstruales p ara d ecidi r su nivel de éxi to sobre este
criterio de valo ració n.
Tabla 2 - Efica cia: tasas de éxito de sangrado men strua l
en población por int enció n de tratar
% dereduccióndesde elinicio
≥ 50%
30-49%
0-29%
< 0%
Pérdidas en el seguimiento
6 meses
Síntomas de masa
Se utilizó un cues tiona rio d e síntomas específicos del
mio ma p ara evaluar los cam bios en tres síntomas
rel acionados con el miom a, dolor pélv ico, molestia
pélvica y disfunción uri naria . El é xito se de finió com o
una mejora moderada o significativa para las pacientes
que se incluy eron en el estudio con síntomas moderados
o graves y/o no em peora mient o para pacientes que se
incluyeron en el e studi o sin sín tomas o con síntomas
leves. 94 de las 107 pa cient es (88%) completaron el
cuestionario sobre síntomas de ma sa a los 6 meses
postratamiento. Las 13 pacientes con falta de datos de
síntomas a los 6 meses por cualquier ra zón se contaron
como fallos. La tabla 3 muestra que la may oría de las
pacientes EMU cumplían los criterios del estudio para el
50 en e l d iagra ma
≥
1
6 meses
N/107 (%)
69 (65%)
15 (14%)
7 (7%)
10 (9%)
4 (4%)
2 (2%)
≥
50% de
éxito sobre los tr es síntomas relacionados con la masa .
ste éxi to se lograba gen eralm ente a los 3 mese s. El
E
84% de las mujeres cumplían lo s criterios de éxito para
al menos un sín toma de masa a los seis meses.
Tabla 3 - Eficacia: tasas de éxito de los síntomas de masa en la
oblación por intención de tratar
p
Síntomas
Dolor pélvico
Molestia pélvica
Disfunción urinaria
Calidad de vida
Se uti lizó el cu estio nario de estado de salud SF-12 para
evaluar los cambios en el estado de salud física y mental
general tras el tratamiento. El objetivo de este criterio de
valoración era de mostr ar al me nos una mejor a mo derada
en la calidad de vida global en la evaluac ión a los 6
meses. Las puntuaciones promedio pre-tratamiento para
el grupo EMU era n 44,4 ± 8,5 y 45,1 ± 1 1,9 para los
compon entes fí sic os y mentale s, respe ctivame nte,
colocando a este grupo un poco mejor que el percentil 25
(44,32) de los casos normalizados publ icado s pa ra l a
población estad ounid ense d e mujeres en g enera l. A los
seis meses, las puntu aciones prome dio de ambos
cuesti onarios f ísico y men tal había n aumenta do
signif icativa mente a 5 2,2 ± 6,7 y 52, 4 ± 8, 8,
respectivamente, colocando el grupo EMU en el percentil
50 (52, 76) de las puntua ciones SF-12 norm alizadas
(p<0,001 para ambas medid as).
Criterios de valoración secundarios de eficacia
Volumen del mioma y uterino
Las pacientes de e mboli zació n de mioma uterino se
sometieron a imag en uterina med iante RM o ec ograf ía en
el in icio y en el segu imien to. Lo s volúmenes uterino y
del mi oma se calcularon utilizando la fórmula para el
volumen de una elipse alarga da (LxAxPx0,52). Med iante
una evaluación a l os 3 meses se r egis trar on u nas
reducciones sign ificativas ta nto en el vol umen uterino
(medid o i ncluyen do el cuello ute rino) como en el
volumen del mio ma uterino para el grupo EM U, con más
mejoras observa das a los 6 meses (p<0,001 en los dos
periodos en com paración co n el in icio) . La tabla 4
res ume los cambios p orcentual es en los volúmen es
uterino y del mioma a los seis meses tras el tratamiento.
Esta tabla inclu ye los datos de volumen uter ino de 91 de
las 108 pacientes EMU de Fase II (84%) y los datos de
volumen del mioma de 83 de estas pacientes (77%) qu e
tenían informes de imágenes completos y ev aluab les en
el inicio, a los 3 mese s y a los 6 meses de tratamiento
tras el EMU. Se in formó de aument os en los vo lúmen es
uterinos de 11 pacientes (12%) y au mento s de los
volúme nes de l m ioma en 8 pa cientes (8 %) en la
evaluación a los sei s me ses.
29
6 meses
N/107 (%)
83 (78%)
80 (75%)
75 (71%)
Page 30

Tabla 4 - Cambio porcentual en los volúmenes uterino y de
Hora del episodio
Descripción del episodio
Nº
que
jas
del
!
pacien
te*
Nº
epi
sodi
os
Pr
ocedim
ien
to
!
En
hospi
tal
!
<1
mes
1-3
mes
es
3-6
mes
es
>6
me
ses
Histerectomía tras EMU 4 4 2 2
Reacción alérgica/erupción cutánea 8 8 2 3 3
Mioma/paso de tejido o eliminación 5 6 2 3 1
Dolor relacionado con los episodios adversos 4 4 3 1
Catéter/punto de punción relacionado con
lesión
67124
Infección vías urinarias/cistitis34 1111
Infección vaginal/vaginitis57 2122
I
rritación vaginal/escozor/flujo22 11
Otro 9 9 4 1 2 1 1
Total 51 7 5 17 11 4 7
ioma desde el inicio
m
% reducción a los
Volumen uterino (ml)
N
Media (DE)
Rango
Volumen del mioma
N
Media (DE)
Rango
Un cambio porcentual positivo indica una reducción en el
volumen, mientras que un cambio porcentual negativo indica
un aumento en volumen.
Satisfacciónde las pacientes
Los dos grupos del estudio mostraron un alto nivel de
satisfacción con el resultado de sus procedimientos tanto a los
3 como a los 6 meses. Noventa y dos de las 100 pacientes de
EMU (92%) y 46 de las 47 pacientes con histerectomía (98%)
que completaron el cuestionario de satisfacción del paciente a
los 6 meses estaban leve, moderadamente o muy satisfechas
con el resultado de su procedimiento, estando la mayoría de los
dos grupos muy satisfecha.
EPISODIOS ADVERSOS:
Se informó de datos de episodios adversos de todas las 132
pacientes tratadas mediante EMU en las dos Fases I y II. No
hubo efectos adversos de l dispositivo inesperados ni
episodios adversos inesperados registrados en este estudio.
La tabla 5 presenta cincuenta y un episodios adversos que se
juzgaban como probable o posiblemente asociados con el
procedimiento, que se produjeron en 37 de las 132 pacientes
de EMU (28%). 7 de los 51 episodios (14%) se produjeron
duran te el procedimiento EMU, 5 (10%) entre el
procedimiento y el alta hospitalaria, 17 (33%) desde el alta
hospitalaria a 1 mes posprocedimiento, 11 (22%) de 1 a 3
meses posprocedimiento, 4 (8%) de 3 a 6 meses
pospr ocedimiento y 7 (14%) después de 6 meses
posprocedimiento. El episodio adverso más común fue la
reacción alérgica o erupción cutánea, que se produjo en 8 de
las 132 pacientes (6%) y que generalmente fueron juzgadas
por el médico que las trataba como relacionadas con los
fármacos o el agente de contraste utilizado durante el
proce dimiento. Todas las r eacciones se resolvieron
espontáneamente o con tratamiento. Cuatro pacientes se
sometieron a histerectomías después del EMU, para una tasa
de histerectomía global del 3%. Se realizó una histerectomía
a los 2 meses tras la EMU debido a una fiebre
conti nua/posible infección. Las otras tres fue ron
histerectomías de elección debido a su insatisfacción con los
resultados de la EMU, que se produjeron a los 2, 10 y 11
meses posteriores a la EMU. Una paciente (<1%) tuvo una
EMU repetida después de encontrarse que sus arterias
uterinas eran permeables.
6 meses
33.2% (30.5%)
-93.6% a 82.0%
50.9% (41.7%)
-173.4% a 99.7%
Tabla 5 - Ritmo y tipo de probabilidad o posibilidad de
pisodios adversos relacionados con la EMU
e
91
83
*Un total de 34 de 132 pacientes (26%) experimentaron uno o
más episodios adversos en este estudio. El número de
pacientes de esta columna refleja el hecho de que algunas
pacientes experimentaron más de un episodio adverso.
REFERENCIAS:
Específicos de la EMU
1. Spies J et al., Initial experience with use of tris-acryl gelatin
microspheres for uterine artery embolization for leiomyomata,
J Vasc Interv Radiol, 12:1059-1063, 2001.
2. Spies J et al., Complications after uterine artery embolization
for leiomyomas. Obstet Gynecol, 100:873-80, 2002.
3. Goldberg J, Pereira L, and Berghella V: Pregnancy After
Uterine Artery Embolization. Obstet Gynecol, 100(5):869-872,
2002.
4. Scialli A: Alternatives to hysterectomy for benign
conditions. Int J Fert & Women's Med, 43(4):186-91, 1998.
5. Nikolic B, Spies JB, Campbell L, et al.: Uterine artery
embolization: reduced radiation with refined technique. J Vasc
Interv Radiol, 12(1):39-44, Jan 2001.
6. Worthington-Kirsch R, G Popky, F Hutchins: Uterine arterial
embolization for the management of leiomyomas: Quality-oflife assessment and clinical response. Radiol, 208: 625-629,
1998.
7. Pelage JP, Le Dref O, Soyer P, et al.: Fibroid-related
menorrhagia: Treatment with superselective embolization of
the uterine arteries and mid-term follow-up. Radiology,
215(2):428-431. May 2000.
Todaslas indicaciones
1. Bendszus M, Klein R, Burger R, et al.: Efficacy of trisacryl
gelatin microspheres versus polyvinyl alcohol particles in the
preoperative embolization of meningiomas. AJNR, 21(2): 25561, Feb 2000.
2. Deveikis JP: Endovascular therapy of intracranial
arteriovenous malformations: materials and techniques.
Neuroimaging Clin of N Am, 8(2):401-424, 1998.
3. Frizzel RT, Fisher WS: Cure, morbidity, and mortality
associated with embolization of brain arteriovenous
malformations: A review of 1246 patients in 32 series over a
35-year period. Neurosurg, 37(6):1031-1040, Dec 1995.
4. Gomes, A: Embolization therapy of congenital arteriovenous
malformations: Use of alternative approaches. Radiology,
190:191-8, Jan 1994.
5. Terada, T; Kinoshita, Y; Yokote, H; Tsuura, M; Itakura, T;
Komai, N; Nakamura, Y; Tanaka, S; Kuriyama, T: Preoperative
30
Page 31

embolization of meningiomas fed by ophthalmic branch
STERILIZE
2
2
STERILE
rteries. Surg Neurol, 45:161-6, 1996.
a
nformación en el envase:
I
Símbolo Designación
Fabricante: Nombre y dirección
Fecha de caducidad: año-mes
LOT
Código de lote
REF
Número de catálogo
No reesterilizar
No utilizar si el envase está dañado
Manténgase protegido de la luz del sol
Manténgase seco
No reutilizar
Precaución - Consultar las Instrucciones de
uso
Apirógeno
Esterilizado con vapor
Límite inferior de temperatura
0°C
Distribuido en EE.UU. por:
Merit Medical Systems, Inc.
Servicio de Atención al Cliente 1-800-356-3748
Información sobrepatentes
EE.UU. 5,635,215 y otras patentes emitidas y pendientes.
Microesferas Embosphere es una marca comercial registrada
de BioSphere Medical.
Todos los episodios adversos serios o potencialmente
mortales o muertes asociadas con el uso de las
Microesferas Embosphere se deben notificar a Food and
Drug Administration de EE.UU. bajo el programa
MedWatch y al fabricante del dispositivo. La información
acerca del programa MedWatch y los formularios para
informar de episodios adversos se pueden obtener en
www.fda.gov/safety/medwatch/howtoreport/ucm053074.h
tm o llamando gratuitamente a 888-463-6332. Los
informes para BioSphere Medical, Inc. se pueden realizar
llamando gratuitamente a 800-394-0295.
781-681-7900
31
Page 32

中文
注意:联邦(美国)法律规定此装置仅限医生使用
遵医嘱使用。
或
预期用途:
Embosphere
微球适用于动静脉畸形、血供丰富型肿瘤以及症状性子宫
肌瘤的栓塞治疗。
治疗子宫肌瘤的临床应用:
子宫肌瘤栓塞术(UFE)是缓解女性因子宫肌瘤引起的大量
月经出血、盆腔疼痛或压迫和/或排尿功能障碍等症状治疗
的一种替代治疗方法。
装置说明:
Embosphere 微球是采用 BioSphere Medical
公司的专有微球技术开发而成的栓塞材料系列产品之一。
本微球产品设计提供可控的靶向栓塞治疗。
Embosphere微球由丙烯酸聚合物浸渍于猪明胶制成,具
有生物相容性、亲水性、不可再吸收性。 Embosphere
微球有多种不同标定尺寸可供选择。
装置包装:
• Embosphere 微球装于带螺纹瓶盖的5.0
毫升无菌玻璃小瓶内,包装于可撕托盘中,每包 5 瓶。
• 每小瓶内有无菌、无热原生理盐水,内含 1.0 毫升或
2.0 毫升Embosphere 微球。 生理盐水和微球的总体积为
5 毫升。
____________________________________________________
以下禁忌症、警告、注意事项以及使用说明的内容首先均
为适用于所有适用范围的信息(即富血管肿瘤、动静脉畸
形、子宫肌瘤),其次再为具体适用范围的信息(即 UFE
和神经系统)。
禁忌症:
所有适应症
• 不能耐受栓塞手术的患者
• 由于血管解剖或血流原因无法置入导管或注入栓塞剂
• 存在或可能发生血管痉挛
• 存在或可能发生出血
• 存在严重的动脉粥样硬化疾病
• 供血动脉的直径的近端小于远端
• 病灶的供血动脉不够大,无法接受 Embosphere 微球
• 存在侧支血管通路,栓塞时可能危及正常区域
• 供血动脉的外周血管阻力较大,Embosphere 微球无
法送入病灶
• 大口径的动静脉分流(即血液不通过动脉/ 毛细血管/静
脉过渡,而是直接从动脉流入静脉)
• 肺部血管系统中
UFE 的特定禁忌症
• 孕妇
无菌小瓶装 Embosphere®栓塞微粒球 用于栓塞治疗
• 怀疑有盆腔炎或其他任何盆腔活动性感染者
• 骨盆区域有任何恶性肿瘤
子宫内膜瘤样病变或增生
•
• 有一个或多个粘膜下子宫肌瘤,其中50%以上已长入宫
腔内以带蒂浆膜下肌瘤为主的子宫肌瘤
• 明显由侧枝血管而非子宫动脉供血的肌瘤
神经系统的特定禁忌症
• 存在通畅的颅外至颅内吻合或分流
• 存在直接汇入颅神经的终动脉
• Embosphere
微球可能直接进入颈内动脉、椎动脉、颅内血管或以上所
列血管的任何脉管系统
警告:
所有适应症
• Embosphere
微球含有猪来源的明胶,因此,对胶原蛋白 或明胶敏感的
患者可能出现免疫反应。
对于怀疑对含有明胶稳定剂的注射液过敏的患者,使用本
产品前应慎重考虑。
• 研究表明 Embosphere 微球不形成聚集体,因此与同样
大小的 PVA 颗粒相比,微球能够渗透到血管更深处。
为动静脉畸形、存在较大分流的患者进行栓塞时,必须谨
慎选择较大尺寸的 Embosphere
微球,避免微球进入肺循环 或冠脉循环。
• 部分 Embosphere 微球可能略超出治疗范围之外,
因此医生一定要根据位于血管系统中所要栓塞层次的靶血
管大小,结合动静脉血管造影的结果慎重选择
Embosphere 微球的大小。 必须选择合适的
Embosphere 微球大小,避免微球从动脉通 入静脉。
• 由于误栓塞的并发症较严重,
因此对环绕头部和颈部的颅外循环的任何手术均应格外小
心,并且医生应对栓塞治疗的潜在益处与风险和潜在并发
症进行仔细权衡。
其并发症包括失明、听力丧失、嗅觉丧失、瘫痪和死亡。
• 患者长时间、大范围暴露在透视下、以倾斜角度照射 X
光,并多次拍摄记录 X 光片,都可能因放射而引起严重的
皮肤损伤。请查阅您所在机构的临床方案,确保所进行的
每一类具体操作均应用了适当的辐射剂量。
医师应对可能存在风险的患者进行监测。
• 放射引起的损伤可能为迟发。
应告知患者有关放射的潜在副作用,并告知患者在出现症
状时应与何人联系。
•应格外留意靶点外误栓塞的征象。
注射过程中仔细监测患者的生命体征,包括 SAO2
(如缺氧、中枢神经系统的变化)。
如果出现靶点外误栓塞的任何征象或患者发生症状,应考
虑终止手术,检查可能存在的分流或增加微球大小。
如果出现靶点外误栓塞的任何征象或患者发生症状,应考
虑终止手术,检查可能存在的分流或增加微球大小。
• 如果血管造影证实在微球注射过程中不能迅速出现明显
栓塞,则考虑加大微球尺寸。
UFE 的特定警告
与 UFE 和妊娠有关的警告
• 目前,UFE 对女性的怀孕和怀胎至足月的能力以及胎
32
Page 33

儿发育的影响还不明确。
因此,该手术只能为不打算再次怀孕的妇女实施。
• 在 UFE 之后怀孕的女性发生产后出血、早产、
剖腹产和先露异常的风险可能增加。
理论上,UFE 阻断子宫肌层血流可能导致 UFE
•
后怀孕的女性发生子宫破裂的风险增高。
术
其他 UFE 警告
• 使用 Embosphere 微球进行子宫肌瘤栓塞术时,
不要使用小于 500 微米的微球。
• 要接受子宫肌瘤栓塞术的患者都应接受适当的妇科检查
(如妇科病史、子宫肌瘤成像、月经异常出血患者子宫内
膜活检排除癌症)。
• 采取非手术方法(如 UFE)治疗子宫肌瘤可能会延
误子宫肉瘤的诊断。 在推荐此类患者接受 UFE 之前,
必须密切留意肉瘤的警告征兆(例如肿瘤生长迅速、绝经
后又出现子宫增大、MRI 表现),并进行更深入细致
的检查。 UFE
之后肿瘤复发或继续增长应视为肉瘤的潜在征兆,此时应
考虑手术治疗。
使用小微球的警告
• 当考虑使用直径小于您的成像设备分辨率的栓塞剂时,
应格外谨慎。
动静脉吻合的存在、靶区域存在分支血管或栓塞前显影不
明显的血管可能导致靶点外误栓塞和严重并发症。
• 小于 100 微米的微球一般会迁移到血管吻合口远端,
因此更有可能终止远端组织的血液供应。
使用较小的微球可能有更大机会造成缺血损伤,因此栓塞
前必须考虑到这种损伤的后果。
可能产生的后果包括:肿胀、坏死、瘫痪、脓肿和/或更严
重的栓塞后综合征。
• 栓塞后肿胀可能会导致靶区域周围组织缺血。
必须注意避开不能耐受缺血的非靶组织,如神经组织。
注意事项:
所有适应症
• 已知对造影剂过敏的患者在进行栓塞前可能需要接受糖
皮质激素。
• 对于以下疾病的患者,围手术期护理管理中可能需要采
取额外评估或预防措施:
- 出血体质或高凝状态
- 免疫功能低下
• 若小瓶、螺纹瓶盖或托盘包装出现破损,请勿使用。
• 仅供一名患者使用 - 内容物无菌 -
如小瓶已打开,不得对内容物重复使用、再加工或再次灭
菌。重复使用、再加工或再次灭菌处理可能会损害装置的
结构完整性和/或使装置失效,从而可能导致患者受伤、生
病或死亡。重复使用、再加工或再次灭菌处理还可能带来污
染风险并/或造成患者感染或交叉感染,包括(但不限于)
将传染性疾病从一位患者传给其他患者。
装置污染可能会造成患者受伤、生病或死亡。
所有操作均必须采用公认的无菌技术进行。
• 根据所要治疗的疾病选择适当的 Embosphere
微球大小和数量。
• 只有接受过所要治疗部位的介入栓塞培训的医生方可使
用 Embosphere 微球实施栓塞治疗。
UFE的特定注意事项
• 子宫动脉血流减少后,Embosphere
微球回迁至非预期血管的几率会增高。
当子宫动脉血运完全停滞前,肌瘤周围的血管系统已不再
可见时,应停止栓塞。
• 只能由接受过子宫肌瘤治疗的适当培训的介入放射科医
师实施 UFE。
• 目前 Embosphere 微球的临床研究数据仅限于 6
月随访。 本研究中的 UFE
个
者将继续接受每年一次的随访,持续至少三年。
患
其信息将随时根据需要更新,以反映 UFE 后长期结果的
任何变化。
潜在并发症:
所有适用范围
血管栓塞是一种风险高的手术。在手术期间或之后可能发
生并发症,并且可能包括但不限于以下:
• 靶点外部位栓塞导致麻痹,
或因相邻组织水肿导致缺血性损伤。
• Embosphere
微球有害回流或进入靶点病灶相邻的正常动脉,或通过病
灶进入其他动脉或动脉床,如颈内动脉、肺动脉或冠状动
脉循环等
• 由于动脉静脉分流而导致肺栓塞
• 非必要位置发生缺血,包括缺血性中风、
缺血性梗阻(包括心肌梗阻),以及组织坏死
• 毛细血管床阻塞和组织损伤
• 血管或病灶破裂出血
• 血管痉挛
• 再通
• 需要医疗干预的异物反应
• 需要医疗干预的感染
• 插管相关并发症(如插管部位血肿、
导管尖形成血凝块并随后脱落、神经和/或循环系统损伤等
,均可能导致腿部损伤)
• 对药物有过敏反应(如止痛药)
• 对造影剂或栓塞剂发生过敏反应
• 栓塞后可能出现疼痛和/或皮疹,症状发生时间可能滞后
• 死亡
• 失明、听力丧失、嗅觉丧失,和/或瘫痪
• 警告部分可看到更多信息
UFE 的特定潜在并发症
• 术后最常见的并发症是腹痛、不适、发烧和/或恶心,统
称为“栓塞后综合征”。 部分患者也可能发生便秘。
该症状一般可采用处方药或非处方药治疗。
• 卵巢早衰(即绝经)
• 闭经
• 骨盆区域感染
• 子宫/卵巢坏死
• 静脉炎
• 深静脉血栓形成,伴或不伴肺栓塞
• 阴道分泌物
• UFE 后组织排出、肌瘤脱落或肌瘤排出
• 为清除坏死的肌瘤组织而进行 UFE 后干预
• 迷走神经反应
• 瞬态高血压发作
• 子宫切除术
• 截至 2002 年 11 月,全世界共有约 25,000 至 30,000
名女性接受 UFE 治疗,其中已知有 4 例死亡,死亡率为
0.01% 至 0.02%。
神经系统的特定潜在并发症
• 缺血性卒中或缺血性梗死
33
Page 34

• 神经功能障碍,包括颅神经麻痹
储存和无菌:
• Embosphere 微球必须装在原有的小瓶和包装中,
存放于阴凉、干燥的避光处。。
• 在小瓶标签上标注的日期前使用。
• 请勿冷冻。
• 请勿再次灭菌。
使用说明:
使用前检查包装,确保其密封完整,产品保持无菌状态。
• 栓塞手术前采用高分辨率成像仔细评估病灶血管网。
• Embosphere 微球有多种尺寸可供选择。
由于误栓塞的可能性和微球大小固有的多样性,医生应确
保根据血管网上所要的堵塞水平上靶血管大小慎重选择
Embosphere 微球大小。
• 栓塞动静脉畸形 (AVM) 时,应选择适当大小的
Embosphere
微球,使其既能阻塞病灶,又不会从动静脉畸形处通过。
• 进行子宫肌瘤栓塞术时,应选择 500 微米或更大的
Embosphere 微球。
• 根据靶血管和所用微球大小,选择合适的输送导管。
Embosphere 微球可耐受高达 33%
的临时压缩,以便通过导管输送。
• 按照标准操作将输送导管送入靶血管。
将导管尖放置在尽可能靠近治疗部位的位置,以避免意外
阻塞正常血管。
• Embosphere 微球不透 X 光。
建议在生理盐水悬浮液中加入适量的造影剂,采用透视对
栓塞过程进行可视化监测。
• 通过以下步骤输送 Embosphere 微球:
将含有 Embosphere 微球的小瓶中轻轻摇匀,用造影剂将
Embosphere
微球稀释,倒入无菌小杯或直接倒入大的混合注射器中。
建议最好配制为 50% 造影剂和 50% 生理盐水的悬浊液。
为确保悬浮均匀,在使用前应轻轻搅动 Embosphere
微球和造影剂混合液,搅拌后静待 2-3 分钟再行注射。 将
Embosphere 微球/造影剂溶液抽取至 1 或 3
毫升注射器中,并将其连接到输送导管上。
在透视下采用搏动性注射将 Embosphere
微球/造影剂溶液缓慢注射到输送导管中,同时观察造影剂
流速。 如果流速没有变化,则再次注射 Embosphere 微
球/造影剂溶液重复输送操作。 如果首次注射后造影剂
流速无变化,可考虑换用更大尺寸的 Embosphere 微球。
在确定栓塞终点时应采取保守判断。
• 股骨穿刺可导致动脉痉挛。
这容易导致股动脉血栓形成(例如腿部损伤)。
最终拔除导管前,应重新评估股动脉通畅情况。
• 治疗完成后,在拔除导管的同时保持轻微的抽吸,以免
仍留在导管腔内的 Embosphere 微球脱落。
• 穿刺部位加压,直到止血为止。
• 丢弃任何打开但未使用的 Embosphere 微球。
UFE 的其他特定说明:
• 医生可酌情决定为目前服用激素治疗、子宫体积 >1000
毫升以及超重的患者使用充气加压装置,以降低深静脉血
栓形成的风险。
• 肌瘤周围的血管系统已不再可见,但在子宫动脉血运完
全停滞前,应停止栓塞。
随着子宫动脉血流的减少,Embosphere
微球逆向移动至非预期血管的几率会增高。
UFE 患者咨询信息:
• 患者在接受栓塞治疗前应对提供术后护理的人员以及栓
塞后发生紧急情况时的联系人有明确的认识。 BioSphere
Medical, Inc. 公司提供并分发患者须知手册。
• UFE 候选患者应当了解与 UFE 相关的潜在利益、
风险以及不良事件。 患者特别应当了解的是进行 UFE
后其子宫肌瘤相关症状可能不会改善。
UFE 临床研究摘要:
研究设计
开展一项前瞻性多中心试验以研究采用 Embosphere
微球进行 UFE 治疗症状性子宫肌瘤。 本研究共有 132
名希望保留子宫、避免手术治疗的女性参与,并接受了
UFE 治疗: 其中 30 名参与了初步可行性研究,102
名参与了关键研究。
研究还纳入了同一时间接受子宫切除术的 50
名患者作为非随机组,与 UFE 组的安全性进行比较。
本次研究共有 11 个研究地点参与,其中 7 个实施
UFE,6 个实施子宫切除术。
这项研究的目的是确定采用 Embosphere 微球进行 UFE
是否能够减少症状性子宫肌瘤的相关症状,如异常出血、
疼痛、不适和泌尿问题等。
主要研究终点包括:
• 采用图示月经出血量评估表 (PBLAC) 评估从基线到
UFE 术后 6 个月的月经出血减少情况
• 采用患者症状调查问卷来评估肿物症状(盆腔疼痛、
盆腔不适/肿胀、泌尿功能障碍)的改善
• 采用 SF-12 健康状况调查问卷来评估生活质量的改善
次要研究终点包括:
• 月经出血变化的其他指标
• 子宫和子宫肌瘤体积的减小
• 住院时间
• 恢复到正常活动所需时间
• 患者对手术满意度的评价
同时还对不良事件和并发症的类型、发病率和严重程度进
行了评估。
入组标准包括:年龄 30 至 50 岁(含)、
不育或没有计划怀孕、存在一个或多个症状性子宫肌瘤、
子宫体积 ≥ 250 毫升或肌瘤体积 ≥ 4 毫升和基线
PBLAC ≥ 150。
以下女性被排除在研究之外:怀孕女性、有盆腔炎病史、
粘膜下子宫肌瘤宫腔内增长已超过 50%、以带蒂浆膜
肌瘤为主的子宫肌瘤、明显由侧枝血管而非子宫动脉供血
的肌瘤、子宫腺肌病为症状主因者、子宫内膜增生或癌前
增生、骨盆区域有任何恶性肿瘤、骨盆区域有任何活动性
感染、已知对静脉造影剂或明胶过敏、出血体质,免疫功
能低下、绝经后或基线 FSH > 40 mIU/毫升,或之前 3
个月内曾接受 GnRH 激动剂治疗。
治疗前的评估包括常规妇科检查和测试、标准实验室检查
、超声或 MRI 检查、月经出血记录(UFE
组)以及整体健康 (SF-12)、月经出血和子宫肿物症状
的自我评估问卷调查。 患者在第 1-3 周、第 3 个月、第
6 个月和第 12 个月时接受评估。 第 3 个月和第 6
个月时获取 PBLAC 评分。
34
Page 35

表 1-患者人口统计学信息
UFE
年龄(岁)
平均值(标准差)
范围
种族
亚洲人/太平洋岛民
裔美国人
非
拉美裔人
白人
其他
身高(厘米)
平均值(标准差)
范围
重量(千克)
平均值(标准差)
范围
月经状态
频繁
少见
规律
未知
先前接受过的子宫肌瘤
治疗
无
GnRH 激动剂
口服避孕药
其他激素治疗
子宫肌瘤摘除术
子宫扩刮手术
宫腔镜术
其他有创治疗
肌瘤的数目
1
2
≥
3
没有回答
子宫体积(毫升)*
平均值(标准差)
范围
主要的肌瘤体积(毫升)
平均值(标准差)
范围
子宫肌瘤类型
壁内
浆膜下
粘膜下
透壁
带蒂
部分患者存在多于一种
类型的肌瘤
*84% 的 UFE 患者及 98%
的子宫切除患者基线时子宫体积为 1000 毫升以下。
42.4 (4.2)
30-50
1 (1%)
67 (59%)
7 (6%)
35 (31%)
3 (3%)
159.9 (10.5)
131-186
72.7 (16.2)
46-123
8 (8%)
1 (1%)
93 (91%)
0 (0%)
53 (52%)
9 (9%)
25 (25%)
9 (9%)
20 (20%)
17 (17%)
13 (13%)
9 (9%)
28 (25%)
37 (33%)
48 (42%)
0 (0%)
692.4 (462.8)
185.6-3076.3
147.4 (154.3)
5.1-776.8
69 (61%)
20 (18%)
18 (16%)
11 (10%)
2 (2%)
子宫切除术
41.6 (5.3)
31-50
2 (4%)
9 (18%)
8 (16%)
31 (62%)
0 (0%)
161.8 (10.1)
132-178
75.1 (21.5)
50-146
14 (28%)
2 (4%)
33 (66%)
1 (2%)
35 (70%)
2 (4%)
5 (10%)
5 (10%)
4 (8%)
1 (2%)
2 (4%)
3 (6%)
20 (40%)
19 (38%)
10 (20%)
1 (2%)
389.2 (521.2)
91.8-3415.1
90.6 (354.8)
3.2-2322.3
32 (64%)
8 (16%)
13 (26%)
1 (2%)
4 (8%)
研究结果
本项研究结果如下,107 名患者属于二期 UFE
研究队列,其中包括符合二期入组标准的 11 名 UFE
期患者以及 96 名可评估的 UFE 二期患者。
一
手术、出院和恢复情况
所有 UFE 手术均成功完成,术中无并发症使得手
术无法完成。 大部分 (77%) UFE 手术采用 5 Fr
导管进行,其余则采用 4 Fr (19%) 或 3 Fr (3%) 进行。
72 名患者采用 500-700 微米微球治疗,66 名采用 700900 微米微球治疗,18 名采用 900-1200 微米微球治疗。
多数患者均采用多于一种尺寸的微球进行治疗。
最常用的治疗方法是从尺寸较小的微球开始,如有必要再
增加尺寸。
治疗所需要的微球体积与所用的微球大小成反比,平均而
言,500-700 微米微球需要使用 7.2 毫升,而 700-900
微米微球需要
6 毫升,900-1200 微米微球需要 4.1 毫升。
大多数 UFE
患者的手术均在穿刺部位局麻下完成,术中患者保持清醒
镇静。 所有 UFE 手术均未在全身麻醉下进行。
按开始动脉穿刺到最终拔除导管的时间计算,UFE
手术的平均时间为 58 ± 28 分钟(范围为 10 到 140
分钟)。
相较之下,无论子宫切除术的类型为何,所有的子宫切除
手术均在全身麻醉下进行,按从皮肤切口到皮肤缝合的时
间计算,平均手术时间为 93 ± 38 分钟(范围为 35-171
分钟)(p<0.001)。 大部分子宫切除术均经开腹完成
(76%)。
87% 的 UFE 患者在栓塞后第二天出院,12%
于手术当天出院。 子宫切除患者住院时间显著较长
(p<0.001),平均住院 2.3 天,而 UFE 患者则为
0.9 天。 UFE 患者平均经过 10.7
天后恢复正常工作,但子宫切除患者则在平均 30.7
天后才恢复工作(p<0.001)。 同样,UFE
患者恢复正常日常活动的速度超过子宫切除患者的 3
倍(UFE 患者平均 10.9 天,子宫切除患者平均 37.4
天,p<0.001)。
主要疗效终点
月经出血
此项研究 UFE 患者的入组标准是必须有大量异常月
经出血、基线≥图示月经出血量评估表 (PBLAC) 评分为
150(Janssen 等人,1995)。
治疗成功被定义为≥治疗后 6 个月随访评估时 PBLAC
评分减少 50%。 研究还采用患者
自我评估出血水平和月经过多问卷等其他指标来评估经期
出血的变化。
UFE 后,月经出血情况通常迅速发生变化,92% 的患者在
3 个月时症状即有改善。 表 2 列出了 6
个月时意向性治疗 人群中月经出血的治疗成功率。 表 2
的数据为107 名 UFE 二期患者中完成了 PBLAC 的 90 名
(84%) 患者的数据。 有 6 例患者 (6%) 由于失访 (n=4)
或在评估期前进行了子宫切除术 (n=2) 而未能完成 6
个月时的 PBLAC。 其余 11 名无 6 个月 PBLAC
35
Page 36

评分的患者 (10%)
由于在其他月经出血评估中提供了充分信息,因此能够确
定其在该终点的成功率。
2-效果:意向治疗人群中月经出血的治疗成功率
表
肿物症状
与与基基线线相相比比的的减减少少值值 ((%%)
≥ 50%
30-49%
0-29%
< 0%
失访
随访满 6 个月前进行子宫切除术
采用子宫肌瘤特异症状问卷来评估与子宫肌瘤相关的三种
症状的变化盆腔疼痛、盆腔不适及泌尿功能障碍。
治疗成功被定义为有中度或严重症状的受试者出现中度或
显着的改善,和/或无症状或有轻微症状的受试者病情无恶
化。 107 名患者中有 94 名 (88%) 于治疗 6
个月后均完成了肿物症状问卷。 6 个月时有 13
名患者的症状数据缺失,无论其理由为何,均计为失败。
表 3 表明大多数 UFE
患者的全部三项肌瘤相关症状均达到研究的成功标准。
通常在治疗后 3 个月实现治疗成功。 6 个月时,有 84%
的女性达到了至少一项肿物症状的成功标准。
表 3-效果:意向治疗人群中肿物症状的治疗成功率
生活质量
盆腔疼痛
盆腔不适
泌尿功能障碍
采用 SF-12
健康状况调查问卷来评估患者治疗后的一般身体状况和心
理健康状况的变化。 该终点的目标是证明 6
个月评估时总体生活质量的改善程度至少达到中等。UFE
组治疗前生理和心理部分的平均得分分别是 44.4 ± 8.5 和
45.1 ±
11.9,略微优于目前已公布的美国一般女性人群标准化得
分的第 25 百分位数 (44.32)。 6 个月时,UFE
组生理和心理问卷的平均得分分别显著增加至 52.2 ± 6.7
和 52.4 ± 8.8,达到标准化 SF-12 得分的第 50
百分位数(52.76,两项指标 p 均 <0.001)。
6 个月
)
N/107 (%)
69 (65%)
15 (14%)
7 (7%)
10 (9%)
4 (4%)
2 (2%)
6 个月
N/107 (%)
83 (78%)
80 (75%)
75 (71%)
次要疗效终点
肌瘤和子宫体积
FE 患者在基线和随访时接受 MRI 或超声子宫成像。
U
子宫和肌瘤体按扁长椭球体体积公式计算
(长×宽×高×0.52)。 3 个月评估时,UFE
组记录的子宫体积(测量包括宫颈部分)和肌瘤体积均有
显著下降,到 6
个月时仍有进一步改善(两个时间段与基线相比 p 均
<0.001)。 表 4 总结了治疗后 6
个月时子宫和肌瘤体积的百分比变化。 此表包含了 108 名
UFE 二期患者中 91 名患者 (84%) 的子宫体积数据以及
83 名患者 (77%)
的肌瘤体积数据,这些患者在基线时以及 UFE 治疗后 3
个月和 6
个月均接受了完整的影像学评估报告。六个月评估时,其
中 11 名患者 (12%) 子宫体积增大,8 名患者 (8%)
的肌瘤体积增大。
表 4-与基线比较的子宫和子宫肌瘤体积百分比变化
百分比变化值为正数表明体积减小,负数则表明体积增大。
66 个个月月时时的的体
子宫体积(毫升)
N
平均值(标准差)
范围
肌瘤体积
N
平均值(标准差)
范围
积积减减少少 ((%%)
91
33.2% (30.5%)
-93.6% 至 82.0%
83
50.9% (41.7%)
-173.4% 至 99.7%
患者满意度
两受试组在 3 个月和 6
个月时对手术结果均表示高度满意。 100 名 UFE
患者中的 92 名 (92%) 以及 47
名接受子宫切除术患者中的 46 名 (98%) 在 6
个月时完成了患者满意度调查问卷,表示对手术结果稍微
、中度或非常满意,两组大部分患者均表示非常满意。
不良事件:
研究收集了一期和二期接受 UFE 治疗的 132
例患者报告的所有不良事件数据。
本次研究未报告非预期的装置不良反应或非预期的不良事
件。 表 5 中所列为 132 名 UFE 患者中的 37 名 (28%)
发生的 51
例被判定为与手术“可能”或“非常可能”相关的不良事
件。 在这 51 例事件中,7 例 (14%) 发生于 UFE
手术过程中,5 例 (10%) 发生于手术后出院前,17 例
(33%) 发生于出院后至术后 1 个月内,11 例 (22%)
发生于术后 1 到 3 个月之间,4 例 (8%) 发生于术后 3 到
6 个月之间,还有 7 例 (14%) 发生于术后 6 个月以后。
最常见的不良事件是过敏反应或皮疹,在 132
36
体
)
Page 37

例患者中出现 8 例
STERILIZE
2
STERILIZE
2
STERILIZE
2
2
2
STERILIZE
2
2
STERILIZE
2
2
STERILE
(6%),主治医生通常判断该不良事件与术中所用的药物或
造影剂有关。 所有不良反应均自发缓解或经治疗后缓解。
4 例患者在 UFE 后进行了子宫切除,总体子宫切除率为
%。 一例患者在 UFE 后 2
3
月因持续发热/可能感染而接受了子宫切除术。 其他 3
个
名患者因不满意 UFE 结果而行择期子宫切除术,分别于
UFE 术后 2、10 和 11 个月进行。 1 例 (<1%)
因发现子宫动脉通畅而再次行 UFE。
表 5-可能或非常可能与 UFE
相关的不良事件发生时间和类型
*参与研究的 132 名患者中共有 34 名 (26%)
经历了一次或多次不良事件。
本列患者人数表明部分患者出现了一次以上的不良事件。
参考文献:
UFE 的特定事项
1. Spies J et al., Initial experience with use of trisacryl gelatin microspheres for uterine artery
embolization for leiomyomata, J Vasc Interv Radiol,
12:1059-1063, 2001.
2. Spies J et al., Complications after uterine artery
embolization for leiomyomas. Obstet Gynecol,
100:873-80, 2002.
3. Goldberg J, Pereira L, and Berghella V: Pregnancy
After Uterine Artery Embolization. Obstet Gynecol,
100(5):869-872, 2002.
4. Scialli A: Alternatives to hysterectomy for benign
conditions. Int J Fert & Women's Med, 43(4):186-91,
1998.
5. Nikolic B, Spies JB, Campbell L, et al.: Uterine
artery embolization: reduced radiation with refined
technique. J Vasc Interv Radiol, 12(1):39-44, Jan 2001.
6. Worthington-Kirsch R, G Popky, F Hutchins:
Uterine arterial embolization for the management of
leiomyomas: Quality-of-life assessment and clinical
response. Radiol, 208: 625-629, 1998.
7. Pelage JP, Le Dref O, Soyer P, et al.: Fibroid-related
menorrhagia: Treatment with superselective
embolization of the uterine arteries and mid-term
follow-up. Radiology, 215(2):428-431. May 2000.
所有适用范围
. Bendszus M, Klein R, Burger R, et al.: Efficacy of
1
trisacryl gelatin microspheres versus polyvinyl alcohol
particles in the preoperative embolization of
meningiomas. AJNR, 21(2): 255-61, Feb 2000.
2. Deveikis JP: Endovascular therapy of intracranial
arteriovenous malformations: materials and
techniques. Neuroimaging Clin of N Am, 8(2):401424, 1998.
3. Frizzel RT, Fisher WS: Cure, morbidity, and
mortality associated with embolization of brain
arteriovenous malformations: A review of 1246
patients in 32 series over a 35-year period.
Neurosurg, 37(6):1031-1040, Dec 1995.
4. Gomes, A: Embolization therapy of congenital
arteriovenous malformations: Use of alternative
approaches. Radiology, 190:191-8, Jan 1994.
5. Terada, T; Kinoshita, Y; Yokote, H; Tsuura, M;
Itakura, T; Komai, N; Nakamura, Y; Tanaka, S;
Kuriyama, T: Preoperative embolization of
meningiomas fed by ophthalmic branch arteries. Surg
Neurol, 45:161-6, 1996.
包装上的信息:
符号 标识
制造商:名称及地址
使用年限:年-月
LOT
批次代码
REF
目录编号
请勿再次灭菌
包装破损时请勿使用
避光保存
保持干燥
请勿重复使用
注意 - 请参阅使用说明
无热原
使用蒸汽灭菌
温度下限
0°C
37
Page 38

美国经销商:
Merit Medical Systems, Inc.
客户服务 1-800-356-3748
利信息
专
781-681-7900
US 5,635,215和其他已授权和申请中的专利。
Embosphere 微球是 BioSphere Medical 的注册商标。
有效期: 36个月;
储存条件: 室温,通风,干燥,避光;
运输条件:运输过程中,避免接触高温潮湿;
注册证号: TBD
标准号:TBD
售后服务单位名称:
麦瑞通医疗器械(北京)有限公司
售后服务单位地址:北京市朝阳区光华路 5 号院 1
号楼 6 层 602 号
售后服务电话:010-8587 5188
售后服务传真:010-8587 5198
38
Page 39

39
Page 40

Biosphere Medical, S.A.
Parc des Nations - Paris Nord 2
383 rue de la Belle Etoile
95700 Roissy en France
France
 Loading...
Loading...