Page 1
!USA
The VERTE-STACK® Spinal System is intended for vertebral body replacement to aid in the surgical correction and stabilization of the spine. This system is indicated for single and
The VERTE-STACK® device consists of hemi-cylindrical center cages of various lengths and diameters, as well as hemi-cylindrical add on cages of various lengths, diameters and angulation.
The assembled VERTE-STACK® device consists of three components (one hollow center cage, and two hollow add-on cages). The VERTE-STACK® components can be rigidly locked into
The design of the VERTE-STACK® device includes a variety of stackable components of different sizes and heights. The stackable components are designed to suit the individual
The VERTE-STACK® device may be used individually, or two or more may be stacked together in order to accommodate the individual anatomical requirements of the vertebral space
The VERTE-STACK® Spinal System implant components are made of medical grade PEEK-OPTIMA LT1 along with a marker made from either Tantalum or titanium. Alternatively,
VERTE-STACK® Spinal System may be manufactured from titanium alloy. No warranties, express or implied, are made. Implied warranties of merchantability and fitness for a par ticular
Le système de fixation rachidienne VERTE-STACK® doit être utilisé avec des appareillages rachidiens antérieurs et/ou postérieurs supplémentaires pour augmenter
la stabilité. Les éléments VERTE-STACK® fabriqués à partir de PEEK peuvent être utilisés avec des dispositifs de fixation supplémentaires en acier inoxydable ou en
titane. Les éléments VERTE-STACK® en titane ne peuvent pas être utilisés avec des dispositifs de fixation supplémentaires en acier inoxydable. Un des systèmes de
fixation rachidienne Medtronic suivants ou leurs successeurs doivent être utilisés avec le système de fixation rachidienne VERTE-STACK®.
Système de fixation rachidienne antérieure ZPLATE II™ √
Système de fixation rachidienne DYNA-LOK CLASSIC® √ √
Système de fixation rachidienne antérieure VANTAGE™ √
Système de fixation rachidienne TSRH® √ √
Système de fixation rachidienne CD HORIZON® √ √
Ne pas utiliser les composants d’implants de tout autre fabricant avec les composants du système de fixation rachidienne VERTE-STACK®. Les implants en acier inoxydable et en titane
ne sont pas compatibles entre eux. Ils ne doivent pas être utilisés ensemble dans un système. Comme pour tout implant orthopédique, il ne faut en aucun cas réutiliser ces implants.
INDICATIONS
Le système de fixation rachidienne VERTE-STACK® est un dispositif de remplacement du corps vertébral prévu pour usage dans le rachis thoracique lombaire (T1-L5) afin de remplacer
un corps vertébral tassé, endommagé ou instable suite à une tumeur ou un traumatisme (p. ex. fracture). Le système de fixation rachidienne VERTE-STACK® doit être utilisé avec une
fixation supplémentaire. En particulier, le dispositif VERTE-STACK® doit être utilisé avec le système de fixation rachidienne antérieure ZPLATE II™, le système de fixation rachidienne
DYNA-LOK CLASSIC®, le système de fixation rachidienne antérieure VANTAGE™, le système de fixation rachidienne TSRH®, le système de fixation rachidienne CD HORIZON® et/ou le
système de fixation rachidienne GDLH®, tous de Medtronic. En outre, le dispositif VERTE-STACK® est conçu pour être utilisé avec les greffes osseuses.
CONTREINDICATIONS
Le dispositif VERTE-STACK® n’est pas prévu pour être utilisé pour implantation chirurgicale postérieure ou cervicale.
Les contre-indications comprennent entre autres :
• Infection localisée au site chirurgical.
• Signes d’inflammation locale.
• Fièvre ou leucocytose.
• Obésité morbide.
• Grossesse.
• Maladie mentale.
• Tout autre état médical ou chirurgical qui entraverait les bénéfices potentiels de la chirurgie d’implants rachidiens, comme l’existence d’anomalies congénitales ou de tumeurs,
une augmentation de la vitesse de sédimentation qui n’est pas du fait d’autres maladies, une augmentation de la leucocytose ou une déviation vers la gauche de la formule
leucocytaire.
• Allergie ou intolérance documentée ou soupçonnée aux métaux.
• Tout cas nécessitant le mélange de métaux à partir de différents composants.
• Tout patient qui présente une couverture tissulaire insuffisante du site chirurgical ou une réserve osseuse insuffisante ou de qualité insuffisante, ou une définition anatomique
inadéquate.
• Tout cas non décrit dans les indications.
• Tout patient ne souhaitant pas suivre les instructions postopératoires.
• Ces dispositifs ne doivent pas être utilisés dans les cas pédiatriques, ni chez les patients qui n’ont pas encore atteint leur maturité squelettique.
Les contre-indications de cet appareil s’appliquent aussi aux autres systèmes vertébraux.
N.B. : bien qu’il ne s’agisse pas de contre-indications absolues, les états pathologiques que l’on doit envisager comme facteurs potentiels de non utilisation de
ce dispositif comprennent :
• Résorption osseuse grave.
• Ostéomalacie
• Ostéoporose grave.
ÉVÉNEMENTS INDÉSIRABLES POSSIBLES
Tous les événements indésirables éventuels ou complications associés à la fusion rachidienne sans appareillage sont possibles. Avec appareillage, la liste des événements indésirables
éventuels inclut, tout en ne s’y limitant pas :
• Le relâchement précoce ou tardif des composants.
• La migration de l’implant.
• Le descellement, une torsion et/ou une rupture de l’un ou de tous les composants du système.
• Une réaction (allergique) à un corps étranger dirigée contre les implants, les débris ou les produits de corrosion comprenant une métallose, la formation de taches, une tumeur
et/ou une maladie auto-immune.
• Une infection.
• Une déchirure de la dure-mère, une pseudoméningocèle, une fistule, une fuite persistante de liquide céphalo-rachidien et/ou méningite.
• Des lésions tissulaires ou nerveuses, une irritation et/ou une douleur provoquées par un mauvais positionnement et une mauvaise mise en place des implants ou des instruments.
• La perte de la fonction neurologique, y compris une paralysie (totale ou partielle), dysesthésie, hyperesthésie, anesthésie, paresthésie, apparition d’une radiculopathie et/ou
apparition ou persistance de douleurs, engourdissements, neuromes, fourmillements, pertes sensorielles et/ou spasmes.
• Un syndrome de la queue de cheval, une neuropathie, des déficits neurologiques (passagers ou permanents), une paraplégie, une paraparésie, une perte des réflexes, une
!USA
!USA
0381152E Rev. A
VERTE-STACK® Spinal System
0381152
IMPORTANT INFORMATION ON THE VERTESTACK® SPINAL SYSTEM
INFORMATIONS IMPORTANTES SUR LE SYSTÈME DE FIXATION RACHIDIENNE VERTESTACK®
INFORMACIÓN IMPORTANTE SOBRE EL SISTEMA VERTEBRAL VERTESTACK®
WICHTIGE INFORMATIONEN ZUM VERTESTACK®SPINALSYSTEM
INFORMAZIONI IMPORTANTI SUL SISTEMA SPINALE VERTESTACK®
BELANGRIJKE INFORMATIE OVER HET VERTESTACK®RUGGENGRAATSYSTEEM
VIGTIGE OPLYSNINGER OM VERTESTACK® SPINAL SYSTEM SPINALSYSTEM
VIKTIG INFORMATION OM VERTESTACK®SPINALSYSTEM
VIKTIG INFORMASJON OM VERTESTACK® SPINALSYSTEM
TÄRKEÄÄ TIETOA VERTESTACK®SPINAALIJÄRJESTELMÄSTÄ
ΣΗΜΑΝΤΙΚΕΣ ΠΛΗΡΟΦΟΡΙΕΣ ΓΙΑ ΤΟ ΣΠΟΝΥΛΙΚΟ ΣΥΣΤΗΜΑ VERTESTACK® SPINAL SYSTEM
INFORMAÇÕES IMPORTANTES SOBRE O SISTEMA DA COLUNA VERTESTACK®
DŮLEŽITÉ INFORMACE O SPINÁLNÍM SYSTÉMU VERTESTACK®
TÄHTIS TEAVE SPINAALSÜSTEEMI VERTESTACK® KOHTA
FONTOS TUDNIVALÓK A VERTESTACK® GERINCRENDSZERREL KAPCSOLATBAN
SVARĪGA INFORMĀCIJA PAR VERTESTACK® MUGURKAULA FIKSĀCIJAS SISTĒMU
SVARBI INFORMACIJA APIE „VERTESTACK®“ STUBURO SISTEMĄ
WAŻNE INFORMACJE O SYSTEMIE KRĘGOSŁUPOWYM VERTESTACK® SPINAL SYSTEM
DÔLEŽITÉ INFORMÁCIE O SPINÁLNOM SYSTÉME VERTESTACK®
2014-04-30
AUSTRALIAN SPONSOR:
0123
ENGLISH
two-level use only in the thoracic and lumbar anterior spine.
DESCRIPTION
a variety of configurations, with each construct being tailor-made for the individual case.
patient pathology.
created by the corpectomy.
purpose or use are specifically excluded. See the MDT Catalog for further information about warranties and limitations of liability.
Medtronic Australasia Pty Ltd Medtronic Sofamor Danek USA, Inc. Medtronic B.V.
97 Waterloo Rd 1800 Pyramid Place Earl Bakkenstraat 10
North Ryde, NSW 2113 Memphis, TN 38132 6422 PJ Heerlen
Australia Telephone 800 933 2635 (In U.S.A.) The Netherlands
901 396 3133 (Outside U.S.A.) Tel: + 31 45 566 80 00
Fax 901 396 0356
IMPORTANT INFORMATION ON THE VERTESTACK® SPINAL SYSTEM
Rev. D
Page 2
!USA
The VERTE-STACK® device may be used individually, or two or more may be stacked together in order to accommodate the individual anatomical requirements of the vertebral space
created by the corpectomy.
The VERTE-STACK® Spinal System implant components are made of medical grade PEEK-OPTIMA LT1 along with a marker made from either Tantalum or titanium. Alternatively,
VERTE-STACK® Spinal System may be manufactured from titanium alloy. No warranties, express or implied, are made. Implied warranties of merchantability and fitness for a par ticular
purpose or use are specifically excluded. See the MDT Catalog for further information about warranties and limitations of liability.
The VERTE-STACK® Spinal System must be used with additional anterior and/or posterior spinal instrumentation to augment stability. VERTE-STACK® constructs
manufactured from PEEK may be used with stainless steel or titanium supplemental fixation devices. Titanium VERTE-STACK® constructs may not be used with
Do not use implant components from any other manufacturer with VERTE-STACK® Spinal System components. Stainless steel and titanium implants are not compatible with each other.
The VERTE-STACK® Spinal System is a vertebral body replacement device intended for use in the thoracolumbar spine (T1-L5) to replace a collapsed, damaged, or unstable vertebral
body due to tumor or trauma (i.e., fracture). The VERTE-STACK® Spinal System is to be used with supplemental fixation. Specifically, the VERTE-STACK® device is to be used with the
Medtronic ZPLATE II™ Anterior Fixation System, the DYNA-LOK CLASSIC® Spinal System, the VANTAGE™ Anterior Fixation System, the TSRH® Spinal System, the CD HORIZON® Spinal
Any medical or surgical condition which would preclude the potential benefit of spinal implant surgery, such as the presence of tumors or congenital abnormalities, elevation of
All of the possible adverse events or complications associated with spinal fusion surgery without instrumentation are possible. With instrumentation, a listing of possible adverse
Loss of neurologial function, including paralysis (complete or incomplete), dysesthesia, hyperesthesia, anesthesia, paraesthesia, appearance or radiculopathy, and/or the
• Une infection.
• Une déchirure de la dure-mère, une pseudoméningocèle, une fistule, une fuite persistante de liquide céphalo-rachidien et/ou méningite.
• Des lésions tissulaires ou nerveuses, une irritation et/ou une douleur provoquées par un mauvais positionnement et une mauvaise mise en place des implants ou des instruments.
• La perte de la fonction neurologique, y compris une paralysie (totale ou partielle), dysesthésie, hyperesthésie, anesthésie, paresthésie, apparition d’une radiculopathie et/ou
apparition ou persistance de douleurs, engourdissements, neuromes, fourmillements, pertes sensorielles et/ou spasmes.
• Un syndrome de la queue de cheval, une neuropathie, des déficits neurologiques (passagers ou permanents), une paraplégie, une paraparésie, une perte des réflexes, une
arachnoïdite et/ou une fonte musculaire.
• La formation de cicatrices susceptibles de provoquer une altération neurologique autour des nerfs et/ou des douleurs.
• Une rétention urinaire ou une perte du contrôle vésical ou d’autres types de troubles de l’appareil urinaire.
• Une perte osseuse ou une diminution de la densité osseuse, sûrement provoquée par l’effet de bouclier anti-contrainte.
• La régression du dispositif dans le ou les corps vertébraux.
• Des altérations postopératoires de la courbure du rachis, la perte et/ou la réduction de la correction ou de la hauteur.
• Un arrêt de la croissance éventuelle de la partie opérée du rachis. Perte de la mobilité du rachis ou de sa fonction. Une impossibilité d’effectuer des tâches quotidiennes.
• Une absence de consolidation osseuse (ou pseudarthrose), une consolidation retardée ou un cal vicieux.
• Une fracture, une microfracture, une résorption, une lésion, une pénétration et/ou une rétropulsion de tout élément osseux vertébral, de la greffe osseuse ou au site de prélèvement
de greffe osseuse à l’endroit, au-dessus et/ou au-dessous du niveau de l’intervention chirurgicale.
• Des complications au niveau du site de prélèvement de la greffe, notamment des douleurs, une fracture ou des difficultés de cicatrisation.
• Une hernie du nucleus pulposus, une rupture du disque ou une dégénérescence à l’endroit, au-dessus ou en dessous du niveau de l’intervention chirurgicale.
• Une occlusion intestinale, gastrite, iléus ou autres types de troubles du système gastro-intestinal.
• Une hémorragie, un hématome, une occlusion, un épanchement séreux, un œdème, une embolie, un accident vasculaire cérébral, une hémorragie, une phlébite, une lésion des
vaisseaux sanguins ou d’autres types d’affections du système cardiovasculaire. Une nécrose ou une déhiscence de la plaie.
• Une atteinte de l’appareil reproducteur, notamment la stérilité, la privation de la compagnie conjugale et un dysfonctionnement sexuel.
• Apparition de problèmes respiratoires, par exemple embolie pulmonaire, bronchite, pneumonie, etc.
• Une modification de l’état mental.
• Décès.
REMARQUE : une intervention supplémentaire peut être nécessaire pour corriger certains de ces événements indésirables possibles.
MISES EN GARDE ET PRÉCAUTIONS
Les cas chirurgicaux ne sont pas toujours couronnés de succès. Cela est vrai surtout dans le cas de la chirurgie rachidienne, où d’autres états du patient peuvent compromettre les résultats.
Ce dispositif n’est pas conçu pour être le seul moyen de support de la colonne vertébrale. Le dispositif VERTE-STACK® doit être associé à un appareillage antérieur ou postérieur
supplémentaire afin d’augmenter la stabilité. L’utilisation de ce produit sans un greffon osseux peut être inefficace. Aucun implant rachidien ne peut supporter le poids du corps
sans soutien osseux. Dans ce cas, une torsion, un desserrement, un descellement et/ou une rupture du ou des dispositifs pourraient se produire.
Les procédures préopératoires et peropératoires, y compris la connaissance des techniques chirurgicales, une sélection et une mise en place correctes des implants, ainsi qu’une bonne
réduction sont des éléments importants à prendre en compte dans la réussite de la procédure chirurgicale. La mise en place et les réglages de position des implants ne doivent être
réalisés qu’avec un appareillage et des instruments spéciaux conçus exclusivement pour ces dispositifs.Ils ne doivent pas être réalisés avec un appareillage différent, sauf si expressément
recommandé par Medtronic, car cette combinaison pourrait se révéler incompatible et ne pas être garantie.
Les pièces assemblées présentent un réglage de longueur in situ. Les informations ci-dessous s’appliquent au dispositif de fixation supplémentaire utilisé avec le dispositif VERTE-STACK®
: des fiches à autorupture sont fournies pour la fixation des plaques sur les cylindres. Le réglage final du couple est déterminé par la rupture du boulon. Les vis doivent être serrées et
cassées in situ après le placement final du dispositif. La partie cassée ne doit pas rester à l’intérieur du patient. Le système de fixation interne ne peut en aucun cas être réutilisé.
Même si un dispositif retiré du corps d’un patient semble intact, il peut présenter de petits défauts et des contraintes internes susceptibles de provoquer une rupture prématurée. Un
taraudage abîmé peut réduire la stabilité de l’appareillage.
En outre, une sélection rigoureuse des patients, ainsi que leur respect des instructions, auront des conséquences importantes sur les résultats. Une augmentation de l’incidence
d’absence de consolidation osseuse a été démontrée chez les fumeurs. Ces patients doivent être informés et avertis de ce risque. Les patients obèses, souffrant de malnutrition et/ou
alcooliques ne doivent pas être soumis à la fusion vertébrale.
Ne pas réutiliser ou retraiter les dispositifs indiqués comme étant à usage unique. Le réemploi ou le retraitement de dispositifs à usage unique peut compromettre l’intégrité de structure
et le fonctionnement prévu de ces dispositifs, ce qui pourrait causer des lésions au patient.
REMARQUE À L’INTENTION DU MÉDECIN : bien que le médecin soit un professionnel informé et l’intermédiaire entre la société et le patient, les informations médicales importantes
contenues dans ce document doivent être transmises au patient.
!USA
Ne s’applique qu’aux États-Unis
ATTENTION : la loi fédérale (États-Unis) restreint la vente de ces dispositifs par un médecin ou sur prescription d’un médecin.
CHOIX DE L’IMPLANT
Le choix de la taille, de la forme et du type d’implant qui convient est essentiel au succès de la procédure chez chaque patient. Les implants chirurgicaux en plastique polymère sont
soumis à des contraintes répétées pendant leur utilisation ; leur résistance est limitée par le besoin d’adapter la conception à la taille et à la forme des os humains. Si le plus grand soin
n’est pas pris dans la sélection des patients, la mise en place de l’implant et la prise en charge postopératoire pour minimiser les contraintes sur l’implant, ces dernières provoqueront
une fatigue du métal et par conséquent, une fracture, une torsion ou un desserrement du dispositif avant que le processus de guérison ne soit terminé. Cela peut avoir pour conséquence
des lésions supplémentaires ou forcer à retirer prématurément le dispositif.
EN PRÉOPÉRATOIRE
• Seuls les patients qui répondent aux critères décrits dans les indications doivent être sélectionnés.
• Les pathologies et/ou les prédispositions chez le patient, telles que celles abordées dans les contre-indications ci-dessus, doivent être évitées.
• Le plus grand soin est de rigueur lors de la manipulation et de la conservation des éléments implantables. Les implants ne doivent être ni rayés, ni endommagés. Les implants et
les instruments doivent être protégés au cours du stockage, en particulier contre les environnements corrosifs.
• Des renseignements complémentaires sur l’utilisation du système sont disponibles sur demande.
• Dans la mesure où des éléments mécaniques sont en cause, le chirurgien doit bien connaître les différents composants du système avant d’utiliser le matériel, et doit monter les
dispositifs personnellement pour s’assurer que toutes les pièces et tous les instruments nécessaires sont présents avant le début de l’intervention.
• Le type de système à assembler pour le cas doit être déterminé avant le début de l’intervention chirurgicale. Un inventaire adapté des tailles d’implants doit être disponible au
moment de l’intervention, y compris les tailles supérieures et inférieures à ce qui doit être normalement utilisé.
• Lorsque les cages d’appoint sont connectées à la cage centrale, elle ne peuvent pas être déconnectées. Si les composants sont déconnectés, tous les composants sont potentiellement
compromis et le dispositif ne doit pas être utilisé.
• À moins qu’ils n’aient été fournis sous emballage stérile, tous les éléments doivent être nettoyés et stérilisés avant usage. Il est essentiel de disposer de composants stériles
supplémentaires en cas de besoin inattendu.
!USA
!USA
!USA
stainless steel supplemental fixation devices. One of the following Medtronic spinal systems or their successors must be used with the VERTE-STACK® Spinal System.
Anterior Posterior
ZPLATE II™ Anterior Fixation System √
DYNA-LOK CLASSIC® Spinal System √ √
VANTAGE™ Anterior Fixation System √
TSRH® Spinal System √ √
CD HORIZON® Spinal System √ √
They must not be used together in a construct. As with all orthopedic implants, in no case may the implants be re-used.
INDICATIONS
System and/or the GDLH® Spinal System. Additionally, the VERTE-STACK® device is intended to be used with bone graft.
CONTRAINDICATIONS
The VERTE-STACK® device is not intended for cervical nor posterior surgical implantation.
Contraindications include, but are not limited to:
• Infection, local to the operative site.
• Signs of local inflammation.
• Fever or leukocytosis.
• Morbid obesity.
• Pregnancy.
• Mental illness.
•
sedimentation rate unexplained by other diseases, elevation of white blood count (WBC), or a marked left shift in the WBC differential count.
• Suspected or documented metal allergy or intolerance.
• Any case needing to mix metals from different components.
• Any patient having inadequate tissue coverage over the operative site or where there is inadequate bone stock, bone quality, or anatomical definition.
• Any case not described in the indications.
• Any patient unwilling to co-operate with postoperative instructions.
• These devices must not be used for pediatric cases, nor where the patient still has general skeletal growth.
Contraindications of this device are consistent with those of other spinal systems.
NOTA BENE: Although not absolute contraindications, conditions to be considered as potential factors for not using this device include:
• Severe bone resorption.
• Osteomalacia
• Severe osteoporosis.
POSSIBLE ADVERSE EVENTS
events or complications includes, but is not limited to:
• Early or late loosening of the components.
• Implant migration.
• Disassembly, bending, and/or breakage of any or all of the components.
• Foreign body (allergic) reaction to the implants, debris, corrosion products, including metallosis, staining, tumor formation and/or autoimmune disease.
• Infection.
• Dural tears, pseudomeningocele, fistula, persistent CSF leakage, meningitis.
• Tissue or nerve damage, irrigation, and/or pain caused by improper positioning and placement of implants or instruments.
•
development or continuation of pain, numbness, neuroma, tingling sensation, sensory loss and/or spasms.
• Cauda equina syndrome, neuropathy, neurological deficits (transient or permanent), paraplegia, paraparesis, reflex deficits, arachnoiditis, and/or muscle loss.
• Scar formation possibly causing neurological compromise around nerves and/or pain.
• Urinary retention or loss of bladder control or other types of urological system compromise.
• Bone loss or decrease in bone density, possibly caused by stress shielding.
• Subsidence of the device into vertebral body(ies).
• Postoperative change in spinal curvature, loss of correction, height, and/or reduction.
• Cessation of any potential growth of the operated portion of the spine. Loss of spinal mobility or function. Inability to perform the activities of daily living.
• Non-union (or pseudarthrosis), delayed union, or mal-union.
Page 3

!USA
• Cauda equina syndrome, neuropathy, neurological deficits (transient or permanent), paraplegia, paraparesis, reflex deficits, arachnoiditis, and/or muscle loss.
• Scar formation possibly causing neurological compromise around nerves and/or pain.
• Urinary retention or loss of bladder control or other types of urological system compromise.
• Bone loss or decrease in bone density, possibly caused by stress shielding.
• Subsidence of the device into vertebral body(ies).
• Postoperative change in spinal curvature, loss of correction, height, and/or reduction.
• Cessation of any potential growth of the operated portion of the spine. Loss of spinal mobility or function. Inability to perform the activities of daily living.
• Non-union (or pseudarthrosis), delayed union, or mal-union.
• Fracture, microfracture, resorption, damage, penetration, and/or retropulsion of any spinal bone, of the bone graft, or at the bone graft harvest site at, above, and/or below the
Hemorrhage, hematoma, occlusion, seroma, edema, embolism, stroke, excessive bleeding, phlebitis, damage to blood vessels, or cardiovascular system compromise. Wound
A successful result is not always achieved in every surgical case. This fact is especially true in spinal surgery where other patient conditions may compromise the results. This device
The VERTE-STACK® device must be used with additional anterior or posterior instrumentation to augment
y. Use of this product without a bone graft may not be successful. No spinal implant can withstand body loads without the support of bone. In this event, bending, loosening,
Preoperative and operating procedures, including knowledge of surgical techniques, proper selection and placement of the implant and good reduction are impor tant considerations in
the success of surgery. Installation and positional adjustment of implants must only be done with special equipment and instruments specific to these devices. They must not be used
length adjustment. The following information applies to the supplemental fixation device used in conjunction with the VERTE-STACK® device: Self-
Further, the proper selection and compliance of the patient will greatly affect the results. Patients who smoke have been shown to have an increased incidence of non-unions. These
Do not re-use or re-process devices labeled as single use devices. Re-use or re-processing of single use devices may compromise the structural integrity and the intended function of
Although the physician is the learned intermediary between the company and the patient, the important medical information given in this document should
!USA
The selection of the proper size, shape and design of the implant for each patient is crucial to the success of the procedure. Plastic polymer implants are subject to repeated stresses in
use, and their strength is limited by the need to adapt the design to the size and shape of human bones. Unless great care is taken in patient selection, proper placement of the implant,
and postoperative management to minimize stresses on the implant, such stresses may cause metal fatigue and consequent breakage, bending, or loosening of the device before the
Care should be used in the handling and storage of the implant components. The implants should not be scratched or damaged. Implants and instruments should be protected
Since mechanical parts are involved, the surgeon should be familiar with the various components before using the equipment and should personally assemble the devices to
The type of construct to be assembled for the case should be determined prior to beginning the surgery. An adequate inventory of implant sizes should be available at the time
Once the add-on cages are connected to the center cage, they should not be disconnected. If the components are disconnected, all components are potentially compromised and
To ensure proper fusion below and around the location of the instrumentation, a bone graft should be used. Bone graft must be placed in the area to be fused and graft material
Bone cement should not be used since this material will make removal of the components difficult or impossible. The heat generated from the curing process may also cause
!USA
dispositifs personnellement pour s’assurer que toutes les pièces et tous les instruments nécessaires sont présents avant le début de l’intervention.
• Le type de système à assembler pour le cas doit être déterminé avant le début de l’intervention chirurgicale. Un inventaire adapté des tailles d’implants doit être disponible au
moment de l’intervention, y compris les tailles supérieures et inférieures à ce qui doit être normalement utilisé.
• Lorsque les cages d’appoint sont connectées à la cage centrale, elle ne peuvent pas être déconnectées. Si les composants sont déconnectés, tous les composants sont potentiellement
compromis et le dispositif ne doit pas être utilisé.
• À moins qu’ils n’aient été fournis sous emballage stérile, tous les éléments doivent être nettoyés et stérilisés avant usage. Il est essentiel de disposer de composants stériles
supplémentaires en cas de besoin inattendu.
EN COURS D’INTERVENTION
• Les consignes présentes dans tout manuel de technique chirurgicale en vigueur doivent être scrupuleusement suivies.
• User d’extrême prudence en permanence autour de la moelle épinière et des racines nerveuses. Une lésion des nerfs entraînera la perte des fonctions neurologiques.
• La rupture, un dérapage ou le mauvais emploi d’instruments ou de composants de l’implant peuvent entraîner des lésions chez le patient ou parmi le personnel du bloc opératoire.
• Pour assurer une bonne fusion en dessous et autour de l’emplacement de l’appareillage, il faut utiliser une greffe osseuse. La greffe osseuse doit être placée dans la zone à fusionner
et le matériau de greffe doit s’étendre de la vertèbre supérieure à la vertèbre inférieure que l’on veut fusionner. Les greffons d’os autogène doivent être utilisés avec le dispositif
VERTE-STACK®.
• Le ciment osseux ne peut être utilisé car ce matériau rend difficile, voire impossible, le retrait des composants. La chaleur générée par le processus de guérison peut également
provoquer des lésions neurologiques et une nécrose de l’os.
EN POSTOPÉRATOIRE
Les instructions et les mises en garde faites par le médecin au patient en postopératoire, ainsi que l’observance de ces directives par le patient, sont extrêmement importantes.
• Fournir au patient des instructions détaillées sur l’utilisation et les limites du dispositif. Si une mise en charge partielle est recommandée ou nécessaire avant la consolidation
complète de l’os, le patient doit être prévenu qu’une courbure, un desserrement ou une rupture des dispositifs sont des complications pouvant survenir du fait du port d’un poids
ou d’une activité musculaire excessifs. Le risque de courbure, de desserrement ou de rupture d’un dispositif de fixation interne provisoire au cours de la rééducation postopératoire
peut augmenter si le patient est actif, s’il est affaibli, s’il est atteint de démence ou encore s’il n’utilise pas de béquilles ou d’autres dispositifs orthotiques. Avertir le patient d’éviter
toute chute ou secousse brutales sur le rachis.
• Pour que le résultat chirurgical ait le plus de chances de réussite possible, le patient ou le dispositif ne doivent pas être exposés à des vibrations ou à un choc mécanique qui
pourraient desserrer le montage. Il faut avertir le patient de ce risque et l’inviter à limiter et à restreindre son activité physique, notamment les mouvements de levage et de
torsion, ainsi que toute pratique sportive. Le patient doit être informé de ne pas fumer ni de consommer d’alcool en excès en cours de la consolidation du greffon osseux.
• Le patient doit être informé de son incapacité à se pencher ou à se tourner à l’endroit de la fusion rachidienne ; il faut lui apprendre à compenser cette restriction physique
permanente des mouvements du corps.
• Si l’on ne parvient pas à immobiliser une consolidation retardée ou l’absence de consolidation, cela provoquera des contraintes excessives et répétées sur l’implant. Du fait du
mécanisme de fatigue, ces contraintes sont susceptibles d’entraîner une torsion, un desserrement ou la rupture du dispositif. Il faut obligatoirement s’assurer de l’immobilisation
du site opératoire du rachis, jusqu’à ce qu’une consolidation osseuse solide soit établie et confirmée par un examen radiologique. Si l’absence de consolidation perdure ou si les
composants se desserrent, se déforment et/ou se cassent, le ou les dispositifs doivent être contrôlés et/ou immédiatement retirés avant qu’une lésion grave ne se produise.
• Tous les dispositifs retirés doivent être traités de telle sorte qu’ils ne puissent plus être réutilisés lors d’une autre procédure chirurgicale.
CONDITIONNEMENT
L’emballage de chaque composant doit être intact lors de sa réception. Si un système de prêt ou de dépôt est utilisé, vérifier soigneusement que tous les lots sont complets et que tous
les composants, en particulier les instruments, ont été soigneusement contrôlés, pour s’assurer qu’ils ne présentent aucun défaut avant leur utilisation. Les emballages ou produits
endommagés ne doivent pas être utilisés, mais renvoyés à MEDTRONIC. Retirer tout le matériel d’emballage avant la stérilisation. Seuls les implants et appareils stérilisés doivent être
utilisés en chirurgie. Toujours restériliser immédiatement tous les implants et appareils qui ont été utilisés dans la zone d’opération. Cette procédure doit être effectuée avant toute
manutention ou avant de renvoyer le produit à Medtronic.
NETTOYAGE ET DÉCONTAMINATION
Sauf s’ils viennent juste d’être retirés d’un emballage MEDTRONIC non ouvert, tous les instruments et implants doivent être démontés (s’il y a lieu) et nettoyés en utilisant des détergents
neutres avant leur stérilisation et leur introduction dans un champ chirurgical stérile ou (s’il y a lieu) renvoyés à MEDTRONIC. Le nettoyage et la désinfection des instruments peuvent
être réalisés avec des solvants exempts d’aldéhyde à des températures plus élevées. Le nettoyage et la décontamination doivent inclure l’emploi de détergents neutres, suivi d’un
rinçage à l’eau désionisée.
Remarque : ne pas utiliser de solutions de nettoyage contenant du formol, du glutaraldéhyde, de l’eau de Javel et/ou d’autres détergents alcalins, car ces produits peuvent endommager
certains dispositifs, notamment les instruments. Ces solutions ne doivent pas être utilisées. En outre, de nombreux instruments doivent être démontés avant leur nettoyage.
Tous les produits doivent être manipulés avec soin. Une mauvaise utilisation ou manipulation peut endommager le dispositif et/ou l’empêcher éventuellement de fonctionner correctement.
STÉRILISATION
Les composants du système de fixation rachidienne VERTE-STACK® peuvent être fournis sous conditionnement stérile ou non stérile. Sauf indication contraire, les implants des autres
systèmes de fixation rachidienne de Medtronic conçus spécifiquement pour usage avec le système de fixation rachidienne VERTE-STACK® et décrits dans la présente notice, sont
fournis sous conditionnement non stérile et doivent être stérilisés avant usage. Seuls des produits stériles doivent être placés dans le champ opératoire. Sauf indication contraire, il est
recommandé que l’hôpital stérilise ces produits à la vapeur, selon les ensembles de paramètres ci-dessous :
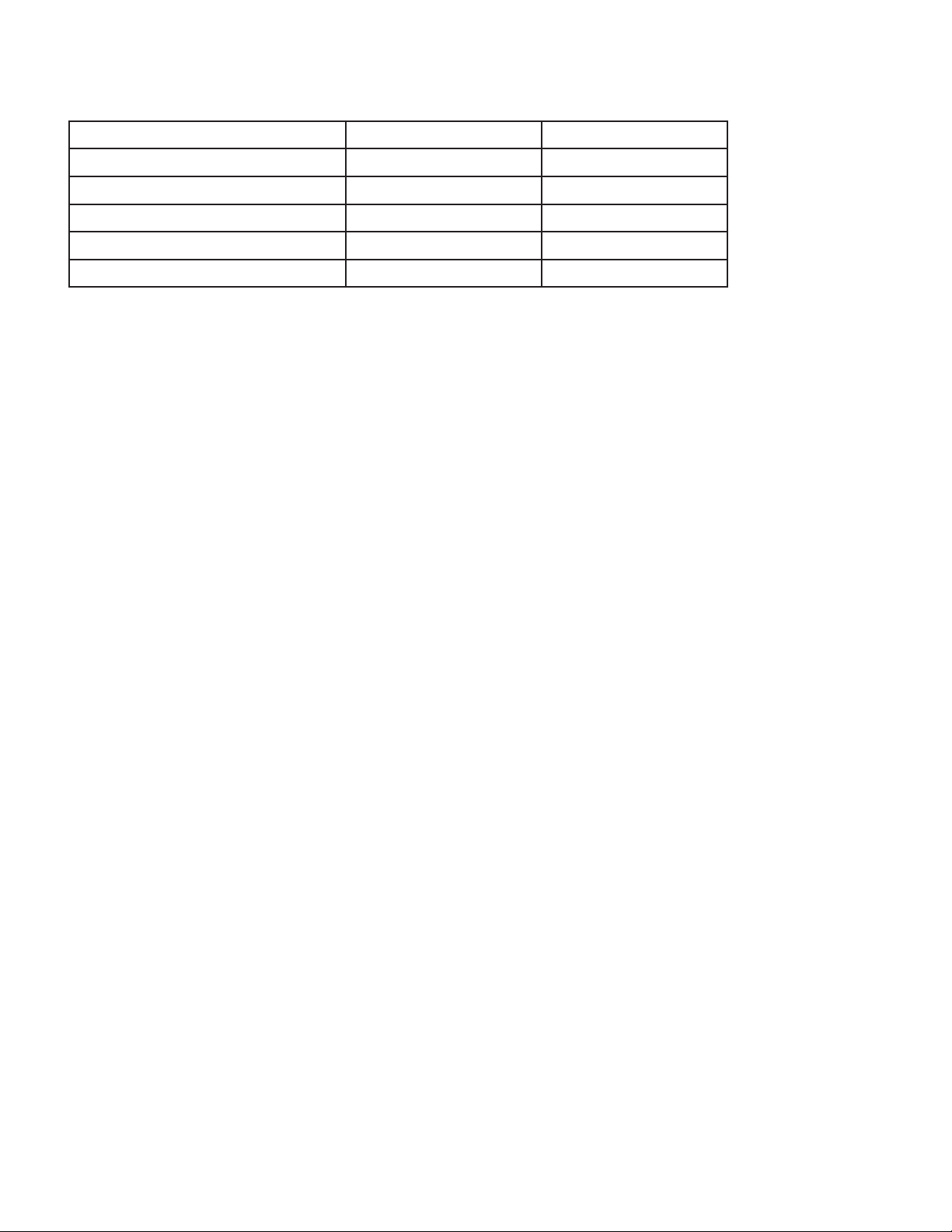
MÉTHODE CYCLE TEMPÉRATURE DURÉE D’EXPOSITION TEMPS DE SÉCHAGE
Vapeur Préaspiration 132 °C (270 °F) 4 minutes 30 minutes
Vapeur Sous pression 121 °C (250 °F) 60 minutes 30 minutes
Vapeur* Préaspiration* 134 °C (273 °F) 20 minutes* 30 minutes
Vapeur* Sous pression* 134 °C (273 °F) 20 minutes* 30 minutes
REMARQUE : en raison des nombreuses variables à prendre en compte au cours de la stérilisation, chaque établissement doit étalonner et vérifier la procédure de
stérilisation (par exemple, les températures et les durées) utilisée pour leur matériel. *En dehors des États-Unis, certaines autorités sanitaires non américaines
recommandent une stérilisation selon ces paramètres, afin de limiter le risque de transmission de la maladie de Creutzfeld-Jakob, en particulier pour les instruments
chirurgicaux qui pourraient entrer en contact avec le système nerveux central.
RÉCLAMATIONS SUR CE PRODUIT
Tout professionnel de la santé (par exemple, un client ou un utilisateur de ce système de produits) avec une réclamation ou un motif d’insatisfaction à formuler sur la qualité du produit,
son identité, sa durée de vie, sa fiabilité, sa sécurité d’emploi, son efficacité et/ou ses performances, doit le communiquer au distributeur ou à MEDTRONIC. En outre, dans l’éventualité
!USA
!USA
!USA
!USA
level of surgery.
• Graft donor site complications including pain, fracture, infection, or wound healing problems.
• Herniated nucleus pulposus, disc disruption or degeneration at, above, or below the level of surgery.
• Ileus, gastritis, bowel obstruction or other types of gastrointestinal system compromise.
•
necrosis or wound dehiscence.
• Reproductive system compromise, including sterility, loss of consortium, and sexual dysfunction.
• Development of respiratory problems (e.g., pulmonary embolism, atelectasis, bronchitis, pneumonia, etc.)
• Change in mental status.
• Death.
NOTE: Additional surgery may be necessary to correct some of these anticipated adverse events
WARNINGS AND PRECAUTIONS
system is not intended to be the sole means of spinal support.
stabilit
disassembly, and/or breakage of the device(s) will eventually occur.
with other instrumentation unless specifically recommended by Medtronic because the combination with other instrumentation may be incompatible, and may not be guaranteed.
The assembled parts have in situ
breaking plugs are provided for plate fixation to the cylinders. The final torque setting is determined by the rupture of the bolt. The screws should be tightened and broken off in situ
after the final placement of the device. The broken part should not remain in the patient. Never reuse an internal fixation device under any circumstances. Even when a removed
device appears undamaged, it may have small defects or internal stress patterns that may lead to early breakage. Damage of the thread will reduce the stability of the instrumentation.
patients should be advised of this fact and warned of this consequence. Obese, malnourished, and/or alcohol abuse patients are also poor candidates for spine fusion.
the device which could result in patient injury.
PHYSICIAN NOTE:
be conveyed to the patient.
CAUTION: FEDERAL LAW (USA) RESTRICTS THESE DEVICES TO SALE BY OR ON THE ORDER OF A PHYSICIAN.
For US Audiences Only
IMPLANT SELECTION
healing process is complete, which may result in further injury or the need to remove the device prematurely.
PREOPERATIVE
• Only patients that meet the criteria described in the indications should be selected.
• Patient conditions and/or predispositions such as those addressed in the aforementioned contraindications should be avoided.
•
during storage especially from corrosive environments.
• Further information on the use of this system will be made available on request.
•
verify that all parts and necessary instruments are present before the surgery begins.
•
of surgery, including sizes larger and smaller than those expected to be used.
•
the device should not be used.
• Unless sterile packaged, all parts should be cleaned and sterilized before use. Additional sterile components should be available in case of an unexpected need.
INTRAOPERATIVE
• The instructions in any available applicable surgical technique manual should be carefully followed.
• At all times, extreme caution should be used around the spinal cord and nerve roots. Damage to the nerves will cause loss of neurological functions.
• Breakage, slippage, or misuse of instruments or implant components may cause injury to the patient or operative personnel.
•
must extend from the upper to the lower vertebrae being fused. When using the VERTE-STACK® device, grafts containing autogenous bone should be used.
•
neurologic damage and bone necrosis.
POSTOPERATIVE
The physician’s postoperative directions and warnings to the patient and the corresponding patient compliance, are extremely important.
Page 4

!USA
!USA
!USA
the device should not be used.
• Unless sterile packaged, all parts should be cleaned and sterilized before use. Additional sterile components should be available in case of an unexpected need.
INTRAOPERATIVE
• The instructions in any available applicable surgical technique manual should be carefully followed.
• At all times, extreme caution should be used around the spinal cord and nerve roots. Damage to the nerves will cause loss of neurological functions.
• Breakage, slippage, or misuse of instruments or implant components may cause injury to the patient or operative personnel.
• To ensure proper fusion below and around the location of the instrumentation, a bone graft should be used. Bone graft must be placed in the area to be fused and graft material
must extend from the upper to the lower vertebrae being fused. When using the VERTE-STACK® device, grafts containing autogenous bone should be used.
• Bone cement should not be used since this material will make removal of the components difficult or impossible. The heat generated from the curing process may also cause
neurologic damage and bone necrosis.
POSTOPERATIVE
The physician’s postoperative directions and warnings to the patient and the corresponding patient compliance, are extremely important.
• Detailed instructions on the use and limitations of the device should be given to the patient. If partial weight bearing is recommended or required prior to firm bony union, the
patient must be warned that bending, loosening, or breakage of the device are complications which can occur as a result of excessive weight bearing or muscular activity. The
risk of bending, loosening, or breakage of a temporary internal fixation device during postoperative rehabilitation may be increased if the patient is active, or if the patient is
To allow the maximum chances for a successful surgical result, the patient or device should not be exposed to mechanical vibrations that may loosen the device construct. The
Failure to immobilize a delayed or non-union of bone will result in excessive and repeated stresses on the implant. By the mechanism of fatigue, these stresses can cause eventual
bending, loosening, or breakage of the device. It is important that immobilization of the union is established and confirmed by roentgenographic examination. Where there is a
Packages for each of the components should be intact upon receipt. If a loaner or consignment system is used, all sets should be carefully checked for completeness and all components
should be carefully checked for lack of damage prior to use. Damaged packages or products should not be used, and should be returned to Medtronic. Remove all packaging material
prior to sterilization. Only sterile implants and instruments should be used in surgery. Always immediately resterilize all implants and instruments, which have been previously in the
Unless just removed from an unopened MEDTRONIC package, all instruments and implants must be disassembled (if applicable) and cleaned using neutral cleaners before sterilization
and introduction into a sterile surgical field or (if applicable) return of the product to MEDTRONIC. Cleaning and disinfecting of instruments can be performed with aldehyde-free solvents
Note: certain cleaning solutions such as those containing formalin, glutaraldehyde, bleach and/or other alkaline cleaners may damage some devices, particularly instruments. These
VERTE-STACK® Spinal System components may be provided sterile or non-sterile. Unless marked otherwise, implants from other Medtronic spinal systems specifically indicated for use
be sterilized prior to use. Only sterile products should be placed in the operative field. Unless
NOTE: Because of the many variables involved in sterilization, each medical facility should c alibrate and verify the sterilization process (e.g. temperatures, times) used
for their equipment. *For outside the United States, some non-U.S. health care authorities recommend sterilization according to these parameters so as to minimize
Any health care professional (e.g., customer or user of this system of products), who has any complaints or who has experienced any dissatisfaction in the product quality, identity,
durability, reliability, safety, effectiveness, and/or performance should notify the distributor, Medtronic. Further, if any of the implanted spinal system component(s) ever “malfunctions”
(i.e., does not meet any of its performance specifications or otherwise does not perform as intended), or is suspected of doing so, the distributor should be notified immediately. If any
Medtronic product ever “malfunctions” and may have caused or contributed to the death or serious injury of a patient, the distributor should be notified immediately by telephone,
FAX, or written correspondence. When filing a complaint, please provide the component(s) name and number, lot number(s), your name and address, the nature of the complaint, and
Recommended directions for use of this system (surgical operative techniques) are available at no charge upon request. If further information is needed or required, please contact
!USA
Vapeur Sous pression 121 °C (250 °F) 60 minutes 30 minutes
Vapeur* Préaspiration* 134 °C (273 °F) 20 minutes* 30 minutes
Vapeur* Sous pression* 134 °C (273 °F) 20 minutes* 30 minutes
REMARQUE : en raison des nombreuses variables à prendre en compte au cours de la stérilisation, chaque établissement doit étalonner et vérifier la procédure de
stérilisation (par exemple, les températures et les durées) utilisée pour leur matériel. *En dehors des États-Unis, certaines autorités sanitaires non américaines
recommandent une stérilisation selon ces paramètres, afin de limiter le risque de transmission de la maladie de Creutzfeld-Jakob, en particulier pour les instruments
chirurgicaux qui pourraient entrer en contact avec le système nerveux central.
RÉCLAMATIONS SUR CE PRODUIT
Tout professionnel de la santé (par exemple, un client ou un utilisateur de ce système de produits) avec une réclamation ou un motif d’insatisfaction à formuler sur la qualité du produit,
son identité, sa durée de vie, sa fiabilité, sa sécurité d’emploi, son efficacité et/ou ses performances, doit le communiquer au distributeur ou à MEDTRONIC. En outre, dans l’éventualité
d’un « mauvais fonctionnement » d’un ou de plusieurs composants du système rachidien implanté (c.-à-d. lorsqu’un composant ne répond à aucune des caractéristiques relatives aux
performances ou ne fonctionne pas comme prévu), ou en cas de suspicion de mauvais fonctionnement, il y a lieu de le signaler immédiatement au distributeur. Si jamais un produit
MEDTRONIC « fonctionne mal » et peut avoir entraîné le décès du patient ou une lésion grave, ou y avoir contribué, le distributeur doit être immédiatement informé par téléphone, par
fax ou par courrier. Lors de toute réclamation, veuillez fournir le nom et le numéro du ou des composants, le ou les numéros du lot, vos nom et adresse, la nature de la réclamation et
indiquer si vous souhaitez un rapport écrit du distributeur.
SÉCURITÉ EN MATIÈRE DE RÉSONANCE MAGNÉTIQUE
Le système de fixation rachidienne VERTE-STACK® n’a pas été évalué en termes de sécurité, de chaleur, de migration ou de compatibilité dans un environnement de résonance magnétique.
INFORMATIONS COMPLÉMENTAIRES
Le mode d’emploi recommandé pour l’utilisation de ce système (techniques chirurgicales) est disponible gratuitement sur demande. Pour en savoir davantage, s’adresser à MEDTRONIC.
Protection assurée par un ou plusieurs brevets américains n° 5,772,661 ; 5,860,973 ; 5,888,222 ; 6,746,484 ; 6,758,862 ; 6,830,570 et d’autres demandes
de brevet en attente.
©2014 MEDTRONIC SOFAMOR DANEK USA, Inc. Tous droits réservés.
El sistema vertebral VERTE-STACK® está concebido para remplazar el cuerpo vertebral, para ayudar en la corrección y estabilización quirúrgica de la columna vertebral. Este sistema está
indicado para un único uso, y en dos niveles únicamente, en la columna dorsal y lumbar anterior.
DESCRIPCIÓN
El dispositivo VERTE-STACK® está formado por moldes centrales semicilíndricos de distintos diámetros y longitudes y por moldes adicionales semicilíndricos de distintos diámetros,
longitudes y ángulos. Cuando está montado, el dispositivo VERTE-STACK® consta de tres componentes (un molde central hueco y dos moldes adicionales huecos). Todos los componentes
del sistema VERTE-STACK® pueden fijarse con rigidez adoptando diversas configuraciones, adaptándose cada configuración a cada caso individual.
El diseño del dispositivo VERTE-STACK® incluye varios componentes apilables de distintos tamaños y alturas. Los componentes apilables se han diseñado para adaptarse a la patología
específica del paciente.
El dispositivo VERTE-STACK® puede utilizarse solo o apilado en número de dos o más con el fin de poder ajustarlo a los requisitos anatómicos individuales del espacio vertebral creado
mediante corpectomía.
Los componentes para implantes del sistema vertebral VERTE-STACK® están hechos de PEEK-OPTIMA LT1 de grado médico junto con un marcador de tantalio o titanio. Para la
fabricación del sistema vertebral VERTE-STACK® también puede utilizarse aleación de titanio. No se establece ninguna garantía, ni expresa ni implícita. Las garantías implícitas de
comercialización y de idoneidad para un propósito o uso determinado quedan específicamente excluidas. Consulte el catálogo de MDT para conocer más detalles sobre las garantías
y las limitaciones de responsabilidad.
El sistema vertebral VERTE-STACK® debe utilizarse junto con instrumental vertebral complementario anterior y/o posterior para aumentar su estabilidad. Las
estructuras del sistema VERTE-STACK® fabricadas con PEEK pueden utilizarse con dispositivos de fijación adicional de acero inoxidable o titanio. Las estructuras
del sistema VERTE-STACK® de titanio no deben utilizarse con dispositivos de fijación adicional de acero inoxidable. Junto con el sistema vertebral VERTE-STACK®
deberá utilizarse uno de los siguientes sistemas vertebrales de Medtronic o alguno de sus sucesores.
Sistema de fijación anterior ZPLATE II™ √
Sistema vertebral DYNA-LOK CLASSIC® √ √
Sistema de fijación anterior VANTAGE™ √
Sistema vertebral TSRH® √ √
Sistema vertebral CD HORIZON® √ √
No utilice componentes para implantes de ningún otro fabricante junto con los componentes del sistema vertebral VERTE-STACK®. Los implantes de acero inoxidable y los implantes de
titanio no son compatibles entre sí. No se deben utilizar de forma conjunta en la misma estructura. Al igual que todos los implantes ortopédicos, estos implantes no deben reutilizarse nunca.
INDICACIONES
El sistema vertebral VERTE-STACK® es un dispositivo de reemplazo del cuerpo vertebral pensado para ser utilizado en la columna toracolumbar (T1-L5) para remplazar un cuerpo vertebral
colapsado, dañado o inestable, debido a un tumor o a un traumatismo (p. ej. una fractura). El sistema vertebral VERTE-STACK® debe utilizarse con fijaciones complementarias. En concreto,
el dispositivo VERTE-STACK® debe utilizarse junto con el sistema de fijación anterior de Medtronic ZPLATE II™, el sistema vertebral DYNA-LOK CLASSIC®, el sistema de fijación anterior
VANTAGE™, el sistema vertebral TSRH®, el sistema vertebral CD HORIZON® y/o el sistema vertebral GDLH®. Además, el dispositivo VERTE-STACK® también puede utilizarse con injertos óseos.
CONTRAINDICACIONES
El dispositivo VERTE-STACK® no está concebido para la implantación quirúrgica posterior ni cervical.
!USA
!USA
!USA
!USA
!USA
!USA
ESPAÑOL
debilitated, demented or otherwise unable to use crutches or other weight supporting devices. The patient should be warned to avoid falls or sudden jolts in spinal position.
•
patient should be warned of this possibility and instructed to limit and restrict physical activities, especially lifting and twisting motions and any type of sport participation. The
patient should be advised not to smoke or consume excess alcohol during the bone graft healing process.
• The patients should be advised of their inability to bend at the point of spinal fusion and taught to compensate for this permanent physical restriction in body motion.
•
non-union, or if the components loosen, bend, and/or break, the device should be revised and/or removed immediately before serious injury occurs.
• Any retrieved devices should be treated in such a manner that reuse in another surgical procedure is not possible.
PACKAGING
operation area. This process must be performed before handling or returning products to Medtronic.
CLEANING AND DECONTAMINATION
at higher temperatures. Cleaning and decontamination must include the use of neutral cleaners followed by a deionized water rinse.
solutions should not be used. Also, many instruments require disassembly before cleaning.
All products should be treated with care. Improper use or handling may lead to damage and/or possible improper functioning of the device.
STERILIZATION
with the VERTE-STACK® device described in this insert are provided non-sterile and must
specified elsewhere these products are recommended to be steam sterilized by the hospital using one of the sets of process parameters below:
METHOD CYCLE TEMPERATURE EXPOSURE TIME DRY TIME
Steam Pre-Vacuum 270°F (132°C) 4 Minutes 30 Minutes
Steam Gravity 250°F (121°C) 60 Minutes 30 Minutes
Steam* Pre-Vacuum * 273°F (134°C)* 20 Minutes* 30 Minutes
Steam* Gravity* 273°F (134°C)* 20 Minutes* 30 Minutes
the potential risk of transmission of Creutzfeldt-Jakob disease, especially of surgical instruments that could come into contact with the central nervous system.
PRODUCT COMPLAINTS
notification of whether or not a written report from the distributor is requested.
MAGNETIC RESONANCE SAFETY
The VERTE-STACK® Spinal System has not been evaluated for safety, heating, migration, or compatibility in the magnetic resonance environment.
FURTHER INFORMATION
MEDTRONIC.
Covered by one or more of U.S. Pat. Nos. 5,772,661; 5,860,973; 5,888,222; 6,746,484; 6,758,862; 6,830,570; and other pending patent applications.
©2014 MEDTRONIC SOFAMOR DANEK USA, Inc. All rights reserved.
Page 5

R
y
EC REP
STERILE R
!USA
EXPLANATION OF SYMBOLS
Authorized representative in the European Community
onl
LOT
REF
CAUTION: Federal law (USA) restricts these devices to sale by or on the order of a physician.
Consult instructions for use
Do not re-use
Batch code
Manufacturer
Catalogue number
For US audiences only
0123
NON
STERILE
The device complies with European Directive MDD 93/42/EEC
Sterilized using irradiation
Use-by date
Non-sterile
 Loading...
Loading...