Page 1

MVP™
0297
Micro Vascular Plug System
Система с микроваскуларна запушалка
Systém cévní mikrouzávěry
System med mikrovaskulær prop
Mikrovaskuläres Verschlusssystem
Σύστημα μικροαγγειακού βύσματος
Sistema de tapón microvascular
Mikrovaskulaarne korgisüsteem
Mikroverisuonitulppajärjestelmä
Système d’obturateur microvasculaire
Mikrovaskularni sustav zapušača
Mikrovaszkuláris dugaszrendszer
Sistem Sumbat Mikrovaskular
Sistema con plug microvascolare
Mikrokraujagyslių kamščio sistema
Mikrovaskulārā noslēga sistēma
Систем на микроваскуларен приклучок
Microvasculaire plug
Mikrovaskulært pluggsystem
System zatyczki do drobnych naczyń
Sistema de plugue microvascular
Sistema de tampão microvascular
Sistem cu dispozitiv de ocluzie microvasculară
Устройство микроваскулярное
Systém mikrovaskulárnej zátky
Sistem čepa za mikrovaskulaturo
Sistem mikrovaskularnog zatvarača
System för mikrovaskulär plugg
Mikro Vasküler Tıpa Sistemi
Система мікроваскулярного оклюдера
Hệ thống nút bịt mạch máu siêu nhỏ
Instructions for Use • Инструкции за употреба • Návod k použití • Brugsanvisning • Gebrauchsanweisung • Οδηγίες χρήσης • Instrucciones de uso • Kasutusjuhend • Käyttöohjeet • Mode d'emploi •
Upute za upotrebu • Használati útmutató • Petunjuk Penggunaan • Istruzioni per l'uso • Naudojimo instrukcijos • Lietošanas pamācība • Упатство за употреба • Gebruiksaanwijzing • Bruksanvisning •
Instrukcja użytkowania • Instruções de utilização • Instruções de utilização • Instrucţiuni de utilizare • Инструкция по эксплуатации • Pokyny na používanie • Navodila za uporabo • Uputstva za upotrebu •
Bruksanvisning • Kullanım Talimatları • Інструкція з використання • Hướng dẫn sử dụng
Caution: Federal law (USA) restricts this device to sale by or on the order of a physician.
Page 2

The following list includes trademarks or registered trademarks of Medtronic in the United States and possibly in other countries. All other trademarks are the property of their respective owners.
В списъка по-долу са изброени търговски марки или регистрирани търговски марки на Medtronic в САЩ и други държави. Всички останали търговски марки са притежание на съответните им собственици.
Následující seznam uvádí ochranné známky nebo registrované ochranné známky společnosti Medtronic v USA a případně v jiných zemích. Všechny ostatní ochranné známky jsou majetkem příslušných vlastníků.
Følgende liste indeholder varemærker eller registrerede varemærker tilhørende Medtronic i USA og muligvis i andre lande. Alle andre varemærker tilhører de respektive ejere.
Die folgende Liste beinhaltet Marken oder eingetragene Marken von Medtronic in den USA und möglicherweise in anderen Ländern. Alle anderen Marken sind Eigentum ihrer jeweiligen Inhaber.
Ο ακόλουθος κατάλογος περιλαμβάνει εμπορικά σήματα ή σήματα κατατεθέντα της Medtronic στις Ηνωμένες Πολιτείες και πιθανόν σε άλλες χώρες. Όλα τα άλλα εμπορικά σήματα είναι ιδιοκτησία των αντίστοιχων κατόχων τους.
La siguiente lista incluye marcas comerciales o marcas registradas de Medtronic en los Estados Unidos y posiblemente en otros países. Todas las marcas comerciales son propiedad de sus propietarios respectivos.
Järgmises loendis on toodud Ameerika Ühendriikides ja ka teistes riikides asuvate ettevõtte Medtronic kaubamärgid või registreeritud kaubamärgid. Kõik teised kaubamärgid on nende vastavate omanike omandid.
Seuraava luettelo sisältää Medtronic-yhtiön tavaramerkit ja rekisteröidyt tavaramerkit Yhdysvalloissa ja mahdollisesti muissa maissa. Kaikki muut tavaramerkit ovat niiden omistajien omaisuutta.
La liste suivante inclut des marques commerciales ou des marques déposées de Medtronic aux États-Unis et eventuellement dans d'autres pays. Toutes les autres marques commerciales sont la propriété de leurs détenteurs respectifs.
Na sljedećem popisu nalaze se registrirani zaštitni znaci tvrtke Medtronic u Sjedinjenim Američkim Državama i, eventualno, u drugim zemljama. Svi ostali zaštitni znaci pripadaju svojim vlasnicima.
Az alábbi lista a Medtronic Egyesült Államokban és valószínűleg más országokban érvényes védjegyeit vagy bejegyzett védjegyeit tartalmazza. Minden egyéb védjegy a megfelelő tulajdonosok tulajdonát képezi.
Daftar berikut ini meliputi merek dagang atau merek dagang terdaftar dari Medtronic di Amerika Serikat dan kemungkinan di negara-negara lainnya. Semua merek dagang lainnya merupakan hak milik dari masing-masing pemiliknya.
L'elenco seguente include marchi di fabbrica o marchi registrati della Medtronic negli Stati Uniti ed eventualmente in altri Paesi. Tutti gli altri marchi di fabbrica sono di proprietà dei rispettivi proprietari.
Tai yra „Medtronic“ prekių ženklai arba registruotieji prekių ženklai JAV ir galimai kitose šalyse. Visi kiti prekių ženklai yra jų atitinkamų savininkų nuosavybė.
Sarakstā, kas norādīts tālāk, uzskaitītas kompānijas Medtronic preču zīmes vai ASV reģistrētās preču zīmes. Visas citas preču zīmes ir to attiecīgo īpašnieku īpašums.
Следниот список содржи трговски марки или регистрирани трговски марки на Medtronic во САД и веројатно во други земји. Сите други трговски марки се сопственост на соодветните сопственици.
In de onderstaande lijst staan de gedeponeerde of geregistreerde handelsmerken van Medtronic in de Verenigde Staten en mogelijk in andere landen. Alle andere handelsmerken zijn het eigendom van de desbetreffende eigenaar.
Den følgende listen inneholder varemerker eller registrerte varemerker for Medtronic i USA og eventuelt i andre land. Alle andre varemerker tilhører de respektive eierne.
Poniższa lista zawiera znaki towarowe lub zastrzeżone znaki towarowe firmy Medtronic w Stanach Zjednoczonych i prawdopodobnie w innych krajach. Wszystkie pozostałe znaki towarowe są własnością ich prawowitych właścicieli.
A lista a seguir inclui marcas comerciais ou marcas comerciais registradas da Medtronic nos Estados Unidos e possivelmente em outros países.Todas as outras marcas comerciais são propriedade dos seus respectivos proprietários.
A lista que se segue inclui marcas comerciais ou marcas comerciais registadas da Medtronic nos EUA e possivelmente noutros países. Todas as outras marcas comerciais são propriedade dos respetivos detentores.
Următoarea listă include mărcile comerciale sau mărcile comerciale înregistrate ale Medtronic în Statele Unite ale Americii şi, posibil, în alte ţări. Toate celelalte mărci comerciale sunt proprietatea deţinătorilor respectivi.
Следующий список включает товарные знаки или зарегистрированные товарные знаки корпорации Medtronic в США и, возможно, в других странах. Все другие товарные знаки являются собственностью их владельцев.
Nasledujúci zoznam obsahuje ochranné známky alebo registrované ochranné známky spoločnosti Medtronic v USA a prípadne v ďalších krajinách. Všetky ostatné ochranné známky sú majetkom príslušných vlastníkov.
Spodaj so navedene blagovne znamke ali registrirane blagovne znamke družbe Medtronic v Združenih državah Amerike in drugih državah. Vse druge blagovne znamke so last njihovih lastnikov.
Sledeća lista obuhvata žigove ili registrovane žigove preduzeća Medtronic u SAD i možda u drugim zemljama. Svi drugi zaštićeni žigovi vlasništvo su odgovarajućih vlasnika.
Följande lista innehåller varumärken eller registrerade varumärken som tillhör Medtronic i USA och möjligen i andra länder. Alla övriga varumärken tillhör respektive innehavare.
Aşağıdaki liste Medtronic şirketinin Amerika Birleşik Devletleri'nde ve muhtemelen diğer ülkelerdeki ticari markalarını veya tescilli ticari markalarını içerir. Diğer ticari markaların tümü ilgili sahiplerinin mülkiyetindedir.
Наступний перелік містить товарні знаки компанії Medtronic в Сполучених Штатах і, можливо, в інших країнах. Усі інші товарні знаки є власністю їх власників.
Danh sách sau đây bao gồm các thương hiệu hoặc thương hiệu đã đăng ký của Medtronic tại Hoa Kỳ và có thể ở các quốc gia khác. Tất cả các thương hiệu khác là tải sản của các chủ sở hữu tương ứng.
Medtronic, MVP
Page 3

Symbol definitions • Дефиниции на символите • Definice symbolů • Symboldefinitioner •
Erläuterung der Symbole • Ορισμοί συμβόλων • Definición de los símbolos • Sümbolite
tähendused • Symbolien määritelmät • Définition des symboles • Definicije simbola • A
szimbólumok magyarázata • Definisi simbol • Spiegazione dei simboli • Simbolių aprašai •
Simbolu nozīme • Дефиниции за симболите • Verklaring van symbolen •
Symbolforklaring • Definicje symboli • Definições dos símbolos • Definições dos símbolos
• Definițiile simbolurilor • Определение символов • Definície symbolov • Definicije
simbolov • Definicije simbola • Förklaring av symboler • Sembol tanımları • Пояснення
символів • Giải thích ký hiệu
Manufacturer • Производител • Výrobce • Fabrikant • Hersteller •
Κατασκευαστής • Fabricante • Tootja • Valmistaja • Fabricant • Proizvođač •
Gyártó • Produsen • Fabbricante • Gamintojas • Ražotājs • Производител •
Fabrikant • Produsent • Producent • Fabricante • Fabricante • Producător •
Производитель • Výrobca • Izdelovalec • Proizvođač • Tillverkare • Üretici •
Виробник • Nhà sản xuất
Authorized representative in the European Community • Упълномощен
представител в Европейската общност • Autorizovaný zástupce pro
Evropské společenství • Autoriseret repræsentant i EF • Autorisierter
Repräsentant in der Europäischen Gemeinschaft • Εξουσιοδοτημένος
αντιπρόσωπος στην Ευρωπαϊκή Κοινότητα • Representante autorizado en la
Comunidad Europea • Volitatud esindaja Euroopa Ühenduses • Valtuutettu
edustaja Euroopan yhteisön alueella • Représentant autorisé dans la
Communauté européenne • Ovlašteni predstavnik u Europskoj zajednici •
Hivatalos képviselet az Európai Közösségben • Perwakilan Resmi di
Negara-Negara Eropa • Rappresentante autorizzato nella Comunità europea •
Įgaliotasis atstovas Europos Bendrijoje • Pilnvarotais pārstāvis Eiropas Kopienā
• Овластен претставник во Европската заедница • Geautoriseerd
vertegenwoordiger in de Europese Gemeenschap • Autorisert representant i
Det europeiske fellesskap • Autoryzowany przedstawiciel w Unii Europejskiej •
Representante autorizado na Comunidade Europeia • Representante
autorizado na Comunidade Europeia • Reprezentant autorizat în Comunitatea
Europeană • Уполномоченный представитель в Европейском сообществе •
Autorizovaný zástupca pre Európske spoločenstvo • Pooblaščeni predstavnik v
Evropski skupnosti • Ovlašćeni predstavnik u Evropskoj zajednici • Auktoriserad
representant inom EG • Avrupa Topluluğu’ndaki yetkili temsilci •
Уповноважений представник у Європейському Співтоваристві • Đại diện
được ủy quyền tại Cộng đồng Châu Âu
Consult instructions for use at this website • Вижте инструкциите за употреба
на този уеб сайт • Viz návod k použití na této webové stránce • Se
brugsanvisningen på dette websted • Gebrauchsanweisung auf dieser
Webseite beachten • Συμβουλευτείτε τις οδηγίες χρήσης σε αυτόν τον
ιστότοπο • Consultar las instrucciones de uso en este sitio web • Lugege sellel
veebilehel toodud kasutusjuhendeid • Katso käyttöohjeet tästä
verkkosivustosta • Consulter le mode d’emploi sur ce site Web • Pogledajte
upute za upotrebu na ovoj internetskoj stranici • Lásd a használati utasítást ezen
a honlapon • Lihat petunjuk penggunaan di situs web ini • Consultare le istruzioni
per l’uso su questo sito web • Naudojimo instrukcijas rasite šioje svetainėje •
Lietošanas pamācību skatīt šajā tīmekļa vietnē • Видете го Упатството за
употреба на оваа веб-страница • Raadpleeg de gebruiksaanwijzing op deze
website • Se bruksanvisningen på dette nettstedet • Należy zapoznać się z
instrukcją użytkowania dostępną w tej witrynie internetowej • Consultar as
instruções de utilização neste site • Consultar instruções de utilização neste
sítio da Internet • Consultaţi instrucţiunile de utilizare la acest site web. • См.
инструкцию по эксплуатации на указанном веб-сайте • Prečítajte si pokyny
na používanie na tejto webovej lokalite • Glejte navodila za uporabo na tem
spletnem mestu • Pogledajte uputstvo za upotrebu na ovoj veb lokaciji • Se
bruksanvisningar på denna webbplats • Bu web sitesindeki kullanım
talimatlarına bakın • Див. інструкцію з експлуатації на цьому веб-сайті •
Tham khảo hướng dẫn sử dụng tại trang web này
Sterilized using ethylene oxide • Стерилизирано с етиленов оксид •
Sterilizováno ethylenoxidem • Steriliseret med etylenoxid • Mit Ethylenoxid
sterilisiert • Αποστειρωμένο με αιθυλενοξείδιο • Esterilizado mediante óxido de
etileno • Steriliseeritud etüleenoksiidiga • Steriloitu etyleenioksidilla • Stérilisé à
l’oxyde d’éthylène • Sterilizirano etilen-oksidom • Etilén-oxiddal sterilizálva •
Disterilkan menggunakan etilena oksida • Sterilizzato a ossido di etilene •
Sterilizuota etileno oksidu • Sterilizēts, izmantojot etilēnoksīdu •
Стерилизирано со етилен оксид • Gesteriliseerd met ethyleenoxide •
Sterilisert med etylenoksid • Sterylizowany tlenkiem etylenu • Esterilizado com
óxido de etileno • Esterilizado utilizando óxido de etileno • Sterilizat cu oxid de
etilenă • Стерилизовано этиленоксидом • Sterilizované pomocou etylénoxidu
• Sterilizirano z etilenoksidom • Sterilisano korišćenjem etilen-oksida •
Steriliserad med etylenoxid • Etilen oksit ile sterilize edilmiştir • Стерилізовано
за допомогою етиленоксиду • Được khử trùng bằng ethylene oxide
Catalog number • Каталожен номер • Katalogové číslo • Katalognummer •
Katalognummer • Αριθμός καταλόγου • Número de catálogo • Katalooginumber
• Luettelonumero • Numéro de référence • Kataloški broj • Katalógusszám •
Nomor katalog • Numero di catalogo • Katalogo numeris • Kataloga numurs •
Каталошки број • Catalogusnummer • Artikkelnummer • Numer katalogowy •
Número de catálogo • Número de catálogo • Număr de catalog • Номер по
каталогу • Katalógové číslo • Kataloška številka • Kataloški broj •
Katalognummer • Katalog numarası • Номер у каталозі • Số danh mục
Lot number • Номер на партида • Číslo šarže • Partinummer • Chargennummer
• Αριθμός παρτίδας • Número de lote • Partii number • Eränumero • Numéro de
lot • Broj serije • Gyártási szám • Nomor lot • Numero di lotto • Partijos numeris •
Partijas numurs • Број на серија • Partijnummer • Lotnummer • Numer partii
produkcyjnej • Número de lote • Número de lote • Număr de lot • Номер партии •
Číslo šarže • Številka serije • Broj serije • Partinummer • Lot numarası • Номер
партії • Số lô
Keep dry • Поддържайте сухо • Udržujte v suchu • Skal opbevares tørt •
Trocken aufbewahren • Διατηρήστε στεγνό • Mantener seco • Hoida kuivas •
Säilytä kuivassa • À conserver dans un endroit sec • Držite na suhom • Szárazon
tartandó • Jaga agar tetap kering • Mantenere asciutto • Laikyti sausoje vietoje •
Uzglabāt sausā vietā • Да се чува на суво место • Droog bewaren • Skal holdes
tørr • Chronić przed wilgocią • Manter em local seco • Manter seco • Păstraţi
într-un spaţiu uscat • Хранить в сухом месте • Uschovajte v suchu • Hranite v
suhem prostoru • Držati na suvom mestu • Förvaras torrt • Kuru yerde saklayın •
Зберігати в сухому місці • Để nơi khô thoáng
Keep away from sunlight • Пазете от слънчева светлина • Chraňte před
slunečním světlem • Må ikke udsættes for direkte sollys • Vor Sonnenlicht
schützen • Διατηρείτε μακριά από το ηλιακό φως • Mantener alejado de la luz
del sol • Hoida päikesevalgusest eemal • Suojaa auringonvalolta • Conserver à
l’abri de la lumière du soleil • Držite podalje od sunčeve svjetlosti • Napfénytől
védendő • Jauhkan dari sinar matahari • Non esporre alla luce solare • Saugoti
nuo saulės šviesos • Sargāt no tiešiem saules stariem • Да се чува подалеку од
сончева светлина • Uit de buurt van zonlicht houden • Må ikke utsettes for sollys
• Chronić przed światłem słonecznym • Manter afastado da luz do sol • Manter
afastado da luz do sol • Nu expuneţi la radiaţia solară • Не допускать
попадания солнечных лучей • Uchovávajte mimo slnečného žiarenia •
Zaščitite pred sončno svetlobo • Držati daleko od sunčeve svetlosti • Får inte
utsättas för solljus • Güneş ışığından uzak tutun • Зберігати у місці,
захищеному від прямих сонячних променів • Tránh tiếp xúc với ánh nắng mặt
trời
Use-by date • Използвайте до • Datum použitelnosti • Kan anvendes til og med
• Verwendbar bis • Ημερομηνία «Χρήση έως» • Fecha de caducidad • Kõlblik
kuni • Viimeinen käyttöpäivämäärä • Date de péremption • Rok upotrebe •
Lejárati idő • Tanggal "gunakan paling lambat" • Utilizzare entro • Naudoti iki •
Izmantot līdz • Употребливо до • Uiterste gebruiksdatum • Siste forbruksdag •
Termin przydatności do użycia • Data de vencimento • Utilizar antes da data • A
se utiliza până la data de • Срок годности • Dátum spotreby • Uporabno do •
Datum „Upotrebljivo do“ • Utgångsdatum • Son kullanma tarihi • Термін
придатності • Hạn sử dụng
Do not reuse • Да не се използва повторно • Nepoužívejte opakovaně • Må
ikke genbruges • Nicht wiederverwenden • Μην επαναχρησιμοποιείτε • No
reutilizar • Mitte kasutada korduvalt • Älä käytä uudelleen • Ne pas réutiliser •
Nemojte upotrebljavati više puta • Kizárólag egyszeri használatra • Jangan
dipakai ulang • Non riutilizzare • Nenaudoti pakartotinai • Nelietot atkārtoti •
Само за еднократна употреба • Niet opnieuw gebruiken • Skal ikke brukes
flere ganger • Nie stosować ponownie • Não reutilizar • Não reutilizável • De
unică folosinţă • Не использовать повторно • Nepoužívajte opakovane • Za
enkratno uporabo • Nije za ponovnu upotrebu • Får inte återanvändas • Yeniden
kullanmayın • Не застосовувати повторно • Không được tái sử dụng
3
Page 4

Do not use if package is damaged • Не използвайте, ако опаковката е
повредена • Nepoužívejte, je-li obal poškozený • Må ikke anvendes, hvis
emballagen er beskadiget • Nicht verwenden, wenn die Verpackung beschädigt
ist • Μην το χρησιμοποιείτε εάν η συσκευασία έχει υποστεί ζημία • No utilizar
si el envase está dañado • Ärge kasutage, kui pakend on kahjustatud • Älä käytä,
jos pakkaus on vaurioitunut • Ne pas utiliser si l’emballage est endommagé •
Nemojte upotrebljavati ako je ambalaža oštećena • Ne használja fel, ha a
csomagolás sérült • Jangan gunakan jika kemasan rusak • Non utilizzare se
l’imballaggio non è integro • Nenaudokite, jei pakuotė pažeista • Nelietot, ja
iepakojums ir bojāts • Да не се употребува доколку пакувањето е оштетено •
Niet gebruiken als de verpakking beschadigd is • Skal ikke brukes hvis
pakningen er skadet • Nie stosować, jeśli opakowanie jest uszkodzone • Não
utilizar se a embalagem estiver danificada • Não utilizar se a embalagem estiver
danificada • Nu folosiţi dacă ambalajul este deteriorat • Не использовать, если
упаковка повреждена • Nepoužívajte, ak je obal poškodený • Ne uporabljajte,
če je embalaža poškodovana • Ne koristiti ako je pakovanje oštećeno • Får ej
användas om förpackningen är skadad • Ambalaj hasarlıysa kullanmayın • Не
використовувати, якщо упаковка пошкоджена • Không được sử dụng nếu
bao bì đã bị hư hỏng
MR Conditional • Условен МР • Podmíněné použití magnetické rezonance •
Betinget kompatibilitet med MR-scanning • Bedingt MRT-sicher • Μαγνητική
τομογραφία (MR) υπό όρους • Compatible con MRI en determinadas
condiciones • MR-tingimuslik • Magneettikuvaus sallittu varauksin • Compatible
avec la RM sous conditions • Može se upotrebljavati tijekom snimanja
magnetskom rezonancijom pod određenim uvjetima • MR-kompatibilitás
feltételekkel • Kondisi MR • Compatibilità RM condizionata • Sąlyginai saugus
MR aplinkoje • Nosacīta saderība ar magnētisko rezonansi • Безбедно при
магнетна резонанција само ако се употребува во определени услови • MR
Conditional (MR-veilig onder voorwaarden) • MR-betinget • Badanie MR
dopuszczalne w określonych warunkach • Condicional para RM • RM
condicional • Compatibilitate RM condiţionată • МРТ выполнять с
соблюдением ограничений • Podmienečne bezpečné v prostredí MR •
Pogojna uporaba pri MR • Uslovno bezbedno za MR • MR-villkorlig • MR Koşullu
• МРТ виконувати з дотриманням обмежень • An toàn cộng hưởng từ (MR)
có điều kiện
Nonpyrogenic • Непирогенно • Nepyrogenní • Ikke-pyrogen • Pyrogenfrei • Μη
πυρετογόνο • Apirógeno • Mittepürogeenne • Pyrogeeniton • Apyrogène •
Nezapaljivo • Nem pirogén • Bebas pirogen • Apirogeno • Nedegus •
Nepirogēns • Апирогено • Niet-pyrogeen • Pyrogenfri • Produkt niepirogenny •
Não pirogênico • Não pirogénico • Apirogen • Апирогенно • Nepyrogénne •
Apirogeno • Nije pirogeno • Icke-pyrogen • Pirojenik Değildir • Апірогенно •
Không chứa pyrogen
Caution: Federal law (USA) restricts this device to sale by or on the order of a
physician • Внимание: Федералният закон (САЩ) поставя ограничение
това устройство да бъде продавано само от или по поръчка на лекар •
Upozornění: Federální zákony (USA) omezují prodej tohoto zařízení pouze na
lékaře nebo na lékařský předpis • Forsigtig: Amerikansk lov (USA) begrænser
denne enhed til salg på foranledning af eller efter ordination af en læge •
Vorsicht: Nach dem Bundesrecht der USA darf dieses Gerät nur an oder auf
Anweisung eines Arztes verkauft werden • Προσοχή: Η ομοσπονδιακή
νομοθεσία (των ΗΠΑ) επιτρέπει την πώληση του παρόντος προϊόντος μόνο σε
ιατρό ή κατόπιν εντολής ιατρού • Precaución: La ley federal de Estados Unidos
permite la venta de este dispositivo exclusivamente a médicos o bajo
prescripción facultativa. • Ettevaatust! Ameerika Ühendriikide föderaalseadus
lubab seda seadet müüa vaid arstil või arsti korraldusel. • Varoitus:
Yhdysvaltojen liittovaltiolaki sallii tämän laitteen myynnin vain lääkärille tai
lääkärin määräyksestä. • Attention : La loi fédérale (États-Unis) limite la vente de
cet appareil par un médecin ou sur ordonnance d’un médecin • Oprez: prema
američkom saveznom zakonu ovaj uređaj može se kupiti samo od liječnika ili na
njihovu preporuku • Vigyázat: A szövetségi törvények (USA) értelmében a
készülék orvosok által vagy orvosi rendelésre értékesíthető. • Perhatian: Hukum
federal (AS) hanya memperbolehkan penjualan perangkat ini oleh atau atas
perintah dokter • Attenzione: le leggi federali (U.S.A.) consentono la vendita di
questo dispositivo soltanto a medici o su prescrizione medica • Dėmesio: pagal
federalinius įstatymus (JAV) šį prietaisą gali parduoti tik gydytojas arba asmuo
gydytojo nurodymu • Uzmanību! Saskaņā ar ASV federālajiem likumiem šo
izstrādājumu drīkst pārdot tikai ārsts vai pēc ārsta norīkojuma • Внимание:
Федералниот закон (САД) ја ограничува продажбата на овој уред,
односно тој може да се продава само од страна на лекар или по нарачка на
лекар • Let op: Dit product is uitsluitend verkrijgbaar op doktersvoorschrift
(wetgeving VS) • Forsiktig! I henhold til amerikansk lovgivning kan denne
enheten kun selges av eller etter forordning fra lege • Przestroga: Zgodnie
z prawem federalnym (USA) urządzenie to może być sprzedawane wyłącznie
przez lekarza lub na jego zlecenie. • Advertência: As leis federais (EUA)
restringem a venda deste dispositivo a médicos ou mediante prescrição médica
• Atenção: As leis federais (E.U.A.) restringem a venda deste dispositivo a um
médico ou mediante prescrição de um médico. • Atenţie: Legislaţia federală
(SUA) permite vânzarea acestui dispozitiv numai pe baza sau în urma
recomandării unui medic • Предупреждение: согласно федеральному
закону США это устройство может продаваться только врачу или по
заказу врача • Upozornenie: Federálny zákon (USA) obmedzuje predaj tohto
zariadenia výhradne na lekárov alebo na ich predpis. • Pozor: Zvezna
zakonodaja v ZDA določa, da lahko napravo prodaja ali predpiše le zdravnik. •
Oprez: Savezni zakon (SAD) ograničava prodaju ovog uređaja na prodaju od
strane ili po nalogu lekara • Obs! Enligt federal lagstiftning (USA) får produkten
endast säljas av eller på ordination av läkare • Dikkat: Federal yasalara (ABD)
göre, bu cihazın yalnızca hekim tarafından veya hekim siparişiyle satışına izin
verilmektedir • ОБЕРЕЖНО! Федеральне законодавство США дозволяє
продаж цього пристрою лише лікарю або на замовлення лікаря • Thận
trọng: Luật liên bang (Hoa Kỳ) hạn chế việc bác sĩ bán hoặc yêu cầu sử dụng
thiết bị này
Do not resterilize • Не стерилизирайте повторно • Neprovádějte resterilizaci
Må ikke resteriliseres • Nicht resterilisieren • Μην επαναποστειρώνετε • No
reesterilizar • Mitte steriliseerida uuesti • Älä steriloi uudelleen • Ne pas
restériliser • Nemojte iznova sterilizirati • Nem újrasterilizálható • Jangan
disterilkan ulang • Non risterilizzare • Nesterilizuokite pakartotinai • Nesterilizēt
atkārtoti • Да не се стерилизира повторно • Niet opnieuw steriliseren • Skal
ikke resteriliseres • Nie sterylizować ponownie • Não reesterilizar • Não
reesterilizar • Nu resterilizaţi • Не стерилизовать повторно • Opakovane
nesterilizujte • Ne sterilizirajte znova • Nije za ponovnu sterilizaciju • Får inte
omsteriliseras • Yeniden sterilize etmeyin • Не стерилізувати повторно •
Không được khử trùng lại
For US audiences only • Само за САЩ • Pouze pro uživatele z USA • Gælder
kun i USA • Gilt nur für Leser in den USA • Μόνο για πελάτες εντός των ΗΠΑ •
Solo aplicable en EE. UU. • Ainult kasutajatele Ameerika Ühendriikides • Koskee
vain Yhdysvaltoja • Ne s’applique qu’aux États-Unis • Samo za američko tržište •
Csak egyesült államokbeli felhasználóknak • Hanya untuk pengguna di AS •
Esclusivamente per il mercato statunitense • Tik JAV naudotojams • Tikai
pircējiem ASV • Наменето само за корисници во САД • Alleen van toepassing
voor de VS • Gjelder kun USA • Dotyczy tylko odbiorców w Stanach
Zjednoczonych • Aplicável apenas aos EUA • Aplicável apenas aos EUA •
Numai pentru clienţii din SUA • Только для США • Len pre používateľov v USA •
Samo za uporabnike v ZDA • Samo za korisnike u SAD • Gäller endast i USA •
Yalnızca ABD’deki kullanıcılar için • Лише для користувачів у США • Chỉ dành
cho độc giả ở Hoa Kỳ
•
4
Page 5

Working length • Работна дължина • Pracovní délka • Arbejdslængde •
Nutzbare Länge • Ωφέλιμο μήκος • Longitud de trabajo • Tööpikkus •
Työskentelypituus • Longueur utile • Radna duljina • Munkahossz • Durasi
pengoperasian • Lunghezza operativa • Darbinis ilgis • Darba garums • Работна
должина • Werklengte • Arbeidslengde • Długość robocza • Comprimento útil •
Comprimento útil • Lungime utilă • Рабочая длина • Pracovná dĺžka • Delovna
dolžina • Radna dužina • Arbetslängd • Çalışma uzunluğu • Робоча довжина •
Thời gian hoạt động
Conformité Européenne (European Conformity). This symbol means that the
device fully complies with applicable European Union acts. • Conformité
Européenne (Европейско съответствие). Този символ означава, че
устройството съответства напълно на приложимото законодателство на
Европейския съюз. • Conformité Européenne (Evropská shoda). Tento symbol
znamená, že výrobek zcela splňuje požadavky příslušných zákonů Evropské
unie. • Conformité Européenne (Europæisk Standard). Dette symbol betyder, at
enheden fuldt ud overholder gældende EU-lovgivning. • Conformité
Européenne (Europäische Konformität). Dieses Symbol besagt, dass das
Produkt allen anwendbaren Vorschriften der Europäischen Union entspricht. •
Conformité Européenne (Ευρωπαϊκή Συμμόρφωση). Το σύμβολο αυτό
σημαίνει ότι το προϊόν συμμορφώνεται πλήρως με τους ισχύοντες νόμους της
Ευρωπαϊκής Ένωσης. • Conformité Européenne (Conformidad Europea). Este
símbolo indica que el dispositivo cumple totalmente las leyes vigentes de la
Unión Europea. • Conformité Européenne (Euroopa vastavusmärgis). See
sümbol tähendab, et seade vastab täielikult kohaldatavatele Euroopa Liidu
seadustele. • Conformité Européenne (eurooppalainen
vaatimustenmukaisuus). Tämä symboli tarkoittaa, että laite on kaikilta osin
Euroopan unionin soveltuvan lainsäädännön mukainen. • Conformité
Européenne. Ce symbole signifie que l’appareil est entièrement conforme aux
lois en vigueur de l’Union européenne. • Conformité Européenne (Usklađenost
s europskim normama). Ovaj simbol znači da je uređaj potpuno usklađen s
odgovarajućim aktima Europske unije. • Conformité Européenne (európai
megfelelőség). Ez a szimbólum azt jelenti, hogy az eszköz teljes mértékben
megfelel az Európai Unió vonatkozó jogszabályainak. • Conformité Européenne
(European Conformity/Kesesuaian untuk Uni Eropa). Simbol ini berarti bahwa
perangkat sepenuhnya mematuhi undang-undang Uni Eropa yang berlaku. •
Conformité Européenne (Conformità europea). Questo simbolo indica che il
dispositivo è pienamente conforme alle direttive europee in vigore. • Conformité
Européenne (Europos atitiktis). Šis simbolis reiškia, kad prietaisas visiškai
atitinka taikytinus Europos Sąjungos aktus. • Conformité Européenne (atbilstība
Eiropas Savienības prasībām). Šis simbols norāda, ka ierīce pilnībā atbilst
piemērojamo Eiropas Savienības tiesību aktu prasībām. • Conformité
Européenne (Европска сообразност). Овој симбол значи дека помагалото
е целосно сообразно со важечките закони на Европската унија. •
Conformité Européenne (Europese Conformiteit). Dit symbool betekent dat het
product volledig voldoet aan de geldende Europese wetgeving. • Conformité
Européenne (samsvar med europeisk standard). Dette symbolet betyr at
enheten er fullstendig i samsvar med gjeldende EU-rettsakter. • Conformité
Européenne (Zgodność z normami Unii Europejskiej). Ten symbol oznacza, że
urządzenie spełnia wszystkie wymogi wynikające z właściwych aktów prawnych
Unii Europejskiej. • Conformité Européenne (Conformidade Europeia). Este
símbolo significa que o dispositivo está em total conformidade com as leis
aplicáveis da União Europeia. • Conformité Européenne (Conformidade
Europeia). Este símbolo significa que o dispositivo está em total conformidade
com as leis da União Europeia aplicáveis. • Conformité Européenne
(Conformitate europeană). Acest simbol atestă conformitatea deplină a
dispozitivului cu legislaţia aplicabilă a Uniunii Europene. • Conformité
Européenne (Европейское соответствие). Этот символ обозначает, что
устройство полностью соответствует требованиям применимых директив
Европейского Союза. • Conformité Européenne (Zhoda s požiadavkami EÚ).
Tento symbol znamená, že zariadenie je v úplnom súlade s platnými právnymi
predpismi Európskej únie. • Conformité Européenne (evropska skladnost). Ta
simbol pomeni, da je pripomoček v celoti skladen z veljavnimi zakoni Evropske
unije. • Conformité Européenne (usklađenost sa evropskim standardima). Ovaj
simbol označava da je uređaj u potpunosti usklađen sa važećim zakonima
Evropske unije. • Conformité Européenne (Europeisk standard). Denna symbol
anger att enheten uppfyller alla gällande direktiv i den Europeiska unionen. •
Conformité Européenne (Avrupa Normlarına Uygunluk). Bu sembol, cihazın
yürürlükteki Avrupa Birliği yasalarına tam olarak uygun olduğunu ifade eder. •
Conformité Européenne (відповідність вимогам ЄС). Цей символ означає,
що пристрій повністю відповідає вимогам застосовних директив
Європейського Союзу. • Conformité Européenne (Cộng đồng Châu Âu). Ký
hiệu này có nghĩa là thiết bị tuân thủ đầy đủ các đạo luật được áp dụng của Liên
minh Châu Âu.
Quantity • Количество • Množství • Antal • Menge • Ποσότητα • Cantidad •
Kogus • Määrä • Quantité • Količina • Mennyiség • Kuantitas • Quantità • Kiekis •
Daudzums • Количина • Aantal • Antall • Ilość • Quantidade • Quantidade •
Cantitate • Количество • Množstvo • Količina • Količina • Antal • Miktar •
Кількість • Số lượng
Inner diameter (compatible catheter) • Вътрешен диаметър (съвместим
катетър) • Vnitřní průměr (kompatibilní katétr) • Indvendig diameter
(kompatibelt kateter) • Innendurchmesser (kompatibler Katheter) • Εσωτερική
διάμετρος (συμβατός καθετήρας) • Diámetro interno (catéter compatible) •
Siseläbimõõt (ühilduv kateeter) • Sisäläpimitta (yhteensopiva katetri) • Diamètre
interne (cathéter compatible) • Unutarnji promjer (kompatibilnog katetera) •
Belső átmérő (kompatibilis katéter) • Diameter bagian dalam (kateter yang
kompatibel) • Diametro interno (catetere compatibile) • Vidinis skersmuo
(suderintas kateteris) • Iekšējais diametrs (saderīga katetra) • Внатрешен
дијаметар (компатибилен катетер) • Binnendiameter (compatibele katheter) •
Indre diameter (kompatibelt kateter) • Średnica wewnętrzna (cewnik
kompatybilny) • Diâmetro interno (cateter compatível) • Diâmetro interno
(cateter compatível) • Diametru intern (cateter compatibil) • Внутренний
диаметр (совместимый катетер) • Vnútorný priemer (kompatibilný katéter) •
Notranji premer (združljivi kateter) • Unutrašnji prečnik (kompatibilni kateter) •
Innerdiameter (kompatibel kateter) • İç çap (uyumlu kateter) • Внутрішній
діаметр (сумісний катетер) • Đường kính trong (que thăm tương thích)
Outer diameter (compatible catheter) • Външен диаметър (съвместим
катетър) • Vnější průměr (kompatibilní katétr) • Udvendig diameter (kompatibelt
kateter) • Außendurchmesser (kompatibler Katheter) • Εξωτερική διάμετρος
(συμβατός καθετήρας) • Diámetro externo (catéter compatible) • Välisläbimõõt
(ühilduv kateeter) • Ulkoläpimitta (yhteensopiva katetri) • Diamètre externe
(cathéter compatible) • Vanjski promjer (kompatibilnog katetera) • Külső átmérő
(kompatibilis katéter) • Diameter bagian luar (kateter yang kompatibel) •
Diametro esterno (catetere compatibile) • Išorinis skersmuo (suderinamas
kateteris) • Ārējais diametrs (saderīga katetra) • Надворешен дијаметар
(компатибилен катетер) • Buitendiameter (compatibele katheter) • Ytre
diameter (kompatibelt kateter) • Średnica zewnętrzna (cewnik kompatybilny) •
Diâmetro externo (cateter compatível) • Diâmetro externo (cateter compatível) •
Diametru extern (cateter compatibil) • Наружный диаметр (совместимый
катетер) • Vonkajší priemer (kompatibilný katéter) • Zunanji premer (združljivi
kateter) • Spoljašnji prečnik (kompatibilni kateter) • Ytterdiameter (kompatibel
kateter) • Dış çap (uyumlu kateter) • Зовнішній діаметр (сумісний катетер) •
Đường kính ngoài (que thăm tương thích)
Vessel diameter • Диаметър на съда • Průměr cévy • Kardiameter •
Gefäßdurchmesser • Διάμετρος αγγείου • Diámetro del vaso • Veresoone
läbimõõt • Suonen läpimitta • Diamètre du vaisseau • Promjer krvne žile •
Érátmérő • Diameter pembuluh • Diametro del vaso • Kraujagyslės skersmuo •
Asinsvada diametrs • Дијаметар на крвниот сад • Diameter bloedvat •
Kardiameter • Średnica naczynia • Diâmetro do vaso • Diâmetro do vaso •
Diametrul vasului • Диаметр сосуда • Priemer cievy • Premer žile • Prečnik
krvnog suda • Kärldiameter • Damar çapı • Діаметр судини • Đường kính mạch
English
1 Device description
The MVP micro vascular plug system is a self-expanding vessel occlusion device. The MVP device
has an ovoid shape, is comprised of nitinol, and is secured at both ends with platinum marker bands.
The device incorporates a partial cover of PTFE. The proximal marker band attaches to a delivery
wire that pushes the device through a commercially available microcatheter or catheter to the
intended treatment site. The delivery wire detaches from the MVP device by rotating the delivery
wire counterclockwise to unscrew it from the device.
The MVP system is packaged as a single unit that contains the MVP device, an introducer sheath
and a detachable delivery wire. The system is provided sterile, is non-pyrogenic, and is intended for
single use only.
5
Page 6

Figure 1. MVP Micro Vascular Plug
1 Partial cover
2 Distal marker
3 MVP device
Figure 2. MVP system dimensions
1 Delivery wire length
2 Length unconstrained (device unsheathed
and without any constraints on it)
Table 1. MVP Dimensions Model Diameter
MVP-3Q 5.3 mm 12 mm 180 cm 1.5 mm – 3.0 mm
MVP-5Q 6.5 mm 12 mm 180 cm 3.0 mm – 5.0 mm
MVP-7Q 9.2 mm 16 mm 165 cm 5.0 mm – 7.0 mm
MVP-9Q 13.0 mm 18 mm 165 cm 7.0 mm – 9.0 mm
Table 2. Recommended microcatheter or catheter Model Recommended Microcath-
MVP-3Q 0.021 in (0.53 mm) to 0.027 in
MVP-5Q 0.027 in (0.69 mm) (ID) 153 cm
MVP-7Q 4 Fr (1.4 mm) (OD) 120 cm
MVP-9Q 5 Fr (1.7 mm) (OD) 120 cm
Unconstrained
Length Unconstrained
eter or Catheter
(0.69 mm) (ID)
4 Detachment zone
5 Delivery wire
6 Proximal marker
3 Diameter unconstrained
Delivery Wire
Length
Recommended Microcatheter or Catheter Max Length
153 cm
Target Vessel
Diameter
2 Intended use / indications for use
The MVP micro vascular plug system is indicated to obstruct or reduce the rate of blood flow in the
peripheral vasculature.
3 Contraindications
There are no known contraindications for this device.
4 Compatibility
Refer to the MVP system product label for device dimensions. Refer to the labeling provided with
other medical technologies to determine compatibility.
5 Warnings
• The safety and effectiveness of the MVP system has not been established for cardiac uses (e.g.,
cardiac septal occlusion, patent ductus arteriosus, paravalvular leak closure) and neurologic
uses.
• The MVP system should only be used by physicians who are familiar with angiographic and
interventional procedures. It is important to read the instructions for use prior to using the MVP
system.
• Use the MVP system before the use-by date printed on the product packaging label.
• The MVP system is non-pyrogenic and is provided sterile unless the packaging of the MVP
system is opened or damaged. Do not use if the packaging is breached or damaged.
• Inspect the MVP system before use and discard if any irregularities or damage are observed.
• The MVP system is intended for single use only. Do not reprocess or resterilize. Reprocessing
and resterilizing could increase the risks of patient infection and compromised device
performance. After using the MVP system, dispose of it in accordance with hospital and local
government policy.
• Use fluoroscopic guidance when advancing or manipulating the MVP system. Do not advance
or withdraw the device when excessive resistance is met, until the cause of resistance is
determined.
• Do not twist or rotate the delivery wire except when intending to detach the device, or else the
device may detach prematurely.
• Do not use a power injection syringe to inject contrast solution with the device through a
microcatheter or catheter.
• Do not advance the delivery wire after detaching it from the MVP device.
• Physicians must be prepared to deal with urgent situations which require removal of the device.
This preparation includes ensuring the availability of an on-site surgeon.
• Do not use with catheters that are contraindicated for embolic devices (for example, coils or a
plug).
6 Precautions
• The MVP device consists of a nickel-titanium alloy that is generally considered safe. However,
in-vitro testing demonstrated that nickel is released from the device after implantation for a
minimum of 60 days. Patients who are allergic to nickel may have an allergic reaction to the
device, especially patients with a history of metal allergies. Certain allergic reactions can be
serious; patients should be instructed to notify their physicians immediately if they suspect they
are experiencing an allergic reaction, such as difficulty breathing or inflammation of the face or
throat. Some patients may develop an allergy to nickel if the device is implanted.
• Physicians should exercise clinical judgment in situations that involve use of anticoagulants or
antiplatelet drugs before, during, or after the use of the device.
• Please note care in the following specific populations:
– For pregnant patients, care should be taken to minimize the exposure of the mother and fetus
to radiation.
– For nursing mothers, there has been no quantitative assessment of the presence of
leachables in breast milk after implantation with the device.
• Verify the MVP system compatibility when using other ancillary devices in intravascular
procedures. Physicians using the MVP system must be familiar with percutaneous,
intravascular techniques, and possible complications associated with the procedure.
• The MVP system should be hydrated prior to use.
• Exercise care in handling the MVP system to reduce the chance of accidental damage.
• There is a potential for higher push forces when used with slotted nitinol composite
microcatheters or catheters.
• Verify that the diameter of any accessory device that is used is compatible with the MVP system
prior to use.
7 Potential adverse events
Potential adverse events that may occur during or after a procedure placing this device include, but
are not limited to, the following items:
• Air embolus
• Allergic reaction or toxic effects
• Bleeding
• Death
• Device migration
• Fever
• Foreign material embolic event
• Infection
• Occlusion of unintended vessel
• Peripheral embolism
• Recanalization
• Residual flow
• Stroke or transient ischemic attack (TIA)
• Surgical intervention
• Vascular access site complication
• Vessel trauma or perforation
6
Page 7

8 Required materials
1. Delivery of the MVP system requires the use of a microcatheter or a catheter (see Table 2 for
recommended size).
2. The following accessories are required:
• Heparinized saline solution
• Rotating hemostatic valve (RHV)
• 3-way stopcock
• Saline bag pressure cuff
• Access sheath
• Guide catheter compatible with a microcatheter or a catheter recommended in Table 2
• Guide wire compatible with the guide catheter and the microcatheter or the catheter
• Intravenous (IV) infusion stand
9 Preparation
1. To achieve optimal performance of the MVP system and to reduce the risk of thromboembolic
complication, maintain a continuous saline flush between the following items:
• the access sheath and the guide catheter
• the microcatheter or catheter and the guide catheter
• the microcatheter or catheter, the guidewire, and the MVP system.
2. Place the appropriate guide catheter following recommended procedure. Connect a rotating
hemostatic valve (RHV) to the hub of the guide catheter. Attach a 3-way stopcock to the side
arm of the RHV. Connect a heparinized saline line for a continuous flush.
3. Check all the fittings to ensure that air is not introduced into the guide catheter or the
microcatheter or catheter during the continuous flush.
10 Directions for use
1. Access the targeted vessel and perform an angiogram using standard technique to measure
the vessel diameter at the desired occlusion site. Ensure the targeted vessel meets the
recommended diameter (see Table 1).
2. Ensure that the occlusion site is long enough to accommodate the implanted MVP device
without obstructing unintended vessels.
3. Select a microcatheter or catheter (see Table 2 for recommended size) and prepare it
according to the manufacturer’s instructions for use.
4. Insert the guidewire and advance the microcatheter or catheter over the guidewire until the
distal tip is near the leading edge of the occlusion site.
5. Remove the guidewire from the microcatheter or catheter.
6. Remove the MVP system from the dispenser tube by gently removing the yellow introducer
sheath from the two outer clips and pull the MVP system out of the clear housing tube. Gently
grasp the introducer sheath at a place that is proximal to the MVP device, and slowly remove
the MVP device, the delivery wire and the introducer sheath simultaneously from the dispenser
tube. See Figure 3.
Figure 3. Packaged MVP system
If the MVP device is pulled too far into the introducer sheath it may not flush correctly. Two
Note:
holes in the introducer sheath, located 3 cm and 6 cm proximal to the tip of the sheath, facilitate
purging air and flushing the device.
10. Insert the MVP system by inserting the distal end of the introducer sheath through the RHV and
into the hub of the microcatheter or catheter until the sheath is firmly seated. Tighten the RHV
enough to prevent the back flow of blood, but not so tight as to damage the MVP system during
its introduction into the microcatheter or catheter.
11. Visually verify the flushing solution is infusing normally. Saline drops should be seen exiting the
proximal end of the introducer sheath.
12. Loosen the RHV enough to allow the MVP device and delivery wire to be advanced together
as a system. Do not loosen the RHV enough to allow the back flow of blood. Remove the
introducer sheath by withdrawing it over the delivery wire’s proximal end.
13. Advance the delivery wire and MVP device until the distal platinum marker of the MVP device
is aligned with the distal marker band on the microcatheter or catheter.
14. Confirm that the marker bands are positioned optimally. Deploy the MVP device by maintaining
forward pressure on the delivery wire while slowly retracting the microcatheter or catheter to
unsheath the MVP device.
15. If the device’s position is unsatisfactory, take the following actions:
a. Stabilize the delivery wire and advance the microcatheter or catheter by moving it distally,
until the MVP device is recaptured within the catheter.
b. Either reposition and deploy the device, or else remove the device from the patient.
Note: The device should not be resheathed and deployed more than a maximum of 3
times.
16. For proper detachment, the MVP device should be positioned beyond the microcatheter or
catheter tip.
17. If the device position is satisfactory, proceed with detachment by taking the following actions:
a. Confirm under fluoroscopy that the microcatheter or catheter tip is proximal to the MVP
device.
b. Attach the torquer to the delivery wire. Detach the MVP device by rotating the delivery wire
counterclockwise until it separates from the device.
c. Verify successful detachment fluoroscopically by slowly pulling the delivery wire in a
proximal direction to make sure the MVP device does not move. In the unlikely event the
MVP device moves in a proximal direction, re-establish the placement of the device and
repeat the counterclockwise rotation of the delivery wire for detachment.
18. While holding the microcatheter or catheter in place, retract the delivery wire into the
microcatheter or catheter and then remove the delivery wire from the patient. Complete the
procedure following standard technique.
11 Post procedural instructions
If the MedicAlert service is available in your region, recommend to the patient to become a
MedicAlert member at www.medicalert.org. The patient will be asked to provide his or her condition,
the name of the implanted device, and the restrictions concerning use of MRI.
12 MRI information
12.1 MR Conditional
1 Clear housing tube
2 Yellow introducer sheath
3 Delivery wire (inside introducer sheath)
7. Inspect the MVP system thoroughly for damage. If the MVP system is damaged, replace it with
a new MVP system.
8. Flush the MVP system by gently immersing a few centimeters of the introducer sheath and the
MVP device in heparinized saline.
9. Pull the MVP device into the introducer sheath by pulling the delivery wire just until the distal tip
of the MVP device is covered by the introducer sheath.
4 Torquer
5 Dispenser tube
6 MVP device
The MVP micro vascular plug was determined to be MR conditional. Non-clinical testing
demonstrated that the MVP micro vascular plug device is MR Conditional. A patient with this device
can be scanned safely, immediately after placement under the following conditions:
• Static magnetic field of 3 Tesla or less
• Maximum spatial gradient magnetic field of 9,000 Gauss/cm or less
• Maximum MR system reported, whole body averaged specific absorption rate (SAR) of 4 W/kg
for 15 minutes of scanning (i.e., per pulse sequence)
• First Level Controlled Operating Mode for the MR system
12.2 MRI related heating
In non-clinical testing, the MVP micro vascular plug device produced the following temperature rise
during MRI performed for 15 min of scanning (i.e., per pulse sequence) in the 3 Tesla MR system
(3 Tesla/128 MHz, Excite, HDx, Software 14X.M5, General Electric Healthcare, Milwaukee, WI):
Highest temperature change +1.8°C
Therefore, the MRI-related heating experiments for the MVP micro vascular plug device at 3 Tesla
using a transmit/receive RF body coil at an MR-system-reported whole-body-averaged SAR of
2.9 W/kg (i.e., associated with a calorimetry-measured whole-body-averaged value of 2.7 W/kg)
indicated that the greatest amount of heating that occurred in association with these specific
conditions was equal to or less than +1.8°C.
7
Page 8

12.3 Artifact information
MR image quality may be compromised if the area of interest is in the exact same area or relatively
close to the position of the MVP micro vascular plug device. Therefore, optimization of MR imaging
parameters to compensate for the presence of this device may be necessary. The maximum artifact
size (i.e., as seen on the gradient echo pulse sequence) extends approximately 5 mm relative to the
size and shape of the MVP micro vascular plug device.
Pulse Sequence T1-SE T1-SE GRE GRE
Signal Void Size 252 mm
Plane Orientation Parallel Perpendicular Parallel Perpendicular
2
91 mm
2
304 mm
2
116 mm
2
13 Storage
Avoid exposing the MVP system to water, sunlight, extreme temperatures, and high humidity during
storage. Store the MVP system under controlled room temperature. See the product label for the
device use-by date. Do not use the device beyond the labeled use-by date.
14 Materials
The MVP system is not made of any latex or PVC materials.
15 Disclaimer of warranty
The warnings contained in the product labeling provide more detailed information and are
considered an integral part of this disclaimer of warranty. Although the product has been
manufactured under carefully controlled conditions, Medtronic has no control over the
conditions under which this product is used. Medtronic, therefore, disclaims all
warranties, both express and implied, with respect to the product, including, but not
limited to, any implied warranty of merchantability or fitness for a particular purpose.
Medtronic shall not be liable to any person or entity for any medical expenses or any direct,
incidental, or consequential damages caused by any use, defect, failure, or malfunction of
the product, whether a claim for such damages is based upon warranty, contract, tort, or
otherwise. No person has any authority to bind Medtronic to any representation or
warranty with respect to the product.
The exclusions and limitations set out above are not intended to, and should not be construed so as
to, contravene mandatory provisions of applicable law. If any part or term of this disclaimer of
warranty is held to be illegal, unenforceable, or in conflict with applicable law by a court of competent
jurisdiction, the validity of the remaining portions of this disclaimer of warranty shall not be affected,
and all rights and obligations shall be construed and enforced as if this disclaimer of warranty did not
contain the particular part or term held to be invalid.
Български
1 Описание на устройството
Системата с микроваскуларна запушалка MVP е саморазгъващо се устройство за оклузия
на съд. Устройството MVP има яйцевидна форма, направено е от нитинол и е укрепено в
двата края с платинени маркерни ленти. Устройството включва частично покритие от
политетрафлуоретилен (PTFE). Проксималната маркерна лента се прикрепва към
проводник за поставяне, който избутва устройството през наличен в търговската мрежа
микрокатетър или катетър до предназначеното място за третиране. Проводникът за
поставяне се отделя от устройството MVP чрез завъртане на проводника за поставяне
обратно на часовниковата стрелка, за да се отвинти от устройството.
Системата MVP е опакована като едно цяло, което съдържа устройството MVP,
интродюсерно дезиле и отделящ се проводник за поставяне. Системата се предоставя
стерилна, тя е непирогенна и е предназначена само за еднократна употреба.
Фигура 1. Микроваскуларна запушалка MVP
1 Частично покритие
2 Дистален маркер
3 Устройство MVP
4 Зона на отделяне
5 Проводник за поставяне
6 Проксимален маркер
Фигура 2. Размери на системата MVP
1 Дължина на проводника за поставяне
2 Неограничена дължина (извадено устройство и без всякакви ограничения на него)
3 Неограничен диаметър
Таблица 1. Размери на MVP Модел Неограничен
MVP-3Q 5,3 mm 12 mm 180 cm 1,5 mm – 3,0 mm
MVP-5Q 6,5 mm 12 mm 180 cm 3,0 mm – 5,0 mm
MVP-7Q 9,2 mm 16 mm 165 cm 5,0 mm – 7,0 mm
MVP-9Q 13,0 mm 18 mm 165 cm 7,0 mm – 9,0 mm
Таблица 2. Препоръчителен микрокатетър или катетър Модел Препоръчителен микрока-
MVP-3Q 0,021 in (0,53 mm) до 0,027 in
MVP-5Q 0,027 in (0,69 mm) (ID) 153 cm
MVP-7Q 4 Fr (1,4 mm) (OD) 120 cm
MVP-9Q 5 Fr (1,7 mm) (OD) 120 cm
диаметър
Неограничена
дължина
тетър или катетър
(0,69 mm) (ID)
Дължина на
проводника за
поставяне
Препоръчителна максимална дължина на микрокатетъра или катетъра
153 cm
Диаметър на
целевия съд
2 Предназначение / показания за употреба
Системата с микроваскуларна запушалка MVP е предназначена да препятства или
намалява скоростта на кръвотока в периферната васкулатура.
3 Противопоказания
Няма известни противопоказания за това устройство.
4 Съвместимост
Вижте продуктовия етикет на системата MVP за размери на устройството. Вижте
етикетите, предоставени с други медицински технологии, за да определите
съвместимостта.
5 Предупреждения
• Безопасността и ефективността на системата MVP не са установени за кардиологично
приложение (напр. сърдечна септална оклузия, отворен артериален проток, затваряне
на излив покрай клапата) и неврологично приложение.
• Системата MVP трябва да се използва само от лекари, които са запознати с
ангиографските и интервенционалните процедури. Важно е инструкциите за употреба
да се прочетат преди да се използва системата MVP.
• Използвайте системата MVP преди датата „Използвайте до“, отпечатана на етикета на
опаковката на продукта.
• Системата MVP е непирогенна и се предоставя стерилна, освен ако опаковката на
системата MVP не е отворена или повредена. Да не се използва, ако опаковката е
нарушена или повредена.
• Проверете системата MVP преди употреба и я изхвърлете, ако се наблюдават
нередности или повреди.
• Системата MVP е предназначена само за еднократна употреба. Не подлагайте на
вторична обработка и не стерилизирайте повторно. Вторичната обработка и повторната
стерилизация могат да увеличат рисковете от инфекция за пациента и компрометирана
работа на устройството. След като използвате системата MVP, я изхвърлете в
съответствие с политиката на болницата и местното управление.
• Използвайте флуороскопски контрол, когато придвижвате или работите със системата
MVP. Когато усетите прекомерно съпротивление, не придвижвайте напред и не
8
Page 9

изтегляйте назад устройството, докато причината за съпротивлението не бъде
установена.
• Не извивайте и не въртете проводника за поставяне, освен когато възнамерявате да
отделите устройството, тъй като в противен случай устройството може да се отдели
преждевременно.
• Не използвайте инжектомат, за да инжектирате контрастен разтвор с устройството
през микрокатетър или катетър.
• Не придвижвайте напред проводника за поставяне след като го отделите от
устройството MVP.
• Лекарите трябва да са подготвени да се справят с неотложни ситуации, които изискват
отстраняване на устройството. Тази подготовка включва осигуряване на присъствието
на хирург на място.
• Не използвайте с катетри, които са противопоказни за устройства за емболизация
(например намотки или запушалка).
6 Предпазни мерки
• Устройството MVP се състои от никел-титаниева сплав, която обикновено се счита за
безопасна. Въпреки това ин витро изследванията показват, че от устройството се
освобождава никел в продължение на минимум 60 дни след имплантиране. Пациентите,
които са алергични към никел, могат да проявят алергична реакция към устройството,
особено пациентите с анамнеза за алергия към метали. Някои алергични реакции могат
да бъдат сериозни и пациентите трябва да бъдат инструктирани да уведомят незабавно
лекарите си, ако имат съмнения, че изпитват алергична реакция, като например
затруднено дишане или възпаление на лицето или гърлото. Някои пациенти могат да
развият алергия към никел, ако устройството е имплантирано.
• Лекарите трябва да прилагат клинична преценка в ситуации, които включват
използване на антикоагуланти или антитромбоцитни лекарства преди, по време на или
след употребата на устройството.
• Моля, обърнете внимание на следните специфични групи от населението:
– За бременни пациенти трябва да се вземат мерки за свеждане до минимум на
излагането на майката и плода на лъчение.
– За кърмещи майки не е направена количествена оценка на наличието на освободени
вещества в кърмата след имплантирането на устройството.
• Проверете съвместимостта на системата MVP при използване на други помощни
устройства при интраваскуларни процедури. Лекарите, използващи системата MVP,
трябва да са запознати с перкутанните интраваскуларни техники и възможните
усложнения, свързани с процедурата.
• Системата MVP трябва да бъде хидратирана преди употреба.
• Бъдете внимателни при работа със системата MVP, за да намалите вероятността от
непредвидени повреди.
• Съществува потенциал за по-голямо усилие за избутване при използване с набраздени
от слотове композитни нитинолови микрокатетри или катетри.
• Преди употреба се уверете, че диаметърът на всяко използвано допълнително
устройство е съвместим със системата MVP.
7 Възможни странични реакции
Възможните нежелани събития, които могат да настъпят по време на или след процедура
по поставяне на това устройство включват, но не се ограничават до следните точки:
• Въздушна емболия
• Алергична реакция или токсични ефекти
• Кървене
• Смърт
• Мигриране на устройството
• Повишена телесна температура
• Емболично събитие от чужд материал
• Инфекция
• Оклузия на различен от предвидения съд
• Периферна емболия
• Реканализация
• Остатъчен поток
• Инсулт или транзиторна исхемична атака (TIA)
• Хирургическа намеса
• Усложнение на мястото за васкуларен достъп
• Травма или перфорация на съд
8 Необходими материали
1. Поставянето на системата MVP изисква използването на микрокатетър или катетър
(вижте Таблица 2 за препоръчителен размер).
2. Необходими са следните аксесоари:
• Хепаринизиран физиологичен разтвор
• Въртяща се хемостатична клапа (ВХК)
• 3-пътен спирателен кран
• Маншет за налягане за сак с физиологичен разтвор
• Дезиле за достъп
• Водещ катетър, съвместим с микрокатетър или катетър, препоръчан в Таблица 2
• Водач, съвместим с водещия катетър и микрокатетъра или катетъра
• Стойка за интравенозна (IV) инфузия
9 Подготовка
1. За да се постигне оптимално действие на системата MVP и да се намали рискът от
тромбоемболично усложнение, поддържайте непрекъснато промиване с
физиологичен разтвор между следните елементи:
• дезилето за достъп и водещия катетър
• микрокатетъра или катетъра и водещия катетър
• микрокатетъра или катетъра, водача и системата MVP.
2. Поставете подходящия водещ катетър, следвайки препоръчаната процедура.
Свържете въртящата се хемостатична клапа (ВХК) към хъба на водещия катетър.
Прикрепете 3-пътен спирателен кран към страничното рамо на ВХК. Свържете линия
с хепаринизиран физиологичен разтвор за непрекъснато промиване.
3. Проверете всички връзки, за да се уверите, че във водещия катетър, микрокатетъра
или катетъра не влиза въздух по време на непрекъснатото промиване.
10 Ръководство за употреба
1. Получете достъп до целевия съд и извършете ангиограма, като използвате стандартна
техника, за да измерите диаметъра на съда на желаното място за оклузия. Уверете се,
че целевият съд съответства на препоръчания диаметър (вижте Таблица 1).
2. Уверете се, че мястото за оклузия е достатъчно дълго, за да побере имплантираното
устройство MVP, без да се запушват неволно други съдове.
3. Изберете микрокатетър или катетър (вижте Таблица 2 за препоръчителен размер) и го
подгответе съгласно инструкциите на производителя за употреба.
4. Въведете водача и придвижете напред микрокатетъра или катетъра върху водача,
докато дисталният връх достигне близо до предния край на мястото за оклузия.
5. Отстранете водача от микрокатетъра или катетъра.
6. Отстранете системата MVP от диспенсърната тръба, като внимателно отстраните
жълтото интродюсерно дезиле от двете външни скоби и извадите системата MVP от
прозрачната корпусна тръба. Внимателно хванете интродюсерното дезиле на място,
което е близко до устройството MVP, и бавно отстранете устройството MVP,
проводника за поставяне и интродюсерното дезиле едновременно от диспенсърната
тръба. Разгледайте Фигура 3.
Фигура 3. Опакована система MVP
1 Прозрачна корпусна тръба
2 Жълто интродюсерно дезиле
3 Проводник за поставяне (в
интродюсерното дезиле)
4 Устройство за извиване
5 Диспенсърна тръба
6 Устройство MVP
9
Page 10

7. Проверете старателно системата MVP за повреди. Ако системата MVP е повредена,
сменете я с нова система MVP.
8. Промийте системата MVP, като внимателно потопите няколко сантиметра от
интродюсерното дезиле и устройството MVP в хепаринизиран физиологичен разтвор.
9. Издърпайте устройството MVP в интродюсерното дезиле, издърпвайки проводника за
поставяне точно докато дисталният връх на устройството MVP се покрие от
интродюсерното дезиле.
Забележка: Ако устройството MVP е издърпано твърде далеч в интродюсерното
дезиле, то може да не се промие правилно. Два отвора в интродюсерното дезиле,
разположени на 3 cm и 6 cm проксимално на върха на дезилето, улесняват
прочистването на въздуха и промиването на устройството.
10. Въведете системата MVP чрез въвеждане на дисталния край на интродюсерното
дезиле през ВХК и в хъба на микрокатетъра или катетъра, докато дезилето бъде
здраво поставено. Затегнете ВХК достатъчно, за да предотвратите обратния поток на
кръв, но не толкова стегнато, че системата MVP да се повреди по време на
въвеждането й в микрокатетъра или катетъра.
11. Визуално проверете дали разтворът за промиване се влива нормално. Трябва да се
виждат капки физиологичен разтвор, излизащи от проксималния край на
интродюсерното дезиле.
12. Разхлабете ВХК достатъчно, за да позволите на устройството MVP и проводника за
поставяне да се придвижват заедно като система. Не разхлабвайте ВХК до такава
степен, че да позволите обратния поток на кръв. Отстранете интродюсерното дезиле,
като го издърпате над проксималния край на проводника за поставяне.
13. Придвижете напред проводника за поставяне и устройството MVP, докато дисталният
платинен маркер на устройството MVP се изравни с дисталната маркерна лента на
микрокатетъра или катетъра.
14. Потвърдете, че маркерните ленти са позиционирани оптимално. Разгънете
устройството MVP, като поддържате натиск напред на проводника за поставяне,
докато бавно издърпвате микрокатетъра или катетъра, за да извадите устройството
MVP.
15. Ако позицията на устройството е незадоволителна, извършете следните действия:
a. Стабилизирайте проводника за поставяне и придвижете напред микрокатетъра
или катетъра, като го премествате дистално, докато устройството MVP се върне в
катетъра.
b. Позиционирайте повторно и разгънете устройството или, в противен случай,
отстранете устройството от пациента.
Забележка: Устройството не трябва да се прибира в дезилето и разгъва повече от
максимум 3 пъти.
16. За правилно отделяне устройството MVP трябва да бъде разположено отвъд върха на
микрокатетъра или катетъра.
17. Ако позицията на устройството е задоволителна, продължете с отделянето, като
извършите следните действия:
a. Под флуороскопски контрол потвърдете, че върхът на микрокатетъра или
катетъра е разположен проксимално на устройството MVP.
b. Прикрепете устройството за извиване към проводника за поставяне. Отделете
устройството MVP, като завъртите проводника за поставяне обратно на
часовниковата стрелка, докато се отдели от устройството.
c. Проверете успешното отделяне чрез флуороскопия, като издърпате бавно
проводника за поставяне в проксимална посока, за да се уверите, че устройството
MVP не се движи. В малко вероятния случай устройството MVP да се придвижи в
проксимална посока, възстановете поставянето на устройството и повторете
въртенето на проводника за поставяне обратно на часовниковата стрелка за
отделяне.
18. Докато държите микрокатетъра или катетъра на място, издърпайте проводника за
поставяне в микрокатетъра или катетъра и след това отстранете проводника за
поставяне от пациента. Завършете процедурата, като следвате стандартна техника.
11 Инструкции след процедурата
Ако услугата MedicAlert е налична във вашия регион, препоръчайте на пациента да стане
член на MedicAlert на www.medicalert.org. Пациентът ще бъде подканен да посочи своето
състояние, името на имплантираното устройство и ограниченията относно използването на
ЯМР.
12 Информация за ЯМР
12.1 Условен МР
Микроваскуларната запушалка MVP е определена като МР условна. Неклиничните
изследвания показват, че устройството с микроваскуларна запушалка MVP е МР условно.
Пациент с това устройство може да се сканира безопасно веднага след поставянето му при
следните условия:
• Статично магнитно поле от 3 тесла или по-малко
• Максимално пространствено градиентно магнитно поле от 9000 Gauss/cm или по-малко
• Максимална отчетена за МР система, усреднена за цялото тяло специфична скорост на
абсорбция (SAR) от 4 W/kg за 15 минути сканиране (т.е. на импулсна последователност)
• Работен режим с управление от първо ниво за МР системата
12.2 Нагряване, свързано с ЯМР
При неклинични тестове устройството с микроваскуларна запушалка MVP е произвело
следното повишение на температурата по време на ЯМР сканиране, извършено за 15 min
(т.е. на импулсна последователност) в МР система от 3 тесла (3 тесла/128 MHz, Excite, HDx,
софтуер 14X.M5, General Electric Healthcare, Милуоки, WI): Най-висока промяна на
температурата +1,8°C
Следователно, свързаните с ЯМР експерименти за нагряване за устройството с
микроваскуларна запушалка MVP при 3 тесла, използвайки РЧ предавателна/приемателна
намотка за тяло при отчетена от МР система осреднена SAR стойност за цялото тяло от
2,9 W/kg (т.е. свързана с калориметрично измервана средна стойност на цялото тяло
2,7 W/kg), показват, че най-голямото нагряване, което е настъпило във връзка с тези
специфични условия, е равно на или по-малко от + 1,8°C.
12.3 Информация за артефакт
Качеството на изображението от магнитен резонанс може да бъде нарушено, ако зоната на
интерес съвпада точно или е сравнително близо до позицията на устройството с
микроваскуларна запушалка MVP. Поради тази причина може да бъде необходимо
параметрите на МР изображението да се оптимизират, за да се компенсира присъствието
на това устройство. Максималният размер на артефакта (т.е. както се вижда с градиентна
ехо-импулсна последователност) е приблизително 5 mm в съотношение към размера и
формата на устройството с микроваскуларна запушалка MVP.
Импулсна
последователност
Размер на области без сигнал
Равнинна ориентация
T1-SE T1-SE GRE GRE
2
252 mm
Паралелна Перпендику-
91 mm
лярна
2
2
304 mm
Паралелна Перпендику-
116 mm
лярна
2
13 Съхранение
Избягвайте излагане на системата MVP на вода, слънчева светлина, екстремни
температури и висока влажност по време на съхранение. Съхранявайте системата MVP при
контролирана стайна температура. Вижте етикета на продукта за срока на годност на
устройството. Не използвайте устройството след обозначения на етикета срок на годност.
14 Материали
Системата MVP не е направена от латекс или PVC материали.
15 Отказ от гаранции
Предупрежденията, които се съдържат в етикетите на продукта, съдържат подробна
информация, и се считат за неразделна част от този отказ от гаранции. Въпреки че
продуктът е произведен при внимателно контролирани условия, Medtronic няма
контрол върху условията, при които той се използва. Поради тази причина Medtronic
отхвърля всички гаранции, изрични или подразбиращи се, по отношение на
продукта, включително, но не само, всяка произтичаща гаранция за продаваемост
или годност за определена цел. Medtronic не носи отговорност пред никой отделен
индивид или субект за каквито и да било медицински разходи или директни,
случайни или последващи щети, нанесени от употреба, дефект или неизправност на
продукта, независимо дали искът се основава на гаранция, договор, законово
нарушение или друго. Никое лице няма право да обвързва Medtronic с каквото и да
било представителство или гаранция относно продукта.
Изключенията и ограниченията, наложени по-горе, не са предназначени и не трябва да се
тълкуват като противоречащи на задължителните разпоредби на приложимото
законодателство. Ако някоя част или условие от настоящата Ограничена гаранция се
приемат от някой съд с компетентна юрисдикция за незаконни, неизпълними или в
противоречие с приложимия закон, валидността на останалата част от настоящата
Ограничена гаранция няма да бъде повлияна и всички права и задължения ще бъдат
10
Page 11

изтълкувани и изпълнени така, сякаш тази Ограничена гаранция не е съдържала частта или
условието, счетени за невалидни.
Česky
1 Popis výrobku
Systém cévní mikrouzávěry MVP je samoexpandující zařízení používané k uzavření cévy. Toto
zařízení MVP má vejčitý tvar, je vyrobeno z nitinolu a na obou koncích je opatřeno platinovými
proužkovými značkami. Výrobek je částečně potažen PTFE. Proximální proužková značka je
připojena k zaváděcímu drátu, který posunuje zařízení komerčně dostupným mikrokatétrem či
katétrem na místo zamýšleného ošetření. Otáčením zaváděcího drátu proti směru hodinových
ručiček se zaváděcí drát od zařízení MVP oddělí (odšroubuje).
Systém MVP je balený jako jedna jednotka obsahující zařízení MVP, zaváděcí pouzdro (plášť) a
oddělitelný zaváděcí drát. Systém se dodává sterilní, je nepyrogenní a je určen pouze
k jednorázovému použití.
Obrázek 1. Systém cévní mikrouzávěry MVP
1 Částečný potah
2 Distální značka
3 Zařízení MVP
Obrázek 2. Rozměry systému MVP
1 Délka zaváděcího drátu
2 Délka bez omezení (zařízení mimo pouzdro
a bez jakýchkoli omezujících faktorů)
Tabulka 1. Rozměry MVP Model Průměr bez
MVP-3Q 5,3 mm 12 mm 180 cm 1,5 mm – 3,0 mm
MVP-5Q 6,5 mm 12 mm 180 cm 3,0 mm – 5,0 mm
MVP-7Q 9,2 mm 16 mm 165 cm 5,0 mm – 7,0 mm
MVP-9Q 13,0 mm 18 mm 165 cm 7,0 mm – 9,0 mm
Tabulka 2. Doporučený mikrokatétr nebo katétr Model Doporučený mikrokatétr
MVP-3Q 0,53 mm (0,021 in) až 0,69 mm
MVP-5Q 0,69 mm (0,027 in) (vnitř. prů-
MVP-7Q 4 Fr (1,4 mm) (vněj. průměr) 120 cm
MVP-9Q 5 Fr (1,7 mm) (vněj. průměr) 120 cm
omezení
Délka bez omezení
nebo katétr
(0,027 in) (vnitř. průměr)
měr)
4 Oblast odpojení
5 Zaváděcí drát
6 Proximální značka
3 Průměr bez omezení
Délka zaváděcího drátu
Doporučený mikrokatétr
nebo katétr – max. délka
153 cm
153 cm
Průměr cílové
cévy
2 Určené použití / indikace k použití
Systém cévní mikrouzávěry MVP je indikován k dosažení uzávěru nebo snížení průtoku krve
v periferních cévách.
3 Kontraindikace
Žádné kontraindikace související s použitím tohoto prostředku nejsou známy.
4 Kompatibilita
Rozměry výrobku jsou uvedeny na štítku systému MVP. Kompatibilitu zjistíte v dokumentaci dodané
spolu s dalšími lékařskými technickými prostředky.
5 Varování
• Bezpečnost a účinnost systému MVP při použití u kardiologických (např. okluze srdečního
septa, otevřená Botallova dučej, uzávěr paravalvulárního leaku) a neurologických onemocnění
nebyly stanoveny.
• Systém MVP smí používat pouze lékaři s dobrou znalostí angiografických a intervenčních
postupů. Před použitím systému MVP je důležité si přečíst návod k použití.
• Systém MVP použijte před datem použitelnosti uvedeným na štítku na obalu výrobku.
• Systém MVP je apyrogenní a dodává se sterilní, pokud není balení systému MVP otevřené nebo
poškozené. Nepoužívejte, pokud je obal porušený nebo poškozený.
• Systém MVP před použitím prohlédněte, a pokud zjistíte jakékoli nesrovnalosti či poškození,
zlikvidujte jej.
• Systém MVP je určen pouze k jednorázovému použití. Neprovádějte renovaci ani resterilizaci.
Renovace a resterilizace mohou zvýšit riziko infekce pacienta a vést k riziku narušení funkce
prostředku. Po použití systém MVP zlikvidujte v souladu s místními nemocničními předpisy a
předpisy místních správních orgánů.
• Při zavádění systému MVP a při manipulaci s ním je nutno používat skiaskopickou kontrolu.
Pokud se setkáte s nadměrným odporem, nezasunujte ani nevytahujte toto zařízení, dokud
nezjistíte příčinu odporu.
• Zaváděcím drátem nekruťte ani jím neotáčejte, kromě případů, kdy chcete zařízení oddělit
zaváděcího drátu – jinak by se zařízení mohlo oddělit předčasně.
• Nepoužívejte přetlakový injektor ke vstřikování kontrastního roztoku mikrokatétrem či katétrem
se zavedeným zařízením.
• Po odpojení zařízení MVP již zaváděcí drát nezasunujte.
• Lékaři musí být připraveni na řešení urgentních situací vyžadujících vyjmutí zařízení. Tato
připravenost znamená, že na pracovišti musí být k dispozici chirurg.
• Nepoužívejte s katétry, jejichž použití je kontraindikováno u embolizačních prostředků
(například spirál nebo uzávěr).
6 Bezpečnostní opatření
• Zařízení MVP je vyrobeno ze slitiny niklu a titanu, která se obecně považuje za bezpečnou.
Testováním in vitro však bylo prokázáno, že se ze zařízení po dobu minimálně 60 dnů po
implantaci uvolňuje nikl. Pacienti, kteří jsou alergičtí na nikl, mohou mít alergickou reakci na nikl;
to se týká zejména pacientů s alergií na kovy v anamnéze. Některé alergické reakce mohou být
závažné; pacienty je nutno poučit, aby lékaře okamžitě upozornili, pokud by se domnívali, že u
nich dochází k alergické reakci, např. pokud by měli potíže s dýcháním nebo zánět ve tváři či
v hrdle. U některých pacientů se po implantaci zařízení může vyvinout alergie na nikl.
• V situacích s použitím antikoagulancií nebo antiagregačních přípravků před, během nebo po
použití zařízení musí lékaři postupovat podle svého klinického úsudku.
• U následujících specifických populací je třeba dbát zvláštní opatrnosti:
– U těhotných pacientek je nutno dbát na minimalizaci expozice matky i plodu vůči záření.
– U kojících matek nebylo provedeno kvantitativní hodnocení přítomnosti vyluhovaných látek
v mateřském mléce po implantaci zařízení.
• Při používání dalších pomocných prostředků při intravaskulárních výkonech ověřte jejich
kompatibilitu se systémem MVP. Lékaři používající systém MVP musí být obeznámeni
s perkutánními a intravaskulárními technikami a s možnými komplikacemi souvisejícími
s výkonem.
• Před použitím musí být systém MVP hydratován.
• Při manipulaci se systémem MVP postupujte opatrně, aby se snížila pravděpodobnost
náhodného poškození.
• Při použití s drážkovanými mikrokatétry či katétry z kompozitu nitinolu je možné použít větší
tlačnou sílu.
• Před použitím ověřte, že je průměr všech použitých pomocných zařízení kompatibilní se
systémem MVP.
7 Možné nežádoucí účinky
Mezi možné nežádoucí příhody, které se mohou vyskytnout během nebo po zavedení tohoto
zařízení, mimo jiné patří:
• Vzduchová embolie
• Alergická reakce nebo toxické účinky
11
Page 12

• krvácení,
• Smrt
• Migrace prostředku
• horečka,
• Embolizace cizího tělesa
• infekce;
• Neúmyslný uzávěr jiné cévy
• Periferní embolie
• Rekanalizace
• Reziduální průtok
• Cévní mozková příhoda nebo tranzitorní ischemická ataka (TIA)
• Chirurgický zákrok
• Komplikace v místě vstupu do cévy
• Zranění nebo perforace cévy
8 Požadované materiály
1. K zavedení systému MVP je nutné použít mikrokatétr nebo katétr (doporučená velikost viz
Tabulka 2).
2. Požadováno je následující příslušenství:
• Heparinizovaný fyziologický roztok
• Rotační hemostatický ventil (RHV)
• Třícestný uzavírací kohout
• Manžeta na vak s fyziologickým roztokem
• Přístupové pouzdro
• Vodicí katétr kompatibilní s mikrokatétrem nebo katétrem, který doporučuje Tabulka 2
• Vodicí drát kompatibilní s vodicím katétrem a mikrokatétrem nebo katétrem
• Infuzní stojan pro intravenózní (i.v.) infuzi
9 Příprava
1. Aby bylo dosaženo optimálního výkonu systému MVP a snížilo se riziko tromboembolických
komplikací, musí být udržováno kontinuální proplachování fyziologickým roztokem mezi:
• přístupovým pouzdrem a vodicím katétrem,
• mikrokatétrem nebo katétrem a vodicím katétrem,
• mikrokatétr nebo katétrem, vodicím drátem a systémem MVP.
2. Zaveďte příslušný vodicí katétr podle doporučeného postupu. Ke kónusu vodicího katétru
připojte rotační hemostatický ventil (RHV). Připojte třícestný uzavírací kohout k bočnímu
ramenu RHV. Připojte hadičku pro kontinuální proplachování heparinizovaným fyziologickým
roztokem.
3. Zkontrolujte veškerá spojení, aby se do vodicího katétru nebo mikrokatétru či katétru
nedostával během kontinuálního proplachování vzduch.
10 Pokyny k použití
1. Standardní technikou zajistěte přístup do cílové cévy a proveďte angiogram ke změření
průměru cévy v místě požadovaného uzávěru. Ujistěte se, že cílová céva vyhovuje
doporučenému průměru (viz Tabulka 1).
2. Ujistěte se, že místo okluze je dostatečně dlouhé, aby se do něj vešlo implantované zařízení
MVP, aniž by došlo k obstrukci jiných, nezamýšlených cév.
3. Vyberte mikrokatétr nebo katétr (doporučená velikost viz Tabulka 2) a připravte jej podle
návodu k použití od výrobce.
4. Zaveďte vodicí drát a zasunujte mikrokatétr nebo katétr po vodicím drátu, dokud se jeho
distální konec nepřesune do blízkosti toho čelního okraje místa okluze.
5. Vytáhněte z mikrokatétru nebo katétru vodicí drát.
6. Vyjměte systém MVP z trubicového zásobníku tak, že opatrně uvolníte žluté zaváděcí pouzdro
ze dvou vnějších svorek a vytáhnete systém MVP z průhledného trubicového pláště. Opatrně
uchopte zaváděcí pouzdro proximálně od zařízení MVP a pomalu vytáhněte z trubicovitého
zásobníku současně zařízení MVP, zaváděcí drát a zaváděcí pouzdro. Viz Obrázek 3.
Obrázek 3.
7. Důkladně systém MVP prohlédněte, zda není poškozený. V případě, že je systém MVP
poškozený, jej nahraďte novým systémem MVP.
8. Propláchněte systém MVP opatrným ponořením několika centimetrů zaváděcího pouzdra a
zařízení MVP do heparinizovaného fyziologického roztoku.
9. Vtáhněte zařízení MVP do zaváděcího pouzdra tak, že zatáhnete za zaváděcí drát, až bude
distální konec zařízení MVP právě překrytý zaváděcím pouzdrem.
Poznámka: Pokud se zařízení MVP zatáhne příliš daleko do zaváděcího pouzdra, nemusí být
správně propláchnuto. Dva otvory v zaváděcím pouzdru, které se nacházejí 3 cm a 6 cm od
proximálního konce pouzdra, usnadňují odvzdušnění a proplachování.
10. Zaveďte systém MVP protahováním distálního konce zaváděcího pouzdra skrz RHV do
kónusu mikrokatétru nebo katétru tak, až se pouzdro pevně usadí. Utáhněte RHV natolik, aby
se zabránilo zpětnému toku krve, ale ne příliš silně, aby nedošlo k poškození systému MVP při
zavádění do mikrokatétru nebo katétru.
11. Vizuálně ověřte, že infuze proplachovacího roztoku probíhá normálně. Na proximálním konci
zaváděcího pouzdra musí být vidět vystupující kapky fyziologického roztoku.
12. Povolte RHV natolik, aby bylo možné posunovat zařízení MVP a zaváděcí drát společně jako
jeden systém. Nepovolujte RHV natolik, aby byl umožněn zpětný tok krve. Vytáhněte zaváděcí
pouzdro přes proximální konec zaváděcího drátu.
13. Zasunujte zaváděcí drát a zařízení MVP, dokud se distální platinová značka na zařízení MVP
nezarovná s distální proužkovou značkou mikrokatétru nebo katétru.
14. Ověřte, zda jsou proužkové značky v optimální poloze. Rozviňte zařízení MVP tak, budete
udržovat dopředný tlak na zaváděcí drát a současně budete pomalu zatahovat mikrokatétr
nebo katétr zpět, čímž se zařízení MVP obnaží (zbaví pouzdra).
15. Pokud není umístění prostředku uspokojivé, proveďte následující opatření:
16. Ke správnému oddělení musí být zařízení MVP v poloze za hrotem mikrokatétru či katétru.
17. Pokud je umístění zařízení uspokojivé, pokračujte jeho oddělením v následujících krocích:
18. Držte mikrokatétr nebo katétr na místě, zatáhněte zaváděcí drát do mikrokatétru nebo katétru
a poté vytáhněte zaváděcí drát z těla pacienta. Dokončete výkon za použití standardních
postupů.
Zabalený systém MVP
1 Průhledný trubicový plášť
2 Žluté zaváděcí pouzdro
3 Zaváděcí drát (uvnitř zaváděcího
pouzdra)
4 Torzní nástroj
5 Trubicový zásobník
6 Zařízení MVP
a. Stabilizujte zaváděcí drát a posunujte mikrokatétr nebo katétr distálně, dokud se zařízení
MVP znovu nezasune do katétru.
b. Upravte polohu zařízení a rozviňte jej, nebo zařízení vytáhněte z těla pacienta.
Poznámka: Zařízení se nesmí zatáhnout zpět do pouzdra a rozvinout více než 3krát.
a. Skiaskopicky ověřte, že je hrot mikrokatétru nebo katétru umístěn proximálně od zařízení
MVP.
b. K zaváděcímu drátu připojte torzní nástroj. Otáčením zaváděcího drátu proti směru
hodinových ručiček oddělte zaváděcí drát od zařízení MVP.
c. Za skiaskopické kontroly ověřte, že došlo k úspěšnému oddělení tak, že pomalu
potáhnete za zaváděcí drát proximálně a ujistíte se, že se zařízení MVP neposune.
V nepravděpodobném případě, že se zařízení MVP posune proximálně, vraťte zařízení do
původní polohy a oddělte jej otáčením zaváděcího drátu proti směru hodinových ručiček.
11 Pokyny k péči po výkonu
Pokud je ve vaší oblasti dostupná služba MedicAlert, doporučte pacientovi, aby se stal členem
služby MedicAlert na www.medicalert.org. Pacient bude požádán, aby uvedl své onemocnění,
název implantovaného zařízení a omezení týkající se použití MRI.
12
Page 13

12 Informace o magnetické rezonanci (MRI)
12.1 Podmíněné použití magnetické rezonance
Bylo zjištěno, že cévní mikrouzávěra MVP umožňuje zobrazení magnetickou rezonancí za dodržení
určitých podmínek. Při neklinických testech bylo zjištěno, že cévní mikrouzávěra MVP je
podmíněně bezpečná při vyšetření MRI. Pacient s tímto implantátem může být bezpečně
snímkován ihned po implantaci za následujících podmínek:
• Statické magnetické pole o indukci 3 tesla nebo méně
• Maximální prostorový gradient magnetického pole 9000 gaussů/cm nebo méně
• Systémem magnetické rezonance uváděná nejvyšší hodnota průměrného celotělového
měrného absorbovaného výkonu (specific absorption rate - SAR) 4 W/kg na 15 minut snímání
(tj. na jednu pulzní sekvenci)
• Řízený provozní režim první úrovně na systému MR
12.2 Zahřívání v souvislosti se zobrazením magnetickou rezonancí (MR)
Při neklinickém testování produkovala cévní mikrouzávěra MVP následující nárůst teploty během
vyšetření MRI prováděného po dobu 15 min (tj. na jednu pulzní sekvenci) pomocí systému MRI o
indukci 3 tesla (3 tesla/ 128 MHz, Excite, HDx, Software 14X.M5, General Electric Healthcare,
Milwaukee, WI): maximální změna teploty +1,8°C
Teplotní pokusy související s MRI proto u cévní mikrouzávěry MVP ukazují, že při maximálním
průměrném celotělovém měrném absorbovaném výkonu (SAR) 2,9 W/kg (tj. ve spojitosti s
kalorimetrií se na celém těle naměřila průměrná hodnota 2,7 W/kg) při snímkování MR systémem
MR s magnetickým polem 3 T používajícím vysílací/přijímací celotělovou RF cívku, se nejvyšší míra
ohřevu spojená s těmito specifickými podmínkami rovnala nebo byla nižší než +1,8°C.
12.3 Informace o artefaktech
Kvalita snímku magnetické rezonance může být zhoršena, pokud se oblast zájmu nachází přesně
ve stejném prostoru nebo relativně blízko cévní mikrouzávěry MVP. Z tohoto důvodu může být nutná
optimalizace parametrů snímání MR kompenzující přítomnost tohoto prostředku. Maximální
velikost artefaktů (pozorovaných v podmínkách zobrazení pulzní sekvencí gradientního echa) do
vzdálenosti přibližně 5 mm vzhledem k velikosti a tvaru cévní mikrouzávěry MVP.
Pulzní sekvence
Velikost plochy s
chybějícím signálem
Orientace roviny Paralelní Kolmá Paralelní Kolmá
T1-SE T1-SE GRE GRE
252 mm
2
91 mm
2
304 mm
2
116 mm
2
Dansk
1 Beskrivelse af enheden
MVP-systemet med mikrovaskulær prop er en selvekspanderende enhed til karokklusion.
MVP-enheden er ægformet, fremstillet af nitinol og sikret i begge ender med platinmarkørbånd.
Enheden har et indbygget delvist hylster af PTFE. Det proksimale markørbånd sidder på en
indføringswire, der skubber enheden igennem et kommercielt tilgængeligt mikrokateter eller kateter
til det tilsigtede behandlingssted. Indføringswiren kobles fra MVP-enheden ved at indføringswiren
drejes mod uret, så den skrues af enheden.
MVP-systemet er pakket som en enkelt enhed, der indeholder MVP-enheden, et indføringshylster
og en aftagelig indføringswire. Systemet leveres sterilt, er ikke-pyrogent og udelukkende beregnet
til engangsbrug.
Figur 1. MVP-mikrovaskulær prop
1 Delvist hylster
2 Distal markør
3 MVP-enhed
4 Frakoblingszone
5 Indføringswire
6 Proksimal markør
Figur 2. MVP-systemets mål
13 Skladování
Během skladování nevystavujte systém MVP působení vody, přímého slunečního záření,
extrémních teplot a vysoké vlhkosti. Systém MVP skladujte při regulované pokojové teplotě. Datum
použitelnosti zařízení najdete na štítku výrobku. Zařízení nepoužívejte po datu použitelnosti
uvedeném na štítku.
14 Materiály
Systém MVP neobsahuje latex ani PVC.
15 Odmítnutí záruky
Varování uvedená na štítcích výrobku obsahují podrobnější informace a jsou považována
za nedílnou součást tohoto odmítnutí záruky. Ačkoli byl tento výrobek vyroben za pečlivě
kontrolovaných podmínek, nemá společnost Medtronic žádný vliv na podmínky, za
kterých je tento výrobek používán. Společnost Medtronic proto odmítá odpovědnost za
jakékoli záruky za tento výrobek, ať už přímé nebo předpokládané, mimo jiné včetně
jakýchkoli předpokládaných záruk prodejnosti nebo vhodnosti k určitému účelu.
Společnost Medtronic neodpovídá žádné osobě ani právnímu subjektu za jakékoli
zdravotní výdaje nebo přímé, náhodné či následné škody způsobené použitím, vadou,
selháním nebo chybnou funkcí výrobku, bez ohledu na to, zda nárok vyplývá ze záruky,
smlouvy, protiprávního činu či z jiného důvodu. Žádná osoba není oprávněna zavázat
společnost Medtronic k poskytnutí jakéhokoli prohlášení nebo záruky týkající se tohoto
výrobku.
Záměrem výše uvedených výjimek a omezení není porušování závazných ustanovení příslušných
právních předpisů a ani by tak neměly být interpretovány. Pokud bude kterákoli část nebo podmínka
tohoto odmítnutí záruky shledána příslušným soudem jako protiprávní, nevynutitelná nebo v
rozporu s příslušnými právními předpisy, nemá to vliv na platnost zbývající části tohoto odmítnutí
záruky a všechna práva a závazky budou chápány a uplatněny tak, jako by toto odmítnutí záruky
neobsahovalo tuto konkrétní část nebo podmínku, která byla shledána neplatnou.
1 Længde på indføringswire
2 Længde i ubegrænset stand (enhed uden hylster og uden nogen begrænsninger på den)
3 Diameter i ubegrænset stand
Tabel 1. MVP-mål Model Diameter i ube-
MVP-3Q 5,3 mm 12 mm 180 cm 1,5 mm – 3,0 mm
MVP-5Q 6,5 mm 12 mm 180 cm 3,0 mm – 5,0 mm
MVP-7Q 9,2 mm 16 mm 165 cm 5,0 mm – 7,0 mm
MVP-9Q 13,0 mm 18 mm 165 cm 7,0 mm – 9,0 mm
Tabel 2. Anbefalet mikrokateter eller kateter Model Anbefalet mikrokateter eller
MVP-3Q 0,021 in (0,53 mm) til 0,027 in
MVP-5Q 0,027 in (0,69 mm) (ID) 153 cm
MVP-7Q 4 Fr (1,4 mm) (UD) 120 cm
MVP-9Q 5 Fr (1,7 mm) (UD) 120 cm
grænset stand
Længde i ubegrænset stand
kateter
(0,69 mm) (ID)
Længde på indføringswire
Maks. længde på anbefalet
mikrokateter eller kateter
153 cm
Diameter på
målkar
2 Tilsigtet brug / Indikationer for brug
MVP-systemet med mikrovaskulær prop er indiceret til obstruktion eller reduktion af
blodgennemstrømningshastigheden i den perifere vaskulatur.
13
Page 14

3 Kontraindikationer
Der er ingen kendte kontraindikationer for denne enhed.
4 Kompatibilitet
Se enhedens mål på MVP-systemets produktmærkning. Se mærkningen på andre medicinske
enheder for at bestemme kompatibiliteten.
5 Advarsler
• Sikkerheden ved og effektiviteten af MVP-systemet er ikke blevet fastslået til kardiel brug (f.eks.
kardiel septumokklusion, åben ductus arteriosus, lukning af paravalvulær lækage) og
neurologisk brug.
• MVP-systemet må kun anvendes af læger, som er fortrolige med angiografiske og
interventionelle procedurer. Det er vigtigt at læse brugsanvisningen, inden MVP-systemet
tages i brug.
• MVP-systemet skal anvendes inden datoen for sidste anvendelse, som er trykt på
produktemballagens etiket.
• MVP-systemet er ikke-pyrogent og leveres sterilt, medmindre emballagen med MVP-systemet
er åbnet eller beskadiget. Må ikke anvendes, hvis der er brud på emballagen, eller hvis den er
beskadiget.
• Undersøg MVP-systemet inden brug, og kassér det, hvis der konstateres nogen form for
uregelmæssigheder eller beskadigelse.
• MVP-systemet er kun beregnet til engangsbrug. Må ikke genbehandles eller resteriliseres.
Genbehandling og resterilisering kan øge risiciene for, at patienten udsættes for
infektionsrisiko, eller at der opstår nedsat funktionsevne i enheden. Efter brug af MVP-systemet
skal det bortskaffes i henhold til hospitalets samt lokale love og regler.
• Brug fluoroskopisk vejledning, når MVP-systemet føres frem eller manipuleres. Hvis der
mærkes stor modstand, må enheden ikke føres frem eller trækkes tilbage, før årsagen til
modstanden er fundet.
• Indføringswiren må ikke vrides eller drejes, undtagen når enheden skal kobles fra, idet det ellers
kan frakoble enheden for tidligt.
• Der må ikke anvendes en trykinjektorsprøjte til injektion af kontrastmiddel med enheden
gennem et mikrokateter eller kateter.
• Indføringswiren må ikke føres frem, når den er koblet fra MVP-enheden.
• Lægerne skal være forberedt på at håndtere akutte situationer, som kræver fjernelse af
enheden. Dette betyder, at der skal være en kirurg til rådighed på stedet.
• Må ikke anvendes sammen med katetre, der er kontraindiceret til emboliske anordninger (f.eks.
spiraler eller en prop).
6 Forholdsregler
• MVP-enheden består af en nikkel-titan-legering, der generelt anses for at være sikker. In-vitro
testning har dog påvist, at nikkel afgives fra enheden efter implantation i mindst 60 dage.
Patienter, som er allergiske over for nikkel, kan få en allergisk reaktion på enheden, især
patienter med metalallergier i anamnesen. Visse allergiske reaktioner kan være alvorlige.
Patienterne skal instrueres i straks at informere deres læge, hvis de har mistanke om, at de har
en allergisk reaktion, som f.eks. vejrtrækningsbesvær eller inflammation i ansigt eller hals.
Nogle patienter kan udvikle allergi over for nikkel, hvis enheden implanteres.
• Lægerne skal foretage et klinisk skøn i situationer, der omfatter brug af antikoagulantia eller
antitrombotika før, under eller efter anvendelse af enheden.
• Vær forsigtig ved følgende specifikke populationer:
– Ved gravide patienter er det vigtigt at sørge for, at mor og foster eksponeres mindst muligt for
stråling.
– For ammende mødre gælder det, at der ikke er foretaget nogen kvantitativ vurdering af,
hvorvidt der er lækstoffer i brystmælk efter implantering af enheden.
• Kontrollér MVP-systemets kompatibilitet, når der anvendes andre hjælpeanordninger i
intravaskulære procedurer. Læger, der anvender MVP-systemet, skal være fortrolige med
perkutane, intravaskulære teknikker og mulige komplikationer forbundet med proceduren.
• MVP-systemet skal hydreres før brug.
• Vær forsigtig ved håndteringen af MVP-systemet for at mindske risikoen for utilsigtet
beskadigelse.
• Der skal muligvis anvendes flere kræfter til at skubbe enheden, når den anvendes sammen med
kærvede mikrokatetre eller katetre af kompositnitinol.
• Kontrollér, at diameteren på de hjælpeanordninger, der anvendes, er kompatible med
MVP-systemet inden brug.
7 Mulige bivirkninger
Potentielle bivirkninger, der kan forekomme under eller efter en procedure, hvor denne enhed
anbringes, omfatter, men er ikke begrænset til, følgende:
• Luftemboli
• Allergisk reaktion eller toksiske virkninger
• Blødning
• Død
• Migrering af enheden
• Feber
• Emboli forårsaget af fremmedlegeme
• Infektion
• Okklusion af utilsigtet kar
• Perifer emboli
• Rekanalisering
• Restflow
• Slagtilfælde eller forbigående iskæmisk anfald (TIA)
• Kirurgisk indgreb
• Komplikation på det vaskulære adgangssted
• Kartraume eller -perforation
8 Nødvendige materialer
1. Indføring af MVP-systemet kræver brug af et mikrokateter eller et kateter (se anbefalet
størrelse i Tabel 2).
2. Følgende tilbehør er nødvendigt:
• Hepariniseret saltvandsopløsning
• Drejelig hæmostaseventil (RHV)
• 3-vejs stophane
• Trykmanchet til saltvandspose
• Adgangshylster
• Guidekateter, der er kompatibelt med et mikrokateter eller et kateter, som anbefales i
Tabel 2
• Guidewire, der er kompatibel med guidekateteret og mikrokateteret eller kateteret
• Dropstativ
9 Klargøring
1. For at opnå optimal ydelse af MVP-systemet og for at reducere risikoen for tromboemboliske
komplikationer, skal der opretholdes en kontinuerlig skylning med saltvand mellem følgende:
• adgangshylsteret og guidekateteret
• mikrokateteret eller kateteret og guidekateteret
• mikrokateteret eller kateteret, guidewiren og MVP-systemet.
2. Anbring det egnede guidekateter i overensstemmelse med den anbefalede procedure. Tilslut
en drejelig hæmostaseventil (RHV) til muffen på guidekateteret. Sæt en 3-vejs stophane på
hæmostaseventilens sidearm. Tilslut en slange med hepariniseret saltvand til kontinuerlig
skylning.
3. Kontrollér alle forbindelserne for at sikre, at der ikke indføres luft i guidekateteret eller
mikrokateteret eller kateteret under den kontinuerlige skylning.
10 Brugsanvisning
1. Opnå adgang til målkarret, og udfør et angiogram ved hjælp af standardteknik for at måle
kardiameteren på det ønskede okklusionssted. Kontrollér, at målkarret stemmer overens med
den anbefalede diameter (se Tabel 1).
2. Kontrollér, at okklusionsstedet er langt nok til at kunne indeholde den implanterede
MVP-enhed uden at obstruere utilsigtede kar.
3. Vælg et mikrokateter eller kateter (se den anbefalede størrelse i Tabel 2), og klargør det i
henhold til producentens brugsanvisning.
4. Indfør guidewiren, og fremfør mikrokateteret eller kateteret over guidewiren, indtil den distale
spids befinder sig nær okklusionsstedets forreste kant.
5. Fjern guidewiren fra mikrokateteret eller kateteret.
6. Tag MVP-systemet ud af dispenserrøret ved forsigtigt at tage det gule indføringshylster af de
to udvendige klemmer og trække MVP-systemet ud af det gennemsigtige opbevaringsrør. Tag
forsigtigt fast i indføringshylsteret på et sted, som er proksimalt for MVP-enheden, og tag
langsomt og samtidigt MVP-enheden, indføringswiren og indføringshylsteret ud af
dispenserrøret. Se Figur 3.
14
Page 15

Figur 3. Emballeret MVP-system
1 Gennemsigtigt opbevaringsrør
2 Gult indføringshylster
3 Indføringswire (inde i indføringshylsteret)
7. Undersøg MVP-system grundigt for skader. Hvis MVP-systemet er beskadiget, skal det skiftes
ud med et nyt MVP-system.
8. Skyl MVP-systemet ved forsigtigt at sænke nogle få centimeter af indføringshylsteret og
MVP-enheden ned i hepariniseret saltvand.
9. Træk MVP-enheden ind i indføringshylsteret ved at trække i indføringswiren, indtil den distale
spids på MVP-enheden lige netop er dækket af indføringshylsteret.
Bemærk: Hvis MVP-enheden trækkes for langt ind i indføringshylsteret, vil den muligvis ikke
blive korrekt skyllet. To huller i indføringshylsteret, 3 cm og 6 cm proksimalt for spidsen af
hylsteret, letter udluftning af luft og skylning af enheden.
10. Indfør MVP-systemet ved at føre den distale ende af indføringshylsteret ind gennem den
drejelige hæmostaseventil og ind i muffen på mikrokateteret eller kateteret, indtil hylsteret
sidder helt fast. Stram den drejelige hæmostaseventil nok til at forhindre tilbageløb af blod,
men ikke så meget, så MVP-systemet beskadiges under indføringen i mikrokateteret eller
kateteret.
11. Kontrollér visuelt, at skylleopløsningen infunderes normalt. Saltvandsdråber skal kunne ses
komme ud af den proksimale ende af indføringshylsteret.
12. Løs den drejelige hæmostaseventil nok til, at MVP-enheden og indføringswiren kan føres frem
som et samlet system. Den drejelige hæmostaseventil må ikke løsnes så meget, så der er
mulighed for tilbageløb af blod. Fjern indføringshylsteret ved at trække det tilbage over
indføringswirens proksimale ende.
13. Fremfør indføringswiren og MVP-enheden, indtil den distale platinmarkør på MVP-enheden
flugter med det distale markørbånd på mikrokateteret eller kateteret.
14. Kontrollér, at markørbåndenes position er optimal. Anlæg MVP-enheden ved at opretholde et
fremadrettet tryk på indføringswiren, mens mikrokateteret eller kateteret langsomt trækkes
tilbage for at frigøre MVP-enheden fra hylsteret.
15. Hvis placeringen af enheden ikke er tilfredsstillende, gøres følgende:
a. Stabilisér indføringswiren, og fremfør mikrokateteret eller kateteret ved at bevæge det
distalt, indtil MVP-enheden igen er inde i kateteret.
b. Enten flyt enheden, og anlæg den igen, eller fjern enheden fra patienten.
Bemærk: Enheden må ikke trækkes tilbage i hylsteret og anlægges mere end maks. 3
gange.
16. For korrekt frakobling skal MVP-enheden anbringes efter mikrokateterets eller kateterets
spids.
17. Hvis enhedens placering er tilfredsstillende, fortsættes der med frakoblingen ved at gøre
følgende:
a. Brug fluoroskopi til at bekræfte, at mikrokateterets eller kateterets spids er proksimalt for
MVP-enheden.
b. Sæt vrideren på indføringswiren. Frakobl MVP-enheden ved at dreje indføringswiren mod
uret, indtil den adskilles fra enheden.
c. Kontrollér fluoroskopisk, at frakoblingen er vellykket, ved langsomt at trække
indføringswiren i proksimal retning for at sikre, at MVP-enheden ikke bevæger sig. Hvis det
usandsynlige skulle ske, at MVP-enheden bevæger sig i proksimal retning, skal
placeringen af enheden genetableres og indføringswiren igen drejes mod uret med
henblik på frakobling.
18. Mens mikrokateteret eller kateteret holdes på plads, trækkes indføringswiren ind i
mikrokateteret eller kateret, hvorefter inføringswiren fjernes fra patienten. Afslut proceduren
ved brug af standardteknik.
4 Vrider
5 Dispenserrør
6 MVP-enhed
11 Anvisninger til efter proceduren
Hvis MedicAlert-service er til rådighed i regionen, anbefales det, at patienten bliver
MedicAlert-medlem på www.medicalert.org. Patienten vil blive bedt om at oplyse sin lidelse, navnet
på den implanterede enhed og begrænsninger vedrørende MR-scanning.
12 Information om MR-scanning
12.1 Betinget kompatibilitet med MR-scanning
Det er påvist, at MVP-mikrovaskulære prop har betinget kompatibilitet med MR-scanning.
Ikke-kliniske tests viste, at MVP-mikrovaskulære prop har betinget kompatibilitet med
MR-scanning. En patient med denne enhed kan scannes sikkert umiddelbart efter anbringelse
under følgende betingelser:
• Statisk magnetfelt på 3 Tesla eller derunder
• Maksimalt rumligt gradient magnetfelt på 9.000 gauss/cm eller derunder
• MR-system med maksimal rapporteret gennemsnitlig helkrops-SAR (specifik
absorptionshastighed) på 4 W/kg ved 15 minutters scanning (dvs. pr. pulssekvens)
• Styret driftsmodus på første niveau for MR-systemet
12.2 Opvarmning i forbindelse med MR-scanning
I ikke-kliniske tests bevirkede MVP-mikrovaskulære prop følgende temperaturstigning under
MR-scanning i 15 min (dvs. pr. pulssekvens) i 3 Tesla MR-systemet (3 Tesla/128 MHz, Excite, HDx,
Software 14X.M5, General Electric Healthcare, Milwaukee, WI): Højeste
temperaturændring +1,8°C
De MR-relaterede opvarmningseksperimenter for MVP-mikrovaskulære prop ved 3 Tesla udført
med en modtage/sende-RF-kropsspole med en rapporteret gennemsnitlig helkrops-SAR på
2,9 W/kg (dvs. forbundet med en gennemsnitlig helkropsværdi på 2,7 W/kg opmålt ved kalorimetri)
angav, at den største opvarmning, der forekom i forbindelse med disse specifikke betingelser, var
lig med eller mindre end +1,8°C.
12.3 Oplysninger om artefakter
MR-scanningens billedkvalitet kan blive forringet, hvis interesseområdet er i nøjagtig samme
område eller relativt tæt på den MVP-mikrovaskulære props position. Det kan derfor være
nødvendigt at optimere parametrene for MR-scanning, så de kompenserer for tilstedeværelsen af
denne enhed. Den maksimale artefaktstørrelse (dvs. i en gradientekkopulssekvens) strækker sig
ca. 5 mm ud over størrelsen og formen på den MVP-mikrovaskulære prop.
Pulssekvens
Signalfraværets
størrelse
Planorientering Parallel Vinkelret Parallel Vinkelret
T1-SE T1-SE GRE GRE
252 mm
2
91 mm
2
304 mm
2
116 mm
13 Opbevaring
Undgå at udsætte MVP-systemet for vand, direkte sollys, ekstreme temperaturer og høj
luftfugtighed under opbevaring. MVP-systemet skal opbevares ved kontrolleret stuetemperatur. Se
datoen for seneste anvendelse på enhedens produktmærkat. Enheden må ikke anvendes efter den
anførte dato for seneste anvendelse.
14 Materialer
MVP-systemet er ikke fremstillet af latex- eller PVC-materialer.
15 Ansvarsfraskrivelse
Advarslerne, som fremgår af produktets mærkater, giver flere detaljerede oplysninger og
betragtes som en integreret del af denne ansvarsfraskrivelse. Selv om produktet er blevet
fremstillet under omhyggeligt kontrollerede forhold, har Medtronic ingen kontrol over de
forhold, hvorunder produktet anvendes. Medtronic fraskriver sig derfor alle garantier,
både udtrykkelige og stiltiende, med hensyn til produktet, herunder, men ikke begrænset
til, alle stiltiende garantier for salgbarhed eller egnethed til et bestemt formål. Medtronic er
ikke ansvarlig over for nogen person eller organisation for nogen som helst medicinske
udgifter eller nogen som helst direkte, tilfældige eller efterfølgende skader, der er
forårsaget af nogen form for brug, defekt, fejl eller funktionssvigt vedrørende produktet,
uanset om et sådant krav bygger på garantiret, aftaleret, erstatningsret eller andet. Ingen
person har nogen bemyndigelse til at binde Medtronic til nogen form for løfter eller garanti
i forbindelse med produktet.
Ovennævnte undtagelser og begrænsninger har ikke til hensigt at være i modstrid med ufravigelige
bestemmelser i gældende lov, og de må ikke fortolkes således. Hvis et afsnit eller et vilkår i denne
ansvarsfraskrivelse af en retsinstans i nogen kompetent retskreds anses for ulovligt, uden retskraft
eller i modstrid med gældende lovgivning, berøres den resterende del af ansvarsfraskrivelsen ikke,
og alle rettigheder og forpligtelser skal tolkes og håndhæves, som om denne ansvarsfraskrivelse
ikke indeholdt det pågældende afsnit eller vilkår, der anses for ugyldigt.
15
2
Page 16

Deutsch
1 Beschreibung
Das MVP mikrovaskuläre Verschlusssystem ist eine selbstexpandierende Vorrichtung zur
Gefäßokklusion. Das ovale MVP-System besteht aus Nitinol und ist an beiden Enden durch
Platinmarkierungsringe gesichert. Das System weist eine PTFE-Teilbeschichtung auf. Der
proximale Markierungsring ist an einem Trägerdraht befestigt, mit dem das Verschlusssystem durch
einen im Handel erhältlichen Mikrokatheter/Katheter zur geplanten Behandlungsstelle
vorgeschoben wird. Das MVP-System löst sich vom Trägerdraht, indem dieser durch Drehung
gegen den Uhrzeigersinn vom System abgeschraubt wird.
Das MVPSystem ist als Einzeleinheit verpackt, die das eigentliche MVP-Produkt, eine Schleuse
und einen abtrennbaren Trägerdraht enthält. Das System wird steril geliefert, ist pyrogenfrei und ist
nur zur einmaligen Verwendung bestimmt.
Abbildung 1. MVP Mikrovaskuläres Verschlusssystem
1 Teilbeschichtung
2 Distaler Markierungsring
3 MVP-System
Abbildung 2. Abmessungen des MVP-Systems
1 Länge des Trägerdrahts
2 Länge, entfaltet (System ohne Schutzhülle
und Rückhaltekräfte)
Tabelle 1. MVPAbmessungen Modell Durchmesser,
MVP-3Q 5,3 mm 12 mm 180 cm 1,5 mm – 3,0 mm
MVP-5Q 6,5 mm 12 mm 180 cm 3,0 mm – 5,0 mm
MVP-7Q 9,2 mm 16 mm 165 cm 5,0 mm – 7,0 mm
MVP-9Q 13,0 mm 18 mm 165 cm 7,0 mm – 9,0 mm
Tabelle 2. Empfohlener Mikrokatheter/Katheter Modell Empfohlener Mikrokathe-
MVP-3Q 0,021 in (0,53 mm) bis 0,027 in
MVP-5Q 0,027 in (0,69 mm) (ID) 153 cm
MVP-7Q 4 Fr (1,4 mm) (AD) 120 cm
MVP-9Q 5 Fr (1,7 mm) (AD) 120 cm
entfaltet
Länge, entfaltet Länge des Trä-
ter/Katheter
(0,69 mm) (ID)
4 Abtrennzone
5 Trägerdraht
6 Proximaler Markierungsring
3 Durchmesser, entfaltet
gerdrahts
Maximale Länge des empfohlenen Mikrokatheters/Katheters
153 cm
Durchmesser
des Zielgefäßes
2 Bestimmungsgemäße Verwendung/Indikationen
Indiziert ist das MVP mikrovaskuläre Verschlusssystem, wenn der Blutstrom in peripheren Gefäßen
gedrosselt oder vollständig blockiert werden soll.
3 Kontraindikationen
Für dieses Produkt sind keine Kontraindikationen bekannt.
4 Kompatibilität
Für die Implantatabmessungen siehe Produktetikett des MVP-Systems. Zur Feststellung der
Kompatibilität siehe die Etiketten der jeweiligen Medizintechnik.
5 Warnhinweise
• Für kardiologische (z. B. kardialer Septumverschluss, persistierender Ductus arteriosus,
Verschluss paravalvulärer Leckagen) und neurologische Anwendungen liegen keine
Erkenntnisse zur Sicherheit und Wirksamkeit des MVP-Systems vor.
• Mit dem MVP-System sollten nur Ärzten arbeiten, die mit angiographischen und
interventionellen Verfahren vertraut sind. Vor Anwendung des MVP-Systems muss unbedingt
die Gebrauchsanleitung gelesen werden.
• Das MVP-System muss vor dem auf dem Verpackungsetikett des Produktes aufgedruckten
Verfallsdatum verwendet werden.
• Solange die Verpackung des MVP-Systems ungeöffnet und unbeschädigt ist, ist das
MVP-System pyrogenfrei und weiterhin steril. Bei angebrochener oder beschädigter
Verpackung darf das System nicht verwendet werden.
• Kontrollieren Sie das MVP-System vor der Anwendung und entsorgen Sie es, wenn
Auffälligkeiten oder Schäden zu sehen sind.
• Das MVP-System ist nur für den einmaligen Gebrauch bestimmt. Nicht wiederaufbereiten oder
resterilisieren. Durch Wiederaufbereitung oder Resterilisation erhöht sich das Risiko einer
Infektion beim Patienten und einer eingeschränkten Leistung des Produkts. Entsorgen Sie das
MVP-System nach der Verwendung entsprechend den Richtlinien der Klinik und der örtlichen
Behörden.
• Das MVP-System sollte unter Durchleuchtungskontrolle vorgeschoben und gehandhabt
werden. Falls ein übermäßiger Widerstand zu spüren ist, schieben Sie das Verschlusssystem
nicht weiter vor und ziehen Sie es auch nicht zurück, bis Sie die Ursache des Widerstands
geklärt haben.
• Drehen Sie den Trägerdraht nur, wenn das System gelöst werden soll, da es andernfalls
möglicherweise vorzeitig abgetrennt wird.
• Bei liegendem Verschlusssystem niemals Kontrastmittellösung mit einem Injektomaten durch
den Mikrokatheter/Katheter injizieren.
• Schieben Sie den Trägerdraht nicht vor, nachdem er vom MVP-System abgetrennt wurde.
• Ärzte müssen auf den Umgang mit kritischen Situationen vorbereitet sein, die eine Entfernung
des Systems erfordern. Zu dieser Vorbereitung gehört auch ein im Notfall abrufbereiter
Operateur vor Ort.
• Nicht mit Kathetern verwenden, die bei Embolievorrichtungen (zum Beispiel Coils und Plugs)
kontraindiziert sind.
6 Sicherheitshinweise
• Das MVP-System besteht aus einer Nickel-Titan-Legierung, die als allgemein sicher gilt.
In-vitro-Studien zeigten jedoch, dass das System nach der Implantation mindestens 60 Tage
lang Nickel freisetzt. Patienten mit Nickelallergie können auf das System allergisch reagieren,
insbesondere jene Patienten mit einer anamnestischen Metallallergie. Bestimmte allergische
Reaktionen können schwerwiegender Natur sein. Daher sind Patienten aufzufordern,
umgehend ihren Arzt zu informieren, wenn sie den Verdacht auf eine allergische Reaktion
haben, z. B. bei Atemproblemen oder Entzündungen im Gesicht oder Rachen. Bei einigen
Patienten kann es durch die Implantation des Systems zu einer Nickelallergie kommen.
• Ärzte sollten Situationen, in denen vor, während oder nach der Implantation des Systems
Antikoagulanzien oder Thrombozytenaggregationshemmer verabreicht wurden, klinisch
einstufen.
• Seien Sie bei folgenden speziellen Patientenpopulationen zurückhaltend:
– Zur Minimierung der Strahlenbelastung von Mutter und Ungeborenem ist bei Schwangeren
Vorsicht geboten.
– Hinsichtlich der Stillzeit wurde quantitativ nicht abgeklärt, inwieweit nach
Geräteimplantation Substanzen in die Muttermilch ausgewaschen werden.
• Wenn bei intravaskulären Eingriffen zusätzliche Komponenten zum Einsatz kommen, muss die
Kompatibilität des MVP-Systems nachgewiesen werden. Ärzte, die mit dem MVP-System
arbeiten, müssen perkutane intravaskuläre Techniken und die dabei möglicherweise
auftretenden Komplikationen beherrschen.
• Das MVP-System muss vor der Anwendung hydriert werden.
• Handhaben Sie das MVP-System vorsichtig, um die Gefahr einer iatrogenen Beschädigung zu
reduzieren.
• Bei Verwendung mit geschlitzten Nitinolverbund-Mikrokathetern/-Kathetern kann das
Vorschieben mehr Kraft erfordern.
• Überprüfen Sie vor der Anwendung, ob die Durchmesser aller weiteren verwendeten Produkte
mit dem MVP-System kompatibel sind.
16
Page 17

7 Mögliche unerwünschte Ereignisse
Während des Eingriffs und/oder nach der Implantation dieses Verschlusssystems können u. a.
folgende unerwünschten potenziellen Nebenwirkungen auftreten:
• Luftembolus
• Allergische Reaktion oder toxische Wirkungen
• Blutung
• Tod
• Migration der Vorrichtung
• Fieber
• Embolisches Ereignis durch Fremdkörper
• Infektionen
• Verschluss eines nicht dafür vorgesehenen Gefäßes
• Periphere Embolie
• Rekanalisierung
• Persistierender Restflow
• Schlaganfall oder transitorisch ischämische Attacke (TIA)
• Chirurgische Intervention
• Komplikation am Gefäßzugang
• Gefäßtrauma/-perforation
8 Erforderliche Materialien
1. Für die Implantation des MVP-Systems wird ein Mikrokatheter/Katheter benötigt (für die
empfohlene Größe siehe Tabelle 2).
2. Folgendes Zubehör ist erforderlich:
• Heparin-Kochsalzlösung
• Rotierendes Hämostaseventil (RHV)
• 3-Wege-Absperrhahn
• Druckmanschette für Kochsalzinfusion
• Zugangsschleuse
• Führungskatheter, kompatibel mit einem unter Tabelle 2 empfohlenen
Mikrokatheter/Katheter
• Führungsdraht, kompatibel mit dem Führungskatheter und dem Mikrokatheter/Katheter
• Infusionsständer
9 Vorbereitung
1. Damit das MVP-System seine optimale Leistung erreicht und das Risiko thromboembolischer
Komplikationen gesenkt wird, müssen folgende Elemente kontinuierlich von Kochsalzlösung
umspült werden:
• Zugangsschleuse und Führungskatheter
• Mikrokatheter/Katheter und Führungskatheter
• Mikrokatheter/Katheter, Führungsdraht und MVP-System.
2. Platzieren Sie in empfohlener Vorgehensweise einen geeigneten Führungskatheter.
Verbinden Sie ein rotierendes Hämostaseventil (RHV) mit dem Anschluss des
Führungskatheters. Bringen Sie am Seitenarm des RHV einen 3-Wege-Absperrhahn an.
Schließen Sie zur kontinuierlichen Spülung den Infusionsschlauch einer
Heparin-Kochsalzlösung an.
3. Kontrollieren Sie alle Anschlüsse, damit während der fortlaufenden Spülung keine Luft in den
Führungskatheter und Mikrokatheter/Katheter eindringen kann.
10 Hinweise zum Gebrauch
1. Schaffen Sie den Zugang zum Zielgefäß und führen Sie in üblicher Technik eine Angiographie
durch, um den Gefäßdurchmesser an der vorgesehenen Okklusionsstelle zu bestimmen.
Achten Sie darauf, dass das Zielgefäß dem empfohlenen Gefäßdurchmesser entspricht
(siehe Tabelle 1).
2. Kontrollieren Sie, dass der zu verschließende Gefäßabschnitt lang genug ist, um das
implantierte MVP-System aufzunehmen, ohne dabei andere Gefäße zu verschließen.
3. Wählen Sie einen Mikrokatheter/Katheter aus (für die empfohlene Größe siehe Tabelle 2) und
bereiten Sie ihn entsprechend der Herstelleranleitung vor.
4. Führen Sie den Führungsdraht ein und schieben Sie den Mikrokatheter/Katheter über den
Führungsdraht vor, bis die distale Spitze nahe der Vorderkante der Okklusionsstelle liegt.
5. Entfernen Sie den Führungsdraht aus dem Mikrokatheter/Katheter.
6. Nehmen Sie das MVP-System aus dem Dispenserschlauch, indem Sie die gelbe
Einführschleuse vorsichtig von den beiden Außenclips entfernen und das MVP-System aus
dem durchsichtigen umhüllenden Schlauch ziehen. Greifen Sie die Einführschleuse vorsichtig
an einer Stelle proximal des MVP-Systems und entfernen Sie langsam gleichzeitig das
MVP-System mit Trägerdraht und Einführschleuse aus dem Dispenserschlauch. Siehe
Abbildung 3.
Abbildung 3. Verpacktes MVP-System
1 Durchsichtiger umhüllender Schlauch
2 Gelbe Einführschleuse
3 Trägerdraht (in der Einführschleuse)
4 Drehvorrichtung
5 Dispenserschlauch
6 MVP-System
Kontrollieren Sie das MVP-System gründlich auf Schäden. Falls das MVP-System beschädigt
7.
ist, ersetzen Sie es durch ein neues MVP-System.
8. Spülen Sie das MVP-System, indem Sie vorsichtig einige Zentimeter der Einführschleuse und
das MVP-System in Heparin-Kochsalzlösung tauchen.
9. Ziehen Sie das MVP-Gerät in die Einführschleuse, indem Sie den Trägerdraht nur so weit
ziehen, bis die distale Spitze des MVP-Systems gerade noch von der Einführschleuse bedeckt
ist.
Hinweis: Falls das MVP-System zu weit in die Einführschleuse gezogen wird, wird es
möglicherweise nicht korrekt gespült. Zwei Öffnungen in der Einführschleuse 3 cm und 6 cm
proximal der Schleusenspitze erleichtern die Entlüftung und Spülung des Systems.
10. Führen Sie das MVP-System ein, indem Sie das distale Ende der Einführschleuse durch das
RHV in den Anschluss des Mikrokatheters/ Katheters einführen, bis die Schleuse fest anliegt.
Schließen Sie das RHV gerade so viel, dass kein Blut zurückströmt, jedoch nicht so fest, dass
das MVP-System bei Einführung in den Mikrokatheter/Katheter beschädigt wird.
11. Führen Sie eine Sichtprüfung durch, um sicherzustellen, dass die Spüllösung normal
infundiert wird. Am proximalen Ende der Einführschleuse sollten Tropfen der Kochsalzlösung
sichtbar austreten.
12. Lockern Sie das RHV so weit, dass das MVP-System und der Führungsdraht als gemeinsame
Einheit vorgeschoben werden können. Lockern Sie das RHV nicht so weit, dass Blut
zurückströmen kann. Entfernen Sie die Einführschleuse, indem Sie diese über das proximale
Ende des Trägerdrahts zurückziehen.
13. Schieben Sie den Trägerdraht und das MVP-System vor, bis die distale Platinmarkierung des
MVP-Systems mit dem distalen Markierungsring auf dem Mikrokathete/Katheter
übereinstimmt.
14. Kontrollieren Sie die optimale Lage der Markierungsringe. Lösen Sie das MVP-System aus,
indem Sie bei weiter bestehendem Vorwärtsdruck auf den Trägerdraht den
Mikrokatheter/Katheter langsam zurückziehen und so das MVP-System entfalten.
15. Bei verbesserungswürdiger Lage des Systems gehen Sie wie folgt vor:
a. Stabilisieren Sie den Trägerdraht und schieben Sie den Mikrokatheter/Katheter soweit
nach distal vor, bis das MVP-System sich wieder im Inneren des Katheters befindet.
b. Positionieren Sie das System entweder neu und setzen es frei oder entfernen Sie es aus
dem Patienten.
Hinweis: Das System darf maximal nur dreimal wieder in den Mikrokatheter/Katheter
gezogen und erneut freigesetzt werden.
16. Bei einer korrekten Freisetzung sollte das MVP-System jenseits der Spitze des
Mikrokatheters/Katheters liegen.
17. Bei zufriedenstellender Positionierung des Systems fahren Sie mit der Freisetzung wie folgt
fort:
a. Stellen Sie unter Durchleuchtungskontrolle sicher, dass die Spitze des
Mikrokatheters/Katheters proximal des MVP-Systems liegt.
b. Befestigen Sie die Drehvorrichtung am Trägerdraht. Setzen Sie das MVP-System frei,
indem Sie den Trägerdraht gegen den Uhrzeigersinn drehen, bis er sich vom System löst.
c. Kontrollieren Sie den erfolgreichen Trennvorgang unter Durchleuchtung, indem Sie den
Trägerdraht langsam nach proximal ziehen, um sicherzustellen, dass sich das
MVP-System nicht bewegt. Für den unwahrscheinlichen Fall, dass das MVP-System sich
17
Page 18

nach proximal bewegt, müssen Sie das System neu positionieren und den Trägerdraht
erneut gegen den Uhrzeigersinn drehen, um das System zu lösen.
18. Ziehen Sie den Trägerdraht in den Mikrokathete/Katheter zurück, während Sie diesen
festhalten, und entfernen Sie dann den Trägerdraht aus dem Patienten. Beenden Sie den
Eingriff in üblicher Vorgehensweise.
11 Hinweise zum Verhalten nach dem Eingriff
Falls es in Ihrer Gegend einen MedicAlert-Dienst gibt, ist dem Patienten die
MedicAlert-Mitgliedschaft unter www.medicalert.org zu empfehlen. Dabei wird der Patient nach
seiner Erkrankung, der Bezeichnung des Implantats und eventuellen Einschränkungen der
MRT-Fähigkeit gefragt.
12 MRT-Informationen
12.1 Bedingt MRT-sicher
Das MVP mikrovaskuläre Verschlusssystem ist als bedingt MRT-sicher eingestuft. Nichtklinische
Tests haben ergeben, dass das mikrovaskuläre VerschlusssystemMVP bedingt MRT-sicher ist. Ein
Patient kann unmittelbar nach der Implantation unter den folgenden Bedingungen problemlos
gescannt werden:
• Statisches Magnetfeld von max. 3 Tesla
• Maximales räumliches Gradientenmagnetfeld von 9.000 Gauß/cm
• Maximale für MRT-Systeme angegebene ganzkörpergemittelte spezifische Absorptionsrate
(SAR) von 4 W/kg für eine Untersuchungsdauer von 15 Minuten (d. h. pro Pulssequenz)
• Kontrollierte Betriebsart der 1. Stufe für das MRT-System
12.2 MRT-bezogene Erwärmung
Bei nichtklinischen Tests hat das MVP mikrovaskuläre Verschlusssystem während einer
MRT-Untersuchungsdauer von 15 min (d. h. pro Pulssequenz) im 3-Tesla-MRT-System
(3 Tesla/128 MHz, Excite, HDx, Software 14X.M5, General Electric Healthcare, Milwaukee, WI,
USA) folgenden Temperaturanstieg verursacht: Maximale Temperaturänderung: +1,8°C
Deshalb ergaben die MRT-bezogenen Erwärmungsversuche für das MVP mikrovaskuläre
Verschlusssystem bei 3 Tesla unter Verwendung einer Sende/Empfangs-HF-Körperspule bei einer
maximalen für MRT-Systeme angegebenen ganzkörpergemittelten SAR von 2,9 W/kg (d. h. im
Zusammenhang mit einem kalorimetrisch gemessenen, ganzkörpergemittelten Wert von
2,7 W/kg), dass die größte Erwärmung unter diesen spezifischen Bedingungen gleich oder
kleiner +1,8°C war.
12.3 Informationen zu Artefakten
Liegt der Zielbereich genau dort, wo sich das MVP mikrovaskuläre Verschlusssystem befindet oder
relativ dicht daneben, kann es zu Einbußen bei der MRT-Bildqualität kommen. Es kann daher
erforderlich werden, die Parameter der MRT-Bildgebung zu optimieren, um das Vorhandensein der
Implantats zu kompensieren. Die maximale Artefaktgröße, (d. h. wie bei der
Gradientenecho-Pulssequenz zu beobachten) beträgt etwa 5 mm relativ zur Größe und Form des
MVP mikrovaskulären Verschlusssystems.
Pulssequenz
Größe der Signalauslöschung
Ebenenausrichtung
T1-SE T1-SE GRE GRE
2
252 mm
Parallel Senkrecht Parallel Senkrecht
91 mm
2
304 mm
2
116 mm
2
daher jede ausdrückliche oder stillschweigende Garantie in Bezug auf das Produkt aus.
Dies schließt jegliche implizite Garantie auf Marktgängigkeit oder Eignung für einen
bestimmten Zweck ein. Medtronic haftet nicht gegenüber natürlichen oder juristischen
Personen jeglicher Art für medizinische Kosten oder unmittelbare, beiläufige oder
Folgeschäden, die durch Gebrauch, Defekt, Ausfall oder Fehlfunktion des Produkts
entstehen, unabhängig davon, ob sich eine Haftung für derartige Schäden auf eine
Garantie, einen Vertrag, eine unerlaubte Handlung oder eine andere Anspruchsgrundlage
stützt. Niemand ist berechtigt, Medtronic an irgendeine Zusicherung oder Garantie
bezüglich dieses Produkts zu binden.
Die hier aufgeführten Haftungsausschlüsse und -beschränkungen sollen nicht gegen geltendes
Recht verstoßen und sind nicht dahingehend auszulegen. Sollte ein zuständiges Gericht
feststellen, dass dieser Haftungsausschluss ganz oder teilweise unwirksam, nicht durchsetzbar
oder im Widerspruch zu zwingendem Recht ist, berührt dies die Gültigkeit der restlichen Klauseln
nicht und alle Rechte und Pflichten aus diesem Haftungsausschluss sind so auszulegen und
durchzusetzen, als sei der für ungültig erklärte Teil oder die ungültige Vorschrift in dem
Haftungsausschluss nicht enthalten.
Ελληνικά
1 Περιγραφή της συσκευής
Το σύστημα μικροαγγειακού βύσματος MVP είναι μια αυτοδιαστελλόμενη συσκευή απόφραξης
αγγείων. Η συσκευή MVP έχει ωοειδές σχήμα, αποτελείται από νιτινόλη και στερεώνεται στα δύο
άκρα με ταινίες-δείκτες από λευκόχρυσο. Η συσκευή διαθέτει ενσωματωμένο ένα μερικό
κάλυμμα από πολυτετραφθοροαιθυλένιο (PTFE). Η εγγύς ταινία-δείκτης προσαρτάται σε ένα
σύρμα τοποθέτησης το οποίο ωθεί τη συσκευή μέσω ενός μικροκαθετήρα ή καθετήρα του
εμπορίου στην επιδιωκόμενη θέση θεραπείας. Το σύρμα τοποθέτησης αποσπάται από τη
συσκευή MVP με περιστροφή του σύρματος τοποθέτησης αριστερόστροφα για να το ξεβιδώσετε
από τη συσκευή.
Το σύστημα MVP είναι συσκευασμένο ως ενιαία μονάδα που περιέχει τη συσκευή MVP, ένα
θηκάρι εισαγωγής και ένα αποσπώμενο σύρμα τοποθέτησης. Το σύστημα διατίθεται
αποστειρωμένο, είναι μη πυρετογόνο και προορίζεται για μία μόνο χρήση.
Εικόνα 1. Σύστημα μικροαγγειακού βύσματος MVP
1 Μερικό κάλυμμα
2 Άπω δείκτης
3 Συσκευή MVP
4 Ζώνη απόσπασης
5 Σύρμα τοποθέτησης
6 Εγγύς δείκτης
Εικόνα 2. Διαστάσεις συστήματος MVP
13 Lagerung
Setzen Sie das MVP-System während der Lagerung weder Wasser, direktem Sonnenlicht,
extremen Temperaturen noch hoher Luftfeuchtigkeit aus. Lagern Sie das MVP-System bei
kontrollierter Raumtemperatur. Das Haltbarkeitsdatum ist dem Produktetikett zu entnehmen.
Verwenden Sie das System nach dem angegebenen Haltbarkeitsdatums nicht mehr.
14 Materialien
Das MVP-System enthält weder Latex- noch PVC-Materialien.
15 Haftungsausschluss
Die Warnhinweise in der Produktinformation enthalten weitere detaillierte Informationen
und sind als Bestandteil dieses Haftungsausschlusses anzusehen. Obwohl das Produkt
unter genau kontrollierten Bedingungen gefertigt wurde, hat Medtronic keinerlei Einfluss
auf die Bedingungen, unter denen dieses Produkt verwendet wird. Medtronic schließt
1 Μήκος σύρματος τοποθέτησης
2 Μήκος χωρίς περιορισμό (συσκευή χωρίς θηκάρι και χωρίς περιορισμούς)
3 Διάμετρος χωρίς περιορισμό
18
Page 19

Πίνακας 1. MVPΔιαστάσεις Μοντέλο Διάμετρος
MVP-3Q 5,3 mm 12 mm 180 cm 1,5 mm – 3,0 mm
MVP-5Q 6,5 mm 12 mm 180 cm 3,0 mm – 5,0 mm
MVP-7Q 9,2 mm 16 mm 165 cm 5,0 mm – 7,0 mm
MVP-9Q 13,0 mm 18 mm 165 cm 7,0 mm – 9,0 mm
Πίνακας 2. Συνιστώμενος μικροκαθετήρας ή καθετήρας Μοντέλο Συνιστώμενος μικροκαθε-
MVP-3Q 0,53 mm (0,021 in) έως
MVP-5Q 0,69 mm (0,027 in) (Εσωτ.
MVP-7Q 1,4 mm (4 Fr) (Εξωτ. διάμ.) 120 cm
MVP-9Q 1,7 mm (5 Fr) (Εξωτ. διάμ.) 120 cm
χωρίς περιορισμό
Μήκος χωρίς
περιορισμό
τήρας ή καθετήρας
0,69 mm (0,027 in) (Εσωτ.
διάμ.)
διάμ.)
Μήκος σύρματος τοποθέτησης
Συνιστώμενο μέγιστο
μήκος μικροκαθετήρα ή
καθετήρα
153 cm
153 cm
Διάμετρος στοχευόμενου
αγγείου
2 Προοριζόμενη χρήση / ενδείξεις χρήσης
Το σύστημα μικροαγγειακού βύσματος MVP ενδείκνυται για την απόφραξη ή την ελάττωση του
ρυθμού ροής του αίματος στο περιφερικό αγγειακό σύστημα.
3 Αντενδείξεις
Δεν υπάρχουν γνωστές αντενδείξεις για το παρόν προϊόν.
4 Συμβατότητα
Ανατρέξτε στην ετικέτα προϊόντος του συστήματος MVP για τις διαστάσεις της συσκευής.
Ανατρέξτε στη σήμανση που παρέχεται με άλλες ιατρικές τεχνολογίες για να προσδιορίσετε τη
συμβατότητα.
5 Προειδοποιήσεις
• Η ασφάλεια και η αποτελεσματικότητα του συστήματος MVP δεν έχει εξακριβωθεί για
καρδιακές χρήσεις (π.χ. καρδιακή διαφραγματική απόφραξη, βατός αρτηριακός πόρος,
σύγκλειση παραβαλβιδικής διαφυγής) και νευρολογικές χρήσεις.
• Το σύστημα MVP θα πρέπει να χρησιμοποιείται μόνο από ιατρούς οι οποίοι είναι
εξοικειωμένοι με αγγειογραφικές και επεμβατικές διαδικασίες. Είναι σημαντικό να
διαβάσετε τις οδηγίες χρήσης πριν από τη χρήση του συστήματος MVP.
• Χρησιμοποιήστε το σύστημα MVP πριν από την ημερομηνία «Χρήση έως» που είναι
τυπωμένη στην ετικέτα της συσκευασίας του προϊόντος.
• Το σύστημα MVP είναι μη πυρετογόνο και διατίθεται αποστειρωμένο, εκτός εάν η
συσκευασία του συστήματος MVP έχει ανοιχτεί ή υποστεί ζημιά. Μην το χρησιμοποιήσετε
εάν η συσκευασία έχει παραβιαστεί ή υποστεί ζημιά.
• Επιθεωρήστε το σύστημα MVP πριν από τη χρήση και απορρίψτε το εάν παρατηρηθούν
ατέλειες ή ζημιά.
• Το σύστημα MVP προορίζεται για μία μόνο χρήση. Μην επανεπεξεργάζεστε και μην
επαναποστειρώνετε. Η επανεπεξεργασία και η επαναποστείρωση θα μπορούσαν να
αυξήσουν τους κινδύνους λοίμωξης του ασθενούς και υποβαθμισμένης απόδοσης του
προϊόντος. Μετά τη χρήση του συστήματος MVP, απορρίψτε το σύμφωνα με τη
νοσοκομειακή και την κρατική πολιτική της χώρας σας.
• Χρησιμοποιήστε ακτινοσκοπική καθοδήγηση όταν προωθείτε ή χειρίζεστε το σύστημα MVP.
Μην προωθείτε και μην αποσύρετε τη συσκευή εάν συναντήσετε υπερβολική αντίσταση,
μέχρι να προσδιοριστεί η αιτία της αντίστασης.
• Μη συστρέφετε και μην περιστρέφετε το σύρμα τοποθέτησης παρά μόνο όταν σκοπεύετε να
αποσπάσετε τη συσκευή, διαφορετικά η συσκευή ενδέχεται να αποσπαστεί πρόωρα.
• Μη χρησιμοποιείτε σύριγγα υποβοηθούμενης έγχυσης για να εγχύσετε σκιαγραφικό
διάλυμα με τη συσκευή μέσα σε μικροκαθετήρα ή καθετήρα.
• Μην προωθείτε το σύρμα τοποθέτησης μετά την απόσπασή του από τη συσκευή MVP.
• Οι ιατροί πρέπει να είναι προετοιμασμένοι να αντιμετωπίσουν καταστάσεις έκτακτης
ανάγκης που απαιτούν την αφαίρεση της συσκευής. Η προετοιμασία αυτή περιλαμβάνει
διασφάλιση διαθεσιμότητας χειρουργού επί τόπου.
• Να μη χρησιμοποιείται με καθετήρες οι οποίοι αντενδείκνυνται για εμβολικές συσκευές (για
παράδειγμα, σπειράματα ή βύσμα).
6 Προφυλάξεις
• Η συσκευή MVP αποτελείται από κράμα νικελίου-τιτανίου το οποίο γενικά θεωρείται
ασφαλές. Ωστόσο, in-vitro δοκιμές έδειξαν ότι μετά την εμφύτευση απελευθερώνεται από τη
συσκευή νικέλιο για τουλάχιστον 60 ημέρες. Οι ασθενείς που είναι αλλεργικοί στο νικέλιο
ενδέχεται να έχουν αλλεργική αντίδραση στη συσκευή, κυρίως οι ασθενείς με ιστορικό
αλλεργιών σε μέταλλα. Ορισμένες αλλεργικές αντιδράσεις μπορούν να είναι σοβαρές. Οι
ασθενείς θα πρέπει να λάβουν οδηγίες να ειδοποιήσουν αμέσως τον ιατρό τους εάν
υποπτευθούν ότι βιώνουν αλλεργική αντίδραση, όπως δυσκολία στην αναπνοή ή φλεγμονή
στο πρόσωπο ή τον λαιμό. Κάποιοι ασθενείς ενδέχεται να αναπτύξουν αλλεργία στο νικέλιο
εάν η συσκευή εμφυτευτεί.
• Οι ιατροί θα πρέπει να χρησιμοποιούν κλινική κρίση σε καταστάσεις που περιλαμβάνουν τη
χρήση αντιπηκτικών ή αντιαιμοπεταλιακών φαρμάκων πριν, κατά τη διάρκεια ή μετά τη
χρήση της συσκευής.
• Παρακαλούμε επιδείξτε προσοχή στους ακόλουθους ειδικούς πληθυσμούς:
– Για εγκύους ασθενείς, θα πρέπει να ληφθεί μέριμνα για την ελαχιστοποίηση της έκθεσης
της μητέρας και του εμβρύου σε ακτινοβολία.
– Για θηλάζουσες μητέρες, δεν υπάρχει ποσοτική αξιολόγηση της παρουσίας εκπλύσιμων
στοιχείων στο μητρικό γάλα μετά την εμφύτευση της συσκευής.
• Επαληθεύστε τη συμβατότητα του συστήματος MVP όταν χρησιμοποιείτε άλλες βοηθητικές
συσκευές σε ενδοαγγειακές διαδικασίες. Οι ιατροί που χρησιμοποιούν το σύστημα MVP
πρέπει να είναι εξοικειωμένοι με τις διαδερμικές, ενδοαγγειακές τεχνικές και τις πιθανές
επιπλοκές που συσχετίζονται με τη διαδικασία.
• Το σύστημα MVP θα πρέπει να ενυδατωθεί πριν από τη χρήση.
• Επιδείξτε προσοχή κατά τον χειρισμό του συστήματος MVP για να μειώσετε την πιθανότητα
τυχαίας βλάβης.
• Υπάρχει ενδεχόμενο υψηλότερων δυνάμεων ώθησης όταν χρησιμοποιείται με
μικροκαθετήρες ή καθετήρες αυλακωτούς σύνθετους με νιτινόλη.
• Επαληθεύστε ότι η διάμετρος οποιασδήποτε βοηθητικής συσκευής που χρησιμοποιείται
είναι συμβατή με το σύστημα MVP πριν από τη χρήση.
7 Πιθανά ανεπιθύμητα συμβάντα
Στις πιθανές ανεπιθύμητες ενέργειες που ενδέχεται να παρουσιαστούν κατά τη διάρκεια ή μετά
από μια διαδικασία τοποθέτησης της παρούσας συσκευής περιλαμβάνονται, μεταξύ άλλων, τα
ακόλουθα είδη:
• Έμβολο αέρα
• Αλλεργική αντίδραση ή τοξικές επιδράσεις
• Αιμορραγία
• Θάνατος
• Μετατόπιση συσκευής
• Πυρετός
• Εμβολικό επεισόδιο από ξένο σώμα
• Λοίμωξη
• Απόφραξη μη επιδιωκόμενου αγγείου
• Περιφερική εμβολή
• Επανασηραγγοποίηση
• Παραμένουσα ροή
• Εγκεφαλικό επεισόδιο ή παροδικό ισχαιμικό επεισόδιο (TIA)
• Χειρουργική παρέμβαση
• Επιπλοκή στο σημείο αγγειακής προσπέλασης
• Τραύμα ή διάτρηση αγγείου
8 Απαιτούμενα υλικά
1. Η τοποθέτηση του συστήματος MVP απαιτεί τη χρήση μικροκαθετήρα ή καθετήρα (βλ.
Πίν. 2 για το συνιστώμενο μέγεθος).
2. Απαιτούνται τα ακόλουθα παρελκόμενα:
• Ηπαρινισμένο αλατούχο διάλυμα
• Περιστρεφόμενη αιμοστατική βαλβίδα (RHV: Rotating Hemostatic Valve)
• Τρίοδη στρόφιγγα
• Αεροθάλαμος πίεσης ασκού αλατούχου διαλύματος
• Θηκάρι προσπέλασης
• Οδηγός καθετήρας συμβατός με έναν μικροκαθετήρα ή καθετήρα που συνιστάται
στον Πίν. 2
• Οδηγό σύρμα συμβατό με τον οδηγό καθετήρα και τον μικροκαθετήρα ή τον καθετήρα
• Στατό ενδοφλέβιας (IV) έγχυσης
19
Page 20

9 Προετοιμασία
1. Για να επιτευχθεί η βέλτιστη απόδοση του συστήματος MVP και να μειωθεί ο κίνδυνος
θρομβοεμβολικής επιπλοκής, διατηρείτε συνεχή έκπλυση με αλατούχο διάλυμα μεταξύ των
ακόλουθων ειδών:
• του θηκαριού προσπέλασης και του οδηγού καθετήρα
• του μικροκαθετήρα ή καθετήρα και του οδηγού καθετήρα
• του μικροκαθετήρα ή καθετήρα, του οδηγού σύρματος και του συστήματος MVP.
2. Τοποθετήστε τον κατάλληλο οδηγό καθετήρα ακολουθώντας τη συνιστώμενη διαδικασία.
Συνδέστε μια περιστρεφόμενη αιμοστατική βαλβίδα (RHV) στον ομφαλό του οδηγού
καθετήρα. Προσαρτήστε μια τρίοδη στρόφιγγα στο πλευρικό σκέλος της βαλβίδας RHV.
Συνδέστε μια γραμμή ηπαρινισμένου αλατούχου διαλύματος για συνεχή έκπλυση.
3. Ελέγξτε όλες τις συναρμογές για να διασφαλίσετε ότι δεν έχει εισέλθει αέρας στον οδηγό
καθετήρα ή στον μικροκαθετήρα ή στον καθετήρα κατά τη διάρκεια της συνεχούς
έκπλυσης.
10 Οδηγίες χρήσης
1. Προσπελάστε το στοχευόμενο αγγείο και προβείτε σε αγγειογραφία χρησιμοποιώντας
συνήθη τεχνική, για να μετρήσετε τη διάμετρο του αγγείου στο επιθυμητό σημείο
απόφραξης. Βεβαιωθείτε ότι το στοχευόμενο αγγείο πληροί τη συνιστώμενη διάμετρο
(βλ. Πίν. 1).
2. Βεβαιωθείτε ότι το σημείο απόφραξης είναι αρκετά μακρύ ώστε να δεχτεί την εμφυτευμένη
συσκευή MVP χωρίς να αποφράσσονται μη επιδιωκόμενα αγγεία.
3. Επιλέξτε έναν μικροκαθετήρα ή καθετήρα (βλ. Πίν. 2 για το συνιστώμενο μέγεθος) και
προετοιμάστε τον σύμφωνα με τις οδηγίες χρήσης του κατασκευαστή.
4. Εισαγάγετε το οδηγό σύρμα και προωθήστε τον μικροκαθετήρα ή τον καθετήρα επί του
οδηγού σύρματος μέχρι το άπω άκρο να βρεθεί κοντά στην πρόσθια παρυφή του σημείου
απόφραξης.
5. Αφαιρέστε το οδηγό σύρμα από τον μικροκαθετήρα ή τον καθετήρα.
6. Αφαιρέστε το σύστημα MVP από τον σωλήνα διανομής αφαιρώντας μαλακά το κίτρινο
θηκάρι εισαγωγής από τα δύο εξωτερικά κλιπ και τραβήξτε το σύστημα MVP έξω από το
διαφανές σωληνοειδές περίβλημα. Αδράξτε μαλακά το θηκάρι εισαγωγής σε ένα σημείο
εγγύς της συσκευής MVP και αφαιρέστε αργά τη συσκευή MVP, το σύρμα τοποθέτησης και
το θηκάρι εισαγωγής ταυτόχρονα από τον σωλήνα διανομής. Βλ. Εικ. 3.
Εικόνα 3. Συσκευασμένο σύστημα MVP
1 Διαφανές σωληνοειδές περίβλημα
2 Κίτρινο θηκάρι εισαγωγής
3 Σύρμα τοποθέτησης (εντός του
θηκαριού εισαγωγής)
7. Επιθεωρήστε το σύστημα MVP σχολαστικά για τυχόν ζημιά. Εάν το σύστημα MVP έχει
υποστεί ζημιά, αντικαταστήστε το με ένα καινούριο σύστημα MVP.
8. Εκπλύνετε το σύστημα MVP βυθίζοντας μαλακά μερικά εκατοστά του θηκαριού εισαγωγής
και τη συσκευή MVP σε ηπαρινισμένο αλατούχο διάλυμα.
9. Τραβήξτε τη συσκευή MVP μέσα στο θηκάρι εισαγωγής τραβώντας το σύρμα τοποθέτησης
μόνο μέχρι το άπω άκρο της συσκευής MVP να καλυφθεί από το θηκάρι εισαγωγής.
Σημείωση: Εάν η συσκευή MVP τραβηχτεί υπερβολικά μέσα στο θηκάρι εισαγωγής, μπορεί
να μην εκπλυθεί σωστά. Δύο οπές στο θηκάρι εισαγωγής, οι οποίες βρίσκονται 3 cm και 6 cm
εγγύς του άκρου του θηκαριού, διευκολύνουν την απομάκρυνση του αέρα και την έκπλυση
της συσκευής.
10. Εισαγάγετε το σύστημα MVP εισάγοντας το άπω άκρο του θηκαριού εισαγωγής μέσω της
βαλβίδας RHV στον ομφαλό του μικροκαθετήρα ή του καθετήρα, μέχρι το θηκάρι να καθίσει
σταθερά. Σφίξτε τη βαλβίδα RHV αρκετά ώστε να αποτρέψετε την ανάδρομη ροή του
αίματος, αλλά όχι τόσο σφιχτά ώστε να προκληθεί ζημιά στο σύστημα MVP κατά την
εισαγωγή του στον μικροκαθετήρα ή στον καθετήρα.
4 Εργαλείο στρέψης
5 Σωλήνας διανομής
6 Συσκευή MVP
11. Επαληθεύστε οπτικά ότι το διάλυμα έκπλυσης εγχέεται κανονικά. Σταγόνες αλατούχου
διαλύματος θα πρέπει να φαίνονται να εξέρχονται από το εγγύς άκρο του θηκαριού
εισαγωγής.
12. Χαλαρώστε τη βαλβίδα RHV αρκετά ώστε να είναι δυνατή η προώθηση της συσκευής MVP
και του σύρματος τοποθέτησης μαζί, ως σύστημα. Μη χαλαρώσετε τη βαλβίδα RHV τόσο
ώστε να επιτραπεί ανάδρομη ροή του αίματος. Αφαιρέστε το θηκάρι εισαγωγής
αποσύροντάς το επί του εγγύς άκρου του σύρματος τοποθέτησης.
13. Προωθήστε το σύρμα τοποθέτησης και τη συσκευή MVP μέχρι ο άπω δείκτης από
λευκόχρυσο της συσκευής MVP να ευθυγραμμιστεί με την άπω ταινία-δείκτη του
μικροκαθετήρα ή του καθετήρα.
14. Επιβεβαιώστε ότι οι ταινίες-δείκτες είναι τοποθετημένες με τον βέλτιστο τρόπο. Εκπτύξτε
τη συσκευή MVP διατηρώντας πρόσθια πίεση στο σύρμα τοποθέτησης ενώ αποσύρετε
αργά τον μικροκαθετήρα ή τον καθετήρα για να εξέλθει η συσκευή MVP από το θηκάρι.
15. Εάν η θέση της συσκευής δεν είναι ικανοποιητική, προβείτε στις ακόλουθες ενέργειες:
a. Σταθεροποιήστε το σύρμα τοποθέτησης και προωθήστε τον μικροκαθετήρα ή τον
καθετήρα μετακινώντας τον άπω, μέχρι η συσκευή MVP να επανασυλληφθεί εντός του
καθετήρα.
b. Είτε επανατοποθετήστε και εκπτύξτε τη συσκευή ή, διαφορετικά, αφαιρέστε τη
συσκευή από τον ασθενή.
Σημείωση: Η συσκευή δεν θα πρέπει να επανεισαχθεί στο θηκάρι και να εκπτυχθεί
περισσότερες από 3 φορές κατά το μέγιστο.
16. Για ορθή απόσπαση, η συσκευή MVP θα πρέπει να τοποθετηθεί πέραν του άκρου του
μικροκαθετήρα ή του καθετήρα.
17. Εάν η θέση της συσκευής είναι ικανοποιητική, προχωρήστε στην απόσπαση προβαίνοντας
στις ακόλουθες ενέργειες:
a. Επιβεβαιώστε υπό ακτινοσκόπηση ότι το άκρο του μικροκαθετήρα ή του καθετήρα
βρίσκεται εγγύς της συσκευής MVP.
b. Προσαρτήστε το εργαλείο στρέψης στο σύρμα τοποθέτησης. Αποσπάστε τη
συσκευή MVP περιστρέφοντας το σύρμα τοποθέτησης αριστερόστροφα μέχρι να
διαχωριστεί από τη συσκευή.
c. Επαληθεύστε την επιτυχή απόσπαση ακτινοσκοπικά, τραβώντας αργά το σύρμα
τοποθέτησης προς μια εγγύς κατεύθυνση, για να βεβαιωθείτε ότι η συσκευή MVP δεν
μετακινείται. Στην απίθανη περίπτωση που η συσκευή MVP μετακινηθεί προς μια εγγύς
κατεύθυνση, επανεδραιώστε την τοποθέτηση της συσκευής και επαναλάβετε την
αριστερόστροφη περιστροφή του σύρματος τοποθέτησης για την απόσπαση.
18. Ενώ κρατάτε τον μικροκαθετήρα ή τον καθετήρα στη θέση του, αποσύρετε το σύρμα
τοποθέτησης μέσα στον μικροκαθετήρα ή τον καθετήρα και κατόπιν αφαιρέστε το σύρμα
τοποθέτησης από τον ασθενή. Ολοκληρώστε τη διαδικασία ακολουθώντας συνήθη τεχνική.
11 Οδηγίες μετά τη διαδικασία
Εάν η υπηρεσία MedicAlert είναι διαθέσιμη στην περιοχή σας, συστήστε στον ασθενή να γίνει
μέλος της MedicAlert στη διαδικτυακή διεύθυνση www.medicalert.org. Θα ζητηθεί από τον
ασθενή να αναφέρει την πάθησή του, το όνομα του εμφυτευμένου προϊόντος και τους
περιορισμούς που αφορούν στη χρήση απεικόνισης μαγνητικού συντονισμού (MRI).
12 Πληροφορίες απεικόνισης μαγνητικού συντονισμού (MRI)
12.1 Μαγνητική τομογραφία (MR) υπό όρους
Το μικροαγγειακό βύσμα MVP διαπιστώθηκε ότι είναι συμβατό με μαγνητικό συντονισμό (MR)
υπό όρους. Μη κλινικές δοκιμές κατέδειξαν ότι η συσκευή μικροαγγειακό βύσμα MVP είναι
συμβατή με μαγνητικό συντονισμό (MR) υπό όρους. Ένας ασθενής με αυτό το προϊόν μπορεί να
υποβληθεί σε σάρωση με ασφάλεια, αμέσως μετά την τοποθέτηση, υπό τις εξής προϋποθέσεις:
• Στατικό μαγνητικό πεδίο 3 Tesla ή λιγότερο
• Μέγιστο χωρικό βαθμωτό μαγνητικό πεδίο 9.000 Gauss/cm ή λιγότερο
• Μέγιστος, αναφερόμενος από σύστημα μαγνητικού συντονισμού (MR), μεσοτιμημένος για
όλο το σώμα ρυθμός ειδικής απορρόφησης (SAR) 4 W/kg για 15 λεπτά σάρωσης (δηλ. ανά
παλμική ακολουθία)
• First Level Controlled Operating Mode (Ελεγχόμενος τρόπος λειτουργίας πρώτου επιπέδου)
για το σύστημα μαγνητικού συντονισμού (MR)
12.2 Θέρμανση σχετιζόμενη με μαγνητικό συντονισμό (MR)
Σε μη κλινικές δοκιμές, η συσκευή μικροαγγειακό βύσμα MVP παρήγαγε την ακόλουθη αύξηση
θερμοκρασίας κατά την απεικόνιση μαγνητικού συντονισμού (MRI) που πραγματοποιήθηκε για
15 min σάρωσης (δηλ. ανά παλμική ακολουθία) στο σύστημα μαγνητικού συντονισμού (MR)
3 Tesla (3 Tesla/128 MHz, Excite, HDx, λογισμικό 14X.M5, General Electric Healthcare, Milwaukee,
WI): Μέγιστη μεταβολή θερμοκρασίας: +1,8°C
20
Page 21

Κατά συνέπεια, τα πειράματα θερμότητας σχετιζόμενης με την απεικόνιση μαγνητικού
συντονισμού (MRI) για τη συσκευή μικροαγγειακό βύσμα MVP στα 3 Tesla με χρήση πηνίου
σώματος εκπομπής/λήψης ραδιοσυχνοτήτων σε αναφερόμενο από το σύστημα μαγνητικού
συντονισμού (MR), μεσοτιμημένο για όλο το σώμα SAR ίσο με 2,9 W/kg (δηλαδή σε σχέση με
θερμιδομετρικά μετρημένη, μεσοτιμημένη για όλο το σώμα, τιμή των 2,7 W/kg) έδειξαν ότι η
μέγιστη ποσότητα θερμότητας που προέκυψε σε σχέση με αυτές τις συγκεκριμένες συνθήκες
ήταν ίση ή μικρότερη από +1,8°C.
12.3 Πληροφορίες για τεχνήματα
Η ποιότητα της εικόνας μαγνητικού συντονισμού (MR) μπορεί να αλλοιωθεί εάν η περιοχή
ενδιαφέροντος βρίσκεται ακριβώς στην ίδια περιοχή ή σχετικά κοντά στη θέση της συσκευής
μικροαγγειακό βύσμα MVP. Επομένως, μπορεί να χρειαστεί βελτιστοποίηση των παραμέτρων
απεικόνισης MR ώστε να αντισταθμιστεί η παρουσία αυτού του προϊόντος. Το μέγιστο μέγεθος
τεχνήματος (δηλαδή όπως παρατηρείται στην παλμική ακολουθία gradient echo) εκτείνεται κατά
προσέγγιση 5 mm σε σχέση με το μέγεθος και το σχήμα της συσκευής μικροαγγειακό
βύσμα MVP.
Παλμική ακολουθία
Μέγεθος κενού
σήματος
Προσανατολισμός επιπέδου
T1-SE T1-SE GRE GRE
2
252 mm
Παράλληλος Κατακόρυφος Παράλληλος Κατακόρυφος
91 mm
2
304 mm
2
116 mm
2
13 Αποθήκευση
Κατά τη φύλαξη, αποφεύγετε την έκθεση του συστήματος MVP σε νερό, ηλιακό φως, ακραίες
θερμοκρασίες και υψηλή υγρασία. Αποθηκεύστε το σύστημα MVP σε ελεγχόμενη θερμοκρασία
δωματίου. Βλ. ετικέτα προϊόντος για την ημερομηνία «Χρήση έως» του προϊόντος. Μη
χρησιμοποιείτε τη συσκευή μετά την αναγραφόμενη ημερομηνία «Χρήση έως».
14 Υλικά
Το σύστημα MVP δεν κατασκευάζεται από υλικά λατέξ ή PVC.
15 Αποποιητική δήλωση εγγύησης
Οι προειδοποιήσεις που περιέχονται στη σήμανση του προϊόντος παρέχουν
λεπτομερείς πληροφορίες και συνιστούν ακέραιο τμήμα αυτής της δήλωσης
αποποίησης της εγγύησης. Παρότι το παρόν προϊόν έχει κατασκευαστεί υπό
προσεκτικά ελεγχόμενες συνθήκες, η Medtronic δεν ασκεί κανέναν έλεγχο στις
συνθήκες υπό τις οποίες χρησιμοποιείται το παρόν προϊόν. Συνεπώς, η Medtronic
αποποιείται όλες τις εγγυήσεις, ρητές και σιωπηρές, αναφορικά με το προϊόν,
περιλαμβανομένης, ενδεικτικά, οποιασδήποτε σιωπηρής εγγύησης
εμπορευσιμότητας ή καταλληλότητας για συγκεκριμένο σκοπό. Η Medtronic δεν θα
είναι υπεύθυνη απέναντι σε οποιοδήποτε φυσικό ή νομικό πρόσωπο για οποιεσδήποτε
ιατρικές δαπάνες ή οποιεσδήποτε άμεσες, θετικές ή αποθετικές ζημίες
προκαλούμενες από οποιαδήποτε χρήση, ελάττωμα, αστοχία ή δυσλειτουργία του
προϊόντος, είτε η αξίωση για τέτοιες ζημίες βασίζεται σε εγγύηση, σύμβαση,
αδικοπραξία είτε σε κάτι άλλο. Κανένα πρόσωπο δεν έχει τη δικαιοδοσία να δεσμεύσει
την Medtronic σε οποιαδήποτε αντιπροσώπευση ή εγγύηση σε σχέση με το προϊόν.
Οι εξαιρέσεις και οι περιορισμοί που ορίζονται ανωτέρω δεν έχουν ως σκοπό και δεν θα πρέπει να
ερμηνεύονται κατά τέτοιο τρόπο ώστε να αντιβαίνουν στις υποχρεωτικές διατάξεις της
ισχύουσας νομοθεσίας. Εάν οποιοδήποτε τμήμα ή όρος της παρούσας αποποιητικής δήλωσης
της εγγύησης κριθεί από οποιοδήποτε δικαστήριο αρμόδιας δικαιοδοσίας παράνομο(ς), άκυρο(ς)
ή συγκρουόμενο(ς) με την ισχύουσα νομοθεσία, η ισχύς των υπόλοιπων τμημάτων της
παρούσας αποποιητικής δήλωσης της εγγύησης δεν θα επηρεαστεί και όλα τα δικαιώματα και οι
υποχρεώσεις θα ερμηνευτούν και θα ισχύσουν ως εάν δεν περιείχε η παρούσα αποποιητική
δήλωση το συγκεκριμένο τμήμα ή τον όρο που κρίθηκε άκυρο(ς).
Español
1 Descripción del dispositivo
El sistema de tapón microvascular MVP es un dispositivo de oclusión vascular autoexpansible. El
dispositivo MVP tiene forma ovoide, está fabricado en nitinol y se fija en ambos extremos con
bandas marcadoras de platino. El dispositivo incorpora una cubierta parcial de PTFE. La banda
marcadora proximal se une a un cable de colocación que empuja el dispositivo a través de un
microcatéter o catéter comercializado hasta el lugar de tratamiento previsto. El cable de colocación
se separa del dispositivo MVP girándolo hacia la izquierda para desenroscarlo del dispositivo.
El sistema MVP se envasa como una única unidad que contiene el dispositivo MVP, una vaina
introductora y un cable de colocación separable. El sistema se suministra estéril, es apirógeno y
está previsto para un solo uso.
Figura 1. Tapón microvascular MVP
1 Cubierta parcial
2 Marcador distal
3 Dispositivo MVP
Figura 2. Dimensiones del sistema MVP
1 Longitud del cable de colocación
2 Longitud sin restricciones (dispositivo sin vaina y sin ningún tipo de limitación)
3 Diámetro sin restricciones
Tabla 1. MVPDimensiones Modelo Diámetro sin
MVP-3Q 5,3 mm 12 mm 180 cm 1,5 mm – 3,0 mm
MVP-5Q 6,5 mm 12 mm 180 cm 3,0 mm – 5,0 mm
MVP-7Q 9,2 mm 16 mm 165 cm 5,0 mm – 7,0 mm
MVP-9Q 13,0 mm 18 mm 165 cm 7,0 mm – 9,0 mm
Tabla 2. Microcatéter o catéter recomendado Modelo Microcatéter o catéter reco-
MVP-3Q 0,53 mm (0,021 in) a 0,69 mm
MVP-5Q 0,69 mm (0,027 in) (DI) 153 cm
MVP-7Q 1,4 mm (4 Fr) (DE) 120 cm
MVP-9Q 1,7 mm (5 Fr) (DE) 120 cm
restricciones
Longitud sin
restricciones
mendado
(0,027 in) (DI)
4 Zona de separación
5 Cable de colocación
6 Marcador proximal
Longitud del
cable de colocación
Longitud máxima del microcatéter o catéter recomendado
153 cm
Diámetro del
vaso de interés
2 Uso previsto/Indicaciones de uso
El sistema de tapón microvascular MVP está indicado para obstruir o reducir el caudal de flujo
sanguíneo en la vasculatura periférica.
3 Contraindicaciones
Este dispositivo no tiene contraindicaciones conocidas.
4 Compatibilidad
Consulte las dimensiones del dispositivo en la etiqueta del producto del sistema MVP. Consulte el
etiquetado proporcionado con otras tecnologías médicas para determinar la compatibilidad.
5 Advertencias
• No se han establecido la seguridad y la efectividad del sistema MVP para usos cardíacos (p. ej.,
oclusión septal cardíaca, conducto arterioso persistente o cierre de fugas paravalvulares) y
usos neurológicos.
• El sistema MVP solo lo deben utilizar médicos familiarizados con los procedimientos
angiográficos e intervencionistas. Es importante leer las instrucciones de uso antes de utilizar
el sistema MVP.
21
Page 22

• Utilice el sistema MVP antes de la fecha de caducidad impresa en la etiqueta del envase del
producto.
• El sistema MVP es apirógeno y se proporciona estéril, a menos que el envase del sistema MVP
esté abierto o dañado. No utilice el producto si el envase está roto o dañado.
• Examine el sistema MVP antes de utilizarlo y deséchelo si observa alguna irregularidad o daño.
• El sistema MVP está previsto para un solo uso. No reprocese ni reesterilice el dispositivo. El
reprocesamiento y la reesterilización del dispositivo podrían aumentar los riesgos de infección
del paciente y de alteración del rendimiento del dispositivo. Después de utilizar el sistema MVP,
deséchelo de acuerdo con la política del hospital y del gobierno local.
• Utilice guía fluoroscópica cuando introduzca o manipule el sistema MVP. No introduzca ni retire
el dispositivo cuando note una resistencia excesiva hasta haber determinado la causa de la
resistencia.
• No retuerza ni gire el cable de colocación, excepto cuando tenga la intención de separar el
dispositivo porque, de lo contrario, este se podría soltar prematuramente.
• No utilice una jeringa de inyección eléctrica para inyectar solución de contraste con el
dispositivo a través de un microcatéter o catéter.
• No introduzca el cable de colocación después de haberlo separado del dispositivo MVP.
• Los médicos deben estar preparados para hacer frente a situaciones urgentes que requieran
la retirada del dispositivo. Esta preparación incluye la garantía de que haya un cirujano
disponible in situ.
• No utilice el dispositivo con catéteres que estén contraindicados para dispositivos embólicos
(por ejemplo, bobinas o un tapón).
6 Medidas preventivas
• El dispositivo MVP está fabricado en una aleación de níquel-titanio considerada, por lo general,
segura. No obstante, en pruebas in vitro se ha demostrado que el níquel se libera del dispositivo
durante 60 días como mínimo después de la implantación. Los pacientes que sean alérgicos al
níquel pueden sufrir una reacción alérgica al dispositivo, especialmente aquellos con
antecedentes de alergias a metales. Algunas reacciones alérgicas pueden ser graves, por lo
que se debe indicar a los pacientes que notifiquen a sus médicos inmediatamente si
sospechan que están sufriendo una reacción alérgica, como dificultad para respirar o
inflamación de la cara o la garganta. Algunos pacientes pueden desarrollar una alergia al níquel
al implantarles el dispositivo.
• Los médicos deben ejercer su criterio clínico en situaciones que impliquen el uso de
medicamentos anticoagulantes o antiplaquetarios antes, durante o después del uso del
dispositivo.
• Tenga precaución en las siguientes poblaciones específicas:
– En el caso de mujeres embarazadas, se deben tomar precauciones para minimizar la
exposición a la radiación de la madre y el feto.
– En el caso de madres lactantes, no se han realizado evaluaciones cuantitativas de la
presencia de lixiviables en la leche materna tras la implantación del dispositivo.
• Compruebe la compatibilidad del sistema MVP cuando se utilicen otros dispositivos auxiliares
en procedimientos intravasculares. Los médicos que utilicen el sistema MVP deben estar
familiarizados con las técnicas percutáneas e intravasculares y las posibles complicaciones
asociadas con el procedimiento.
• Es necesario hidratar el sistema MVP antes de utilizarlo.
• Se deben tomar precauciones cuando se manipule el sistema MVP para reducir la posibilidad
de daños accidentales.
• Existe una posibilidad de presencia de fuerzas de empuje más elevadas cuando este se utiliza
con microcatéteres o catéteres de compuesto de nitinol ranurados.
• Compruebe que el diámetro de cualquier dispositivo accesorio empleado sea compatible con
el sistema MVP antes de utilizarlo.
7 Posibles eventos adversos
Los efectos adversos que pueden ocurrir durante o después de un procedimiento de colocación de
este dispositivo incluyen, entre otros, los siguientes:
• Embolia gaseosa
• Reacción alérgica o efectos tóxicos
• Hemorragia
• Muerte
• Desplazamiento del dispositivo
• Fiebre
• Evento embólico por materia extraña
• Infección
• Oclusión de un vaso no deseado
• Embolia periférica
• Recanalización
• Flujo residual
• Ictus o accidente isquémico transitorio (AIT)
• Intervención quirúrgica
• Complicación en el punto de acceso vascular
• Perforación o traumatismo del vaso
8 Materiales necesarios
1. Para colocar el sistema MVP se requiere el uso de un microcatéter o catéter (consulte en la
Tabla 2 los tamaños recomendados).
2. Se necesitan los siguientes accesorios:
• Solución salina heparinizada.
• Válvula hemostática giratoria (VHG)
• Llave de paso de 3 vías
• Manguito de presión para bolsa de solución salina
• Vaina de acceso
• Catéter guía compatible con un microcatéter o catéter recomendado en la Tabla 2
• Guía compatible con el catéter guía y con el microcatéter o catéter
• Portasueros IV
9 Preparación
1. A fin de obtener un rendimiento óptimo del sistema MVP y reducir el riesgo de complicaciones
tromboembólicas, se debe mantener una irrigación continua de solución salina entre los
elementos siguientes:
• la vaina de acceso y el catéter guía
• el microcatéter o catéter y el catéter guía
• el microcatéter o catéter, la guía y el sistema MVP
2. Coloque el catéter guía adecuado según el procedimiento recomendado. Conecte una válvula
hemostática giratoria (VHG) en el conector del catéter guía. Conecte una llave de paso de
3 vías en el brazo lateral de la VHG. Conecte una vía de solución salina heparinizada para
realizar una irrigación continua.
3. Compruebe todas las conexiones para garantizar que no entre aire en el catéter guía ni en el
microcatéter o catéter durante la irrigación continua.
10 Instrucciones de uso
1. Acceda al vaso de interés y realice un angiograma mediante una técnica estándar para medir
el diámetro del vaso en el lugar de oclusión deseado. Asegúrese de que el vaso de interés
tiene el diámetro recomendado (consulte la Tabla 1).
2. Asegúrese de que el lugar de oclusión es suficientemente largo para dar cabida al dispositivo
MVP implantado sin obstruir vasos no deseados.
3. Seleccione un microcatéter o catéter (consulte en la Tabla 2 los tamaños recomendados) y
prepárelo según las instrucciones de uso del fabricante.
4. Inserte la guía e introduzca el microcatéter o catéter sobre ella hasta que la punta distal se
encuentre cerca del borde delantero del lugar de oclusión.
5. Extraiga la guía del microcatéter o catéter.
6. Retire el sistema MVP del tubo dispensador retirando con suavidad la vaina introductora
amarilla de los dos clips externos y tire del sistema MVP para sacarlo del tubo transparente
que lo aloja. Sujete con suavidad la vaina introductora en una posición proximal al dispositivo
MVP y retire lentamente el dispositivo MVP, el cable de colocación y la vaina introductora
simultáneamente del tubo dispensador. Consulte la Figura 3.
Figura 3. Sistema MVP envasado
22
Page 23

1 Tubo de alojamiento transparente
2 Vaina introductora amarilla
3 Cable de colocación (dentro de la vaina
introductora)
7. Examine exhaustivamente el sistema MVP por si tuviera daños. Si el sistema MVP presenta
algún daño, sustitúyalo por un sistema MVP nuevo.
8. Irrigue el sistema MVP sumergiendo con cuidado unos centímetros de la vaina introductora y
el dispositivo MVP en solución salina heparinizada.
9. Introduzca el dispositivo MVP en la vaina introductora tirando del cable de colocación justo
hasta que la punta distal del dispositivo MVP esté cubierta por la vaina introductora.
Nota: Si se tira demasiado del dispositivo MVP hacia el interior de la vaina introductora, puede
que no se irrigue correctamente. Dos orificios en la vaina introductora, situados a una distancia
de 3 cm y 6 cm proximal a la punta de la vaina, facilitan el purgado del aire y la irrigación del
dispositivo.
10. Inserte el sistema MVP; para ello, introduzca el extremo distal de la vaina introductora por la
VHG y en el conector del microcatéter o catéter hasta que la vaina esté firmemente asentada.
Apriete la VHG lo suficiente para evitar el reflujo sangre, pero no tanto como para dañar el
sistema MVP durante su introducción en el microcatéter o catéter.
11. Compruebe visualmente que la solución de irrigación se está infundiendo normalmente. Se
debe ver que la solución salina gotea por el extremo proximal de la vaina introductora.
12. Afloje la VHG lo suficiente para dejar que el dispositivo MVP y el cable de colocación avancen
juntos como un sistema. No afloje la VHG lo suficiente como para permitir el reflujo de sangre.
Retire la vaina introductora por el extremo proximal del cable de colocación.
13. Haga avanzar el cable de colocación y el dispositivo MVP hasta que el marcador distal de
platino del dispositivo MVP esté alineado con la banda marcadora distal del microcatéter o
catéter.
14. Confirme que las bandas marcadoras están colocadas de forma óptima. Despliegue el
dispositivo MVP manteniendo la presión hacia delante en el cable de colocación mientas
retrae lentamente el microcatéter o catéter para destapar el dispositivo MVP.
15. Si la posición del dispositivo no es satisfactoria, realice las acciones siguientes:
a. Estabilice el cable de colocación e introduzca el microcatéter o catéter distalmente hasta
volver a capturar el dispositivo MVP dentro del catéter.
b. Recoloque y despliegue el dispositivo o retírelo del paciente.
Nota: El dispositivo no se debe volver a introducir en el catéter y desplegar más de
3 veces.
16. El dispositivo MVP se debe colocar más allá de la punta del microcatéter o catéter para
separarlo correctamente.
17. Si la posición del dispositivo es satisfactoria, proceda a separarlo por medio de las acciones
siguientes:
a. Confirme bajo fluoroscopia que la punta del microcatéter o catéter se encuentra proximal
al dispositivo MVP.
b. Acople la herramienta de torsión al cable de colocación. Separe el dispositivo MVP
girando el cable de colocación hacia la izquierda hasta que se separe del dispositivo.
c. Compruebe que la separación se ha llevado a cabo correctamente bajo fluoroscopia;
para ello, tire lentamente del cable de colocación en dirección proximal para asegurarse
de que el dispositivo MVP no se mueva. En el caso improbable de que el dispositivo MVP
se mueva en dirección proximal, restablezca la posición del dispositivo y repita la rotación
hacia la izquierda del cable de colocación para realizar la separación.
18. Mientras sujeta el microcatéter o catéter en su sitio, retraiga el cable de colocación en el
microcatéter o catéter y luego retire el cable de colocación del paciente. Complete el
procedimiento mediante una técnica estándar.
4 Herramienta de torsión
5 Tubo dispensador
6 Dispositivo MVP
11 Instrucciones posteriores al procedimiento
Si el servicio MedicAlert está disponible en su región, recomendamos al paciente que se haga
miembro de MedicAlert en www.medicalert.org. Se pedirá al paciente que especifique su afección,
el nombre del dispositivo implantado y las restricciones relativas al uso de RM.
12 Información sobre RM
12.1 Condicionalmente compatible con la RM
Se ha determinado que el tapón microvascular MVP es condicionalmente compatible con la RM.
Se ha demostrado a través de pruebas no clínicas que el dispositivo de tapón microvascular MVP
es condicionalmente compatible con la RM. Un paciente portador de este dispositivo puede
someterse a exploraciones por resonancia magnética de forma segura, justo después de la
implantación del dispositivo en las siguientes condiciones:
• Campo magnético estático igual o inferior a 3 T.
• Campo magnético de gradiente espacial máximo igual o inferior a 9000 Gs/cm.
• Índice de absorción específico (Specific Absorption Rate, SAR) medio de cuerpo completo
informado por el sistema de RM máximo de 4 W/kg durante 15 minutos de exploración (es
decir, por secuencia de pulsos).
• Modo de funcionamiento controlado de primer nivel para el sistema de RM.
12.2 Calentamiento relacionado con la RM
En pruebas no clínicas, el dispositivo de tapón microvascular MVP produjo la siguiente elevación
de la temperatura durante la exploración por RM realizada durante 15 min (es decir, por secuencia
de pulsos) en un sistema de RM de 3 T (3 T/128 MHz, Excite, HDx, Software 14X.M5, General
Electric Healthcare, Milwaukee, WI, Estados Unidos): variación máxima de la
temperatura +1,8°C.
Por consiguiente, los experimentos de calentamiento relacionado con la exploración por RM con el
dispositivo de tapón microvascular MVP a 3 T utilizando una bobina corporal de
transmisión/recepción de radiofrecuencia (RF) con una tasa de absorción específica (TAE)
promediada en todo el cuerpo registrada con el sistema de RM de 2,9 W/kg (es decir, asociada a
un valor promediado en todo el cuerpo medido por calorimetría de 2,7 W/kg) indicaron que la mayor
cantidad de calentamiento producido en relación con estas condiciones específicas fue igual o
inferior a +1,8°C.
12.3 Información sobre artefactos
La calidad de las imágenes de RM puede resultar afectada si el área de interés se encuentra
exactamente en la misma área o relativamente cerca de la posición del dispositivo de tapón
microvascular MVP. Por consiguiente, puede ser necesario optimizar los parámetros de
exploración por RM para compensar la presencia de este dispositivo. El tamaño de artefacto
máximo (es decir, observado en la secuencia de pulsos de eco de gradiente) se extiende
aproximadamente 5 mm con respecto al tamaño y la forma del dispositivo de tapón microvascular
MVP.
Secuencia de
impulsos
Tamaño de vacío
de señal
Orientación del
plano
T1-SE T1-SE GRE GRE
2
252 mm
Paralelo Perpendicular Paralelo Perpendicular
91 mm
2
304 mm
2
116 mm
2
13 Almacenamiento
Evite la exposición del sistema MVP al agua, la luz solar directa, las temperaturas extremas y una
humedad elevada durante el almacenamiento. Almacene el sistema MVP a temperatura ambiente
controlada. Consulte la fecha de caducidad del dispositivo en la etiqueta del producto. No utilice el
dispositivo después de la fecha de caducidad indicada.
14 Materiales
El sistema MVP no está fabricado con látex ni PVC.
15 Renuncia de responsabilidad
Las advertencias que contiene la documentación del producto proporcionan información
más detallada y se consideran como parte integrante de esta renuncia de
responsabilidad. Aunque el producto se ha fabricado en condiciones cuidadosamente
controladas, Medtronic no tiene control sobre las condiciones en las que se utilice. Por
tanto, Medtronic no ofrece garantía alguna, ya sea expresa o implícita, con respecto al
producto, incluida entre otras toda garantía implícita de comerciabilidad o idoneidad para
un fin particular. Medtronic no será responsable ante ninguna persona o entidad por los
gastos médicos o daños directos, indirectos o resultantes causados por el uso, defecto,
fallo o mal funcionamiento del producto, aun cuando la reclamación por dichos daños se
base en una garantía, contrato, responsabilidad extracontractual u otros fundamentos
legales. Ninguna persona tiene autoridad para obligar a Medtronic a ninguna
representación o garantía con respecto al producto.
Las exclusiones y limitaciones descritas anteriormente no pretenden contravenir las disposiciones
obligatorias establecidas por la legislación vigente ni deben interpretarse de dicha forma. En el
supuesto de que cualquier parte o término de la presente Renuncia de responsabilidad fuera
declarado por cualquier tribunal competente como ilegal, inaplicable o contrario a la ley, ello no
afectará a la validez del resto de la Renuncia de responsabilidad, interpretándose y aplicándose
cuantos derechos y obligaciones se contienen en la misma como si la presente Renuncia de
responsabilidad no contuviera la parte o término considerado no válido.
23
Page 24

Eesti
1 Seadme kirjeldus
Mikrovaskulaarne korgisüsteem MVP on iselaienev seade veresoone sulgemiseks. Seade MVP on
munakujuline, koosneb nitinoolist ja selle mõlemad otsad on varustatud plaatinast markerribadega.
Seadmel on osaline PTFE-kate. Proksimaalne markerriba on kinnitatud paigaldustraadi külge, mille
abil lükatakse seade kaubandusvõrgus saadaoleva mikrokateetri või kateetri kaudu soovitud
protseduuripaika. Paigaldustraadi eraldamiseks seadme MVP küljest tuleb paigaldustraati pöörata
vastupäeva, et see seadme küljest lahti kruvida.
Süsteem MVP on pakendatud ühes tükis, mis hõlmab seadet MVP, sisestushülssi ja eraldatavat
paigaldustraati. Süsteem tarnitakse steriilsena, see on mittepürogeenne ning mõeldud ainult
ühekordseks kasutamiseks.
Joonis 1. Mikrovaskulaarne kork MVP
1 Osaline kate
2 Distaalne marker
3 Seade MVP
Joonis 2. Süsteemi MVP mõõtmed
1 Paigaldustraadi pikkus
2 Piiramata pikkus (hülsist vabastatud ja
piiranguteta seade)
Tabel 1. Seadme MVP Mõõtmed Mudel Piiramata läbi-
MVP-3Q 5,3 mm 12 mm 180 cm 1,5 mm–3,0 mm
MVP-5Q 6,5 mm 12 mm 180 cm 3,0 mm–5,0 mm
MVP-7Q 9,2 mm 16 mm 165 cm 5,0 mm–7,0 mm
MVP-9Q 13,0 mm 18 mm 165 cm 7,0 mm–9,0 mm
Tabel 2. Soovitatav mikrokateeter või kateeter Mudel Soovitatav mikrokateeter
MVP-3Q 0,021 in (0,53 mm) kuni
MVP-5Q 0,027 in (0,69 mm) (siseläbi-
MVP-7Q 4 Fr (1,4 mm) (välisläbimõõt) 120 cm
MVP-9Q 5 Fr (1,7 mm) (välisläbimõõt) 120 cm
mõõt
Piiramata pikkus
või kateeter
0,027 in (0,69 mm) (siseläbimõõt)
mõõt)
4 Eraldumistsoon
5 Paigaldustraat
6 Proksimaalne marker
3 Piiramata läbimõõt
Paigaldustraadi
pikkus
Mikrokateetri või kateetri
soovitatav maksimaalne
pikkus
153 cm
153 cm
Sihtveresoone
läbimõõt
2 Sihtotstarve/kasutusnäidustused
Mikrovaskulaarne korgisüsteem MVP on näidustatud verevoolu sulgemiseks või aeglustamiseks
perifeersetes veresoontes.
3 Vastunäidustused
Seadmel ei ole teadaolevaid vastunäidustusi.
4 Ühilduvus
Seadme mõõtmed leiate süsteemi MVP tooteetiketilt. Ühilduvust muu meditsiinitehnikaga
kontrollige vastava toote märgistuselt.
5 Hoiatused
• Süsteemi MVP ohutust ja tõhusust ei ole katsetatud kardiaalsete (nt südame vaheseina
oklusioon, avatud arterioosjuha, paravalvulaarse lekke sulgemine) ega neuroloogiliste
kasutusviiside puhul.
• Süsteemi MVP tohivad kasutada ainult arstid, kes tunnevad angiograafilisi ja
interventsionaalseid protseduure. Enne süsteemi MVP kasutamist tuleb kindlasti lugeda
kasutusjuhendit.
• Kasutage süsteemi MVP enne tootepakendi etiketile trükitud kõlblikkusaja möödumist.
• Süsteem MVP on mittepürogeenne ja tarnitakse steriilsena, kui süsteemi MVP pakendit ei ole
avatud ega kahjustatud. Mitte kasutada, kui pakend on rikutud või kahjustatud.
• Kontrollige süsteemi MVP enne kasutamist ja kõrvaldage see, kui tuvastate mis tahes
ebakorrapärasusi või kahjustusi.
• Süsteem MVP on ette nähtud ainult ühekordseks kasutamiseks. Ärge taastöödelge ega
resteriliseerige. Taastöötlemine ja resteriliseerimine võib suurendada patsiendi infektsiooni
ning seadme rikete ohtu. Pärast süsteemi MVP kasutamist kõrvaldage see haigla ja kohaliku
omavalitsusüksuse eeskirjade kohaselt.
• Kasutage süsteemi MVP liigutamisel või käsitsemisel fluoroskoopilist jälgimist. Tugeva
takistuse tundmisel ärge liigutage seadet edasi ega tagasi enne, kui takistuse põhjus on
kindlaks tehtud.
• Ärge väänake ega pöörake paigaldustraati muidu, kui ainult seadme eraldamiseks, kuna
vastasel korral võib seade enneaegselt eralduda.
• Ärge kasutage perfuusorit kontrastaine süstimiseks seadmega läbi mikrokateetri või kateetri.
• Ärge lükake paigaldustraati edasi pärast selle eraldamist seadme MVP küljest.
• Arstid peavad olema valmis reageerima olukordadele, kus seade tuleb kiiresti eemaldada.
Seesugune valmisolek hõlmab valvekirurgi olemasolu tagamist.
• Mitte kasutada kateetritega, mis on emboliseadmete (nt mähiste või korkide) puhul
vastunäidustatud.
6 Ettevaatusabinõud
• Seade MVP koosneb nikli-titaani sulamist, mida loetakse üldjuhul ohutuks. In vitro katsed on
aga näidanud, et kui seade on olnud implanteeritud vähemalt 60 päeva, vabaneb sellest niklit.
Niklile allergilistel patsientidel (eriti patsientidel, kellel on varem esinenud metalliallergiat) võib
tekkida seadme suhtes allergiline reaktsioon. Teatavad allergilised reaktsioonid võivad olla
raskekujulised. Patsientidel tuleb paluda kohe arsti poole pöörduda, kui nad kahtlustavad endal
allergilist reaktsiooni, nagu hingamisraskused või näo- või kõriturse. Mõnel patsiendil võib
nikliallergia välja kujuneda seadme implanteerimisel.
• Olukordades, kus enne või pärast seadme kasutamist või selle ajal tuleb kasutada hüübimisvõi trombotsüüdivastaseid ravimeid, peavad arstid rakendama oma parimat kliinilist
äranägemist.
• Erilist hoolikust tuleb üles näidata järgmiste eripopulatsioonide korral.
– Rasedate patsientide puhul tuleb kanda hoolt, et ema ja loote kokkupuude kiirgusega oleks
minimaalne.
– Imetavate emade puhul tuleb arvestada, et seadme implanteerimise järgselt rinnapiima
erituvaid aineid ei ole kvantitatiivselt uuritud.
• Kui kasutate intravaskulaarsete protseduuride puhul ka muid seadmeid, kontrollige nende
ühilduvust süsteemiga MVP. Süsteemi MVP kasutavad arstid peavad tundma perkutaanseid ja
intravaskulaarseid töövõtteid ning protseduuriga kaasneda võivaid tüsistusi.
• Süsteemi MVP tuleb enne kasutamist niisutada.
• Juhuslike kahjustuste vältimiseks olge süsteemi MVP käsitsemisel ettevaatlik.
• Nitinooliühendist piludega mikrokateetrite või kateetritega kasutamise korral võib tõukejõud
olla suurem.
• Enne tarvikute kasutamist veenduge, et nende läbimõõt ühilduks süsteemiga MVP.
7 Võimalikud kõrvaltoimed
Seadme paigaldamise ajal või järel tekkida võivad kõrvaltoimed on muu hulgas järgmised.
• Õhkemboolia
• Allergiline reaktsioon või toksiline mõju
• Veritsus
• Surm
24
Page 25

• Seadme migratsioon
• Palavik
• Võõrkehast tingitud emboolia
• Infektsioon
• Soovimatu veresoone oklusioon
• Perifeerne emboolia
• Rekanalisatsioon
• Jääkvool
• Insult või mööduv isheemiline atakk (TIA)
• Kirurgiline sekkumine
• Veresoonde sisenemise koha tüsistus
• Veresoone trauma või perforatsioon
8 Vajalikud vahendid
1. Süsteemi MVP paigaldamiseks läheb vaja mikrokateetrit või kateetrit (soovitatavat suurust vt
tabel 2).
2. Vaja läheb järgmisi tarvikuid.
• Hepariniseeritud füsioloogiline lahus
• Pöörlev hemostaatiline klapp (RHV)
• Kolmesuunaline korkkraan
• Füsioloogilise lahuse koti rõhumansett
• Sisenemiskoha hülss
• Soovitatava mikrokateetri või kateetriga (vt tabel 2) ühilduv juhtekateeter
• Juhtekateetriga ja mikrokateetri või kateetriga ühilduv juhtetraat
• Tilgajalg
9 Ettevalmistamine
1. Süsteemi MVP optimaalse toimivuse saavutamiseks ja trombembooliliste tüsistuste riski
vähendamiseks tagage pidev loputus füsioloogilise lahusega järgmiste komponentide vahel:
• sisenemiskoha hülss ja juhtekateeter;
• mikrokateeter või kateeter ja juhtekateeter;
• mikrokateeter või kateeter, juhtetraat ja süsteem MVP.
2. Paigaldage sobiv juhtekateeter, kasutades soovitatud protseduuri. Ühendage pöörlev
hemostaatiline klapp (RHV) juhtekateetri liitmikuga. Kinnitage kolmesuunaline korkkraan RHV
külghaara külge. Ühendage pideva loputuse jaoks mõeldud hepariniseeritud füsioloogilise
lahuse liin.
3. Kontrollige kõiki ühendusi veendumaks, et juhtekateetrisse ega mikrokateetrisse või
kateetrisse ei satuks pideva loputuse käigus õhku.
10 Kasutusjuhised
1. Sisenege sihtveresoonde ja viige standardmeetodil läbi angiogramm, et mõõta veresoone
läbimõõtu soovitud oklusioonikohas. Veenduge, et sihtveresoon oleks soovitusliku
läbimõõduga (vt tabel 1).
2. Veenduge, et oklusioonikoht oleks piisavalt suur, et seadme MVP saaks implanteerida ilma
muid veresooni sulgemata.
3. Valige välja mikrokateteer või kateeter (soovituslikku suurust vt tabel 2) ja valmistage see tootja
kasutusjuhendi kohaselt ette.
4. Sisestage juhtetraat ja lükake mikrokateetrit või kateetrit üle juhtetraadi edasi, kuni distaalne
otsak jõuab oklusioonikoha eesmise servani.
5. Eemaldage juhtetraat mikrokateetrist või kateetrist.
6. Eemaldage süsteem MVP sisestusvoolikust, eemaldades kollase sisestushülsi ettevaatlikult
kahe välimise klambri küljest, ja tõmmake süsteem MVP läbipaistvast torukujulisest korpusest
välja. Võtke ettevaatlikult kinni sisestushülsi sellisest kohast, mis asub seadme MVP suhtes
proksimaalselt, ja eemaldage seade MVP, paigaldustraat ja sisestushülss aeglaselt
ühekorraga sisestusvoolikust. Vt joonis 3.
Pakendatud süsteem MVP
Joonis 3.
1 Läbipaistev torukujuline korpus
2 Kollane sisestushülss
3 Paigaldustraat (sisestushülsi sees)
4 Pööramisseade
5 Sisestusvoolik
6 Seade MVP
7. Kontrollige süsteemi MVP hoolikalt, et veenduda kahjustuste puudumises. Kui süsteem MVP
on saanud kahjustada, asendage see uue süsteemiga MVP.
8. Loputage süsteemi MVP, kastes sisestushülsi mõne sentimeetri ulatuses ja seadme MVP
hepariniseeritud füsioloogilisse lahusesse.
9. Tõmmake seadme MVP sisestushülssi, tõmmates paigaldustraati tagasi, kuni seadme MVP
distaalne otsak on napilt sisestushülsiga kaetud.
Märkus. Kui seade MVP tõmmatakse liiga sügavale sisestushülsi sisse, ei pruugi selle
loputamine korralikult toimida. Sisestushülsis olevad kaks auku, mis asuvad hülsi otsakust
3 cm ja 6 cm proksimaalses suunas, hõlbustavad õhu väljutamist ja seadme loputamist.
10. Sisestage süsteem MVP, juhtides sisestushülsi distaalse otsaku läbi RHV mikrokateetri või
kateetri liitmikku, kuni hülss kinnitub paigale. Pingutage RHV-d piisavalt, et takistada vere
tagasivoolu, aga mitte nii tugevasti, et süsteem MVP saaks mikokateetrisse või kateetrisse
sisestamisel kahjustada.
11. Kontrollige visuaalselt, et loputuslahuse infusioon toimuks normaalselt. Sisestushülsi
proksimaalsest otsast peaks tilkuma füsioloogilist lahust.
12. Lõdvendage RHV-d nii palju, et seadet MVP ja paigaldustraati saaks ühes tükis süsteemina
edasi lükata. Ärge lõdvendage RHV-d nii palju, et veri saaks tagasi voolata. Eemaldage
sisestushülss, tõmmates selle üle paigaldustraadi proksimaalse otsa tagasi.
13. Lükake paigaldustraati ja seadet MVP edasi, kuni seadme MVP distaalne plaatinamarker
jõuab ühele joonele mikrokateetri või kateetri distaalse markerribaga.
14. Veenduge, et markerribade asetus oleks optimaalne. Aktiveerige seade MVP, surudes
paigaldustraati ettepoole ning tõmmates mikokateetrit või kateetrit samal ajal aeglaselt tagasi,
nii et seade MVP tuleb hülsist välja.
15. Kui seadme asend on mitterahuldav, tehke järgmist.
a. Stabiliseerige paigaldustraat ja lükake mikrokateetrit või kateetrit distaalses suunas
edasi, kuni seade MVP jõuab kateetrisse tagasi.
b. Muutke seadme asendit ja paigaldage see uuesti või eemaldage seade patsiendist.
Märkus. Seadet ei tohi uuesti hülsi sisse tõmmata ja aktiveerida rohkem kui kolm korda.
16. Et eraldumine toimuks korralikult, tuleb seade MVP paigutada mikrokateetri või kateetri
otsakust kaugemale.
17. Kui seadme asend on mitterahuldav, tehke selle eraldamiseks järgmist.
a. Kontrollige fluoroskoopiliselt, et mikrokateetri või kateetri otsak asuks seadme MVP
suhtes proksimaalselt.
b. Kinnitage pööramisseade paigaldustraadi külge. Seadme MVP eraldamiseks pöörake
paigaldustraati vastupäeva, kuni see seadme küljest lahti tuleb.
c. Kontrollige eraldumise õnnestumist fluoroskoopiliselt, tõmmates paigaldustraati
aeglaselt proksimaalses suunas veendumaks, et seade MVP jääb paigale. Kui seade
MVP peaks siiski proksimaalses suunas liikuma, kontrollige seadme paigutus üle ja
pöörake paigaldustraati selle eraldamiseks uuesti vastupäeva.
18. Hoidke mikrokateetrit või kateetrit paigal ja tõmmake paigaldustraat tagasi mikrokateetrisse
või kateetrisse ning seejärel eemaldage paigaldustraat patsiendi kehast. Viige protseduur
standardmeetodil lõpule.
11 Protseduurijärgsed juhised
Kui teenus MedicAlert on teie piirkonnas saadaval, soovitage patsiendil hakata MedicAlerti liikmeks
aadressil www.medicalert.org. Patsiendil palutakse täpsustada oma haigusseisundit,
implanteeritud seadme nime ja MRT kasutamisega seotud piiranguid.
25
Page 26

12 MRT-alane teave
12.1 MR-tingimuslik
Mikrovaskulaarset korki MVP loetakse MR-tingimuslikuks. Mittekliinilised katsed on näidnud, et
mikrovaskulaarne korgiseade MVP on MR-tingimuslik. Selle seadmega patsiendil võib vahetult
pärast paigaldamist teha ohutult uuringut järgmistes tingimustes:
• staatiline magnetväli 3 T või vähem;
• magnetvälja maksimaalne ruumiline gradient 9000 gaussi/cm või vähem;
• MRT-süsteemi teatatud maksimaalne terve keha suhtes keskmistatud SAR
(erineelduvuskiirus) 4 W/kg 15 minuti skannimise kohta (st impulsijärjestuse kohta);
• MR-süsteemi režiim First Level Controlled Operating Mode (Esimese taseme kontrollitud
töörežiim).
12.2 MRT-ga seotud soojenemine
Mittekliinilistes katsetes esinesid mikrovaskulaarse korgiseadme MVP puhul järgmised
temperatuuritõusud pärast 15 min pikkust MRT-skannimist (st impulsijärjestuse kohta) 3 T
MR-süsteemis (3 T / 128 MHz, Excite, HDx, tarkvara 14X.M5, General Electric Healthcare,
Milwaukee, WI): suurim temperatuurimuutus +1,8°C
Seega näitasid mikrovaskulaarse korgiseadme MVP MRT-uuringuga seotud soojenemiskatsed
magnetväljaga 3 T, kasutades saate/vastuvõtu raadiosagedusel töötavat keha pooli MRT-süsteemi
teatatud kogu keha keskmistatud erineeldumismääraga (SAR) 2,9 W/kg (st vastav kalorimeetriliselt
mõõdetud kogu keha keskmistatud väärtus 2,7 W/kg), et neis konkreetsetes tingimustes oli
maksimaalne soojenemine kuni +1,8°C.
12.3 Teave artefaktide kohta
MR-kujutise kvaliteet võib halveneda, kui huvipakkuv ala on täpselt samas piirkonnas või suhteliselt
lähedal mikrovaskulaarse koriseadme MVP asukohale. Seetõttu võib osutuda vajalikuks
optimeerida MRT-uuringu kujutise parameetreid selle seadme olemasolu suhtes. Artefaktide
maksimaalne suurus (st gradientkaja impulsijärjestusega skannimisel) umbes 5 mm
mikrovaskulaarse korgiseadme MVP suuruse ja kuju suhtes.
Impulsijärjestus
Signaalita ala
suurus
Tasandi orientatsioon
T1-SE T1-SE GRE GRE
2
252 mm
Paralleelne Risti Paralleelne Risti
91 mm
2
304 mm
2
116 mm
2
Suomi
1 Laitteen kuvaus
MVP-mikroverisuonitulppajärjestelmä on itsestään laajeneva suonensulkulaite. MVP-laite on
munanmuotoinen ja valmistettu nitinolista, ja se on kiinnitetty molemmista päistä
platinamerkkirenkailla. Laitteessa on osittainen PTFE-pinnoite. Proksimaalinen merkkirengas on
kiinnitetty asetusvaijeriin, jolla laite työnnetään tavallisen mikrokatetrin tai katetrin läpi haluttuun
hoitokohtaan. Asetusvaijeri irrotetaan MVP-laitteesta kiertämällä asetusvaijeria vastapäivään niin,
että se irtoaa laitteesta.
MVP-järjestelmä on pakattu yhtenä yksikkönä, joka sisältää MVP-laitteen, sisäänvientiholkin ja
irrotettavan asetusvaijerin. Järjestelmä toimitetaan steriilinä ja pyrogeenittomana ja on tarkoitettu
vain kertakäyttöön.
Kuva 1. MVP-mikroverisuonitulppa
1 Osittainen pinnoite
2 Distaalinen merkki
3 MVP-laite
4 Irrotusalue
5 Asetusvaijeri
6 Proksimaalinen merkki
Kuva 2. MVP-järjestelmän mitat
13 Hoiustamine
Süsteemi MVP hoiustamise ajal vältige selle kokkupuudet veega, päikesevalgusega, äärmuslike
temperatuuridega ja suure õhuniiskusega. Hoidke süsteemi MVP reguleeritud toatemperatuuril.
Seadme kõlblikkusaega vaadake tooteetiketilt. Ärge kasutage seadet pärast etiketile märgitud
kõlblikkusaja möödumist.
14 Materjalid
Süsteem MVP ei sisalda lateksit ega PVC-materjale.
15 Garantiist lahtiütlemine
Tootedokumentatsioonis toodud hoiatused annavad üksikasjalikumat teavet ning neid
loetakse käesoleva garantiist lahtiütlemise lahutamatuks osaks. Kuigi see toode on
toodetud hoolikalt kontrollitud tingimustes, ei ole ettevõttel Medtronic mingit kontrolli
selle toote kasutustingimuste üle. Seega ütleb Medtronic lahti kõigist otsestest ja
kaudsetest tootega seotud garantiidest, sealhulgas, kuid mitte ainult, kõikidest
kaudsetest garantiidest müügikõlblikkuse või teatud eesmärgil kasutamiseks sobivuse
osas. Medtronic ei vastuta ühegi füüsilise ega juriidilise isiku ees mis tahes
meditsiinikulude ega mingite otseste, juhuslike või kaasnevate kahjude eest, mida
põhjustab toote mis tahes kasutamine, defekt, tõrge või talitlushäire, olenemata sellest,
kas selliste kahjude kahjunõue põhineb garantiil, lepingul, lepinguvälisel kahjul või muul.
Ühelgi isikul ei ole volitust siduda ettevõtet Medtronic mingite tootega seotud avalduste
ega garantiidega.
Ülaltoodud välistamised ja piirangud ei ole mõeldud kohaldatavate seaduste kohustuslike sätetega
vastuollu sattuma ning neid ei tohi sellisena käsitada. Kui mis tahes pädeva jurisdiktsiooni kohus
peab selle garantiist lahtiütlemise mis tahes osa või tingimust ebaseaduslikuks, jõustamatuks või
kohaldatavate seadustega vastuolus olevaks, ei mõjuta see garantiist lahtiütlemise ülejäänud
osade kehtivust ning kõiki õigusi ja kohustusi tuleb mõista ning rakendada nii, nagu poleks garantiist
lahtiütlemine kehtetuks kuulutatud osa või tingimust sisaldanud.
1 Asetusvaijerin pituus
2 Rajoittamaton pituus (laite työnnettynä ulos niin, ettei mikään purista sitä)
3 Rajoittamaton läpimitta
Taulukko 1. MVP-laitteen mitat Malli Rajoittamaton
MVP-3Q 5,3 mm 12 mm 180 cm 1,5 mm – 3,0 mm
MVP-5Q 6,5 mm 12 mm 180 cm 3,0 mm – 5,0 mm
MVP-7Q 9,2 mm 16 mm 165 cm 5,0 mm – 7,0 mm
MVP-9Q 13,0 mm 18 mm 165 cm 7,0 mm – 9,0 mm
Taulukko 2. Suositeltu mikrokatetri tai katetri Malli Suositeltu mikrokatetri tai
MVP-3Q 0,53 mm – 0,69 mm
MVP-5Q 0,69 mm (0,027 in) (sisäläpi-
MVP-7Q 4 Fr (1,4 mm) (ulkoläpimitta) 120 cm
MVP-9Q 5 Fr (1,7 mm) (ulkoläpimitta) 120 cm
läpimitta
Rajoittamaton
pituus
katetri
(0,021 in – 0,027 in) (sisäläpimitta)
mitta)
Asetusvaijerin
pituus
Kohdesuonen
läpimitta
Suositellun mikrokatetrin tai
katetrin maksimipituus
153 cm
153 cm
2 Käyttötarkoitus ja käyttöaiheet
MVP-mikroverisuonitulppajärjestelmä on tarkoitettu veren virtausnopeuden rajoittamiseen eli
hidastamiseen ääreisverisuonistossa.
26
Page 27

3 Vasta-aiheet
Laitteelle ei ole tunnettuja vasta-aiheita.
4 Yhteensopivuus
Katso laitteen mitat MVP-järjestelmän tuote-etiketistä. Määritä yhteensopivuus muiden
lääkintälaitteiden mukana toimitetusta dokumentaatiosta.
5 Vaarat
• MVP-järjestelmän turvallisuutta ja vaikuttavuutta ei ole osoitettu käytettäessä sydämessä
(esimerkiksi väliseinän aukon, avoimen valtimotiehyen, paravalvulaarisen vuodon
sulkemisessa) ja neurologisessa käytössä.
• MVP-järjestelmää saavat käyttää vain lääkärit, jotka tuntevat angiografiatoimenpiteet ja
interventionaaliset toimenpiteet. On tärkeää lukea käyttöohjeet ennen MVP-järjestelmän
käyttöä.
• Käytä MVP-järjestelmä ennen tuotteen pakkausetikettiin merkittyä viimeistä
käyttöpäivämäärää.
• MVP-järjestelmä on pyrogeeniton ja toimittaessa steriili, paitsi jos MVP-järjestelmän pakkaus
on auennut tai vaurioitunut. Älä käytä laitetta, jos pakkaus on rikki tai vaurioitunut.
• Tarkasta MVP-järjestelmä ennen käyttöä ja hävitä se, jos havaitset siinä poikkeavuuksia tai
vaurioita.
• MVP-järjestelmä on tarkoitettu vain kertakäyttöön. Älä käsittele tai steriloi laitetta uudelleen.
Uudelleenkäsittely ja -sterilointi saattaa altistaa potilaan infektiolle ja mahdollisesti aiheuttaa
laitteen toimintahäiriön. Hävitä MVP-järjestelmä käytön jälkeen sairaalan ja paikallisten
viranomaisten käytännön mukaisesti.
• Käytä läpivalaisuohjausta, kun työnnät MVP-järjestelmää eteenpäin tai käsittelet sitä. Älä
työnnä tai vedä laitetta, jos siinä tuntuu liikaa vastusta, ennen kuin vastuksen syy on selvitetty.
• Älä väännä tai kierrä asetusvaijeria, paitsi kun aiot irrottaa laitteen, sillä muutoin laite voi irrota
ennenaikaisesti.
• Älä ruiskuta varjoaineliuosta automaattisella injektioruiskulla laitteen kanssa mikrokatetrin tai
katetrin läpi.
• Älä työnnä asetusvaijeria eteenpäin, kun olet irrottanut sen MVP-laitteesta.
• Lääkäreiden on oltava valmiita toimimaan hätätilanteissa, jotka edellyttävät laitteen
poistamista. Tämä valmius tarkoittaa, että kirurgin on oltava käytettävissä paikan päällä.
• Älä käytä laitetta katetrien kanssa, joiden käyttö on vasta-aiheista embolialaitteiden
(esimerkiksi koilien tai tulpan) kanssa.
6 Varotoimet
• MVP-laite koostuu nikkeli-titaaniseoksesta, jota pidetään yleisesti turvallisena. In vitro -testit
ovat kuitenkin osoittaneet, että laitteesta vapautuu nikkeliä vähintään 60 päivän ajan
implantoinnista. Laite saattaa aiheuttaa allergisen reaktion nikkelille allergisille potilaille,
etenkin potilaille, joilla on ollut aiemmin metalliallergioita. Jotkin allergiset reaktiot voivat olla
vakavia; potilaita on neuvottava ilmoittamaan lääkäreilleen välittömästi, jos he epäilevät, että
heillä on allerginen reaktio, kuten hengitysvaikeuksia tai kasvojen tai kurkun tulehdus. Joillekin
potilaille voi kehittyä nikkeliallergia, kun laite implantoidaan.
• Lääkäreiden on käytettävä kliinistä harkintaa tilanteissa, joissa käytetään antikoagulantteja tai
verihiutaleiden estäjiä ennen laitteen käyttöä, sen aikana tai sen jälkeen.
• Huomattavaa seuraavien erityisryhmien hoidossa:
– Hoidettaessa raskaana olevia potilaita äidin ja sikiön säteilyaltistus on minimoitava.
– Hoidettaessa imettäviä äitejä on huomattava, että uuttuvien aineiden määrää rintamaidossa
ei ole arvioitu laitteen implantoinnin jälkeen.
• Tarkista MVP-järjestelmän yhteensopivuus, kun käytät muita lisälaitteita suonensisäisissä
toimenpiteissä. MVP-järjestelmää käyttävien lääkäreiden on tunnettava perkutaaniset
suonensisäiset menetelmät ja toimenpiteeseen liittyvät mahdolliset komplikaatiot.
• MVP-järjestelmä on kostutettava ennen käyttöä.
• Käsittele MVP-järjestelmää varovasti, jotta se ei vaurioidu tahattomasti.
• Työntövoiman täytyy mahdollisesti olla suurempi, kun järjestelmää käytetään uritettujen
nitinolikomposiittimikrokatetrien tai -katetrien kanssa.
• Tarkista ennen käyttöä, että käytettävien lisälaitteiden läpimitta on yhteensopiva
MVP-järjestelmän kanssa.
7 Mahdolliset haittatapahtumat
Mahdollisia haittatapahtumia, joita voi ilmetä laitteen asetustoimenpiteen aikana tai sen jälkeen
ovat muun muassa seuraavat:
• ilmaembolus
• allerginen reaktio tai toksiset vaikutukset
• verenvuoto
• kuolema
• laitteen siirtyminen
• kuume
• vierasaineen aiheuttama emboliatapahtuma
• infektio
• väärän suonen sulkeminen
• perifeerinen embolia
• rekanalisaatio
• jäännösvirtaus
• aivohaveri tai ohimenevä aivoverenkiertohäiriö (TIA)
• kirurginen toimenpide
• verisuonen sisäänvientikohdan komplikaatio
• suonen vamma tai perforaatio.
8 Tarvittavat materiaalit
1. MVP-järjestelmän asetuksessa on käytettävä mikrokatetria tai katetria (Taulukko 2 sisältää
suositellun koon).
2. Seuraavat lisävarusteet tarvitaan:
• heparinisoitua keittosuolaliuosta
• pyörivä hemostaasiventtiili (RHV)
• kolmitiesulkuhana
• keittosuolaliuospussin painemansetti
• yhteysholkki
• ohjainkatetri, joka on yhteensopiva taulukossa (Taulukko 2) suositellun mikrokatetrin tai
katetrin kanssa
• ohjainvaijeri, joka on yhteensopiva ohjainkatetrin ja mikrokatetrin tai katetrin kanssa
• infuusioteline.
9 Valmisteleminen
1. Jotta MVP-järjestelmä toimisi optimaalisesti ja tromboemboliakomplikaatioiden riskiä
saataisiin vähennettyä, ylläpidä jatkuvaa keittosuolaliuoshuuhtelua seuraavien osien välillä:
• yhteysholkki ja ohjainkatetri
• mikrokatetri tai katetri ja ohjainkatetri
• mikrokatetri tai katetri, ohjainvaijeri ja MVP-järjestelmä.
2. Aseta asianmukainen ohjainkatetri paikalleen suositellulla menetelmällä. Liitä pyörivä
hemostaasiventtiili (RHV) ohjainkatetrin kantaan. Kiinnitä kolmitiesulkuhana pyörivän
hemostaasiventtiilin sivuvarteen. Liitä heparinisoidun keittosuolaliuoksen letku jatkuvaa
huuhtelua varten.
3. Tarkista kaikki liittimet ja varmista, ettei ilmaa pääse ohjainkatetriin tai mikrokatetriin tai katetriin
jatkuvan huuhtelun aikana.
10 Käyttöohjeet
1. Avaa yhteys kohdesuoneen ja mittaa suonen läpimitta halutussa sulkukohdassa tekemällä
angiografia vakiomenetelmällä. Varmista, että kohdesuoni vastaa suositeltua läpimittaa (katso
Taulukko 1).
2. Varmista, että sulkukohta on riittävän pitkä, jotta implantoitu MVP-laite mahtuu siihen
ahtauttamatta vääriä suonia.
3. Valitse mikrokatetri tai katetri (katso Taulukko 2, jossa on suositeltu koko) ja valmistele se
valmistajan käyttöohjeiden mukaisesti.
4. Vie ohjainvaijeri sisään ja työnnä mikrokatetria tai katetria eteenpäin ohjainvaijeria pitkin,
kunnes distaalinen kärki on lähellä sulkukohdan etureunaa.
5. Poista ohjainvaijeri mikrokatetrista tai katetrista.
6. Poista MVP-järjestelmä suojaputkesta irrottamalla varovasti keltainen sisäänvientiholkki
kahdesta ulommasta klipsistä ja vedä MVP-järjestelmä pois läpinäkyvästä koteloletkusta.
Tartu varovasti sisäänvientiholkkiin MVP-laitteen proksimaaliselta puolelta ja poista MVP-laite,
asetusvaijeri ja sisäänvientiholkki hitaasti samanaikaisesti suojaputkesta. Katso Kuva 3.
27
Page 28
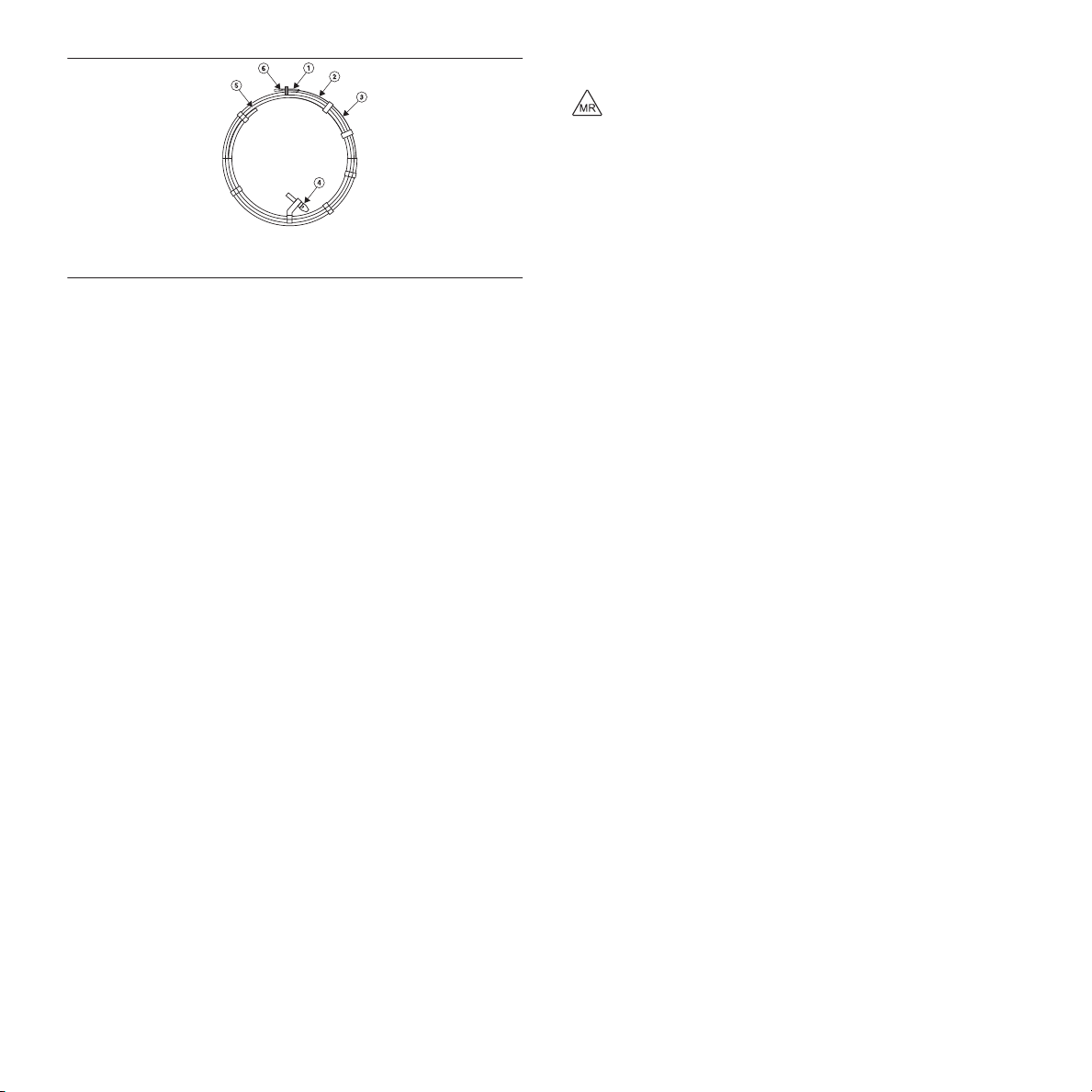
Kuva 3. Pakattu MVP-järjestelmä
1 Läpinäkyvä koteloletku
2 Keltainen sisäänvientiholkki
3 Asetusvaijeri (sisäänvientiholkin sisällä)
7. Tarkasta MVP-järjestelmä perusteellisesti vaurioiden varalta. Jos MVP-järjestelmä on
vaurioitunut, vaihde se uuteen MVP-järjestelmään.
8. Huuhtele MVP-järjestelmä upottamalla varovasti muutama senttimetri sisäänvientiholkista ja
MVP-laitteesta heparinisoituun keittosuolaliuokseen.
9. Vedä MVP-laite sisäänvientiholkkiin vetämällä asetusvaijeria, kunnes sisäänvientiholkki
peittää juuri MVP-laitteen distaalisen kärjen.
Huomautus: Jos MVP-laite vedetään liian pitkälle sisäänvientiholkkiin, se ei ehkä huuhtoudu
kunnolla. Sisäänvientiholkin kaksi reikää, jotka ovat 3 cm:n ja 6 cm:n päässä proksimaalisesti
holkin kärjestä, helpottavat ilman poistamista ja laitteen huuhtelemista.
10. Vie MVP-järjestelmä sisään työntämällä sisäänvientiholkin distaalinen pää pyörivän
hemostaasiventtiilin läpi ja mikrokatetrin tai katetrin kantaan, kunnes holkki on tiukasti
paikallaan. Kiristä pyörivää hemostaasiventtiiliä riittävästi niin, että se estää veren
takaisinvirtauksen, mutta ei niin tiukasti, että MVP-järjestelmä vaurioituu, kun se viedään
mikrokatetriin tai katetriin.
11. Tarkasta silmämääräisesti, että huuhteluliuoksen infuusio on normaali. Keittosuolaliuosta
pitäisi näkyä tippuvan sisäänvientiholkin proksimaalisesta päästä.
12. Löysää pyörivää hemostaasiventtiiliä riittävästi, jotta MVP-laitetta ja asetusvaijeria voi työntää
eteenpäin yhdessä järjestelmänä. Älä löysää pyörivää hemostaasiventtiiliä niin paljon, että
veri voi virrata takaisin. Poista sisäänvientiholkki vetämällä se pois asetusvaijerin
proksimaalisen pään yli.
13. Työnnä asetusvaijeria ja MVP-laitetta eteenpäin, kunnes MVP-laitteen distaalinen
platinamerkki on mikrokatetrin tai katetrin distaalisen merkkirenkaan kohdalla.
14. Varmista, että merkkirenkaiden sijainti on optimaalinen. Ota MVP-laite käyttöön painamalla
asetusvaijeria eteenpäin ja vetämällä samalla mikrokatetria tai katetria hitaasti taaksepäin niin,
että MVP-laite työntyy ulos.
15. Jos laitteen sijainti ei ole tyydyttävä, tee seuraavat toimet:
a. Stabiloi asetusvaijeri ja työnnä mikrokatetria tai katetria eteenpäin siirtämällä sitä
distaalisesti, kunnes MVP-laite on saatu takaisin katetriin.
b. Siirrä laitetta ja ota se käyttöön tai poista laite muutoin potilaasta.
Huomautus: Laitetta ei saa vetää takaisin sisään ja ottaa käyttöön enempää kuin kolme
kertaa.
16. Jotta MVP-laite irtoaa kunnolla, se on asetettava mikrokatetrin tai katetrin kärkeä pitemmälle.
17. Jos laitteen sijainti on tyydyttävä, jatka irrotukseen tekemällä seuraavat toimet:
a. Varmista läpivalaisussa, että mikrokatetrin tai katetrin kärki on MVP-laitteen
proksimaalisella puolella.
b. Kiinnitä ohjauskäännin asetusvaijeriin. Irrota MVP-laite kiertämällä asetusvaijeria
vastapäivään, kunnes se irtoaa laitteesta.
c. Varmista irrotuksen onnistuminen läpivalaisussa vetämällä asetusvaijeria hitaasti
proksimaaliseen suuntaan. Tämä varmistaa, ettei MVP-laite liiku. Jos MVP-laite liikkuu
proksimaaliseen suuntaan, mikä on epätodennäköistä, aseta se uudelleen paikalleen ja
irrota se kiertämällä asetusvaijeria uudelleen vastapäivään.
18. Pidä mikrokatetria tai katetria paikallaan, vedä asetusvaijeri takaisin mikrokatetriin tai katetriin
ja poista sitten asetusvaijeri potilaasta. Päätä toimenpide vakiomenetelmällä.
4 Ohjauskäännin
5 Suojaputki
6 MVP-laite
11 Toimenpiteen jälkeiset ohjeet
Jos MedicAlert-palvelu on käytettävissä alueellasi, suosittele potilaalle MedicAlert-jäseneksi
liittymistä osoitteessa www.medicalert.org. Potilasta pyydetään kuvaamaan sairautensa,
antamaan implantoidun laitteen nimi ja ilmoittamaan magneettikuvauksen käyttöä koskevat
rajoitukset.
12 MRI-tiedot
12.1 Magneettikuvaus sallittu varauksin
MVP-mikroverisuonitulpan on määritetty soveltuvan magneettikuvaukseen varauksin. Ei-kliinisen
testauksen perusteella MVP-mikroverisuonitulppalaitteen magneettikuvaus sallitaan varauksin.
Potilas, jolla on tämä laite, voidaan kuvata turvallisesti heti laitteen asettamisen jälkeen seuraavin
edellytyksin:
• Staattinen magneettikenttä on enintään 3 teslaa.
• Maksimaalinen spatiaalinen gradienttimagneettikenttä on enintään 9 000 gaussia/cm.
• Magneettikuvausjärjestelmän ilmoittama koko kehon keskimääräinen maksimaalinen
ominaisabsorptionopeus (SAR) on 4 W/kg 15 minuuttia kestävän kuvauksen aikana (eli
pulssisekvenssiä kohden).
• Magneettikuvausjärjestelmän ensimmäisen tason valvottu käyttötila.
12.2 Magneettikuvaukseen liittyvä lämpeneminen
Ei-kliinisessä testauksessa MVP-mikroverisuonitulppalaite tuotti seuraavan lämpötilan nousun
15 minuuttia kestävän kuvauksen aikana (eli pulssisekvenssiä kohden) käytettäessä 3 teslan
magneettikuvausjärjestelmää (3 teslaa / 128 MHz, Excite, HDx, ohjelmisto 14X.M5, General
Electric Healthcare, Milwaukee, WI): suurin lämpötilan muutos +1,8°C
Näin ollen MVP-mikroverisuonitulppalaitteella tehdyt magneettikuvaukseen liittyvää lämpenemistä
koskevat kokeet 3 teslalla, kun käytettiin lähetin-vastaanotinkelana toimivaa RF-vartalokelaa ja
magneettikuvausjärjestelmän ilmoittama koko kehon keskimääräinen SAR oli 2,9 W/kg (eli siihen
liittyvä kalorimetrialla mitattu koko kehon keskimääräinen arvo oli 2,7 W/kg), osoittivat, että suurin
lämpeneminen näissä tietyissä olosuhteissa oli enintään +1,8°C.
12.3 Artefaktitietoja
Magneettikuvan laatu voi heiketä, jos kuvattava kohde on tarkalleen samalla alueella kuin
MVP-mikroverisuonitulppalaite tai suhteellisen lähellä sitä. Tämän vuoksi saattaa olla tarpeen
optimoida magneettikuvausparametrit, jotta laitteen vaikutuksia magneettikuvaan saadaan
kompensoitua. Kooltaan suurin artefakti (joka on havaittu gradienttikaikupulssisekvenssissä)
ulottuu noin 5 mm:n etäisyydelle suhteessa MVP-mikroverisuonitulppalaitteen kokoon ja muotoon.
Pulssisekvenssi
Signaalikadon
koko
Tason suunta Samansuuntai-
T1-SE T1-SE GRE GRE
252 mm
nen
2
2
91 mm
Kohtisuora Samansuuntai-
304 mm
nen
2
116 mm
Kohtisuora
2
13 Säilyttäminen
Vältä MVP-järjestelmän altistamista vedelle, auringonvalolle, äärilämpötiloille tai suurelle
ilmankosteudelle säilytyksen aikana. Säilytä MVP-järjestelmä valvotussa huoneenlämmössä.
Katso laitteen viimeinen käyttöpäivämäärä tuote-etiketistä. Älä käytä laitetta etikettiin merkityn
viimeisen käyttöpäivämäärän jälkeen.
14 Materiaalit
MVP-järjestelmässä ei ole lateksi- tai PVC-materiaaleja.
15 Takuuta koskeva vastuuvapauslauseke
Tuotedokumentaatiossa olevat varoitukset sisältävät tarkempia lisätietoja ja kuuluvat
olennaisena osana tähän takuuta koskevaan vastuuvapauslausekkeeseen. Vaikka tuote
on valmistettu tarkasti valvotuissa olosuhteissa, Medtronic ei pysty valvomaan
olosuhteita, joissa tätä tuotetta käytetään. Medtronic sanoutuu siten irti kaikista
tuotteeseen liittyvistä nimenomaisista ja konkludenttisista takuista, mukaan lukien, mutta
niihin rajoittumatta, konkludenttiset takuut soveltuvuudesta kaupankäynnin kohteeksi tai
tiettyyn tarkoitukseen. Medtronic ei ole vastuussa kenenkään henkilön tai tahon
hoitokuluista tai mistään suorasta, satunnaisesta tai välillisestä vahingosta, joka on
aiheutunut tuotteen käytöstä, viasta, toiminnan lakkaamisesta tai virheellisestä
toiminnasta, riippumatta siitä, perustuuko vahingonkorvausvaatimus takuuseen,
sopimukseen, oikeudenloukkaukseen tai muuhun seikkaan. Kenelläkään ei ole valtuuksia
sitoa Medtronic-yhtiötä mihinkään tuotetta koskeviin ilmoituksiin tai takuisiin.
Yllä mainittuja rajoituksia ei ole tarkoitettu voimassa olevan pakottavan lainsäädännön vastaisiksi,
eikä niitä pidä tällä tavoin tulkita. Mikäli toimivaltainen tuomioistuin katsoo, että jokin tämän takuuta
koskevan vastuuvapauslausekkeen osa tai ehto on laiton, täytäntöönpanokelvoton tai ristiriidassa
tapaukseen sovellettavan lainsäädännön kanssa, takuuta koskeva vastuuvapauslauseke säilyy
kuitenkin muilta osin voimassa, ja kaikkia oikeuksia ja velvollisuuksia on tulkittava ja pantava
28
Page 29

täytäntöön ikään kuin tämä takuuta koskeva vastuuvapauslauseke ei sisältäisi sitä erityistä osaa tai
ehtoa, joka katsotaan pätemättömäksi.
Français
1 Description du dispositif
Le système d’obturateur microvasculaire MVP est un dispositif d’occlusion des vaisseaux
auto-expansible. Le dispositif MVP, de forme ovoïde et constitué de nitinol, est fixé aux deux
extrémités avec des bandes de marquage en platine. Il présente un revêtement partiel en PTFE. La
bande de marquage proximale se fixe à un guide de pose qui pousse le dispositif à travers un
microcathéter ou un cathéter disponible dans le commerce vers le site de traitement prévu. Le guide
de pose se détache du dispositif MVP en tournant le guide de pose dans le sens inverse des
aiguilles d’une montre afin de le dévisser du dispositif.
Le système MVP est conditionné sous forme d’une seule unité comprenant le dispositif MVP, une
gaine d’introduction et un guide de pose détachable. Le système, fourni stérile, est apyrogène et
exclusivement destiné à un usage unique.
Figure 1. Obturateur microvasculaire MVP
1 Revêtement partiel
2 Marqueur distal
3 Dispositif MVP
Figure 2. Dimensions du système MVP
1 Longueur du guide de pose
2 Longueur non contrainte (dispositif retiré de la gaine et non soumis à contraintes)
3 Diamètre non contraint
Tableau 1. Dimensions du MVP Modèle Diamètre non
MVP-3Q 5,3 mm 12 mm 180 cm 1,5 mm - 3,0 mm
MVP-5Q 6,5 mm 12 mm 180 cm 3,0 mm - 5,0 mm
MVP-7Q 9,2 mm 16 mm 165 cm 5,0 mm - 7,0 mm
MVP-9Q 13,0 mm 18 mm 165 cm 7,0 mm - 9,0 mm
Tableau 2. Microcathéter ou cathéter recommandé Modèle Microcathéter ou cathéter
MVP-3Q 0,53 mm (0,021 in) à 0,69 mm
MVP-5Q 0,69 mm (0,027 in) (DI) 153 cm
MVP-7Q 1,4 mm (4 Fr) (DE) 120 cm
MVP-9Q 1,7 mm (5 Fr) (DE) 120 cm
contraint
Longueur non
contrainte
recommandé
(0,027 in) (DI)
4 Zone de détachement
5 Guide de pose
6 Marqueur proximal
Longueur du
guide de pose
Longueur max du microcathéter ou du cathéter recommandée
153 cm
Diamètre du
vaisseau cible
2 Usage prévu/indications d’utilisation
Le système d’obturateur microvasculaire MVP est indiqué pour obstruer ou réduire le débit sanguin
dans le système vasculaire périphérique.
3 Contre-indications
Il n’existe aucune contre-indication connue à ce dispositif.
4 Compatibilité
Se reporter à l’étiquette produit du système MVP pour les dimensions du dispositif. Se reporter à
l’étiquetage fourni avec les autres technologies médicales afin de déterminer la compatibilité.
5 Avertissements
• L’innocuité et l’efficacité du système MVP n’ont pas été établies pour des utilisations cardiaques
(par exemple, occlusion du septum cardiaque, perméabilité du canal artériel, fermeture d’une
fuite paravalvulaire) ni pour des utilisations neurologiques.
• Le système MVP ne doit être utilisé que par des médecins qui ont une bonne connaissance des
procédures angiographiques et interventionnelles. Il est important de lire le mode d’emploi
avant d’utiliser le système MVP.
• Utiliser le système MVP avant la date de péremption imprimée sur l’étiquette de l’emballage du
produit.
• Le système MVP est apyrogène et fourni stérile à moins que l’emballage du système MVP ne
soit ouvert ou endommagé. Ne pas utiliser si le conditionnement comporte une brèche ou est
endommagé.
• Inspecter le système MVP avant l’utilisation et mettre au rebut en cas d’irrégularités ou de
dommages.
• Le système MVP est destiné exclusivement à un usage unique. Ne pas retraiter ni restériliser.
Le retraitement et la restérilisation pourraient augmenter les risques d’infection du patient et
d’altération des performances du dispositif. Après utilisation du système MVP, l’éliminer
conformément aux procédures hospitalières et légales locales.
• Recourir au guidage fluoroscopique pour avancer ou manipuler le système MVP. Ne pas
avancer ou retirer le dispositif en présence d’une résistance excessive tant que la cause n’en
est pas déterminée.
• Ne pas tordre ni tourner le guide de pose excepté pour détacher le dispositif, ou ce dernier
risque de se détacher prématurément.
• Ne pas utiliser de seringue d’injection électrique pour injecter la solution de contraste avec le
dispositif à travers un microcathéter ou un cathéter.
• Ne pas avancer le guide de pose après l’avoir détaché du dispositif MVP.
• Les médecins doivent être préparés à faire face à des situations d’urgence nécessitant le retrait
du dispositif. Cette préparation implique de garantir la disponibilité d’un chirurgien sur site.
• Ne pas utiliser avec des cathéters dont l’utilisation est contre-indiquée pour les dispositifs
emboliques (par exemple, spirales ou obturateurs).
6 Précautions
• Le dispositif MVP est constitué d’un alliage de nickel-titane généralement considéré comme
sans danger. Cependant, des essais in vitro ont démontré que le nickel est libéré du dispositif
après l’implantation pendant 60 jours minimum. Les patients allergiques au nickel peuvent
présenter une réaction au dispositif, en particulier en cas d’antécédents d’allergies au métal.
Certaines réactions allergiques peuvent être graves ; il est impératif d’aviser les patients qu’ils
doivent immédiatement informer leur médecin en cas de suspicion d’une réaction allergique,
notamment en présence de difficultés à respirer ou d’une inflammation du visage ou de la
gorge. Certains patients peuvent présenter une allergie au nickel si le dispositif est implanté.
• Les médecins doivent faire appel à leur jugement clinique dans les situations qui impliquent
l’utilisation d’anticoagulants ou de médicaments antiplaquettaires avant, pendant ou après
l’utilisation du dispositif.
• Il convient de noter les précautions à prendre pour les populations spécifiques suivantes :
– Pour les patientes enceintes, des précautions doivent être prises afin de réduire au
maximum l’exposition de la mère et du fœtus aux rayonnements.
– Pour les mères allaitantes, aucune évaluation quantitative n’a été menée sur la présence de
substances lixiviables dans le lait maternel après l’implantation du dispositif.
• Vérifier la compatibilité du système MVP lors de l’utilisation d’autres dispositifs auxiliaires dans
le cadre de procédures intravasculaires. Les médecins qui utilisent le système MVP doivent
avoir une bonne connaissance des techniques intravasculaires percutanées et des
complications possibles associées à la procédure.
• Le système MVP doit être hydraté avant l’utilisation.
• Manipuler le système MVP avec précaution afin de réduire le risque de dommage accidentel.
• Il existe une possibilité de forces de pression plus élevées en cas d’utilisation avec des
microcathéters ou des cathéters en composé de nitinol rainurés.
• Avant l’utilisation, vérifier que le diamètre de tout dispositif accessoire utilisé est compatible
avec le système MVP.
29
Page 30

7 Événements indésirables potentiels
Les événements indésirables susceptibles de survenir pendant ou après une procédure de mise en
place de ce dispositif incluent, mais sans s’y limiter :
• Embolie gazeuse
• Réaction allergique ou effets toxiques
• Hémorragie
• Décès
• Migration du dispositif
• Fièvre
• Événement embolique dû à un corps étranger
• Infection
• Occlusion d’un vaisseau non souhaité
• Embolie périphérique
• Recanalisation
• Flux résiduel
• Accident cérébrovasculaire ou attaque ischémique transitoire (AIT)
• Intervention chirurgicale
• Complication au site d’accès vasculaire
• Traumatisme ou perforation du vaisseau
8 Matériel requis
1. La pose du système MVP nécessite l’utilisation d’un microcathéter ou d’un cathéter (consulter
le Tableau 2 pour la taille recommandée).
2. Les accessoires suivants sont requis :
• Solution saline héparinée
• Valve hémostatique rotative (VHR)
• Robinet d’arrêt à 3 voies
• Manchon à pression de poche de solution saline
• Gaine d’accès
• Cathéter-guide compatible avec un microcathéter ou un cathéter recommandé au
Tableau 2
• Fil-guide compatible avec le cathéter-guide et le microcathéter ou le cathéter
• Potence de perfusion intraveineuse (IV)
9 Préparation
1. Afin d’optimiser les performances du système MVP et de réduire le risque de complication
thrombo-embolique, maintenir un rinçage continu avec la solution saline entre les dispositifs
suivants :
• La gaine d’accès et le cathéter-guide
• Le microcathéter ou le cathéter et le cathéter-guide
• Le microcathéter ou le cathéter, le fil-guide et le système MVP
2. Mettre en place le cathéter-guide approprié en suivant la procédure recommandée. Connecter
une valve hémostatique rotative (VHR) à l’embase du cathéter-guide. Fixer un robinet à 3 voies
au bras latéral de la VHR. Connecter une ligne de solution saline héparinée pour un rinçage en
continu.
3. Vérifier tous les raccords pour s’assurer que de l’air ne s’introduit pas dans le cathéter-guide,
le microcathéter ou le cathéter pendant le rinçage en continu.
10 Instructions d’utilisation
1. Accéder au vaisseau ciblé et réaliser un angiogramme en utilisant la technique standard pour
mesurer le diamètre du vaisseau au site d’occlusion souhaité. S’assurer que le vaisseau ciblé
correspond au diamètre recommandé (consulter le Tableau 1).
2. Vérifier que le site d’occlusion est suffisamment long pour recevoir le dispositif MVP implanté
sans obstruer les vaisseaux non souhaités.
3. Sélectionner un microcathéter ou un cathéter (consulter le Tableau 2 pour la taille
recommandée) et le préparer selon le mode d’emploi du fabricant.
4. Insérer le fil-guide et avancer le microcathéter ou le cathéter au-dessus du fil-guide jusqu’à ce
que l’extrémité distale se trouve à proximité du bord avant du site d’occlusion.
5. Retirer le fil-guide du microcathéter ou du cathéter.
6. Retirer le système MVP du tube de distribution en retirant délicatement la gaine d’introduction
jaune des deux pinces extérieures et tirer le système MVP hors du tube de logement
transparent. Saisir délicatement la gaine d’introduction en un point proximal par rapport au
dispositif MVP et retirer lentement le dispositif MVP, le guide de pose et la gaine d’introduction
simultanément du tube de distribution. Voir la Figure 3.
Système MVP conditionné
Figure 3.
1 Tube de logement transparent
2 Gaine d’introduction jaune
3 Guide de pose (à l’intérieur de la gaine
d’introduction)
4 Torqueur
5 Tube de distribution
6 Dispositif MVP
7. Inspecter minutieusement le système MVP pour vérifier qu’il n’est pas endommagé. Si le
système MVP est endommagé, le remplacer par un système MVP neuf.
8. Rincer le système MVP en immergeant délicatement quelques centimètres de la gaine
d’introduction et du dispositif MVP dans la solution saline héparinée.
9. Tirer le dispositif MVP dans la gaine d’introduction en tirant le guide de pose uniquement
jusqu’à ce que l’extrémité distale du dispositif MVP soit recouverte par la gaine d’introduction.
Remarque : Si le dispositif MVP est tiré trop loin dans la gaine d’introduction, il peut être
impossible de le rincer correctement. Deux trous dans la gaine d’introduction situés à 3 cm et
à 6 cm du côté proximal de l’extrémité de la gaine facilitent la purge de l’air et le rinçage du
dispositif.
10. Introduire le système MVP en insérant l’extrémité distale de la gaine d’introduction dans la
VHR et dans l’embase du microcathéter ou du cathéter jusqu’à ce que la gaine soit solidement
en place. Serrer la VHR suffisamment pour éviter le reflux sanguin, mais pas trop afin de ne pas
endommager le système MVP lors de son introduction dans le microcathéter ou le cathéter.
11. Vérifier visuellement que la solution de rinçage perfuse normalement. Les gouttes de solution
saline doivent visiblement sortir de l’extrémité proximale de la gaine d’introduction.
12. Desserrer la VHR suffisamment pour pouvoir avancer le dispositif MVP et le guide de pose
d’un seul tenant. Ne pas trop desserrer la VHR pour permettre le reflux du sang. Enlever la
gaine d’introduction en la retirant au-dessus de l’extrémité proximale du guide de pose.
13. Avancer le guide de pose et le dispositif MVP jusqu’à ce que le marqueur distal en platine du
dispositif MVP soit aligné sur la bande de marquage distale du microcathéter ou du cathéter.
14. Vérifier que les bandes de marquage sont positionnées de manière optimale. Déployer le
dispositif MVP en maintenant une pression vers l’avant sur le guide de pose tout en rétractant
lentement le microcathéter ou le cathéter afin de retirer le dispositif MVP de la gaine.
15. Si la position du dispositif n’est pas satisfaisante, effectuer les actions suivantes :
a. Stabiliser le guide de pose et avancer le microcathéter ou le cathéter en le déplaçant dans
le sens distal jusqu’à ce que le dispositif MVP soit recapturé à l’intérieur du cathéter.
b. Repositionner et déployer le dispositif ou bien le retirer du corps du patient.
Remarque : Le dispositif ne doit pas être remis dans la gaine et déployé plus de 3 fois
maximum.
16. Pour un détachement correct, le dispositif MVP doit être positionné au-delà de l’extrémité du
microcathéter ou du cathéter.
17. Si la position du dispositif est satisfaisante, procéder au détachement comme suit :
a. Vérifier sous fluoroscopie que l’extrémité du microcathéter ou du cathéter se trouve du
côté proximal du dispositif MVP.
b. Fixer le torqueur au guide de pose. Détacher le dispositif MVP en tournant le guide de
pose dans le sens inverse des aiguilles d’une montre jusqu’à ce qu’il se sépare du
dispositif.
c. Pour s’assurer que le dispositif MVP ne bouge pas, vérifier sous fluoroscopie que le
détachement a réussi en tirant lentement le guide de pose en direction proximale. Dans le
cas peu probable d’un déplacement du dispositif MVP dans le sens proximal, rétablir la
mise en place du dispositif et répéter la rotation du guide de pose dans le sens inverse des
aiguilles d’une montre pour qu’il se détache.
18. Tout en tenant le microcathéter ou le cathéter en place, rétracter le guide de pose à l’intérieur
de celui-ci, puis retirer le guide de pose du corps du patient. Terminer la procédure en suivant
la technique standard.
30
Page 31

11 Instructions post-procédurales
Si le service MedicAlert est disponible dans la région, recommander au patient de devenir membre
de MedicAlert sur le site www.medicalert.org. Le patient devra indiquer son affection, le nom du
dispositif implanté et les restrictions concernant l’utilisation de l’IRM.
12 Informations sur l’IRM
12.1 IRM sous conditions
Il est établi que l’obturateur microvasculaire MVP est compatible avec la RM sous conditions. Des
essais non cliniques ont démontré que le dispositif d’obturateur microvasculaire MVP est
compatible avec la RM sous conditions. Un patient porteur de ce dispositif ne court aucun risque
lors d’un examen par résonance magnétique, immédiatement après l’implantation, dans les
conditions suivantes :
• Champ magnétique statique de 3 teslas ou moins
• Champ magnétique de gradient spatial maximum de 9000 gauss/cm ou moins
• Taux d’absorption spécifique (TAS) maximum moyenné sur l’ensemble du corps rapporté par
le système de RM de 4 W/kg pendant 15 minutes de balayage (c’est-à-dire par séquence
d’impulsions)
• Mode de fonctionnement contrôlé de premier niveau pour le système de RM
12.2 Échauffement lié à l’IRM
Au cours d’essais non cliniques, le dispositif d’obturateur microvasculaire MVP a produit l’élévation
de température suivante au cours d’une IRM réalisée pendant 15 min de balayage (c’est-à-dire par
séquence d’impulsions) dans le système de RM de 3 teslas (3 teslas/128 MHz, Excite, HDx,
logiciel 14X.M5, General Electric Healthcare, Milwaukee, WI) : Plus forte variation de
température +1,8°C.
Par conséquent, les essais sur l’échauffement lié à l’IRM pour le dispositif d’obturateur
microvasculaire MVP à 3 teslas à l’aide d’une bobine d’émission/de réception RF pour le corps à un
TAS moyenné sur l’ensemble du corps rapporté par le système de RM de 2,9 W/kg (c’est-à-dire
associé à une valeur moyennée sur l’ensemble du corps mesurée par calorimétrie de 2,7 W/kg) ont
indiqué que le plus haut niveau d’échauffement qui s’est produit en association avec ces conditions
spécifiques était inférieur ou égal à +1,8°C.
12.3 Informations sur les artefacts
La qualité des images de RM peut être compromise si la zone d’intérêt se trouve exactement dans
la même zone ou est relativement proche de la position du dispositif d’obturateur microvasculaire
MVP. Il peut donc s’avérer nécessaire d’optimiser les paramètres d’imagerie par RM pour
compenser la présence de ce dispositif. La taille maximum de l’artéfact (c’est-à-dire telle qu’elle est
visible sur la séquence d’impulsions d’écho de gradient) s’étend sur environ 5 mm par rapport à la
taille et à la forme du dispositif d’obturateur microvasculaire MVP.
Séquence d’impulsions T1-SE T1-SE GRE GRE
Taille du vide de
signal
Orientation Parallèle Perpendiculaire Parallèle Perpendiculaire
252 mm
2
91 mm
2
304 mm
2
116 mm
2
dommages directs, fortuits ou indirects causés par tous usages, défectuosités,
défaillances ou dysfonctionnements du produit, qu’une plainte pour de tels dommages
soit fondée sur une garantie, une responsabilité contractuelle, délictueuse ou autre. Nul
n’est habilité à lier Medtronic à une représentation ou une garantie quelconque
concernant le produit.
Les exclusions et les limitations mentionnées ci-dessus ne sont pas, et ne doivent pas être,
interprétées comme contraires aux dispositions obligatoires des lois applicables. Si une partie ou
une disposition du présent déni de garantie devait être considérée illégale, non applicable ou
contraire à la loi en vigueur par un tribunal compétent, la validité des autres dispositions du présent
déni de garantie n’en sera pas affectée et tous les droits et obligations seront interprétés et
appliqués comme si le présent déni de garantie ne contenait pas la partie ou la disposition
considérée comme non valide.
Hrvatski
1 Opis uređaja
Mikrovaskularni sustav zapušača MVP samoproširivi je uređaj za okluziju krvne žile. Uređaj MVP
ovalnog je oblika te je izrađen od nitinola te na oba kraja osiguran markerima od platine. Uređaj je
djelomično pokriven PTFE-om. Proksimalni marker spaja se na žicu za isporuku koja uređaj gura
kroz komercijalno dostupan mikrokateter ili kateter do predviđenog mjesta liječenja. Žica za
isporuku odspaja se od uređaja MVP obrtanjem žice za isporuku u smjeru suprotnom od kazaljke
sata sa ciljem odvijanja s uređaja.
Sustav MVP pakiran je u jedinstveno pakiranje koje sadrži uređaj MVP, omotač uvodnice i odspojivu
žicu za isporuku. Sustav se isporučuje sterilan, nepirogen je i namijenjen samo jednokratnoj
upotrebi.
Sl. 1. Mikrovaskularni sustav zapušača MVP
1 Djelomični pokrov
2 Distalni marker
3 Uređaj MVP
4 Područje odspajanja
5 Žica za isporuku
6 Proksimalni marker
Sl. 2. Dimenzije sustava MVP
13 Stockage
Éviter d’exposer le système MVP à l’eau, à la lumière du soleil, aux températures extrêmes et à une
humidité élevée pendant le stockage. Stocker le système MVP à température ambiante contrôlée.
Consulter l’étiquette du produit pour la date de péremption du dispositif. Ne pas utiliser le dispositif
au-delà de la date de péremption mentionnée sur l’étiquette.
14 Matériaux
Le système MVP ne contient aucun matériau en latex ou en PVC.
15 Limitation de garantie
Les avertissements figurant dans la documentation du Produit contiennent des
informations détaillées qui doivent être considérées comme faisant partie intégrante du
présent déni de garantie. Bien que le produit ait été fabriqué dans des conditions
soigneusement contrôlées, Medtronic n’a aucun contrôle sur les conditions dans
lesquelles ce produit est utilisé. En conséquence, Medtronic décline toute garantie,
expresse ou implicite, relative au produit, dont, entre autres, toute garantie implicite de
qualité marchande ou d’adéquation à un but particulier. Medtronic ne pourra en aucun cas
être tenue responsable, envers aucune personne ou entité, des frais médicaux ou des
1 Duljina žice za isporuku
2 Duljina slobodnog dijela (uređaj bez pokrova i bez bilo kakvih ograničenja na njemu)
3 Promjer slobodnog dijela
Tabl. 1. Dimenzije MVP-a Model Promjer
MVP-3Q 5,3 mm 12 mm 180 cm 1,5 mm – 3,0 mm
MVP-5Q 6,5 mm 12 mm 180 cm 3,0 mm – 5,0 mm
MVP-7Q 9,2 mm 16 mm 165 cm 5,0 mm – 7,0 mm
MVP-9Q 13,0 mm 18 mm 165 cm 7,0 mm – 9,0 mm
31
slobodnog
dijela
Duljina
slobodnog
dijela
Duljina žice za
isporuku
Promjer ciljne
krvne žile
Page 32

Tabl. 2. Preporučeni mikrokateter ili kateter Model Preporučeni mikrokateter ili
MVP-3Q 0,021 in (0,53 mm) do 0,027 in
MVP-5Q 0,027 in (0,69 mm) (ID) 153 cm
MVP-7Q 4 Fr (1,4 mm) (OD) 120 cm
MVP-9Q 5 Fr (1,7 mm) (OD) 120 cm
kateter
(0,69 mm) (ID)
Najveća duljina preporučenog mikrokatetera ili
katetera
153 cm
2 Predviđena upotreba / indikacije za upotrebu
Mikrovaskularni sustav zapušača MVP indiciran je za opstrukciju ili smanjenje brzine protoka krvi u
perifernom žilnom sustavu.
3 Kontraindikacije
Nema poznatih kontraindikacija za ovaj uređaj.
4 Kompatibilnost
Pogledajte dimenzije uređaja na naljepnici sustava MVP. Kako biste utvrdili kompatibilnost,
pogledajte naljepnice isporučene s drugim medicinskim tehnologijama.
5 Upozorenja
• Sigurnost i djelotvornost sustava MVP nisu utvrđene za srčane upotrebe (npr. pri okluziji
srčanog septuma, otvoreni ductus arteriosus, zatvaranje paravalvularnog propuštanja) te za
neurološke upotrebe.
• Sustav MVP smiju upotrebljavati samo liječnici koji su upoznati s angiografskim i
intervencijskim postupcima. Važno je prije upotrebe sustava MVP pročitate upute.
• Sustav MVP upotrijebite prije datuma isteka roka upotrebe navedenog na naljepnici na
pakiranju.
• Sustav MVP nije pirogen te je sterilan ako pakiranje sustava MVP nije otvoreno ni oštećeno.
Nemojte upotrebljavati ako je pakiranje otvoreno ili oštećeno.
• Prije upotrebe provjeriite sustav MVP te odložite ako opazite bilo kakve nepravilnosti ili
oštećenje.
• Sustav MVP namijenjen je isključivo jednokratnoj upotrebi. Nemojte ga ponovno obrađivati niti
ponovno sterilizirati. Ponovna obrada i sterilizacija mogu povećati rizike od infekcije bolesnika
i ugroziti izvedbu uređaja. Nakon upotrebe sustava MVP odložite ga u skladu s bolničkim i
lokalnim pravilima.
• Pri napredovanju ili rukovanju sustavom MVP primijenite fluoroskopiju. Ako osjećate prevelik
otpor, nemojte dalje potiskivati ni povlačiti uređaj dok ne utvrdite uzrok otpora.
• Žicu za isporuku nemojte uvijati ni obrtati ako ne namjeravate odspojiti uređaj. U suprotnom se
uređaj može prerano odspojiti.
• Za ubrizgavanje kontrastnog sredstva kroz mirkokateter ili kateter nemojte upotrebljavati
štrcaljke pod tlakom.
• Žicom za isporuku nemojte napredovati nakon što je odspojite s uređaja MVP.
• Liječnici moraju biti spremni na hitne situacije koje zahtijevaju uklanjanje uređaja. Ta pripravnost
uključuje dostupnost kirurga na licu mjesta.
• Nemojte upotrebljavati katetere koji su kontraindicirani za uređaje za emboliju (na primjer,
zavojnice ili zapušač).
6 Mjere opreza
• Uređaj MVP sastoji se od nikal-titanij sliitne koja se općenito smatra neškodljivom. Međutim,
in-vitro testiranja pokazala su da se nikal oslobađa iz uređaja nakon implantacije tijekom
najmanje 60 dana. Bolesnici koji su alergični na nikal mogu imati alergijsku reakciju na uređaj,
posebice bolesnici s povijesti alergija na metale. određene alergijske reakcije mogu biti
ozbiljne. Bolesnike je potrebno uputiti da odmah obavijeste svoje liječnike ako sumnjaju na
alergijske reakcije, kao što su poteškoće s disanjem ili upala lica ili grla. U nekih bolesnika može
se razviti alergija na nikal ako uređaj bude implantiran.
• Lijčenici trebaju prosuditi situacije koje uključuju upotrebu antikoagulantnih ili antitrombotičkih
lijekova prije, tijekom ili nakon upotrebe uređaja.
• Obratite pažnju na sljedeće posebne populacije:
– U trudnica je izloženost zračenju majke i fetusa potrebno svesti na najmanju mjeru.
– Ne postoji kvantitativna procjena prisutnosti tvari koje su curenjem prešle u mlijeko majke
nakon implantacije uređaja u dojilja.
• Provjerite kompatibilnost sustava MVP kada ga upotrebljavate s drugim pomoćnim uređajima
u intravaskularnim postupcima. Liječnici koji upotrebljavaju sustav MVP moraju biti upoznati s
perkutanim, intravaskularnim tehnikama i mogućim komplikacijama povezanim s postupkom.
• Sustav MVP potrebno je prije upotrebe hidrirati.
• Budite pažljivi pri rukovanju sustavom MVP kako biste umanjili mogućnost slučajnog oštećenja.
• Postoji mogućnost većih sila potiska ako se upotrebljava s nitinolskim mikrokateterima ili
kateterima s utorom.
• Prije upotrebe provjerite je li promjer svakog pomoćnog uređaja koji se upotrebljava
kompatibilan sa sustavom MVP.
7 Moguće nuspojave
Potencijalne nuspojave koje se mogu pojaviti tijekom ili nakon postupka postavljanja uređaja
uključuju, ali nisu ograničene na navedeno u nastavku:
• zračni ugrušak
• alergijska reakciae ili toksični učinci
• krvarenje
• smrt
• pomicanje uređaja
• vrućica
• embolijski događaj stranog materijala
• infekcija
• okluzija nepredviđene krvne žile
• periferna embolija
• rekanalizacija
• rezidualni protok
• moždani udar ili tranzitorni ishemijski napadaj (TIA)
• kiruršku intervenciju
• komplikacije na mjestu pristupa žili
• perforacija ili trauma žile
8 Potrebni materijali
1. Isporuka sustava MVP zahtijeva upotrebu mikrokatetera ili katetera (vidjeti tabl. 2 za
preporučene veličine).
2. Potreban je sljedeći pribor:
• Heparinizirana fiziološka otopina
• Okretni hemostatski ventil (RHV)
• Trosmjerni pipac
• Manžeta za tlak za vrećicu fiziološke otopine
• Pristuno omotač
• Vodeći kateter kompatibilan s mikrokateterom ili kateterom preporučen u tabl. 2
• Žica vodilica kompatibilna s vodećim kateterom i mikrokateterom ili kateterom
• Postolje za intravensku (i.v.) infuziju
9 Priprema
1. Za optimalnu izvedbu sustava MVP te kako biste umanjili rizik od tromboembolijskih
komplikacija, održavajte trajni protok fiziološke otopine kroz:
• pristupni omotač i vodeći kateter
• mikrokateter ili kateter te vodeći kateter
• mikrokateter ili kateter, žicu vodili te sustav MVP
2. Postavite prikladni vodeći kateter slijedeći preporučeni postupak. Spojite okretni hemostatski
ventil (RHV) na čvorište vodećeg katetera. Spojite trosmjerni pipac na bočni priključak RHV-a.
Spojite liniju heparizirane fiziološke linije radi trajnog protoka.
3. Provjerite sve spojeve kako biste osigurali da zrak ne ulazi u vodeći kateter ili mikrokateter ili
kateter tijekom trajnog protoka.
10 Upute za upotrebu
1. Pristupite ciljnoj žili i obavite angiogram primjenom standardne tehnike za mjerenje promjera
žile na željenom mjestu okluzije. Pobrinite se da ciljna žila udovoljava preporučenom promjeru
(vidjeti tabl. 1).
2. Pobrinite se da je mjesto okluzije dovoljno dugo da primi implantirani uređaj MVP bez
opstrukcije nepredviđenih žila.
3. Odaberite mikrokateter ili kateter (vidjeti tabl. 2 za preporučene veličine) i pripremite ga u
skladu s proizvođačevim uputama za upotrebu.
4. Umetnite žicu vodilicu u napredujte mikrokateterom ili kateterom preko žice vodilice dok
dostalni vrh ne bude u blizini vodećeg ruba mjesta okuzije.
5. Uklonite žicu vodilicu iz mikrokatetera ili katetera.
32
Page 33

6. Uklonite sustav MVP iz cijevi dispenzera pažljivo uklanjajući žuti omotač uvodnice iz dviju
vanjskih spojnica te povucite sustav MVP iz cijevi-kućišta. Pažljivo uhvatite omotač uvodnice
na mjestu koje je proksimalno od uređaja MVP i polagano uklonite uređaj MVP, žicu za
isporuku i omotač uvodnice istodobno iz cijevi dispenzera. Vidjeti sl. 3.
Sl. 3. Pakirani sustav MVP
1 Prozirna cijev-kućište
2 Žuti omotač uvodnice
3 Žica za isporuku (unutar omotača
uvodnice)
7. Temeljito pregledajte sustav MVP radi oštećenja. Ako je sustav MVP oštećen, zamijenite ga
novim sustavom MVP.
8. Isperite sustav MVP pažljivo uranjajući nekoliko centimetara omotača uvodnice i uređaja MVP
u hepariziranu otopinu.
9. Povucite uređaj MVP u omotač uvodnice povlačeći žicu za isporuku dok distalni vrh uređaja
MVP ne bude pokriven omotačem uvodnice.
Napomena: Ako uređaj MVP previše povučete u omotač uvodnice, možda se neće pravilno
isprati. Dvije rupice na omotaču uvodnice, smještene 3 cm i 6 cm proksimalno od vrha
omotača, olakšavaju pročišćavanje zrakom i ispiranje uređaja.
10. Umetnite sustav MVP umetanjem distalnog kraja omotača uvodnice kroz RHV, u čvorište
mikrokatetera ili katetera dok omotač ne nasjedne na mjesto. Pritegnite RHV dovoljno jako da
spriječi povrat protoka krvi, no ne prečvrsto kako ne biste oštetili sustav MVP tijekom njegova
uvođenja u mikrokateter ili kateter.
11. Vizualno provjerite infuzira li se otopina za infuziju normalno. Trebali biste vidjeti kako kapi
fiziološke otopine izlaze iz prokasimlanog kraja omotača uvodnice.
12. Olabavite RHV dovoljno da omogućite uređaju MVP i žici za isporuku da zajedno napreduju
kao sustav. RHV nemojte previše olabaviti kako ne biste omogućili povrat protoka krvi. Uklonite
omotač uvodnice povlačeći ga preko proksimalnog kraja žice za isporuku.
13. Napredujte žicom za isporuku i uređajem MVP dok distalni marker od platine uređaja MVP ne
poravnate s distalnim markerom na mikrokateteru ili kateteru.
14. Potvrdite optimalni položaj markera. Postavite uređaj MVP održavajući žicom za isporuku
pritisak prema naprijed uz istodobno povlačenje mikrokatetera ili katetera kako biste s uređaja
MVP skinuli omotač.
15. Ako položaj uređaja nije zadovoljavajući, poduzmite radnje navedene u nastavku:
a. Stabilizirajte žicu za isporuku i napredujte mikrokateterom ili kateterom pomičući ga
distalno dok uređaj MVP ne zahvatite ponovno unutar katetera.
b. Premjestite uređaj i ponovno ga uvedite ili izvadite uređaj iz bolesnika.
Napomena: Uređaj nemojte ponovno stavljati u omotač i postavljati više od tri puta.
16. Za prikladno odspajanje, uređaj MVP potrebno je postaviti iznad vrha mikrokatetera ili
katetera.
17. Ako je položaj uređaja zadovoljavajući, nastavite s odspajanjem slijedeći navedene radnje:
a. Pod fluoroskopijom potvrdite da je vrh mikrokatetera ili katetera proksimalno od uređaja
MVP.
b. Spojite dio za obrtanje na žicu za isporuku. Odspojite uređaj MVP okretanjem žice za
isporuku za smjeru suprotnom od kazaljke sata dok se ne odspoji od uređaja.
c. Fluoroskopski provjerite uspješno odspajanje laganim povlačenjem žice za isporuku u
proksimalnom smjeru kako biste se uvjerili da se uređaj MVP ne pomiče. U rijetkim
slučajevima kada se uređaj MVP pomakne u proksimalnom smjeru, ponovno postavite
uređaj i ponovite okretanje žice za isporuku u smjeru suprotnom od kazaljke sata radi
odspajanja.
18. Držeći kateter ili mikrokateter u mjestu, povucite žicu za isporuku u mikrokateter ili kateter, a
zatim uklonite žicu za isporuku iz bolesnika. Postupak završite prateći sljedeće standardne
tehnike.
4 Dio za obrtanje
5 Cijev dispenzera
6 Uređaj MVP
11 Upute nakon postupka
Ako je usluga MedicAlert dosutpna na vašem području, preporučite bolesniku neka postane član
usluge MedicAlert te ga uputite na internetsku stranicu www.medicalert.org. Bolesnik će trebati
navesti svoje stanje, naziv implantiranog uređaja i ograničenja u pogledu upotrebe MR-a.
12 Informacije o MR snimanju
12.1 Može se upotrebljavati tijekom snimanja magnetskom rezonancijom pod određenim uvjetima
Utvrđeno je da je mikrovaskularni zapušač MVP uvjetno pogodan za snimanje MR-om. Neklinička
ispitivanja pokazala su da je mikrovaskularni zapušač MVP uvjetno pogodan za snimanje MR-om.
Snimanje bolesnika s ovim uređajem može se sigurno obaviti neposredno nakon postavljanja
uređaja pod sljedećim uvjetima:
• statično magnetsko polje od 3 T ili manje
• maksimalno magnetno polje prostornog gradijenta od 9000 G/cm ili manje
• maksimalna prosječna specifična stopa apsorpcije (SAR) koju bilježi sustav MR-a od 4 W/kg za
15 minuta snimanja (tj. po pulsnoj sekvenciji)
• prva razina kontroliranog načina rada za sustav MR-a
12.2 grijanje povezano s MR-om
U nekliničkom je testiranju mirkovaskularni zapušač MVP proizveo sljedeće povišenje temperature
tijekom MR_a provedenog tijekom 15 min snimanja (tj. po pulsnoj sekvenciji) u sustavu MR-a od 3 T
(3 T/128 MHz, Excite, HDx, softver 14X.M5, General Electric Healthcare, Milwaukee, WI): Najveća
promjena temperature +1,8°C
Stoga ispitivanja zagrijavanja povezanog s MR-om za mirovaskularni zapušač MVP pri 3 T
primjenom RF tjelesne zavojnice za prijenos/primanje pri prosječnom SAR-u za cijelo tijelo, koji
prijavljuje sustav MR-a, od 2,9 W/kg (tj. povezano s kalometrijom mjerenom vrijednosti za cijelo
tijelo od 2,7 W/kg) pokazuju da je najveći iznos zagrijavanja koji se pojavio u vezi s tim specifičnim
uvjetima jednak ili manji od 1,8°C.
12.3 Informacije o artefaktima
Kvaliteta snimanja MR-om može biti narušena ako je područje od interesa u točno istom području
ili relativno blizu položaju mirkovaskularnom zapušaču MVP. Zato će možda biti potrebno
optimizirati parametre snimanja magnetskom rezonancijom da bi se kompenzirala prisutnost
uređaja. Najveća veličina artefakta (kako je uočena na sekvenciji impulsa gradijentske jeke) širila se
do približno 5 mm u odnosu na relativnu veličinu i oblik mikrovaskularnog zapušača MVP.
Sekvencija
impulsa T1-SE T1-SE GRE GRE
Veličina nepotpunog signala
Orijantacija ravnine
2
252 mm
Paralelno Okomito Paralelno Okomito
91 mm
2
304 mm
2
116 mm
2
13 Skladištenje
Izbjegavajte izlaganje vodi, izravnoj sunčevoj svjetlosti, ekstremnim temperaturama ili visokoj
vlažnosti tijekom skladištenja sustava sustava MVP. Sustav MVP čuvajte na kontroliranoj sobnoj
temperaturi. Pogledajte rok upotrebe uređaja na naljepnici proizvoda. Uređaj nemojte
upotrebljavati nakon navedenog roka upotrebe.
14 Materijali
Sustav MVP nije izrađen od lateksa ni PVC materijala.
15 Isključenje jamstva
Upozorenja na oznaci proizvoda sadrže detaljnije informacije i smatraju se sastavnim
dijelom ovog isključenja jamstva. Iako je proizvod proizveden u pažljivo kontroliranim
uvjetima, tvrtka Medtronic nema kontrolu nad uvjetima pod kojima se proizvod
upotrebljava. Medtronic se stoga odriče svih jamstava, izričitih i podrazumijevanih, u
odnosu na proizvod, uključujući između ostaloga sva podrazumijevana jamstva o
mogućnostima prodaje ili prikladnosti za određenu svrhu. Medtronic stoga nije odgovoran
bilo kojoj privatnoj ili pravnoj osobi za bilo kakve medicinske troškove, izravne, slučajne ili
posljedične štete nastale zbog upotrebe, pogreške, neispravnosti ili kvara proizvoda, bilo
da se zahtjev temelji na jamstvu, ugovoru, kaznenom djelu ili nekoj drugoj osnovi. Nijedna
osoba nema pravo tražiti od tvrtke Medtronic nikakvu izjavu ni jamstvo koje se odnosi na
proizvod.
33
Page 34

Prethodno opisana isključenja i ograničenja nisu zamišljena kao opreka obveznim odredbama
mjerodavnog zakona te ih se tako ne smije tumačiti. Ako bilo koji dio ovog Isključenja jamstva
nadležni sud proglasi nezakonitim, neprovedivim ili u sukobu s važećim zakonom, to ne utječe na
valjanost preostalih dijelova ovog Isključenja jamstva te se sva prava i obaveze moraju tumačiti i
provoditi kao da ovo Isključenje jamstva ne sadrži opisani dio ili uvjet koji se smatra nezakonitim.
Magyar
1 Az eszköz ismertetése
Az MVP mikrovaszkuláris dugaszrendszer egy öntágító érelzáró eszköz. Az MVP eszköz ovális
alakú, nitinolból készült és mindkét végét platina jelölősávok zárják le. Az eszköz egy részleges
PTFE-bevonatot is tartalmaz. A proximális jelölősávhoz egy bevezetődrót csatlakozik, amellyel az
eszköz keresztültolható egy kereskedelmi forgalomban kapható mikrokatéteren vagy katéteren a
kívánt kezelési helyre. Ez a bevezetődrót az MVP eszközről leválasztható, ha a bevezetődrót
elforgatják az óramutató járásával ellentétes irányban.
Az MVP rendszer egyetlen egységként van csomagolva, amely az MVP eszközből, a
bevezetőhüvelyből és a leválasztható bevezetődrótból áll. A rendszer steril, nem pirogén és
kizárólag egyszer használatos.
1. ábra. MVP mikrovaszkuláris dugó
1 Részleges fedél
2 Disztális marker
3 MVP eszköz
2. ábra. Az MVP rendszer méretei
1 Bevezetődrót hossza
2 Hossz kinyitva (eszköz szabadon és
mindenféle korlátozás nélkül)
1. táblázat. MVPMéretek Típus Átmérő kinyitva Hossz kinyitva Bevezetődrót
MVP-3Q 5,3 mm 12 mm 180 cm 1,5 mm – 3,0 mm
MVP-5Q 6,5 mm 12 mm 180 cm 3,0 mm – 5,0 mm
MVP-7Q 9,2 mm 16 mm 165 cm 5,0 mm – 7,0 mm
MVP-9Q 13,0 mm 18 mm 165 cm 7,0 mm – 9,0 mm
2. táblázat. Ajánlott mikrokatéter vagy katéter Típus Ajánlott mikrokatéter vagy
MVP-3Q 0,021 in (0,53 mm) - 0,027 in
MVP-5Q 0,027 in (0,69 mm) (belső átm-
MVP-7Q 4 Fr (1,4 mm) (belső átmérő) 120 cm
MVP-9Q 5 Fr (1,7 mm) (belső átmérő) 120 cm
katéter
(0,69 mm) (belső átmérő)
érő)
4 Leválasztási zóna
5 Bevezetődrót
6 Proximális marker
3 Átmérő kinyitva
hossza
Ajánlott mikrokatéter vagy
katéter maximális hossza
153 cm
153 cm
Célzott ér átmérője
2 Rendeltetés / alkalmazási terület
Az MVP mikrovaszkuláris dugaszrendszer a perifériás érrendszerben fennálló véráram elzárására
vagy sebességének csökkentésére javallott.
3 Ellenjavallatok
Erre az eszközre vonatkozóan nem ismeretesek ellenjavallatok.
4 Kompatibilitás
Az MVP rendszer méretei a termékcímkén vannak feltüntetve. A kompatibilitás megállapításához
olvassa el a többi orvostechnikai eszközön található címkét.
5 Figyelmeztetések
• Az MVP rendszer biztonságossága és hatékonysága kardiális (pl. septalis cardialis occlusio,
nyitott ductus arteriosus, paravalvularis szivárgás zárása) és neurológiai felhasználás esetén
nem megállapított.
• Az MVP rendszert kizárólag az angiográfiás és intervenciós beavatkozásokat ismerő orvosok
használhatják. Az MVP rendszer használata előtt fontos elolvasni a használati utasítást.
• Az MVP rendszert a termék csomagolásán található címkén feltüntetett lejárati dátum előtt
használja fel.
• Az MVP rendszer nem pirogén és szállítása steril állapotban történik, kivéve, ha az MVP
rendszer csomagolása fel van bontva vagy sérült. Ne használja fel, ha a csomagolás fel van
bontva vagy sérült.
• A használat előtt ellenőrizze az MVP rendszert, és selejtezze le, ha bármilyen
szabálytalanságot vagy sérülést tapasztal.
• Az MVP rendszer kizárólag egyszeri használatra szolgál. Tilos újrafeldolgozni vagy
újrasterilizálni. Az újrafeldolgozás és újrasterilizálás fokozhatja a beteg megfertőződésének
kockázatát, valamint kedvezőtlenül hathat az eszköz teljesítményére. Az MVP rendszert
használata után a kórházi vagy helyi jogszabályi előírások szerint kell ártalmatlanítani.
• Az MVP rendszer előre tolását vagy mozgatását fluoroszkópiás ellenőrzés mellett kell végezni.
Amikor túlzott ellenállást tapasztal, ne tolja előre, illetve ne húzza vissza az eszközt, amíg az
ellenállás okát nem állapítja meg.
• A bevezetődrótot ne csavarja meg és ne forgassa el, kivéve akkor, ha le akarja az eszközt
választani, ellenkező esetben az eszköz idő előtt leválhat.
• Mikrokatéteren vagy katéteren keresztül ne használjon motoros fecskendőt a kontrasztanyag
befecskendezésére az eszközzel együtt.
• Az MVP eszközről történt leválasztás után ne tolja tovább a bevezetődrótot.
• Az orvosnak fel kell készülnie olyan sürgős esetek kezelésére, amelyeknél el kell távolítani az
eszközt. A felkészülés részeként biztosítani kell egy azonnal rendelkezésre álló sebészt.
• Ne használja az embóliás eszközök (tekercsek és/vagy dugasz) esetén ellenjavallt
katéterekkel.
6 Előírások
• Az MVP eszköz nikkel-titán ötvözetből készül, amely általában véve biztonságosnak
tekinthető. Azonban az in vitro vizsgálatok kimutatták, hogy a beültetés után az eszközből
minimum 60 napig nikkel szabadul fel. A nikkelallergiában szenvedő, különösen pedig
fémallergia kórtörténetű pácienseknél allergiás reakció léphet fel az eszközzel szemben.
Bizonyos allergiás reakciók súlyosak lehetnek; a pácienseket utasítani kell arra, hogy
haladéktalanul értesítsék kezelőorvosukat, ha gyaníthatóan allergiás reakciót, például légzési
nehézségeket vagy arc környéki gyulladást, illetve torokgyulladást tapasztalnak. Egyes
pácienseknél az eszköz beültetése esetén alakulhat ki nikkelallergia.
• Az orvosnak az eszköz használata előtti, közbeni és/vagy utáni, véralvadás- vagy
vérlemezkegátló szerek alkalmazásával járó helyzetek tekintetében saját klinikai megítélésére
kell hagyatkoznia.
• Kérjük, legyen óvatos a konkrét populációkra vonatkozó ellátás során:
– terhes betegek esetén külön figyelmet kell fordítani arra, hogy az anyát és a magzatot érő
sugárzás minimális legyen;
– szoptató anyák esetén nem történt érdemleges kutatás a beültetés után az anyatejbe
átszivárgó anyagok jelenlétéről.
• Az MVP rendszer kompatibilitását ellenőrizni kell, amikor intravaszkuláris beavatkozások során
egyéb kiegészítő eszközöket használ. Az MVP rendszert használó orvosnak ismernie kell a
perkután intravaszkuláris technikákat és a beavatkozással összefüggő lehetséges
szövődményeket.
• Az MVP rendszert a felhasználás előtt hidratálni kell.
• A véletlen károsodás esélyének csökkentése érdekében óvatosan kezelje az MVP rendszert.
34
Page 35

• A hornyos nitinol kompozit mikrokatéterrel vagy katéterrel való használatkor nagyobb tolóerő
alakulhat ki.
• A használat előtt ellenőrizze, hogy bármely alkalmazott kiegészítő eszköz átmérője
kompatibilis-e az MVP rendszerrel.
7 Lehetséges nemkívánatos események
Az eszköz behelyezése során, illetve után potenciálisan bekövetkező nemkívánatos események
közé egyebek mellett a következők tartozhatnak:
• légembólia
• allergiás reakció vagy toxikus hatások
• Vérzés
• Halál
• az eszköz elmozdulása
• láz
• idegen anyag miatti embóliás esemény
• fertőzés
• nem tervezett ér elzáródása
• perifériás embólia
• rekanalizáció
• maradványfolyás
• stroke vagy átmeneti agyi vérellátási zavar (TIA)
• műtéti beavatkozás
• az erek hozzáférési területén kialakuló szövődmény
• értrauma vagy perforálódás
8 Szükséges anyagok
1. Az MVP rendszer kezelési helyre való bevezetésére mikrokatéterre vagy katéterre van
szükség (ennek javasolt méretét itt találja: 2. táblázat).
2. A következő tartozékok szükségesek:
• heparinos sóoldat
• forgó hemosztatikus szelep (RHV)
• háromállású csap
• sóoldat-tasak mandzsetta
• hozzáférést biztosító hüvely
• a mikrokatéterrel vagy katéterrel kompatibilis javasolt vezetőkatéter (lásd: 2. táblázat)
• a vezetőkatéterrel és mikrokatéterrel vagy katéterrel kompatibilis vezetődrót
• intravénás (IV) infúziós állvány
9 Előkészületek
1. Annak érdekében, hogy az MVP rendszerrel optimális teljesítményt érjen el, valamint a
tromboembóliás szövődmény kockázatának csökkentése érdekében sóoldattal folyamatos
öblítést kell végezni a következő elemek között:
• a hozzáférést biztosító hüvely és a vezetőkatéter
• a mikrokatéter vagy katéter és a vezetőkatéter
• a mikrokatéter vagy katéter, a vezetődrót, valamint az MVP rendszer.
2. Az ajánlott eljárást követve helyezze el a megfelelő vezetőkatétert. Csatlakoztasson egy forgó
hemosztatikus szelepet (RHV) a vezetőkatéter csatlakozófejéhez. Az RHV oldalágára
szereljen fel egy háromállású elzárócsapot. Csatlakoztassa a folyamatos öblítést biztosító
heparinos sóoldatvezetéket.
3. Ellenőrizzen minden szerelvényt, hogy ne kerülhessen levegő a vezetőkatéterbe, a
mikrokatéterbe vagy a katéterbe a folyamatos öblítés alatt.
10 Használati utasítás
1. Közelítse meg a célzott eret, és a kívánt okklúzió helyénél lévő érátmérő megmérése céljából
készítsen angiogrammot standard technika használatával. Ellenőrizze, hogy a megcélzott ér
megfelel-e az ajánlott átmérőknek (lásd: 1. táblázat).
2. Ellenőrizze, hogy az okklúzió helye elég hosszú-e a beültetett MVP eszköz befogadásához
anélkül, hogy nem tervezett erek is elzáródnának.
3. Válassza ki a mikrokatétert vagy katétert (a javasolt méretet lásd itt: 2. táblázat), és készítse elő
a gyártó használati útmutatója alapján.
4. Vezesse be a vezetődrótot, és tolja rajta előre a mikrokatétert vagy katétert, amíg a disztális
csúcs az okklúzió helyének elülső szegélyének közelébe nem kerül.
5. Távolítsa el a vezetődrótot a mikrokatéterből vagy katéterből.
6. Vegye ki az MVP rendszert az adagolótubusból úgy, hogy a két külső csipeszről óvatosan
eltávolítja a sárga bevezetőhüvelyt, és kihúzza az MVP rendszert az átlátszó csőházból. Fogja
meg óvatosan a bevezetőhüvelyt proximálisan az MVP eszközhöz képest, majd lassan,
egyidejűleg vegye ki az MVP eszközt, a bevezetődrótot és a bevezetőhüvelyt az
adagolócsőből. Lásd: 3. ábra.
3. ábra. A becsomagolt MVP rendszer
1 Átlátszó csőház
2 Sárga bevezetőhüvely
3 Bevezetődrót (a bevezetőhüvelyben)
4 Nyomatékoló
5 Adagolócső
6 MVP eszköz
7. Az MVP rendszert alaposan vizsgálja át, hogy nem sérült-e. Ha az MVP rendszer sérült,
cserélje le egy új MVP rendszerre.
8. Öblítse át az MVP rendszert úgy, hogy a bevezetőhüvely pár centiméternyi részét és az MVP
eszközt óvatosan heparinos sóoldatba mártja.
9. Húzza az MVP eszközt a bevezetőhüvelybe úgy, hogy meghúzza a bevezetődrótot épp addig,
ameddig az MVP eszköz disztális hegyét befedi a bevezetőhüvely.
Megjegyzés: Ha túl nagy mértékben húzza be az MVP eszközt a bevezetőhüvelybe,
előfordulhat, hogy nem megfelelően fog kiöblítődni. A bevezetőhüvelyen a csúcshoz képest
proximálisan található, 3 cm-re és 6 cm-re lévő két lyuk teszi lehetővé a levegővel történő
ürítést és öblítést.
10. Vezesse be az MVP rendszert úgy, hogy a bevezetőhüvely disztális végét bevezeti az RHV-n
keresztül a mikrokatéter vagy katéter csatlakozófejébe addig, amíg a hüvely nincs szilárdan a
helyén. Húzza meg az RHV-t annyira, hogy megakadályozza a vér visszafolyását, de ne
károsítsa az MVP rendszert a mikrokatéterbe vagy katéterbe való bevezetése során.
11. Szemrevételezéssel ellenőrizze, hogy az öblítőoldat megfelelő infúziót biztosít-e. A sóoldat
cseppjeit látni kell, ahogy elhagyják a bevezetőhüvely proximális végét.
12. Lazítsa meg az RHV-t annyira, hogy az MVP eszközt és a bevezetődrótot egy rendszerként
lehessen előretolni. Ne lazítsa meg az RHV-t annyira, hogy a vér visszaáramolhasson a
vezetőkatéterbe. Távolítsa el a bevezetőhüvelyt a bevezetődrót proximális végén át.
13. Tolja előre a bevezetődrótot és az MVP eszközt, amíg az MVP eszköz disztális platina
jelölősávja egy vonalba nem kerül a mikrokatéter vagy katéter disztális jelölősávjával.
14. Bizonyosodjon meg róla, hogy a jelölősávok optimális helyzetben vannak. Helyezze be az
MVP eszközt úgy, hogy folyamatosan előreirányuló nyomást fejt ki a bevezetődróton, majd
bontsa ki az MVP eszközt úgy, hogy lassan visszahúzza a mikrokatétert vagy katétert.
15. Amennyiben az eszköz elhelyezkedése nem megfelelő, végezze el a következő műveleteket:
a. Stabilizálja a bevezetődrótot, és tolja előre a mikrokatétert vagy katétert addig, amíg az
MVP eszköz vissza nem kerül a katéterbe.
b. Pozicionálja újra és juttassa be újra az eszközt, vagy távolítsa el az eszközt a betegből.
Megjegyzés: Az eszközt tilos háromnál többször a hüvelybe visszahúzni és bejuttatni.
16. A megfelelő leválasztáshoz az MVP eszköznek túl kell jutnia a mikrokatéter vagy katéter
hegyén.
17. Amennyiben az eszköz elhelyezkedése megfelelő, a következő lépésekkel folytassa a
leválasztást:
a. Erősítse meg fluoroszkópia segítségével, hogy a mikrokatéter vagy katéter csúcsa az
MVP eszközhöz képest proximális helyzetben van.
b. Csatlakoztassa a nyomatékolót a bevezetődróthoz. Válassza le az MVP eszközt; ehhez
fordítsa el a bevezetődrótot az óramutató járásával ellentétes irányban, amíg a drót el nem
válik az eszköztől.
c. A sikeres leválasztást fluoroszkópiával ellenőrizze úgy, hogy lassan elhúzza a
bevezetődrótot proximális irányba, arra ügyelve, hogy az MVP eszköz ne mozduljon el.
Abban a valószínűtlen esetben, ha az MVP eszköz proximálisan elmozdulna, helyezze el
újra az eszközt, és a leválasztáshoz ismételje meg az óramutató járásával ellentétes
irányú elforgatást.
35
Page 36

18. Tartsa a mikrokatétert vagy katétert a helyén, húzza vissza a bevezetődrótot a mikrokatéterbe
vagy katéterbe, és távolítsa el a bevezetődrótot a betegből. Fejezze be a műtétet a standard
technikáknak megfelelően.
11 Beavatkozás utáni utasítások
Amennyiben a MedicAlert szolgáltatás elérhető a régióban, javasolja a páciensnek, hogy
csatlakozzon a MedicAlert tagsághoz a www.medicalert.org címen. A pácienstől el fogják kérni az
állapotára, a beültetett eszköz nevére, illetve az MR-képalkotás alkalmazásával kapcsolatos
korlátozásokra vonatkozó információkat.
12 MRI-vizsgálatokkal kapcsolatos tudnivalók
12.1 MR-kompatibilitás feltételekkel
Az MVP mikrovaszkuláris dugasz MR környezetben feltételekkel használható. A nem klinikai
tesztelés kimutatta, hogy az MVP mikrovaszkuláris dugasz eszköz MR környezetben feltételekkel
használható. Az ezzel az eszközzel eszközzel élő betegek a beültetés után akár azonnal
biztonságosan alávethetők a vizsgálatnak az alábbi feltételek betartása mellett:
• 3 tesla vagy kisebb térerejű statikus mágneses tér
• Legfeljebb 9000 Gauss/cm térbeli grádiensmező
• Az MR-rendszer által jelzett maximális teljes testre vonatkoztatott fajlagosan elnyelt
teljesítmény (SAR) 4 W/kg 15 perces vizsgálat során (azaz impulzussorozatonként)
• Az MR-rendszer első szintű szabályozott üzemmódja
12.2 MRI-vel kapcsolatos melegedés
Nem klinikai vizsgálatok során az MVP mikrovaszkuláris dugasz eszköz a következő
hőmérséklet-emelkedést mutatta 3 teslás MR-rendszerben (3 tesla/128 MHz, Excite, HDx, 14X.M5
szoftver, General Electric Healthcare, Milwaukee, WI), 15 min-es szkenneléssel (azaz
impulzussorozatonként) végzett MRI-vizsgálat során: Legnagyobb
hőmérsékletváltozás +1,8°C
Tehát az MVP mikrovaszkuláris dugasz eszköz MRI-vel kapcsolatos, MR-rendszerben 3 teslával,
adó-vevő RF testtekerccsel végzett melegedési kísérletei 2,9 W/kg teljes testre átlagolt SAR értéket
mutattak (amely tehát 2,7 W/kg kalorimetriával mért teljes testre átlagolt értékhez kapcsolható); ez
azt jelzi, hogy az említett fajlagos körülményekkel összefüggésben bekövetkezett melegedés
legnagyobb mértéke +1,8°C vagy ennél kevesebb volt.
12.3 Műtermékekre vonatkozó információk
Az MR-képminőség romolhat, ha a vizsgált terület pontosan ugyanoda esik, mint ahol az MVP
mikrovaszkuláris dugasz eszköz elhelyezkedik, vagy viszonylag közel van hozzá. Ezért az eszköz
jelenlétének kompenzálásához szükség lehet az MR-képalkotás paramétereinek optimalizálására.
A maximális műtermék méret (azaz ami a gradiens visszaverődés impulzussorozaton látható) kb.
5 mm-rel nyúlik túl az MVP mikrovaszkuláris dugasz eszköz méretéhez és alakjához képest.
Impulzusszekvencia T1-SE T1-SE GRE GRE
Jelhiány mérete 252 mm
Sík tájolása Párhuzamos Merőleges Párhuzamos Merőleges
2
91 mm
2
304 mm
2
116 mm
2
közvetlen, véletlen vagy következményes kárért, legyen a kárigény alapja akár
szavatosság, akár szerződés, akár szerződésen kívüli károkozás, akár valami egyéb dolog.
Senki sem jogosult kötelezni a Medtronic vállalatot semmilyen nyilatkozattételre vagy
szavatosságvállalásra a termékkel kapcsolatban.
A fenti kizárások és korlátozások nem szándékoznak a vonatkozó törvények kötelező hatályú
rendelkezéseivel ellentétbe kerülni, és ilyen irányú értelmezésnek nincs helye. Ha a jelen
szavatossági nyilatkozat bármely elemét vagy rendelkezését illetékes bíróság jogellenesnek,
hatálytalannak vagy a vonatkozó jogszabályokkal ellentétesnek mondja ki, a szavatossági
nyilatkozat fennmaradó részeit ez nem érinti, és minden jog és kötelezettség úgy értelmezendő és
tartandó be, mintha a jelen szavatossági nyilatkozat nem tartalmazná az érvénytelenített részt vagy
pontot.
Bahasa Indonesia
1 Deskripsi perangkat
Sistem sumbat mikrovaskular MVP adalah perangkat oklusi pembuluh yang mengembang sendiri.
Perangkat MVP berbentuk bulat telur, terdiri dari nitinol, dan diamankan di kedua ujungnya dengan
pita penanda platinum. Perangkat ini dilengkapi dengan penutup parsial PTFE. Pita penanda
proksimal ditempelkan pada kawat pengaliran yang mendorong perangkat melalui mikrokateter
atau kateter yang tersedia secara komersial ke lokasi perawatan yang dimaksud. Kawat pengaliran
dilepaskan dari perangkat MVP dengan memutarnya berlawanan arah jarum jam untuk
melepaskannya dari perangkat.
Sistem MVP dikemas sebagai satu unit yang terdiri dari perangkat MVP, selubung pengantar, dan
kawat pengaliran yang dapat dilepas. Sistem ini disediakan dalam kondisi steril, bebas pirogen, dan
ditujukan hanya untuk sekali pakai.
Gambar 1. Sumbat Mikrovaskular MVP
1 Penutup parsial
2 Penanda distal
3 Perangkat MVP
4 Zona pelepasan
5 Kawat pengaliran
6 Penanda proksimal
Gambar 2. Dimensi sistem MVP
13 Tárolás
A tárolás során kerülni kell az MVP rendszer vízzel, napfénnyel, szélsőséges hőmérséklettel és
magas páratartalommal való érintkezését. Az MVP rendszert szabályozott szobahőmérsékleten
kell tárolni. Az eszköz felhasználhatósági időtartama a termékcímkén van feltüntetve. A címke
szerinti felhasználhatósági időtartam után tilos használni az eszközt.
14 Anyagok
Az MVP rendszer nem tartalmaz latexet vagy PVC-t.
15 Szavatossági nyilatkozat
A termék címkéin feltüntetett figyelmeztetések további információkkal szolgálnak, és jelen
szavatossági nyilatkozat szerves részének tekintendők. Bár a termék gyártása gondosan
ellenőrzött körülmények között történt, a Medtronic vállalatnak nincs befolyása arra, hogy
a terméket milyen körülmények között használják fel. A Medtronic ezért a termékkel
kapcsolatban semminemű kifejezett vagy hallgatólagos felelősséget nem vállal, többek
között arra sem, hogy a termék forgalomképes, és egy adott célra megfelel. A Medtronic
semmilyen természetes vagy jogi személynek nem felel a termék használatából,
működésképtelenségéből vagy hibás működéséből eredő orvosi költségért, sem
1 Panjang kawat pengaliran
2 Panjang tidak dibatasi (perangkat ditarik dan tanpa kendala apa pun di atasnya)
3 Diameter tidak dibatasi
Tabel 1. Dimensi MVP Model Diameter Tidak
MVP-3Q 5,3 mm 12 mm 180 cm 1,5 mm – 3,0 mm
MVP-5Q 6,5 mm 12 mm 180 cm 3,0 mm – 5,0 mm
MVP-7Q 9,2 mm 16 mm 165 cm 5,0 mm – 7,0 mm
MVP-9Q 13,0 mm 18 mm 165 cm 7,0 mm – 9,0 mm
36
Dibatasi
Panjang Tidak
Dibatasi
Panjang Kawat
Pengaliran
Diameter Pembuluh Target
Page 37

Tabel 2. Mikrokateter atau kateter yang direkomendasikan Model Mikrokateter atau Kateter
MVP-3Q 0,021 in (0,53 mm) hingga
MVP-5Q 0,027 in (0,69 mm) (ID) 153 cm
MVP-7Q 4 Fr (1,4 mm) (OD) 120 cm
MVP-9Q 5 Fr (1,7 mm) (OD) 120 cm
yang Direkomendasikan
0,027 in (0,69 mm) (ID)
Panjang Maks. Mikrokateter
atau Kateter yang Direkomendasikan
153 cm
2 Tujuan penggunaan/Indikasi penggunaan
Sistem sumbat mikrovaskular MVP dimaksudkan untuk menghalangi atau mengurangi laju aliran
darah dalam pembuluh darah periferal.
3 Kontraindikasi
Tidak ada kontraindikasi yang diketahui untuk perangkat ini.
4 Kompatibilitas
Lihat label produk sistem MVP untuk mengetahui dimensi perangkat. Lihat label yang diberikan
pada teknologi medis lainnya untuk menentukan kompatibilitas.
5 Peringatan
• Keamanan dan keefektifan sistem MVP belum ditetapkan untuk penggunaan pada jantung
(mis., oklusi septum jantung, patent ductus arteriosus (duktus arteriosus paten), penutupan
kebocoran dari pinggir katup) dan penggunaan neurologis.
• Sistem MVP hanya boleh digunakan oleh dokter yang sudah memahami prosedur angiografi
dan intervensi. Penting untuk membaca petunjuk penggunaan sebelum menggunakan sistem
MVP.
• Gunakan sistem MVP sebelum tanggal "gunakan paling lambat" yang dicetak pada label
kemasan produk.
• Sistem MVP bebas pirogen dan disediakan dalam kondisi steril, kecuali jika kemasan sistem
MVP terbuka atau rusak. Jangan digunakan jika kemasan sobek atau rusak.
• Periksa sistem MVP sebelum digunakan dan buang jika mendapati adanya penyimpangan
atau kerusakan.
• Sistem MVP ini ditujukan hanya untuk sekali pakai. Jangan diproses ulang atau disterilkan
ulang. Pemrosesan ulang dan sterilisasi ulang dapat meningkatkan risiko infeksi pada pasien
dan mengganggu kinerja perangkat. Setelah menggunakan sistem MVP, buang sesuai dengan
kebijakan rumah sakit dan pemerintah setempat.
• Gunakan panduan fluoroskopi saat memajukan atau memanipulasi sistem MVP. Jangan
memajukan atau menarik perangkat jika resistansi berlebihan terpenuhi, sampai penyebab
resistansi telah ditentukan.
• Jangan memilin atau memutar kawat pengaliran selain untuk melepaskan perangkat, karena
hal tersebut dapat melepaskan perangkat sebelum waktunya.
• Jangan menggunakan alat suntik injeksi daya untuk menyuntikkan larutan kontras dengan
perangkat melalui mikrokateter atau kateter.
• Jangan memajukan kawat pengaliran setelah melepaskannya dari perangkat MVP.
• Dokter harus siap menghadapi situasi mendesak yang mengharuskan pelepasan perangkat.
Persiapan ini termasuk memastikan ketersediaan ahli bedah di lokasi.
• Jangan menggunakannya dengan kateter yang memiliki kontraindikasi dengan perangkat
emboli (misalnya, koil atau colokan).
6 Tindakan pencegahan
• Perangkat MVP terdiri dari campuran nikel-titanium yang umumnya dianggap aman. Namun,
pengujian in-vitro menunjukkan bahwa nikel dilepaskan dari perangkat setelah implantasi
selama minimal 60 hari. Pasien yang alergi terhadap nikel mungkin memiliki reaksi alergi
terhadap perangkat, terutama pasien yang memiliki riwayat alergi logam. Reaksi alergi tertentu
bisa jadi serius; pasien harus diinstruksikan untuk segera memberi tahu dokter jika mereka
merasa mengalami reaksi alergi, seperti kesulitan bernapas atau radang pada wajah atau
tenggorokan. Beberapa pasien mungkin mengalami alergi terhadap nikel jika perangkat
ditanamkan.
• Dokter harus melakukan penilaian klinis terkait penggunaan antikoagulan atau obat
antitrombosit sebelum, selama, atau setelah penggunaan perangkat.
• Harap perhatikan perawatan dalam populasi spesifik berikut:
– Untuk pasien hamil, perawatan harus dilakukan untuk meminimalkan paparan radiasi pada
ibu dan janin.
– Untuk ibu menyusui, belum ada penilaian kuantitatif tentang keberadaan zat yang dapat
dilindi (leachable) dalam ASI setelah implantasi dengan perangkat.
• Verifikasi kompatibilitas sistem MVP saat menggunakan perangkat tambahan lainnya dalam
prosedur intravaskular. Dokter yang menggunakan sistem MVP harus memahami teknik
intravaskular, perkutan, dan kemungkinan komplikasi yang terkait dengan prosedur.
• Sistem MVP harus terhidrasi sebelum digunakan.
• Berhati-hatilah dalam menangani sistem MVP untuk mengurangi kemungkinan kerusakan
akibat kecelakaan.
• Terdapat potensi gaya dorong yang lebih tinggi ketika digunakan dengan mikrokateter atau
kateter campuran nitinol berlubang.
• Pastikan diameter perangkat aksesori apa pun yang digunakan kompatibel dengan sistem
MVP sebelum digunakan.
7 Potensi efek samping
Potensi efek samping yang mungkin terjadi selama atau setelah prosedur penempatan perangkat
ini meliputi, tetapi tidak terbatas pada, item berikut:
• Emboli udara
• Reaksi alergi atau efek toksik
• Berdarah
• Kematian
• Perangkat bergeser
• Demam
• Emboli benda asing
• Infeksi
• Penyumbatan pembuluh yang tidak diinginkan
• Emboli periferal
• Rekanalisasi
• Aliran residu
• Stroke atau transient ischemic attack (TIA/stroke ringan)
• Intervensi bedah
• Komplikasi tempat akses vaskular
• Trauma atau perforasi pembuluh
8 Bahan yang diperlukan
1. Penyaluran sistem MVP membutuhkan penggunaan mikrokateter atau kateter (lihat Tabel 2
untuk mengetahui ukuran yang direkomendasikan).
2. Aksesori berikut diperlukan:
• Larutan garam yang diheparinisasi
• Rotating hemostatic valve (katup hemostasis putar/RHV)
• Keran 3 arah
• Manset tekanan pengikat larutan garam
• Selubung akses
• Kateter pemandu yang kompatibel dengan mikrokateter atau kateter yang
direkomendasikan dalam Tabel 2
• Kawat pemandu yang kompatibel dengan kateter pemandu dan mikrokateter atau kateter
• Tiang infus intravena (IV)
9 Persiapan
1. Untuk mencapai kinerja sistem MVP yang optimal dan mengurangi risiko komplikasi
tromboembolik, pertahankan pembilasan larutan garam yang berkelanjutan antara item
berikut:
• selubung akses dan kateter pemandu
• mikrokateter atau kateter dan kateter pemandu
• mikrokateter atau kateter, kawat pemandu, dan sistem MVP.
2. Tempatkan kateter pemandu yang sesuai dengan mengikuti prosedur yang
direkomendasikan. Hubungkan rotating hemostatic valve (katup hemostasis putar/RHV) ke
hub kateter pemandu. Pasang keran 3 arah ke lengan samping RHV. Hubungkan saluran
larutan garam yang diheparinisasi untuk mendapatkan pembilasan berkelanjutan.
3. Periksa semua perlengkapan untuk memastikan tidak ada udara yang masuk ke dalam kateter
pemandu atau mikrokateter atau kateter selama pembilasan berkelanjutan.
37
Page 38

10 Petunjuk penggunaan
1. Akses pembuluh yang ditargetkan dan lakukan angiogram menggunakan teknik standar untuk
mengukur diameter pembuluh di lokasi oklusi yang diinginkan. Pastikan pembuluh yang
ditargetkan sesuai dengan diameter yang direkomendasikan (lihat Tabel 1).
2. Pastikan lokasi oklusi cukup panjang untuk mengakomodasi perangkat MVP yang diimplan
tanpa menghalangi pembuluh yang tidak diinginkan.
3. Pilih mikrokateter atau kateter (lihat Tabel 2 untuk mengetahui ukuran yang
direkomendasikan) dan siapkan sesuai dengan petunjuk penggunaan dari produsen.
4. Masukkan kawat pemandu dan majukan mikrokateter atau kateter melewati kawat pemandu
sampai ujung distal berada di dekat tepi depan lokasi oklusi.
5. Lepaskan kawat pemandu dari mikrokateter atau kateter.
6. Lepaskan sistem MVP dari selang dispenser dengan melepas selubung pengantar kuning
secara perlahan dari dua klip luar dan menarik sistem MVP dari tabung casing yang bening.
Pegang selubung pengantar secara perlahan di tempat yang dekat dengan bagiah tengah
perangkat MVP, dan lepaskan secara perlahan perangkat MVP, kawat pengaliran, dan
selubung pengantar secara bersamaan dari selang dispenser. Lihat Gambar 3.
Gambar 3. Sistem MVP yang dikemas
1 Selang casing yang bening
2 Selubung pengantar kuning
3 Kawat pengaliran (di dalam selubung
pengantar)
7. Periksa sistem MVP secara menyeluruh untuk mengetahui apakah ada kerusakan. Jika sistem
MVP rusak, ganti dengan sistem MVP yang baru.
8. Bilas sistem MVP dengan merendam perlahan beberapa sentimeter selubung pengantar dan
perangkat MVP dalam larutan garam yang diheparinisasi.
9. Tarik perangkat MVP ke dalam selubung pengantar dengan menarik kawat pengaliran sampai
ujung distal perangkat MVP tertutup oleh selubung pengantar.
Catatan: Jika perangkat MVP ditarik terlalu jauh ke dalam selubung pengantar, perangkat
tersebut mungkin tidak dibilas dengan benar. Dua lubang di selubung pengantar, terletak 3 cm
dan 6 cm di dekat bagian tengah ujung selubung, memfasilitasi udara pembersih dan
membilas perangkat.
10. Masukkan sistem MVP dengan memasukkan ujung distal selubung pengantar melalui RHV
dan ke dalam hub mikrokateter atau kateter sampai selubung terpasang dengan kuat.
Kencangkan RHV secukupnya untuk mencegah darah mengalir balik, tetapi tidak terlalu ketat
sehingga dapat merusak sistem MVP saat dimasukkan ke dalam mikrokateter atau kateter.
11. Verifikasi secara visual bahwa larutan pembilasan meresap secara normal. Tetesan larutan
garam harus terlihat keluar dari ujung dekat bagian tengah selubung pengantar.
12. Longgarkan RHV secukupnya agar perangkat MVP dan kawat pengaliran dapat didorong
bersama sebagai suatu sistem. Jangan terlalu melonggarkan RHV agar darah tidak mengalir
balik. Lepaskan selubung pengantar dengan menariknya ke ujung dekat bagian tengah kawat
pengaliran.
13. Dorong kawat pengaliran dan perangkat MVP hingga penanda platinum distal dari perangkat
MVP sejajar dengan pita penanda distal pada mikrokateter atau kateter.
14. Pastikan pita penanda diposisikan secara optimal. Terapkan perangkat MVP dengan
mempertahankan tekanan ke depan pada kawat pengaliran sambil menarik kembali
mikrokateter atau kateter secara perlahan untuk melepaskan perangkat MVP.
15. Jika posisi perangkat tidak memuaskan, lakukan tindakan berikut:
a. Stabilkan kawat pengaliran dan majukan mikrokateter atau kateter dengan
menggerakkannya dari jauh hingga perangkat MVP ditangkap kembali di dalam kateter.
b. Ubah posisi dan terapkan perangkat, atau lepas perangkat dari pasien.
Catatan: Perangkat tidak boleh diselubungkan ulang dan diterapkan lebih dari maksimal
3 kali.
16. Untuk pelepasan yang tepat, perangkat MVP harus diposisikan di luar ujung mikrokateter atau
kateter.
4 Pemutar
5 Selang dispenser
6 Perangkat MVP
17. Jika posisi perangkat memuaskan, lakukan pelepasan dengan mengambil tindakan berikut:
a. Konfirmasikan di bawah fluoroskopi bahwa ujung mikrokateter atau kateter berada di
dekat bagian tengah perangkat MVP.
b. Pasang pemutar ke kawat pengaliran. Lepas perangkat MVP dengan memutar kawat
pengaliran berlawanan arah jarum jam hingga terlepas dari perangkat.
c. Verifikasi keberhasilan pelepasan secara fluoroskopi dengan menarik kawat pengaliran
secara perlahan ke arah dekat bagian tengah untuk memastikan perangkat MVP tidak
bergerak. Seandainya perangkat MVP bergerak ke arah dekat ke pusat, lakukan kembali
penempatan perangkat dan putar lagi kawat pengaliran berlawanan arah jarum untuk
pelepasan.
18. Sambil menahan mikrokateter atau kateter pada tempatnya, tarik kembali kawat pengaliran ke
dalam mikrokateter atau kateter, lalu lepaskan kawat pengaliran dari pasien. Selesaikan
prosedur dengan mengikuti teknik standar.
11 Petunjuk pascaprosedural
Jika layanan MedicAlert tersedia di wilayah Anda, rekomendasikan pasien untuk menjadi anggota
MedicAlert di www.medicalert.org. Pasien akan diminta untuk menyampaikan kondisinya, nama
perangkat yang diimplan, dan batasan terkait penggunaan MRI.
12 Informasi MRI
12.1 MR Conditional
Sumbat mikrovaskular MVP ditentukan sebagai MR Conditional. Pengujian non-klinis
menunjukkan bahwa perangkat sumbat mikrovaskular MVP adalah MR Conditional. Pasien yang
dipasangi perangkat ini dapat dipindai dengan aman, segera setelah penempatan dalam kondisi
berikut:
• Medan magnet statis 3 Tesla atau kurang
• Medan magnet gradien spasial maksimum sebesar 9.000 Gauss/cm atau kurang
• Sistem MR maksimum yang dilaporkan, tingkat penyerapan spesifik (SAR) rata-rata seluruh
tubuh sebesar 4 W/kg selama 15 menit pemindaian (mis., per urutan denyut)
• Mode Operasi Terkendali Tingkat Pertama untuk sistem MR
12.2 Pemanasan terkait MRI
Dalam pengujian non-klinis, perangkat sumbat mikrovaskular MVP menghasilkan kenaikan suhu
berikut saat MRI dilakukan selama 15 min pemindaian (yaitu, per urutan denyut) dalam sistem MR
3 Tesla (3 Tesla/128 MHz, Excite, HDx, Perangkat Lunak 14X.M5, General Electric Healthcare,
Milwaukee, WI): Perubahan suhu tertinggi +1,8°C
Oleh karena itu, eksperimen pemanasan terkait MRI untuk perangkat sumbat mikrovaskular MVP
pada 3 Tesla yang menggunakan koil bodi RF pengirim/penerima pada SAR rata-rata seluruh tubuh
yang dilaporkan sistem MR sebesar 2,9 W/kg (yaitu, terkait dengan nilai rata-rata seluruh tubuh
yang diukur dengan kalorimetri sebesar 2,7 W/kg) menunjukkan bahwa jumlah pemanasan
terbesar yang terjadi sehubungan dengan kondisi spesifik ini sama dengan atau kurang
dari +1,8°C.
12.3 Informasi artefak
Kualitas gambar MR dapat dikompromikan jika area perhatian berada di area yang sama persis
atau relatif dekat dengan posisi perangkat sumbat mikrovaskular MVP. Oleh karena itu, mungkin
diperlukan pengoptimalan parameter pencitraan MR untuk mengimbangi keberadaan perangkat
ini. Ukuran artefak maksimum (mis., seperti yang terlihat pada urutan denyut gema gradien) meluas
sekitar 5 mm yang relatif terhadap ukuran dan bentuk perangkat sumbat mikrovaskular MVP.
Urutan Denyut
Ukuran Ketiadaan
Sinyal
Orientasi Bidang Paralel Tegak lurus Paralel Tegak lurus
T1-SE T1-SE GRE GRE
252 mm
2
91 mm
2
304 mm
2
116 mm
2
13 Penyimpanan
Jangan biarkan sistem MVP terkena air, sinar matahari, suhu ekstrem, dan kelembapan tinggi
selama penyimpanan. Simpan sistem MVP di bawah suhu kamar yang terkendali. Lihat label
produk untuk mengetahui tanggal "gunakan paling lambat" perangkat. Jangan menggunakan
perangkat melewati tanggal "gunakan paling lambat" pada label.
14 Bahan
Sistem MVP tidak terbuat dari bahan lateks atau PVC.
38
Page 39

15 Sanggahan Garansi
Peringatan yang ada pada pelabelan produk memberikan informasi yang lebih terperinci
dan dianggap sebagai bagian yang tidak terpisahkan dari sanggahan garansi ini.
Meskipun produk telah diproduksi dalam kondisi yang dikontrol dengan cermat,
Medtronic tidak memiliki kendali atas kondisi pada saat produk ini digunakan. Medtronic,
oleh karena itu, menyanggah semua garansi, baik tersurat maupun tersirat, sehubungan
dengan produk, termasuk, namun tidak terbatas pada, garansi tersirat atas kelayakan
diperdagangkan atau kesesuaian untuk tujuan tertentu. Medtronic tidak akan
bertanggung jawab kepada siapa pun atau entitas mana pun atas biaya medis atau
kerugian langsung, insidental, atau konsekuensial yang disebabkan oleh penggunaan,
kecacatan, kegagalan, atau malafungsi produk, baik klaim atas kerugian tersebut
didasarkan pada garansi, kontrak, tort atau di luar kontrak, maupun lainnya. Tidak ada
seorang pun yang memiliki wewenang untuk mengikat Medtronic dengan representasi
atau garansi apa pun sehubungan dengan produk.
Pengecualian dan batasan yang disebutkan di atas tidak dimaksudkan untuk, dan tidak boleh
ditafsirkan sehingga, melanggar ketentuan wajib pada hukum yang berlaku. Jika ada bagian atau
ketentuan pada sanggahan garansi ini yang dianggap tidak sah, tidak dapat diberlakukan, atau
bertentangan dengan hukum yang berlaku oleh pengadilan yang berwenang, keabsahan bagian
yang tersisa dari sanggahan garansi ini tidak akan terpengaruh, dan semua hak dan kewajiban
harus ditafsirkan dan ditegakkan seolah-olah sanggahan garansi ini tidak mengandung bagian
atau ketentuan tertentu yang dianggap tidak sah.
Italiano
1 Descrizione del dispositivo
Il sistema con plug microvascolare MVP è un dispositivo per occlusione vascolare autoespandibile.
Il dispositivo MVP ha una forma ovoidale, è costituito in Nitinol ed è dotato di marker in platino situati
ad entrambe le estremità. Il dispositivo presenta inoltre una copertura parziale in
politetrafluoroetilene (PTFE). Il marker prossimale si collega a un filo di rilascio per la spinta del
dispositivo attraverso un microcatetere o un catetere disponibile in commercio fino al sito da
sottoporre a trattamento. Per scollegare il filo di rilascio dal dispositivo MVP, ruotare il filo di rilascio
in senso antiorario per svitarlo dal dispositivo.
Il sistema MVP è confezionato come una singola unità comprendente il dispositivo MVP, un
introduttore e un filo di rilascio separabile. Il sistema viene fornito sterile, è apirogeno ed è
esclusivamente monouso.
Figura 1. Plug microvascolare MVP
1 Copertura parziale
2 Marker distale
3 Dispositivo MVP
Figura 2. Dimensioni del sistema MVP
1 Lunghezza del filo di rilascio
2 Lunghezza senza restrizioni (dispositivo fuoriuscito e senza restrizioni)
3 Diametro senza restrizioni
4 Zona di distacco
5 Filo di rilascio
6 Marker prossimale
Tabella 1. Dimensioni MVP Modello Diametro senza
MVP-3Q 5,3 mm 12 mm 180 cm 1,5 mm – 3,0 mm
MVP-5Q 6,5 mm 12 mm 180 cm 3,0 mm – 5,0 mm
MVP-7Q 9,2 mm 16 mm 165 cm 5,0 mm – 7,0 mm
MVP-9Q 13,0 mm 18 mm 165 cm 7,0 mm – 9,0 mm
Tabella 2. Catetere o microcatetere consigliato Modello Catetere o microcatetere
MVP-3Q Da 0,53 mm (0,021 in) a
MVP-5Q 0,69 mm (0,027 in) (DI) 153 cm
MVP-7Q 4 Fr (1,4 mm) (DE) 120 cm
MVP-9Q 5 Fr (1,7 mm) (DE) 120 cm
restrizioni
Lunghezza
senza restrizioni
consigliato
0,69 mm (0,027 in) (DI)
Lunghezza del
filo di rilascio
Lunghezza massima del
catetere o del microcatetere
consigliato
153 cm
Diametro del
vaso target
2 Uso previsto / indicazioni per l’uso
Il sistema con plug microvascolare MVP è indicato per l’ostruzione o la riduzione del flusso
sanguigno nella sistema vascolare periferico.
3 Controindicazioni
Non sono note controindicazioni all’uso di questo dispositivo.
4 Compatibilità
Per le dimensioni del dispositivo, fare riferimento all’etichetta del prodotto del sistema MVP. Fare
riferimento alla documentazione fornita con le altre tecnologie mediche per determinare la
compatibilità.
5 Avvertenze
• La sicurezza e l’efficacia del sistema MVP non sono state valutate né per l’utilizzo cardiaco (ad
esempio, in caso di occlusione del setto cardiaco, dotto arterioso pervio, chiusura della perdita
paravalvolare) né per l’uso neurologico.
• L’utilizzo del sistema MVP è riservato ai medici esperti nelle procedure interventistiche e
angiografiche. Prima dell’utilizzo del sistema MVP, è essenziale leggere le istruzioni per l’uso.
• Utilizzare il sistema MVP prima della data di scadenza stampata sull’etichetta della confezione
del prodotto.
• Il sistema MVP è apirogeno e viene fornito sterile, a condizione che la confezione del sistema
MVP non sia stata aperta o danneggiata. Non utilizzare se la confezione non è integra o
presenta altri segni di danni.
• Esaminare il sistema MVP prima dell’uso e smaltirlo in caso di danni o anomalie.
• Il sistema MVP è esclusivamente monouso. Non ricondizionare o risterilizzare. Il
ricondizionamento e la risterilizzazione possono aumentare il rischio di infezione del paziente
e di compromettere le prestazioni del dispositivo. Dopo l’utilizzo, smaltire il sistema MVP in
conformità con le normative ospedaliere e la legislazione vigente.
• Servirsi della fluoroscopia per l’avanzamento e la manipolazione del sistema MVP. Non fare
avanzare né ritrarre il dispositivo in caso di eccessiva resistenza finché non viene determinata
la causa di tale resistenza.
• Per evitare il distacco prematuro del dispositivo, non torcere né ruotare il filo di rilascio se non
per scollegare il dispositivo.
• Non utilizzare una siringa con iniettore automatico per l’iniezione del mezzo di contrasto con il
dispositivo attraverso il microcatetere o il catetere.
• Non fare avanzare il filo di rilascio dopo averlo scollegato dal dispositivo MVP.
• I medici devono essere pronti a gestire situazioni urgenti che richiedono la rimozione del
dispositivo. Tale preparazione include la disponibilità di un chirurgo in situ.
• Non utilizzare con cateteri il cui utilizzo è controindicato con i dispositivi embolici (ad esempio,
coil o plug).
6 Precauzioni
• Il dispositivo MVP è costituito da una lega di nickel e titanio che è generalmente considerata
sicura. Tuttavia, test in vitro hanno dimostrato che il dispositivo rilascia nickel dopo l’impianto
per almeno 60 giorni. I pazienti con allergia al nickel possono manifestare una reazione allergica
al dispositivo, in particolar modo i pazienti che presentano allergie al metallo nella loro
anamnesi. Alcune reazioni allergiche possono essere di grave entità. Informare i pazienti della
39
Page 40

necessità di contattare immediatamente il medico in caso di reazione allergica sospetta, come
nel caso di respirazione difficoltosa o infiammazione del viso o della gola. Alcuni pazienti
possono sviluppare un’allergia al nickel se il dispositivo viene impiantato.
• I medici devono ricorrere al proprio giudizio clinico nelle situazioni che riguardano l’utilizzo di
farmaci anticoagulanti o antipiastrinici prima, durante o dopo l’utilizzo del dispositivo.
• Prestare particolare attenzione nelle seguenti categorie:
– Per le pazienti in stato di gravidanza, assicurarsi di minimizzare l’esposizione della madre e
del feto alle radiazioni.
– Per le madri in fase di allattamento, non vi è stata alcuna valutazione quantitativa in merito al
rilascio di eventuali sostanze nel latte materno dopo l’impianto del dispositivo.
• Verificare la compatibilità del sistema MVP con gli eventuali dispositivi aggiuntivi utilizzati nelle
procedure intravascolari. L’utilizzo del sistema MVP è riservato ai medici esperti nelle tecniche
percutanee e intravascolari, nonché nelle possibili complicazioni associate alla procedura.
• Idratare il sistema MVP prima dell’uso.
• Utilizzare il sistema MVP con cautela onde evitare il rischio di danni accidentali.
• È possibile dover ricorrere a forze di spinta maggiori se il dispositivo viene utilizzato con cateteri
o microcateteri compositi in Nitinol dotati di scanalature.
• Prima dell’uso, verificare che il diametro dei dispositivi accessori sia compatibile con il sistema
MVP.
7 Possibili effetti collaterali
I possibili effetti collaterali che possono verificarsi durante o dopo la procedura di posizionamento
di questo dispositivo includono, tra gli altri:
• Embolia gassosa
• Reazione allergica o tossicità
• Emorragia
• Decesso
• Migrazione del dispositivo
• Febbre
• Embolizzazione di materiale estraneo
• Infezione
• Occlusione di un vaso diverso dal vaso target
• Embolia periferica
• Ricanalizzazione
• Flusso residuo
• Ictus o attacco ischemico transitorio (TIA)
• Intervento chirurgico
• Complicazioni del sito di accesso vascolare
• Trauma o perforazione del vaso
8 Materiali richiesti
1. Il rilascio del sistema MVP richiede l’utilizzo di un microcatetere o di un catetere (fare
riferimento alla Tabella 2 per le dimensioni consigliate).
2. Sono inoltre richiesti gli accessori elencati di seguito:
• Soluzione fisiologica eparinizzata
• Valvola emostatica girevole (RHV)
• Rubinetto di arresto a 3 vie
• Manicotto a pressione per la sacca di soluzione fisiologica
• Guaina di accesso
• Catetere guida compatibile con un microcatetere o un catetere consigliato nella Tabella 2
• Filo guida compatibile con il catetere guida e il microcatetere o il catetere
• Supporto per infusione endovenosa
9 Preparazione
1. Per le prestazioni ottimali del sistema MVP e per ridurre il rischio di complicazioni
tromboemboliche, assicurare l’irrigazione continua con soluzione fisiologica tra i seguenti
componenti:
• la guaina di accesso e il catetere guida
• il microcatetere o il catetere e il catetere guida
• il microcatetere o il catetere, il filo guida e il sistema MVP.
2. Posizionare il catetere guida appropriato secondo la procedura consigliata. Collegare una
valvola emostatica girevole (RHV) al raccordo del catetere guida. Collegare un rubinetto di
arresto a 3 vie al braccio laterale della valvola emostatica girevole. Collegare una linea per la
soluzione fisiologica eparinizzata per l’irrigazione continua.
Controllare tutte le connessioni per evitare l’ingresso di aria all’interno del catetere guida, del
3.
microcatetere o del catetere durante l’irrigazione continua.
10 Istruzioni per l’uso
1. Accedere al vaso target e, tramite angiogramma effettuato con tecniche standard, misurare il
diametro del vaso in corrispondenza del sito da sottoporre a occlusione. Assicurarsi che il
diametro del vaso target sia conforme alle dimensioni consigliate (fare riferimento alla
Tabella 1).
2. Assicurarsi che il sito da sottoporre a occlusione sia abbastanza lungo da permettere
l’impianto del dispositivo MVP senza che si verifichi l’ostruzione involontaria di altri vasi.
3. Selezionare un microcatetere o un catetere (fare riferimento alla Tabella 2 per le dimensioni
raccomandate) e prepararlo secondo le istruzioni per l’uso fornite dal fabbricante.
4. Inserire il filo guida e fare avanzare il microcatetere o il catetere lungo il filo guida fino a quando
la punta distale non si trova in prossimità dell’estremità opposta del sito da sottoporre a
occlusione.
5. Rimuovere il filo guida dal microcatetere o dal catetere.
6. Rimuovere il sistema MVP dal dispenser rimuovendo delicatamente l’introduttore giallo dalle
due clip esterne ed estrarre il sistema MVP dall’alloggiamento trasparente. Afferrare
delicatamente l’introduttore in posizione prossimale rispetto al dispositivo MVP e rimuovere
lentamente e simultaneamente il dispositivo MVP, il filo di rilascio e l’introduttore dal dispenser.
Vedere la Figura 3.
Figura 3. Sistema MVP nella confezione
1 Alloggiamento trasparente
2 Introduttore giallo
3 Filo di rilascio (all’interno
dell’introduttore)
4 Dispositivo di torsione
5 Dispenser
6 Dispositivo MVP
7. Ispezionare attentamente il sistema MVP per escludere la presenza di danni. Se il sistema
MVP risulta danneggiato, sostituirlo con un sistema MVP nuovo.
8. Irrigare il sistema MVP immergendo delicatamente l’introduttore e il dispositivo MVP per
qualche centimetro nella soluzione fisiologica eparinizzata.
9. Inserire il dispositivo MVP nell’introduttore tirando il filo di rilascio fino a coprire la punta distale
del dispositivo MVP con l’introduttore.
Nota: l’inserimento del dispositivo MVP nell’introduttore ad una profondità eccessiva potrebbe
impedirne la corretta irrigazione. L’introduttore presenta due fori, posizionati a 3 cm e 6 cm in
posizione prossimale rispetto alla punta dell’introduttore per facilitare la rimozione dell’aria e
l’irrigazione del dispositivo.
10. Introdurre il sistema MVP inserendo, attraverso la valvola emostatica girevole, l’estremità
distale dell’introduttore nel raccordo del microcatetere o del catetere fino a quando
l’introduttore non è saldamente in posizione. Serrare la valvola emostatica girevole per
impedire il riflusso sanguigno, senza tuttavia stringere eccessivamente per non danneggiare
il sistema MVP durante l’inserimento nel microcatetere o nel catetere.
11. Verificare visivamente la regolare infusione della soluzione di irrigazione. Dovrebbe essere
possibile osservare la fuoriuscita delle gocce di soluzione fisiologica dall’estremità prossimale
dell’introduttore.
12. Allentare sufficientemente la valvola emostatica girevole per permettere l’avanzamento del
sistema formato dal dispositivo MVP e dal filo di rilascio. Non allentare eccessivamente la
valvola emostatica girevole per evitare il riflusso sanguigno. Rimuovere l’introduttore
ritraendolo lungo l’estremità prossimale del filo di rilascio.
13. Far avanzare il filo di rilascio e il dispositivo MVP fino a quando il marker distale in platino del
dispositivo MVP non è allineato al marker distale presente sul microcatetere o sul catetere.
14. Verificare che i marker siano posizionati in maniera ottimale. Installare il dispositivo MVP
facendo pressione sul filo di rilascio per mantenerlo in posizione e ritraendo
40
Page 41

contemporaneamente il microcatetere o il catetere con delicatezza per fare fuoriuscire il
dispositivo MVP.
15. Se la posizione del dispositivo non è soddisfacente, procedere come segue:
a. Stabilizzare il filo di rilascio e fare avanzare il microcatetere o il catetere spostandolo in
posizione distale fino a ricatturare il dispositivo MVP nel catetere.
b. Riposizionare e installare il dispositivo oppure rimuovere il dispositivo dal paziente.
Nota: non ricatturare il dispositivo né installarlo per più di 3 volte.
16. Per il corretto distacco, il dispositivo MVP deve essere posizionato oltre la punta del
microcatetere o del catetere.
17. Se la posizione del dispositivo è soddisfacente, procedere al distacco nel modo seguente:
a. Verificare sotto fluoroscopia che la punta del microcatetere o del catetere si trovi in
posizione prossimale rispetto al dispositivo MVP.
b. Collegare il dispositivo di torsione al filo di rilascio. Scollegare il dispositivo MVP ruotando
il filo di rilascio in senso antiorario fino a quando non si separa dal dispositivo.
c. Con l’ausilio della fluoroscopia, verificare che il distacco sia avvenuto correttamente
tirando lentamente il filo di rilascio in direzione prossimale per accertarsi che il dispositivo
MVP non si muova. Qualora il dispositivo MVP dovesse muoversi in direzione prossimale,
riposizionare il dispositivo e ruotare nuovamente filo di rilascio in senso antiorario per
effettuare il distacco.
18. Mantenendo in posizione il microcatetere o il catetere, ritrarre il filo di rilascio all’interno del
microcatetere o del catetere, quindi rimuovere il filo di rilascio dal paziente. Completare la
procedura seguendo le tecniche standard.
11 Istruzioni dopo la procedura
Se il servizio MedicAlert è disponibile nell’area di residenza, invitare il paziente a registrarsi presso
www.medicalert.org. Al paziente verrà richiesto di comunicare la propria condizione clinica, il nome
del dispositivo impiantato e le limitazioni relative all’utilizzo della risonanza magnetica.
12 Informazioni sulla risonanza magnetica (RM)
12.1 Compatibilità RM condizionata
Il plug microvascolare MVP è stato riconosciuto come compatibile con la risonanza magnetica a
determinate condizioni. Test non clinici hanno dimostrato che il plug microvascolare MVP è
compatibile con la risonanza magnetica a determinate condizioni. È possibile eseguire la
scansione di un paziente in sicurezza con questo dispositivo immediatamente dopo il
posizionamento attenendosi alle seguenti condizioni:
• Campo magnetico statico di 3 Tesla o inferiore
• Campo magnetico a gradiente spaziale massimo non superiore a 9.000 gauss/cm
• Tasso di assorbimento specifico (SAR) massimo mediato sul corpo intero, rilevato nel sistema
di risonanza magnetica, pari a 4 W/kg per 15 minuti di scansione (ossia, per sequenza di
impulsi)
• Sistema per la risonanza magnetica impostato sulla modalità di funzionamento controllata di
primo livello
12.2 Riscaldamento associato alla risonanza magnetica
In test non clinici, il plug microvascolare MVP ha prodotto il seguente aumento di temperatura
durante un esame di risonanza magnetica con scansione della durata di 15 min (ossia, per
sequenza di impulsi) in un sistema per risonanza magnetica da 3 Tesla (3 Tesla/128 MHz, Excite,
HDx, Software 14X.M5, General Electric Healthcare, Milwaukee, WI): variazione massima della
temperatura: +1,8°C
Pertanto, gli esperimenti sul riscaldamento indotto dalla risonanza magnetica per il plug
microvascolare MVP a 3 Tesla, con bobina trasmittente/ricevente a radiofrequenza per il corpo e
SAR mediato sul corpo intero di 2,9 W/kg (ossia, associato a un valore mediato sul corpo intero di
2,7 W/kg misurato con calorimetro) indicano che la maggior quantità di calore emessa in
associazione a queste condizioni specifiche è stata pari o inferiore a +1,8°C.
12.3 Informazioni sugli artefatti
La qualità delle immagini ottenute tramite risonanza magnetica può risultare compromessa se
l’area di interesse si trova esattamente nella stessa area o relativamente vicina al sito del plug
microvascolare MVP. Pertanto, la presenza di questo dispositivo potrebbe rendere necessaria una
compensazione ottimizzando i parametri della risonanza magnetica. Le dimensioni massime degli
artefatti (ossia, come osservato nella sequenza di impulsi a eco di gradiente) si estendono per circa
5 mm rispetto alle dimensioni e alla forma del plug microvascolare MVP.
Sequenza di
impulsi T1-SE T1-SE GRE GRE
Dimensioni del
vuoto di segnale
Orientamento del
piano
2
252 mm
Parallelo Perpendicolare Parallelo Perpendicolare
91 mm
2
304 mm
2
116 mm
2
13 Conservazione
Durante la conservazione, evitare l’esposizione del sistema MVP ad acqua, luce solare,
temperature estreme e umidità elevata. Conservare il sistema MVP a temperatura ambiente
controllata. Consultare l’etichetta del prodotto per la data di scadenza del dispositivo. Non utilizzare
il dispositivo oltre la data di scadenza riportata sull’etichetta.
14 Materiali
Il sistema MVP non contiene materiali in lattice o PVC.
15 Esclusione dalla garanzia
Le avvertenze indicate sulle etichette del prodotto forniscono informazioni più dettagliate
a tale riguardo e sono da considerarsi parte integrante della presente Esclusione dalla
garanzia. Sebbene il prodotto sia stato fabbricato in condizioni attentamente controllate,
Medtronic non ha alcun controllo sulle condizioni in presenza delle quali il prodotto verrà
utilizzato. Medtronic non rilascia pertanto alcuna garanzia, né espressa né implicita, in
merito al prodotto, compresa, tra l’altro, qualsiasi garanzia implicita di commerciabilità o
di idoneità a determinati scopi. Medtronic non può in alcun caso essere ritenuta
responsabile nei confronti di alcun soggetto o entità per spese mediche, danni diretti,
incidentali o consequenziali causati da uso, difetti, o malfunzionamento del prodotto,
indipendentemente dal fatto che la richiesta di risarcimento di tali danni sia basata su
garanzia, contratto, fatto illecito o altro. Nessun soggetto ha facoltà di vincolare Medtronic
ad alcuna dichiarazione o garanzia relativa al prodotto.
Le esclusioni e le restrizioni di cui sopra non vanno intese, né devono essere interpretate in quanto
tali, come contrarie a norme ritenute inderogabili dalla legislazione vigente. Nel caso in cui una parte
o un termine della presente esclusione dalla garanzia venga giudicato illegale, inefficace o in
conflitto con il diritto applicabile da un organo giudiziario competente, la validità delle rimanenti parti
della presente esclusione dalla garanzia non verrà compromessa e tutti i diritti e gli obblighi
verranno interpretati ed applicati come se la presente esclusione dalla garanzia non contenesse la
parte o i termini ritenuti non validi.
Lietuviškai
1 Prietaiso aprašymas
MVP mikrokraujagyslių kamščio sistema yra savaime išsiplečiantis kraujagyslės užkimšimo
prietaisas. MVP prietaisas yra kiaušinio formos, sudarytas iš nitinolo, o abiejuose jo galuose
pritvirtintos platininės žymeklio juostos. Prietaisas turi dalinę PTFE dangą. Proksimalinė žymeklio
juosta prisitvirtina prie įstūmimo vielos, kuria prietaisas įstumiamas į numatomą gydymo vietą per
rinkoje siūlomą mikrokateterį arba kateterį. Įstūmimo viela nuo MVP prietaiso atskiriama sukant
įstūmimo vielą prieš laikrodžio rodyklę, kad ji atsisuktų nuo prietaiso.
MVP sistema supakuota kaip vientisas mazgas, kurį sudaro MVP prietaisas, įstūmimo mova ir
atskiriamoji įstūmimo viela. Sistema tiekiama sterili, nepirogeninė ir skirta tik vienkartiniam
naudojimui.
1 pav. MVP mikrokraujagyslių kamščio sistema
1 Dalinė danga
2 Distalinis žymeklis
3 MVP prietaisas
4 Atskyrimo sritis
5 Įstūmimo viela
6 Proksimalinis žymeklis
41
Page 42

2 pav. MVP sistemos matmenys
1 Įstūmimo vielos ilgis
2 Neapriboto prietaiso ilgis (prietaisas išstumtas iš movos ir niekaip neapribotas)
3 Neapriboto prietaiso skersmuo
1 lentelė. MVP matmenys Modelis Neapriboto prie-
MVP-3Q 5,3 mm 12 mm 180 cm Nuo 1,5 mm iki
MVP-5Q 6,5 mm 12 mm 180 cm Nuo 3,0 mm iki
MVP-7Q 9,2 mm 16 mm 165 cm Nuo 5,0 mm iki
MVP-9Q 13,0 mm 18 mm 165 cm Nuo 7,0 mm iki
2 lentelė. Rekomenduojamas mikrokateteris arba kateteris Modelis Rekomenduojamas mikro-
MVP-3Q Nuo 0,53 mm (0,021 in) iki
MVP-5Q 0,69 mm (0,027 in) (vid. skers-
MVP-7Q 1,4 mm (4 Fr) (išor. skersmuo) 120 cm
MVP-9Q 1,7 mm (5 Fr) (išor. skersmuo) 120 cm
taiso skersmuo
Neapriboto prietaiso ilgis
kateteris arba kateteris
0,69 mm (0,027 in) (vid. skersmuo)
muo)
Įstūmimo vielos
ilgis
Tikslinės kraujagyslės skersmuo
3,0 mm
5,0 mm
7,0 mm
9,0 mm
Didžiausias rekomenduojamo mikrokateterio arba
kateterio ilgis
153 cm
153 cm
2 Paskirtis / naudojimo indikacijos
MVP mikrokraujagyslių kamščio sistema skirta kraujo tėkmei sustabdyti arba apriboti periferinėse
kraujagyslėse.
3 Kontraindikacijos
Nėra jokių žinomų šio prietaiso naudojimo kontraindikacijų.
4 Suderinamumas
Prietaiso matmenys nurodyti MVP sistemos etiketėje. Norėdami nustatyti suderinamumą, žr. kitų
medicinos priemonių etiketes.
5 Įspėjimai
• MVP sistemos naudojimo širdies struktūroms (pvz., širdies pertvarai užkimšti, atviram
arteriniam latakui, protėkiui šalia vožtuvo uždaryti) ir neurologinėms struktūroms sauga ir
veiksmingumas nenustatyti.
• MVP sistemą turi naudoti tik gydytojai, susipažinę su angiografijos ir intervencinėmis
procedūromis. Prieš naudojant MVP sistemą, svarbu perskaityti naudojimo instrukciją.
• MVP sistemą panaudokite iki galiojimo pabaigos datos, nurodytos ant pakuotės etiketės.
• MVP sistema yra nepirogeninė ir tiekiama sterili, nebent MVP sistemos pakuotė atidaryta arba
pažeista. Jei pakuotė atidaryta arba pažeista, nenaudokite.
• Prieš naudodami apžiūrėkite MVP sistemą. Pastebėję nukrypimų nuo normos arba pažeidimą,
išmeskite.
• MVP sistema skirta tik vienkartiniam naudojimui. Neapdorokite ir nesterilizuokite pakartotinai.
Apdorojant pakartotinai arba sterilizuojant pakartotinai, gali padidėti paciento užkrėtimo ir
prastesnio prietaiso veikimo rizika. Panaudotą MVP sistemą išmeskite pagal ligoninės ir vietos
valdžios nustatytą tvarką.
• Stumdami MVP sistemą ar atlikdami jos manipuliacijas, stebėkite vaizdą fluoroskopu. Jei
pajutote per didelį pasipriešinimą, nestumkite ir netraukite prietaiso, kol nenustatysite
pasipriešinimo priežasties.
• Nesukite įstūmimo vielos, išskyrus tada, kai ketinate atskirti prietaisą, kitaip prietaisas gali
atsiskirti pirma laiko.
• Su prietaisu nenaudokite elektrinio švirkštiklio kontrastinės medžiagos tirpalui įšvirkšti per
mikrokateterį arba katerį.
• Nestumkite įstūmimo vielos atskyrę ją nuo MVP prietaiso.
• Gydytojai privalo būti pasiruošę atvejams, kai reikia skubiai pašalinti prietaisą. Šis pasiruošimas
taip pat reiškia, kad gydymo įstaigoje turi būti pasiruošęs chirurgas.
• Nenaudokite kateterių, kurių negalima naudoti embolizavimo prietaisams (pvz., ritėms arba
kamščiui).
6 Atsargumo priemonės
• MVP prietaisas sudarytas iš nikelio ir titano lydinio, kuris paprastai laikomas saugiu. Tačiau in
vitro tyrimai parodė, kad įsodinus prietaisą mažiausiai 60 dienų iš jo išsiskiria nikelio. Nikeliui
alergiškiems pacientams, ypač tiems, kuriems jau buvo pasireiškusi alergija į metalą, gali
pasireikšti alerginė reakcija į prietaisą. Kai kurios alerginės reakcijos gali būti sunkios.
Pacientams reikia nurodyti nedelsiant informuoti gydytoją įtarus, kad pasireiškė alerginė
reakcija, pvz., tapo sunku kvėpuoti arba prasidėjo veido ar gerklės uždegimas. Įsodinus
prietaisą, kai kurie pacientai gali tapti alergiški nikeliui.
• Tais atvejais, kai prieš naudojant, naudojimo metu arba panaudojus prietaisą skiriami
antikoaguliantai arba antiagregantai, dėl tolesnės eigos gydytojai turi remtis klinikiniu vertinimu.
• Atsižvelkite į atsargumo priemones atlikdami procedūrą toliau nurodytoms pacientų grupėms.
– Nėščiosios: reikia stengtis kuo daugiau sumažinti motinos ir vaisiaus apšvitą.
– Žindyvės: išplautų medžiagų kiekis motinos piene kiekybiškai neįvertintas.
• Kai atlikdami intravaskulines procedūras naudojate kitus pagalbinius prietaisus, patikrinkite
MVP sistemos suderinamumą. MVP sistemą naudojantys gydytojai privalo būti susipažinę su
perkutaniniais, intravaskuliniais metodais ir galimomis komplikacijomis, susijusiomis su
procedūra.
• Prieš naudojant MVP sistemą reikia sudrėkinti.
• MVP sistemą naudokite atsargiai, kad sumažintumėte atsitiktinio pažeidimo tikimybę.
• Naudojant sudėtinius mikrokateterius arba kateterius su plyšine nitinolo konstrukcija, gali
reikėti stumti didesne jėga.
• Prieš naudodami bet kokį papildomą prietaisą, patikrinkite, ar jis suderintas su MVP sistema.
7 Galimi nepageidaujami poveikiai
Toliau išvardyti galimi nepageidaujami reiškiniai, galintys pasireikšti per šio prietaiso įterpimo
procedūrą arba ją atlikus (sąrašas negalutinis).
• Oro embolija
• Alerginė reakcija arba toksinis poveikis
• Kraujavimas
• Mirtis
• Prietaiso pasislinkimas
• Karščiavimas
• Pašalinių medžiagų sukelta embolija
• infekcija,
• Nenumatytos kraujagyslės užkimšimas
• Periferinės kraujagyslės embolija
• Rekanalizacija
• Likutinė tėkmė
• Insultas arba praeinantis smegenų išemijos priepuolis (PSIP)
• Chirurginio įsikišimo būtinybė
• Prieigos per kraujagyslę vietos komplikacija
• Kraujagyslės trauma arba pradūrimas
8 Reikalingos medžiagos
1. MVP sistemai įterpti reikalingas mikrokateteris arba kateteris (rekomenduojamą dydį žr.
2 lent.).
2. Reikalingos toliau nurodytos papildomos priemonės.
• Heparinu papildytas fiziologinis tirpalas
• Sukamasis hemostatinis vožtuvas (RHV)
• Trikryptis čiaupas
• Fiziologinio tirpalo maišelio slėginis veržiklis
42
Page 43

• Prieigos mova
• Kreipiamasis kateteris, suderintas su mikrokateteriu arba kateteriu, kuris
rekomenduojamas 2 lent.
• Kreipiamoji viela, suderinta su kreipiamuoju kateteriu ir mikrokateteriu arba kateteriu
• Intraveninės (IV) infuzijos stovas
9 Pasiruošimas
1. Kad užtikrintumėte optimalų MVP sistemos veikimą ir sumažintumėte tromboembolinių
komplikacijų riziką, nustatykite nuolatinį plovimą fiziologiniu tirpalu tarp šių elementų:
• prieigos movos ir kreipiamojo kateterio;
• mikrokateterio arba kateterio ir kreipiamojo kateterio;
• mikrokateterio arba kateterio, kreipiamosios vielos ir MVP sistemos.
2. Įterpkite tinkamą kreipiamąjį kateterį laikydamiesi rekomenduojamos procedūros. Prijunkite
sukamąjį hemostatinį vožtuvą (RHV) prie kreipiamojo kateterio jungties. Prijunkite trikryptį
čiaupą prie RHV šoninės jungties. Prijunkite heparinu papildyto fiziologinio tirpalo liniją
nuolatiniam plovimui.
3. Patikrinkite visas jungtis ir įsitikinkite, kad atliekant nuolatinį plovimą į kreipiamąjį kateterį,
mikrokateterį arba kateterį nepatenka oro.
10 Naudojimo nurodymai
1. Pasiekite tikslinę kraujagyslę ir taikydami standartinį metodą atlikite angiografiją, kad
išmatuotumėte kraujagyslės skersmenį užkimštinoje vietoje. Įsitikinkite, kad tikslinė
kraujagyslė atitinka rekomenduojamą skersmenį (žr. 1 lent.).
2. Įsitikinkite, kad užkimština vieta yra pakankamo ilgio, kad MVP prietaisą būtų galima įsodinti
neužkemšant nenumatytų kraujagyslių.
3. Pasirinkite mikrokateterį arba kateterį (rekomenduojamą dydį žr. 2 lent.) ir paruoškite jį pagal
gamintojo pateiktą naudojimo instrukciją.
4. Įkiškite kreipiamąją vielą ir stumkite ant jos užmautą mikrokateterį arba kateterį, kol distalinis
galiukas atsidurs šalia priekinio užkimštinos vietos krašto.
5. Ištraukite kreipiamąją vielą iš mikrokateterio arba kateterio.
6. Atsargiai išimdami geltoną įstūmimo movą iš dviejų išorinių spaustukų išimkite MVP sistemą iš
išdavimo vamzdelio, tada ištraukite MVP sistemą iš skaidraus laikymo vamzdelio. Atsargiai
suimkite įstūmimo movą proksimaliau MVP prietaiso esančioje vietoje ir iš lėto vienu metu
ištraukite MVP prietaisą, įstūmimo vielą ir įstūmimo movą iš išdavimo vamzdelio. Žr. 3 pav.
3 pav. Supakuota MVP sistema
12. Atlaisvinkite RHV tiek, kad galėtumėte vienu metu stumti MVP prietaisą ir įstūmimo vielą.
Tačiau neatlaisvinkite RHV tiek, kad kraujas galėtų tekėti atgal. Ištraukite įstūmimo movą,
numaudami ją nuo įstūmimo vielos proksimalinio galo.
13. Stumkite įstūmimo vielą ir MVP prietaisą, kol MVP prietaiso distalinis platininis žymeklis
susilygiuos su mikrokateterio arba kateterio distaline žymeklio juosta.
14. Įsitikinkite, kad žymeklių juostos nustatytos į optimalią padėtį. Išskleiskite MVP prietaisą,
laikydami įstūmimo vielą, kad nejudėtų, ir lėtai atitraukdami mikrokateterį arba kateterį, kad
išstumtumėte MVP prietaisą.
15. Jei prietaiso padėtis netinkama, atlikite toliau nurodytus veiksmus.
a. Stabilizuokite įstūmimo vielą ir stumkite mikrokateterį arba kateterį distaline kryptimi, kol
MVP prietaisas vėl atsidurs kateteryje.
b. Pakeiskite prietaiso padėtį ir jį išskleiskite arba pašalinkite prietaisą iš paciento.
Pastaba. Prietaisą kartotinai įtraukti ir išskleisti galima daugiausia 3 kartus.
16. Kad būtų galima tinkamai atskirti, MVP prietaisas turi būti nustatytas į padėtį už mikrokateterio
arba kateterio galiuko.
17. Jei prietaiso padėtis tinkama, vykdykite atskyrimą atlikdami toliau nurodytus veiksmus.
a. Apžiūrėdami fluoroskopu įsitikinkite, kad mikrokateterio arba kateterio galiukas yra
proksimalinėje MVP prietaiso pusėje.
b. Pritvirtinkite suktuvą prie įstūmimo vielos. Atskirkite MVP prietaisą, sukdami įstūmimo
vielą prieš laikrodžio rodyklę, kol ji atsiskirs nuo prietaiso.
c. Apžiūrėdami fluoroskopu patikrinkite, ar pavyko sėkmingai atskirti – iš lėto traukite
įstūmimo vielą proksimaline kryptimi ir įsitikinkite, kad MVP prietaisas nejuda. Jei mažai
tikėtinu atveju MVP prietaisas judėtų proksimaline kryptimi, iš naujo nustatykite prietaiso
padėtį ir dar kartą sukite įstūmimo vielą prieš laikrodžio rodyklę, kad ji atsiskirtų.
18. Laikydami mikrokateterį arba kateterį, kad nejudėtų, įtraukite įstūmimo vielą į mikrokateterį
arba kateterį, tada ištraukite įstūmimo vielą iš paciento. Užbaikite procedūrą taikydami
standartinį metodą.
11 Poprocedūriniai nurodymai
Jei jūsų regione teikiama paslauga „MedicAlert“, rekomenduokite pacientui apsilankyti adresu
www.medicalert.org ir tapti „MedicAlert“ nariu. Paciento bus paprašyta nurodyti savo sveikatos
būklę, įsodintą prietaisą ir apribojimus dėl MRT naudojimo.
12 Informacija apie MRT
12.1 Sąlyginai saugus MR aplinkoje
1 Skaidrus laikymo vamzdelis
2 Geltona įstūmimo mova
3 Įstūmimo viela (įstūmimo movos viduje)
7. Atidžiai apžiūrėkite, ar MVP sistema nepažeista. Jei MVP sistema pažeista, pakeiskite ją nauja
MVP sistema.
8. Praplaukite MVP sistemą, atsargiai panardindami įstūmimo movą ir MVP prietaisą kelis
centimetrus į heparinu papildytą fiziologinį tirpalą.
9. Traukdami įstūmimo vielą įtraukite MVP prietaisą į įstūmimo movą tik tiek, kad įstūmimo mova
uždengtų MVP prietaiso distalinį galiuką.
Pastaba. Jei MVP prietaisas į įstūmimo movą bus įtrauktas per giliai, jis gali būti netinkamai
plaunamas. Dvi įstūmimo movos skylutės, esančios 3 cm ir 6 cm atstumu nuo proksimalinio
movos galiuko, padeda išstumti orą ir plauti prietaisą.
10. Įkiškite MVP sistemą, kišdami distalinį įstūmimo movos galą per RHV į mikrokateterio arba
kateterio jungtį, kol mova tvirtai įsistatys. Priveržkite RHV pakankamai stipriai, kad kraujas
nepratekėtų atgal, tačiau ne per stipriai, kad nepažeistumėte MVP sistemos įterpdami ją į
mikrokateterį arba kateterį.
11. Apžiūrėkite, ar praplovimo tirpalo infuzija vyksta normaliai. Per proksimalinį įstūmimo movos
galą turi lašėti fiziologinis tirpalas.
4 Suktuvas
5 Išdavimo vamzdelis
6 MVP prietaisas
Nustatyta, kad MVP mikrokraujagyslių kamštis yra sąlyginai saugus MR aplinkoje. Neklinikiniai
tyrimai parodė, kad MVP mikrokraujagyslių kamščio prietaisas yra sąlyginai saugus MR aplinkoje.
Atlikus įsodinimo procedūrą, pacientą su šiuo prietaisu iškart galima saugiai skenuoti toliau
nurodytomis sąlygomis.
• Statinio magnetinio lauko magnetinio srauto tankis – 3 teslos arba mažiau
• Didžiausias erdvinis magnetinio lauko gradientas – 9 000 Gs/cm arba mažesnis
• Didžiausia MR sistemos pranešama viso kūno vidutinė savitosios sugerties sparta (SSS)
atliekant 15 minučių tyrimą (t. y. per vieną impulsų seką) – 4 W/kg
• MR sistemos pirmo lygio valdomas darbo režimas
12.2 Su MRT susijęs kaitimas
Neklinikiniai tyrimai parodė, kad atlikus 15 min trukmės MRT tyrimą (t. y. viena impulsų seka) su
3 teslų MR sistema (3 teslos / 128 MHz, „Excite“, „HDx“, programinė įranga 14X.M5, „General
Electric Healthcare“, Milvokis, WI) MVP mikrokraujagyslių kamščio prietaiso temperatūra pakilo
šiuo dydžiu: didžiausias temperatūros pokytis – +1,8°C
Taigi, su MRT kaitimu susiję bandymai, atlikti su MVP mikrokraujagyslių kamščio prietaisu 3 teslų
magnetiniame lauke, naudojant viso kūno RD perdavimo / priėmimo ritę, kai MR sistemos pranešta
viso kūno vidutinė SSS yra 2,9 W/kg (t. y. atitinka kalorimetriniu metodu nustatytą viso kūno vidutinę
2,7 W/kg vertę), parodė, kad didžiausias kaitimas, pasireiškęs šiomis konkrečiomis sąlygomis,
buvo ne didesnis nei +1,8°C.
12.3 Informacija apie artefaktus
MR vaizdo kokybė gali būti prastesnė, jei tiriamoji sritis visiškai sutampa su MVP mikrokraujagyslių
kamščio prietaiso vieta arba yra santykinai arti jos. Todėl gali reikėti optimizuoti MR tomografijos
parametrus, kad būtų kompensuotas šio įtaiso buvimas. Didžiausias artefaktas (t. y. matomas
gradientinio aido impulsų sekoje) tęsiasi maždaug 5 mm ir atitinka MVP mikrokraujagyslių kamščio
prietaiso dydį bei formą.
43
Page 44

Impulsų seka T1-SE T1-SE GRE GRE
Signalo neskleidžiančios srities
dydis
Plokštumos
padėtis
2
252 mm
Lygiagreti Statmena Lygiagreti Statmena
91 mm
2
304 mm
2
116 mm
2
13 Laikymas
Laikant MVP sistema turi būti apsaugota nuo vandens, saulės šviesos, itin žemos ir itin aukštos
temperatūros ir didelio drėgnio. MVP sistemą laikykite reguliuojamoje kambario temperatūroje.
Atkreipkite dėmesį į prietaiso galiojimo pabaigos datą, nurodytą gaminio etiketėje. Nenaudokite
prietaiso praėjus etiketėje nurodytai galiojimo pabaigos datai.
14 Medžiagos
MVP sistema pagaminta nenaudojant jokių latekso arba PVC medžiagų.
15 Atsisakymas suteikti garantiją
Gaminio etiketėse esančiuose įspėjimuose pateikiama išsamesnė informacija ir jie laikomi
neatsiejama šio atsisakymo suteikti garantiją dalimi. Nors gaminys pagamintas laikantis
griežtai kontroliuojamų sąlygų, „Medtronic“ negali kontroliuoti šio gaminio naudojimo
sąlygų. Todėl „Medtronic“ nesuteikia jokių aiškiai išreikštų ar numanomų garantijų dėl šio
gaminio, įskaitant bet kokią numanomą garantiją dėl perkamumo ar tinkamumo
konkrečiam tikslui, bet tuo neapsiribojant. „Medtronic“ nėra atsakinga asmenims ar
įmonėms už medicinines išlaidas, tiesioginius, atsitiktinius ar netiesioginius nuostolius,
patirtus dėl gaminio naudojimo, defekto, neveikimo ar sutrikimo, neatsižvelgiant į tai, ar
pretenzija dėl tokių nuostolių paremta garantija, sutartimi, deliktu ar kitu pagrindu. Joks
asmuo neturi teisės įpareigoti „Medtronic“ atstovauti gaminiui arba suteikti kokią nors kitą
garantiją dėl jo.
Pirmiau išdėstytos išimtys bei apribojimai nėra ir nelaikytini prieštaraujančiais privalomosioms
taikomo įstatymo nuostatoms. Jei kurią nors šio atsisakymo suteikti garantiją dalį arba sąlygą
kompetentingos jurisdikcijos teismas paskelbtų neteisėta, neįgyvendinama arba prieštaraujančia
galiojantiems įstatymams, tai neturės poveikio likusių šio atsisakymo suteikti garantiją dalių
galiojimui, o visos teisės ir įsipareigojimai bus aiškinami ir įgyvendinami taip, lyg šiame atsisakyme
suteikti garantiją nebūtų negaliojančia paskelbtos dalies arba sąlygos.
Latviski
1 Ierīces apraksts
MVP mikrovaskulārā noslēga sistēma ir pašizpletoša asinsvadu oklūzijas ierīce. MVP ierīcei ir ovāla
forma, tā ir izgatavota no nitinola un abos galos nostiprināta ar platīna marķiera joslām. Ierīcei ir
daļējs pārsegs, kas izgatavots no PTFE. Proksimālā marķiera josla tiek piestiprināta pie
ievadstīgas, ar kuru ierīce tiek bīdīta caur tirdzniecībā pieejamu mikrokatetru vai katetru līdz
paredzētajai terapijas vietai. Lai atvienotu vadītājstīgu no MVP ierīces, vadītājstīga ir jāgriež pretēji
pulksteņrādītāju kustības virzienam, lai to noskrūvētu no ierīces.
MVP sistēma ir iepakota kā viens veselums, kurā ietilpst MVP ierīce, ievadslūžas un atvienojama
vadītājstīga. Šī sistēma tiek piegādāta sterila, nepirogēna un ir paredzēta tikai vienreizējai
lietošanai.
1. att. MVP mikrovaskulārais noslēgs
1 Daļējs pārsegs
2 Distālais marķieris
3 MVP ierīce
4 Atvienošanas zona
5 Ievadstīga
6 Proksimālais marķieris
2. att. MVP sistēmas izmēri
1 Vadītājstīgas garums
2 Garums bez ierobežojumiem (ierīce nav ievietota ievadslūžās un tai nav ierobežojumu)
3 Diametrs bez ierobežojumiem
1. tab. MVP izmēri Modelis Diametrs bez
MVP-3Q 5,3 mm 12 mm 180 cm 1,5 mm–3,0 mm
MVP-5Q 6,5 mm 12 mm 180 cm 3,0 mm–5,0 mm
MVP-7Q 9,2 mm 16 mm 165 cm 5,0 mm–7,0 mm
MVP-9Q 13,0 mm 18 mm 165 cm 7,0 mm–9,0 mm
2. tab. Ieteicamais mikrokatetrs vai katetrs Modelis Ieteicamais mikrokatetrs vai
MVP-3Q no 0,021 in (0,53 mm) līdz
MVP-5Q 0,027 in (0,69 mm) (ID) 153 cm
MVP-7Q 4 Fr (1,4 mm) (OD) 120 cm
MVP-9Q 5 Fr (1,7 mm) (OD) 120 cm
ierobežojumiem
Garums bez
ierobežojumiem
katetrs
0,027 in (0,69 mm) (ID)
Ievadstīgas
garums
Ieteicamā mikrokatetra vai
katetra maksimālais garums
153 cm
Mērķa asinsvada diametrs
2 Paredzētais lietojums/lietošanas indikācijas
MVP mikrovaskulārā noslēga sistēma ir indicēta asins plūsmas apturēšanai vai samazināšanai
perifērajos asinsvados.
3 Kontrindikācijas
Nav zināmas ar šīs ierīces lietošanu saistītas kontrindikācijas.
4 Saderība
Ierīces izmērus skatiet uz MVP sistēmas marķējuma. Lai noteiktu saderību, skatiet citu medicīnas
tehnikas ierīču marķējumus.
5 Brīdinājumi
• MVP sistēmas izmantošanas drošība un efektivitāte nav noteikta attiecībā uz izmantošanu sirdī
(piemēram, sirds starpsienas oklūzijai, atvērtam arteriālajam vadam, perivalvulāras noplūdes
slēgšanai) un neiroloģiskam izmantojumam.
• MVP sistēmu drīkst izmantot tikai ārsti, kas apguvuši angiogrāfijas un intervences procedūras.
Pirms MVP sistēmas lietošanas ir jāizlasa lietošanas pamācība.
• Izmantojiet MVP sistēmu līdz derīguma termiņa beigām, kas norādīts uz iepakojuma etiķetes.
• MVP sistēma ir nepirogēna un tiek piegādāta sterila, ja vien MVP sistēmas iepakojums nav
atvērts vai bojāts. Nelietojiet izstrādājumu, ja iepakojums ir atvērts vai bojāts.
• Pārbaudiet MVP sistēmu pirms lietošanas un atbrīvojieties no tās, ja ir konstatējamas novirzes
no normas vai bojājumi.
• MVP sistēma ir paredzēta tikai vienreizējai lietošanai. To nedrīkst atkārtoti apstrādāt vai
sterilizēt. Atkārtota apstrāde un atkārtota sterilizēšana var palielināt pacienta inficēšanas un
ierīces darbības pasliktināšanās risku. Pēc MVP sistēmas lietošanas atbrīvojieties no tās
atbilstoši slimnīcā un valstī spēkā esošajiem noteikumiem.
• Virzot MVP sistēmu vai veicot manipulācijas ar to, izmantojiet fluoroskopijas kontroli. Ja
konstatējat pārmērīgu pretestību, nevirziet ierīci uz priekšu un neizvelciet to, kamēr nav noteikts
pretestības iemesls.
• Ievadstīgu drīkst savērpt vai pagriezt tikai tad, ja tas tiek darīts, lai atvienotu ierīci, jo pretējā
gadījumā ierīce var priekšlaicīgi atvienoties.
• Neizmantojiet automātisko šļirci, lai injicētu kontrastvielu ar ierīci caur mikrokatetru vai katetru.
• Nevirziet ievadstīgu uz priekšu pēc tam, kad tā ir atvienota no MVP ierīces.
44
Page 45

• Ārstiem ir jābūt gataviem rīcībai ārkārtas situācijās, kad nepieciešama ierīces izņemšana.
Slimnīcā ir jābūt pieejamai arī ķirurģiskai palīdzībai.
• Nelietojiet ar katetriem, kas kontrindicēti izmantošanai ar emboliskām ierīcēm (piemēram,
spirālēm vai noslēgu).
6 Piesardzības pasākumi
• MVP ierīce ir izgatavota no niķeļa-titāna sakausējuma, kas kopumā tiek uzskatīts par drošu.
Tomēr in-vitro testēšanas rezultāti liecina, ka no šīs ierīces izdalās niķelis, ja ierīces
implantēšanas ilgums ir vismaz 60 dienas. Pacientiem, kuriem ir zināma alerģija pret niķeli, var
būt alerģiska reakcija pret šo ierīci, it īpaši tiem pacientiem, kuriem ir bijušas alerģiskas
reakcijas pret metāliem. Noteiktas alerģiskas reakcijas var būt nopietnas; pacienti ir jāinstruē
nekavējoties informēt ārstu, ja rodas aizdomas par alerģisku reakciju, piemēram, ir apgrūtināta
elpošana, vai arī sejas vai rīkles iekaisums. Dažiem pacientiem var izveidoties alerģija pret
niķeli, ja ierīce tiek implantēta.
• Ja pirms ierīces izmantošanas, tās laikā vai pēc tās ir nepieciešams izmantot antikoagulantus
vai antiagregantus, ārstam ir jāveic klīniskais novērtējums.
• Attiecībā uz tālāk minētajām pacientu grupām ir jāievēro īpaša piesardzība.
– Grūtnieces — jānodrošina, lai paciente un auglis saņemtu pēc iespējas mazāku starojuma
devu.
– Sievietes, kas baro bērnu ar krūti — nav veikta kvantitatīva izvērtēšana par izdalīto vielu
klātbūtni mātes pienā pēc šīs ierīces implantēšanas.
• Izmantojot citas palīgierīces intravaskulārās procedūrās, pārliecinieties par MVP sistēmas
saderību. Ārstiem, kas izmanto MVP sistēmu, ir jāpārzina perkutānās, intravaskulārās metodes
un iespējamās komplikācijas, kas saistītas ar šo procedūru.
• Pirms MVP sistēmas lietošanas ir jāveic tās hidratācija.
• Lietojot MVP sistēmu, ievērojiet piesardzību, lai samazinātu nejaušas bojājumu izraisīšanas
iespējamību.
• Izmantojot sistēmu kopā ar rievotiem nitinola kompozītmateriāla mikrokatetriem vai katetriem,
pastāv lielāku bīdes spēku iespējamība.
• Pirms palīgierīču izmantošanas pārliecinieties, vai to diametrs atbilst MVP sistēmai.
7 Iespējamie nevēlamie notikumi
Ierīces ievietošanas procedūras laikā vai pēc tās var rasties šādas (bet ne tikai) nevēlamas
blakusparādības:
• gaisa emboli;
• alerģiska reakcija vai toksiska iedarbība;
• asiņošana;
• nāve;
• ierīces migrācija;
• drudzis;
• svešķermeņu embolizācija;
• infekcija;
• neplānota asinsvada oklūzija;
• perifērā embolija;
• rekanalizācija;
• nepilnīga plūsmas apturēšana;
• insults vai transitīva išēmiska lēkme (TIL);
• ķirurģiska iejaukšanās;
• komplikācijas ievadīšanas vietā;
• asinsvada trauma vai perforācija.
8 Nepieciešamie materiāli
1. Lai ievietotu MVP sistēmu, ir jāizmanto mikrokatetrs vai katetrs (ieteicamo izmēru skatiet
2. tab.).
2. Ir nepieciešami tālāk minētie piederumi.
• Heparinizēts fizioloģiskais šķīdums
• Rotējošs hemostatiskais vārsts (Rotating Hemostatic Valve — RHV)
• Trīsvirzienu noslēgkrāns
• Fizioloģiskā šķīduma maisa spiediena manšete
• Piekļuves ievadslūžas
• Ar mikrokatetru vai katetru (ieteicamos mikrokatetrus un katetrus skatiet 2. tab.) saderīgs
vadītājkatetrs
• Ar vadītājkatetru un mikrokatetru vai katetru saderīga vadītājstīga
• Intravenozās (IV) infūzijas statīvs
9 Sagatavošana
1. Lai nodrošinātu MVP sistēmas optimālu darbību un samazinātu trombembolisku komplikāciju
risku, nodrošiniet nepārtrauktu fizioloģiskā šķīduma plūsmu starp šādiem elementiem:
• piekļuves ievadslūžas un vadītājkatetrs;
• mikrokatetrs vai katetrs un vadītājkatetrs;
• mikrokatetrs vai katetrs, vadītājstīga un MVP sistēma.
2. Ievietojiet piemērotu vadītājkatetru, izpildot ieteicamo procedūru. Pievienojiet rotējošo
hemostatisko vārstu (RHV) vadītājkatetra pieslēgvietai. Pievienojiet trīsvirzienu noslēgkrānu
RHV sānu atzaram. Pievienojiet heparinizēta fizioloģiskā šķīduma caurulīti, lai nodrošinātu
nepārtrauktu skalošanu.
3. Pārbaudiet visus savienojumus, lai nepārtrauktās skalošanas laikā novērstu gaisa iekļūšanu
vadītājkatetrā, mikrokatetrā vai katetrā.
10 Norādījumi par lietošanu
1. Piekļūstiet mērķa asinsvadam un veiciet angiogrammas procedūru, izmantojot standarta
metodi, lai izmērītu asinsvada diametru vajadzīgajā oklūzijas vietā. Pārliecinieties, vai mērķa
asinsvads atbilst ieteicamajam diametram (skatiet 1. tab.).
2. Nodrošiniet, lai oklūzijas vieta būtu pietiekami gara un implantētā MVP ierīce nenosprostotu
citus asinsvadus.
3. Izvēlieties mikrokatetru vai katetru (ieteicamo izmēru skatiet 2. tab.) un sagatavojiet to
atbilstoši ražotāja sniegtajiem lietošanas norādījumiem.
4. Ievietojiet vadītājstīgu un virziet mikrokatetru vai katetru pa vadītājstīgu, līdz distālais gals
sasniedz oklūzijas vietas priekšējo malu.
5. Izņemiet vadītājstīgu no mikrokatetra vai katetra.
6. Izņemiet MVP sistēmu no uzglabāšanas caurulītes, uzmanīgi izņemot dzeltenās ievadslūžas
no divām ārējām spailēm, un izvelciet MVP sistēmu no caurspīdīgā caurulītes korpusa.
Uzmanīgi satveriet ievadslūžas vietā, kas atrodas proksimāli MVP ierīcei, un lēnām izņemiet
MVP ierīci, ievadstīgu un ievadslūžas kopā kā vienu veselumu no uzglabāšanas caurulītes.
Skatiet 3. att.
3. att. Iepakota MVP sistēma
1 Caurspīdīga uzglabāšanas caurulīte
2 Dzeltenas ievadslūžas
3 Ievadstīga (ievadslūžās)
4 Pagriešanas ierīce
5 Uzglabāšanas caurulīte
6 MVP ierīce
7. Rūpīgi pārbaudiet, vai MVP sistēma nav bojāta. Ja MVP sistēma ir bojāta, nomainiet to pret
jaunu MVP sistēmu.
8. Veiciet MVP sistēmas skalošanu, uzmanīgi iegremdējot dažus centimetrus ievadslūžu un
MVP ierīci heparinizētā fizioloģiskajā šķīdumā.
9. Ievelciet MVP ierīci ievadslūžās, velkot ievadstīgu, līdz ievadslūžas nosedz MVP ierīces
distālo galu.
Piezīme: ja MVP ierīce tiek ievilkta ievadslūžās pārāk tālu, tā var netikt skalota pareizi. Abas
ievadslūžu atveres, kas atrodas proksimāli 3 cm un 6 cm attālumā no ievadslūžu gala, atvieglo
gaisa izvadīšanu un ierīces skalošanu.
10. Ievietojiet MVP sistēmu, ievietojot ievadslūžu distālo galu caur rotējošo hemostatisko vārstu
(RHV) mikrokatetra vai katetra savienojuma pieslēgvietā, līdz ievadslūžas ir stingri ievietotas.
Pievelciet rotējošo hemostatisko vārstu (RHV) pietiekami cieši, lai novērstu asiņu
atpakaļplūsmu, bet ne pārāk cieši, lai netiktu izraisīti MVP sistēmas bojājumi, kas tā tiek
ievietota mikrokatetrā vai katetrā.
11. Vizuāli pārbaudiet, vai skalošanas šķīduma infūzija notiek pareizi. No ievadslūžu proksimālā
gala ir jāpil fizioloģiskā šķīduma lāsēm.
12. Atlaidiet vaļīgāk rotējošo hemostatisko vārstu (RHV), lai MVP ierīci un ievadstīgu varētu virzīt
kopā kā sistēmu. Rotējošo hemostatisko vārstu (RHV) nedrīkst atlaist pārāk vaļīgi, jo pretējā
45
Page 46

gadījumā var rasties asiņu atpakaļplūsma. Izņemiet ievadslūžas, izvelkot tās pāri ievadstīgas
proksimālajam galam.
13. Virziet ievadstīgu un MVP ierīci, līdz MVP ierīces distālais platīna marķieris ir savietots ar
mikrokatetra vai katetra distālā marķiera joslu.
14. Pārliecinieties, vai marķiera joslu novietojums ir pareizs. Izvietojiet MVP ierīci, uzturot uz
priekšu vērstu spiedienu uz ievadstīgu, vienlaikus lēni atvelkot mikrokatetru vai katetru, lai
MVP ierīci izvadītu no katetra.
15. Ja ierīces novietojums nav apmierinošs, veiciet tālāk norādītās darbības.
a. Stabilizējiet ievadstīgu un virziet mikrokatetru vai katetru, pārvietojot to distāli, līdz MVP
ierīce no jauna ir ievietota katetrā.
b. Mainiet ierīces novietojumu un izvērsiet to vai arī izvelciet ierīci no pacienta ķermeņa.
Piezīme: ierīces atkārtotu ievietošanu katetrā un izvēršanu drīkst veikt ne vairāk kā
3 reizes.
16. Lai pareizi veiktu atvienošanu, MVP ierīcei jābūt novietotai aiz mikrokatetra vai katetra gala.
17. Ja ierīces novietojums ir apmierinošs, atvienojiet to, veicot tālāk minētās darbības.
a. Fluoroskopijas kontrolē apstipriniet, ka mikrokatetra vai katetra gals atrodas proksimāli
MVP ierīcei.
b. Pievienojiet pagriešanas ierīci pie ievadstīgas. Atvienojiet MVP ierīci, griežot ievadstīgu
pretēji pulksteņrādītāju kustības virzienam, līdz tā atdalās no ierīces.
c. Pārliecinieties par sekmīgu atvienošanu fluoroskopijas kontrolē, lēni velkot ievadstīgu
proksimālā virzienā, lai pārliecinātos, vai MVP ierīce nekustas. Ja MVP ierīce tomēr
pārvietojas proksimālā virzienā, no jauna novietojiet ierīci un atkārtojiet ievadstīgas
griešanu pretēji pulksteņrādītāju kustības virzienam, lai atvienotu ievadstīgu.
18. Turot mikrokatetru vai katetru tā vietā, ievelciet ievadstīgu mikrokatetrā vai katetrā un pēc tam
izvelciet ievadstīgu no pacienta ķermeņa. Pabeidziet procedūru, ievērojot standarta metodi.
11 Norādījumi pēc procedūras
Ja jūsu reģionā ir pieejams MedicAlert pakalpojums, iesakiet pacientam kļūt par MedicAlert
dalībnieku vietnē www.medicalert.org. Pacientam būs jānorāda savs veselības stāvoklis,
implantētās ierīces nosaukums un ierobežojumi attiecībā uz magnētiskās rezonanses
attēldiagnostiku.
12 Informācija par magnētiskās rezonanses attēldiagnostiku
12.1 Nosacīta saderība ar magnētisko rezonansi
Ir noteikts, ka MVP mikrovaskulārais noslēgs ir nosacīti saderīgs ar magnētisko rezonansi.
Neklīniskas testēšanas rezultāti liecina, ka MVP mikrovaskulārā noslēga ierīce ir nosacīti saderīga
ar magnētisko rezonansi. Pacientu ar šo ierīci var droši skenēt tūlīt pēc ierīces ievietošanas,
ievērojot tālāk norādītos nosacījumus.
• Statiskais magnētiskais lauks ir 3 T vai mazāks
• Maksimālais telpiskā gradienta magnētiskais lauks ir 9000 gausi/cm vai mazāks
• Maksimālais magnētiskās rezonanses sistēmas ziņotais visa ķermeņa vidējotais īpatnējās
absorbcijas ātrums, skenējot 15 minūtes, ir 4 W/kg (atbilstoši impulsu sekvencei).
• Magnētiskās rezonanses sistēmas pirmā līmeņa kontrolēts darbības režīms
12.2 Ar magnētiskās rezonanses attēldiagnostiku saistīta sakaršana
Neklīniskajās pārbaudēs MVP mikrovaskulārā noslēga ierīce 15 min ilga MR attēldiagnostikas
izmeklējuma laikā (uz impulsu sekvenci) 3 teslu magnētiskās rezonanses sistēmā (3
teslas/128 MHz, Excite, HDx, programmatūra 14X.M5, General Electric Healthcare, Milwaukee,
WI): augstākās temperatūras izmaiņas +1,8°C
Tāpēc ar MR attēldiagnostiku saistītie sakaršanas eksperimenti MVP mikrovaskulārā noslēga
ierīcei pie 3 teslām, izmantojot raidošu/uztverošu RF ķermeņa spoli MR sistēmā, uzrādīja visa
ķermeņa vidējoto īpatnējās absorbcijas ātrumu 2,9 W/kg (saistībā ar visa ķermeņa vidējo vērtību
2,7 W/kg, kas tika noteikta ar kalorimetriju), kas norādīja, ka lielākā sakaršana, kas notika šajos
specifiskajos apstākļos, bija vienāda ar vērtību +1,8°C vai mazāka par to.
12.3 Informācija par artefaktiem
Ja interesējošais apgabals atrodas tieši tajā pašā vietā, kur atrodas MVP mikrovaskulārā noslēga
ierīce, vai relatīvi tuvu tai, var tikt ietekmēta MR attēla kvalitāte. Tāpēc, lai kompensētu šīs ierīces
klātbūtni, var būt nepieciešama MR attēldiagnostikas parametru optimizācija. Maksimālais
artefakta lielums (kā redzams gradienta ehoimpulsu sekvencē) attiecībā pret MVP mikrovaskulārā
noslēga ierīces izmēru un formu palielinās par aptuveni 5 mm.
Impulsu
sekvence T1-SE T1-SE GRE GRE
Signāla neesamības zonas lielums
Plaknes orientācija
2
252 mm
Paralēli Perpendikulāri Paralēli Perpendikulāri
91 mm
2
304 mm
2
116 mm
2
13 Uzglabāšana
Uzglabāšanas laikā nepakļaujiet MVP sistēmu ūdens, tiešas saules gaismas, ļoti augstas vai
zemas temperatūras un augsta mitruma līmeņa iedarbībai. Glabājiet MVP sistēmu kontrolējamā
istabas temperatūrā. Ierīces derīguma termiņu skatiet uz ierīces etiķetes. Ja uz etiķetes norādītais
derīguma termiņš ir beidzies, neizmantojiet ierīci.
14 Materiāli
MVP sistēmas izgatavošanā nav izmantoti lateksa vai PVH materiāli.
15 Garantijas atruna
Brīdinājumi uz izstrādājuma etiķetes ietver plašāku informāciju un ir uzskatāmi par šīs
garantijas atrunas neatņemamu sastāvdaļu. Lai gan šis izstrādājums ir ražots rūpīgi
kontrolētos apstākļos, Medtronic nevar kontrolēt apstākļus, kādos šis izstrādājums tiek
lietots. Tādēļ Medtronic atsakās no visām ar izstrādājumu saistītajām tiešajām un
netiešajām garantijām, tostarp (bet ne tikai) visām netiešajām kvalitātes garantijām vai
garantijām par piemērotību noteiktam mērķim. Uzņēmums Medtronic nav atbildīgs par
fizisku vai juridisku personu medicīniskiem izdevumiem vai tiešiem, nejaušiem vai
netiešiem zaudējumiem, kas radušies izstrādājuma lietošanas laikā, defekta, kļūmes vai
darbības traucējumu dēļ, neatkarīgi no tā, vai zaudējumu atlīdzības prasības pamatojums
ir garantija, līgums, likumā noteikts atlīdzināms zaudējums vai cits pamatojums. Nevienai
personai nav tiesību saistīt uzņēmumu Medtronic ne ar kādu paziņojumu vai garantiju
attiecībā uz šo izstrādājumu.
Iepriekš minētie izņēmumi un ierobežojumi nav paredzēti un nav skaidrojami tā, lai būtu pretrunā ar
piemērojamo tiesību aktu obligātajiem nosacījumiem. Ja kāda garantijas atrunas daļa vai
noteikums tiek uzskatīts par nelikumīgu, nepiemērojamu vai ir pretrunā ar likumu kompetentas
jurisdikcijas tiesā, tas neattiecas uz pārējām šīs garantijas atrunas daļām vai noteikumiem, un visas
tiesības un saistības ir jāskaidro un jāīsteno tā, it kā garantijas atrunā nebūtu minēta par nederīgu
uzskatītā daļa vai noteikums.
Македонски
1 Опис на помагалото
MVP системот на микроваскуларен приклучок е помагало за оклузија на крвни садови
коешто се проширува самостојно. MVP помагалото има овален облик, се состои од нитинол
и е прицврстено на двата краја со платински маркер-ленти. Помагалото содржи делумен
политетрафлуороетиленски слој. Проксималната маркер-лента се прицврстува на жица за
испорака со којашто се турка помагалото преку комерцијално достапен микрокатетер или
катетер до планираното место за третман. Жицата за испорака се одделува од MVP
помагалото со нејзино вртење спротивно од стрелките на часовникот.
MVP системот е спакуван како една единица којашто ги содржи MVP помагалото, обвивката
на воведувачот и жицата за испорака којашто може да се вади. Системот се испорачува
стерилен, непироген и е наменет само за еднократна употреба.
Слика 1. MVP микроваскуларен приклучок
1 Делумен слој
2 Дистален маркер
3 MVP помагало
4 Зона на одделување
5 Жица за испорака
6 Проксимален маркер
46
Page 47

Слика 2. MVP димензии на системот
1 Должина на жица за испорака
2 Неограничена должина (помагало без
обвивка и без никакви ограничувања)
Табела 1. MVP Димензии Модел Неограничен
MVP-3Q 5,3 mm 12 mm 180 cm 1,5 mm – 3,0 mm
MVP-5Q 6,5 mm 12 mm 180 cm 3,0 mm – 5,0 mm
MVP-7Q 9,2 mm 16 mm 165 cm 5,0 mm – 7,0 mm
MVP-9Q 13,0 mm 18 mm 165 cm 7,0 mm – 9,0 mm
Табела 2. Препорачан микрокатетер или катетер Модел Препорачан микрокатетер
MVP-3Q од 0,021 in (0,53 mm) до
MVP-5Q 0,027 in (0,69 mm) (ID) 153 cm
MVP-7Q 4 Fr (1,4 mm) (OD) 120 cm
MVP-9Q 5 Fr (1,7 mm) (OD) 120 cm
дијаметар
Неограничена
должина
или катетер
0,027 in (0,69 mm) (ID)
3 Неограничен дијаметар
Должина на
жица за испорака
Макс. должина на препорачан микрокатетер или
катетер
153 cm
Дијаметар на
целниот крвен
сад
2 Намена / индикации за употреба
MVP системот на микроваскуларен приклучок е наменет да ја попречи или да ја намали
стапката на проток на крв во периферната васкулатура.
3 Контраиндикации
Нема познати контраиндикации за ова помагало.
4 Компатибилност
Видете ја MVP етикетата на системот за димензии на помагалото. Видете ја етикетата
обезбедена со останатите медицински технологии за да ја одредите компатибилноста.
5 Предупредувања
• Безбедноста и ефективноста на MVP системот не е утврдена за срцева употреба (на
пример, срцева септална оклузија, патентен дуктус артериосус, затворање на
паравалвуларното истекување) и невролошка употреба.
• MVP системот треба да го користат само лекари коишто се запознаени со ангиографски
и интервентни процедури. Важно е да го прочитате упатството за употреба пред да го
користите MVP системот.
• Употребете го MVP системот пред да истече рокот на употреба отпечатен на етикетата
на пакувањето на производот.
• MVP системот е непироген и се испорачува стерилен, освен ако пакувањето на MVP
системот не е отворено или оштетено. Не користете го пакувањето ако е прекршено или
оштетено.
• Проверете го MVP системот пред употреба и фрлете го ако забележите неправилности
или оштетувања.
• MVP системот е наменет само за еднократна употреба. Не смее да се обработува или
стерилизира повторно. Повторната обработка и стерилизација може да ги зголемат
ризиците од инфекција на пациентот, како и од неправилно функционирање на
помагалото. Откако ќе го употребите MVP системот, фрлете го во согласност со
болничката и локалната владина политика.
• Користете флуороскопски насоки кога го движите или манипулирате со MVP системот.
Не движете го и не повлекувајте го помагалото ако наидете на прекумерен отпор,
додека не се утврди причината за отпор.
• Не искривувајте ја и не вртете ја жицата за испорака, освен кога имате намера да го
откачите помагалото, во спротивно, помагалото може прерано да се откачи.
• Не користете шприц за вбризгување за да вбризгате раствор на контрастно средство со
помагалото преку микрокатетер или катетер.
• Не движете ја жицата за испорака откако ќе ја одвоите од помагалото MVP.
• Лекарите мора да бидат подготвени да се справат со итни ситуации кога треба да се
отстрани помагалото. Оваа подготовка вклучува обезбедување на достапност на хирург
на лице место.
• Не користете го со катетри коишто се контраиндицирани за емболични уреди (на
пример, калеми или приклучок).
6 Превентивни мерки
• MVP помагалото се состои од легура на никел и титаниум којашто генерално се смета за
безбедна. Меѓутоа, со ин витро тестирањата се докажа дека од помагалото се
ослободува никел по имплантацијата во период од најмалку 60 дена. Пациентите коишто
се алергични на никел може да имаат алергиска реакција на помагалото, особено кај
пациенти со историја на алергии на метал. Одредени алергиски реакции може да бидат
сериозни; на пациентите треба да им се каже дека треба веднаш да ги известат
лекарите ако се сомневаат дека имаат алергиска реакција, како што се тешкотии при
дишењето или воспаление на лицето или грлото. Некои пациенти може да развијат
алергија на никел ако помагалото е имплантирано.
• Лекарите треба да вршат клинички проценки во ситуации на употреба на
антикоагуланси или антитромбоцитни лекови пред, за време или по употребата на
помагалото.
• Обрнете внимание кај следните специфични популации:
– кај бремени пациентки, треба да се внимава да се минимизира изложеноста на
мајката и фетусот на зрачење.
– кај доилки, нема квантитативна проценка за присуството на исцедок во мајчиното
млеко по имплантацијата на помагалото.
• Потврдете ја компатибилноста на MVP системот кога користите други помошни
помагала во интраваскуларни постапки. Лекарите коишто го користат MVP системот
мора да бидат запознаени со перкутаните, интраваскуларните техники и можните
компликации поврзани со постапката.
• MVP системот треба да се хидрира пред употреба.
• Бидете внимателни при ракување со MVP системот за да ја намалите можноста од
случајно оштетување.
• Постои можност од појава на поголеми сили на притисок кога се употребува со
издупчени нитнинолошки композитни микрокатетри или катетери.
• Пред употреба, потврдете дека дијаметарот на кој било дополнителен уред којшто се
користи е компатибилен со MVP системот.
7 Потенцијални несакани појави
Можните несакани настани до коишто може да дојде за време или по постапката на
поставување на ова помагало вклучуваат, но не се ограничуваат на следниве работи:
• Воздушна емболија
• Алергиска реакција или токсични ефекти
• Крвавење
• Смрт
• Миграција на уреди
• Треска
• Настан на емболија од надворешен материјал
• Инфекција
• Оклузија на непланиран крвен сад
• Периферна емболија
• Реканализација
• Резидуален проток
• Удар или минлив исхемичен напад (TIA)
• Хируршка интервенција
• Компликација на место за васкуларен пристап
• Траума или перфорација на крвниот сад
8 Потребни материјали
1. За испорака на MVP системот треба да се користи микрокатетер или катетер (видете
Таб. 2 за препорачаната големина).
47
Page 48

2. Потребна е следнава дополнителна опрема:
• Хепаринизиран физиолошки раствор
• Ротирачки хемостатски вентил (RHV)
• 3-насочен вентил/скретник за инфузија
• Стегач за притисок на кесичка со физиолошки раствор
• Обвивка на пристап
• Водечки катетер компатибилен со микрокатетер или катетер препорачан во Таб. 2
• Жица водилка компатибилна со водечкиот катетер и микрокатетерот или
катетерот
• Интравенски (IV) држач за инфузија
9 Подготовка
1. За да се постигнат оптимални перформанси на MVP системот и за да се намали
опасноста од тромбоемболиска компликација, одржувајте континуиран физиолошки
раствор помеѓу следните работи:
• обвивката на пристапот и водечкиот катетер
• микрокатетерот или катетерот и водечкиот катетер
• микрокатетерот или катетерот и жицата водилка и MVP системот.
2. Поставете го соодветниот водечки катетер според препорачана постапка. Поврзете
ротирачки хемостатски вентил (RHV) во центарот на водечкиот катетер. Прицврстете
го 3-насочниот вентил/скретник за инфузија до страничниот дел на RHV. Поврзете
хепаринизиран физиолошки раствор за континуирано испирање.
3. Проверете ги сите приклучоци за да спречите навлегување воздух во водечкиот
катетер или во микрокатетерот или катетерот за време на континуираното испирање.
10 Упатство за употреба
1. Пристапете до целниот крвен сад и извршете ангиограм користејќи стандардна
техника за да го измерите дијаметарот на садот на саканото место за оклузија. Целниот
крвен сад треба да одговара на препорачаниот дијаметар (видете Таб. 1).
2. Местото на оклузија треба да е доволно долго за вграденото MVP помагало да може да
се постави без да се попречуваат непланираните садови.
3. Изберете микрокатетер или катетер (видете Таб. 2 за препорачаната големина) и
подгответе го во согласност со упатството за употреба на производителот.
4. Вметнете ја жицата водилка и движете го микрокатетерот или катетерот преку жицата
водилка додека дисталниот врв не дојде близу до водечкиот раб на местото на
оклузија.
5. Извадете ја жицата водилка од микрокатетерот или катетерот.
6. Извадете го MVP системот од цевката за дозирање така што нежно ќе ја извадите
жолтата обвивка на воведувачот од двата надворешни клипови и ќе го повлечете MVP
системот од проѕирната цевка на куќиштето. Нежно фатете ја обвивката на
воведувачот на место коешто е проксимално на MVP помагалото и полека извадете ги
MVP помагалото, жицата за испорака и обвивката на воведувачот истовремено од
цевката за дозирање. Видете во Сл. 3.
Слика 3. Спакуван MVP систем
1 Проѕирна цевка на куќиште
2 Жолта обвивка на воведувач
3 Жица за испорака (во обвивката на
воведувачот)
7. Детално проверете дали MVP системот е оштетен. Ако MVP системот е оштетен,
заменете го со нов MVP систем.
8. Измијте го MVP системот така што нежно ќе го потопите неколку центиметри од
обвивката на воведувачот и MVP помагалото во хепаринизиран физиолошки раствор.
4 Вратило на вртежен момент
5 Цевка за дозирање
6 MVP помагало
9. Туркајте го MVP помагалото во обвивката на воведувачот со туркање на жицата за
испорака само додека дисталниот врв на MVP помагалото не биде покриен со
обвивката на воведувачот.
Забелешка: Доколку MVP помагалото се турне премногу во обвивката на воведувачот,
може да не се исплакне правилно. Двете дупки во обвивката на воведувачот,
поставени 3 cm и 6 cm проксимално до врвот на обвивката, го олеснуваат
прочистувањето на воздухот и испирањето на помагалото.
10. Вметнете го MVP системот така што ќе го вметнете дисталниот крај на обвивката на
воведувачот преку RHV и во центарот на микрокатетерот или катетерот додека
обвивката не биде цврсто поставена. Затегнете ja RHV доволно за да го спречите
повратниот проток на крв, но не толку цврсто за да не го оштетите MVP системот додека
го воведувате во микрокатетерот или катетерот.
11. Визуелно проверете дали растворот за испирање се внесува нормално. Треба да се
гледаат капки на физиолошки раствор коишто излегуваат од проксималниот крај на
обвивката на воведувачот.
12. Олабавете ja RHV доволно за MVP помагалото и жицата за испорака да може да се
движат заедно како систем. Не олабавувајте ja RHV за да се овозможи повратен проток
на крв. Извадете ја обвивката на воведувачот така што ќе ја повлечете преку
проксималниот крај на жицата за испорака.
13. Поместете ги жицата за испорака и MVP помагалото додека дисталниот платински
маркер на MVP помагалото не се порамни со дисталната маркер-лента на
микрокатетерот или катетерот.
14. Потврдете дека маркер-лентите се оптимално позиционирани. Уредувајте го MVP
уредот со одржување на преден притисок врз жицата за испорака додека полека го
повлекувате микрокатетерот или катетерот за да ја извадите обвивката на MVP
помагалото.
15. Ако не сте задоволни со позицијата на помагалото, направете ги следните чекори:
a. Стабилизирајте ја жицата за испорака и поместете го микрокатетерот или
катетерот така што дистално ќе го поместите, додека MVP помагалото не се врати
во катетерот.
b. Повторно позиционирајте го и распоредете го помагалото или извадете го
помагалото од пациентот.
Забелешка: Не треба повторно да поставите обвивка на помагалото и да го
употребите повеќе од 3 пати.
16. За правилно одвојување, треба да го позиционирате MVP помагалото надвор од врвот
на микрокатетерот или катетерот.
17. Ако сте задоволни со позицијата на помагалото, продолжете со одвојување,
преземајќи ги следниве чекори:
a. Потврдете под флуороскопија дека врвот на микрокатетерот или катетерот е
проксимален во однос на MVP помагалото.
b. Прикачете го вратилото за вртежен момент на жицата за испорака. Одвојте го MVP
помагалото со вртење на жицата за испорака во спротивна насока од насоката на
движење на стрелките на часовникот додека не ја разделите од помагалото.
c. Потврдете го успешното одвојување флуороскопски така што полека ќе ја
повлечете жицата за испорака во проксимална насока за да се погрижите дека
MVP помагалото не се поместува. Ако во многу малку веројатен случај MVP
помагалото се помести во проксимална насока, повторно поставете го помагалото
и повторете ја ротацијата на жицата за испорака во спротивната страна од
стрелките на часовникот за да ја одделите.
18. Додека го држите микрокатетерот или катетерот во место, повлечете ја жицата за
испорака во микрокатетерот или катетерот и потоа извадете ја жицата за испорака од
пациентот. Извршете ја постапката со стандардна техника.
11 Упатства по постапката
Доколку услугата MedicAlert е достапна во вашиот регион, препорачајте му на пациентот да
стане член на MedicAlert на www.medicalert.org. Од пациентот ќе биде побарано да обезбеди
информации за неговата или нејзината состојба, името на вграденото помагало и
ограничувањата во врска со употребата на MRI.
12 Информации за магнетна резонанција
12.1 Безбедно при магнетна резонанција само ако се употребува во определени услови
Утврдено е дека MVP микроваскуларниот приклучок е безбеден при магнетна резонанција
само ако се употребува во определени услови. Неклиничките испитувања покажаа дека
MVP помагалото за микроваскуларниот приклучок е безбедно при магнетна резонанција
48
Page 49

само ако се употребува во определени услови. Пациент со ова помагало може безбедно да
се скенира, веднаш по поставувањето, и тоа под следниве услови:
• Статичко магнетно поле од 3 тесли или помалку
• Максимално магнетно поле на просторниот градиент од 9000 гаус/см или помалку
• Максимална забележана вредност за системот за магнетна резонанција, просечна
стапка на специфична апсорпција за целото тело (SAR) од 4 W/kg за скенирање од 15
мин. (т.е. од импулсна секвенца)
• Режим на работа контролиран од прв степен за системот за магнетна резонанција
12.2 Загревање поврзано со MRI
Кај неклинички тестирања, MVP помагалото за микроваскуларен приклучок го создало
следниов пораст на температурата за време на MRI извршена за 15 min на скенирање (т.е.
по импулсна секвенца) во системот за магнента резонанција од 3 тесли (3 тесли/128 MHz,
Excite, HDx, Софтвер 14X.M5, General Electric Healthcare, Milwaukee, WI): Највисока
промена на температурата +1,8°C
Од таа причина, експериментите за загревање поврзани со MRI за MVP помагалото со
микроваскуларен приклучок за 3 тесли со користење на радиофреквентен калем за
пренос/прием во систем за магнетна резонанција со просечена SAR на цело тело од 2,9 W/kg
(т.е. поврзани со калориметриски резултат на целото тело со просечна вредност од
2,7 W/kg) покажаа дека најголемото количество на загревање во врска со овие специфични
услови е еднакво или помало од +1,8°C.
12.3 Информации за артефактите
Квалитетот на снимањето со магнетна резонанција може да се намали доколку областа од
интерес се наоѓа во истата област или релативно блиску до положбата на MVP помагалото
за микроваскуларен приклучок. Од таа причина, може да биде потребно да се оптимизираат
параметрите на снимањето со магнетна резонанција за да се надомести за присуството на
ова помагало. Максималната големина на артефактот (т.е. како што се гледа на градиент
ехо импулсна секвенца) се протега приближно 5 mm во зависност од големината и обликот
на MVP помагалото за микроваскуларен приклучок.
Импулсна секвенца
Големина на сигнал
Ориентација на
рамнина
T1-SE T1-SE GRE GRE
2
252 mm
Паралелна Под прав агол Паралелна Под прав агол
91 mm
2
304 mm
2
116 mm
2
Nederlands
1 Productbeschrijving
De MVP is een zelfontplooiende microvasculaire plug voor bloedvatocclusie. De MVP is ovaal,
bestaat uit nitinol en is aan beide uiteinden versterkt met platina markeringsringetjes. Een deel is
bedekt met PTFE. Het proximale markeringsringetje wordt bevestigd aan een plaatsingsdraad, die
het product door een commercieel beschikbare (micro)katheter naar de beoogde
behandelingslocatie duwt. Draai de plaatsingsdraad linksom om deze los te schroeven van de MVP.
De verpakking met het MVP-systeem bevat één MVP, een introducersheath en een demonteerbare
plaatsingsdraad. Het systeem wordt steriel, niet-pyrogeen geleverd en is uitsluitend bestemd voor
eenmalig gebruik.
Afbeelding 1. MVP microvasculaire plug
1 Bedekt deel
2 Distale markering
3 De MVP
4 Ontkoppelingspunt
5 Plaatsingsdraad
6 Proximale markering
Afbeelding 2. Afmetingen van het MVP-systeem
13 Чување
Избегнувајте изложување на MVP системот на вода, сончева светлина, екстремни
температури и висока влажност за време на складирањето. Чувајте го MVP системот на
контролирана собна температура. Видете ја етикетата на производот за да го дознаете
рокот на траење на помагалото. Не користете го помагалото по означениот рок на траење.
14 Материјали
MVP системот не е изработен од латекс или ПВЦ материјали.
15 Одрекување од одговорност во однос на гаранцијата
Предупредувањата означени на етикетата на производот содржат подетални
информации и се сметаат за составен дел од ова одрекување од одговорност во
однос на гаранцијата. Иако производот е произведен во внимателно контролирани
услови, Medtronic нема контрола врз условите во коишто се употребува
производот. Medtronic, поради ова, ги откажува сите гаранции, изречни и
имплицирани, во врска со производот, вклучувајќи ги, но не ограничувајќи се на
имплицираната гаранција за комерцијална вредност или погодноста за одредена
намена. Medtronic нема да биде одговорна пред лица или субјекти за какви било
медицински трошоци или други директни, случајни или последични оштетувања
предизвикани од употреба, дефект, грешка или нефункционирање на производот,
без оглед дали барањето се заснова на гаранција, договор, прекршок или на нешто
друго. Ниту едно лице нема овластувања да ја обврзе Medtronic на какви било
застапувања или гаранција во врска со производот.
Горенаведените исклучоци и ограничувања немаат за цел и не треба да се толкуваат како
спротивни на задолжителните законски одредби на важечкиот закон. Доколку надлежен
суд смета дека некој дел или услов од ова Одрекување од одговорност во однос на
гаранцијата е незаконски, неспроведлив или спротивен на законските одредби, тоа нема да
влијае врз важноста на останатите делови од ова Одрекување од одговорност во однос на
гаранцијата, а сите права и обврски ќе се толкуваат и ќе се спроведуваат како ова
Одрекување од одговорност во однос на гаранцијата да не го содржело конкретниот дел или
термин кој се смета за неважечки.
1 Lengte plaatsingsdraad
2 Lengte zonder sheath of andere
beperkingen
3 Diameter zonder beperkingen
Tabel 1. Afmetingen van de MVP Model Diameter zon-
MVP-3Q 5,3 mm 12 mm 180 cm 1,5 mm – 3,0 mm
MVP-5Q 6,5 mm 12 mm 180 cm 3,0 mm – 5,0 mm
MVP-7Q 9,2 mm 16 mm 165 cm 5,0 mm – 7,0 mm
MVP-9Q 13,0 mm 18 mm 165 cm 7,0 mm – 9,0 mm
Tabel 2. Aanbevolen (micro)katheter Model Aanbevolen (micro)katheter Max aanbevolen
MVP-3Q 0,021 in (0,53 mm) tot 0,027 in
MVP-5Q 0,027 in (0,69 mm) (binnendia-
MVP-7Q 4 Fr (1,4 mm) (buitendiameter) 120 cm
MVP-9Q 5 Fr (1,7 mm) (buitendiameter) 120 cm
der beperkingen
Lengte zonder
beperkingen
(0,69 mm) (binnendiameter)
meter)
Lengte plaatsingsdraad
(micro)katheterlengte
153 cm
153 cm
Diameter doelvat
2 Gebruiksdoel / gebruiksindicaties
De MVP microvasculaire plug is bedoeld om de bloedstroom in het perifere vaatstelsel te blokkeren
of te beperken.
49
Page 50

3 Contra-indicaties
Er zijn geen contra-indicaties bekend voor dit product.
4 Compatibiliteit
Raadpleeg het productlabel van het MVP-systeem voor de afmetingen. Raadpleeg de
documentatie van andere medisch-technische instrumenten om de compatibiliteit vast te stellen.
5 Waarschuwingen
• De veiligheid en werkzaamheid van het MVP-systeem zijn niet vastgesteld voor
harttoepassingen (bv. occlusie van het atrioventriculaire septum, persisterende ductus
arteriosus, sluiting van paravalvulaire lekkage) en neurologische toepassingen.
• Het MVP-systeem mag uitsluitend worden gebruikt door artsen die bekend zijn met angiografie
en interventieprocedures. Het is belangrijk om de gebruiksaanwijzing te lezen alvorens het
MVP-systeem in gebruik te nemen.
• Gebruik het MVP-systeem vóór de op het verpakkingslabel vermelde vervaldatum.
• Het MVP-systeem is niet-pyrogeen en steriel tenzij de verpakking van het MVP-systeem
geopend of beschadigd is. Niet gebruiken als de verpakking geopend of beschadigd is.
• Inspecteer het MVP-systeem vóór gebruik en werp het weg indien u onregelmatigheden of
schade constateert.
• Het MVP-systeem is bedoeld voor eenmalig gebruik. Niet herverwerken of hersteriliseren.
Herverwerking en hersterilisatie kunnen het infectierisico voor de patiënt vergroten en de
werking van het product verslechteren. Werp het MVP-systeem na gebruik weg conform de
ziekenhuis- en overheidsregels.
• Het MVP-systeem moet onder geleide van röntendoorlichting worden opgevoerd of
gemanipuleerd. Als u overmatige weerstand voelt, het product niet verder opvoeren of
terugtrekken totdat de oorzaak is vastgesteld.
• Draai nooit aan de plaatsingsdraad tenzij u het product wilt loskoppelen. Anders kan het
product voortijdig losraken.
• Gebruik geen powerinjector voor het injecteren van contrastvloeistof door een (micro)katheter.
• Voer de plaatsingsdraad niet op nadat u deze van de MVP heeft losgekoppeld.
• Artsen moeten voorbereid zijn op urgente situaties waarbij het product moet worden verwijderd.
Als onderdeel van deze voorbereiding moet u zorgen dat er ter plaatse een chirurg beschikbaar
is.
• Niet gebruiken met katheters waarvoor een contra-indicatie voor embolische instrumenten
geldt (bv. spiralen of een plug).
6 Voorzorgsmaatregelen
• De MVP is vervaardigd van een nikkeltitaniumlegering die in het algemeen als veilig wordt
aangemerkt. Uit in-vitro-onderzoek is echter gebleken dat het product na implantatie minimaal
60 dagen lang nikkel afgeeft. Patiënten die allergisch voor nikkel zijn, kunnen een allergische
reactie op het product vertonen, met name patiënten die bekend zijn met metaalallergie.
Bepaalde allergische reacties kunnen ernstig zijn; patiënten moeten hun arts onmiddellijk
inlichten als ze denken een allergische reactie te hebben, zoals ademhalingsmoeilijkheden of
ontsteking van het gelaat of de keel. Bij sommige patiënten kan zich een nikkelallergie
ontwikkelen als het product wordt geïmplanteerd.
• Artsen moeten afgaan op hun klinisch oordeel indien vóór, tijdens of na gebruik van het product
antistolling of trombocytenaggregatieremmers worden gebruikt.
• Let op bij de volgende patiëntgroepen:
– Patiënten die zwanger zijn; beperk de blootstelling aan straling van moeder en foetus tot een
minimum.
– Patiënten die borstvoeding geven; er is geen kwantitatieve evaluatie uitgevoerd van de
aanwezigheid van uitloogbare stoffen in de moedermelk na implantatie van het product.
• Controleer alvorens aanvullende hulpinstrumenten voor intravasculaire procedures te
gebruiken of deze compatibel zijn met het MVP-systeem. Het MVP-systeem mag uitsluitend
worden gebruikt door artsen die bekend zijn met percutane, intravasculaire technieken en de
mogelijke complicaties in verband met de ingreep.
• Het MVP-systeem moet vóór gebruik worden gehydrateerd.
• Ga voorzichtig met het MVP-systeem om om schade te voorkomen.
• De drukkrachten kunnen hoger zijn bij gebruik van (micro)katheters van gegleufde
nitinolsamenstelling.
• Controleer alvorens aanvullende hulpinstrumenten te gebruiken of de diameter compatibel is
met het MVP-systeem.
7 Mogelijke complicaties
Tot de bijwerkingen die mogelijk optreden tijdens of na plaatsing van dit product, behoren onder
meer:
• Luchtembolie
• Allergische reactie of toxische effecten
• Bloeding
• Overlijden
• Migratie van het product
• Koorts
• Embolisch incident door vreemd materiaal
• Infectie
• Occlusie van onbedoeld bloedvat
• Perifere embolie
• Rekanalisatie
• Resterende doorstroming
• Beroerte of TIA (transiënt ischemisch attack)
• Chirurgische interventie
• Complicatie bij de vasculaire toegangsplaats
• Vaattrauma of -perforatie
8 Benodigdheden
1. Plaats het MVP-systeem met behulp van een (micro)katheter (zie Tabel 2 voor de aanbevolen
afmetingen).
2. De volgende benodigdheden zijn vereist:
• Gehepariniseerde zoutoplossing
• Draaibare hemostaseklep
• Driewegkraan
• Manchet voor zak met zoutoplossing
• Toegangssheath
• Geleidekatheter compatibel met een (micro)katheter aanbevolen in Tabel 2
• Voerdraad compatibel met de geleidekatheter en (micro)katheter
• Infuusstandaard
9 Voorbereiding
1. Voor een optimale werking van het MVP-systeem en zo min mogelijk risico op
trombo-embolische complicaties, dient u continu met zoutoplossing te spoelen tussen de
volgende onderdelen:
• De toegangssheath en de geleidekatheter
• De (micro)katheter en de geleidekatheter
• De (micro)katheter, de voerdraad en het MVP-systeem.
2. Plaats een geschikte geleidekatheter volgens de aanbevolen procedure. Bevestig een
draaibare hemostaseklep aan de hub van de geleidekatheter. Bevestig een driewegkraan aan
de zijarm van de draaibare hemostaseklep. Sluit een lijn met gehepariniseerde zoutoplossing
aan om continu te spoelen.
3. Controleer alle aansluitingen zodat er geen lucht in de geleidekatheter of (micro)katheter kan
komen tijdens het continu spoelen.
10 Gebruiksinstructies
1. Prik het doelvat aan en neem met de standaardtechniek een angiogram af om de vaatdiameter
op de gewenste occlusieplaats te meten. Controleer of het doelvat de aanbevolen diameter
heeft (zie Tabel 1).
2. Controleer of de occlusieplaats lang genoeg is om plaats te bieden aan de geïmplanteerde
MVP zonder obstructie van onbedoelde vaten.
3. Selecteer een (micro)katheter (zie Tabel 2 voor de aanbevolen afmeting) en bereid deze voor
volgens de gebruiksaanwijzing van de fabrikant.
4. Breng de voerdraad in en voer de (micro)katheter op over de voerdraad totdat de distale tip
zich vlak bij de achterste rand van de occlusie bevindt.
5. Verwijder de voerdraad uit de (micro)katheter.
6. Verwijder het MVP-systeem uit de dispenserslang door de gele introducersheath voorzichtig
uit de twee buitenste clips te halen en het MVP-systeem uit de doorzichtige houderslang te
trekken. Pak de introducersheath voorzichtig proximaal van de MVP vast en verwijder de MVP,
de plaatsingsdraad en de introducersheath tegelijkertijd langzaam uit de dispenserslang. Zie
Afbeelding 3.
50
Page 51

Afbeelding 3. MVP-systeem in verpakking
1 Doorzichtige houderslang
2 Gele introducersheath
3 Plaatsingsdraad (in introducersheath)
7. Inspecteer het MVP-systeem zorgvuldig op schade. Als het MVP-systeem beschadigd is,
gebruik dan een nieuw MVP-systeem.
8. Spoel het MVP-systeem door enkele centimeters van de introducersheath en de MVP
voorzichtig onder te dompelen in gehepariniseerde zoutoplossing.
9. Trek de MVP in de introducersheath door aan de plaatsingsdraad te trekken totdat de distale
tip van de MVP net wordt bedekt door de introducersheath.
Opmerking: Als de MVP te ver in de introducersheath wordt getrokken, wordt hij mogelijk niet
goed gespoeld. Twee openingen in de introducersheath op 3 cm en 6 cm proximaal van de tip
dienen voor ontluchten en spoelen.
10. Breng het MVP-systeem in door het distale uiteinde van de introducersheath via de draaibare
hemostaseklep in de hub van de (micro)katheter te voeren totdat de sheath stevig vastzit.
Draai de draaibare hemostaseklep vast om te voorkomen dat er bloed terugstroomt, maar niet
zo strak dat het MVP-systeem beschadigd raakt tijdens het invoeren ervan in de
(micro)katheter.
11. Controleer visueel of de instroom van spoeloplossing normaal is. U moet druppelsgewijs
zoutoplossing uit het proximale uiteinde van de introducersheath zien komen.
12. Draai de draaibare hemostaseklep los genoeg om de MVP en de plaatsingsdraad als één
geheel te kunnen opvoeren. Draai de draaibare hemostaseklep niet zo ver los dat er bloed kan
terugstromen. Trek de introducersheath over het proximale uiteinde van de plaatsingsdraad
terug.
13. Voer de plaatsingsdraad en de MVP op totdat de distale platina markering van de MVP op één
lijn ligt met het distale markeringsringetje van de (micro)katheter.
14. Controleer of de markeringsringetjes optimaal gepositioneerd zijn. Plaats de MVP door
voorwaartse druk uit te oefenen op de plaatsingsdraad en de MVP uit de sheath te drukken
door de (micro)katheter langzaam terug te trekken.
15. Als de positie niet naar wens is, gaat u als volgt te werk:
a. Stabiliseer de plaatsingsdraad en voer de (micro)katheter distaal op totdat de MVP weer
in de katheter zit.
b. Herpositioneer het product en plaats het opnieuw, of verwijder het product uit de patiënt.
Opmerking: U mag het product maximaal 3 keer terugbrengen in de sheath en opnieuw
plaatsen.
16. De MVP moet voorbij de tip van de (micro)katheter worden gepositioneerd voor een correcte
ontkoppeling.
17. Als de positie naar wens is, gaat u als volgt te werk om te ontkoppelen:
a. Controleer onder röntgendoorlichting of de tip van de (micro)katheter zich proximaal van
de MVP bevindt.
b. Bevestig het torsie-instrument aan de plaatsingsdraad. Draai de plaatsingsdraad linksom
om deze los te koppelen van de MVP.
c. Controleer onder röntgendoorlichting of het loskoppelen is geslaagd door de
plaatsingsdraad langzaam in proximale richting te trekken terwijl u kijkt of de MVP niet
beweegt. In het onwaarschijnlijke geval dat de MVP toch in proximale richting beweegt,
brengt u het product terug op de juiste plaats en draait u de plaatsingsdraad nogmaals
linksom om deze los te koppelen.
18. Houd de (micro)katheter op zijn plaats, trek de plaatsingsdraad terug in de (micro)katheter en
verwijder de plaatsingsdraad uit de patiënt. Voltooi de procedure volgens de
standaardtechniek.
4 Torsie-instrument
5 Dispenserslang
6 De MVP
11 Instructies voor na de procedure
Als MedicAlert in uw regio beschikbaar is, adviseer de patiënt dan om lid te worden via
www.medicalert.org. De patiënt zal worden gevraagd om de aandoening, de naam van het
implantaat en MRI-beperkingen op te geven.
12 MRI-informatie
12.1 MR Conditional (MR-veilig onder voorwaarden)
De MVP microvasculaire plug is MR-veilig onder voorwaarden. Uit niet-klinische tests is gebleken
dat de MVP microvasculaire plug MR-veilig onder voorwaarden is. Een patiënt met dit product kan
onmiddellijk na plaatsing worden gescand onder de volgende voorwaarden:
• Statisch magnetisch veld van 3 tesla of minder
• Maximaal ruimtelijk magnetisch gradiëntveld van 9000 gauss/cm of minder
• Maximale door MR-systeem gerapporteerde, gemiddelde totalelichaams-SAR
(specifieke-absorptieratio) van 4 W/kg bij 15 minuten scannen (per pulssequentie)
• First level controlled-werkingsmodus voor het MR-systeem
12.2 Opwarming door MRI
In niet-klinische onderzoeken produceerde de MVP microvasculaire plug de volgende
temperatuurstijging tijdens MRI gedurende 15 min scannen (per pulssequentie) in het 3 tesla
MR-systeem (3 tesla/128 MHz, Excite, HDx, Software 14X.M5, General Electric Healthcare,
Milwaukee, WI): Hoogste temperatuurverandering +1,8°C
De MRI-gerelateerde opwarmingsexperimenten voor de MVP microvasculaire plug bij 3 tesla met
gebruikmaking van een RF-zend-/ontvangstspoel voor het lichaam bij een door het MR-systeem
gerapporteerde, gemiddelde totalelichaams-SAR (specifieke-absorptieratio) van 2,9 W/kg
(geassocieerd met een calorimetriemeting van een gemiddelde totalelichaamswaarde van
2,7 W/kg) toonden aan dat de hoogste opwarmingswaarde die zich voordeed onder deze specifieke
voorwaarden kleiner dan of gelijk aan +1,8°C was.
12.3 Informatie over artefacten
De MRI-beeldkwaliteit kan achteruitgaan als het te scannen gebied zich precies bij of in de buurt van
de MVP microvasculaire plug bevindt. Het kan daarom nodig zijn om de MRI-parameters te
optimaliseren om te compenseren voor de aanwezigheid van dit apparaat. De maximale omvang
van het artefact (zoals waargenomen op de gradiënt-echosequentie) strekte zich uit over ongeveer
5 mm, afhankelijk van de maat en vorm van de MVP microvasculaire plug.
Pulssequentie
Formaat signaalleegte
Oriëntatie van het
vlak
T1-SE T1-SE GRE GRE
2
252 mm
Parallel Loodrecht Parallel Loodrecht
91 mm
2
304 mm
2
116 mm
13 Opslag
Stel het MVP-systeem tijdens opslag niet bloot aan water, zonlicht, extreme temperaturen en een
hoge luchtvochtigheid. Bewaar het MVP-systeem bij een gereguleerde kamertemperatuur.
Raadpleeg het productlabel voor de uiterste gebruiksdatum van het product. Gebruik het product
niet na de vermelde uiterste gebruiksdatum.
14 Materialen
Het MVP-systeem bevat geen latex- of pvc-houdende materialen.
15 Uitsluiting van garantie
De waarschuwingen in de productdocumentatie bieden meer gedetailleerde informatie en
vormen een integraal onderdeel van deze Uitsluiting van garantie. Hoewel het product is
vervaardigd onder zorgvuldig gecontroleerde omstandigheden, ligt de manier waarop het
product wordt gebruikt buiten de controle van Medtronic. Medtronic verleent daarom geen
enkele garantie, noch expliciet noch impliciet, met betrekking tot het product, met inbegrip
van maar niet beperkt tot eventuele impliciete garanties betreffende verkoopbaarheid of
geschiktheid voor bepaalde toepassingen. Medtronic kan door geen enkel rechtspersoon
aansprakelijk worden gesteld voor medische kosten of directe, incidentele of
gevolgschade veroorzaakt door om het even welk gebruik, defect, falen of onjuist
functioneren van het product, ongeacht of een vordering is gebaseerd op een garantie,
contract, onrechtmatige daad of anderszins. Geen enkel persoon is gerechtigd om
Medtronic aan enige verklaring of garantie te binden met betrekking tot het product.
De uitsluitingen en beperkingen die hierboven uiteengezet zijn, zijn niet bedoeld, en moeten niet
geïnterpreteerd worden als een inbreuk op dwingende bepalingen van de van toepassing zijnde
wet. Indien enig onderdeel of enige bepaling van deze uitsluiting van garantie door een daartoe
bevoegde rechtbank als onrechtmatig, onuitvoerbaar of in strijd met de van toepassing zijnde wet
beschouwd wordt, zal dit de geldigheid van het overige deel van deze uitsluiting van garantie niet
aantasten en zullen alle rechten en plichten worden uitgelegd en ten uitvoer worden gebracht alsof
deze uitsluiting van garantie het betreffende ongeldig verklaarde gedeelte niet bevatte.
51
2
Page 52

Norsk
1 Beskrivelse av ledningen
MVP mikrovaskulært pluggsystem er en selvekspanderende karokklusjonsenhet. MVP-enheten
har en egglignende form, består av nitinol og er sikret i begge ender med markørbånd av platina.
Enheten er delvis dekket av PTFE. Det proksimale markørbåndet er festet til en innføringsvaier som
skyver enheten gjennom et kommersielt tilgjengelig mikrokateter eller kateter frem til det tiltenkte
behandlingsstedet. Innføringsvaieren kobles fra MVP-enheten ved å dreie innføringsvaieren mot
klokken til den frigjøres fra enheten.
MVP-systemet leveres i én enkelt pakning som inneholder MVP-enheten, en innføringshylse og en
innføringsvaier som kan kobles fra. Systemet leveres sterilt og ikke-pyrogent og er kun beregnet for
engangsbruk.
Figur 1. MVP mikrovaskulær plugg
1 Delvis dekket
2 Distal markør
3 MVP-enhet
Figur 2. MVP-systemets mål
1 Innføringsvaierens lengde
2 Lengde i frigjort tilstand (enheten ute av kateteret og uten begrensninger)
3 Diameter i frigjort tilstand
Tabell 1. MVP-mål Modell Diameter i fri-
MVP-3Q 5,3 mm 12 mm 180 cm 1,5 mm–3,0 mm
MVP-5Q 6,5 mm 12 mm 180 cm 3,0 mm–5,0 mm
MVP-7Q 9,2 mm 16 mm 165 cm 5,0 mm–7,0 mm
MVP-9Q 13,0 mm 18 mm 165 cm 7,0 mm–9,0 mm
Tabell 2. Anbefalt mikrokateter eller kateter Modell Anbefalt mikrokateter eller
MVP-3Q 0,021 in (0,53 mm) til 0,027 in
MVP-5Q 0,027 in (0,69 mm) (ID) 153 cm
MVP-7Q 4 Fr (1,4 mm) (YD) 120 cm
MVP-9Q 5 Fr (1,7 mm) (YD) 120 cm
gjort tilstand
Lengde i frigjort
tilstand
kateter
(0,69 mm) (ID)
4 Frakoblingssone
5 Innføringsvaier
6 Proksimal markør
Innføringsvaierens lengde
Maks. lengde for anbefalt
mikrokateter eller kateter
153 cm
Målkarets diameter
2 Tiltenkt bruk / indikasjoner for bruk
MVP mikrovaskulært pluggsystem er indisert for å blokkere eller redusere blodflowen i den perifere
vaskulaturen.
3 Kontraindikasjoner
Det er ingen kjente kontraindikasjoner for denne enheten.
4 Kompatibilitet
MVP-systemets mål finner du på produktetiketten. Se merkingen til andre medisinske teknologier
for å fastslå kompatibiliteten.
5 Advarsler
• Sikkerheten og effekten til MVP-systemet er ikke dokumentert for kardial bruk (f.eks. okklusjon
av hjerteskillevegg, persisterende ductus arteriosus, lukking av paravalvulær lekkasje) og
nevrologisk bruk.
• MVP-systemet skal kun brukes av leger som er kjent med angiografiske og intervensjonelle
prosedyrer. Det er viktig å lese bruksanvisningen før bruk av MVP-systemet.
• Bruk MVP-systemet før siste forbruksdag som er trykt på produktets pakningsetikett.
• MVP-systemet er ikke-pyrogent og leveres sterilt så sant emballasjen til MVP-systemet ikke er
åpnet eller skadet. Må ikke brukes hvis emballasjen er åpnet eller skadet.
• Kontroller MVP-systemet før bruk, og kasser det hvis det observeres skade eller
uregelmessigheter.
• MVP-systemet er kun beregnet for engangsbruk. Må ikke bearbeides på nytt eller resteriliseres.
Hvis enheten bearbeides på nytt eller resteriliseres, kan det føre til økt risiko for pasientinfeksjon
og nedsatt ytelse for enheten. Etter bruk må MVP-systemet kasseres i henhold til sykehusets
retningslinjer og kommunale retningslinjer.
• Bruk gjennomlysning når MVP-systemet føres frem eller manipuleres. Enheten må ikke føres
frem eller trekkes tilbake når det møtes stor motstand, før årsaken til motstanden er fastslått.
• Innføringsvaieren må ikke vris eller dreies med mindre hensikten er å koble fra enheten, ellers
kan enheten bli koblet fra for tidlig.
• Bruk ikke en trykksprøyte til å injisere kontrastmiddel med enheten gjennom et mikrokateter
eller kateter.
• Før ikke frem innføringsvaieren etter at den er koblet fra MVP-enheten.
• Leger må være forberedt på å håndtere akutte situasjoner som krever fjerning av enheten. Slike
forberedelser omfatter å sørge for å ha en kirurg tilgjengelig på stedet.
• Må ikke brukes med katetre som er kontraindisert for emboliserende enheter (for eksempel
coiler eller en plugg).
6 Forholdsregler
• MVP-enheten består av en nikkel-titan-legering som generelt anses som sikker. In vitro-testing
har imidlertid vist at nikkel avgis fra enheten etter implantasjon i 60 dager eller mer. Pasienter
med nikkelallergi kan få en allergisk reaksjon på enheten, spesielt pasienter som tidligere har
hatt metallallergier. Visse allergiske reaksjoner kan være alvorlige. Pasienter må instrueres om
å kontakte legene umiddelbart hvis de mistenker at de har en allergisk reaksjon, for eksempel
ved pustebesvær eller inflammasjon i ansikt eller hals. Noen pasienter kan utvikle en allergi
overfor nikkel hvis enheten implanteres.
• Leger må utvise klinisk skjønn i situasjoner som involverer bruk av antikoagulanter eller
blodplatehemmende midler før, under eller etter bruk av enheten.
• Vær spesielt oppmerksom ved behandling i følgende populasjoner:
– Hos gravide pasienter må du passe på at moren og fosteret utsettes for minst mulig stråling.
– For ammende mødre foreligger det ingen kvantitativ vurdering av forekomsten av utvaskbare
stoffer i brystmelk etter implantasjon av enheten.
• Bekreft kompatibilitet med MVP-systemet ved bruk av andre tilbehørsenheter ved
intravaskulære prosedyrer. Leger som bruker MVP-systemet, må være kjent med perkutane,
intravaskulære teknikker og mulige komplikasjoner forbundet med prosedyren.
• MVP-systemet må fuktes før bruk.
• Vær forsiktig ved håndtering av MVP-systemet, for å redusere sannsynligheten for utilsiktet
skade.
• Det er potensial for høyere skyvekraft ved bruk med slissede nitinolkomposittmikrokatetre
eller -katetre.
• Bekreft at diameteren til tilbehørsenheter som brukes, er kompatibel med MVP-systemet før
bruk.
7 Mulige bivirkninger
Mulige bivirkninger som kan oppstå under eller etter en prosedyre for å plassere denne enheten,
kan omfatte, men er ikke begrenset til, følgende:
• luftemboli
• allergisk reaksjon eller giftvirkninger
• Blødninger
• Død
• forskyvning av enheten
• feber
• embolisk hendelse forårsaket av fremmed materiale
52
Page 53

• infeksjon
• okklusjon av utilsiktet kar
• perifer embolisme
• rekanalisering
• restflow
• slag eller transitorisk iskemisk anfall (TIA)
• kirurgisk intervensjon
• komplikasjon på det vaskulære tilgangsstedet
• kartraume eller -perforasjon
8 Nødvendig utstyr
1. Innføring av MVP-systemet krever bruk av et mikrokateter eller et kateter (se anbefalt størrelse i
Tabell 2).
2. Følgende tilbehør er nødvendig:
• heparinisert saltvann
• roterende hemostaseventil (RHV)
• treveisstoppekran
• overtrykksmansjett til saltvannspose
• tilgangshylse
• ledekateter som er kompatibelt med et mikrokateter eller et kateter som er anbefalt i
Tabell 2
• ledevaier som er kompatibel med ledekateteret og mikrokateteret eller kateteret
• iv-stativ
9 Klargjøring
1. For å oppnå optimal ytelse for MVP-systemet og for å redusere risikoen for tromboembolisk
komplikasjon må kontinuerlig skylling med saltvann opprettholdes mellom følgende
elementer:
• tilgangshylsen og ledekateteret
• mikrokateteret eller kateteret og ledekateteret
• mikrokateteret eller kateteret, ledevaieren og MVP-systemet
2. Plasser det aktuelle ledekateteret i henhold til anbefalt prosedyre. Koble en roterende
hemostaseventil (RHV) til ledekateterets muffe. Koble en treveisstoppekran til sidearmen på
den roterende hemostaseventilen. Koble til en slange for kontinuerlig skylling med heparinisert
saltvann.
3. Kontroller alle tilkoblingene for å forsikre deg om at det ikke kommer luft inn i ledekateteret eller
mikrokateteret eller kateteret under kontinuerlig skylling.
10 Bruksanvisning
1. Opprett tilgang til målkaret og utfør angiografi ved bruk av standard teknikk for å måle karets
diameter på det ønskede okklusjonsstedet. Forsikre deg om at målkaret oppfyller den
anbefalte diameteren (se Tabell 1).
2. Forsikre deg om at okklusjonsstedet er langt nok til at MVP-enheten kan implanteres uten å
blokkere utilsiktede kar.
3. Velg et mikrokateter eller kateter (se anbefalt størrelse i Tabell 2), og klargjør det i henhold til
produsentens bruksanvisning.
4. Før inn ledevaieren, og før mikrokateteret eller kateteret frem over ledevaieren til den distale
tuppen er nær okklusjonsstedets fremre kant.
5. Fjern ledevaieren fra mikrokateteret eller kateteret.
6. Fjern MVP-systemet fra oppbevaringsrøret ved forsiktig å fjerne den gule innføringshylsen fra
de to ytre klemmene og trekke MVP-systemet ut av det gjennomsiktige røret. Grip forsiktig tak
i innføringshylsen på et sted proksimalt for MVP-enheten, og fjern langsomt MVP-enheten,
innføringsvaieren og innføringshylsen samtidig fra oppbevaringsrøret. Se Figur 3.
MVP-systemet i emballasjen
Figur 3.
1 Gjennomsiktig rør
2 Gul innføringshylse
3 Innføringsvaier (inni innføringshylsen)
4 Momentenhet
5 Oppbevaringsrør
6 MVP-enhet
7. Kontroller MVP-systemet nøye for avdekke eventuelle skader. Hvis MVP-systemet er skadet,
skal det erstattes med et nytt MVP-system.
8. Skyll MVP-systemet ved å legge noen få centimeter av innføringshylsen og MVP-enheten
forsiktig ned i heparinisert saltvann.
9. Trekk MVP-enheten inn i innføringshylsen ved å trekke i innføringsvaieren til MVP-enhetens
distale tupp så vidt er dekket av innføringshylsen.
Merk! Hvis MVP-enheten trekkes for langt inn i innføringshylsen, kan det være skyllingen ikke
skjer på riktig måte. To hull i innføringshylsen, 3 cm og 6 cm proksimalt for hylsens tupp, sørger
for fjerning av luft og skylling av enheten.
10. Før inn MVP-systemet ved å føre den distale enden av innføringshylsen gjennom den
roterende hemostaseventilen og inn i muffen på mikrokateteret eller kateteret til hylsen sitter
godt på plass. Stram den roterende hemostaseventilen så mye at tilbakeflow av blod hindres,
men ikke så mye at MVP-systemet skades ved innføring i mikrokateteret eller kateteret.
11. Kontroller visuelt at skylleløsningen infunderes normalt. Du skal se at det kommer dråper av
saltvann ut av innføringshylsens proksimale ende.
12. Løsne den roterende hemostaseventilen så mye at MVP-enheten og innføringsvaieren kan
føres frem sammen som et system. Den roterende hemostaseventilen må ikke løsnes så mye
at det fører til tilbakeflow av blod. Fjern innføringshylsen ved å trekke den ut over
innføringsvaierens proksimale ende.
13. Før frem innføringsvaieren og MVP-enheten til MVP-enhetens distale platinamarkør er rettet
inn med det distale markørbåndet på mikrokateteret eller kateteret.
14. Kontroller at markørbåndene er i optimal posisjon. Plasser MVP-enheten ved å opprettholde
forovertrykk på innføringsvaieren samtidig som du trekker mikrokateteret eller kateteret
langsomt tilbake for å avdekke MVP-enheten.
15. Hvis enhetens posisjon ikke er tilfredsstillende, gjør du følgende:
a. Stabiliser innføringsvaieren og før frem mikrokateteret eller kateteret ved å bevege det i
distal retning til MVP-enheten igjen er dekket av kateteret.
b. Reposisjoner enheten og plasser den på nytt, eller fjern enheten fra pasienten.
Merk! Enheten skal ikke dekkes av kateteret og plasseres på nytt mer enn maksimalt tre
ganger.
16. For at MVP-enheten skal kunne kobles fra på riktig måte, må den være posisjonert utenfor
mikrokateterets eller kateterets tupp.
17. Hvis enhetens posisjon er tilfredsstillende, kan du koble den fra på følgende måte:
a. Kontroller under gjennomlysning at mikrokateterets eller kateterets tupp befinner seg
proksimalt for MVP-enheten.
b. Koble momentenheten til innføringsvaieren. Koble fra MVP-enheten ved å dreie
innføringsvaieren mot klokken til den frigjøres fra enheten.
c. Bekreft under gjennomlysning at frakoblingen er vellykket, ved å trekke innføringsvaieren
langsomt i proksimal retning og forsikre deg om at MVP-enheten ikke beveger seg. Hvis
MVP-enheten mot formodning beveger seg i proksimal retning, må du gjenopprette
enhetens plassering og igjen dreie innføringsvaieren mot klokken for å koble fra.
18. Mens du holder mikrokateteret eller kateteret på plass, trekker du innføringsvaieren inn i
mikrokateteret eller kateteret og fjerner deretter innføringsvaieren fra pasienten. Fullfør
prosedyren i henhold til standard teknikk.
53
Page 54

11 Instruksjoner etter prosedyren
Hvis MedicAlert-tjenesten er tilgjengelig i din region, kan du anbefale pasienten å bli
MedicAlert-medlem på www.medicalert.org. Pasienten vil bli bedt om å oppgi tilstanden sin, navnet
på den implanterte enheten og begrensningene med hensyn til bruk av MR.
12 MR-informasjon
12.1 MR-betinget
Det er fastslått at MVP mikrovaskulær plugg er MR-betinget. Ikke-klinisk testing har vist at MVP
mikrovaskulær pluggenhet er MR-betinget. En pasient med denne enheten kan trygt skannes rett
etter plassering under følgende betingelser:
• statisk magnetfelt på 3 tesla eller mindre
• maksimalt romlig gradientmagnetfelt på 9000 gauss/cm eller mindre
• maksimal MR-systemrapportert spesifikk absorpsjonsrate (SAR) i gjennomsnitt for hele
kroppen på 4 W/kg ved skanning i 15 minutter (dvs. per pulssekvens)
• Kontrollert driftsmodus på første nivå for MR-systemet
12.2 MR-relatert oppvarming
Ved ikke-klinisk testing gav MVP mikrovaskulær pluggenhet følgende temperaturstigning ved
MR-skanning i 15 min (dvs. per pulssekvens) i MR-systemet på 3 tesla (3 tesla/128 MHz, Excite,
HDx, Software 14X.M5, General Electric Healthcare, Milwaukee, WI): Høyeste
temperaturforandring +1,8°C
Eksperimentene med hensyn til MR-relatert oppvarming for MVP mikrovaskulær pluggenhet ved
3 tesla ved bruk av en RF-kroppsspole med sender/mottaker ved en MR-systemrapportert SAR i
gjennomsnitt for hele kroppen på 2,9 W/kg (dvs. assosiert med en kalorimetrimålt verdi i
gjennomsnitt for hele kroppen på 2,7 W/kg) viste derfor at den største varmeøkningen som oppstod
i forbindelse med disse spesifikke forholdene, var lik eller mindre enn +1,8°C.
12.3 Informasjon om artefakter
Kvaliteten på MR-bildene kan bli redusert hvis undersøkelsesområdet er i nøyaktig det samme
området eller relativt nært stedet der MVP mikrovaskulær pluggenhet er plassert. Det kan derfor
være nødvendig å optimalisere MR-bildeparameterne for å kompensere for nærværet av denne
enheten. Den maksimale artefaktstørrelsen (dvs. som sett på gradientekko-pulssekvensen)
strekker seg ca. 5 mm i forhold til størrelsen og formen på MVP mikrovaskulær pluggenhet.
Pulssekvens
Signalbortfallstørrelse
Planretning Parallelt Perpendikulært Parallelt Perpendikulært
T1-SE T1-SE GRE GRE
252 mm
2
91 mm
2
304 mm
2
116 mm
2
retter og plikter skal tolkes og håndheves som om denne ansvarsfraskrivelsen ikke inneholdt den
bestemte delen eller betingelsen som ble funnet å være ugyldig.
Polski
1 Opis urządzenia
System zatyczki do drobnych naczyń MVP to samorozprężalne urządzenie służące do zamykania
światła naczynia. Urządzenie MVP ma jajowaty kształt i jest wykonane z nitinolu, a na jego obu
końcach zamocowane są platynowe znaczniki paskowe. Urządzenie jest częściowo pokryte PTFE.
Proksymalny znacznik paskowy jest przymocowany do drutu wprowadzającego, który przepycha
urządzenie do docelowego miejsca leczenia przez dostępny na rynku mikrocewnik lub cewnik. Drut
wprowadzający odłącza się od urządzenia MVP poprzez obrócenie drutu w kierunku przeciwnym
do ruchu wskazówek zegara w celu odkręcenia go od urządzenia.
System MVP pakowany jest jako jedna całość, która składa się z urządzenia MVP, koszulki
naczyniowej i odłączanego drutu wprowadzającego. System jest dostarczany w postaci jałowej,
jako niepirogenny i jest przeznaczony wyłącznie do jednorazowego użytku.
Rycina 1. Zatyczka do drobnych naczyń MVP
1 Częściowa osłona
2 Znacznik dystalny
3 Urządzenie MVP
4 Strefa odłączania
5 Drut wprowadzający
6 Znacznik proksymalny
Rycina 2. Wymiary systemu MVP
13 Oppbevaring
Unngå å eksponere MVP-systemet for vann, sollys, ekstreme temperaturer og høy fuktighet under
oppbevaring. Oppbevar MVP-systemet ved kontrollert romtemperatur. Siste forbruksdag for
enheten er angitt på produktetiketten. Bruk ikke enheten etter angitt siste forbruksdag.
14 Materialer
MVP-systemet inneholder ingen lateks- eller PVC-materialer.
15 Ansvarsfraskrivelse
Advarslene som finnes i produktmerkingen, inneholder mer detaljert informasjon og skal
betraktes som en uatskillelig del av denne ansvarsfraskrivelsen. Selv om produktet er
produsert under nøye kontrollerte forhold, har ikke Medtronic noen kontroll over
forholdene som produktet brukes under. Medtronic frasier seg derfor alt garantiansvar,
både uttrykt og underforstått, for dette produktet, inkludert, men ikke begrenset til enhver
underforstått garanti om salgbarhet eller egnethet til et bestemt formål. Medtronic påtar
seg ikke ansvar overfor noen person eller juridisk enhet for medisinske utgifter eller
direkte eller tilfeldige skader eller følgeskader forårsaket av bruk eller defekt, svikt eller feil
på produktet, enten kravet om slik erstatning er basert på garanti, kontrakt,
erstatningskrav utenfor kontraktsforhold eller annet. Ingen har myndighet til å binde
Medtronic til noen representasjon eller garanti vedrørende dette produktet.
Unntakene og begrensningene som er angitt ovenfor, er ikke ment å omgå obligatoriske
bestemmelser i gjeldende lov og skal heller ikke tolkes slik. Hvis en kompetent domstol finner at en
del eller betingelse i denne ansvarsfraskrivelsen er ulovlig, ikke kan håndheves eller er i strid med
gjeldende lov, skal ikke gyldigheten av de øvrige delene av ansvarsfraskrivelsen berøres, og alle
1 Długość drutu wprowadzającego
2 Długość w stanie nieograniczonym (urządzenie poza koszulką, niczym nieograniczone)
3 Średnica w stanie nieograniczonym
Tabela 1. Wymiary MVP Model Średnica w sta-
MVP-3Q 5,3 mm 12 mm 180 cm 1,5 mm–3,0 mm
MVP-5Q 6,5 mm 12 mm 180 cm 3,0 mm–5,0 mm
MVP-7Q 9,2 mm 16 mm 165 cm 5,0 mm–7,0 mm
MVP-9Q 13,0 mm 18 mm 165 cm 7,0 mm–9,0 mm
Tabela 2. Zalecany mikrocewnik lub cewnik Model Zalecany mikrocewnik lub
MVP-3Q od 0,53 mm (0,021 in) do
MVP-5Q 0,69 mm (0,027 in) (średnica
54
nie nieograniczonym
Długość w stanie nieograniczonym
cewnik
0,69 mm (0,027 in) (średnica
wewnętrzna)
wewnętrzna)
Długość drutu
wprowadzającego
Średnica naczynia docelowego
Maksymalna długość zalecanego mikrocewnika lub
cewnika
153 cm
153 cm
Page 55

Tabela 2. Zalecany mikrocewnik lub cewnik (ciąg dalszy)
Model Zalecany mikrocewnik lub
MVP-7Q 4 Fr (1,4 mm) (średnica zew-
MVP-9Q 5 Fr (1,7 mm) (średnica zew-
cewnik
nętrzna)
nętrzna)
Maksymalna długość zalecanego mikrocewnika lub
cewnika
120 cm
120 cm
2 Przeznaczenie / wskazania do stosowania
System zatyczki do drobnych naczyń MVP jest przeznaczony do utrudniania przepływu krwi w
naczyniach obwodowych lub zmniejszania szybkości tego przepływu.
3 Przeciwwskazania
Brak znanych przeciwwskazań do stosowania tego urządzenia.
4 Zgodność
Wymiary urządzenia podano na etykiecie produktu – systemu MVP. Aby ustalić zgodność, patrz
dokumentacja dostarczona z innymi produktami powiązanymi z technologiami medycznymi.
5 Ostrzeżenia
• Nie określono bezpieczeństwa i skuteczności stosowania systemu MVP podczas zabiegów
kardiologicznych (np. zamknięcie przegrody serca, przetrwały przewód tętniczy, zamknięcie
przecieku okołozastawkowego) i neurologicznych.
• System MVP powinien być stosowany wyłącznie przez lekarzy posiadających wiedzę na temat
zabiegów angiograficznych i interwencyjnych. Ważne jest, aby przed użyciem systemu MVP
przeczytać instrukcję użytkowania.
• Systemu MVP należy użyć przed upływem daty ważności wskazanej na etykiecie znajdującej
się na opakowaniu produktu.
• System MVP jest niepirogenny i dostarczany w postaci jałowej, chyba że opakowanie systemu
MVP zostało otwarte lub uszkodzone. Nie używać, jeżeli opakowanie zostało naruszone lub
uszkodzone.
• Przed użyciem systemu MVP należy go sprawdzić, a w przypadku zaobserwowania
jakichkolwiek nieprawidłowości lub uszkodzenia należy go wyrzucić.
• System MVP jest przeznaczony wyłącznie do jednorazowego użytku. Nie należy ponownie
poddawać obróbce ani sterylizacji. Ponowna obróbka i resterylizacja mogą zwiększyć ryzyko
zakażenia u pacjenta i niekorzystnie wpłynąć na działanie urządzenia. Po użyciu systemu MVP
należy go wyrzucić zgodnie z zasadami obowiązującymi w szpitalu i przepisami lokalnymi.
• System MVP należy wprowadzać lub manipulować nim pod kontrolą fluoroskopii. W razie
napotkania nadmiernego oporu nie wprowadzać dalej ani nie wycofywać do momentu
ustalenia przyczyny oporu.
• Nie należy skręcać ani obracać drutu wprowadzającego, z wyjątkiem sytuacji, w których
użytkownik ma zamiar odłączyć urządzenie, ponieważ może to doprowadzić do
przedwczesnego odłączenia urządzenia.
• Nie należy stosować strzykawki do wstrzyknięć pod ciśnieniem do wstrzykiwania roztworu
środka cieniującego, gdy urządzenie wprowadzone jest przez mikrocewnik lub cewnik.
• Nie należy wprowadzać drutu wprowadzającego po odłączeniu go od urządzenia MVP.
• Lekarz musi być przygotowany na sytuacje wyjątkowe wymagające usunięcia urządzenia. To
przygotowanie obejmuje upewnienie się, że na miejscu obecny jest chirurg.
• Nie należy stosować z cewnikami, które są przeciwwskazane w przypadku stosowania
urządzeń do embolizacji (na przykład spiral i/lub zatyczki).
6 Środki ostrożności
• Urządzenie MVP zbudowane jest ze stopu niklu i tytanu, który jest ogólnie uważany za
bezpieczny. Jednak badania in-vitro wykazały, że po wszczepieniu urządzenia nikiel jest z
niego uwalniany przez co najmniej 60 dni. U pacjentów uczulonych na nikiel, a w szczególności
u pacjentów, u których występowały alergie na metal, może dojść do reakcji alergicznej na
urządzenie. Niektóre reakcje alergiczne mogą być poważne; należy poinstruować pacjentów,
aby niezwłocznie powiadamiali lekarzy, jeśli podejrzewają u siebie wystąpienie reakcji
alergicznej, takiej jak trudności w oddychaniu lub zapalenie w obrębie twarzy lub gardła. U
niektórych pacjentów po wszczepieniu urządzenia może wystąpić alergia na nikiel.
• Lekarz powinien dokonać oceny klinicznej w sytuacjach obejmujących użycie leków
przeciwzakrzepowych lub przeciwpłytkowych przed, w trakcie lub po użyciu urządzenia.
• Należy zachować ostrożność w poniższych szczególnych populacjach pacjentów:
– W przypadku pacjentek w ciąży należy zadbać o to, aby ograniczyć napromieniowanie matki
i płodu.
– W przypadku matek karmiących nie dokonano ilościowej oceny obecności ługów w mleku
matki po wszczepieniu urządzenia.
• W przypadku stosowania podczas zabiegów wewnątrznaczyniowych innych urządzeń
dodatkowych należy sprawdzić kompatybilność systemu MVP. Lekarze stosujący system MVP
muszą znać techniki przezskórne i wewnątrznaczyniowe oraz możliwe powikłania związane z
zabiegiem.
• Przed użyciem system MVP należy nawodnić.
• Z systemem MVP należy obchodzić się ostrożnie, aby zmniejszyć ryzyko jego przypadkowego
uszkodzenia.
• W przypadku stosowania nacinanych mikrocewników lub cewników z kompozytu nitinolowego
istnieje ryzyko wystąpienia większych sił nacisku.
• Przed użyciem należy sprawdzić, czy średnica używanego akcesorium jest zgodna z
systemem MVP.
7 Możliwe zdarzenia niepożądane
Możliwe zdarzenia niepożądane, które mogą wystąpić w trakcie lub po zabiegu umieszczenia tego
urządzenia, obejmują między innymi:
• Zator powietrzny
• Reakcja alergiczna lub zatrucie
• Krwawienie
• Zgon
• Migracja urządzenia
• Gorączka
• Zator wywołany ciałem obcym
• Zakażenie
• Zamknięcie niewłaściwego naczynia
• Zator obwodowy
• Rekanalizacja
• Przepływ resztkowy
• Udar lub przejściowy incydent niedokrwienny (TIA)
• Interwencja chirurgiczna
• Powikłanie w miejscu dostępu naczyniowego
• Uraz lub perforacja naczynia
8 Wymagane materiały
1. Wprowadzenie systemu MVP wymaga użycia mikrocewnika lub cewnika (zalecany rozmiar,
patrz Tab. 2).
2. Wymagane są następujące akcesoria:
• Heparynizowany roztwór soli fizjologicznej
• Obrotowa zastawka hemostatyczna (RHV)
• Kranik trójdrożny
• Mankiet ciśnieniowy na worek z solą fizjologiczną
• Koszulka dostępowa
• Cewnik prowadzący kompatybilny z mikrocewnikiem lub cewnikiem zalecanym w Tab. 2
• Prowadnik kompatybilny z cewnikiem prowadzącym i mikrocewnikiem lub cewnikiem
• Stojak do infuzji dożylnej
9 Przygotowanie
1. Aby osiągnąć optymalne działanie systemu MVP i zmniejszyć ryzyko powikłań
zakrzepowo-zatorowych, konieczne jest zachowanie ciągłego przepływu roztworu soli
fizjologicznej pomiędzy następującymi elementami:
• koszulką dostępową i cewnikiem prowadzącym
• mikrocewnikiem lub cewnikiem i cewnikiem prowadzącym
• mikrocewnikiem lub cewnikiem i prowadnikiem oraz systemem MVP.
2. Umieścić odpowiedni cewnik prowadzący zgodnie z zalecaną procedurą. Podłączyć
obrotową zastawkę hemostatyczną (RHV) do gniazda cewnika prowadzącego. Przymocować
kranik trójdrożny do ramienia bocznego obrotowej zastawki hemostatycznej (RHV).
Podłączyć linię z heparynizowaną solą fizjologiczną w celu uzyskania ciągłego
przepłukiwania.
3. Sprawdzić wszystkie połączenia, aby się upewnić, że podczas ciągłego przepłukiwania
powietrze nie zostało wprowadzone do cewnika prowadzącego ani mikrocewnika lub cewnika.
55
Page 56

10 Instrukcja użycia
1. Uzyskać dostęp do docelowego naczynia i wykonać angiogram przy użyciu standardowej
techniki w celu pomiaru średnicy naczynia w żądanym miejscu zamknięcia. Upewnić się, że
średnica naczynia docelowego jest zgodna z zalecaną (patrz Tab. 1).
2. Upewnić się, że miejsce zamknięcia jest wystarczająco długie, aby mogło pomieścić
wszczepione urządzenie MVP bez blokowania naczyń, które nie są przedmiotem zabiegu.
3. Wybrać mikrocewnik lub cewnik (zalecany rozmiar podano w Tab. 2) i przygotować zgodnie z
instrukcjami stosowania dostarczonymi przez producenta.
4. Włożyć prowadnik i wprowadzać mikrocewnik lub cewnik po prowadniku, aż dystalna
końcówka znajdzie się w pobliżu przedniej krawędzi miejsca zamknięcia.
5. Wyjąć prowadnik z mikrocewnika lub cewnika.
6. Wyjąć system MVP z rurki zasobnika, delikatnie wyjmując żółtą koszulkę naczyniową z dwóch
zewnętrznych zacisków i wyciągając system MVP z rurki z przezroczystą obudową. Delikatnie
chwycić koszulkę naczyniową proksymalnie względem urządzenia MVP i powoli wyjąć
równocześnie urządzenie MVP, drut wprowadzający i koszulkę naczyniową z rurki zasobnika.
Patrz Ryc. 3.
Rycina 3. Zapakowany system MVP
Jeśli położenie urządzenia jest zadowalające, należy rozpocząć odłączanie poprzez podjęcie
17.
następujących działań:
a. Potwierdzić za pomocą fluoroskopii, że końcówka mikrocewnika lub cewnika ustawiona
jest proksymalnie względem urządzenia MVP.
b. Przymocować torquer do drutu wprowadzającego. Odłączyć urządzenie MVP przez
obracanie drutu wprowadzającego w kierunku przeciwnym do ruchu wskazówek zegara,
aż odłączy się on od urządzenia.
c. Należy potwierdzić pomyślne odłączenie przy użyciu fluoroskopii, delikatnie pociągając
proksymalnie drut wprowadzający w celu upewnienia się, że urządzenie MVP nie
przemieszcza się. Jeśli, co jest mało prawdopodobne, urządzenie MVP przemieści się
proksymalnie, należy ponownie je umieścić i jeszcze raz obrócić drut w kierunku
przeciwnym do ruchu wskazówek zegara, aby go odłączyć.
18. Przytrzymać mikrocewnik lub cewnik na miejscu, wycofać drut wprowadzający do
mikrocewnika lub cewnika, a następnie wyjąć drut wprowadzający z ciała pacjenta. Zakończyć
zabieg, stosując technikę standardową.
11 Instrukcje pozabiegowe
W przypadku dostępności usługi MedicAlert w danym regionie należy zalecić pacjentowi, aby
został członkiem MedicAlert na stronie www.medicalert.org. Pacjent zostanie poproszony o
opisanie swojego stanu, podanie nazwy wszczepionego urządzenia oraz ograniczeń dotyczących
użycia MRI.
12 Informacje dotyczące obrazowania metodą magnetycznego rezonansu jądrowego (MRI; Magnetic Resonance Imaging)
12.1 Badanie MR dopuszczalne w określonych warunkach
1 Rurka z przezroczystą obudową
2 Żółta koszulka naczyniowa
3 Drut wprowadzający (wewnątrz koszulki
wprowadzającej)
7. Sprawdzić dokładnie system MVP pod kątem uszkodzeń. Jeśli system MVP jest uszkodzony,
należy wymienić go na nowy system MVP.
8. Przepłukać system MVP poprzez delikatne zanurzenie kilkucentymetrowego odcinka koszulki
naczyniowej i urządzenia MVP w heparynizowanej soli fizjologicznej.
9. Wciągnąć urządzenie MVP do koszulki naczyniowej, pociągając drut wprowadzający tylko na
tyle, aby dystalna końcówka urządzenia MVP została przykryta koszulką naczyniową.
Uwaga: Jeśli urządzenie MVP zostanie wciągnięte zbyt głęboko do koszulki naczyniowej, jego
prawidłowe przepłukanie może nie być możliwe. Dwa otwory znajdujące się w koszulce
naczyniowej, w odległości 3 cm i 6 cm proksymalnie względem końcówki koszulki, ułatwiają
usuwanie powietrza i przepłukiwanie urządzenia.
10. Wprowadzić system MVP poprzez wprowadzenie dystalnego końca koszulki naczyniowej
przez obrotową zastawkę hemostatyczną (RHV) do gniazda mikrocewnika lub cewnika do
momentu pewnego osadzenia koszulki. Aby zapobiec wstecznemu przepływowi krwi,
zacisnąć obrotową zastawkę hemostatyczną (RHV) z wyczuciem, żeby nie uszkodzić systemu
MVP podczas wprowadzania go do mikrocewnika lub cewnika.
11. Sprawdzić wzrokowo, czy infuzja roztworu płuczącego przebiega prawidłowo. Z
proksymalnego końca koszulki naczyniowej powinny wypływać krople soli fizjologicznej.
12. Poluzować obrotową zastawkę hemostatyczną (RHV) na tyle, aby wprowadzić urządzenie
MVP i drut wprowadzający razem, jako układ. Obrotowej zastawki hemostatycznej (RHV) nie
należy luzować na tyle aby umożliwić wsteczny przepływ krwi. Wyjąć koszulkę naczyniową,
wycofując ją po proksymalnym końcu drutu wprowadzającego.
13. Wsuwać drut wprowadzający i urządzenie MVP, aż dystalny znacznik platynowy urządzenia
MVP zostanie wyrównany z dystalnym znacznikiem paskowym mikrocewnika lub cewnika.
14. Potwierdzić optymalne ustawienie znaczników paskowych. Umieścić urządzenie MVP
poprzez dopychanie drutu wprowadzającego i jednoczesne powolne wycofywanie
mikrocewnika lub cewnika w celu odsłonięcia urządzenia MVP.
15. Jeśli położenie urządzenia nie jest zadowalające, należy wykonać następujące czynności:
a. Ustabilizować drut wprowadzający i wsuwać mikrocewnik lub cewnik dystalnie, aż
urządzenie MVP zostanie ponownie uchwycone do wnętrza cewnika.
b. Zmienić położenie urządzenia i umieścić je, bądź wyjąć z ciała pacjenta.
Uwaga: Urządzenie nie powinno być ponownie umieszczane w koszulce ani zakładane
więcej niż 3 razy.
16. Urządzenie MVP powinno znajdować się za końcówką mikrocewnika lub cewnika, aby mogło
nastąpić prawidłowe odłączenie.
4 Torquer
5 Rurka zasobnika
6 Urządzenie MVP
Ustalono, że zatyczkę do drobnych naczyń MVP można warunkowo stosować w środowisku MR.
Badania niekliniczne wykazały, że urządzenie w postaci zatyczki do drobnych naczyń MVP można
warunkowo stosować w środowisku MR. Pacjent z tym urządzeniem może być bezpiecznie
skanowany bezpośrednio po implantacji przy zachowaniu następujących warunków:
• Statyczne pole magnetyczne o indukcji nieprzekraczającej 3 tesli
• Pole o maksymalnym gradiencie przestrzennym nie większym niż 9000 Gs/cm
• Maksymalny zgłoszony dla systemu MR uśredniony dla całego ciała współczynnik
pochłaniania (SAR) równy 4 W/kg dla skanowania trwającego 15 minut (czyli na sekwencję
impulsów)
• Kontrolowany tryb pracy pierwszego poziomu dla systemu MR
12.2 Nagrzewanie związane z MRI
W badaniach nieklinicznych urządzenie w postaci zatyczki do drobnych naczyń MVP spowodowało
następujący wzrost temperatury podczas skanowana MRI wykonywanego przez 15 min (czyli na
sekwencję impulsów) w systemie MR wytwarzającym pole o indukcji 3 T (3 T/128 MHz, Excite, HDx,
oprogramowanie 14X.M5, General Electric Healthcare, Milwaukee, WI): Największa zmiana
temperatury: +1,8°C
Dlatego eksperymenty związane z rozgrzewaniem w środowisku MRI przeprowadzone na
urządzeniu w postaci zatyczki do drobnych naczyń MVP w polu o indukcji 3 T z użyciem cewki
nadawczej/odbiorczej RF dla całego ciała przy wskaźniku absorpcji SAR zarejestrowanym przez
system MR równym 2,9 W/kg (tzn. powiązanym ze zmierzoną przy użyciu kalorymetrii uśrednioną
wartością dla całego ciała wynoszącą 2,7 W/kg) wykazały, że największa ilość wytworzonego
ciepła związana z tymi specyficznymi warunkami była mniejsza lub równa +1,8°C.
12.3 Informacje o artefaktach
W sytuacji gdy obszar zainteresowania odpowiada ściśle lub w przybliżeniu położeniu urządzenia
w postaci zatyczki do drobnych naczyń MVP jakość obrazu uzyskanego metodą rezonansu
magnetycznego może być obniżona. Dlatego w przypadku obecności tego urządzenia konieczne
może być zoptymalizowanie parametrów obrazowania metodą MR. Największy artefakt (tj. artefakt
widoczny w sekwencji impulsów echa gradientowego) rozciągał się na około 5 mm względem
rozmiaru i kształtu urządzenia w postaci zatyczki do drobnych naczyń MVP.
Sekwencja
impulsów T1-SE T1-SE GRE GRE
Wielkość obszaru
bez emisji
sygnału
Orientacja płaszczyzny
2
252 mm
Równoległa Prostopadła Równoległa Prostopadła
91 mm
2
304 mm
2
116 mm
2
56
Page 57

13 Przechowywanie
W trakcie przechowywania systemu MVP należy chronić go przed wodą, światłem słonecznym,
skrajnymi temperaturami i dużą wilgotnością. System MVP należy przechowywać w kontrolowanej
temperaturze pokojowej. Data ważności urządzenia, patrz etykieta produktu. Urządzenia nie
należy używać po upływie daty ważności podanej na etykiecie.
14 Materiały
System MVP nie jest wykonany z lateksu ani PCW.
15 Wyłączenie gwarancji
Ostrzeżenia podane na etykietach produktu zawierają bardziej szczegółowe informacje
i stanowią integralną część niniejszego wyłączenia gwarancji. Niezależnie od faktu, że
niniejszy produkt został wyprodukowany w starannie kontrolowanych warunkach, firma
Medtronic nie ma żadnej kontroli nad warunkami, w jakich ten produkt jest używany. Firma
Medtronic niniejszym wyklucza wszelkie gwarancje w odniesieniu do produktu, zarówno
wyraźne, jak i dorozumiane, w tym między innymi wszelkie dorozumiane gwarancje
przydatności handlowej lub przydatności do określonego celu. Firma Medtronic nie
ponosi odpowiedzialności wobec żadnej osoby ani innego podmiotu za żadne koszty
medyczne ani żadne bezpośrednie, przypadkowe ani wtórne szkody spowodowane
dowolnym zastosowaniem, wadą, awarią lub nieprawidłowym działaniem produktu, bez
względu na to, czy roszczenie z tytułu takich szkód zostanie wysunięte na podstawie
gwarancji, umowy, odpowiedzialności za szkodę wyrządzoną czynem niedozwolonym lub
w inny sposób. Nikomu nie przysługuje prawo do zobowiązania firmy Medtronic do
wydania oświadczenia lub gwarancji w związku z produktem.
Wyżej określone wyłączenia i ograniczenia nie mają na celu naruszania obowiązkowych
uregulowań stosowanego prawa i nie należy ich tak interpretować. Jeśli którakolwiek część lub
warunek niniejszego wyłączenia gwarancji zostaną uznane przez właściwy sąd za sprzeczne
z prawem, niemożliwe do wyegzekwowania lub stojące w konflikcie z obowiązującym prawem, fakt
ten nie wpłynie na ważność pozostałej części wyłączenia gwarancji, a wszelkie prawa
i zobowiązania będą interpretowane i egzekwowane tak, jak gdyby niniejsze wyłączenie gwarancji
nie zawierało danej części lub warunku uznanego za nieważny.
Português (Brasil)
1 Descrição do dispositivo
O sistema de plugue microvascular MVP é um dispositivo autoexpansível para oclusão de vasos.
O dispositivo MVP tem um formato oval, é feito de nitinol e fixo nas duas extremidades com bandas
marcadoras de platina. O dispositivo incorpora uma cobertura parcial de PTFE. A banda
marcadora proximal se liga a um fio de colocação que empurra o dispositivo através de um
microcateter ou cateter disponível comercialmente para o local de tratamento pretendido. O fio de
colocação é separado do dispositivo MVP pela rotação do fio de colocação no sentido anti-horário
para desaparafusá-lo do dispositivo.
O sistema MVP é embalado como uma unidade contendo o dispositivo MVP, uma bainha
introdutora e um fio de colocação separável. O sistema é fornecido estéril, apirogênico e se destina
apenas a uso único.
Figura 1. Plugue microvascular MVP
1 Cobertura parcial
2 Marcador distal
3 Dispositivo MVP
4 Zona de separação
5 Fio de colocação
6 Marcador proximal
Figura 2. Dimensões do sistema MVP
1 Comprimento do fio de colocação
2 Comprimento livre (dispositivo sem a
bainha e sem quaisquer restrições)
Tabela 1. Dimensões do MVP Modelo Diâmetro livre Comprimento
MVP-3Q 5,3 mm 12 mm 180 cm 1,5 mm – 3,0 mm
MVP-5Q 6,5 mm 12 mm 180 cm 3,0 mm – 5,0 mm
MVP-7Q 9,2 mm 16 mm 165 cm 5,0 mm – 7,0 mm
MVP-9Q 13,0 mm 18 mm 165 cm 7,0 mm – 9,0 mm
Tabela 2. Microcateter ou cateter recomendado Modelo Microcateter ou cateter
MVP-3Q 0,53 mm (0,021 in) a 0,69 mm
MVP-5Q 0,69 mm (0,027 in) (DI) 153 cm
MVP-7Q 4 Fr (1,4 mm) (DE) 120 cm
MVP-9Q 5 Fr (1,7 mm) (DE) 120 cm
livre
recomendado
(0,027 in)
3 Diâmetro livre
Comprimento
do fio de colocação
Diâmetro do
vaso alvo
Comprimento máximo do
microcateter ou cateter
recomendado
153 cm
2 Uso previsto/indicações de uso
O sistema de plugue microvascular MVP é indicado para obstruir ou reduzir o fluxo sanguíneo na
vasculatura periférica.
3 Contraindicações
Não existem contraindicações conhecidas para este dispositivo.
4 Compatibilidade
Consulte a etiqueta do produto do sistema MVP para ver as dimensões do dispositivo. Consulte as
etiquetas fornecidas com outras tecnologias médicas para determinar a compatibilidade.
5 Avisos
• A segurança e eficácia do sistema MVP não foram determinadas para usos cardíacos (por
exemplo, oclusão do septo cardíaco, persistência do canal arterial, fechamento de vazamento
paravalvular) e usos neurológicos.
• O sistema MVP deve ser usado apenas por médicos familiarizados com procedimentos
angiográficos e intervencionistas. É importante ler as instruções de utilização antes de usar o
sistema MVP.
• Use o sistema MVP antes do prazo de validade impresso na etiqueta da embalagem do
produto.
• O sistema MVP é apirogênico e fornecido estéril, a menos que a embalagem do sistema MVP
esteja aberta ou danificada. Não use se a embalagem tiver sido violada ou danificada.
• Inspecione o sistema MVP antes do uso e descarte se observar alguma irregularidade ou
danos.
• O sistema MVP se destina apenas a uso único. Não reprocesse nem reesterilize. O
reprocessamento e a reesterilização podem aumentar os riscos de infecção do paciente e de
comprometimento do desempenho do dispositivo. Depois de usar o sistema MVP, descarte em
conformidade com as diretivas hospitalares e governamentais locais.
• Use orientação fluoroscópica quando avançar ou manipular o sistema MVP. Não avance ou
retire o dispositivo quando encontrar resistência excessiva, até determinar a causa da
resistência.
• Não torça nem rode o fio de colocação, exceto se pretender separar o dispositivo, ou então o
dispositivo poderá se separar prematuramente.
57
Page 58

• Não use uma seringa de injeção elétrica para injetar solução de contraste com o dispositivo
através de um microcateter ou cateter.
• Não avance o fio de colocação após separá-lo do dispositivo MVP.
• Os médicos devem estar preparados para lidar com situações urgentes que exijam a remoção
do dispositivo. Essa preparação inclui garantir a disponibilidade de um cirurgião no local.
• Não use com cateteres contraindicados para dispositivos embólicos (por exemplo, espirais ou
um plugue).
6 Precauções
• O dispositivo MVP consiste de uma liga de níquel-titânio normalmente considerada segura.
Porém, testes in vitro demonstraram que níquel é liberado do dispositivo por um mínimo de 60
dias após o implante. Os pacientes alérgicos ao níquel podem apresentar uma reação alérgica
ao dispositivo, sobretudo os pacientes com um histórico de alergias a metais. Algumas reações
alérgicas podem ser graves; os pacientes devem ser aconselhados a notificar seus médicos
imediatamente se suspeitarem que estão tendo uma reação alérgica, como dificuldade para
respirar ou inflamação da face ou da garganta. Alguns pacientes podem desenvolver alergia ao
níquel se o dispositivo for implantado.
• Os médicos devem exercer seu julgamento clínico em situações que envolvam o uso de
fármacos anticoagulantes ou antiplaquetários antes, durante ou após o uso do dispositivo.
• Tenha cuidado nas seguintes populações específicas:
– Nas pacientes grávidas, deve ser tomado cuidado para minimizar a exposição da mãe e do
feto à radiação.
– No caso de lactantes, não houve avaliação quantitativa da presença de substâncias
lixiviáveis no leite materno após o implante do dispositivo.
• Verifique a compatibilidade do sistema MVP quando usar outros dispositivos auxiliares em
procedimentos intravasculares. Os médicos que usam o sistema MVP devem estar
familiarizados com técnicas percutâneas e intravasculares e com as complicações possíveis
associadas ao procedimento.
• O sistema MVP deve ser hidratado antes do uso.
• Tenha cuidado quando manusear o sistema MVP para reduzir as probabilidades de danos
acidentais.
• Existe potencial para forças de impulsão mais elevadas quando usado com microcateteres ou
cateteres de compósito de nitinol ranhurados.
• Antes de usar, verifique se o diâmetro de qualquer dispositivo acessório utilizado é compatível
com o sistema MVP.
7 Eventos adversos potenciais
Os eventos adversos potenciais que podem ocorrer durante ou após o procedimento de colocação
deste dispositivo incluem, entre outros, os seguintes:
• Êmbolos gasosos
• Reação alérgica ou efeitos tóxicos
• Sangramento
• Morte
• Migração do dispositivo
• Febre
• Evento embólico por material estranho
• Infecção
• Oclusão de outro vaso não pretendido
• Embolia periférica
• Recanalização
• Fluxo residual
• AVC ou ataque isquêmico transitório (AIT)
• Intervenção cirúrgica
• Complicação no local de acesso vascular
• Trauma ou perfuração do vaso
8 Materiais necessários
1. A colocação do sistema MVP requer o uso de um microcateter ou de um cateter (consulte a
Tabela 2 para ver o tamanho recomendado).
2. São necessários os acessórios seguintes:
• Soro fisiológico heparinizado
• Válvula hemostática rotativa (VHR)
• Torneira de 3 vias
• Braçadeira de pressão para bolsa de soro fisiológico
• Bainha para acesso
• Cateter-guia compatível com um microcateter ou com um cateter recomendado na
Tabela 2
• Fio-guia compatível com o cateter-guia e com o microcateter ou com o cateter
• Suporte de infusão intravenosa (IV)
9 Preparação
1. Para obter o desempenho ideal do sistema MVP e para reduzir o risco de complicações
tromboembólicas, mantenha uma irrigação contínua com soro fisiológico entre os seguintes
itens:
• a bainha de acesso e o cateter-guia;
• o microcateter ou cateter e o cateter-guia;
• o microcateter ou cateter, o fio-guia e o sistema MVP.
2. Coloque o cateter-guia adequado seguindo o procedimento recomendado. Conecte uma
válvula hemostática rotativa (VHR) ao conector do cateter-guia. Ligue uma torneira de 3 vias
ao braço lateral da VHR. Conecte uma linha de soro fisiológico heparinizado para obter uma
irrigação contínua.
3. Verifique todas as conexões para garantir que não é introduzido ar no cateter-guia nem no
microcateter ou cateter durante a irrigação contínua.
10 Instruções de uso
1. Acesse o vaso alvo e realize um angiograma usando uma técnica padrão para medir o
diâmetro do vaso no local desejado da oclusão. Certifique-se de que o vaso alvo atende ao
diâmetro recomendado (consulte a Tabela 1).
2. Certifique-se de que o local da oclusão é suficientemente longo para acomodar o dispositivo
MVP implantado sem obstruir outros vasos não pretendidos.
3. Selecione um microcateter ou cateter (consulte a Tabela 2 para o tamanho recomendado) e
o prepare de acordo com as instruções de uso do fabricante.
4. Insira o fio-guia e avance o microcateter ou cateter sobre o fio-guia até a ponta distal estar
próxima da borda de ataque (a borda mais avançada) do local da oclusão.
5. Remova o fio-guia do microcateter ou cateter.
6. Remova o sistema MVP do tubo de acondicionamento, removendo suavemente a bainha
introdutora amarela dos dois grampos externos, e puxe o sistema MVP para fora do tubo de
proteção transparente. Agarre suavemente a bainha introdutora em um local proximal ao
dispositivo MVP e remova lentamente o dispositivo MVP, o fio de colocação e a bainha
introdutora do tubo de acondicionamento. Consulte a Figura 3.
Figura 3. Sistema MVP embalado
1 Tubo de proteção transparente
2 Bainha introdutora amarela
3 Fio de colocação (dentro da bainha
introdutora)
4 Dispositivo de torção
5 Tubo de acondicionamento
6 Dispositivo MVP
7. Inspecione minuciosamente o sistema MVP para verificar a existência de danos. Se o sistema
MVP estiver danificado, substitua por um sistema MVP novo.
8. Irrigue o sistema MVP mergulhando cuidadosamente alguns centímetros da bainha
introdutora e o dispositivo MVP em soro fisiológico heparinizado.
9. Puxe o dispositivo MVP para dentro da bainha introdutora puxando o fio de colocação
somente até a ponta distal do dispositivo MVP ficar coberta pela bainha introdutora.
Observação: Se o dispositivo MVP for puxado muito para dentro da bainha introdutora ele
poderá não ser irrigado corretamente. Dois orifícios na bainha introdutora, localizados a 3 cm
e 6 cm proximais à ponta da bainha, facilitam a purga de ar e a irrigação do dispositivo.
10. Introduza o sistema MVP inserindo a extremidade distal da bainha introdutora através da VHR
e para dentro do conector do microcateter ou cateter, até a bainha introdutora ficar firmemente
58
Page 59

assentada. Aperte a VHR o suficiente para evitar o refluxo de sangue, mas não tão apertada
que danifique o sistema MVP durante sua introdução no microcateter ou cateter.
11. Verifique visualmente se a infusão da solução de irrigação está normal. Deve ser possível ver
gotas de soro fisiológico saindo pela extremidade proximal da bainha introdutora.
12. Desaperte a VHR o suficiente para permitir que o dispositivo MVP e o fio de colocação sejam
avançados em conjunto como um sistema. Não desaperte a VHR tanto que permita o refluxo
de sangue. Remova a bainha introdutora retirando-a sobre a extremidade proximal do fio de
colocação.
13. Avance o fio de colocação e o dispositivo MVP até o marcador distal de platina do dispositivo
MVP estar alinhado com a banda marcadora distal do microcateter ou cateter.
14. Confirme que as bandas marcadoras estão posicionadas de forma ideal. Implante o
dispositivo MVP mantendo pressão no fio de colocação para mantê-lo no lugar, ao mesmo
tempo que retrai lentamente o microcateter ou cateter, para retirar o dispositivo MVP de dentro
deste.
15. Se a posição do dispositivo não for satisfatória, faça o seguinte:
a. Estabilize o fio de colocação e avance o microcateter ou cateter movendo-o distalmente,
até o dispositivo MVP ser recapturado no interior do cateter.
b. Ou reposicione e implante o dispositivo, ou remova o dispositivo do paciente.
Observação: O dispositivo não deve ser reintroduzido no microcateter ou cateter e
implantado mais de 3 vezes.
16. Para uma separação correta, o dispositivo MVP deve ser posicionado além da ponta do
microcateter ou do cateter.
17. Se a posição do dispositivo for satisfatória, prossiga com a separação fazendo o seguinte:
a. Confirme sob fluoroscopia que a ponta do microcateter ou cateter está proximal ao
dispositivo MVP.
b. Prenda o dispositivo de torção ao fio de colocação. Solte o dispositivo MVP rodando o fio
de colocação no sentido anti-horário, até ele se separar do dispositivo.
c. Verifique o êxito da separação com fluoroscopia, puxando lentamente o fio de colocação
na direção proximal (contrária ao dispositivo) para certificar-se de que o dispositivo MVP
não se move. No caso improvável de o dispositivo MVP se mover na direção proximal,
restabeleça a colocação do dispositivo e repita a rotação no sentido anti-horário do fio de
colocação para separá-lo.
18. Mantendo o microcateter ou cateter no lugar, retraia o fio de colocação para dentro do
microcateter ou cateter e, em seguida, remova o fio de colocação do paciente. Conclua o
procedimento seguindo uma técnica padrão.
11 Instruções pós-procedimento
Se o serviço MedicAlert estiver disponível em sua região, recomende ao paciente para tornar-se
membro do MedicAlert em www.medicalert.org. Será pedido ao paciente para fornecer sua
condição clínica, o nome do dispositivo implantado e as restrições referentes a RM.
12 Informações sobre RM
12.1 Condicional para RM
Foi determinado que o plugue microvascular MVP é condicional para RM. Testes não clínicos
demonstraram que o plugue microvascular MVP é condicional para RM. Um paciente com este
dispositivo pode ser examinado em segurança, imediatamente após a colocação, nas seguintes
condições:
• Campo magnético estático de 3 Tesla ou inferior
• Gradiente espacial máximo do campo magnético de 9000 Gauss/cm ou inferior
• Sistema de RM máximo relatado, taxa de absorção específica média de corpo inteiro (SAR) de
4 W/kg para 15 minutos de exame (i.e., por sequência de impulsos)
• Modo de funcionamento controlado de primeiro nível para o sistema de RM
12.2 Aquecimento relacionado com a RM
Em testes não clínicos, o dispositivo do plugue microvascular MVP produziu a seguinte elevação
de temperatura durante RM realizada em 15 min de exame (i.e., por sequencia de impulsos) no
sistema de RM de 3 Tesla (3 Tesla/128 MHz, Excite, HDx, Software 14X.M5, General Electric
Healthcare, Milwaukee, WI): maior alteração de temperatura de +1,8°C
Por conseguinte, as experiências de aquecimento relacionadas à RM do dispositivo de plugue
microvascular MVP a 3 Tesla, usando uma bobina de transmissão/recepção de RF para o corpo em
um sistema de RM relatado como tendo uma taxa de absorção específica (SAR) média de corpo
inteiro de 2,9 W/kg (i.e., associada a um valor médio de corpo inteiro, medido por calorimetria, de
2,7 W/kg) indicaram que a maior elevação de temperatura ocorrida nessas condições específicas
foi igual ou inferior a +1,8°C.
12.3 Informações sobre artefatos
A qualidade das imagens de RM pode ser comprometida se a área de interesse estiver na mesma
área ou relativamente próxima da posição do dispositivo de plugue microvascular MVP. Portanto,
poderá ser necessário otimizar os parâmetros da RM para compensar a presença deste
dispositivo. O tamanho máximo do artefato (isto é, conforme visto na sequência de impulsos eco
gradiente), se estende por aproximadamente 5 mm em relação ao tamanho e forma do dispositivo
de plugue microvascular MVP.
Sequência de
impulsos T1-SE T1-SE GRE GRE
Tamanho do vazio
de sinal
Orientação do
plano
2
252 mm
Paralelo Perpendicular Paralelo Perpendicular
91 mm
2
304 mm
2
116 mm
2
13 Armazenamento
Evite exposição do sistema MVP à água, à luz solar direta, a temperaturas extremas e à umidade
durante o armazenamento. Armazene o sistema MVP em temperatura ambiente controlada.
Consulte a etiqueta do produto quanto à data de validade. Não use o dispositivo depois do prazo
de validade indicado na etiqueta.
14 Materiais
O sistema MVP não contém látex nem materiais de PVC.
15 Renúncia de garantia
Os avisos contidos nas etiquetas do produto fornecem informações mais detalhadas e
são considerados como parte integrante desta renúncia de garantia. Embora o produto
tenha sido fabricado em condições cuidadosamente controladas, a Medtronic não tem
qualquer controle sobre as condições nas quais este produto é usado. Portanto, a
Medtronic renuncia a quaisquer garantias, expressas ou implícitas, em relação ao
produto, incluindo, sem limitação, quaisquer garantias implícitas de comercialização ou
de adequação a um fim específico. A Medtronic não será responsável, perante qualquer
pessoa ou entidade, por quaisquer despesas médicas ou por quaisquer danos diretos,
incidentais ou consequenciais causados por qualquer uso, defeito, falha ou mau
funcionamento do produto, quer a reclamação relativa a tais danos tenha por base a
garantia, o contrato, delito ou outros. Nenhuma pessoa possui autoridade para vincular a
Medtronic a qualquer tipo de representação ou garantia relativas ao produto.
As exclusões e limitações acima não se destinam a infringir disposições obrigatórias da lei
aplicável, não devendo ser interpretadas como tal. Se alguma parte ou termo desta renúncia de
garantia for considerado ilegal, não executável ou em conflito com a lei aplicável por parte de um
tribunal da jurisdição competente, a validade das partes restantes desta renúncia de garantia não
deverá ser afetada e todos os direitos e obrigações devem ser interpretados e executados como se
esta renúncia de garantia não contivesse a parte ou termo particular considerado inválido.
Português (Portugal)
1 Descrição do dispositivo
O sistema de tampão microvascular MVP é um dispositivo de oclusão de vasos autoexpansível. O
dispositivo MVP tem uma forma ovoide, é fabricado em nitinol e é fixado em ambas as
extremidades com faixas marcadoras em platina. O dispositivo incorpora uma cobertura parcial de
PTFE. A faixa marcadora proximal fixa-se num fio de colocação que empurra o dispositivo através
de um microcateter ou cateter disponível no mercado até ao local de tratamento pretendido. O fio
de colocação solta-se do dispositivo MVP, rodando o fio de colocação no sentido contrário ao dos
ponteiros do relógio para o desaparafusar do dispositivo.
O sistema MVP é embalado como uma só unidade que contém o dispositivo MVP, uma bainha
introdutora e um fio de colocação destacável. O sistema é fornecido estéril, é não pirogénico e
destina-se a uma única utilização.
59
Page 60

Figura 1. Tampão microvascular MVP
1 Cobertura parcial
2 Marcador distal
3 Dispositivo MVP
Figura 2. Dimensões do sistema MVP
1 Comprimento do fio de colocação
2 Comprimento sem restrições (dispositivo desembainhado e sem quaisquer restrições sobre
o mesmo)
3 Diâmetro sem restrições
Tabela 1. Dimensões do MVP Modelo Diâmetro sem
MVP-3Q 5,3 mm 12 mm 180 cm 1,5 mm – 3,0 mm
MVP-5Q 6,5 mm 12 mm 180 cm 3,0 mm – 5,0 mm
MVP-7Q 9,2 mm 16 mm 165 cm 5,0 mm – 7,0 mm
MVP-9Q 13,0 mm 18 mm 165 cm 7,0 mm – 9,0 mm
Tabela 2. Microcateter ou cateter recomendado Modelo Microcateter ou cateter
MVP-3Q 0,53 mm (0,021 in [pol.]) a
MVP-5Q 0,69 mm (0,027 in [pol.]) (D.I.) 153 cm
MVP-7Q 1,4 mm (4 Fr) (D.E.) 120 cm
MVP-9Q 1,7 mm (5 Fr) (D.E.) 120 cm
restrições
Comprimento
sem restrições
recomendado
0,69 mm (0,027 in [pol.]) (D.I.)
4 Zona de separação
5 Fio de colocação
6 Marcador proximal
Comprimento
do fio de colocação
Comprimento máximo recomendado do microcateter
ou cateter
153 cm
Diâmetro do
vaso-alvo
2 Utilização prevista/Indicações de utilização
O sistema de tampão microvascular MVP é indicado para obstruir ou reduzir o fluxo sanguíneo na
vasculatura periférica.
3 Contraindicações
Não existem contraindicações conhecidas para este dispositivo.
4 Compatibilidade
Para obter as dimensões do dispositivo, consulte a etiqueta de produto do sistema MVP. Para
determinar a compatibilidade, consulte a documentação fornecida juntamente com outras
tecnologias médicas.
5 Avisos
• A segurança e eficácia do sistema MVP não foram estabelecidas para utilizações cardíacas
(por exemplo, oclusão do septo cardíaco, persistência do canal arterial, fecho de fuga
paravalvular) e utilizações neurológicas.
• O sistema MVP deverá ser apenas utilizado por médicos familiarizados com procedimentos
angiográficos e de intervenção. É importante ler as instruções de utilização antes de utilizar o
sistema MVP.
• Utilize o sistema MVP antes da data de validade impressa na etiqueta da embalagem do
produto.
• O sistema MVP é não pirogénico e fornecido estéril, exceto se a embalagem do sistema MVP
estiver aberta ou danificada. Não utilize se a embalagem tiver sido violada ou danificada.
• Inspecione o sistema MVP antes da utilização e elimine-o se observar irregularidades ou
danos.
• O sistema MVP destina-se a uma única utilização. Não reprocesse nem reesterilize. O
reprocessamento e a reesterilização podem aumentar os riscos de infeção para o doente e de
comprometimento do desempenho do dispositivo. Após a utilização do sistema MVP, elimine-o
de acordo com as políticas hospitalares e governamentais locais.
• Utilize a orientação fluoroscópica quando avançar ou manusear o sistema MVP. Não avance
nem recue o dispositivo quando encontrar uma resistência excessiva, até que a causa da
resistência seja determinada.
• Não torça nem rode o fio de colocação, a não ser que pretenda separar o dispositivo, pois este
pode destacar-se prematuramente.
• Não utilize uma seringa de injeção automática para injetar solução de contraste com o
dispositivo através de um microcateter ou cateter.
• Não avance o fio de colocação depois de o separar do dispositivo MVP.
• Os médicos deverão estar preparados para lidar com situações urgentes que exijam a
remoção do dispositivo. Esta preparação inclui assegurar a presença de um cirurgião no local.
• Não utilize com cateteres que estejam contraindicados para dispositivos embólicos (por
exemplo, espirais ou uma ficha).
6 Precauções
• O dispositivo MVP é composto por uma liga de níquel-titânio, geralmente considerada segura.
Contudo, os testes in vitro demonstraram que o níquel é libertado do dispositivo após o
implante durante um mínimo de 60 dias. Os doentes alérgicos ao níquel poderão ter uma
reação alérgica ao dispositivo, em particular os doentes com um historial de alergias a metais.
Determinadas reações alérgicas podem ser graves. Os doentes deverão ser instruídos a
notificar o médico de imediato, caso suspeitem que estão a ter uma reação alérgica, tal como
dificuldade respiratória ou inflamação do rosto ou da garganta. Alguns doentes poderão
desenvolver uma alergia ao níquel se o dispositivo for implantado.
• Os médicos devem fazer uma avaliação clínica em situações que envolvam a utilização de
fármacos anticoagulantes ou antiplaquetários antes, durante ou após a utilização do
dispositivo.
• Tenha em atenção as seguintes populações específicas:
– Em caso de gravidez, deverão ser tomadas precauções para minimizar a exposição da mãe
e do feto à radiação.
– Em relação a mães lactantes, a presença de lixiviáveis no leito materno após implante com
o dispositivo não foi avaliada quantitativamente.
• Verifique a compatibilidade do sistema MVP se pretender utilizar outros dispositivos auxiliares
em procedimentos intravasculares. Os médicos que utilizem o sistema MVP devem conhecer
as técnicas percutâneas e intravasculares, bem como as possíveis complicações associadas
ao procedimento.
• O sistema MVP deve ser hidratado antes da utilização.
• Proceda com cuidado ao manusear o sistema MVP para reduzir o risco de ocorrência de danos
acidentais.
• Existe a probabilidade de se exercer uma pressão superior quando o sistema é utilizado com
microcateteres ou cateteres ranhurados compostos de nitinol.
• Antes da utilização, certifique-se de que o diâmetro de qualquer dispositivo acessório que
utilize é compatível com o sistema MVP.
7 Possíveis efeitos adversos
Os efeitos adversos que podem ocorrer durante ou após um procedimento de colocação deste
dispositivo incluem, entre outros, os seguintes itens:
• Êmbolo gasoso
• Reação alérgica ou efeitos tóxicos
• Hemorragia
• Morte
• Migração do dispositivo
• Febre
• Evento embólico por material estranho
• Infeção
• Oclusão de vaso indesejado
60
Page 61

• Embolia periférica
• Recanalização
• Fluxo residual
• AVC ou ataque isquémico transitório (AIT)
• Intervenção cirúrgica
• Complicação no local de acesso vascular
• Trauma ou perfuração de vasos sanguíneos
8 Materiais necessários
1. A colocação do sistema MVP requer a utilização de um microcateter ou cateter (consulte a
Tabela 2 para o tamanho recomendado).
2. São necessários os seguintes acessórios:
• Soro fisiológico heparinizado
• Válvula hemostática rotativa (VHR)
• Torneira de passagem de 3 vias
• Manga de pressão para saco de soro fisiológico
• Bainha de acesso
• Cateter-guia compatível com um microcateter ou cateter recomendado na Tabela 2
• Fio-guia compatível com o cateter-guia e o microcateter ou cateter
• Suporte de infusão intravenosa (IV)
9 Preparação
1. Para obter o melhor desempenho do sistema MVP e reduzir o risco de complicação
tromboembólica, mantenha uma irrigação constante de soro fisiológico entre os itens
seguintes:
• Bainha de acesso e cateter-guia
• Microcateter ou cateter e cateter-guia
• Microcateter ou cateter, fio-guia e sistema MVP
2. Coloque o cateter-guia adequado de acordo com o procedimento recomendado. Ligue uma
válvula hemostática rotativa (VHR) ao conector do cateter-guia. Coloque uma torneira de
passagem de 3 vias no braço lateral da VHR. Ligue uma linha de soro heparinizado para uma
irrigação contínua.
3. Verifique todos os encaixes para garantir que não entra ar no cateter-guia ou no microcateter
ou cateter durante a irrigação contínua.
10 Instruções de utilização
1. Aceda ao vaso-alvo e efetue um angiograma utilizando uma técnica padrão para medir o
diâmetro do vaso no local de oclusão pretendido. Certifique-se de que o vaso-alvo obedece
ao diâmetro recomendado (consulte a Tabela 1).
2. Certifique-se de que o local de oclusão tem um comprimento suficiente para acomodar o
dispositivo MVP implantado, sem obstruir vasos indesejados.
3. Selecione um microcateter ou cateter (consulte a Tabela 2 para o tamanho recomendado) e
prepare-o de acordo com as instruções de utilização do fabricante.
4. Insira o fio-guia e avance o microcateter ou cateter sobre o fio-guia até a ponta distal ficar perto
da extremidade anterior do local de oclusão.
5. Remova o fio-guia do microcateter ou cateter.
6. Retire o sistema MVP do tubo dispensador, removendo com cuidado a bainha introdutora
amarela dos dois clipes externos e puxe o sistema MVP para fora do tubo de alojamento
transparente. Pegue cuidadosamente na bainha introdutora num local proximal ao dispositivo
MVP e retire lentamente o dispositivo MVP, o fio de colocação e a bainha introdutora em
simultâneo do tubo dispensador. Consulte a Figura 3.
Figura 3. Sistema MVP embalado
1 Tubo de alojamento transparente
2 Bainha introdutora amarela
3 Fio de colocação (dentro da bainha
introdutora)
4 Dispositivo de aperto
5 Tubo dispensador
6 Dispositivo MVP
7. Inspecione o sistema MVP cuidadosamente para detetar a presença de danos. Se o sistema
MVP apresentar danos, substitua-o por um sistema MVP novo.
8. Irrigue o sistema MVP mergulhando com cuidado alguns centímetros da bainha introdutora e
o dispositivo MVP em soro fisiológico heparinizado.
9. Introduza o dispositivo MVP na bainha introdutora puxando o fio de colocação apenas até a
ponta distal do dispositivo MVP estar coberta pela bainha introdutora.
Nota: Se for demasiado inserido na bainha introdutora, o dispositivo MVP poderá não irrigar
corretamente. Os dois orifícios existentes na bainha introdutora, localizados 3 cm e 6 cm
proximalmente à ponta da bainha, facilitam a purga de ar e a irrigação do dispositivo.
10. Introduza o sistema MVP, inserindo a extremidade distal da bainha introdutora através da VHR
dentro do conector do microcateter ou cateter até a bainha estar firmemente instalada. Aperte
a VHR o suficiente para evitar o refluxo de sangue, mas não a ponto de danificar o sistema
MVP durante a respetiva introdução no microcateter ou cateter.
11. Verifique visualmente se a infusão da solução de irrigação é normal. Deverão estar visíveis
gotas de soro fisiológico a sair da extremidade proximal da bainha introdutora.
12. Desaperte a VHR o suficiente para permitir que o dispositivo MVP e o fio de colocação
avancem em conjunto como um sistema. Não desaperte a VHR em demasia, uma vez que
isso pode permitir o refluxo de sangue. Retire a bainha introdutora, fazendo-a recuar sobre a
extremidade proximal do fio de colocação.
13. Avance o fio de colocação e o dispositivo MVP até o marcador de platina distal do dispositivo
MVP estar alinhado com a faixa marcadora distal do microcateter ou cateter.
14. Certifique-se de que as faixas marcadoras estão posicionadas corretamente. Coloque o
dispositivo MVP em utilização exercendo pressão no fio de colocação enquanto retrai
lentamente o microcateter ou cateter para desembainhar o dispositivo MVP.
15. Se a posição do dispositivo não for satisfatória, faça o seguinte:
a. Estabilize o fio de colocação e avance o microcateter ou cateter deslocando-o
distalmente, até o dispositivo MVP ser recapturado dentro do cateter.
b. Reposicione e desprenda o dispositivo ou remova-o do doente.
Nota: O dispositivo não deve voltar a ser embainhado e desprendido mais do que um
máximo de 3 vezes.
16. Para um desprendimento adequado, o dispositivo MVP deve ser posicionado para além da
ponta do microcateter ou cateter.
17. Se a posição do dispositivo for satisfatória, prossiga com o desprendimento e faça o seguinte:
a. Confirme sob fluoroscopia que a ponta do microcateter ou cateter está em posição
proximal ao dispositivo MVP.
b. Coloque o dispositivo de aperto no fio de colocação. Desprenda o dispositivo MVP
rodando o fio de colocação no sentido contrário ao dos ponteiros do relógio até que este
se separe do dispositivo.
c. Verifique fluoroscopicamente se o desprendimento foi bem-sucedido, puxando com
cuidado o fio de colocação numa direção proximal para se certificar de que o dispositivo
MVP não se move. No caso improvável de o dispositivo MVP se deslocar numa direção
proximal, restabeleça a colocação do dispositivo e repita a rotação no sentido contrário
ao dos ponteiros do relógio do fio de colocação para efetuar o desprendimento.
18. Enquanto segura o microcateter ou cateter no devido lugar, retraia o fio de colocação para
dentro do microcateter ou cateter e, em seguida, remova o fio de colocação do doente. Siga
a técnica padrão para concluir o procedimento.
11 Instruções de pós-procedimento
Se o serviço MedicAlert estiver disponível na sua área, recomende ao doente que se torne membro
do MedicAlert em www.medicalert.org. Será pedido ao doente que indique a sua situação, o nome
do dispositivo implantado e as restrições relativas à utilização de RM.
12 Informações sobre RM
12.1 RM condicional
Foi determinado que o tampão microvascular MVP é RM condicional. Testes não clínicos
demonstraram que o dispositivo do tampão microvascular MVP é RM condicional. Um doente com
61
Page 62

este dispositivo pode ser submetido a uma leitura em segurança, imediatamente após a colocação,
nas seguintes condições:
• Campo magnético estático de 3 Tesla ou inferior
• Campo magnético com gradiente espacial máximo de 9000 Gauss/cm ou inferior
• Taxa máxima de absorção específica (SAR) de corpo inteiro, referida para o sistema de RM,
de 4 W/kg para uma leitura de 15 minutos (ou seja, por sequência de impulsos)
• Modo de funcionamento controlado de primeiro nível para o sistema de RM
12.2 Aquecimento relacionado com a RM
Em testes não clínicos, o dispositivo do tampão microvascular MVP produziu a seguinte subida de
temperatura durante uma RM efetuada durante 15 min de leitura (ou seja, por sequência de
impulsos) no sistema de RM de 3 Tesla (3 Tesla/128 MHz, Excite, HDx, Software 14X.M5, General
Electric Healthcare, Milwaukee, WI): variação máxima da temperatura de +1,8°C
Por conseguinte, as experiências de aquecimento relacionado com a RM do dispositivo do tampão
microvascular MVP a 3 Tesla, utilizando uma bobina de transmissão/receção de radiofrequência
(RF) para o corpo num sistema de RM, mostraram uma taxa de absorção específica (SAR) média
de corpo inteiro de 2,9 W/kg (ou seja, associada a um valor médio de corpo inteiro de 2,7 W/kg
medido por calorimetria), indicando que a maior quantidade de aquecimento que se produziu
nestas condições específicas foi igual ou inferior a +1,8°C.
12.3 Informações sobre artefactos
A qualidade das imagens de RM poderá ser comprometida se a área de interesse se encontrar
exatamente na mesma zona ou relativamente próxima da posição do dispositivo do tampão
microvascular MVP. Desta forma, poderá ser necessário otimizar os parâmetros da RM para
compensar a presença deste dispositivo. O tamanho máximo dos artefactos (ou seja, como revela
a sequência de impulsos de eco de gradiente) estende-se por aproximadamente 5 mm, em relação
ao tamanho e forma do dispositivo do tampão microvascular MVP.
Sequência de
impulsos
Tamanho do vazio
de sinal
Orientação do
plano
T1-SE T1-SE GRE GRE
2
252 mm
Paralelo Perpendicular Paralelo Perpendicular
91 mm
2
304 mm
2
116 mm
2
13 Armazenamento
Durante o armazenamento, evite a exposição do sistema MVP a água, luz solar, temperaturas
extremas e humidade elevada. Armazene o sistema MVP a uma temperatura ambiente controlada.
Consulte a etiqueta do produto para ver a data de validade do dispositivo. Não utilize o dispositivo
após a data de validade indicada.
14 Materiais
O sistema MVP não contém quaisquer materiais em látex ou PVC.
15 Renúncia de garantia
Os avisos contidos nas etiquetas do produto fornecem informações mais detalhadas e
são considerados como parte integrante desta renúncia. Embora o produto tenha sido
fabricado em condições cuidadosamente controladas, a Medtronic não tem qualquer
controlo sobre as condições nas quais este produto é usado. Por conseguinte, a
Medtronic renuncia quaisquer garantias, expressas e implícitas, em relação ao produto,
incluindo, entre outras, quaisquer garantias implícitas de comercialização ou de
adequação a um fim específico. A Medtronic não será responsável, perante nenhuma
pessoa ou entidade, por quaisquer despesas médicas ou por quaisquer danos diretos,
acidentais ou indiretos causados por qualquer tipo de utilização, defeito, falha ou mau
funcionamento do produto, quer a reclamação relativa a tais danos tenha por base a
garantia, o contrato, danos ou outros. Nenhuma pessoa possui autoridade para vincular a
Medtronic a qualquer tipo de representação ou garantia relativas ao produto.
As exclusões e limitações acima definidas não se destinam a infringir estipulações obrigatórias da
lei aplicável e não devem ser interpretadas como tal. Se alguma parte ou termo desta renúncia de
garantia for considerado ilegal, não executável ou em conflito com a lei aplicável por parte de um
tribunal da jurisdição competente, a validade das restantes partes desta renúncia de garantia não
deverá ser afetada e todos os direitos e obrigações devem ser interpretados e executados como se
esta renúncia de garantia não contivesse a parte ou termo particular considerado inválido.
Română
1 Descrierea dispozitivului
Sistemul cu dispozitiv de ocluzie microvasculară MVP este un dispozitiv de ocluzie vasculară
autoexpansibil. Dispozitivul MVP are formă ovoidală, este realizat din nitinol și fixat la ambele
capete cu benzi de marcaj din platină. Dispozitivul încorporează un înveliș parţial din
politetrafluoretilenă (PTFE). Banda de marcaj proximală se atașează de un fir de amplasare care
împinge dispozitivul printr-un microcateter sau cateter disponibil comercial până la locul vizat
pentru tratament. Firul de amplasare se detașează de dispozitivul MVP prin rotirea în sens opus
acelor de ceasornic a firului de amplasare, pentru a-l deșuruba de la dispozitiv.
Sistemul MVP este ambalat ca un tot unitar format din dispozitivul MVP, o teacă de introducere și un
fir de amplasare detașabil. Sistemul este livrat steril; este apirogen și este exclusiv de unică
folosinţă.
Figura 1. Dispozitiv de ocluzie microvasculară MVP
1 Înveliș parţial
2 Marcaj distal
3 Dispozitiv MVP
4 Zonă de detașare
5 Fir de amplasare
6 Marcaj proximal
Figura 2. Dimensiunile sistemului MVP
1 Lungimea firului de amplasare
2 Lungimea netensionată (dispozitivul scos din teacă, fără nicio forţă exercitată asupra lui)
3 Diametrul netensionat
Tabelul 1. Dimensiunile MVP Model Diametrul
MVP-3Q 5,3 mm 12 mm 180 cm 1,5 mm – 3,0 mm
MVP-5Q 6,5 mm 12 mm 180 cm 3,0 mm – 5,0 mm
MVP-7Q 9,2 mm 16 mm 165 cm 5,0 mm – 7,0 mm
MVP-9Q 13,0 mm 18 mm 165 cm 7,0 mm – 9,0 mm
Tabelul 2. Microcateter sau cateter recomandat Model Microcateter sau cateter
MVP-3Q 0,021 in (0,53 mm) – 0,027 in
MVP-5Q 0,027 in (0,69 mm) (DI) 153 cm
MVP-7Q 4 Fr (1,4 mm) (DE) 120 cm
MVP-9Q 5 Fr (1,7 mm) (DE) 120 cm
netensionat
Lungimea
netensionată
recomandat
(0,69 mm) (DI)
Lungimea firului
de amplasare
Lungimea maximă a microcateterului sau cateterului
recomandat
153 cm
Diametrul vasului-țintă
2 Scopul utilizării / indicații de utilizare
Sistemul cu dispozitiv de ocluzie microvasculară MVP este indicat pentru obstrucţionarea sau
reducerea debitului sangvin în vasele periferice.
62
Page 63

3 Contraindicații
Nu există contraindicaţii cunoscute ale acestui dispozitiv.
4 Compatibilitate
Pentru dimensiunile dispozitivului, consultaţi eticheta sistemului MVP. Pentru a determina
compatibilitatea, consultaţi etichetele celorlalte echipamente tehnologice medicale.
5 Avertismente
• Siguranţa și eficacitatea sistemului MVP nu au fost stabilite pentru utilizări cardiovasculare (de
exemplu, ocluzie de sept cardiac, canal arterial permeabil, închiderea scurgerii paravalvulare)
și utilizări neurologice.
• Sistemul MVP trebuie să fie utilizat numai de către medici familiarizaţi cu procedurile
angiografice și de intervenţie. Este important să citiţi instrucţiunile de utilizare înainte de a utiliza
sistemul MVP.
• Utilizaţi sistemul MVP înainte de data expirării imprimată pe eticheta de pe ambalajul
produsului.
• Sistemul MVP este apirogen și este furnizat steril, cu excepţia cazului în care ambalajul
sistemului MVP este deschis sau deteriorat. Nu utilizaţi dacă ambalajul este perforat sau
deteriorat.
• Inspectaţi sistemul MVP înainte de utilizare și eliminaţi-l dacă observaţi vreo neregularitate sau
vreo deteriorare.
• Sistemul MVP este destinat exclusiv pentru unică folosinţă. A nu se recondiţiona sau resteriliza.
Recondiţionarea și resterilizarea pot crește riscurile de infecţii ale pacientului și riscul de a
compromite funcţionarea dispozitivului. După utilizarea sistemului MVP, eliminaţi-l în
conformitate cu normele spitalicești și guvernamentale locale.
• Utilizaţi ghidaj fluoroscopic atunci când avansaţi sau manipulaţi sistemul MVP. Dacă
întâmpinaţi rezistenţă excesivă, nu avansaţi și nu retrageţi dispozitivul până când nu este
determinată cauza rezistenţei.
• Nu răsuciţi și nu rotiţi firul de amplasare decât atunci când vreţi să detașaţi dispozitivul; în caz
contrar, dispozitivul se poate detașa prematur.
• Nu utilizaţi injectomatul pentru a injecta soluţia cu substanţă de contrast împreună cu
dispozitivul printr-un microcateter sau cateter.
• Nu avansaţi firul de amplasare după detașarea acestuia de la dispozitivul MVP.
• Medicii trebuie să fie pregătiţi să gestioneze situaţii urgente care necesită îndepărtarea
dispozitivului. Pregătirea include asigurarea prezenţei unui chirurg la faţa locului.
• Nu utilizaţi dispozitivul împreună cu catetere care sunt contraindicate pentru dispozitivele de
embolizare (de exemplu, bucle sau obturatoare).
6 Precauții
• Dispozitivul MVP este realizat dintr-un aliaj de nichel-titan care în general este considerat sigur.
Totuși, testele in vitro au demonstrat că nichelul este eliberat din dispozitiv după implantare timp
de minimum 60 de zile. Este posibil ca pacienţii alergici la nichel să aibă o reacţie alergică la
dispozitiv, în special pacienţii cu antecedente de alergii la metal. Anumite reacţii alergice pot fi
grave; pacienţilor trebuie să li se spună să anunţe medicii imediat dacă bănuiesc că au o reacţie
alergică, de exemplu dificultăţi de respiraţie sau inflamaţie la nivelul feţei sau al gâtului. Unii
pacienţi pot dezvolta alergie la nichel dacă este implantat dispozitivul.
• Medicii trebuie să evalueze clinic situaţiile care implică utilizarea anticoagulantelor sau a
antiagregantelor plachetare înainte de utilizarea dispozitivului, în timpul utilizării sau după
aceasta.
• Reţineţi că se impune precauţie în cazul următoarelor grupe de pacienţi specifice:
– În cazul pacientelor gravide, este necesară precauţie pentru a reduce la minimum
expunerea la radiaţii a mamei și a fătului.
– În cazul mamelor care alăptează, nu s-a realizat o evaluare cantitativă a prezenţei
substanţelor excretate în laptele matern după implantarea dispozitivului.
• Confirmaţi compatibilitatea sistemului MVP atunci când utilizaţi alte dispozitive auxiliare în
procedurile intravasculare. Medicii care utilizează sistemul MVP trebuie să cunoască bine
tehnicile intravasculare percutanate și posibilele complicaţii asociate cu procedura.
• Sistemul MVP trebuie să fie hidratat înainte de utilizare.
• Procedaţi cu precauţie atunci când manipulaţi sistemul MVP, pentru a reduce probabilitatea
deteriorării accidentale.
• Există potenţialul de a exercita o forţă de împingere mai mare atunci când dispozitivul este
utilizat cu microcatetere sau catetere canelate din material compozit cu nitinol.
• Înainte de utilizare, confirmaţi că diametrul tuturor dispozitivelor accesorii pe care le utilizaţi este
compatibil cu sistemul MVP.
7 Evenimente adverse posibile
Posibilele reacţii adverse care pot surveni în timpul procedurii de amplasare a acestui dispozitiv sau
după procedură includ, fără limitare, următoarele:
• Embolie gazoasă
• Reacţie alergică sau efecte toxice
• Hemoragie
• Deces
• Migrarea dispozitivului
• Febră
• Eveniment embolic cu material străin
• Infecţie
• Ocluzia altui vas decât a celui avut în vedere
• Embolie periferică
• Recanalizare
• Flux rezidual
• Accident cerebrovascular sau atac ischemic tranzitoriu (TIA)
• Intervenţie chirurgicală
• Complicaţie în zona de abord vascular
• Traumatism vascular sau perforarea vasului
8 Materiale necesare
1. Pentru amplasarea sistemului MVP este necesară utilizarea unui microcateter sau a unui
cateter (consultaţi Tabelul 2 pentru dimensiunea recomandată).
2. Sunt necesare următoarele accesorii:
• Soluţie salină heparinizată
• Valvă hemostatică rotativă (RHV)
• Robinet de închidere cu trei căi
• Manșetă de perfuzie sub presiune, pentru perfuzia cu soluţie salină
• Teacă de acces
• Cateter de ghidare compatibil cu un microcateter sau cateter recomandat în Tabelul 2
• Fir de ghidare compatibil cu cateterul de ghidare și cu microcateterul sau cateterul
• Stativ pentru perfuzie intravenoasă (i.v.)
9 Pregătire
1. Pentru a obţine performanţa optimă a sistemului MVP și a reduce riscul de complicaţii
tromboembolice, menţineţi spălarea continuă cu soluţie salină între următoarele componente:
• teaca de acces și cateterul de ghidare
• microcateterul sau cateterul și cateterul de ghidare
• microcateterul sau cateterul, firul de ghidare și sistemul MVP.
2. Plasaţi cateterul de ghidare corespunzător, urmând procedura recomandată. Conectaţi o
valvă hemostatică rotativă (RHV) la hubul cateterului de ghidare. Atașaţi un ventil cu 3 căi la
braţul lateral al valvei RHV. Conectaţi o linie cu soluţie salină heparinizată pentru flux de spălare
continuu.
3. Verificaţi toate garniturile, pentru a vă asigura că nu pătrunde aer în cateterul de ghidare, în
microcateter sau în cateter în timpul spălării continue.
10 Instrucțiuni de utilizare
1. Realizaţi accesul în vasul-ţintă și efectuaţi angiograma utilizând tehnica standard, pentru a
măsura diametrul vasului la locul avut în vedere pentru ocluzie. Asiguraţi-vă că vasul-ţintă are
diametrul recomandat (consultaţi Tabelul 1).
2. Asiguraţi-vă că locul ocluziei este suficient de lung pentru a permite amplasarea dispozitivului
MVP implantat fără a obstrucţiona vasele neavute în vedere.
3. Selectaţi un microcateter sau cateter (consultaţi Tabelul 2 pentru dimensiunea recomandată)
și pregătiţi-l conform instrucţiunilor de utilizare ale fabricantului.
4. Introduceţi firul de ghidare și avansaţi microcateterul sau cateterul peste firul de ghidare până
când vârful distal se află în apropierea frontului anterior al locului de ocluzie.
5. Scoateţi firul de ghidare din cateter sau din microcateter.
6. Scoateţi sistemul MVP din tubul de protecţie, desprinzând ușor teaca de introducere galbenă
din cele două cleme externe, și extrageţi sistemul MVP din carcasa cilindrică transparentă.
Prindeţi cu delicateţe teaca de introducere într-un punct aflat proximal faţă de dispozitivul MVP,
și scoateţi lent din tubul de protecţie, în același timp, dispozitivul MVP, firul de amplasare și
teaca de introducere. Vezi Figura 3.
63
Page 64

Figura 3. Sistemul MVP ambalat
1 Carcasă cilindrică transparentă
2 Teacă de introducere galbenă
3 Fir de amplasare (în interiorul tecii de
introducere)
7. Inspectaţi cu atenţie sistemul MVP pentru a depista eventualele deteriorări. Dacă sistemul
MVP este deteriorat, înlocuiţi-l cu un sistem MVP nou.
8. Spălaţi sistemul MVP, scufundând ușor câţiva centimetri din teaca de introducere și
dispozitivul MVP în soluţie salină heparinizată.
9. Trageţi dispozitivul MVP în interiorul tecii de introducere, trăgând de firul de amplasare până
când numai vârful distal al dispozitivului MVP este acoperit de teaca de introducere.
Notă: Dacă dispozitivul MVP este tras prea mult în interiorul tecii de introducere, este posibil
să nu fie spălat corect. Două orificii din teaca de introducere, aflate la 3 cm și 6 cm proximal faţă
de vârful tecii, facilitează purjarea aerului și spălarea dispozitivului.
10. Introduceţi sistemul MVP introducând capătul distal al tecii de introducere prin valva RHV și în
interiorul hubului microcateterului sau al cateterului, până când teaca este fixată stabil.
Strângeţi valva RHV îndeajuns pentru a preveni fluxul retrograd al sângelui, dar nu atât de
strâns încât să deterioraţi sistemul MVP în timp ce este introdus în interiorul microcateterului
sau al cateterului.
11. Confirmaţi vizual că soluţia de spălare se perfuzează normal. Ar trebui să puteţi observa
picături de soluţie salină ieșind din capătul proximal al tecii de introducere.
12. Slăbiţi valva RHV îndeajuns pentru a permite ca dispozitivul MVP și firul de amplasare să
avanseze împreună, ca un sistem unitar. Nu slăbiţi valva RHV îndeajuns pentru a permite fluxul
retrograd al sângelui. Scoateţi teaca de introducere, retrăgând-o peste capătul proximal al
firului de amplasare.
13. Avansaţi firul de amplasare și dispozitivul MVP până când marcajul de platină distal al
dispozitivului MVP este aliniat cu banda de marcaj distală a microcateterului sau a cateterului.
14. Confirmaţi că benzile de marcaj sunt în poziţia optimă. Desfășuraţi dispozitivul MVP
menţinând presiunea de înaintare asupra firului de amplasare, în timp ce retrageţi lent
microcateterul sau cateterul pentru a scoate din teacă dispozitivul MVP.
15. Dacă poziţia dispozitivului este nesatisfăcătoare, efectuaţi următoarele acţiuni:
a. Stabilizaţi firul de amplasare și avansaţi microcateterul sau cateterul mișcându-l distal,
până când dispozitivul MVP este recapturat în interiorul cateterului.
b. Fie repoziţionaţi și desfășuraţi dispozitivul, fie scoateţi dispozitivul din pacient.
Notă: Dispozitivul nu trebuie să fie introdus înapoi în teacă și desfășurat mai mult de 3 ori.
16. Pentru o detașare corectă, dispozitivul MVP trebuie să fie poziţionat astfel încât să
depășească vârful microcateterului sau al cateterului.
17. Dacă poziţia dispozitivului este satisfăcătoare, treceţi la detașare, realizând următoarele
acţiuni:
a. Confirmaţi sub fluoroscopie că vârful microcateterului sau al cateterului este proximal faţă
de dispozitivul MVP.
b. Atașaţi dispozitivul de torsiune la firul de amplasare. Detașaţi dispozitivul MVP prin rotirea
în sens opus acelor de ceasornic a firului de amplasare, până când se separă de
dispozitiv.
c. Confirmaţi fluoroscopic reușita detașării, trăgând încet firul de amplasare în direcţie
proximală, pentru a vă asigura că dispozitivul MVP nu se mișcă. În cazul puţin probabil în
care dispozitivul MVP se mișcă în direcţie proximală, restabiliţi poziţia dispozitivului și
repetaţi rotaţia în sens invers acelor de ceasornic a firului de amplasare, pentru a realiza
detașarea.
18. În timp ce ţineţi în poziţie microcateterul sau cateterul, retrageţi firul de amplasare în
microcateter sau cateter, după care extrageţi firul de amplasare din organismul pacientului.
Finalizaţi procedura urmând tehnica standard.
4 Dispozitiv de torsiune
5 Tub de protecţie
6 Dispozitiv MVP
11 Instrucțiuni post-procedurale
Dacă în regiunea dvs. este disponibil serviciul MedicAlert, recomandaţi-i pacientului să se înscrie
în reţeaua MedicAlert la www.medicalert.org. Pacientului i se va cere să precizeze afecţiunea de
care suferă, numele dispozitivului implantat și restricţiile privind utilizarea IRM.
12 Informații despre IRM
12.1 Compatibilitate RM condiționată
S-a stabilit că dispozitivul de ocluzie microvasculară MVP are compatibilitate RM condiţionată.
Testele non-clinice au demonstrat că dispozitivul de ocluzie microvasculară MVP are
compatibilitate RM condiţionată. Un pacient cu acest dispozitiv poate fi scanat în siguranţă, imediat
după amplasarea dispozitivului, în următoarele condiţii:
• Câmp magnetic static de 3 Tesla sau mai puţin
• Gradient spaţial maxim al câmpului magnetic de cel mult 9000 Gauss/cm
• Rata de absorbţie specifică maximă exprimată ca medie pe întregul corp (SAR), raportată de
sistemul RM, de 4 W/kg pentru 15 minute de scanare (adică pe secvenţa de puls)
• Modul de funcţionare controlat Nivel 1 pentru sistemul RM
12.2 Încălzire asociată cu IRM
În testele non-clinice, dispozitivul de ocluzie microvasculară MVP a cauzat următoarea creștere de
temperatură în timpul IRM în 15 min de scanare (adică pe secvenţa de puls) în sistemul RM de
3 Tesla (3 Tesla/128 MHz, Excite, HDx, Software 14X.M5, General Electric Healthcare, Milwaukee,
WI): Modificarea maximă a temperaturii +1,8°C
Prin urmare, experimentele privind încălzirea asociată cu IRM pentru dispozitivul de ocluzie
microvasculară MVP la 3 Tesla, utilizând o antenă de emisie/recepţie cu RF pentru întregul corp la
o rată de absorbţie specifică exprimată ca medie a întregului corp (SAR), raportată de sistemul RM,
de 2,9 W/kg (adică asociată cu o medie a întregului corp de 2,7 W/kg, măsurată prin calorimetrie)
au indicat că încălzirea maximă care a survenit în asociere cu aceste condiţii specifice a fost mai
mică sau egală cu +1,8°C.
12.3 Informații cu privire la artefacte
Calitatea imaginilor produse prin rezonanţă magnetică poate fi compromisă dacă zona de interes
coincide exact sau este relativ apropiată de poziţia dispozitivului de ocluzie microvasculară MVP.
Prin urmare, poate fi necesară optimizarea parametrilor examinării IRM pentru a compensa
prezenţa acestui dispozitiv. Dimensiunea maximă a artefactelor (astfel cum sunt vizualizate în
secvenţa de puls de tip ecou de gradient) atinge aproximativ 5 mm în raport cu dimensiunea și forma
dispozitivului de ocluzie microvasculară MVP.
Secvență de
puls T1-SE T1-SE GRE GRE
Zonă de pierdere
a semnalului
Orientare în plan Paralel Perpendicular Paralel Perpendicular
252 mm
2
91 mm
2
304 mm
2
116 mm
2
13 Depozitare
În timpul depozitării, evitaţi expunerea sistemului MVP la apă, la lumină solară directă, la
temperaturi extreme și la umiditate ridicată. Depozitaţi sistemul MVP la o temperatură controlată a
camerei. Pentru data expirării dispozitivului, consultaţi eticheta produsului. Nu utilizaţi dispozitivul
după data de expirare de pe etichetă.
14 Materiale
Sistemul MVP nu conţine materiale cu latex sau PVC.
15 Declarație de limitare a garanției
Avertismentele de pe etichetele produsului oferă informații mai detaliate și sunt
considerate parte integrantă din prezenta declarație de limitare a garanției. Deși produsul
a fost fabricat în condiții controlate cu atenție, Medtronic nu are niciun control asupra
condițiilor în care este utilizat acest produs. Prin urmare, Medtronic limitează toate
garanțiile, atât exprese, cât și implicite privitoare la produs, incluzând dar nelimitându-se
la orice garanție implicită de vandabilitate sau de adecvare pentru un anumit scop.
Compania Medtronic nu va fi răspunzătoare față de nicio persoană sau entitate pentru
niciun fel de cheltuieli medicale sau daune directe, accidentale sau indirecte cauzate de
utilizarea, defectarea sau funcționarea defectuoasă a acestui produs, indiferent dacă
pretențiile se bazează pe garanții, contracte, răspundere civilă delictuală sau altă doctrină.
64
Page 65

Nicio persoană nu are autoritatea de a angaja Medtronic în alte declarații sau garanții
referitoare la produs.
Excluderile și limitările stipulate mai sus nu au intenţia și nu trebuie interpretate a contraveni
prevederilor obligatorii ale legislaţiei aplicabile. Dacă orice parte sau clauză a acestei Declaraţii de
declinare a garanţiei este considerată de o instanţă competentă ca fiind ilegală sau în conflict cu
legislaţia aplicabilă, validitatea restului Declaraţiei de declinare a garanţiei nu va fi afectată și toate
drepturile și obligaţiile vor fi interpretate și respectate ca și cum această Declaraţie de declinare a
garanţiei nu ar conţine partea sau clauza considerată nulă.
На русском языке
1 Описание устройства
Устройство микроваскулярное MVP представляет собой самораскрывающееся устройство
для окклюзии сосудов. Окклюдер MVP имеет овоидную форму, состоит из нитинола и с двух
концов закреплен с помощью платиновых маркерных колец. В этом окклюдере
предусмотрено частичное покрытие из ПТФЭ. Проксимальное маркерное кольцо
прикреплено к толкателю, который позволяет проталкивать окклюдер через коммерчески
доступный микрокатетер или катетер к заданному участку коррекции. Для отсоединения
окклюдера MVP от толкателя толкатель вращают против часовой стрелки, чтобы открутить
его от окклюдера.
Устройство MVP поставляется в единой упаковке, содержащей окклюдер MVP, гильзу для
загрузки и отсоединяемый толкатель системы доставки. Устройство поставляется
стерильным и непирогенным; оно предназначено только для одноразового использования.
Рисунок 1. Устройство микроваскулярное MVP
1 Частичное покрытие
2 Дистальный маркер
3 Окклюдер MVP
Рисунок 2. Размеры устройства MVP
1 Длина толкателя
2 Длина без сжатия (гильза с окклюдера
снята и поэтому его ничего не сжимает)
Таблица 1. MVP Размеры Модель Диаметр без
MVP-3Q 5,3 mm 12 mm 180 cm 1,5 mm – 3,0 mm
MVP-5Q 6,5 mm 12 mm 180 cm 3,0 mm – 5,0 mm
MVP-7Q 9,2 mm 16 mm 165 cm 5,0 mm – 7,0 mm
MVP-9Q 13,0 mm 18 mm 165 cm 7,0 mm – 9,0 mm
сжатия
Длина без сжатия
4 Зона отсоединения
5 Толкатель
6 Проксимальный маркер
3 Диаметр без сжатия
Длина толкателя
Диаметр
выбранного
сосуда
Таблица 2. Рекомендуемый микрокатетер или катетер Модель Рекомендуемый микрока-
MVP-3Q 0,021 in (0,53 mm) – 0,027 in
MVP-5Q 0,027 in (0,69 mm) (внутрен-
MVP-7Q 4 Fr (1,4 mm) (наружный диа-
MVP-9Q 5 Fr (1,7 mm) (наружный диа-
тетер или катетер
(0,69 mm) (внутренний диаметр)
ний диаметр)
метр)
метр)
Максимальная длина
рекомендуемого микрокатетера или катетера
153 cm
153 cm
120 cm
120 cm
2 Предусмотренное назначение / показания к применению
Устройство микроваскулярное MVP предназначено для окклюзии периферических сосудов
или уменьшения скорости кровотока в них.
3 Противопоказания
Противопоказания к использованию устройства неизвестны.
4 Совместимость
Размеры устройства указаны на этикетке системы MVP. Для определения совместимости
см. документацию, поставляемую с другими медицинскими устройствами.
5 Предостережения
• Безопасность и эффективность использования устройства MVP в кардиологии
(например для окклюзии сердечной перегородки, закрытия проходимого
артериального протока, закрытия парапротезной фистулы) и неврологии не
установлена.
• К использованию устройства MVP допускаются только врачи, владеющие
ангиографическими и интервенционными методами. Перед использованием
устройства MVP следует изучить инструкцию по применению.
• Используйте устройство MVP до истечения срока годности, указанного на этикетке
упаковки изделия.
• Устройство MVP является непирогенным и стерильным при условии, что упаковка
устройства MVP не вскрыта и не повреждена. Не использовать, если упаковка
нарушена или повреждена.
• Перед использованием осмотрите устройство MVP и в случае обнаружения дефектов
или повреждений утилизируйте его.
• Устройство MVP предназначено только для одноразового использования. Повторная
обработка и стерилизация запрещены. Повторная обработка и стерилизация могут
повышать риск инфицирования пациента и риск нарушения функционирования
устройства. После использования устройство MVP следует утилизировать в
соответствии с требованиями лечебного учреждения и местных органов власти.
• Продвигайте устройство MVP или управляйте им под контролем рентгеноскопии. Если
возникает чрезмерное сопротивление, не продвигайте и не выводите устройство до
определения причины сопротивления.
• Толкатель разрешается скручивать или вращать только с целью отсоединения
окклюдера; в противном случае возможно преждевременное отсоединение
окклюдера.
• Для введения контрастного раствора через микрокатетер или катетер, содержащий
окклюдер, использовать автоматический шприц запрещено.
• После отсоединения окклюдера MVP продвигать толкатель вперед запрещено.
• Врачам следует подготовиться к экстренным ситуациям, в которых может
потребоваться извлечение окклюдера. Такая подготовка подразумевает наличие в
учреждении хирурга.
• Не использовать с катетерами, противопоказанными для эмболических устройств
(например, спирали или заглушка).
6 Меры предосторожности
• Окклюдер MVP состоит из никель-титанового сплава, который считается в целом
безопасным. Тем не менее, в испытаниях in vitro установлено, что после имплантации в
течение не менее 60 дней никель выделяется из окклюдера. У пациентов с аллергией на
никель может возникать аллергическая реакция на этот окклюдер, особенно у
пациентов с аллергией на металлы в анамнезе. Некоторые аллергические реакции
могут быть серьезными; пациенту следует дать инструкции, чтобы в случае подозрения
65
Page 66

на аллергическую реакцию (например при затруднении дыхания или воспалении лица
или горла) он немедленно сообщал об этом врачу. У некоторых пациентов аллергия на
никель развивается при имплантации окклюдера.
• В ситуациях, требующих применения антикоагулянтных или антитромбоцитарных
средств до, во время или после использования этого окклюдера, врачам следует
руководствоваться клинической оценкой.
• В отношении указанных ниже особых групп пациентов требуются меры
предосторожности:
– В случае беременных пациентов следует проявлять осторожность, чтобы свести к
минимуму облучение матери и плода.
– Что касается кормящих грудью матерей, количественное определение выделяемых
веществ в грудном молоке после имплантации окклюдера не проводилось.
• При использовании других вспомогательных устройств во время внутрисосудистых
манипуляций проверяйте их совместимость с окклюдером MVP. Врачам, использующим
устройство MVP, следует знать методы чрескожных внутрисосудистых вмешательств и
осложнения, которые могут сопровождать эту процедуру.
• Перед использованием устройство MVP следует увлажнить.
• При обращении с устройством MVP проявляйте осторожность, чтобы снизить риск его
случайного повреждения.
• При использовании с микрокатетерами или катетерами с прорезями, изготовленными
из нитинолового сплава, возможно, потребуется прикладывать больше усилий для
проталкивания.
• Перед использованием окклюдера MVP проверяйте его совместимость с диаметром
принадлежностей.
7 Возможные нежелательные явления
Возможные нежелательные явления, которые могут возникнуть во время или после
процедуры размещения этого устройства, включают в себя (список не исчерпывающий)
следующее:
• Воздушная эмболия
• Аллергическая реакция или токсическое воздействие
• Кровотечение
• Смерть
• Миграция окклюдера
• Лихорадка
• Явление эмболии инородным материалом
• Инфицирование;
• Окклюзия непредусмотренного сосуда
• Эмболия периферических сосудов
• Реканализация
• Остаточный ток
• Инсульт или транзиторная ишемическая атака (ТИА)
• Хирургическое вмешательство
• Осложнение в месте сосудистого доступа
• Травма или перфорация сосуда
8 Требуемые материалы
1. Для доставки устройства MVP требуется использовать микрокатетер или катетер
(рекомендуемый размер см. в Табл. 2).
2. Требуются следующие принадлежности:
• Гепаринизированный физиологический раствор
• Вращающийся гемостатический клапан (Rotating Hemostatic Valve, RHV)
• Трехходовой запорный кран
• Манжета для сдавления пакета с физиологическим раствором
• Интродьюсер для создания доступа
• Проводниковый катетер, совместимый с микрокатетером или катетером,
рекомендованным в Табл. 2
• Проводник, совместимый с проводниковым катетером и микрокатетером или
катетером
• Стойка для внутривенной (в/в) инфузии
9 Подготовка
1. Для достижения оптимальной работы устройства MVP и снижения риска
тромбоэмболических осложнений поддерживайте постоянный ток физиологического
раствора между следующими изделиями:
• интродьюсер для создания доступа и проводниковый катетер;
• микрокатетер или катетер и проводниковый катетер;
• микрокатетер или катетер, проводниковый катетер и система MVP.
2. Установите подходящий проводниковый катетер в соответствии с рекомендуемой
процедурой. Подсоедините вращающийся гемостатический клапан (RHV) к разъему
проводникового катетера. Подсоедините трехходовой запорный кран к боковому
порту RHV. Подсоедините трубку с гепаринизированным физиологическим раствором
для обеспечения непрерывной промывки.
3. Проверьте все разъемы, чтобы убедиться, что во время непрерывной промывки воздух
не поступает в проводниковый катетер или микрокатетер или катетер.
10 Указания по применению
1. Создайте доступ к выбранному сосуду и выполните ангиографию стандартным
методом, чтобы измерить диаметр сосуда в заданном месте окклюзии. Убедитесь, что
выбранный сосуд имеет рекомендуемый диаметр (см. Табл. 1).
2. Убедитесь, что место окклюзии имеет длину, достаточную для вмещения
имплантируемого окклюдера MVP без обструкции непредусмотренных сосудов.
3. Выберите микрокатетер или катетер (рекомендуемый размер см. в Табл. 2) и
подготовьте его в соответствии с инструкцией по применению производителя.
4. Введите проводник и продвиньте микрокатетер или катетер по проводнику так, чтобы
его дистальный кончик оказался около переднего края места окклюзии.
5. Извлеките проводник из микрокатетера или катетера.
6. Извлеките устройство MVP из трубки диспенсера, аккуратно сняв желтую гильзу для
загрузки с двух наружных зажимов, и вытяните устройство MVP из прозрачной
защитной трубки. Аккуратно захватите гильзу для загрузки в месте, находящемся
проксимальнее устройства MVP, и медленно одновременно извлеките окклюдер MVP,
толкатель и гильзу для загрузки из трубки диспенсера. См. Рис. 3.
Рисунок 3. Упакованное устройство MVP
1 Прозрачная защитная трубка
2 Желтая гильза для загрузки
3 Толкатель (внутри гильзы для
загрузки)
4 Устройство для вращения
5 Трубка диспенсера
6 Окклюдер MVP
7. Внимательно осмотрите устройство MVP на предмет повреждения. Если устройство
MVP повреждено, замените его на новое устройство MVP.
8. Промойте устройство MVP, аккуратно погрузив на несколько сантиметров гильзу для
загрузки и окклюдер MVP в гепаринизированный физиологический раствор.
9. Втяните окклюдер MVP в гильзу для загрузки, потянув толкатель так, чтобы
дистальный кончик окклюдера MVP оказался покрыт гильзой.
Примечание: Если втянуть окклюдер MVP в гильзу слишком далеко, его промывка
может оказаться недостаточной. Два отверстия на гильзе, расположенные на 3 cm и
6 cm проксимальнее кончика интродьюсера, облегчают удаление воздуха и промывку
окклюдера.
10. Введите устройство MVP, вставив дистальный кончик гильзы для загрузки через RHV в
разъем микрокатетера или катетера так, чтобы гильза плотно села. Затяните RHV
достаточно плотно, чтобы не допустить обратного тока крови, но не настолько, чтобы
повредить устройство MVP при его введении в микрокатетер или катетер.
11. Зрительно убедитесь, что промывающий раствор вливается нормально. Из
проксимального конца гильзы должны поступать капли физиологического раствора.
66
Page 67

12. Ослабьте RHV до степени, позволяющей продвигать окклюдер MVP и толкатель
единым блоком. Не ослабляйте RHV настолько, чтобы пропускать обратный ток крови.
Снимите гильзу для загрузки, стянув ее через проксимальный конец толкателя.
13. Продвиньте толкатель и окклюдер MVP так, чтобы дистальный платиновый маркер
окклюдера MVP совместился с дистальным маркерным кольцом на микрокатетере или
катетере.
14. Убедитесь, что маркерные кольца размещены оптимально. Разверните окклюдер MVP,
оказывая поступательное давление на толкатель и медленно отводя микрокатетер или
катетер, чтобы снять оболочку с окклюдера MVP.
15. Если окклюдер занял неудовлетворительное положение, выполните следующие
действия:
a. Стабилизируйте положение толкателя и продвиньте микрокатетер или катетер
дистально так, чтобы втянуть окклюдер MVP обратно в катетер.
b. Повторно расположите окклюдер и разверните его или же извлеките окклюдер из
тела пациента.
Примечание: Втягивание в гильзу и развертывание окклюдера допускается
выполнять не более 3 раз.
16. Для правильного отсоединения окклюдер MVP следует размещать за пределами
кончика микрокатетера или катетера.
17. Если окклюдер занял неудовлетворительное положение, приступайте к
отсоединению, выполнив следующие действия:
a. Под контролем рентгеноскопии убедитесь, что кончик микрокатетера или катетера
находится проксимальнее окклюдера MVP.
b. Подсоедините устройство для вращения к толкателю. Для отсоединения
устройства MVP вращайте толкатель против часовой стрелки до его отделения от
окклюдера.
c. Под контролем рентгеноскопии подтвердите, что отделение действительно
произошло, медленно потянув толкатель в проксимальном направлении, чтобы
убедиться, что окклюдер MVP не смещается. В том маловероятном случае, если
окклюдер MVP смещается в проксимальном направлении, установите окклюдер
на прежнее место и повторите вращение толкателя против часовой стрелки для
отсоединения окклюдера.
18. Удерживая микрокатетер или катетер на месте, отведите толкатель в микрокатетер
или катетер и затем извлеките толкатель из тела пациента. Завершите процедуру в
соответствии со стандартным методом.
11 Указания после процедуры
Если в вашем регионе доступна служба MedicAlert, рекомендуйте пациенту стать ее членом
на веб-сайте www.medicalert.org. Пациенту предложат указать свое заболевание,
наименование имплантированного устройства и ограничения по применению МРТ.
12 Информация о МРТ
12.1 МРТ выполнять с соблюдением ограничений
Установлено, что МРТ устройства микроваскулярного MVP можно выполнять с
соблюдением определенных условий. Неклинические исследования показали, что МРТ
окклюдера MVP можно выполнять с соблюдением определенных условий. Пациент с таким
окклюдером может безопасно подвергаться сканированию сразу после имплантации при
следующих условиях:
• Статическое магнитное поле не более 3 Тл
• Максимальный пространственный градиент поля не более 9000 Гаусс/см
• Максимальное зарегистрированное для системы МРТ среднее для всего тела значение
удельной скорости поглощения излучения (SAR) 4 W/kg при сканировании в течение
15 минут (т. е. одной последовательности импульсов)
• Управляемый режим работы первого уровня для системы МРТ
12.2 Нагревание, обусловленное МРТ
Неклинические исследования показали, что во время МРТ, проводимого в течение 15 min
(т. е. одной последовательности импульсов)в МРТ-системе при 3 Tл (3 Tл/128 MHz, Excite,
HDx, Software 14X.M5, General Electric Healthcare, Milwaukee, WI), наблюдалось следующее
повышение температуры окклюдера MVP: максимальное изменение
температуры: +1,8°C
Таким образом, эксперименты, изучавшие нагрев окклюдера MVP при МРТ с магнитной
индукцией 3 Тл, создаваемой приемо-передающей РЧ-катушкой для тела, показали
зарегистрированное в системе МРТ среднее для всего тела значение удельной скорости
поглощения излучения 2,9 W/kg (относительно калориметрически измеренной средней для
всего тела удельной скорости поглощения излучения 2,7 W/kg), что означает, что
максимальный нагрев, наблюдаемый в этих специфических условиях, составляет
не более +1,8°C.
12.3 Информация об артефактах
В области окклюдера MVP и вблизи от него качество МР изображения может ухудшаться.
Следовательно, может потребоваться оптимизация параметров получения
МРТ-изображения с целью компенсации наличия данного окклюдера. Максимальный
размер артефакта, наблюдаемый при последовательности импульсов градиентного эхо,
превышает приблизительно на 5 mm размер и форму окклюдера MVP.
Серия импульсов
Длина пропуска
между сигналами
Ориентация плоскости
T1-SE T1-SE GRE GRE
2
252 mm
Параллельно Перпендику-
91 mm
лярно
2
2
304 mm
Параллельно Перпендику-
116 mm
лярно
2
13 Хранение
Во время хранения устройства MVP не допускайте воздействия на его воды, солнечного
света, экстремальных температур и высокой влажности. Храните устройство MVP при
контролируемой комнатной температуре. Дата окончания срока годности указана на
этикетке изделия. Не используйте устройство по истечении указанного на этикетке срока
годности.
14 Материалы
При изготовлении устройства MVP латекс и ПВХ не используются.
15 Отказ от гарантии
Приведенные на этикетках данного продукта предостережения содержат более
подробную информацию и являются неотъемлемой частью данного отказа от
гарантии. Хотя продукт изготовлен в строго контролируемых условиях, компания
Medtronic не может контролировать условия применения данного продукта.
Поэтому компания Medtronic отказывается от всех гарантийных обязательств, как
прямых, так и опосредованных, по отношению к данному продукту, включая, но не
ограничиваясь любыми опосредованными гарантиями пригодности для продажи
или соответствия какой-либо определенной цели. Компания Medtronic не несет
ответственности перед любым лицом или организацией за расходы на медицинское
обслуживание или за любые прямые, случайные или опосредованные убытки,
возникшие в результате любого использования, дефекта, неисправности или сбоя в
работе данного продукта, вне зависимости от того, основано ли заявление о таких
убытках на гарантийных обязательствах, контракте, гражданских
правонарушениях или других обстоятельствах. Ни одно лицо не имеет полномочий
связывать компанию Medtronic какими-либо заявлениями или гарантиями по
отношению к данному продукту.
Вышеизложенные исключения и ограничения не подразумеваются и не будут толковаться
так, чтобы противоречить обязательным положениям применяемых правовых норм. Если
какая-либо часть или условие данного отказа от гарантии признается судом компетентной
юрисдикции незаконным, не имеющим юридической силы или противоречащим
каким-либо применяемым правовым нормам, остальные части отказа от гарантии будут
считаться имеющими юридическую силу и все права и обязательства будут толковаться и
принудительно обеспечиваться, как если бы данный отказ от гарантии не содержал
отдельных частей или условий, которые были признаны не имеющими законной силы.
Slovenčina
1 Popis zariadenia
Systém mikrovaskulárnej zátky MVP je samoexpandujúce zariadenie na oklúziu ciev. Zariadenie
MVP má ovoidný tvar, je vytvorené z nitinolu a na oboch koncoch je zaistené platinovými
označovacími prúžkami. Zariadenie obsahuje neúplný plášť z PTFE. Proximálny označovací
prúžok sa pripája k aplikačnému drôtu, ktorý tlačí zariadenie cez komerčne dostupný mikrokatéter
alebo katéter k zamýšľanému miestu zákroku. Aplikačný drôt sa od zariadenia MVP odpája
otáčaním aplikačného drôtu proti smeru chodu hodinových ručičiek, aby sa drôt odskrutkoval od
zariadenia.
Systém MVP je balený ako jedna pomôcka, ktorá obsahuje zariadenie MVP, zavádzacie puzdro
a odpojiteľný aplikačný drôt. Systém sa dodáva sterilný a apyrogénny a je určený len na
jednorazové použitie.
67
Page 68

Obrázok 1. Mikrovaskulárna zátka MVP
1 Neúplný plášť
2 Distálna značka
3 Zariadenie MVP
Obrázok 2. Rozmery systému MVP
1 Dĺžka aplikačného drôtu
2 Dĺžka bez obmedzení (zariadenie nie je
v puzdre a nič ho neobmedzuje)
Tabuľka 1. Rozmery zariadenia MVP Model Priemer bez
MVP-3Q 5,3 mm 12 mm 180 cm 1,5 mm – 3,0 mm
MVP-5Q 6,5 mm 12 mm 180 cm 3,0 mm – 5,0 mm
MVP-7Q 9,2 mm 16 mm 165 cm 5,0 mm – 7,0 mm
MVP-9Q 13,0 mm 18 mm 165 cm 7,0 mm – 9,0 mm
Tabuľka 2. Odporúčaný mikrokatéter alebo katéter Model Odporúčaný mikrokatéter
MVP-3Q 0,021 in (0,53 mm) až 0,027 in
MVP-5Q 0,027 in (0,69 mm) (vnútorný
MVP-7Q 4 Fr (1,4 mm) (vonkajší prie-
MVP-9Q 5 Fr (1,7 mm) (vonkajší prie-
obmedzení
Dĺžka bez obmedzení
alebo katéter
(0,69 mm) (vnútorný priemer)
priemer)
mer)
mer)
4 Oblasť odpojenia
5 Aplikačný drôt
6 Proximálna značka
3 Priemer bez obmedzení
Dĺžka aplikačného drôtu
Maximálna dĺžka odporúčaného mikrokatétra alebo
katétra
153 cm
153 cm
120 cm
120 cm
Priemer cieľovej
cievy
2 Účel použitia/indikácie použitia
Systém mikrovaskulárnej zátky MVP je indikovaný na obštrukciu alebo zníženie rýchlosti prietoku
krvi v periférnej vaskulatúre.
3 Kontraindikácie
Nie sú známe žiadne kontraindikácie použitia tohto zariadenia.
4 Kompatibilita
Rozmery zariadenia sú uvedené na označení systému MVP. Ak chcete stanoviť kompatibilitu
zariadenia s inými zdravotníckymi technológiami, pozrite si dokumentáciu dodanú s danými
technológiami.
5 Varovania
• Bezpečnosť a účinnosť systému MVP nebola stanovená pre kardiologické použitie (napr.
oklúzia srdcového septa, otvorený ductus arteriosus, uzavretie paravalvulárneho úniku)
a neurologické použitie.
Systém MVP by mali používať len lekári, ktorí sú oboznámení s angiografickými a intervenčnými
•
zákrokmi. Pred použitím systému MVP je dôležité prečítať si pokyny na používanie.
• Systém MVP použite pred dátumom najneskoršej spotreby uvedeným na označení produktu na
obale.
• Systém MVP je apyrogénny a dodáva sa sterilný, pokiaľ nebolo otvorené alebo poškodené
balenie systému MVP. Systém nepoužívajte, aj je balenie narušené alebo poškodené.
• Systém MVP pred použitím skontrolujte. Ak spozorujete akékoľvek odchýlky alebo
poškodenia, zlikvidujte ho.
• Systém MVP je určený len na jednorazové použitie. Neregenerujte ani opätovne nesterilizujte.
Uvedenie do opätovne použiteľného stavu a opätovné sterilizovanie môžu zvýšiť riziká infekcie
pacienta a zhoršenia funkčnosti zariadenia. Systém MVP po použití zlikvidujte v súlade
s postupmi nemocnice a nariadeniami miestnej samosprávy.
• Systém MVP zavádzajte a manipulujte s ním za pomoci skiaskopického zobrazovania. Ak
pocítite nadmerný odpor, zariadenie neposúvajte ani nevyťahujte, kým nezistíte príčinu odporu.
• Aplikačný drôt neskrúcajte ani ním neotáčajte, pokiaľ sa nepokúšate odpojiť zariadenie.
V opačnom prípade by mohlo dôjsť k predčasnému odpojeniu zariadenia.
• Na vstreknutie kontrastnej látky spolu so zariadením cez mikrokatéter alebo katéter
nepoužívajte tlakové injekčné striekačky.
• Neposúvajte aplikačný drôt po tom, ako ho odpojíte od zariadenia MVP.
• Lekári musia byť pripravení na riešenie urgentných situácií, ktoré si môžu vyžadovať
odstránenie zariadenia. V rámci tejto prípravy je nutné zabezpečiť, aby bol na pracovisku
k dispozícii chirurg.
• Nepoužívajte s katétrami, ktoré sú kontraindikované pre embolické pomôcky (napr. cievky
alebo zátky).
6 Preventívne opatrenia
• Zariadenie MVP je tvorené zliatinou niklu a titánu, ktorá sa vo všeobecnosti považuje za
bezpečnú. In-vitro testovanie však preukázalo, že minimálne 60 dní po implantácii sa zo
zariadenia uvoľňuje nikel. U pacientov alergických na nikel sa môže vyskytnúť alergická reakcia
na zariadenie, najmä ak ide o pacientov s potvrdenými alergiami na kovy. Niektoré alergické
reakcie môžu byť závažné. Upovedomte preto pacientov, aby pri podozrení na alergickú
reakciu, napríklad v prípade sťaženého dýchania, začervenania tváre alebo zápalu hrdla,
okamžite informovali svojho lekára. U niektorých pacientov sa môže po implantácii zariadenia
vyvinúť alergia na nikel.
• V situáciách, ktoré zahŕňajú použitie antikoagulačných alebo antitrombocytových liečiv pred,
počas alebo po použití zariadenia, by mali lekári vykonať klinický posudok.
• V prípade nasledujúcich osobitných skupín populácie postupujte opatrne:
– U tehotných žien je potrebné dbať na to, aby sa minimalizovalo vystavenie matky a plodu
žiareniu.
– U dojčiacich žien nebolo vykonané žiadne kvantitatívne zhodnotenie prítomnosti výluhov
v materskom mlieku.
• V prípade použitia iných pomocných zariadení pri intravaskulárnych zákrokoch overte
kompatibilitu systému MVP. Lekári používajúci systém MVP musia byť oboznámení
s perkutánnymi intravaskulárnymi technikami, ako aj možnými komplikáciami súvisiacimi
s týmto zákrokom.
• Systém MVP je potrebné pred použitím hydratovať.
• So systémom MVP manipulujte opatrne, aby ste znížili riziko neúmyselného poškodenia.
• Pri použití s drážkovanými nitinolovými mikrokatétrami alebo katétrami bude pri tlačení možno
potrebné vyvinúť väčšiu silu.
• Pred použitím akéhokoľvek doplnkového zariadenia overte, či je jeho priemer kompatibilný so
systémom MVP.
7 Možné nežiaduce udalosti
Medzi nežiaduce udalosti, ktoré sa môžu vyskytnúť počas zákroku alebo po zavedení zariadenia,
patria okrem iného tieto:
• vzduchový embolus
• alergická reakcia alebo toxické účinky
• krvácanie,
• smrť
• migrácia zariadenia
• horúčka,
• embolická udalosť súvisiaca s cudzím materiálom
• infekcia
• oklúzia nežiaducej cievy
• periférna embólia
• rekanalizácia
68
Page 69

• reziduálny prietok
• mozgová príhoda alebo prechodný ischemický záchvat (TIA)
• potreba chirurgickej intervencie
• komplikácie v mieste prístupu do cievy
• poranenie alebo perforácia cievy
8 Potrebné materiály
1. Na zavedenie systému MVP je potrebný mikrokatéter alebo katéter (odporúčané veľkosti
uvádza Tab. 2).
2. Je tiež potrebné nasledujúce príslušenstvo:
• heparinizovaný fyziologický roztok
• rotujúci hemostatický ventil (RHV)
• 3-cestný kohútik
• tlaková manžeta na vak s fyziologickým roztokom
• prístupové puzdro
• vodiaci katéter kompatibilný s mikrokatétrom alebo katétrom, ktorý odporúča Tab. 2
• vodiaci drôt kompatibilný s vodiacim katétrom a mikrokatétrom alebo katétrom
• infúzny stojan na intravenózne podávanie
9 Príprava
1. S cieľom dosiahnuť optimálne fungovanie systému MVP a znížiť riziko výskytu
tromboembolických komplikácií by sa malo udržiavať kontinuálne preplachovanie
fyziologickým roztokom medzi týmito položkami:
• medzi prístupovým puzdrom a vodiacim katétrom
• medzi mikrokatétrom alebo katétrom a vodiacim katétrom
• medzi mikrokatétrom alebo katétrom, vodiacim drôtom a systémom MVP
2. Pomocou odporúčaného postupu umiestnite vhodný vodiaci katéter. K otvoru vodiaceho
katétra pripojte rotujúci hemostatický ventil (RHV). K bočnému ramenu RHV pripojte 3-cestný
kohútik. Pripojte linku s heparinizovaným fyziologickým roztokom, ktorý sa bude používať na
preplachovanie.
3. Skontrolujte všetky spojovacie prvky a zabezpečte, aby počas kontinuálneho preplachovania
nevnikal do vodiaceho katétra alebo mikrokatétra, respektíve katétra, vzduch.
10 Návod na použitie
1. Prejdite k cieľovej cieve a pomocou štandardného postupu urobte angiogram, aby ste zmerali
priemer cievy v požadovanom mieste oklúzie. Overte, či cieľová cieva spĺňa odporúčaný
priemer, ktorý uvádza Tab. 1.
2. Overte, či je miesto oklúzie dostatočne dlhé na umiestnenie implantovaného zariadenia MVP
bez toho, aby zariadenie blokovalo nechcené cievy.
3. Vyberte mikrokatéter alebo katéter (odporúčané veľkosti uvádza Tab. 2) a pripravte ho podľa
pokynov výrobcu.
4. Zaveďte vodiaci drôt a posúvajte po ňom mikrokatéter alebo katéter, až kým sa distálny hrot
nebude nachádzať v blízkosti okraja miesta oklúzie.
5. Vytiahnite vodiaci drôt z mikrokatétra alebo katétra.
6. Vyberte systém MVP z dávkovacej hadičky tak, že jemne vyberiete žlté zavádzacie puzdro
z dvoch vonkajších svoriek a vytiahnete systém MVP z priehľadnej ochrannej hadičky. Jemne
uchopte zavádzacie puzdro v mieste proximálne voči zariadeniu MVP a pomaly spoločne
vytiahnite zariadenie MVP, aplikačný drôt a zavádzacie puzdro z dávkovacej hadičky. Pozrite
Obr. 3.
Obrázok 3. Zabalený systém MVP
1 Priehľadná ochranná hadička
2 Žlté zavádzacie puzdro
3 Aplikačný drôt (vnútri zavádzacieho
puzdra)
7. Dôkladne skontrolujte, či systém MVP nie je poškodený. Ak je systém MVP poškodený,
vymeňte ho za nový systém MVP.
8. Prepláchnite systém MVP tak, že jemne ponoríte niekoľko centimetrov zavádzacieho puzdra
a zariadenia MVP do heparinizovaného fyziologického roztoku.
9. Vtiahnite zariadenie MVP do zavádzacieho puzdra tak, že budete ťahať aplikačný drôt, až kým
distálny hrot zariadenia MVP nebude prekrytý zavádzacím puzdrom.
Poznámka: Ak bude zariadenie MVP vtiahnuté príliš hlboko do zavádzacieho puzdra, nemusí
sa správne prepláchnuť. Dva otvory v zavádzacom puzdre, ktoré sú umiestnené 3 cm a 6 cm
proximálne od hrotu puzdra, uľahčujú vypúšťanie vzduchu a preplachovanie zariadenia.
10. Zaveďte systém MVP zasúvaním distálneho konca zavádzacieho puzdra cez RHV do otvoru
mikrokatétra alebo katétra, až kým nebude puzdro pevne usadené. Dotiahnite RHV tak, aby
ste zamedzili spätnému toku krvi, ale nie až príliš silno, aby nedošlo k poškodeniu systému
MVP počas jeho zavádzania do mikrokatétra alebo katétra.
11. Vizuálne overte, že infúzia preplachovacieho roztoku prebieha normálne. Z proximálneho
konca zavádzacieho puzdra by mali vychádzať kvapky fyziologického roztoku.
12. Uvoľnite RHV dostatočne na to, aby bolo možné spoločne posúvať zariadenie MVP
a aplikačný drôt ako jeden systém. RHV neuvoľnite príliš, aby nedošlo k spätnému toku krvi.
Vyberte zavádzacie puzdro tak, že ho vytiahnete cez proximálny koniec aplikačného drôtu.
13. Posúvajte aplikačný drôt a zariadenie MVP, až kým nebude distálna platinová značka na
zariadení MVP zarovno s distálnym označovacím prúžkom na mikrokatétri alebo katétri.
14. Overte, či sú označovacie prúžky optimálne umiestnené. Rozviňte zariadenie MVP
aplikovaním stáleho tlaku smerom vpred na aplikačný drôt a súčasným pomalým vyťahovaním
mikrokatétra alebo katétra, aby zariadenie MVP vyšlo z puzdra.
15. Ak je umiestnenie zariadenia nevyhovujúce, vykonajte tieto kroky:
a. Stabilizujte aplikačný drôt a zasúvajte mikrokatéter alebo katéter distálnym posúvaním, až
kým sa zariadenie MVP vnútri katétra znovu nezachytí.
b. Zmeňte polohu zariadenia a opätovne ho rozviňte, alebo ho odstráňte z tela pacienta.
Poznámka: Zariadenie by nemalo byť vtiahnuté a rozvinuté viac ako trikrát.
16. Pre správne odpojenie musí byť zariadenie MVP umiestnené za hrotom mikrokatétra alebo
katétra.
17. Ak je umiestnenie zariadenia vyhovujúce, pokračujte jeho odpojením podľa týchto krokov:
a. Pomocou skiaskopie overte, či je hrot mikrokatétra alebo katétra proximálne voči
zariadeniu MVP.
b. K aplikačnému drôtu pripojte otočnú páčku. Odpojte zariadenie MVP otáčaním
aplikačného drôtu proti smeru chodu hodinových ručičiek, až kým sa drôt neodpojí od
zariadenia.
c. Skiaskopicky overte úspešné odpojenie zariadenia tak, že budete pomaly ťahať aplikačný
drôt v proximálnom smere, aby ste sa uistili, či sa zariadenie MVP nehýbe spolu s ním.
V nepravdepodobnom prípade, že sa zariadenie MVP bude posúvať v proximálnom
smere, vráťte zariadenie na pôvodné miesto a opätovne otáčajte aplikačným drôtom proti
smeru chodu hodinových ručičiek, aby sa oddelil od zariadenia.
18. Držte mikrokatéter alebo katéter pevne na mieste a zasuňte aplikačný drôt späť do
mikrokatétra alebo katétra a potom vytiahnite aplikačný drôt z tela pacienta. Zákrok dokončite
štandardným spôsobom.
4 Otočná páčka
5 Dávkovacia hadička
6 Zariadenie MVP
11 Pokyny týkajúce sa postupu po zákroku
Ak je vo vašej krajine k dispozícii služba MedicAlert, odporučte pacientovi, aby sa stal členom
služby MedicAlert na stránke www.medicalert.org. Pacient bude požiadaný, aby uviedol svoj
zdravotný stav, názov implantovaného zariadenia a obmedzenia týkajúce sa použitia MR.
12 Informácie o magnetickej rezonancii (MR)
12.1 Podmienečne bezpečné v prostredí MR
Mikrovaskulárna zátka MVP bola vyhodnotená ako podmienečne bezpečná v prostredí MR.
Neklinické testovanie preukázalo, že mikrovaskulárna zátka MVP je podmienečne bezpečná
v prostredí MR. Pacienta s týmto zariadením možno bezpečne skenovať bezprostredne po
umiestnení zariadenia za nasledujúcich podmienok:
• statické magnetické pole s intenzitou 3,0 Tesla alebo menej,
• maximálny priestorový gradient magnetického poľa 9 000 Gauss/cm alebo menej,
69
Page 70

• maximálna celotelová priemerná špecifická miera absorpcie (SAR) udávaná MR systémom na
úrovni 4 W/kg počas 15 minút skenovania (t. j. za pulznú sekvenciu),
• riadený prevádzkový režim systému MR prvej úrovne.
12.2 Zahrievanie v súvislosti so skenovaním MR
V neklinickom testovaní počas skenovania MR v trvaní 15 min (t. j. za jednu pulznú sekvenciu)
systémom MR s intenzitou 3 Tesla (3 Tesla/128 MHz, Excite, HDx, Software 14X.M5, General
Electric Healthcare, Milwaukee, WI) generovala mikrovaskulárna zátka MVP nasledujúci nárast
teploty: najväčšia zmena teploty +1,8°C
Preto pokusy týkajúce sa zahrievania mikrovaskulárnej zátky MVP v súvislosti so skenovaním MR
s intenzitou 3 Tesla pomocou vysielacej/prijímacej RF telovej cievky s hodnotou SAR (celotelová
priemerná špecifická miera absorpcie udávaná MR systémom) 2,9 W/kg (t. j. spojená s priemernou
celotelovou hodnotou 2,7 W/kg meranou kalorimetrom) ukázali, že najvyššie zahriatie, ktoré sa
vyskytlo v týchto špecifických podmienkach, bolo nižšie alebo rovné +1,8°C.
12.3 Informácie o artefaktoch
Kvalita zobrazenia MR sa môže zhoršiť, ak sa oblasť záujmu nachádza presne v tej istej oblasti
alebo relatívne blízko k oblasti, kde je umiestnená mikrovaskulárna zátka MVP. Preto je potrebná
optimalizácia parametrov zobrazenia MR, aby sa vykompenzovala prítomnosť tohto zariadenia.
Maximálna veľkosť artefaktov (t. j. pozorovaných pri pulznej sekvencii gradient echo) siaha do
vzdialenosti približne 5 mm v závislosti od veľkosti a tvaru mikrovaskulárnej zátky MVP.
Pulzná sekvencia
Veľkosť medzery
signálov
Orientácia roviny rovnobežná kolmá rovnobežná kolmá
T1-SE T1-SE GRE GRE
252 mm
2
91 mm
2
304 mm
2
116 mm
2
13 Skladovanie
Systém MVP počas skladovania nevystavujte priamemu slnečnému žiareniu, extrémnym teplotám
ani vysokej vlhkosti a zamedzte jeho kontaktu s vodou. Systém MVP skladujte pri regulovanej
izbovej teplote. Dátum najneskoršej spotreby zariadenia nájdete na označení výrobku. Toto
zariadenie nepoužívajte po dátume najneskoršej spotreby uvedenom na označení.
14 Materiály
Systém MVP nie je vyrobený z materiálov obsahujúcich latex alebo PVC.
15 Odmietnutie záruky
Varovania na štítkoch, ktorými je produkt označený, poskytujú podrobnejšie informácie
a považujú sa za neoddeliteľnú súčasť tohto odmietnutia záruky. Hoci bol produkt
vyrobený za starostlivo sledovaných podmienok, spoločnosť Medtronic nemôže ovplyvniť
podmienky, za akých sa tento produkt používa. Spoločnosť Medtronic preto odmieta
všetky záruky na produkt, či už výslovné alebo predpokladané, vrátane (ale nielen)
všetkých predpokladaných záruk predajnosti alebo spôsobilosti na konkrétny účel.
Spoločnosť Medtronic nenesie zodpovednosť voči žiadnej fyzickej ani právnickej osobe za
žiadne liečebné náklady ani žiadne priame, náhodné alebo následné škody spôsobené
akýmkoľvek používaním, poruchou, zlyhaním alebo nesprávnym fungovaním produktu, či
už sa nárok na tieto škody uplatňuje na základe záruky, zmluvy, protiprávneho konania
alebo inej právnej teórie. Žiadna osoba nemá oprávnenie zaviazať spoločnosť Medtronic
k žiadnym vyhláseniam ani zárukám týkajúcim sa tohto produktu.
Vyššie uvedené výnimky a obmedzenia by nemali byť v rozpore s povinnými ustanoveniami
platných právnych predpisov a ani by sa ako také nemali vykladať. Ak bude ľubovoľný súd
kompetentnej jurisdikcie považovať niektorú časť alebo podmienku tohto odmietnutia záruky za
nelegálnu, nevynútiteľnú alebo nezlučiteľnú s relevantnými právnymi ustanoveniami, vyhlásenie
súdu nebude mať vplyv na platnosť zvyšných častí tohto odmietnutia záruky a všetky práva
a povinnosti sa musia posudzovať a presadzovať tak, ako keby toto odmietnutie záruky
neobsahovalo časť alebo podmienku, ktorá sa považovala za neplatnú.
Slovenščina
1 Opis naprave
Sistem čepa za mikrovaskulaturo MVP je samorazširljiv pripomoček za okluzijo žile. Pripomoček
MVP je ovalne oblike, izdelan iz nitinola, in na obeh koncih zaščiten z označevalnima trakovoma iz
platine. Pripomoček vključuje delno prevleko PTFE. Proksimalni označevalni trak se pritrdi na
uvajalno žico, ki pripomoček potisne skozi mikrokateter ali kateter, ki je komercialno dostopen, do
ciljnega mesta zdravljenja. Uvajalna žica se s pripomočka MVP sname tako, da jo zavrtite v
nasprotni smeri urnega kazalca in tako odvijete s pripomočka.
Sistem MVP je pakiran kot ena enota, ki vsebuje pripomoček MVP, uvajalni tulec in snemljivo
uvajalno žico. Sistem je dobavljen sterilen in apirogen ter je namenjen samo za enkratno uporabo.
Slika 1. Čep za mikrovaskulaturo MVP
1 Delna prevleka
2 Distalni označevalec
3 Pripomoček MVP
Slika 2. Dimenzije sistema MVP
1 Dolžina uvajalne žice
2 Dolžina nevpetega pripomočka (pripomoček ni v tulcu in na njem ni drugih priključkov)
3 Premer nevpetega pripomočka
Tabela 1. Dimenzije MVP Model Premer neovira-
MVP-3Q 5,3 mm 12 mm 180 cm 1,5 mm – 3,0 mm
MVP-5Q 6,5 mm 12 mm 180 cm 3,0 mm – 5,0 mm
MVP-7Q 9,2 mm 16 mm 165 cm 5,0 mm – 7,0 mm
MVP-9Q 13,0 mm 18 mm 165 cm 7,0 mm – 9,0 mm
Tabela 2. Priporočen mikrokateter ali kateter Model Priporočen mikrokateter ali
MVP-3Q 0,021 in (0,53 mm) do 0,027 in
MVP-5Q 0,027 in (0,69 mm) (notranji
MVP-7Q 4 Fr (1,4 mm) (zunanji premer) 120 cm
MVP-9Q 5 Fr (1,7 mm) (zunanji premer) 120 cm
nega dela
Dolžina nevpetega pripomočka
kateter
(0,69 mm) (notranji premer)
premer)
4 Območje snetja
5 Uvajalna žica
6 Proksimalni označevalec
Dolžina uvajalne žice
Največja dolžina priporočenega mikrokatetra ali katetra
153 cm
153 cm
Premer ciljne
žile
2 Namen uporabe/indikacije za uporabo
Sistem čepa za mikrovaskulaturo MVP je indiciran za zamašitev ali zmanjšanje hitrosti krvnega
pretoka v periferni vaskulaturi.
3 Kontraindikacije
Pri uporabi tega pripomočka ni znanih kontraindikacij.
4 Združljivost
Za dimenzije pripomočka glejte oznako izdelka za sistem MVP. Pri določanju združljivosti glejte
oznake drugih medicinskih tehnologij.
5 Opozorila
• Varnost in učinkovitost sistema MVP nista bili ugotovljeni za uporabe v kardiologiji (npr.
septalna okluzija srca, patentni duktus arteriosus, zaprtje paravalvularnega puščanja) in v
nevrologiji.
• Sistem MVP smejo uporabljati samo zdravniki, seznanjeni z angiografskimi in intervencijskimi
posegi. Pred uporabo sistema MVP je pomembno prebrati navodila za uporabo.
70
Page 71

• Sistem MVP uporabite pred datumom izteka roka uporabnosti, ki je natisnjen na oznaki na
ovojnini izdelka.
• Sistem MVP je apirogen in dobavljen sterilen, razen če je bila ovojnina sistema MVP odprta ali
poškodovana. Ne uporabite, če je ovojnina predrta ali poškodovana.
• Pred uporabo sistem MVP preglejte in ga v primeru nepravilnosti ali poškodb zavrzite.
• Sistem MVP je namenjen samo za enkratno uporabo. Pripomočka ne smete znova predelati ali
znova sterilizirati. Ponovna predelava ali ponovna sterilizacija lahko povečata nevarnost za
okužbo pri bolniku ter tveganje za nepravilno delovanje pripomočka. Po uporabi sistem MVP
zavrzite v skladu z bolnišničnimi in lokalnimi vladnimi predpisi.
• Pri uvajanju ali rokovanjem s sistemom MVP uporabite fluoroskopsko spremljanje. Če začutite
prekomeren upor, pripomočka ne potiskajte oz. izvlecite, dokler ne ugotovite vzroka za upor.
• Uvajalne žice ne zvijajte ali vrtite, razen če želite pripomoček sneti, sicer se lahko pripomoček
sname prezgodaj.
• Za vbrizgavanje kontrastnega sredstva s pripomočkom skozi mikrokateter ali kateter ne
uporabljajte injekcijske brizge za hitro vbrizgavanje.
• Ko uvajalno žico snamete s pripomočka MVP, je več ne potiskajte.
• Zdravniki morajo biti pripravljeni na reševanje urgentnih situacij, zaradi katerih bi bilo treba
pripomoček odstraniti. To vključuje razpoložljivost kirurga na kraju samem.
• Ne uporabljajte katetrov, ki so kontraindicirani za pripomočke za embolijo (npr. tuljave ali čep).
6 Previdnostni ukrepi
• Pripomoček MVP je izdelan iz zlitine niklja in titana, ki na splošno velja za varno. Vendar je
in-vitro preskušanje pokazalo, da se po vsaditvi nikelj sprošča s pripomočka še najmanj 60 dni.
Pri bolnikih z alergijo na nikelj se lahko pojavi alergijska reakcija na pripomoček, zlasti pri
bolnikih z alergijami na kovino v anamnezi. Nekatere alergijske reakcije so lahko resne.
Bolnikom je treba naročiti, naj takoj obvestijo svoje zdravnike, če sumijo, da se je pri njih pojavila
alergijska reakcija, npr. oteženo dihanje ali vnetje obraza ali grla. Pri nekaterih bolnikih se lahko
razvije alergija na nikelj, če je bil pripomoček vsajen.
• Zdravniki morajo v primerih, ki vključujejo uporabo antikoagulacijskih ali antiagregacijskih
zdravil pred, med ali po uporabo pripomočka, uporabiti klinično presojo.
• Upoštevajte napotke za naslednje specifične populacije:
– Pri nosečnicah je treba paziti, da se zmanjša izpostavljenost matere in zarodka sevanju.
– Pri doječih materah ni bilo opravljene nobene kvantitativne ocene prisotnosti izlužin v
materinem mleku po vsaditvi pripomočka.
• Kadar pri intravaskularnih posegih uporabljate pomožne pripomočke, potrdite njihovo
združljivost s sistemom MVP. Zdravniki, ki uporabljajo sistem MVP, morajo biti seznanjeni s
perkutanimi, intravaskularnimi tehnikami in morebitnimi zapleti, povezanimi s posegom.
• Sistem MVP je treba pred uporabo omočiti.
• Pri rokovanju s sistemom MVP bodite previdni, da zmanjšate možnost nenamernih poškodb.
• Kadar pripomoček uporabljate s kompozitnimi mikrokatetri ali kateteri iz nitinola z režami, boste
morali pripomoček morda potisniti močneje.
• Pred uporabo potrdite, da je premer posameznega pripomočka, ki ga uporabljate, združljiv s
sistemom MVP.
7 Morebitni neželeni dogodki
Morebitni neželeni učinki, do katerih lahko pride med postopkom namestitve tega pripomočka ali po
njem, med drugim vključujejo te učinke:
• zračne emboluse;
• alergijske reakcije ali toksične učinke;
• krvavenje;
• smrti
• premik pripomočka;
• vročina;
• embolične dogodke tujka;
• okužba;
• okuzijo neciljne žile;
• periferno embolijo;
• rekanalizacijo;
• rezidualni pretok;
• kap ali prehodni ishemični napad (TIA);
• kirurški poseg;
• zaplete na vaskularnem mestu posega;
• poškodbo ali predrtje žile.
8 Potrebni material
1. Za uvajanje sistema MVP potrebujete mikrokateter ali kateter (za priporočeno velikost glejte
tab. 2).
2. Potrebni pripomočki:
• heparinizirana fiziološka raztopina;
• vrtljivi hemostatski ventil;
• 3-potna pipa;
• tlačna manšeta vrečke s fiziološko raztopino;
• uvajalna cev;
• vodilni kateter, združljiv z mikrokatetrom ali katetrom, priporočenim v tab. 2;
• vodilna žica, združljiva z vodilnim katetrom in mikrokatetrom ali katetrom;
• stojalo za infuzijo.
9 Priprava
1. Za najboljše delovanje sistema MVP in zmanjšanje tveganja za trombembolične zaplete s
fiziološko raztopino neprekinjeno izpirajte poti med naslednjimi pripomočki:
• med uvajalno cevjo in vodilnim katetrom;
• med mikrokatetrom ali katetrom in vodilnim katetrom;
• med mikrokatetrom ali katetrom in vodilno žico ter sistemom MVP.
2. Namestite ustrezni vodilni kateter v skladu s priporočenim postopkom. Priključite vrtljivi
hemostatski ventil na nastavek na vodilnem katetru. Namestite 3-potno pipo na stranski
priključek vrtljivega hemostatskega ventila. Priključite cevko s heparinizirano fiziološko
raztopino za neprekinjeno izpiranje.
3. Preglejte vse priključke in se prepričajte, da med neprekinjenim izpiranjem v vodilni kateter ali
mikrokateter ali kateter ni vstopil zrak.
10 Navodila za uporabo
1. Dostopite do ciljne žile in izvedite angiogram z uporabo standardne tehnike ter izmerite premer
žile na želenem mestu okluzije. Zagotovite, da je ciljna žila v skladu s priporočenim premerom
(glejte tab. 1).
2. Mesto okluzije naj bo dovolj dolgo, da lahko vanj vstavite vsajeni pripomoček MVP, ne da bi pri
tem zamašili neciljne žile.
3. Izberite mikrokateter ali kateter (za priporočeno velikost glejte tab. 2) in ga pripravite v skladu
z navodili za uporabo proizvajalca.
4. Vstavite vodilno žico in potisnite mikrokateter ali kateter čez vodilno žico tako daleč, da se
distalna konica približa sprednjemu robu mesta okluzije.
5. Odstranite vodilno žico iz mikrokatetra ali katetra.
6. Odstranite sistem MVP iz ovojne cevi, tako da nežno odstranite rumeni uvajalni tulec z dveh
zunanjih sponk in izvlečete sistem MVP iz prozorne zaščitne cevke. Nežno primite uvajalni
tulec na mestu proksimalno od pripomočka MVP in iz ovojne cevi počasi sočasno izvlecite
pripomoček MVP, uvajalno žico in uvajalni tulec. Glejte sl. 3.
Slika 3. Pakirani sistem MVP
1 Prozorna zaščitna cevka
2 Rumeni uvajalni tulec
3 Uvajalna žica (znotraj uvajalnega tulca)
4 Pripomoček za privijanje
5 Ovojna cev
6 Pripomoček MVP
7. Temeljito preglejte sistem MVP glede poškodb. Če je sistem MVP poškodovan, ga zamenjajte
z novim sistemom MVP.
8. Izperite sistem MVP, tako da nežno potopite nekaj centimetrov uvajalnega tulca in pripomočka
MVP v heparinizirano fiziološko raztopino.
71
Page 72

9. Povlecite pripomoček MVP v uvajalni tulec, tako da povlečete uvajalno žico tako daleč, da
uvajalni tulec prekrije distalno konico pripomočka MVP.
Opomba: Če pripomoček MVP povlečete predaleč v uvajalni tulec, se morda ne bo pravilno
izpral. Dve odprtini v uvajalnem tulcu, ki se nahajata 3 cm in 6 cm proksimalno od konice tulca,
olajšata odstranjevanje zraka in izpiranje pripomočka.
10. Vstavite sistem MVP, tako da vstavite distalni konec uvajalnega tulca skozi vrtljivi hemostatski
ventil in v nastavek za mikrokateter ali kateter tako daleč, da je tulec ustrezno nameščen.
Privijte vrtljivi hemostatski ventil dovolj močno, da preprečite povratni tok krvi, vendar ne
premočno, da se sistem MVP med vstavljanjem v mikrokateter ali kateter ne bi poškodoval.
11. Vizualno preverite, da se raztopina za izpiranje normalno infundira. Iz proksimalnega konca
uvajalnega tulca mora kapljati fiziološka raztopina.
12. Zrahljajte vrtljivi hemostatski ventil, tako da boste lahko pripomoček MVP in uvajalno žico
vstavili skupaj kot sistem. Vrtljivega hemostatskega ventila ne zrahljajte toliko, da bi omogočili
povratni tok krvi. Odstranite uvajalni tulec, tako da ga izvlečete čez proksimalni konec uvajalne
žice.
13. Potiskajte uvajalno žico in pripomoček MVP tako daleč, da je distalni označevalec iz platine
pripomočka MVP poravnan z distalnim označevalnim trakom na mikrokatetru ali katetru.
14. Potrdite optimalni položaj označevalnih trakov. Namestite pripomoček MVP, tako da vzdržujete
pritisk na uvajalno žico naprej, medtem pa počasi umikate mikrokateter ali kateter, da izvlečete
tulec s pripomočka MVP.
15. Če pripomoček ni v ustreznem položaju, upoštevajte naslednje:
a. Sterilizirajte uvajalno žico in vstavite mikrokateter ali kateter tako, da ga pomikate distalno,
dokler pripomoček MVP ni znova v katetru.
b. Ponovno namestite pripomoček in ga znova sprostite, ali pa ga odstranite iz bolnika.
Opomba: Pripomoček lahko znova uvedete v tulec in sprostite največ 3-krat.
16. Za ustrezno snetje mora biti pripomoček MVP nameščen preko konice mikrokatetra ali katetra.
17. Če je pripomoček v ustreznem položaju, nadaljujte snetjem po naslednjih navodilih:
a. S pomočjo fluoroskopije potrdite, da je konica mikrokatetra ali katetra proksimalno od
pripomočka MVP.
b. Na uvajalno žico priključite pripomoček za privijanje. Snemite pripomoček MVP, tako da
uvajalno žico vrtite v nasprotni smeri urnega kazalca, dokler se ne sname s pripomočka.
c. Potrdite uspešno snetje s fluoroskopijo, tako da počasi povlečete uvajalno žico v
proksimalni smeri in se prepričate, da se pripomoček MVP ne premika. V malo verjetnem
primeru, da se pripomoček MVP premakne v proksimalni smeri, znova potrdite postavitev
pripomočka in znova zavrtite uvajalno žico v nasprotni smeri urnega kazalca, da
pripomoček snamete.
18. Držite mikrokateter ali kateter na mestu, medtem pa povlecite uvajalno žico v mikrokateter ali
kateter ter nato odstranite uvajalno žico iz bolnika. Dokončajte postopek v skladu s standardno
tehniko.
11 Navodila po postopku
Če je v vaši regiji na voljo storitev MedicAlert, bolniku priporočite, da postane član storitve
MedicAlert na spletnem mestu www.medicalert.org. Bolnik bo moral navesti svoje zdravstveno
stanje, ime vsadnega pripomočka in omejitve glede uporabe MRI.
12 Podatki o magnetnoresonančnem slikanju (MRI)
12.1 Pogojna uporaba pri MR
Za čep za mikrovaskulaturo MVP je bilo ugotovljeno, da je primeren za pogojno uporabo pri MRI.
Neklinično preskušanje je pokazalo, da je pripomoček čepa za mikrovaskulaturo MVP primeren za
pogojno uporabo pri MRI. Bolnika s tem pripomočkom lahko varno slikate takoj po namestitvi, pod
naslednjimi pogoji:
• statično magnetno polje je 3 T ali manj,
• največji prostorski gradient magnetnega polja je 9000 gauss/cm ali manj,
• najvišja povprečna stopnja specifične absorpcije (SAR) za celo telo, ki jo zabeleži sistem za
magnetnoresonančno slikanje, je 4 W/kg v 15 minutah slikanja (na pulzno zaporedje),
• način delovanja, nadziran na prvi ravni, za sistem MR.
12.2 Segrevanje, povezano z MRI
V nekliničnem preskušanju je pripomoček čepa za mikrovaskulaturo MVP povzročil naslednji dvig
temperature med 15- min slikanjem z MRI (tj. na pulzno zaporedje) v sistemu MR s 3 tesla
(3 tesla/128 MHz, Excite, HDx, Software 14X.M5, General Electric Healthcare, Milwaukee, WI):
Najvišja temperaturna sprememba +1,8°C
Preizkusi segrevanja, povezanega z MRI, za pripomoček čepa za mikrovaskulaturo MVP pri 3 tesla
z radiofrekvenčno oddajno/sprejemno tuljavo za telo pri povprečnem SAR za celo telo, o katerem so
poročali pri sistemu MR, 2,9 W/kg (tj. povezano s povprečno vrednostjo, izmerjeno s kalorimetrijo
za celo telo, 2,7 W/kg), so pokazali, da je bilo največje segrevanje, do katerega je prišlo v povezavi
s temi pogoji, enako ali manjše od +1,8°C.
12.3 Podatki o artefaktih
Kakovost magnetnoresonančne (MR) slike je lahko ogrožena, če je želeno območje slikanja točno
na mestu ali v relativni bližini mesta pripomočka čepa za mikrovaskulaturo MVP. Če želite izničiti
učinek prisotnosti pripomočka, boste morda morali optimizirati parametre za magnetnoresonančno
slikanje. Največja velikost artefaktov (tj. pri slikanju s pulznim zaporedjem postopnega odmeva) se
razteza približno 5 mm glede na velikost in obliko pripomočka čepa za mikrovaskulaturo MVP.
Pulzno zaporedje
Velikost signalne
praznine
Usmeritev ravnine Vzporedno Pravokotno Vzporedno Pravokotno
T1-SE T1-SE GRE GRE
252 mm
2
91 mm
2
304 mm
2
116 mm
13 Shranjevanje
Med shranjevanjem preprečite izpostavljenost sistema MVP vodi, sončni svetlobi, ekstremni
temperaturi in visoki vlažnosti. Sistem MVP shranjujte pri nadzorovani sobni temperaturi. Za »rok
uporabnosti« pripomočka glejte oznako izdelka. Pripomočka ne uporabljajte po izteku
navedenega »roka uporabnosti«.
14 Materiali
Sistem MVP ni izdelan iz lateksa ali materialov PVC.
15 Zavrnitev jamstva
V opozorilih na oznakah izdelka so podrobnejše informacije, ki so sestavni del te zavrnitve
jamstva. Čeprav je bil izdelek izdelan v pozorno nadzorovanih razmerah, družba Medtronic
nima nadzora nad razmerami, v katerih se ta izdelek uporablja. Medtronic zato zavrača vsa
izrecna ali naznačena jamstva v zvezi z izdelkom, vključno s kakršnim koli naznačenim
jamstvom glede primernosti za prodajo ali določen namen, a ne omejeno nanj. Medtronic
ne odgovarja nobeni fizični ali pravni osebi za kakršne koli zdravstvene stroške ali kakršno
koli neposredno, naključno ali posledično škodo, ki je posledica kakršne koli uporabe,
okvare, odpovedi ali nepravilnega delovanja izdelka, ne glede na to, ali zahtevek temelji na
jamstvu, pogodbi, odškodninski odgovornosti ali drugem. nobena oseba nima nikakršnih
pooblastil, s katerimi bi družbo Medtronic zavezala h kakršnemu koli zagotovilu ali jamstvu
v povezavi z izdelkom.
Izjeme in omejitve, določene zgoraj, se ne smejo razlagati v nasprotju z obveznimi določili veljavne
zakonodaje in se kot take tudi ne smejo obravnavati. Če pristojno sodišče ugotovi, da je kateri koli
del ali določilo te zavrnitve jamstva nezakonit, neuveljavljiv ali v nasprotju z veljavno zakonodajo, to
ne vpliva na veljavnost preostalih delov zavrnitve jamstva, vse pravice in obveznosti pa se razlagajo
in uveljavljajo, kot da ta zavrnitev jamstva ne bi vsebovala dela ali določila, za katerega je bilo
ugotovljeno, da je neveljaven.
Srpski
1 Opis uređaja
MVP sistem mikrovaskularnog zatvarača predstavlja samošireće medicinsko sredstvo za okluziju
krvnog suda. MVP medicinsko sredstvo je ovalnog oblika, napravljeno je od nitinola i na oba kraja
je pričvršćeno trakastim markerima od platine. Medicinsko sredstvo je delimično obloženo
PTFE-om. Proksimalni trakasti marker je povezan sa žicom za uvođenje koja gura sredstvo kroz
komercijalno dostupni mikrokateter ili kateter do predviđenog mesta terapije. Žica za plasiranje se
odvaja od MVP medicinskom sredstva tako što se rotira u smeru suprotnom od smera kazaljke na
satu da bi se odvila sa medicinskog sredstva.
MVP sistem se pakuje kao jedinstvena celina koja se sastoji od MVP medicinskog sredstva,
uvodnika i odvojive žice za plasiranje. Sistem se isporučuje kao sterilan, apirogen i namenjen je
isključivo za jednokratnu upotrebu.
72
2
Page 73

Slika 1. MVP Micro Vascular Plug
1 Delimična obloga
2 Distalni marker
3 MVP medicinsko sredstvo
Slika 2. Dimenzije sistema MVP
1 Dužina žice za plasiranje
2 Dužina bez ikakvih ograničenja (medicinsko sredstvo je izvađeno iz omotača i na sebi nema
nikakvih ograničenja)
3 Prečnik bez ikakvih ograničenja
Tabela 1. MVPDimenzije Model Prečnik bez
MVP-3Q 5,3 mm 12 mm 180 cm 1,5 mm – 3,0 mm
MVP-5Q 6,5 mm 12 mm 180 cm 3,0 mm – 5,0 mm
MVP-7Q 9,2 mm 16 mm 165 cm 5,0 mm – 7,0 mm
MVP-9Q 13,0 mm 18 mm 165 cm 7,0 mm – 9,0 mm
Tabela 2. Preporučeni mikrokateter ili kateter Model Preporučeni mikrokateter ili
MVP-3Q od 0,021 in (0,53 mm) do
MVP-5Q 0,027 in (0,69 mm) (UP) 153 cm
MVP-7Q 4 Fr (1,4 mm) (SP) 120 cm
MVP-9Q 5 Fr (1,7 mm) (SP) 120 cm
ikakvih
ograničenja
Dužina bez
ikakvih
ograničenja
kateter
0,027 in (0,69 mm) (UP)
4 Zona odvajanja
5 Žica za plasiranje
6 Proksimalni marker
Dužina žice za
plasiranje
Maksimalna dužina preporučenog mikrokatetera ili
katetera
153 cm
Prečnik ciljnog
krvnog suda
2 Predviđena primena / uputstva za upotrebu
MVP sistem mikrovaskularnog zatvarača je indikovan za opstrukciju ili smanjivanje brzine protoka
krvi u perifernoj cirkulaciji.
3 Kontraindikacije
Za ovaj uređaj ne postoje poznate kontraindikacije.
4 Kompatibilnost
Dimenzije medicinskog sredstva možete pronaći na oznaci proizvoda MVP sistema. Da biste
odredili eventualnu kompatibilnost, vodite se podacima koje nude oznake drugih medicinskih
tehnoloških proizvoda.
5 Upozorenja
• Nije utvrđena bezbednost i efikasnost MVP sistema za kardiološku primenu (npr. za okluziju
septalnog defekta, prohodnog duktusa arteriozusa, zatvaranja para valvularnog protoka), kao
ni za primenu u neurologiji.
MVP sistem treba da koriste samo lekari koji poznaju angiografske i interventne procedure. Pre
•
primene važno je pročitati uputstva za upotrebu MVP sistema.
• Upotrebite MVP sistem pre isteka roka trajanja odštampanog na etiketi pakovanja proizvoda.
• MVP sistem je apirogen i isporučuje se sterilan, osim kada je pakovanje MVP sistema otvoreno
ili oštećeno. Nemojte koristiti proizvod ako je pakovanje probijeno ili oštećeno.
• Pre upotrebe pregledajte MVP sistem i odbacite ga ako primetite bilo kakve nepravilnosti ili
oštećenja.
• MVP sistem je namenjen isključivo za jednokratnu upotrebu. Nije za ponovnu obradu ili
ponovnu sterilizaciju. Ponovna obrada i resterilizacija mogu povećati rizike od infekcije za
pacijenta i narušavanja performansi medicinskog sredstva. Nakon korišćenja MVP sistema,
odložite ga u otpad pridržavajući se pravila koja propisuju bolnica i lokalna uprava.
• Koristite fluoroskopski snimak kao vodič prilikom ubacivanja i pomeranja MVP sistema. Ako se
javi izražen otpor, nemojte gurati ni izvlačiti medicinsko sredstvo dok se ne utvrdi uzrok otpora.
• Nemojte uvijati ni okretati žicu za plasiranje osim u slučaju kada želite da odvojite medicinsko
sredstvo, zato što u suprotnom može doći do trajnog odvajanja medicinskog sredstva.
• Sa ovim medicinskim sredstvom nemojte koristiti špric za automatsko ubrizgavanje rastvora
kontrasta kroz mikrokateter, odnosno kateter.
• Nemojte gurati žicu za plasiranje nakon što je odvojite od MVP medicinskog sredstva.
• Lekari moraju biti spremni da se suoče sa hitnim situacijama koje zahtevaju uklanjanje
medicinskog sredstva. Ova priprema znači obezbediti i prisustvo hirurga u ustanovi koji će biti
na raspolaganju.
• Nemojte koristiti sa kateterima koji su kontraindikovani za primenu sa medicinskim sredstvima
za embolizaciju (na primer kalemima ili zatvaračima).
6 Mere opreza
• MVP medicinsko sredstvo se sastoji od nikl-titanijum legure koja se po pravilu smatra
bezbednom. Međutim, in vitro testiranja su pokazala da, nakon implantacije medicinskog
sredstva u trajanju od najmanje 60 dana, dolazi do otpuštanja nikla. Kod pacijenata koji su
alergični na nikl može doći do alergije na medicinsko sredstvo, što se posebno odnosi na
pacijente sa prethodnim alergijama na metal. Određene alergijske reakcije mogu biti ozbiljne;
pacijentima treba naložiti da obaveste svog lekara ako sumnjaju da kod njih može doći do
alergijske reakcije, zbog otežanog disanja ili pojave znakova zapaljenja na licu i u grlu. Nakon
implantacije medicinskog sredstva kod nekih pacijenata se može razviti alergija na nikl.
• Lekari treba da se vode svojom kliničkom procenom u situacijama koje podrazumevaju primenu
antikoagulantnih i antiagregantnih lekova pre, za vreme ili nakon korišćenja medicinskog
sredstva.
• Obratite pažnju kod sledećih grupa pacijenata:
– Kod pacijentkinja koje su trudne, treba voditi računa da se izlaganje majke i ploda zračenju
svede na najmanju moguću meru.
– Kod majki koje doje nije vršena kvantitativna procena izluženih elemenata u majčinom mleku
nakon implantacije medicinskog sredstva.
• Proverite eventualnu kompatibilnost MVP sistema kada prilikom intravaskularnih procedura
koristite druga pomoćna medicinska sredstva. Lekari koji koriste MVP sistem moraju poznavati
perkutane intravaskularne tehnike i moguće komplikacije povezane sa postupkom.
• MVP sistem treba navlažiti pre primene.
• Budite oprezni prilikom rukovanja MVP sistemom da bi se smanjila mogućnost zadesnog
oštećenja.
• Postoji mogućnost primene veće sile guranja kada se sredstvo koristi sa nazubljenim
nitinolskim kompozitnim mikrokateterima, odnosno kateterima.
• Pre korišćenja se uverite da je prečnik svih pratećih medicinskih sredstava koja se koriste
kompatibilan sa MVP sistemom.
7 Mogući neželjeni događaji
Mogući neželjeni događaji koji se mogu javiti tokom ili nakon postupka postavljanja ovog
medicinskog sredstva, između ostalog obuhvataju:
• nastanak vazdušnog embolusa
• alergijska reakcija ili toksični efekti
• krvarenje
• smrt
• pomeranje uređaja
• groznica
• embolija stranim telom
• infekcija
• okluzija neodgovarajućeg krvnog suda
• embolija periferne cirkulacije
• rekanalizacija
73
Page 74

• neželjeni protok krvi na mestu okluzije
• moždani udar i prolazni ishemijski napad (TIA)
• hirurška intervencija
• komplikacije na pristupnom mestu krvnom sudu
• perforacija ili povreda krvnog suda
8 Neophodni materijal
1. Uvođenje MVP sistema zahteva primenu mikrokatetera, odnosno katetera (za preporučenu
veličinu pogledajte tabela 2).
2. Evo neophodne prateće opreme i materijala:
• Rastvor soli sa heparinom
• Rotacioni hemostatski ventil (RHV)
• trokraki ventil
• Manžetna pod pritiskom za kesu sa fiziološkim rastvorom
• Pristupni omotač
• Vodič kateter kompatibilan sa mikrokateterom, odnosno kateterom koji preporučuje
tabela 2
• Vodič žica kompatibilna sa vodič kateterom i mikrokateterom, odnosno kateterom
• Stalak za intravensku (IV) infuziju
9 Priprema
1. Da bi se postigle optimalne performanse MVP sistema i smanjio rizik od tromboembolijskih
komplikacija, potrebno je fiziološkim rastvorom vršiti kontinuirano ispiranje između sledećih
elemenata:
• pristupni omotač i vodič kateter
• mikrokateter, odnosno kateter i vodič kateter
• mikrokateter, odnosno kateter, vodič-žica i MVP sistem.
2. Nakon preporučene procedure postavite odgovarajući vodič kateter. Povežite rotacioni
hemostatski ventil (RHV) sa adapterom vodič katetera. Povežite trokraku slavinu sa bočnom
granom RHV-a. Povežite liniju sa heparinizovanim fiziološkim rastvorom radi neprekidnog
ispiranja.
3. Proverite sve spojeve kako biste se uverili da u toku neprekidnog ispiranja nije došlo do
ubacivanja vazduha u vodič kateter ili mikrokateter, odnosno kateter.
10 Uputstva za upotrebu
1. Pristupite ciljnom krvnom sudu i obavite angiografsko snimanje standardnom tehnikom da
biste izmerili prečnik suda i željenog mesta okluzije. Uverite se da ciljni krvni sud odgovara
preporučenom prečniku (pogledajte tabela 1).
2. Vodite računa da mesto okluzije bude dovoljno dugačko da primi implantirano MVP
medicinsko sredstvo, tako da ne vrši neplaniranu opstrukciju drugih krvnih sudova.
3. Odaberite mikrokateter, odnosno kateter (preporučenu veličinu možete pronaći na tabela 2) i
pripremite ga prema uputstvima za upotrebu koja je propisao proizvođač.
4. Ubacite vodič-žicu i gurajte mikrokateter, odnosno kateter preko vodič-žice, sve dok se distalni
vrh ne približi početnoj ivici mesta okluzije.
5. Izvadite vodič-žicu iz mikrokatetera, odnosno katetera.
6. Izvadite MVP sistem iz cevi za primenu, pažljivo uklanjajući žuti uvodnik sa dva spoljašnja
klipsa i izvlačeći MVP sistem iz providnog valjkastog kućišta. Pažljivo uhvatite uvodnik za deo
koji je proksimalan MVP medicinskom sredstvu i polako istovremeno izvadite MVP medicinsko
sredstvo, žicu za plasiranje i uvodnik iz cevi za primenu. Pogledajte slika 3.
Slika 3. Spakovan MVP sistem
7. Pažljivo pregledajte MVP sistem kako biste otkrili eventualna oštećenja. Ako je MVP sistem
oštećen, zamenite ga novim MVP sistemom.
8. Isperite MVP sistem pažljivo potapajući nekoliko centimetara uvodnika i MVP medicinskog
sredstva u heparinizovani fiziološki rastvor.
9. Uvucite MVP medicinsko sredstvo u uvodnik, povlačeći žicu za plasiranje sve dok uvodnik ne
pokrije distalni vrh MVP medicinskog sredstva.
Napomena: Ako se MVP medicinsko sredstvo previše uvuče u uvodnik, njegovo ispiranje
možda neće biti adekvatno. Dva otvora na uvodniku smeštena 3 cm i 6 cm proksimalno od vrha
uvodnika, olakšavaju izbacivanje vazduha i ispiranje medicinskog sredstva.
10. Ubacite MVP sistem uvodeći distalni kraj uvodnika kroz RHV i adapter mikrokatetera, odnosno
katetera, sve dok uvodnika ne bude čvrsto postavljen na mesto. Zategnite RHV dovoljno da bi
se sprečio tok krvi unazad, ali ne toliko da se time ošteti MVP sistem prilikom uvođenja u
mikrokateter, odnosno kateter.
11. Pogledajte kako biste se uverili da rastvor za ispiranje normalno dotiče. Kapi fiziološkog
rastvora treba da budu vidljive kako izlaze iz proksimalnog kraja uvodnika.
12. Olabavite RHV u dovoljnoj meri da bi se omogućilo guranje MVP medicinskog sredstva i žice
za plasiranje zajedno kao jednog sistema. Nemojte olabaviti RHV toliko da to dovede do toka
krvi unazad. Izvadite uvodnik tako što ćete ga povući unazad preko proksimalnog kraja žice za
plasiranje.
13. Gurajte žicu za plasiranje i MVP medicinsko sredstvo sve dok se distalni marker od platine
MVP medicinskog sredstva ne postavi u pravcu trakastog markera mikrokatetera, odnosno
katetera.
14. Uverite se da su trakasti markeri u optimalnom položaju. Postavite MVP medicinsko sredstvo
vršeći pritisak prema napred na žicu za plasiranje i istovremeno pažljivo povlačeći
mikrokateter, odnosno kateter kako bi se MVP medicinsko sredstvo oslobodilo omotača.
15. Ako položaj medicinskog sredstva nije odgovarajući, preduzmite sledeće radnje:
a. Stabilizujte žicu za plasiranje i gurajte mikrokateter, odnosno kateter pomerajući ga
distalno, sve dok kateter ponovo ne uhvati MVP medicinsko sredstvo.
b. Promenite položaj i ponovo postavite medicinsko sredstvo ili ga uklonite iz pacijenta.
Napomena: Medicinsko sredstvo ne treba vraćati u omotač i postavljati više od 3 puta.
16. Da bi se postiglo pravilno odvajanje, MVP medicinsko sredstvo treba postaviti iza vrha
mikrokatetera, odnosno katetera.
17. Ako je položaj medicinskog sredstva zadovoljavajući, nastavite sa postupkom odvajanja
preduzimajući sledeće radnje:
a. Fluoroskopskim snimanjem potvrdite da se vrh mikrokatetera, odnosno katetera nalazi
proksimalno od MVP medicinskog sredstva.
b. Povežite zatezač sa žicom za plasiranje. Odvojite MVP medicinsko sredstvo rotirajući žicu
za plasiranje u smeru suprotnom od kazaljke na satu, sve dok se ne odvoji od medicinskog
sredstva.
c. Fluoroskopskim snimanjem potvrdite da je odvajanje bilo uspešno, povlačeći žicu za
plasiranje u proksimalnom smeru kako biste se uverili da se MVP medicinsko sredstvo ne
pomera. Ako se nekim slučajem MVP medicinsko sredstvo pomeri u proksimalnom
smeru, ponovo postavite sredstvo na odgovarajuće mesto i ponovite okretanje žice za
plasiranje u smeru suprotnom od kazaljke na satu kako bi se postiglo odvajanje.
18. Držeći mikrokateter, odnosno kateter na mestu, povlačite žicu za plasiranje unazad uvlačeći je
u mikrokateter, odnosno kateter, a zatim izvadite žicu za plasiranje iz pacijenta. Dovršite
proceduru pridržavajući se standardne tehnike.
11 Uputstva za postupanje nakon procedure
Ako su MedicAlert usluge dostupne u vašoj regiji, preporučite pacijentu da se učlani u MedicAlert
preko internet stranice www.medicalert.org. Od pacijenta će se tražiti da dostavi podatke o svom
zdravstvenom stanju, nazivu implantiranog medicinskog sredstva i ograničenjima za primenu
MR-a.
12 Informacije o magnetnoj rezonanci
12.1 Uslovno bezbedno za MR
1 Providno valjkasto kućište
2 Uvodnik žute boje
3 Žica za plasiranje (unutar uvodnika)
4 Zatezač
5 Cev za primenu
6 MVP medicinsko sredstvo
Utvrđeno je da je MVP mikrovaskularni zatvarač uslovno bezbedan za MR. Nekliničkim
ispitivanjima je utvrđeno da je MVP medicinsko sredstvo za mikrovaskularnu opstrukciju uslovno
bezbedno za MR. Pacijent sa ovim medicinskim sredstvom se odmah nakon ugradnje stenta može
bezbedno snimati pod sledećim uslovima:
• Statičko magnetno polje od 3 T ili manje
• Maksimalno magnetno polje prostornog gradijenta od 9000 gaus/cm ili manje
74
Page 75

• Maksimalna prosečna specifična apsorpcija (SAR) za celo telo od 4 W/kg za 15-minutno
snimanje (tj. po sekvenci impulsa)
• Režim rada MR sistema koji se kontroliše na prvom nivou
12.2 Zagrevanje povezano sa MR-om
U nekliničkim ispitivanjima je MVP medicinsko sredstvo za mikrovaskularnu opstrukciju dovodilo do
sledećeg rasta temperature za vreme snimanja MR-om u trajanju od 15 min (tj. po sekvenci
impulsa) sistemom sa magnetnim poljem od 3 Tesle (3 Tesla/128 MHz, Excite, HDx, Software
14X.M5, General Electric Healthcare, Milwaukee, WI): Najveća promena temperature +1,8°C
Samim tim, eksperimenti povezani sa zagrevanje usled dejstva MR-a za MVP medicinsko sredstvo
za mikrovaskularnu opstrukciju u magnetnom polju od 3 Tesle i uz primenu emisionog/prijemnog
kalema za telo sa prosečnom specifično apsorpcijom prijavljenom za dati MR sistem od 2,9 W/kg
(tj. povezano sa kalorimetrijski izmerenom prosečnom vrednošću za celo telo od 2,7 W/kg) su
pokazivali da je najveće zagrevanje koje se javljalo u datim specifičnim uslovima bilo jednako ili
manje od +1,8°C.
12.3 Informacije o artefaktu
Kvalitet slike magnetne rezonance može biti narušen ako se oblast interesovanja nalazi u istoj
oblasti ili relativno blizu položaja MVP medicinskog sredstva za mikrovaskularnu opstrukciju. Zbog
toga će možda biti potrebno da se parametri magnetne rezonance optimizuju za prisustvo ovog
uređaja. Najveća zabeležena veličina artefakta (tj. pri gradijentnoj eho-sekvenci impulsa) bila je
približno 5 mm, u zavisnosti od veličine i oblika MVP medicinskog sredstva za mikrovaskularnu
opstrukciju.
Sekvenca
impulsa
Veličina praznine
signala
Orijentacija ravni Paralelna Vertikalna Paralelna Vertikalna
T1-SE T1-SE GRE GRE
252 mm
2
91 mm
2
304 mm
2
116 mm
2
13 Skladištenje
Izbegavajte izlaganje MVP sistema vodi, sunčevoj svetlosti, ekstremnim temperaturama ili visokoj
vlažnosti za vreme čuvanja. MVP sistem čuvati na kontrolisanoj sobnoj temperaturi. Rok trajanja
medicinskog sredstva je naznačen na etiketi proizvoda. Medicinsko sredstvo nemojte koristiti
nakon isteka roka trajanja.
14 Materijali
Prilikom proizvodnje MVP sistema nisu korišćeni materijali koji sadrže lateks ili PVC.
15 Odricanje garancije
Upozorenja na oznakama proizvoda pružaju detaljnije informacije i smatraju se sastavnim
delom ovog odricanja garancije. Iako je „proizvod”, proizveden u u pažljivo kontrolisanim
uslovima, kompanija Medtronic nema kontrolu nad uslovima korišćenja ovog proizvoda.
Preduzeće Medtronic se zbog toga odriče svih garancija, navedenih i podrazumevanih, u
vezi sa proizvodom, uključujući, ali ne ograničavajući se na podrazumevanu garanciju o
mogućnosti prodaje ili primenljivosti za određenu svrhu. Preduzeće Medtronic neće
odgovarati bilo kojoj osobi ili entitetu za bilo kakve medicinske troškove ili bilo kakvu
direktnu, slučajnu ili posledičnu štetu izazvanu upotrebom, nedostatkom, greškom ili
neispravnim radom proizvoda, bez obzira na to da li je zahtev u vezi sa takvom štetom
zasnovan na garanciji, ugovoru, deliktu ili po drugom osnovu. Nijedna osoba nema
ovlašćenje da obaveže Medtronic na bilo koju tvrdnju ili garanciju u vezi sa proizvodom.
Svrha gorenavedenih isključenja i ograničenja nije da se suprotstave obaveznim odredbama
primenljivog zakona i ne smeju se tako tumačiti. Ako sud ili merodavna nadležnost utvrdi da je neki
deo ili odredba ovog odricanja garancije nezakonita, da se ne može sprovesti ili da je neusaglašena
sa primenljivim zakonom, to neće uticati na važenje ostalih delova odricanja garancije, a sva prava
i obaveze tumačiće se i sprovoditi kao da ovo odricanje garancije ne sadrži određeni deo ili odredbu
koja se smatra nevažećom.
Svenska
1 Beskrivning av enheten
Systemet för MVP mikrovaskulär plugg är en självexpanderande enhet för kärlocklusion.
MVP-enheten är äggformad, består av nitinol och fästs i båda ändar med markörband av platina.
Enheten är delvis belagd med PTFE. Det proximala markörbandet fästs vid en införingsledare som
trycker fram enheten genom en kommersiellt tillgänglig mikrokateter eller kateter till det avsedda
behandlingsstället. Införingsledaren lossas från MVP-enheten genom att införingsledaren roteras
moturs så att den skruvas loss från enheten.
MVP-systemet är förpackat som en enhet som innehåller MVP-enheten, en införingshylsa och en
löstagbar införingsledare. Systemet levereras sterilt, är pyrogenfritt och endast avsett för
engångsbruk.
Figur 1. MVP mikrovaskulär plugg
1 Partiell beläggning
2 Distal markör
3 MVP-enhet
Figur 2. MVP-systemets mått
1 Införingsledarens längd
2 Utfälld längd (enheten utanför katetern och
utan några begränsningar)
Tabell 1. MVP-mått Modell Diameter utan
MVP-3Q 5,3 mm 12 mm 180 cm 1,5 mm–3,0 mm
MVP-5Q 6,5 mm 12 mm 180 cm 3,0 mm–5,0 mm
MVP-7Q 9,2 mm 16 mm 165 cm 5,0 mm–7,0 mm
MVP-9Q 13,0 mm 18 mm 165 cm 7,0 mm–9,0 mm
Tabell 2. Rekommenderad mikrokateter eller kateter Modell Rekommenderad mikroka-
MVP-3Q 0,021 in (0,53 mm) till 0,027 in
MVP-5Q 0,027 in (0,69 mm) (ID) 153 cm
MVP-7Q 4 Fr (1,4 mm) (YD) 120 cm
MVP-9Q 5 Fr (1,7 mm) (YD) 120 cm
begränsningar
Längd utan
begränsningar
teter eller kateter
(0,69 mm) (ID)
4 Lösgöringszon
5 Införingsledare
6 Proximal markör
3 Diameter utan begränsningar
Införingsledarens längd
Rekommenderad mikrokateter eller kateter, maximal
längd
153 cm
Målkärlets diameter
2 Avsedd användning/indikationer för användning
Systemet för MVP mikrovaskulär plugg är indikerat för obstruktion eller minskning av blodflödet i det
perifera kärlsystemet.
3 Kontraindikationer
Det finns inga kända kontraindikationer för denna enhet.
4 Kompatibilitet
Enhetens mått finns på produktmärkningen till MVP-enheten. Se märkningen för andra
medicintekniska enheter för att avgöra om de är kompatibla.
5 Varningar
• Säkerheten och effektiviteten hos MVP-systemet har inte fastställts för användning i hjärtat
(t.ex. septumocklusion, öppetstående ductus arteriosus, förslutning av paravalvulärt läckage)
och för neurologisk användning.
75
Page 76

• MVP-systemet ska endast användas av läkare som är förtrogna med angiografiska och
interventionella ingrepp. Det är viktigt att läsa bruksanvisningen innan MVP-systemet används.
• Använd MVP-systemet före det utgångsdatum som står tryckt på förpackningsetiketten.
• MVP-systemet är pyrogenfritt och levereras sterilt såvida inte förpackningen till MVP-systemet
har öppnats eller skadats. Får inte användas om förpackningen är öppnad eller skadad.
• Inspektera MVP-systemet före användning och kassera det om det förekommer avvikelser eller
skada.
• MVP-systemet är endast avsett för engångsbruk. Får inte ombearbetas eller omsteriliseras.
Ombearbetning och omsterilisering kan öka riskerna för infektion hos patienten och försämra
enhetens funktion. Kassera MVP-systemet efter användning enligt sjukhusets och lokala
myndigheters föreskrifter.
• Använd fluoroskopisk vägledning när MVP-systemet förs fram eller manipuleras. För inte fram
eller dra tillbaka enheten om det känns stort motstånd förrän orsaken till motståndet har
fastställts.
• Införingsledaren får inte vridas eller roteras förutom när avsikten är att lösgöra enheten. I annat
fall kan enheten lösgöras i förtid.
• Använd inte tryckinjektionsspruta för att injicera kontrastmedel med enheten genom en
mikrokateter eller kateter.
• För inte fram införingsledaren efter att den lösgjorts från MVP-enheten.
• Läkare måste vara beredda på att hantera akuta situationer som kräver att enheten avlägsnas.
Detta inbegriper att säkerställa att en kirurg finns på plats.
• Får inte användas med katetrar som är kontraindicerade för embolienheter (t.ex. spiraler eller
en plugg).
6 Försiktighetsåtgärder
• MVP-enheten består av en nickel-titanlegering som generellt anses vara säker. In vitro-tester
har emellertid visat att nickel frigörs från den implanterade enheten i minst 60 dagar. Patienter
med nickelallergi kan få allergiska reaktioner mot enheten, särskilt patienter med tidigare
metallallergier. Vissa allergiska reaktioner kan vara allvarliga. Patienter ska instrueras att
meddela läkare omedelbart om de misstänker att de har en allergisk reaktion, t.ex. svårigheter
att andas eller inflammation i ansikte eller svalg. Vissa patienter kan utveckla allergi mot nickel
om enheten implanteras.
• Läkare ska göra en klinisk bedömning vid situationer som inbegriper användning av
antikoagulantia eller trombocytaggregationshämmande läkemedel före, under eller efter
användning av enheten.
• Var försiktig med följande särskilda populationer:
– För gravida patienter ska noggrannhet iakttas för att minimera moderns och fostrets
exponering för strålning.
– För ammande mödrar har ingen kvantitativ bedömning gjorts av förekomsten av
urlakningsbara ämnen i bröstmjölk efter att enheten implanterats.
• Kontrollera MVP-enhetens kompatibilitet vid användning av andra tillbehörsenheter vid
kärlingrepp. Läkare som använder MVP-systemet måste vara förtrogna med perkutana,
intravaskulära tekniker och möjliga komplikationer i samband med ingreppet.
• MVP-systemet ska hydreras före användning.
• Var noga vid hantering av MVP-systemet för att minska risken för oavsiktlig skada.
• Det finns en möjlighet att tryckkrafterna blir högre vid användning tillsammans med slitsade
mikrokatetrar eller katetrar av nitinolkomposit.
• Kontrollera att diametern hos alla tillbehörsenheter som används är kompatibel med
MVP-systemet före användning.
7 Möjliga komplikationer
Möjliga biverkningar som kan uppstå under eller efter ingreppet för placering av enheten inkluderar,
men är inte begränsade till, följande:
• luftemboli
• allergiska reaktioner eller toxiska effekter
• Blödning
• Dödsfall
• enheten flyttar sig
• feber
• embolihändelse från främmande material
• infektion
• ocklusion av icke avsett kärl
• perifer emboli
• rekanalisering
• residualflöde
• stroke eller transitorisk ischemisk attack (TIA)
• kirurgisk intervention
• komplikation vid kärlets ingångssnitt
• kärltrauma eller perforation
8 Material som krävs
1. Införing av MVP-systemet kräver användning av en mikrokateter eller kateter (se Tabell 2 för
rekommenderad storlek).
2. Följande tillbehör krävs:
• Hepariniserad koksaltlösning
• Roterande hemostasventil (RHV)
• Trevägskran
• Kuff för påse med koksaltlösning
• Åtkomsthylsa
• Styrkateter som är kompatibel med en mikrokateter eller en kateter som rekommenderas i
Tabell 2
• Ledare som är kompatibel med styrkatetern och mikrokatetern eller katetern
• Infusionsstativ
9 Förberedelser
1. För att uppnå optimala prestanda hos MVP-systemet och minska risken för tromboembolisk
komplikation ska kontinuerlig spolning ske mellan följande enheter:
• åtkomsthylsan och styrkatetern
• mikrokatetern eller katetern och styrkatetern
• mikrokatetern eller katetern, ledaren och MVP-systemet.
2. Placera den lämpliga styrkatetern enligt rekommenderat förfarande. Anslut en roterande
hemostasventil (RHV) till styrkateterns fattning. Fäst en trevägskran vid den roterande
hemostasventilens sidoarm. Anslut en slang för hepariniserad koksaltlösning för kontinuerlig
spolning.
3. Kontrollera alla kopplingar för att säkerställa att ingen luft tränger in i styrkatetern eller
mikrokatetern eller katetern under den kontinuerliga spolningen.
10 Anvisningar för användning
1. Skaffa åtkomst till målkärlet och gör en angiografi med sedvanlig teknik för att mäta kärlets
diameter vid det önskade stället för ocklusionen. Säkerställ att målkärlet motsvarar den
rekommenderade diametern (se Tabell 1).
2. Säkerställ att ocklusionsstället är tillräckligt långt för att rymma den implanterade
MVP-enheten utan att blockera icke avsedda kärl.
3. Välj en mikrokateter eller kateter (rekommenderad storlek finns i Tabell 2) och förbered den
enligt tillverkarens bruksanvisning.
4. För in ledaren och för fram mikrokatetern eller katetern över ledaren tills den distala spetsen är
nära ocklusionsställets framkant.
5. Ta bort ledaren från mikrokatetern eller katetern.
6. Ta ut MVP-systemet ur dispenseringsröret genom att försiktigt avlägsna den gula
införingshylsan från de två utvändiga klämmorna och dra ut MVP-systemet ur det
genomskinliga förvaringsröret. Fatta försiktigt införingshylsan på ett ställe proximalt om
MVP-enheten och ta långsamt ut MVP-enheten, införingsledaren och införingshylsan ur
dispenseringsröret samtidigt. Se Figur 3.
Figur 3. Förpackat MVP-system
1 Genomskinligt förvaringsrör
2 Gul införingshylsa
3 Införingsledare (inuti införingshylsan)
7. Inspektera MVP-systemet noga med avseende på skada. Om MVP-systemet är skadat ska
det bytas ut mot ett nytt MVP-system.
4 Vridenhet
5 Dispenseringsrör
6 MVP-enhet
76
Page 77

8. Spola MVP-systemet försiktigt genom att sänka ned några centimeter av införingshylsan och
MVP-enheten i hepariniserad koksaltlösning.
9. Dra in MVP-enheten i införingshylsan genom att dra införingsledaren tills MVP-enhetens
distala spets precis täcks av införingshylsan.
Observera: Om MVP-enheten dras för långt in i införingshylsan kanske den inte spolas
ordentligt. Två hål i införingshylsan, 3 cm och 6 cm proximalt om hylsans spets, underlättar vid
evakuering av luft och spolning av enheten.
10. För in MVP-systemet genom att föra in införingshylsans distala ände genom den roterande
hemostasventilen och in i fattningen på mikrokatetern eller katetern tills hylsan sitter säkert.
Dra åt den roterande hemostasventilen för att förhindra återflöde av blod, men inte så hårt att
MVP-systemet skadas när det förs in i mikrokatetern eller katetern.
11. Kontrollera visuellt att spollösningen infunderas normalt. Droppar av koksaltlösning ska
komma ut ur införingshylsans proximala ände.
12. Lossa den roterande hemostasventilen tillräckligt mycket för att MVP-enheten och
införingsledaren ska kunna föras fram tillsammans som ett system. Lossa inte den roterande
hemostasventilen så mycket att det medger återflöde av blod. Avlägsna införingshylsan
genom att dra den tillbaka över införingsledarens proximala ände.
13. För fram införingsledaren och MVP-enheten tills den distala platinamarkören på MVP-enheten
riktas in mot det distala markörbandet på mikrokatetern eller katetern.
14. Bekräfta att markörbanden är placerade optimalt. Placera ut MVP-enheten genom att
bibehålla trycket framåt på införingsledaren och samtidigt dra tillbaka mikrokatetern eller
katetern så att MVP-enheten kommer ut ur katetern.
15. Om enhetens position inte är tillfredsställande, gör så här:
a. Stabilisera införingsledaren och för fram mikrokatetern eller katetern genom att flytta den
distalt tills MVP-enheten återigen befinner sig i katetern.
b. Flytta och placera ut enheten igen, eller ta ut enheten från patienten.
Observera: Enheten ska inte föras in i katetern och placeras ut mer än högst tre gånger.
16. För att lossa MVP-enheten på korrekt sätt ska den positioneras bortom mikrokatetern eller
katetern.
17. Om enhetens position är tillfredsställande lossas den på följande sätt:
a. Bekräfta med fluoroskopi att mikrokateterns eller kateterns spets befinner sig proximalt
om MVP-enheten.
b. Fäst vridenheten vid införingsledaren. Lossa MVP-enheten genom att rotera
införingsledaren moturs tills den lossnar från enheten.
c. Kontrollera med fluoroskopi att den har lossnat genom att långsamt dra införingsledaren
proximalt för att säkerställa att MVP-enheten inte rör på sig. I det osannolika fall att
MVP-enheten rör sig i proximal riktning ska enheten placeras tillbaka på plats och
införingsledaren återigen roteras moturs för att lossa den.
18. Håll mikrokatetern eller katetern på plats och dra tillbaka införingsledaren in i mikrokatetern
och ta sedan bort införingsledaren från patienten. Slutför ingreppet med sedvanlig teknik.
11 Efter ingreppet
Rekommendera patienten att bli medlem i MedicAlert på www.medicalert.org om MedicAlert är
tillgängligt i ditt område. Patienten ombeds att ange sitt medicinska tillstånd, namnet på den
implanterade enheten och begränsningar avseende användning av MR.
12 MR-information
12.1 MR-villkorlig
MVP mikrovaskulär plugg har bedömts vara MR-villkorlig. Icke-kliniska tester har visat att MVP
mikrovaskulär plugg är MR-villkorlig. En patient med den här enheten kan skannas på ett säkert sätt
direkt efter placeringen under följande villkor:
• Statiskt magnetfält på 3 tesla eller mindre
• Maximalt spatialt gradientfält på högst 9 000 gauss/cm eller mindre
• En högsta, av MR-systemet rapporterad genomsnittlig helkropps-SAR (specific absorption
rate, specifik absorptionsnivå) på 4 W/kg under 15 minuters skanning (dvs. per pulssekvens)
• Första nivån kontrollerat driftsläge för MR-systemet
12.2 MR-relaterad uppvärmning
Vid icke-kliniska tester gav MVP mikrovaskulär plugg följande temperaturökning under
MR-undersökning under 15 min skanning (dvs. per pulssekvens) vid 3 tesla MR-system
(3 tesla/128 MHz, Excite, HDx, Software 14X.M5, General Electric Healthcare, Milwaukee, WI):
Högsta temperaturändring: +1,8°C
Experimenten avseende MR-relaterad uppvärmning av graftet med MVP mikrovaskulär plugg vid
3 tesla med användning av en sändar-/mottagar-RF-kroppsspole i ett MR-system med
genomsnittlig helkropps-SAR på 2,9 W/kg (dvs. associerat med ett genom kalometri uppmätt
genomsnittligt helkroppsvärde på 2,7 W/kg) visade att den största värmeökning som uppstod under
dessa specifika förhållanden motsvarade eller var lägre än +1,8°C.
12.3 Information om artefakter
Kvaliteten på MR-bilder kan försämras om området av intresse befinner sig inom exakt samma
område som eller relativt nära MVP mikrovaskulär plugg. Det kan därför vara nödvändigt att
optimera parametrarna för MR-bildåtergivning för att kompensera för närvaron av detta implantat.
De största artefakterna (dvs. som syns på gradientekopulssekvensen) sträcker sig ungefär 5 mm
utanför MVP mikrovaskulär plugg-enhetens storlek och form.
Pulssekvens
Signalbortfallsstorlek
Planriktning Parallell Vinkelrät Parallell Vinkelrät
T1-SE T1-SE GRE GRE
252 mm
2
91 mm
2
304 mm
2
116 mm
2
13 Förvaring
Undvik att exponera MVP-systemet för vatten, direkt solljus, extrema temperaturer och hög
luftfuktighet under lagring. Förvara MVP-systemet vid kontrollerad rumstemperatur. På
produktmärkningen anges enhetens utgångsdatum. Enheten får inte användas efter det
utgångsdatum som anges på märkningen.
14 Material
MVP-systemet är inte tillverkat av något latex- eller PVC-material.
15 Garantifriskrivning
Varningstexter på produktmärkningen innehåller mera detaljerade upplysningar och utgör
en integrerad del av denna friskrivning från ansvar. Oaktat att produkten har tillverkats
under noggrant kontrollerade förhållanden har Medtronic ingen kontroll över de
förhållanden under vilka produkten används. Medtronic frånsäger sig därför alla garantier,
såväl uttryckliga som underförstådda, med avseende på produkten, inklusive, men inte
begränsat till, eventuella underförstådda garantier om säljbarhet eller lämplighet för ett
visst syfte. Medtronic kan inte hållas ansvarigt gentemot någon fysisk eller juridisk person
för några medicinska kostnader eller några direkta skador, oförutsedda skador eller
följdskador som orsakats av någon form av användning av eller brist, fel eller funktionsfel
hos produkten, oavsett om ett krav gällande sådana skador grundar sig på garanti, avtal,
skadegörande handling eller annat. Ingen person har behörighet att binda Medtronic vid
någon utfästelse eller garanti som gäller produkten.
Ovan angivna undantag och begränsningar är inte avsedda att stå i strid med tvingande regler i
tillämplig lag, och de ska inte heller tolkas så. Skulle friskrivning från ansvar till någon del av behörig
domstol anses ogiltig, verkningslös eller stridande mot tillämplig lag, skall friskrivning från ansvar
gälla i övrigt, varvid alla rättigheter och skyldigheter skall bestå, som om avtalet inte innehöll den del
av garantin eller friskrivning från ansvar som underkänts.
Türkçe
1 Cihaz tanımı
MVP mikro vasküler tıpa sistemi, kendinden genişleyen bir damar tıkama cihazıdır. MVP cihazı oval
biçimdedir, nitinolden yapılmıştır ve her iki ucundan platin belirteç bantlarıyla sabitlenmiştir. Cihazın
PTFE’den kısmi bir mahfazası vardır. Proksimal belirteç bandı, cihazı piyasada bulunabilir bir
mikrokateter veya kateter içerisinden hedeflenen tedavi bölgesine iten bir taşıma teline takılır.
Taşıma teli, MVP cihazından sökülmesi için saat yönünün tersine çevrilmek suretiyle cihazdan
ayrılır.
MVP sistemi; MVP cihazını, bir introdüser kılıfı ve bir ayrılabilir taşıma telini içeren tek bir birim
halinde ambalajlanmıştır. Sistem steril olarak kullanıma sunulur, pirojenik değildir ve sadece tek
kullanıma yöneliktir.
77
Page 78

Şekil 1. MVP Mikro Vasküler Tıpa
1 Kısmi kapak
2 Distal belirteç
3 MVP cihazı
Şekil 2. MVP sistemi boyutları
1 Taşıma teli uzunluğu
2 Kısıtlanmamış uzunluk (cihaz kateter/mikrokateter içinde değilken ve üzerinde herhangi bir
kısıtlayıcı yokken)
3 Kısıtlanmamış çap
Tablo 1. MVPBoyutlar Model Kısıtlanmamış
MVP-3Q 5,3 mm 12 mm 180 cm 1,5 mm – 3,0 mm
MVP-5Q 6,5 mm 12 mm 180 cm 3,0 mm – 5,0 mm
MVP-7Q 9,2 mm 16 mm 165 cm 5,0 mm – 7,0 mm
MVP-9Q 13,0 mm 18 mm 165 cm 7,0 mm – 9,0 mm
Tablo 2. Önerilen mikrokateter veya kateter Model Önerilen Mikrokateter veya
MVP-3Q 0,53 mm (0,021 inç) ila
MVP-5Q 0,69 mm (0,027 inç) (İ.Ç.) 153 cm
MVP-7Q 4 Fr (1,4 mm) (D.Ç.) 120 cm
MVP-9Q 5 Fr (1,7 mm) (D.Ç.) 120 cm
Çap
Kısıtlanmamış
Uzunluk
Kateter
0,69 mm (0,027 inç) (İ.Ç.)
4 Ayırma bölgesi
5 Taşıma teli
6 Proksimal belirteç
Taşıma Teli
Uzunluğu
Önerilen Mikrokateter veya
Kateter Maksimum Uzunluğu
153 cm
Hedef Damar
Çapı
2 Kullanım amacı / Kullanım endikasyonları
MVP mikro vasküler tıpa sistemi, periferik vaskülatürde kan akışının engellenmesi veya hızının
azaltılmasında endikedir.
3 Kontrendikasyonlar
Bu cihaza yönelik bilinen herhangi bir kontrendikasyon yoktur.
4 Uyumluluk
Cihaz boyutları için MVP sistemi ürün etiket ve belgelerine bakın. Uyumluluğu belirlemek için diğer
tıbbi teknolojilerle sunulan belge ve etiketlere başvurun.
5 Uyarılar
• MVP sisteminin kardiyak kullanımlar (örn. kardiyak septal oklüzyon, patent duktus arteriozus,
paravalvüler sızıntı kapama) ve nörolojik kullanımlar için güvenliliği ve etkililiği belirlenmemiştir.
• MVP sistemi yalnızca anjiyografik ve girişimsel prosedürlere hakim olan hekimler tarafından
kullanılmalıdır. MVP sistemini kullanmadan önce kullanım talimatlarını okumanız önem taşır.
• MVP sistemini ürün ambalaj etiketinde basılı olan son kullanma tarihinden önce kullanın.
• MVP sistemi pirojenik değildir ve MVP sisteminin ambalajı açılmadığı veya hasar görmediği
sürece steril olarak sağlanır. Ambalaj bozulmuş veya hasar görmüşse kullanmayın.
• Kullanmadan önce MVP sistemini inceleyin ve herhangi bir bozukluk veya hasar
gözlemlerseniz sistemi atın.
• MVP sistemi, yalnızca tek kullanıma yöneliktir. Yeniden işlemeye tabi tutmayın veya yeniden
sterilize etmeyin. Yeniden işlemeye tabi tutulması ve yeniden sterilize edilmesi hastada
enfeksiyon riskini ve cihaz performansının zarar görmesi riskini arttırabilir. MVP sistemini
kullandıktan sonra, hastane ve yerel yönetim tarafından belirlenen politikaya uygun biçimde
bertaraf edin.
• MVP sistemini ilerletirken veya manipüle ederken floroskopi rehberliğinden yararlanın. Aşırı
dirençle karşılaşırsanız direncin nedeni belirleninceye kadar cihazı ilerletmeyin veya geri
çekmeyin.
• Cihazı ayırmayı amaçladığınız durumlar dışında taşıma telini bükmeyin veya döndürmeyin; aksi
takdirde cihaz vaktinden önce ayrılabilir.
• Mikrokateter veya kateter yoluyla cihazla kontrast çözeltisi enjekte etmek için otomatik
enjeksiyon şırıngası kullanmayın.
• Taşıma telini MVP cihazından ayırdıktan sonra teli ilerletmeyin.
• Hekimler, cihazın çıkarılmasını gerektiren acil durumların üstesinden gelmek için hazırlıklı
olmalıdır. Bu hazırlık, bir cerrahın yerinde hazır bulunmasını sağlamayı içermektedir.
• Embolik cihazlar (örneğin sarmallar veya tıpa) için kontrendike olan kateterlerle birlikte
kullanmayın.
6 Önlemler
• MVP cihazı genel olarak güvenli kabul edilen nikel titanyum alaşımından meydana gelir.
Bununla birlikte, in vitro testler, nikelin en az 60 gün boyunca implante edilmesinin ardından
cihazdan salındığını ortaya koymuştur. Özellikle metal alerjil öyküsü olan hastalar olmak üzere,
nikele alerjisi olan hastalar cihaza karşı alerjik reaksiyon gösterebilir. Belirli alerjik reaksiyonlar
ciddi olabilir; hastalara, nefes darlığı veya yüzde ya da boğazda enflamasyon gibi bir alerjik
reaksiyon yaşadıklarından şüphelenirlerse, durumu vakit kaybetmeden hekimlerine bildirmeleri
yönünde talimat verilmelidir. Bazı hastalar, cihaz implante edilirse nikele karşı alerji geliştirebilir.
• Hekimler, cihazın kullanımı öncesinde, sırasında veya sonrasında antikoagülan ya da
antitrombosit ilaçlar kullanılmasını içeren durumlarda klinik muhakemelerine başvurmalıdır.
• Aşağıdaki spesifik popülasyonlarda lütfen dikkatle hareket edin:
– Gebe hastalarda, annenin ve fetüsün radyasyona maruziyetini en aza indirmek için dikkatli
olunmalıdır.
– Emziren annelerde, cihaz implante edildikten sonra anne sütüne geçen maddelerin varlığına
ilişkin kantitatif bir değerlendirme yapılmamıştır.
• İntravasküler prosedürlerde başka yardımcı cihazlar kullanırken MVP sisteminin uyumluluğunu
doğrulayın. MVP sistemini kullanan hekimler, perkütan, intravasküler tekniklere ve prosedürle
ilişkili olası komplikasyonlara hakim olmalıdır.
• MVP sistemi, kullanılmadan önce hidrate edilmelidir.
• Yanlışlıkla hasar görmesi ihtimalini azaltmak için MVP sistemini tutarken dikkatli olun.
• Nitinol yan yüzeyli kompozit mikrokateterler veya kateterlerle birlikte kullanıldığında daha fazla
itme gücü uygulanması gerekebilir.
• Kullanılan herhangi bir aksesuar cihazının çapının MVP sistemiyle uyumlu olduğunu kullanım
öncesinde doğrulayın.
7 Olası advers olaylar
Bu cihazın yerleştirildiği bir prosedür sırasında veya sonrasında görülebilecek olası advers olaylar,
bunlarla sınırlı olmamak üzere aşağıdaki maddeleri içerir:
• Hava embolisi
• Alerjik reaksiyon veya toksik etkiler
• Kanama
• Ölüm
• Cihazın yer değiştirmesi
• Ateş
• Yabancı madde kaynaklı embolik olay
• Enfeksiyon
• Hedeflenmeyen damarda oklüzyon
• Periferik embolizm
• Rekanalizasyon
• Rezidüel akış
• İnme veya geçici iskemik atak (GİA)
• Cerrahi girişim
• Vasküler erişim bölgesi komplikasyonu
• Damar travması veya perforasyonu
78
Page 79
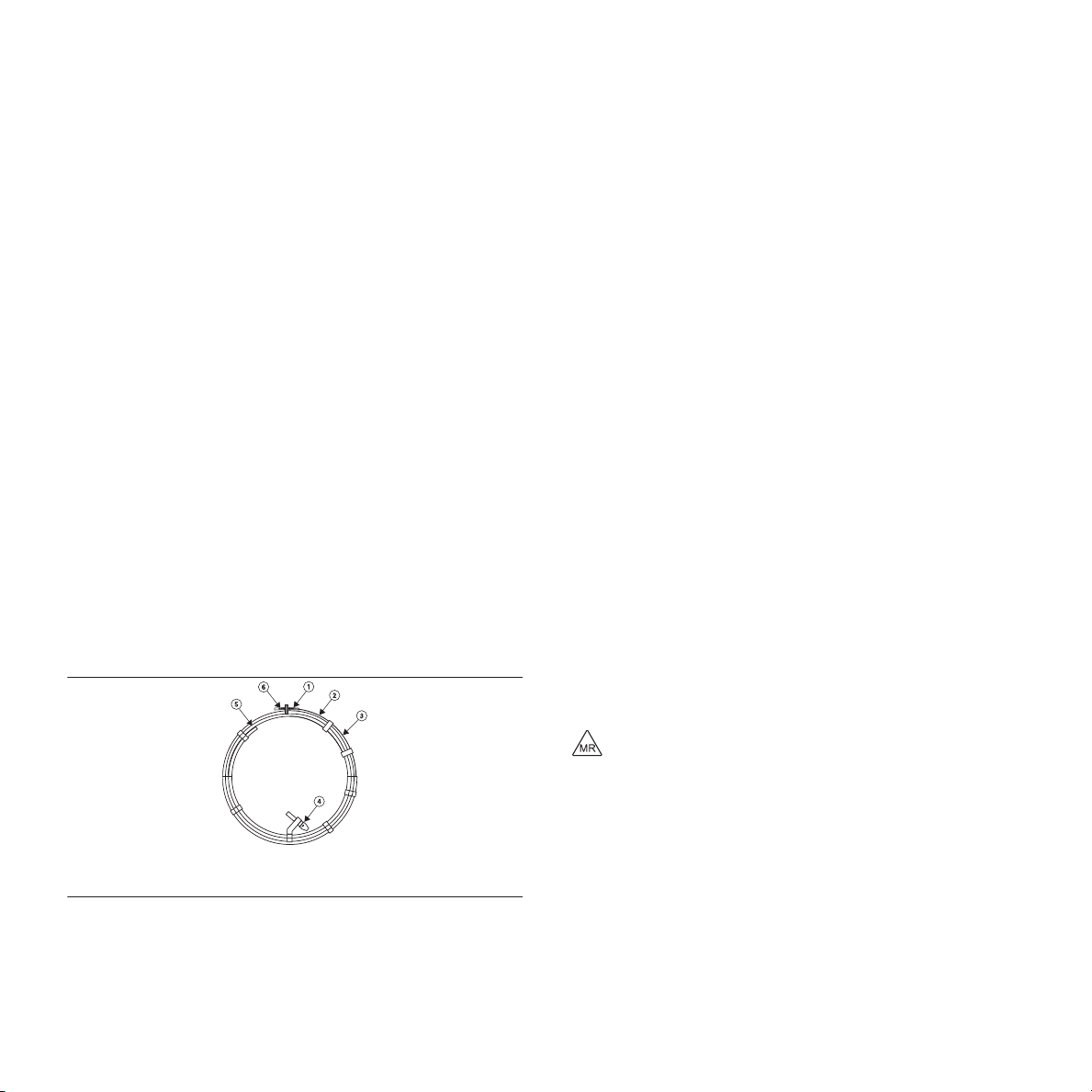
8 Gerekli malzemeler
1. MVP sisteminin taşınması, mikrokateter veya kateter kullanılmasını gerekli kılar (önerilen boyut
için bkz. Tablo 2).
2. Aşağıdaki aksesuarlar gereklidir:
• Heparinize salin çözeltisi
• Döner hemostatik valf (RHV)
• 3 yollu vana
• Salin torbası basınç manşeti
• Erişim kılıfı
• Tablo 2’de önerilen mikrokateter veya kateterle uyumlu kılavuz kateter
• Kılavuz kateter ve mikrokateter veya kateterle uyumlu kılavuz tel
• İntravenöz (İV) infüzyon standı
9 Hazırlık
1. MVP sisteminin olası en iyi biçimde performans göstermesini sağlamak ve tromboembolik
komplikasyon riskini azaltmak için aşağıdaki öğeler arasında sürekli olarak salinle yıkama
gerçekleştirin:
• erişim kılıfı ile kılavuz kateter
• mikrokateter veya kateter ile kılavuz kateter
• mikrokateter veya kateter, kılavuz tel ile MVP sistemi.
2. Önerilen prosedürü izleyerek uygun kılavuz kateteri yerleştirin. Kılavuz kateterin göbeğine
döner hemostatik valfi (RHV) takın. RHV’nin yan koluna 3 yollu vanayı takın. Sürekli yıkama
sağlamak için heparinize salin hattı bağlayın.
3. Sürekli yıkama sırasında kılavuz kateterin veya mikrokateter ya da kateterin içine hava
girmediğinden emin olmak için tüm bağlantıları kontrol edin.
10 Kullanım talimatları
1. Hedeflenen damara erişin ve istenen oklüzyon bölgesinde damar çapını ölçmek için standart
teknikten yararlanarak bir anjiyogram gerçekleştirin. Hedeflenen damarın önerilen çapı
karşıladığından emin olun (bkz. Tablo 1).
2. Oklüzyon bölgesinin, istenmeyen damarları tıkamadan implante MVP cihazını içine alacak
kadar uzun olduğundan emin olun.
3. Bir mikrokateter veya kateter (önerilen boyut için bkz. Tablo 2) seçin ve bunu imalatçının
kullanım talimatlarına uygun olarak hazırlayın.
4. Kılavuz teli sokun ve mikrokateteri veya kateteri, distal uç oklüzyon bölgesinin başlangıç
kenarının yakınında oluncaya dek kılavuz tel üzerinden ilerletin.
5. Kılavuz teli, mikrokateterden veya kateterden ayırın.
6. Sarı introdüser kılıfı iki dış klipsten nazikçe ayırarak ve MVP sistemini şeffaf muhafaza
borusundan çekip çıkararak MVP sistemini dağıtma borusundan ayırın. İntrodüser kılıfı
MVP cihazına proksimal olan bir yerinden nazikçe kavrayın ve MVP cihazını, taşıma telini ve
introdüser kılıfı dağıtma borusundan aynı anda yavaşça çıkarın. Bkz. Şekil 3.
Şekil 3. Ambalajlı MVP sistemi
MVP cihazı introdüser kılıf içine fazla çekilirse doğru biçimde yıkanmayabilir. İntrodüser
Not:
kılıfın ucuna 3 cm ve 6 cm proksimal konumda bulunan iki delik, havanın boşaltılmasını ve
cihazın yıkanmasını kolaylaştırır.
10. İntrodüser kılıfın distal ucunu RHV içinden geçirip mikrokateter veya kateterin göbeğine, kılıf
sağlam bir biçimde oturuncaya dek sokarak MVP sistemini yerleştirin. Kanın geri akışını
önlemeye yetecek, ancak mikrokateter veya kateter içine sokulduğu sırada MVP sistemine
zarar verecek kadar sıkı olmayacak biçimde RHV’yi sıkın.
11. Yıkama çözeltisinin normal olarak infüze olduğunu gözle doğrulayın. Salin damlacıklarının
introdüser kılıfın proksimal ucundan çıktığı görülmelidir.
12. MVP cihazının ve taşıma telinin birlikte bir sistem olarak ilerletilmesine yetecek kadar RHV’yi
gevşetin. RHV’yi, kanın geri akışına izin verecek kadar gevşetmeyin. İntrodüser kılıfı taşıma
telinin proksimal ucu üzerinden geri çekerek çıkarın.
13. Taşıma telini ve MVP cihazını, MVP cihazının distal platin belirteci, mikrokateter veya kateter
üzerindeki distal belirteç bandıyla hizalanıncaya dek ilerletin.
14. Belirteç bantlarının olası en iyi biçimde konumlandırıldığını doğrulayın. MVP cihazını kılıftan
ayırmak için mikrokateter veya kateteri yavaşça geri çekerken taşıma telini öne doğru bastırma
yoluyla sabit tutmayı sürdürerek MVP cihazını açın.
15. Cihazın konumu tatmin edici değilse aşağıdaki eylemleri yerine getirin:
a. Taşıma telini dengeli hale getirin ve MVP cihazı kateter içinde yeniden yakalanıncaya dek
mikrokateter veya kateteri distal olarak hareket ettirerek ilerletin.
b. Cihazı yeniden konumlandırın ve açın ya da cihazı hastadan çıkarın.
Not: Cihaz maksimum 3 kereden fazla yeniden kateter/mikrokateter içine sokulmamalı ve
açılmamalıdır.
16. Doğru biçimde ayrılması için, MVP cihazı mikrokateter veya kateter ucunun ilerisinde
konumlandırılmalıdır.
17. Cihaz konumu tatmin ediciyse aşağıdaki eylemleri yerine getirerek ayırma işlemiyle devam
edin:
a. Floroskopi altında, mikrokateter veya kateter ucunun MVP cihazına proksimal konumda
olduğunu doğrulayın.
b. Tork aletini taşıma teline takın. Taşıma telini cihazdan ayrılıncaya dek saat yönünün tersine
çevirerek MVP cihazını ayırın.
c. MVP cihazının hareket etmediğinden emin olmak için taşıma telini proksimal yönde
yavaşça çekerek ayırma işleminin başarılı olduğunu floroskopi yoluyla doğrulayın. Olası bir
durum olmamakla birlikte, MVP cihazının proksimal yönde hareket etmesi halinde, cihazın
yerleşimini yeniden tesis edin ve taşıma telini ayırma işlemi için tekrar saat yönünün tersine
çevirin.
18. Mikrokateter veya kateteri yerinde tutarken taşıma telini mikrokateter veya kateter içine geri
çekin ve daha sonra taşıma telini hastadan çıkarın. Prosedürü standart tekniği izleyerek
tamamlayın.
11 Prosedür sonrasıyla ilgili talimatlar
Bölgenizde MedicAlert hizmeti mevcutsa, hastaya www.medicalert.org adresi üzerinden
MedicAlert üyesi olmasını tavsiye edin. Hastadan tıbbi durumu, implante cihazın adı ve MRI
kullanımına ilişkin kısıtlamalarla ilgili olarak bilgi sağlaması istenecektir.
12 MRI bilgileri
12.1 MR Koşullu
1 Şeffaf muhafaza borusu
2 Sarı introdüser kılıf
3 Taşıma teli (introdüser kılıfın içinde)
7. MVP sisteminde hasar olup olmadığını iyice inceleyin. MVP sistemi hasar görmüşse bunu yeni
bir MVP sistemiyle değiştirin.
8. İntrodüser kılıfın ve MVP cihazının birkaç santimetresini heparinize salin içine hafifçe daldırarak
MVP sistemini yıkayın.
9. Taşıma telini yalnızca MVP cihazının distal ucu introdüser kılıfla kaplanıncaya dek çekmek
suretiyle MVP cihazını introdüser kılıf içine çekin.
4 Tork aleti
5 Dağıtma borusu
6 MVP cihazı
MVP mikro vasküler tıpanın MR koşullu olduğu belirlenmiştir. Klinik olmayan testler, MVP mikro
vasküler tıpa cihazının MR Koşullu olduğunu ortaya koymuştur. Bu cihazın bulunduğu bir hasta,
yerleştirmeden hemen sonra, aşağıdaki koşullar altında güvenle taranabilir:
• 3 Tesla veya daha altındaki statik manyetik alan
• 9000 Gauss/cm veya daha düşük maksimum uzamsal gradyan manyetik alan
• Bildirilen maksimum MR sistemi, 15 dakika taramada (yani, vuru dizilimi başına) 4 W/kg’lık tüm
vücut ortalama özgül emilim oranı (SAR)
• MR sistemi için Birinci Seviye Kontrollü Çalışma Modu
12.2 MRI ile bağlantılı ısınma
Klinik olmayan testlerde, MVP mikro vasküler tıpa cihazı, 3 Tesla MR sisteminde (3 Tesla/128 MHz,
Excite, HDx, Yazılım 14X.M5, General Electric Healthcare, Milwaukee, WI) 15 min tarama boyunca
gerçekleştirilen MRI sırasında şu sıcaklık artışını meydana getirmiştir: Sıcaklıktaki en yüksek
değişiklik +1,8°C
Dolayısıyla, MVP mikro vasküler tıpa cihazı için, MR sisteminde 3 Tesla’da iletim/alım RF vücut
sarmalı kullanılarak gerçekleştirilen MRI ile bağlantılı ısınma deneylerinde, 2,9 W/kg’lık tam gövde
ortalamalı SAR (başka bir deyişle, 2,7 W/kg’lık kalorimetri ölçümlü tam gövde ortalamalı değer ile
79
Page 80

bağlantılı) bildirilmesi, bu özgül koşullarla bağlantılı olarak meydana gelen en yüksek ısınma
miktarının +1,8°C’ye eşit ya da bunun altında olduğunu ortaya koymuştur.
12.3 Artefakt bilgileri
Görüntülenmek istenen bölge MVP mikro vasküler tıpa cihazının konumuyla tam olarak aynı alanda
veya göreceli olarak yakınındaysa, MR görüntü kalitesinde bozulma olabilir. Dolayısıyla, bu cihazın
varlığını telafi etmek için, MR görüntüleme parametrelerinin optimize edilmesi gerekli olabilir.
Maksimum artefakt boyutu (yani, gradyan eko vuru diziliminde görüldüğü üzere), MVP mikro
vasküler tıpa cihazının boyutu ve şekline kıyasla yaklaşık 5 mm uzanır.
Vuru Sırası T1-SE T1-SE GRE GRE
Sinyal Boşluğu
Büyüklüğü
Düzlemde Yönlendirme
2
252 mm
Paralel Dikey Paralel Dikey
91 mm
2
304 mm
2
116 mm
2
13 Saklama
Saklama sırasında MVP sistemini suya, gün ışığına, aşırı sıcaklıklara ve yüksek neme maruz
bırakmaktan kaçının. MVP sistemini kontrollü oda sıcaklığında saklayın. Ürün etiket ve
belgelerindeki cihaz son kullanma tarihine bakın. Cihazı etiket ve belgelerdeki son kullanma
tarihinden sonra kullanmayın.
14 Materyaller
MVP sistemi herhangi bir lateks veya PVC malzemeden yapılmamıştır.
15 Garantiden feragat beyannamesi
Ürün etiketindeki uyarılar daha ayrıntılı bilgiler içermektedir ve garanti feragat
beyannamesinin bir parçası sayılır. Ürün dikkatle kontrol edilen koşullarda üretilmiş
olmakla birlikte, Medtronic’in bu ürünün kullanıldığı koşullar üzerinde hiçbir denetimi
bulunmamaktadır. Medtronic, bu nedenden ötürü, ürünle ilgili olarak, satılabilirliğe ya da
özel bir amaca uygunluğa dair her türlü örtülü garanti de dahil olmak üzere, ancak bunlarla
sınırlı olmayacak şekilde, gerek açık, gerekse örtülü tüm garantilerden feragat eder.
Medtronic ürünün herhangi bir kullanımı, kusuru veya arızasından ileri gelen her türlü tıbbi
masraftan, doğrudan, kaza eseri veya dolaylı hasardan ötürü, hiçbir şahsa veya kuruma
karşı, söz konusu hasarlara ilişkin talebin garantiye, sözleşmeye, haksız fiile veya başka
herhangi bir nedene dayalı olup olmamasına bakılmaksızın yükümlü olmaz. Hiçbir şahsın,
Medtronic’i, ürünle ilgili herhangi bir ifadeye veya garantiye dayalı olarak bağlama yetkisi
yoktur.
Yukarıda belirtilen istisnalar ve sınırlamalar, yürürlükteki kanunun uyulması zorunlu hükümlerini ihlal
etme niyetiyle oluşturulmamıştır ve bu anlamda yorumlanmamalıdır. Bu garantiden feragat
beyannamesinin herhangi bir bölümünün veya şartının, salahiyet yetkisi bulunan bir mahkeme
tarafından yasalara aykırı, uygulanamaz ya da yürürlükteki kanunlara ters olduğuna hükmedilirse,
garantiden feragat beyannamesinin geri kalan kısımlarının geçerliliği bundan etkilenmez; tüm haklar
ve yükümlülükler, bu garantiden feragat beyannamesi geçersiz bulunan söz konusu bölümü ya da
şartı içermiyormuş gibi yorumlanır ve uygulanır.
Українська мова
1 Опис пристрою
Система мікроваскулярного оклюдера MVP – це саморозкривний пристрій для оклюзії
судини. Пристрій MVP має форму овоїда, виготовлений із нітинолу й оснащений з обох кінців
платиновими маркерними смужками. Пристрій має часткове покриття
політетрафторетиленом (ПТФЕ). Проксимальна маркерна смужка приєднана до дротового
провідника, який проштовхує пристрій крізь доступний у продажу мікрокатетер або катетер
до планового місця процедури. Дротовий провідник від’єднується від пристрою MVP
повертанням проти годинникової стрілки: таким чином провідник відгвинчується від
пристрою.
Систему MVP упаковано як єдиний модуль, що містить пристрій MVP, оболонку інтрод’юсера
та від’єднуваний дротовий провідник. Система постачається в стерильному апірогенному
вигляді й призначена тільки для одноразового застосування.
Малюнок 1. Мікроваскулярний оклюдер MVP
1 Часткове покриття
2 Дистальний маркер
3 Пристрій MVP
Малюнок 2. Розміри системи MVP
1 Довжина дротового провідника
2 Довжина без обмежувачів (пристрій без оболонки та будь-яких обмежувачів)
3 Діаметр без обмежувачів
Таблиця 1. Розміри MVP Модель Діаметр без
MVP-3Q 5,3 mm 12 mm 180 cm 1,5 mm – 3,0 mm
MVP-5Q 6,5 mm 12 mm 180 cm 3,0 mm – 5,0 mm
MVP-7Q 9,2 mm 16 mm 165 cm 5,0 mm – 7,0 mm
MVP-9Q 13,0 mm 18 mm 165 cm 7,0 mm – 9,0 mm
Таблиця 2. Рекомендований мікрокатетер або катетер Модель Рекомендований мікрока-
MVP-3Q Від 0,021 in (0,53 mm) до
MVP-5Q 0,027 in (0,69 mm) (ВД) 153 cm
MVP-7Q 4 Fr (1,4 mm) (ЗД) 120 cm
MVP-9Q 5 Fr (1,7 mm) (ЗД) 120 cm
обмежувачів
Довжина без
обмежувачів
тетер або катетер
0,027 in (0,69 mm) (ВД)
4 Зона відділення
5 Дротовий провідник
6 Проксимальний маркер
Довжина дротового провідника
Макс. довжина рекомендованого мікрокатетера
або катетера
153 cm
Діаметр цільової судини
2 Призначення/показання до застосування
Система мікроваскулярного оклюдера MVP призначена для обструкції або зниження
швидкості кровоплину в периферичній судинній системі.
3 Протипоказання
Цей пристрій не має відомих протипоказань.
4 Сумісність
Розміри пристрою див. на маркуванні системи MVP. Для визначення сумісності див.
маркування, надане на інших медичних виробах.
5 Попередження
• Безпечність і ефективність системи MVP для кардіологічного (наприклад, оклюзія
серцевої перегородки, незарощення артеріальної протоки, зупинка паравальвулярних
витоків) і неврологічного застосування не досліджено.
• Систему MVP дозволяється застосовувати тільки лікарям, знайомим із процедурами
ангіографії та черезшкірними хірургічними процедурами. Перед використанням системи
MVP обов’язково прочитайте інструкцію з експлуатації.
80
Page 81

• Забороняється використовувати систему MVP після завершення зазначеного на
упаковці терміну придатності.
• Система MVP апірогенна й постачається стерильною, якщо упаковка системи MVP не
розкрита й не пошкоджена. Забороняється користуватися системою, якщо упаковка
розкрита або пошкоджена.
• Перед використанням огляньте систему MVP; якщо виявлено будь-які дефекти або
пошкодження, утилізуйте її.
• Система MVP призначена тільки для одноразового використання. Заборонено
обробляти або стерилізувати повторно. Повторна обробка або стерилізація можуть
підвищити ризик інфікування пацієнта та порушення роботи пристрою. Після
застосування систему MVP слід утилізувати відповідно до інструкцій, що діють у
лікувальному закладі, а також місцевих правил.
• Просувати систему MVP та здійснювати будь-які маніпуляції з нею слід під
рентгеноскопічним контролем. Забороняється вводити або витягувати пристрій за
наявності опору, доки не виявлено його причину.
• Доки немає необхідності від’єднати пристрій, не перекручуйте й не обертайте дротовий
провідник, щоб пристрій не від’єднався передчасно.
• Забороняється через мікрокатетер або катетер разом із пристроєм здійснювати ін’єкції
рентгеноконтрастного розчину шприцами високого тиску.
• Не просувайте вперед дротовий провідник після його від’єднання від пристрою MVP.
• Лікарі повинні бути готові до дій у разі виникнення надзвичайних ситуацій, що вимагають
вилучення пристрою. Зокрема, необхідна наявність чергового хірурга.
• Забороняється використовувати пристрій із катетерами, несумісними з емболічними
пристроями (наприклад, спіралями або оклюдером).
6 Запобіжні заходи
• Пристрій MVP виготовлений із нікель-титанового сплаву, який загалом вважається
безпечним. Однак випробування in vitro показали, що пристрій виділяє нікель після
імплантації як мінімум протягом 60 днів. У пацієнтів з алергією на нікель (особливо з
алергією на метали в анамнезі) може розвинутися алергічна реакція на пристрій. Певні
алергічні реакції можуть бути дуже важкі; слід пояснити пацієнту, що в разі появи
алергічних реакцій (як-от утрудненого дихання, запалення лиця або шиї) необхідно
негайно зв’язатися зі своїм лікарем. У деяких пацієнтів алергія на нікель може
розвинутися після імплантування пристрою.
• Якщо до, під час або після використання пристрою проводиться антитромбоцитарна або
антикоагулянтна терапія пацієнта, лікар повинен приймати рішення, покладаючись на
власний досвід і знання.
• Особливі запобіжні заходи для окремих груп пацієнтів.
– Для вагітних пацієнток: слід мінімізувати вплив радіації на плід і організм матері.
– Для матерів, які годують грудьми: кількісне визначення вилуговуваних у грудне
молоко речовин після імплантації пристрою не проводилося.
• За використання інших допоміжних пристроїв під час внутрішньосудинних маніпуляцій
перевіряйте їх сумісність із системою MVP. Лікарям, які використовують систему MVP,
слід знати методи черезшкірних внутрішньосудинних втручань і ускладнення, які
можуть супроводжувати цю процедуру.
• Перед використанням систему MVP слід зволожити.
• Під час роботи із системою MVP проявляйте обережність, щоб знизити ризик її
випадкового пошкодження.
• За використання з мікрокатетерами або катетерами з прорізами, виготовленими з
нітинолового сплаву, можливі більші сили проштовхування.
• Перед використанням будь-якого приладдя перевіряйте його діаметр на сумісність із
системою MVP.
7 Можливі небажані явища
До можливих небажаних явищ, які можуть виникати під час або після процедури розміщення
цього пристрою, належать (зокрема, але не виключно):
• Повітряна емболія
• Алергічна реакція або токсичні ефекти
• Кровотеча
• Смерть
• Зміщення пристрою
• Жар
• Явище емболії чужорідним матеріалом
• Інфекція
• Оклюзія невідповідної судини
• Емболія периферичних судин
• Реканалізація
• Залишковий кровоплин
• Інсульт або транзиторна ішемічна атака (ТІА)
• Хірургічне втручання
• Ускладнення в місці судинного доступу
• Травма або перфорація судини
8 Необхідні матеріали
1. Для доставки системи MVP потрібно використовувати мікрокатетер або катетер
(рекомендований розмір див. в Табл. 2).
2. Потрібне таке приладдя:
• Гепаринізований фізіологічний розчин
• Обертовий гемостатичний клапан (ОГК)
• 3-ходовий запірний кран
• Манжета для пакета з фізіологічним розчином
• Інтрод’юсер для створення доступу
• Провідниковий катетер, сумісний із мікрокатетером або катетером,
рекомендованим у Табл. 2
• Провідник, сумісний із провідниковим катетером і мікрокатетером або катетером
• Стійка для внутрішньовенної (в/в) інфузії
9 Підготовка
1. Для забезпечення оптимальної роботи системи MVP та зниження ризику
тромбоемболічних ускладнень підтримуйте постійний потік фізіологічного розчину між
такими елементами:
• інтрод’юсер для створення доступу й провідниковий катетер;
• мікрокатетер або катетер і провідниковий катетер;
• мікрокатетер або катетер, провідниковий катетер і система MVP.
2. Розмістіть відповідний провідниковий катетер, дотримуючись рекомендованої
процедури. Під’єднайте обертовий гемостатичний клапан (ОГК) до гнізда
провідникового катетера. Під’єднайте 3-ходовий запірний кран до бічного порту ОГК.
Під’єднайте лінію подачі гепаринізованого фізіологічного розчину для забезпечення
безперервного промивання.
3. Перевірте всі роз’єми, щоб переконатися, що під час безперервного промивання
повітря не надходить у провідниковий катетер, мікрокатетер або катетер.
10 Вказівки щодо застосування
1. Створіть доступ до цільової судини й виконайте ангіографію стандартним методом, щоб
виміряти діаметр судини в потрібному місці оклюзії. Переконайтеся, що цільова судина
відповідає рекомендованому діаметру (див. Табл. 1).
2. Переконайтеся, що місце оклюзії має довжину, достатню для вміщення імплантованого
пристрою MVP без обструкції нецільових судин.
3. Виберіть мікрокатетер або катетер (рекомендований розмір див. в Табл. 2) і підготуйте
його відповідно до інструкції з експлуатації від виробника.
4. Введіть провідник і просуньте мікрокатетер або катетер по провіднику так, щоб його
дистальний кінчик опинився біля переднього краю місця оклюзії.
5. Вийміть провідник із мікрокатетера або катетера.
6. Вийміть систему MVP з трубки диспенсера: акуратно зніміть жовту оболонку
інтрод’юсера з двох зовнішніх затискачів і витягніть систему MVP з прозорої захисної
трубки. Обережно візьміться за оболонку інтрод’юсера в проксимальній до пристрою
MVP точці та повільно й одночасно вийміть пристрій MVP, дротовий провідник і
оболонку інтрод’юсера з трубки диспенсера. Див. Мал. 3.
Малюнок 3. Упакована система MVP
81
Page 82

1 Прозора захисна трубка
2 Жовта оболонка інтрод’юсера
3 Дротовий провідник (в оболонці
інтрод’юсера)
4 Пристрій для обертання
5 Трубка диспенсера
6 Пристрій MVP
7. Уважно огляньте систему MVP на наявність пошкоджень. Якщо система MVP
пошкоджена, замініть її на нову систему MVP.
8. Промийте систему MVP, акуратно зануривши кілька сантиметрів оболонки
інтрод’юсера та пристрій MVP у гепаринізований фізіологічний розчин.
9. Втягніть пристрій MVP в оболонку інтрод’юсера, потягнувши дротовий провідник так,
щоб дистальний кінчик пристрою MVP закрила оболонка інтрод’юсера.
Примітка: Якщо втягнути пристрій MVP в оболонку інтрод’юсера занадто далеко, це
може ускладнити його належне промивання. Два отвори в оболонці інтрод’юсера,
розташовані на відстані 3 cm і 6 cm проксимально відносно кінчика інтрод’юсера,
полегшують видалення повітря й промивання пристрою.
10. Введіть систему MVP, вставивши дистальний кінчик оболонки інтрод’юсера через ОГК
в гніздо мікрокатетера або катетера так, щоб оболонка сіла щільно. Затягніть ОГК
досить щільно, щоб не допустити зворотного потоку крові, але не настільки, щоб
пошкодити систему MVP під час її введення в мікрокатетер або катетер.
11. Візуально переконайтеся, що розчин для промивання вливається нормально. З
проксимального кінця оболонки інтрод’юсера мають виходити краплі фізіологічного
розчину.
12. Ослабте ОГК достатньо, щоб просувати пристрій MVP і дротовий провідник разом як
єдину систему. Не ослаблюйте ОГК настільки, щоб пропускати зворотний потік крові.
Зніміть оболонку інтрод’юсера, стягнувши її через проксимальний кінець дротового
провідника.
13. Просувайте дротовий провідник і пристрій MVP, доки дистальний платиновий маркер
пристрою MVP суміститься з дистальною маркерною смужкою на мікрокатетері або
катетері.
14. Переконайтеся, що маркерні смужки розміщені оптимально. Розгорніть пристрій MVP,
здійснюючи спрямований уперед тиск на дротовий провідник і повільно відводячи
мікрокатетер або катетер, щоб вивільнити пристрій MVP з оболонки.
15. Якщо пристрій зайняв незадовільне положення, виконайте описані нижче дії.
a. Стабілізуйте положення дротового провідника й просуньте мікрокатетер або
катетер дистально так, щоб втягнути пристрій MVP назад у катетер.
b. Повторно розташуйте пристрій і розгорніть його або ж витягніть пристрій із тіла
пацієнта.
Примітка: Втягування в оболонку й розгортання пристрою допускається
виконувати не більше 3 разів.
16. Для правильного від’єднання пристрій MVP слід розміщувати за межами кінчика
мікрокатетера або катетера.
17. Якщо пристрій зайняв задовільне положення, виконайте описані нижче кроки для його
від’єднання.
a. Під рентгеноскопічним контролем переконайтеся, що кінчик мікрокатетера або
катетера розташований проксимально відносно пристрою MVP.
b. Приєднайте пристрій для обертання до дротового провідника. Від’єднайте пристрій
MVP, обертаючи дротовий провідник проти годинникової стрілки до його відділення
від пристрою.
c. Під рентгеноскопічним контролем перевірте успішність відділення: повільно
потягніть дротовий провідник у проксимальному напрямку, щоб переконатися, що
пристрій MVP не зміщується. У тому малоймовірному випадку, якщо пристрій MVP
зміщується в проксимальному напрямку, знову розмістіть пристрій у потрібному
місці й повторіть обертання дротового провідника проти годинникової стрілки для
його від’єднання від пристрою.
18. Утримуючи мікрокатетер або катетер на місці, відведіть дротовий провідник у
мікрокатетер або катетер, а потім витягніть дротовий провідник із тіла пацієнта.
Завершіть процедуру відповідно до стандартного методу.
11 Інструкції після процедури
Якщо у вашому регіоні доступна служба MedicAlert, порекомендуйте пацієнтові
зареєструватися в ній на веб-сайті www.medicalert.org. Пацієнта попросять указати своє
захворювання, найменування імплантованого пристрою та обмеження щодо застосування
МРТ.
12 Інформація про МРТ
12.1 МРТ виконувати з дотриманням обмежень
Установлено, що з мікроваскулярним оклюдером MVP можна виконувати МРТ з
дотриманням певних умов. Неклінічне випробування показало, що з мікроваскулярним
оклюдером MVP можна виконувати МРТ з дотриманням певних умов. Пацієнт із таким
пристроєм може безпечно піддаватися скануванню відразу після імплантації за таких умов:
• статичне магнітне поле з індукцією 3 Тл або менше;
• максимальний просторовий градієнт магнітного поля щонайбільше 9000 ґаус/см;
• максимальне зареєстроване для системи МРТ середнє для всього тіла значення
питомої швидкості поглинання випромінювання (SAR) 4 W/kg при скануванні протягом
15 хвилин (тобто на одну послідовність імпульсів);
• керований режим роботи першого рівня для системи МРТ.
12.2 Нагрівання, обумовлене МРТ
Неклінічне випробування показало, що під час МРТ, проведеного протягом 15 min (тобто
однієї послідовності імпульсів) у МРТ-системі при 3 Tл (3 Tл/128 MHz, Excite, HDx, програмне
забезпечення 14X.M5, General Electric Healthcare, Мілуокі, Вісконсин) спостерігалося таке
підвищення температури мікроваскулярного оклюдера MVP: максимальна зміна
температури на +1,8°C
Таким чином, експерименти з нагріву мікроваскулярного оклюдера MVP в умовах МРТ з
магнітною індукцією 3 Тл із застосуванням приймально-передавальної РЧ-котушки для тіла
показали зареєстроване в системі МРТ середнє для всього тіла значення питомої швидкості
поглинання випромінювання 2,9 W/kg (що відповідає калориметрично виміряній середній
для всього тіла питомій швидкості поглинання випромінювання 2,7 W/kg). Це означає, що в
цих специфічних умовах максимальне нагрівання не перевищувало +1,8°C.
12.3 Інформація щодо артефактів зображень
Якість МР-зображень може знижуватися, якщо область дослідження точно збігається з
місцеположенням мікроваскулярного оклюдера MVP або відносно близька до нього. Отже,
для компенсації наявності пристрою може знадобитись оптимізація параметрів отримання
МРТ-зображення. Максимальний розмір артефакту (тобто при послідовності імпульсів
градієнтного відлуння) відповідає розміру й формі мікроваскулярного оклюдера MVP з
різницею приблизно 5 mm.
Послідовність
імпульсів T1-SE T1-SE GRE GRE
Довжина пропуску між сигналами
Орієнтація площини
2
252 mm
Паралельна Перпендику-
91 mm
лярна
2
2
304 mm
Паралельна Перпендику-
116 mm
лярна
2
13 Зберігання
Під час зберігання системи MVP оберігайте її від впливу води, сонячного світла,
екстремальних температур і високої вологості. Зберігайте систему MVP при контрольованій
кімнатній температурі. Дату закінчення терміну придатності див. на етикетці пристрою. Не
використовуйте пристрій після завершення зазначеного на етикетці терміну придатності.
14 Матеріали
Система MVP не містить латексу й ПВХ.
15 Заява про відмову від гарантій і обмеження відповідальності
Попередження на етикетках і маркуванні виробу надають докладнішу інформацію та
являють собою невід’ємну частину цієї заяви про відмову від гарантій і обмеження
відповідальності. Незважаючи на те, що виріб виготовлений у контрольованих
умовах, компанія Medtronic не має можливості контролювати умови використання
виробу. Відповідно, компанія Medtronic відмовляється від будь-яких гарантій,
прямих і непрямих, щодо виробу, зокрема, але не виключно, непрямих гарантій
комерційної придатності або придатності для певного способу застосування.
Компанія Medtronic не несе будь-якої відповідальності перед будь-якою особою або
організацією за будь-які витрати на медичне обслуговування чи за будь-які прямі,
непрямі або опосередковані витрати, спричинені будь-яким застосуванням,
дефектом, несправністю або некоректним спрацюванням виробу, незалежно від
того, чи ґрунтується позов щодо відшкодування цих витрат або збитків на
гарантійних зобов’язаннях, контрактних зобов’язаннях, порушеннях правил або
82
Page 83

інших приводах. Жодна особа не має права зобов’язати компанію Medtronic до
будь-яких заяв або гарантій стосовно цього виробу.
Викладені вище виключення та обмеження встановлено без наміру суперечити
обов’язковим положенням застосовних норм законодавства та не мають тлумачитися в
такому розумінні. Якщо суд відповідної юрисдикції визнає будь-яке положення цієї Заяви
про відмову від гарантій і обмеження відповідальності незаконним, юридично
нездійсненним або суперечним застосовному законодавству, це не впливатиме на
юридичну силу інших частин цієї Заяви, а всі права та обов’язки тлумачитимуться й
реалізовуватимуться так, як коли б ця Заява не містила положення, визнаного нечинним.
Tiếng Việt
1 Mô tả thiết bị
Hệ thống nút bịt mạch máu siêu nhỏ MVP là một thiết bị bít mạch máu tự mở rộng. Thiết bị MVP có
dạng hình trứng, làm bằng hợp kim loại nitinol và hai đầu được cố định bằng đai chốt bạch kim. Thiết
bị có một phần vỏ được làm bằng PTFE. Đai chốt điểm gần gốc gắn với một dây phân phối có nhiệm
vụ đẩy thiết bị qua một ống thông siêu nhỏ hoặc ống thông tiêu chuẩn có bán sẵn trên thị trường đến
vị trí điều trị dự kiến. Tháo dây phân phối khỏi thiết bị MVP bằng cách xoay dây phân phối ngược
chiều kim đồng hồ để vặn và tháo dây phân phối khỏi thiết bị.
Hệ thống MVP được đóng gói thành một cụm thiết bị, gồm có thiết bị MVP, một ống dẫn và một dây
phân phối có thể tháo rời. Hệ thống được cung cấp đã khử trùng sẵn, không chứa pyrogen và chỉ
được thiết kế để sử dụng một lần.
Hình 1. Nút bịt mạch máu siêu nhỏ MVP
1 Một phần vỏ
2 Điểm ngoại biên
3 Thiết bị MVP
Hình 2. Kích thước hệ thống MVP
1 Chiều dài dây phân phối
2 Chiều dài không giới hạn (thiết bị không có ống dẫn và trên thiết bị không có bất kỳ chốt giới
hạn nào)
3 Đường kính không giới hạn
Bảng 1. Kích thước MVP Kiểu máy Đường kính
MVP-3Q 5,3 mm 12 mm 180 cm 1,5 mm – 3,0 mm
MVP-5Q 6,5 mm 12 mm 180 cm 3,0 mm – 5,0 mm
MVP-7Q 9,2 mm 16 mm 165 cm 5,0 mm – 7,0 mm
MVP-9Q 13,0 mm 18 mm 165 cm 7,0 mm – 9,0 mm
không giới hạn
Chiều dài không
giới hạn
4 Vùng tháo rời
5 Dây phân phối
6 Đai chốt đầu gần
Chiều dài dây
phân phối
Đường kính
mạch đích
Bảng 2. Ống thông siêu nhỏ hoặc ống thông tiêu chuẩn khuyến cáo sử dụng Kiểu máy Ống thông siêu nhỏ hoặc
MVP-3Q 0,021 in (0,53 mm) đến 0,027 in
MVP-5Q 0,027 in (0,69 mm) (ID) 153 cm
MVP-7Q 4 Fr (1,4 mm) (OD) 120 cm
MVP-9Q 5 Fr (1,7 mm) (OD) 120 cm
ống thông tiêu chuẩn
khuyến cáo sử dụng
(0,69 mm) (ID)
Chiều dài tối đa của ống
thông siêu nhỏ hoặc ống
thông tiêu chuẩn khuyến
cáo sử dụng
153 cm
2 Mục đích sử dụng / hướng dẫn sử dụng
Hệ thống nút bịt mạch máu siêu nhỏ MVP được dùng để chặn hoặc giảm lưu lượng máu trong mạch
máu ngoại biên.
3 Chống chỉ định
Hiện chưa có chống chỉ định đã biết nào đối với thiết bị này.
4 Tương thích
Tham khảo nhãn sản phẩm của hệ thống MVP để biết kích thước thiết bị. Tham khảo nhãn đi kèm
với các thiết bị công nghệ y học khác để xác định khả năng tương thích.
5 Cảnh báo
• Độ an toàn và hiệu quả của hệ thống MVP chưa được xác lập cho các mục đích sử dụng liên
quan đến tim (ví dụ: bịt vách tim, bịt dị tật ống động mạch còn mở và bịt chỗ hở cận van hai lá)
và mục đích sử dụng liên quan đến thần kinh.
• Chỉ những bác sĩ đã quen với các thủ thuật chụp động mạch và thủ thuật can thiệp mới được
sử dụng hệ thống MVP. Cần đọc hướng dẫn sử dụng trước khi sử dụng hệ thống MVP.
• Sử dụng hệ thống MVP trước hạn sử dụng in trên nhãn bao bì sản phẩm.
• Hệ thống MVP không chứa pyrogen và được cung cấp đã khử trùng sẵn trừ khi bao bì của hệ
thống MVP đã được mở hoặc bị hư hỏng. Không được sử dụng nếu bao bì đã bị chọc thủng
hoặc hư hỏng.
• Kiểm tra hệ thống MVP trước khi sử dụng và thải bỏ nếu thấy có bất kỳ bất thường hoặc hư hỏng
nào.
• Hệ thống MVP chỉ được thiết kế để sử dụng một lần. Không được tái chế hoặc khử trùng lại. Tái
chế và khử trùng lại có thể làm tăng nguy cơ bệnh nhân bị nhiễm trùng và ảnh hưởng đến hiệu
năng của thiết bị. Sau khi sử dụng hệ thống MVP, hãy thải bỏ thiết bị theo chính sách của bệnh
viện và chính quyền sở tại.
• Làm theo hướng dẫn về phóng xạ tuyến khi đẩy hoặc thao tác hệ thống MVP. Không được đẩy
hoặc rút thiết bị khi gặp phải lực cản quá mức cho đến khi đã xác định được nguyên nhân gây
ra lực cản.
• Không được vặn hoặc xoay dây phân phối trừ khi có ý định tháo thiết bị nếu không thiết bị có
thể bị tháo ra sớm.
• Không được sử dụng ống tiêm cao áp để bơm dung dịch cản quang cùng thiết bị qua một ống
thông siêu nhỏ hoặc ống thông tiêu chuẩn.
• Không được đẩy dây phân phối sau khi tháo ra khỏi thiết bị MVP.
• Bác sĩ phải chuẩn bị ứng phó với các tình huống khẩn cấp yêu cầu phải tháo thiết bị ra. Công
tác chuẩn bị này bao gồm cả việc đảm bảo có một bác sĩ phẫu thuật tại chỗ.
• Không được sử dụng cùng những loại ống thông chống chỉ định dùng cho thiết bị tắc mạch (ví
dụ: cuộn dây hoặc nút bịt).
6 Thận trọng
• Thiết bị MVP gồm có một hợp kim nicken-titan thường được cho là an toàn. Tuy nhiên, thử
nghiệm trong ống nghiệm cho thấy rằng nicken sẽ được giải phóng từ thiết bị sau khi cấy trong
thời gian tối thiểu 60 ngày. Những bệnh nhân dị ứng với nicken có thể bị dị ứng với thiết bị, đặc
biệt là những bệnh nhân có tiền sử dị ứng với kim loại. Một số phản ứng dị ứng có thể nghiêm
trọng; cần hướng dẫn bệnh nhân lập tức thông báo cho bác sĩ nếu họ có phản ứng dị ứng,
chẳng hạn như khó thở hoặc sưng mặt hay họng. Một số bệnh nhân có thể bị dị ứng với niken
khi cấy thiết bị.
• Bác sĩ cần tiến hành đánh giá lâm sàng trong những tình huống có liên quan đến sử dụng chất
kháng đông hoặc thuốc chống tiểu cầu trước, trong hoặc sau khi sử dụng thiết bị.
• Xin lưu ý đến những nhóm đối tượng cụ thể sau:
– Đối với bệnh nhân đang mang thai, cần chú ý đảm bảo thai phụ và thai nhi tiếp xúc tối thiểu
với phóng xạ.
– Đối với thai phụ đang nuôi con nhỏ, hiện chưa có đánh giá định lượng về sự hiện diện của
chất ngâm chiết trong sữa mẹ sau khi cấy thiết bị.
83
Page 84

• Xác minh khả năng tương thích của hệ thống MVP khi sử dụng các thiết bị phụ trợ khác trong
các thủ thuật nội mạch. Bác sĩ sử dụng hệ thống MVP phải quen với các kỹ thuật qua da và nội
mạch cũng như các biến chứng có thể xảy ra liên quan đến thủ thuật.
• Cần hydrat hóa hệ thống MVP trước khi sử dụng.
• Chú ý khi sử dụng hệ thống MVP để giảm nguy cơ hỏng hóc do vô tình.
• Có khả năng xuất hiện lực đẩy lớn hơn khi sử dụng với ống thông siêu nhỏ hoặc ống thông tiêu
chuẩn làm bằng hỗn hợp kim loại có khía rãnh.
• Xác minh rằng đường kính của mọi thiết bị phụ trợ được sử dụng đều tương thích với hệ thống
MVP trước khi sử dụng.
7 Biến cố bất lợi tiềm ẩn
Biến cố bất lợi tiềm ẩn có thể xảy ra trong hoặc sau khi thực hiện một thủ thuật đặt thiết bị này bao
gồm nhưng không giới hạn các biến cố sau:
• Tắc nghẽn mạch máu
• Phản ứng dị ứng hoặc tác dụng độc hại
• Chảy máu
• Tử vong
• Dịch chuyển thiết bị
• Sốt
• Biến cố gây tắc chất tạp
• Nhiễm trùng
• Bị tắc nghẽn mạch máu không mong muốn
• Nghẽn mạch máu ngoại vi
• Tái tạo dòng chảy trong cục nghẽn
• Dư thừa lưu lượng
• Đột quỵ hoặc cơn thiếu máu não thoáng qua (TIA)
• Can thiệp bằng phẫu thuật
• Biến chứng vị trí tiếp cận mạch máu
• Chấn thương hoặc thủng mạch máu
8 Vật liệu cần có
1. Quá trình phân phối của hệ thống MVP, cần phải sử dụng ống thông siêu nhỏ hoặc ống thông
tiêu chuẩn (xem Bảng 2 để biết kích thước khuyến cáo sử dụng).
2. Cần có các phụ kiện sau:
• Dung dịch muối kháng đông
• Van cầm máu cánh quay (RHV)
• Van khóa 3 chiều
• Băng quấn áp lực túi muối
• Tiếp cận ống dẫn
• Khuyến cáo sử dụng ống thông dẫn hướng tương thích với ống thông siêu nhỏ hoặc ống
thông tiêu chuẩn trong Bảng 2
• Dây dẫn hướng tương thích với ống thông dẫn hướng và ống thông siêu nhỏ hoặc ống
thông tiêu chuẩn
• Cây treo truyền dịch (IV)
9 Chuẩn bị
1. Để hệ thống MVP đạt hiệu suất tối ưu và giảm nguy cơ biến chứng nghẽn mạch huyết khối, hãy
duy trì dòng chảy dung dịch muối liên tục giữa các thành phần sau:
• ống dẫn tiếp cận và ống thông dẫn hướng
• ống thông siêu nhỏ hoặc ống thông tiêu chuẩn và ống thông dẫn hướng
• ống thông siêu nhỏ hoặc ống thông tiêu chuẩn, dây dẫn hướng và hệ thống MVP.
2. Đặt ống thông dẫn hướng phù hợp theo quy trình khuyến cáo. Kết nối van cầm máu cánh quay
(RHV) với trục của ống thông dẫn hướng. Gắn van khóa 3 chiều vào cần bên của RHV. Kết nối
ống dung dịch muối đã qua xử lý bằng chất kháng đông để xối liên tục.
3. Kiểm tra toàn bộ các khớp nối để đảm bảo không khí không bị lọt vào trong ống thông dẫn
hướng hoặc ống thông siêu nhỏ hoặc ống thông tiêu chuẩn trong quá trình xối liên tục.
10 Hướng dẫn sử dụng
1. Tiếp cận mạch máu đích và tiến hành chụp động mạch bằng kỹ thuật tiêu chuẩn để đo đường
kính mạch máu tại điểm nghẽn mong muốn. Đảm bảo mạch máu đích đáp ứng đường kính
khuyến cáo (xem Bảng 1).
2. Đảm bảo rằng điểm nghẽn đủ dài để chứa thiết bị cấy MVP mà không gây tắc các mạch máu
ngoài dự kiến.
3. Chọn một ống thông siêu nhỏ hoặc ống thông tiêu chuẩn (xem
khuyến cáo) và chuẩn bị ống thông theo hướng dẫn sử dụng của nhà sản xuất.
4. Chèn dây dẫn hướng vào rồi đẩy ống thông siêu nhỏ hoặc ống thông tiêu chuẩn về phía dây
dẫn hướng cho đến khi đầu ngoại biên tiền gần đến mép trước của điểm nghẽn.
5. Tháo dây dẫn hướng ra khỏi ống thông siêu nhỏ hoặc ống thông tiêu chuẩn.
6. Tháo hệ thống MVP ra khỏi ống phân phối bằng cách nhẹ nhàng tháo ống dẫn màu vàng ra
khỏi hai kẹp ngoài rồi kéo hệ thống MVP ra khỏi ống chứa trong suốt. Nhẹ nhàng cầm lấy ống
dẫn tại vị trí gần với thiết bị MVP rồi từ từ tháo thiết bị MVP, dây phân phối và ống dẫn ra khỏi
ống phân phối. Xem Hình 3.
Hình 3. Hệ thống MVP trong bao bì
1 Ống chứa trong suốt
2 Ống dẫn màu vàng
3 Dây phân phối (bên trong ống dẫn)
4 Bộ tạo mô men xoắn
5 Ống phân phối
6 Thiết bị MVP
Kiểm tra kỹ hệ thống MVP xem có bị hư hỏng không. Nếu hệ thống MVP bị hư hỏng, thay hệ
7.
thống bằng một hệ thống MVP mới.
8. Xối hệ thống MVP bằng cách nhẹ nhàng nhúng ống dẫn và thiết bị MVP ngập vài cm trong dung
dịch muối đã qua xử lý bằng chất kháng đông.
9. Kéo thiết bị MVP vào ống dẫn bằng cách kéo dây phân phối cho đến khi đầu ngoại biên của
thiết bị MVP nằm trọn bên trong ống dẫn.
Lưu ý: Nếu thiết bị MVP bị kéo quá sâu vào trong ống dẫn, quá trình xối của thiết bị có thể
không hiệu quả. Hai lỗ trên ống dẫn, nằm tại vị trí 3 cm và 6 cm gần với đầu của ống dẫn, hỗ
trợ làm sạch bằng khí và xối thiết bị.
10. Chèn hệ thống MVP bằng cách chèn đầu ngoại biên của ống dẫn qua RHV rồi vào trục của ống
thông siêu nhỏ hoặc ống thông tiêu chuẩn cho đến khi ống dẫn được định vị chắc chắn. Siết
RHV đủ chặt để ngăn chặn máu chảy ngược, tuy nhiên không nên siết quá chặt để không làm
hư hỏng hệ thống MVP trong quá trình đưa hệ thống vào ống thông siêu nhỏ hoặc ống thông
tiêu chuẩn.
11. Xác minh bằng mắt xem dung dịch xối có ngấm bình thường không. Phải nhìn thấy dung dịch
muối nhỏ giọt ra ở đầu gần gốc của ống dẫn.
12. Nới lỏng RHV tới mức có thể đẩy thiết bị MVP và dây phân phối cùng nhau như một hệ thống.
Không được nới lỏng RHV tới mức máu chảy ngược ra. Tháo ống dẫn ra bằng cách rút bộ
phận này về phía đầu gần gốc của dây phân phối.
13. Đẩy dây phân phối và thiết bị MVP cho đến khi đai chốt bạch kim ngoại biên của thiết bị MVP
thẳng hàng với đai chốt ngoại biên của ống thông siêu nhỏ hoặc ống thông tiêu chuẩn.
14. Xác nhận rằng đai chốt được định vị một cách tối ưu. Triển khai thiết bị MVP bằng lực đẩy về
phía trước trên dây phân phối trong khi từ từ kéo ống thông siêu nhỏ hoặc ống thông tiêu chuẩn
lại để tháo thiết bị khỏi ống dẫn MVP.
15. Nếu không thỏa mãn với vị trí của thiết bị, áp dụng các biện pháp sau:
a. Ổn định dây phân phối và đẩy ống thông siêu nhỏ hoặc ống thông tiêu chuẩn bằng cách
di chuyển ống thông ra ngoại biên cho đến khi thiết bị MVP nằm trọn trong ống thông tiêu
chuẩn.
b. Định vị lại và triển khai thiết bị hoặc lấy thiết bị ra khỏi bệnh nhân.
Lưu ý: Không được lắp lại ống dẫn và triển khai thiết bị quá 3 lần.
16. Để tháo dễ dàng, cần định vị thiết bị MVP nằm ngoài đầu của ống thông siêu nhỏ hoặc ống
thông tiêu chuẩn.
17. Nếu không thỏa mãn với vị trí của thiết bị, hãy tiến hành tháo bằng các hành động sau:
a. Xác nhận bằng phóng xạ tuyến rằng đầu của ống thông siêu nhỏ hoặc ống thông tiêu
chuẩn ở gần với thiết bị MVP.
b. Gắn bộ phận tạo mô men xoắn vào dây phân phối. Tháo thiết bị MVP bằng cách xoay dây
phân phối ngược chiều kim đồng hồ cho đến khi dây phân phối tách khỏi thiết bị.
c. Xác minh tháo thành công bằng phóng xạ tuyến bằng cách từ từ kéo dây phân phối về phía
gần để đảm bảo thiết bị MVP không bị dịch chuyển. Trong trường hợp hiếm gặp thiết bị
Bảng 2 để biết kích thước
84
Page 85

MVP bị dịch chuyển về phía gần, hãy thiết lập lại vị trí của thiết bị rồi thực hiện lại quá trình
xoay dây phân phối ngược chiều kim đồng hồ để tháo.
18. Trong khi giữ ống thông siêu nhỏ hoặc ống thông tiêu chuẩn ở nguyên vị trí, hãy rút dây phân
phối vào ống thông siêu nhỏ hoặc ống thông tiêu chuẩn rồi lấy dây phân phối khỏi bệnh nhân.
Hoàn thành thủ thuật theo kỹ thuật tiêu chuẩn.
11 Hướng dẫn sau khi thực hiện thủ thuật
Nếu dịch vụ MedicAlert được cung cấp tại khu vực của bạn, hãy khuyến cáo bệnh nhân trở thành
hội viên MedicAlert tại địa chỉ www.medicalert.org. Bệnh nhân sẽ được yêu cầu cho biết về tình
trạng sức khỏe của mình, tên thiết bị cấy và những hạn chế khi chụp MRI.
12 Thông tin về MRI
12.1 An toàn cộng hưởng từ (MR) có điều kiện
Nút bịt mạch máu siêu nhỏ MVP được xác định là an toàn cộng hưởng từ (MR) có điều kiện. Thử
nghiệm phi lâm sàng chứng minh rằng thiết bị bịt mạch máu siêu nhỏ MVP là thiết bị an toàn cộng
hưởng từ (MR) có điều kiện. Có thể chiếu chụp một cách an toàn cho bệnh nhân sử dụng thiết bị
này ngay sau khi cấy thiết bị theo các điều kiện sau:
• Từ trường tĩnh điện bằng 3 Texla trở xuống
• Từ trường građien không gian tối đa bằng 9.000 Gauss/cm trở xuống
• Hệ thống MR tối đa được báo cáo, tỷ lệ hấp thụ riêng trung bình toàn thân (SAR) bằng 4 W/kg
trong 15 phút chụp chiếu (tức là trên mỗi chuỗi xung)
• Chế độ vận hành có kiểm soát, cấp độ một cho hệ thống MR
12.2 Sinh nhiệt có liên quan đến MRI
Trong thử nghiệm phi lâm sàng, thiết bị bịt mạch máu siêu nhỏ MVP làm gia tăng mức nhiệt sau trong
quá trình chụp MRI trong thời gian chụp chiếu 15 min (tức là trên mỗi chuỗi xung) trên hệ thống MR
3 Texla (3 Texla/128 MHz, Excite, HDx, Software 14X.M5, General Electric Healthcare, Milwaukee,
WI): Dao động nhiệt độ lớn nhất +1,8°C
Do đó, các thí nghiệm sinh nhiệt liên quan đến MRI cho thiết bị bịt mạch máu siêu nhỏ MVP ở mức
3 Texla sử dụng cuộn dây RF thu/phát ở giá trị SAR trung bình trên toàn cơ thể, được báo cáo trên
hệ thống MR bằng 2,9 W/kg (tức là có liên quan đến giá trị trung bình trên toàn cơ thể, được đo bằng
phép đo nhiệt lượng bằng 2,7 W/kg) chỉ ra rằng lượng nhiệt lớn nhất sinh ra có liên quan đến các
điều kiện này bằng hoặc nhỏ hơn +1,8°C.
12.3 Thông tin về ảnh giả
Chất lượng ảnh MR có thể bị ảnh hưởng nếu khu vực quan tâm trùng hoặc nằm tương đối gần vị
trí thiết bị bịt mạch máu siêu nhỏ MVP. Do đó, cần tối ưu hóa các thông số ảnh MR để bù lại ảnh
hưởng của việc sử dụng thết bị này. Kích thước tối đa của ảnh giả (ví dụ: như nhìn thấy trên chuỗi
xung dội građien) tăng thêm gần 5 mm so với kích thước và hình dạng của thiết bị bịt mạch máu siêu
nhỏ MVP.
Chuỗi xung
Kích thước không
có tín hiệu
Hướng mặt
phẳng
T1-SE T1-SE GRE GRE
2
252 mm
Song song Vuông góc Song song Vuông góc
91 mm
2
304 mm
2
116 mm
2
tiếp, vô tình hoặc do hậu quả từ việc sử dụng sản phẩm, lỗi, sự cố hoặc hoạt động sai chức
năng của sản phẩm, cho dù khiếu nại về thiệt hại đó được dựa trên chế độ bảo hành, hợp
đồng, lỗi cá nhân hay lý do khác. Không cá nhân nào có thẩm quyền ràng buộc Medtronic
với bất kỳ tuyên bố hoặc đảm bảo nào liên quan đến sản phẩm.
Các trường hợp loại trừ và giới hạn quy định ở trên không nhằm mục đích, cũng như không được
hiểu là, vi phạm các quy định bắt buộc của luật được áp dụng. Nếu bất kỳ phần hoặc điều khoản nào
trong tuyên bố từ chối bảo hành này được coi là trái pháp luật, không thể thực thi hoặc xung đột với
luật áp dụng của một tòa án có thẩm quyền, thì tính hiệu lực của các phần còn lại trong tuyên bố từ
chối bảo hành này sẽ không bị ảnh hưởng và toàn bộ quyền và nghĩa vụ phải được hiểu và thực thi
như thể tuyên bố từ chối bảo hành này không có phần hoặc điều khoản không có hiệu lực đó.
13 Bảo quản
Tránh để hệ thống MVP tiếp xúc với nước, ánh nắng mặt trời, nhiệt độ quá cao hoặc quá thấp và độ
ẩm cao trong quá trình bảo quản. Bảo quản hệ thống MVP ở nhiệt độ phòng có kiểm soát. Xem nhãn
sản phẩm để biết hạn sử dụng thiết bị. Không được sử dụng thiết bị sau hạn sử dụng ghi trên nhãn.
14 Vật liệu
Hệ thống MVP không được làm từ bất kỳ loại nhựa cao su hoặc vật liệu PVC nào.
15 Tuyên bố từ chối trách nhiệm bảo hành
Các cảnh báo ghi trên nhãn của sản phẩm cung cấp thêm thông tin chi tiết và được coi là
một phần không thể tách rời của miễn trừ trách nhiệm bảo hành này. Mặc dù sản phẩm
được sản xuất theo điều kiện được kiểm soát kỹ lưỡng, nhưng Medtronic không kiểm soát
về điều kiện sử dụng sản phẩm này. Do đó, Medtronic tuyên bố từ chối toàn bộ trách nhiệm
bảo hành, cả trường hợp nói rõ hoặc ngầm định, liên quan đến sản phẩm, bao gồm nhưng
không giới hạn bất kỳ trách nhiệm bảo hành ngầm định nào đối với khả năng tiêu thụ cũng
như sự phù hợp của sản phẩm cho mục đích sử dụng nào đó. Medtronic không chịu trách
nhiệm pháp lý với bất kỳ cá nhân hay thực thể nào về mọi chi phí y tế hoặc mọi thiệt hại trực
85
Page 86

Page 87

Page 88

Medtronic, Inc.
*510665-002*
710 Medtronic Parkway
Minneapolis, MN 55432
USA
www.medtronic.com
+1 763 514 4000
LifeLine Technical Support, 24-hour consultation service:
1 877 526 7890
Medtronic B.V.
Earl Bakkenstraat 10
6422 PJ Heerlen
The Netherlands
+31 45 566 8000
© 2020 Medtronic
510665-002 B
2020-03-03
 Loading...
Loading...