Page 1

KYPHON XPANDER™ II M708348B326 Rev. B
Inflatable Bone Tamps,
KYPHON® EXPRESS™ II Inflatable Bone Tamps
IMPORTANT INFORMATION ON THE KYPHON XPANDER™ II INFLATABLE BONE TAMPS,
INFORMATIONS IMPORTANTES SUR LES DISPOSITIFS GONFLABLES DE PLOMBAGE OSSEUX KYPHON XPANDER™ II
INFORMACIÓN IMPORTANTE SOBRE LOS IMPACTORES ÓSEOS INFLABLES KYPHON XPANDER™ II,
IFORMAÇÃO IMPORTANTE SOBRE OS CALCADORES DE OSSO INSUFLÁVEIS KYPHON XPANDER™ II
2013-06-20
1800 Pyramid Place
Memphis, TN 38132
Telephone 800 933 2635 (In U.S.A.)
901 396 3133 (Outside U.S.A.)
Fax 901 396 0356
ENGLISH
INSTRUCTIONS FOR USE
KYPHON XPANDER™ II INFLATABLE BONE TAMPS, KYPHON® EXPRESS™ II INFLATABLE BONE TAMPS
INDICATIONS FOR USE
The KYPHON Xpander™ II Inflatable Bone Tamps and Kyphon® Express™ II Inflatable Bone Tamps are intended to be used as a conventional bone tamp for the reduction of fractures and/or creation of a void in cancellous bone in the
spine (including use during balloon kyphoplasty with a PMMA-based bone cement that is cleared for use in kyphoplasty procedures), hand, tibia, radius, and calcaneus.
DEVICE DESCRIPTION
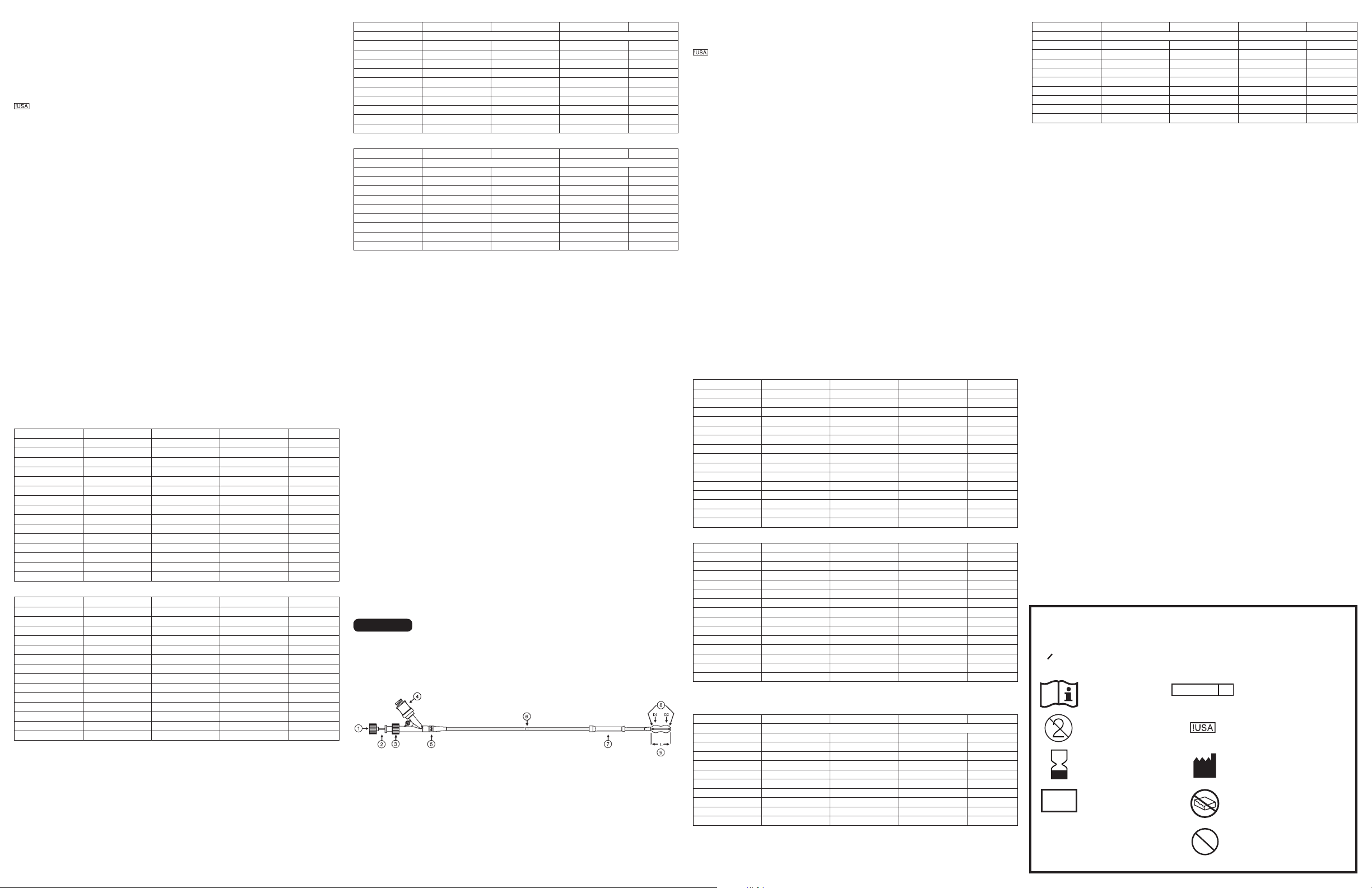
Figure 1: KYPHON Xpander™ II Inflatable Bone Tamp, Kyphon® Express™ II Inflatable Bone Tamp
1. Cap
2. Stylet
3. Stylet Port
4. Inflation Port
5. Color Coded Band
6. Exit Marker Band
7. Insertion Sleeve
8. Radiopaque Markers
9. Balloon
The main components of the Inflatable Bone Tamp (IBT) are a Y-Adapter with the IBT shaft and the IBT balloon, which is located near the distal tip, as shown in Figure 1. The balloon is designed to compress cancellous bone and/or
move cortical bone as it inflates. Radiopaque markers located at the distal and proximal end of the deflated balloon allow fluoroscopic visualization of the deflated IBT during positioning.
The shaft contains two non-communicating lumens. The outer lumen is used for IBT inflation, and the central lumen contains a removable stiffening stylet for IBT insertion. An exit marker that is printed on the shaft serves as an
indicator of the insertion depth.
The proximal end of the shaft has a Y-Adapter with two ports; the stylet port and the inflation port. The inflation port of the adapter is contiguous with the outer lumen. The stylet port is contiguous with the inner lumen and contains
the stiffening stylet. The stylet has a cap at its proximal end for optional stylet removal.
The color coded band (i.e. a yellow band for 10/3 and 10/2 sizes, a black band for 15/3 and 15/2 sizes, and a clear/white band for 20/3 and 20/2 sizes), located just distal to the Y-Adapter, states the balloon size.
CONTRAINDICATIONS
• Bleeding disorder or treatment that increases the chance of excessive bleeding.
• In the presence of active or incompletely treated infection at the site where the bone cement is to be applied.
• Any known severe allergy to contrast media and bone cements.
• Should not be used if vertebral dimensions or fracture pattern do not allow safe placement and inflation of the balloon.
• If the patient has a confirmed pregnancy.
• Instability of posterior wall and/or pedicles.
FOR US AUDIENCES ONLY
CAUTION
• Federal (USA) law restricts this device to sale by or on the order of a physician.
WARNINGS
• Breakage of the device may require intervention or retrieval.
• Do not use this product after the expiration (Use-by) date printed on the package. The device may not be safe or effective beyond its expiration (Use-by) date.
• For a transpedicular approach, if the pedicle is not large enough or stable enough to withstand the procedure, pedicle fracture may occur.
• Complications that may occur during a parapedicular approach include pneumothorax and bleeding.
• The balloon of the IBT may fail due to contact with bone splinters, bone cement, and/or surgical tools.
• Do not inflate the balloon until it has been correctly positioned in the vertebral body. Inflating the balloon prior to full deployment may result in premature balloon failure due to contact between the balloon and the access cannula.
• Inflating the IBT beyond the maximum inflation volume may cause the balloon to rupture before reaching the maximum inflation pressure.
• Inflating the IBT beyond the maximum inflation pressure may cause the balloon to rupture before reaching the maximum inflation volume.
• Never use air or gaseous materials to inflate the balloon.
PRECAUTIONS
• It is important to read the Instructions For Use carefully prior to use.
• Do not use if the package is opened or damaged because product integrity or sterility may be compromised.
• Do not use damaged products. Prior to use, inspect the packaging and product to verify that no damage has occurred.
• Prior to use, the IBT should be examined to verify functionality and ensure that its size is suitable for the specific procedure for which it is to be used.
• The KYPHON Xpander™ II Inflatable Bone Tamps and Kyphon® Express™ II Inflatable Bone Tamps are single use devices intended to contact body tissues. Do not reuse, reprocess, or resterilize. Reusing these devices carries the risk
of contamination and may cause patient infection or cross-infection, regardless of the cleaning and resterilization methods. There is also an increased risk of the deterioration of the device performance due to the reprocessing
steps, which may lead to patient injury or death.
• Reconditioning, refurbishing, repair, modification, or resterilization of the product to enable further use is expressly prohibited.
• Do not use this product if you have not been properly trained. The IBT should only be used by physicians who are trained in the techniques of bone tamp use. Physicians using the devices should be familiar with the physiology
and pathology of the selected anatomy.
• The IBT should be manipulated only while under fluoroscopic observation with radiographic equipment that provides high quality images.
• KYPHON Xpander™ II Inflatable Bone Tamps must be used with KYPHON® Osteo Introducer® Devices containing the cannula with purple hub. The Kyphon® Express™ II Inflatable Bone Tamps must be used with Kyphon Express
™ Osteo Introducer® Devices containing the cannula with purple hub.
• The IBT should only be used with the Kyphon® inflation syringe that provides adequate volume control required for inflation of the KYPHON Xpander™ II IBT and Kyphon® Express™ II IBT and is capable of attaining an inflation
pressure of 700 psi (48atm). The KYPHON Xpander™II IBT and Kyphon® Express™ II IBT should not be used with the KYPHON Xpander™ Inflation Syringe, as this device is not capable of attaining an inflation pressure of 700psi.
• Only inflate the IBT with liquid contrast media: a 60% solution is recommended. Follow manufacturer’s instructions for contrast media indications, usage, and cautions.
• Risk of balloon rupture increases if IBTcomes in contact with bone cement when balloon volume has not been decreased by 1cc from inflated volume.
• The inflation characteristics of the IBT are altered by inflation inside bone.
• Handle and dispose of this product in accordance with accepted medical practice and applicable laws and regulations.
NOTE: Reference the instructions for use of the Kyphon® Inflation Syringe.
ADVERSE EVENTS
Adverse events potentially associated with use of the IBT include:
• Embolism of fat, thrombus or other materials resulting in symptomatic pulmonary embolism or other clinical sequelae.
• Rupture with fragmentation of the balloon of the IBT resulting in retention of a fragment within the vertebral body.
• Rupture of the IBT causing contrast media exposure, possibly resulting in an allergic reaction or anaphylaxis.
• Deep or superficial wound infection.
• Retropulsed vertebral body bone fragments which may cause injury to the spinal cord or nerve roots resulting in radiculopathy, paresis, or paralysis.
• Bleeding or hematoma.
• Pneumothorax.
• Pedicle fracture.
DIRECTIONS FOR USE
PREPARATION OF THE IBT
CAUTION: Contrast media may have different viscosity and precipitation levels that may cause slower inflation and deflation times. For this reason, the use of 60% contrast media is recommended.
NOTE: Scales of syringes have been found to use either the milliliter (ml) unit or the cubic centimeter (cc) unit. 1cc = 1ml.
1. Twist cap (1) on stylet port (3) to tighten stylet on IBT. Push plunger all the way into locking syringe. Attach locking syringe to inflation port (4) on IBT.
2. Pull locking syringe plunger back. Turn plunger to lock it in position on the last slot in syringe.
3. Detach locking syringe from IBT. Set IBT aside.
4. Prepare inflation syringe with contrast media according to inflation syringe manufacturer’s Instructions For Use.
5. Attach luer connecting port on inflation syringe flexible tubing to inflation port (4) on IBT. The system is now prepared and ready to use.
USE OF IBT
1. Select IBT size based on site and treatment goal. Figure 1 and Tables 1.1 and 1.2 define the inflated diameter (D) and inflated length (L) of the IBTs in 37°C water at inflation volume increments to the maximum inflation volume.
2. These dimensions may vary during product use due to local variation in bone structure.
KYPHON® EXPRESS™ II INFLATABLE BONE TAMPS
ET KYPHON® EXPRESS™ II
IMPACTORES ÓSEOS INFLABLES KYPHON® EXPRESS™ II
E CALCADORES DE OSSO INSUFLÁVEIS KYPHON® EXPRESS™ II
Medtronic Sofamor Danek USA, Inc.
IMPORTANT INFORMATION ON THE KYPHON XPANDER™ II INFLATABLE
BONE TAMPS, KYPHON® EXPRESS™ II INFLATABLE BONE TAMPS
Model Number KX103 Inflated Dimensions
Size 10/3 Volume Diameter (max of D1, D2) Length (L)
Max. Inflation Volume 4cc 2cc 13.7mm 16.3mm
Max. Inflation Pressure 700psi (48atm) 4cc 17.3mm 21.6mm
Model Number KX153 Inflated Dimensions
Size 15/3 Volume Diameter (max of D1, D2) Length (L)
Max. Inflation Volume 5cc 2cc 12.0mm 19.9mm
Max. Inflation Pressure 700psi (48atm) 4 cc 15.6mm 25.0mm
Model Number KX203 Inflated Dimensions
Size 20/3 Volume Diameter (max of D1, D2) Length (L)
Max. Inflation Volume 6cc 2cc 11.2mm 23.0mm
Max. Inflation Pressure 700psi (48atm) 4 cc 14.5mm 28.1mm
Model Number KE102 Inflated Dimensions
Size 10/2 Volume Diameter (max of D1, D2) Length (L)
Max. Inflation Volume 3cc 2cc 12.7mm 15.6mm
Max. Inflation Pressure 700psi (48atm) 3cc 15.0mm 18.7mm
Model Number KE152 Inflated Dimensions
Size 15/2 Volume Diameter (max of D1, D2) Length (L)
Max. Inflation Volume 4cc 2cc 11.4mm 18.9mm
Max. Inflation Pressure 700psi (48atm) 4 cc 15.3mm 24.4mm
Model Number KE202 Inflated Dimensions
Size 20/2 Volume Diameter (max of D1, D2) Length (L)
Max. Inflation Volume 5cc 2cc 10.9mm 19.6mm
Max. Inflation Pressure 700psi (48atm) 4 cc 14.8mm 25.9mm
NOTE:
• Inflating the IBT beyond the maximum inflation volume may cause the balloon to rupture before reaching the maximum inflation pressure.
• Inflating the IBT beyond the maximum inflation pressure may cause the balloon to rupture before reaching the maximum inflation volume.
Size Volume cc Average Pressure psi (atm) Volume cc Average Pressure psi (atm)
10/3 2 135.9psi (9.3atm) 2 295.3psi (20.1atm)
15/3 2 128.3psi (8.7atm) 2 272.0psi (18.5atm)
20/3 2 136.0psi (9.3atm) 2 283.2psi (19.3atm)
Size Volume cc Average Pressure psi (atm) Volume cc Average Pressure psi (atm)
10/2 2 122.9psi (8.4atm) 2 332.1 psi (22.6atm)
15/2 2 118.1psi (8.0atm) 2 321.0 psi (21.8atm)
20/2 2 122.8psi (8.4atm) 2 329.0 psi (22.4atm)
NOTE:
• Volume and pressure data were established in in vitro testing. Due to differences in patient anatomy and bone structure, the data is not representative of clinical use.
IBT INSERTION
1. An access channel is required for IBT placement.
2. Follow the Instructions for Use for the chosen KYPHON® Bone Access Tools to create an access channel into the bone. The KYPHON Xpander™ II IBTs should only be used with KYPHON® Osteo Introducer® Devices containing the
cannula with purple hub. The Kyphon® Express™ II Inflatable Bone Tamps must be used with Kyphon Express™ Osteo Introducer® Devices containing the cannula with purple hub.
INSERTION SLEEVE WITHDRAWAL
1. Without taking the insertion sleeve off the IBT, twist and slightly push the insertion sleeve distally and then pull it proximally over the shaft to expose the distal tip of the balloon. If the insertion sleeve comes off distally while
pushing, slide it back proximally over the shaft. Always keep the insertion sleeve on the shaft of the IBT and outside of the cannula during the procedure.
NOTE: The distal tip of the deflated IBT has reached the distal end of the cannula when the exit marker band (6) on the outer lumen of the IBT enters the proximal end of the cannula.
2. Place the deflated IBT into the access channel and position it under image guidance using the radiopaque markers (8). A gentle twisting motion with the forward push can aid insertion.
3. While holding the IBT in place, inflate to 44psi (3atm) to secure IBT in position. Remove the stylet (2), if desired.
IBT INFLATION
1. Inflate the IBT under continuous image guidance. Use the lateral view to monitor distance from the anterior and posterior cortex. Use the AP view to monitor the lateral cortices.
2. If continuous imaging is not used, increase the volume in small increments (0.25 – 0.5cc). Assess tamp position in lateral and AP views before proceeding to further volume increase.
3. Stop when treatment goal is achieved: any part of the IBT inflated length contacts cortical bone or maximum inflation volume and/or maximum inflation pressure is attained. See Table 1.1 and 1.2.
IBT REMOVAL
To deflate, unlock the inflation syringe plunger, pull the plunger all the way back and lock. Deflate according to the inflation syringe Instructions For Use. Remove the IBT from the bone through the cannula with a gentle twisting motion.
When removing the IBT, pull the insertion sleeve back over the balloon.
1. If there is resistance, connect the 30ml locking syringe, pull the syringe plunger back to the “30ml” mark to create a vacuum, and resume the IBT removal.
2. Confirm entry of the balloon of the IBT into the cannula. If the balloon does not move into the cannula, advance the cannula over the IBT to the proximal radiopaque marker. Following cannula advancement, withdraw the IBT
through the cannula. If resistance is noted, remove IBT and cannula simultaneously.
CAUTION: Do not withdraw the IBT unless the balloon is fully deflated. Never withdraw the IBT against resistance. Determine the cause of resistance under fluoroscopy and take the necessary remedial actions.
COMPLETION OF BALLOON KYPHOPLASTY PROCEDURE
Following void creation in a pathological fracture of the vertebral body, KYPHON® Bone Cement may be introduced to fill the void using the KYPHON® Bone Filler Device or KYPHON® Cement Delivery System. Refer to the bone cement
Instructions for Use, KYPHON® Bone Filler Device or KYPHON® Cement Delivery System Instructions for Use.
CEMENT RESISTANCE TECHNIQUE
If leaving an inflated IBT inside the vertebral body during cement fill on the contra-lateral side, prior to injection of cement, ensure IBT volume is reduced by 1.0cc. It is recommended that the balloon is not placed in contact with
the bone cement for more than 5 minutes.
STERILIZATION
Sterilized with irradiation.
HOW SUPPLIED
The KYPHON Xpander™ II IBTs and Kyphon® Express™ II IBTs are supplied sterile in a peel-open package. In the event of damage to the sterile packaging, do not use and notify the manufacturer.
MATERIALS NOT SUPPLIED
• Kyphon® Inflation Syringe
• Locking Syringe
• Contrast Media
• Small Bowl
NOTE: Kyphon® Inflation Syringe with Locking Syringe is available from Medtronic.
STORAGE
The IBTs should be stored in their original packaging. Proper care should be taken to ensure that the IBTs will not be damaged. Store in a cool (at max. 25°C /77°F), dry place.
LIMITATION OF LIABILITY
MEDTRONIC WILL NOT BE RESPONSIBLE FOR ANY DIRECT, INDIRECT, INCIDENTAL, CONSEQUENTIAL, OR EXEMPLARY DAMAGES RESULTING FROM REUSE OF THE KYPHON XPANDER™ II INFLATABLE BONE TAMP AND KYPHON® EXPRESS™
II INFLATABLE BONE TAMP.
IN NO EVENT SHALL MEDTRONIC BE LIABLE FOR ANY DIRECT, INDIRECT, INCIDENTAL, CONSEQUENTIAL, OR EXEMPLARY DAMAGES ARISING OUT OF OR IN CONNECTION WITH THE KYPHON XPANDER™ II INFLATABLE BONE TAMP AND KYPHON®
EXPRESS™ II INFLATABLE BONE TAMP BASED UPON BREACH OF CONTRACT (INCLUDING BREACH OF WARRANTY).
REQUESTS FOR INFORMATION
For further information, contact Medtronic.
This product and/or its use may be protected, in whole or in part, by one or more of the following U.S. patents: 5,972,015; 6,607,544; 6,623,505; 6,663,647; 6,979,341. Other U.S. and foreign patents pending.
Metronic is a registered trademark of Medtronic Inc.
KYPHON and Osteo Introducer are registered trademarks of a Medtronic affiliated company.
KYPHON Xpander is a registered trademark of a Medtronic affiliated company.
Kyphon Express is a trademark of a Medtronic affiliated company.
© 2013 Medtronic Sofamor Danek USA, Inc. All rights reserved.
FraNçaIS
MODE D’EMPLOI
DISPOSITIFS GONFLABLES DE PLOMBAGE OSSEUX KYPHON XPANDER™ II, DISPOSITIFS GONFLABLES DE PLOMBAGE OSSEUX KYPHON® EXPRESS™ II
Table 1.1 – KYPHON Xpander™ II IBT Inflated Dimensions (in 37°C water)
5cc 16.8mm 27.4mm
6cc 16.7mm 32.6mm
Table 1.2 – Kyphon® Express™ II IBT Inflated Dimensions (in 37°C water)
5cc 16.0mm 28.5mm
Table 2.1 – KYPHON Xpander™ II IBT Inflated Dimensions (in 37°C water and in 5.0 pcf Sawbone)
In 37°C water In 5.0 pcf Sawbone
4 129.9psi (8.8atm) 4 329.7psi (22.4atm)
4 121.4psi (8.3atm) 4 313.9psi (21.4atm)
5 120.5psi (8.2atm) 5 325.6psi (22.2atm)
4 130.3psi (8.9atm) 4 325.6psi (22.2atm)
6 127.4psi (8.7atm) 6 342.8psi (23.3atm)
Table 2.2 – Kyphon® Express™ II IBT Inflated Dimensions (in 37°C water and in 5.0 pcf Sawbone)
In 37°C water In 5.0 pcf Sawbone
3 103.3psi (7.0atm) 3 321.2 psi (21.9atm)
4 94.4psi (6.4atm) 4 317.6 psi (21.6atm)
4 98.8psi (6.7atm) 4 326.7 psi (22.2atm)
5 95.3psi (6.5atm) 5 330.7 psi (22.5atm)
INFORMATIONS IMPORTANTES SUR LES DISPOSITIFS GONFLABLES
DE PLOMBAGE OSSEUX KYPHON XPANDER™ II ET KYPHON® EXPRESS™ II
MODE D’EMPLOI
Les dispositifs gonflables de plombage osseux KYPHON Xpander™ II et Kyphon® Express™ II sont conçus pour être utilisés en tant que système standard de cimentation osseuse pour la réduction des fractures et/ou la création d’une
cavité dans un os spongieux de la colonne vertébrale (notamment lors d’une cyphoplastie par ballonnet avec un ciment osseux en polyméthylméthacrylate (PMMA) pouvant être utilisé dans les procédures de cyphoplastie), de la
main, du tibia, du radius et du calcanéus.
DESCRIPTION DU DISPOSITIF
Figure 1 : Dispositifs gonflables de plombage osseux KYPHON Xpander™ II et Kyphon® Express™ II
1. Capuchon
2. Stylet
3. Raccord du stylet
4. Raccord de gonflage
5. Bande à code de couleurs
6. Bande du repère de sortie
7. Manchon d’insertion
8. Marqueurs radio-opaques
9. Ballonnet
Le dispositif gonflable de plombage osseux est principalement composé d’un adaptateur en Y, doté d’une tige, et le ballonnet, situé près de l’extrémité distale, comme indiqué dans la figure 1. Le ballonnet est conçu pour comprimer
l’os spongieux et/ou déplacer l’os cortical lorsqu’il se gonfle. Les marqueurs radio-opaques situés aux extrémités distale et proximale du ballonnet dégonflé permettent la visualisation fluoroscopique du dispositif gonflable de
plombage osseux dégonflé lors de son positionnement.
La tige contient deux lumières non communicantes. La lumière extérieure est utilisée pour le gonflage du dispositif gonflable de plombage osseux. La lumière centrale, quant à elle, contient un stylet de durcissement amovible pour
l’insertion du dispositif gonflable de plombage osseux. Le repère de sortie imprimé sur la tige indique la profondeur d’insertion.
L’extrémité proximale de la tige est équipée d’un adaptateur en Y comportant deux raccords ; le raccord du stylet et le raccord de gonflage. Le raccord de gonflage de l’adaptateur est contigu à la lumière extérieure. Le raccord du stylet
est contigu à la lumière intérieure et contient le stylet de durcissement. L’extrémité proximale du stylet est équipée d’un capuchon pour faciliter son retrait (facultatif).
La bande à code de couleurs (c.-à-d. une bande jaune pour les tailles 10/3 et 10/2, une bande noire pour les tailles 15/3 et 15/2 et une bande transparente/blanche pour les tailles 20/3 et 20/2), située en position distale sur
l’adaptateur en Y, indique la taille du ballonnet.
CONTREINDICATIONS
• Trouble du saignement ou traitement augmentant le risque de saignement excessif.
• Présence d’infection active ou non traitée correctement sur le lieu où le ciment osseux doit être appliqué.
• Toute allergie grave connue aux produits de contraste et aux ciments osseux.
• Ne pas utiliser si la taille de la vertèbre ou le type de fracture ne permet pas de positionner et de gonfler le ballonnet en toute sécurité.
• Si la patiente est enceinte.
• Instabilité de la paroi postérieure et/ou des pédicules.
NE S’APPLIQUE QU’AUX ETATS-UNIS
ATTENTION
• La loi fédérale (aux États-Unis) n’autorise la vente de ces dispositifs que par un médecin ou sur ordonnance d’un médecin.
MISES EN GARDE
• La rupture du dispositif peut nécessiter une intervention ou son retrait.
• Ne pas utiliser ce produit après la date de péremption (« Utiliser avant le ») imprimée sur l’emballage. Il se peut que le dispositif ne soit plus sûr ni efficace au-delà de sa date de péremption.
• Lors d’une approche transpédiculaire, si le pédicule n’est pas assez grand ou assez stable pour supporter l’intervention, il risque de se fracturer.
• Des complications peuvent survenir lors d’une approche parapédiculaire, notamment un pneumothorax ou un saignement.
• Le ballonnet du dispositif gonflable de plombage osseuxpeut connaître des défaillances à la suite d’un contact avec des esquilles, un ciment osseux et/ou des outils chirurgicaux.
• Ne pas gonfler le ballonnet tant qu’il n’a pas été correctement positionné dans le corps vertébral. Le fait de gonfler le ballonnet avant de l’avoir complètement déployé peut entraîner sa défaillance prématurée, en raison d’un
contact avec la canule d’accès.
• En cas de gonflement du dispositif gonflable de plombage osseux au-delà du volume de gonflage maximal, le ballonnet risque d’éclater avant d’avoir atteint la pression de gonflage maximale.
• En cas de gonflement du dispositif gonflable de plombage osseux au-delà de la pression de gonflage maximale, le ballonnet risque d’éclater avant d’avoir atteint le volume de gonflage maximal.
• Ne jamais utiliser d’air ou de substances gazeuses pour gonfler le ballonnet.
PRÉCAUTIONS
• Il est important de lire attentivement le mode d’emploi avant toute utilisation du produit.
• Ne pas utiliser le produit si l’emballage est ouvert ou endommagé, car son intégrité et sa stérilité peuvent être compromises.
• Ne pas utiliser de produits endommagés. Avant d’utiliser le produit, inspectez-le, ainsi que l’emballage afin de vérifier qu’il n’a pas été endommagé.
• Avant toute utilisation, le dispositif gonflable de plombage osseux doit être examiné en vue de vérifier ses fonctionnalités et de s’assurer que sa taille est adaptée à l’intervention spécifique à laquelle il est destiné.
• Les dispositifs gonflables de plombage osseux KYPHON Xpander™ II et Kyphon® Express™ II sont des dispositifs à usage unique conçus pour entrer en contact avec les tissus du corps. Ces produits ne doivent pas être réutilisés,
retraités ou restérilisés. En cas de réutilisation de ces dispositifs, une contamination pourrait se produire et infecter le patient ou provoquer une infection croisée, quelles que soient les méthodes de nettoyage et de restérilisation
utilisées. Il existe également un risque accru de détérioration des performances du dispositif due aux étapes de retraitement, ce qui pourrait entraîner des blessures ou le décès du patient.
• Il est formellement interdit de reconditionner, remettre à neuf, réparer, modifier ou restériliser le produit en vue d’une utilisation ultérieure.
• Ne pas utiliser ce produit si vous n’avez pas reçu de formation adéquate. Le dispositif gonflable de plombage osseux doit être uniquement utilisé par des médecins formés aux techniques d’utilisation du dispositif gonflable de plombage
osseux. Les médecins qui utilisent ces dispositifs doivent connaître la physiologie et la pathologie de la région anatomique concernée.
• Le dispositif gonflable de plombage osseux ne doit être manipulé que sous observation fluoroscopique, à l’aide d’un équipement radiographique qui fournit des images de haute qualité.
• Les dispositifs gonflables de plombage osseux KYPHON Xpander™ II doivent être utilisés avec les dispositifs KYPHON® Osteo Introducer® contenant la canule avec un embout violet. Les dispositifs gonflables de plombage osseux Kyphon®
Express™ II doivent être utilisés avec les dispositifs Kyphon Express™ Osteo Introducer® contenant la canule avec un embout violet.
• Le dispositif gonflable de plombage osseux ne doit être utilisé qu’avec la seringue de gonflage Kyphon® qui contrôle le volume nécessaire au gonflage des dispositifs gonflables de plombage osseux KYPHON Xpander™ II et
Kyphon® Express™ II et qui est capable d’atteindre une pression de gonflage de 48 atm (700 psi). Les dispositifs gonflables de plombage osseux KYPHON Xpander™ II et Kyphon® Express™ II ne doivent pas être utilisés avec la
seringue de gonflage KYPHON Xpander™, car ce dispositif n’est pas capable d’atteindre une pression de gonflage de 48 atm (700 psi).
• Utiliser uniquement un produit de contraste liquide pour gonfler le dispositif gonflable de plombage osseux : il est recommandé d’utiliser une solution à 60 %. Suivre les instructions du fabricant pour les indications, l’utilisation
et les mises en garde relatives au produit de contraste.
• Le risque de rupture du ballonnet augmente si le dispositif gonflable de plombage osseux entre en contact avec le ciment osseux, alors que le volume du ballonnet n’a pas baissé de 1 cc par rapport au volume de gonflage.
• Les caractéristiques de gonflage du dispositif gonflable de plombage osseux sont modifiées par le gonflage à l’intérieur de l’os.
• Manipuler et éliminer ce produit conformément aux pratiques médicales reconnues et aux lois et réglementations en vigueur.
REMARQUE : consulter le mode d’emploi de la seringue de gonflage Kyphon®.
EFFETS INDÉSIRABLES
Effets indésirables potentiellement liés à l’utilisation du dispositif gonflable de plombage osseux :
• Embolie graisseuse, thrombus ou autres affections liées à une embolie pulmonaire symptomatique ou à d’autres séquelles cliniques.
• Rupture avec fragmentation du ballonnet du dispositif gonflable de plombage osseux provoquant la rétention d’un fragment dans le corps vertébral.
• Exposition du produit de contraste en raison de la rupture du dispositif gonflable de plombage osseux, entraînant ainsi une réaction allergique ou anaphylaxie.
• Infection profonde ou superficielle de la blessure.
• Rétropulsion des fragments osseux du corps vertébral pouvant provoquer une lésion de la moelle épinière ou des racines nerveuses, entraînant ainsi une radiculopathie, une parésie ou une paralysie.
• Saignement ou hématome.
• Pneumothorax.
• Fracture du pédicule.
MODE D’EMPLOI
PRÉPARATION DU DISPOSITIF GONFLABLE DE PLOMBAGE OSSEUX
ATTENTION : le produit de contraste peut présenter différents niveaux de viscosité et de précipitation susceptibles de ralentir le gonflage et le dégonflage. Pour cette raison, il est recommandé d’utiliser un produit de contraste à 60 %.
REMARQUE : les graduations des seringues utilisent le millilitre (ml) ou le centimètre cube (cc). 1 cc = 1 ml.
1. Faire tourner le capuchon (1) sur le raccord du stylet (3) pour fixer le stylet au dispositif gonflable de plombage osseux. Pousser entièrement le piston dans la seringue à verrouillage. Fixer la seringue à verrouillage au raccord
de gonflage (4) du dispositif gonflable de plombage osseux.
2. Tirer en arrière le piston de la seringue à verrouillage. Faire tourner le piston de manière à le bloquer sur la dernière position de la seringue.
3. Détacher la seringue à verrouillage du dispositif gonflable de plombage osseux. Mettre celui-ci de côté.
4. Préparer la seringue de gonflage avec du produit de contraste conformément au mode d’emploi du fabricant de la seringue.
5. Fixer le raccord de connexion Luer de la tubulure souple de la seringue de gonflage au raccord de gonflage (4) du dispositif gonflable de plombage osseux. Le système est désormais préparé et prêt à être utilisé.
UTILISATION DU DISPOSITIF GONFLABLE DE PLOMBAGE OSSEUX
1. Sélectionner la taille du dispositif gonflable de plombage osseux en fonction du site et de l’objectif du traitement. La figure 1, ainsi que les tableaux 1.1 et 1.2 définissent le diamètre de gonflage (D) et la longueur de gonflage
(L) des dispositifs gonflables de plombage osseux dans de l’eau à 37°C à différents volumes de gonflage jusqu’au volume de gonflage maximal.
2. Ces dimensions peuvent varier lors de l’utilisation du produit en raison des variations locales de la structure osseuse.
Numéro de modèle KX103 Dimensions de gonflage
Taille 10/3 Volume Diamètre (max. de D1, D2) Longueur (L)
Volume de gonflage max. 4 cc 2 cc 13,7 mm 16,3 mm
Pression de gonflage max. 48 atm (700 psi) 4 cc 17,3 mm 21,6 mm
Numéro de modèle KX153 Dimensions de gonflage
Taille 15/3 Volume Diamètre (max. de D1, D2) Longueur (L)
Volume de gonflage max. 5 cc 2 cc 12 mm 19,9 mm
Pression de gonflage max. 48 atm (700 psi) 4 cc 15,6 mm 25 mm
Numéro de modèle KX203 Dimensions de gonflage
Taille 20/3 Volume Diamètre (max. de D1, D2) Longueur (L)
Volume de gonflage max. 6 cc 2 cc 11,2 mm 23 mm
Pression de gonflage max. 48 atm (700 psi) 4 cc 14,5 mm 28,1 mm
Numéro de modèle KE102 Dimensions de gonflage
Taille 10/2 Volume Diamètre (max. de D1, D2) Longueur (L)
Volume de gonflage max. 3 cc 2 cc 12,7 mm 15,6 mm
Pression de gonflage max. 48 atm (700 psi) 3 cc 15 mm 18,7 mm
Numéro de modèle KE152 Dimensions de gonflage
Taille 15/2 Volume Diamètre (max. de D1, D2) Longueur (L)
Volume de gonflage max. 4 cc 2 cc 11,4 mm 18,9 mm
Pression de gonflage max. 48 atm (700 psi) 4 cc 15,3 mm 24,4 mm
Numéro de modèle KE202 Dimensions de gonflage
Taille 20/2 Volume Diamètre (max. de D1, D2) Longueur (L)
Volume de gonflage max. 5 cc 2 cc 10,9 mm 19,6 mm
Pression de gonflage max. 48 atm (700 psi) 4 cc 14,8 mm 25,9 mm
Tableau 1.1 : Dimensions de gonflage du dispositif gonflable de plombage osseux KYPHON Xpander™ II (dans de l’eau à 37°C)
5 cc 16,8 mm 27,4 mm
6 cc 16,7 mm 32,6 mm
Tableau 1.2 : Dimensions de gonflage du dispositif gonflable de plombage osseux Kyphon® Express™ II (dans de l’eau à 37°C)
5 cc 16 mm 28,5 mm
REMARQUE :
• en cas de gonflement du dispositif gonflable de plombage osseux au-delà du volume de gonflage maximal, le ballonnet risque d’éclater avant d’avoir atteint la pression de gonflage maximale.
• En cas de gonflement du dispositif gonflable de plombage osseux au-delà de la pression de gonflage maximale, le ballonnet risque d’éclater avant d’avoir atteint le volume de gonflage maximal.
Tableau 2.1 : Dimensions de gonflage du dispositif gonflable de plombage osseux KYPHON Xpander™ II (dans de l’eau à 37°C et dans un os synthétique de 80 kg/m3 (5 lb/pi3))
Taille Volume cc Pression moyenne atm (psi) Volume cc Pression moyenne atm (psi)
10/3 2 9,3 atm (135,9 psi) 2 20,1 atm (295,3 psi)
15/3 2 8,7 atm (128,3 psi) 2 18,5 atm (272 psi)
20/3 2 9,3 atm (136 psi) 2 19,3 atm (283,2 psi)
Tableau 2.2 : Dimensions de gonflage du dispositif gonflable de plombage osseux Kyphon® Express™ II (dans de l’eau à 37°C et dans un os synthétique de 80 kg/m3 (5 lb/m3))
Taille Volume cc Pression moyenne atm (psi) Volume cc Pression moyenne atm (psi)
10/2 2 8,4 atm (122,9 psi) 2 22,6 atm (332,1 psi)
15/2 2 8 atm (118,1 psi) 2 21,8 atm (321 psi)
20/2 2 8,4 atm (122,8 psi) 2 22,4 atm (329 psi)
REMARQUE :
• les données relatives au volume et à la pression ont été établies lors d’un test in vitro. En raison des différences au niveau de l’anatomie et la structure osseuse du patient, les données ne sont pas représentatives de l’utilisation
clinique.
INSERTION DU DISPOSITIF GONFLABLE DE PLOMBAGE OSSEUX
1. Un canal d’accès est nécessaire pour la mise en place du dispositif gonflable de plombage osseux.
2. Suivre le mode d’emploi des outils d’accès à l’os KYPHON® sélectionnés pour créer un canal d’accès dans l’os. Les dispositifs gonflables de plombage osseux KYPHON Xpander™ II ne doivent être utilisés qu’avec des dispositifs
KYPHON® Osteo Introducer® contenant la canule avec un embout violet. Les dispositifs gonflables de plombage osseux Kyphon® Express™ II doivent être utilisés avec des dispositifs Kyphon Express™ Osteo Introducer® contenant
la canule avec un embout violet.
RETRAIT DU MANCHON D’INSERTION
1. Sans le retirer du dispositif gonflable de plombage osseux, faire tourner le manchon d’insertion en poussant légèrement dessus par le côté distal. Le tirer ensuite de façon proximale sur la tige de manière à exposer l’extrémité
distale du ballonnet. Si le manchon d’insertion se détache distalement lorsque vous la poussez, le faire glisser en arrière de façon proximale sur la tige. Toujours maintenir le manchon d’insertion sur la tige du dispositif gonflable
de plombage osseux et à l’extérieur de la canule au cours de l’intervention.
REMARQUE : l’extrémité distale du dispositif gonflable de plombage osseux dégonflé a atteint l’extrémité distale de la canule lorsque la bande de repère de sortie (6) de la lumière extérieure du dispositif gonflable de plombage
osseux entre dans l’extrémité proximale de la canule.
2. Placer le dispositif gonflable de plombage osseux dégonflé dans le canal d’accès et le positionner sous guidage par imagerie utilisant les marqueurs radio-opaques (8). Pour simplifier l’insertion, pousser le dispositif tout en
appliquant un léger mouvement de torsion.
3. Gonfler le dispositif gonflable de plombage osseux jusqu’à 3 atm (44 psi) tout en le maintenant en place afin de le fixer. Le cas échéant, retirer le stylet (2).
GONFLAGE DU DISPOSITIF GONFLABLE DE PLOMBAGE OSSEUX
1. Gonfler le dispositif gonflable de plombage osseux sous guidage par imagerie en continu. Utiliser la vue latérale pour surveiller la distance entre le cortex antérieur et le cortex postérieur. Utiliser la vue antéro-postérieure pour
surveiller les cortex latéraux.
2. En l’absence de guidage par imagerie en continu, augmenter le volume par petits incréments (0,25 à 0,5 cc). Évaluer la position du dispositif dans des vues latérale et antéro-postérieure avant d’augmenter le volume.
3. Arrêter l’opération une fois l’objectif de traitement atteint : une partie de la longueur gonflée du dispositif gonflable de plombage osseux entre en contact avec l’os cortical ou le volume et/ou la pression de gonflage maximal
est atteinte. Voir les tableaux 1.1 et 1.2.
RETRAIT DU DISPOSITIF GONFLABLE DE PLOMBAGE OSSEUX
Pour dégonfler le dispositif, débloquer le piston de la seringue de gonflage, tirer complètement le piston en arrière et le bloquer. Dégonfler le dispositif conformément au mode d’emploi de la seringue de gonflage. Retirer le dispositif
gonflable de plombage osseux de l’os au travers de la canule en appliquant un léger mouvement de torsion.
Lors du retrait du dispositif gonflable de plombage osseux, tirer le manchon d’insertion en arrière par-dessus le ballonnet.
1. En cas de résistance, connecter la seringue à verrouillage de 30 ml, tirer le piston de la seringue en arrière jusqu’au repère « 30 ml » pour créer un vide et tenter à nouveau le retrait du dispositif gonflable de plombage osseux.
2. Vérifier que le ballonnet du dispositif gonflable de plombage osseux est bien entré dans la canule. Si le ballonnet n’entre pas dans la canule, faire avancer la canule le long du dispositif gonflable de plombage osseux jusqu’au
marqueur radio-opaque proximal. Après avoir fait avancer la canule, retirer le dispositif gonflable de plombage osseux à travers cette dernière. En cas de résistance, retirer simultanément le dispositif gonflable de plombage
osseux et la canule.
ATTENTION : ne pas retirer le dispositif gonflable de plombage osseux avant d’avoir complètement dégonflé le ballonnet. En cas de résistance, ne jamais retirer le dispositif gonflable de plombage osseux. Trouver la cause de
la résistance sous fluoroscopie et prendre les mesures correctives nécessaires.
ACHÈVEMENT DE L’INTERVENTION DE CYPHOPLASTIE PAR BALLONET
Suite à la création d’une cavité dans une fracture pathologique du corps vertébral, il est possible d’injecter du ciment osseux KYPHON® afin de remplir cette cavité à l’aide du dispositif de comblement osseux KYPHON® ou le système
de cimentation KYPHON®. Se reporter aux modes d’emploi du ciment osseux, du dispositif de comblement osseux KYPHON® ou du système de cimentation KYPHON®.
TECHNIQUE ASSURANT LA RÉSISTANCE DU CIMENT
Si un dispositif gonflable de plombage osseux gonflé est laissé à l’intérieur du corps vertébral lors d’un remplissage de ciment sur le côté controlatéral, avant d’injecter du ciment, vérifier que le volume du dispositif gonflable de
plombage osseux est réduit de 1 cc. Il est recommandé de ne pas mettre en contact le ballonnet avec le ciment osseux pendant plus de 5 minutes.
STÉRILISATION
Stérilisé par irradiation.
PRÉSENTATION
Les dispositifs gonflables de plombage osseux KYPHON Xpander™ II et Kyphon® Express™ II sont fournis sous conditionnement stérile dans un emballage à ouverture décollable. Si l’emballage stérile est endommagé, ne pas utiliser
le produit et en informer le fabricant.
ÉQUIPEMENTS NON FOURNIS
• Seringue de gonflage Kyphon®
• Seringue à verrouillage
• Produit de contraste
• Petit bol
REMARQUE : la seringue de gonflage Kyphon® et la seringue à verrouillage sont disponibles auprès de Medtronic.
STOCKAGE
Les dispositifs gonflables de plombage osseux doivent être stockés dans leur emballage d’origine. Toutes les précautions nécessaires doivent être prises pour éviter d’endommager les dispositifs gonflables de plombage osseux.
Stocker le produit dans un endroit frais (25 °C/77 °F max.) et sec.
LIMITES DE RESPONSABILITÉ
MEDTRONIC N’EST PAS RESPONSABLE DES DOMMAGES DIRECTS, INDIRECTS, FORTUITS, CONSÉCUTIFS OU EXEMPLAIRES RÉSULTANT DE LA RÉUTILISATION DES DISPOSITIFS GONFLABLES DE PLOMBAGE OSSEUX KYPHON XPANDER™ II
ET KYPHON® EXPRESS™ II.
EN AUCUN CAS, MEDTRONIC NE POURRA ÊTRE TENU POUR RESPONSABLE DES DOMMAGES DIRECTS, INDIRECTS, FORTUITS, CONSÉCUTIFS OU EXEMPLAIRES LIÉS AUX DISPOSITIFS GONFLABLES DE PLOMBAGE OSSEUX KYPHON XPANDER™
II ET KYPHON® EXPRESS™ II SUITE À UNE RUPTURE DE CONTRAT (Y COMPRIS UNE VIOLATION DE GARANTIE).
DEMANDES D’INFORMATIONS
Pour plus d’informations, contacter Medtronic.
Ce produit et/ou son utilisation peuvent être protégés, intégralement ou partiellement, par un ou plusieurs des brevets américains suivants : 5,972,015 ; 6,607,544 ; 6,623,505 ; 6,663,647 ; 6,979,341. Autres brevets américains et
étrangers en cours d’homologation.
Medtronic est une marque déposée de Medtronic Inc.
KYPHON et Osteo Introducer sont des marques déposées d’une entreprise affiliée à Medtronic.
KYPHON Xpander est une marque déposée d’une entreprise affiliée à Medtronic.
Kyphon Express est une marque déposée d’une entreprise affiliée à Medtronic.
© 2013 Medtronic Sofamor Danek USA, Inc. Tous droits réservés.
ESpañoL
INSTRUCCIONES DE USO
IMPACTORES ÓSEOS INFLABLES KYPHON XPANDER™ II, IMPACTORES ÓSEOS INFLABLES KYPHON® EXPRESS™ II
INDICACIONES DE USO
Los impactores óseos inflables KYPHON Xpander™ II y los impactores óseos inflables Kyphon® Express™ II están previstos para utilizarse como impactor óseo convencional para la reducción de fracturas y/o creación de una cavidad en el
hueso esponjoso de la columna (incluido el uso durante la cifoplastia con balón con un cemento óseo a base de PMMA autorizado para su uso en procedimientos cifoplásticos), manos, tibia, radio y calcáneo.
DESCRIPCIÓN DEL DISPOSITIVO
Figura 1: Impactor óseo inflable KYPHON Xpander™ II, Impactor óseo inflable Kyphon® Express™ II
1. Capuchón
2. Estilete
3. Orificio del estilete
4. Orificio de inflado
5. Banda codificada por colores
6. Banda del marcador de salida
7. Manguito de inserción
8. Marcadores radiopacos
9. Balón
INFORMACIÓN IMPORTANTE SOBRE LOS IMPACTORES ÓSEOS INFLABLES
KYPHON XPANDER™ II, IMPACTORES ÓSEOS INFLABLES KYPHON® EXPRESS™ II
Dans de l’eau à 37°C Dans un os synthétique de 80 kg/m3 (5 lb/pi3)
4 8,8 atm (129,9 psi) 4 22,4 atm (329,7 psi)
4 8,3 atm (121,4 psi) 4 21,4 atm (313,9 psi)
5 8,2 atm (120,5 psi) 5 22,2 atm (325,6 psi)
4 8,9 atm (130,3 psi) 4 22,2 atm (325,6 psi)
6 8,7 atm (127,4 psi) 6 23,3 atm (342,8 psi)
Dans de l’eau à 37°C Dans un os synthétique de 80 kg/m3 (5 lb/pi3)
3 7 atm (103,3 psi) 3 21,9 atm (321,2 psi)
4 6,4 atm (94,4 psi) 4 21,6 atm (317,6 psi)
4 6,7 atm (98,8 psi) 4 22,2 atm (326,7 psi)
5 6,5 atm (95,3 psi) 5 22,5 atm (330,7 psi)
Page 2
Los componentes principales del impactor óseo inflable (Inflatable Bone Tamp, IBT) son el adaptador en estrella con el cuerpo IBT y el balón IBT, que está ubicado cerca de la punta distal, tal como se muestra en la Figura 1. El balón
REF
STERILE R
R
only
está diseñado para comprimir el hueso esponjoso y/o mover el hueso cortical al inflarse. Los marcadores radiopacos ubicados en los extremos distal y proximal del balón desinflado permiten la visualización fluoroscópica del IBT
desinflado durante la colocación.
El cuerpo contiene dos cavidades no comunicantes. La cavidad exterior se utiliza para inflar el IBT y la cavidad central contiene un estilete enderezador desmontable para la introducción del IBT. Un marcador de salida impreso en el
cuerpo sirve como indicador de la profundidad de inserción.
El extremo proximal del cuerpo tiene un adaptador en estrella con dos puertos: el orificio del estilete y el orificio de inflado. El orificio de inflado del adaptador es adyacente a la cavidad exterior. El orificio del estilete es adyacente a la
cavidad interior y contiene el estilete enderezador. El estilete tiene un capuchón en su extremo proximal para la extracción opcional del estilete.
La banda codificada con colores (es decir, una banda amarilla para los tamaños 10/3 y 10/2, una banda negra para los tamaños 15/3 y 15/2 y una banda transparente/blanca para los tamaños 20/3 y 20/2), ubicada distalmente al
adaptador en estrella, indica el tamaño del balón.
CONTRAINDICACIONES
• Trastorno hemorrágico o tratamiento que aumente la posibilidad de hemorragia excesiva.
• En presencia de una infección activa o mal tratada en el lugar donde se va a aplicar el cemento óseo.
• Toda alergia grave conocida al medio de contraste y cementos óseos.
• No debe usarse si las dimensiones vertebrales o el patrón de la fractura no permiten la colocación segura y el inflado del balón.
• Si la paciente tiene un embarazo confirmado.
• Inestabilidad de la pared posterior y/o los pedículos.
SOLO APLICABLE EN EE. UU.
PRECAUCIÓN
• Las leyes federales estadounidenses restringen la venta de este dispositivo a médicos o por prescripción facultativa.
ADVERTENCIAS
• La rotura del dispositivo puede necesitar intervención o extracción.
• No utilice este producto después de la fecha de caducidad impresa en el paquete. Puede que el dispositivo no sea seguro ni eficaz después de su fecha de caducidad.
• Para un abordaje transpedicular, si el pedículo no es lo suficientemente grande o estable para resistir el procedimiento, podría producirse la factura del pedículo.
• Pueden producirse complicaciones durante un abordaje parapedicular incluidos neumotórax y hemorragia.
• El balón del IBT puede fallar debido al contacto con esquirlas, cemento óseo y/o instrumentos quirúrgicos.
• No infle el balón hasta que se haya colocado correctamente en el cuerpo vertebral. El inflar el balón antes de su despliegue total podría causar su fallo prematuro debido al contacto entre el balón y la cánula de acceso.
• El inflar el IBT más allá de su volumen máximo de inflado podría causar la rotura del balón antes de alcanzar la presión máxima de inflado.
• El inflar el IBT más allá de su presión máxima de inflado podría causar la rotura del balón antes de alcanzar el volumen máximo de inflado.
• No use nunca materiales gaseosos para inflar el balón.
PRECAUCIONES
• Es importante leer las instrucciones de uso detenidamente antes de usarlo.
• No lo use si el paquete está abierto o dañado, puesto que la integridad o la esterilidad del producto podrían estar comprometidas.
• No use productos dañados. Antes de usarlo, inspeccione el paquete y el producto para verificar que no se haya producido ningún daño.
• Antes de usarlo, se debe examinar el IBT para verificar su funcionalidad y asegurarse de que su tamaño es apto para el procedimiento específico para el que se va a utilizar.
• Los impactores óseos inflables KYPHON Xpander™ II y los impactores óseos inflables Kyphon® Express™ son dispositivos de un solo uso previstos para el contacto con los tejidos corporales. No reutilizar, reprocesar ni reesterilizar
este producto. El reutilizar estos dispositivos conlleva el riesgo de contaminación y podría provocar la infección del paciente o una infección cruzada, independientemente de los métodos de limpieza y reesterilización. También
existe el mayor riesgo de deterioro del rendimiento del dispositivo debido a los pasos de reprocesamiento, lo cual puede provocar la lesión o muerte del paciente.
• Se prohíbe terminantemente el reacondicionamiento, arreglo, modificación o reesterilización del producto para posibilitar más usos.
• No use este producto si no ha recibido la formación adecuada. El IBT solo lo pueden usar médicos que hayan recibido formación en las técnicas de impactación del hueso. Los médicos que usen los dispositivos deben estar
familiarizados con la fisiología y patología de la anatomía seleccionada.
• El IBT solo puede ser manipulado bajo observación fluoroscópica con equipo radiográfico que suministre imágenes de alta calidad.
• Los impactores óseos inflables KYPHON Xpander™ II deben usarse con los dispositivos KYPHON® Osteo Introducer® que contienen la cánula con el conector violeta. Los impactores óseos inflables Kyphon® Express™ II deben usarse
con los dispositivos Kyphon Express ™ Osteo Introducer® que contienen la cánula con el conector violeta.
• El IBT solo debe utilizarse con la jeringa de inflado Kyphon® que proporciona un control adecuado del volumen requerido para inflar el IBT KYPHON Xpander™ II y el IBT Kyphon® Express™ II IBT y es capaz de conseguir la presión
de inflado de 700 psi (48 atm). El IBT KYPHON Xpander™ II y el IBT Kyphon® Express™ II no deben usarse con la jeringa de inflado KYPHON Xpander™, ya que este dispositivo no es capaz de conseguir la presión de inflado de 700
psi.
• Infle el IBT solamente con un medio de contraste líquido: se recomienda una solución del 60%. Siga las instrucciones del fabricante en cuanto a las indicaciones, uso y precauciones del medio de contraste.
• El riesgo de rotura del balón aumenta si el IBT entra en contacto con el cemento óseo cuando el volumen del balón no se haya disminuido 1 cc del volumen de inflado.
• Las características de inflado del IBT cambian debido al inflado dentro del hueso.
• Manipule y elimine este producto de conformidad con las prácticas médicas aceptadas y las leyes y regulaciones vigentes.
NOTA: Consulte las instrucciones de uso de la jeringa de inflado Kyphon®.
ACONTECIMIENTOS ADVERSOS
Los posibles acontecimientos adversos asociados al uso del IBT incluyen:
• Embolia de grasa, trombo o de otros materiales que producen una embolia pulmonar sintomática u otras secuelas clínicas.
• La rotura con fragmentación del balón de IBT que causa la retención de un fragmento dentro del cuerpo vertebral.
• La rotura del IBT que provoca la exposición al medio de contraste, produciendo posiblemente una reacción alérgica o una anafilaxis.
• Infección profunda o superficial de la herida.
• Fragmentos óseos del cuerpo vertebral retropulsados que pueden lesionar la médula espinal o las raíces de los nervios produciendo una radiculopatía, paresia o parálisis.
• Hemorragia o hematoma.
• Neumotórax.
• Fractura pedicular.
INSTRUCCIONES DE USO
PREPARACIÓN DEL IBT
PRECAUCIÓN: El medio de contraste puede tener niveles diferentes de viscosidad y precipitación que pueden causar tiempos más largos de inflado y desinflado. Por esta razón, se recomienda el uso de medio de contraste del 60%.
NOTA: Las escalas de las jeringas usan la unidad de milímetro (ml) o de centímetro cúbico (cc). 1 cc = 1 ml.
1. Gire el capuchón (1) del orificio del estilete (3) para apretar el estilete en el IBT. Empuje el émbolo del todo en la jeringa de bloqueo. Conecte la jeringa de bloqueo al orificio de inflado (4) en el IBT.
2. Tire del émbolo de la jeringa de bloqueo. Gire el émbolo para bloquearlo en su sitio en la última ranura de la jeringa.
3. Separe la jeringa de bloqueo del IBT. Ponga el IBT a un lado.
4. Prepare la jeringa de inflado con medio de contraste según las instrucciones de uso del fabricante de la jeringa de inflado.
5. Conecte el orificio de conexión Luer del tubo flexible de la jeringa de inflado al orificio de inflado (4) en el IBT. El sistema ya está preparado y listo para usarse.
USO DEL IBT
1. Seleccione el tamaño del IBT basándose en la zona de intervención y en el objetivo del tratamiento. La Figura 1 y las Tablas 1.1 y 1.2 definen el diámetro de inflado (D) y la longitud de inflado (L) del IBT en agua a 37ºC con
incrementos de volumen de inflado hasta el volumen máximo de inflado.
2. Las dimensiones pueden variar durante el uso del producto debido a la variación local en la estructura ósea.
Número de modelo KX103 Dimensiones de inflado
Tamaño 10/3 Volumen Diámetro (máx. de D1, D2) Longitud (L)
Máx. volumen de inflado 4 cc 2 cc 13,7 mm 16,3 mm
Máx. presión de inflado 700 psi (48 atm) 4 cc 17,3 mm 21,6 mm
Número de modelo KX153 Dimensiones de inflado
Tamaño 15/3 Volumen Diámetro (máx. de D1, D2) Longitud (L)
Máx. volumen de inflado 5 cc 2 cc 12,0 mm 19,9 mm
Máx. presión de inflado 700 psi (48 atm) 4 cc 15,6 mm 25,0 mm
Número de modelo KX203 Dimensiones de inflado
Tamaño 20/3 Volumen Diámetro (máx. de D1, D2) Longitud (L)
Máx. volumen de inflado 6 cc 2 cc 11,2 mm 23,0 mm
Máx. presión de inflado 700 psi (48 atm) 4 cc 14,5 mm 28,1 mm
Número de modelo KE102 Dimensiones de inflado
Tamaño 10/2 Volumen Diámetro (máx. de D1, D2) Longitud (L)
Máx. volumen de inflado 3 cc 2 cc 12,7 mm 15,6 mm
Máx. presión de inflado 700 psi (48 atm) 3 cc 15,0 mm 18,7 mm
Número de modelo KE152 Dimensiones de inflado
Tamaño 15/2 Volumen Diámetro (máx. de D1, D2) Longitud (L)
Máx. volumen de inflado 4 cc 2 cc 11,4 mm 18,9 mm
Máx. presión de inflado 700 psi (48 atm) 4 cc 15,3 mm 24,4 mm
Número de modelo KE202 Dimensiones de inflado
Tamaño 20/2 Volumen Diámetro (máx. de D1, D2) Longitud (L)
Máx. volumen de inflado 5 cc 2 cc 10,9 mm 19,6 mm
Máx. presión de inflado 700 psi (48 atm) 4 cc 14,8 mm 25,9 mm
NOTA:
• El inflar el IBT más allá de su volumen máximo de inflado podría causar la rotura del balón antes de alcanzar la presión máxima de inflado.
• El inflar el IBT más allá de su presión máxima de inflado podría causar la rotura del balón antes de alcanzar el volumen máximo de inflado.
Tabla 1.1: Dimensiones de inflado del IBT KYPHON Xpander™ II (en agua a 37ºC)
5 cc 16,8 mm 27,4 mm
6 cc 16,7 mm 32,6 mm
Tabla 1.2: Dimensiones de inflado del IBT Kyphon® Express™ II (en agua a 37ºC)
5 cc 16,0 mm 28,5 mm
Tabla 2.1: Dimensiones de inflado del IBT KYPHON Xpander™ II (en agua a 37ºC y en modelo anatómico de 5,0 libras por pie cúbico)
Tamaño Volumen cc Presión media psi (atm) Volumen cc Presión media psi (atm)
10/3 2 135,9 psi (9,3 atm) 2 295,3 psi (20,1 atm)
15/3 2 128,3 psi (8,7 atm) 2 272,0 psi (18,5 atm)
20/3 2 136,0 psi (9,3 atm) 2 283,2 psi (19,3 atm)
Tabla 2.2: Dimensiones de inflado del IBT Kyphon® Express™ II (en agua a 37ºC y en modelo anatómico de 5,0 libras por pie cúbico)
Tamaño Volumen cc Presión media psi (atm) Volumen cc Presión media psi (atm)
10/2 2 122,9 psi (8,4 atm) 2 332,1 psi (22,6 atm)
15/2 2 118,1 psi (8,0 atm) 2 321,0 psi (21,8 atm)
20/2 2 122,8 psi (8,4 atm) 2 329,0 psi (22,4 atm)
NOTA:
• Los datos de volumen y presión se establecieron con pruebas in vitro. Debido a las diferencias en la anatomía y estructura ósea de los pacientes, los datos no son representativos del uso clínico.
INSERCIÓN DEL IBT
1. Se necesita un canal de acceso para la colocación del IBT.
2. Siga las instrucciones de uso para los instrumentos de acceso óseo KYPHON® elegidos para crear un canal de acceso dentro del hueso. Los impactores óseos inflables KYPHON Xpander™ II deben usarse con los dispositivos
KYPHON® Osteo Introducer® que contienen la cánula con el conector violeta. Los impactores óseos inflables Kyphon® Express™ II deben usarse con los dispositivos Kyphon Express™ Osteo Introducer® que contienen la cánula
con el conector violeta.
RETIRADA DEL MANGUITO DE INSERCIÓN
1. Sin quitar el manguito de inserción del IBT, gire y empuje ligeramente el manguito de inserción distalmente y luego tire del mismo proximalmente sobre el cuerpo para exponer la punta distal del balón. Si el manguito de
inserción sale distalmente al empujarlo, deslícelo de vuelta sobre el cuerpo proximalmente. Mantenga siempre el manguito de inserción sobre el cuerpo del IBT y fuera de la cánula durante el procedimiento.
NOTA: La punta distal del IBT desinflado ha alcanzado el extremo distal de la cánula cuando la banda marcadora de la salida (6) de la cavidad externa del IBT entra en el extremo proximal de la cánula.
2. Ponga el IBT desinflado dentro del canal de acceso y colóquelo bajo la guía por imagen usando los marcadores radiopacos (8). Un movimiento suave de giro al empujar hacia delante puede ayudar con la inserción.
3. Mientras sujeta el IBT en su sitio, infle hasta 44 psi (3 atm) para fijar el IBT en su sitio. Quite el estilete (2), si lo desea.
INFLADO DEL IBT
1. Infle el IBT bajo la guía por imagen continua. Use la vista lateral para controlar la distancia desde el córtex anterior y posterior. Use la vista AP (anteroposterior) para controlar los córtex laterales.
2. Si no se utiliza la imagen continua, aumente el volumen en pequeños incrementos (0,25-0,5 cc). Evalúe la posición del impactor en las vistas AP y lateral antes de continuar aumentando el volumen.
3. Deténgase cuando se haya conseguido el objetivo del tratamiento: alguna parte de la longitud inflada del IBT entra en contacto con el hueso cortical o se consigue un volumen máximo de inflado y/o una presión máxima de
inflado. Vea las Tablas 1.1 y 1.2.
EXTRACCIÓN DEL IBT
Para desinflarlo, desbloquee el émbolo de la jeringa de inflado, tire del émbolo del todo y bloquee. Desinfle según las instrucciones de uso de la jeringa de inflado. Retire el IBT del hueso a través de la cánula con un movimiento suave de giro.
Al quitar el IBT, tire del manguito de inserción de vuelta sobre el balón.
1. Si encuentra resistencia, conecte la jeringa de bloqueo de 30 ml, tire del émbolo de la jeringa hasta la marca de “30 ml” para crear un vacío y continúe retirando el IBT.
2. Confirme la entrada del balón del IBT dentro de la cánula. Si el balón no se mueve dentro de la cánula, haga avanzar la cánula sobre el IBT hasta el marcador radiopaco proximal. Después del avance de la cánula, retire el IBT a
través de la cánula. Si nota resistencia, quite el IBT y la cánula al mismo tiempo.
PRECAUCIÓN: No quite el IBT a menos que el balón esté totalmente desinflado. No retire nunca el IBT si encuentra resistencia. Determine la causa de la resistencia bajo fluoroscopia y tome las medidas de remedio necesarias.
FINALIZACIÓN DEL PROCEDIMIENTO DE CIFOPLASTIA CON BALÓN
Después de crear una cavidad en una fractura patológica del cuerpo vertebral, se puede introducir el cemento óseo KYPHON® para llenar la cavidad usando el dispositivo de relleno óseo KYPHON® o el sistema de distribución de cemento
KYPHON®. Consulte las instrucciones de uso del cemento óseo y las instrucciones de uso del dispositivo de relleno óseo KYPHON® o del sistema de distribución de cemento KYPHON®.
TÉCNICA DE RESISTENCIA AL CEMENTO
Si se deja un IBT inflado dentro del cuerpo vertebral durante el llenado de cemento en el lado contralateral, antes de inyectar el cemento, asegúrese de que el volumen de IBT se reduzca en 1,0 cc. Se recomienda no colocar el balón
en contacto con el cemento óseo durante más de 5 minutos.
ESTERILIZACIÓN
Esterilización con irradiación.
CÓMO SE SUMINISTRA
Los impactores óseos inflables KYPHON Xpander™ II y los impactores óseos inflables Kyphon® Express™ II se suministran estériles en un paquete que se abre despegándolo. En caso de daños en el paquete esterilizado, no lo use y
notifique al fabricante.
MATERIALES NO SUMINISTRADOS
• Jeringa de inflado Kyphon®
• Jeringa de bloqueo
• Medio de contraste
• Tazón pequeño
NOTA: La jeringa de inflado Kyphon® con la jeringa de bloqueo se encuentra disponible en Medtronic.
ALMACENAMIENTO
Los IBT se deben guardar en sus paquetes originales. Se deben tomar las medidas necesarias para asegurarse de que los IBT no sufran daños. Guárdelos en un lugar frío (a 25° C /77° F como máx.) y seco.
LIMITACIÓN DE RESPONSABILIDAD
MEDTRONIC NO SE HACE RESPONSABLE POR NINGUNOS DAÑOS DIRECTOS, INDIRECTOS, INCIDENTALES, CONSECUENTES O EJEMPLARES QUE SE DEBAN A LA REUTILIZACIÓN DEL IMPACTOR ÓSEO INFLABLE KYPHON XPANDER™ II Y DEL
IMPACTOR ÓSEO INFLABLE KYPHON® EXPRESS™ II.
EN NINGÚN CASO SERÁ MEDTRONIC RESPONSABLE POR DAÑOS DIRECTOS, INDIRECTOS, INCIDENTALES, CONSECUENTES O EJEMPLARES QUE SURJAN O ESTÉN RELACIONADOS CON EL IMPACTOR ÓSEO INFLABLE KYPHON XPANDER™ II Y EL
IMPACTOR ÓSEO INFLABLE KYPHON® EXPRESS™ II CUANDO EXISTA INCUMPLIMIENTO DE CONTRATO (INCLUIDO EL INCUMPLIMIENTO DE LA GARANTÍA).
SOLICITUDES DE INFORMACIÓN
Para mayor información, póngase en contacto con Medtronic.
Este producto y/o su uso pueden estar protegidos, en su totalidad o en parte, por una o más de las siguientes patentes estadounidenses: 5,972,015; 6,607,544; 6,623,505; 6,663,647; 6,979,341. Otras patentes estadounidenses y
extranjeras pendientes.
Medtronic es una marca comercial registrada de Medtronic Inc.
KYPHON y Osteo Introducer son marcas comerciales registradas de una compañía afiliada de Medtronic.
KYPHON Xpander es una marca comercial registrada de una compañía afiliada de Medtronic.
Kyphon Express es una marca comercial de una compañía afiliada de Medtronic.
© 2013 Medtronic Sofamor Danek USA, Inc. Todos los derechos reservados.
portuGuêS
INSTRUÇÕES DE UTILIZAÇÃO
CALCADORES DE OSSO INSUFLÁVEIS KYPHON XPANDER™ II, CALCADORES DE OSSO INSUFLÁVEIS KYPHON® EXPRESS™ II
INSTRUÇÕES DE UTILIZAÇÃO
Os calcadores de osso insufláveis KYPHON Xpander™ II e os calcadores de osso insufláveis Kyphon® Express™ II são indicados serem utilizados como calcadores de osso convencionais para a redução de fracturas e/ou criação de uma
cavidade no osso esponjoso da coluna (incluindo a utilização durante a cifoplastia com balão com um cimento ósseo de base PMMA com autorização para ser usado em intervenções de cifoplastia), mão, tíbia, rádio e tendão de Aquiles.
DESCRIÇÃO DO DISPOSITIVO
Figura 1: Calcador de osso insuflável KYPHON Xpander™ II e calcador de osso insuflável Kyphon® Express™ II
1. Tampa
2. Estilete
3. Porta do estilete
4. Porta de insuflação
5. Cinta com código de cor
6. Cinta de marcador de saída
7. Manga de inserção
8. Marcadores radiopacos
9. Balão
Os principais componentes do calcador de osso insuflável (IBT) são um adaptador em “Y” com a haste IBT e o balão IBT, localizados perto da ponta distal, conforme mostrado na Figura 1. O balão foi concebido para comprimir o osso
esponjoso e/ou mover o osso cortical à medida que enche. Os marcadores radiopacos localizados na extremidade distal e proximal do balão esvaziado permitem a visualização fluoroscópica do IBT esvaziado durante o posicionamento.
A haste contém dois lúmenes sem comunicação. O lúmen externo é usado para o enchimento do IBT e o lúmen central contém um estilete de reforço removível para a inserção do IBT. Um marcador de saída que está impresso na
haste serve como indicador da profundidade de inserção.
A extremidade proximal da haste tem um adaptador em Y com duas portas: a porta do estilete e a porta de insuflação. A porta de insuflação do adaptador é contígua ao lúmen externo. A porta do estilete é contígua ao lúmen interior
e contém o estilete de reforço. O estilete tem uma tampa na extremidade proximal para remoção opcional do estilete.
A cinta de código de cor (ou seja, uma cinta amarela para as dimensões 10/3 e 10/2, uma cinta preta para as dimensões 15/3 e 15/2 e uma cinta transparente/branca para as dimensões 20/3 e 20/2), localizada distalmente ao
adaptador em Y, indica a dimensão do balão.
INFORMAÇÃO IMPORTANTE SOBRE OS CALCADORES DE OSSO INSUFLÁVEIS
KYPHON XPANDER™ II E CALCADORES DE OSSO INSUFLÁVEIS KYPHON® EXPRESS™ II
En agua a 37ºC En modelo anatómico de 5,0 libras por pie cúbico
4 129,9 psi (8,8 atm) 4 329,7 psi (22,4 atm)
4 121,4 psi (8,3 atm) 4 313,9 psi (21,4 atm)
5 120,5 psi (8,2 atm) 5 325,6 psi (22,2 atm)
4 130,3 psi (8,9 atm) 4 325,6 psi (22,2 atm)
6 127,4 psi (8,7 atm) 6 342,8 psi (23,3 atm)
En agua a 37ºC En modelo anatómico de 5,0 libras por pie cúbico
3 103,3 psi (7,0 atm) 3 321,2 psi (21,9 atm)
4 94,4 psi (6,4 atm) 4 317,6 psi (21,6 atm)
4 98,8 psi (6,7 atm) 4 326,7 psi (22,2 atm)
5 95,3 psi (6,5 atm) 5 330,7 psi (22,5 atm)
CONTRAINDICAÇÕES
• Perturbações hemorrágicas ou tratamento que aumente a possibilidade de hemorragia excessiva.
• Na presença de uma infecção activa ou que não foi totalmente tratada no local onde o cimento ósseo será aplicado.
• Qualquer alergia grave conhecida a meios de contraste e cimentos ósseos.
• Não deve ser usado se as dimensões vertebrais ou padrão da fractura não permitirem o posicionamento e enchimento seguros do balão.
• Se a doente tiver uma gravidez confirmada.
• Instabilidade da parede posterior e/ou pedículos.
APENAS APLICÁVEL AOS E.U.A.
PRECAUÇÃO
• A lei federal (dos E.U.A.) restringe a venda destes dispositivos a um médico ou mediante prescrição médica.
ADVERTÊNCIAS
• A quebra do dispositivo pode requerer intervenção ou recuperação.
• Não use este produto após o prazo de validade impresso na embalagem. O dispositivo pode não ser seguro ou eficiente depois do prazo de validade.
• Para uma abordagem transpedicular, se o pedículo não for suficientemente grande ou estável para suportar a intervenção, pode ocorrer uma fractura no pedículo.
• Podem ocorrer complicações durante uma abordagem parapedicular, incluindo pneumotórax e hemorragia.
• O balão do IBT pode falhar devido ao contacto com fragmentos ósseos, cimento ósseo e/ou ferramentas cirúrgicas.
• Não encha o balão até ter sido devidamente posicionado no corpo vertebral. O enchimento do balão antes do posicionamento completo pode resultar numa falha prematura do balão devido ao contacto entre o balão e a cânula
de acesso.
• O enchimento do IBT além do volume de enchimento máximo pode levar à ruptura do balão antes de atingir a pressão de enchimento máxima.
• O enchimento do balão além da pressão de enchimento máxima pode levar o balão à ruptura antes de atingir o volume máximo de enchimento.
• Nunca use ar nem material gasoso para encher o balão.
PRECAUÇÕES
• É importante ler as instruções de utilização cuidadosamente antes da utilização.
• Não utilize se a embalagem tiver sido aberta ou danificada, pois a integridade do produto ou esterilização podem estar comprometidas.
• Não use produtos danificados. Antes da utilização inspeccione a embalagem e o produto para verificar que não ocorreram danos.
• Antes da utilização, o IBT deve ser examinado para verificar a funcionalidade e assegurar que a sua dimensão é apropriada para a intervenção específica para a qual será usado.
• Os calcadores de osso insufláveis KYPHON Xpander™ II e Kyphon® Express™ II são dispositivos de utilização única indicados para o contacto entre tecidos ósseos. Não reutilizar, reprocessar ou reesterilizar. A reutilização destes
dispositivos origina o risco de contaminação e pode levar à infecção do doente ou infecção transversal, independentemente dos métodos de limpeza e reesterilização. Existe também um risco acrescido de deterioração do
desempenho do dispositivo devido aos passos de reprocessamento, que podem levar a lesões ou morte.
• O recondicionamento, remodelação, modificação ou reesterilização do produto para permitir uma nova utilização são expressamente proibidos.
• Não use este produto se não tiver recebido a formação adequada. O IBT deve ser usado apenas por médicos com formação nas técnicas de utilização de calcadores ósseos. Os médicos que usam os dispositivos devem estar
familiarizados com a fisiologia e patologia da anatomia seleccionada.
• O IBT deve ser manipulado apenas sob observação fluoroscópica com equipamento radiográfico que forneça imagens de alta qualidade.
• Os calcadores de osso insufláveis KYPHON Xpander™ II devem ser usados com os dispositivos KYPHON® Osteo Introducer® que contêm a cânula com conector roxo. Os calcadores de osso insufláveis Kyphon® Express™ II devem
ser usados com dispositivos Kyphon Express ™ Osteo Introducer® que contêm a cânula com o conector roxo.
• O IBT deve apenas ser usado com a seringa de insuflação Kyphon® que proporciona o controlo de volume adequado necessário para o enchimento do IBT KYPHON Xpander™ II e IBT Kyphon® Express™ II e é capaz de atingir uma
pressão de enchimento de 700 psi (48 atm). O IBT KYPHON Xpander™II e IBT Kyphon® Express™ II não devem ser usados com a seringa de enchimento KYPHON Xpander™ pois este dispositivo não é capaz de atingir uma pressão
de enchimento de 700 psi.
• Encha apenas o IBT com meios de contraste líquidos: recomenda-se uma solução de 60%. Siga as instruções do fabricante para indicações relativas aos meios de contraste, utilização e precauções.
• O risco da ruptura do balão aumenta se o IBT entrar em contacto com cimento ósseo quando o volume do balão não diminuiu em 1 cc em comparação com o volume insuflado.
• As características de enchimento do IBT são alteradas pelo enchimento dentro do osso.
• Manuseie e elimine este produto de acordo com a prática médica aceite e leis e regulamentos aplicáveis.
NOTA: Consulte as instruções de utilização da seringa de insuflação Kyphon®.
EVENTOS ADVERSOS
Os efeitos adversos potencialmente associados com a utilização do IBT incluem:
• Embolia gordurosa, trombos ou outros materiais resultando em embolias pulmonares sintomáticas ou outras sequelas clínicas.
• Ruptura com fragmentação do balão do IBT resultante na retenção de um fragmento dentro do corpo vertebral.
• Ruptura do IBT causando exposição a meios de contraste, possivelmente resultando numa reacção alérgica ou anafilaxia.
• Infecção da ferida profunda ou superficial.
• Fragmentos ósseos do corpo vertebral retropulsado que podem causar lesões na medula espinal ou raiz dos nervos resultando em radiculopatia, paresia ou paralisia.
• Hemorragia ou hematoma.
• Pneumotórax.
• Fractura do pedículo.
INSTRUÇÕES DE UTILIZAÇÃO
PREPARAÇÃO DO IBT
ATENÇÃO: Os meios de contraste podem ter diferentes níveis de viscosidade e precipitação que podem causar um tempo de enchimento e esvaziamento mais lentos. Por este motivo, é recomendada a utilização de meio de contraste a 60%.
NOTA: Foi descoberto que as escalas das seringas usam a unidade milímetro (ml) ou centímetro cúbico (cc). 1cc = 1ml.
1. Gire a tampa (1) na porta do estilete (3) para apertar o estilete ao IBT. Empurre o êmbolo na sua totalidade na seringa de bloqueio. Anexe a seringa de bloqueio à porta de enchimento (4) no IBT.
2. Puxe o êmbolo da seringa de bloqueio para trás. Gire a haste para a fixar na posição da última ranhura da seringa.
3. Retire a seringa de bloqueio do IBT. Ponha o IBT de lado.
4. Prepare a seringa de enchimento com um meio de contraste de acordo com as instruções de utilização do fabricante da seringa de enchimento.
5. Fixe a porta de conexão do Luer à tubagem flexível da seringa de insuflação à porta de insuflação (4) do IBT. O sistema está agora preparado e pronto a ser utilizado.
UTILIZAÇÃO DO IBT
1. Seleccione a dimensão do IBT com base no local e objectivo de tratamento. A Figura 1 e Tabelas 1.1 e 1.2 definem o diâmetro com enchimento (D) e comprimento com enchimento (L) dos IBTs em água a 37°C com incrementos
no volume do enchimento até ao volume de enchimento máximo.
2. Estas dimensões podem variar durante a utilização do produto devido à variação local na estrutura óssea.
Número do modelo KX103 Dimensões com enchimento
Dimensão 10/3 Volume Diâmetro (máximo de D1, D2) Comprimento (C)
Volume máximo de enchimento 4 cc 2 cc 13,7 mm 16,3 mm
Volume máximo de enchimento 700 psi (48 atm) 4 cc 17,3 mm 21,6 mm
Número do modelo KX153 Dimensões com enchimento
Dimensão 15/3 Volume Diâmetro (máximo de D1, D2) Comprimento (C)
Volume máximo de enchimento 5 cc 2 cc 12,0 mm 19,9 mm
Volume máximo de enchimento 700 psi (48 atm) 4 cc 15,6 mm 25,0 mm
Número do modelo KX203 Dimensões com enchimento
Dimensão 20/3 Volume Diâmetro (máximo de D1, D2) Comprimento (C)
Volume máximo de enchimento 6 cc 2 cc 11,2 mm 23,0 mm
Pressão de enchimento máxima 700 psi (48 atm) 4 cc 14,5 mm 28,1 mm
Número do modelo KE102 Dimensões com enchimento
Dimensão 10/2 Volume Diâmetro (máximo de D1, D2) Comprimento (C)
Volume máximo de enchimento 3 cc 2 cc 12,7 mm 15,6 mm
Volume máxima de enchimento 700 psi (48 atm) 3 cc 15,0 mm 18,7 mm
Número do modelo KE152 Dimensões com enchimento
Dimensão 15/2 Volume Diâmetro (máximo de D1, D2) Comprimento (C)
Volume máximo de enchimento 4 cc 2 cc 11,4 mm 18,9 mm
Pressão de enchimento máxima 700 psi (48 atm) 4 cc 15,3 mm 24,4 mm
Número do modelo KE202 Dimensões com enchimento
Dimensão 20/2 Volume Diâmetro (máximo de D1, D2) Comprimento (C)
Volume máximo de enchimento 5 cc 2 cc 10,9 mm 19,6 mm
Pressão de enchimento máxima 700 psi (48 atm) 4 cc 14,8 mm 25,9 mm
NOTA:
• O enchimento do IBT além do volume de enchimento máximo pode levar à ruptura do balão antes de atingir a pressão de enchimento máxima.
• O enchimento do IBT além da pressão de enchimento máxima pode levar o balão à ruptura antes de atingir o volume de enchimento máximo.
Tabela 2.1 – Dimensões com enchimento do IBT KYPHON Xpander™ II (em água a 37ºC e em Sawbone com 5,0 de pcf de densidade)
Dimensão Volume cc Pressão média psi ( atm) Volume cc Pressão média psi ( atm)
10/3 2 135,9 psi (9,3 atm) 2 295,3 psi (20,1 atm)
15/3 2 128,3 psi (8,7 atm) 2 272,0 psi (18,5 atm)
20/3 2 136,0 psi (9,3 atm) 2 283,2 psi (19,3 atm)
Tabela 1.1 – Dimensões com enchimento do IBT KYPHON Xpander™ II (em água a 37ºC)
5 cc 16,8 mm 27,4 mm
6 cc 16,7 mm 32,6 mm
Tabela 1.2 – Dimensões de enchimento do IBT Kyphon® Express™ II (em água a 37ºC)
5 cc 16,0 mm 28,5 mm
Em água a 37ºC Em Sawbone com 5,0 de pcf
4 129,9 psi (8,8 atm) 4 329,7 psi (22,4 atm)
4 121,4 psi (8,3 atm) 4 313,9 psi (21,4 atm)
5 120,5 psi (8,2 atm) 5 325,6 psi (22,2 atm)
4 130,3 psi (8,9 atm) 4 325,6 psi (22,2 atm)
6 127,4 psi (8,7 atm) 6 342,8 psi (23,3 atm)
Dimensão Volume cc Pressão média psi ( atm) Volume cc Pressão média psi ( atm)
10/2 2 122,9 psi (8,4 atm) 2 332,1 psi (22,6 atm)
15/2 2 118,1 psi (8,0 atm) 2 321,0 psi (21,8 atm)
20/2 2 122,8 psi (8,4 atm) 2 329,0 psi (22,4 atm)
NOTA:
• Os dados de volume e pressão foram determinados com testes in vitro. Devido às diferenças na anatomia do doente e estrutura óssea, os dados não são representativos da utilização clínica.
INSERÇÃO DO IBT
1. É necessário um canal de acesso para a colocação do IBT.
2. Siga as instruções de utilização para as ferramentas de acesso ósseo escolhidas KYPHON® para criar um canal de acesso para o osso. Os IBTs KYPHON Xpander™ II devem apenas ser usados com dispositivos KYPHON® Osteo
Introducer® que tenham uma cânula com conector roxo. Os calcadores de osso insufláveis Kyphon® Express™ II têm de ser usados com dispositivos Kyphon Express™ Osteo Introducer® que contenham a cânula com o conector
roxo.
REMOÇÃO DA MANGA DE INSERÇÃO
1. Sem tirar a manga de inserção do IBT, gire e empurre ligeiramente a manga de inserção no sentido distal e, depois, puxe-a no sentido proximal sobre a haste para expor a extremidade distal do balão. Se a manga de inserção
sair no sentido distal enquanto estiver a empurrar, deslize-a para trás no sentido proximal, sobre a haste. Mantenha sempre a manga de inserção na haste do IBT e fora da cânula durante a intervenção.
NOTA: A extremidade distal do IBT esvaziado atingiu a extremidade distal da cânula quando a cinta de marcador de saída (6) no lúmen externo do IBT entra na extremidade proximal da cânula.
2. Coloque o IBT esvaziado no canal de acesso e posicione-o, sob orientação imagiológica, usando os marcadores radiopacos (8). Um movimento ligeiro de torção com um empurrão para a frente pode ajudar a inserção.
3. Enquanto segura o IBT, encha até 44 psi (3 atm) para fixar a posição do IBT. Retire o estilete (2), se desejado.
ENCHIMENTO DO IBT
1. Insufle o IBT sob orientação contínua da imagem. Use a visão lateral para monitorizar a distância desde o córtex anterior ao posterior. Use a visão AP para monitorizar os córtices laterais.
2. Se não for usada imagiologia contínua, aumente o volume em pequenos incrementos (0,25 - 0,5 cc). Avalie a posição do calcador nas visões laterais e AP antes de prosseguir para um maior aumento do volume.
3. Pare quando for atingido o objectivo de tratamento, ou seja, quando qualquer parte do comprimento com enchimento do IBT entrar em contacto com o osso cortical ou forem atingidos o volume de enchimento máximo e/ou
pressão de enchimento máximo. Consultar tabela 1.1 e 1.2.
REMOÇÃO DO IBT
Para esvaziar, desbloqueie o êmbolo da seringa de insuflação, puxe o êmbolo para trás e fixe. Esvazie de acordo com as instruções de utilização da seringa de insuflação. Retire o IBT do osso através da cânula com um movimento
ligeiro de torção.
Quando retirar o IBT, puxe a manga de inserção para trás, por cima do balão.
1. Se houver resistência, ligue a seringa de bloqueio de 30 ml, puxe o êmbolo da seringa para trás, para a marca de “30 ml” de forma a criar um vácuo e recomece a remoção do IBT.
2. Confirme a entrada do balão do IBT na cânula. Se o balão não se mexer para dentro da cânula, faça avançar a cânula sobre o IBT até ao marcador radiopaco proximal. Depois do avanço da cânula, retire o IBT através da cânula.
Se notar resistência, retire o IBT e a cânula simultaneamente.
ATENÇÃO: Não retire o IBT a não ser que o balão esteja completamente vazio. Nunca retire o IBT quando sentir resistência. Determine a causa da resistência sob fluoroscopia e tome as acções correctivas necessárias.
CONCLUSÃO DO PROCEDIMENTO DE CIFOPLASTIA COM BALÃO
Depois da criação de uma cavidade numa fractura patológica do corpo vertebral, o cimento ósseo KYPHON® pode ser introduzido para preencher a cavidade usando o dispositivo de enchimento ósseo KYPHON® ou o sistema de aplicação
de cimento KYPHON®. Consulte as instruções de utilização do cimento ósseo para o dispositivo de enchimento ósseo KYPHON® ou o sistema de aplicação de cimento KYPHON®.
TÉCNICA DE RESISTÊNCIA DO CIMENTO
Se deixar um IBT cheio dentro do corpo vertebral durante o preenchimento com cimento no lado contralateral, antes da injecção do cimento, assegure que o volume do IBT foi reduzido em 1,0 cc. Recomenda-se que o balão não seja
colocado em contacto com o cimento ósseo durante mais de 5 minutos.
ESTERILIZAÇÃO
Esterilizado com radiação.
APRESENTAÇÃO
Os IBT KYPHON Xpander™ II e Kyphon® Express™ II são fornecidos esterilizados numa embalagem destacável. No caso de danos na embalagem estéril, não use e notifique o fabricante.
MATERIAIS NÃO FORNECIDOS
• Seringa de insuflação Kyphon®
• Seringa de bloqueio
• Meio de contraste
• Tigela pequena
NOTA: A seringa de insuflação Kyphon® com seringa de bloqueio está disponível na Medtronic.
ARMAZENAMENTO
Os IBTs devem ser armazenados na sua embalagem original. Deve ser exercido o cuidado adequado para garantir que os IBTs não são danificados. Armazene num local fresco (máximo de 25 °C /77 °F) e seco.
LIMITAÇÃO DA RESPONSABILIZAÇÃO
A MEDTRONIC NÃO SERÁ RESPONSÁVEL POR QUAISQUER DANOS DIRECTOS, INDIRECTOS, ACIDENTAIS, CONSEQUENTES OU EXEMPLARES RESULTANTES DA REUTILIZAÇÃO DO CALCADOR DE OSSO INSUFLÁVEL XPANDER™ II E DO CALCADOR
DE OSSO INSUFLÁVEL KYPHON® EXPRESS™ II.
EM CASO ALGUM DEVERÁ A MEDTRONIC SER RESPONSABILIZADA POR QUAISQUER DANOS DIRECTOS, INDIRECTOS, ACIDENTAIS, CONSEQUENTES OU EXEMPLARES RESULTANTES DE OU EM LIGAÇÃO AOS CALCADORES DE OSSO INSUFLÁVEIS
KYPHON XPANDER™ II E KYPHON® EXPRESS™ II COM BASE NA VIOLAÇÃO DO CONTRATO (INCLUINDO VIOLAÇÃO DA GARANTIA).
PEDIDOS DE INFORMAÇÃO
Para mais informação, contacte a Medtronic.
Este produto e/ou a sua utilização podem ser protegidos, total ou parcialmente, por uma ou mais das seguintes patentes dos E.U.A.: 5,972,015; 6,607,544; 6,623,505; 6,663,647; 6,979,341. Outras patentes nos E.U.A. e no estrangeiro
estão pendentes.
A Medtronic é uma marca comercial registada da Medtronic Inc.
KYPHON e Osteo Introducer são marcas comerciais registadas de uma empresa afiliada da Medtronic.
KYPHON Xpander é uma marca comercial registada de uma empresa afiliada da Medtronic.
Kyphon Express é uma marca comercial registada de uma empresa afiliada da Medtronic.
© 2013 Medtronic Sofamor Danek USA, Inc. Todos os direitos reservados
LOT
Tabela 2.2 – Dimensões com enchimento do IBT Kyphon® Express™ II (em água a 37ºC ou Sawbone com 5,0 de pcf)
Em água a 37ºC Em Sawbone com 5,0 de pcf
3 103,3 psi (7,0 atm) 3 321,2 psi (21,9 atm)
4 94,4 psi (6,4 atm) 4 317,6 psi (21,6 atm)
4 98,8 psi (6,7 atm) 4 326,7 psi (22,2 atm)
5 95,3 psi (6,5 atm) 5 330,7 psi (22,5 atm)
EXPLANATION OF SYMBOLS
EXPLICATION DES SYMBOLES
EXPLICACIÓN DE LOS SÍMBOLOS
EXPLICAÇÃO DOS SÍMBOLOS
Caution: Federal law (U.S.A.) restricts this device to sale by or on the order of a physician
Attention : la loi fédérale des États-Unis n’autorise la vente de ce dispositif que par un médecin ou sur ordonnance d’un médecin
Precaución: Las leyes federales estadounidenses restringen la venta de este dispositivo a médicos o por prescripción facultativa
Atenção: A Lei Federal (E.U.A.) restringe a venda deste dispositivo a um médico ou mediante prescrição médica
Consult instructions for use
Consulter le mode d’emploi
Consulte las instrucciones de uso
Consultar as instruções de utilização
Do not re-use
Ne pas réutiliser
No reutilizar
Não reutilizar
Use-by date
Utiliser avant le
Fecha de caducidad
Prazo de validade
Batch code
Numéro de code du lot
Número de lote
Código de lote
Catalogue Number
Numéro du catalogue
Número de catálogo
Número de catálogo
2
STERILIZE
Sterilized using irradiation
Stérilisé par rayons
Esterilizado por radiación
Esterilizado por radiação
For U.S. audiences only.
Ne s’applique qu’aux États-Unis.
Solo aplicable en EE. UU.
Apenas aplicável aos E.U.A.
Manufacturer
Fabricant
Fabricante
Fabricante
Do not use if package is damaged
Ne pas utiliser si l’emballage est endommagé
No utilizar si el embalaje está dañado
Não utilizar se a embalagem estiver danificada
Do not resterilize
Ne pas restériliser
No reesterilizar
Não reesterilize
 Loading...
Loading...