Page 1

DLP™
0123
Y-Adapter, Venting
Nástavec „Y“, s odvzdušněním
Y-adapter, udluftning
Y-Adapter, Entlüftung
Προσαρμογέας σχήματος «Υ», εξαερισμού
Adaptador en Y con ventilación
Ilmaa poistava Y-sovitin
Adaptateur en Y, purge
„Y” adapter, leszívószáras
Adattatore a Y con sfiato
“Y”-verloopstuk met ontluchting
Y-kontakt, ventilering
Łącznik typu „Y”, z odpowietrzeniem
Adaptador em Y, ventilação
Y-образный адаптер с отводом
Y-adapter, med ventilation
Y Adaptör, Havalandırmalı
Instructions for Use • Návod k použití • Brugsanvisning • Gebrauchsanweisung • Οδηγίες χρήσης • Instrucciones
de uso • Käyttöohjeet • Mode d'emploi • Használati útmutató • Istruzioni per l'uso • Gebruiksaanwijzing •
Bruksanvisning • Instrukcja użytkowania • Instruções de utilização • Инструкция по эксплуатации •
Bruksanvisning • Kullanım Talimatları
Caution: Federal law (USA) restricts this device to sale by or on the order of a physician.
Page 2

The following list includes trademarks or registered trademarks of Medtronic in the United States and possibly in other countries. All other trademarks are the property
of their respective owners.
Následující seznam uvádí ochranné známky nebo registrované ochranné známky společnosti Medtronic v USA a případně v jiných zemích. Všechny ostatní
ochranné známky jsou majetkem příslušných vlastníků.
Følgende liste indeholder varemærker eller registrerede varemærker tilhørende Medtronic i USA og muligvis i andre lande. Alle andre varemærker tilhører de
respektive ejere.
Die folgende Liste beinhaltet Marken oder eingetragene Marken von Medtronic in den USA und möglicherweise in anderen Ländern. Alle anderen Marken sind
Eigentum ihrer jeweiligen Inhaber.
Ο ακόλουθος κατάλογος περιλαμβάνει εμπορικά σήματα ή σήματα κατατεθέντα της Medtronic στις Ηνωμένες Πολιτείες και πιθανόν σε άλλες χώρες. Όλα τα
άλλα εμπορικά σήματα είναι ιδιοκτησία των αντίστοιχων κατόχων τους.
La siguiente lista incluye marcas comerciales o marcas registradas de Medtronic en los Estados Unidos y posiblemente en otros países. Todas las marcas
comerciales son propiedad de sus propietarios respectivos.
Seuraava luettelo sisältää Medtronic-yhtiön tavaramerkit ja rekisteröidyt tavaramerkit Yhdysvalloissa ja mahdollisesti muissa maissa. Kaikki muut tavaramerkit ovat
niiden omistajien omaisuutta.
La liste suivante inclut des marques commerciales ou des marques déposées de Medtronic aux États-Unis et eventuellement dans d'autres pays. Toutes les autres
marques commerciales sont la propriété de leurs détenteurs respectifs.
Az alábbi lista a Medtronic Egyesült Államokban és valószínűleg más országokban érvényes védjegyeit vagy bejegyzett védjegyeit tartalmazza. Minden egyéb
védjegy a megfelelő tulajdonosok tulajdonát képezi.
L'elenco seguente include marchi di fabbrica o marchi registrati della Medtronic negli Stati Uniti ed eventualmente in altri Paesi. Tutti gli altri marchi di fabbrica sono
di proprietà dei rispettivi proprietari.
In de onderstaande lijst staan de gedeponeerde of geregistreerde handelsmerken van Medtronic in de Verenigde Staten en mogelijk in andere landen. Alle andere
handelsmerken zijn het eigendom van de desbetreffende eigenaar.
Den følgende listen inneholder varemerker eller registrerte varemerker for Medtronic i USA og eventuelt i andre land. Alle andre varemerker tilhører de respektive
eierne.
Poniższa lista zawiera znaki towarowe lub zastrzeżone znaki towarowe firmy Medtronic w Stanach Zjednoczonych i prawdopodobnie w innych krajach. Wszystkie
pozostałe znaki towarowe są własnością ich prawowitych właścicieli.
A lista que se segue inclui marcas comerciais ou marcas comerciais registadas da Medtronic nos EUA e possivelmente noutros países. Todas as outras marcas
comerciais são propriedade dos respetivos detentores.
Следующий список включает товарные знаки или зарегистрированные товарные знаки корпорации Medtronic в США и, возможно, в других странах. Все
другие товарные знаки являются собственностью их владельцев.
Följande lista innehåller varumärken eller registrerade varumärken som tillhör Medtronic i USA och möjligen i andra länder. Alla övriga varumärken tillhör respektive
innehavare.
Aşağıdaki liste Medtronic şirketinin Amerika Birleşik Devletleri'nde ve muhtemelen diğer ülkelerdeki ticari markalarını veya tescilli ticari markalarını içerir. Diğer ticari
markaların tümü ilgili sahiplerinin mülkiyetindedir.
Cortiva, DLP, Medtronic
Page 3

Explanation of symbols on package labeling • Vysvětlení symbolů uvedených na štítcích balení • Forklaring
til symbolerne på emballagens mærkater • Erläuterung der Symbole auf der Verpackung • Επεξήγηση των
συμβόλων στη σήμανση της συσκευασίας • Explicación de los símbolos que aparecen en la
documentación del envase • Pakkausetiketin symbolien selitykset • Explication des symboles des
étiquettes sur l’emballage • A csomag címkéin látható szimbólumok jelentése • Spiegazione dei simboli
presenti sulle etichette della confezione • Verklaring van de symbolen op de verpakkingslabels • Forklaring
av symboler på pakningen • Objaśnienie symboli znajdujących się na etykietach opakowania • Explicação
dos símbolos na documentação da embalagem • Пояснение к символам на этикетках упаковки •
Förklaring av symboler på förpackningsmärkningen • Ambalaj etiketindeki sembollerin açıklamaları
Refer to the outer package label to see which symbols apply to this product. • Symboly, které se vztahují k tomuto
výrobku, naleznete na štítku na vnější straně obalu. • Se mærkaten på den ydre emballage for de symboler, der gælder
for dette produkt. • Welche Symbole für dieses Produkt zutreffen, entnehmen Sie bitte dem Etikett auf der Verpackung.
• Ανατρέξτε στην ετικέτα της εξωτερικής συσκευασίας για να δείτε ποια σύμβολα ισχύουν για το παρόν προϊόν. •
Consulte la etiqueta del envase exterior para comprobar qué símbolos son aplicables a este producto. • Katso
ulkopakkauksen etiketistä, mitkä symbolit koskevat tätä tuotetta. • Se référer à l’étiquette sur l’emballage extérieur
pour savoir quels symboles s’appliquent à ce produit. • A termékre vonatkozó szimbólumok a csomagoláson
találhatók. • Fare riferimento all’etichetta sulla confezione esterna per sapere quali simboli si applicano a questo
prodotto. • Controleer het label op de buitenverpakking om te zien welke symbolen op dit product van toepassing zijn. •
Se på etiketten på den ytre pakningen for å fastslå hvilke symboler som gjelder for dette produktet. • Należy zapoznać
się z etykietą na zewnętrznym opakowaniu, aby określić, które symbole dotyczą niniejszego produktu. • Consultar a
etiqueta exterior da embalagem para ver quais os símbolos que se aplicam a este produto. • См. на этикетке
внешней упаковки, какие символы применимы к данному продукту. • Se etiketten på ytterförpackningen för de
symboler som gäller denna produkt. • Bu üründe hangi sembollerin geçerli olduğunu görmek için dış ambalaj etiketine
başvurun.
Conformité Européenne (European Conformity). This symbol means that the device fully complies
with applicable European Union acts. • Conformité Européenne (Evropská shoda). Tento symbol
znamená, že výrobek zcela splňuje požadavky příslušných zákonů Evropské unie. • Conformité
Européenne (Europæisk Standard). Dette symbol betyder, at enheden fuldt ud overholder gældende
EU-lovgivning. • Conformité Européenne (Europäische Konformität). Dieses Symbol besagt, dass
das Produkt allen anwendbaren Vorschriften der Europäischen Union entspricht. • Conformité
Européenne (Ευρωπαϊκή Συμμόρφωση). Το σύμβολο αυτό σημαίνει ότι το προϊόν συμμορφώνεται
πλήρως με τους ισχύοντες νόμους της Ευρωπαϊκής Ένωσης. • Conformité Européenne
(Conformidad Europea). Este símbolo indica que el dispositivo cumple totalmente las leyes vigentes
de la Unión Europea. • Conformité Européenne (eurooppalainen vaatimustenmukaisuus). Tämä
symboli tarkoittaa, että laite on kaikilta osin Euroopan unionin soveltuvan lainsäädännön mukainen. •
Conformité Européenne. Ce symbole signifie que l’appareil est entièrement conforme aux lois en
vigueur de l’Union européenne. • Conformité Européenne (európai megfelelőség). Ez a szimbólum
azt jelenti, hogy az eszköz teljes mértékben megfelel az Európai Unió vonatkozó jogszabályainak. •
Conformité Européenne (Conformità europea). Questo simbolo indica che il dispositivo è
pienamente conforme alle direttive europee in vigore. • Conformité Européenne (Europese
Conformiteit). Dit symbool betekent dat het product volledig voldoet aan de geldende Europese
wetgeving. • Conformité Européenne (samsvar med europeisk standard). Dette symbolet betyr at
enheten er fullstendig i samsvar med gjeldende EU-rettsakter. • Conformité Européenne (Zgodność
z normami Unii Europejskiej). Ten symbol oznacza, że urządzenie spełnia wszystkie wymogi
wynikające z właściwych aktów prawnych Unii Europejskiej. • Conformité Européenne
(Conformidade Europeia). Este símbolo significa que o dispositivo está em total conformidade com
as leis da União Europeia aplicáveis. • Conformité Européenne (Европейское соответствие). Этот
символ обозначает, что устройство полностью соответствует требованиям применимых
директив Европейского Союза. • Conformité Européenne (Europeisk standard). Denna symbol
anger att enheten uppfyller alla gällande direktiv i Europeiska unionen. • Conformité Européenne
(Avrupa Normlarına Uygunluk). Bu sembol, cihazın yürürlükteki Avrupa Birliği yasalarına tam olarak
uygun olduğunu ifade eder.
Nonpyrogenic • Nepyrogenní • Ikke-pyrogen • Pyrogenfrei • Μη πυρετογόνο • Apirógeno •
Pyrogeeniton • Apyrogène • Nem pirogén • Apirogeno • Niet-pyrogeen • Pyrogenfri • Produkt
niepirogenny • Não pirogénico • Апирогенно • Icke-pyrogen • Pirojenik Değildir
Sterilized using ethylene oxide • Sterilizováno ethylenoxidem • Steriliseret med etylenoxid • Mit
Ethylenoxid sterilisiert • Αποστειρωμένο με αιθυλενοξείδιο • Esterilizado mediante óxido de etileno •
Steriloitu etyleenioksidilla • Stérilisé à l’oxyde d’éthylène • Etilén-oxiddal sterilizálva • Sterilizzato a
ossido di etilene • Gesteriliseerd met ethyleenoxide • Sterilisert med etylenoksid • Sterylizowany
tlenkiem etylenu • Esterilizado utilizando óxido de etileno • Стерилизовано этиленоксидом •
Steriliserad med etylenoxid • Etilen oksit ile sterilize edilmiştir
Do not reuse • Nepoužívejte opakovaně • Må ikke genbruges • Nicht wiederverwenden • Μην
επαναχρησιμοποιείτε • No reutilizar • Älä käytä uudelleen • Ne pas réutiliser • Kizárólag egyszeri
használatra • Non riutilizzare • Niet opnieuw gebruiken • Skal ikke brukes flere ganger • Nie stosować
ponownie • Não reutilizável • Не использовать повторно • Får inte återanvändas • Yeniden
kullanmayın
3
Page 4

Use-by date • Datum použitelnosti • Kan anvendes til og med • Verwendbar bis • Ημερομηνία «Χρήση
έως» • Fecha de caducidad • Viimeinen käyttöpäivämäärä • Date de péremption • Lejárati idő •
Utilizzare entro • Uiterste gebruiksdatum • Siste forbruksdag • Termin przydatności do użycia • Utilizar
antes da data • Срок годности • Utgångsdatum • Son kullanma tarihi
Do not use if package is damaged • Nepoužívejte, je-li obal poškozený • Må ikke anvendes, hvis
emballagen er beskadiget • Nicht verwenden, wenn die Verpackung beschädigt ist • Μην το
χρησιμοποιείτε εάν η συσκευασία έχει υποστεί ζημία • No utilizar si el envase está dañado • Älä
käytä, jos pakkaus on vaurioitunut • Ne pas utiliser si l’emballage est endommagé • Ne használja fel,
ha a csomagolás sérült • Non utilizzare se l’imballaggio non è integro • Niet gebruiken als de
verpakking beschadigd is • Skal ikke brukes hvis pakningen er skadet • Nie stosować, jeśli
opakowanie jest uszkodzone • Não utilizar se a embalagem estiver danificada • Не использовать,
если упаковка повреждена • Får ej användas om förpackningen är skadad • Ambalaj hasarlıysa
kullanmayın
Do not resterilize • Neprovádějte resterilizaci • Må ikke resteriliseres • Nicht resterilisieren • Μην
επαναποστειρώνετε • No reesterilizar • Älä steriloi uudelleen • Ne pas restériliser • Nem
újrasterilizálható • Non risterilizzare • Niet opnieuw steriliseren • Skal ikke resteriliseres • Nie
sterylizować ponownie • Não reesterilizar • Не стерилизовать повторно • Får inte omsteriliseras •
Yeniden sterilize etmeyin
Lot number • Číslo šarže • Partinummer • Chargennummer • Αριθμός παρτίδας • Número de lote •
Eränumero • Numéro de lot • Tételszám • Numero di lotto • Partijnummer • Lotnummer • Numer partii
produkcyjnej • Número de lote • Номер партии • Partinummer • Lot numarası
Quantity • Množství • Antal • Menge • Ποσότητα • Cantidad • Määrä • Quantité • Mennyiség • Quantità
• Aantal • Antall • Ilość • Quantidade • Количество • Antal • Miktar
Consult instructions for use • Viz návod k použití • Se brugsanvisningen • Gebrauchsanweisung lesen
• Συμβουλευτείτε τις οδηγίες χρήσης • Consultar instrucciones de uso • Katso käyttöohjeet •
Consulter le mode d’emploi • Lásd a használati útmutatót • Consultare le istruzioni per l’uso • Zie
gebruiksaanwijzing • Se i bruksanvisningen • Należy zapoznać się z instrukcją użytkowania •
Consultar as instruções de utilização • См. инструкцию по эксплуатации • Läs bruksanvisningen •
Kullanım talimatlarına bakın
For US audiences only • Pouze pro uživatele z USA • Gælder kun i USA • Gilt nur für Leser in den USA •
Μόνο για πελάτες εντός των ΗΠΑ • Solo aplicable en EE. UU. • Koskee vain Yhdysvaltoja • Ne
s’applique qu’aux États-Unis • Csak egyesült államokbeli felhasználóknak • Esclusivamente per il
mercato statunitense • Alleen van toepassing voor de VS • Gjelder kun USA • Dotyczy tylko odbiorców
w Stanach Zjednoczonych • Aplicável apenas aos EUA • Только для США • Gäller endast i USA •
Yalnızca ABD’deki kullanıcılar için
Transit temperature limit • Mezní hodnoty teploty při přepravě • Temperaturgrænse under transport •
Grenzwerte Transporttemperatur • Όριο θερμοκρασίας μεταφοράς • Límite de temperatura de
transporte • Kuljetuslämpötilaraja • Limite de température de transport • Szállítási hőmérséklet
határértéke • Limite della temperatura di trasporto • Bereik transporttemperatuur • Temperaturgrense,
forsendelse • Dopuszczalna temperatura transportu • Limite da temperatura de transporte •
Диапазон температуры транспортировки • Temperaturgräns vid transport • Nakliyat sıcaklığı sınırı
Catalog number • Katalogové číslo • Katalognummer • Katalognummer • Αριθμός καταλόγου •
Número de catálogo • Luettelonumero • Numéro de référence • Katalógusszám • Numero di catalogo
• Catalogusnummer • Artikkelnummer • Numer katalogowy • Número de catálogo • Номер по
каталогу • Katalognummer • Katalog numarası
Date of manufacture • Datum výroby • Fabrikationsdato • Herstellungsdatum • Ημερομηνία
κατασκευής • Fecha de fabricación • Valmistuspäivämäärä • Date de fabrication • Gyártás ideje • Data
di fabbricazione • Productiedatum • Produksjonsdato • Data produkcji • Data de fabrico • Дата
изготовления • Tillverkningsdatum • Üretim tarihi
Manufacturer • Výrobce • Fabrikant • Hersteller • Κατασκευαστής • Fabricante • Valmistaja • Fabricant
• Gyártó • Fabbricante • Fabrikant • Produsent • Producent • Fabricante • Производитель • Tillverkare
• Üretici
Contains di(2-ethylhexyl)phthalate (DEHP) • Obsahuje di(2-ethylhexyl) ftalát (DEHP) • Indeholder
di(2-ethylhexyl)phthalat (DEHP) • Enthält Bis(2-ethylhexyl)phthalat (DEHP) • Περιέχει φθαλικό
δισ(2-αιθυλεξυλ)εστέρα (DEHP) • Contiene di(2-etilhexil)ftalato (DEHP) • Sisältää
di(2-etyyliheksyyli)ftalaattia (DEHP) • Contient du di(2-éthylhexyl)phtalate (DEHP) •
Di-(2-etilhexil)-ftalátot (DEHP) tartalmaz • Contiene di-2-etilesilftalato (DEHP) • Bevat
di(2-ethylhexyl)ftalaat (DEHP) • Inneholder di(2-etylheksyl)ftalat (DEHP) • Zawiera ftalan
di(2-etyloheksylu) (DEHP) • Contém ftalato de bis(2-etil-hexilo) (DEHP) • Содержит
ди(2-этилгексил)фталат (DEHP) • Innehåller di(2-etylhexyl)ftalat (DEHP) • Di(2-etilhekzil)ftalat
(DEHP) içerir
Authorized representative in the European Community • Autorizovaný zástupce pro Evropské
společenství • Autoriseret repræsentant i EU • Autorisierter Repräsentant in der Europäischen
Gemeinschaft • Εξουσιοδοτημένος αντιπρόσωπος στην Ευρωπαϊκή Κοινότητα • Representante
4
Page 5

autorizado en la Comunidad Europea • Valtuutettu edustaja Euroopan yhteisön alueella •
Représentant autorisé dans la Communauté européenne • Hivatalos képviselet az Európai
Közösségben • Rappresentante autorizzato nella Comunità europea • Geautoriseerd
vertegenwoordiger in de Europese Gemeenschap • Autorisert representant i Det europeiske
fellesskap • Autoryzowany przedstawiciel w Unii Europejskiej • Representante autorizado na
Comunidade Europeia • Уполномоченный представитель в Европейском сообществе •
Auktoriserad representant inom EG • Avrupa Topluluğu’ndaki yetkili temsilci
5
Page 6
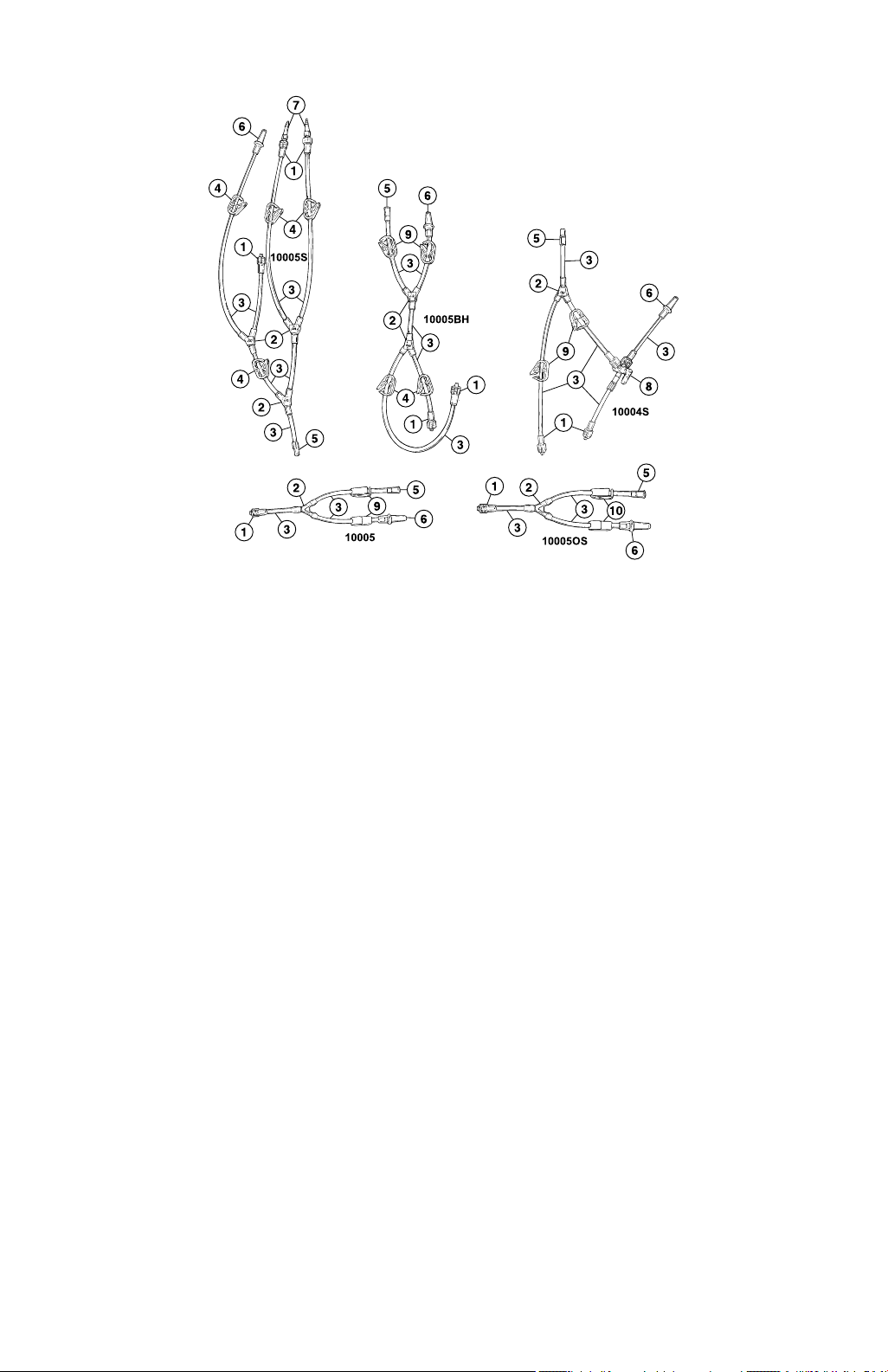
Figure 1. • Obrázek 1. • Figur 1. • Abbildung 1. • Εικόνα 1. • Figura 1. • Kuva 1. • Figure 1. • 1. ábra • Figura 1. •
Afbeelding 1. • Figur 1. • Rycina 1. • Figura 1. • Рисунок 1. • Figur 1. • Şekil 1.
EN
CS
DA
DE
EL
ES
1 Locking male luer fitting
2 “Y” connector
3 Flexible tubing
4 White clamp
5 Locking female luer fitting
1 Uzamykací konektor se samčí koncovkou Luer
2 Konektor „Y“
3 Pružná hadička
4 Bílá svorka
5 Uzamykací konektor se samičí koncovkou Luer
1 Låsende han-luerfitting
2 "Y"-stik
3 Bøjelig slange
4 Hvid klemme
5 Låsende hun-luerfitting
1 Luer-Lock-Anschluss (männlich)
2 „Y“-Konnektor
3 Flexibler Schlauch
4 Weiße Klemme
5 Luer-Lock-Anschluss (weiblich)
1 Αρσενικός σύνδεσμος ασφάλισης luer
2 Σύνδεσμος σχήματος Υ
3 Εύκαμπτη σωλήνωση
4 Λευκός σφιγκτήρας
5 Θηλυκός σύνδεσμος ασφάλισης luer
1 Conector de bloqueo luer macho
2 Conector en "Y"
3 Tubo flexible
4 Pinza blanca
5 Conector de bloqueo luer hembra
6 0.64 cm (0.25 in) slip connector
7 Vein graft cannulae
8 Stopcock
9 Color-coded clamp
10 Color-coded arrow clamp
6 Nasunovací konektor 0,64 cm (0,25 in)
7 Kanyly žilního štěpu
8 Uzavírací kohout
9 Svorka označená barvou
10 Svorka s tlačnou pružinou označená barvou
6 0,64 cm (0,25 in) slip-konnektor
7 Venegraftkanyle
8 Stophane
9 Farvekodet klemme
10 Klemme med farvekodet pil
6 0,64 cm (0,25 in) Steckanschluss
7 Kanülen für Venentransplantate
8 Absperrhahn
9 Farbkodierte Klemme
10 Farbkodierte Pfeilklemme
6 Συρόμενος σύνδεσμος 0,64 cm (0,25 in)
7 Κάνουλες φλεβικού μοσχεύματος
8 Στρόφιγγα
9 Χρωματικά κωδικοποιημένος σφιγκτήρας
10 Σφιγκτήρας με χρωματικά κωδικοποιημένα βέλη
6 Conector a presión de 0,64 cm (0,25 in)
7 Cánulas para injerto venoso
8 Llave de paso
9 Pinzas codificadas por colores
10 Pinzas con flechas codificadas por colores
6
Page 7

FI
FR
HU
IT
NL
NO
PL
PT-PT
RU
SV
TR
1 Luer lock -urosliitin
2 Y-liitin
3 Joustava letku
4 Valkoinen puristin
5 Luer lock -naarasliitin
1 Verrouillage luer mâle
2 Connecteur en Y
3 Tubulure flexible
4 Clamp blanc
5 Verrouillage luer femelle
1 Menetes apaluer-csatlakozó
2 „Y” csatlakozó
3 Hajlékony cső
4 Fehér leszorító
5 Menetes anyaluer-csatlakozó
1 Raccordo luer lock maschio
2 Connettore a Y
3 Tubo flessibile
4 Clamp bianco
5 Raccordo luer lock femmina
1 Afsluitbare mannelijke luerfitting
2 “Y”-connector
3 Flexibele slang
4 Witte klem
5 Afsluitbare vrouwelijke luerfitting
1 Låsbar hannluerkobling
2 Y-kobling
3 Fleksibel slange
4 Hvit klemme
5 Låsbar hunnluerkobling
1 Męskie złącze typu luer lock
2 Konektor typu „Y”
3 Elastyczny dren
4 Biały zacisk
5 Żeńskie złącze typu luer lock
1 Encaixe de bloqueio Luer macho
2 Conector em “Y”
3 Tubo flexível
4 Pinça branca
5 Encaixe de bloqueio Luer fêmea
1 Охватываемый винтовой люэровский разъем
2 Y-образный соединитель
3 Гибкая трубка
4 Белый зажим
5 Охватывающий винтовой люэровский разъем
6 Конусный коннектор диаметром 0,64 cm
(0,25 in)
1 Koppling med hanluerlås
2 ”Y”-koppling
3 Mjuk slang
4 Vit klämma
5 Koppling med honluerlås
1 Kilitli erkek luer bağlantısı
2 “Y” konektörü
3 Esnek boru
4 Beyaz klemp
5 Kilitli dişi luer bağlantısı
6 0,64 cm:n (0,25 in) liukuliitin
7 Laskimosiirrekanyylit
8 Sulkuhana
9 Värillinen puristin
10 Puristin, jossa on värillinen nuoli
6 Connecteur à glissement de 0,64 cm (0,25 in)
7 Canules de prothèse veineuse
8 Robinet d’arrêt
9 Clamp de couleur
10 Clamp à flèche de couleur
6 0,64 cm-es (0,25 ines) egyszerű csatlakozó
7 Vénás grafthoz vezető kanülök
8 Zárócsap
9 Színkódolt leszorító
10 Színkódolt nyíllal jelölt leszorító
6 Connettore a innesto rapido da 0,64 cm (0,25 in)
7 Cannule per innesto venoso
8 Rubinetto
9 Clamp codificato a colori
10 Clamp con frecce codificate a colori
6 Schuifconnector van 0,64 cm (0,25 in)
7 Canules voor veneuze grafts
8 Driewegkraan
9 Klem met kleurcode
10 Klem met kleurgecodeerde pijl
6 0,64 cm (0,25 in)-glidekobling
7 Venegraftkanyle
8 Stoppekran
9 Fargekodet klemme
10 Klemme med fargekodet pil
6 Wsuwany konektor 0,64 cm (0,25 in (cala))
7 Kaniule do pomostowania żylnego
8 Kurek zamykający
9 Zacisk oznaczony kolorem
10 Zacisk ze strzałką oznaczoną kolorem
6 Conector de encaixe de 0,64 cm (0,25 in [pol.])
7 Cânulas de enxertos de veias
8 Torneira de passagem
9 Pinça codificada por cor
10 Seta de pinça codificada por cor
7 Канюля венозного трансплантата
8 Запорный кран
9 Зажим с цветной маркировкой
10 Зажим с цветной маркировкой и стрелкой
6 0,64 cm (0,25 in) glidanslutning
7 Vengraftkanyl
8 Avstängningskran
9 Färgkodad klämma
10 Färgkodad pilklämma
6 0,64 cm (0,25 in) kaymalı konektör
7 Damar grefti kanülleri
8 Vana
9 Renk kodlu kelepçe
10 Renk kodlu ok kelepçe
7
Page 8

1 Product description
Model 10004S is a “Y” adapter with the addition of a 3-way stopcock on the short leg to toggle between cardioplegia
and venting. The inlet begins with a locking female luer fitting. The venting leg terminates in a slip connector. Both
perfusion legs terminate with locking male luer fittings.
Models 10005 and 10005OS have a short leg that terminates with a locking male luer fitting. One of the outlet legs
terminates with a slip connector that connects to a 0.48 cm (0.19 in) to 0.64 cm (0.25 in) ID vent line. The other leg
terminates with a locking female luer fitting to connect with the locking male luer fitting from the administration set. Flow
direction is controlled by color-coded clamps on Model 10005 and clamps with color-coded arrows on
Model 10005OS.
Model 10005BH is a double “Y” configuration that terminates in 2 locking male luer fittings on one side and a slip
connector and locking female luer fitting on the other side.
Model 10005S is a 4-legged perfusion adapter. The inlet begins with a locking female luer fitting attached to the
tubing. Through a series of “Y” connectors, the adapter splits into 4 legs, 2 of which terminate with soft silicone vein
graft cannulae. The third leg terminates with a locking male luer fitting, and the fourth terminates with a slip connector
used to vent the system.
These instructions for use apply to both uncoated cannulae and cannulae coated with Cortiva™ bioactive surface.
Cannulae coated with Cortiva bioactive surface include a “CB” prefix in the model number. For more information
regarding Cortiva bioactive surface, see the insert “Information for Products with Cortiva BioActive Surface.”
This product is sterile, nonpyrogenic, and intended for single use only. Store the product at room temperature.
Maximum transit temperature: uncoated 50°C (122°F), Cortiva-coated 40°C (104°F).
2 Indications for use
This adapter is intended for use in conjunction with cardiopulmonary bypass surgery.
3 Contraindications
Use only as directed.
4 Precautions
Proper surgical procedures and techniques are the responsibility of the medical professional. The described
procedure is furnished for informational purposes only. Surgeons must evaluate the appropriateness of the procedure
based on their own medical training and experience and the type of delivery and suction systems selected for the
procedure.
This device was designed for single patient use only. Do not reuse, reprocess, or resterilize this product. Reuse,
reprocessing, or resterilization may compromise the structural integrity of the device or create a risk of contamination
of the device, which could result in patient injury, illness, or death.
Applicable to products with phthalates identified on the product label: This product contains phthalates.
Dispose of the product according to hospital policy.
5 Adverse effects
The following known adverse effects are associated with the use of the product: coagulopathy, excessive blood
component activation or thrombogenicity, hemolysis, hypotension, infection, ischemia, neurological dysfunction, and
organ dysfunction.
6 Instructions for use
1. Inspect the package and product for damage and check the use-by date. If undamaged and unexpired, open the
package and transfer the product onto the sterile field using aseptic technique.
2. Connect the slip connector to the vent line and the locking female luer fitting to the administration set.
3. Prime all tubing (and the vein graft cannulae for Model 10005S) with cardioplegia fluid.
4. To connect the tubing to the cardioplegia cannula, allow the cardioplegia fluid to drip from the end and connect
the locking male luer fitting to the inlet fitting of the preprimed cannula.
5. Model 10005S: To connect the vein graft cannula to the bypass graft, first prime the graft retrogradely taking care
to expel all of the air. Open the clamp and allow the cardioplegia fluid to drip from the end of the vein graft cannula.
Insert the cannula loosely into the graft. Stop the retrograde flow. Carefully and firmly insert the vein graft cannula
into the graft. While holding the cannula in place, perfuse the graft antegradely.
6. At the completion of the procedure, dispose of the product according to hospital policy.
7 Disclaimer of warranty (global)
Important: This disclaimer of warranty does not apply in Australia.
8English
Page 9

ALTHOUGH THE PRODUCT HAS BEEN DESIGNED, MANUFACTURED, AND TESTED UNDER CAREFULLY
CONTROLLED CONDITIONS PRIOR TO SALE, THE PRODUCT MAY FAIL TO PERFORM ITS INTENDED
FUNCTION FOR A VARIETY OF REASONS. MEDTRONIC HAS NO CONTROL OVER THE CONDITIONS UNDER
WHICH THIS PRODUCT IS USED. THE WARNINGS CONTAINED IN THE PRODUCT LABELING PROVIDE
MORE DETAILED INFORMATION AND ARE CONSIDERED AN INTEGRAL PART OF THIS DISCLAIMER OF
WARRANTY. MEDTRONIC, THEREFORE, DISCLAIMS ALL WARRANTIES, BOTH EXPRESS AND IMPLIED,
WITH RESPECT TO THE PRODUCT, INCLUDING, BUT NOT LIMITED TO, ANY IMPLIED WARRANTY OF
MERCHANTABILITY OR FITNESS FOR A PARTICULAR PURPOSE. MEDTRONIC SHALL NOT BE LIABLE TO
ANY PERSON OR ENTITY FOR ANY MEDICAL EXPENSES OR ANY DIRECT, INCIDENTAL, OR
CONSEQUENTIAL DAMAGES CAUSED BY ANY USE, DEFECT, FAILURE, OR MALFUNCTION OF THE
PRODUCT, WHETHER THE CLAIM IS BASED UPON WARRANTY, CONTRACT, TORT, OR OTHERWISE.
EXCEPT AS OTHERWISE AGREED TO IN WRITING BY AUTHORIZED MEDTRONIC PERSONNEL, NO
PERSON HAS ANY AUTHORITY TO BIND MEDTRONIC TO ANY REPRESENTATION OR WARRANTY WITH
RESPECT TO THE PRODUCT.
The exclusions and limitations set out above are not intended to, and should not be construed so as to, contravene
mandatory provisions of applicable law. If any part or term of this Disclaimer of Warranty is held by any court of
competent jurisdiction to be illegal, unenforceable, or in conflict with applicable law, the validity of the remaining
portions of this Disclaimer of Warranty shall not be affected, and all rights and obligations shall be construed and
enforced as if this Disclaimer of Warranty did not contain the particular part or term held to be invalid.
9 English
Page 10

1 Popis výrobku
Model 10004S je nástavec „Y“ s 3cestným uzavíracím kohoutem na krátkém rameni pro přepínání mezi kardioplegií
a odvzdušněním. Vstup začíná uzamykacím konektorem se samičí koncovkou Luer. Odvzdušňovací rameno je
zakončeno nasunovacím konektorem. Obě perfuzní ramena jsou zakončena konektory s uzamykacími samčími
koncovkami Luer.
Modely 10005 a 10005OS mají krátké rameno, které je zakončeno konektorem s uzamykací samčí koncovkou Luer.
Jedno z výstupních ramen je zakončeno nasunovacím konektorem, který je připojen k odvzdušňovací hadičce
o vnitřním průměru 0,48 cm (0,19 in) až 0,64 cm (0,25 in). Další rameno je zakončeno uzamykacím konektorem
se samičí koncovkou Luer pro připojení ke konektoru se samčí koncovkou Luer ze sady pro podávání. Směr toku na
modelu 10005 je regulován barevně odlišenými svorkami a na modelu 10005OS svorkami s barevnými šipkami.
Model 10005BH má dvojitou konfiguraci „Y“, která je zakončena 2 uzamykacími konektory se samčí koncovkou Luer
na jedné straně a nasunovacím konektorem s uzamykacím konektorem se samičí koncovkou Luer na druhé straně.
Model 10005S je 4ramenný perfuzní nástavec. Vstup začíná uzamykacím konektorem se samičí koncovkou Luer
připojenou k hadičce. Pomocí řady konektorů „Y“ se nástavec dělí do 4 ramen, z nichž jsou 2 zakončena měkkými
silikonovými kanylami pro žilní štěpy. Třetí rameno je zakončeno uzamykacím konektorem se samčí koncovkou Luer
a čtvrté je zakončeno nasunovacím konektorem používaným k odvzdušnění systému.
Tyto pokyny k použití se vztahují na nepotažené kanyly i na kanyly potažené bioaktivním povrchem Cortiva™. Kanyly
potažené bioaktivním povrchem Cortiva jsou označeny předponou „CB“ v čísle modelu. Další informace o bioaktivním
povrchu Cortiva uvádí příloha „Informace týkající se výrobků s bioaktivním povrchem Cortiva“.
Tento výrobek je sterilní, nepyrogenní a určen pouze k jednorázovému použití. Výrobek skladujte při pokojové teplotě.
Maximální teplota při přepravě: bez potahu 50°C (122°F), potaženo bioaktivním povrchem Cortiva 40°C (104°F).
2 Indikace k použití
Tento nástavec je určen pro použití při chirurgickém zákroku s mimotělním oběhem.
3 Kontraindikace
Používejte pouze v souladu s pokyny.
4 Zvláštní upozornění
Za použití správných chirurgických postupů a technik zodpovídá odborný lékař. Popsaný postup slouží pouze
k informačním účelům. Chirurgové musí vždy vyhodnotit vhodnost postupu na základě vlastního lékařského vzdělání
a zkušeností a typu přívodního a sacího systému vybraného pro zákrok.
Tento výrobek je určen pouze k jednorázovému použití u jednoho pacienta. Nepoužívejte výrobek opakovaně ani
neprovádějte jeho renovaci nebo resterilizaci. Opakované používání, renovace nebo resterilizace mohou ohrozit
strukturální integritu výrobku nebo způsobit riziko jeho kontaminace, což by mohlo mít za následek poranění,
onemocnění nebo smrt pacienta.
Platí pro výrobky obsahující ftaláty identifikované na štítku výrobku: Tento výrobek obsahuje ftaláty.
Zlikvidujte výrobek podle předpisů příslušného zdravotnického zařízení.
5 Nežádoucí účinky
S použitím tohoto výrobku jsou spojeny následující známé nežádoucí účinky: koagulopatie, nadměrná aktivace
krevních komponent nebo trombogenicita, hemolýza, hypotenze, infekce, ischémie, neurologická dysfunkce a
orgánová dysfunkce.
6 Návod k použití
1. Zkontrolujte datum použitelnosti a zda balení a výrobek nejsou poškozeny. Jestliže jsou nepoškozeny a výrobek
není prošlý, otevřete obal a přeneste výrobek aseptickou technikou do sterilního pole.
2. Připojte nasunovací konektor k odvzdušňovací hadičce a uzamykací konektor se samičí koncovkou Luer k sadě
pro podávání.
3. Naplňte všechny hadičky (a kanyly pro žilní štěpy u modelu 10005S) kardioplegickým roztokem.
4. Aby bylo možno připojit hadičku ke kardioplegické kanyle, nechte kardioplegický roztok odkapat z konce a
připojte konektor se samčí koncovkou Luer ke vstupnímu konektoru naplněné kanyly.
5. Model 10005S: Kanylu pro žilní štěp připojíte k bypassu štěpem tak, že nejprve retrográdně naplníte štěp. Přitom
dávejte pozor na to, abyste vytlačili všechen vzduch. Otevřete svorku a nechte kardioplegický roztok odkapávat
z konce kanyly pro žilní štěp. Do štěpu volně zaveďte kanylu. Zastavte zpětný tok. Pečlivě a pevně zaveďte do
štěpu kanylu pro žilní štěp. Držte kanylu na místě a přitom antegrádně promyjte štěp.
6. Po dokončení výkonu výrobek zlikvidujte podle předpisů příslušného zdravotnického zařízení.
10Česky
Page 11

7 Odmítnutí záruk (globální)
Důležité: Toto odmítnutí záruky se nevztahuje na Austrálii.
AČKOLI BYL VÝROBEK NAVRŽEN, VYROBEN A PŘED PRODEJEM TESTOVÁN ZA PEČLIVĚ
KONTROLOVANÝCH PODMÍNEK, JE MOŽNÉ, ŽE U VÝROBKU Z RŮZNÝCH DŮVODŮ SELŽE JEHO
ZAMÝŠLENÁ FUNKCE. SPOLEČNOST MEDTRONIC NEMÁ ŽÁDNOU KONTROLU NAD PODMÍNKAMI, VE
KTERÝCH SE VÝROBEK POUŽÍVÁ. VAROVÁNÍ UVEDENÁ V DOKUMENTACI K VÝROBKU POSKYTUJÍ
PODROBNĚJŠÍ INFORMACE A JSOU POVAŽOVÁNA ZA NEDÍLNOU SOUČÁST TOHOTO ODMÍTNUTÍ ZÁRUK.
SPOLEČNOST MEDTRONIC PROTO ODMÍTÁ ODPOVĚDNOST ZA JAKÉKOLI ZÁRUKY ZA TENTO VÝROBEK,
AŤ UŽ PŘÍMÉ NEBO PŘEDPOKLÁDANÉ, MIMO JINÉ VČETNĚ JAKÝCHKOLI PŘEDPOKLÁDANÝCH ZÁRUK
PRODEJNOSTI NEBO VHODNOSTI K URČITÉMU ÚČELU. SPOLEČNOST MEDTRONIC NEODPOVÍDÁ
ŽÁDNÉ OSOBĚ ANI PRÁVNÍMU SUBJEKTU ZA JAKÉKOLI ZDRAVOTNÍ VÝDAJE NEBO PŘÍMÉ, NÁHODNÉ ČI
NÁSLEDNÉ ŠKODY ZPŮSOBENÉ POUŽITÍM, VADOU, SELHÁNÍM NEBO CHYBNOU FUNKCÍ VÝROBKU, BEZ
OHLEDU NA TO, ZDA NÁROK VYPLÝVÁ ZE ZÁRUKY, SMLOUVY, PROTIPRÁVNÍHO ČINU ČI Z JINÉHO
DŮVODU. POKUD NENÍ AUTORIZOVANÝMI PRACOVNÍKY SPOLEČNOSTI MEDTRONIC PÍSEMNĚ
SCHVÁLENO JINAK, ŽÁDNÁ OSOBA NENÍ OPRÁVNĚNA ZAVAZOVAT SPOLEČNOST MEDTRONIC
K JAKÝMKOLI PROHLÁŠENÍM NEBO ZÁRUKÁM TÝKAJÍCÍM SE TOHOTO VÝROBKU.
Výjimky a omezení zde uvedená nejsou zamýšlena a nemají být v rozporu s platným ustanovením rozhodného práva.
Pokud bude kterákoli část nebo podmínka tohoto odmítnutí záruk shledána příslušným soudem jako protiprávní,
nevynutitelná nebo v rozporu s příslušnými právními předpisy, nemá to vliv na platnost zbývající části tohoto odmítnutí
záruk a všechna práva a závazky budou chápány a uplatněny tak, jako by toto odmítnutí záruk neobsahovalo tuto
konkrétní část nebo podmínku, která byla shledána neplatnou.
11 Česky
Page 12

1 Produktbeskrivelse
Model 10004S er en “Y”-adapter, hvor der er tilføjet en 3-vejs stophane på den korte arm til at skifte mellem kardioplegi
og udluftning. Indløbet starter med en låsende hun-luerfitting. Udluftningsarmen ender i en slip-konnektor. Begge
perfusionsarme ender i låsende han-luerfittings.
Model 10005 og 10005OS er forsynet med en kort arm, som ender i en låsende han-luerfitting. Den ene af
udløbsarmene ender i en slip-konnektor, som er forbundet til en udluftningsslange med en indvendig diameter på
0,48 cm (0,19 in) til 0,64 cm (0,25 in). Den anden arm ender i en låsende hun-luerfitting, der kan forbindes med den
låsende han-luerfitting fra infusionssættet. Flowretningen styres med farvekodede klemmer på model 10005 og med
klemmer med farvekodede pile på model 10005OS.
Model 10005BH er en dobbelt “Y”-konfiguration, som ender i 2 låsende han-luerfittings på den ene side og en
slip-konnektor og låsende hun-luerfitting på den anden side.
Model 10005S er en 4-armet perfusionsadapter. Indløbet starter med en låsende hun-luerfitting, der er forbundet til
slangen. Via en række "Y"-konnektorer deler adapteren sig i 4 arme, hvoraf de 2 ender i venegraftkanyler af blød
silikone. Den tredje arm ender i en låsende hun-luerfitting, og den fjerde ender i en slip-konnektor, der anvendes til at
udlufte systemet.
Denne brugsanvisning gælder både kanyler uden belægning og kanyler belagt med Cortiva™ bioactive-overflade.
Kanyler, der er belagt med Cortiva bioactive-overflade, har et “CB” præfix i modelnummeret. Se flere oplysninger
vedrørende Cortiva bioactive-overflade i indlægget “Oplysninger vedrørende produkter med Cortiva
BioActive-overflade”.
Dette produkt er sterilt og ikke-pyrogent og er kun beregnet til engangsbrug. Produktet skal opbevares ved
stuetemperatur. Maksimal temperatur under transport: uden belægning 50°C (122°F), belagt med Cortiva 40°C
(104°F).
2 Indikationer for brug
Denne adapter er beregnet til brug i forbindelse med kardiopulmonal bypass-kirurgi.
3 Kontraindikationer
Må kun anvendes i henhold til anvisningerne.
4 Forholdsregler
Korrekte operationsprocedurer og -teknikker er lægens ansvar. Den beskrevne procedure er kun vejledende.
Kirurgerne skal vurdere procedurens egnethed på baggrund af egen uddannelse og egne erfaringer samt typen af de
indgivelses- og sugesystemer, der er valgt til proceduren.
Enheden må kun anvendes på én patient. Dette produkt må ikke genanvendes, genbehandles eller resteriliseres.
Genbrug, genbehandling eller resterilisering kan forringe enhedens strukturelle integritet eller skabe risiko for
kontaminering af enheden, hvilket kan føre til personskade, sygdom eller dødsfald.
Gælder for produkter, hvor phthalater er angivet på produktets etiket: Dette produkt indeholder phthalater.
Bortskaf produktet i overensstemmelse med hospitalets retningslinjer.
5 Bivirkninger
Følgende kendte bivirkninger er forbundet med brugen af produktet: koagulopati, overdreven aktivering af
blodkomponenter eller trombogenicitet, hæmolyse, hypotension, infektion, iskæmi, neurologisk dysfunktion og
organdysfunktion.
6 Brugsanvisning
1. Efterse emballagen og dens indhold for skader, og kontrollér datoen for seneste anvendelse. Hvis emballagen er
ubeskadiget, og produktet ikke er udløbet, åbnes emballagen, og produktet overføres til det sterile område ved
hjælp af en aseptisk teknik.
2. Forbind slip-konnektoren til udluftningsslangen, og forbind den låsende hun-luerfitting til administrationssættet.
3. Prim alle slanger (og venegraftkanylen ved model 10005S) med kardioplegiopløsning.
4. Når slangen forbindes med kardioplegikanylen, skal man lade kardioplegiopløsningen dryppe fra enden og
forbinde den låsende han-luerfitting med den på forhånd primede kanyles indløbsfitting.
5. Model 10005S: Når venegraftkanylen forbindes med bypass-graften, skal man først prime graften retrogradt og
sørge for at tømme den helt for luft. Åbn klemmen, og lad kardioplegiopløsningen dryppe fra enden af
venegraftkanylen. Indfør kanylen løst i graften. Stop det retrograde flow. Før omhyggeligt venegraftkanylen ind i
transplantatet. Mens kanylen holdes på plads, perfunderes transplantatet antegradt.
6. Når indgrebet er gennemført, skal produktet bortskaffes i overensstemmelse med gængs praksis på hospitalet.
12Dansk
Page 13

7 Ansvarsfraskrivelse (globalt)
Vigtigt: Denne ansvarsfraskrivelse gælder ikke i Australien.
SELVOM PRODUKTET ER BLEVET OMHYGGELIGT KONSTRUERET, FREMSTILLET OG AFPRØVET INDEN
SALG, KAN DER AF FORSKELLIGE ÅRSAGER VÆRE RISIKO FOR, AT PRODUKTET IKKE FUNGERER EFTER
HENSIGTEN. MEDTRONIC HAR INGEN KONTROL OVER DE FORHOLD, SOM PRODUKTET ANVENDES
UNDER. ADVARSLERNE, SOM FREMGÅR AF PRODUKTETS MÆRKATER, GIVER YDERLIGERE
OPLYSNINGER OG BETRAGTES SOM EN INTEGRERET DEL AF DENNE ANSVARSFRASKRIVELSE.
MEDTRONIC FRASKRIVER SIG DERFOR ALLE GARANTIER, BÅDE UDTRYKKELIGE OG
UNDERFORSTÅEDE, MED HENSYN TIL PRODUKTET, HERUNDER, MEN IKKE BEGRÆNSET TIL, ALLE
UNDERFORSTÅEDE GARANTIER FOR SALGBARHED ELLER EGNETHED TIL ET BESTEMT FORMÅL.
MEDTRONIC ER IKKE ANSVARLIG OVER FOR NOGEN PERSON ELLER ORGANISATION FOR NOGEN SOM
HELST MEDICINSKE UDGIFTER ELLER NOGEN SOM HELST DIREKTE, TILFÆLDIGE ELLER
FØLGESKADER, DER ER FORÅRSAGET AF NOGEN FORM FOR BRUG, DEFEKT, FEJL ELLER
FUNKTIONSVIGT VEDRØRENDE PRODUKTET, UANSET OM KRAVET BYGGER PÅ GARANTIRET,
AFTALERET, ERSTATNINGSRET ELLER ANDET. MEDMINDRE DER FORELIGGER EN SKRIFTLIG AFTALE
MED BEMYNDIGET MEDTRONIC PERSONALE, HAR INGEN PERSON NOGEN SOM HELST BEMYNDIGELSE
TIL AT BINDE MEDTRONIC TIL NOGEN ERKLÆRING ELLER GARANTI I FORBINDELSE MED PRODUKTET.
Ovennævnte undtagelser og begrænsninger har ikke til hensigt at være i modstrid med ufravigelige bestemmelser i
gældende lov, og de må ikke fortolkes således. Hvis noget afsnit eller vilkår i denne ansvarsfraskrivelse af en
kompetent retsinstans anses for ulovligt, uden retskraft eller i modstrid med gældende lovgivning, berøres den
resterende del af ansvarsfraskrivelsen ikke, og alle rettigheder og forpligtelser skal tolkes og håndhæves, som om
denne ansvarsfraskrivelse ikke indeholdt det pågældende afsnit eller vilkår, der anses for ugyldigt.
13 Dansk
Page 14

1 Produktbeschreibung
Das Modell 10004S ist ein „Y“-Adapter mit einem Dreiwegehahn am kurzen Schenkel des Adapters zum Wechsel
zwischen Kardioplegie und Entlüftung. Der Einlassanschluss ist ein weiblicher Luer-Lock-Anschluss. Der
Belüftungsschenkel endet mit einem Steckanschluss. Beide Perfusionsschenkel schließen mit männlichen
Luer-Lock-Anschlüssen ab.
Die Modelle 10005 und 10005OS verfügen über einen kurzen Schenkel, der mit einem männlichen
Luer-Lock-Anschluss abschließt. Einer der Auslassschenkel endet mit einem Steckanschluss, der auf
Entlüftungsleitungen mit einem Innendurchmesser zwischen 0,48 cm (0,19 in) und 0,64 cm (0,25 in) passt. Der andere
Schenkel endet mit einem weiblichen Luer-Lock-Anschluss, der in den männlichen Luer-Lock-Anschluss des
Zuführungssets passt. Die Flussrichtung wird bei Modell 10005 durch farbkodierte Klemmen und bei Modell 10005OS
durch Klemmen mit farbkodierten Pfeilen kontrolliert.
Das Modell 10005BH verfügt über eine doppelte „Y“-Konfiguration, die auf einer Seite mit 2 männlichen
Luer-Lock-Anschlüssen und auf der anderen Seite mit einem Steckanschluss und einem weiblichen
Luer-Lock-Anschluss abschließt.
Das Modell 10005S ist ein Perfusionsadapter mit 4 Schenkeln. Der Einlassanschluss ist ein weiblicher
Luer-Lock-Anschluss für Schlauchverbindungen. Über mehrere „Y“-Konnektoren teilt sich der Adapter in insgesamt
4 Schenkel auf, von denen 2 mit weichen Silikonkanülen für Venentransplantate abschließen. Der dritte Schenkel
endet mit einem männlichen Luer-Lock-Anschluss, der vierte mit einem Steckanschluss zur Entlüftung des Systems.
Diese Gebrauchsanweisung gilt für Kanülen sowohl mit als auch ohne bioaktive Cortiva™ Oberflächenbeschichtung.
Modellnummern von Kanülen, die mit der bioaktiven Cortiva Oberfläche beschichtet sind, beginnen mit „CB“. Weitere
Angaben zur bioaktiven Cortiva Oberfläche finden sich in der Broschüre „Informationen zu Produkten mit bioaktiver
Cortiva Oberfläche“.
Dieses Produkt ist steril, pyrogenfrei und nur zur einmaligen Verwendung bestimmt. Das Produkt bei Raumtemperatur
lagern. Maximale Transporttemperatur: Unbeschichtet 50°C (122°F), Cortiva-beschichtet 40°C (104°F).
2 Indikationen
Dieser Adapter ist für den Gebrauch bei kardiopulmonalen Bypassoperationen vorgesehen.
3 Kontraindikationen
Ausschließlich wie in der Gebrauchsanweisung beschrieben verwenden.
4 Vorsichtsmaßnahmen
Die Verantwortung für die Anwendung und Einhaltung geeigneter operativer Maßnahmen und Techniken obliegt dem
Arzt. Das beschriebene Verfahren ist ausschließlich zu Informationszwecken erarbeitet worden. Der Chirurg muss
anhand der eigenen ärztlichen Ausbildung und Erfahrung sowie des Typs der für das Verfahren verwendeten Zulaufund Absaugsysteme die Eignung des Verfahrens selbst beurteilen.
Dieses Produkt ist zur Verwendung an nur einem Patienten bestimmt. Das Produkt darf nicht wiederverwendet,
aufbereitet oder resterilisiert werden. Die Wiederverwendung, Aufbereitung oder Resterilisation kann die strukturelle
Integrität des Produkts beeinträchtigen oder eine Kontamination des Produkts bewirken, die zu Verletzung,
Erkrankung oder zum Tod des Patienten führen kann.
Gilt für Produkte, auf deren Etikett ein Phthalatgehalt angegeben ist: Dieses Produkt enthält Phthalate.
Entsorgen Sie das Produkt gemäß den in Ihrer Klinik geltenden Vorschriften.
5 Unerwünschte Nebenwirkungen
Die folgenden bekannten unerwünschten Nebenwirkungen können im Zusammenhang mit der Verwendung des
Produkts auftreten: Koagulopathie, übermäßige Aktivierung der Blutkomponenten oder Thrombogenität, Hämolyse,
Hypotonie, Infektion, Ischämie, neurologische Dysfunktion und Organfunktionsstörungen.
6 Gebrauchsanweisung
1. Überprüfen Sie die Verpackung und das Produkt auf Schäden und kontrollieren Sie das Verfallsdatum. Wenn die
Verpackung unbeschädigt und das Verwendbarkeitsdatum noch nicht überschritten ist, öffnen Sie die
Verpackung und bringen Sie das Produkt unter aseptischen Bedingungen in das sterile Feld.
2. Schließen Sie den Steckanschluss an die Entlüftungsleitung und den weiblichen Luer-Lock-Anschluss an das
Zuführungsset an.
3. Befüllen Sie alle Schläuche (und bei Modell 10005S die Kanülen für Venentransplantate) mit
Kardioplegieflüssigkeit.
4. Um die Schläuche an die Kardioplegiekanüle anzuschließen, lassen Sie die Kardioplegieflüssigkeit an der Spitze
heraustropfen, und schließen Sie den männlichen Luer-Lock-Anschluss an den Einlassanschluss der
vorbefüllten Kanüle an.
14Deutsch
Page 15

5. Modell 10005S: Um die Kanüle für Venentransplantate an den Bypass-Graft anzuschließen, befüllen Sie den
Graft zuerst retrograd, und achten Sie darauf, die gesamte Luft abzuführen. Öffnen Sie die Klemme, und lassen
Sie die Kardioplegieflüssigkeit an der Spitze der Kanüle für Venentransplantate heraustropfen. Führen Sie die
Kanüle lose in das Transplantat ein. Stoppen Sie den retrograden Fluss. Führen Sie die Kanüle für
Venentransplantate vorsichtig und fest in das Transplantat ein. Halten Sie die Kanüle fest, und führen Sie eine
antegrade Perfusion des Transplantats durch.
6. Nach Abschluss des Verfahrens entsorgen Sie das Produkt entsprechend den in Ihrer Klinik geltenden
Vorschriften.
7 Haftungsausschluss (weltweit)
Wichtig: Der folgende Haftungsausschluss gilt nicht in Australien.
TROTZ SORGFÄLTIGER KONSTRUKTION, HERSTELLUNG UND VOR VERKAUF DURCHGEFÜHRTER
TESTDURCHLÄUFE IST ES MÖGLICH, DASS DAS PRODUKT AUS DEN VERSCHIEDENSTEN GRÜNDEN
NICHT ZUFRIEDENSTELLEND FUNKTIONIERT. MEDTRONIC HAT KEINEN EINFLUSS AUF DIE
BEDINGUNGEN, UNTER DENEN DIESES PRODUKT VERWENDET WIRD. DIE WARNHINWEISE IN DER
PRODUKTINFORMATION ENTHALTEN WEITERE DETAILLIERTE INFORMATIONEN UND SIND ALS
BESTANDTEIL DIESES HAFTUNGSAUSSCHLUSSES ANZUSEHEN. MEDTRONIC SCHLIESST DAHER JEDE
AUSDRÜCKLICHE ODER STILLSCHWEIGENDE GARANTIE IN BEZUG AUF DAS PRODUKT AUS. DIES
SCHLIESST JEGLICHE IMPLIZITE GARANTIE AUF MARKTGÄNGIGKEIT ODER EIGNUNG FÜR EINEN
BESTIMMTEN ZWECK EIN. MEDTRONIC HAFTET NICHT GEGENÜBER NATÜRLICHEN ODER
JURISTISCHEN PERSONEN JEGLICHER ART FÜR MEDIZINISCHE KOSTEN ODER UNMITTELBARE,
BEILÄUFIGE ODER FOLGESCHÄDEN, DIE DURCH GEBRAUCH, DEFEKT, AUSFALL ODER FEHLFUNKTION
DES PRODUKTS ENTSTEHEN, UNABHÄNGIG DAVON, OB SICH EINE HAFTUNG FÜR DERARTIGE
SCHÄDEN AUF EINE GARANTIE, EINEN VERTRAG, EINE UNERLAUBTE HANDLUNG ODER EINE ANDERE
ANSPRUCHSGRUNDLAGE STÜTZT. SOWEIT NICHT SCHRIFTLICH MIT ENTSPRECHEND BEFUGTEN
MEDTRONIC MITARBEITERN ETWAS ANDERES VEREINBART WURDE, IST NIEMAND BERECHTIGT,
MEDTRONIC AN IRGENDEINE ZUSICHERUNG ODER GARANTIE IN BEZUG AUF DAS PRODUKT ZU BINDEN.
Die hier aufgeführten Haftungsausschlüsse und -beschränkungen sollen nicht gegen geltendes Recht verstoßen und
sind nicht dahingehend auszulegen. Sollte ein zuständiges Gericht feststellen, dass dieser Haftungsausschluss ganz
oder teilweise unwirksam, nicht durchsetzbar oder im Widerspruch zu geltendem Recht ist, berührt dies die Gültigkeit
der restlichen Klauseln nicht. Alle Rechte und Pflichten aus diesem Haftungsausschluss sind so auszulegen und
durchzuführen, als sei der für ungültig erklärte Teil oder die ungültige Vorschrift in dem Haftungsausschluss nicht
enthalten.
15 Deutsch
Page 16

1 Περιγραφή προϊόντος
Το Μοντέλο 10004S είναι ένας προσαρμογέας σχήματος «Y» με την προσθήκη μιας τρίοδης στρόφιγγας στο
βραχύ σκέλος για εναλλαγή μεταξύ καρδιοπληγίας και αερισμού. Η γραμμή εισόδου ξεκινάει με έναν θηλυκό
σύνδεσμο ασφάλισης luer. Το σκέλος αερισμού καταλήγει σε έναν συρόμενο σύνδεσμο. Και τα δύο σκέλη έγχυσης
καταλήγουν σε αρσενικούς συνδέσμους ασφάλισης luer.
Τα Μοντέλα 10005 και 10005OS διαθέτουν ένα βραχύ σκέλος που καταλήγει σε αρσενικό σύνδεσμο ασφάλισης
luer. Ένα από τα σκέλη εξόδου καταλήγει σε έναν συρόμενο σύνδεσμο που συνδέεται σε μια γραμμή εξαερισμού
εσωτερικής διαμέτρου 0,48 cm (0,19 in) έως 0,64 cm (0,25 in). Το άλλο σκέλος καταλήγει σε έναν θηλυκό σύνδεσμο
ασφάλισης luer για σύνδεση με τον αρσενικό σύνδεσμο ασφάλισης luer του σετ χορήγησης. Η κατεύθυνση της
ροής ελέγχεται από χρωματικά κωδικοποιημένους σφιγκτήρες στο Μοντέλο 10005 και σφιγκτήρες με χρωματικά
κωδικοποιημένα βέλη στο Μοντέλο 10005OS.
Το Μοντέλο 10005BH είναι μια διπλή διαμόρφωση σχήματος «Y» που καταλήγει σε 2 αρσενικούς συνδέσμους
ασφάλισης luer στη μία πλευρά και σε έναν συρόμενο σύνδεσμο και έναν θηλυκό σύνδεσμο ασφάλισης luer στην
άλλη πλευρά.
Το Μοντέλο 10005S είναι ένας προσαρμογέας έγχυσης 4 σκελών. Η γραμμή εισόδου ξεκινά με έναν θηλυκό
σύνδεσμο ασφάλισης luer που είναι προσαρτημένος στη σωλήνωση. Μέσω μιας σειράς συνδέσμων σχήματος “Y”,
ο προσαρμογέας διαχωρίζεται σε 4 σκέλη, εκ των οποίων τα 2 καταλήγουν σε κάνουλες φλεβικού μοσχεύματος
από μαλακή σιλικόνη. Το τρίτο σκέλος καταλήγει σε έναν αρσενικό σύνδεσμο ασφάλισης luer και το τέταρτο
καταλήγει σε έναν συρόμενο σύνδεσμο που χρησιμοποιείται για τον αερισμό του συστήματος.
Οι παρούσες οδηγίες χρήσης ισχύουν και για τις μη επικαλυμμένες κάνουλες και για τις κάνουλες με βιοενεργή
επίστρωση Cortiva™. Οι κάνουλες που είναι επικαλυμμένες με τη βιοενεργή επίστρωση Cortiva περιλαμβάνουν
ένα πρόθεμα «CB» στον αριθμό μοντέλου. Για περισσότερες πληροφορίες σχετικά με τη βιοενεργή επίστρωση
Cortiva, δείτε το ένθετο «Πληροφορίες για προϊόντα με βιοενεργή επίστρωση Cortiva».
Το παρόν προϊόν είναι αποστειρωμένο, μη πυρετογόνο και προορίζεται για μία μόνο χρήση. Φυλάσσετε το προϊόν
σε θερμοκρασία δωματίου. Μέγιστη θερμοκρασία μεταφοράς: μη επικαλυμμένο 50°C (122°F), με επίστρωση
Cortiva 40°C (104°F).
2 Ενδείξεις χρήσης
Αυτός ο προσαρμογέας προορίζεται για χρήση σε συνδυασμό με χειρουργικές επεμβάσεις καρδιοπνευμονικής
παράκαμψης (bypass).
3 Αντενδείξεις
Να χρησιμοποιείται μόνο σύμφωνα με τις οδηγίες.
4 Προφυλάξεις
Η χρήση κατάλληλων χειρουργικών διαδικασιών και τεχνικών αποτελεί ευθύνη του ιατρού. Η περιγραφόμενη
διαδικασία παρέχεται μόνο για σκοπούς πληροφόρησης. Οι χειρουργοί πρέπει να αξιολογήσουν την
καταλληλότητα της επέμβασης, με βάση την προσωπική τους ιατρική εκπαίδευση και εμπειρία και με βάση τον
τύπο των συστημάτων χορήγησης και αναρρόφησης που έχουν επιλεγεί για την επέμβαση.
Το παρόν προϊόν έχει σχεδιαστεί για μία χρήση σε έναν μόνο ασθενή. Μην επαναχρησιμοποιείτε, μην
επανεπεξεργάζεστε και μην επαναποστειρώνετε το παρόν προϊόν. Η επαναχρησιμοποίηση, η επανεπεξεργασία ή
η επαναποστείρωση ενδέχεται να διακυβεύσουν τη δομική ακεραιότητα του προϊόντος ή να δημιουργήσουν
κίνδυνο μόλυνσης του προϊόντος, που μπορεί να οδηγήσει σε τραυματισμό, ασθένεια ή θάνατο του ασθενούς.
Ισχύει για τα προϊόντα με φθαλικούς εστέρες που προσδιορίζονται στη σήμανση του προϊόντος: Το
παρόν προϊόν περιέχει φθαλικούς εστέρες.
Απορρίψτε το προϊόν σύμφωνα με τη νοσοκομειακή πολιτική.
5 Ανεπιθύμητες ενέργειες
Οι ακόλουθες γνωστές ανεπιθύμητες ενέργειες σχετίζονται με τη χρήση του προϊόντος: διαταραχή πήξης του
αίματος, υπερβολική ενεργοποίηση συστατικών του αίματος ή θρομβογονικότητα, αιμόλυση, υπόταση, λοίμωξη,
ισχαιμία, νευρολογική δυσλειτουργία και οργανική δυσλειτουργία.
6 Οδηγίες χρήσης
1. Επιθεωρήστε τη συσκευασία και το προϊόν για ζημίες και ελέγξτε την ημερομηνία «Χρήση έως». Εάν δεν
υπάρχει ζημία και δεν έχει παρέλθει η ημερομηνία λήξης, ανοίξτε τη συσκευασία και μεταφέρετε το προϊόν
στο στείρο πεδίο χρησιμοποιώντας άσηπτη τεχνική.
2. Συνδέστε τον συρόμενο σύνδεσμο στη γραμμή εξαερισμού και τον θηλυκό σύνδεσμο ασφάλισης luer στο σετ
χορήγησης.
16Ελληνικά
Page 17

3. Πραγματοποιήστε αρχική πλήρωση όλων των σωληνώσεων (και των κανουλών φλεβικού μοσχεύματος για το
Μοντέλο 10005S) με υγρό καρδιοπληγίας.
4. Για να συνδέσετε τις σωληνώσεις στην κάνουλα καρδιοπληγίας, επιτρέψτε στο υγρό καρδιοπληγίας να
εκρεύσει από την απόληξη και συνδέστε τον αρσενικό σύνδεσμο ασφάλισης luer στην υποδοχή εισόδου της
κάνουλας στην οποία έχετε πραγματοποιήσει αρχική πλήρωση.
5. Μοντέλο 10005S: Για να συνδέσετε την κάνουλα φλεβικού μοσχεύματος στο μόσχευμα παράκαμψης,
πραγματοποιήστε πρώτα αρχική πλήρωση του μοσχεύματος με ανάδρομη ροή, εξασφαλίζοντας την
απομάκρυνση όλου του αέρα. Ανοίξτε τον σφιγκτήρα και επιτρέψτε στο υγρό καρδιοπληγίας να εκρεύσει από
την απόληξη της κάνουλας φλεβικού μοσχεύματος. Εισαγάγετε χαλαρά την κάνουλα μέσα στο μόσχευμα.
Διακόψτε την ανάδρομη ροή. Εισαγάγετε προσεκτικά και σταθερά την κάνουλα φλεβικού μοσχεύματος μέσα
στο μόσχευμα. Ενώ κρατάτε την κάνουλα στη θέση της, πραγματοποιήστε έγχυση στο μόσχευμα με
ορθόδρομη ροή.
6. Μετά από την ολοκλήρωση της διαδικασίας, απορρίψτε το προϊόν σύμφωνα με τη νοσοκομειακή πολιτική.
7 Αποποιητική δήλωση της εγγύησης (παγκόσμια)
Σημαντικό: Αυτή η αποποιητική δήλωση της εγγύησης δεν ισχύει στην Αυστραλία.
ΠΑΡΟΤΙ ΤΟ ΠΡΟΪΟΝ ΕΧΕΙ ΣΧΕΔΙΑΣΤΕΙ, ΚΑΤΑΣΚΕΥΑΣΤΕΙ ΚΑΙ ΔΟΚΙΜΑΣΤΕΙ ΥΠΟ ΠΡΟΣΕΚΤΙΚΑ
ΕΛΕΓΧΟΜΕΝΕΣ ΣΥΝΘΗΚΕΣ ΠΡΙΝ ΑΠΟ ΤΗΝ ΠΩΛΗΣΗ, ΤΟ ΠΡΟΪΟΝ ΜΠΟΡΕΙ ΝΑ ΑΠΟΤΥΧΕΙ ΣΤΗΝ ΕΚΤΕΛΕΣΗ
ΤΗΣ ΠΡΟΟΡΙΖΟΜΕΝΗΣ ΛΕΙΤΟΥΡΓΙΑΣ ΛΟΓΩ ΠΟΙΚΙΛΩΝ ΑΙΤΙΩΝ. Η MEDTRONIC ΔΕΝ ΕΧΕΙ ΕΛΕΓΧΟ ΤΩΝ
ΣΥΝΘΗΚΩΝ ΥΠΟ ΤΙΣ ΟΠΟΙΕΣ ΧΡΗΣΙΜΟΠΟΙΕΙΤΑΙ ΤΟ ΠΑΡΟΝ ΠΡΟΪΟΝ. ΟΙ ΠΡΟΕΙΔΟΠΟΙΗΣΕΙΣ ΠΟΥ
ΠΕΡΙΕΧΟΝΤΑΙ ΣΤΗ ΣΗΜΑΝΣΗ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΠΑΡΕΧΟΥΝ ΛΕΠΤΟΜΕΡΕΣΤΕΡΕΣ ΠΛΗΡΟΦΟΡΙΕΣ ΚΑΙ
ΘΕΩΡΟΥΝΤΑΙ ΑΝΑΠΟΣΠΑΣΤΟ ΤΜΗΜΑ ΤΗΣ ΠΑΡΟΥΣΑΣ ΑΠΟΠΟΙΗΤΙΚΗΣ ΔΗΛΩΣΗΣ ΤΗΣ ΕΓΓΥΗΣΗΣ.
ΣΥΝΕΠΩΣ, Η MEDTRONIC ΑΠΟΠΟΙΕΙΤΑΙ ΟΛΕΣ ΤΙΣ ΕΓΓΥΗΣΕΙΣ, ΡΗΤΕΣ ΚΑΙ ΣΙΩΠΗΡΕΣ, ΣΕ ΣΧΕΣΗ ΜΕ ΤΟ
ΠΡΟΪΟΝ, ΠΕΡΙΛΑΜΒΑΝΟΜΕΝΗΣ, ΕΝΔΕΙΚΤΙΚΑ, ΟΠΟΙΑΣΔΗΠΟΤΕ ΣΙΩΠΗΡΗΣ ΕΓΓΥΗΣΗΣ ΠΕΡΙ
ΕΜΠΟΡΕΥΣΙΜΟΤΗΤΑΣ Ή ΚΑΤΑΛΛΗΛΟΤΗΤΑΣ ΓΙΑ ΣΥΓΚΕΚΡΙΜΕΝΟ ΣΚΟΠΟ. H MEDTRONIC ΔΕΝ ΘΑ ΕΙΝΑΙ
ΥΠΕΥΘΥΝΗ ΑΠΕΝΑΝΤΙ ΣΕ ΟΠΟΙΟΔΗΠΟΤΕ ΦΥΣΙΚΟ Ή ΝΟΜΙΚΟ ΠΡΟΣΩΠΟ ΓΙΑ ΟΠΟΙΕΣΔΗΠΟΤΕ ΙΑΤΡΙΚΕΣ
ΔΑΠΑΝΕΣ Ή ΟΠΟΙΕΣΔΗΠΟΤΕ ΑΜΕΣΕΣ, ΘΕΤΙΚΕΣ Ή ΑΠΟΘΕΤΙΚΕΣ ΖΗΜΙΕΣ ΠΡΟΚΑΛΟΥΜΕΝΕΣ ΑΠΟ
ΟΠΟΙΑΔΗΠΟΤΕ ΧΡΗΣΗ, ΕΛΑΤΤΩΜΑ, ΑΣΤΟΧΙΑ Ή ΔΥΣΛΕΙΤΟΥΡΓΙΑ ΤΟΥ ΠΡΟΪΟΝΤΟΣ, ΕΙΤΕ Η ΑΞΙΩΣΗ
ΒΑΣΙΖΕΤΑΙ ΣΕ ΕΓΓΥΗΣΗ, ΣΥΜΒΑΣΗ, ΑΔΙΚΟΠΡΑΞΙΑ ΕΙΤΕ ΣΕ ΟΤΙΔΗΠΟΤΕ ΑΛΛΟ. ΕΚΤΟΣ ΑΝ ΕΧΕΙ
ΣΥΜΦΩΝΗΘΕΙ ΔΙΑΦΟΡΕΤΙΚΑ ΕΓΓΡΑΦΩΣ ΑΠΟ ΕΞΟΥΣΙΟΔΟΤΗΜΕΝΟ ΠΡΟΣΩΠΙΚΟ ΤΗΣ MEDTRONIC,
ΚΑΝΕΝΑ ΠΡΟΣΩΠΟ ΔΕΝ ΕΧΕΙ ΤΗ ΔΙΚΑΙΟΔΟΣΙΑ ΝΑ ΔΕΣΜΕΥΣΕΙ ΤΗ MEDTRONIC ΣΕ ΟΠΟΙΑΔΗΠΟΤΕ
ΔΗΛΩΣΗ Ή ΕΓΓΥΗΣΗ ΣΕ ΣΧΕΣΗ ΜΕ ΤΟ ΠΡΟΪΟΝ.
Οι εξαιρέσεις και οι περιορισμοί που ορίζονται ανωτέρω, δεν έχουν ως σκοπό και δεν θα πρέπει να ερμηνεύονται
κατά τέτοιο τρόπο, ώστε να αντιβαίνουν στις υποχρεωτικές διατάξεις της ισχύουσας νομοθεσίας. Εάν
οποιοδήποτε τμήμα ή όρος της παρούσας Αποποιητικής Δήλωσης της Εγγύησης κριθεί από οποιοδήποτε
δικαστήριο αρμόδιας δικαιοδοσίας παράνομο(ς), μη εφαρμόσιμο(ς) ή συγκρουόμενο(ς) με την ισχύουσα
νομοθεσία, η εγκυρότητα των υπολοίπων τμημάτων της παρούσας Αποποιητικής Δήλωσης της Εγγύησης δεν θα
επηρεαστεί, και όλα τα δικαιώματα και οι υποχρεώσεις θα ερμηνεύονται και θα εφαρμόζονται ως εάν η παρούσα
Αποποιητική Δήλωση της Εγγύησης να μην περιείχε το συγκεκριμένο τμήμα ή όρο που κρίθηκε άκυρο(ς).
17 Ελληνικά
Page 18

1 Descripción del producto
El Modelo 10004S es un adaptador en “Y” con una llave de paso de 3 vías en el ramal corto que permite alternar entre
cardioplejía y ventilación. El conector de entrada cuenta con un adaptador de bloqueo luer hembra. El ramal de
ventilación termina en un conector a presión. Ambos ramales de perfusión terminan en adaptadores de bloqueo luer
macho.
Los Modelos 10005 y 10005OS cuentan con un ramal corto que termina en un adaptador de bloqueo luer macho.
Uno de los ramales de salida termina en un conector a presión que puede conectase a una vía de ventilación de entre
0,48 cm (0,19 in) y 0,64 cm (0,25 in) de diámetro interno. El otro ramal termina en un adaptador de bloqueo luer hembra
que permite conectarlo al adaptador de bloqueo luer macho del juego para administración. La dirección del flujo se
controla mediante pinzas codificadas por colores en el Modelo 10005 y mediante pinzas con flechas codificadas por
colores en el Modelo 10005OS.
El Modelo 10005BH consta de una configuración en doble “Y” que termina en 2 adaptadores de bloqueo luer macho
en un lado y en un conector a presión y un adaptador de bloqueo luer hembra en el otro lado.
El Modelo 10005S es un adaptador de perfusión con 4 ramales. El adaptador de entrada cuenta con un adaptador
de bloqueo luer hembra conectado al tubo. Mediante una serie de conectores en “Y”, el adaptador se divide en
4 ramales, 2 de los cuales terminan en cánulas para injerto venoso de silicona blanda. El tercer ramal termina en un
adaptador de bloqueo luer macho, y el cuarto termina con un conector a presión utilizado para ventilar el sistema.
Estas instrucciones de uso son aplicables tanto a las cánulas sin revestimiento como a las cánulas revestidas con la
superficie biocompatible Cortiva™. Las cánulas revestidas con la superficie biocompatible Cortiva contienen el
prefijo “CB” en el número de modelo. Si desea más información sobre la superficie biocompatible Cortiva, consulte el
documento “Información para productos con la superficie biocompatible Cortiva”.
Este producto es estéril, apirógeno y válido para un solo uso. Almacene el producto a temperatura ambiente.
Temperatura máxima de transporte: sin revestimiento 50°C (122°F), con revestimiento Cortiva 40°C (104°F).
2 Indicaciones de uso
Este adaptador está diseñado para su utilización durante intervenciones quirúrgicas con bypass pulmonar.
3 Contraindicaciones
Debe utilizarse exclusivamente tal como se indica.
4 Medidas preventivas
Las técnicas y procedimientos quirúrgicos adecuados son responsabilidad del profesional médico. El procedimiento
descrito se proporciona exclusivamente con fines informativos. Cada cirujano debe evaluar la conveniencia del
procedimiento según sus propias formación y experiencia médicas y el tipo de sistemas de administración y
aspiración elegidos para el procedimiento.
Este dispositivo es válido para utilizarse en un solo paciente. No reutilice, reprocese ni reesterilice este producto. La
reutilización, el reprocesamiento o la reesterilización del dispositivo pueden poner en peligro su integridad estructural
o generar riesgos de contaminación del mismo que podrían provocar al paciente lesiones, enfermedades o incluso la
muerte.
Aplicable a los productos en cuya etiqueta se indique que contienen ftalatos: Este producto contiene ftalatos.
Deseche el producto de acuerdo con la normativa hospitalaria aplicable.
5 Efectos adversos
Los siguientes efectos adversos conocidos están asociados al uso del producto: coagulopatía, activación excesiva
de componentes sanguíneos o trombogenia, hemólisis, hipotensión, infección, isquemia, disfunción neurológica y
disfunción orgánica.
6 Instrucciones de uso
1. Inspeccione el envase y el producto en busca de daños y compruebe su fecha de caducidad. Si no presenta
daños ni ha caducado, abra el envase y transfiera el producto al campo estéril mediante una técnica aséptica.
2. Conecte el conector a presión a la vía de ventilación y el adaptador de bloqueo luer hembra al juego para
administración.
3. Cebe todos los tubos (y las cánulas para injerto venoso en el caso del Modelo 10005S) con solución de
cardioplejía.
4. Antes de conectar el tubo a la cánula de cardioplejía, permita que la solución de cardioplejía gotee por el extremo
y, a continuación, conecte el adaptador de bloqueo luer macho al adaptador de entrada de la cánula cebada
previamente.
5. Modelo 10005S: Antes de conectar la cánula para injerto venoso al injerto de bypass, cebe el injerto mediante
flujo retrógrado con cuidado de expulsar todo el aire. Abra la pinza y permita que la solución de cardioplejía gotee
18Español
Page 19

por el extremo de la cánula para injerto venoso. Asegúrese de que la cánula entra libremente en el injerto.
Detenga el flujo retrógrado. Introduzca la cánula para injerto venoso cuidadosa y firmemente en el injerto. A la vez
que sujeta la cánula en posición, perfunda el injerto mediante flujo anterógrado.
6. Una vez finalizado el procedimiento, deseche el producto de acuerdo con la normativa hospitalaria aplicable.
7 Renuncia de responsabilidad (global)
Importante: Esta renuncia de responsabilidad no es aplicable en Australia.
AUNQUE EL PRODUCTO HA SIDO DISEÑADO, FABRICADO Y PROBADO EN CONDICIONES
CUIDADOSAMENTE CONTROLADAS ANTES DE PONERLO A LA VENTA, EL PRODUCTO PUEDE NO
CUMPLIR SUS FUNCIONES SATISFACTORIAMENTE POR VARIAS RAZONES. MEDTRONIC NO TIENE
CONTROL SOBRE LAS CONDICIONES BAJO LAS QUE SE UTILIZA ESTE PRODUCTO. LAS ADVERTENCIAS
QUE CONTIENE LA DOCUMENTACIÓN DEL PRODUCTO PROPORCIONAN INFORMACIÓN MÁS
DETALLADA Y SE CONSIDERAN COMO PARTE INTEGRANTE DE ESTA RENUNCIA DE RESPONSABILIDAD.
POR TANTO, MEDTRONIC NIEGA TODA GARANTÍA, TANTO EXPRESA COMO IMPLÍCITA, CON RESPECTO
AL PRODUCTO, INCLUIDA ENTRE OTRAS TODA GARANTÍA IMPLÍCITA DE COMERCIABILIDAD O
IDONEIDAD PARA UN FIN PARTICULAR. MEDTRONIC NO SERÁ RESPONSABLE ANTE NINGUNA PERSONA
O ENTIDAD POR LOS GASTOS MÉDICOS O DAÑOS DIRECTOS, INDIRECTOS O RESULTANTES CAUSADOS
POR EL USO, DEFECTO, FALLO O MAL FUNCIONAMIENTO DEL PRODUCTO AUN CUANDO LA
RECLAMACIÓN SE BASE EN UNA GARANTÍA, CONTRATO, RESPONSABILIDAD EXTRACONTRACTUAL U
OTRO FUNDAMENTO LEGAL. SALVO QUE PERSONAL AUTORIZADO DE MEDTRONIC HAYA ACORDADO LO
CONTRARIO POR ESCRITO, NINGUNA PERSONA TIENE AUTORIDAD PARA VINCULAR A MEDTRONIC CON
NINGUNA DECLARACIÓN O GARANTÍA EN RELACIÓN CON EL PRODUCTO.
Las exclusiones y limitaciones detalladas anteriormente no pretenden contravenir las disposiciones obligatorias
establecidas por la legislación vigente ni deben interpretarse de dicha forma. En el supuesto de que cualquier parte
o término de la presente Renuncia de responsabilidad fuera declarado por cualquier tribunal competente como ilegal,
inaplicable o contrario a la ley, ello no afectará a la validez del resto de la Renuncia de responsabilidad,
interpretándose y aplicándose cuantos derechos y obligaciones se contienen en la misma como si la presente
Renuncia de responsabilidad no contuviera la parte o término considerado no válido.
19 Español
Page 20

1 Tuotteen kuvaus
Malli 10004S on Y-sovitin, jonka lyhyessä haarassa on kolmitiesulkuhana. Kolmitiesulkuhanan avulla voidaan vaihtaa
kardioplegian ja ilmanpoiston välillä. Tulohaaran päässä on luer lock -naarasliitin. Ilmanpoistohaaran päässä on
liukuliitin. Molempien perfuusiohaarojen päässä on luer lock -urosliitin.
Malleissa 10005 ja 10005OS on lyhyt haara, jonka päässä on luer lock -urosliitin. Toisen lähtöhaaran päässä on
liukuliitin. Se liitetään ilmanpoistoletkuun, jonka sisäläpimitta on 0,48 cm – 0,64 cm (0,19 in – 0,25 in). Toisen haaran
päässä on luer lock -naarasliitin, joka liitetään antovälinesarjan luer lock -urosliittimeen. Virtaussuuntaa säädellään
mallissa 10005 värillisillä puristimilla ja mallissa 10005OS puristimilla, joissa on värilliset nuolet.
Malli 10005BH on Y-kaksoissovitin, jonka päässä on toisella puolella kaksi luer lock -urosliitintä ja toisella puolella
liukuliitin ja luer lock -naarasliitin.
Malli 10005S on 4-haarainen perfuusiosovitin. Sen tulohaarassa on letkuun liitetty luer lock -naarasliitin. Sovittimessa
on useita Y-liittimiä, ja se jakautuu neljään haaraan. Kahden haaran päässä on pehmeä silikoninen
laskimosiirrekanyyli. Kolmannen haaran päässä on luer lock -urosliitin, ja neljännen haaran päässä on järjestelmän
ilmanpoistoon tarkoitettu liukuliitin.
Nämä käyttöohjeet koskevat sekä pinnoittamattomia kanyyleja että kanyyleja, jotka on päällystetty bioaktiivisella
Cortiva™-pinnoitteella. Bioaktiivisella Cortiva-pinnoitteella päällystettyjen kanyylien mallinumerossa on etuliite ”CB”.
Lisätietoja bioaktiivisesta Cortiva-pinnoitteesta on selosteessa ”Tietoja bioaktiivisella Cortiva-pinnoitteella
päällystetyistä tuotteista”.
Tämä tuote on steriili ja pyrogeeniton ja tarkoitettu vain kertakäyttöön. Säilytä tuote huoneenlämmössä.
Enimmäislämpötila kuljetuksen aikana: pinnoittamaton 50°C (122°F), Cortiva-pinnoitettu 40°C (104°F).
2 Käyttöaiheet
Tämä sovitin on tarkoitettu käytettäväksi sydän-keuhkokoneen avulla tehtävässä leikkauksessa.
3 Vasta-aiheet
Käytä tuotetta aina ohjeiden mukaisesti.
4 Varotoimet
Lääketieteen ammattilainen vastaa asianmukaisista kirurgisista toimenpiteistä ja menetelmistä. Kuvattu menetelmä
on tarkoitettu vain ohjeelliseksi. Arvioidessaan käytettävän menetelmän soveltuvuutta kirurgien on huomioitava oma
lääketieteellinen koulutuksensa ja kokemuksensa sekä toimenpiteeseen valittujen anto- ja imujärjestelmien tyyppi.
Laite on tarkoitettu käytettäväksi vain yhdellä potilaalla. Älä käytä, käsittele tai steriloi tuotetta uudelleen.
Uudelleenkäyttö, -käsittely tai -sterilointi voi heikentää laitteen rakennetta tai aiheuttaa laitteen kontaminaatiovaaran,
mikä voi johtaa potilaan vammaan, sairauteen tai kuolemaan.
Seuraava koskee tuotteita, joissa on ftalaatteja niiden etiketin mukaan: Tämä tuote sisältää ftalaatteja.
Hävitä tuote sairaalan käytäntöjen mukaisesti.
5 Haittavaikutukset
Tuotteen käyttöön liittyy seuraavia tunnettuja haittavaikutuksia: koagulopatia, runsas verikomponenttien
aktivoituminen tai trombogeenisuus, hemolyysi, hypotensio, infektio, iskemia, neurologinen toimintahäiriö ja elimen
toimintahäiriö.
6 Käyttöohjeet
1. Tarkista pakkaus ja tuote vaurioiden varalta sekä viimeinen käyttöpäivämäärä. Jos pakkaus on ehjä eikä sen
käyttöaika ole umpeutunut, avaa pakkaus ja siirrä tuote aseptisesti steriilille alueelle.
2. Liitä liukuliitin ilmanpoistoletkuun ja luer lock -naarasliitin antovälinesarjaan.
3. Esitäytä kaikki letkut (ja mallissa 10005S laskimosiirrekanyylit) kardioplegialiuoksella.
4. Kun liität letkun kardioplegiakanyyliin, anna kardioplegialiuoksen tippua päästä ja liitä luer lock -urosliitin
esitäytetyn kanyylin tuloliittimeen.
5. Malli 10005S: Kun liität laskimosiirrekanyylin ohitussiirteeseen, esitäytä siirre ensin retrogradisesti. Varmista,
että kaikki ilma saadaan pois. Avaa puristin ja anna kardioplegialiuoksen tippua laskimosiirrekanyylin päästä.
Aseta kanyyli alustavasti siirteen sisään. Pysäytä retrogradinen virtaus. Työnnä laskimosiirrekanyyli varovasti
kunnolla siirteen sisään. Pidä kanyylia paikallaan ja perfusoi siirre antegradisesti.
6. Hävitä tuote toimenpiteen päätyttyä sairaalan käytäntöjen mukaisesti.
7 Takuuta koskeva vastuuvapauslauseke (maailmanlaajuinen)
Tärkeää: tämä takuuta koskeva vastuuvapauslauseke ei ole voimassa Australiassa.
20Suomi
Page 21

VAIKKA TUOTE ON SUUNNITELTU, VALMISTETTU JA TESTATTU HUOLELLISESTI VALVOTUISSA
OLOSUHTEISSA ENNEN MYYNTIÄ, USEISTA ERI SYISTÄ SAATTAA JOHTUA, ETTÄ TUOTE EI TOIMI
TARKOITETULLA TAVALLA. MEDTRONIC EI PYSTY VALVOMAAN OLOSUHTEITA, JOISSA TÄTÄ TUOTETTA
KÄYTETÄÄN. TUOTEDOKUMENTAATIOSSA OLEVAT VAROITUKSET SISÄLTÄVÄT TARKEMPIA
LISÄTIETOJA JA KUULUVAT OLENNAISENA OSANA TÄHÄN TAKUUTA KOSKEVAAN
VASTUUVAPAUSLAUSEKKEESEEN. MEDTRONIC SANOUTUU SITEN IRTI KAIKISTA TUOTTEESEEN
LIITTYVISTÄ NIMENOMAISISTA JA KONKLUDENTTISISTA TAKUISTA, MUKAAN LUKIEN, MUTTA NIIHIN
RAJOITTUMATTA, KONKLUDENTTISET TAKUUT SOVELTUVUUDESTA KAUPANKÄYNNIN KOHTEEKSI TAI
TIETTYYN TARKOITUKSEEN. MEDTRONIC EI OLE VASTUUSSA KENENKÄÄN HENKILÖN TAI TAHON
HOITOKULUISTA TAI MISTÄÄN SUORASTA, SATUNNAISESTA TAI VÄLILLISESTÄ VAHINGOSTA, JOKA ON
AIHEUTUNUT TUOTTEEN KÄYTÖSTÄ, VIASTA, TOIMINNAN LAKKAAMISESTA TAI VIRHEELLISESTÄ
TOIMINNASTA, RIIPPUMATTA SIITÄ, PERUSTUUKO VAATIMUS TAKUUSEEN, SOPIMUKSEEN,
OIKEUDENLOUKKAUKSEEN TAI MUUHUN SEIKKAAN. KENELLÄKÄÄN EI OLE VALTUUKSIA SITOA
MEDTRONIC-YHTIÖTÄ MIHINKÄÄN TUOTETTA KOSKEVIIN ILMOITUKSIIN TAI TAKUISIIN, PAITSI SILLOIN,
KUN MEDTRONIC-YHTIÖN VALTUUTETTU HENKILÖKUNTA ON ANTANUT SIIHEN KIRJALLISEN
SUOSTUMUKSEN.
Yllä mainittuja rajoituksia ei ole tarkoitettu voimassa olevan pakottavan lainsäädännön vastaisiksi, eikä niitä pidä tällä
tavoin tulkita. Mikäli toimivaltainen tuomioistuin katsoo, että jokin tämän takuuta koskevan vastuuvapauslausekkeen
osa tai ehto on laiton, täytäntöönpanokelvoton tai ristiriidassa tapaukseen sovellettavan lainsäädännön kanssa,
takuuta koskeva vastuuvapauslauseke säilyy kuitenkin muilta osin voimassa, ja kaikkia oikeuksia ja velvollisuuksia on
tulkittava ja pantava täytäntöön ikään kuin tämä takuuta koskeva vastuuvapauslauseke ei sisältäisi sitä erityistä osaa
tai ehtoa, joka katsotaan pätemättömäksi.
21 Suomi
Page 22

1 Description du produit
Le modèle 10004S est un adaptateur en Y équipé d’un robinet d’arrêt à 3 voies au niveau de la branche la plus courte,
ce qui permet d’utiliser cette dernière à des fins d’administration de la cardioplégie ou à des fins de purge. La branche
d’administration est dotée d’un verrouillage luer femelle. La branche de purge se termine par un connecteur à
glissement. Les deux branches de perfusion se terminent chacune par un verrouillage luer mâle.
Les modèles 10005 et 10005OS sont dotés d’une branche plus courte qui se termine par un verrouillage luer mâle.
L’une des branches d’évacuation se termine par un connecteur à glissement qui se raccorde à une tubulure de purge
présentant un DI de 0,48 cm (0,19 in) à 0,64 cm (0,25 in). La seconde branche se termine par un verrouillage luer
femelle qui se raccorde au verrouillage luer mâle du dispositif d’administration. Le sens d’écoulement est contrôlé par
des clamps de couleur sur le modèle 10005 et par des clamps portant des flèches de couleur sur le modèle 10005OS.
Le modèle 10005BH présente une double configuration en Y qui se termine par 2 verrouillages luer mâles d’une part
et par un connecteur à glissement et un verrouillage luer femelle d’autre part.
Le modèle 10005S est un adaptateur de perfusion à 4 branches. La branche d’administration est dotée d’un
verrouillage luer femelle qui se raccorde à la tubulure. Par l’intermédiaire d’une série de connecteurs en Y, l’adaptateur
se divise en 4 branches, 2 d’entre elles se terminant par des canules de prothèse veineuse souples en silicone. La
troisième branche se termine par un verrouillage luer mâle et la quatrième par un connecteur à glissement destiné à
la purge du système.
Ce mode d’emploi s’applique aussi bien aux canules non enduites qu’aux canules enduites de surface bioactive
Cortiva™. Les numéros de modèle des canules enduites de surface bioactive Cortiva comportent le préfixe "CB". Pour
de plus amples informations concernant la surface bioactive Cortiva, se reporter à la notice "Informations relatives aux
produits avec surface bioactive Cortiva".
Ce produit est stérile, apyrogène et uniquement destiné à un usage unique. Stocker le produit à température ambiante.
Température de transport maximum : non enduite 50°C (122°F), enduite de Cortiva 40°C (104°F).
2 Indications d’utilisation
Cet adaptateur est destiné à être utilisé au cours des interventions de circulation extracorporelle.
3 Contre-indications
Utiliser exclusivement comme indiqué.
4 Précautions
L’utilisation de procédures et de techniques chirurgicales appropriées relève de la responsabilité du médecin. La
procédure décrite est uniquement donnée à titre indicatif. Le chirurgien doit évaluer l’adéquation de la procédure en
fonction de sa formation et de son expérience médicale, mais aussi du système d’aspiration et d’administration
sélectionné pour l’intervention.
Cet appareil est destiné à un patient unique. Ne pas réutiliser, retraiter ni restériliser ce produit. La réutilisation, le
retraitement ou la restérilisation risque de compromettre l’intégrité de la structure du dispositif ou de le contaminer, ce
qui pourrait entraîner des blessures, une maladie ou le décès du patient.
Applicable aux produits pour lesquels la présence de phtalates est indiquée sur l’étiquette : Ce produit
contient des phthalates.
Éliminer le produit conformément aux directives de l’établissement hospitalier.
5 Effets secondaires
Les effets indésirables connus suivants sont associés à l’utilisation du produit : coagulopathie, activation excessive
des composants du sang ou thrombogénicité, hémolyse, hypotension, infection, ischémie, dysfonctionnement
neurologique et dysfonctionnement d’organes.
6 Mode d’emploi
1. Inspecter l’emballage et le produit afin de détecter tout dommage éventuel et vérifier la date de péremption. Si
l’emballage n’est pas endommagé et si la date de péremption n’est pas dépassée, ouvrir l’emballage et transférer
le produit sur le champ stérile en utilisant une technique aseptique.
2. Raccorder le connecteur à glissement à la tubulure de purge et le verrouillage luer femelle au dispositif
d’administration.
3. Amorcer toutes les tubulures (et les canules de prothèse veineuse pour le modèle 10005S) avec le liquide de
cardioplégie.
4. Pour raccorder la tubulure à la canule de cardioplégie, faire goutter le liquide de cardioplégie à l’extrémité de la
canule et raccorder le verrouillage luer mâle au raccord d’entrée de la canule pré-amorcée.
5. Modèle 10005S : pour raccorder la canule de prothèse veineuse au greffon, amorcer d’abord le greffon de façon
rétrograde en veillant à évacuer complètement l’air. Ouvrir le clamp et faire goutter le liquide de cardioplégie à
22Français
Page 23

l’extrémité de la canule de prothèse veineuse. Insérer la canule dans le greffon sans forcer. Bloquer la circulation
rétrograde. Insérer délicatement mais fermement la canule de prothèse veineuse dans le greffon. Procéder à la
perfusion antérograde du greffon tout en maintenant la canule en place.
6. Une fois la procédure terminée, éliminer le produit conformément aux directives de l’établissement hospitalier.
7 Déni de garantie (global)
Important : Ce déni de garantie ne s’applique pas en Australie.
BIEN QUE LE PRODUIT AIT ÉTÉ CONÇU, FABRIQUÉ ET TESTÉ DANS DES CONDITIONS SOIGNEUSEMENT
CONTRÔLÉES AVANT LA MISE EN VENTE, LE PRODUIT PEUT, POUR DIVERSES RAISONS, CONNAÎTRE
DES DÉFAILLANCES. MEDTRONIC N’A AUCUN CONTRÔLE SUR LES CONDITIONS DANS LESQUELLES CE
PRODUIT EST UTILISÉ. LES AVERTISSEMENTS FIGURANT SUR LES ÉTIQUETTES DU PRODUIT DONNENT
DES INFORMATIONS PLUS DÉTAILLÉES ET DOIVENT ÊTRE CONSIDÉRÉS COMME FAISANT PARTIE
INTÉGRANTE DU PRÉSENT DÉNI DE GARANTIE. EN CONSÉQUENCE, MEDTRONIC DÉCLINE TOUTE
GARANTIE, EXPRESSE OU IMPLICITE, RELATIVE AU PRODUIT, DONT, ENTRE AUTRES, TOUTE GARANTIE
IMPLICITE DE QUALITÉ MARCHANDE OU D’ADÉQUATION À UN USAGE PARTICULIER. MEDTRONIC NE
POURRA EN AUCUN CAS ÊTRE TENUE POUR RESPONSABLE, ENVERS AUCUNE PERSONNE OU ENTITÉ,
DES FRAIS MÉDICAUX OU DES DOMMAGES DIRECTS, FORTUITS OU INDIRECTS QUI SERAIENT
PROVOQUÉS PAR TOUS USAGES, DÉFECTUOSITÉS, DÉFAILLANCES OU DYSFONCTIONNEMENTS DU
PRODUIT, ET CE QUE LA PLAINTE SOIT FONDÉE SUR UNE GARANTIE, UNE RESPONSABILITÉ
CONTRACTUELLE, DÉLICTUEUSE OU AUTRE. SAUF DISPOSITION CONTRAIRE MENTIONNÉE PAR ÉCRIT
PAR LE PERSONNEL AUTORISÉ DE MEDTRONIC, NUL N’EST HABILITÉ À LIER MEDTRONIC À QUELQUE
GARANTIE OU RESPONSABILITÉ QUE CE SOIT CONCERNANT LE PRODUIT.
Les exclusions et les limitations mentionnées ci-dessus ne sont pas, et ne doivent pas être, interprétées comme
contraires aux dispositions obligatoires des lois applicables. Si une partie ou une disposition du présent Déni de
garantie devait être considérée comme illégale, non applicable ou contraire à la loi en vigueur par un tribunal
compétent, la validité des autres dispositions du présent Déni de garantie n’en sera pas affectée et tous les droits et
obligations seront interprétés et appliqués comme si le présent Déni de garantie ne contenait pas la partie ou la
disposition considérée comme non valide.
23 Français
Page 24

1 A termék leírása
10004S típus: „Y” adapter, a rövidebb szárán háromállású csappal, amellyel a kardioplégiás oldat és a leszívás között
lehet váltani. A bemenő szár menetes anyaluer-csatlakozóval van ellátva. A leszívószár egyszerű csatlakozóban
végződik. Mindkét perfúziós száron menetes apaluer-csatlakozó található.
10005 és 10005OS típus: menetes apaluer-csatlakozóban végződő, rövid szárral rendelkeznek. A kimenő szárak
egyike egyszerű csatlakozóban végződik, amelyre egy 0,48 cm (0,19 in) – 0,64 cm (0,25 in) belső átmérőjű
leszívóvezeték csatlakoztatható. A másik szár végén menetes anyaluer-csatlakozó található, amely az
adagolókészlet menetes apaluer-csatlakozójára csatlakoztatható. Az áramlás iránya a(z) 10005 típus esetében
színkódolt leszorítókkal, a(z) 10005OS típus esetében pedig színkódolt nyíllal jelölt leszorítókkal szabályozható.
10005BH típus: kettős „Y” elrendezésű adapter, amely az egyik oldalon 2 menetes apaluer-csatlakozóban, a
másikon pedig egy egyszerű csatlakozóban és egy menetes anyaluer-csatlakozóban végződik.
10005S típus: 4 szárral rendelkező perfúziós adapter. A bemenő szár menetes anyaluer-csatlakozóval van ellátva,
amely a vezetékhez csatlakozik. Egy sor „Y” csatlakozón keresztül az adapter 4 szárra oszlik, amelyek közül 2 a vénás
grafthoz vezető puha szilikonkanülben végződik. A harmadik szár végén menetes apaluer-csatlakozó található, a
negyedik pedig egy egyszerű csatlakozóban végződik, amely a rendszer leszívására használatos.
Ezek a használati utasítások a bevonat nélküli és a Cortiva™ bioaktív felülettel bevont kanülökre is érvényesek. A
Cortiva bioaktív felülettel bevont kanülök típusszáma „CB” előtaggal kezdődik. A Cortiva bioaktív felülettel kapcsolatos
további információk az „Információk a Cortiva bioaktív felülettel ellátott termékek” betétlapon találhatók.
Ez a termék steril, nem pirogén és csak egyszer használatos. A termék szobahőmérsékleten tárolandó. Maximális
szállítási hőmérséklet – bevonat nélkül: 50°C (122°F), Cortiva bevonattal: 40°C (104°F).
2 Alkalmazási terület
Az adapter kardiopulmonális bypass műtétek során használatos.
3 Ellenjavallatok
Kizárólag az utasításoknak megfelelően használandó.
4 Előírások
A megfelelő sebészeti eljárások és módszerek alkalmazása a szakorvos felelőssége. A bemutatott eljárás csak
tájékoztató jellegű. A sebész felelőssége, hogy képzettségének és tapasztalatának, illetve a műtéti eljárás és az
eljáráshoz kiválasztott folyadékbejuttató és elszívó rendszerek típusának megfelelően mérlegelje az eszköz
alkalmazhatóságát.
Az eszközt egyetlen betegben történő egyszeri használatra tervezték. Tilos a termék ismételt felhasználása,
újrafeldolgozása és újrasterilizálása. Az ismételt felhasználás, az újrafeldolgozás vagy az újrasterilizálás károsíthatja
az eszköz szerkezeti épségét, illetve az eszköz fertőződésének veszélyét hordozhatja magában, ami a beteg
sérülését, megbetegedését vagy halálát okozhatja.
Alkalmazandó, ha a termék címkéje ftalátokat jelez: A termék ftalátokat tartalmaz.
A termék ártalmatlanítása a kórházi előírásoknak megfelelően történjen.
5 Szövődmények
A termék használatával összefüggésben a következő nemkívánatos hatások ismeretesek: coagulapathia, túlzott
mértékű vérkomponens-aktiválódás vagy thrombogenitás, hemolízis, hipotenzió, fertőzés, ischaemia, neurológiai
működési zavar és szervi működési zavar.
6 Használati utasítás
1. Ellenőrizze a csomagoláson és a terméken a lejárati dátumot, és vizsgálja meg, hogy a csomagolás és a termék
nem sérültek-e meg. Ha nincs sérülés, és nem járt le a szavatossági idő, bontsa fel a csomagot, és aszeptikus
körülmények között helyezze a terméket steril területre.
2. Csatlakoztassa az egyszerű csatlakozót a leszívóvezetékre, a menetes anyaluer-csatlakozót pedig az
adagolókészletre.
3. Töltse fel a vezetékeket (és a(z) 10005S típus esetén a vénás graftra csatlakozó kanülöket is) kardioplégiás
folyadékkal.
4. A vezeték és a kardioplégiás kanül csatlakoztatásakor várjon, amíg a szár végéből csöpögni nem kezd a
kardioplégiás folyadék, és ekkor illessze a menetes apaluer-csatlakozót az előzőleg feltöltött kanül bemeneti
csatlakozójába.
5. 10005S típus: A kanül és a vénás bypass graft csatlakoztatása előtt töltse fel a graftot retrográd úton, ügyelve
arra, hogy az összes levegőt kiszorítsa belőle. Engedje fel a leszorítást, és hagyja, hogy a vénás grafthoz vezető
kanül végéből csöpögni kezdjen a kardioplégiás oldat. Vezesse lazán a kanült a graftba. Állítsa le a retrográd
24Magyar
Page 25

áramlást. Óvatosan, de határozottan vezesse a kanült a vénás graftba. A kanült egy helyben tartva perfundálja
a graftot anterográd irányban.
6. Az eljárás végeztével ártalmatlanítsa az eszközt a kórházi előírásoknak megfelelően.
7 Szavatossági nyilatkozat (globális érvényű)
Fontos! Ez a felelősségkizárás nem vonatkozik Ausztráliára.
BÁR A TERMÉK TERVEZÉSE, GYÁRTÁSA ÉS ÉRTÉKESÍTÉS ELŐTTI ELLENŐRZÉSE KÖRÜLTEKINTŐEN
SZABÁLYOZOTT FELTÉTELEK MELLETT TÖRTÉNT, ELŐFORDULHAT, HOGY A TERMÉK KÜLÖNBÖZŐ
OKOKBÓL ESETLEG NEM LÁTJA EL FELADATÁT. A MEDTRONIC NEM TUDJA FELÜGYELNI A TERMÉK
FELHASZNÁLÁSÁNAK KÖRÜLMÉNYEIT. A TERMÉK CÍMKÉIN FELTÜNTETETT FIGYELMEZTETÉSEK
TOVÁBBI INFORMÁCIÓKKAL SZOLGÁLNAK, ÉS JELEN SZAVATOSSÁGI NYILATKOZAT SZERVES
RÉSZÉNEK TEKINTENDŐEK. A MEDTRONIC ENNEK MEGFELELŐEN A TERMÉKKEL KAPCSOLATBAN
SEMMINEMŰ KIFEJEZETT VAGY TÖRVÉNYI FELELŐSSÉGET NEM VÁLLAL, TÖBBEK KÖZÖTT ARRA SEM,
HOGY A TERMÉK FORGALOMKÉPES, ÉS EGY ADOTT CÉLRA MEGFELEL. A MEDTRONIC SEMMILYEN
TERMÉSZETES VAGY JOGI SZEMÉLYNEK NEM FELEL A TERMÉK HASZNÁLATÁBÓL,
MŰKÖDÉSKÉPTELENSÉGÉBŐL VAGY HIBÁS MŰKÖDÉSÉBŐL EREDŐ ORVOSI KÖLTSÉGÉRT, SEM
KÖZVETLEN, VÉLETLEN VAGY KÖVETKEZMÉNYES KÁRÉRT, LEGYEN AZ IGÉNY ALAPJA AKÁR
SZAVATOSSÁG, AKÁR SZERZŐDÉS, AKÁR SZERZŐDÉSEN KÍVÜLI KÁROKOZÁS, AKÁR VALAMI EGYÉB
DOLOG. AMENNYIBEN ABBA A MEDTRONIC JOGOSÍTOTT SZEMÉLYZETE ÍRÁSBAN MÁSKÉPPEN BELE
NEM EGYEZIK, SENKI SEM JOGOSULT KÖTELEZNI A MEDTRONIC VÁLLALATOT SEMMILYEN
NYILATKOZATTÉTELRE VAGY SZAVATOSSÁGVÁLLALÁSRA A TERMÉKKEL KAPCSOLATBAN.
A fenti kizárásoknak és korlátozásoknak nem célja a vonatkozó jogszabályok kötelező előírásait megkerülni, és olyan
értelmezésnek nincs helye. Ha a jelen Szavatossági nyilatkozat bármely részét vagy feltételét illetékes bíróság
jogellenesnek, érvényesíthetetlennek vagy a vonatkozó jogszabályokkal ellentétesnek mondja ki, az a Szavatossági
nyilatkozat fennmaradó részének érvényességét nem érinti; minden jog és kötelezettség úgy értelmezendő és
érvényesítendő, mintha a jelen Szavatossági nyilatkozat nem tartalmazná az érvénytelennek minősített részt vagy
feltételt.
25 Magyar
Page 26

1 Descrizione del prodotto
Il modello 10004S è un adattatore a Y con l’aggiunta di un rubinetto a 3 vie posizionato sul braccio corto, per la
commutazione tra cardioplegia e sfiato. La parte iniziale del punto di ingresso presenta un raccordo luer lock femmina.
Il braccio di sfiato termina con un connettore a innesto rapido. Entrambi i bracci di perfusione terminano con un
raccordo luer lock maschio.
I modelli 10005 e 10005OS sono dotati di un braccio corto che termina con un raccordo luer lock maschio. Uno dei
bracci di uscita termina con un connettore a innesto rapido che si collega a una linea di sfiato con diametro interno
compreso tra 0,48 cm (0,19 in) e 0,64 cm (0,25 in). L’altro braccio termina con un raccordo luer lock femmina che si
collega al raccordo luer lock maschio dal set di somministrazione. La direzione del flusso viene controllata mediante
clamp codificati a colori per il modello 10005 e clamp con frecce codificate a colori per il modello 10005OS.
Il modello 10005BH si presenta con una doppia configurazione a “Y” che termina con 2 raccordi luer lock maschi su
un lato e con un connettore a innesto rapido e un raccordo luer lock femmina sull’altro.
Il modello 10005S è un adattatore per perfusione a 4 bracci. La parte iniziale del punto di ingresso presenta un
raccordo luer lock femmina collegato al tubo. Mediante una serie di connettori a “Y”, l’adattatore si suddivide in
4 bracci, 2 dei quali terminano con cannule per innesto venoso morbide in silicone. Il terzo braccio termina con un
raccordo luer lock maschio e il quarto con un connettore a innesto rapido utilizzato per lo sfiato del sistema.
Le presenti istruzioni per l’uso si riferiscono sia alle cannule senza rivestimento sia alle cannule rivestite con superficie
bioattiva Cortiva™. Il numero di modello delle cannule rivestite con superficie bioattiva Cortiva contiene il prefisso
"CB". Per ulteriori informazioni sulla superficie bioattiva Cortiva, fare riferimento all’inserto "Informazioni per i prodotti
con superficie bioattiva Cortiva".
Questo prodotto è sterile, apirogeno ed esclusivamente monouso. Conservare il prodotto a temperatura ambiente.
Temperatura massima di trasporto: senza rivestimento: 50°C (122°F), con rivestimento Cortiva: 40°C (104°F).
2 Indicazioni per l’uso
Questo adattatore deve essere utilizzato durante gli interventi di bypass cardiopolmonare.
3 Controindicazioni
Utilizzare esclusivamente secondo le istruzioni.
4 Precauzioni
È responsabilità del medico adottare procedure e tecniche chirurgiche adeguate. La procedura descritta viene fornita
unicamente a scopo informativo. Ciascun chirurgo deve valutare l’adeguatezza della procedura in base alla propria
formazione ed esperienza medica e al tipo di sistemi di somministrazione e aspirazione scelti per la procedura.
Il dispositivo è destinato all’utilizzo monouso su un singolo paziente. Non riutilizzare, rigenerare o risterilizzare il
prodotto. Il riutilizzo, la rigenerazione o la risterilizzazione possono compromettere l’integrità strutturale del dispositivo
o comportare un rischio di contaminazione dello stesso con conseguenti lesioni, insorgenza di malattie o decesso del
paziente.
Se l’etichetta del prodotto indica la presenza di ftalati: questo prodotto contiene ftalati.
Procedere allo smaltimento del prodotto in conformità alle direttive dell’ospedale.
5 Effetti indesiderati
Gli effetti indesiderati noti associati all’utilizzo di questo prodotto sono: coagulopatia, trombogenicità o eccessiva
attivazione dei componenti ematici, emolisi, ipotensione, infezione, ischemia, disfunzione neurologica e degli organi.
6 Istruzioni per l’uso
1. Ispezionare la confezione e il prodotto per verificare la presenza di eventuali danni e per controllare la data di
scadenza. Se il prodotto non presenta danni e non è scaduto, aprire la confezione e trasferire il prodotto sul
campo sterile utilizzando una tecnica asettica.
2. Collegare il connettore a innesto rapido alla linea di sfiato e il raccordo luer lock femmina al set di
somministrazione.
3. Procedere al priming di tutti i tubi (e della cannula per innesto venoso per il modello 10005S) con la soluzione
cardioplegica.
4. Per collegare il tubo alla cannula per cardioplegia, attendere che la soluzione cardioplegica fluisca dall’estremità
finale e collegare il raccordo luer lock maschio al raccordo di ingresso della cannula precedentemente sottoposta
a priming.
5. Modello 10005S: per collegare la cannula per innesto venoso all’innesto del bypass, sottoporre l’innesto a
priming retrogrado ed espellere con cura tutta l’aria. Aprire il clamp e lasciare che la soluzione cardioplegica
fluisca dall’estremità finale della cannula per innesto venoso. Inserire la cannula nell’innesto. Arrestare il flusso
26Italiano
Page 27

retrogrado. Inserire con attenzione e decisione la cannula nell’innesto. Tenendo la cannula in posizione, eseguire
la perfusione anterograda dell’innesto.
6. A procedura completata, smaltire il prodotto in conformità alle direttive dell’ospedale.
7 Esclusione dalla garanzia (globale)
Importante: questa esclusione dalla garanzia non è valida in Australia.
SEBBENE IL PRODOTTO SIA STATO ACCURATAMENTE PROGETTATO, REALIZZATO E TESTATO IN
CONDIZIONI ATTENTAMENTE CONTROLLATE PRIMA DI ESSERE COMMERCIALIZZATO, IL PRODOTTO
POTREBBE NON FUNZIONARE IN MODO SODDISFACENTE PER DIVERSE RAGIONI. MEDTRONIC NON
ESERCITA ALCUN CONTROLLO SULLE MODALITÀ DI IMPIEGO DEL PRODOTTO. LE AVVERTENZE
INDICATE SULLE ETICHETTE DEL PRODOTTO FORNISCONO INFORMAZIONI PIÙ DETTAGLIATE A TALE
RIGUARDO E SONO DA CONSIDERARSI PARTE INTEGRANTE DELLA PRESENTE ESCLUSIONE DALLA
GARANZIA. DI CONSEGUENZA, MEDTRONIC NON RILASCIA ALCUNA GARANZIA, NÉ ESPRESSA NÉ
TACITA, IN MERITO AL PRODOTTO COMPRESA, TRA L’ALTRO, QUALSIASI GARANZIA IMPLICITA DI
COMMERCIABILITÀ O DI IDONEITÀ A DETERMINATI SCOPI. MEDTRONIC NON PUÒ IN ALCUN CASO
ESSERE RITENUTA RESPONSABILE NEI CONFRONTI DI ALCUN SOGGETTO O ENTITÀ, PER SPESE
MEDICHE, DANNI DIRETTI, INCIDENTALI O CONSEQUENZIALI CAUSATI DALL’USO, DAI DIFETTI O DAL
MALFUNZIONAMENTO DEL PRODOTTO, INDIPENDENTEMENTE DAL FATTO CHE LA RICHIESTA DI
RISARCIMENTO DI TALI DANNI SIA BASATA SU GARANZIA, CONTRATTO, FATTO ILLECITO O ALTRO.
SALVO DIVERSO ACCORDO SOTTOSCRITTO DA PERSONALE AUTORIZZATO MEDTRONIC, NESSUN
SOGGETTO HA L’AUTORITÀ DI VINCOLARE MEDTRONIC A QUALSIASI RAPPRESENTAZIONE O GARANZIA
IN MERITO AL PRODOTTO.
Le esclusioni e le restrizioni di cui sopra non sono intese, né devono essere interpretate, come contravvenenti a norme
ritenute inderogabili dalla legislazione vigente. Nel caso in cui una parte od un termine della presente Esclusione dalla
Garanzia venga giudicato illegale, inefficace od in conflitto con la legge vigente, la validità delle rimanenti parti della
presente Esclusione dalla Garanzia non verrà compromessa e tutti i diritti e gli obblighi verranno interpretati ed
applicati come se la presente Esclusione dalla Garanzia non contenesse la parte od i termini ritenuti non validi.
27 Italiano
Page 28

1 Productbeschrijving
Model 10004S is een “Y”-verloopstuk met een 3-weg plugkraan aan de korte aftakking om te schakelen tussen
cardioplegie en ontluchting. De toevoer begint met een afsluitbare, vrouwelijke luerfitting. De ontluchtings-aftakking
eindigt met een schuifconnector. Beide perfusie-aftakkingen eindigen met een afsluitbare, mannelijke luerfitting.
Model 10005 en 10005OS hebben een korte aftakking die eindigt met een afsluitbare, mannelijke luerfitting. Eén van
de uitlaat-aftakkingen eindigt met een schuifconnector die kan worden aangesloten op een ontluchtingslijn met een
binnendiameter van 0,48 cm (0,19 in) tot 0,64 cm (0,25 in). De andere aftakking eindigt met een afsluitbare,
vrouwelijke luerfitting die kan worden aangesloten op de afsluitbare, mannelijke luerfitting van de toedieningsset. Op
Model 10005 kan de stroomrichting worden geregeld met de kleurgecodeerde klemmen. Op Model 10005OS kan dit
met de klemmen met kleurgecodeerde pijlen.
Model 10005BH is een dubbel “Y”-systeem dat eindigt in 2 afsluitbare, mannelijke luerfittings aan de ene kant, en een
schuifconnector en afsluitbare, vrouwelijke, luerfitting aan de andere kant.
Model 10005S is een perfusieverloopstuk met 4 aftakkingen. De toevoer begint met een afsluitbare, vrouwelijke
luerfitting die is aangesloten op de slang. Via een aantal “Y”-connectoren splitst het verloopstuk zich in 4 aftakkingen,
waarvan er 2 eindigen met zachte siliconen canules voor veneuze grafts. De derde aftakking eindigt met een
afsluitbare, mannelijke luerfitting en de vierde met een schuifconnector die wordt gebruikt om het systeem te
ontluchten.
Deze instructies gelden zowel voor ongecoate canules als voor canules gecoat met een bioactieve
Cortiva™-oppervlaktelaag. Canules gecoat met een bioactieve Cortiva-oppervlaktelaag zijn herkenbaar aan een
modelnummer dat begint met "CB”. Zie de bijlage “Informatie voor producten met een bioactieve
Cortiva-oppervlaktelaag” voor meer informatie over de bioactieve Cortiva-oppervlaktelaag.
Dit product is steriel, niet-pyrogeen en uitsluitend bestemd voor eenmalig gebruik. Bewaar het product bij
kamertemperatuur. Maximale transporttemperatuur: ongecoat 50°C (122°F), gecoat met Cortiva 40°C (104°F).
2 Gebruiksindicaties
Dit verloopstuk is bedoeld om te gebruiken bij cardiopulmonaire bypassoperaties.
3 Contra-indicaties
Alleen gebruiken volgens de instructies.
4 Voorzorgsmaatregelen
De juiste chirurgische procedures en technieken vallen onder de verantwoordelijkheid van de arts. De beschreven
procedure wordt slechts ter informatie aangeboden. Elke chirurg moet de geschiktheid van de procedure evalueren
op basis van zijn of haar medische opleiding en ervaring, en het type plaatsings- en vacuümsysteem dat voor de
procedure wordt gebruikt.
Dit product is uitsluitend bedoeld voor eenmalig gebruik bij één patiënt. Niet hergebruiken, herverwerken of
hersteriliseren. Door hergebruiken, herverwerken of hersteriliseren kan het product worden besmet of de structuur
ervan worden aangetast, hetgeen kan resulteren in letsel, ziekte of overlijden van de patiënt.
Van toepassing op producten waarbij ftalaten op het label staat vermeldt: Dit product bevat ftalaten.
Werp het product weg volgens de richtlijnen van het ziekenhuis.
5 Bijwerkingen
De volgende bekende bijwerkingen kunnen bij het gebruik van dit product optreden: bloedverlies, coagulopathie,
embolie, overmatig activeren van bloedcomponenten of trombogenese, hemolyse, hypotensie, infectie, ischemie,
neurologische disfunctie en orgaanfalen.
6 Gebruiksinstructies
1. Controleer de verpakking en het product op beschadigingen en controleer de uiterste gebruiksdatum. Als er geen
beschadigingen zijn en de uiterste gebruiksdatum niet is verstreken, opent u de verpakking en brengt u het
product met een steriele techniek over naar het steriele veld.
2. Sluit de schuifconnector aan op de ontluchtingslijn en de afsluitbare, vrouwelijke luerfitting op de toedieningsset.
3. Vul alle slangen (en de veneuze-graftcanules voor Model 10005S) handmatig met cardioplegievloeistof.
4. Laat bij het aansluiten van de slang op de cardioplegiecanule de cardioplegievloeistof uit het uiteinde druppelen
en sluit de afsluitbare, mannelijke luerfitting aan op de toevoerfitting van de vooraf gevulde canule.
5. Model 10005S: Voor het aansluiten van de veneuze-graftcanule op de bypassgraft moet de graft eerst
retrograad worden gevuld om ervoor te zorgen dat alle aanwezige lucht wordt verwijderd. Open de klem en laat
de cardioplegievloeistof aan het uiteinde uit de veneuze-graftcanule druppelen. Schuif de canule losjes in de
28Nederlands
Page 29

graft. Stop de retrograde flow. Schuif de veneuze-graftcanule voorzichtig helemaal in de graft. Houd de canule op
zijn plaats en voer een anterograde perfusie uit van de graft.
6. Werp het product na voltooiing van de procedure weg volgens de voorschriften van het ziekenhuis.
7 Uitsluiting van garantie (wereldwijd)
Belangrijk: Deze uitsluiting van garantie geldt niet in Australië.
HOEWEL HET PRODUCT ONDER ZORGVULDIG GECONTROLEERDE OMSTANDIGHEDEN IS ONTWORPEN,
VERVAARDIGD EN VÓÓR DE VERKOOP GETEST, KUNNEN ER VERSCHILLENDE REDENEN ZIJN WAAROM
HET PRODUCT NIET VOLGENS DE SPECIFICATIES WERKT. DE MANIER WAAROP HET PRODUCT WORDT
GEBRUIKT LIGT BUITEN DE CONTROLE VAN MEDTRONIC. DE WAARSCHUWINGEN IN DE
PRODUCTDOCUMENTATIE BIEDEN MEER GEDETAILLEERDE INFORMATIE EN VORMEN EEN INTEGRAAL
ONDERDEEL VAN DEZE UITSLUITING VAN GARANTIE. MEDTRONIC VERLEENT DAAROM GEEN ENKELE
GARANTIE, NOCH EXPLICIET NOCH IMPLICIET, MET BETREKKING TOT HET PRODUCT, MET INBEGRIP
VAN MAAR NIET BEPERKT TOT EVENTUELE IMPLICIETE GARANTIES BETREFFENDE
VERKOOPBAARHEID OF GESCHIKTHEID VOOR BEPAALDE TOEPASSINGEN. MEDTRONIC KAN DOOR
GEEN ENKEL RECHTSPERSOON AANSPRAKELIJK WORDEN GESTELD VOOR MEDISCHE KOSTEN OF
DIRECTE, INCIDENTELE OF GEVOLGSCHADE VEROORZAAKT DOOR OM HET EVEN WELK GEBRUIK,
DEFECT, FALEN OF ONJUIST FUNCTIONEREN VAN HET PRODUCT, ONGEACHT OF DE VORDERING IS
GEBASEERD OP EEN GARANTIE, CONTRACT, ONRECHTMATIGE DAAD OF ANDERSZINS. GEEN ENKELE
PERSOON IS GEMACHTIGD MEDTRONIC TE BINDEN AAN ENIGE VERKLARING OF GARANTIE MET
BETREKKING TOT HET PRODUCT, TENZIJ SCHRIFTELIJK ANDERS IS OVEREENGEKOMEN MET BEVOEGD
PERSONEEL VAN MEDTRONIC.
De uitsluitingen en beperkingen die hierboven uiteengezet zijn, zijn niet bedoeld, en moeten niet geïnterpreteerd
worden als een inbreuk op dwingende bepalingen van de van toepassing zijnde wet. Indien enig onderdeel of enige
bepaling van deze Uitsluiting van Garantie door een daartoe bevoegde rechtbank als onrechtmatig, onuitvoerbaar of
in strijd met de van toepassing zijnde wet beschouwd wordt, zal dit de geldigheid van de overige delen van deze
Uitsluiting van Garantie niet aantasten en zullen alle rechten en verplichtingen worden uitgelegd en ten uitvoer worden
gebracht alsof deze Uitsluiting van Garantie het betreffende ongeldig verklaarde gedeelte niet bevatte.
29 Nederlands
Page 30

1 Beskrivelse av produktet
Modell 10004S er en Y-kontakt med en treveiskran på den korte delen for å veksle mellom kardioplegi og ventilering.
Inngangen starter med en låsbar hunnluerkobling. Ventileringsdelen ender i en glidekobling. Begge perfusjonsdelene
ender i låsbare hannluerkoblinger.
Modell 10005 og 10005OS har en kort del som ender i en låsbar hannluerkobling. Én av utgangsdelene ender i en
glidekobling som kobles til en ventileringsslange med indre diameter på 0,48 cm (0,19 in) til 0,64 cm (0,25 in). Den
andre delen ender i en låsbar hunnluerkobling som kobles til den låsbare hannluerkoblingen fra administrasjonssettet.
Strømningsretningen kontrolleres av fargekodede klemmer på modell 10005 og klemmer med fargekodede piler på
modell 10005OS.
Modell 10005BH er en dobbel Y-konfigurasjon som ender i 2 låsbare hannluerkoblinger på den ene siden, og en
glidekobling og låsbar hunnluerkobling på den andre siden.
Modell 10005S er en perfusjonskontakt med 4 deler. Inngangen starter med en låsbar hunnluerkobling festet til
slangen. Gjennom en serie Y-kontakter deles kontakten i 4 deler, hvorav 2 ender i en myk venegraftkanyle av silikon.
Den tredje delen ender i en låsbar hannluerkobling, og den fjerde ender i en glidekobling som brukes til å ventilere
systemet.
Denne bruksanvisningen gjelder både for den ubelagte kanylen og for kanylen som er belagt med Cortiva™ bioaktiv
overflate. Kanylen som er belagt med Cortiva bioaktiv overflate, har prefikset “CB” i modellnummeret. Du finner mer
informasjon om Cortiva bioaktiv overflate i vedlegget “Informasjon for produkter med Cortiva bioaktiv overflate”.
Produktet er sterilt og ikke-pyrogent, og er kun beregnet for engangsbruk. Oppbevar produktet ved romtemperatur.
Maksimal forsendelsestemperatur: ubelagt 50°C (122°F), belagt med Cortiva 40°C (104°F).
2 Indikasjoner for bruk
Denne kontakten er ment for bruk i forbindelse med kardiopulmonal bypasskirurgi.
3 Kontraindikasjoner
Skal kun brukes som anvist.
4 Forholdsregler
Riktige kirurgiske prosedyrer og teknikker er legens ansvar. Prosedyren som beskrives er kun til informasjon. Kirurgen
må selv vurdere om prosedyren er hensiktsmessig på grunnlag av egen medisinsk opplæring og erfaring, samt de
aktuelle systemene for tilførsel og sug som er valgt for prosedyren.
Denne enheten skal kun brukes til én enkelt pasient. Produktet må ikke brukes, bearbeides eller steriliseres flere
ganger. Hvis enheten brukes, bearbeides eller steriliseres flere ganger, kan det påvirke enhetens strukturelle integritet
eller skape en risiko for kontaminering av enheten, som kan føre til at pasienten skades, blir syk eller dør.
Gjelder for produkter med ftalater identifisert på produktmerkingen: Dette produktet inneholder ftalater.
Produktet skal avhendes i samsvar med sykehusets retningslinjer.
5 Bivirkninger
Følgende kjente bivirkninger er forbundet med bruken av produktet: koagulopati, høy blodkomponentaktivering eller
trombogenisitet, hemolyse, hypotensjon, infeksjon, iskemi, nevrologisk dysfunksjon og organdysfunksjon.
6 Bruksanvisning
1. Kontroller om pakningen og produktet er skadet, og kontroller også siste forbruksdag. Hvis pakningen ikke er
skadet eller utgått, kan du åpne den og overføre produktet til det sterile feltet ved hjelp av aseptisk teknikk.
2. Koble glidekoblingen til ventileringsslangen og den låsbare hunnluerkoblingen til administrasjonssettet.
3. Prime alle slangene (og venegraftkanylen for modell 10005S) med kardioplegivæske.
4. Når slangen skal kobles til kardioplegikanylen, skal du la kardioplegivæsken dryppe fra enden og koble den
låsbare hannluerkoblingen til inngangskoblingen på den forprimede kanylen.
5. Modell 10005S: Når venegraftkanylen skal kobles til bypassgraftet, skal du først utføre en retrograd priming av
graftet og sørge for at all luft fortrenges. Åpne klemmen og la kardioplegivæsken dryppe fra enden av
venegraftkanylen. Før kanyletuppen løst inn i graftet. Stopp den retrograde strømningen. Sett venegraftkanylen
inn i graftet på en forsiktig og bestemt måte. Hold kanylen på plass mens du utfører en antegrad perfusjon av
graftet.
6. Når prosedyren er fullført, avhendes produktet i samsvar med sykehusets retningslinjer.
7 Ansvarsfraskrivelse (global)
Viktig! Denne garantifraskrivelsen gjelder ikke i Australia.
30Norsk
Page 31

SELV OM PRODUKTET ER KONSTRUERT, FREMSTILT OG TESTET UNDER NØYE KONTROLLERTE
FORHOLD FØR SALG, KAN DET AV EN REKKE ULIKE GRUNNER LIKEVEL SKJE AT PRODUKTET IKKE
OPPFYLLER SIN TILTENKTE FUNKSJON. MEDTRONIC HAR INGEN KONTROLL OVER FORHOLDENE
DETTE PRODUKTET BRUKES UNDER. ADVARSLENE SOM FINNES I PRODUKTMERKINGEN, INNEHOLDER
MER DETALJERT INFORMASJON OG SKAL BETRAKTES SOM EN UATSKILLELIG DEL AV DENNE
ANSVARSFRASKRIVELSEN. MEDTRONIC FRASKRIVER SEG DERFOR ALT GARANTIANSVAR, BÅDE
UTTRYKT OG UNDERFORSTÅTT, FOR DETTE PRODUKTET, INKLUDERT, MEN IKKE BEGRENSET TIL,
ENHVER UNDERFORSTÅTT GARANTI VEDRØRENDE SALGBARHET ELLER EGNETHET TIL ET BESTEMT
FORMÅL. MEDTRONIC PÅTAR SEG IKKE ANSVAR OVERFOR NOEN PERSON ELLER JURIDISK ENHET FOR
MEDISINSKE UTGIFTER ELLER DIREKTE ELLER TILFELDIGE SKADER ELLER FØLGESKADER
FORÅRSAKET AV BRUK ELLER DEFEKT, SVIKT ELLER FEIL PÅ PRODUKTET, ENTEN KRAVET ER BASERT
PÅ GARANTI, KONTRAKT, ERSTATNINGSKRAV UTENFOR KONTRAKTSFORHOLD ELLER PÅ NOEN ANNEN
MÅTE. MED UNNTAK AV SAMTYKKE SOM ELLERS ER GITT SKRIFTLIG AV AUTORISERT
MEDTRONIC-PERSONELL, HAR INGEN PERSON MYNDIGHET TIL Å BINDE MEDTRONIC TIL NOEN LØFTER
ELLER GARANTIER MED HENSYN TIL PRODUKTET.
Unntakene og begrensningene som er angitt ovenfor, er ikke ment å omgå obligatoriske bestemmelser i gjeldende lov
og skal heller ikke tolkes slik. Hvis en kompetent domstol finner at en del eller betingelse i denne ansvarsfraskrivelsen
er ulovlig, ikke kan håndheves eller er i strid med gjeldende lov, skal gyldigheten til de øvrige delene av denne
ansvarsfraskrivelsen ikke berøres, og alle rettigheter og plikter skal tolkes og håndheves som om denne
ansvarsfraskrivelsen ikke inneholdt den bestemte delen eller betingelsen som ble funnet å være ugyldig.
31 Norsk
Page 32

1 Opis produktu
Model 10004S to łącznik typu „Y” z 3-drożnym kurkiem zamykającym umieszczonym na krótkim odgałęzieniu,
umożliwiającym przełączanie pomiędzy podawaniem kardiopleginy a odprowadzaniem powietrza. Część wlotowa
jest wyposażona w żeńskie złącze typu luer lock. Odgałęzienie do odprowadzania powietrza zakończone jest
wsuwanym konektorem. Obydwa odgałęzienia perfuzyjne zakończone są męskimi złączami typu luer lock.
Modele 10005 i 10005OS są wyposażone w krótkie odgałęzienie zakończone męskim złączem typu luer lock. Jedno
z odgałęzień wylotowych zakończone jest wsuwanym konektorem podłączanym do linii odprowadzania powietrza o
średnicy wewnętrznej od 0,48 cm (0,19 in (cala)) do 0,64 cm (0,25 in (cala)). Na końcu drugiego odgałęzienia znajduje
się żeńskie złącze typu luer lock, podłączane do męskiego złącza typu luer lock zestawu do podawania kardiopleginy.
Kierunek przepływu w modelu 10005 jest regulowany za pomocą oznaczonych kolorami zacisków, a w
modelu 10005OS za pomocą zacisków z oznaczonymi kolorem strzałkami.
Model 10005BH jest wyposażony w dwa konektory typu „Y” zakończone 2 męskimi złączami typu luer lock po jednej
stronie i wsuwanym konektorem oraz żeńskim złączem typu luer lock po drugiej stronie.
Model 10005S to łącznik do perfuzji z czterema odgałęzieniami. Część wlotowa jest wyposażona w podłączone do
drenu, żeńskie złącze typu luer lock. Zastosowanie kilku konektorów typu „Y” umożliwiło uzyskanie 4 odgałęzień, z
których 2 zakończone są elastycznymi, silikonowymi kaniulami do pomostowania żylnego. Trzecie odgałęzienie
zakończone jest męskim złączem typu luer lock, a czwarte wyposażono we wsuwany konektor służący do
odprowadzania powietrza z układu.
Niniejsza instrukcja użytkowania ma zastosowanie zarówno do kaniul niepowlekanych, jak i do kaniul pokrytych
powłoką bioaktywną Cortiva™. Numery modeli kaniul pokrytych powłoką bioaktywną Cortiva zaczynają się od
przedrostka „CB”. Dodatkowe informacje na temat powłoki bioaktywnej Cortiva zawiera broszura „Informacje
dotyczące produktów z powłoką bioaktywną Cortiva”.
Niniejszy produkt jest jałowy, niepirogenny i przeznaczony wyłącznie do jednorazowego użytku. Produkt należy
przechowywać w temperaturze pokojowej. Maksymalna temperatura transportu: niepowlekane: 50°C (122°F), z
powłoką Cortiva: 40°C (104°F).
2 Wskazania do stosowania
Ten łącznik jest przeznaczony do stosowania podczas zabiegów z wykorzystaniem krążenia pozaustrojowego.
3 Przeciwwskazania
Stosować wyłącznie zgodnie z instrukcjami.
4 Środki ostrożności
Odpowiedzialność za stosowanie prawidłowych procedur i technik chirurgicznych spoczywa na personelu
medycznym. Opisana procedura została podana tylko w celach informacyjnych. Celowość zabiegu musi być
oceniona każdorazowo przez chirurga w oparciu o jego własne wykształcenie medyczne i doświadczenie oraz z
uwzględnieniem rodzaju systemów podawania i odsysania wybranych do zabiegu.
Urządzenie jest przeznaczone wyłącznie do użytku u jednego pacjenta. Nie używać ponownie, nie przystosowywać
do ponownego użycia ani nie poddawać produktu ponownej sterylizacji. Ponowne użycie, przygotowanie do
ponownego użycia lub ponowna sterylizacja mogą naruszyć integralność strukturalną urządzenia lub doprowadzić do
jego skażenia, co może spowodować obrażenia, chorobę lub zgon pacjenta.
Dotyczy produktów, na których etykiecie umieszczono informację o zawartości ftalanów: Ten produkt zawiera
ftalany.
Usunąć produkt zgodnie z zasadami obowiązującymi w danej placówce szpitalnej.
5 Działania niepożądane
Ze stosowaniem produktu związane są następujące znane działania niepożądane: koagulopatia, nadmierna
aktywacja składników krwi lub trombogeniczność, hemoliza, niedociśnienie, zakażenie, niedokrwienie, dysfunkcja
neurologiczna i dysfunkcja narządów.
6 Instrukcja użytkowania
1. Sprawdzić stan opakowania i produktu pod kątem uszkodzeń, a także upewnić się co do terminu ważności. Jeśli
opakowanie nie jest uszkodzone i nie minął termin ważności, otworzyć je i z zachowaniem jałowości przenieść
produkt na sterylne pole.
2. Podłączyć wsuwany konektor do linii odprowadzania powietrza, a żeńskie złącze typu luer lock do zestawu do
podawania kardiopleginy.
3. Napełnić wstępnie wszystkie dreny (oraz kaniulę do pomostowania żylnego w przypadku modelu 10005S)
kardiopleginą.
32Polski
Page 33

4. W celu podłączenia drenu do kaniuli doprowadzającej kardiopleginę należy umożliwić wypływ kardiopleginy
z końcówki i podłączyć męskie złącze typu luer lock do złącza wlotowego wstępnie napełnionej kaniuli.
5. Model 10005S: W celu podłączenia kaniuli do pomostowania żylnego do pomostu naczyniowego należy
najpierw napełnić pomost z użyciem przepływu wstecznego, aby usunąć z niego całe powietrze. Następnie
otworzyć zacisk i umożliwić wypływ kardiopleginy z końcówki kaniuli do pomostowania żylnego. Luźno
wprowadzić kaniulę do pomostu. Zatrzymać przepływ wsteczny. Ostrożnie i stabilnie wprowadzić kaniulę do
pomostowania żylnego do wnętrza pomostu. Przytrzymując kaniulę w żądanym miejscu, dokonać perfuzji
pomostu z użyciem normalnego przepływu.
6. Po zakończeniu procedury usunąć produkt zgodnie z przepisami obowiązującymi w danej placówce szpitalnej.
7 Wyłączenie gwarancji (obowiązuje na całym świecie)
Ważne: Niniejsze wyłączenie gwarancji nie ma zastosowania w Australii.
NIEZALEŻNIE OD FAKTU, ŻE PRODUKT ZOSTAŁ PRZED WPROWADZENIEM DO SPRZEDAŻY
ZAPROJEKTOWANY, WYTWORZONY I PRZETESTOWANY W ŚCIŚLE KONTROLOWANYCH WARUNKACH,
PRODUKT MOŻE NIE SPEŁNIAĆ W ZADOWALAJĄCY SPOSÓB ZAMIERZONYCH FUNKCJI Z WIELU
POWODÓW. FIRMA MEDTRONIC NIE MA KONTROLI NAD WARUNKAMI, W JAKICH PRODUKT JEST
UŻYWANY. OSTRZEŻENIA PODANE NA ETYKIETACH PRODUKTU ZAWIERAJĄ BARDZIEJ SZCZEGÓŁOWE
INFORMACJE I STANOWIĄ INTEGRALNĄ CZĘŚĆ NINIEJSZEGO WYŁĄCZENIA GWARANCJI. FIRMA
MEDTRONIC NINIEJSZYM WYKLUCZA WSZELKIE GWARANCJE W ODNIESIENIU DO PRODUKTU,
ZARÓWNO WYRAŹNE, JAK I DOROZUMIANE, WŁĄCZAJĄC W TO RÓWNIEŻ WSZELKIE DOROZUMIANE
GWARANCJE PRZYDATNOŚCI HANDLOWEJ LUB PRZYDATNOŚCI DO OKREŚLONEGO CELU. FIRMA
MEDTRONIC NIE PONOSI ODPOWIEDZIALNOŚCI WOBEC JAKIEJKOLWIEK OSOBY LUB INNEGO
PODMIOTU ZA JAKIEKOLWIEK KOSZTY MEDYCZNE ANI JAKIEKOLWIEK BEZPOŚREDNIE, PRZYPADKOWE
LUB WTÓRNE SZKODY SPOWODOWANE DOWOLNYM ZASTOSOWANIEM, WADĄ, AWARIĄ LUB
NIEPRAWIDŁOWYM DZIAŁANIEM PRODUKTU, BEZ WZGLĘDU NA TO, CZY ROSZCZENIE ZOSTANIE
WYSUNIĘTE NA PODSTAWIE GWARANCJI, UMOWY, ODPOWIEDZIALNOŚCI ZA SZKODĘ WYRZĄDZONĄ
CZYNEM NIEDOZWOLONYM LUB W INNY SPOSÓB. O ILE AUTORYZOWANY PRACOWNIK FIRMY
MEDTRONIC NIE WYRAZIŁ NA TO PISEMNEJ ZGODY, ŻADNA OSOBA NIE JEST UPRAWNIONA DO
ZWIĄZANIA FIRMY MEDTRONIC JAKĄKOLWIEK DEKLARACJĄ LUB GWARANCJĄ W ODNIESIENIU DO
PRODUKTU.
Wyżej określone wyłączenia i ograniczenia nie mają na celu naruszania obowiązkowych uregulowań stosowanego
prawa i nie należy ich tak interpretować. Jeśli którakolwiek część lub warunek niniejszego wyłączenia gwarancji
zostaną uznane przez właściwy sąd za nielegalne, niemożliwe do wyegzekwowania lub kolidujące z obowiązującym
prawem, fakt ten nie wpłynie na ważność pozostałych części wyłączenia gwarancji, a wszelkie uprawnienia
i zobowiązania będą interpretowane i egzekwowane tak, jak gdyby niniejsze wyłączenie gwarancji nie zawierało danej
części lub warunku uznanych za nieważne.
33 Polski
Page 34

1 Descrição do produto
O modelo 10004S é um adaptador em “Y” com adição de uma torneira de passagem de 3 vias no pé curto para
alternar entre a cardioplegia e a ventilação. A secção de entrada termina com um encaixe de bloqueio Luer fêmea. O
pé de ventilação termina num conector de encaixe. Ambos os pés de perfusão terminam com encaixes de bloqueio
Luer macho.
Os modelos 10005 e 10005OS têm um pé curto que termina com um encaixe de bloqueio Luer macho. Um dos pés
de saída termina com um conector de encaixe que se liga a uma linha de ventilação com diâmetro interno de 0,48 cm
(0,19 in [pol.]) a 0,64 cm (0,25 in [pol.]). O outro pé termina com um encaixe de bloqueio Luer fêmea para ligar com
o encaixe de bloqueio Luer macho do conjunto de administração. A direção do fluxo é controlada pelas pinças
codificadas por cor no modelo 10005 e pelas pinças com setas codificadas por cor no modelo 10005OS.
O modelo 10005BH é de configuração em “Y” duplo que termina em 2 encaixes de bloqueio Luer macho de um lado
e num conector de encaixe e encaixe de bloqueio Luer fêmea do outro lado.
O modelo 10005S é um adaptador de perfusão de 4 pés. A secção de entrada termina com um encaixe de bloqueio
Luer fêmea ligado à tubagem. Através de uma série de conectores em “Y”, o adaptador divide-se em 4 pés, 2 dos
quais terminam com cânulas de enxertos de veias em silicone maleável. O terceiro pé termina com um encaixe de
bloqueio Luer macho e o quarto termina com um conector de encaixe utilizado para ventilar o sistema.
Estas instruções de utilização aplicam-se a cânulas não revestidas e a cânulas revestidas com a superfície bioativa
Cortiva™. As cânulas revestidas com a superfície bioativa Cortiva incluem um prefixo “CB” no número do modelo.
Para obter mais informações sobre a superfície bioativa Cortiva, consulte a adenda “Informações para produtos com
superfície bioativa Cortiva”.
Este produto é estéril, não pirogénico e destina-se a uma única utilização. Guarde o produto à temperatura ambiente.
Temperatura máxima de transporte: não revestido 50°C (122°F), revestido com Cortiva 40°C (104°F).
2 Indicações de utilização
Este adaptador destina-se a utilização em cirurgia de bypass cardiopulmonar.
3 Contraindicações
Utilize apenas de acordo com as indicações.
4 Precauções
As técnicas e procedimentos cirúrgicos adequados são da responsabilidade do profissional médico. O procedimento
descrito é fornecido apenas a título informativo. Os cirurgiões devem avaliar a adequação do procedimento com base
na sua própria formação e experiência médica e no tipo de sistemas de administração e aspiração selecionados para
o procedimento.
Este dispositivo foi concebido apenas para utilização num único doente. Não reutilize, reprocesse ou volte a esterilizar
este produto. A reutilização, o reprocessamento ou a reesterilização poderão comprometer a integridade estrutural
do dispositivo ou criar um risco de contaminação do dispositivo, o que poderá resultar em lesões, doença ou morte
do doente.
Aplicável a produtos em cuja etiqueta surja a indicação de ftalatos: Este produto contém ftalatos.
Elimine o produto de acordo com a política hospitalar.
5 Efeitos adversos
Os seguintes efeitos adversos conhecidos estão associados à utilização do produto: coagulopatia, ativação
excessiva dos componentes sanguíneos ou trombogenicidade, hemólise, hipotensão, infeção, isquemia, disfunção
neurológica e disfunção de órgãos.
6 Instruções de utilização
1. Inspecione a embalagem e o produto, verificando se existem danos e confirmando a data de validade. Se não
existirem danos e se o prazo de validade não tiver expirado, abra a embalagem e transfira o produto para o campo
estéril, utilizando uma técnica asséptica.
2. Ligue o conector de encaixe à linha de ventilação e o encaixe de bloqueio Luer fêmea ao conjunto de
administração.
3. Encha toda a tubagem (e as cânulas de enxertos de veias para o modelo 10005S) com solução de cardioplegia.
4. Para ligar a tubagem à cânula de cardioplegia, permita que a solução de cardioplegia goteje a partir da
extremidade e ligue o encaixe de bloqueio Luer macho ao encaixe de entrada da cânula pré-enchida.
5. Modelo 10005S: Para ligar a cânula de enxerto de veias ao enxerto de bypass, encha primeiro o enxerto de
forma retrógrada, certificando-se de que todo o ar é expelido. Abra a pinça e deixe a solução de cardioplegia
gotejar a partir da extremidade da cânula de enxerto de veias. Introduza a cânula no enxerto. Pare o fluxo
34Português (Portugal)
Page 35

retrógrado. Insira cuidadosamente a cânula de enxerto de veias no enxerto. Enquanto mantém a cânula no lugar,
perfure o enxerto de forma anterógrada.
6. Após concluir o procedimento, elimine o produto de acordo com a política hospitalar.
7 Renúncia de garantia (global)
Importante: Esta renúncia de garantia não se aplica à Austrália.
EMBORA O PRODUTO TENHA SIDO DESENHADO, FABRICADO E TESTADO EM CONDIÇÕES
CUIDADOSAMENTE CONTROLADAS ANTES DA COMERCIALIZAÇÃO, O PRODUTO PODE NÃO
DESEMPENHAR A SUA FUNÇÃO DEVIDO A UMA VARIEDADE DE MOTIVOS. A MEDTRONIC NÃO TEM
CONTROLO SOBRE AS CONDIÇÕES EM QUE ESTE PRODUTO É UTILIZADO. OS AVISOS CONTIDOS NA
DOCUMENTAÇÃO DO PRODUTO FORNECEM INFORMAÇÕES MAIS DETALHADAS E SÃO CONSIDERADOS
UMA PARTE INTEGRANTE DESTA RENÚNCIA DE GARANTIA. ASSIM, A MEDTRONIC RENUNCIA TODAS AS
GARANTIAS, EXPRESSAS OU IMPLÍCITAS, RELATIVAS AO PRODUTO, INCLUINDO, MAS NÃO
EXCLUSIVAMENTE, QUAISQUER GARANTIAS IMPLÍCITAS DE COMERCIALIZAÇÃO OU DE ADEQUAÇÃO A
UM FIM ESPECÍFICO. A MEDTRONIC NÃO SERÁ RESPONSÁVEL, PERANTE NENHUMA PESSOA OU
ENTIDADE, POR QUAISQUER DESPESAS MÉDICAS OU POR QUAISQUER DANOS DIRETOS, ACIDENTAIS
OU INDIRETOS CAUSADOS POR QUALQUER TIPO DE UTILIZAÇÃO, DEFEITO, FALHA OU MAU
FUNCIONAMENTO DO PRODUTO, QUER A RECLAMAÇÃO TENHA POR BASE A GARANTIA, O CONTRATO,
DANOS OU OUTROS. SALVO ACORDO POR ESCRITO EM CONTRÁRIO FIRMADO POR FUNCIONÁRIOS
AUTORIZADOS DA MEDTRONIC, NENHUM INDIVÍDUO TERÁ QUALQUER AUTORIDADE PARA VINCULAR A
MEDTRONIC A QUALQUER DECLARAÇÃO OU GARANTIA RELATIVA AO PRODUTO.
As exclusões e limitações acima definidas não se destinam a infringir estipulações obrigatórias da lei aplicável e não
devem ser interpretadas como tal. Se alguma parte ou termo desta renúncia de garantia for considerado ilegal, não
executável ou em conflito com a lei aplicável por parte de um tribunal da jurisdição competente, a validade das partes
restantes desta renúncia de garantia não deverá ser afetada e todos os direitos e obrigações devem ser interpretados
e executados como se esta renúncia de garantia não contivesse a parte ou termo particular considerado inválido.
35 Português (Portugal)
Page 36

1 Описание продукта
Модель 10004S — это Y-образный адаптер с добавлением на коротком колене тройникового запорного
крана для переключения между кардиоплегией и вентиляцией. Вход начинается охватывающим винтовым
люэровским разъемом. Вентиляционное колено закачивается скользящим разъемом. Оба перфузионных
колена заканчиваются охватываемыми винтовыми люэровскими разъемами.
У моделей 10005 и 10005OS короткое колено заканчивается охватываемым винтовым люэровским
разъемом. Одно из выходных ответвлений заканчивается конусным разъемом, подсоединяемым к
дренажной линии с внутренним диаметром от 0,48 cm (0,19 in) до 0,64 cm (0,25 in). Другое колено
заканчивается охватывающим винтовым люэровским разъемом для соединения с охватываемым винтовым
люэровским разъемом установки для ввода раствора. На модели 10005 направление потока регулируется
зажимами с цветной маркировкой, на модели 10005OS — зажимами с цветной маркировкой и стрелкой.
Модель 10005BH — это двойная Y-образная конфигурация, одна сторона которой заканчивается
2 охватываемыми винтовыми люэровскими разъемами, а другая — скользящим разъемом и охватывающим
винтовым люэровским разъемом.
Модель 10005S — это 4-коленный перфузионный адаптер. Вход начинается охватывающим винтовым
люэровским разъемом, подсоединяемым к трубкам. Группа Y-образных соединителей разделяет адаптер на
4 колена, 2 из которых заканчиваются мягкой силиконовой канюлей венозного трансплантата. Третье колено
заканчивается охватываемым винтовым люэровским разъемом, а четвертое колено заканчивается
скользящим разъемом, используемым для вентиляции системы.
Эти инструкции по эксплуатации предназначены для канюль без покрытия и канюль с биоактивным
покрытием Cortiva™. У канюль с биоактивным покрытием Cortiva присутствует префикс «CB» в номере
модели. Для получения дополнительной информации о биоактивном покрытии Cortiva см. вкладыш
«Информация о продуктах с биоактивным покрытием Cortiva».
Это изделие стерильно, непирогенно и предназначено только для однократного применения. Храните
продукт при комнатной температуре. Максимальная температура транспортировки: без покрытия — 50°C
(122°F), с покрытием Cortiva — 40°C (104°F).
2 Показания к применению
Данный переходник предназначен для использования во время хирургической операции в условиях
искусственного кровообращения.
3 Противопоказания
Использовать только в соответствии с указаниями.
4 Меры предосторожности
Ответственность за правильность хирургических процедур и методов несет медицинский персонал.
Описание процедуры приведено исключительно в справочных целях. Хирурги должны оценить
целесообразность проведения данной процедуры на основе собственных профессиональных знаний и
опыта, с учетом типа систем доставки и аспирации, выбранных для процедуры.
Данное устройство предназначено для использования только у одного пациента. Запрещается
использовать, обрабатывать или стерилизовать данное изделие повторно. Повторные использование,
обработка или стерилизация могут нарушить структурную целостность устройства или создать риск его
загрязнения, что может привести к травме, заболеванию или смерти пациента.
Относится к продуктам, на этикетке которых указано содержание фталатов: Этот продукт содержит
фталаты.
Утилизируйте изделие в соответствии с правилами, принятыми в медицинском учреждении.
5 Нежелательные явления
Использование изделия сопровождается следующими известными нежелательными явлениями:
коагулопатия, чрезмерная активация компонентов крови или тромбогенность, гемолиз, артериальная
гипотензия, инфекция, ишемия, неврологическая дисфункция и дисфункция органов.
6 Инструкция по эксплуатации
1. Осмотрите упаковку и изделие на предмет повреждений и проверьте дату истечения срока годности.
Если повреждения отсутствуют, а срок годности не истек, вскройте упаковку и поместите изделие в
стерильное поле с соблюдением требований асептики.
2. Подсоедините конусный разъем к дренажной линии, а охватывающий винтовой люэровский разъем —
к установке для ввода раствора.
36На русском языке
Page 37

3. Наполните кардиоплегическим раствором все трубки (и канюлю венозного трансплантата в случае
модели 10005S).
4. Чтобы подсоединить трубку к канюле для кардиоплегии, дайте нескольким каплям кардиоплегического
раствора упасть с кончика и подсоедините охватываемый винтовой люэровский разъем к входному
разъему предварительно наполненной канюли.
5. Модель 10005S: Чтобы подсоединить канюлю венозного трансплантата к обходному сосудистому
шунту, сначала ретроградно наполните трансплантат, стараясь полностью вытеснить воздух. Откройте
зажим и дайте нескольким каплям кардиоплегической жидкости упасть с конца канюли венозного
трансплантата. Вставьте свободно канюлю в трансплантат. Перекройте ретроградный поток.
Осторожно и плотно вставьте канюлю венозного трансплантата в трансплантат. Удерживая канюлю на
месте, пустите в трансплантат антероградный поток.
6. По завершении процедуры утилизируйте изделие в соответствии с правилами, принятыми в
медицинском учреждении.
7 Отказ от гарантии (общий)
Важная информация: этот отказ от гарантии не применим в Австралии.
НЕСМОТРЯ НА ТО ЧТО ПРОДУКТ БЫЛ СПРОЕКТИРОВАН, ПРОИЗВЕДЕН И ПРОШЕЛ ДОПРОДАЖНЫЕ
ИСПЫТАНИЯ ПРИ ТЩАТЕЛЬНО КОНТРОЛИРУЕМЫХ УСЛОВИЯХ, СУЩЕСТВУЕТ МНОЖЕСТВО
ПРИЧИН ВОЗМОЖНОГО ОТКАЗА В РАБОТЕ ПРОДУКТА. КОМПАНИЯ MEDTRONIC НЕ МОЖЕТ
КОНТРОЛИРОВАТЬ УСЛОВИЯ ЭКСПЛУАТАЦИИ ПРОДУКТА. ПРИВЕДЕННЫЕ НА ЭТИКЕТКАХ
ПРОДУКТА ПРЕДОСТЕРЕЖЕНИЯ СОДЕРЖАТ БОЛЕЕ ПОДРОБНЫЕ СВЕДЕНИЯ И ЯВЛЯЮТСЯ
СОСТАВНОЙ ЧАСТЬЮ ДАННОГО ОТКАЗА ОТ ГАРАНТИИ. ПОЭТОМУ КОМПАНИЯ MEDTRONIC
ОТКАЗЫВАЕТСЯ ОТ ВСЕХ ГАРАНТИЙНЫХ ОБЯЗАТЕЛЬСТВ, КАК ПРЯМЫХ, ТАК И
ОПОСРЕДОВАННЫХ, ПО ОТНОШЕНИЮ К ДАННОМУ ПРОДУКТУ, ВКЛЮЧАЯ, НО НЕ ОГРАНИЧИВАЯСЬ
ЛЮБЫМИ ОПОСРЕДОВАННЫМИ ГАРАНТИЯМИ ПРИГОДНОСТИ ДЛЯ ПРОДАЖИ ИЛИ СООТВЕТСТВИЯ
КАКОЙ-ЛИБО ОПРЕДЕЛЕННОЙ ЦЕЛИ. КОМПАНИЯ MEDTRONIC НЕ НЕСЕТ ОТВЕТСТВЕННОСТИ
ПЕРЕД ЛЮБЫМ ЛИЦОМ ИЛИ ОРГАНИЗАЦИЕЙ ЗА РАСХОДЫ НА МЕДИЦИНСКОЕ ОБСЛУЖИВАНИЕ
ИЛИ ЗА ЛЮБЫЕ ПРЯМЫЕ, СЛУЧАЙНЫЕ ИЛИ ОПОСРЕДОВАННЫЕ УБЫТКИ, ВОЗНИКШИЕ В
РЕЗУЛЬТАТЕ ЛЮБОГО ИСПОЛЬЗОВАНИЯ, ДЕФЕКТА, НЕИСПРАВНОСТИ ИЛИ СБОЯ В РАБОТЕ
ДАННОГО ПРОДУКТА, ВНЕ ЗАВИСИМОСТИ ОТ ТОГО, ОСНОВАНО ЛИ ЗАЯВЛЕНИЕ НА ГАРАНТИЙНЫХ
ОБЯЗАТЕЛЬСТВАХ, КОНТРАКТЕ, ГРАЖДАНСКИХ ПРАВОНАРУШЕНИЯХ ИЛИ ДРУГИХ
ОБСТОЯТЕЛЬСТВАХ. НИ ОДНО ЛИЦО НЕ ИМЕЕТ ПОЛНОМОЧИЙ СВЯЗЫВАТЬ КОМПАНИЮ
MEDTRONIC ЛЮБЫМИ ЗАЯВЛЕНИЯМИ ИЛИ ГАРАНТИЯМИ В ОТНОШЕНИИ ДАННОГО ПРОДУКТА, ЗА
ИСКЛЮЧЕНИЕМ СЛУЧАЕВ НАЛИЧИЯ НА ЭТО ПИСЬМЕННОГО СОГЛАСИЯ УПОЛНОМОЧЕННОГО
СОТРУДНИКА КОМПАНИИ MEDTRONIC.
Вышеизложенные исключения и ограничения не могут пониматься или истолковываться таким образом,
чтобы противоречить обязательным положениям применяемых правовых норм. Если какая-либо часть или
условие данного Отказа от гарантии признается судом компетентной юрисдикции как незаконное, не
имеющее юридической силы или противоречащим применяемым правовым нормам, оставшиеся части
данного Отказа от гарантии будут считаться имеющими юридическую силу, и все права и обязательства
будут толковаться и принудительно обеспечиваться, как если бы данный Отказ от гарантии не содержал
отдельных частей или условий, которые были признаны не имеющими законной силы.
37 На русском языке
Page 38

1 Produktbeskrivning
Modell 10004S är en ”Y”-adapter med tillägg av en trevägskran på det korta benet för att växla mellan kardioplegi- och
ventilationsläge. I inloppsänden sitter en honluerlockkoppling. I slutet av ventilationsslangen sitter en glidanslutning.
De båda perfusionsslangarna avslutas med hanluerlockkopplingar.
Modellerna 10005 och 10005OS har ett kort ben med en hanluerlockkoppling i änden. I slutet av en av
utloppsslangarna sitter en glidanslutning som ansluts till en ventilationsslang med en inre diameter på 0,48 cm
(0,19 in) till 0,64 cm (0,25 in). I slutet av den andra slangen sitter en honluerlockkoppling som ansluts till
hanluerlockkopplingen på administreringssetet. Flödesriktningen styrs av färgkodade klämmor på modell 10005 och
klämmor med färgkodade pilar på modell 10005OS.
Modell 10005BH har en dubbel ”Y”-utformning som avslutas med två hanluerlockkopplingar i ena änden och en
glidanslutning och honluerlockkoppling i den andra.
Modell 10005S är en fyrgrenad perfusionsadapter. En honluerlockkoppling är ansluten till slangens inloppsände.
Genom en rad ”Y”-anslutningar förgrenar sig adaptern i fyra slangar. I ena änden av två av slangarna sitter en mjuk
vengraftkanyl av silikon. I den tredje slangens ände sitter en hanluerlockkoppling och i den fjärde slangens ände sitter
en glidanslutning som används till att ventilera systemet.
Denna bruksanvisning avser såväl obelagda kanyler som kanyler belagda med Cortiva™ bioaktiv yta. Kanyler som är
belagda med Cortiva bioaktiv yta har prefixet ”CB” i modellnumret. Ytterligare information om Cortiva bioaktiv yta finns
i bipacksedeln ”Information om produkter med Cortiva bioaktiv yta”.
Produkten är steril och icke-pyrogen och är avsedd endast för engångsbruk. Förvara produkten i rumstemperatur.
Maximal temperatur vid transport: obelagd 50°C (122°F), belagd med Cortiva 40°C (104°F).
2 Indikationer för användning
Den här adaptern är avsedd att användas i samband med kardiopulmonell bypasskirurgi.
3 Kontraindikationer
Använd endast enligt anvisningarna.
4 Försiktighetsåtgärder
Läkaren ansvarar för att lämpliga kirurgiska procedurer och tekniker används. Beskrivningen av ingreppet ges endast
i informationssyfte. Kirurgen måste, med utgångspunkt från sin medicinska utbildning och erfarenhet samt den typ av
tillförsel- eller vakuumsystem som valts för ingreppet, bedöma ingreppets lämplighet.
Denna enhet har utformats för användning till en enda patient. Denna produkt får ej återanvändas, omarbetas eller
omsteriliseras. Återanvändning, omarbetning eller omsterilisering kan försämra den strukturella integriteten hos
enheten eller medföra risk för kontaminering av enheten, vilket kan resultera i skada, sjukdom eller dödsfall hos
patienten.
Gäller för produkter där ftalater indikeras på produktetiketten: Den här produkten innehåller ftalater.
Kassera produkten enligt sjukhusets rutiner.
5 Komplikationer
Följande kända biverkningar är förknippade med användningen av produkten: koagulopati, förhöjd aktivering av
blodkomponenter eller trombogenicitet, hemolys, hypotoni, infektion, ischemi, neurologisk dysfunktion och
organdysfunktion.
6 Bruksanvisning
1. Kontrollera att förpackningen och produkten inte är skadade och kontrollera utgångsdatumet. Om förpackningen
och produkten är oskadade och utgångsdatumet inte passerats öppnar du förpackningen och flyttar produkten
till ett sterilt område med användning av antiseptisk teknik.
2. Anslut glidanslutningen till ventilationsslangen och honluerlockkopplingen till administreringssetet.
3. Prima alla slangar (och vengraftkanylen för modell 10005S) med kardioplegilösning.
4. Om du vill ansluta slangarna till kardioplegikanylen ska du låta kardioplegilösningen droppa från den ena änden
och ansluta hanluerlockkopplingen till den förprimade kanylens inloppskoppling.
5. Modell 10005S: Om du vill ansluta vengraftkanylen till bypassgraftet utför du först en retrograd priming av graftet
så att all luft töms ut. Öppna klämman och låt kardioplegilösningen droppa från vengraftkanylens ände. För in
kanylen löst i graftet. Stoppa det retrograda flödet. För försiktigt men bestämt in vengraftkanylen i graftet. Håll
kanylen på plats och utför samtidigt antegrad perfusion av graftet.
6. När ingreppet är klart kasserar du produkten i enlighet med sjukhusets policy.
38Svenska
Page 39

7 Garantifriskrivning (global)
Viktigt: Den här garantifriskrivningen gäller inte i Australien.
OAKTAT ATT PRODUKTEN HAR KONSTRUERATS, TILLVERKATS OCH TESTATS UNDER NOGGRANT
KONTROLLERADE FÖRHÅLLANDEN FÖRE FÖRSÄLJNINGEN, KAN DET AV OLIKA SKÄL INTRÄFFA ATT
PRODUKTEN INTE FUNGERAR TILLFREDSSTÄLLANDE. MEDTRONIC HAR INGEN KONTROLL ÖVER
UNDER VILKA FÖRHÅLLANDEN PRODUKTEN ANVÄNDES. VARNINGSTEXTERNA I
PRODUKTDOKUMENTATIONEN INNEHÅLLER MER DETALJERAD INFORMATION OCH UTGÖR EN
INTEGRERAD DEL AV DENNA GARANTIFRISKRIVNING. MEDTRONIC FRISKRIVER SIG DÄRFÖR HELT
FRÅN ALLA GARANTIER, SÅVÄL UTTRYCKLIGA SOM UNDERFÖRSTÅDDA, VAD GÄLLER PRODUKTEN,
INKLUSIVE MEN EJ BEGRÄNSAT TILL EVENTUELL GARANTI OM SÄLJBARHET ELLER LÄMPLIGHET FÖR
ETT SPECIFIKT SYFTE. MEDTRONIC SKA INTE HÅLLAS ANSVARIGT GENTEMOT NÅGON PERSON ELLER
JURIDISK PERSON FÖR NÅGRA MEDICINSKA KOSTNADER ELLER NÅGRA DIREKTA, OAVSIKTLIGA
ELLER FÖLJDSKADOR SOM UPPKOMMER MED ANLEDNING AV ANVÄNDNING AV, BRIST, FEL ELLER
FELAKTIG FUNKTION HOS PRODUKTEN, OAVSETT OM ETT KRAV GÄLLANDE SÅDANA SKADOR
GRUNDAR SIG PÅ GARANTI, AVTALSBROTT, SKADEGÖRANDE HANDLING ELLER ANNAT. FÖRUTSATT
ATT INGET ANNAT SKRIFTLIGEN ÖVERENSKOMMITS MED AUKTORISERAD PERSONAL FRÅN
MEDTRONIC, KAN INGEN PERSON BINDA MEDTRONIC TILL NÅGOT ÅTAGANDE ELLER NÅGON GARANTI
VAD GÄLLER PRODUKTEN.
De undantag och begränsningar som anges ovan är inte avsedda att stå i strid med tvingande regler i tillämplig lag, och
ska inte heller tolkas så. Om denna garantifriskrivning till någon del av behörig domstol bedöms vara olaglig,
verkningslös eller stå i strid med tillämplig lag, ska övriga delar av garantifriskrivningen gälla, varvid alla rättigheter och
skyldigheter skall bestå som om garantifriskrivningen inte innehöll den del eller det villkor som bedömts vara ogiltigt.
39 Svenska
Page 40

1 Ürün tanımı
10004S Model, kardiyopleji ile havalandırma arasında geçiş yapmak için kısa ayakta ek olarak 3 yönlü vana bulunan
bir “Y” adaptörüdür. Giriş kısmı, kilitli bir dişi luer bağlantısıyla başlar. Havalandırma ayağı kaymalı bir konektörde son
bulur. İki perfüzyon ayağı da kilitli erkek luer bağlantılarıyla son bulur.
10005 ve 10005OS Model kilitli bir erkek luer bağlantısıyla son bulan kısa birer ayağa sahiptir. Çıkış kısmı
ayaklarından biri, 0,48 cm (0,19 inç) ila 0,64 cm (0,25 inç) iç çaplı havalandırma hattına bağlanan bir kaymalı konektör
ile sonlanır. Diğer ayak, uygulama setinden gelen kilitli erkek luer bağlantısıyla bağlanmak üzere kilitli bir dişi luer
bağlantısıyla son bulur. Akış yönü, 10005 Model’de renk kodlu kelepçelerle ve 10005OS Model’de renk kodlu oklar
bulunan kelepçelerle kontrol edilir.
10005BH Model bir tarafta 2 kilitli erkek luer bağlantısıyla, diğer tarafta da kaymalı bir konektör ve kilitli dişi luer
bağlantısıyla son bulan bir çift “Y” yapılandırmasındadır.
10005S Model 4 ayaklı bir perfüzyon adaptörüdür. Giriş, borulara takılmış kilitli bir dişi luer bağlantısıyla başlar. Bir dizi
“Y” konektörü aracılığıyla adaptör 4 ayağa ayrılır ve bu ayaklardan ikisi yumuşak silikon damar grefti kanülleriyle
sonlanır. Üçüncü ayak kilitli erkek luer bağlantısıyla sonlanır ve dördüncüsü de sistemi havalandırmak için kullanılan bir
kaymalı konektör ile sonlanır.
Bu kullanım talimatları hem kaplamasız kanüller hem de Cortiva™ biyo aktif yüzeyi ile kaplı kanüller için geçerlidir.
Cortiva biyo aktif yüzeyi ile kaplı kanüllerin model numarası, “CB” ön ekini içerir. Cortiva biyo aktif yüzeyine ilişkin daha
fazla bilgi için, "Cortiva Biyo Aktif Yüzeyli Ürünler için Bilgiler" ekine bakın.
Bu ürün steril olup pirojenik değildir ve sadece tek kullanıma yöneliktir. Ürünü oda sıcaklığında saklayın. Maksimum
taşıma sıcaklığı: kaplamasız 50°C (122°F), Cortiva kaplı 40°C (104°F).
2 Kullanım Endikasyonları
Bu adaptör, kardiyopulmoner bypass cerrahisiyle birlikte kullanılmak üzere tasarlanmıştır.
3 Kontrendikasyonlar
Yalnızca talimat verildiği şekilde kullanın.
4 Önlemler
Uygun cerrahi prosedürlerin ve tekniklerin seçilmesi hekimin sorumluluğundadır. Anlatılan prosedür yalnızca
bilgilendirme amacıyla sağlanmıştır. Cerrahlar, gerçekleştirilen prosedürün uygunluğunu kendi tıbbi eğitim ve
deneyimlerine, cerrahi prosedürün ve prosedür için seçilen iletim ve emme sistemlerinin türüne dayanarak
değerlendirmelidirler.
Bu cihaz sadece tek bir hastada, tek bir kez kullanılmak üzere tasarlanmıştır. Bu ürünü yeniden kullanmayın, işleme
tabi tutmayın veya sterilize etmeyin. Cihazın yeniden kullanılması, yeniden işlenmesi veya yeniden sterilize edilmesi
yapısal sağlamlığını tehlikeye atabilir veya cihazda hastanın yaralanması, hastalanması veya ölümüyle
sonuçlanabilecek bir kontaminasyon riski oluşturabilir.
Ürün etiketinde ftalatların tanımlandığı ürünlerde geçerlidir: Bu ürün ftalatlar içerir.
Ürünü hastane politikasına uygun şekilde bertaraf edin.
5 Advers etkiler
Bilinen şu advers etkiler ürünün kullanımıyla ilişkilendirilir: koagülopati, aşırı kan bileşeni aktivasyonu veya
trombojenisite, hemoliz, hipotansiyon, enfeksiyon, iskemi, nörolojik disfonksiyon ve organ disfonksiyonu.
6 Kullanım talimatları
1. Ambalajda ve üründe hasar olup olmadığını inceleyip son kullanma tarihini kontrol edin. Hasarsızsa ve son
kullanım tarihi geçmemişse, ambalajı açın ve aseptik tekniği kullanarak ürünü steril alana aktarın.
2. Kaymalı konektörü havalandırma hattına ve kilitli dişi luer bağlantısını uygulama setine bağlayın.
3. Tüm hortumları (ve 10005S Model için damar grefti kanüllerini) kardiyopleji sıvısıyla doldurun.
4. Boruları kardiyopleji kanülüne bağlamak için, kardiyopleji sıvısının bir uçtan damlamasına izin verin ve kilitli erkek
luer bağlantısını dolumu yapılmış kanülün giriş bağlantısına takın.
5. 10005S Model: Damar grefti kanülünü bypass greftine bağlamak için önce, tüm havayı dışarı çıkarmaya özen
göstererek grefti retrograd olarak doldurun. Kelepçeyi açın ve kardiyopleji sıvısının damar grefti kanülünün
ucundan damlamasına izin verin. Kanülü grefte gevşek bir şekilde takın. Retrograd akışı durdurun. Damar grefti
kanülünü grefte dikkatle ve sıkıca yerleştirin. Kanülü yerinde tutarken grefti antegrad olarak perfüze edin.
6. Prosedür tamamlandıktan sonra, ürünü hastane politikasına uygun şekilde bertaraf edin.
7 Garantiden feragat beyannamesi (küresel)
Önemli: Bu garantiden feragat beyannamesi Avustralya’da geçerli değildir.
40Türkçe
Page 41

ÜRÜN, DİKKATLE DENETLENEN KOŞULLAR ALTINDA TASARLANMIŞ, ÜRETİLMİŞ VE SATIŞTAN ÖNCE
TEST EDİLMİŞ OLMAKLA BİRLİKTE, AMAÇLANAN İŞLEVİNİ ÇEŞİTLİ SEBEPLERDEN DOLAYI TATMİN EDİCİ
ÖLÇÜDE YERİNE GETİREMEYBİLİR. MEDTRONIC’İN, BU ÜRÜNÜN KULLANILDIĞI KOŞULLAR ÜZERİNDE
HİÇBİR DENETİMİ BULUNMAMAKTADIR. ÜRÜN ETİKETİ VE BELGELERİNDEKİ UYARILAR DAHA AYRINTILI
BİLGİLER İÇERMEKTEDİR VE BU GARANTİ FERAGATNAMESİNİN AYRILMAZ BİR PARÇASI OLARAK
DEĞERLENDİRİLMEKTEDİR. MEDTRONIC, BU SEBEPLE, ÜRÜNLE İLGİLİ OLARAK, GEREK AÇIK GEREKSE
ÖRTÜLÜ SATILABİLİRLİK YA DA ÖZEL BİR AMACA UYGUNLUK DAHİL OLMAK ÜZERE, FAKAT BUNLARLA
SINIRLI OLMAYACAK ŞEKİLDE TÜM GARANTİLERDEN FERAGAT EDER. MEDTRONIC, ÜRÜNÜN HERHANGİ
BİR KULLANIMI, KUSURU VEYA ARIZASINDAN İLERİ GELEN HER TÜRLÜ TIBBİ MASRAFTAN, DOĞRUDAN,
KAZA ESERİ VEYA DOLAYLI HASARDAN ÖTÜRÜ, HİÇBİR ŞAHSA VEYA KURUMA KARŞI, SÖZ KONUSU
TALEBİN GARANTİYE, SÖZLEŞMEYE, HAKSIZ FİİLE VEYA BAŞKA HERHANGİ BİR NEDENE DAYALI OLUP
OLMAMASINA BAKILMAKSIZIN YÜKÜMLÜ OLMAZ. YETKİLİ MEDTRONIC PERSONELİ TARAFINDAN YAZILI
OLARAK AKSİ KABUL EDİLMEDİĞİ SÜRECE, HİÇBİR ŞAHSIN ÜRÜNLE İLGİLİ HERHANGİ BİR İFADEYE
VEYA GARANTİYE DAYALI OLARAK MEDTRONIC’İ BAĞLAMA YETKİSİ YOKTUR.
Yukarıda ortaya konan istisnalar ve sınırlamalar, yürürlükteki kanunun uyulması zorunlu hükümlerini ihlal etme amacını
taşımamaktadır ve bu şekilde yorumlanmamalıdır. Bu Garantiden Feragat Beyannamesinin herhangi bir bölümünün
veya şartının, salahiyet sahibi, yetkili bir mahkeme tarafından yasaya aykırı, yürürlüğe konamaz veya yürürlükteki
yasayla çelişkili olduğuna hükmedilirse bu Garantiden Feragat Beyannamesinin geri kalan kısmının geçerliliği bu
durumdan etkilenmez; tüm haklar ve yükümlülükler, bu Garantiden Feragat Beyannamesi geçersiz olduğuna
hükmedilen söz konusu bölümü ya da şartı içermiyormuş gibi yorumlanır ve uygulanır.
41 Türkçe
Page 42

Page 43

Page 44

Medtronic, Inc.
*M959244A002*
710 Medtronic Parkway
Minneapolis, MN 55432
USA
www.medtronic.com
+1 763 514 4000
LifeLine Technical Support, 24-hour consultation service:
1 877 526 7890
Medtronic B.V.
Earl Bakkenstraat 10
6422 PJ Heerlen
The Netherlands
+31 45 566 8000
Canada
Medtronic of Canada Ltd
99 Hereford Street
Brampton, Ontario L6Y 0R3
Canada
1 800 268 5346
© 2018 Medtronic
M959244A002 1A
2018-10-17
 Loading...
Loading...