Page 1
Bestemmelsen om bruk av profylaktisk antibiotika hviler derfor på praktiserende lege og/eller kirurg.
Shunting til peritoneum kan mislykkes fordi kateteret innføres i sløyfer i tarmen eller i det store bukhinnenettet. Perforering av tarmen av peritonealt
kateter med påfølgende peritonitt har blitt beskrevet.
CSF-overdrenasje kan medføre for stor reduksjon av CSF-trykk og predisponere for utvikling av subduralt hematom eller hygrom, og for stor reduksjon av
ventrikkelstørrelse som fører til obstruksjon, fordi ventrikkelveggene støter mot inngangshullene i kateteret. Hos spedbarn kan for stor trykkreduksjon
medføre påvisbar fordypning i anterior fontanell, dominerende kranieben og kan endre kommuniserende hydrocephalus til obstruktiv hydrocephalus.
Det har vært rapportert insidens av epilepsi etter ventrikulære shuntingprosedyrer. Denne studien indikerte også at anfallsinsidensen økte ved flere
kateterrevisjoner.
Retningslinjer for retur av varer
For å få godkjent erstatning med nye produkter eller kreditt, må produktet returneres i uåpnet pakke med produsentens forseglinger intakte, med mindre
det returneres fordi produktet er defekt eller har feil etikett. Bestemmelsen om et produkt er defekt eller har feil etikett foretas av Medtronic Neurosurgery,
og den avgjørelsen vil være den endelige. Produkter vil ikke bli godtatt for utskifting eller kreditt hvis de har vært i kundens eie i over 90 dager.
Garanti
A. Standard begrenset garanti. Medtronic Neurosurgery garanterer overfor den opprinnelige kjøperen (“Kjøperen”) at det vedlagte implanterbare
produktet (“Produkt”) kjøpt av Kjøperen, er vesentlig fritt for defekter i materiale og utførelse på det tidspunktet det ble levert til Kjøperen. Medtronic
Neurosurgery gir ingen garantier (uttrykte, underforståtte eller lovbestemte) for Produkter som er endret (bortsett fra de som er uttrykkelig beskrevet heri)
eller har gjennomgått uvanlig belastning, misbruk, feil bruk, vanstell, feil testing, brukt i kombinasjon med andre produkter eller komponenter enn det
Produktet var beregnet på, eller brukt på en måte eller i en medisinsk prosedyre der Produktene ikke er indisert.
B. Rettsmiddel. Kjøperens eksklusive rettsmiddel, og Medtronic Neurosurgery eneste ansvar, for brudd på ovenstående garanti skal være at Medtronic
Neurosurgerys kan, i henhold til sitt eget skjønn, velge å erstatte Produktet eller kreditere Kjøperen for nettobeløpet som faktisk var betalt for et slikt
Produkt, forutsatt at (i) Medtronic Neurosurgery har fått skriftlig melding innen nitti (90) dager etter Kjøperen har mottatt Produktet om at Produktet
ikke var i samsvar med spesifikasjonene, inkludert en detaljert forklaring på engelsk om eventuell påstått manglende samsvar, (ii) skal dette Produktet
returneres til Medtronic Neurosurgery innen nitti (90) dager etter Kjøperen mottok Produktet, sendt F.O.B. til 125 Cremona Drive, Goleta, California
93117, USA eller etter annen anvisning av Medtronic Neurosurgery, og (iii) Medtronic Neurosurgery er rimelig overbevist om at de påståtte manglende
samsvarene faktisk eksisterer. Bortsett fra det som er uttrykkelig fremsatt i dette avsnittet, skal Kjøperen ikke ha rett til å returnere Produktene til Medtronic
Neurosurgery uten forutgående skriftlig samtykke fra Medtronic Neurosurgery.
C. Eksklusjon av andre garantier. BORTSETT FRA DEN BEGRENSEDE GARANTIEN GITT I (A) OVENFOR, GIR MEDTRONIC NEUROSURGERY
INGEN ANDRE GARANTIER ELLER BETINGELSER, UTTRYKTE ELLER UNDERFORSTÅTTE, OG PRODUSENTEN FRASIER SEG SPESIELT EVENTUELLE
UNDERFORSTÅTTE GARANTIER OG BETINGELSER FOR SALGBARHET OG EGNETHET TIL ET SPESIELT FORMÅL. MEDTRONIC NEUROSURGERY
VERKEN PÅTAR SEG, ELLER AUTORISERER NOEN ANNEN PERSON TIL Å PÅTA SEG NOE ANNET ANSVAR SOM OPPSTÅR FRA ELLER I FORBINDELSE
MED SALG ELLER BRUK AV NOE PRODUKT.
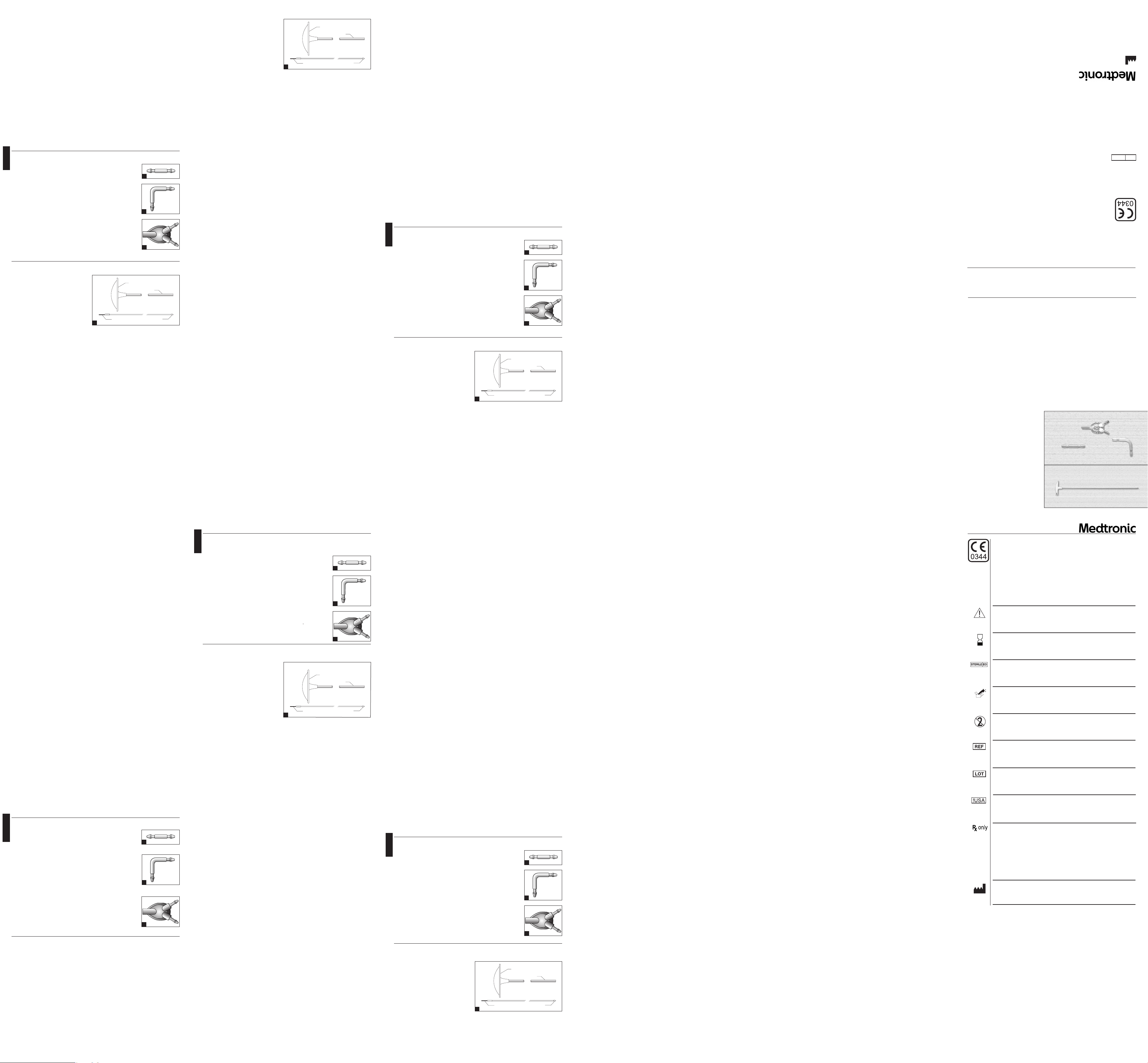
Łączniki cewników
Opis
Łącznik cewnika, prosty
Polski
Prosty nylonowy łącznik cewnika (rys. 1) jest przeznaczony do stosowania z cewnikiem wewnątrzsercowo-otrzewnowym firmy
Medtronic Neurosurgery PS Medical, cewnikiem wewnątrzsercowym firmy Medtronic Neurosurgery PS Medical lub cewnikiem
otrzewnowym firmy Medtronic Neurosurgery PS Medical.
Łącznik cewnika, kąt prosty
Prostopadły nylonowy łącznik cewnika (rys. 2) jest przeznaczony do stosowania z cewnikami komorowymi firmy Medtronic Neurosurgery
PS Medical.
Łącznik cewnika, trójdrożny
Trójdrożny łącznik cewnika (rys. 3) wykonany z polipropylenu i silikonu jest przeznaczony do łączenia dwóch cewników komorowych PS
Medical z łącznikiem wlotowym zastawki przepływowej płynu mózgowo-rdzeniowego firmy Medtronic Neurosurgery PS Medical.
1
Wskazania
Łącznik cewnika, prosty
Prosty łącznik cewnika jest przeznaczony do stosowania podczas rewizji dystalnej części cewnika.
Łącznik cewnika, kąt prosty
Prostopadły łącznik cewnika stosuje się w celu połączenia cewnika komorowego pod kątem 90º (wartość nominalna) w miejscu otworu
trepanacyjnego lub nawierconego.
Łącznik cewnika, trójdrożny
Trójdrożny łącznik cewnika stosuje się do łączenia dwóch cewników komorowych PS Medical z łącznikiem wlotowym zastawki
przepływowej płynu mózgowo-rdzeniowego PS Medical.
Instrukcja użytkowania
Decyzja o technice zakładania i miejscu założenia łączników cewników należy do chirurga.
2
3
Jednorazowe podskórne prowadniki cewników
Opis
Jednorazowe podskórne prowadniki cewników są instrumentami chirurgicznymi przeznaczonymi do użytku jednorazowego, zbudowanymi z trzech elementów:
1. wydrążonego korpusu o długości 60 cm lub 38 cm;
2. uchwytu w kształcie litery T oraz
3. mandrynu ze stożkowatą, zaokrągloną końcówką.
Instrumenty spełniają funkcję odkształcalnych tuneli przeznaczonych do
prowadzenia cewników systemów przepływowych dla płynu mózgowordzeniowego. Model o długości 60 cm nadaje się do stosowania w większości
zabiegów wytworzenia drenażu komorowo-otrzewnowego. Model o długości
38 cm nadaje się do stosowania w większości zabiegów wszczepiania zastawek
komorowo-otrzewnowych u malych pacjentów oraz zabiegów wytworzenia
drenażu lędźwiowo-otrzewnowego.
Wskazania
Jednorazowe podskórne prowadniki cewników stosuje się w celu wytworzenia
podskórnego kanału i (lub) wykorzystania cylindrycznego korpusu podczas
wprowadzania cewnika otrzewnowego wchodzącego w skład systemu drenażu
płynu mózgowo-rdzeniowego. Model o długości 38 cm można również stosować w celu wprowadzania cewnika lędźwiowo-otrzewnowego wchodzącego w skład systemu cewnikowania
lędźwiowo-otrzewnowego firmy Medtronic Neurosurgery PS Medical.
Instrukcja użytkowania
Wybór techniki chirurgicznej stosowanej podczas zakładania jednorazowych podskórnych prowadników cewników należy do chirurga. Zaleca się, by chirurg przed rozpoczęciem zabiegu
sprawdził możliwość przeprowadzenia cewnika przez instrument.
Elastyczna struktura cylindrycznego korpusu umożliwia ręczne formowanie optymalnego kształtu przez chirurga podczas zabiegu. Podczas przeprowadzania instrumentu pod skórą
mandryn musi się znajdować wewnątrz cylindrycznego korpusu i być umocowany do uchwytu przez zatrzaśnięcie końcówki blokującej mandrynu na właściwym miejscu. Po usunięciu
mandrynu można ręcznie wprowadzić cewnik przez światło cylindrycznego korpusu.
Mandryn posiada również element do połączenia z cewnikiem, służący do podłączania otwartej dystalnej części cewnika. Podłączenie cewnika do mandrynu pozwala na przeprowadzenie
cewników o odpowiedniej specyfikacji przez korpus prowadnika.
Sposób dostarczania
Łączniki cewników produkcji firmy Medtronic Neurosurgery PS Medical oraz jednorazowe podskórne prowadniki cewników, pakowane w warunkach STERYLNYCH i NIEPIROGENNYCH, są
przeznaczone wyłącznie do jednorazowego użytku. NIE PODDAWAĆ PONOWNEJ STERYLIZACJI. Nie należy używać produktu, którego opakowanie nosi ślady otwarcia lub uszkodzenia.
Powtórna sterylizacja może powodować uszkodzenia produktu, powodując ryzyko uszczerbku na zdrowiu pacjenta. Firma Medtronic Neurosurgery nie odpowiada za funkcjonowanie
któregokolwiek z produktów poddanego resterylizacji.
Produkty wykonywane na specjalne zamówienie
Jeżeli niniejsza Instrukcja użytkowania została załączona do produktu wykonywanego na specjalne zamówienie, parametry fizyczne produktu zawartego w opakowaniu mogą się różnić
od parametrów produktów opisywanych w niniejszej Instrukcji użytkowania. Niemniej jednak różnice nie mają wpływu na bezpieczeństwo lub skuteczność produktu wykonywanego
na specjalne zamówienie. Produkty na specjalne zamówienie mogą być jałowe lub niejałowe. Odpowiednią informację przedstawiono na etykiecie informacyjnej produktu. Produkty
niejałowe muszą być wyczyszczone i wyjałowione przed użyciem.
Przeciwwskazania
Nie należy stosować drenażu płynu mózgowo-rdzeniowego do prawego przedsionka, jamy otrzewnej ani innych okolic anatomicznych zawierających implantowane elementy
systemu przepływowego, np. zakażenia skóry głowy i innych okolic skóry, przez które przebiega system drenażu, opony mózgowe, komory mózgu, otrzewna, narządy położone
wewnątrzotrzewnowo i pozaotrzewnowo, opłucna i krew. Drenaż płynu mózgowo-rdzeniowego jest przeciwwskazany w przypadku zakażenia w którejkolwiek z okolic anatomicznych. Poza
tym przeciwwskazania obejmują drenaż do przedsionka serca u pacjentów z wrodzoną wadą serca lub innymi poważnymi zaburzeniami układu krążenia i oddychania.
Edukacja pacjenta
Lekarz odpowiada za poinformowanie pacjenta i (lub) przedstawiciela(i) pacjenta w kwestii zabiegów z drenażem płynu mózgowo-rdzeniowego. Informacja powinna zawierać opis
powikłań związanych z wszczepianymi systemami drenażu, a także opisy alternatywnych produktów i metod terapeutycznych.
Ostrzeżenia i środki ostrożności
Rodzaj produktu, rozmiar, wartości ciśnienia oraz zakres wydajności muszą być dopasowane do potrzeb poszczególnych pacjentów dobieranych na podstawie testów diagnostycznych i
doświadczenia lekarza. Odpowiednie poziomy i zakresy wydajności oraz wskazania do stosowania produktu wyszczególniono na etykiecie informacyjnej.
Powtarzane ręczne odkształcanie jednorazowego podskórnego prowadnika cewnika może spowodować osłabienie struktury i pęknięcie korpusu.
Ostre brzegi wytworzone na skutek modyfikacji lub naruszenia integralności jednorazowego podskórnego prowadnika cewnika mogą powodować uszkodzenia cewników wprowadzanych
przez prowadnik.
Nie należy dopuścić do kontaktu implantowanych elementów z przedmiotami uwalniającymi włókienka materiału, talkiem z rękawiczek, wydzieliną gruczołów skóry, mydłami na bazie
olejów, syntetycznymi detergentami lub innymi materiałami powodującymi zanieczyszczenia powierzchni.
Niewłaściwe posługiwanie się lub używanie narzędzi podczas implantacji produktów do drenażu może prowadzić do przecięcia, rozcięcia, zmiażdżenia lub uszkodzenia elementów. Takie
uszkodzenia mogą być przyczyną utraty integralności systemu drenażu i wymagać rewizji.
Należy dopilnować, by podczas testowania przed implantacją lub manipulowania do elementów systemu drenażu nie przedostały się drobiny zanieczyszczeń. Wprowadzenie takich
zanieczyszczeń może doprowadzić do nieprawidłowego funkcjonowania (zbyt dużego lub zbyt małego drenażu) systemu przepływowego. Cząstki stałe wprowadzone do systemu
drenującego mogą również uniemożliwiać prawidłową kontrolę ciśnienia i przepływu, powodując zbyt silny drenaż.
Podczas mocowania cewników komorowych i dystalnych do łączników zastawki podwiązki okrężne wokół przewodów należy zacisnąć mocno, ale nie nadmiernie ciasno, aby nie doszło do
przecięcia silikonowych rurek.
Cewniki należy układać ostrożnie, unikając zagięć i niepotrzebnych otarć na ich przebiegu. Na krawędzi otworu nawierconego lub otworu trepanacyjnego, w miejscu wejścia cewnika
komorowego, można naciąć skośny rowek, aby cewnik przylegał ściśle do czaszki.
Pacjenci z systemami odpływowymi w wodogłowiu muszą podlegać ścisłej obserwacji w okresie pooperacyjnym w celu diagnostyki objawów podmiotowych i przedmiotowych
wskazujących na wadliwe działanie systemu. Objawy kliniczne mogą wskazywać na obecność zakażenia, niedrożność przetoki lub nadmierny drenaż płynu mózgowo-rdzeniowego.
W każdym z elementów systemu drenującego może dojść do niedrożności. Może dojść do zablokowania cewnika komorowego przez cząstki stałe, np. skrzepy krwi lub fragmenty tkanki
mózgowej, na skutek wprowadzenia końcówki cewnika w splocie naczyniówkowym, uwięźnięcia cewnika w tkance mózgowej lub zapadnięcie ścian komory mózgowej na skutek
nadmiernego drenażu (tzw. komora szczelinowata).
Obecność zakrzepów wokół końca cewnika znajdującego się w przedsionku może prowadzić do zatorowości tętnicy płucnej, powstania serca płucnego i nadciśnienia w krążeniu płucnym.
Jeżeli dojdzie do rozłączenia, może nastąpić przemieszczenie elementów układu przepływowego do serca lub jamy otrzewnowej.
Systemy przepływowe mogą działać wadliwie na skutek uszkodzenia mechanicznego, co prowadzi do niedostatecznego lub nadmiernego drenażu.
Uszkodzenie lub niedrożność systemu drenażu może wywoływać objawy wzmożonego ciśnienia śródczaszkowego, jeżeli wodogłowie nie jest kompensowane. U niemowląt do częstych
objawów zalicza się zwiększone napięcie ciemiączka przedniego, zastój w żyłach skóry głowy, spowolnienie, senność, drażliwość, wymioty i sztywność karku. U starszych dzieci i osób
dorosłych stwierdza się objawy przedmiotowe i podmiotowe często związane z nadciśnieniem śródczaszkowym, np. bóle głowy, wymioty, zaburzenia ostrości wzroku, sztywność karku,
zaburzenia świadomości oraz różnorodne patologiczne objawy neurologiczne.
Zdrenowanie zbyt dużej ilości płynu mózgowo-rdzeniowego może predysponować do wystąpienia krwiaka lub wodniaka podtwardówkowego bądź zapadnięcia ścian komory, prowadząc
do niedrożności cewnika komorowego.
Jeżeli nastąpi uwięźnięcie cewnika komorowego w splocie naczyniówkowym lub tkance mózgu przez zrosty łącznotkankowe, nie należy usuwać cewnika z użyciem siły. W celu uwolnienia
cewnika zaleca się stosowanie delikatnej rotacji. Jeżeli usunięcie cewnika wymaga użycia pewnej siły, zaleca się pozostawienie cewnika na miejscu; w przeciwnym wypadku może dojść
do krwotoku do komór mózgu.
Powikłania
Powikłania związane bezpośrednio ze stosowaniem jednorazowego podskórnego prowadnika cewnika obejmują utrudnione wprowadzanie przyrządu przez tkanki zmienione bliznowato
i ryzyko wystąpienia krwiaków.
Powikłania związane z użytkowaniem systemów drenażu komorowo-przedsionkowego i komorowo-otrzewnowego mogą być podobne do powikłań każdej operacji przeprowadzanej
w znieczuleniu miejscowym i (lub) ogólnym. Do powikłań zalicza się reakcje na leki i substancje znieczulające, zaburzenia równowagi elektrolitowej i znaczną utratę krwi, zwłaszcza u
niemowląt. W sporadycznych przypadkach może dojść do reakcji nadwrażliwości na implant.
Podobnie jak we wszystkich procedurach wytworzenia systemów przepływowych, najczęstsze powikłania są związane z niedrożnością systemu - zobacz opis w części o ostrzeżeniach.
Niedrożność, która może dotyczyć każdego z elementów systemu, występuje na skutek zaczopowania fragmentami tkanki mózgowej, skrzepami krwi i (lub) skupiskami komórek
nowotworowych. Niedrożność może również nastąpić na skutek rozdzielenia elementów układu przepływowego i (lub) zagięcia lub skręcenia cewnika. Może to predysponować do
przemieszczenia cewnika komorowego do światła komory bocznej mózgu i cewnika dystalnego do jam serca i odgałęzień tętnicy płucnej, otrzewnej lub innych struktur tkankowych
znajdujących się w sąsiedztwie implantowanego cewnika. Jak zaznaczono powyżej, wzrost niemowlęcia lub dziecka może doprowadzić do wysunięcia dystalnej części cewnika z
przedsionka serca do żyły szyjnej wewnętrznej lub z otrzewnej do przestrzeni tkankowych, w których nie zachodzi możliwość wchłaniania płynów.
Istnieją również inne powikłania grożące poważnymi następstwami. W przypadku procedur z wytworzeniem układu przepływowego nierzadko występują infekcje miejscowe i układowe,
spowodowane najczęściej drobnoustrojami kolonizującymi skórę, zwłaszcza Staphylococcus epidermidis. Niemniej jednak istnieje możliwość kolonizacji również patogenami obecnymi we
krwi. W większości przypadków konieczne jest wówczas usunięcie implantu.
W 1973 r. Robertson i wsp. podsumowali częstość występowania wszystkich opisanych zakażeń przetok komorowo-przedsionkowych i komorowo-otrzewnowych. Częstość występowania
zakażeń przetok komorowo-przedsionkowych wynosiła 7-31%. W większości prac zakażenie przetok komorowo-otrzewnowych stwierdzano w 5-10% przypadków. Ponieważ wytworzenie
systemu drenażu komorowo-przedsionkowego zwiększa ryzyko rozsiewu bakterii do narządów, uważa się, że przetoki komorowo-otrzewnowe są obarczone mniejszym ryzykiem powikłań.
W 1993 roku Kestle i wsp. ogłosili znaczący spadek infekcji (poniżej 4%) dzięki zastosowaniu antybiotyków, skróceniu czasu zabiegu chirurgicznego (doświadczenie chirurga) i kontroli
środowiska sali operacyjnej (np. wyznaczenie specjalnej sali operacyjnej, ograniczenie ilości ruchu i personelu, osłonięcie powierzchni skóry). Stwierdzono, że podobne rezultaty można
uzyskać bez użycia antybiotyków, jedynie ściśle kontrolując środowisko okołooperacyjne.
Celowość profilaktyki antybiotykowej u pacjentów z systemami przepływowymi jest dyskusyjna z uwagi na możliwość rozwoju infekcji szczepami o zwiększonej lekooporności. W związku z
tym decyzja o profilaktycznym użyciu antybiotyków leży w gestii lekarza prowadzącego i (lub) chirurga.
Wytworzenie systemu odpływowego do otrzewnej może się nie powieść na skutek uwięźnięcia cewnika w pętlach jelitowych lub sieci większej. Opisano perforację jelita wywołaną przez
cewnik otrzewnowy, prowadzącą do rozwoju zapalenia otrzewnej.
Nadmierny drenaż płynu mózgowo-rdzeniowego może powodować zbyt duże zmniejszenie ciśnienia płynu mózgowo-rdzeniowego i ryzyko powstania krwiaka lub wodniaka
podtwardówkowego oraz znacznego obkurczenia komory i niedrożności układu w wyniku zamknięcia otworów wlotowych cewnika przez ściany komory. U niemowląt nadmierne
obniżenie ciśnienia powoduje wyraźne zapadnięcie ciemiączka przedniego i wzajemne zachodzenie kości czaszki i może doprowadzić do przekształcenia się wodogłowia komunikującego
w wodogłowie z niedrożności.
Opisano wystąpienie padaczki po zabiegach wytworzenia przetoki komorowej. Wyniki wspomnianego badania wskazują również, że częstość występowania napadów padaczkowych rośnie
w przypadku wielokrotnych rewizji.
Zasady zwrotu produktów
Warunkiem przyjęcia zwrotu i uzyskania zamiany lub zwrotu należności jest dostarczenie produktów w nieotwartych opakowaniach z nienaruszonymi plombami producenta. Nie dotyczy
to przypadków reklamacji z powodu wad wyrobu lub błędnego oznakowania produktu. Stwierdzenie wad wyrobu lub błędnego oznakowania produktu należy do firmy Medtronic
Neurosurgery. Decyzja firmy ma charakter ostateczny. Produkty, które były w posiadaniu klienta przez ponad 90 dni, nie podlegają wymianie ani zwrotowi należności.
Gwarancja
A. Standardowa ograniczona gwarancja. Firma Medtronic Neurosurgery udziela gwarancji użytkownikowi końcowemu, nabywcy produktu (“Nabywcy”), że załączony produkt
przeznaczony do implantacji (“Produkt”) zakupiony przez Nabywcę w momencie dostarczenia do Nabywcy, jest zasadniczo wolny od wad materiałowych i związanych z wykonaniem.
Gwarancja firmy Medtronic Neurosurgery nie obejmuje (w formie wyrażonej, domniemanej ani ustawowej) produktów, które zostały zmodyfikowane (z wyjątkiem przypadków wyraźnie
określonych w niniejszym dokumencie), poddane nadzwyczajnym obciążeniom fizycznym, były użytkowane niezgodnie z przeznaczeniem, nieprawidłowo, bez zachowania należytej
ostrożności, były nieprawidłowo testowane, użytkowane w połączeniu z produktami lub elementami innymi niż te, do których Produkt został przeznaczony, lub w sposób niezgodny ze
wskazaniami bądź do procedur medycznych niezgodnych ze wskazaniami.
B. Postępowanie reklamacyjne. Jedyne prawo Nabywcy i wyłączna odpowiedzialność firmy Medtronic Neurosurgery ogranicza się do naruszenia warunków niniejszej gwarancji i
skutkuje, zgodnie z wolą i decyzją firmy Medtronic Neurosurgery, wymianą produktu lub zwrotem kosztów netto poniesionych przez Nabywcę produktu pod następującymi warunkami:
(i) firma Medtronic Neurosurgery zostanie powiadomiona pisemnie przed upływem dziewięćdziesięciu (90) dni od daty wystawienia rachunku, że Produkt jest wadliwy oraz otrzyma
szczegółowy opis rzekomych wad w języku angielskim, (ii) Produkt zostanie zwrócony do firmy Medtronic Neurosurgery (adres: F.O.B. 125 Cremona Drive, Goleta, California 93117, USA)
lub na inny adres wskazany przez firmę Medtronic Neurosurgery w ciągu dziewięćdziesięciu (90) dni od daty wystawienia rachunku oraz (iii) firma Medtronic Neurosurgery stwierdzi, że
zgłoszone wady rzeczywiście zaistniały. Za wyjątkiem sytuacji wyrażonych w postanowieniach powyższego paragrafu Nabywca nie posiada prawa do zwrotu Produktu do firmy Medtronic
Neurosurgery bez uprzedniej pisemnej zgody firmy Medtronic Neurosurgery.
C. Wykluczenie innych gwarancji. Z WYJĄTKIEM OGRANICZONEJ GWARANCJI OPISANEJ W PUNKCIE (A) FIRMA MEDTRONIC NEUROSURGERY NIE UDZIELA ŻADNYCH INNYCH
GWARANCJI LUB WARUNKÓW WYRAŻONYCH LUB DOROZUMIANYCH. PRODUCENT ODRZUCA W SZCZEGÓLNOŚCI GWARANCJE I WARUNKI PRZYDATNOŚCI HANDLOWEJ I
PRZYDATNOŚCI DO OKREŚLONEGO CELU. FIRMA MEDTRONIC NEUROSURGERY NIE ODPOWIADA ANI NIE UDZIELA UPOWAŻNIENIA OBEJMUJĄCEGO ODPOWIEDZIALNOŚĆ
ŻADNEGO INNEGO PODMIOTU Z TYTUŁU LUB ZWIĄZANEJ ZE SPRZEDAŻĄ LUB UŻY TKOWANIEM JAKIEGOKOLWIEK PRODUKTU.
4
Uchwyt z polipropylenu
Korpus ze stali nierdzewnej
Połączenie cewnika (końcówka
blokująca)
Polipropylenowa końcówka
mandrynu
Conectores de Cateteres
Descrição
Conector de cateter, Recto
O conector de cateter, recto (Fig. 1), é um conector de nylon concebido para utilização com o Cateter Peritoneal
Cardíaco PS Medical da Medtronic Neurosurgery, o Cateter Cardíaco PS Medical da Medtronic Neurosurgery e os
Português
produtos de Cateter Peritoneal PS Medical da Medtronic Neurosurgery.
Conector de cateter, Ângulo recto
O conector de cateter em ângulo recto (Fig. 2) é um conector de nylon concebido para utilização com os
cateteres ventriculares PS Medical da Medtronic Neurosurgery.
Conector de cateter, 3 Vias
O conector de cateteres de 3 vias (Fig. 3) é um conector de polipropileno e elastómero de silicone concebido para
ligar dois Cateteres Ventriculares PS Medical a um conector de entrada da Válvula de Controlo do Fluxo de LCR PS
Medical da Medtronic Neurosurgery.
1
Indicações
Conector de cateter, Recto
O conector de cateter, recto, está indicado para utilização quando se torna necessário proceder à revisão do
cateter distal.
Conector de cateter, Ângulo recto
O conector de cateter, ângulo recto, está indicado para ser utilizado para angular o cateter ventricular para um
ângulo de 90º (nominal) no local onde sai do orifício da broca de torção ou do orifício do trépano.
Conector de cateter, 3 Vias
O conector de cateteres de 3 vias está indicado para utilização em situações em que dois cateteres ventriculares
PS Medical estão ligados a uma válvula de controlo do fluxo de LCR PS Medical.
Instruções para uso
A escolha da técnica utilizada na utilização de conectores de cateteres deverá ser feita pelo cirurgião.
2
3
Introdutores subcutâneos de cateteres descartáveis
Descrição
Os introdutores subcutâneos de cateteres, descartáveis, são instrumentos cirúrgicos descartáveis, consistindo em três componentes:
1. Uma haste tubular (60 cm de comprimento ou 38 cm de comprimento);
2. Manípulo em T; e
3. Um obturador com uma ponta em forma de bala.
Os instrumentos foram concebidos como dispositivos subcutâneos maleáveis de tunelização para passagem de cateteres de derivações de líquido
cefalorraquidiano. O modelo de 60 cm possui um comprimento apropriado para a maioria dos procedimentos de derivações ventriculo-peritoneais. O
modelo de 38 cm possui um comprimento apropriado para procedimentos de criação de derivações ventriculo-peritoneais em pacientes mais pequenos e
para procedimentos de criação de derivações lomboperitoneais.
Indicações
Os introdutores subcutâneos de cateteres, descartáveis, são utilizados para estabelecer um túnel subcutâneo e/ou para posicionamento de uma haste tubular
que irá ser utilizada na colocação do componente do cateter peritoneal de uma derivação de líquido cefalorraquidiano. O modelo de 38 cm pode ser igualmente
utilizado na colocação do componente do cateter lomboperitoneal do Sistema de Cateter Lomboperitoneal PS Medical da Medtronic Neurosurgery.
Instruções para uso
A escolha da técnica empregue na utilização dos introdutores subcutâneos de cateteres, descartáveis, deverá ser feita pelo cirurgião. Recomenda-se que o
cirurgião se certifique de que o cateter irá passar através do instrumento antes de iniciar o procedimento.
A haste tubular é maleável e pode ser moldada manualmente pelo cirurgião conforme indicado para o procedimento cirúrgico. Quando o instrumento é
introduzido subcutaneamente, o obturador tem de estar introduzido na haste tubular e fixo no manípulo, encaixando a ponta de bloqueio do obturador em
posição. Após a remoção do obturador, o cateter pode ser orientado manualmente através do lúmen da haste tubular.
O obturador também inclui um local de ligação do cateter para prender um cateter distal de extremidade aberta. A ligação do cateter ao obturador permite
que os cateteres de diâmetro interno apropriado sejam puxados através da haste do introdutor.
Apresentação
Os introdutores subcutâneos de cateteres, descartáveis, e os conectores de cateteres PS Medical da Medtronic Neurosurgery são embalados ESTÉREIS
e APIROGÉNICOS e destinam-se a ser utilizados uma única vez (utilização única). NÃO REESTERILIZE. Não utilize caso a embalagem tenha
sido previamente aberta ou se encontre danificada. A reesterilização poderá danificar o produto, podendo provocar lesões no paciente. A Medtronic
Neurosurgery não é responsável pelo desempenho de produtos que tenham sido reesterilizados.
Produtos com encomenda especial
Se estas instruções para uso acompanharem um produto com
encomenda especial poderão existir diferenças nas características
físicas entre o produto e a descrição do mesmo contida nestas
instruções para uso. Estas diferenças não afectarão a segurança nem
a eficácia do produto com encomenda especial. Os produtos com
encomenda especial podem ser fornecidos estéreis ou não estéreis,
conforme indicado no rótulo da embalagem. Os produtos não
estéreis devem ser limpos e esterilizados antes de serem
utilizados.
Contra-indicações
A criação de uma derivação de LCR para a aurícula direita, cavidade
peritoneal ou outras zonas do corpo não deverá ser executada se
existir infecção em alguma das áreas onde os vários componentes
do sistema de derivação irão ser implantados. Estas incluem
infecções do couro cabeludo e de outras áreas da pele que o sistema de derivação irá atravessar, das meninges e ventrículos cerebrais, peritoneu, órgãos
intraperitoneais e retroperitoneais, pleura e sangue. A criação de derivações de LCR está contra-indicada se existir infecção em qualquer parte do corpo.
Além disso, a criação de uma derivação para dentro da aurícula está contra-indicada em pacientes com doença cardíaca congénita ou outras anomalias
cardiopulmonares graves.
Educação do paciente
É da responsabilidade do médico fornecer as informações necessárias ao paciente e/ou ao(s) seu(s) representante(s) relativamente à criação de derivações
de LCR. Estas deverão incluir uma descrição das complicações associadas aos sistemas de derivações implantáveis e uma explicação dos produtos e
tratamentos alternativos possíveis.
Advertências e Precauções
O produto, o tamanho e a pressão apropriados ou a variabilidade de desempenho devem ser escolhidos de acordo com as necessidades específicas do
paciente, com base em testes de diagnóstico e na experiência do médico. O rótulo do produto especifica os níveis ou intervalos de desempenho do produto
aplicáveis.
A configuração manual repetida do introdutor subcutâneo de cateteres descartável pode enfraquecer a haste, resultando em ruptura durante a sua
utilização.
As arestas aguçadas, resultantes de modificações ou danos causados ao introdutor subcutâneo de cateteres descartável, poderão afectar negativamente os
cateteres que são introduzidos através do instrumento.
Evite o contacto dos produtos implantáveis com tecidos com fios, pó de talco de luvas, resíduos oleosos da pele, sabonetes com base oleosa, detergentes
sintéticos ou outros contaminantes de superfície.
A utilização ou manuseamento incorrecto dos instrumentos na implantação dos produtos de derivação poderá originar o corte, formação de fendas,
esmagamento ou fractura dos componentes. Tais danos podem levar à perda da integridade da derivação e à necessidade de intervenção cirúrgica
prematura no sistema de derivação.
Durante o manuseamento ou teste executado antes da implantação, deverá ter o cuidado de garantir que não são introduzidas partículas contaminantes
dentro dos componentes da derivação. A introdução de contaminantes poderá resultar no desempenho inapropriado (drenagem excessiva ou insuficiente)
do sistema de derivação. As partículas que entram no sistema de derivação podem igualmente manter os mecanismos de controlo da pressão/fluxo abertos
originando uma drenagem excessiva.
Ao fixar os cateteres ventricular e distal aos conectores da válvula, as ligaduras que circundam o tubo devem ser fixadas de forma segura, mas não
excessivamente apertadas, para não cortarem a tubagem de silicone.
Deverá avançar os cateteres com cuidado para evitar a formação de dobras e abrasões desnecessárias ao longo do percurso dos mesmos. O rebordo do
orifício da broca de torção ou do trépano pode ser aparado para obter um orifício biselado, por onde o cateter ventricular emerge e forma uma curva, de
forma a ficar adjacente ao crânio.
Os pacientes com sistemas de derivação para tratamento de hidrocefalia devem ser mantidos sob vigilância apertada no período pós-operatório,
verificando-se se existem sinais e sintomas que sugiram um mau funcionamento da derivação. Os achados clínicos podem indicar infecção, obstrução da
derivação ou drenagem excessiva de LCR.
A obstrução da derivação pode ocorrer em qualquer um dos componentes do sistema de derivação. O cateter ventricular pode ficar ocluído por partículas,
tais como coágulos sanguíneos ou fragmentos cerebrais, pelo contacto da ponta do cateter com o plexo coróide, pela introdução do cateter no tecido
cerebral ou pela coaptação das paredes ventriculares na presença de drenagem excessiva (“ventrículos em fenda”).
A coagulação em volta da parte auricular de um cateter pode conduzir à embolização da árvore arterial pulmonar, resultando em core pulmonale e
hipertensão pulmonar.
Os componentes da derivação que se separam podem migrar para o interior do coração ou da cavidade peritoneal.
Os sistemas de derivação podem falhar devido a avaria mecânica, conduzindo a uma drenagem deficiente ou excessiva.
O mau funcionamento ou obstrução do sistema de derivação pode conduzir a sinais e sintomas de aumento da pressão intracraniana, se a hidrocefalia
não for compensada. Nos bebés, os achados mais frequentes são o aumento da tensão na fontanela anterior, congestão das veias do couro cabeludo,
inquietação, sonolência e irritabilidade, vómitos e rigidez da nuca. As crianças mais velhas e os adultos desenvolverão sinais e sintomas frequentemente
associados ao aumento da pressão intracraniana, tais como cefaleias, vómitos, visão turva, rigidez da nuca, deterioração da consciência e vários achados
neurológicos anormais.
A drenagem excessiva de LCR pode predispor ao desenvolvimento de hematoma subdural ou hidroma, ou ao colapso das paredes dos ventrículos laterais
conduzindo à obstrução do cateter ventricular.
Se o cateter ventricular ficar aderente ao plexo coróide ou ao tecido cerebral adjacente por tecido fibroso, sugere-se que o cateter não seja removido
utilizando a força. A rotação suave do cateter poderá ajudar a libertá-lo. É preferível que o cateter permaneça nessa posição, em vez de se correr o risco de
hemorragia intraventricular, que poderá ser provocada pela remoção forçada.
Complicações
As complicações directamente associadas à utilização do introdutor subcutâneo de cateteres descartável incluem dificuldade em introduzir o instrumento
através de áreas fibrosas e a possibilidade de formação de hematomas.
As complicações associadas aos sistemas de criação de derivações de LCR ventrículo-auriculares e ventrículo-peritoneais podem ser semelhantes às
complicações que podem ocorrer em qualquer procedimento cirúrgico executado sob anestesia local e/ou geral. Estas incluem as reacções aos fármacos e
agentes anestésicos, o desequilíbrio electrolítico e a perda excessiva de sangue, particularmente em bebés. Em raras ocasiões, o paciente pode exibir uma
reacção devido a hipersensibilidade ao implante.
Nos procedimentos de criação de derivações de LCR, as complicações mais frequentes são provocadas pela obstrução do sistema, conforme descrito em
“Advertências”. A obstrução pode ocorrer em qualquer componente do sistema devido a bloqueio causado por fragmentos cerebrais, coágulos sanguíneos
e/ou agregados de células tumorais, em qualquer ponto do seu percurso. A obstrução poderá igualmente ocorrer devido à separação dos componentes
do sistema ou a dobras e/ou enrolamento do cateter. Estas condições podem predispor à migração do cateter ventricular para o ventrículo lateral e do
cateter distal para o interior do coração e árvore arterial pulmonar, peritoneu ou para outras estruturas nas quais o cateter esteja implantado. Conforme
foi anteriormente referido, o crescimento de um bebé ou criança poderá provocar a deslocação do cateter distal da aurícula para o interior da veia jugular
interna ou do peritoneu para planos de tecidos onde o líquido não pode ser absorvido.
Existem outras complicações potencialmente graves. As infecções locais e sistémicas não são raras com os procedimentos de criação de derivações.
Normalmente as infecções são provocadas por organismos que habitam a pele, particularmente o Staphylococcus epizdermidis. Outros agentes patogénicos
que circulem na corrente sanguínea poderão colonizar a derivação, sendo necessário, na maioria dos pacientes, a remoção do mesmo.
Em 1973, Robertson e colaboradores resumiram a incidência de infecção nas derivações ventrículo-auriculares e ventrículo-peritoneais descritas até aquela
data. A incidência de infecções nas derivações ventrículo-auriculares variou entre 7 e 31%. Na maior parte dos casos, a infecção nas derivações ventrículoperitoneais ocorreu em 5 a 10% dos pacientes. Devido ao facto de a derivação ventrículo-auricular predispor à disseminação de bactérias para outros
órgãos, a derivação ventrículo-peritoneal é considerada como sendo menos lesiva.
Em 1993, Kestle e colaboradores assinalaram reduções significativas na infecção (inferior a 4%) com a utilização de antibióticos, diminuição do tempo de
cirurgia (experiência cirúrgica) e controlo do ambiente do bloco operatório (por exemplo, bloco operatório exclusivo, limitação da permanência e passagem
de pessoal do bloco, cobertura das superfícies da pele). O artigo refere que os resultados podem igualmente ser obtidos sem a utilização de antibióticos,
mas com um controlo rigoroso do ambiente no período antes e após a cirurgia.
A utilização profilática de antibióticos em doentes com derivações é, de certa forma, controversa porque a sua utilização pode predispor à infecção por
organismos mais resistentes. Assim, a decisão de utilizar antibióticos profilaticamente é tomada pelo médico assistente e/ou cirurgião.
A criação de derivações para o peritoneu pode falhar devido ao contacto do cateter com as ansas intestinais ou com o grande epíploo. Foi descrita a
perfuração do intestino pelo cateter peritoneal, com o subsequente desenvolvimento de peritonite.
A drenagem excessiva de LCR pode resultar numa diminuição excessiva da pressão do LCR e predispor ao desenvolvimento de um hematoma subdural ou
higroma, e à redução excessiva do tamanho ventricular, conduzindo à obstrução devido ao contacto das paredes ventriculares com os orifícios de entrada
do cateter. Em bebés, esta redução excessiva da pressão originará uma depressão marcada da fontanela anterior e o cavalgamento dos ossos cranianos,
podendo converter-se numa hidrocefalia obstrutiva (em vez de comunicante).
Foi referida a incidência de epilepsia após procedimentos de criação de derivações ventriculares. Este estudo indicou igualmente que a incidência de
convulsões aumentou com revisões múltiplas do cateter.
Normas para a devolução dos produtos
A fim de poderem ser aceites para substituição ou crédito, os produtos devem ser devolvidos em embalagens não abertas com o selo do fabricante intacto,
excepto se tiverem sido devolvidos devido a uma reclamação por defeito do produto ou rotulagem incorrecta. A determinação do defeito de um produto ou
de uma rotulagem incorrecta será efectuada pela Medtronic Neurosurgery, cuja determinação será final. Os produtos não serão aceites para substituição ou
crédito se estiverem na posse do cliente durante um período superior a 90 dias.
Garantia
A. Garantia limitada padrão. A Medtronic Neurosurgery garante ao comprador e utilizador final original (“Comprador”) que o produto implantável embalado
(“Produto”), adquirido pelo Comprador se encontrará, na altura em que é entregue ao Comprador, substancialmente livre de defeitos de material e de fabrico. A
Medtronic Neurosurgery não oferece qualquer garantia (expressa, implícita ou estabelecida por legislação) para os Produtos que sejam alterados (excepto nos
casos expressamente referidos neste documento) ou submetidos a esforços físicos pouco habituais, utilização incorrecta, funcionamento incorrecto, negligência,
incorrecções nos testes, utilização em combinação com outros produtos ou componentes para além daqueles para os quais os Produtos foram concebidos, ou
utilização de maneiras ou em procedimentos médicos para os quais os Produtos não estão indicados.
B. Recurso. O único recurso oferecido ao Comprador e a única obrigação da Medtronic Neurosurgery em caso de violação da garantia será, por opção única
e escolha da Medtronic Neurosurgery, a substituição do Produto ou a atribuição de um crédito ao Comprador no valor líquido pago pelo referido Produto;
sob a condição de (i) a Medtronic Neurosurgery ser notificada por escrito, num período de noventa (90) dias após o Comprador ter recebido o Produto, de
que tal Produto não cumpriu as especificações, incluindo uma explicação detalhada em Inglês sobre qualquer inconformidade alegada; (ii) tal Produto ser
devolvido à Medtronic Neurosurgery num período de noventa (90) dias após o Comprador ter recebido o Produto, F.O.B., para o seguinte endereço: 125
Cremona Drive, Goleta, California 93117, E.U.A., ou para um endereço alternativo indicado pela Medtronic Neurosurgery; e (iii) a Medtronic Neurosurgery
ficar razoavelmente satisfeita sobre a realidade da existência de inconformidades alegadas. Exceptuando as situações expressamente referidas neste
parágrafo, o Comprador não poderá devolver produtos à Medtronic Neurosurgery sem o consentimento prévio, por escrito, da Medtronic Neurosurgery.
C. Exclusão de outras garantias. COM A EXCEPÇÃO DA GARANTIA LIMITADA ACIMA REFERIDA EM (A), A MEDTRONIC NEUROSURGERY NÃO
OFERECE QUAISQUER OUTRAS GARANTIAS OU CONDIÇÕES, EXPRESSAS OU IMPLÍCITAS, E O FABRICANTE RENUNCIA ESPECIFICAMENTE
AS GARANTIAS E CONDIÇÕES IMPLÍCITAS DE COMERCIALIZAÇÃO E ADEQUAÇÃO PARA UM DETERMINADO PROPÓSITO. A MEDTRONIC
NEUROSURGERY NÃO ASSUME NEM AUTORIZA QUALQUER OUTRA PESSOA A ASSUMIR QUAISQUER OUTRAS RESPONSABILIDADES DERIVADAS
OU RELACIONADAS COM A VENDA OU A UTILIZAÇÃO DE QUALQUER PRODUTO.
4
Manípulo de polipropileno
Conexão do cateter
(ponta de bloqueio)
Haste de aço inoxidável
Ponta do obturador
de polipropileno
Conectores de catéter
Descripción
Conector de catéter, recto
El conector de catéter recto (fig. 1) es un conector de nilón diseñado para usarse con el catéter cardíaco-peritoneal PS Medical de Medtronic Neurosurgery, el
Español
catéter cardíaco PS Medical de Medtronic Neurosurgery y el catéter peritoneal PS Medical Medtronic Neurosurgery.
Conector de catéter, ángulo recto
El conector de catéter de ángulo recto (fig. 2) es un conector de nilón diseñado para usarse con los catéteres
ventriculares PS Medical de Medtronic Neurosurgery.
Conector de catéter, 3 vías
El conector de catéter de 3 vías (fig. 3) es un conector de elastómero de silicona y polipropileno diseñado para
conectar dos catéteres ventriculares PS Medical al conector de entrada de una válvula de control de flujo de LCR
PS Medical de Medtronic Neurosurgery.
1
Indicaciones
Conector de catéter, recto
El conector del catéter recto está indicado para usarse cuando se requiere una revisión del catéter distal.
Conector de catéter, ángulo recto
El conector de catéter de ángulo recto está indicado para doblar el catéter ventricular a un ángulo de 90˚
(nominal) en el lugar por donde ssale de la broca helicoidal u orificio de trépano.
Conector de catéter, 3 vías
El conector de catéter de 3 vías está indicado para usarse cuando dos catéteres ventriculares PS Medical están
conectados a una válvula de control del flujo de LCR PS Medical de Medtronic Neurosurgery.
Instrucciones de uso
La técnica quirúrgica empleada en el uso de los conectores de catéteres se deja a la discreción del cirujano.
Introductores desechables de catéteres subcutáneos
Descripción
Los introductores desechables de catéteres subcutáneos son instrumentos quirúrgicos desechables. Estos instrumentos constan de tres componentes:
1. Un eje tubular (de 60 cm o 38 cm de longitud),
2. Un asa en T y
3. Un obturador con una punta en forma de bala.
Los instrumentos están diseñados como dispositivos de tunelización
subcutáneos maleables para pasar catéteres de derivación del líquido
cefalorraquídeo. El modelo de 60 cm es de una longitud adecuada para la
mayoría de los procedimientos de derivación ventriculoperitoneal. El modelo
de 38 cm es de una longitud adecuada para los procedimientos de derivación
ventriculoperitoneal con pacientes pequeños y para procedimientos de
derivación lumboperitoneal.
Indicaciones
Los introductores desechables de catéteres subcutáneos se utilizan
para establecer un túnel subcutáneo y/o colocar un eje tubular que
se empleará en la colocación del componente del catéter peritoneal
de una derivación de líquido cefalorraquídeo. El modelo de 38 cm
también puede usarse para la colocación del componente del catéter
lumboperitoneal del sistema de catéter lumboperitoneal PS Medical de Medtronic Neurosurgery.
Instrucciones de uso
La técnica quirúrgica empleada en el uso de los introductores desechables de catéteres subcutáneos se deja a la discreción del cirujano. Se recomienda que
el cirujano se asegure de que el catéter pase por el instrumento antes de comenzar el procedimiento.
El eje tubular es maleable y el cirujano puede darle forma manualmente según lo requiera el procedimiento quirúrgico. Cuando el instrumento se pasa
subcutáneamente, el obturador debe insertarse en el eje tubular y sujetarse en el asa encajando la punta de bloqueo del obturador en su sitio. Después de
retirar el obturador, el catéter puede hacerse avanzar a mano por la luz del eje tubular.
El obturador también incluye un lugar de conexión de catéteres para conectar un catéter distal de extremo abierto. La conexión del catéter al obturador
permite que los catéteres de diámetro interior adecuado pasen por el eje del introductor.
Presentación
Los conectores de catéteres y los introductores desechables de catéteres subcutáneos PS Medical de Medtronic Neurosurgery se presentan envasados en
condiciones ESTÉRILES y APIRÓGENAS, y están indicados para un solo uso (una sola vez). NO LOS VUELVA A ESTERILIZAR. No utilice este producto si el
envase está abierto o dañado. La reesterilización puede dañar el producto con el riesgo potencial de ocasionar lesiones al paciente. Medtronic Neurosurgery
no se responsabiliza del funcionamiento de ningún producto que haya sido esterilizado por segunda vez.
Productos que requieren pedido especial
Si estas Instrucciones de uso acompañan a un producto que requiera pedido especial, es posible que se observen diferencias en las características físicas
entre el producto enviado y la descripción que de él se da en el prospecto incluido en el envase. Estas diferencias no afectarán a la inocuidad o eficacia del
producto de pedido especial. Los productos que requieren pedido especial pueden suministrarse en condiciones estériles o no estériles, según se indique en
la etiqueta del envase. Los productos no estériles deben limpiarse y esterilizarse antes de utilizarse.
Contraindicaciones
La derivación del LCR a la aurícula derecha, a la cavidad peritoneal o a otras zonas del cuerpo no se debe llevar a cabo si hay infección en alguna de las zonas
en las que se van a implantar los distintos componentes del sistema de derivación. Esto incluye infecciones del cuero cabelludo y otras zonas de la piel por
las que pasará el sistema de derivación, las meninges y ventrículos cerebrales, el peritoneo y los órganos intraperitoneales y retroperitoneales, la pleura y el
torrente sanguíneo. La derivación de LCR está contraindicada si hay infección presente en alguna parte del cuerpo. Asimismo, la derivación a la aurícula está
contraindicada en pacientes con cardiopatía congénita u otras anomalías cardiopulmonares graves.
Educación del paciente
Es la responsabilidad del médico informar al paciente y/o a sus representantes acerca de la derivación de LCR. Esto deberá incluir una descripción de las
complicaciones asociadas con los sistemas de derivación implantables y una explicación de los posibles productos y tratamientos alternativos.
Advertencias y precauciones
Se debe elegir el producto, tamaño, presión o margen de rendimiento adecuado a las necesidades específicas del paciente, basándose en las pruebas de
diagnóstico y en la experiencia del médico. La etiqueta del producto indica los rangos o niveles de rendimiento aplicables.
El moldeado repetido del introductor desechable de catéteres subcutáneos puede debilitar al eje, pudiendo éste romperse durante su empleo.
Los bordes afilados que resulten de la modificación o los daños sufridos por el introductor desechable de catéteres subcutáneos podrían afectar
adversamente a los catéteres introducidos a través del instrumento.
Evite el contacto de los productos implantables con pelusa, talco para guantes, residuo graso de la piel, jabones de base oleosa, detergentes sintéticos u
otros contaminantes de superficie.
El manejo o uso indebido de instrumentos al implantar productos de derivación puede ocasionar cortes, rajaduras, aplastamiento o rotura de los
componentes. Tales daños podrían producir una pérdida de la integridad de la derivación y ser por consiguiente necesaria una revisión quirúrgica prematura
del sistema de derivación.
Se deben tomar medidas para asegurar que no entren partículas contaminantes en los componentes de la derivación durante las pruebas o la manipulación
previa implantación. La introducción de partículas contaminantes podría provocar un rendimiento inadecuado (drenaje excesivo o insuficiente) del sistema
de derivación.
Las partículas materiales que entren en el sistema de derivación podrían también mantener abiertos los mecanismos de control del flujo y la presión,
causando un drenaje excesivo.
Al asegurar los catéteres ventricular y distal a los conectores de la válvula, las circunligaduras del tubo deben sujetarse bien, pero sin apretarse demasiado,
no sea que terminen cortando el tubo de silicona.
Deberá tenerse cuidado al encaminar los catéteres para evitar que se doblen y la abrasión innecesaria a lo largo de su trayectoria. El reborde de la
broca helicoidal o del orificio de trépano podrá recortarse para proporcionar una muesca biselada por donde salga el catéter ventricular y se curve para
permanecer adyacente al cráneo.
Los pacientes con sistemas de derivación hidrocéfalos deben mantenerse bajo estrecha observación en el período postoperatorio por si exteriorizan signos o
síntomas que pudieran sugerir un funcionamiento defectuoso de la derivación. Los hallazgos clínicos podrían indicar infección, obstrucción de la derivación
o drenaje excesivo de LCR.
Se pueden producir obstrucciones en cualquiera de los componentes de la derivación. El catéter ventricular podría ocluirse por partículas materiales, tales
como coágulos de sangre o fragmentos de cerebro, al clavarse la punta del catéter en el plexo coroideo, por la incrustación del catéter en tejido cerebral o
por la coaptación de las paredes ventriculares en presencia de un exceso de drenaje (“ventrículos rajados”).
La coagulación en torno al segmento auricular del catéter podría provocar embolización del árbol arterial pulmonar con hipertensión pulmonar y cor
pulmonale como consecuencia.
Los componentes de la derivación desconectados podrían migrar al corazón o a la cavidad peritoneal.
Los sistemas de derivación podrían fallar debido al mal funcionamiento mecánico, causando un drenaje excesivo o insuficiente.
El mal funcionamiento de la derivación, o su obstrucción, puede producir signos y síntomas de aumento de la presión intracraneal en circunstancias en que
no sea posible compensar el hidrocéfalo. En el recién nacido, los hallazgos comunes incluyen el aumento de tensión en la fontanela anterior, congestión de
las venas del cuero cabelludo, apatía, somnolencia e irritabilidad, vómitos y rigidez de la nuca. Los niños mayores y los adultos desarrollan signos y síntomas
normalmente asociados con el aumento de presión intracraneal tales como dolores de cabeza, vómitos, visión borrosa, pérdida de la memoria, rigidez de la
nuca, deterioro del conocimiento y hallazgos neurológicos variables y anormales.
El exceso de drenaje de LCR puede predisponer a la aparición de hematoma subdural o higroma, o al colapso de las paredes ventriculares laterales, lo que
ocasionará la obstrucción del catéter ventricular.
Si el catéter ventricular se pega al plexo coroideo o al tejido cerebral adyacente por medio de adherencias fibrosas, se sugiere no tratar de extraerlo a la
fuerza. A veces, bastará para desprenderlo girarlo con suavidad. Se aconseja dejar el catéter en su lugar a correr el riesgo de provocar una hemorragia
intraventricular al intentar retirar el catéter por la fuerza.
Complicaciones
Las complicaciones directamente asociadas con el uso del introductor desechable de catéteres subcutáneos incluyen la dificultad de pasar el instrumento
por zonas con cicatrices y la posible formación de hematomas.
Las complicaciones asociadas con sistemas ventriculoperitoneales y ventriculoauriculares de derivación de LCR son a menudo análogas a las experimentadas
en toda otra intervención quirúrgica practicada bajo anestesia local y/o general. Éstas incluyen reacciones a medicamentos y anestésicos, desequilibrios
electrolíticos y pérdida excesiva de sangre, sobre todo en los lactantes. Excepcionalmente, el paciente puede presentar una reacción de sensibilidad al
implante propiamente dicho.
En los procedimientos de implantación de derivaciones de LCR, las complicaciones más comunes se deben a obstrucción del sistema según se describe bajo
“Advertencias”. Se pueden producir obstrucciones en cualquiera de los componentes de la derivación por taponamiento debido a fragmentos de tejido
cerebral, coágulos sanguíneos y/o agregados de élulas tumorales en el catéter. También se pueden producir obstrucciones debido a la separación de los
Conexión del catéter
(punta de bloqueo)
4
2
3
Asa de polipropileno
Eje de acero inoxidable
Punta del obturador
de polipropileno
componentes del sistema o al doblamiento o enrollamiento del catéter. Esto puede predisponer a la migración del catéter ventricular al ventrículo lateral
y del catéter distal al corazón y árbol arterial pulmonar, al peritoneo o a otra estructura en la que se haya implantado el catéter. Como ya hemos señalado,
el crecimiento del lactante o del niño puede hacer que el catéter distal se salga de la aurícula a la vena yugular interna, o del peritoneo a planos de tejido,
donde no pueda absorberse líquido.
Además, pueden producirse otras complicaciones de carácter grave. Por ejemplo, en la implantación de derivaciones no son infrecuentes las infecciones
locales y sistémicas. Estas infecciones se deben generalmente a microorganismos que habitan en la piel, sobre todo al Staphylococcus epidermidis. Otros
agentes patógenos en la circulación sanguínea pueden también colonizar la derivación y, en la mayoría de los casos, exigir su extracción.
En 1973, Robertson y cols. resumieron la incidencia de infecciones en las derivaciones ventriculoauriculares y ventriculoperitoneales de las que se tenía
noticia hasta la fecha. La incidencia de infecciones de las derivaciones ventriculoauriculares oscilaba entre el 7 y el 31 por ciento. Las infecciones en
derivaciones ventriculoperitoneales se produjeron en el 5 al 10 por ciento de los pacientes en la mayoría de los informes. Dado que las derivaciones
ventriculoauriculares predisponen a la propagación de bacterias a otros órganos, las derivaciones ventriculoperitoneales se consideran menos devastadoras.
En 1993, Kestle y cols. informaron de una importante reducción (a menos del 4%) de las cifras de infecciones con el uso de antibióticos, con la corta
duración del acto quirúrgico (mucha experiencia del cirujano) y con el control del ambiente del quirófano (p.ej., previa designación de éste, limitación del
personal y del tránsito, cobertura de superficies cutáneas). El artículo citado sostiene que también se pueden obtener resultados sin el uso de antibióticos,
siempre que el ambiente perioperatorio se controle rigurosamente.
El uso profiláctico de antibióticos en pacientes con derivaciones es algo controvertido ya que predispone a infecciones por microorganismos más resistentes.
Por lo tanto, la decisión de usar o no antibióticos profilácticamente compete al médico responsable o al cirujano.
La derivación al peritoneo puede fallar si el catéter se clava o queda envuelto en las asas intestinales o en el epiplón mayor. Se han descrito casos de
perforación del intestino por el catéter peritoneal, con el desarrollo consiguiente de peritonitis.
Un drenaje excesivo de LCR puede provocar una reducción excesiva de la presión del LCR y predisponer a la formación de hematomas o hidromas subdurales,
así como a la reducción excesiva del tamaño del ventrículo, con posibilidad de obstrucción debida a la intrusión de la pared ventricular en los orificios
de entrada del catéter. En el lactante, la reducción excesiva de la presión del LCR ocasionará una pronunciada depresión de la fontanela anterior, el
acaballamiento de los huesos del cráneo, o la conversión de un hidrocéfalo comunicante en hidrocéfalo obstructivo.
Se ha informado de la incidencia de epilepsia tras la implantación de derivaciones ventriculares. El estudio en cuestión también indicaba que la incidencia
de episodios convulsivos aumenta con las revisiones múltiples del catéter.
Normas para la devolución de productos
Los productos deben devolverse en sus envases sin abrir y con los precintos del fabricante intactos para ser aceptados para su reemplazo o crédito, a menos
que se devuelvan por una queja debido a un defecto del producto o un etiquetado incorrecto. La determinación de un defecto o etiquetado incorrecto del
producto corresponde a Medtronic Neurosurgery, determinación que será definitiva. Los productos no serán aceptados para su reemplazo o crédito si han
estado en posesión del cliente durante más de 90 días.
Garantía
A. Garantía limitada corriente. Medtronic Neurosurgery garantiza al comprador y usuario final original (“Comprador”) que el producto implantable que
se adjunta (“Producto”) adquirido por el Comprador, en el momento de la entrega al Comprador, estará esencialmente libre de defectos de material y mano
de obra. Medtronic Neurosurgery no ofrece garantía alguna (expresa, implícita o establecida por legislación) para Productos que sufran modificaciones
(salvo en los casos contemplados expresamente en el presente documento), o que se sometan a tensión física poco común, abuso, manejo incorrecto,
negligencia, o que se los pruebe incorrectamente o utilice en combinación con otros productos o componentes ajenos a los destinados para los Productos, o
que se utilicen de una manera o en un procedimiento médico distinto al indicado para los Productos.
B. Recurso. El recurso exclusivo del Comprador y la responsabilidad única de Medtronic Neurosurgery en el caso de incumplimiento de la garantía
precedente será, a elección y opción única de Medtronic Neurosurgery, el reemplazo del Producto o la emisión de un crédito a nombre del Comprador por el
importe neto efectivamente pagado por dicho Producto. Esto último se aplica siempre que: (i) Medtronic Neurosurgery reciba notificación por escrito dentro
de los noventa (90) días a partir de la fecha de recepción del Producto por parte del Comprador de que dicho Producto no se conformó a las especificaciones,
inclusive una explicación detallada en inglés de cualquier disconformidad; (ii) dicho Producto sea devuelto a Medtronic Neurosurgery dentro de los noventa
(90) días a partir de la fecha de recepción del Producto franco a bordo por parte del Comprador, a la siguiente dirección: 125 Cremona Drive, Goleta,
California 93117, EE.UU., o a un domicilio alternativo designado por Medtronic Neurosurgery; y que (iii) Medtronic Neurosurgery quede justificadamente
satisfecho de que las disconformidades reclamadas efectivamente existen. Salvo disposición en contrario en este párrafo, el Comprador no tendrá derecho a
devolver Productos a Medtronic Neurosurgery sin el previo consentimiento por escrito de Medtronic Neurosurgery.
C. Exclusión de otras garantías. SALVO LA GARANTÍA LIMITADA PROVISTA EN EL APARTADO (A) ANTERIOR, MEDTRONIC NEUROSURGERY NO
OTORGA NINGUNA OTRA GARANTÍA O CONDICIÓN, EXPRESA O IMPLÍCITA, Y EL FABRICANTE DESCONOCE ESPECÍFICAMENTE LAS GARANTÍAS Y
CONDICIONES IMPLÍCITAS DE COMERCIABILIDAD Y APTITUD PARA UN PROPÓSITO EN PARTICULAR. MEDTRONIC NEUROSURGERY NO ASUME NI
AUTORIZA A PERSONA ALGUNA A ASUMIR NINGUNA OTRA RESPONSABILIDAD DERIVADA DE LA VENTA O UTILIZACIÓN DE PRODUCTO ALGUNO, O
RELACIONADA CON DICHA VENTA O UTILIZACIÓN.
Kateteranslutningar
Beskrivning
Kateteranslutni ng, rak
Kateteranslutningen, rak (figur 1), är en anslutning av nylon som är avsedd för användning med Medtronic Neurosurgery PS Medical
Svenska
kardiell-peritoneal kateter-, Medtronic Neurosurgery PS Medical kardiell kateter- samt Medtronic Neurosurgery PS Medical peritoneal
kateterprodukter.
Kateteranslutni ng, rätvinklig
Kateteranslutningen, rätvinklig (figur 2), är en anslutning av nylon som är avsedd att användas tillsammans med Medtronic
Neurosurgery PS Medicals ventrikulära katetrar.
Kateteranslutning, 3-vägs
Kateteranslutningen, 3-vägs (figur 3), är en anslutning av polypropylen och silikonelastomer och är avsedd att ansluta två ventrikulära
katetrar från PS Medical till en inloppsanslutning för en ventil för CSV-flödesreglering från Medtronic Neurosurgery PS Medical.
1
Indikationer
Kateteranslutni ng, rak
Kateteranslutningen, rak, är indicerad för användning när distal kateterrevision är nödvändig.
Kateteranslutni ng, rätvinklig
Den rätvinklade anslutningen är indicerad för vinkling av den ventrikulära katetern i 90˚ vinkel (nominellt) vid utgången ur
spiralborr- eller borrhålet.
Kateteranslutning, 3-vägs
Kateteranslutningen, 3-vägs, är indicerad för användning när två ventrikulära katetrar från PS Medical skall kopplas till en ventil för
CSV-flödesreglering från PS Medical.
Bruksanvisning
Kirurgen avgör vilken kirurgisk teknik som skall användas vid användning av kateteranslutningar.
2
3
Subkutana katetergenomförare för engångsbruk
Beskrivning
De subkutana katetergenomförarna för engångsbruk är kirurgiska instrument för engångsbruk. De består av tre komponenter:
1. Ett rörformigt skaft (60cm långt eller 38cm långt),
2. T-handtag samt
3. En obturator med kulformad spets.
Instrumenten är avsedda att användas som ett böjligt
instrument för subkutan tunnelering vid insättning av CSV-shuntkatetrar.
Modellen 60 cm är en lämplig längd för de flesta v
shuntingrepp. Modellen 38 cm är en lämplig längd för ventrikulo-peritoneala
shuntingrepp på små patienter och för lumbo-peritoneala shuntingrepp.
Indikationer
De subkutana katetergenomförarna för engångsbruk används till att etablera
en subkutan tunnel och/eller till att placera ett rörformat skaft som används för
placeringen av en CSV-shunts peritoneala kateterkomponent. Modellan 38 cm kan
också användas för placeringen av den lumboperitoneala kateterkomponenten på
Medtronic Neurosurgery PS Medicals lumbo-peritoneala katetersystem.
Bruksanvisning
Kirurgen avgör vilken kirurgisk teknik som skall användas vid användning av den subkutana katetergenomföraren för engångsbruk. Kirurgen bör före ingreppet säkerställa att katetern kan
föras genom instrumentet.
Det rörformiga skaftet är formbart och kan formas för hand av kirurgen efter behov för det kirurgiska ingreppet. När instrumentet förs in subkutant måste obturatorn föras in i det
rörformade skaftet och fästas i handtaget genom att snäppa obturatorns låsspets på plats. När obturatorn har avlägsnats kan katetern matas in för hand genom det rörformade skaftets
lumen.
Obturatorn är också försedd med en kateteranslutningsplats för anslutning av en distal kateter med öppna ändar. Denna kateteranslutning till obturatorn gör det möjligt att dra katetrar av
lämplig innerdiameter genom genomförarskaftet.
Leverans
Kateteranslutningar och subkutana katetergenomförare för engångsbruk från Medtronic Neurosurgery PS Medical är STERILT och ICKE-PYROGENT förpackade och är avsedda endast
för engångsbruk. FÅR EJ RESTERILISERAS. Får ej användas om förpackningen har öppnats tidigare eller skadats. Resterilisering kan skada produkten och skapa risk för patientskador.
Medtronic Neurosurgery ansvarar inte för funktionen hos någon produkt som har resteriliserats.
Specialbeställda produkter
Om denna bruksanvisning medföljer en specialbeställd produkt, kan det eventuellt förekomma skillnader vad gäller produktens faktiska fysiska egenskaper, jämfört med
produktbeskrivningen i denna bruksanvisning. Dessa skillnader påverkar inte den specialbeställda produktens säkerhet eller effektivitet. Special produkter kan ibland levereras sterila, ibland
osterila, i enlighet med den information som anges på produktförpackningens etikett. Osterila produkter måste rengöras och steriliseras före användning.
Kontraindikationer
Utför inte CSV-shuntning till det högra förmaket, den peritoneala kaviteten eller andra delar av kroppen, om det råder en infektion i någon av de kroppsdelar där de olika delarna
av shuntsystemet kommer att föras in. Detta avser också infektioner i skalp och annan hud där shuntsystemet kommer att passera, hjärnhinna och hjärnventriklar, peritoneum och
intraperitoneala och retroperitoneala organ, pleura samt blodomlopp. Faktum är att CSV-shuntning är kontraindicerat om det förekommer någon infektion över huvud taget i kroppen.
Dessutom är shuntning till hjärtförmaket kontraindicerat hos patienter med en medfödd hjärtsjukdom eller med andra allvarliga kardiopulmonella avvikelser.
Patientinformation
Det åligger läkaren att informera patienten och/eller patientens ombud rörande CSV-shuntning. Som en del av denna information bör ingå en redogörelse för de komplikationer som kan
inträffa vid implantering av shuntsystem, samt en beskrivning av alternativa produkter och behandlingar.
Varningar och försiktighetsåtgärder
Med utgångspunkt från diagnostiska tester och sin egen erfarenhet skall läkaren välja den produkt, storlek, tryck eller prestandaområde som passar den enskilda patientens behov. På
produktförpackningens etikett finns information om tillämpliga funktionsnivåer och omfång.
Upprepad formning för hand av den subkutana katetergenomföraren för engångsbruk kan försvaga skaftet, vilket kan leda till att det går sönder under användningens gång.
Skarpa kanter som uppstått från modifiering av eller skada på den subkutana katetergenomföraren för engångsbruk kan skada katetrar som förs genom instrumentet.
Ludd, talk från handskar, hudfettsrester, oljebaserade tvålmedel, syntetiska tvättmedel eller andra ytföroreningar får ej komma i kontakt med implanterbara produkter.
Felaktig hantering eller användning av instrumenten vid implantation av shuntprodukter kan orsaka revor, brott och skär- eller krosskador på utrustningen. Dessa skador kan leda till att
shunten skadas och påtvinga en tidigarelagd kirurgisk kontroll eller avlägsnande av utrustningen.
Var försiktig så att inga partikelkontaminanter kommer in i shuntsystemet under förimplantationstestet eller under hanteringen. Om kontaminanter kommer in i systemet kan detta
leda till att shuntsystemet fungerar felaktigt (över- eller underdränering). Om partikelämnen kommer in i shuntsystemet, kan detta leda till att shunten täpps till eller till att tryck-/
flödesstyrmekanismerna hålls öppna, vilket leder till överdränering.
Då de ventrikulära och distala katetrarna fästs på ventilanslutningen skall ligaturerna som omger slangen dras åt, fast inte så hårt att de skär igenom silikonslangen.
Var försiktig vid styrningen av katetern, så att den inte böjs eller skaver onödigt mycket vid insättningen. Kanten på borrhålet kan putsas så att det skapas ett avfasat hack, där katetern
löper ut och böjer sig för att ligga intill skallbenet.
Patienter med shuntsystem för hydrocefali måste hållas under noggrann observation under den postoperativa fasen för tecken och symptom på funktionsfel hos shunten. De kliniska
iakttagelserna kan indikera infektion, tilltäppning av shunten eller överdränering av CSV.
Tilltäppning av shunten kan inträffa i shuntsystemets samtliga delar. Den ventrikulära katetern kan bli tilltäppt av partikelämnen såsom koagel eller hjärnfragment, av att kateterspetsen
blir innesluten i plexus choroideus, av att katetern blir inbäddad i hjärnvävnad eller genom koaptation av de ventrikulära väggarna i närvaro av överdränering (”slitsventriklar”).
Koagulering runt den del av katetern som befinner sig i förmaket kan leda till embolisering i lungornas artärförgreningar, vilket kan orsaka cor pulmonale och pulmonell hypertoni.
Urkopplade shuntdelar kan förflytta sig längre in i hjärtat eller in i den peritoneala kaviteten.
Shuntsystem kan upphöra att fungera på grund av mekaniskt funktionsfel, vilket kan leda till under- eller överdränering.
Funktionsfel eller tilltäppning av shuntsystemet kan framkalla symptom på ökat intrakraniellt tryck om hydrocefalin inte kompenseras. De vanligaste symtomen hos ett spädbarn är ökad spänning i den
stora fontanellen, blodstockning i skalpådrorna, håglöshet, dåsighet och irritation, kräkningar och nackstyvhet. Större barn och vuxna visar tecken och symptom som vanligtvis är associerade med ökat
intrakraniellt tryck såsom huvudvärk, kräkningar, dimsyn, nackstyvhet, försämrat medvetande samt olika avvikande neurologiska symptom.
Överdränering av CSV kan göra att patienten lättare drabbas av subdural hematom eller hydrom eller kollaps i sidoventrikelns vägg, vilket kan täppa till den ventrikulära katetern.
Om den ventrikulära katetern pga vidhäftande fibrös vävnad fastnar i plexus choroideus eller intilliggande hjärnvävnad, är det tillrådligt att man inte använder för stor kraft då katetern
skall avlägsnas. Försök att lossa på katetern genom att försiktigt rotera den. Det är bättre att lämna katetern på plats än att riskera en intraventrikulär blödning som kan bli följden av att
katetern avlägsnas med våld.
Komplikationer
Bland de komplikationer som är direkt knutna till användandet av subkutan katetergenomförare märks svårigheter att föra instrumentet genom områden med kraftig ärrbildning samt
risken för hematom.
De komplikationer som kan inträffa med ventrikulo-atriala och ventrikulo-peritoneala CSV-shuntsystem kan påminna om dem som kan inträffa vid alla kirurgiska ingrepp med
lokalbedövning och/eller helnarkos. Dessa innefattar reaktioner på läkemedel och bedövningsmedel, störningar i elektrolytbalans samt kraftig blodförlust, i synnerhet hos spädbarn. En
patient kan i undantagsfall uppvisa reaktioner orsakade av känslighet mot implantatet.
De vanligaste komplikationerna vid CSV-shuntprocedurer orsakas av tilltäppning av systemet, såsom beskrivs under ”Varningsföreskrifter”. Tilltäppning kan inträffa i samtliga delar
av systemet pga hjärnfragment, koagel och klumpar av tumörceller någonstans längs shuntens sträckning. Tilltäppning kan också inträffa om systemets olika delar skiljs åt eller om
katetern veckas och/eller lindas upp. Detta ökar risken att den ventrikulära katetern förflyttar sig in i sidoventrikeln och att den distala katetern förflyttar sig in i hjärtat eller lungornas
artärförgrening, peritoneum eller annan struktur där katetern implanterats. Såsom nämnts ovan, då ett spädbarn eller barn växer kan den distala katetern förflyttas från förmaket till vena
jugularis interna eller från peritoneum in i vävnadsplan, där vätska inte kan absorberas.
Andra potentiellt allvarliga komplikationer kan förekomma. Lokala eller systemiska infektioner är inte ovanliga vid shuntningsprocedurer. Vanligtvis orsakas de av de organismer som finns
på huden, i synnerhet Staphylococcus epidermidis. Andra patogener som återfinns i blodomloppet kan också kolonisera shunten. I de flesta fall då detta inträffar, måste shunten avlägsnas.
1973 gjorde Robertson mfl en sammanställning av de fall av infektioner i ventrikulo-atriala och ventrikulo-peritoneala shuntar, som hade rapporterats fram till detta år. Antalet fall av
infektioner vid ventrikulo-atrial shuntning varierade från 7 till 31%. Infektioner vid ventrikulo-peritoneal shuntning inträffade hos mellan 5 och 10% av patienterna i de flesta rapporterna.
Eftersom bakterierna lättare sprider sig till andra organ vid ventrikulo-atrial shuntning, anses ventrikulo-peritoneal shuntning medföra mindre risk.
Kestle m fl rapporterade nyligen (1993) om en avsevärd minskning av antalet infektioner (mindre än 4%) efter behandling med antibiotika, kortvarigt kirurgiskt ingrepp (pga kirurgisk
erfarenhet) samt styrning av miljön i operationssalen (t ex speciellt utformade operationssalar, minskad personal och minskat spring, övertäckande av hud). I artikeln konstateras att
liknande resultat kan erhållas utan antibiotika, men endast om man utför en strikt perioperativ styrning av miljön.
Profylaktisk behandling med antibiotika hos shuntpatienter anses vara något kontro versiellt, eftersom detta kan göra att patienten blir mer mottaglig för andra, mer motståndskraftiga
organismer. Därför åligger det kirurg och/eller läkare att avgöra om profylaktisk behandling med antibiotika skall sättas in.
Shuntning in i peritoneum kan misslyckas om katetern innesluts i tarmslingor eller i det större bukhinnenätet. Det har rapporterats fall då den peritoneala katetern har stuckit hål på
tarmen, varefter peritonit har utvecklats.
CSV-överdränering kan resultera i kraftig minskning av CSV-trycket, vilket kan öka risken för subduralt hematom eller hydrom, samt kraftigt minska ventrikelns storlek. Detta kan i sin
tur leda till tilltäppning då ventrikelväggarna tränger in i kateterns inloppshål. Hos ett spädbarn skapar det kraftigt minskade trycket en tydlig nedtryckning av den stora fontanellen,
överlappning av skallbenen samt att en kommunicerande hydrocefali förvandlas till en obstruktiv.
Det har rapporterats fall av epilepsi efter ventrikulära shuntprocedurer. Samma studie tydde också på att antalet anfall ökar vid upprepad kateterrevision.
Policy avseende returvaror
Såvida produkten inte reklameras och skickas tillbaka p.g.a. påstådd defekt hos eller felmärkning av produkten, måste den returneras i oöppnad förpackning med tillverkarens förseglingar
intakta för att kunna accepteras för utbyte eller återbetalning. Huruvida produkten är defekt eller felmärkt kommer att fastställas av Medtronic Neurosurgery, vars beslut inte kan
överklagas. Produkter som varit i kundens ägo under längre tid än 90 dagar accepteras ej för utbyte eller återbetalning.
Garanti
A. Allmän begränsad garanti. Medtronic Neurosurgery garanterar ursprunglig köpare och samtidig slutanvändare (”Köpare”) att den levererade implanterbara produkten (”Produkt”),
som inköpts av Köparen, skall, vid tidpunkten för leverans till Köparen, vara i huvudsak felfri med avseende på material och utförande. Medtronic Neurosurgery lämnar ingen garanti (vare
sig uttrycklig, underförstådd eller i lag föreskriven) för Produkt(er) som modifierats (med undantag för vad som häri uttryckligen angivits), eller som utsatts för onormal fysisk påfrestning,
felaktig användning, oriktigt handhavande, slarv, oriktigt testförfarande, använts i kombination med andra produkter eller komponenter än de för vilka nämnda Produkt(er) konstruerats,
eller använts på ett sätt eller i medicinsk procedur för vilken nämnda Produkt(er) ej är indicerad(e).
B. Gottgörelse. Köparens enda gottgörelse samt Medtronic Neurosurgerys enda ansvar vid brott mot ovannämnda garanti skall vara, i enlighet med Medtronic Neurosurgerys eget
gottfinnande, utbyte av Produkten eller återbetalning till Köparen av det nettobelopp som faktiskt betalats för sådan Produkt, under förutsättning att (i) Medtronic Neurosurgery inom
nittio (90) dagar efter att Köparen mottagit den Produkt som fallerat i uppfyllandet av förväntningarna skriftligen meddelas härom, via en detaljerad, på engelska författad redogörelse
rörande det påstådda bristande uppfyllandet av förväntningarna; (ii) sådan Produkt sänds i retur till Medtronic Neurosurgery inom nittio (90) dagar efter Köparen mottagit Produkten, med
frakten betald, till 125 Cremona Drive, Goleta, California 93117, USA, eller på annat av Medtronic Neurosurgery angivet sätt; och (iii) Medtronic Neurosurgery finner det tillfredsställande
klarlagt att den påstådda bristen de facto föreligger. Med undantag för vad som uttryckligen anförts i detta avsnitt skall Köparen ej ha rätt att till Medtronic Neurosurgery sända Produkter i
retur utan att Medtronic Neurosurgery dessförinnan skriftligen givit tillstånd därtill.
C. Uteslutande av andra garantier. MED UNDANTAG FÖR DEN OVAN I (A) LÄMNADE GARANTIN LÄMNAR MEDTRONIC NEUROSURGERY INGA ANDRA GARANTIER ELLER
VILLKOR, VARKEN UTTRYCKLIGA ELLER UNDERFÖRSTÅDDA, OCH SPECIELLT GÄLLER ATT TILLVERKAREN FRÅNSÄGER SIG UNDERFÖRSTÅDDA GARANTIER OCH VILLKOR
AVSEENDE SÄLJBARHET OCH LÄMPLIGHET FÖR NÅGOT SPECIELLT ÄNDAMÅL. MEDTRONIC NEUROSURGERY VARKEN PÅTAGER SIG ELLER BEMYNDIGAR ANNAN PERSON ATT
FÖR DESS RÄKNING PÅTAGA SIG ANNAT ANSVAR SOM EVENTUELLT UPPKOMMER VID ELLER I SAMBAND MED FÖRSÄLJNING ELLER ANVÄNDNING AV NÅGON PRODUKT.
entrikulo-peritoneala
4
Handtag av polypropylen
Kateteranslutning
(låsspets)
Skaft av rostfritt stål
Obturatorspets
av polypropylen
Kateter Konektšrleri
Tanım
Kateter Ko nektör ü, Düz
Türkçe
Kateter Konektörü, Düz (Șekil 1) Medtronic Neurosurgery PS Medical Kardiyak-Peritoneal Kateter, Medtronic Neurosurgery PS Medical
Kardiyak Kateter ve Medtronic Neurosurgery PS Medical Peritoneal Kateter ürünleriyle kullanılmak üzere tasarlanmıș bir naylon
konektördür.
Kateter Ko nektör ü, Dik Açılı
Kateter Konektörü, Dik Açılı (Șekil 2) Medtronic Neurosurgery PS Medical Ventriküler Kateterleri ile kullanılmak üzere tasarlanmış bir
naylon konektördür.
Kateter Ko nektör ü, 3 Yollu
Kateter Konektörü, 3 Yollu (Șekil 3), iki PS Medical Ventriküler Kateteri bir Medtronic Neurosurgery PS Medical BOS-Akıș Kontrol Valfi
giriș konektörüne bașlamak üzere tasarlanmıș bir polipropilen ve silikon elastomer konektördür.
1
Endikasyonlar
Kateter Ko nektör ü, Düz
Kateter Konektörü, Düz kullanımı distal kateter revizyonu gerektișinde endikedir.
Kateter Ko nektör ü, Dik Açılı
Kateter Konektörü, Dik Açılı, ventriküler katetere dönmeli matkap veya burr delișinden çıktıșı yerde yaklașık 90 ș açı (nominal) vermek
için kullanılabilir.
Kateter Ko nektör ü, 3 Yollu
Kateter Konektörü, 3 Yollu, iki PS Medical Ventriküler Kateter bir PS Medical BOS-Akıș Kontrol Valfine takıldığı zaman endikedir.
Kullanma Talimatı
Kateter Konektörlerinin kullanımı için kullanılan cerrahi teknik cerrahın sorumluluğundadır.
2
3
Atılabilir Subkütan Kateter Geçiriciler
Tanım
Atılabilir Subkütan Kateter Geçiriciler atılabilir cerrahi aletlerdir. Üç bileșenden olușurlar:
1. Tübüler bir șaft (60 cm uzunlușunda veya 38 cm uzunluğunda);
2. T-sap; ve
3. Kurșun șeklinde bir uca sahip bir obturatör.
Bu aletler, serebrospinal sıvı șant kateterlerinin geçirilmesi için șekillendirilebilir
subkütan tünel açma cihazları olarak tasarlanmıștır. 60 cm’lik model çoğu
ventriküloperitoneal șant ișlemi için uygun uzunluktadır. 38 cm’lik model küçük
hastalarda ventriküloperitoneal șant ișlemleri için ve lumboperitoneal șant ișlemleri
için uygun uzunluktadır.
Endikasyonlar
Atılabilir Subkütan Kateter Geçiriciler bir serebrospinal sıvı șantının peritoneal
kateter bileșeninin yerleștirilmesinde kullanılmak üzere subkütan tünel olușturma
ve/veya tübüler șaftı konumlandırmak üzere kullanılırlar. 38 cm’lik model
ayrıca Medtronic Neurosurgery PS Medical Lumboperitoneal Kateter Sisteminin
lumboperitoneal kateter bileșeninin yerleștirilmesi için de kullanılabilir.
Kullanma Talimatı
Atılabilir Subkütan Kateter Geçiricilerin kullanımı için kullanılan cerrahi teknik cerrahın sorumluluğundadır. Cerrahın ișlemden önce kateterin aletten geçeceğinden emin olması önerilir.
Tübüler șaft cerrah tarafından cerrahi ișlem için gerektiği șekilde elle șekillendirilebilir. Alet subkütan olarak geçirildiğinde obturatör tübüler șafta sokulmalı ve obturatörün kilitlenen ucu
gerekli konuma oturtularak sapta sabitlenmelidir. Obturatörün çıkarılmasından sonra kateter tübüler șaftın lümeninden elle sokulabilir.
Obturatörde ayrıca açık uçlu bir distal kateterin takılması için bir kateter takma bölgesi bulunur. Kateterin obturatöre takılması, uygun iç çapa sahip kateterlerin geçirici șaftın içinden çekilmesini sağlar.
Sașlanma șekli
Medtronic Neurosurgery PS Medical Kateter Konektörleri ve Atılabilir Subkütan Kateter Geçiriciler STERİLDİR ve PİROJENİK OLMAYAN bir șekilde ambalajlanmıștır ve sadece bir kez (tek
sefer) kullanılmaları tasarlanmıștır. TEKRAR STERİLİZE ETMEYİN. Ambalaj daha önce açılmıș veya hasarlıysa kullanmayın. Tekrar sterilizasyon ürüne zarar verebilir ve hastanın zarar
görmesine neden olabilir. Medtronic Neurosurgery tekrar sterilize edilmiș herhangi bir ürünün performansından sorumlu deșildir.
4
ateter Bağlantısı
K
(Kilitlenen Uçlu)
olipropilen Sap
P
Paslanmaz Çelik Şaft
Polipropilen
Obturatör Ucu
Özel Sipariș Ürünler
Bu kullanma talimatı özel sipariș ürünle geliyorsa, ürün ile bu kullanma talimatındaki ürün tanımı arasında fiziksel özelliklerde farklılıklar olabilir. Bu değişiklikler özel sipariş ürününün
güvenlik veya etkinliğini etkilemeyecektir. Özel sipariş ürünler ürün paketindeki etikette belirtildiği şekilde steril olan veya olmayan bir şekilde sağlanabilir. Steril olmayan ürünler
kullanımdan önce temizlenmeli ve sterilize edilmelidir.
Kontrendikasyonlar
BOS’un sağ atriyum, peritoneal boşluk veya vücudun başka alanlarına şant edilmesi şant sisteminin çeşitli bileşenlerinin yerleştirileceği bölgelerden herhangi birinde enfeksiyon varsa
yapılmamalıdır. Bunlar arasında şant sisteminin geçeceği kafa derisi veya diğer cilt bölgeleri, beyin zarları ve serebral ventriküller, periton ve intraperitoneal ve retroperitoneal organlar,
pleura ve kan yolu enfeksiyonları bulunur. BOS’un şant edilmesi vücudun herhangi bir bölgesinde enfeksiyon mevcutsa kontrendikedir. Ayrıca konjenital kalp hastalığı veya başka ciddi
kardiyopulmoner anomalileri olan hastalarda atriyuma şant oluşturulması kontrendikedir.
Hasta Eğitimi
Hastanın ve/veya temsilcisinin/temsilcilerinin BOS şantıyla ilgili olarak eğitilmesi doktorun sorumluluğudur. Bu eğitim implante edilebilen şant sistemleriyle ilgili komplikasyonların bir
tanımı ve olası alternatif ürünler ve tedavilerin bir açıklamasını da içermelidir.
Uyarılar ve Önlemler
Belirli bir hastanın gereksinimine göre, tanısal testler ve doktorun deneyimi temelinde, uygun ürün, büyüklük, basınç veya performans aralığı seçilmelidir. Ürün etiketi ilgili ürün performans
düzeylerini veya aralıklarını belirler.
Atılabilir Subkütan Kateter Geçiricinin elle tekrar tekrar şekillendirilmesi şaftı zayıflatabilir ve kullanım sırasında kırılmaya neden olabilir.
Atılabilir Subkütan Kateter Geçiricinin modifikasyonu veya hasar görmesi nedeniyle oluşan sivri kenarlar aletten geçirilen kateterleri olumsuz etkileyebilir.
İmplante edilebilir ürünlerin kumaş lifi, eldiven pudrası, cildin yağlı kalıntıları, yağ tabanlı sabunlar, sentetik deterjanlar veya yüzey kontaminanlarına temas etmesinden kaçının.
Şant ürünleri implante edilirken aletlerin doğru kullanılmaması bileşenlerin kesilmesine, yarık açılmasına, ezilmesine veya kırılmasına neden olabilir. Bu tür bir zarar şant bütünlüğünün
kaybına yol açabilir ve şant sisteminin erken cerrahi revizyonunu gerektirebilir.
İmplantasyon öncesi test veya kullanım sırasında şant bileşenlerine partiküllü kontaminanların sokulmamasına dikkat edilmelidir. Kontaminanların sokulması, şant sisteminin hatalı
çalışmasına (fazla drenaj veya eksik drenaj) neden olabilir. Şant sistemine giren partiküllü maddeler ayrıca basınç/akış kontrolü mekanizmalarını açık tutarak fazla drenaja neden olabilir.
Ventriküler ve distal kateterler valf konektörlerine sabitlenirken tüpü çevreleyen bağlar sağlamca tutturulmalı ama zamanla silikon tüpü kesmemeleri için fazla sıkı olmamalıdır.
Kateterler yönlendirilirken seyirleri boyunca bükülmeleri ve gereksiz şekilde aşınmalarını önlemek için dikkatli olunmalıdır. Bir dönmeli matkap veya burr deliğinin kenarı, ventriküler
kateterin çıkıp kafatası yanında duracak şekilde kıvrımlandırıldığı bölgede, kademeli bir çentik saşlayacak şekilde şekillendirilebilir.
Hidrosefali şant sistemleri bulunan hastalar postoperatif dönemde şantın hatalı çalışmasını düşündüren bulgu ve semptomlar açısından yakından takip edilmelidir. Klinik bulgular
enfeksiyon, şant obstrüksiyonu veya BOS fazla drenajına işaret edebilir.
Şant obstrüksiyonu şant sisteminin bileşenlerinin herhangi birinde oluşabilir. Ventriküler kateter kan pıhtıları veya beyin parçaları gibi partiküllü maddeler, kateter ucunun koroid pleksusa
girmesi, kateterin beyin dokusuna gömülmesi veya ventriküler duvarların fazla drenaj varlığında karşılıklı gelmesi (”yarık ventriküller”) nedeniyle tıkanabilir.
Kateterin atriyal kısmı etrafında pıhtılaşma pulmoner arteriyel ağacın embolizasyonuna ve sonuçta kor pulmonale ve pulmoner hipertansiyona neden olabilir.
Ayrılmış şant bileşenleri kalbe veya peritoneal boşluk içine daha da fazla hareket edebilir.
Şant sistemleri mekanik bozukluk nedeniyle çalışmayabilir ve eksik drenaj veya fazla drenaj oluşabilir.
Şant sisteminin bozulması veya obstrüksiyonu eğer hidrosefali durumu kompanse edilemezse artmış intrakraniyal basınç bulgu ve semptomlarına yol açabilir. İnfantta sık görülen bulgular
ön fontanelde gerginlik artması, kafa derisi venlerinde konjesyon, cansızlık, uyku hali ve gerginlik, kusma ve ense sertliğidir. Daha büyük çocuklar ve yetişkinlerde başağrıları, kusma, görme
bulanıklığı, ense sertliği, bilinç bozulması ve çeşitli anormal nörolojik bulgular gibi sıklıkla artmış intrakraniyal basınç ile ilişkili bulgu ve semptomlar gelişir.
Fazla BOS drenajı subdural hematom veya higromaya veya lateral ventriküler duvarların çökmesine neden olarak ventriküler kateterin obstrüksiyonuna yol açabilir.
Ventriküler kateter koroid pleksus veya komşu beyin dokusuna fibroz adezyonlar nedeniyle bağlı hale gelirse kateterin zorla çıkarılmaması önerilir. Kateterin hafifçe döndürülmesi
serbestleştirilmesine yardımcı olabilir. Zorla çıkarmanın neden olabileceği intraventriküler kanama riskiyle karşılaşmak yerine kateterin yerinde bırakılması önerilir.
Komplikasyonlar
Atılabilir Subkütan Kateter Geçirici kullanımı ile doğrudan ilişkili komplikasyonlar arasında aletin nedbe dokusu oluşmuş alanlardan geçirilmesinde zorluk ve olası hematom oluşumu vardır.
Ventriküloatriyal ve ventriküloperitoneal BOS şant sistemleriyle görülen komplikasyonlar lokal ve/veya genel anesteziyle yapılan herhangi bir cerrahi işlemle yaşananlara benzer olabilir.
Bunlar arasında özellikle infantlarda aşırı kan kaybı, elektrolit dengesizliği ve ilaçlar ve anestezik ajanlara reaksiyonlar bulunur. Bir hasta nadiren implanta karşı hassasiyet nedeniyle
reaksiyon gösterebilir.
BOS şantı oluşturma işlemlerinde en sık görülen komplikasyonlar “Uyarılar” kısmında tanımlandığı şekilde sistemin obstrüksiyonudur. Obstrüksiyon sistemin herhangi bir bileşeninde, seyri
boyunca bir noktada, beyin parçaları, kan pıhtıları ve/veya tümör hücresi agregatlarının oluşturduğu tıkanıklık nedeniyle oluşabilir. Obstrüksiyon ayrıca sistem bileşenlerinin ayrılması veya
kateterin bükülmesi ve/veya sarmal yapması nedeniyle de oluşabilir. Bu durum ventriküler kateterin lateral ventriküle ve distal kateterin kalp ve pulmoner arteriyel ağaç, periton veya
kateterin implante edildiği başka yapıya yer değiştirmesine neden olabilir. Daha önce belirtildiği şekilde infant veya çocuğun büyümesi distal kateterin atriyumdan internal juguler vene
veya peritondan sıvının emilemeyeceği doku düzlemlerine çekilmesine neden olabilir.
Başka olası ciddi komplikasyonlar da mevcuttur. Şant işlemleriyle lokal ve sistemik enfeksiyonların görülmesi ender değildir. Bunlar genellikle Staphylococcus epidermidis gibi ciltte yaşayan
organizmalar nedeniyledir. Kan akımında dolaşan başka patojenler şantta kolonizasyona neden olabilir ve hastaların çoğunda şantın çıkarılmasını gerektirir.
1973 yılında, Robertson et al o zamana kadar bildirilen ventriküloatriyal ve ventriküloperitoneal şantlarda enfeksiyon insidansını özetlemiştir. Ventriküloatriyal şantlarda enfeksiyon
insidansı %7-31 bulunmuştur. Ventriküloperitoneal şantlarda enfeksiyon, yayınların çoğunda hastaların %5-10’unda görülmüştür. Ventriküloatriyal şant oluşturulması diğer organlara
bakteri yayılmasına yatkınlık oluşturduğundan ventriküloperitoneal şant oluşturulmasının daha az zarar verebileceği düşünülür.
1993’te Kestle et al antibiyotik kullanımı, kısa cerrahi süresi (cerrahi deneyim), ve ameliyathane ortamının kontrolü (örn. ayrılmış ameliyathane, kısıtlı personel ve trafik, örtülü cilt yüzeyleri)
kullanımıyla enfeksiyonda önemli bir azalma (%4’ten az) bildirmiştir. Makaleleri bu sonuçların çevrenin kapsamlı perioperatif kontrolüyle antibiyotik kullanılmadan da elde edilebileceğini
belirtmektedir.
şant yerleştirilmiş hastada profilaktik antibiyotik kullanımı, daha dirençli organizmalarla enfeksiyonlara yatkınlık oluşturabileceğinden, nispeten tartışmalıdır. Bu nedenle antibiyotiklerin
profilaktik olarak kullanılması kararını ilgili doktor ve/veya cerrahın vermesi gerekir.
Periton içine şant oluşturulması kateterin başırsak veya omentum majör halkaları içine girmesi nedeniyle başarısız olabilir. Bağırsağın peritoneal kateter nedeniyle perforasyonu ve
sonrasında peritonit gelişmesi tanımlanmıştır.
Fazla BOS drenajı BOS basıncının aşırı azalmasına neden olabilir ve bir subdural hematom veya higroma gelişmesine ve ventriküler büyüklüğün aşırı azalmasına neden olarak ventriküler
duvarların kateterin giriş delikleri üzerine gelmesiyle obstrüksiyona yol açabilir. İnfantta bu aşırı basınç azalması ön fontanelde belirgin bir çöküntü ve kraniyal kemiklerin üst üste binmesine
yol açacaktır ve komünikan bir hidrosefaliyi obstrüktif hidrosefaliye dönüştürebilir.
Ventriküler şant işlemlerinden sonra epilepsi görülmesi bildirilmiştir. Bu çalışma havale insidansının çok sayıda kateter revizyonuyla arttığına da işaret etmiştir.
Mal İadesi Politikası
Ürünler eğer bir ürün defekti veya yanlış etiket şikayeti nedeniyle geri gönderilmiyorsa değiştirme veya kredi açısından kabul edilebilmeleri için açılmamış paketlerde üreticinin mührü
sağlam olarak geri gönderilmelidir. Ürün defekti veya yanlış etiket saptamasını Medtronic Neurosurgery yapacak ve son kararı verecektir. Ürünler müşteride 90 günden fazla kaldıysa
değiştirme veya kredi için kabul edilmeyecektir.
Garanti
A. Standart Sınırlı Garanti. Medtronic Neurosurgery orijinal son kullanıcı müşteriye (“Müşteri”) Müşteri tarafından satın alınan buradaki implante edilebilir ürünün (“Ürün”) Müşteriye
iletildiği tarihte malzeme ve işçilik açısından büyük ölçüde hatasız olacağını garanti eder. Medtronic Neurosurgery modifiye edilmiş (burada açık olarak ifade edilen şekil dışında)
veya olağandışı fiziksel stres, hatalı kullanım, uygun olmayan çalıştırma, ihmal, uygun olmayan test yapılması, Ürünlerin tasarlanandan farklı ürünler veya bileşenlerle kombinasyon
halinde kullanılması veya Ürünlerin tasarlanandan farklı bir şekilde veya tıbbi işlemde kullanılması halinde Ürünler için herhangi bir garanti (ifade veya ima edilen veya mevzuata bağlı)
vermemektedir.
B. Çözüm. Müşterinin yukarıdaki garantinin ihlali durumunda tek alabileceği çözüm ve Medtronic Neurosurgery’nin tek yükümlülüğü Medtronic Neurosurgery’nin kendi isteği ve seçimine
göre, aşağıdaki şartların karşılanması halinde Ürünün yerine yenisini vermek veya Müşteriye bu tür herhangi bir Ürün için fiili olarak ödediği net miktarı iade etmektir: (i) Medtronic
Neurosurgery Müşterinin Ürünü almasından sonraki doksan (90) gün içinde yazılı olarak Ürünün uygun olmadığı konusunda haberdar edilmeli ve bu tür bir uygun olmama ithamı ile
birlikte İngilizce olarak ayrıntılı bir açıklama sağlanmalıdır; (ii) bu Ürün Müşterinin Ürünü almasından sonraki doksan (90) gün içinde Medtronic Neurosurgery’e F.O.B. 125 Cremona Drive,
Goleta, California 93117, A.B.D. adresi kullanılarak veya Medtronic Neurosurgery tarafından başka şekilde belirtilen bilgiler kullanılarak geri gönderilmelidir; ve (iii) Medtronic Neurosurgery
iddia edilen uygunsuzluğun gerçekten mevcut olduğu konusunda makul bir şekilde tatmin olmalıdır. Bu paragrafta açık olarak ifade edilenler dışında Müşterinin Ürünleri Medtronic
Neurosurgery’e, Medtronic Neurosurgery’nin önceden yazılı onayı olmadan geri gönderme hakkı olmayacaktır.
C. Bașka Garantilerin Hariç Bırakılması. YUKARIDA (A) KISMINDA SAĞLANAN KISITLI GARANTİ DIȘINDA MEDTRONIC NEUROSURGERY İFADE VEYA İMA EDİLEN BAȘKA BİR
GARANTİ VEYA ȘARTI KABUL ETMEZ VE ÜRETİCİ ÖZELLİKLE BELİRLİ BİR AMAÇ İÇİN SATILABİLİRLİK VE UYGUNLUK AÇISINDAN ȘARTLARI VE İMA EDİLEN GARANTİLERİ KABUL
ETMEZ. MEDTRONIC NEUROSURGERY HERHANGİ BİR ÜRÜNÜN SATILMASI VEYA KULLANILMASIYLA BAĞLANTILI OLARAK VEYA BU DURUM SONUCUNDA OLUȘAN BAȘKA
HERHANGİ BİR YÜKÜMLÜLÜĞÜ ÜSTLENMEZ VE BAȘKA BİR KİȘNİN ÜSTLENMESİ İÇİN YETKİ VERMEZ.
Printe d in USA
All Rights Reserved
© Medtronic, Inc. 2018
201 8-10
11337 -1L
geBrauchsanweIsung /Οδηγίες χρηςης /használatI utasítás /IstruzIonI per l’uso /
BruksanvIsnIng /Instrukcja użytkowanIa /Instruções para uso /InstruccIones de uso/
CSF-Flow Control aCCeSSorieS
CSV-FlowreguleringStilbehor
aCCeSSoireS Voor regeling Van CSV-Flow
aCCeSSoireS de Contrôle de Flux de lCr
luSSkontrollzubehör
CSF-F
Παρελκόμενα συστήματόσ ελεγχόυ ρόήσ ενυ
áramláSSzabályozó tartozékok
CSFaCCeSSori per il Controllo del FluSSo di lCr
Tilbehør til CSF-Flowkontroll
akCeSoria do kontroli przepływu płynu mózgowo-rdzeniowego
aCeSSórioS do Controlo de Fluxo de lCr
CCeSorioS para el Control del Flujo de lCr
a
illbehör till CSV-FlödeSreglage
t
boS-akiș kontrol akSeSuarlari
Conformité européenne (European Conformity). This symbol means that the device fully complies with European Directive 93/42/EEC.
Conformité européenne (European Conformity). Dette symbol angiver, at anordningen er i fuld overensstemmelse med EU-direktivet 93/42/EØF.
Conformité européenne (Europese conformiteit). Dit symbool betekent dat het apparaat voldoet aan Europese richtlijn 93/42/EEC.
Conformité européenne. Ce symbole signifie que le dispositif est entièrement conforme aux exigences de la directive 93/42 de la CEE.
Conformité européenne (europäische Konformität). Dieses Symbol bedeutet, dass die Vorrichtung vollständig mit der europäischen Direktive
93/42/EWG in Einklang steht.
Conformité européenne (Συμμόρφωση με τις ευρωπαϊκές οδηγίες). Αυτό το σύμβολο υποδεικνύει ότι η συσκευή συμμορφώνεται πλήρως με την
ευρωπαϊκή οδηγία 93/42/ΕΟΚ.
Conformité européenne (Európai megfelelőség). Ez a jel azt jelenti, hogy az eszköz teljes mértékben megfelel a 93/42/EEC európai irányelvnek.
Conformité européenne (conformità europea). Questo simbolo indica che il dispositivo aderisce pienamente ai termini della Direttiva europea
93/42/CEE.
Conformité européenne (europeisk konformitet). Dette symbolet angir at enheten oppfyller europeisk direktiv 93/42/EEC.
Znak CE (Conformité européenne, European Conformity). Symbol oznaczający, że urządzenie spełnia w całości wymogi Dyrektywy Rady nr 93/42/EEC.
Conformité européene (conformidade europeia). Este símbolo significa que o dispositivo cumpre na íntegra a Directiva Europeia 93/42/EEC.
Conformité européenne (conformidad europea). Este símbolo significa que el dispositivo cumple totalmente con lo dispuesto en la Directiva Europea
93/42/EEC.
Conformité européenne (Europeisk konformitet). Denna symbol anger att anordningen uppfyller kraven i EU-direktivet 93/42/EEC.
Conformité européenne (Avrupa Uyumu). Bu işaret cihazın Avrupa Direktifi 93/42/EEC ile tam uyumlu olduğunu göstermektedir.
Caution: Consult Accompanying Documents
Bemærk: Se brugsanvisningen
Opgelet: Raadpleeg de gebruiksaanwijzing
Attention : Consulter le mode d’emploi
Achtung: Siehe Gebrauchsanweisung
Προσοχή: Συμβουλευτείτε τα συνοδευτικά έντυπα
Figyelem: Lásd a használati utasítást
Use by
Anvendes inden
Te gebruiken vóóri
Utiliser avant le
Verwendbar bis
Ημερομηνία λήξης
Szavatossági idő lejár:
Sterilization: Ethylene-Oxide Gas
Sterilisering: Ethylenoxid
Sterilisatie: ethyleenoxidegas
Stérilisation : oxyde d’éthylène
Sterilisation: Ethylenoxid
Αποστείρωση: Αέριο οξείδιο αιθυλενίου
Sterilizálás: Etilén-oxid gáz
Package Contents
Pakkeindhold
Inhoud van de verpakking
Contenu de l’emballage
Packungsinhalt
Περιεχόμενα συσκευασίας
Csomag tartalma
Do Not Reuse
Må ikke genbruges
Niet opnieuw gebruiken
Ne pas réutiliser
Nicht wiederverwenden
Να μην επαναχρησιμοποιείται
Nem használható újra
Reference Number
Referencenummer
Referentienummer
Numéro de référence
Referenznummer
Αριθμός αναφοράς
Referenciaszám
Lot Number
Partinummer
Partijnummer
Numéro de lot
Chargen-Nr.
Αριθμός παρτίδας
Tételszám
CAUTION: For U.S. audiences only.
Forsigtig: Kun til publikum i USA..
Let op: Uitsluitend voor gebruikers in de V.S.
Attention : Réservé au public américain.
Achtung: Nur für die Verwendung in den USA.
ΠΡΟΣΟΧΗ: Μόνο για τις Η.Π.Α.
Figyelem: Csak USA felhasználók számára.
CAUTION: U. S. federal law restricts this device to sale by or on the order of a physician.
BEMÆRK: Ifølge amerikansk lov må dette udstyr kun forhandles eller ordineres af en læge.
LET OP: Krachtens de federale wet van de VS mag dit instrument uitsluitend door of op voorschrift van een arts worden verkocht.
ATTENTION : La législation fédérale américaine n’autorise la vente de ce dispositif que sur prescription médicale.
ACHTUNG: Gemäß US-Bundesgesetzen ist der Verkauf dieses Geräts nur an oder im Auftrag von Ärzten zulässig.
ΠΡΟΣΟΧΗ: Η ομοσπονδιακή νομοθεσία των Η.Π.Α. επιτρέπει την πώληση της συσκευής αυτής μόνο σε ιατρό ή κατόπιν εντολής ιατρού.
FIGYELEM: Az USA szövetségi törvények értelmében ez az eszköz kizárólag orvosoktól vagy orvosi rendelvényre szerezhető be.
ATTENZIONE: la legge federale statunitense limita la vendita di questo dispositivo ai medici o su prescrizione medica.
OBS! Føderal lov (USA) begrenser salget av denne enheten til leger eller etter legers bestilling.
UWAGA: Zgodnie z przepisami prawa federalnego USA sprzedaż opisywanego urządzenia może być realizowana wyłącznie na zlecenie lub zamówienie
wydane przez lekarza.
ATENÇÃO: A lei federal dos E.U.A. limita a venda deste dispositivo a médicos ou mediante receita médica.
PRECAUCIÓN: La ley federal de los EE.UU. restringe la venta de este dispositivo a un médico o a una orden facultativa.
VARNING! Enligt amerikansk federal lag får denna anordning endast säljas av eller på ordination av läkare.
DİKKAT: A.B.D. federal kanunlarına göre bu cihaz sadece bir doktor tarafından veya emriyle satılabilir.
Manufacturer
Producent
Fabrikant
Fabricant
Hersteller
Κατασκευαστής
Gyártó
pS m
ή
όνόμασία pS mediCal
pS m
ediCal jeSt zarejeStrowanym znakiem towarowym Firmy medtroniC, inC.
2113 Australia
InstructIons for use /BrugsanvIsnIng /geBruIksaanwIjzIng /Mode d’eMploI /
BruksanvIsnIng /kullanMa talİMatI
Attenzione: vedere le istruzioni per l’uso
Obs! Se dokumentasjonen som følger med
Uwaga: zobacz instrukcję użytkowania
Atenção: Consulte as Instruções para Uso
Atención: consulte las Instrucciones de uso
Obs! Se bruksanvisningen
Dikkat: Beraberindeki Belgelere Bakınız
Da utilizzare entro
Brukes før
Termin ważności
Usar até
Fecha de caducidad
Användes före
Son Kullanma Tarihi
Sterilizzazione: ossido di etilene
Sterilisering: Etylenoksidgass
Sterylizacja: gazowy tlenek etylenu
Esterilização: Gás Óxido de Etileno
Esterilización: óxido de etileno
Steriliseringsmetod: Etylenoxid
Sterilizasyon: Etilen Oksit Gazı
Contenuto della confezione
Pakkeinnhold
Zawartość opakowania
Conteúdo da Embalagem
Contenido del paquete
Förpackningens innehåll
Paket İçeriği
Non riutilizzare
Må ikke gjenbrukes
Nie używać powtórnie
Não Reutilizar
No volver a utilizar
Får ej återanvändas
Tekrar Kullanmayın
Numero di riferimento
Referansenummer
Nr referencyjny
Número de referência
Número de referencia
Referensnummer
Referans Numarası
Numero di partita
Partinummer
Nr partii
Número do lote
Número de lote
Lotnr
Lot Numarası
Attenzione: esclusivamente per utenti negli USA.
OBS! Bare til publikum i USA.
Przestroga: Dotyczy wyłącznie odbiorców w USA.
Aviso: Apenas para o público nos E.U.A.
Precaución: Sólo para el público de EE.UU.
Obs! Gäller endast användare i USA.
DİKKAT: Sadece A.B.D.’de yaşayanlar için.
Produttore
Produsent
Wytwórca
Fabricante
Fabricante
Tillverkare
Üretici
pS mediCal® iS a regiStered trademark oF medtroniC, inC.
ediCal er et regiStreret Varemærke, der tilhører medtroniC. inC.
pS m
ediCal een wetig gedeponeerd handelSmerk Van medtroniC inC.
pS m
pS m
ediCal eSt une marque dépoSée de medtroniC. inC.
ediCal iSt ein eingetrageneS warenzeiChen der medtroniC. inC.
®
αΠότελεί εμΠόρίκό σήμα κατατεθεν τήσ εταίρίασ medtroniC, inC.
a pS m
ediCal a medtroniC inC. bejegyzett Védjegye.
pS m
ediCal un marChio regiStrato della medtroniC, inC.
pS m
ediCal er et regiStrert Varemerke For medtroniC, inC.
pS m
pS m
pS m
ediCal é uma marCa da medtroniC inC.
ediCal eS una marCa de regiStrada de medtroniC, inC.
ediCal är regiStrerat Varumärke För medtroniC. inC.
pS m
ediCal ’in teSCilli bir tiCari markaSidir.
(901) 396-2698 FAX International
(800) 468-9713 FAX USA/Canada
(901) 344-0645 International
(800) 468-9710 USA/Canada
Minneapolis, MN 55432 USA
710 Medtronic Parkway NE
Medtronic, Inc.
Macquarie Park, NSW
2 Alma Road
Medtronic Australasia Pty Ltd
Australian Sponsor:
The Netherlands
6422 PJ Heerlen
Earl Bakkenstraat 10
Medtronic B.V.
Authorized EC-representative:
EC REP
Page 2
Catheter Connectors
Description
Catheter Connector, Straight
The Catheter Connector, Straight (Fig. 1), is a nylon connector designed for use with Medtronic
English
Neurosurgery PS Medical
Catheter, and Medtronic Neurosurgery PS Medical
Catheter Connector, Right Angle
The Catheter Connector, Right Angle (Fig. 2), is a nylon connector designed for use with Medtronic
Neurosurgery PS Medical Ventricular Catheters.
Catheter Connector, 3-Way
The Catheter Connector, 3-Way (Fig. 3), is a polypropylene and silicone elastomer connector designed
to connect two PS Medical Ventricular Catheters to one Medtronic Neurosurgery PS Medical CSF-Flow
Control Valve inlet connector.
Indications
Catheter Connector, Straight
The Catheter Connector, Straight, is indicated for use when distal catheter revision
is required.
Catheter Connector, Right Angle
The Catheter Connector, Right Angle, is indicated for use to angulate the ventricular catheter to a 90°
angle (nominal) where it exits the twist drill or burr hole.
Catheter Connector, 3-Way
The Catheter Connector, 3-Way, is indicated for use when two PS Medical Ventricular Catheters are
connected to one PS Medical CSF-Flow Control Valve.
Instructions for Use
The surgical technique employed in the use of Catheter Connectors is at the discretion of the surgeon.
®
Cardiac-Peritoneal Catheter, Medtronic Neurosurgery PS Medical® Cardiac
®
Peritoneal Catheter products.
1
2
3
Disposable Subcutaneous Catheter Passers
Description
The Disposable Subcutaneous Catheter Passers are disposable
surgical instruments. They consist of three components:
1. A tubular shaft (60 cm long or 38 cm long);
2. T-handle; and
3. An obturator with a bullet-shaped tip.
The instruments are designed as malleable subcutaneous
tunneling devices for passing cerebrospinal fluid shunt
catheters. The 60 cm model is an appropriate length for most
ventriculoperitoneal shunt procedures. The 38 cm model is an
appropriate length for ventriculoperitoneal shunt procedures with
small patients and for lumboperitoneal shunt procedures.
Indications
The Disposable Subcutaneous Catheter Passers are used to
establish a subcutaneous tunnel and/or position a tubular shaft to be used for the placement of the peritoneal catheter component of a cerebrospinal
fluid shunt. The 38 cm model can also be used for the placement of the lumboperitoneal catheter component of the Medtronic Neurosurgery PS Medical
Lumboperitoneal Catheter System.
Instructions for Use
The surgical technique employed in the use of the Disposable Subcutaneous Catheter Passers is at the discretion of the surgeon. The surgeon is advised to
insure that the catheter will pass through the instrument prior to beginning the procedure.
The tubular shaft is malleable and may be hand-formed by the surgeon as indicated for the operative procedure. When the
instrument is passed subcutaneously, the obturator must be inserted in the tubular shaft and secured into the handle by snapping the obturator’s locking
tip into position. After removal of the obturator, the catheter may be hand-fed through the lumen of the tubular shaft.
The obturator also includes a catheter attachment site for attachment of an open-ended distal catheter. Attachment of the catheter to the obturator allows
catheters of appropriate I.D. to be pulled through the passer shaft.
How Supplied
Medtronic Neurosurgery PS Medical Catheter Connectors and Disposable Subcutaneous Catheter Passers are packaged STERILE and NON-PYROGENIC
and are intended for single (one-time) use only. DO NOT RESTERILIZE. Do not use if package has been previously opened or damaged. Resterilization
can damage the product, potentially leading to patient injury. Medtronic Neurosurgery is not responsible for the performance of any product which has
been resterilized.
Special Order Products
If this Instructions for Use accompanies a Special Order product, there may be differences in the physical characteristics between the product and product
description in this Instructions for Use. These differences will not affect the safety or efficacy of the
special order product. Special order products may be supplied sterile or nonsterile as indicated on the product package label.
Nonsterile products must be cleaned and sterilized prior to use.
Contraindications
Shunting of CSF into the right atrium, peritoneal cavity, or other areas of the body should not be carried out if there is infection in any areas in which the
various components of the shunt system will be implanted. These include infections of the scalp and other skin area through which the shunt system will
traverse, the meninges and cerebral ventricles, peritoneum, and intraperitoneal and retroperitoneal organs, pleura and blood stream. CSF shunting is
contraindicated if there is infection present in any area of the body. Additionally, shunting into the atrium of patients with congenital heart disease or other
serious cardiopulmonary abnormalities is contraindicated.
Patient Education
It is the responsibility of the physician to educate the patient and/or representative(s) regarding CSF shunting. This should include
a description of the complications associated with implantable shunt systems, and an explanation of potential alternative products and treatments.
Warnings and Precautions
The appropriate product, size, pressure, or performance range must be chosen for the specific patient’s needs, based on diagnostic tests and physician
experience. Product labeling specifies applicable product performance levels or ranges.
Repeated hand forming of the Disposable Subcutaneous Catheter Passer may weaken the shaft, resulting in breakage during use.
Sharp edges resulting from modification of or damage to the Disposable Subcutaneous Catheter Passer could adversely affect catheters passed through
the instrument.
Avoid contacting implantable products with lint, glove talc, oily residue from skin, oil based soaps, synthetic detergents or other surface contaminants.
Improper handling or use of instruments when implanting shunt products may result in the cutting, slitting, crushing or breaking of components. Such
damage may lead to a loss of shunt integrity, and necessitate premature surgical revision of the shunt system.
Care must be taken to ensure that particulate contaminants are not introduced into shunt components during preimplantation
testing or handling. Introduction of contaminants could result in improper performance (overdrainage or underdrainage) of the shunt system. Particulate
matter which enters the shunt system may also hold pressure/flow controlling mechanisms open,
resulting in overdrainage.
In securing the ventricular and distal catheters to the valve connectors, the ligatures encircling the tube should be securely, but not too tightly fastened, lest
they eventually cut through the silicone tubing.
Care must be taken in the routing of catheters to prevent kinking and needless abrasion along their course. The rim of the twist drill or burr hole may be
trimmed to provide a beveled notch where the ventricular catheter emerges and is curved to lie adjacent to the skull.
Patients with hydrocephalus shunt systems must be kept under close observation in the postoperative period for signs or symptoms suggesting shunt
malfunction. Clinical findings may indicate infection, shunt obstruction or overdrainage of CSF.
Shunt obstruction may occur in any of the components of the shunt system. The ventricular catheter may become occluded by particulate matter such as
blood clots or brain fragments, by investment of the catheter tip in choroid plexus, by embedding of the catheter in brain tissue, or by coaptation of the
ventricular walls in the presence of overdrainage (“slit ventricles”).
Clotting around the atrial portion of the catheter may lead to embolization of the pulmonary arterial tree with resulting cor pulmonale and pulmonary
hypertension.
Disconnected shunt components may further migrate into the heart, or into the peritoneal cavity.
Shunt systems may fail due to mechanical malfunction, leading to underdrainage or overdrainage.
Malfunction or obstruction of the shunt system may lead to signs and symptoms of increased intracranial pressure if the
hydrocephalus is not compensated. In the infant, common findings are increased tension of the anterior fontanelle, congestion of scalp veins, listlessness,
drowsiness and irritability, vomiting, and nuchal rigidity. Older children and adults will develop signs and symptoms commonly associated with increased
intracranial pressure such as headaches, vomiting, blurring of vision, nuchal
rigidity, deterioration of consciousness and variable abnormal neurological findings.
Overdrainage of CSF may predispose development of subdural hematoma or hygroma or collapse of the lateral ventricular walls leading to obstruction of
the ventricular catheter.
If the ventricular catheter becomes bound to the choroid plexus or adjacent brain tissue by fibrous adhesions, it is suggested that the catheter should not
be removed forcibly. It is suggested that gentle rotation of the catheter may help to free it. It is advised that the catheter be left in place rather than risk
intraventricular hemorrhage which forcible removal may cause.
Complications
Complications directly associated with the use of the Disposable Subcutaneous Catheter Passer include difficulty in passing the instrument through scarred
areas and the possible formation of hematomas.
Complications associated with ventriculoatrial and ventriculoperitoneal CSF shunting systems may be similar to those experienced in any surgical procedure
carried out under local and/or general anesthesia. These include reactions to drugs and anesthetic agents, electrolyte imbalance and excessive blood loss,
particularly in infants. A patient may rarely exhibit a reaction due to sensitivity to the implant.
In CSF shunting procedures, the most common complications are due to obstruction of the system as described under “Warnings.” Obstruction may occur
in any component of the system due to plugging by brain fragments, blood clots, and/or tumor cell aggregates at some point along its course. Obstruction
may also occur because of separation of the system components or kinking and/or coiling of the catheter. This may predispose migration of the ventricular
catheter into the lateral ventricle and the distal catheter into the heart and pulmonary arterial tree, the peritoneum, or other structure in which the
catheter is implanted. As noted previously, growth of the infant or child may cause the distal catheter to be withdrawn from the atrium into the internal
jugular vein or from the peritoneum into tissue planes where the fluid cannot be absorbed.
There are other potentially serious complications. Local and systemic infections are not uncommon with shunting procedures. Usually, they are due to
organisms inhabiting the skin, particularly Staphylococcus epidermidis. Other pathogens circulating in the blood stream may colonize the shunt and, in the
majority of patients, require its removal.
In 1973, Robertson et al. summarized the incidence of infection in ventriculoatrial and ventriculoperitoneal shunts reported up to that time. The incidence
of infection in ventriculoatrial shunting varied from 7 to 31%. Infection in ventriculoperitoneal shunting
occurred in 5 to 10% of the patients in most of the reports. Because ventriculoatrial shunting predisposes the spread of bacteria into other organs,
ventriculoperitoneal shunting is considered less devastating.
In 1993, Kestle et al. reported significant reductions in infection (less than 4%) with the use of antibiotics, short duration of surgery (surgical experience)
and control of the operating room environment (e.g., designated operating room, limited personnel and traffic, covered skin surfaces). The article states
that results can also be obtained without the use of antibiotics, but with rigorous perioperative control of the environment.
Using prophylactic antibiotics in shunted patients is somewhat controversial as their use may predispose infection by more resistant organisms. Therefore,
the decision to use antibiotics prophylactically rests with the attending physician and/or surgeon.
Shunting into the peritoneum may fail because of investments of the catheter in loops of bowel or in the greater omentum. Perforation of the bowel by the
peritoneal catheter with subsequent development of peritonitis has been described.
CSF overdrainage may result in excessive reduction of CSF pressure and predispose the development of a subdural hematoma or hygroma, and excessive
reduction of ventricular size leading to obstruction because of impingement of the ventricular walls on the inlet holes in the catheter. In the infant, this
excessive pressure reduction will cause marked depression of the anterior fontanelle, overriding of cranial bones and may convert communicating into
obstructive hydrocephalus.
The incidence of epilepsy after ventricular shunting procedures has been reported. This study also indicated that the incidence of seizures increased with
multiple catheter revisions.
Returned Goods Policy
Products must be returned in unopened packages, with manufacturer’s seals intact, to be accepted for replacement or credit, unless returned due to a complaint
of product defect or mislabeling. Determination of a product defect or mislabeling will be made by Medtronic Neurosurgery, which determination will be final.
Products will not be accepted for replacement or credit if they have been in the possession of the customer for more than 90 days.
Warranty
A. Standard Limited Warranty. Medtronic Neurosurgery warrants to the original end user purchaser (“Purchaser”) that the enclosed implantable
product (“Product”) purchased by Purchaser, at the time of delivery to Purchaser, shall be substantially free from defects in material and workmanship.
Medtronic Neurosurgery makes no warranty (express, implied, or statutory) for Products that are modified (except as expressly contemplated herein) or
subjected to unusual physical stress, misuse, improper operation, neglect, improper testing, use in combination with other products or components other
than those for which the Products were designed, or use in any manner or medical procedure for which the Products are not indicated.
B. Remedy. Purchaser’s exclusive remedy and Medtronic Neurosurgery’s sole liability for breach of the foregoing warranty shall be, at Medtronic
Neurosurgery’s sole option and election, to replace the Product or credit Purchaser for the net amount actually paid for any such Product; provided that (i)
Medtronic Neurosurgery is notified in writing within ninety (90) days after Purchaser’s receipt of the Product that such Product failed to conform, including
a detailed explanation in English of any alleged nonconformity; (ii) such Product is returned to Medtronic Neurosurgery within ninety (90) days after
Purchaser’s receipt of the Product F.O.B. 125 Cremona Drive, Goleta, California 93117, U.S.A. or as otherwise designated by Medtronic Neurosurgery; and (iii)
Medtronic Neurosurgery is reasonably satisfied that the claimed nonconformities actually exist. Except as expressly provided in this paragraph, Purchaser
shall not have the right to return Products to Medtronic Neurosurgery without Medtronic Neurosurgery’s prior written consent.
C. Exclusion of Other Warranties. EXCEPT FOR THE LIMITED WARRANTY PROVIDED IN (A) ABOVE, MEDTRONIC NEUROSURGERY GRANTS NO OTHER
WARRANTIES OR CONDITIONS, EXPRESS OR IMPLIED, AND MANUFACTURER SPECIFICALLY DISCLAIMS THE IMPLIED WARRANTIES AND CONDITIONS
OF MERCHANTABILITY AND FITNESS FOR A PARTICULAR PURPOSE. MEDTRONIC NEUROSURGERY NEITHER ASSUMES NOR AUTHORIZES ANY OTHER
PERSON TO ASSUME ANY OTHER LIABILITIES ARISING OUT OF OR IN CONNECTION WITH THE SALE OR USE OF ANY PRODUCT.
4
Catheter Connection
(Locking Tip)
Polypropylene Handle
Stainless Steel Shaft
Polypropylene
Obturator Tip
Kateterkonnektorer
Beskrivelse
Kateterkonnektor, lige
Dansk
Kateterkonnektoren, lige (fig. 1), er en nylonkonnektor, der er beregnet til brug sammen med produkterne Medtronic Neurosurgery PS Medical cardialtperitonealt kateter, Medtronic Neurosurgery PS Medical cardialt kateter og Medtronic Neurosurgery PS
Medical peritonealt kateter.
Kateterkonnektor, retvinklet
Kateterkonnektoren, retvinklet (fig. 2), er en nylonkonnektor, der er beregnet til brug sammen med
Medtronic Neurosurgery PS Medical ventrikelkatetre.
Kateterkonnektor, 3-vejs
Kateterkonnektoren, 3-vejs (fig. 3), er en polypropylen- og silikoneelastomerkonnektor, der er
fremstillet til sammenkobling af to PS Medical ventrikelkatetre og indgangsporten på én Medtronic
Neurosurgery PS Medical CSV-flow-kontrolventil.
1
Indikationer
Kateterkonnektor, lige
Kateterkonnektoren, lige, er indiceret til brug, når en distal kateterrevision er påkrævet.
Kateterkonnektor, retvinklet
Kateterkonnektoren, retvinklet, er indiceret til at vinkle ventrikelkatetret 90˚ (teoretisk) på det sted,
hvor det går ud af spiralborehullet eller borehullet.
Kateterkonnektor, 3-vejs
Kateterkonnektoren, 3-vejs, er indiceret til brug, hvor to PS Medical ventrikelkatetre kobles til én PS
Medical CSV-flow-kontrolventil.
Brugsanvisning
Det er op til kirurgen, hvilken kirurgisk teknik der anvendes ved brug af kateterkonnektorerne.
2
3
Engangsanordninger til subkutan kateteranbringelse
Beskrivelse
Engangsanordningerne til subkutan kateteranbringelse er
kirurgiske instrumenter til engangsbrug. De består af tre
komponenter:
1. Et rørgreb (60 cm eller 38 cm langt);
2. T-håndtag; og
3. En obturator med en kugleformet spids.
Instrumenterne er designet som bøjelige subkutane
tunneleringsenheder til passage af cerebrospinalvæske-shuntkatetre. Modellen på 60 cm har en passende længde til de fleste
ventrikuloperitoneale shunt-procedurer. Modellen på 38 cm har
en passende længde til ventrikuloperitoneale shunt-procedurer
på små patienter samt til lumbal-peritoneale shunt-procedurer.
Indikationer
Engangsanordningerne til subkutan kateteranbringelse bruges til
at etablere en subkutan tunnel og/eller til at anbringe et rørgreb,
der skal bruges til at placere peritonealkateterkomponenten i
en cerebrospinalvæske-shunt. Modellen på 38 cm kan også anvendes til placering af lumbo-peritonealkateterkomponenten i Medtronic Neurosurgery’s PS
Medical lumbo-peritoneal katetersystem.
Brugsanvisning
Det er op til kirurgen, hvilken kirurgisk teknik der anvendes ved brug af engangsanordningerne til subkutan kateteranbringelse. Kirurgen rådes til at sikre,
at katetret kan passere gennem instrumentet, før indgrebet påbegyndes.
Rørgrebet er bøjeligt, og kirurgen kan håndforme det som angivet til det operative indgreb. Når instrumentet indføres subkutant, skal obturatoren være indsat i
rørgrebet og fastgjort i håndtaget ved at klikke obtoratorens låsespids på plads. Efter ernelse af obturatoren kan katetret håndindføres gennem rørgrebets lumen.
Obturatoren har desuden et katetermonteringssted, hvor et distalt kateter med åben ende fastgøres. Ved fastgørelse af katetret på obturatoren kan katetre
med passende indvendige diametre trækkes gennem indføringsskaftet.
Levering
Medtronic Neurosurgery PS Medical kateterkonnektorer og engangsanordninger til subkutan kateteranbringelse leveres STERILE og IKKE-PROGENE og er
udelukkende beregnet til engangsbrug. MÅ IKKE RESTERILISERES. Pakningen må ikke anvendes, hvis den har været åbnet eller er blevet beskadiget.
Resterilisation kan skade produktet, hvilket kan føre til patientskade. Medtronic Neurosurgery er ikke ansvarlig for ydeevnen af et produkt, der er blevet resteriliseret.
Specialprodukter
Hvis denne brugsanvisning er vedlagt et specialprodukt, kan der være forskelle mellem produktets fysiske karakteristika og produktbeskrivelserne i denne
brugsanvisning. Disse forskelle har ingen betydning for sikkerheden eller effektiviteten af specialproduktet. Specialprodukter kan leveres sterile eller
usterile som angivet på produktets pakkeetiket. Usterile produkter skal rengøres og steriliseres før brug.
Kontraindikationer
Shunting af CSV til højre hjerteforkammer, bughulen eller andre steder i kroppen bør ikke gennemføres, hvis der forekommer infektion i et af de områder, hvor
shunt-systemets komponenter skal implanteres. Det gælder bl.a. infektioner i kraniet og andre hudområder, som shunt-systemet skal gå igennem, meninges og
cerebralventriklerne, peritoneum og intraperitoneale og retroperitoneale organer, pleura og blodbanerne. CSV-shunting er kontraindiceret, hvis der er infektion
i en hvilken som helst del af kroppen. Desuden er shunting ind i atrium på patienter med medfødte hjertesygdomme eller andre alvorlige kardiopulmonale
abnormaliteter kontraindiceret.
Patientinstruktion
Det er lægens ansvar at orientere patienten og/eller dennes pårørende om CSV-shunting. Dette indebærer en beskrivelse af de komplikationer, der er
knyttet til implanterbare shunt-systemer, og en forklaring af mulige alternative produkter og behandlinger.
Advarsler og forholdsregler
Passende produkt, størrelse, tryk eller anvendelsesområde skal vælges efter patientens specifikke behov på baggrund af diagnostiske tests og lægens
erfaringer. Produktetiketten specificerer det relevante produkts ydeevne eller anvendelsesområder.
Gentagne håndformninger af engangsanordningen til subkutan kateteranbringelse kan svække grebet, hvilket kan føre til brud under brugen.
Skarpe kanter som følge af ændring eller beskadigelse af engangsanordningen til subkutan kateteranbringelse kan påvirke de katetre, der føres gennem
instrumentet, negativt.
Implanterbare produkter må ikke komme i kontakt med fnug, talkum, olierester fra hud, oliebaserede sæber, syntetiske rengøringsmidler eller andre
overfladekontaminanter.
Ukorrekt håndtering eller brug af instrumenter ved implantation af shunt-produkter kan føre til, at komponenterne bliver skåret, flænget, brudt eller knust.
Sådanne beskadigelser kan føre til tab af shuntens integritet, og de kan nødvendiggøre en for tidlig revision af shunt-systemet.
Vær omhyggelig for at sikre, at der ikke trænger partikelkontaminanter ind i shuntens komponenter under testning eller håndtering før implantationen.
4
Katetertilslutning
(låsespids)
Håndtag af polypropylen
Rustfrit stålskaft
Obturatorspids af
polypropylen
Indtrængen af kontaminanter kan resultere i dårlig ydeevne (over- eller underdrænage) af shunt-systemet. Partikler, der trænger ind i shunt-systemet, kan
desuden holde tryk- eller flydekontrolmekanismerne åbne, hvilket kan føre til overdrænage.
Ved fastgørelse af ventrikel- og distalkatetre til ventilkonnektorerne skal de ligaturer, der ligger omkring røret, fastgøres sikkert, men ikke for stramt, for at
de ikke efterhånden skal skære sig igennem silikonerørene.
Vær omhyggelig ved indføringen af katetrene for at forhindre kinking og unødigt slid langs med indføringsvejen. Kanten af spiralboret eller borehullet kan
klippes til for at opnå en skråt skåret kant, hvor ventrikelkatetret kommer til syne og buer for at ligge tæt ved kraniet.
Patienter med hydrocephalus-shunt-systemer skal holdes under skarp observation i den postoperative periode, så eventuelle tegn og symptomer på, at der
er fejl i shunten, kan konstateres. De kliniske fund kan indikere infektion, shunt-okklusion eller overdrænage af CSV.
Shunt-okklusion kan forekomme i en hvilken som helst komponent i shunt-systemet. Ventrikelkatetret kan blive okkluderet af partikler, såsom
blodkoagler eller hjernefragmenter, ved indsættelse af kateterspidsen i plexus chorioideus, ved indlejring af katetret i hjernevæv eller ved koaptation af
ventrikelvæggene i tilfælde af overdrænage (“spaltet ventrikel”).
Koagulation omkring atriedelen af katetret kan føre til embolisering af pulmunararteriegrenen med deraf følgende cor pulmonale og pulmonal
hypertension.
Desuden kan løsrevne shunt-komponenter vandre ind i hjertet eller bughulen.
Shunt-systemer kan svigte på grund af mekanisk fejlfunktion, hvilket kan føre til under- og overdrænage.
Fejlfunktion eller okklusion af shunt-systemet kan medføre tegn og symptomer på øget intrakranialt tryk, hvis der ikke kompenseres for hydrocephalus.
Hos det lille barn er de almindelige symptomer øget spænding i den anteriore fontanel, blodophobning i kranievenerne, apati, omtågethed og irritabilitet,
opkastning og nakkestivhed. Større børn og voksne udvikler tegn og symptomer, der normalt forbindes med øget intrakranialt tryk, f.eks. hovedpine,
opkastning, synssløring, nakkestivhed, forværring af bevidsthedsniveauet og forskellige abnormale neurologiske tilstande.
Overdrænage af CSV kan prædisponere for udvikling af en subdural hæmatom, hydrom eller kollaps af de laterale ventrikelvægge, hvilket kan føre til
okklusion af ventrikelkatetret.
Hvis ventrikelkatetret bliver bundet til plexus chorioideus eller det tilstødende hjernevæv med fibrøse vævsadhæsioner, anbefales det, at det ikke ernes
ukontrolleret. Det anbefales at dreje katetret forsigtigt for at gøre det lettere at frigøre det. Det tilrådes, at katetret bliver på plads for at undgå risiko for
intraventrikulær blødning, der kan blive resultatet af en ukontrolleret ernelse.
Komplikationer
De komplikationer, der er direkte forbundet med anvendelse af engangsanordningen til subkutan kateteranbringelse, er bl.a. besvær med at passere
instrumenter gennem cikatriceområder og mulig dannelse af hæmatomer.
Komplikationer, der er knyttet til ventrikuloatriale og ventrikuloperitoneale CSV-shunt-systemer, kan ligne dem, man møder inden for alle kirurgiske
procedurer, der gennemføres under lokal og/eller fuld bedøvelse. Det er blandt andet reaktioner over for medicin og bedøvelsesmidler, elektrolyt-ubalance
og stort blodtab, især hos små børn. En patient kan sjældent udvise en reaktion på grund af følsomhed over for implantatet.
I CSV-shunt-procedurerne er årsagen til de mest almindelige komplikationer okklusion af systemet som beskrevet under “Advarsler”. Okklusion kan
forekomme i en hvilken som helst komponent i systemet på grund af tilstopning af hjernefragmenter, blodstørkninger og/eller tumorcelleophobninger et
eller andet sted i systemet. Der kan også forekomme okklusion på grund af separation af systemkomponenter eller kinking og/eller snoning af katetret.
Dette kan prædisponere for vandring af ventrikelkatetret til den laterale ventrikel og af det distale kateter til hjerte- og lungepulsåren, peritoneum eller
andre strukturer, som katetret er implanteret i. Som tidligere nævnt kan et barns vækst medføre, at det distale kateter trækkes tilbage fra atrium til den
indre jugularvene eller fra peritoneum til vævsplaner, hvorfra væsken ikke kan absorberes.
Der er andre potentielt alvorlige komplikationer. Lokale og systemiske infektioner er ikke ualmindelige i shunting-procedurer. Normalt skyldes de, at
organismer indtager huden, især Staphylococcus epidermidis. Andre patogener, der cirkulerer rundt i blodet, kan kolonisere shunten, og hos størstedelen af
patienterne kræver det en ernelse af shunten.
I 1973 opstillede Robertson et al. forekomsten af infektioner i ventrikuloatriale og ventrikuloperitoneale shunts, der var rapporteret indtil dette tidspunkt.
Forekomsten af infektioner i ventrikuloatrial shunting varierede fra 7 til 31 %. Infektion i ventrikuloperitoneal shunting forekom hos 5 til 10 % af patienterne i de fleste
rapporter. Da ventrikuloatrial shunting prædisponerer for spredning af bakterier i andre organer, anses ventrikuloperitoneal shunting for at være mindre kritisk.
I 1993 rapporterede Kestle et al. signifikante reduktioner i infektionsraten (mindre end 4 %) under anvendelse af antibiotika, kortvarig operation (kirurgisk
erfaring) og kontrol af operationsstuemiljøet (dvs., designeret operationsstue, begrænset personale og trafik, dækkede hudflader). Artiklen anf ører, at
disse resultater også kan opnås uden brug af antibiotika, men med omfattende perioperativ kontrol af miljøet.
Brug af profylaktiske antibiotika til shuntede patienter er temmelig kontroversiel, idet dette kan prædisponere for infektioner af mere resistente
organismer. Derfor hviler beslutningen om at bruge antibiotika profylaktisk på den behandlende læge og/eller kirurgen.
Shunting til peritoneum kan mislykkes, hvis katetret indesluttes i tarmslyngninger eller i store omentum. Perforering af tarmen af peritonealkatetret med
efterfølgende udvikling af peritonitis er beskrevet.
CSV-overdrænage kan resultere i betydelig reduktion af CSV-trykket og kan prædisponere for udvikling af et subduralt hæmatom eller hygrom og i
betydelig reduktion af ventrikelstørrelsen med okklusion til følge på grund af indtrængning i ventrikelvæggene i katetrets indgangshuller. Hos det lille
barn vil denne store trykreduktion medføre markant sænkning af den anteriore fontanel, overskydning af kranieknoglerne og eventuelt ændret overførsel
til obstruktiv hydrocephalus.
Der er rapporteret om tilfælde af epilepsi efter ventrikulære shunting-procedurer. Denne undersøgelse indikerede, at forekomsten af anfald steg i takt med
flere kateterrevisioner.
Returnering af varer
Produkter skal returneres i uåbnede pakninger med producentens forseglinger intakte for at blive accepteret til udskiftning eller tilbagebetaling, medmindre
returneringen er sket pga. en klage over produktdefekt eller forkert etikettering. Hvorvidt et produkt er defekt eller forkert etiketteret afgøres af Medtronic
Neurosurgery, hvis afgørelse er endelig. Produkter vil ikke blive accepteret til erstatning eller kreditering, hvis de har været i kundens besiddelse i mere end 90 dage.
Garanti
A. Almindelig begrænset garanti. Medtronic Neurosurgery garanterer over for den oprindelige køber og endelige bruger (“Køber”), at vedlagte produkt
til engangsbrug (“Produkt”), der er købt af Køber, på tidspunktet for levering til Køber er fri for defekter i materiale og udførelse. Medtronic Neurosurgery
giver ingen garanti (udtrykt, underforstået eller lovmæssig) for Produkter, der er ændret (undtagen som udtrykkelig påtænkt heri) eller udsat for
usædvanlig fysisk belastning, misbrug, forkert brug, forsømmelse, upassende afprøvning, brug i forbindelse med andre produkter eller andre komponenter
end dem, hvortil Produkterne blev konstrueret, eller brug på nogen anden måde eller til et medicinsk indgreb, hvortil Produkterne ikke er indicerede.
B. Retsmiddel. Købers eneste retsmiddel og Medtronic Neurosurgery’s eneste ansvar for brud på forudgående garanti er, at Medtronic Neurosurgery’s
eneste mulighed og valg er at erstatte Produktet eller kreditere Køber for det nettobeløb, der blev betalt for et sådant Produkt, forudsat at (i) Medtronic
Neurosurgery bliver skriftligt underrettet inden for halvfems (90) dage efter Købers modtagelse af Produktet, at Produktet ikke var i konformitet, herunder
en detaljeret forklaring på engelsk af enhver påstået manglende konformitet, (ii) Produktet returneres til Medtronic Neurosurgery inden for halvfems (90)
dage efter Købers modtagelse af Produktet F.O.B. (frit om bord) til 125 Cremona Drive, Goleta, California 93117, USA eller anden adresse, der er angivet
af Medtronic Neurosurgery’s anden angivelse og (iii) Medtronic Neurosurgery er rimeligt indforstået med, at de påståede manglende konformiteter rent
faktisk eksisterer. Bortset fra, hvad der er udtrykkeligt fastsat i dette afsnit, har Køber ikke ret til at returnere Produkter til Medtronic Neurosurgery uden
Medtronic Neurosurgery’s forudgående skriftlige tilladelse.
C. Udelukkelse af andre garantier. BORTSET FRA DEN BEGRÆNSEDE GARANTI NÆVNT UNDER (A) HEROVER GIVER MEDTRONIC NEUROSURGERY
INGEN ANDRE GARANTIER ELLER BETINGELSER, HVERKEN UDTRYKTE ELLER UNDERFORSTÅEDE, OG PRODUCENTEN FRALÆGGER SIG ISÆR
ANSVAR FOR UNDERFORSTÅEDE GARANTIER OG BETINGELSER FOR SALGBARHED OG EGNETHED TIL ET BESTEMT FORMÅL. MEDTRONIC
NEUROSURGERY PÅTAGER SIG IKKE OG BEMYNDIGER IKKE NOGEN ANDEN PERSON TIL AT PÅTAGE SIG NOGET ANDET ANSVAR SOM RESULTAT AF
ELLER I FORBINDELSE MED SALGET ELLER BRUGEN AF ET PRODUKT.
Katheterconnectors
Beschrijving
Katheterconnector, recht
De rechte katheterconnector (figuur 1) is een nylon connector ontworpen voor gebruik met Medtronic Neurosurgery PS Medical cardiale-peritoneale
katheters, Medtronic Neurosurgery PS Medical cardiale katheters en Medtronic Neurosurgery PS Medical
peritoneale katheters.
Nederlands
Katheterconnector, met rechte hoek
De katheterconnector met rechte hoek (figuur 2) is een nylon connector ontworpen voor gebruik met de
Medtronic Neurosurgery PS Medical ventriculaire katheters.
Katheterconnector, driewegs
De driewegse katheterconnector (figuur 3) is een polypropyleen en siliconenelastomeer connector ontworpen
om twee PS Medical ventriculaire katheters te verbinden met één Medtronic Neurosurgery PS Medical
inlaatconnector van een flowregelingsklep voor CSV.
1
Indicaties
Katheterconnector, recht
De rechte katheterconnector is aangewezen voor gebruik wanneer revisie van een distale katheter noodzakelijk
is.
Katheterconnector, met rechte hoek
De katheterconnector met rechte hoek is aangewezen voor gebruik om de ventriculaire katheter een hoek van
90˚ (nominaal) te doen vormen, op de plaats waar hij het boorgat of het spiraalboorgat verlaat.
Katheterconnector, driewegs
De driewegse katheterconnector is aangewezen voor gebruik wanneer twee PS Medical ventriculaire katheters
verbonden zijn met één PS Medical flowregelingsklep voor CSV.
Gebruiksaanwijzing
De voor het gebruik van de katheterconnectors aangewende operatieve techniek is naar keus van de chirurg.
2
3
Disposable subcutane katheterinplanters
Beschrijving
De disposable subcutane katheterinplanters zijn voor eenmalig
gebruik bestemde chirurgische instrumenten. Zij bestaan uit drie
onderdelen:
1. een buisvormige schacht (met een lengte van 60 cm of 38 cm);
2. een T-hendel en
3. een obturator met een kogelvormige tip.
De instrumenten worden gebruikt als buigzame subcutane
tunnelingsapparaten om shuntkatheters voor cerebrospinaal
vocht op te voeren. Het model van 60 cm heeft de geschikte
lengte voor het merendeel van de ventriculoperitoneale
shuntprocedures. Het model van 38 cm heeft de geschikte lengte
voor ventriculoperitoneale shuntprocedures bij kleine patiënten en
voor lumboperitoneale shuntprocedures.
Indicaties
De disposable subcutane katheterinplanters worden gebruikt om een subcutane tunnel te vormen en/of een buisvormige schacht te positioneren voor
het plaatsen van het peritoneale katheteronderdeel van een shunt voor cerebrospinaal vocht. Het model van 38 cm kan tevens worden gebruikt voor het
plaatsen van het lumboperitoneale katheteronderdeel dat deel uitmaakt van het lumboperitoneale kathetersysteem van Medtronic Neurosurgery PS
Medical.
Gebruiksaanwijzing
De voor het gebruik van de disposable subcutane katheterinplanter aangewende operatieve techniek is naar keus van de chirurg. De chirurg doet er goed
aan zich ervan te vergewissen dat de katheter door het instrument past alvorens met de procedure te beginnen.
De buisvormige schacht is buigzaam en kan door de chirurg met de hand worden gevormd zoals aangewezen voor de operatieve procedure. Wanneer
het instrument subcutaan wordt geplaatst, moet de obturator in de buisvormige schacht worden gestoken en in de hendel worden vastgezet door de
vergrendelende tip op zijn plaats vast te klikken. Nadat de obturator is verwijderd, kan de katheter met de hand door het lumen van de buisvormige
schacht worden opgevoerd.
De obturator omvat ook een bevestigingsplaats voor het bevestigen van een distale katheter met open einde. Door de katheter aan de obturator te
bevestigen, kunnen katheters met de juiste binnendiameter door de schacht van de inplanter worden getrokken.
Leveringswijze
De Medtronic Neurosurgery PS Medical katheterconnectors en disposable subcutane katheterinplanters zijn STERIEL en PYROGEENVRIJ verpakt en zijn
uitsluitend voor eenmalig gebruik bestemd (één keer gebruiken). NIET OPNIEUW STERILISEREN. Niet gebruiken als de verpakking voordien geopend
of beschadigd is. Het opnieuw steriliseren kan het product beschadigen en mogelijk letsel toebrengen aan de patiënt. Medtronic Neurosurgery is niet
aansprakelijk voor de prestatie van een product dat opnieuw gesteriliseerd is.
Speciaal te bestellen producten
Indien deze gebruiksaanwijzing bij een speciaal besteld product is gevoegd, is het mogelijk dat er verschillen zijn tussen de uitwendige karakteristieken van
het bijgevoegde product en het product dat in deze productbijsluiter is beschreven. Deze verschillen hebben geen invloed op de veiligheid of werkzaamheid
van het speciaal bestelde product. Speciaal te bestellen producten kunnen steriel of niet-steriel worden geleverd, zoals aangeduid op het verpakkingslabel
van het product. Niet steriele producten moeten vóór gebruik worden gereinigd en gesteriliseerdis.
Contra-indicaties
Het shunten van CSV in het rechter atrium, de peritoneale holte of andere delen van het lichaam mag niet worden uitgevoerd indien een infectie aanwezig is in
een van de delen waarin een van de verscheidene onderdelen van het shuntsysteem zal worden geïmplanteerd. Dit omvat infecties van de hoofdhuid en andere
delen van de huid waar het shuntsysteem door komt, de meninges en hersenventrikels, het peritoneum en de intraperitoneale en retroperitoneale organen, de
pleura en de bloedstroom. Het shunten van CSV is gecontra-indiceerd indien een infectie aanwezig is in welk deel dan ook van het lichaam. Het shunten in het
atrium van patiënten met congenitale hartkwalen of andere ernstige cardiopulmonale afwijkingen is eveneens gecontraïndiceerd.
Informatie voor de patiënt
Het behoort tot de verantwoordelijkheid van de arts om de patiënt en/of zijn/haar vertegenwoordiger(s) te informeren over het shunten van CSV. Dit dient een
beschrijving te omvatten van de complicaties van implanteerbare shuntsystemen en een uitleg over mogelijke alternatieve producten en behandelingen.
Waarschuwingen en voorzorgsmaatregelen
Het juiste product, de juiste maat, de juiste druk of het juiste prestatiebereik moeten worden gekozen volgens de specifieke behoeften van de patiënt, op
basis van diagnostische tests en de ervaring van de arts. Het label van het product specificeert de prestatieniveaus of -bereiken die van toepassing zijn.
Herhaalde handmatige vervorming van de disposable subcutane katheterinplanter kan de schacht verzwakken en kan leiden tot breuken tijdens gebruik.
Scherpe randen tengevolge van het wijzigen van of beschadiging van de disposable subcutane katheterinplanter kunnen de katheters die door het
instrument worden gevoerd beschadigen.
Vermijd aanraking van de implanteerbare producten met pluksel, handschoentalk, olie-achtig huidresidu, zeep op oliebasis, synthetische detergenten of
andere verontreinigingen op de oppervlakte.
Onjuiste hantering of gebruik van instrumenten tijdens het implanteren van deze shuntproducten kan insnijdingen, scheuren, verpletteren of breken van
onderdelen tot gevolg hebben. Dergelijke schade kan de integriteit van de shunt aantasten en vroegtijdige operatieve revisie van het geïmplanteerde
shuntsysteem noodzakelijk maken.
Zorg dat verontreinigende deeltjes niet in de shuntonderdelen worden geïntroduceerd gedurende de preïmplantatietests of bij het hanteren. De introductie van
verontreinigende deeltjes kan een slechte werking (te veel of te weinig drainage) van het shuntsysteem tot gevolg hebben. Verontreinigende deeltjes die het
shuntsysteem binnendringen kunnen ook de mechanismen voor druk- en flowregeling open houden, wat overmatige drainage tot gevolg kan hebben.
Bij het aansluiten van de ventriculaire en distale katheters op de klepconnectors, moeten de omringende ligaturen goed, maar niet te strak worden
vastgemaakt, zodat ze uiteindelijk niet door de siliconenslang snijden.
Ga zorgvuldig te werk bij het leiden van katheters, om knikken en onnodig schuren langs het traject te voorkomen. De rand van het spiraalboorgat of boorgat kan
worden bijgesneden om een schuine keep te verkrijgen op de plaats waar de ventriculaire katheter uitkomt en gebogen is om tegen de schedel aan te liggen.
Patiënten met hydrocephalus shuntsystemen moeten gedurende de postoperatieve periode van nabij worden gevolgd op tekenen en symptomen die op
defecten van de shunt wijzen. Klinische tekenen kunnen wijzen op infectie, shuntobstructie of overmatige drainage van CSV.
Obstructie van de shunt kan zich voordoen in elk onderdeel van het shuntsysteem. De ventriculaire katheter kan verstopt raken door partikeltjes
zoals bloedklonters of hersenfragmenten, door insluiting van de ventriculaire kathetertip in de choroid plexus, door inbedding van de katheter in het
hersenweefsel of door coaptatie van de ventrikelwanden in geval van overmatige drainage (“gespleten ventrikels”).
Stolling rond het atriale gedeelte van de katheter kan leiden tot embolisatie van de pulmonale arteriële bloedbaan en de eruit voortvloeiende cor
pulmonale en pulmonale hypertensie.
Ontkoppelde shuntonderdelen kunnen zich in het hart of in de peritoneale holte verplaatsen.
Shuntsystemen kunnen falen tengevolge van mechanische defecten, wat tot te weinig of te veel drainage kan leiden.
Defecten of obstructie van het shuntsysteem kunnen leiden tot tekenen en symptomen van verhoogde intracraniele druk indien de hydrocephalus niet wordt
gecompenseerd. Bij de zuigeling zijn vaak voorkomende symptomen verhoogde druk van de fontanella maior, congestie van de venen van de hoofdhuid, lusteloosheid,
slaperigheid en prikkelbaarheid, braken en nekstijfheid. Oudere kinderen en volwassenen vertonen tekenen en symptomen die gewoonlijk met verhoogde intracraniele
druk worden geassocieerd, zoals hoofdpijn, braken, wazig zien, nekstijfheid, verlaagd bewustzijn en verscheidene abnormale neurologische bevindingen.
Overmatige drainage van CSV kan de patiënt vatbaar maken voor subduraal hematoom of hydroma of inzakken van de laterale ventrikelwanden, wat tot
obstructie van de ventriculaire katheter leidt.
Indien de ventriculaire katheter aan de choroid plexus of belendend hersenweefsel vast komt te zitten tengevolge van bindweefseladhesies, wordt aanbevolen
de katheter niet met kracht te verwijderen. Er wordt gesuggereerd dat voorzichtige rotatie de katheter kan helpen losmaken. Het verdient aanbeveling de
katheter op zijn plaats te laten in plaats van hem krachtdadig te verwijderen, teneinde het risico op intraventriculaire bloeding te vermijden.
Complicaties
Complicaties die rechtstreeks geassocieerd worden met het gebruik van de disposable subcutane katheterinplanter omvatten het ervaren van
moeilijkheden bij het doorvoeren van het instrument door littekenweefsel en de mogelijke vorming van hematomen.
Complicaties van ventriculoatriale en ventriculoperitoneale shuntsystemen voor CSV kunnen lijken op de complicaties geassocieerd met andere operatieve ingrepen
die onder plaatselijke en/of algemene anesthesie worden uitgevoerd. Deze complicaties omvatten reacties op geneesmiddelen en anesthetische middelen, elektrolytonevenwicht en overmatig bloedverlies, vooral bij zuigelingen. In zeldzame gevallen kan de patiënt een sensitiviteitsreactie vertonen tegenover het implantaat.
De meest voorkomende complicaties bij procedures voor het shunten van CSV zijn te wijten aan obstructie van het systeem, zoals beschreven in de sectie
“Waarschuwingen” van deze bijsluiter. De obstructie kan zich in elk onderdeel van het systeem voordoen tengevolge van hersenfragmenten, bloedklonters
en/of ophopingen van tumorcellen in de katheter. De obstructie kan zich ook voordoen tengevolge van het loskoppelen van systeemonderdelen of
van het knikken en/of kronkelen van de katheter. Dit kan de patiënt vatbaar maken voor migratie van de ventriculaire katheter in het laterale ventrikel
en van de distale katheter in het hart, de pulmonale aders, het peritoneum of een andere structuur waarin de katheter is geïmplanteerd. Zoals eerder
uiteengezet, kan de groei van de zuigeling of van het kind er de oorzaak van zijn dat de distale katheter uit het atrium en in de vena jugularis interna wordt
teruggetrokken of uit het peritoneum wordt teruggetrokken en in weefsellagen terechtkomt waar de vloeistof niet kan worden geabsorbeerd.
Er zijn andere, potentieel ernstige complicaties. Lokale en systemische infecties zijn niet ongewoon bij shuntingprocedures. Zij zijn meestal te wijten aan
organismen die zich op de huid bevinden, meer bepaald Staphylococcus epidermidis. Andere pathogeen die in de bloedstroom circuleren, kunnen echter de
shunt koloniseren en, bij het merendeel van de patiënten, de verwijdering van de shunt noodzakelijk maken.
In 1973 vatten Robertson et al. de incidentie samen van infecties in ventriculoatriale en ventriculoperitoneale shunts die tot dan toe waren gerapporteerd.
De incidentie van infecties bij ventriculoatriale shunts varieerde van 7 tot 31 %. Infecties bij ventriculoperitoneale shunts kwam voor in 5 tot 10 % van de
patiënten in de meeste rapporten. Aangezien ventriculoatriale shunts de patiënt vatbaar maken voor de verspreiding van bacteriën in andere organen,
worden ventriculoperitoneale shunts als minder verwoestend gezien.
In 1993 meldden Kestle et al. een aanzienlijke daling van infecties (minder dan 4 %) dankzij het gebruik van antibiotica, korte duur van de operatieve
ingreep (chirurgische ondervinding) en controle van de omgeving in de operatiezaal (nl. een speciaal daartoe bestemde operatiezaal, beperkt personeel en
heen en weer geloop, huidoppervlak bedekt). Het artikel vermeldt dat de resultaten ook kunnen worden bereikt zonder gebruik van antibiotica, maar met
een strenge preoperatieve controle van de omgeving.
Het gebruik van profylactische antibiotica in patiënten met shunts is enigszins controversieel, omdat het gebruik ervan de patiënt vatbaar kan maken voor infectie
door organismen met een hoger weerstandsvermogen. Daarom berust de beslissing om antibiotica profylactisch te gebruiken bij de behandelende arts en/of chirurg.
Shunting in het peritoneum kan mislukken vanwege insluiting van de katheter in lussen van de darm of de omentum maius. Perforatie van de darm door
de peritoneale katheter en de erop volgende ontwikkeling van peritonitis is eveneens beschreven.
Overmatige drainage van CSV kan te grote vermindering van CSV-druk tot gevolg hebben en de patiënt vatbaar maken voor de ontwikkeling van een subduraal
hematoom of hydroma, en overmatige vermindering van de afmetingen van het ventrikel, wat tot obstructie leidt tengevolge van botsing van de ventriculaire
wanden met de inlaatgaten van de katheter. Bij de zuigeling zal deze overmatige drukvermindering een uitgesproken depressie van de fontanella maior en
overhelling van de schedelbeenderen veroorzaken, en kan de hydrocephalus communicans worden omgezet in obstructieve hydrocephalus.
De incidentie van epilepsie na ventriculaire shuntingprocedures is gerapporteerd. Deze studie indiceerde ook dat de incidentie van aanvallen steeg bij
meervoudige katheterrevisies.
Teruggezonden goederen
De producten moeten in de ongeopende verpakking worden teruggestuurd, met de zegels van de fabrikant ongeschonden, om in aanmerking te komen
voor vervanging of vergoeding, behalve indien zij worden teruggestuurd ten gevolge van een klacht in verband met een defect aan of verkeerd etiket op
het product. Medtronic Neurosurgery zal bepalen of een product al dan niet defect of verkeerd gelabeld is. Deze beslissing is definitief. Producten zullen
niet voor vervanging of vergoeding in aanmerking komen indien de klant deze gedurende meer dan 90 dagen in zijn bezit heeft gehad.
Garantie
A. Standaard beperkte garantie. Medtronic Neurosurgery garandeert de oorspronkelijke koper (hierna genaamd de koper) dat het ingesloten
implanteerbare product (hierna genaamd het product) dat door de koper is aangekocht, op het ogenblik van aflevering ervan aan de koper in wezen
vrij zal zijn van defecten in materiaal en afwerking. Medtronic Neurosurgery geeft geen enkele garantie (hetzij uitdrukkelijk, stilzwijgend of statutair)
voor producten die zijn gewijzigd (behalve zoals uitdrukkelijk hierin voorzien) of onderworpen aan uitzonderlijke spanning, verkeerd gebruik, onjuiste
behandeling, onachtzaamheid, onjuist testen, gebruik in combinatie met andere producten of met onderdelen waarvoor de producten niet speciaal zijn
ontworpen, of gebruik op een wijze of in een medische procedure waarvoor de producten niet zijn aangewezen.
B. Verhaal. Het uitsluitende verhaal van de koper, en de uitsluitende aansprakelijkheid van Medtronic Neurosurgery wegens inbreuk op de hierboven vermelde
garantie bestaat - naar de uitsluitende keus van Medtronic Neurosurgery - uit het vervangen van het product of het crediteren van de koper voor het netto,
feitelijk voor het product betaalde bedrag, op voorwaarde dat (i) Medtronic Neurosurgery schriftelijk in kennis wordt gesteld, binnen negentig (90) dagen na
ontvangst van het product door de koper, dat dit product niet conform was; de kennisgeving moet een gedetailleerde uitleg in het Engels omvatten van de
beweerde non-conformiteit; (ii) het product, binnen negentig (90) dagen na ontvangst door koper van het product, F.O.B. wordt teruggestuurd naar Medtronic
Neurosurgery, 125 Cremona Drive, Goleta, California 93117, Verenigde Staten of zoals aangewezen door Medtronic Neurosurgery; en (iii) Medtronic Neurosurgery
er redelijkerwijs van overtuigd is dat deze non-conformiteit werkelijk bestaat. Behalve zoals uitdrukkelijk in deze paragraaf voorzien, beschikt de koper niet over
het recht om producten naar Medtronic Neurosurgery terug te sturen zonder voorafgaande schriftelijke toestemming van Medtronic Neurosurgery.
C. Uitsluiting van andere garanties. BUITEN DE HIERBOVEN IN (A) BESCHREVEN GARANTIE BIEDT MEDTRONIC NEUROSURGERY GEEN
ENKELE ANDERE GARANTIE, HETZIJ UITDRUKKELIJK OF STILZWIJGEND, EN DE FABRIKANT WIJST IN HET BIJZONDER DE STILZWIJGENDE
GARANTIES EN CONDITIES VAN VERKOOPBAARHEID EN GESCHIKTHEID VOOR EEN BEPAALD DOEL AF. MEDTRONIC NEUROSURGERY NEEMT
GEEN ENKELE ANDERE AANSPRAKELIJKHEID OP ZICH EN GEEFT EVENMIN AAN ANDEREN TOESTEMMING OM ANDERE AANSPRAKELIJKHEDEN,
VOORTVLOEIENDE UIT OF IN VERBAND MET DE VERKOOP OF HET GEBRUIK VAN EEN PRODUCT, OP ZICH TE NEMEN.
4
Polypropyleen hendel
Roestvrijstalen schacht
Katheterverbinding (vergrendelende tip)
Polypropyleen
obturatortip
Connecteurs de cathéter
Description
ais
ç
Connecteur de cathéter droit
Le connecteur de cathéter droit (Fig. 1) est un connecteur en nylon destiné à être utilisé avec les produits de
Fran
cathéter intracardiaque-péritonéal, cathéter intracardiaque et cathéter péritonéal Medtronic Neurosurgery
PS Medical.
Connecteur de cathéter à angle droit
Le connecteur de cathéter à angle droit (Fig. 2) est un connecteur en nylon destiné à être utilisé avec les
cathéters ventriculaires Medtronic Neurosurgery PS Medical.
Connecteur de cathéter à trois voies
Le connecteur de cathéter à trois voies (Fig. 3), est un connecteur fabriqué à partir de polypropylène et
d’élastomère de silicone, destiné à relier deux cathéters ventriculaires PS Medical à un connecteur d’admission à
valve de contrôle de flux de LCR Medtronic Neurosurgery PS Medical.
1
2
Indications
Connecteur de cathéter, droit
L’usage du connecteur de cathéter droit est indiqué en cas de révision d’un cathéter distal.
Connecteur de cathéter à angle droit
L’usage du connecteur de cathéter à angle droit est indiqué pour couder le cathéter ventriculaire à un angle de
90˚ (nominal) à son point de sortie du trou percé au trépan ou à la perceuse hélicoïdale.
Connecteur de cathéter à trois voies
L’usage du connecteur de cathéter à trois voies est indiqué lorsqu’on vise à relier deux cathéters ventriculaires PS
Medical à une valve de contrôle de flux de LCR PS Medical.
Mode d’emploi
Il incombe au chirurgien de choisir la technique chirurgicale se rapportant à l’usage des connecteurs de cathéter.
3
Introducteurs de cathéter sous-cutané jetables
Description
Les introducteurs de cathéter sous-cutané jetables sont des instruments chirurgicaux à usage unique. Ils sont constitués de trois composants :
1. Une tige tubulaire (de 60 ou 38 cm de long) ;
2. Une poignée en T; et
3. Un obturateur à embout fuselé.
Ces instruments se présentent sous forme de dispositifs de
tunnellisation sous-cutanée malléables servant à introduire les
cathéters de dérivation de LCR. La longueur du modèle de 60 cm
est appropriée à la plupart des procédures de dérivation ventriculopéritonéales. La longueur du modèle de 38 cm est appropriée aux
procédures de dérivation ventriculo-péritonéales chez les patients
de petit gabarit ainsi que pour les rachipéritonéostomies
Indications
Les introducteurs de cathéter sous-cutané jetables servent à établir
un tunnel sous-cutané et/ou à positionner une tige tubulaire
avant la mise en place d’un composant de cathéter péritonéal
d’un système de dérivation du liquide céphalo-rachidien. On peut
également employer le modèle de 38 cm pour la mise en place d’un
composant de cathéter péritonéal d’un système de cathéter lombopéritonéal Medtronic Neurosurgery PS Medical.
Mode d’emploi
Il incombe au chirurgien de choisir la technique chirurgicale se rapportant à l’usage des introducteurs de cathéter sous-cutané jetables. Celui-ci doit
toutefois s’assurer que le cathéter peut passer à travers l’instrument avant de commencer l’intervention.
La tige tubulaire est malléable et peut être manuellement façonnée selon les indications de la méthode opératoire. Lorsque l’instrument est introduit
de manière sous-cutanée, il faut insérer l’obturateur dans la tige tubulaire et le fixer à la poignée en enclenchant l’embout de l’obturateur en position de
verrouillage. Suite au retrait de l’obturateur, on peut enfoncer le cathéter à la main par la lumière de la tige tubulaire.
L’obturateur comprend également un site de fixation de cathéter servant au raccordement d’un cathéter distal à extrémité ouverte. La fixation du cathéter à
l’obturateur permet de tirer les cathéters de D.I. approprié par la tige de l’introducteur.
Présentation
Les connecteurs de cathéter et les introducteurs de cathéter sous-cutané jetables Medtronic Neurosurgery PS Medical sont livrés sous emballage STÉRILE
et APYROGÈNE, et sont exclusivement destinés à un usage unique. NE PAS RESTÉRILISER. Ne pas utiliser si l’emballage a été ouvert ou endommagé.
La restérilisation pourrait endommager le produit, entraînant d’éventuelles lésions pour le patient. Medtronic Neurosurgery n’est pas responsable des
performances de tout produit ayant été restérilisé.
Produits de commande spéciale
Si ce mode d’emploi accompagne un produit de commande spéciale, les caractéristiques physiques du produit fourni peuvent différer de celles décrites
dans cette notice. Ces différences n’affectent pas la sécurité d’emploi, ni l’efficacité du produit concerné. Les produits de commande spéciale peuvent être
fournis stériles ou non stériles, comme indiqué sur l’étiquette apposée sur l’emballage du produit. Les produits non stériles doivent être nettoyés et
stérilisés avant usage.
Contre-indications
L’implantation d’un système de dérivation de LCR dans l’oreillette droite, dans la cavité péritonéale ou un autre organe est contre-indiquée en présence d’une
infection dans l’une des régions où les divers composants du système de dérivation seront implantés. Ces infections comprennent celle du cuir chevelu et
d’autres zones cutanées que traverse le système de dérivation, notamment, les méninges, les ventricules cérébraux, le péritoine, les organes intrapéritonéaux
et rétropéritonéaux, la plèvre et le courant sanguin. En fait, la dérivation du LCR est contre-indiquée en présence de toute infection corporelle. En outre, la
dérivation dans l’oreillette de patients souffrant de cardiopathie congénitale ou d’autres anomalies cardio-pulmonaires graves est contre-indiquée.
Informations aux Patients
Il incombe au médecin d’informer le patient et/ou son (ses) représentant(s) en ce qui concerne la dérivation du LCR. Ces informations doivent comprendre
une description des complications liées aux systèmes de dérivation implantables et une explication des éventuels produits ou traitements alternatifs.
Avertissements et mises en garde
Il convient de choisir le produit, la taille, la pression et la plage de performance convenant aux besoins spécifiques du patient, déterminés par essais
diagnostiques et par expérience médicale. L’étiquette du produit précise les niveaux de performance ou l’étendue des applications qu’on peut en attendre.
Un façonnage manuel excessif de l’introducteur de cathéter sous-cutané à usage unique risque d’affaiblir la tige et d’entraîner la rupture du dispositif durant usage.
Des bords tranchants provenant d’une modification ou de l’endommagement de l’introducteur de cathéter sous-cutané jetable risquent d’endommager les
cathéters introduits par l’instrument.
Eviter tout contact entre les produits implantables et des peluches, talc des gants, résidus huileux de la peau, savons à bases d’huile, détergents
synthétiques ou tout autre contaminant de surface.
La manipulation ou l’usage incorrect d’instruments lors de l’implantation de ces produits peut entraîner une coupure, une entaille, l’écrasement ou la
rupture accidentel d’un composant. Un tel dommage peut mener à la perte d’intégrité du système de dérivation et nécessiter une reprise chirurgicale du
système d’implant.
Il faut veiller à ne pas introduire de matières particulaires contaminantes dans les composants du système de dérivation durant l’implantation, les essais ou
la manipulation. L’introduction de contaminants pourrait compromettre le fonctionnement du système de dérivation (drainage excessif ou insuffisant). Les
matières particulaires qui pénètrent dans le système de dérivation risquent également de maintenir ouverts les mécanismes de contrôle de la pression et
du flux, provoquant un drainage excessif.
Lors du raccord des cathéters ventriculaire et distal aux connecteurs, les ligatures encerclantes doivent être fixées solidement, sans toutefois trop serrer, sous
peine de sectionner la tubulure en silicone.
On doit faire très attention lors de l’acheminement des cathéters afin d’éviter toute coudure et abrasion sur leur parcours. Le bord du trou percé par la
perceuse hélicoïdale ou par la fraise peut être taillé de manière à disposer d’une encoche biseautée permettant au cathéter ventriculaire d’émerger et de se
courber pour reposer près du crâne.
Les patients qui ont reçu un système de dérivation pour hydrocéphalie doivent être maintenus sous étroite surveillance durant la période postopératoire
afin de détecter tout signe ou symptôme suggérant un mauvais fonctionnement de la dérivation. Des observations cliniques peuvent indiquer une
infection, une obstruction du système ou un drainage de LCR excessif.
Une obstruction de la dérivation peut survenir dans n’importe quel composant du système. Le cathéter ventriculaire peut s’occlure en raison de matières
particulaires telles que des caillots sanguins ou des fragments cérébraux, du logement de l’embout d’un cathéter ventriculaire dans le plexus choroïde, de
l’encastrement du cathéter dans les tissus cérébraux ou de la coaptation des parois ventriculaires en présence d’un drainage excessif (« ventricules fendus »).
La formation de caillots sanguins autour de la partie auriculaire du cathéter risque de mener à l’embolisation de l’arbre des artères pulmonaires et
d’engendrer un coeur pulmonaire et une hypertension artérielle pulmonaire.
Des composants de dérivation débranchés peuvent migrer dans le coeur ou dans la cavité péritonéale.
La défaillance d’un système de dérivation peut être causée par une défectuosité mécanique, menant à un drainage excessif ou insuffisant.
Un mauvais fonctionnement ou une obstruction du système de dérivation peut mener à des signes et des symptômes de pression intracrânienne accrue si
l’on ne compense pas l’hydrocéphalie. Chez le nourrisson, des signes courants sont l’augmentation de la pression de la fontanelle antérieure, la congestion
des veines du cuir chevelu, l’apragmatisme, la somnolence et l’irritabilité, des vomissements et une nuque rigide. Chez les enfants plus âgés et les adultes,
les symptômes courants sont des maux de tête, vomissements, troubles visuels, perte de mémoire, rigidité de la nuque, détérioration de la conscience ainsi
que diverses observations neurologiques anormales.
Un drainage excessif de LCR peut favoriser le développement d’un hygroma ou d’un hématome sous-dural ou le collapsus des parois ventriculaires latérales,
provoquant ainsi l’obstruction du cathéter ventriculaire.
Si le cathéter devient solidaire du plexus choroïde ou des tissus cérébraux adjacents par l’intermédiaire d’adhérences fibreuses, il est recommandé de ne pas
retirer le cathéter de force. Une rotation délicate du cathéter peut aider à le libérer. Il est conseillé de laisser le cathéter en place plutôt que de risquer une
hémorragie intraventriculaire éventuellement causée par un retrait forcé.
Complications possibles
Les complications directement associées à l’usage de l’introducteur de cathéter sous-cutané jetable comprennent des difficultés d’introduction de
l’instrument à travers des tissus cicatriciels et la formation possible d’hématomes.
Les complications liées aux systèmes de dérivation ventriculo-auriculaire et ventriculo-péritonéale de LCR peuvent ressembler à celles liées à toute
intervention chirurgicale pratiquée sous anesthésie locale et/ou générale. Ces complications comprennent
les réactions aux médicaments et aux agents anesthésiques, un déséquilibre des électrolytes et une perte excessive de sang,
notamment chez les nouveau-nés. En de rares occasions, le patient peut présenter une réaction en raison d’une sensibilisation
à l’implant.
Lors de toutes les interventions de dérivation de LCR, les complications les plus courantes proviennent de l’obstruction du système ainsi qu’il a été décrit
dans la rubrique « Mises en garde et précautions » de la notice de ce produit. Une obstruction peut survenir dans n’importe lequel des composants du
système en raison d’un bouchage provoqué par des fragments de cerveau, des caillots sanguins et/ou par des agrégats de cellules tumorales à un point
quelconque le long de sa trajectoire. L’obstruction peut également survenir suite à la déconnexion des composants du système ou suite à l’entortillement
du cathéter. Cette obstruction peut favoriser la migration du cathéter ventriculaire dans le ventricule latéral et celle du cathéter distal dans le coeur et
l’arbre des artères pulmonaires, le péritoine ou une autre structure dans laquelle le cathéter est implanté. La croissance du nouveau-né ou de l’enfant peut
provoquer le retrait d’un cathéter distal de l’oreillette et son déplacement dans la veine jugulaire interne ou le retrait du péritoine et son déplacement dans
des plans de tissus où le liquide ne peut pas être absorbé.
Il existe d’autres sérieuses complications possibles. Les infections locales et généralisées sont courantes à la suite de n’importe quelle intervention de
dérivation. Elles sont généralement causées par des organismes qui habitent la peau, notamment le staphylocoque de l’épiderme. Toutefois, d’autres agents
pathogènes qui circulent dans le courant sanguin peuvent coloniser le système, ce qui chez la plupart des patients nécessite le retrait de l’implant.
En 1973, Robertson et autres ont résumé l’incidence d’infections dans les dérivations ventriculo-auriculaire et ventriculo-péritonéale ayant fait l’objet de
comptes rendus jusqu’à cette époque. La fréquence d’infection dans les dérivations ventriculo-auriculaires variait entre 7 et 31 %. Au cours d’une dérivation
ventriculopéritonéale, une infection survient dans 5 à 10 % des cas selon la plupart des rapports. Etant donné que la dérivation ventriculo-auriculaire
favorise la dissémination des bactéries à d’autres organes, la dérivation ventriculo-péritonéale est considérée impliquer moins de risques.
En 1993, Kestle et autres observèrent une réduction considérable des cas d’infections (moins de 4 %) grâce à l’usage d’antibiotiques, à une intervention
chirurgicale de courte durée (l’expérience chirurgicale) et au contrôle de l’environnement de la salle d’opération (c’est à dire, une salle destinée uniquement
aux opérations, un personnel et un trafic limités, les surfaces épidermiques couvertes). L’article annonce que l’on peut également obtenir des résultats sans
utiliser d’antibiotiques, mais en prenant des précautions rigoureuses pour contrôler l’environnement périopératoire.
L’utilisation prophylactique d’antibiotiques chez des patients ayant une dérivation est quelque peu controversée car leur utilisation peut prédisposer à des infections
par des organismes plus résistants. Pour cette raison, la décision de faire un usage prophylactique d’antibiotiques relève du médecin traitant et/ou du chirurgien.
Une dérivation dans le péritoine peut échouer en raison du placement du cathéter dans les anses de l’intestin ou dans le grand épiploon. Des incidences de
perforations de l’intestin causées par un cathéter péritonéal et se développant consécutivement en péritonite ont été notées.
Un drainage excessif du LCR peut entraîner une baisse importante de la pression du LCR. Il peut alors s’ensuivre la formation d’un hématome sousdural
ou bursite et un rétrécissement excessif du ventricule provoquant une obstruction en raison de l’empiétement des parois ventriculaires sur les orifices
d’admission du cathéter. Chez le nouveau-né, cette réduction de pression excessive peut provoquer une dépression marquée de la fontanelle antérieure, un
surplombement des os du crâne et peut conduire à une hydrocéphalie obstructive.
Des incidents épileptiques ont été documentés à la suite de procédures de dérivation. Cette même étude indiqua également que la fréquence de crises
épileptiques s’accroît en proportion de la multiplicité de révisions d’implant de cathéter chez un patient.
Modalités de renvoi des marchandises
Les produits doivent être renvoyés dans leurs emballages non ouverts, avec les sceaux du fabricant intacts, pour être acceptés pour remplacement ou crédit,
à moins qu’ils ne soient renvoyés en raison d’une plainte de défectuosité de produit ou d’un mauvais étiquetage. La détermination d’une défectuosité de
produit ou d’un étiquetage erroné sera faite par Medtronic Neurosurgery, et cette détermination sera définitive. Les produits ne seront pas acceptés pour
remplacement ou crédit s’ils ont été en la possession du client depuis plus de 90 jours.
Garantie
A. Garantie limitée standard. Medtronic Neurosurgery garantit à l’utilisateur final initial (« Acheteur ») que le produit implantable à usage unique
ci-joint (« Produit »), acheté par l’Acheteur, au moment de la livraison du produit, sera entièrement exempt de tout vice de matériel et défaut de fabrication.
Medtronic Neurosurgery n’offre pas de garantie (expresse, implicite ou légale) pour des Produits modifiés (sauf dispositions expresses appliquées
conformément à la présente) ou soumis à une contrainte physique anormale, emploi impropre, fonctionnement inadéquat, acte de négligence, essais non
conformes, utilisation en combinaison avec des produits ou composants autres que ceux pour lesquels les Produits ont été conçus, ou encore utilisation
quelconque ou toute procédure médicale auxquels les produits ne sont pas destinés.
B. Recours. Le recours exclusif de l’Acheteur et la seule responsabilité de Medtronic Neurosurgery en cas de rupture de la garantie précitée, dépend du
choix et de la décision de Medtronic Neurosurgery de remplacer le Produit ou de créditer l’Acheteur du montant net effectivement payé pour ledit Produit,
pour autant que (i) Medtronic Neurosurgery ait été notifié par écrit, dans les quatre-vingt dix (90) jours après réception du Produit par l’Acheteur, de la
non-conformité du Produit, accompagné d’une explication détaillée en anglais de toute défectuosité rapportée; (ii) ledit Produit sera renvoyé à Medtronic
Neurosurgery dans les quatre-vingt dix (90) jours après réception du Produit par l’Acheteur, franco de port, au 125 Cremona Drive, Goleta, CA 93117,
États-Unis, sauf indication contraire par Medtronic Neurosurgery; et (iii) Medtronic Neurosurgery soit raisonnablement satisfaite du bien-fondé des nonconformités rapportées. Sauf dispositions expresses énoncées dans ce paragraphe, l’Acheteur n’est pas autorisé à renvoyer les Produits chez Medtronic
Neurosurgery sans le consentement préalable écrit de Medtronic Neurosurgery.
C. Refus d’autres garanties. À L’EXCEPTION DE LA GARANTIE STIPULÉE CI-DESSUS (A), MEDTRONIC NEUROSURGERY N’ACCORDE AUCUNE AUTRE
GARANTIE OU CONDITION, EXPLICITE OU IMPLICITE, ET LE FABRICANT RÉFUTE SPÉCIFIQUEMENT LES GARANTIES ET CONDITIONS IMPLICITES DE
COMMERCIALISATION ET D’APTITUDE À UN USAGE PARTICULIER. MEDTRONIC NEUROSURGERY N’ASSUME NI N’AUTORISE AUCUNE AUTRE PERSONNE À
ASSUMER TOUTE AUTRE RESPONSABILITÉ PROVENANT DE LA VENTE OU DE L’UTILISATION DE TOUT PRODUIT, OU EN RAPPORT AVEC CES ACTIVITÉS.
4
Poignée en polypropylène
Tige en acier inoxydable
Raccord de cathéter (à
embout verrouillé)
Embout d’obturateur en
polypropylène
Katheteranschlüsse
Beschreibung
Katheteranschluss, gerade
Deutsch
Der gerade Katheteranschluss (Abb. 1) ist ein aus Nylon gefertigtes Verbindungsstück, das für den Gebrauch in
Kombination mit Medtronic Neurosurgery PS Medical Herz-Peritonealkathetern, mit Medtronic Neurosurgery
PS Medical Herzkathetern und mit Medtronic Neurosurgery PS Medical Peritonealkathetern vorgesehen ist.
Katheteranschluss, rechtwinklig
Der rechtwinklige Katheteranschluss (Abb. 2) ist ein aus Nylon gefertigtes Verbindungsstück, das für den
Gebrauch in Kombination mit Medtronic Neurosurgery PS Medical Ventrikelkathetern vorgesehen ist.
3-Wege-Katheteranschluss
Der 3-Wege-Katheteranschluss (Abb. 3) ist ein aus Polypropylen und Silikonelastomer gefertigtes
Verbindungsstück, das dazu dient, zwei PS Medical Ventrikelkatheter mit einem Medtronic Neurosurgery PS
Medical CSF-Flußkontrolleinlassventil zu verbinden.
1
2
Indikationen
Katheteranschluss, gerade
Der Gebrauch des geraden Katheteranschlusses ist indiziert, wenn eine Distalkatheterrevision erforderlich ist.
Katheteranschluss, rechtwinklig
Der rechtwinklige Katheteranschluss dient dazu, den Ventrikelkatheter an der Austrittsstelle aus dem Bohrloch
bzw. der Spiralbohrstelle um 90˚ (nominal) abzuwinkeln.
3-Wege-Katheteranschluss
Der Gebrauch des 3-Wege-Katheteranschlusses ist indiziert, wenn zwei PS Medical Ventrikelkatheter mit einem
PS Medical CSF-Flußkontrollventil verbunden werden sollen.
Gebrauchsanweisung
Die OP-Technik bei der Verwendung von Katheteranschlüssen liegt
im Ermessen des Chirurgen.
Subkutane Katheterpassierer für den
3
Polypropylenhåndtak
Edelstahlschaft
Einmalgebrauch
Beschreibung
Die subkutanen Katheterpassierer für den Einmalgebrauch
sind chirurgische Einweginstrumente. Sie bestehen aus drei
Komponenten:
1. Einem röhrenförmigen Schaft (60 cm oder 38 cm lang),
2. Einem T-förmigen Griff und
3. Einem Obturator mit abgerundeter Spitze.
Die Instrumente wurden als verformbare subkutane Tunnelierungsinstrumente für die Passage von CSF-Shuntkathetern konzipiert. Die Länge der 60-cmAusführung ist für die meisten ventrikuloperitonealen Shuntverfahren geeignet. Die 38-cm-Ausführung hat die passende Länge für ventrikuloperitoneale
Shuntverfahren bei kleinen Patienten und für lumboperitoneale Shuntverfahren.
Indikationen
Die subkutanen Katheterpassierer für den Einmalgebrauch werden zur Herstellung eines subkutanen Tunnels und/oder zur Positionierung eines
röhrenförmigen Schafts verwendet, welcher für die Platzierung der Peritonealkatheterkomponente eines CSF-Shunts benutzt wird. Die 38-cm-Ausführung
kann auch für die Platzierung der Lumboperitonealkatheterkomponente des Medtronic Neurosurgery PS Medical Lumboperitonealkathetersystems
verwendet werden.
Gebrauchsanweisung
Die Wahl der Operationstechnik beim Gebrauch des subkutanen Katheterpassierers für den Einmalgebrauch ist dem Chirurgen überlassen. Es wird dem
Chirurgen empfohlen, vor Beginn des Verfahrens sicherzustellen, dass der Katheter durch das Instrument passieren kann.
Der röhrenförmige Schaft ist verformbar und kann vom Chirurgen entsprechend der Indikation für das chirurgische Verfahren manuell geformt werden.
Wenn das Instrument subkutan passiert wird, muss der Obturator in den röhrenförmigen Schaft eingeführt und durch Einrasten der Verschlussspitze im
Griff gesichert werden. Nach Entfernen des Obturators kann der Katheter manuell durch das Lumen des röhrenförmigen Schafts geschoben werden.
Am Obturator befindet sich eine Befestigungsmöglichkeit für einen Distalkatheter mit offenem Ende. Die Befestigung des Katheters am Obturator
ermöglicht, dass Katheter mit entsprechendem Innendurchmesser durch den Passiererschaft gezogen werden können.
Lieferart
Medtronic Neurosurgery PS Medical Katheteranschlüsse und subkutane Katheterpassierer für den Einmalgebrauch sind STERIL und NICHT-PYROGEN
verpackt und sind nur für den einmaligen Gebrauch bestimmt. NICHT RESTERILISIEREN! Das Produkt nicht verwenden, wenn die Packung bereits
geöffnet wurde oder beschädigt ist. Eine Resterilisation kann das Produkt beschädigen und möglicherweise zu einer Verletzung des Patienten führen.
Medtronic Neurosurgery ist nicht für die Leistung resterilisierter Produkte verantwortlich.
Spezialanfertigungen
Falls diese Gebrauchsanweisung einer Spezialanfertigung beiliegt, können unter Umständen die äußeren Merkmale des mitgelieferten Produktes von
der Produktbeschreibung in dieser Packungsbeilage abweichen. Diese Unterschiede haben keinen Einfluss auf die Sicherheit oder Wirksamkeit der
Spezialanfertigung. Spezialanfertigungen können wie auf dem Produktverpackungsetikett gekennzeichnet steril oder unsteril geliefert werden. Unsterile
Produkte müssen vor Gebrauch gereinigt und sterilisiert werden.
Kontraindikationen
Der Shunt von CSF in den rechten Herzvorhof, die Peritonealhöhle oder andere Körperbereiche sollte nicht durchgeführt werden, wenn an irgendeiner
Stelle, an der die verschiedenen Komponenten des Shuntsystems zu implantieren sind, eine Infektion vorhanden ist. Dies gilt auch für Infektionen der
Kopfhaut und anderer Hautregionen, durch die das Shuntsystem geführt wird, sowie für die Meningen und die Hirnventrikel, für das Peritoneum, für
intra- und retroperitoneale Organe, Pleura und Blutkreislauf. Im Allgemeinen ist der Shunt von CSF kontraindiziert, wenn in irgendeinem Teil des Körpers
eine Infektion vorliegt. Weiterhin kontraindiziert ist der Shunt in den Vorhof von Patienten mit kongenitalem Herzleiden oder anderen schwerwiegenden
kardiopulmonalen Anomalien.
4
Katheterverbindung
(Verschlussspitze)
Polypropylen-Obturatorspitze
Aufklärung des Patienten
Der Arzt ist dafür verantwortlich, dass der Patient und/oder sein(e) Stellvertreter in Hinsicht auf den CSF-Shunt aufgeklärt werden. Dazu gehören
eine Beschreibung der mit implantierbaren Shuntsystemen verbundenen Komplikationen und eine Erklärung möglicher alternativer Produkte und
Behandlungsmethoden.
Warnhinweise und Vorsichtsmaßnahmen
Das geeignete Produkt sowie Größe, Druck und Leistungsbereich müssen aufgrund der Diagnose und der Erfahrung des Arztes den Anforderungen des
jeweiligen Patienten entsprechend ausgesucht werden. Die zutreffenden Leistungsstufen oder -bereiche des Produkts sind auf dem Produktetikett angegeben.
Wiederholtes manuelles Verformen des subkutanen Katheterpassierers für den Einmalgebrauch kann den Schaft schwächen und während des Gebrauchs
zum Bruch des Instruments führen.
Scharfe Kanten, die durch Modifikation oder Beschädigung des subkutanen Katheterpassierers für den Einmalgebrauch verursacht wurden, können die
Katheter, welche durch das Instrument passiert werden, beschädigen.
Kontakt der implantierbaren Produkte mit Flusen, Handschuhtalk, Hautfettrückständen, Fettseifen, synthetischen Reinigungsmitteln und anderen
Oberflächenverunreinigungen ist zu vermeiden.
Unsachgemäßer Umgang oder Gebrauch der Instrumente bei der Implantation der Shuntprodukte können dazu führen, dass Komponenten angeschnitten,
aufgeschlitzt, zerquetscht oder zerbrochen werden. Eine solche Beschädigung kann zum Verlust der Shuntintegrität führen und eine verfrühte chirurgische
Revision des Shuntsystems erforderlich machen.
Es ist besonders darauf zu achten, dass während der Präimplantation oder Handhabung keine Schadstoffpartikel in die Shuntbestandteile gelangen. Das
Eindringen von Verunreinigungen könnte zu einer Beeinträchtigung der Leistung des Shuntsystems führen (übermäßige oder mangelhafte Drainage).
Schadstoffpartikel im Shuntsystem können auch die Druck-/Fluss-Kontrollmechanismen offen halten, was zu übermäßiger Drainage führt.
Beim Befestigen der Ventrikelkatheter und der distalen Katheter an den Ventilanschlüssen sollten die Ligaturen, die den Schlauch umschließen, sicher, aber
nicht zu fest angezogen werden, da sie sonst den Silikonschlauch durchtrennen könnten.
Beim Katheterlegen ist Vorsicht geboten, um Abknicken und unnötige Abrasion im Katheterverlauf zu vermeiden. Der Rand des Bohr- oder
Gewindebohrlochs kann gekürzt werden, damit dort, wo der Ventrikelkatheter austritt und sich am Schädel anschmiegt, eine abgeschrägte Kerbe entsteht.
Patienten mit Hydrozephalus-Shuntsystemen müssen während der postoperativen Phase unter ständiger Beobachtung bleiben, um Anzeichen und
Symptome für eine Shunt-Fehlfunktion feststellen zu können. Die klinischen Befunde können eine Infektion, Shuntobstruktion oder übermäßige CSFDrainage anzeigen.
Eine Shuntobstruktion kann in jedem Teil des Shuntsystems auftreten. Der Ventrikelkatheter kann durch Partikel wie Blutgerinnsel oder Hirnfragmente,
durch Einführung der Katheterspitze in den Plexus choroideus, durch Einbettung des Katheters im Hirngewebe oder durch Koaptation der Ventrikelwände
bei ÜberDrainage („Schlitzventrikel“) blockiert werden.
Koagulation im Bereich des atrialen Katheteranteils kann zur Embolisation des Pulmonalarteriensystems und damit zu Cor pulmonale und zu pulmonalem
Hochdruck führen.
Abgetrennte Shunt-Komponenten könnten weiter ins Herz oder in die Peritonealhöhle abwandern.
Shuntsysteme können aufgrund einer mechanischen Fehlfunktion versagen und übermäßige oder mangelhafte Drainage zur Folge haben.
Eine Fehlfunktion oder Obstruktion des Shuntsystems kann zu Anzeichen und Symptomen von zunehmendem intrakraniellem Druck führen, wenn
der Hydrozephalus nicht kompensiert wird. Beim Kleinkind sind die allgemeinen Befunde erhöhter Druck der anterioren Fontanelle, Stauung der
Kopfhautvenen, Teilnahmslosigkeit, Schläfrigkeit und Reizbarkeit, Erbrechen und nuchale Rigidität. Ältere Kinder und Erwachsene entwickeln die mit
erhöhtem intrakraniellen Druck verbundenen Anzeichen und Symptome wie Kopfschmerzen, Erbrechen, Schleiersehen, nuchale Rigidität, Verschlechterung
der Vigilanz und verschiedene neurologische Befunde.
Übermäßige CSF-Drainage kann zur Entwicklung von subduralen Blutergüssen, von Hygromen oder zum Kollaps der seitlichen Ventrikelwände und somit
zur Obstruktion des Ventrikelkatheters führen.
Sollte der Ventrikelkatheter durch fibröses Gewebe mit dem Plexus choroideus oder mit angrenzendem Hirngewebe verwachsen, wird empfohlen, ihn nicht
mit Gewalt zu entfernen. Vorsichtige Drehung des Katheters kann dazu beitragen, ihn zu lösen. Es empfiehlt sich, den Katheter lieber an Ort und Stelle zu
belassen, anstatt eine intraventrikuläre Hämorrhagie zu riskieren, welche durch gewaltsame Entfernung entstehen kann.
Komplikationen
Komplikationen, die unmittelbar mit dem Gebrauch des subkutanen Katheterpassierers für den Einmalgebrauch zusammenhängen, umfassen
Schwierigkeiten bei der Passage des Instruments durch vernarbte Bereiche sowie die Möglichkeit der Hämatombildung.
Komplikationen im Zusammenhang mit ventrikuloatrialen und ventrikuloperitonealen CSF-Shuntsystemen ähneln möglicherweise denen, die auch
bei anderen operativen Verfahren unter Lokalanästhesie und/oder Vollnarkose auftreten können. Dazu gehören Reaktionen auf Medikamente oder
Anästhetika, Störungen des Elektrolytgleichgewichts und hoher Blutverlust, besonders bei Kleinkindern. In seltenen Fällen kann beim Patienten eine
Überempfindlichkeitsreaktion gegenüber dem Implantat auftreten.
Bei CSF-Shuntverfahren sind die am häufigsten auftretenden Komplikationen auf eine Obstruktion des Systems zurückzuführen, wie diese im
Abschnitt „Warnhinweise und Vorsichtsmaßnahmen“ beschrieben sind. Eine Obstruktion kann bei allen Systemkomponenten durch Verstopfung mit
Hirngewebsfragmenten, Blutgerinnseln und/oder Tumorzellanhäufungen an irgendeiner Stelle auftreten. Weiterhin kann es durch die Trennung der
Systemkomponenten sowie durch Abknicken und Aufwicklung des Katheters zu Obstruktionen kommen. Dies kann die Migration des Ventrikelkatheters in
den lateralen Ventrikel und des distalen Katheters in das Herz und das Pulmonalarteriensystem, die Peritonealhöhle oder andere Körperteile, in welche der
Katheter implantiert ist, verursachen. Beim Kleinkind und Kind kann, wie bereits erwähnt, das Körperwachstum dazu führen, dass sich der Distalkatheter
vom Atrium in die Vena jugularis interna oder vom Peritoneum in Gewebeflächen, in denen die Flüssigkeit nicht absorbiert werden kann, verlagert.
Es gibt noch andere eventuell schwerwiegende Komplikationen. Lokale und systemische Infektionen sind bei Shuntverfahren nicht selten. Sie sind meist
auf in der Haut befindliche Organismen zurückzuführen, besonders Staphylococcus epidermidis. Auch andere Krankheitserreger, die sich im Blutkreislauf
befinden, können sich im Shunt ansiedeln und bei der Mehrzahl der Patienten die Entfernung des Shunts erforderlich machen.
Robertson et al. haben 1973 die Inzidenz von Infektionen bei ventrikuloatrialen und ventrikuloperitonealen Shunts bis zum Zeitpunkt der Veröffentlichung
zusammengefasst. Die Inzidenz von Infektionen bei ventrikuloatrialen Shunts variierte zwischen 7% und 31%. Infektionen in ventrikuloperitonealen
Shunts traten bei 5 bis 10% der Patienten in den meisten Berichten auf. Da ventrikuloatriale Shunts die Verbreitung von Bakterien zu anderen Organen
begünstigen, werden ventrikuloperitoneale Shunts als weniger zerstörerisch angesehen.
Im Jahre 1993 berichteten Kestle et al. über eine signifikante Infektionsreduktion (weniger als 4% Infektionen) durch den Einsatz von Antibiotika, kurze
Operationsdauer (Erfahrung des Chirurgen) und kontrollierte Umgebung im Operationssaal (z. B. abgeschlossener Operationssaal, wenig Personal und
beschränkter Verkehr, bedeckte Hautoberflächen). In diesem Artikel wird berichtet, dass auch ohne Antibiotika gute Resultate durch rigorose perioperative
Kontrolle der Umgebung erzielt werden.
Der Gebrauch prophylaktischer Antibiotika bei Shunt-Patienten ist etwas umstritten, weil er zu Infektionen durch widerstandsfähigere Organismen führen
kann. Daher bleibt die Entscheidung über die Antibiotikaprophylaxe dem behandelnden Arzt und/oder Chirurgen überlassen.
Shunts in die Peritonealhöhle könnten wegen der Einbettung des Katheters in die Darmschlingen oder in das Omentum majus versagen. Perforation des
Darms durch einen Peritonealkatheter mit nachfolgender Peritonitis wurde beschrieben.
Die Überdränage von CSF kann eine übermäßige Senkung des CSF-Drucks verursachen und zur Entwicklung eines subduralen Hämatoms oder Hygroms
sowie zu übermäßiger Schrumpfung des Ventrikels mit nachfolgender Obstruktion durch Kollaps der Ventrikelwände auf die Einlasslöcher des Katheters
führen. Beim Kleinkind verursacht diese übermäßige Drucksenkung einen sichtbaren Einfall der vorderen Fontanelle sowie Kraniostenose. Außerdem kann
durch sie ein kommunizierender Hydrozephalus zu einem obstruierenden Hydrozephalus werden.
In gewissen Fällen wurde das Auftreten von Epilepsie nach ventrikulären Shuntverfahren festgestellt. In dieser Studie hat sich auch erwiesen, dass das
Auftreten von Anfällen mit mehrfachen Katheterrevisionen zunahm.
Warenrücksendungen
Produkte müssen in ungeöffneten Verpackungen mit intakten Herstellerverschlüssen zurückgeschickt werden, damit sie für den Ersatz oder zur
Gutschrift angenommen werden, es sei denn, das Produkt wird aufgrund einer Beschwerde bezüglich eines Produktfehlers oder einer Falschetikettierung
zurückgeschickt. Medtronic Neurosurgery bestimmt, ob ein Produkt defekt oder falsch etikettiert ist. Diese Feststellung ist endgültig. Produkte, die sich
länger als 90 Tage im Besitz des Kunden befinden, können weder für den Umtausch noch gegen Gutschrift angenommen werden.
Garantie
A. Standardmäßige Garantiebeschränkung. Medtronic Neurosurgery garantiert dem ursprünglichen Endbenutzer-Käufer („Käufer“), dass das
beiliegende Produkt („Produkt“) für den Einmalgebrauch zum Zeitpunkt der Auslieferung frei von Verarbeitungs- und Materialfehlern ist. Medtronic
Neurosurgery übernimmt keine Garantie (ausdrücklich, stillschweigend oder gesetzlich) für Produkte, die abgeändert wurden (außer wie hierin
ausdrücklich angegeben) oder ungewöhnlichen physikalischen Belastungen, Missbrauch, unsachgemäßen Tests, Gebrauch in Kombination mit anderen
Produkten oder Komponenten als den für das Produkt indizierten, Gebrauch in einer nicht indizierten Art oder für ein nicht indiziertes medizinisches
Verfahren unterzogen wurden.
B. Ausschließlicher Rechtsbehelf. Es ist der ausschließliche Rechtsbehelf des Käufers und die einzige und ausschließliche Verantwortung von Medtronic
Neurosurgery, dass Medtronic Neurosurgery nach eigenem Gutdünken das Produkt repariert oder ersetzt, oder den Einkaufspreis eines solchen Produktes
dem Konto des Käufers gutschreibt, vorausgesetzt, dass (i) Medtronic Neurosurgery innerhalb von neunzig (90) Tagen nach Empfang des Produktes durch
den Käufer schriftlich über einen Fehler in Kenntnis gesetzt wird und eine detaillierte Erklärung dieses Fehlers in Englisch erhält; dass (ii) dieses Produkt
innerhalb von neunzig (90) Tagen nach Empfang durch den Käufer F.O.B. an Medtronic Neurosurgery, 125 Cremona Drive, Goleta, California 93117, USA,
oder eine andere von Medtronic Neurosurgery angegebene Adresse zurückgeschickt wird und dass (iii) Medtronic Neurosurgery von der Existenz des
angegebenen Fehlers überzeugt ist. Außer wie zuvor ausdrücklich in diesem Abschnitt festgelegt, ist der Käufer nicht berechtigt, Produkte ohne die
vorherige schriftliche Genehmigung von Medtronic Neurosurgery an Medtronic Neurosurgery zurückzuschicken.
C. Ausschluss weiterer Garantieleistungen. AUSSER DER GARANTIEBESCHRÄNKUNG VON ABSCHNITT (A) OBEN MACHT MEDTRONIC NEUROSURGERY
KEINERLEI GARANTIEN ODER BEDINGUNGEN, WEDER AUSDRÜCKLICH NOCH STILLSCHWEIGEND, UND DER HERSTELLER ÜBERNIMMT KEINE GARANTIE
FÜR DIE MARKTEIGNUNG ODER TAUGLICHKEIT FÜR EINEN BESTIMMTEN ZWECK. MEDTRONIC NEUROSURGERY BERECHTIGT KEINE WEITERE PERSON
DAZU, WEITERE HAFTUNG AUFGRUND DES VERKAUFS ODER GEBRAUCHS EINES PRODUKTES ZU ÜBERNEHMEN.
Συνδετικά καθετήρων
Περιγραφή
Ευθύγραμμο συνδετικό καθετήρα
Το ευθύγραμμο συνδετικό καθετήρα (Εικ. 1) είναι ένα συνδετικό από νάιλον, σχεδιασμένο για χρήση με τον καρδιακό/περιτοναϊκό καθετήρα PS Medical®
Ελληνικά
της Medtronic Neurosurgery, τον καρδιακό καθετήρα PS Medical
Neurosurgery.
Συνδετικό καθετήρα ορθής γωνίας
Το συνδετικό καθετήρα ορθής γωνίας (Εικ. 2) είναι ένα συνδετικό από νάιλον, σχεδιασμένο για χρήση με τους
κοιλιακούς καθετήρες PS Medical της Medtronic Neurosurgery.
Τρίοδο συνδετικό καθετήρα
Το τρίοδο συνδετικό καθετήρα (Εικ. 3) είναι ένα συνδετικό από ελαστομερές πολυπροπυλενίου και σιλικόνης
που χρησιμοποιείται για τη σύνδεση δύο κοιλιακών καθετήρων PS Medical σε ένα συνδετικό εισόδου βαλβίδας
ελέγχου ροής ΕΝΥ PS Medical της Medtronic Neurosurgery.
®
της Medtronic Neurosurgery και τον περιτοναϊκό καθετήρα PS Medical® της Medtronic
1
Ενδείξεις
Ευθύγραμμο συνδετικό καθετήρα
Το ευθύγραμμο συνδετικό καθετήρα ενδείκνυται για χρήση όταν απαιτείται αναθεώρηση του περιφερικού
καθετήρα.
Συνδετικό καθετήρα ορθής γωνίας
Το συνδετικό καθετήρα ορθής γωνίας ενδείκνυται για χρήση με σκοπό την κάμψη του κοιλιακού καθετήρα σε
γωνία 90° (ονομαστική), στο σημείο από όπου εξέρχεται μέσω της οπής που δημιουργήθηκε με ελικοειδές
τρύπανο ή φρέζα.
Τρίοδο συνδετικό καθετήρα
Το τρίοδο συνδετικό καθετήρα ενδείκνυται για χρήση όταν δύο κοιλιακοί καθετήρες PS Medical είναι
συνδεδεμένοι σε μία βαλβίδα ελέγχου ροής ΕΝΥ PS Medical.
Οδηγίες χρήσης
Η χειρουργική τεχνική που θα εφαρμοστεί για τη χρήση των συνδετικών των καθετήρων επαφίεται στην κρίση
του χειρουργού.
2
3
Αναλώσιμα υποδόρια εξαρτήματα διέλευσης καθετήρων
Περιγραφή
Τα αναλώσιμα υποδόρια εξαρτήματα διέλευσης καθετήρων είναι χειρουργικά εργαλεία μίας χρήσης. Αποτελούνται από τρία εξαρτήματα:
1. Έναν σωληνοειδή άξονα (μήκους 60 cm ή 38 cm)
2. Μια χειρολαβή σχήματος T και
3. Έναν αποφράκτη με σφαιροειδές άκρο.
Τα εργαλεία είναι σχεδιασμένα ως εύκαμπτες συσκευές
υποδόριας σηραγγοποίησης για τη διέλευση καθετήρων
αναστόμωσης εγκεφαλονωτιαίου υγρού. Το μοντέλο των 60 cm
διαθέτει το κατάλληλο μήκος για τις περισσότερες διαδικασίες
κοιλιοπεριτοναϊκής αναστόμωσης. Το μοντέλο των 38 cm
διαθέτει το κατάλληλο μήκος για διαδικασίες κοιλιοπεριτοναϊκής
αναστόμωσης σε μικρόσωμους ασθενείς και για διαδικασίες
οσφυοπεριτοναϊκής αναστόμωσης.
Ενδείξεις
Τα αναλώσιμα υποδόρια εξαρτήματα διέλευσης καθετήρων
χρησιμοποιούνται για τη δημιουργία μιας υποδόριας σήραγγας
ή/και την τοποθέτηση ενός σωληνοειδούς άξονα που θα
χρησιμοποιηθεί για την τοποθέτηση του περιτοναϊκού καθετήρα, ο οποίος αποτελεί εξάρτημα του συστήματος αναστόμωσης του εγκεφαλονωτιαίου υγρού.
Το μοντέλο των 38 cm μπορεί επίσης να χρησιμοποιηθεί για την τοποθέτηση του οσφυοπεριτοναϊκού καθετήρα, ο οποίος αποτελεί εξάρτημα του συστήματος
οσφυοπεριτοναϊκού καθετήρα PS Medical της Medtronic Neurosurgery.
Οδηγίες χρήσης
Η χειρουργική τεχνική που θα εφαρμοστεί για τη χρήση των αναλώσιμων υποδόριων εξαρτημάτων διέλευσης καθετήρων επαφίεται στην κρίση του
χειρουργού. Πριν από την έναρξη της επέμβασης, ο χειρουργός θα πρέπει να εξασφαλίσει ότι ο καθετήρας θα περάσει μέσα από το εργαλείο.
Ο σωληνοειδής άξονας είναι εύκαμπτος και μπορεί να μορφοποιηθεί με το χέρι από τον χειρουργό, όπως υποδεικνύεται για την εκάστοτε χειρουργική
επέμβαση. Όταν το εργαλείο διέλθει υποδορίως, ο αποφράκτης πρέπει να εισαχθεί στο σωληνοειδή άξονα και να ασφαλίσει μέσα στη χειρολαβή μέσω
κουμπώματος του ασφαλιστικού άκρου του αποφράκτη στη θέση του. Μετά την αφαίρεση του αποφράκτη, ο καθετήρας μπορεί να τοποθετηθεί με το χέρι
διαμέσου του αυλού του σωληνοειδούς άξονα.
Ο αποφράκτης περιλαμβάνει επίσης μια θέση προσάρτησης καθετήρα για την προσάρτηση ενός περιφερικού καθετήρα με ανοικτό άκρο. Η προσάρτηση του
καθετήρα στον αποφράκτη καθιστά δυνατή την απόσυρση των καθετήρων που έχουν κατάλληλη εσωτερική διάμετρο, διαμέσου του άξονα του εξαρτήματος
διέλευσης.
Τρόπος διάθεσης
Τα συνδετικά καθετήρων PS Medical της Medtronic Neurosurgery και τα αναλώσιμα υποδόρια εξαρτήματα διέλευσης καθετήρων είναι συσκευασμένα ΣΤΕΙΡΑ
και ΜΗ ΠΥΡΕΤΟΓΟΝΑ και προορίζονται για μία χρήση μόνο (εφάπαξ χρήση). ΜΗΝ ΕΠΑΝΑΠΟΣΤΕΙΡΩΝΕΤΕ. Μη χρησιμοποιείτε εάν η συσκευασία έχει
ήδη ανοιχτεί ή έχει υποστεί ζημιά. Η επαναποστείρωση μπορεί να προκαλέσει ζημιά στο προϊόν, οδηγώντας, ενδεχομένως, σε τραυματισμό του ασθενούς. Η
Medtronic Neurosurgery δεν είναι υπεύθυνη για την απόδοση οποιουδήποτε προϊόντος το οποίο έχει επαναποστειρωθεί.
Προϊόντα ειδικής παραγγελίας
Εάν οι παρούσες οδηγίες χρήσης συνοδεύουν ένα προϊόν ειδικής παραγγελίας, ενδέχεται να υπάρχουν διαφορές μεταξύ των φυσικών χαρακτηριστικών
του προϊόντος και της περιγραφής του προϊόντος στις οδηγίες χρήσης. Οι διαφορές αυτές δεν επηρεάζουν την ασφάλεια ή την αποτελεσματικότητα
του προϊόντος ειδικής παραγγελίας. Τα προϊόντα ειδικής παραγγελίας μπορεί να διατίθενται στείρα ή μη στείρα, όπως υποδεικνύεται στην ετικέτα της
συσκευασίας του προϊόντος.
Τα μη στείρα προϊόντα πρέπει να καθαρίζονται και να αποστειρώνονται πριν από τη χρήση.
Αντενδείξεις
Δεν θα πρέπει να διενεργείται αναστόμωση του ΕΝΥ στον δεξιό κόλπο, στην περιτοναϊκή κοιλότητα ή σε άλλες περιοχές του σώματος εάν υπάρχει λοίμωξη
σε κάποιο από τα σημεία όπου πρόκειται να εμφυτευτούν τα διάφορα εξαρτήματα του συστήματος αναστόμωσης. Στις λοιμώξεις αυτές συγκαταλέγονται
λοιμώξεις του τριχωτού της κεφαλής και άλλων περιοχών του δέρματος, από τις οποίες θα διέλθει το σύστημα αναστόμωσης, καθώς και λοιμώξεις
των μηνίγγων και των κοιλιών του εγκεφάλου, του περιτοναίου και των ενδοπεριτοναϊκών και οπισθοπεριτοναϊκών οργάνων, του υπεζωκότα και του
κυκλοφορικού. Η αναστόμωση ΕΝΥ αντενδείκνυται εάν υπάρχει λοίμωξη σε οποιοδήποτε σημείο του σώματος. Αντενδείκνυται επίσης η αναστόμωση εντός
του κόλπου της καρδιάς σε ασθενείς με συγγενή καρδιοπάθεια ή άλλες σοβαρές καρδιοπνευμονικές ανωμαλίες.
Ενημέρωση του ασθενούς
Είναι ευθύνη του ιατρού να ενημερώσει τον ασθενή ή/και τους εκπροσώπους του σχετικά με την αναστόμωση για την παροχέτευση του ΕΝΥ. Αυτή η
ενημέρωση θα πρέπει να περιλαμβάνει περιγραφή των επιπλοκών που συσχετίζονται με τα εμφυτεύσιμα συστήματα αναστόμωσης, καθώς και επεξήγηση
των δυνητικών εναλλακτικών προϊόντων και θεραπειών.
Προειδοποιήσεις και προφυλάξεις
Πρέπει να επιλέγεται το κατάλληλο προϊόν, το κατάλληλο μέγεθος, η κατάλληλη πίεση και το κατάλληλο εύρος απόδοσης για τις ειδικές ανάγκες του
ασθενούς, βάσει των διαγνωστικών εξετάσεων και της πείρας του ιατρού. Η ετικέτα του προϊόντος καθορίζει τα επίπεδα ή τις κλίμακες απόδοσης του
προϊόντος.
Η επανειλημμένη διαμόρφωση των αναλώσιμων υποδόριων εξαρτημάτων διέλευσης καθετήρων με το χέρι ενδέχεται να επιφέρει μείωση της αντοχής του
άξονα, με αποτέλεσμα τη θραύση του κατά τη χρήση.
Τα αιχμηρά άκρα που δημιουργούνται από την τροποποίηση ή την πρόκληση ζημιάς στα αναλώσιμα υποδόρια εξαρτήματα διέλευσης καθετήρων ενδέχεται
να προκαλέσουν ζημιά στους καθετήρες που περνούν μέσα από το εργαλείο.
Αποφεύγετε την επαφή των εμφυτεύσιμων προϊόντων με χνουδωτό ύφασμα, ταλκ γαντιών, λιπαρά κατάλοιπα από το δέρμα, σαπούνια με βάση έλαια,
συνθετικά απορρυπαντικά ή άλλες μολυσματικές ουσίες επιφανειών.
Ο λανθασμένος χειρισμός ή η ακατάλληλη χρήση εργαλείων κατά την εμφύτευση των προϊόντων ενός συστήματος αναστόμωσης μπορεί να προκαλέσει
κοπή, σχίσιμο, σύνθλιψη ή θραύση των εξαρτημάτων. Τέτοιες ζημιές μπορεί να βλάψουν την ακεραιότητα του συστήματος αναστόμωσης και ως εκ τούτου να
απαιτηθεί πρόωρη χειρουργική αναθεώρηση του συστήματος αναστόμωσης.
Απαιτείται προσοχή προκειμένου να διασφαλιστεί ότι δεν εισάγονται μολυσματικά σωματίδια μέσα στα εξαρτήματα του συστήματος αναστόμωσης κατά τις
δοκιμές ή τους χειρισμούς πριν από την εμφύτευση. Η εισαγωγή μολυσματικών ουσιών μπορεί να προκαλέσει ελαττωματική απόδοση (υπερπαροχέτευση
ή υποπαροχέτευση) του συστήματος αναστόμωσης. Σωματίδια που μπορεί να παρεισφρήσουν στο σύστημα αναστόμωσης μπορεί επίσης να κρατήσουν
ανοικτούς τους μηχανισμούς ελέγχου πίεσης/ροής, κάτι που θα επιφέρει υπερπαροχέτευση.
Κατά τη στερέωση των κοιλιακών και των περιφερικών καθετήρων στα συνδετικά της βαλβίδας, οι απολινώσεις που περιβάλλουν τον σωλήνα θα πρέπει να
είναι μεν καλά στερεωμένες, αλλά όχι πολύ σφικτές, ώστε να μην κόψουν τον σωλήνα από σιλικόνη.
Θα πρέπει να δίνεται προσοχή στη δρομολόγηση των καθετήρων, ώστε να αποφεύγεται η στρέβλωση και η άσκοπη τριβή σε όλο το μήκος τους. Το χείλος της
οπής που δημιουργήθηκε με ελικοειδές τρύπανο ή φρέζα μπορεί να διαμορφωθεί για τη δημιουργία μιας λοξής εγκοπής στο σημείο από όπου εξέρχεται ο
κοιλιακός καθετήρας και καμπυλώνεται για να παραμένει σε επαφή με το κρανίο.
Ασθενείς στους οποίους εμφυτεύονται συστήματα αναστόμωσης για υδροκεφαλία πρέπει να παρακολουθούνται στενά κατά τη μετεγχειρητική περίοδο
για σημεία και συμπτώματα τα οποία υποδεικνύουν κάποια δυσλειτουργία του συστήματος αναστόμωσης. Τα κλινικά ευρήματα μπορεί να υποδεικνύουν
λοίμωξη, απόφραξη του συστήματος αναστόμωσης ή υπερπαροχέτευση του ΕΝΥ.
Μπορεί να προκληθεί απόφραξη της αναστόμωσης σε οποιοδήποτε από τα εξαρτήματα του συστήματος αναστόμωσης. Ο κοιλιακός καθετήρας μπορεί να
αποφραχθεί από σωματιδιακή ύλη, όπως θρόμβοι αίματος ή τεμάχια εγκεφαλικού ιστού, με εμπλοκή του άκρου του καθετήρα μέσα στο χοριοειδές πλέγμα,
με ενσωμάτωση του καθετήρα στον εγκεφαλικό ιστό ή με σύμπτωση των κοιλιακών τοιχωμάτων όταν υπάρχει υπερπαροχέτευση («σχισμοειδείς κοιλίες»).
Θρόμβοι αίματος γύρω από το τμήμα του καθετήρα που εισέρχεται στον κόλπο της καρδιάς μπορεί να προκαλέσουν εμβολή του πνευμονικού αρτηριακού
δένδρου, κάτι που μπορεί να επιφέρει πνευμονική καρδία και πνευμονική υπέρταση.
Αποσυνδεδεμένα εξαρτήματα του συστήματος αναστόμωσης μπορεί να μετατοπιστούν εντός της καρδιάς ή εντός της περιτοναϊκής κοιλότητας.
Τα συστήματα αναστόμωσης ενδέχεται να παρουσιάσουν αστοχία λόγω μηχανικής δυσλειτουργίας, προκαλώντας υποπαροχέτευση ή υπερπαροχέτευση.
Η δυσλειτουργία ή η απόφραξη του συστήματος αναστόμωσης μπορεί να προκαλέσει σημεία και συμπτώματα αυξημένης ενδοκρανιακής πίεσης, εάν η
υδροκεφαλία δεν είναι αντιρροπούμενη. Στα βρέφη, τα συνήθη ευρήματα είναι αυξημένη τάση της πρόσθιας πηγής, συμφόρηση των φλεβών του τριχωτού
της κεφαλής, ατονία, υπνηλία και ευερεθιστότητα, έμετος και αυχενική δυσκαμψία. Στα μεγαλύτερα παιδιά και στους ενήλικες, τα σημεία και τα συμπτώματα
είναι εκείνα που συνήθως συσχετίζονται με αυξημένη ενδοκρανιακή πίεση, όπως πονοκέφαλος, έμετος, θάμβος όρασης, αυχενική δυσκαμψία, απώλεια
συνείδησης και διάφορα ανώμαλα νευρολογικά ευρήματα.
Η υπερπαροχέτευση του ΕΝΥ μπορεί να προδιαθέσει τον ασθενή σε ανάπτυξη υποσκληριδίου αιματώματος ή υγρώματος ή σε σύμπτωση των τοιχωμάτων της
πλάγιας κοιλίας, προκαλώντας απόφραξη του κοιλιακού καθετήρα.
Εάν ο κοιλιακός καθετήρας δεσμευτεί στο χοριοειδές πλέγμα ή σε παρακείμενο εγκεφαλικό ιστό λόγω συμφύσεων ινώδους ιστού, συνιστάται να μην
αφαιρεθεί βίαια. Συνιστάται η περιστροφή του καθετήρα με ήπιες κινήσεις, η οποία ενδεχομένως θα βοηθήσει στην απελευθέρωσή του. Συνιστάται να
αφήσετε τον καθετήρα στη θέση του παρά να διακινδυνεύσετε την πρόκληση ενδοκοιλιακής αιμορραγίας με τη βίαιη αφαίρεσή του.
Επιπλοκές
Οι επιπλοκές που συσχετίζονται άμεσα με τη χρήση αναλώσιμων υποδόριων εξαρτημάτων διέλευσης καθετήρων περιλαμβάνουν τη δυσκολία διέλευσης του
εργαλείου μέσα από ουλοποιημένες περιοχές και τον πιθανό σχηματισμό αιματωμάτων.
Οι επιπλοκές που συσχετίζονται με τα κοιλιοκολπικά και τα κοιλιοπεριτοναϊκά συστήματα αναστόμωσης ΕΝΥ μπορεί να είναι παρόμοιες με εκείνες που
εμφανίζονται σε οποιαδήποτε χειρουργική επέμβαση με τοπική ή/και γενική αναισθησία. Σε αυτές τις επιπλοκές, περιλαμβάνονται αντιδράσεις σε φάρμακα
και αναισθητικούς παράγοντες, διαταραχή της ισορροπίας των ηλεκτρολυτών και υπερβολική απώλεια αίματος, ιδιαίτερα σε βρέφη. Σε σπάνιες περιπτώσεις,
ο ασθενής ενδέχεται να εμφανίσει αντίδραση που οφείλεται σε ευαισθησία στο εμφύτευμα.
Σε διαδικασίες αναστόμωσης ΕΝΥ, οι πιο κοινές επιπλοκές οφείλονται στην απόφραξη του συστήματος όπως περιγράφεται στην ενότητα «Προειδοποιήσεις».
Μπορεί να εμφανιστεί απόφραξη σε οποιοδήποτε εξάρτημα του συστήματος λόγω απόφραξης από συντρίμματα εγκεφαλικού ιστού, θρόμβους αίματος ή/
και συσσωματώματα καρκινικών κυττάρων σε κάποιο σημείο καθ' όλο του το μήκος. Απόφραξη μπορεί επίσης να σημειωθεί εξαιτίας διαχωρισμού των
εξαρτημάτων του συστήματος ή λόγω συστροφής ή/και περιέλιξης του καθετήρα. Κάτι τέτοιο μπορεί να προδιαθέσει σε μετατόπιση του κοιλιακού καθετήρα
μέσα στην πλάγια κοιλία και του περιφερικού καθετήρα μέσα στην καρδιά και στο πνευμονικό αρτηριακό δένδρο, το περιτόναιο ή κάποια άλλη δομή στην
οποία έχει εμφυτευθεί ο καθετήρας. Όπως σημειώθηκε προηγουμένως, η ανάπτυξη του βρέφους ή του παιδιού μπορεί να προκαλέσει την απόσυρση του
περιφερικού καθετήρα από τον κόλπο και να τον οδηγήσει στην εσωτερική σφαγίτιδα φλέβα ή από το περιτόναιο σε επίπεδα του ιστού όπου το υγρό δεν
μπορεί να απορροφηθεί.
Υπάρχουν και άλλες δυνητικά σοβαρές επιπλοκές. Κατά τις διαδικασίες αναστόμωσης, οι τοπικές και συστηματικές λοιμώξεις δεν είναι σπάνιες. Συνήθως,
οφείλονται σε μικροοργανισμούς που απαντώνται στο δέρμα και ειδικότερα στον Staphylococcus epidermidis. Άλλα παθογόνα που κυκλοφορούν στο αίμα
μπορούν να αποικίσουν την αναστόμωση και, στην πλειονότητα των ασθενών, να δημιουργήσουν την ανάγκη για αφαίρεση του συστήματος.
Το 1973, οι Robertson et al. συνόψισαν τη συχνότητα εμφάνισης λοίμωξης σε κοιλιοκολπικά και κοιλιοπεριτοναϊκά συστήματα αναστόμωσης, σύμφωνα
με τις έως τότε σχετικές αναφορές. Η συχνότητα εμφάνισης λοίμωξης σε κοιλιοκολπικά συστήματα αναστόμωσης κυμαινόταν μεταξύ 7% και 31%. Στις
περισσότερες αναφορές, καταγράφεται εμφάνιση λοίμωξης σε κοιλιοπεριτοναϊκά συστήματα αναστόμωσης σε ποσοστό 5% έως 10% των ασθενών. Καθώς
τα κοιλιοκολπικά συστήματα αναστόμωσης προδιαθέτουν στη διασπορά των βακτηρίων σε άλλα όργανα, τα κοιλιοπεριτοναϊκά συστήματα αναστόμωσης
θεωρούνται λιγότερο καταστρεπτικά.
4
Λαβή από πολυπροπυλένιο
Σύνδεση καθετήρα (Άκρο
ασφάλισης)
Άξονας από
ανοξείδωτο χάλυβα
Άκρο αποφράκτη από
πολυπροπυλένιο
Το 1993, οι Kestle et al. ανέφεραν σημαντική μείωση των λοιμώξεων (λιγότερο από 4%) με τη χρήση αντιβιοτικών, τη μείωση του χρόνου των χειρουργικών
επεμβάσεων (χειρουργική πείρα) και τον έλεγχο του περιβάλλοντος στο χειρουργείο (π.χ. καθορισμένος χώρος χειρουργείου, περιορισμένος αριθμός και
μετακίνηση προσωπικού, καλυμμένες επιφάνειες δέρματος). Στο άρθρο αναφέρεται ότι μπορούν να επιτευχθούν καλά αποτελέσματα και χωρίς τη χρήση
αντιβιοτικών, αλλά με αυστηρό περιεγχειρητικό έλεγχο του περιβάλλοντος.
Η χρήση προφυλακτικής αντιβίωσης σε ασθενείς με αναστόμωση είναι κάπως αμφιλεγόμενη, καθώς η χρήση της προδιαθέτει στη λοίμωξη από πιο
ανθεκτικούς μικροοργανισμούς. Συνεπώς, η απόφαση για τη χορήγηση προφυλακτικής αντιβίωσης επαφίεται στην κρίση του θεράποντος ιατρού ή/και του
χειρουργού.
Η αναστόμωση μέσα στο περιτόναιο μπορεί να αποτύχει λόγω εμπλοκής του καθετήρα στις εντερικές έλικες ή στο μείζον επίπλουν. Έχει περιγραφεί διάτρηση
του εντέρου από τον περιτοναϊκό καθετήρα με επακόλουθη ανάπτυξη περιτονίτιδας.
Η υπερπαροχέτευση ΕΝΥ μπορεί να προκαλέσει υπερβολική μείωση της πίεσης ΕΝΥ και να προδιαθέσει στην ανάπτυξη υποσκληρίδιου αιματώματος ή
υγρώματος, καθώς και στην υπερβολική μείωση του κοιλιακού μεγέθους που επιφέρει την απόφραξη λόγω πρόσκρουσης των τοιχωμάτων της κοιλίας στις
οπές εισροής του καθετήρα. Στα βρέφη, αυτή η υπερβολική μείωση της πίεσης προκαλεί σημαντική εμβύθιση της πρόσθιας πηγής, εφιππεύοντα κρανιακά
οστά και μπορεί να μετατρέψει την επικοινωνούσα υδροκεφαλία σε αποφρακτική.
Έχει αναφερθεί εμφάνιση επιληψίας μετά από διαδικασία κοιλιακής αναστόμωσης. Αυτή η μελέτη έδειξε επίσης ότι η συχνότητα εμφάνισης επιληπτικών
κρίσεων αυξήθηκε με τις πολλαπλές αναθεωρήσεις του καθετήρα.
Πολιτική επιστροφής προϊόντων
Για να γίνουν δεκτά τα προϊόντα που επιστρέφονται για αντικατάσταση ή παροχή πίστωσης, η συσκευασία τους πρέπει να είναι κλειστή και οι σφραγίσεις
του κατασκευαστή να είναι άθικτες, εκτός εάν η επιστροφή οφείλεται σε παράπονο του πελάτη για ελάττωμα ή εσφαλμένη επισήμανση του προϊόντος.
Ο προσδιορισμός του ελαττώματος ή της εσφαλμένης επισήμανσης ενός προϊόντος γίνεται κατά τρόπο οριστικό και αμετάκλητο από τη Medtronic
Neurosurgery. Προϊόντα τα οποία παρέμειναν στην κατοχή του πελάτη για διάστημα μεγαλύτερο των 90 ημερών δεν θα γίνονται αποδεκτά προς
αντικατάσταση ή παροχή πίστωσης.
Εγγύηση
Α. Τυπική περιορισμένη εγγύηση. Η Medtronic Neurosurgery εγγυάται στον αρχικό αγοραστή (εφεξής «Αγοραστής») ότι το εσώκλειστο, εμφυτεύσιμο
προϊόν (εφεξής «Προϊόν») που αγοράζει ο Αγοραστής δεν θα παρουσιάζει κανένα ελάττωμα όσον αφορά τα υλικά και την κατασκευή του κατά τη στιγμή
της παράδοσής του στον Αγοραστή. Η Medtronic Neurosurgery δεν παρέχει καμία εγγύηση (ρητή, σιωπηρή ή εκ του νόμου) για Προϊόντα που έχουν
τροποποιηθεί (με εξαίρεση τα ρητώς προβλεπόμενα στο παρόν) ή που έχουν υποβληθεί σε ασυνήθιστη φυσική καταπόνηση, εσφαλμένη χρήση, ακατάλληλη
λειτουργία, αμέλεια, εσφαλμένο έλεγχο, χρήση σε συνδυασμό με προϊόντα ή εξαρτήματα διαφορετικά από εκείνα για τα οποία έχουν σχεδιαστεί τα Προϊόντα
ή χρήση με οποιονδήποτε τρόπο ή σε οποιαδήποτε ιατρική διαδικασία για την οποία δεν ενδείκνυνται τα Προϊόντα.
B. Αποζημίωση. Η αποκλειστική αποζημίωση του Αγοραστή και η μόνη ευθύνη της Medtronic Neurosurgery για παραβίαση της παραπάνω εγγύησης θα
είναι, κατά την αποκλειστική κρίση και ευχέρεια της Medtronic Neurosurgery, η αντικατάσταση του Προϊόντος ή η πίστωση του λογαριασμού του Αγοραστή
με το καθαρό ποσό που πράγματι καταβλήθηκε για το Προϊόν, με την προϋπόθεση ότι (i) η Medtronic Neurosurgery θα ειδοποιηθεί γραπτώς εντός ενενήντα
(90) ημερών μετά την παραλαβή του προϊόντος από τον Αγοραστή ότι το εν λόγω Προϊόν δεν συμμορφώνεται με τις απαιτήσεις, συμπεριλαμβανομένης
μιας λεπτομερούς επεξήγησης οποιασδήποτε εικαζόμενης μη συμμόρφωσης στα αγγλικά, (ii) το Προϊόν θα επιστραφεί στη Medtronic Neurosurgery
εντός ενενήντα (90) ημερών μετά την παραλαβή του Προϊόντος από τον Αγοραστή, F.O.B. (free on board – ελεύθερο επί του μεταφορικού μέσου), στη
διεύθυνση: 125 Cremona Drive, Goleta, California 93117, Η.Π.Α., ή όπως αλλιώς καθορίζει η Medtronic Neurosurgery, και (iii) η Medtronic Neurosurgery
θα λάβει εύλογες και ικανοποιητικές αποδείξεις ότι τα αναφερόμενα ελαττώματα πράγματι υπάρχουν. Με εξαίρεση τα ρητώς προβλεπόμενα στην παρούσα
παράγραφο, ο Αγοραστής δεν έχει δικαίωμα να επιστρέψει Προϊόντα στη Medtronic Neurosurgery χωρίς την προηγούμενη έγγραφη συγκατάθεση της
Medtronic Neurosurgery.
Γ. Εξαίρεση άλλων εγγυήσεων. ΕΚΤΟΣ ΑΠΟ ΤΗΝ ΠΕΡΙΟΡΙΣΜΕΝΗ ΕΓΓΥΗΣΗ ΠΟΥ ΟΡΙΖΕΤΑΙ ΣΤΟ ΤΜΗΜΑ (Α) ΠΑΡΑΠΑΝΩ, Η MEDTRONIC
NEUROSURGERY ΔΕΝ ΠΑΡΕΧΕΙ ΚΑΜΙΑ ΑΛΛΗ ΕΓΓΥΗΣΗ Ή ΟΡΟΥΣ, ΡΗΤΟΥΣ Ή ΣΙΩΠΗΡΟΥΣ, ΚΑΙ Ο ΚΑΤΑΣΚΕΥΑΣΤΗΣ ΑΠΟΠΟΙΕΙΤΑΙ ΕΙΔΙΚΑ ΤΩΝ
ΣΙΩΠΗΡΩΝ ΕΓΓΥΗΣΕΩΝ ΚΑΙ ΟΡΩΝ ΕΜΠΟΡΕΥΣΙΜΟΤΗΤΑΣ ΚΑΙ ΚΑΤΑΛΛΗΛΟΤΗΤΑΣ ΓΙΑ ΣΥΓΚΕΚΡΙΜΕΝΟ ΣΚΟΠΟ. Η MEDTRONIC NEUROSURGERY
ΔΕΝ ΑΝΑΛΑΜΒΑΝΕΙ ΟΥΤΕ ΕΞΟΥΣΙΟΔΟΤΕΙ ΟΠΟΙΟΔΗΠΟΤΕ ΑΛΛΟ ΠΡΟΣΩΠΟ ΝΑ ΑΝΑΛΑΒΕΙ ΤΥΧΟΝ ΑΛΛΕΣ ΕΥΘΥΝΕΣ ΠΟΥ ΑΠΟΡΡΕΟΥΝ Ή
ΠΡΟΚΥΠΤΟΥΝ ΣΕ ΣΧΕΣΗ ΜΕ ΤΗΝ ΠΩΛΗΣΗ Ή ΤΗ ΧΡΗΣΗ ΟΠΟΙΟΥΔΗΠΟΤΕ ΠΡΟΪΟΝΤΟΣ.
Katétercsatlakozók
Leírás
Katétercsatlakozó, egyenes
A katétercsatlakozó, egyenes (1. ábra) eszköz nejlon csatlakozó, amely rendeltetésszerűen a Medtronic Neurosurgery PS Medical szív-peritonealis
Magyar
katéter, a Medtronic Neurosurgery PS Medical szívkatéter és a Medtronic Neurosurgery PS Medical peritonealis katéter termékekkel
használandó.
Katétercsatlakozó, derékszögű
A katétercsatlakozó, derékszögű (2. ábra) eszköz nejlon csatlakozó, amely rendeltetésszerűen a Medtronic Neurosurgery PS Medical
ventricularis katéterekkel használandó.
Katétercsatlakozó, háromágú
A katétercsatlakozó, háromágú (3. ábra) eszköz polipropilén és elasztomer csatlakozó, amelynek célja két PS Medical ventricularis
katéter csatlakoztatása egy Medtronic Neurosurgery PS Medical CSF-áramlásszabályozó szelep bemeneti csatlakozójára.
1
Javallatok
Katétercsatlakozó, egyenes
A katétercsatlakozó, egyenes eszköz használata javasolt, ha distalis katéter revízió szükséges.
Katétercsatlakozó, derékszögű
A katétercsatlakozó, derékszögű használata javasolt, ha a ventricularis katétert meg kell hajlítani (névlegesen) 90º-ban ott, ahol kilép
a spirálfúrt vagy burr lyukból.
Katétercsatlakozó, háromágú
A katétercsatlakozó, háromágú eszköz használata javasolt, ha két PS Medical ventricularis katéter van csatlakoztatva egy PS Medical
CSF-áramlásszabályozó szelep bemeneti csatlakozójára.
Használati utasítás
A katétercsatlakozók használatakor alkalmazott sebészeti technikát a sebész legjobb belátása szerint választhatja ki.
2
3
Eldobható subcutan katéter-bevezető
Leírás
Az eldobható katéter-bevezetők eldobható sebészi eszközök. Három összetevőből állnak:
1. Üreges tengely (60 cm hosszú vagy 38 cm hosszú);
2. T-fogó; és
3. Obturator golyó alakú heggyel.
Ezek a műszerek hajlékony subcutan alagúteszközként vannak kivitelezve
a cerebrospinalis folyadék söntkatéterek bevezetése céljára. A legtöbb
ventriculoperitonealis sönteljáráshoz a 60 cm-es modell a megfelelő hosszúság.
A 38 cm-es modell a megfelelő hosszúság a ventriculoperitonealis sönteljáráshoz
kisméretű betegeken, illetve lumboperitonealis sönteljárásokhoz.
Javallatok
Az eldobható subcutan katéter-bevezetők a cerebrospinalis
folyadéksönt peritonealis katéterkomponensének behelyezésére
szolgáló subcutan alagút létrehozására és/vagy üreges tengely
elhelyezésére használatosak. A 38 cm-es modell használható a
Medtronic Neurosurgery PS Medical lumboperitonealis katéterrendszer
lumboperitonealis katéterkomponensének elhelyezésére is.
Használati utasítás
Az eldobható subcutan katéter-bevezetők használatakor alkalmazott sebészeti technikát a sebész legjobb belátása szerint választhatja ki. A sebésznek az eljárás megkezdése előtt meg kell
győződnie arról, hogy az eszköz át fog haladni.
Az üreges tengely hajlékony és azt a sebész kézzel alakíthatja, a műtéti eljárásban jelzettek szerint. Ha megtörtént a műszer
subcutan bevezetése, az obturatort be kell helyezni az üreges tengelybe, majd rögzíteni kell a fogóban, az obturator
záróhegyének megfelelő helyzetbe kattintásával. Az obturator eltávolítása után a katéter kézzel vezethető be az üreges
tengely lumenén keresztül.
Az obturatoron van katétercsatlakozási hely is, ahová felszerelhető egy nyitott végű, distalis katéter. A katéter felszerelése az obturátorra lehetővé teszi megfelelő belső átmérőjű katéterek
áthúzását a bevezető tengelyen keresztül.
Kiszerelés
Minden Medtronic Neurosurgery PS Medical katétercsatlakozó és eldobható subcutan katéter-bevezető STERIL és NEM PIROGÉN csomagolásban kerül forgalomba és csak egyszeri (egy
alkalommal való) használatra alkalmas. ÚJRASTERILIZÁLÁSUK TILOS! Ne használja, ha a csomag már nyitott vagy sérült. Az újrasterilizálás megkárosíthatja a terméket, és potenciálisan
a beteg sérülését okozhatja. A Medtronic Neurosurgery nem felelős semmilyen újrasterilizált termék teljesítményéért.
Külön megrendelt termékek
Ha ezt a Használati utasítást külön megrendelt termékkel kapta, lehetséges, hogy termék fizikai tulajdonságai különböznek az ebben a használati utasításban található termékleírástól. Ezek
a különbségek nincsenek kihatással a külön megrendelt termék biztonságosságára vagy hatékonyságára. A külön megrendelt termékek szállítása steril vagy nem-steril állapotban történik,
a termék csomagolásán jelzettek szerint. A nem steril termékeket először feltétlenül tisztítani és sterilizálni kell.
Ellenjavallatok
Tilos a CSF-söntölés a jobb pitvarba, a peritonealis üregbe vagy a test más térségébe, ha fertőzés van jelen bármely olyan térségben, ahová a söntrendszer különböző komponensei
beültetésre kerülnek. Ezek többek között magukban foglalják a következő területek fertőzéseit: a fejbőr, illetve más olyan bőrfelület, ahol a söntrendszer áthalad, az agyhártyák és
agykamrák, illetve a peritoneum és az intraperitonealis és retroperitonealis szervek, a pleura és a véráram. A CSF-söntölés ellenjavallt, ha a test bármely részében fertőzés van jelen.
Ezenkívül, congenitalis szívbetegségben vagy más súlyos cardiopulmonalis elváltozásban szenvedők esetén is ellenjavallt a kamrába söntölés.
Betegtájékoztatás
Az orvos felelőssége a beteget és/vagy a beteg képviselőjét/képviselőit tájékoztatni a ventricularis vagy a CSF-söntölésre vonatkozóan. A tájékoztatónak ki kell térnie az implantálható
söntrendszerekkel kapcsolatos komplikációk ismertetésére, és a lehetséges alternatív termékek és kezelések elmagyarázására..
Figyelmeztetések és óvintézkedések
A megfelelő terméket, méretet, nyomást vagy teljesítményjellemzőt az adott beteg igényeinek megfelelően kell kiválasztani, diagnosztikai tesztek és az orvos tapasztalata alapján. A
termék címkéje megadja a vonatkozó termékteljesítményeket, illetve tartományokat.
Az eldobható subcutan katéter-bevezető ismételt kézzel való alakítása gyengítheti a tengelyt, amely használat alatt törést okozhat.
Az eldobható subcutan katéter-bevezető módosításából vagy károsodásából származó éles szélek hátrányos hatással lehetnek az eszközön áthaladó katéterre.
A beültethető termékek ne érintkezzenek kötszerrel, talkummal, bőrről származó olajmaradvánnyal, olaj alapú szappanokkal, szintetikus mosószerekkel vagy más felületi szennyezőkkel.
Szerszámok nem megfelelő kezelése vagy használata sönt termékek beültetésekor az alkatrészek elvágását, behasítását, összezúzását vagy törését eredményezheti. Ilyen károsodás a sönt
integritásának elvesztéséhez vezethet, és szükségessé teheti a söntrendszer idő előtti sebészeti felülvizsgálatát.
Vigyázni kell arra, hogy szemcsés szennyezők ne kerüljenek be a söntalkatrészekbe az implantációt megelőző tesztelés vagy kezelés alatt. Szennyezők bevitele a söntrendszer nem megfelelő
teljesítményét eredményezheti (túlzott vagy nem elegendő drenázs). A söntrendszerbe bekerülő szemcsék nyitva tarthatják a nyomás- és áramláskontrolláló mechanizmust, amely túlzott
drenázst eredményez.
A ventricularis és distalis katéterek szelepcsatlakozókhoz rögzítésekor a csövet körbefogó kötéseket erősen, de nem túl szorosan kell rögzíteni, mert esetleg átvághatják a szilikon
csűvezetéket.
A katéter vezetésekor körültekintően kell eljárni, hogy pályájuk során ne legyenek kitéve hajlításnak és szükségtelen dörzsölődésnek. A spirálfúróval készített vagy burr lyuk pereme
körülvágható, hogy lesarkított horony keletkezzen ott, ahol a katéter kilép és el van hajlítva, hogy közvetlenül ráfeküdjön a koponyára.
A hydrocephalus söntrendszerekkel ellátott betegeket alapos megfigyelés alatt kell tartani a műtétet követő időszakban, hogy nem lépnek-e fel a sönt nem megfelelő működésére utaló
jelek és tünetek. A klinikai megfigyelések jelezhetnek fertőzést, söntelzáródást vagy túlzott CSF-drenázst.
Söntelzáródás a söntrendszer bármely alkatrészében előfordulhat. A ventricularis katéter elzáródhat a következő okokból: szemcsés anyag (vérrögök vagy agytörmelék) bekerülése, a
katétercsúcs behatolása a plexus choroideus-ba, a katéter beágyazódása az agyszövetbe, vagy pedig a ventricularis falak összezáródása túlzott drenázs következtében („szűkült kamra”).
Vérrögképződés a katéter pitvari része körül a pulmonalis artériák embolisatiojához vezethet, amelynek eredménye cor pulmonale vagy hypertensio pulmonalis lehet.
Levált söntalkatrészek bevándorolhatnak a szívbe vagy a peritonealis üregbe.
Söntrendszerek nem megfelelő működése mechanikai hiba miatt is bekövetkezhet, amely nem elegendő vagy túlzott
drenázshoz vezethet.
A söntrendszer nem megfelelő működése vagy elzáródása növekedett intracranialis nyomás jeleihez vagy tüneteihez vezethet, ha a hydrocephalus nem kompenzált. Csecsemőkben szokás
szerint a következők figyelhetők meg: a fontanella anterior megnövekedett feszülése, a fejbőr ereinek vérbősége, figyelmetlenség, álmosság, ingerlékenység, hányás és tarkómerevség.
Idősebb gyermekek és felnőttek a megnövekedett intracranialis nyomáshoz kapcsolódó szokásos tüneteket mutatják: fejfájás, hányás, homályos látás, tarkómerevség, a tudatosság
csökkenése és különböző kóros neurológiai tünetek.
Túlzott CSF drenázs prediszponálja a subduralis haematoma vagy hydroma kialakulását, illetve okozhatja a lateralis kamrafalak kollapszusát, amely a ventricularis katéter elzáródásához
vezethet.
Ha a ventricularis katéter a rostos szövetek összenövése révén kötődik a plexus choroideus-hoz vagy a szomszédos agyszövethez, nem javasoljuk a katéter erőszakos eltávolítását. Javaslatunk
szerint a katéter óvatos elforgatása segítheti annak kiszabadítását. Tanácsosabb a katétert a helyén hagyni, mert az erőszakos eltávolítás az intraventricularis haemorrhagia kockázatát
hozza magával.
Komplikációk
Az eldobható subcutan katéter-bevezető használatához közvetlenül kapcsolódó komplikációk többek között: nehézség az eszköz átvezetésekor a heges területeken, illetve haematomák
esetleges kialakulása.
A ventriculoatrialis és ventriculoperitonealis CSF söntrendszerekkel kapcsolatos komplikációk hasonlatosak lehetnek bármilyen, helyi és/vagy általános anaesthesia alatt elvégzett sebészi
eljáráséhoz. Ezek többek között: gyógyszerekkel és érzéstelenítő szerekkel szembeni reakciók, elektrolit kiegyensúlyozatlanság vagy túlzott vérveszteség, különösen csecsemők esetén. Ritka
esetben a betegben az implantátummal szembeni érzékenység miatt léphet fel reakció.
Minden CSF söntölési eljárás esetén a legszokásosabb komplikációk a rendszer „Figyelmeztetések” alatt leírt eldugulásának következményei. Az elzáródás bekövetkezhet a rendszer
bármely alkatrészében bárhol, agytörmelékek, vérrögök és/vagy tumorsejt aggregátumok tömítő hatásának következtében. Elzáródás bekövetkezhet a rendszeralkatrészek szétválása
és/vagy a katéter csavarodása következtében is. Ez elősegítheti a ventricularis katéter bevándorlását a lateralis kamrába, a distalis katéterét a szívbe és a pulmonalis artériarendszerbe, a
peritoneumba, vagy más olyan szerkezetbe, amelybe a katéter be van ültetve. Mint már korábban megjegyeztük, a csecsemő vagy gyermek növekedése okozhatja azt, hogy a distalis katéter
visszahúzásra kerül a pitvarból a belső torkolati vénába, vagy pedig a peritoneumból olyan szövetsíkokba, ahol folyadék nem abszorbeálható.
Más potenciálisan súlyos komplikációk is felléphetnek. Helyi vagy általános fertőzések nem szokatlanok sönteljárások esetén. Ezeket rendszerint a bőrön található fertőzések
(különösképpen Staphylococcus epidermidis) okozhatják. Azonban a vérben keringő más patogének is megtelepedhetnek a söntben, és a betegek többségében szükségessé tehetik annak
eltávolítását.
1973-ban Robertson és munkatársai az addigi jelentések alapján összefoglalták a ventriculoatrialis és ventriculoperitonealis söntökben előforduló fertőzéseket. Ventriculoatrialis söntölés
esetén a fer tőzés előfordulási aránya 7-31% között változott. A legtöbb beszámoló szerint a ventriculoperitonealis söntölésben a betegek 5-10%-a esetén fordult elő fertőzés. Mivel a
ventriculoatrialis söntölés elősegíti a baktériumok továbbterjedését más szervek felé, a ventriculoperitonealis söntölés kevésbé káros hatású.
1993-ban Kestle és munkatársai a fertőzések jelentős csökkenését (4%-nál alacsonyabb szintet) érték el, antibiotikum használatával, rövid műtéti idővel (sebészeti tapasztalat) és
a műtőbeli környezet kontrollálásával (pl. erre a célra kijelölt műtő, korlátozott számú személyzet és csökkent forgalom, lefedett bőrfelületek). A cikk azt állítja, hogy eredmények
antibiotikumok használata nélkül is elérhetők, a környezet szigorú operáció előtti kontrolljával.
A profilaktikus antibiotikumok használata söntölt betegekben kissé ellentmondásos, mert használatuk prediszponálhatja az ellenállóbb organizmusokkal való fertőzést. Ezért a profilaktikus
antibiotikumok használatáról a kezelőorvosnak és/vagy a sebésznek kell döntenie.
A peritoneumba történő söntölés sikertelen lehet, mert a katéter behatolhat a belek közé vagy az omentummajorba. Ezenkívül leírták már a bél perforációját peritonealis katéter esetében,
amelyet peritonitis kialakulása követett.
Túlzott CSF drenázs a CSF nyomás túlzott csökkenését okozhatja, és ez elősegítheti subduralis haematoma vagy hydroma kialakulását, illetve a kamra méretének túlzott csökkenését
okozhatja, amely elzáródáshoz vezet, mert a kamrafalak rázárulnak a katéter bemeneti nyílásaira. Csecsemőben ez a túlzott nyomáscsökkenés a fontanella anterior kifejezett depresszióját
és a koponyacsontok egymásra fekvését okozhatja, amely átalakulhat obstrukciós hydrocephalussá.
Beszámoltak már epilepszia előfordulásáról is ventricularis söntölési eljárások után. Ez a tanulmány azt is jelezte, hogy a rohamok gyakorisága növekedett többszörös katéterrevíziók esetén.
Visszaküldött árukkal kapcsolatos irányelv
A termékeket fel nem nyitott csomagolásban, érintetlen gyártói zárópecséttel kell visszaküldeni, egyébként azok nem elfogadhatók cserére vagy jóváírásra. Ez alól csak a termékhiba vagy
címkézési hiba panaszával visszaküldött termékek képeznek kivételt. A Medtronic Neurosurgery fogja eldönteni, hogy fennáll-e termékhiba vagy címkézési hiba, és a döntés végleges lesz.
Csere vagy jóváírás céljából csak akkor fogadhatók el a termékek, ha azok 90 napnál rövidebb ideig voltak a vevő birtokában.
Garancia
A. Standard korlátozott garancia. A Medtronic Neurosurgery garantálja az eredeti végfelhasználónak („vevő”), hogy a vevő által megvásárolt, mellékelt implantálható termék
(„termék”) a vevőnek való kiszállítás időpontjában anyag- és gyártási hibáktól alapvetően mentes lesz. A Medtronic Neurosurgery semmilyen garanciát (kifejezett, beleértett vagy
kötelező) sem vállal olyan termékekért, amelyeket módosítottak (kivéve az itt kifejezetten említetteket) vagy szokatlan mértékű fizikai terhelésnek, nem megfelelő használatnak
vagy üzemeltetésnek, hanyagságnak, nem megfelelő teszteknek tettek ki, vagy a termék tervezésétől eltérő más termékekkel vagy alkatrészekkel együtt használtak, vagy a termék
rendeltetésének nem megfelelő bármi más módon vagy orvosi eljárásban alkalmaztak.
B. Jogorvoslat. A fenti garancia be nem tartása esetén a vevő egyetlen jogorvoslata és a Medtronic Neurosurgery egyetlen felelőssége, a Medtronic Neurosurgery kizárólagos döntése és
választása alapján, ezen termék cseréje vagy az ilyen termékért ténylegesen kifizetett nettó összeg jóváírása lesz, feltéve, hogy (i) a Medtronic Neurosurgery írásos értesítést kap a termék
hibás működéséről, a feltételezett hibás működés angol nyelvű részletes magyarázatával, attól számított 90 napon belül, hogy a vásárló átvette a terméket; (ii) az átvételtől számított 90
napon belül az ilyen terméket visszaküldik a F.O.B. 125 Cremona Drive, Goleta, California 93117, U.S.A. címre, vagy más, a Medtronic Neurosurgery által megadott címre; és (iii) a Medtronic
Neurosurgery kielégítően meggyőződött arról, hogy a panaszban említett hiba ténylegesen létezik. Az ebben a paragrafusban kifejezetten leírtak kivételével a vásárlónak nincs joga a
termékeket a Medtronic Neurosurgery vállalatnak visszaküldeni, a Medtronic Neurosurgery előzetes írásos engedélye nélkül.
C. Egyéb garanciák kizárása. A FENTI (A) PONTBAN LEÍRT KORLÁTOZOTT GARANCIA KIVÉTELÉVEL A MEDTRONIC NEUROSURGERY SEMMILYEN MÁS, KIFEJEZETT VAGY
BELEÉRTETT GARANCIÁT VAGY KIKÖTÉST SEM NYÚJT, ÉS A GYÁRTÓ KIFEJEZETTEN ELHÁRÍTJA AZ ELADHATÓSÁGRA ÉS EGY ADOTT CÉLRA VALÓ ALKALMASSÁGRA VONATKOZÓ
BELEÉRTETT GARANCIÁKAT ÉS KIKÖTÉSEKET. A MEDTRONIC NEUROSURGERY A TERMÉK ELADÁSÁVAL KAPCSOLATOSAN VAGY ABBÓL SZÁRMAZÓAN NEM VÁLLAL SEMMILYEN
MÁS FELELŐSSÉGET, ÉS ENNEK VÁLLALÁSÁVAL SEMMILYEN MÁS SZEMÉLYT SEM HATALMAZOTT FEL.
4
Polipropilén fogó
Rozsdamentes acél tengely
Katétercsatlakozó (zárolóhegy)
Polipropilén
obturatorhegy
Connettori per catetere
Descrizione
Connettore per catetere diritto
Il connettore per catetere diritto (Fig. 1) è un dispositivo in nylon creato per essere usato con cateteri cardiaci/peritoneali PS Medical, cateteri cardiaci PS
Italiano
Medical e cateteri peritoneali PS Medical prodotti dalla Medtronic Neurosurgery.
Connettore per catetere ad angolo retto
Il connettore per catetere ad angolo retto (Fig. 2) è un dispositivo in nylon creato per essere usato con cateteri
ventricolari PS Medical della Medtronic Neurosurgery.
Connettore per catetere a tre vie
Il connettore per catetere a tre vie (Fig. 3) è un dispositivo in polipropilene ed elastomero al silicone creato per
collegare due cateteri ventricolari PS Medical a un connettore di entrata della valvola a controllo del flusso di
LCR PS Medical della Medtronic Neurosurgery.
1
Indicazioni
Connettore per catetere diritto
Il connettore per catetere diritto è da utilizzarsi quando è necessaria una revisione del catetere distale.
Connettore per catetere ad angolo retto
Il connettore per catetere ad angolo retto è indicato per l’uso quando occorre curvare il catetere ventricolare
ad un angolo di 90˚ (nominale) nel punto in cui fuoriesce dal foro del trapano a punta elicoidale o dal foro
di trapano.
Connettore per catetere a tre vie
Il connettore per catetere a tre vie deve essere usato quando due cateteri ventricolari PS Medical sono collegati
ad una valvola a controllo del flusso di LCR PS Medical.
Istruzioni per l’uso
Sta alla discrezione del chirurgo scegliere la tecnica chirurgica da impiegare durante l’utilizzo dei connettori
per catetere.
2
3
Introduttori del catetere sottocutanei monouso
Descrizione
Gli introduttori del catetere sottocutanei monouso sono strumenti chirurgici monouso composti da tre componenti:
1. Una guida a tubo (lunga 60 cm o 38 cm);
2. Manico a T; ed
3. Un otturatore a punta arrotondata.
Gli strumenti fungono da tunnelizzatori sottocutanei malleabili
in grado di far passare dei cateteri di derivazione del liquido
cerebrospinale. Il modello da 60 cm è indicato per la maggioranza
delle procedure di derivazione ventricoloperitoneale, mentre
il modello da 38 cm è indicato per le procedure di derivazione
ventricoloperitoneale con pazienti di piccola taglia, e per le
procedure di derivazione lomboperitoneali.
Indicazioni
Gli introduttori del catetere sottocutanei monouso sono utilizzati
per fornire un tunnel sottocutaneo e/o per posizionare guide a tubo
da utilizzarsi per il posizionamento del componente del catetere
peritoneale di una derivazione del liquido cerebrospinale. Il modello
da 38 cm può inoltre essere usato per posizionare il componente del catetere lomboperitoneale del sistema di catetere lomboperitoneale PS Medical della
Medtronic Neurosurgery.
Istruzioni per l’uso
Sta alla discrezione del chirurgo scegliere la tecnica chirurgica da impiegare durante l’utilizzo degli introduttori del catetere sottocutanei monouso. Si
consiglia che il chirurgo verifichi il passaggio del catetere attraverso lo strumento prima di iniziare la procedura.
La guida a tubo è malleabile e pertanto il chirurgo può sagomarla con la propria mano a seconda della procedura operatoria. Quando lo strumento viene
4
Collegamento del catetere
(punta di bloccaggio)
Manico in polipropilene
Guida in acciaio
inossidabile
Punta dell’otturatore
in polipropilene
fatto passare sottocute, l’otturatore deve essere inserito nella guida a tubo e fissato nel manico facendo scattare in posizione la punta di bloccaggio
dell’otturatore. Una volta tolto l’otturatore, il catetere può essere alimentato manualmente mediante il lume della guida a tubo.
Con l’otturatore è incluso anche un sito per l’attacco di cateteri allo scopo di collegare cateteri distali a estremità aperta. L’attacco del catetere all’otturatore
permette che cateteri con D.I. appropriato vengano tirati attraverso la guida per introduttore.
Confezioni
I connettori per catetere e gli introduttori del catetere sottocutanei monouso PS Medical prodotti dalla Medtronic Neurosurgery vengono confezionati
STERILI e APIROGENI e sono esclusivamente monouso. NON RISTERILIZZARE. Non usare se la
confezione è stata precedentemente aperta o se risulta danneggiata. La risterilizzazione può danneggiare il prodotto, con la
possibilità di arrecare lesioni al paziente. La Medtronic Neurosurgery non è responsabile delle prestazioni di un prodotto che sia stato risterilizzato.
Prodotti a ordinazione speciale
Se le presenti istruzioni per l’uso accompagnano un prodotto a ordinazione speciale potrebbero esistere delle differenze riguardanti le caratteristiche
fisiche tra il prodotto realmente confezionato e la descrizione di prodotto nell’inserto informativo. Queste differenze non avranno peraltro alcun effetto
sulla sicurezza o l’efficacia del prodotto a ordinazione speciale. I prodotti a ordinazione speciale possono essere forniti sterili o non sterili, come indicato
sull’etichetta della confezione del prodotto. I prodotti non sterili devono essere puliti e sterilizzati prima dell’uso.
Controindicazioni
Non si deve eseguire la derivazione di LCR nell’atrio destro, nella cavità peritoneale o in altre parti del corpo se esistono infezioni in una qualsiasi zona in cui i
vari componenti della derivazione verranno impiantati. Esempi di infezioni sono quelle del cuoio capelluto e di altre parti dell’epidermide attraverso le quali
passerà la derivazione, infezioni a livello delle meningi, dei ventricoli cerebrali, del peritoneo, degli organi intraperitoneali e retroperitoneali, della pleura e
del circolo ematico. La derivazione del liquor cefalorachidiano è in definitiva da evitare se è presente un’infezione in qualsiasi area del corpo. La derivazione
è inoltre controindicata nell’atrio di pazienti con cardiopatie congenite o altre gravi malattie cardiopolmonari.
Informazioni per il paziente
È responsabilità del medico informare il paziente e/o chi lo rappresenta sulla derivazione del liquor cefalorachidiano. Il medico dovrebbe anche descrivere le
complicazioni associate con l’applicazione di sistemi di derivazione impiantabili e spiegare i prodotti e le cure alternative possibili.
Avvertenze e precauzioni
È necessario scegliere prodotto, dimensione, pressione o livello di prestazione adeguato a seconda delle necessità specifiche del paziente e in base ai test
diagnostici e all’esperienza del medico. L’etichetta del prodotto specifica i livelli e le caratteristiche di rendimento del prodotto stesso.
Una ripetuta sagomatura manuale dell’introduttore del catetere sottocutaneo monouso potrebbe indebolire la guida, provocando rotture durante l’uso.
I bordi affilati provocati dalla modifica o dal danneggiamento dell’introduttore del catetere sottocutaneo monouso potrebbero influire negativamente sui
cateteri che vengono fatti passare attraverso lo strumento.
Evitare di mettere a contatto i prodotti dell’impianto con filaccia da garza, talco per guanti, residui oleosi prodotti dall’epidermide, saponi oleosi, detergenti
sintetici o altri contaminanti di superficie.
La manipolazione o l’uso inadeguato degli strumenti durante l’impianto dei prodotti di derivazione potrebbe causare tagli, fessure, schiacciamento o rottura
dei componenti. Tali danni potrebbero portare a una perdita dell’integrità della derivazione e richiedere una revisione chirurgica anticipata di quest’ultima.
Fare attenzione affinché contaminanti particellari non vengano introdotti nei componenti del sistema di derivazione durante la prova prima dell’impianto
o la manipolazione del sistema. L’introduzione di contaminanti potrebbe provocare una prestazione inadeguata (iperdrenaggio oppure ipodrenaggio) della
derivazione. Le materie particellari che vengono inserite nella derivazione potrebbero inoltre mantenere aperti i meccanismi di controllo della pressione/
flusso causando iperdrenaggio.
Quando si fissano i cateteri ventricolari e distali ai connettori della valvola, i lacci che circondano il tubo devono essere allacciati in modo sicuro ma non
troppo stretto in quanto potrebbero tagliare il tubo di silicone.
Fare attenzione a instradare i cateteri per impedirne l’attorcigliamento e l’inutile abrasione lungo il percorso. Il bordo del foro ottenuto mediante la punta
elicoidale o il trapano può essere rifilato ottenendo in tal modo un intaglio smussato dove il catetere ventricolare emerge e viene piegato per giacere
accanto al cranio.
Pazienti con derivazione per idrocefali devono essere tenuti sotto stretto controllo nel periodo postoperatorio allo scopo di identificare segni o sintomi indicanti
un cattivo funzionamento della derivazione. I risultati clinici potrebbero indicare infezioni, occlusioni nella derivazione oppure iperdrenaggio di LCR.
L’occlusione può verificarsi in uno qualsiasi dei componenti del sistema di derivazione. Il catetere ventricolare potrebbe essere occluso da materie particellari
quali coaguli ematici o frammenti cerebrali, dallo scontro della punta del catetere contro il plesso coroideo, dall’incastro del catetere nel tessuto cerebrale o
dal combaciamento delle pareti ventricolari in presenza di iperdrenaggio (“sindrome dei ventricoli a fessura”).
La coagulazione intorno alla parte atriale del catetere potrebbe dar luogo e embolizzazione nell’albero arterioso polmonare provocando cuore polmonare
e ipertensione polmonare.
I componenti della derivazione che si disinseriscono potrebbero spostarsi ulteriormente nel cuore o nella cavità peritoneale.
Le derivazioni potrebbero fallire a causa di un cattivo funzionamento meccanico, provocando ipodrenaggio o iperdrenaggio.
Il malfunzionamento o l’occlusione del sistema di derivazione può causare segni o sintomi indicativi di una aumentata pressione intracranica se
l’idrocefalo non riceve compensazione. Nei neonati i sintomi più comuni sono un aumento di tensione della fontanella anteriore, congestione delle vene
del cuoio capelluto, apatia, sonnolenza e irritabilità, vomito e rigidità della nuca. In bambini più grandi ed adulti si svilupperanno invece segni o sintomi
comunemente associati a un aumento della pressione intracranica, quali mal di testa, vomito, offuscamento della vista, rigidità della nuca, deterioramento
della conoscenza e vari reperti neurologici anomali.
L’iperdrenaggio di LCR potrebbe facilitare lo sviluppo di ematomi o igromi subdurali o il crollo delle pareti ventricolari laterali causando l’occlusione del
catetere ventricolare.
Se il catetere ventricolare si lega al plesso coroideo o al tessuto cerebrale adiacente mediante adesioni fibrose, si consiglia di non rimuoverlo con forza. Si
suggerisce invece una delicata rotazione del catetere, la cui rimozione può risultare facilitata. Si consiglia di lasciare il catetere in posizione piuttosto di
rischiare un’emorragia intraventricolare causata da una rimozione forzata.
Complicazioni
Fra le complicazioni direttamente associate all’uso dell’introduttore del catetere sottocutaneo monouso sono comprese la difficoltà di passaggio dello
strumento attraverso zone affette da cicatrici e l’eventuale formazione di ematomi.
Le complicazioni associate alle derivazioni ventricoloatriale e ventricoloperitoneale di LCR potrebbero essere analoghe a quelle sperimentate durante una
qualsiasi procedura chirurgica eseguita sotto anestesia locale e/o generale. Tali complicazioni includono eventuali reazioni a farmaci e agenti anestetici,
squilibrio elettrolitico e un’eccessiva perdita di sangue, soprattutto nel caso di neonati. Molto raramente si è verificato il caso in cui il paziente abbia una
reazione dovuta a sensibilità all’impianto.
Nei procedimenti di derivazione del liquido cerebrospinale, le complicazioni più comuni sono correlate all’occlusione del sistema, come descritto nella
sezione “Avvertenze” di questo foglietto illustrativo. L’occlusione può avvenire in qualsiasi componente del sistema, causata da frammenti cerebrali, coaguli
di sangue e/o aggregati di cellule tumorali, in un punto qualunque del percorso. Occlusioni possono verificarsi anche a seguito della separazione dei
componenti del sistema o dell’attorcigliamento e/o avvitamento del catetere. Ciò potrebbe facilitare lo spostamento del catetere ventricolare nel ventricolo
laterale e del catetere distale nel cuore o nell’albero arterioso polmonare, nel peritoneo o in altre strutture in cui il catetere viene impiantato. Come prima
menzionato, la crescita del neonato o del bambino può far sì che il catetere distale venga ritirato dall’atrio nella vena giugulare interna oppure dal peritoneo
negli strati dei tessuti dove il fluido non può essere assorbito.
Esistono altre potenziali, gravi complicazioni. Infezioni locali e sistemiche non sono infrequenti con gli interventi di derivazione. Le infezioni sono causate
il più delle volte da organismi residenti sulla pelle, in particolare lo Staphylococcus epidermidis. Tuttavia, altri agenti patogeni presenti nel circolo ematico
possono formare colonie nella derivazione; in tal caso, nella maggior parte dei pazienti, il sistema di derivazione deve essere rimosso.
Nel 1973 Robertson et al. riepilogarono l’incidenza di infezioni nelle derivazioni ventricoloatriale e ventricoloperitoneale manifestatesi fino a quel
momento. L’incidenza di infezione nelle derivazioni ventricoloatriali variava tra il 7 e il 31%. L’incidenza di infezioni nella derivazione ventricoloperitoneale
si era verificata nel 5-10% dei pazienti che figuravano nella maggior parte della documentazione. Dal momento che la derivazione ventricoloatriale facilita
lo sviluppo di batteri in altri organi, la derivazione ventricoloperitoneale viene considerata meno rischiosa.
Nel 1993 Kestle et al. hanno riportato un valore enormemente ridotto delle infezioni, ossia al di sotto del 4%, in seguito all’impiego di antibiotici, brevi
interventi chirurgici per esperienza del chirurgo e controllo dell’ambiente operatorio, per esempio una sala operatoria designata, personale e traffico limitati
e superfici del corpo coperte. In tale articolo gli autori affermano che si possono ottenere gli stessi risultati senza l’impiego di antibiotici ma con un rigoroso
controllo perioperatorio dell’ambiente.
La somministrazione di antibiotici profilattici ai pazienti con derivazione impiantata è un provvedimento alquanto controverso, in quanto tali farmaci
possono far insorgere infezioni causate da organismi normalmente più resistenti a queste infezioni. La decisione di somministrare antibiotici profilattici
viene lasciata pertanto alla discrezione del medico e/o del chirurgo che ha in cura il paziente.
La derivazione nel peritoneo può fallire a causa di coperture del catetere nelle anse dell’intestino o nel grande omento. È stato documentato il caso di
perforazioni dell’intestino da parte del catetere peritoneale con conseguente sviluppo di peritonite.
L’iperdrenaggio del liquido cerebrospinale può comportare un’eccessiva riduzione della pressione del liquido cerebrospinale e predisporre il paziente allo
sviluppo di ematoma o igroma subdurale e anche un’eccessiva riduzione del volume ventricolare con conseguente occlusione causata dalla lesione delle
pareti ventricolari sui fori d’entrata del catetere. Nei neonati, l’eccessiva riduzione della pressione causa una marcata depressione della fontanella anteriore,
con conseguente cessione delle ossa del cranio, con possibilità di trasformare l’idrocefalo da comunicante a ostruttivo.
Esiste la documentazione riguardante l’incidenza dei casi di epilessia manifestatisi dopo l’esecuzione di procedure di derivazione ventricolare. In questa
documentazione viene indicato che l’incidenza degli attacchi epilettici aumenta con le revisioni multiple di cateteri.
Restituzione
I prodotti devono essere restituiti nelle confezioni originali, con il sigillo del produttore intatto, e saranno sostituiti o verrà applicato un credito a meno
che il reso sia stato necessario a causa di difetto o errata etichettatura del prodotto. La determinazione di prodotto difettoso o di errata etichettatura sarà
effettuata dalla Medtronic Neurosurgery, la cui decisione sarà finale. I prodotti non saranno accettati per sostituzioni o credito se sono rimasti in possesso
del cliente per un periodo superiore a 90 giorni.
Garanzia
A. Garanzia standard limitata. La Medtronic Neurosurgery garantisce all’acquirente originale (“Acquirente”) che, al momento della consegna, l’allegato
prodotto impiantabile (“Prodotto”) è esente da difetti nei materiali e nella lavorazione. La Medtronic Neurosurgery non fa alcuna garanzia (esplicita,
implicita o di legge) per quei Prodotti che siano stati modificati (tranne i casi espressamente contemplati in questo documento) oppure sottoposti a
eccezionale stress fisico, abuso, uso improprio, negligenza, collaudo improprio, uso con prodotti o componenti diversi da quelli designati per l’uso con i
Prodotti, uso in qualsiasi maniera o procedura medica non indicata per i Prodotti.
B. Rimedio. In caso di rottura della garanzia sopra menzionata, l’unica ed esclusiva responsabilità a carico della Medtronic Neurosurgery e l’unico ed
esclusivo rimedio per l’Acquirente sarà, a scelta e discrezione esclusiva della Medtronic Neurosurgery, la sostituzione del Prodotto, oppure il rimborso
all’Acquirente della somma effettivamente pagata per il Prodotto, ammesso che (i) la Medtronic Neurosurgery venga avvisata, per iscritto ed entro
novanta (90) giorni dalla data del ricevimento del Prodotto da parte dell’Acquirente, che tale Prodotto non soddisfa i requisiti di garanzia, includendo
una dettagliata spiegazione in lingua inglese di tutti i difetti asseriti; (ii) tale Prodotto venga riconsegnato alla Medtronic Neurosurgery entro novanta
(90) giorni dal ricevimento F.O.B. del Prodotto da parte dell’Acquirente, all’indirizzo 125 Cremona Drive, Goleta, California, 93117, USA, o altro indirizzo
designato dalla Medtronic Neurosurgery; (iii) la Medtronic Neurosurgery sia ragionevolmente convinta della reale esistenza dei difetti dichiarati. Tranne
quanto espressamente previsto in questo paragrafo, l’Acquirente non avrà diritto di restituire i Prodotti alla Medtronic Neurosurgery senza la preventiva
approvazione scritta della Medtronic Neurosurgery.
C. Esclusione di altre garanzie. OLTRE ALLA GARANZIA LIMITATA DI CUI ALLA SEZIONE (A) SOPRA RIPORTATA, LA MEDTRONIC NEUROSURGERY
NON OFFRE ALCUN ALTRO TIPO DI GARANZIA O CONDIZIONE, ESPLICITA O IMPLICITA. LA MEDTRONIC NEUROSURGERY DISCONOSCE
SPECIFICATAMENTE LE GARANZIE IMPLICITE DI COMMERCIABILITÀ O IDONEITÀ A UN UTILIZZO PARTICOLARE. LA MEDTRONIC NEUROSURGERY
NON SI ASSUME NESSUN’ALTRA RESPONSABILITÀ, NÉ AUTORIZZA NESSUN’ALTRA PERSONA AD ASSUMERSELA A NOME DELLA MEDTRONIC
NEUROSURGERY, CHE INSORGA O SIA CONNESSA ALLA VENDITA O ALL’USO DI QUALSIASI PRODOTTO.
Kateterkoblinger
Beskrivelse
Kateterkobling, rett
Norsk
Kateterkobling, rett (fig. 1) er en nylonkobling, fremstilt til bruk med følgende produkter: Medtronic
Neurosurgery PS Medical hjerte-/peritonealkateter, Medtronic Neurosurgery PS Medical hjertekateter og
Medtronic Neurosurgery PS Medical peritonealkateter.
Kateterkobling, rettvinklet
Kateterkobling, rettvinklet (fig. 2) er en nylonkobling, fremstilt til bruk med Medtronic Neurosurgery PS Medical
ventrikkelkatetre.
Kateterkobling, 3-veis
Kateterkobling, 3-veis (fig. 3) er en kobling av polypropylen og silikonelastomer, fremstilt for sammenkobling
av to PS Medical ventrikkelkatetre til én Medtronic Neurosurgery’s PS Medical inngangskobling for CSFflowkontrollventil.
Bruksområder
Kateterkobling, rett
Kateterkobling, rett, er indisert når det kreves distal kateterrevisjon.
Kateterkobling, rettvinklet
Kateterkobling, rettvinklet, er indisert for å sette ventrikkelkateteret i 90° vinkel (nominelt) der det kommer ut
av et spiralbor- eller trepanasjonshull.
Kateterkobling, 3-veis
Kateterkobling, 3-veis, er indisert når to PS Medical ventrikkelkatetre er koblet til én PS Medical CSFflowkontrollventil.
Bruksanvisning
Den kirurgiske teknikken som foretrekkes ved bruk av kateterkoblinger er basert på kirurgens skjønn.
1
2
3
Subkutan kateterinnfører til engangsbruk
Beskrivelse
Engangs subkutane kateterinnførere er engangs kirurgiske
instrumenter. De består av tre komponenter:
1. Et rørformet skaft (60 cm langt eller 38 cm langt).
2. T-håndtak.
3. En obturator med kuleformet spiss.
Instrumentene er designet som bøyelige, subkutane
tunneleringsenheter for innføring av shuntkatetre for
cerebrospinalvæske. Modellen på 60 cm har passende lengde for de
fleste ventrikulo-periotoneale shuntprosedyrer. Modellen på 38 cm
har passende lengde for ventrikulo-periotoneale shuntprosedyrer på
små pasienter og for lumbo-periotoneale shuntprosedyrer.
Bruksområder
Subkutane kateterinnførere til engangsbruk brukes til å lage en subkutan tunnel og/eller posisjonere et rørskaft som skal brukes til plassering av en
peritoneal kateterkomponent i en cerebrospinalvæskeshunt. Modellen på 38 cm kan også brukes til plassering av en lumbo-peritoneal kateterkomponent i
Medtronic Neurosurgery PS Medical lumbo-peritoneale katetersystem.
Bruksanvisning
Den kirurgiske teknikken som foretrekkes ved bruk av engangs subkutane kateterinnførere er basert på kirurgens skjønn. Kirurgen anbefales å påse at
kateteret blir ført gjennom instrumentet før prosedyren starter.
Rørskaftet er bøyelig og kan formes for hånd av kirurgen, som indikert av operasjonsprosedyren. Når instrumentet føres inn subkutant, må obturatoren
settes inn i rørskaftet og festes til håndtaket ved å kneppe låsespissen på obturatoren på plass. Når obturatoren er ernet, kan kateteret føres for hånd
gjennom lumen på rørskaftet.
Obturatoren har også et kateterfeste for tilfesting av et distalt kateter med åpen ende. Tilfesting av kateteret på obturatoren gjør det mulig å trekke katetre
med passende innvendig diameter gjennom innføringsskaftet.
Levering
Medtronic Neurosurgery’s PS Medical kateterkoblinger og engangs subkutane kateterinnførere er pakket STERILE og IKKE-PYROGENE og er beregnet på å
brukes kun én gang (engangsbruk). MÅ IKKE RESTERILISERES. De skal ikke brukes hvis emballasjen har vært åpnet eller blitt skadet. Resterilisering kan
skade produktet og muligens føre til pasientskade. Medtronic Neurosurgery er ikke ansvarlig for ytelsen til noe produkt som er resterilisert.
Spesialbestilte produkter
Hvis denne bruksanvisningen leveres med et spesialbestilt produkt, kan det være fysiske forskjeller mellom produktet og produktbeskrivelsen i denne
bruksanvisningen. Disse forskjellene vil ikke ha innvirkning på sikkerheten eller effektiviteten for det spesialbestilte produktet. Spesialbestilte produkter kan
leveres sterile eller ikke-sterile. Dette angis på produktets pakkeetikett. Ikke-sterile produkter må rengjøres og steriliseres før bruk.
Kontraindikasjoner
Shunting av cerebrospinalvæske inn i høyre atrium, peritoneale hulrom, eller andre områder i kroppen, må ikke utføres hvis det er infeksjon på steder
der de ulike komponentene i shuntsystemet skal implanteres. Dette inkluderer infeksjoner i skalle eller andre hudområder shuntsystemet går gjennom,
hjernehinne og cerebrale ventrikler, peritoneum, intraperitoneale og retroperitoneale organer, plevra og blodstrøm. CSF-shunting er kontraindisert
hvis det er infeksjon noe sted i kroppen. Dessuten er shunting kontraindisert i atrium hos pasienter med medfødt hjertesykdom eller andre alvorlige
kardiopulmonære abnormaliteter.
Pasientopplæring
Det er legens ansvar å informere pasienten og/eller pasientens omsorgsperson(er) om CSF-shunting. Dette må inkludere en beskrivelse av komplikasjonene
i forbindelse med implanterbare shuntsystemer, samt en beskrivelse av mulige alternative produkter og behandlingsformer.
Advarsler og forholdsregler
Passende produkt, størrelse, trykk eller bruksområde må velges i henhold til hver enkelt pasients behov, basert på undersøkelser og legens erfaring.
Produktets etikett spesifiserer det aktuelle produktets bruksnivå eller -områder.
Gjentatt håndtilpassing av den subkutane kateterinnføreren kan svekke skaftet og føre til brekkasje mens det er i bruk.
Skarpe kanter som følge av endringer eller skade på den subkutane kateterinnføreren kan ha ugunstig virkning på katetre som føres gjennom instrumentet.
Implanterbare produkter må ikke komme i kontakt med lo, hansketalkum, oljerester fra hud, oljebaserte såper, syntetiske rengjøringsmidler eller andre
kontamineringsmidler.
Feil håndtering eller uriktig bruk av instrumenter ved implantering av shuntprodukter, kan føre til at komponentene får kutt, snitt, eller blir knust eller
brekker. Slik skade kan ødelegge shunter og gjøre det nødvendig å foreta prematur kirurgisk revisjon av shuntsystemet.
Påse at partikkelkontaminanter ikke kommer inn i shuntkomponentene under pre-implantasjonstesting eller -håndtering. Tilførsel av kontaminanter
kan resultere i sviktende ytelse (overdrenasje eller underdrenasje) i shuntsystemet. Partikler som kommer inn i shuntsystemet kan også holde
kontrollmekanismene for trykk og flow åpne og medføre overdrenering.
For å feste ventrikkel- og distale katetre til ventilkoblingene, må båndene som omgir slangen festes godt, men ikke for stramt, ellers kan de kutte gjennom
silikonslangen.
Påse at innføringen foregår på en måte som hindrer knekk og unødig slitasje på katetrene. Kanten på spiralbor- eller trepanasjonshullet kan trimmes til et
skråkantet hakk der ventrikkelkateteret kommer ut og er kurvet slik at det kan ligge tett inn til skallen.
Pasienter med hydeocephalus-shuntsystemer må observeres nøye i den postoperative perioden for tegn eller symptomer på shuntsvikt. Kliniske funn kan
være indikasjon på infeksjon, shuntblokkering eller overdrenasje av CSF.
Shuntblokkering kan forekomme i alle komponenter i shuntsystemet. Ventrikkelkateteret kan blokkeres av partikler, for eksempel blodklumper eller
hjernefragmenter, ved å sette kateterspissen i choroid plexus, ved å plassere kateteret i hjernemasse eller ved sammenføying av ventrikkelveggene ved
overdrenasje (“slit ventricle”).
Koagulering rundt den atriale delen av kateteret kan føre til embolisering av pulmonalarterietreet og føre til cor pulmonale og lungehypertensjon.
Frakoblede shuntkomponenter kan migrere inn i hjertet eller inn i peritonealhulrommet.
Shuntsystemer kan svikte på grunn av mekanisk svikt og føre til underdrenasje eller overdrenasje.
Svikt eller blokkering i shuntsystemet kan føre til tegn eller symptomer på økt intrakranialt trykk hvis hydrokefali ikke blir kompensert. Hos barn er
det vanlig å finne økt spenning i anterior fontanell, økt blodansamling i skallevener, sløvhet, døsighet og irritabilitet, oppkast og nakkestivhet. Eldre
barn og voksne kan utvikle tegn og symptomer som vanligvis assosieres med økt intrakranialt trykk, for eksempel hodepine, oppkast, synsforstyrrelser,
nakkestivhet, bevissthetssvikt og varierende unormale nevrologiske tegn.
Overdrenasje av CSF kan føre til predisponering for subduralt hematom eller hygrom eller sammenfall av laterale ventrikkelvegger, som fører til blokkering
av ventrikkelkateteret.
Hvis ventrikkelkateteret blir bundet til choroid plexus eller tilleggende hjernevev ved fibrøs adhesjon, anbefales det ikke å erne kateteret med makt.
Forsiktig rotasjon av kateteret kan være en hjelp til å erne det. Det tilrådes å la kateteret sitte på plass i stedet for å risikere intraventrikulær blødning,
som kan forekomme hvis kateteret ernes med makt.
Komplikasjoner
Komplikasjoner assosiert med bruk av engangs subkutan kateterinnfører er for eksempel vanskelighet med å sette inn instrumentet gjennom arrvev, samt
mulig hematomdannelse.
Komplikasjoner assosiert med ventrikuloatriale og ventrikuloperiotoneale CSF-shuntingsystemer kan ligne på komplikasjoner som kan opptre i kirurgiske
prosedyrer utført under lokal og/eller generell anestesi. Disse inkluderer reaksjoner mot medikamenter og anestesimidler, elektrolyttubalanse og stort
blodtap, spesielt hos barn. En pasient vil sjelden ha reaksjoner på grunn av ømfintlighet overfor implantatet.
Under CSF-shuntingprosedyrer er de mest vanlige komplikasjonene et resultat av obstruksjon av systemet som beskrevet under Advarsler. Obstruksjon kan
forekomme i alle komponentene i systemet som følge av blokkering med hjernefragmenter, blodklumper og/eller tumorcelleaggregater i innføringsbanen.
Obstruksjoner kan også oppstå på grunn av separasjon i systemkomponentene eller knekk og/eller kveiling av kateteret. Dette kan predisponere
ventrikkelkateteret for migrering inn i den laterale ventrikkelen og det distale kateteret inn i hjertet og det pulmonalarterietreet, peritoneum eller andre
strukturer der kateteret implanteres. Som nevnt tidligere, kan spedbarnets eller barnets vekst føre til at det distale kateteret trekkes ut av atrium og inn i
den interne halsblodåren eller fra peritoneum og inn i vevsplan der væsken ikke kan absorberes.
Det kan forekomme andre potensielt alvorlige komplikasjoner. Lokale og systemiske infeksjoner er ikke uvanlig i shuntingsprosedyrer. De oppstår vanligvis
av organismer som angriper huden, spesielt staphylococcus epidermidis. Andre patogener som sirkulerer i blodstrømmen kan kolonisere shunten og må
ernes hos de fleste pasienter.
I 1973 oppsummerte Robertson et al. insidensraten for infeksjoner i ventriculoatriale og ventriculoperitoneale shunter opp til den tid. Insidensraten for
infeksjoner i ventriculoatrial shunting varierte fra 7 til 31 %. I de fleste rapportene oppstod infeksjoner i ventriculoperitoneal shunting hos 5 til 10 % av
pasientene. Siden ventriculoatrial shunting predisponerer for spredning av bakterier til andre organer, er ventriculoperitoneal shunting betraktet som
mindre ødeleggende.
I 1993 rapporterte Kestle et al. signifikant reduksjon i infeksjoner (under 4 %) ved bruk av antibiotika, kort operasjonstid (kirurgisk erfaring) og kontroll av
miljøet i operasjonsrommet (for eksempel designerte operasjonsrom, begrenset personell og trafikk, tildekking av hudflater). Artikkelen hevder at disse
resultatene også kan oppnås uten bruk av antibiotika, men med streng perioperativ kontroll over miljøet.
Bruk av profylaktisk antibiotika i shuntpasienter er noe kontroversielt, fordi bruken kan predisponere for infeksjon av mer resistente organismer.
4
Polypropylenhåndtak
Skaft av rustfritt stål
Kateterkobling (låsespiss)
Obturatorspiss av
polypropylen
 Loading...
Loading...