Page 1

Avalus™ 400
2797
Bioprosthesis
Биопротеза
Bioprotéza
Bioprotese
Bioprothese
Βιοπρόσθεση
Bioprótesis
Bioprotees
Bioproteesi
Bioprothèse
Bioproteza
Biológiai műbillentyű
Bioprotesi
Bioprotezas
Bioprotēze
Биопротеза
Bioprothese
Biologisk protese
Bioproteza
Bioprótese
Bioprótese
Bioproteză
Биологический протез
Bioprotéza
Bioproteza
Bioproteza
Biologisk klaffprotes
Biyoprotez
Біопротез
Instructions for Use • Инструкции за употреба • Návod k použití • Brugsanvisning • Gebrauchsanweisung • Οδηγίες χρήσης •
Instrucciones de uso • Kasutusjuhend • Käyttöohjeet • Mode d'emploi • Upute za upotrebu • Használati útmutató • Istruzioni per
l'uso • Naudojimo instrukcijos • Lietošanas pamācība • Упатство за употреба • Gebruiksaanwijzing • Bruksanvisning • Instrukcja
użytkowania • Instruções de utilização • Instruções de utilização • Instrucțiuni de utilizare • Инструкция по эксплуатации • Pokyny
na používanie • Navodila za uporabo • Uputstva za upotrebu • Bruksanvisning • Kullanım Talimatları • Інструкція з використання
Page 2

Medtronic, Medtronic with rising man logo, and Medtronic logo are trademarks of Medtronic. Third-party trademarks (“TM*”) belong to their respective owners. The
following list includes trademarks or registered trademarks of a Medtronic entity in the United States and/or in other countries.
Medtronic, Medtronic с логото с изправящ се човек и логото на Medtronic са търговски марки на Medtronic. Търговските марки на трети страни („TM*“)
принадлежат на съответните им собственици. Списъкът по-долу включва търговски марки или регистрирани търговски марки на юридическо лице на
Medtronic в САЩ и/или в други държави.
Medtronic, Medtronic s logem se vstávající postavou a logo Medtronic jsou ochrannými známkami společnosti Medtronic. Značky třetích stran („TM*“) jsou ochrannými
známkami příslušných vlastníků. Následující seznam obsahuje ochranné známky nebo registrované ochranné známky obchodní jednotky společnosti Medtronic
v USA a/nebo v jiných zemích.
Medtronic, Medtronic-logoet med en person, der rejser sig op og Medtronic-logoet er varemærker tilhørende Medtronic. Tredjepartsvaremærker (“TM*”) tilhører deres
respektive ejere. Følgende liste indeholder varemærker eller registrerede varemærker tilhørende en Medtronic virksomhed i USA og/eller i andre lande.
Medtronic, das Medtronic Logo „Rising Man“ und das Medtronic Logo sind Marken von Medtronic. Die Marken Dritter („TM*“) sind Eigentum ihrer jeweiligen Inhaber.
Die folgende Liste enthält Marken oder eingetragene Marken einer Medtronic Gesellschaft in den USA und/oder in anderen Ländern.
Το Medtronic, το λογότυπο της Medtronic με τον εγειρόμενο άνθρωπο και το λογότυπο Medtronic είναι εμπορικά σήματα της Medtronic. Τα εμπορικά σήματα τρίτων
(«TM») ανήκουν στους αντίστοιχους κατόχους τους. Η ακόλουθη λίστα περιλαμβάνει εμπορικά σήματα ή σήματα κατατεθέντα μιας εταιρείας της Medtronic στις
Ηνωμένες Πολιτείες ή/και σε άλλες χώρες.
Medtronic, el logotipo de Medtronic con la figura de una persona levantándose y el logotipo de Medtronic son marcas comerciales de Medtronic. Las marcas de
terceros (“TM*”) son marcas comerciales de sus respectivos propietarios. La siguiente lista incluye marcas comerciales o marcas comerciales registradas de una
entidad de Medtronic en Estados Unidos o en otros países.
Medtronic, Medtronic koos tõusva inimese logoga ja ettevõtte Medtronic logo on ettevõtte Medtronic kaubamärgid. Kolmandate isikute kaubamärgid („TM*“) kuuluvad
nende vastavatele omanikele. Järgmine loend sisaldab ettevõtte Medtronic kaubamärke või registreeritud kaubamärke Ameerika Ühendriikides ja/või teistes riikides.
Medtronic, Medtronic ja nouseva mies -logo ja Medtronic-logo ovat Medtronic-yhtiön tavaramerkkejä. Kolmansien osapuolien tavaramerkit (”TM*”) ovat niiden
omistajien omistuksessa. Seuraavassa luettelossa ovat jonkin Medtronic-yhtiön tavaramerkit tai rekisteröidyt tavaramerkit Yhdysvalloissa ja/tai muissa maissa.
Medtronic, Medtronic avec le logo de l'homme qui se relève et le logo Medtronic sont des marques commerciales de Medtronic. Les marques commerciales tierces
(“TM*”) appartiennent à leurs détenteurs respectifs. La liste suivante comprend des marques commerciales ou des marques déposées d'une entité Medtronic aux
États-Unis et/ou dans d'autres pays.
Medtronic, Medtronic s logotipom uspravnog čovjeka i logotip tvrtke Medtronic žigovi su tvrtke Medtronic. Žigovi trećih strana (“TM*”) pripadaju njihovim vlasnicima.
Sljedeći popis uključuje žigove ili registrirane žigove tvrtke Medtronic u SAD-u i/ili u drugim zemljama.
A Medtronic szó, a felemelkedő embert ábrázoló logóval kiegészített Medtronic szó és a Medtronic logó a Medtronic védjegye. A harmadik felek védjegyei ("TM*") az
adott tulajdonosok védjegyei. A következő felsorolás a Medtronic vállalat védjegyeit vagy bejegyzett védjegyeit tartalmazza az Amerikai Egyesült Államokra és/vagy
más országokra vonatkozóan.
Medtronic, l'indicazione Medtronic con la rappresentazione grafica del logo e il logo Medtronic sono marchi di fabbrica di Medtronic. I nomi commerciali di parti terze
("TM*") appartengono ai rispettivi proprietari. L'elenco seguente comprende i marchi o i marchi registrati di un'azienda Medtronic negli Stati Uniti e/o, in altri Paesi.
„Medtronic“, „Medtronic“ su atsistojančio vyro logotipu ir „Medtronic“ logotipas yra „Medtronic“ prekių ženklai. Trečiųjų šalių prekių ženklai („TM*“) priklauso
atitinkamiems jų savininkams. Toliau pateikti bendrovės „Medtronic“ prekių ženklai arba registruotieji prekių ženklai JAV ir (arba) kitose šalyse.
Medtronic, Medtronic logotips ar augšāmcēlušos cilvēku un Medtronic logotips ir uzņēmuma Medtronic preču zīmes. Trešo pušu preču zīmes (“™*”) pieder to
attiecīgajiem īpašniekiem. Tālāk sarakstā ir norādītas ASV un/vai citās valstīs reģistrētas Medtronic uzņēmuma preču zīmes.
Medtronic, логото Medtronic со човек што станува и логото Medtronic се трговски марки на Medtronic. Трговските марки на трети лица (“™*”) им припаѓаат
на соодветните сопственици. Следниот список содржи трговски марки или регистрирани трговски марки на субјектот Medtronic во САД и/или во други
земји.
Medtronic, het Medtronic-logo met de opstaande mens, en het Medtronic-logo zijn handelsmerken van Medtronic. Handelsmerken van derden (“TM*”) zijn eigendom
van de desbetreffende eigenaren. Onderstaande termen zijn gedeponeerde of geregistreerde handelsmerken van een Medtronic-entiteit in de Verenigde Staten en/of
in andere landen.
Medtronic, Medtronic-logoen med mannen som reiser seg opp, og Medtronic-logoen er varemerker for Medtronic. Tredjeparters varemerker (“TM*”) tilhører de
respektive eierne. Den følgende listen inneholder varemerker eller registrerte varemerker for en Medtronic-enhet i USA og/eller i andre land.
Medtronic, logo firmy Medtronic z podnoszącym się człowiekiem i logo Medtronic są znakami towarowymi firmy Medtronic. Znaki towarowe podmiotów trzecich (“TM*”)
należą do ich właścicieli. Poniższa lista zawiera znaki towarowe lub zastrzeżone znaki towarowe podmiotu firmy Medtronic w Stanach Zjednoczonych i/lub w innych
krajach.
Medtronic, o logotipo da Medtronic com a figura do homem se levantando e o logotipo da Medtronic são marcas comerciais da Medtronic. As marcas comerciais de
terceiros (“TM*”) pertencem a seus respectivos proprietários. A lista a seguir inclui marcas comerciais ou marcas comerciais registradas de uma entidade da
Medtronic nos Estados Unidos e/ou em outros países.
Medtronic, o logótipo da Medtronic com homem a elevar-se e o logótipo da Medtronic são marcas comerciais da Medtronic. As marcas comerciais de terceiros (“TM*”)
pertencem aos respetivos proprietários. A lista seguinte inclui marcas comerciais ou marcas comerciais registadas de uma entidade da Medtronic nos Estados Unidos
e/ou noutros países.
Medtronic, sigla Medtronic cu omul care se ridică și sigla Medtronic sunt mărci comerciale ale Medtronic. Mărcile comerciale terțe („TM*”) aparțin deținătorilor lor
respectivi. Lista următoare include mărci comerciale sau mărci comerciale înregistrate ale unei entități Medtronic în Statele Unite și/sau în alte țări.
Medtronic, логотип Medtronic с изображением человека, принимающего вертикальное положение, и логотип Medtronic являются торговыми марками /
товарными знаками компании Medtronic. Торговые марки сторонних производителей, отмеченные символом "TM*", являются собственностью
соответствующих владельцев. Следующий перечень включает торговые марки или зарегистрированные товарные знаки компании Medtronic в США и /
или в других странах.
Medtronic, logo Medtronic so vstávajúcim človekom a logo Medtronic sú ochranné známky spoločnosti Medtronic. Ochranné známky tretích strán („TM*“) patria ich
príslušným vlastníkom. Nasledujúci zoznam obsahuje ochranné známky alebo registrované ochranné známky organizačnej jednotky spoločnosti Medtronic
v Spojených štátoch a/alebo v iných krajinách.
Medtronic, logotip družbe Medtronic z osebo, ki vstaja, ter logotip Medtronic so blagovne znamke družbe Medtronic. Blagovne znamke tretjih oseb (“TM*”) so last
njihovih lastnikov. Na spodnjem seznamu so navedene blagovne znamke ali registrirane blagovne znamke družbe Medtronic v Združenih državah Amerike in/ali drugih
državah.
Naziv Medtronic, logotip Medtronic sa čovekom koji se podiže i logotip Medtronic zaštitni su znaci kompanije Medtronic. Zaštitni znakovi trećih lica („TM*”) pripadaju
svojim vlasnicima. Sledeća lista uključuje zaštićene znakove ili registrovane zaštićene znakove preduzeća Medtronic, pravnog lica u SAD i/ili u drugim zemljama.
Page 3

Medtronic, Medtronic-logotypen med mannen som reser sig upp och Medtronic-logotypen är varumärken som tillhör Medtronic. Tredje parters varumärken (”TM*”)
tillhör sina respektive ägare. Följande lista omfattar varumärken eller registrerade varumärken som tillhör ett Medtronic-företag i USA och/eller i andra länder.
Medtronic, ayağa kalkan adamlı Medtronic logosu ve Medtronic logosu Medtronic şirketinin ticari markalarıdır. Üçüncü taraf ticari markaları (“TM*”) ilgili sahiplerinin
mülkiyetindedir. Aşağıdaki listede, bir Medtronic şirketinin Amerika Birleşik Devletleri ve/veya diğer ülkelerdeki ticari markaları veya tescilli ticari markaları
bulunmaktadır.
Medtronic, логотип Medtronic з людиною, що піднімається, і Medtronic є торговими марками компанії Medtronic. Торгові марки сторонніх виробників (“TM*”)
є майном відповідних власників. Подальший перелік містить товарні знаки або зареєстровані товарні знаки компанії Medtronic у Сполучених Штатах і/або
в інших країнах.
AOA™, Avalus™
Page 4

Explanation of symbols on package labeling • Обяснение на символите от етикетите на опаковката • Vysvětlení
symbolů uvedených na štítcích balení • Forklaring til symbolerne på emballagens mærkater • Erläuterung der Symbole
auf der Verpackung • Επεξήγηση των συμβόλων στη σήμανση της συσκευασίας • Explicación de los símbolos que
aparecen en la documentación del envase • Pakendi siltidel olevate tingmärkide tähendus • Pakkausetiketin symbolien
selitykset • Explication des symboles des étiquettes sur l’emballage • Objašnjenje simbola na ambalažnoj etiketi • A
csomag címkéin látható szimbólumok jelentése • Spiegazione dei simboli presenti sulle etichette della confezione •
Pakuotės etiketėse nurodytų simbolių reikšmės • Uz iepakojuma etiķetes attēloto simbolu skaidrojums • Објаснување на
симболите од етикетата на пакувањето • Verklaring van de symbolen op de verpakkingslabels • Forklaring av symboler
på pakningen • Objaśnienie symboli znajdujących się na etykietach opakowania • Explicação dos símbolos nas etiquetas
da embalagem • Explicação dos símbolos na documentação da embalagem • Legenda simbolurilor cuprinse în etichetele
de pe ambalaj • Пояснение к символам на этикетках упаковки • Vysvetlivky k symbolom na označení balenia • Razlaga
simbolov na embalaži • Objašnjenje simbola na oznakama na pakovanju • Förklaring av symboler på
förpackningsmärkningen • Ambalaj etiketindeki sembollerin açıklamaları • Пояснення символів на маркуванні
упаковки
Refer to the device labeling to see which symbols apply to this product. • Направете справка с етикета на устройството, за да
видите кои символи се отнасят за този продукт. • Symboly, které se vztahují k tomuto výrobku, naleznete na štítcích obalu. • Se
enhedens mærkater for de symboler, der gælder for dette produkt. • Welche Symbole für dieses Produkt zutreffen, entnehmen Sie
bitte der Produktbeschriftung. • Ανατρέξτε στη σήμανση του προϊόντος για να δείτε ποια σύμβολα ισχύουν για το παρόν προϊόν. •
Consulte la documentación del dispositivo para comprobar qué símbolos se utilizan con este producto. • Toote puhul kehtivad
sümbolid leiate seadme siltidelt. • Katso laitteen etiketistä, mitkä symbolit koskevat tätä tuotetta. • Se référer aux étiquettes sur
l’appareil pour savoir quels symboles s’appliquent à ce produit. • Na oznakama na uređaju pogledajte koji se simboli odnose na ovaj
proizvod. • A termékre vonatkozó szimbólumok az eszköz címkéin találhatók. • Fare riferimento alle etichette presenti sul dispositivo
per individuare i simboli relativi a questo prodotto. • Norėdami sužinoti, kokiu simboliu pažymėtas gaminys, žiūrėkite į pakuotės
etiketę. • Skatiet etiķetes uz ierīces, lai redzētu, kādi simboli attiecas uz šo izstrādājumu. • Проверете ја етикетата на помагалото
за да видите кои симболи се однесуваат на овој производ. • Controleer het productlabel om te zien welke symbolen op dit product
van toepassing zijn. • Se på etiketten på enheten for å fastslå hvilke symboler som gjelder for dette produktet. • Aby określić, które
symbole dotyczą niniejszego produktu, należy zapoznać się z etykietami urządzenia. • Consulte a documentação do dispositivo para
ver quais símbolos se aplicam a este produto. • Consulte a documentação do dispositivo para ver que símbolos se aplicam a este
produto. • Consultați eticheta dispozitivului pentru simbolurile aplicabile acestui produs. • См. на этикетках устройства, какие
символы применимы к данному продукту. • Prezrite si označenie zariadenia, aby ste zistili, ktoré symboly sa vzťahujú na tento
produkt. • Na nalepkah na embalaži so navedeni simboli, ki se nanašajo na ta izdelek. • Pogledajte spoljnu oznaku na pakovanju da
biste videli koji se simboli primenjuju na ovaj proizvod. • Se märkningen på enheten för de symboler som gäller denna produkt. • Bu
üründe hangi sembollerin geçerli olduğunu görmek için cihazın etiketlerine bakın. • Зверніться до маркування пристрою, щоб
визначити, які символи стосуються цього виробу.
4
Page 5

Conformité Européenne (European Conformity). This symbol means that the device fully complies with applicable
European Union acts. • Conformité Européenne (Европейско съответствие). Този символ означава, че устройството
съответства напълно на приложимото законодателство на Европейския съюз. • Conformité Européenne (Evropská
shoda). Tento symbol znamená, že výrobek zcela splňuje požadavky příslušných zákonů Evropské unie. • Conformité
Européenne (Europæisk Standard). Dette symbol betyder, at enheden fuldt ud overholder gældende EU-lovgivning. •
Conformité Européenne (Europäische Konformität). Dieses Symbol besagt, dass das Produkt allen anwendbaren
Vorschriften der Europäischen Union entspricht. • Conformité Européenne (Ευρωπαϊκή Συμμόρφωση). Το σύμβολο αυτό
σημαίνει ότι το προϊόν συμμορφώνεται πλήρως με τους ισχύοντες νόμους της Ευρωπαϊκής Ένωσης. • Conformité
Européenne (Conformidad Europea). Este símbolo indica que el dispositivo cumple totalmente las leyes vigentes de la
Unión Europea. • Conformité Européenne (Euroopa vastavusmärgis). See sümbol tähendab, et seade vastab täielikult
kohaldatavatele Euroopa Liidu seadustele. • Conformité Européenne (eurooppalainen vaatimustenmukaisuus). Tämä
symboli tarkoittaa, että laite on kaikilta osin Euroopan unionin soveltuvan lainsäädännön mukainen. • Conformité
Européenne. Ce symbole signifie que l’appareil est entièrement conforme aux lois en vigueur de l’Union européenne. •
Conformité Européenne (Usklađenost s europskim normama). Ovaj simbol znači da je uređaj potpuno usklađen s
odgovarajućim aktima Europske unije. • Conformité Européenne (európai megfelelőség). Ez a szimbólum azt jelenti, hogy
az eszköz teljes mértékben megfelel az Európai Unió vonatkozó jogszabályainak. • Conformité Européenne (Conformità
europea). Questo simbolo indica che il dispositivo è pienamente conforme alle direttive europee in vigore. • Conformité
Européenne (Europos atitiktis). Šis simbolis reiškia, kad prietaisas visiškai atitinka taikytinus Europos Sąjungos aktus. •
Conformité Européenne (atbilstība Eiropas Savienības prasībām). Šis simbols norāda, ka ierīce pilnībā atbilst
piemērojamo Eiropas Savienības tiesību aktu prasībām. • Conformité Européenne (Европска сообразност). Овој
симбол значи дека помагалото е целосно сообразно со важечките закони на Европската унија. • Conformité
Européenne (Europese Conformiteit). Dit symbool betekent dat het product volledig voldoet aan de geldende Europese
wetgeving. • Conformité Européenne (samsvar med europeisk standard). Dette symbolet betyr at enheten er fullstendig
i samsvar med gjeldende EU-rettsakter. • Conformité Européenne (Zgodność z normami Unii Europejskiej). Ten symbol
oznacza, że urządzenie spełnia wszystkie wymogi wynikające z właściwych aktów prawnych Unii Europejskiej. •
Conformité Européenne (Conformidade Europeia). Este símbolo significa que o dispositivo está em total conformidade
com as leis aplicáveis da União Europeia. • Conformité Européenne (Conformidade Europeia). Este símbolo significa que
o dispositivo está em total conformidade com as leis da União Europeia aplicáveis. • Conformité Européenne
(Conformitate europeană). Acest simbol atestă conformitatea deplină a dispozitivului cu legislația aplicabilă a Uniunii
Europene. • Conformité Européenne (Европейское соответствие). Этот символ обозначает, что устройство
полностью соответствует требованиям применимых директив Европейского Союза. • Conformité Européenne
(Zhoda s požiadavkami EÚ). Tento symbol znamená, že zariadenie je v úplnom súlade s platnými právnymi predpismi
Európskej únie. • Conformité Européenne (evropska skladnost). Ta simbol pomeni, da je pripomoček v celoti skladen z
veljavnimi zakoni Evropske unije. • Conformité Européenne (usklađenost sa evropskim standardima). Ovaj simbol
označava da je uređaj u potpunosti usklađen sa važećim zakonima Evropske unije. • Conformité Européenne (Europeisk
standard). Denna symbol anger att enheten uppfyller alla gällande direktiv i den Europeiska unionen. • Conformité
Européenne (Avrupa Normlarına Uygunluk). Bu sembol, cihazın yürürlükteki Avrupa Birliği yasalarına tam olarak uygun
olduğunu ifade eder. • Conformité Européenne (відповідність вимогам ЄС). Цей символ означає, що пристрій
повністю відповідає вимогам застосовних директив Європейського Союзу.
Do not reuse • Да не се използва повторно • Nepoužívejte opakovaně • Må ikke genbruges • Nicht wiederverwenden •
Μην επαναχρησιμοποιείτε • No reutilizar • Mitte kasutada korduvalt • Älä käytä uudelleen • Ne pas réutiliser • Nemojte
upotrebljavati više puta • Kizárólag egyszeri használatra • Non riutilizzare • Nenaudoti pakartotinai • Nelietot atkārtoti •
Само за еднократна употреба • Niet opnieuw gebruiken • Skal ikke brukes flere ganger • Nie stosować ponownie • Não
reutilizar • Não reutilizável • De unică folosință • Не использовать повторно • Nepoužívajte opakovane • Za enkratno
uporabo • Nije za ponovnu upotrebu • Får inte återanvändas • Yeniden kullanmayın • Не застосовувати повторно
Use-by date • Използвайте до • Datum použitelnosti • Kan anvendes til og med • Verwendbar bis • Ημερομηνία «Χρήση
έως» • Fecha de caducidad • Kõlblik kuni • Viimeinen käyttöpäivämäärä • Date de péremption • Rok upotrebe • Lejárati idő
• Utilizzare entro • Naudoti iki • Izmantot līdz • Употребливо до • Uiterste gebruiksdatum • Siste forbruksdag • Termin
przydatności do użycia • Data de vencimento • Utilizar antes da data • A se utiliza până la data de • Срок годности • Dátum
spotreby • Uporabno do • Datum „Upotrebljivo do“ • Utgångsdatum • Son kullanma tarihi • Термін придатності
5
Page 6

Sterile LC: Device has been sterilized using liquid chemical sterilants according to EN/ISO 14160 • Стерилно LC (Течно
химическо вещество): Устройството е стерилизирано с помощта на течни стерилизиращи химически вещества
в съответствие с EN/ISO 14160 • Sterilizace pomocí kapalných chemikálií: Výrobek byl sterilizován pomocí kapalných
chemických sterilizačních prostředků v souladu s normou EN/ISO 14160. • Steril LC: Enheden er steriliseret med kemisk
steriliseringsvæske i overensstemmelse med EN/ISO 14160 • Steril LC: Das Produkt wurde nach EN/ISO 14160 mit
flüssigen Chemikalien sterilisiert. • Αποστειρωμένο LC: Το προϊόν έχει αποστειρωθεί με υγρά χημικά μέσα
αποστείρωσης σύμφωνα με το πρότυπο EN/ISO 14160 • Estéril LC: El dispositivo se ha esterilizado con esterilizadores
químicos líquidos según la norma EN/ISO 14160 • Sterile LC: seade on steriliseeritud vedelate keemiliste
steriliseerimisvahenditega standardi EN/ISO 14160 kohaselt • Sterile LC: laite on steriloitu standardin EN/ISO 14160
mukaisilla nestemäisillä kemiallisilla sterilointiaineilla • Stérile LC : le dispositif a été stérilisé avec des produits chimiques
liquides stérilisants en conformité avec la norme EN/ISO 14160 • Sterilizirano LC-om: uređaj je steriliziran pomoću tekućih
kemijskih sredstava za steriliziranje u skladu s normom EN/ISO 14160 • Kémiai úton sterilizálva: Az eszközt folyékony
kémiai sterilizálószerekben sterilizálták az EN/ISO 14160 szabvány szerint. • Sterile LC: il dispositivo è stato sterilizzato
utilizzando sterilizzanti chimici liquidi in conformità alla norma EN/ISO 14160 • Sterilus LC: prietaisas sterilizuotas
naudojant skystas chemines sterilizavimo priemones pagal EN/ISO 14160 • Sterils LC: ierīce ir sterilizēta, izmantojot
šķidru ķīmiskās sterilizācijas līdzekli saskaņā ar standartu EN/ISO 14160. • Стерилно LC: Помагалото е стерилизирано
со течни хемиски стерилизатори во согласност со EN/ISO 14160 • Sterile LC: Product is gesteriliseerd met vloeibare
chemische sterilisatiemiddelen volgens EN/ISO 14160 • Sterile LC: Enheten har blitt sterilisert ved bruk av flytende,
kjemiske steriliseringsmidler i henhold til EN/ISO 14160 • Sterile LC: Urządzenie sterylizowane za pomocą ciekłych
chemicznych środków sterylizujących zgodnie z normą EN/ISO 14160 • LC estéril: o dispositivo foi esterilizado utilizando
esterilizantes químicos líquidos de acordo com a norma EN/ISO 14160 • Estéril LC: O dispositivo foi esterilizado por meio
de esterilizantes químicos líquidos de acordo com a norma EN/ISO 14160 • LC steril: dispozitivul a fost sterilizat cu agenți
chimici lichizi de sterilizare în conformitate cu EN/ISO 14160 • Стерилизовано ЖВ: устройство стерилизовано
жидкими химическими стерилизующими веществами в соответствии со стандартом EN/ISO 14160 • Chemicky
sterilizované kvapalinou: Zariadenie bolo sterilizované použitím kvapalných chemických sterilizačných látok v súlade
s normou EN/ISO 14160 • Sterile LC: Pripomoček je steriliziran s tekočimi kemičnimi sterilizacijskimi sredstvi v skladu s
standardom EN/ISO 14160 • LC sterilno: sredstvo je sterilizovano primenom tečnih hemijskih sredstava za sterilizaciju u
skladu sa standardom EN/ISO 14160 • Sterile LC: Enheten har steriliserats med flytande kemiska steriliseringsmedel
enligt EN/ISO 14160 • Steril Sıvı Kimyasal Madde: Cihaz, EN/ISO 14160’a uygun biçimde sıvı kimyasal sterilanlar
kullanılarak sterilize edilmiştir • Стерилізовано РР: пристрій стерилізовано рідкими хімічними стерилізуючими
речовинами відповідно до стандарту EN/ISO 14160
Temperature limit • Ограничение за температурата • Mezní hodnoty teploty • Temperaturgrænse • Temperaturbereich •
Όριο θερμοκρασίας • Limitación de temperatura • Temperatuuripiirang • Lämpötilaraja • Limite de température •
Ograničenje temperature • Hőmérsékleti határok • Limiti di temperatura • Temperatūros ribos • Temperatūras
ierobežojums • Ограничување на температурата • Temperatuurbereik • Temperaturgrense • Zakres temperatur • Limite
de temperatura • Limites de temperatura • Limită de temperatură • Температурный предел • Teplotný limit • Omejitev
temperature • Ograničenje temperature • Temperaturgräns • Sıcaklık limiti • Температурне обмеження
Size • Размер • Velikost • Størrelse • Größe • Μέγεθος • Tamaño • Suurus • Koko • Taille • Veličina • Méret • Dimensione •
Dydis • Lielums • Големина • Maat • Størrelse • Rozmiar • Dimensão • Tamanho • Dimensiune • Размер • Veľkosť • Velikost
• Veličina • Storlek • Boyut • Розмір
Serial number • Сериен номер • Sériové číslo • Serienummer • Seriennummer • Αριθμός σειράς • Número de serie •
Seerianumber • Sarjanumero • Numéro de série • Serijski broj • Sorozatszám • Numero di serie • Serijos numeris • Sērijas
numurs • Сериски број • Serienummer • Serienummer • Numer seryjny • Número de série • Número de série • Număr de
serie • Серийный номер • Sériové číslo • Serijska številka • Serijski broj • Serienummer • Seri numarası • Серійний номер
Catalog number • Каталожен номер • Katalogové číslo • Katalognummer • Katalognummer • Αριθμός καταλόγου •
Número de catálogo • Katalooginumber • Luettelonumero • Numéro de référence • Kataloški broj • Katalógusszám •
Numero di catalogo • Katalogo numeris • Kataloga numurs • Каталошки број • Catalogusnummer • Artikkelnummer •
Numer katalogowy • Número de catálogo • Número de catálogo • Număr de catalog • Номер по каталогу • Katalógové
číslo • Kataloška številka • Kataloški broj • Katalognummer • Katalog numarası • Номер у каталозі
Date of manufacture • Дата на производство • Datum výroby • Fabrikationsdato • Herstellungsdatum • Ημερομηνία
κατασκευής • Fecha de fabricación • Tootmiskuupäev • Valmistuspäivämäärä • Date de fabrication • Datum proizvodnje •
Gyártás ideje • Data di fabbricazione • Pagaminimo data • Ražošanas datums • Датум на производство •
Productiedatum • Produksjonsdato • Data produkcji • Data de fabricação • Data de fabrico • Data fabricării • Дата
изготовления • Dátum výroby • Datum izdelave • Datum proizvodnje • Tillverkningsdatum • Üretim tarihi • Дата
виготовлення
Manufacturer • Производител • Výrobce • Fabrikant • Hersteller • Κατασκευαστής • Fabricante • Tootja • Valmistaja •
Fabricant • Proizvođač • Gyártó • Fabbricante • Gamintojas • Ražotājs • Производител • Fabrikant • Produsent •
Producent • Fabricante • Fabricante • Producător • Изготовитель • Výrobca • Izdelovalec • Proizvođač • Tillverkare •
Üretici • Виробник
6
Page 7

MR Safe • МР безопасно • Bezpečné z hlediska magnetické rezonance • MR-sikker • MR-sicher • Ασφαλές για
μαγνητική τομογραφία (MR) • Seguro para RM • MR-ohutu • Turvallinen magneettikuvauksessa • Compatible avec la RM
• Sigurno za MR • MR szempontjából biztonságos • Dispositivo sicuro per la risonanza magnetica (RM) • MR saugus • MR
drošs • Безбедно за МР • MR Safe (MR-veilig) • MR-sikker • Bezpieczny w zastosowaniu z rezonansem magnetycznym •
Seguro para RM • Seguro para RM • Compatibil cu sisteme RM • Безопасно для МРТ • Bezpečné v prostredí MR • Varno
za uporabo pri MR • Bezbedno za korišćenje sa magnetnom rezonancom • MR-säker • MR Güvenli • Безпечно для
процедур МРТ
Quantity • Количество • Množství • Antal • Menge • Ποσότητα • Cantidad • Kogus • Määrä • Quantité • Količina •
Mennyiség • Quantità • Kiekis • Daudzums • Количина • Aantal • Antall • Ilość • Quantidade • Quantidade • Cantitate •
Количество • Množstvo • Količina • Količina • Antal • Miktar • Кількість
Nonpyrogenic • Непирогенно • Nepyrogenní • Ikke-pyrogen • Pyrogenfrei • Μη πυρετογόνο • Apirógeno •
Mittepürogeenne • Pyrogeeniton • Apyrogène • Nezapaljivo • Nem pirogén • Apirogeno • Nedegus • Nepirogēns •
Апирогено • Niet-pyrogeen • Pyrogenfri • Produkt niepirogenny • Não pirogênico • Não pirogénico • Apirogen •
Апирогенно • Nepyrogénne • Apirogeno • Nije pirogeno • Icke-pyrogen • Pirojenik Değildir • Апірогенно
Do not resterilize • Не стерилизирайте повторно • Neprovádějte resterilizaci • Må ikke resteriliseres • Nicht resterilisieren
• Μην επαναποστειρώνετε • No reesterilizar • Mitte steriliseerida uuesti • Älä steriloi uudelleen • Ne pas restériliser •
Nemojte iznova sterilizirati • Nem újrasterilizálható • Non risterilizzare • Nesterilizuokite pakartotinai • Nesterilizēt atkārtoti
• Да не се стерилизира повторно • Niet opnieuw steriliseren • Skal ikke resteriliseres • Nie sterylizować ponownie • Não
reesterilizar • Não reesterilizar • Nu resterilizați • Не стерилизовать повторно • Opakovane nesterilizujte • Ne sterilizirajte
znova • Nije za ponovnu sterilizaciju • Får inte omsteriliseras • Yeniden sterilize etmeyin • Не стерилізувати повторно
Do not use if indicator turns black • Не използвайте, ако индикаторът е станал черен • Nepoužívejte, pokud je indikátor
černý • Må ikke anvendes, hvis indikatoren bliver sort • Nicht verwenden, wenn sich der Indikator schwarz verfärbt hat •
Μην το χρησιμοποιείτε εάν η ένδειξη γίνει μαύρη • No utilizar si el indicador cambia a color negro • Mitte kasutada, kui
indikaator muutub mustaks • Älä käytä, jos ilmaisimen väri muuttuu mustaksi • Ne pas utiliser si l’indicateur devient noir •
Nemojte upotrebljavati ako indikator postane crne boje • Nem használható, ha az indikátor színe feketére változik • Non
utilizzare in caso di annerimento dell’indicatore • Nenaudoti, jei indikatorius juodos spalvos • Nelietot, ja indikators ir melnā
krāsā • Да не се користи ако поцрни показателот • Niet gebruiken als de indicator zwart wordt • Må ikke brukes hvis
indikatoren blir svart • Nie stosować, jeśli wskaźnik ma kolor czarny • Não utilizar se o indicador ficar preto • Não utilizar
se o indicador ficar preto • Nu folosiți dacă indicatorul este negru • Не использовать, если индикатор стал черным •
Nepoužívajte, ak je farba indikátora čierna • Ne uporabljajte, če se kazalec obarva črno. • Ne koristiti ako indikator postane
crn • Får inte användas om indikatorn är svart • Gösterge siyaha dönerse kullanmayın • Не використовувати, якщо
індикатор став чорним
Authorized representative in the European Community • Упълномощен представител в Европейската общност •
Autorizovaný zástupce pro Evropské společenství • Autoriseret repræsentant i EF • Autorisierter Repräsentant in der
Europäischen Gemeinschaft • Εξουσιοδοτημένος αντιπρόσωπος στην Ευρωπαϊκή Κοινότητα • Representante
autorizado en la Comunidad Europea • Volitatud esindaja Euroopa Ühenduses • Valtuutettu edustaja Euroopan yhteisön
alueella • Représentant autorisé dans la Communauté européenne • Ovlašteni predstavnik u Europskoj zajednici •
Hivatalos képviselet az Európai Közösségben • Rappresentante autorizzato nella Comunità europea • Įgaliotasis atstovas
Europos Bendrijoje • Pilnvarotais pārstāvis Eiropas Kopienā • Овластен претставник во Европската заедница •
Geautoriseerd vertegenwoordiger in de Europese Gemeenschap • Autorisert representant i Det europeiske fellesskap •
Autoryzowany przedstawiciel w Unii Europejskiej • Representante autorizado na Comunidade Europeia • Representante
autorizado na Comunidade Europeia • Reprezentant autorizat în Comunitatea Europeană • Уполномоченный
представитель в Европейском сообществе • Autorizovaný zástupca pre Európske spoločenstvo • Pooblaščeni
predstavnik v Evropski skupnosti • Ovlašćeni predstavnik u Evropskoj zajednici • Auktoriserad representant inom EG •
Avrupa Topluluğu’ndaki yetkili temsilci • Уповноважений представник у Європейському Співтоваристві
For US audiences only • Само за САЩ • Pouze pro uživatele z USA • Gælder kun i USA • Gilt nur für Leser in den USA •
Μόνο για πελάτες εντός των ΗΠΑ • Solo aplicable en EE. UU. • Ainult kasutajatele Ameerika Ühendriikides • Koskee vain
Yhdysvaltoja • Ne s’applique qu’aux États-Unis • Samo za američko tržište • Csak egyesült államokbeli felhasználóknak •
Esclusivamente per il mercato statunitense • Tik JAV naudotojams • Tikai pircējiem ASV • Наменето само за корисници
во САД • Alleen van toepassing voor de VS • Gjelder kun USA • Dotyczy tylko odbiorców w Stanach Zjednoczonych •
Aplicável apenas aos EUA • Aplicável apenas aos EUA • Numai pentru clienții din SUA • Только для США • Len pre
používateľov v USA • Samo za uporabnike v ZDA • Samo za korisnike u SAD • Gäller endast i USA • Yalnızca ABD’deki
kullanıcılar için • Лише для користувачів у США
Model • Модел • Model • Model • Modell • Μοντέλο • Modelo • Mudel • Malli • Modèle • Model • Típus • Modello • Modelis •
Modelis • Модел • Model • Modell • Model • Modelo • Modelo • Model • Модель • Model • Model • Model • Modell • Model •
Модель
7
Page 8

Figure 1. Location of sewing markers • Фигура 1. Местоположение на маркерите за зашиване • Obrázek 1. Umístění značek
pro stehy • Figur 1. Placering af symarkører • Abbildung 1. Position der Nahtmarkierungen • Εικόνα 1. Θέση δεικτών συρραφής •
Figura 1. Posición de las marcas de sutura • Joonis 1. Õmblusmarkerite asukoht • Kuva 1. Ommelmerkkien sijainti •
Figure 1. Emplacement des repères de suture • Sl. 1. Lokacija oznaka za šivanje • 1. ábra. Varrásjelölők • Figura 1. Posizione dei
marker di sutura • 1 pav. Žymeklių siuvimo vieta • 1. att. Šūšanas marķieru atrašanās vieta • Слика 1. Лоцирање на маркерите за
шиење • Afbeelding 1. Locatie van de hechtmarkeringen • Figur 1. Plassering av suturmarkører • Rycina 1. Lokalizacja znaczników
przyszywania • Figura 1. Localização dos marcadores de sutura • Figura 1. Localização dos marcadores de sutura •
Figura 1. Locația indicatorilor de fixare • Рисунок 1. Расположение шовных маркеров • Obrázok 1. Miesto našívacích značiek •
Slika 1. Lokacija šivalnih markerjev • Slika 1. Položaj markera za ušivanje • Figur 1. Suturmarkeringarnas placering • Şekil 1. Dikiş
belirteçlerinin yeri • Малюнок 1. Розташування шовних маркерів
Figure 2. Opening the valve container • Фигура 2. Отваряне на контейнера с клапата • Obrázek 2. Otevření nádoby s chlopní •
Figur 2. Åbning af klapbeholderen • Abbildung 2. Öffnen des Klappenbehälters • Εικόνα 2. Άνοιγμα του περιέκτη της βαλβίδας •
Figura 2. Apertura del envase de la válvula • Joonis 2. Klappi sisaldava mahuti avamine • Kuva 2. Läpän säilytysastian avaaminen •
Figure 2. Ouverture du conteneur de la valve • Sl. 2. Otvaranje spremnika sa zaliskom • 2. ábra. A billentyűtartály kinyitása •
Figura 2. Apertura del contenitore della valvola • 2 pav. Vožtuvo konteinerio atidarymas • 2. att. Vārstuļa tvertnes atvēršana •
Слика 2. Отворање на кутијата на залистокот • Afbeelding 2. De klepcontainer openen • Figur 2. Åpne beholderen med klaffen •
Rycina 2. Otwieranie pojemnika z zastawką • Figura 2. Abertura do recipiente da válvula • Figura 2. Abertura do recipiente da válvula
• Figura 2. Deschiderea cutiei valvulei • Рисунок 2. Открытие контейнера с клапаном • Obrázok 2. Otvorenie schránky
s chlopňou • Slika 2. Odpiranje vsebnika z zaklopko • Slika 2. Otvaranje pakovanja sa zaliskom • Figur 2. Klaffbehållaren öppnas •
Şekil 2. Kapak kabının açılması • Малюнок 2. Відкриття контейнера з клапаном
Figure 3. Removing the retainer from the jar • Фигура 3. Отстраняване на фиксатора от буркана • Obrázek 3. Vyjmutí nádržky
z nádoby • Figur 3. Fjernelse af beholderen fra glasset • Abbildung 3. Entnehmen des Trägers aus dem Behälter •
Εικόνα 3. Αφαίρεση του υποστηρίγματος από το δοχείο • Figura 3. Extracción del recipiente de retención del frasco •
Joonis 3. Fiksaatori eemaldamine purgist • Kuva 3. Kotelon poistaminen purkista • Figure 3. Retrait du récipient du bocal •
Sl. 3. Uklananje nosača iz posude • 3. ábra. A tégely kiemelése az üvegből • Figura 3. Rimozione del dispositivo di ritenuta dal
contenitore • 3 pav. Laikiklio išėmimas iš indo • 3. att. Aizsarga izņemšana no trauka • Слика 3. Вадење на прицврстувачот од
садот • Afbeelding 3. De koker uit de container halen • Figur 3. Fjerne den indre beholderen fra glasset • Rycina 3. Wyjmowanie
pojemnika wewnętrznego z pojemnika zewnętrznego • Figura 3. Remoção do retentor de dentro do recipiente • Figura 3. Remoção
do retentor de dentro do recipiente • Figura 3. Detașarea dispozitivului de retenție de pe flacon • Рисунок 3. Извлечение
фиксатора из контейнера • Obrázok 3. Vybratie vnútornej schránky z nádoby • Slika 3. Odstranjevanje držala iz vsebnika •
8
Page 9
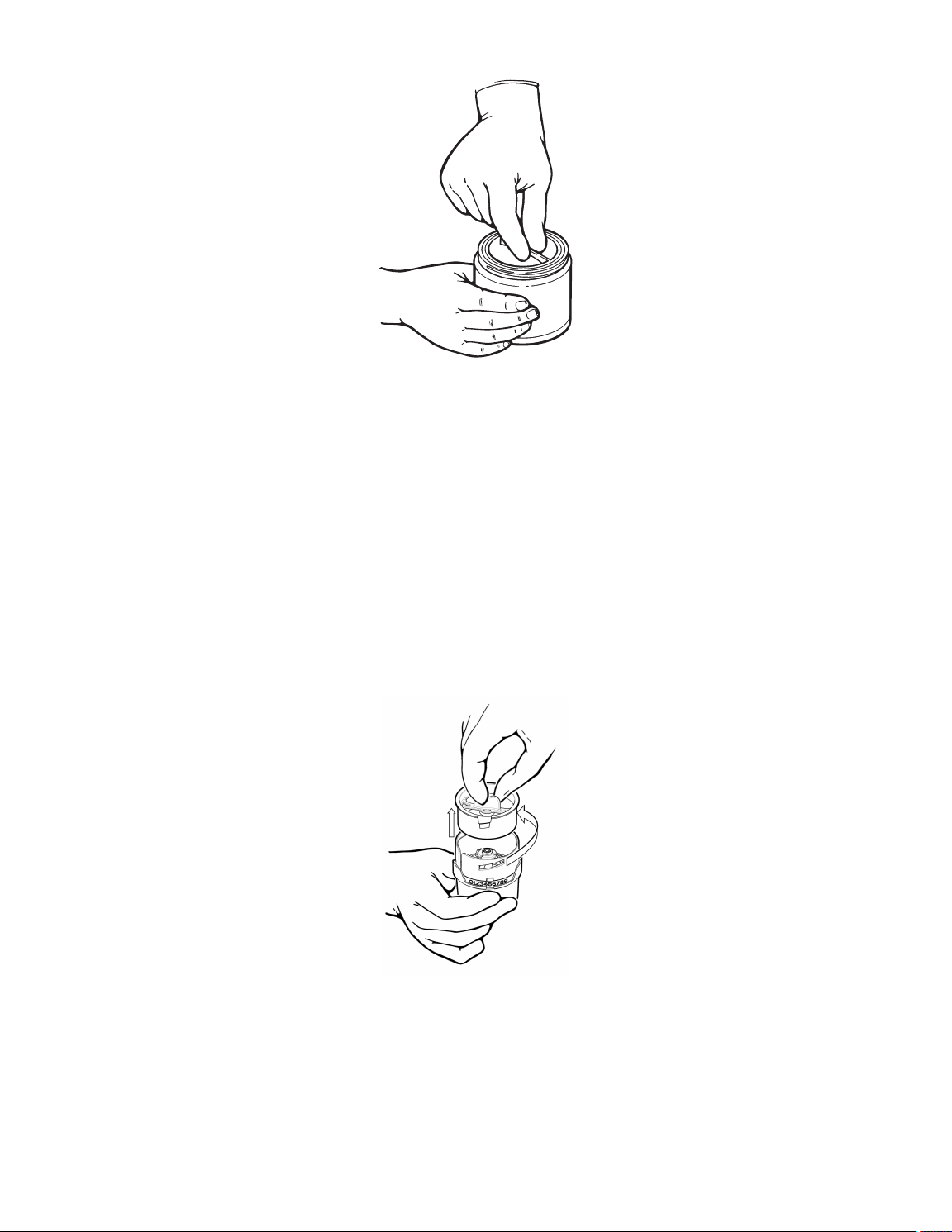
Slika 3. Vađenje čašice iz tegle • Figur 3. Den inre behållaren tas ut ur kärlet • Şekil 3. Koruyucunun kavanozdan çıkarılması •
Малюнок 3. Виймання фіксатора з контейнера
Figure 4. Verifying the serial number and removing the retainer cap • Фигура 4. Проверка на серийния номер и сваляне на
капачката на фиксатора • Obrázek 4. Ověření sériového čísla a odstranění uzávěru nádržky • Figur 4. Kontrol af serienummeret
og udtagning af den indvendige beholders hætte • Abbildung 4. Überprüfen der Seriennummer und Entfernen des Trägerdeckels •
Εικόνα 4. Επαλήθευση του αριθμού σειράς και αφαίρεση του πώματος του υποστηρίγματος • Figura 4. Verificación del número
de serie y extracción de la tapa del recipiente de retención • Joonis 4. Seerianumbri kindlakstegemine ja fiksaatori korgi
eemaldamine • Kuva 4. Sarjanumeron tarkistaminen ja kotelon kannen irrottaminen • Figure 4. Vérification du numéro de série et
retrait du couvercle du récipient • Sl. 4. Provjera serijskog broja i skidanje poklopca držača • 4. ábra. A sorozatszám ellenőrzése és
a tégely tetejének az eltávolítása • Figura 4. Verifica del numero di serie e rimozione del coperchio del dispositivo di ritenuta •
4 pav. Serijos numerio patikrinimas ir fiksatoriaus gaubto nuėmimas • 4. att. Sērijas numura pārbaude un aizsargvāciņa noņemšana •
Слика 4. Потврдување на серискиот број и вадење на капакот на прицврстувачот • Afbeelding 4. Het serienummer verifiëren
en de dop van de koker verwijderen • Figur 4. Kontrollere serienummeret og fjerne lokket på den indre beholderen •
Rycina 4. Sprawdzanie numeru seryjnego i zdejmowanie pokrywy zabezpieczenia • Figura 4. Verificação do número de série e
remoção da tampa do retentor • Figura 4. Verificação do número de série e remoção da tampa do retentor • Figura 4. Verificarea
numărului de serie și îndepărtarea capacului de retenție • Рисунок 4. Проверка серийного номера и удаление колпачка
фиксатора • Obrázok 4. Kontrola sériového čísla a odstránenie uzáveru vnútornej schránky • Slika 4. Preverjanje serijske številke
in odstranjevanje pokrovčka držala • Slika 4. Provera serijskog broja i uklanjanje poklopca držača • Figur 4. Serienumret verifieras
och locket på den inre behållarens tas bort • Şekil 4. Seri numarasının doğrulanması ve koruyucu kapakçığının çıkarılması •
Малюнок 4. Перевірка серійного номера і видалення ковпачка фіксатора
Figure 5. Inserting the valve handle into the holder • Фигура 5. Поставяне на дръжката за клапа в държача • Obrázek 5. Zasunutí
rukojeti chlopně do držáku • Figur 5. Isættelse af klaphåndtaget i holderen • Abbildung 5. Einführen des Herzklappenhandgriffs in
den Halter • Εικόνα 5. Εισαγωγή της λαβής της βαλβίδας στον συγκρατητήρα • Figura 5. Inserción del mango para válvulas en el
soporte • Joonis 5. Klapi käepideme sisestamine hoidikusse • Kuva 5. Läppäkahvan työntäminen pitimeen • Figure 5. Insertion du
manche pour valve dans le support • Sl. 5. Umetanje ručke zaliska u držač • 5. ábra. A billentyűnyél ráhelyezése a tartóra •
Figura 5. Inserimento del manico della valvola nel supporto • 5 pav. Vožtuvo rankenėlės įkišimas į laikiklį • 5. att. Vārstuļa roktura
ievietošana turētājā • Слика 5. Вметнување на рачката на залисокот во држачот • Afbeelding 5. Het klephandvat in de houder
inbrengen • Figur 5. Sette klaffehåndtaket inn i holderen • Rycina 5. Wkładanie rączki zastawki do uchwytu • Figura 5. Introdução
do manípulo de válvula no suporte • Figura 5. Introdução do manípulo da válvula no suporte • Figura 5. Introducerea mânerului de
valvulă în suport • Рисунок 5. Введение рукоятки клапана в держатель • Obrázok 5. Vloženie chlopňovej rukoväti do držiaka •
9
Page 10

Slika 5. Vstavljanje ročice zaklopke v držalo • Slika 5. Umetanje metalne ručice zaliska u držač • Figur 5. Klaffhandtaget förs in i
hållaren • Şekil 5. Kapak kolunun tutucuya takılması • Малюнок 5. Введення рукоятки клапана в тримач
Figure 6. Removing the valve from the retainer and placing it in the rinse basin • Фигура 6. Изваждане на клапата от фиксатора
и поставяне в съда за изплакване • Obrázek 6. Vyjmutí chlopně z nádržky a vložení do proplachovací misky • Figur 6. Udtagning
af klappen fra den indvendige holder og anbringelse af den i skylleskålen • Abbildung 6. Entnehmen der Herzklappe aus dem Träger
und Überführen in das Spülbecken • Εικόνα 6. Αφαίρεση της βαλβίδας από το υποστήριγμα και τοποθέτησή της στη λεκάνη
έκπλυσης • Figura 6. Extracción de la válvula del recipiente de retención y colocación de la válvula en la cubeta de enjuague •
Joonis 6. Klapi eemaldamine fiksaatorist ja asetamine loputusvanni • Kuva 6. Läpän poistaminen kotelosta ja asettaminen
huuhteluastiaan • Figure 6. Retrait de la valve du récipient et immersion dans le bac de rinçage • Sl. 6. Vađenje zaliska iz držača i
postavljanje u posudu za ispiranje • 6. ábra. A billentyű eltávolítása a tégelyből és öblítés • Figura 6. Rimozione della valvola dal
dispositivo di ritenuta e collocazione nella bacinella di risciacquo • 6 pav. Vožtuvo išėmimas iš fiksatoriaus ir įdėjimas į skalavimo
vonelę • 6. att. Vārstuļa izņemšana no aizsarga un ievietošana skalošanas traukā • Слика 6. Вадење на залистокот од
прицврстувачот и ставање на залистокот во садот за плакнење • Afbeelding 6. De klep uit de koker halen en in het spoelbad
plaatsen • Figur 6. Fjerne klaffen fra den indre beholderen og legge den i skylleskålen • Rycina 6. Wyjmowanie zastawki z
zabezpieczenia i umieszczanie jej w miseczce do płukania • Figura 6. Remoção da válvula do retentor e sua colocação na bacia de
lavagem • Figura 6. Remoção da válvula do retentor e colocação da mesma na bacia de lavagem • Figura 6. Scoaterea valvulei din
dispozitivul de retenție și așezarea acesteia în bazinul de clătire • Рисунок 6. Извлечение клапана из фиксатора и помещение
в емкость для промывки • Obrázok 6. Vybratie chlopne z vnútornej schránky a uloženie do preplachovacej misky •
Slika 6. Odstranjevanje zaklopke iz držala in odlaganje zaklopke v posodo za izpiranje • Slika 6. Uklanjanje zaliska iz držača i
smeštanje u posudu za ispiranje • Figur 6. Klaffen tas ut ur behållaren och placeras i sköljskålen • Şekil 6. Kapağın koruyucudan
çıkarılması ve durulama çanağına yerleştirilmesi • Малюнок 6. Виймання клапана з фіксатора і промивання в ємності для
промивання
Figure 7. Removing the holder • Фигура 7. Отстраняване на държача • Obrázek 7. Odstranění držáku • Figur 7. Udtagning af
holderen • Abbildung 7. Entfernen des Halters • Εικόνα 7. Αφαίρεση του συγκρατητήρα • Figura 7. Extracción del soporte •
Joonis 7. Hoidiku eemaldamine • Kuva 7. Pitimen irrottaminen • Figure 7. Retrait du support • Sl. 7. Uklanjanje držača • 7. ábra. A
tartó eltávolítása • Figura 7. Rimozione del supporto • 7 pav. Laikiklio nuėmimas • 7. att. Turētāja noņemšana •
Слика 7. Отстранување на држачот • Afbeelding 7. De houder verwijderen • Figur 7. Fjerne holderen • Rycina 7. Wyjmowanie
uchwytu • Figura 7. Remoção do suporte • Figura 7. Remoção do suporte • Figura 7. Scoaterea suportului •
10
Page 11
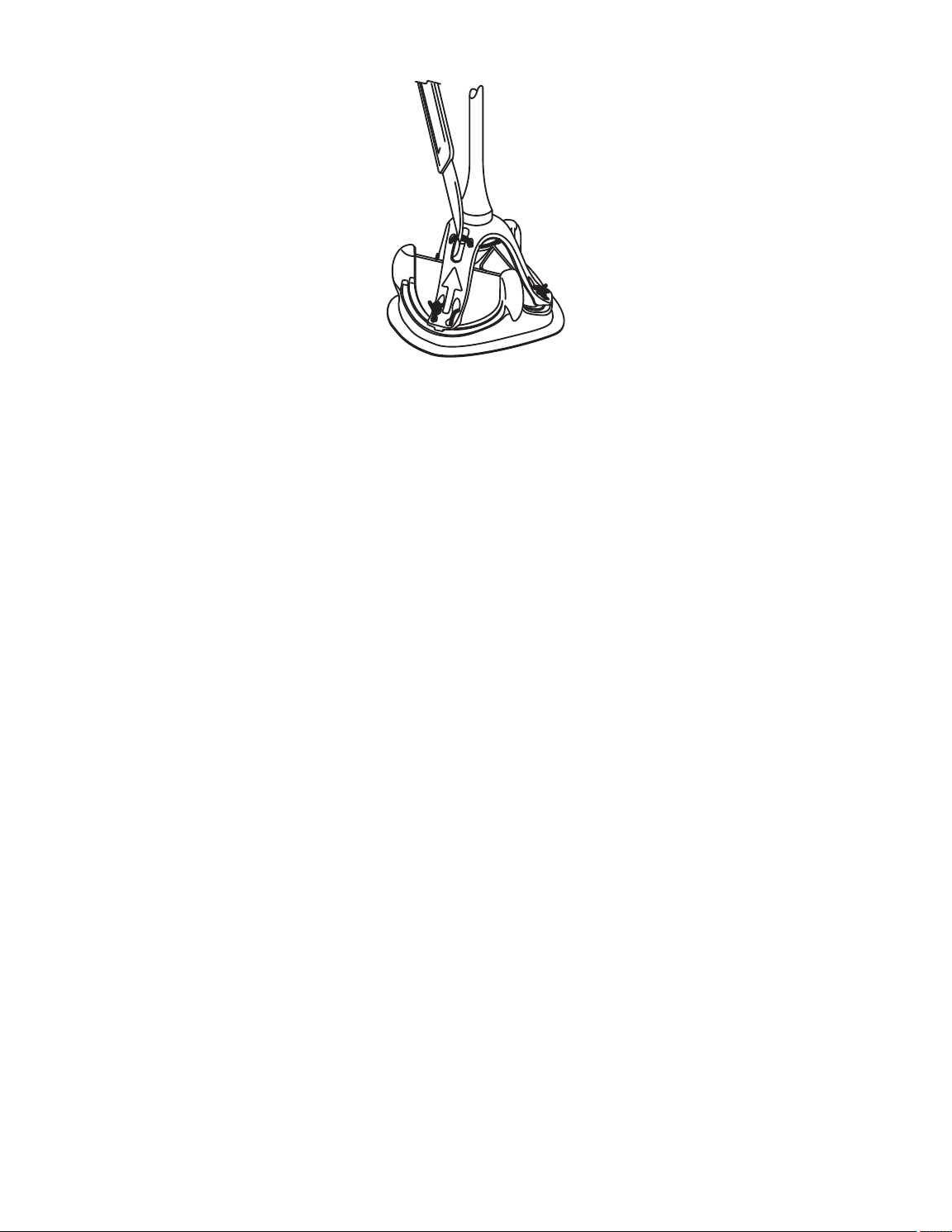
Рисунок 7. Извлечение держателя • Obrázok 7. Odstránenie držiaka • Slika 7. Odstranjevanje držala • Slika 7. Uklanjanje držača
• Figur 7. Borttagning av hållaren • Şekil 7. Tutucunun çıkarılması • Малюнок 7. Виймання тримача
11
Page 12

1 Device description
3
2
1
4
5
The Avalus bioprosthesis, Model 400, consists of a polyester covered base frame and trileaflet support frame structure shaped to the
geometry of a trileaflet valve. The base frame and trileaflet support frame are injection-molded using Polyetheretherketone (PEEK)
material. The base frame PEEK material is impregnated with barium sulphate to allow for radiographic visualization. The leaflets are
laser cut from bovine tissue that have been cross-linked in buffered glutaraldehyde. The leaflets are inserted between the trileaflet
support frame and the base frame, and then all components are securely sutured together. A sewing ring, fabricated from polyester
cloth, is integrated into the inflow base frame cover to allow the user to suture and seat the Avalus bioprosthesis in the supra-annular
position. Sewing markers are located on the sewing ring in the mid sinus area of each cusp to provide guidance for even spacing of
the implant sutures (Figure 1). A disposable holder is attached to the outflow of the valve to facilitate implantation. The aortic
bioprosthesis (valve) is treated with an alpha amino oleic acid (AOA) antimineralization process that has been shown to mitigate
porcine leaflet calcification in animal studies.
The disposable holder is designed to fit the reusable Medtronic valve handle, Model 7420. The holder features a single cut point to
remove the holder from the valve. Double-ended sizers are used to select the appropriate valve size. The barrel end represents the
valve orifice. The replica end imitates the prosthesis geometry.
Table 1. Available sizes and sewing ring diameters (nominal values in millimeters)
Size 19 mm 21 mm 23 mm 25 mm 27 mm 29 mm
(1) Stent diameter (TAD) 19 21 23 25 27 29
(2) Internal orifice diameter 17.5 19.5 21.5 23.5 25.5 27.5
(2a) Internal orifice diameter
(3) External sewing ring diameter 27.0 29.0 31.0 33.0 36.0 38.0
(4) Valve profile height 13.0 14.0 15.0 16.0 17.0 18.0
(5) Aortic protrusion 11.0 12.0 13.0 14.0 15.0 16.0
a
18 20 22 24 26 28
Note: TAD—tissue annulus diameter
a
Measurement shows stent frame including tissue (2) and stent frame excluding tissue (2a)
2 Indications for use
The Avalus bioprosthesis is indicated for the replacement of a diseased, damaged, or malfunctioning native or prosthetic aortic valve.
3 Contraindications
Do not use the valve if its use is not in the best interest of the patient. Evaluate all of the risks involved, including the anatomy and
pathology observed at the time of surgery.
4 Warnings and precautions
4.1 Warnings
• This device was designed for single use only. Do not reuse, reprocess, or resterilize this device. Reuse, reprocessing, or
resterilization may compromise the structural integrity of the device or create a risk of contamination, which could result in patient
injury, illness, or death.
• Do not resterilize the valve by any method. Exposure of the valve and container to irradiation, steam, ethylene oxide, or other
chemical sterilants will render the valve unfit for use.
• Check the shipping temperature indicator inside the carton. If the shipping temperature indicator window is black, the valve is not
suitable for clinical use.
• Do not use the valve in any of the following circumstances:
– The valve has been dropped, damaged, or mishandled in any way
– The Use-by date has elapsed
– All tamper strips are damaged
– The serial number tag does not match the number on the container label
– The glutaraldehyde storage solution does not completely cover the valve or if fluid is leaking from the packaging
– The valve shows signs of deterioration
12English
Page 13

• Do not handle the tissue portion of the valve with instruments. Extreme care must be taken to prevent damage to the delicate valve
tissue. Even a minor perforation could enlarge in time to significantly impair valve function.
• Do not attempt to repair a damaged valve. A damaged valve must not be used.
• Do not add antibiotics or any other substance to the storage solution or the rinse solution.
• Do not attempt to insert a valve that is too large for the annulus. Select a valve that will fit securely in the aortic root without
deforming the native anatomy or the Avalus bioprosthesis.
• Do not use other manufacturers’ valve sizers, or sizers for another Medtronic prosthesis, to size the valve.
• Do not allow the valve to dry. To prevent the valve tissue from drying, periodically irrigate the valve with sterile, normal saline during
implantation.
4.2 Precautions
• Carefully consider these potential hazards when selecting an appropriate valve substitute:
– Calcific degeneration could cause accelerated deterioration of the valve in patients with altered calcium metabolism (for
example, chronic renal failure, hyperparathyroidism).
– Calcification may occur earlier in children, adolescents, or young adults.
– Premature calcification may also occur in older adults who accept a biologic prosthesis.
– Patients with a bioprosthesis that require chronic anticoagulation are at additional risk of bleeding.
• Do not place the nonsterile exterior of the valve container in the sterile field.
• Do not use the Avalus sizers, Model 7400S, or the Medtronic valve handle, Model 7420, until they have been thoroughly cleaned
and sterilized. Refer to the appropriate instructions for use for further instructions.
• When selecting a valve size, consider the patient’s anatomy, and select a valve that adequately provides for the
hemodynamic requirements of the patient.
• Do not implant a valve without completing proper rinsing procedures.
• Orient the stent posts and seat the valve so that the coronary ostia are not obstructed.
• Avoid contact of the valve or the rinse solution with towels, linens, or other sources that may transfer particulate matter to the leaflet
tissue.
• Identify the inflow and outflow of the valve before suturing.
• Use caution when placing sutures through the sewing ring to avoid laceration of the leaflet tissue. If the leaflet tissue is damaged,
the valve must be explanted and replaced.
• Do not use cutting needles, unprotected forceps, or sharp instruments that could cause structural damage to the valve.
• Consider the potential for damage before passing catheters, surgical instruments, and transvenous pacing leads across the valve.
• When using interrupted sutures, it is important to cut the sutures close to the knots. Ensure that exposed suture tails will not come
into contact with the leaflet tissue.
• Do not bend the bioprosthesis commissures when tying knots.
• Do not handle the leaflet tissue.
• Avoid prolonged contact with the valve storage solution. Glutaraldehyde could cause irritation of the eyes, nose, skin, and throat
if continued exposure occurs. Avoid prolonged exposure to, or breathing of, the chemical vapor. Use only with adequate
ventilation. If skin contact occurs, immediately flush the affected area with copious amounts of water for 10 to 15 minutes. If eye
contact occurs, flush the eye with water for 15 minutes and seek immediate medical attention.
5 Potential adverse events
Adverse events potentially associated with the use of bioprosthetic heart valves include:
• Angina
• Cardiac dysrhythmias
• Endocarditis
• Heart failure
• Hemolysis
• Hemolytic anemia
• Hemorrhage, anticoagulant/antiplatelet-related
• Leak, transvalvular or paravalvular
• Myocardial infarction
• Nonstructural dysfunction (leaflet entrapment/impingement, obstructive pannus ingrowth, suture dehiscence, inappropriate
sizing, other)
• Prosthesis regurgitation
13 English
Page 14

• Stroke
• Structural deterioration (calcification, leaflet tear, stenosis, other)
• Thromboembolism
• Valve thrombosis
These complications could lead to:
• Reoperation
• Explant of the bioprosthesis
• Permanent disability
• Death
6 Instructions for use
6.1 Handling and preparation instructions
Proper size selection is critical to heart valve replacement. Use Avalus sizers, Model 7400S, to select the appropriately sized Avalus
bioprosthesis. For further information, refer to the instructions for use.
The exterior of the container and lid are nonsterile. The valve and all packaging components inside the container are sterile and must
be handled within the sterile operative field.
1. Prepare 2 rinse basins each containing 500 mL of sterile, normal saline solution.
2. Examine the tamper strips to verify that the container has not been damaged or previously opened. Do not use the valve if all of
the tamper strips are damaged.
3. Turn the lid counterclockwise and open the container (Figure 2).
4. Hold the retainer with the thumb and index finger. Slowly lift the valve out of the container, allowing for drainage of the
glutaraldehyde storage solution (Figure 3).
5. Verify that the serial number on the retainer matches the serial number on the container lid, shelf carton, and Patient Registration
Form. Record the serial number in the patient’s record using the stickers provided on the Patient Registration Form.
6. Hold the retainer upright. Remove the retainer cap by turning it counterclockwise using the thumb and index finger (Figure 4). The
holder will be visible.
7. Insert a sterile handle into the holder. Rotate the handle clockwise into the threaded opening of the holder until resistance is felt
(Figure 5).
8. Pull upward on the handle to remove the valve from the retainer (Figure 6).
6.2 Rinse procedure
1. Place the entire valve and holder in 1 of the rinse basins (Figure 6).
2. Use the handle to continually agitate the valve for a minimum of 30 seconds.
3. Gently squeeze the sewing ring to remove any residual glutaraldehyde. Do not touch the tissue portion of the valve.
4. Place the valve in the second basin. Keep the valve in the basin until required by the surgeon.
6.3 Aortic valve implantation
The Avalus bioprosthesis is designed for implantation in the supra-annular position. Use Avalus sizers, Model 7400S, to visualize
placement of the sewing cuff above the annulus and to confirm placement and fit of the valve in the supra-annular space.
The choice of surgical technique is left to the discretion of the individual surgeon when implanting in the supra-annular position. Any
modified technique should be in accordance with Chapter 4, Warnings and precautions, page 12. In general, follow these steps:
1. Orient the valve so that the coronary ostia are not obstructed by the stent and sewing ring.
2. Irrigate the valve periodically with sterile, normal saline to prevent drying of the delicate tissue.
3. Position the valve in the annulus and place the sutures in the sewing ring.
4. Suture the valve in place using an appropriate suture technique. Refer to Chapter 4, Warnings and precautions, page 12 to avoid
potential problems.
5. Cut the sutures at the single cut point indicated by the white arrow to release the holder (Figure 7). Gently pull the handle away
from the valve to remove the holder.
6. Remove the holder from the handle and discard the holder.
7. Tie all knots and trim suture tails. Verify that no suture remnants are present. If suture remnants are present, remove them before
completing the valve implantation.
14English
Page 15

7 Individualization of treatment
Except where contraindicated, during the initial stages after implantation, patients receiving a bioprosthetic heart valve should be
maintained on anticoagulant therapy.
Consider long-term anticoagulant or antiplatelet therapy in patients with a dilated left atrium, a history of thromboembolic events, or
a cardiac rhythm of atrial fibrillation or atrial flutter.
8 Patient counseling information
Continuous medical follow up (at least annually) is recommended so that complications related to the valve can be diagnosed and
properly managed.
Patients with a bioprosthetic valve are at risk for bacteremia (for example, undergoing dental procedures). Advise the patient about
prophylactic antibiotic therapy.
Encourage patients to carry the Implanted Device Identification Card, provided by Medtronic, with them at all times.
9 How supplied
9.1 Packaging
The Avalus bioprosthesis is chemically sterilized and is supplied sterile in a buffered 0.2% glutaraldehyde solution. Sterility is
compromised if the glass jar-and-lid container is opened or damaged. The outside of the container is not sterile. Do not place it in the
sterile field.
9.2 Storage
Store the Avalus bioprosthesis between 5°C and 25°C (41°F and 77°F). Refrigeration is not required, and freezing could damage the
valve. Room temperature storage up to 25°C (77°F) is satisfactory. Do not expose the valve to sunlight or other ultraviolet light sources,
or placed where significant temperature fluctuations could occur.
Maintain appropriate inventory control so that bioprostheses with earlier Use-by dates are implanted first to avoid expiration dates.
9.3 Return of explanted bioprostheses
Contact a Medtronic sales representative in order to request a product return kit to return explanted bioprostheses for analysis and
disposal. If a kit is not available, place the explanted bioprosthesis in a container filled with glutaraldehyde or 10% buffered formalin
immediately after explantation. For further return instructions, contact a Medtronic sales representative.
10 Patient information
10.1 Registration information
Note: Patient registration does not apply in countries where patient privacy laws conflict with providing patient information, including
countries from the European Union.
A Patient Registration Form is included in each device package. After implantation, please complete all requested information. Return
the original form to the Medtronic address indicated on the form. Provide the patient with the temporary identification card before
discharge.
An Implanted Device Identification Card is provided to the patient. This card contains the name and telephone number of the patient’s
physician, as well as information that medical personnel would require in the event of an emergency.
11 Postoperative information
11.1 Magnetic resonance imaging (MRI) compatibility
The Avalus bioprosthesis Model 400, is magnetic resonance (MR) safe. The valve contains no metal and, therefore, poses no known
hazards in all MR environments.
MR scanning at 3.0 T and 1.5 T can be performed immediately after implantation. The valve will not cause any harm to the patient when
exposed to MR scanning.
11.2 Image artifact
MR image quality could be compromised if scanning on or near the position of the valve. If necessary, optimize the MR imaging
parameters for the presence of the valve.
15 English
Page 16

12 Accessories
Use only Avalus sizers, Model 7400S, and the Medtronic valve handle, Model 7420, to determine the appropriate Avalus bioprosthesis
size.
Caution: Do not use the sizers or handles until they have been thoroughly cleaned and sterilized. Refer to the appropriate instructions
for use for further instructions.
Caution: Do not use other manufacturers’ valve sizers, or sizers from another Medtronic prosthesis, to size the Avalus bioprosthesis.
13 Disclaimer of warranty
THE FOLLOWING DISCLAIMER OF WARRANTY APPLIES TO CUSTOMERS OUTSIDE THE UNITED STATES:
ALTHOUGH THE AVALUS BIOPROSTHESIS, MODEL 400, HEREAFTER REFERRED TO AS “PRODUCT,” HAS BEEN
CAREFULLY DESIGNED, MANUFACTURED, AND TESTED PRIOR TO SALE, THE PRODUCT MAY FAIL TO PERFORM ITS
INTENDED FUNCTION SATISFACTORILY FOR A VARIETY OF REASONS. THE WARNINGS CONTAINED IN THE PRODUCT
LABELING PROVIDE MORE DETAILED INFORMATION AND ARE CONSIDERED AN INTEGRAL PART OF THIS DISCLAIMER
OF WARRANTY. MEDTRONIC, THEREFORE, DISCLAIMS ALL WARRANTIES, BOTH EXPRESS AND IMPLIED, WITH
RESPECT TO THE PRODUCT. MEDTRONIC SHALL NOT BE LIABLE FOR ANY INCIDENTAL OR CONSEQUENTIAL
DAMAGES CAUSED BY ANY USE, DEFECT, OR FAILURE OF THE PRODUCT, WHETHER THE CLAIM IS BASED ON
WARRANTY, CONTRACT, TORT, OR OTHERWISE.
The exclusions and limitations set out above are not intended to, and should not be construed so as to, contravene mandatory
provisions of applicable law. If any part or term of this DISCLAIMER OF WARRANTY is held by any court of competent jurisdiction to
be illegal, unenforceable, or in conflict with applicable law, the validity of the remaining portion of the DISCLAIMER OF WARRANTY
shall not be affected, and all rights and obligations shall be construed and enforced as if this DISCLAIMER OF WARRANTY did not
contain the particular part or term held to be invalid.
16English
Page 17

1 Описание на устройството
3
2
1
4
5
Биопротезата Avalus модел 400 се състои от покрита с полиестер основна рамка и поддържаща рамкова структура с три
платна, оформена по геометрията на клапа с три платна. Основната рамка и поддържащата рамка с три платна са
инжекционно излети от материал от полиетеретеркетон (PEEK). PEEK материалът на основната рамка е импрегниран с
бариев сулфат, за да се даде възможност за радиографска визуализация. Платната, които са кръстосано свързани в
буферен глутаралдехид, са лазерно изрязани от говежда тъкан. Платната са вмъкнати между поддържащата рамка с три
платна и основната рамка, а след това всички компоненти са здраво зашити заедно. Пръстен за зашиване, изработен от
полиестерна тъкан, е интегриран в покритието на основната рамка от страната на входящия поток, за да се даде
възможност на потребителя да зашие и намести биопротезата Avalus в супраануларна позиция. Маркерите за зашиване се
намират на пръстена за зашиване в средата на синусовата област на всяко платно, за да се даде ориентир за равно
разстояние между шевовете на импланта (Фигура 1). Държач за еднократна употреба е прикрепен от страната на изходния
поток на клапата, за да се улесни имплантирането. Аортната биопротеза (клапа) е преминала през процес на
антиминерализация с алфа-амино-олеинова киселина (AOA), показваща смекчаващ ефект върху калцификацията на
платната на свинската клапа при изследвания на животни.
Държачът за еднократна употреба е проектиран да съответства на предназначената за многократна употреба дръжка за
клапа модел 7420 на Medtronic. Държачът има една обособена точка на прекъсване за отстраняване на държача от
клапата. За да се избере подходящият размер клапа, се използват сепаратори с два края. Цилиндричният край
представлява отворът на клапата. Краят – точно копие наподобява геометрията на протезата.
Таблица 1. Налични размери и диаметри на пръстена за зашиване (номинални стойности в милиметри)
Размер 19 mm 21 mm 23 mm 25 mm 27 mm 29 mm
(1) Диаметър на стента (TAD) 19 21 23 25 27 29
(2) Вътрешен диаметър на отвора 17,5 19,5 21,5 23,5 25,5 27,5
(2a) Вътрешен диаметър на отвора
(3) Външен диаметър на пръстена за зашиване 27,0 29,0 31,0 33,0 36,0 38,0
(4) Височина на профила на клапата 13,0 14,0 15,0 16,0 17,0 18,0
(5) Изпъкване на аортата 11,0 12,0 13,0 14,0 15,0 16,0
a
18 20 22 24 26 28
Забележка: TAD – диаметър на тъканния анулус
a
Измерването показва рамката на стента заедно с тъканта (2) и рамката на стента без тъканта (2а)
2 Показания за употреба
Биопротезата Avalus е предназначена за замяна на засегната от заболяване, увредена или неправилно функционираща
нативна или протезна аортна клапа.
3 Противопоказания
Не използвайте клапата, ако нейната употреба не е най-доброто решение за пациента. Оценете всички възможни рискове,
включително анатомията и патологията, наблюдавани по време на операцията.
4 Предупреждения и предпазни мерки
4.1 Предупреждения
• Това устройство е предназначено само за еднократна употреба. Не използвайте повторно това устройство и не го
подлагайте на повторна обработка или повторна стерилизация. Повторната употреба, обработка или стерилизация
може да компрометира структурната цялост на устройството или да създаде риск от замърсяване, което може да
доведе до нараняване, заболяване или смърт на пациента.
• Не стерилизирайте клапата повторно по никакъв начин. Излагането на клапата и контейнера на облъчване, пара,
етиленов оксид или други химически стерилизиращи вещества ще направи клапата негодна за употреба.
• Проверете индикатора за температурата по време на доставка в кутията. Ако прозорецът на индикатора за
температурата по време на доставка е черен, клапата не е подходяща за клинична употреба.
17 Български
Page 18

• Клапата не трябва да се използва при следните обстоятелства:
– Клапата е изпусната, повредена или третирана по неправилен начин
– Датата „Използвайте не по-късно от“ е изтекла
– Всички защитни ленти са повредени
– Обозначението със серийния номер не отговаря на номера върху етикета на контейнера
– Глутаралдехидният разтвор за съхранение не покрива напълно клапата или ако е налице изтичане на течност от
опаковката
– Клапата показва признаци на детериорация
• Не използвайте инструменти за боравене с тъканната част от клапата. Трябва да се вземат изключителни предпазни
мерки, за да се предотврати повреда на деликатната тъкан на клапата. Дори малка перфорация с времето може да се
увеличи и значително да наруши функционирането на клапата.
• Не опитвайте да поправяте повредена клапа. Повредена клапа не трябва да се използва.
• Не добавяйте антибиотици или каквото и да е друго вещество към разтвора за съхранение или разтвора за изплакване.
• Не се опитвайте да поставяте клапа, която е прекалено голяма за анулуса. Изберете клапа, която ще приляга плътно
към аортния корен, без да се деформира нативната анатомия или биопротезата Avalus.
• Не използвайте клапни сепаратори на други производители или сепаратори за друга протеза на Medtronic, за да
оразмерите клапата.
• Не оставяйте клапата да изсъхва. За да избегнете изсъхването на тъканта на клапата, по време на имплантацията
периодично промивайте клапата със стерилен физиологичен разтвор.
4.2 Предпазни мерки
• Обмислете внимателно тези възможни рискове, когато избирате подходяща изкуствена клапа:
– Калцифициращата дегенерация може да доведе до ускорено влошаване на състоянието на клапата при пациенти с
нарушен калциев метаболизъм (например хронична бъбречна недостатъчност, хиперпаратиреоидизъм).
– Калцификация може да възникне по-рано при деца, юноши или млади хора.
– Преждевременна калцификация може да възникне също така при по-възрастни хора с биологична протеза.
– Пациентите с биопротеза, които се нуждаят от хронична антикоагулация, са изложени на допълнителен риск от
кървене.
• Не поставяйте нестерилната външна повърхност на контейнера на клапата в стерилното поле.
• Не използвайте сепараторите Avalus, модел 7400S или дръжката за клапа модел 7420 на Medtronic, докато не бъдат
напълно почистени и стерилизирани. Разгледайте подходящите инструкции за употреба за допълнителни инструкции.
• При избор на размер на клапата вземете предвид анатомията на пациента и изберете клапа, която адекватно
отговаря на хемодинамиката на пациента.
• Не имплантирайте клапа, без да сте завършили подходящите процедури за изплакване.
• Ориентирайте шините на стента и поставете клапата така, че да няма обструкция на коронарните отвори.
• Избягвайте контакт на клапата или разтвора за изплакване с кърпи, ленени покривки или други източници, които могат
да прехвърлят прахови частици на тъканта на платното.
• Определете притока и оттока на клапата, преди да зашиете.
• Бъдете много внимателни при поставяне на шевове през пръстена за пришиване, за да се избегне разкъсване на
тъканта на клапното платно. Ако тъканта на платното е увредена, клапата трябва да се експлантира и да се замени.
• Не използвайте режещи игли, незащитени пинсети или остри инструменти, които биха могли да причинят структурно
повреждане на клапата.
• Възможността от повреждане трябва да се има предвид преди прокарването на катетри, хирургически инструменти и
трансвенозни електроди за стимулация през клапата.
• При използването на прекъснати шевове е важно шевовете да се срежат в близост до възлите. Уверете се, че
отрязаните краища на конеца не влизат в контакт с тъканта на клапното платно.
• Не огъвайте биопротезните комисури, когато завързвате възли.
• Не докосвайте тъканта на платната.
• Избягвайте продължителен контакт с разтвора за съхранение на клапата. Глутаралдехидът би могъл да причини
възпаление на очите, носа, кожата или гърлото, ако възникне продължително излагане. Избягвайте продължително
съприкосновение или вдишване на химическите изпарения. Използвайте само в добре вентилирани помещения. Ако
се осъществи контакт с кожата, незабавно да се промие засегнатата област обилно с вода в продължение на 10 – 15
минути. Ако възникне контакт с очите, промийте окото с вода в продължение на 15 минути, след което незабавно
потърсете медицинска помощ.
18Български
Page 19

5 Възможни нежелани реакции
Нежеланите реакции, които са потенциално свързани с използването на биопротезни сърдечни клапи, включват:
• Ангина
• Ритъмни нарушения на сърцето
• Ендокардит
• Сърдечна недостатъчност
• Хемолиза
• Хемолитична анемия
• Хеморагия, свързана с антикуагулантно/антитромбоцитно лечение
• Пропускане, трансвалвуларно или паравалвуларно
• Миокарден инфаркт
• Неструктурна дисфункция (заклещване/въздействие на платно, врастване на обструктивен панус, дехисценция на
шева, неправилно оразмеряване и др.)
• Регургитация в протезата
• Инсулт
• Структурно влошаване (калцификация, скъсване на платно, стеноза и др.)
• Тромбоемболизъм
• Тромбоза на клапата
Тези усложнения могат да доведат до:
• Повторна операция
• Експлантиране на биопротезата
• Постоянна инвалидност
• Смърт
6 Инструкции за употреба
6.1 Инструкции за манипулация и подготовка
Правилният избор на размер е изключително важен за замяната на сърдечната клапа. Използвайте сепаратори Avalus,
модел 7400S, за да изберете подходящия размер биопротеза Avalus. За допълнителна информация разгледайте
инструкциите за употреба.
Външната част на контейнера и капака не са стерилни. Клапата и всички компоненти на опаковката в контейнера са
стерилни и с тях трябва да се борави в рамките на стерилното оперативно поле.
1. Подгответе 2 съда за изплакване, всеки от които съдържа 500 ml стерилен нормален физиологичен разтвор.
2. Проверете защитните ленти, за да сте сигурни, че контейнерът не е бил повреден или отварян преди това. Не
използвайте клапата, ако всички защитни ленти са повредени.
3. Завъртете капака по посока, обратна на часовниковата стрелка, след което отворете контейнера (Фигура 2).
4. Дръжте фиксатора с палец и показалец. Бавно извадете клапата от контейнера, като оставите глутаралдехидния
разтвор за съхранение да се отцеди (Фигура 3).
5. Проверете дали серийният номер на фиксатора съответства на серийния номер върху капака на контейнера,
картонената кутия и формуляра за регистрация на пациента. Запишете серийния номер в досието на пациента, като
използвате предоставените стикери във формуляра за регистрация на пациента.
6. Дръжте фиксатора изправен. Махнете капачката на фиксатора, като с палец и показалец завъртите по посока,
обратна на часовниковата стрелка (Фигура 4). Държачът ще може да се види.
7. Поставете стерилната дръжка в държача. Завъртете дръжката по посока на часовниковата стрелка в отвора на
държача с поставени конци, докато усетите съпротивление (Фигура 5).
8. Издърпайте дръжката нагоре, за да извадите клапата от фиксатора (Фигура 6).
6.2 Процедура на изплакване
1. Поставете цялата клапа и държача в 1 от съдовете за изплакване (Фигура 6).
2. Като използвате дръжката продължително разклащайте клапата в продължение на най-малко 30 секунди.
3. Леко стиснете пръстена за пришиване, за да отстраните остатъците от глутаралдехид, ако има такива. Не докосвайте
тъканната част на клапата.
4. Поставете клапата във втория съд. Задръжте клапата в съда, докато бъде поискана от хирурга.
19 Български
Page 20

6.3 Имплантиране на аортна клапа
Биопротезата Avalus е предназначена за имплантиране в супраануларна позиция. Използвайте сепаратори Avalus,
модел 7400S, за да визуализирате поставянето на маншета за зашиване над анулуса и да потвърдите правилното
поставяне и напасването на клапата в супраануларното пространство.
При имплантиране в супраануларна позиция изборът на хирургическа техника е оставен на преценката на отделния хирург.
Всяка промяна на техниката следва да се извършва в съответствие с Глава 4, Предупреждения и предпазни мерки,
страница 17. Като цяло, следвайте тези стъпки:
1. Ориентирайте клапата така, че отворите на коронарните артерии да не бъдат запушени от стента или пръстена за
пришиване.
2. За да избегнете изсъхването на деликатната тъкан, периодично промивайте клапата с нормален стерилен
физиологичен разтвор.
3. Позиционирайте клапата в анулуса и поставете конците в пръстена за зашиване.
4. Зашийте клапата на място, като използвате подходяща техника за зашиване. За да избегнете потенциални проблеми,
направете справка с Глава 4, Предупреждения и предпазни мерки, страница 17.
5. Изрежете конците в обособената точка на прекъсване, указана с бялата стрелка, за да освободите държача
(Фигура 7). Внимателно издърпайте дръжката от клапата, за да отстраните държача.
6. Отстранете държача от дръжката и изхвърлете държача.
7. Завържете всички възли и подрежете крайчетата на шевовете. Уверете се, че не са налице остатъци от шева. При
наличие на остатъци от шева, отстранете ги преди да завърши имплантирането на клапата.
7 Персонализиране на лечението
С изключение на случаите, в които това е противопоказано, по време на началните етапи след имплантацията при
пациентите с имплантирана биопротезна сърдечна клапа трябва да се поддържа антикоагулантна терапия.
Обмислете прилагането на дългосрочна антикоагулантна или антитромбоцитна терапия при пациенти с дилатирано ляво
предсърдие, анамнеза за тромбоемболични инциденти или сърдечен ритъм от тип предсърдно мъждене или трептене.
8 Съвети за пациента
Препоръчва се непрекъснато медицинско проследяване (поне веднъж годишно), така че свързаните с клапата усложнения
да могат да бъдат диагностицирани и контролирани правилно.
Пациентите с биопротезна клапа са изложени на риск от бактериемия (например при подлагане на дентални процедури).
Насочете пациента за профилактична антибиотична терапия.
Пациентите трябва да се насърчават по всяко време да носят със себе си идентификационната карта за имплантирано
устройство, предоставена от Medtronic.
9 Начин на доставяне
9.1 Опаковка
Биопротезата Avalus е химично стерилизирана и се доставя стерилна в буфериран 0,2%-тен разтвор на глутаралдехид.
Стерилността е нарушена, ако контейнерът, представляващ стъклен буркан с капачка, е отворен или повреден. Външната
повърхност на контейнера не е стерилна. Не го поставяйте в стерилното поле.
9.2 Съхранение
Съхранявайте биопротезата Avalus при температури между 5°C и 25°C (41°F и 77°F). Не е необходимо поставяне в
хладилник, а замразяването би могло да повреди клапата. Съхранението на стайна температура до 25°C (77°F) е
задоволително. Не излагайте клапата на слънчева светлина или други източници на ултравиолетова светлина и не я
поставяйте на място, където могат да настъпят значителни температурни колебания.
Поддържайте подходящ контрол на складовия инвентар, така че биопротезите с по-ранни дати на изтичане на срока на
годност да се имплантират първи, за да се избегне изтичане на срока на годност.
9.3 Връщане на експлантирани биопротези
За връщане на експлантирани биопротези за анализ и изхвърляне се свържете с търговски представител на Medtronic, за
да направите заявка за комплект за връщане на продукта. Ако няма налични комплекти, поставете експлантираната
биопротеза в контейнер, пълен с глутаралдехид или 10%-тен буфериран формалин, непосредствено след
експлантирането. За повече инструкции относно връщането се свържете с търговски представител на Medtronic.
20Български
Page 21

10 Patient information (Информация за пациента)
10.1 Информация за регистрация
Забележка: Регистрацията на пациента не е приложима за страни, където законите за защита на поверителността на
пациента влизат в конфликт с предоставянето на информация за пациента, включително и страните от Европейския съюз.
Във всяка опаковка е включен формуляр за регистрация на пациента. След имплантиране попълнете всички необходими
данни. Върнете оригиналния формуляр на адреса на Medtronic, посочен във формуляра. Осигурете предоставянето на
временната идентификационна карта на пациента преди изписване.
Всеки пациент получава идентификационна карта за имплантирано устройство. Тази карта съдържа името и телефонния
номер на лекуващия лекар на пациента, както и информация, която е важна за медицинския персонал при спешни случаи.
11 Следоперативна информация
11.1 Съвместимост с ядрено-магнитен резонанс (ЯМР)
Биопротезата Avalus, модел 400 е безопасна при подлагане на магнитен резонанс (МР). Клапата не съдържа метали и
поради това не представлява опасност по явни показатели във всички МР среди.
Сканиране с МР при 3,0 T и 1,5 T може да бъде извършено веднага след имплантацията. Клапата няма да навреди по
никакъв начин на пациента при излагане на сканиране чрез МР.
11.2 Артефакти в изображението
Качеството на МР изображението може да бъде нарушено, ако се сканира на или в близост до мястото на клапата. Ако е
необходимо, оптимизирайте параметрите на МР изображението поради присъствието на клапата.
12 Аксесоари
Използвайте само сепаратори Avalus, модел 7400S и дръжка за клапа модел 7420 на Medtronic, за да определите
подходящия размер на биопротезата Avalus.
Внимание: Не използвайте сепараторите или дръжките, докато не бъдат напълно почистени и стерилизирани.
Разгледайте подходящите инструкции за употреба за допълнителни инструкции.
Внимание: Не използвайте клапни сепаратори на други производители или сепаратори от друга протеза на Medtronic, за
да оразмерите биопротезата Avalus.
13 Отказ от гаранции
СЛЕДНИЯТ ОТКАЗ ОТ ГАРАНЦИИ СЕ ОТНАСЯ САМО ЗА КЛИЕНТИ ИЗВЪН СЪЕДИНЕНИТЕ АМЕРИКАНСКИ ЩАТИ:
ВЪПРЕКИ ЧЕ БИОПРОТЕЗАТА AVALUS, МОДЕЛ 400, НАРИЧАНА ПО-ДОЛУ „ПРОДУКТ“, Е ВНИМАТЕЛНО
ПРОЕКТИРАНА, ПРОИЗВЕДЕНА И ТЕСТВАНА ПРЕДИ ПРОДАЖБА, ПРОДУКТЪТ МОЖЕ ДА НЕ ИЗПЪЛНИ
ЗАДОВОЛИТЕЛНО ПРЕДНАЗНАЧЕНАТА МУ ФУНКЦИЯ ПОРАДИ РЕДИЦА ПРИЧИНИ. ПРЕДУПРЕЖДЕНИЯТА, КОИТО
СЕ СЪДЪРЖАТ В ЕТИКЕТИТЕ НА ПРОДУКТА, ПРЕДОСТАВЯТ ПО-ПОДРОБНА ИНФОРМАЦИЯ И СЕ СЧИТАТ ЗА
НЕРАЗДЕЛНА ЧАСТ ОТ ТОЗИ ОТКАЗ ОТ ГАРАНЦИИ. ЗАТОВА MEDTRONIC ОТХВЪРЛЯ ВСЯКАКВИ ГАРАНЦИИ,
ИЗРИЧНИ ИЛИ ПОДРАЗБИРАЩИ СЕ, ПО ОТНОШЕНИЕ НА ПРОДУКТА. MEDTRONIC НЕ НОСИ ОТГОВОРНОСТ ЗА
СЛУЧАЙНИ ИЛИ ПОСЛЕДВАЩИ ЩЕТИ, ПРИЧИНЕНИ ОТ УПОТРЕБА, ДЕФЕКТ ИЛИ НЕИЗПРАВНОСТ НА ПРОДУКТА,
КОГАТО ИСКЪТ СЕ ОСНОВАВА НА ГАРАНЦИЯ, ДОГОВОР, ЗАКОНОВО НАРУШЕНИЕ ИЛИ ДРУГО.
Изключенията и ограниченията, изложени по-горе, не са предназначени да противоречат и не трябва да се тълкуват като
противоречащи на задължителните разпоредби на съответния закон. Ако някоя част или условие от този ОТКАЗ ОТ
ГАРАНЦИИ се приемат от някой съд с компетентна юрисдикция за незаконни, неизпълними или в противоречие със
съответното законодателство, валидността на останалата част от ОТКАЗА ОТ ГАРАНЦИИ няма да бъде повлияна и всички
права и задължения ще бъдат изтълкувани и изпълнени така, сякаш този ОТКАЗ ОТ ГАРАНЦИИ не е съдържал частта или
условието, счетени за невалидни.
21 Български
Page 22

1 Popis výrobku
3
2
1
4
5
Bioprotéza Avalus, model 400, se skládá ze základního rámečku potaženého polyesterem a z konstrukce trojcípého výztužného
rámečku vytvarované do geometrie trojcípé chlopně. Základní rámeček a trojcípý výztužný rámeček jsou vytvarovány lisováním
vstřikovaného polyéteréterketonu (PEEK). PEEK, z něhož je zhotoven základní rámeček, je impregnován síranem barnatým, aby jej
bylo možné zobrazit rentgenem. Cípy jsou vyřezány laserem z hovězí tkáně a zesíťované v pufrovaném glutaraldehydu. Cípy se
vkládají mezi trojcípý výztužný rámeček a základní rámeček a potom se všechny komponenty pevně sešijí dohromady. Našívací
prstenec, zhotovený z polyesterové tkaniny, je integrován do potahu základního rámečku v přítokové části, aby uživatel mohl
bioprotézu Avalus usadit a přišít v supraanulární pozici. Na našívacím prstenci ve středové oblasti sinusů jednotlivých cípů jsou
umístěny značky pro stehy, které slouží jako vodítko k dosažení stejnoměrných rozestupů stehů při přišívání implantátu (Obrázek 1).
Jednorázový držák je připojen k výtokové části chlopně, aby byla implantace snadnější. Aortální bioprotéza (chlopeň) je ošetřena
antimineralizačním procesem s využitím kyseliny alfa-amino-olejové (AOA); studie na zvířatech prokázaly, že tento proces potlačuje
kalcifikaci cípů zhotovených z prasečí tkáně.
Jednorázový držák je určen k upevnění na opakovaně použitelnou rukojeť chlopně Medtronic, model 7420. Na držáku se nalézá jeden
řezný bod, v němž lze oddělit držák od chlopně. K výběru vhodné velikosti chlopně lze použít dvoustranné měrky. Válcové zakončení
představuje ústí chlopně. Zakončení ve tvaru repliky napodobuje geometrii bioprotézy.
Tabulka 1. Dostupné velikosti a průměry našívacího prstence (nominální hodnoty v milimetrech)
Velikost 19 mm 21 mm 23 mm 25 mm 27 mm 29 mm
(1) Průměr stentu (TAD) 19 21 23 25 27 29
(2) Vnitřní průměr ústí 17,5 19,5 21,5 23,5 25,5 27,5
(2a) Vnitřní průměr ústí
(3) Vnější průměr našívacího prstence 27,0 29,0 31,0 33,0 36,0 38,0
(4) Výška profilu chlopně 13,0 14,0 15,0 16,0 17,0 18,0
(5) Aortální výstupek 11,0 12,0 13,0 14,0 15,0 16,0
a
18 20 22 24 26 28
Poznámka: TAD—průměr tkáně anulu
a
Uvedené míry jsou rozměrem kostry stentu (rámečku) včetně tkáně (2) a kostry stentu bez tkáně (2a)
2 Indikace k použití
Bioprotéza Avalus je určena k náhradě nemocné, poškozené nebo nesprávně fungující přirozené nebo protetické aortální chlopně.
3 Kontraindikace
Pokud použití chlopně není v nejlepším zájmu pacienta, nepoužívejte ji. Zhodnoťte všechna související rizika, včetně anatomických
a patologických poměrů zjištěných v době operace.
4 Varování a bezpečnostní opatření
4.1 Varování
• Tento výrobek je určen pouze k jednorázovému použití. Nepoužívejte výrobek opakovaně ani neprovádějte jeho renovaci nebo
resterilizaci. Opakované používání, renovace nebo resterilizace mohou ohrozit strukturální integritu výrobku nebo způsobit riziko
jeho kontaminace, což by mohlo mít za následek poranění, onemocnění nebo smrt pacienta.
• Neprovádějte resterilizaci chlopně žádnou metodou. Po vystavení chlopně a nádoby ozáření, páře, ethylenoxidu či jiným
chemickým sterilizačním prostředkům chlopeň již není vhodná k použití.
• Zkontrolujte indikátor přepravní teploty uvnitř krabice. Pokud je okénko indikátoru přepravní teploty černé, chlopeň není vhodná
pro klinické použití.
• Chlopeň nepoužívejte, pokud dojde k některé z následujících okolností:
– chlopeň upadla, byla poškozena nebo s ní bylo jakýmkoli způsobem nesprávně zacházeno;
– uplynulo datum použitelnosti;
– všechny pečetící pásky jsou poškozeny;
– sériové číslo na štítku neodpovídá sériovému číslu na štítku nádoby;
22Česky
Page 23

– skladovací roztok glutaraldehydu nepokrývá celou chlopeň nebo z obalu uniká tekutina;
– chlopeň vykazuje známky degradace.
• Při manipulaci s tkáňovou částí chlopně nepoužívejte žádné nástroje. Tkáň chlopně je velmi choulostivá a proto je nutné pracovat
s nejvyšší opatrností, aby nedošlo k jejímu poškození. I nepatrná perforace se může časem zvětšit a způsobit tak závažné
poškození funkce chlopně.
• Nepokoušejte se opravovat poškozenou chlopeň. Poškozená chlopeň se nesmí použít.
• Do skladovacího roztoku ani do roztoku pro oplachování nepřidávejte antibiotika ani žádné jiné látky.
• Nepokoušejte se zavádět chlopeň, která je pro anulus příliš velká. Vyberte chlopeň, která pevně dosedne do aortálního kořene,
aniž by došlo ke zdeformování přirozené anatomie nebo bioprotézy Avalus.
• Při určování velikosti chlopně nepoužívejte měrky chlopní od jiných výrobců, ani měrky určené pro jiné protézy od společnosti
Medtronic.
• Tkáň chlopně nenechejte zaschnout. Pravidelným zvlhčováním chlopně běžným sterilním fyziologickým roztokem během
implantace zabráníte oschnutí tkáně chlopně.
4.2 Zvláštní upozornění
• Při výběru vhodné náhrady chlopně důkladně zvažte tato možná rizika:
– Kalcifikující degenerace by mohla vést k urychlené deterioraci chlopně u pacientů s poruchou metabolismu vápníku (např.
chronické selhání ledvin, hyperparathyreoidismus).
– U dětí, dospívajících a mladých dospělých může dojít ke kalcifikaci dříve.
– U starších dospělých, kteří jsou příjemci biologické protézy, může rovněž dojít k předčasné kalcifikaci.
– U pacientů s bioprotézou, kteří potřebují chronickou antikoagulační léčbu, existuje další riziko krvácení.
• Vnější strana nádoby s chlopní není sterilní a nesmí být umístěna do sterilního pole.
• Nepoužívejte měrky Avalus, model 7400S, ani rukojeť chlopně Medtronic, model 7420, dokud nebyly důkladně vyčištěny a
sterilizovány. Další náležité pokyny naleznete v příslušných návodech k použití.
• Při výběru velikosti chlopně je nutné vzít v úvahu anatomické poměry u příslušného pacienta a je třeba pečlivě vybrat
chlopeň, která bude dostatečně pokrývat hemodynamické potřeby pacienta.
• Neimplantujte chlopeň bez řádného provedení postupů propláchnutí.
• Zorientujte podpěry stentu a usaďte chlopeň tak, aby nedošlo k obstrukci koronárních ústí.
• Zabraňte styku chlopně či roztoku pro oplachování s utěrkami, rouškami nebo jinými materiály, z nichž by se na cípy chlopně
mohly přenést pevné částice.
• Před všitím identifikujte přítokovou a výtokovou stranu chlopně.
• Při umísťování stehů v našívacím prstenci postupujte opatrně, aby nedošlo k laceraci tkáně cípů. Je-li tkáň cípu poškozena, je
třeba chlopeň explantovat a vyměnit.
• Nepoužívejte řezací jehly, nechráněné pinzety ani ostré nástroje, protože by mohly poškodit strukturu chlopně.
• Dříve než se rozhodnete protahovat chlopní katétry, chirurgické nástroje a transvenózní stimulační elektrody, zvažte možné riziko
jejího poškození.
• Při použití přerušovaných stehů je důležité stehy přestřihnout blízko uzlů. Zajistěte, aby se exponované konce stehů nedostaly do
kontaktu s tkání cípů.
• Při zavazování uzlů neohýbejte komisury bioprotézy.
• Nemanipulujte s tkání cípů.
• Zabraňte dlouhodobému kontaktu s roztokem pro skladování chlopně. Glutaraldehyd by mohl při dlouhodobé expozici způsobit
podráždění očí, nosu, kůže a hrdla. Vyhněte se dlouhodobé expozici či vdechování chemických výparů. Zajistěte dostatečné
větrání. Dojde-li ke kontaktu s kůží, postižené místo ihned oplachujte vydatným množstvím vody po dobu 10 až 15 minut. Dojde-li
ke kontaktu s očima, vyplachujte je vodou po dobu 15 minut a ihned vyhledejte lékařskou pomoc.
5 Možné nežádoucí příhody
S použitím bioprotetických srdečních chlopní mohou být spojeny následující nežádoucí příhody:
• Angina pectoris
• Poruchy srdečního rytmu
• Endokarditida
• Srdeční selhání
• Hemolýza
• Hemolytická anémie
• Krvácení související s antikoagulační/protidestičkovou léčbou
23 Česky
Page 24

• Transvalvulární nebo paravalvulární leak
• Infarkt myokardu
• Nestrukturální dysfunkce (zachycení/impingement cípů, obstrukční přerůstání panusu, dehiscence stehů, nesprávné stanovení
velikosti, jiné)
• Regurgitace protézy
• Cévní mozková příhoda
• Strukturální poškození (kalcifikace, odtržení cípu, stenóza, jiné)
• Tromboembolie
• Trombóza chlopně
Tyto komplikace by mohly vést k těmto následkům:
• reoperace,
• Explantace bioprotézy
• Trvalá invalidita
• Smrt
6 Návod k použití
6.1 Pokyny k manipulaci a přípravě
Výběr správné velikosti je pro náhradu srdeční chlopně rozhodující. K výběru vhodné velikosti bioprotézy Avalus použijte měrky
Avalus, model 7400S. Další informace získáte v návodu k použití.
Vnější strana a víko nádoby jsou nesterilní. Chlopeň a všechny součásti balení uvnitř nádoby jsou sterilní a je třeba s nimi ve sterilním
operačním poli odpovídajícím způsobem zacházet.
1. Připravte 2 proplachovací misky a do každé nalijte 500 ml běžného sterilního fyziologického roztoku.
2. Zkontrolujte pečetící pásky a ověřte, že nádoba není poškozena nebo že nebyla již dříve otevřena. Pokud jsou všechny pečetící
pásky poškozeny, chlopeň nepoužívejte.
3. Otočte víkem proti směru hodinových ručiček a otevřete nádobu (Obrázek 2).
4. Uchopte nádržku palcem a ukazováčkem. Pomalu vytáhněte chlopeň z nádoby a nechejte odtéct skladovací roztok
glutaraldehydu (Obrázek 3).
5. Zkontrolujte, zda sériové číslo na nádržce odpovídá sériovému číslu na víku nádoby, na skladovací krabici a ve formuláři pro
registraci pacienta. Pomocí samolepicích štítků, které naleznete na registračním formuláři pacienta, zaznamenejte sériové číslo
do dokumentace pacienta.
6. Podržte nádržku ve svislé poloze. Palcem a ukazováčkem otočte uzávěrem nádržky proti směru hodinových ručiček a odstraňte
jej (Obrázek 4). Uvidíte držák.
7. Vložte sterilní rukojeť do držáku. Do otvoru držáku se závitem zašroubujte rukojeť po směru hodinových ručiček, dokud neucítíte
odpor (Obrázek 5).
8. Vytažením rukojeti směrem nahoru vyjměte chlopeň z nádržky (Obrázek 6).
6.2 Postup proplachování
1. Vložte celou chlopeň a držák do 1 z proplachovacích misek (Obrázek 6).
2. Za použití rukojeti chlopeň nepřetržitě proplachujte po dobu minimálně 30 sekund.
3. Zlehka stlačte našívací prstenec, aby se z něj odstranily zbytky glutaraldehydu. Nedotýkejte se tkáňové části chlopně.
4. Vložte chlopeň do druhé misky. Chlopeň nechte v misce až do okamžiku, kdy ji bude chirurg potřebovat.
6.3 Implantace aortální chlopně
Bioprotéza Avalus je určena k implantaci do supraanulární pozice. K vizualizaci umístění našívací manžety nad anulem a k ověření,
že supraanulární umístění a usazení chlopně je správné, použijte měrky Avalus, model 7400S.
Při implantaci do supraanulární pozice je volba chirurgické techniky ponechána na rozhodnutí každého jednotlivého chirurga.
Jakékoli změny techniky musí být v souladu s informacemi, které obsahuje Kapitola 4, Varování a bezpečnostní opatření, strana 22.
Zpravidla se postupuje podle následujících kroků:
1. Chlopeň orientujte tak, aby stent ani našívací prstenec neblokovaly koronární ústí.
2. Pravidelným proplachováním chlopně běžným sterilním fyziologickým roztokem zabraňte oschnutí její choulostivé tkáně.
3. Umístěte chlopeň do anulu a do našívacího prstence zaveďte stehy.
4. Pomocí vhodné techniky šití přišijte chlopeň v zamýšlené pozici. Abyste předešli případným problémům, prostudujte informace,
které uvádí Kapitola 4, Varování a bezpečnostní opatření, strana 22.
24Česky
Page 25

5. Oddělte držák přestřižením stehů v řezném bodě, který označuje bílá šipka (Obrázek 7). Odstraňte držák opatrným vytažením
rukojeti z chlopně.
6. Oddělte držák od rukojeti a zlikvidujte jej.
7. Utáhněte všechny uzly a odstřihněte konce stehů. Ověřte, že nejsou přítomny žádné zbytky stehů. Případné zbytky stehů
odstraňte před dokončením implantace chlopně.
7 Individualizace léčby
Během počátečních stádií po implantaci bude pacientům, kterým byla implantována bioprotéza srdeční chlopně, podána
antikoagulační léčba, pokud tato léčba není kontraindikována.
U pacientů s dilatací levé síně, s anamnézou tromboembolických událostí nebo se srdečním rytmem vykazujícím fibrilaci síní či flutter
síní zvažte dlouhodobou antikoagulační nebo protidestičkovou léčbu.
8 Poskytování informací pacientům
Doporučuje se trvalé lékařské sledování (s kontrolami nejméně jednou ročně), aby mohly být diagnostikovány a správně léčeny
komplikace související s chlopní.
U pacientů s bioprotetickou chlopní existuje riziko bakterémie (například při podstoupení stomatologickým zákrokům). Informujte
pacienta o profylaktické léčbě antibiotiky.
Pacientům doporučte, aby vždy při sobě nosili identifikační kartu implantovaného výrobku poskytnutou společností Medtronic.
9 Stav při dodání
9.1 Balení
Bioprotéza Avalus je chemicky sterilizována a dodávána sterilní v 0,2% pufrovaném roztoku glutaraldehydu. Sterilita je porušena,
jestliže skleněná nádoba a víko nádoby jsou otevřeny nebo poškozeny. Vnější strana nádoby není sterilní. Neumísťujte ji do sterilního
pole.
9.2 Skladování
Bioprotézu Avalus skladujte při teplotě 5°C až 25°C (41°F až 77°F). Chlazení není nutné a zmrazení by mohlo chlopeň poškodit.
Skladování při pokojové teplotě do 25°C (77°F) je vyhovující. Nevystavujte chlopeň slunečnímu světlu ani jiným zdrojům ultrafialového
záření a neukládejte ji na místě, kde by mohlo dojít k významným výkyvům teploty.
Náležitými kontrolami skladu zajistěte, aby bioprotézy s dřívějším datem použitelnosti byly implantovány přednostně, aby nedošlo k
exspiraci výrobku.
9.3 Vrácení explantovaných bioprotéz
Kontaktujte obchodního zástupce společnosti Medtronic a vyžádejte si soupravu pro vrácení výrobku k vrácení explantovaných
bioprotéz za účelem provedení analýzy a likvidace. Pokud nemáte soupravu k dispozici, vložte explantovanou bioprotézu ihned po
explantaci do nádoby naplněné glutaraldehydem nebo 10% pufrovaným roztokem formalínu. Další pokyny vám poskytne obchodní
zástupce společnosti Medtronic.
10 Informace o pacientovi
10.1 Registrační informace
Poznámka: Registrace se netýká pacientů v zemích, kde je poskytování informací o pacientech v rozporu se zákony na ochranu
soukromí pacientů, včetně zemí z Evropské unie.
Součástí balení každého výrobku je formulář pro registraci pacienta. Po implantaci vyplňte všechny požadované informace. Originál
formuláře vraťte na adresu společnosti Medtronic uvedenou na formuláři. Před propuštěním pacientovi vydejte prozatímní
identifikační kartu.
Pacient obdrží identifikační kartu implantovaného produktu. Na této kartě je uvedeno jméno a telefonní číslo pacientova ošetřujícího
lékaře a informace, které by v naléhavých situacích potřeboval znát zdravotnický personál.
11 Pooperační informace
11.1 Kompatibilita s vyšetřením magnetickou rezonancí (MRI)
Bioprotéza Avalus, model 400, je bezpečná v prostředí magnetické rezonance (MR). Chlopeň neobsahuje žádné kovy, a proto
nepředstavuje žádná známá rizika ve všech prostředích magnetické rezonance.
Snímkování magnetickou rezonancí při 3,0 T a 1,5 T lze provádět ihned po implantaci. Chlopeň nezpůsobí žádnou újmu pacientovi,
který podstupuje snímkování magnetickou rezonancí.
25 Česky
Page 26

11.2 Obrazové artefakty
Kvalita snímku magnetické rezonance může být zhoršena při snímkování v místě implantace chlopně nebo v jeho blízkosti. Je-li třeba,
optimalizujte parametry zobrazení magnetickou rezonancí vzhledem k přítomnosti této chlopně.
12 Příslušenství
Ke stanovení správné velikosti bioprotézy Avalus používejte pouze měrky Avalus, model 7400S, a rukojeť chlopně Medtronic,
model 7420.
Upozornění: Nepoužívejte měrky nebo rukojeti, dokud nebyly důkladně vyčištěny a sterilizovány. Další náležité pokyny naleznete
v příslušných návodech k použití.
Upozornění: Při určování velikosti bioprotézy Avalus nepoužívejte měrky chlopní od jiných výrobců, ani měrky určené pro jiné protézy
od společnosti Medtronic.
13 Odmítnutí záruky
NÁSLEDUJÍCÍ ODMÍTNUTÍ ZÁRUKY SE VZTAHUJE NA ZÁKAZNÍKY MIMO USA:
AČKOLI JE BIOPROTÉZE AVALUS MODEL 400, DÁLE NAZÝVANÉ „VÝROBEK“, PŘED PRODEJEM VĚNOVÁNA PEČLIVÁ
POZORNOST VE FÁZI JEJÍ KONSTRUKCE, VÝROBY I ZKOUŠEK, JE MOŽNÉ, ŽE VÝROBEK Z RŮZNÝCH DŮVODŮ
PŘESTANE USPOKOJIVĚ VYKONÁVAT ZAMÝŠLENOU FUNKCI. VAROVÁNÍ UVEDENÁ V DOKUMENTACI K VÝROBKU
POSKYTUJÍ PODROBNĚJŠÍ INFORMACE A JSOU POVAŽOVÁNA ZA NEDÍLNOU SOUČÁST TOHOTO ODMÍTNUTÍ ZÁRUKY.
SPOLEČNOST MEDTRONIC PROTO ODMÍTÁ VŠECHNY ZÁRUKY TÝKAJÍCÍ SE TOHOTO VÝROBKU, AŤ UŽ PŘÍMÉ NEBO
PŘEDPOKLÁDANÉ. SPOLEČNOST MEDTRONIC NEODPOVÍDÁ ZA JAKÉKOLIV NÁHODNÉ NEBO NÁSLEDNÉ ŠKODY
ZPŮSOBENÉ POUŽITÍM, VADOU NEBO SELHÁNÍM VÝROBKU, BEZ OHLEDU NA TO, VYPLÝVÁ-LI NÁROK ZE ZÁRUKY,
SMLOUVY, PROTIPRÁVNÍHO ČINU ČI Z JINÉHO DŮVODU.
Záměrem výše uvedených výjimek a omezení není porušování závazných nařízení příslušných právních předpisů a ani by tak neměly
být interpretovány. Pokud bude kterákoli část nebo podmínka tohoto ODMÍTNUTÍ ZÁRUKY shledána příslušným soudem jako
protiprávní, nevynutitelná nebo v rozporu s příslušnými právními předpisy, nemá to vliv na platnost zbývající části tohoto ODMÍTNUTÍ
ZÁRUKY a všechna práva a závazky budou chápány a uplatněny tak, jako by toto ODMÍTNUTÍ ZÁRUKY neobsahovalo tuto konkrétní
část nebo podmínku, která byla shledána neplatnou.
26Česky
Page 27

1 Beskrivelse af enheden
3
2
1
4
5
Avalus-bioprotese model 400 består af en polyesterdækket bundramme og en trefliget støtteramme, der er formet efter en trefliget
klaps geometri. Bundrammen og den trefligede støtteramme er injektionsstøbt af materialet polyetheretherketon (PEEK).
PEEK-materialet i bundrammen er imprægneret med bariumsulfat for at muliggøre røntgenvisualisering. Fligene er laserskåret af
bovint væv, der er blevet krydsbundet i bufferet glutaraldehyd. Fligene indsættes mellem den trefligede støtteramme og bundrammen,
hvorefter alle komponenter sys fast sammen. En suturring fremstillet af polyesterstof er integreret i indløbsbundrammens hylster, så
brugeren kan suturere og anbringe Avalus-bioprotesen i den supra-annulære position. Der er symarkører på suturringen i det
midterste sinusområde af hver flig, så mellemrummene mellem implanteringssuturerne bliver ensartede (Figur 1). Der er fastgjort en
engangsholder til klappens udløb for at lette implantering. Aortabioprotesen (klap) er behandlet med en alpha-amino oleinsyre
anti-mineraliseringsproces (AOA), som i dyreforsøg har vist sig at mindske forkalkning af porcinfligene.
Engangsholderen er beregnet til brug sammen med det genbrugelige klaphåndtag model 7420 fra Medtronic. Holderen kan fjernes
fra klappen med et enkelt snit. Størrelsesmålere med to ender bruges til at vælge den korrekte klapstørrelse. Cylinderenden svarer
til klapåbningen. Replikaenden immiterer protesens geometri.
Tabel 1. Tilgængelige størrelser og diametre på suturringe (nominelle værdier i millimeter)
Størrelse 19 mm 21 mm 23 mm 25 mm 27 mm 29 mm
(1) Stentdiameter (TAD) 19 21 23 25 27 29
(2) Orificiets interne diameter 17,5 19,5 21,5 23,5 25,5 27,5
(2a) Orificiets interne diameter
(3) Suturringens eksterne diameter 27,0 29,0 31,0 33,0 36,0 38,0
(4) Klapprofilhøjde 13,0 14,0 15,0 16,0 17,0 18,0
(5) Aorta-fremspring 11,0 12,0 13,0 14,0 15,0 16,0
a
18 20 22 24 26 28
Bemærk: TAD – diameter på vævsannulus
a
Målinger viser stentramme inklusive væv (2) og stentramme eksklusive væv (2a)
2 Indikationer for brug
Avalus-bioprotesen er indikeret til udskiftning af en syg, beskadiget eller fejlfungerende nativ aortaklap eller aortaklapprotese.
3 Kontraindikationer
Klappen må ikke anvendes, hvis det ikke gavner patienten. Evaluer alle de involverede risici, herunder anatomi og patologi, der
observeres på tidspunktet for indgrebet.
4 Advarsler og forholdsregler
4.1 Advarsler
• Enheden er udelukkende beregnet til engangsbrug. Enheden må ikke genanvendes, genbehandles eller resteriliseres.
Genanvendelse, genbehandling eller resterilisering kan forringe enhedens strukturelle integritet eller skabe risiko for
kontaminering, hvilket kan føre til personskade, -sygdom eller -død.
• Klappen må ikke resteriliseres på nogen måde. Udsættelse af klappen og dens beholder for bestråling, damp, etylenoxid eller
andre kemiske steriliseringsmidler vil gøre klappen uegnet til brug.
• Kontrollér indikatoren for forsendelsestemperatur inde i emballagen. Hvis indikatorvinduet for forsendelsestemperatur er sort, er
klappen ikke egnet til klinisk brug.
• Klappen må ikke anvendes, hvis:
– Klappen er blevet tabt, beskadiget eller på anden måde håndteret forkert
– Sidste anvendelsesdato er overskredet
– Alle forseglinger er beskadigede
– Serienummermærket ikke stemmer overens med nummeret på beholderens etiket
– Glutaraldehydopløsningen til opbevaring ikke dækker klappen helt, eller emballagen lækker væske
– Der er tegn på nedbrydning af klappen
27 Dansk
Page 28

• Klappens vævsdel må ikke håndteres med instrumenter. Der skal udvises den største omhyggelighed for ikke at beskadige
klappens skrøbelige væv. Selv den mindste perforation kan vokse sig større med tiden og medføre væsentlige forstyrrelser i
klapfunktionen.
• Forsøg ikke at reparere en beskadiget klap. En beskadiget klap må ikke anvendes.
• Der må ikke tilsættes antibiotika eller andre stoffer til opbevaringsvæsken eller skyllevæsken.
• Forsøg ikke at indføre en klap, der er for stor til annulus. Vælg en klap, der passer godt i aortaroden uden at deformere den native
anatomi eller Avalus-bioprotesen.
• Der må ikke anvendes klapstørrelsesmålere fra andre producenter eller størrelsesmålere til andre proteser fra Medtronic til måling
af klappen.
• Klappen må ikke tørre ud. Under implanteringen skal klappen regelmæssigt oversprøjtes med normal, steril saltvandsopløsning,
så klapvævet ikke tørrer ud.
4.2 Forholdsregler
• Disse mulige risici skal nøje overvejes, når der vælges en egnet klaperstatning:
– Forkalkningsdegenerering kan fremskynde nedbrydningen af klappen hos personer med ændret kalciumstofskifte (for
eksempel kronisk nyresvigt, hyperparathyreoidisme).
– Forkalkning kan forekomme tidligere hos børn, teenagere eller yngre voksne.
– Præmatur forkalkning kan også forekomme hos ældre voksne, der accepterer en bioprotese.
– Patienter med en bioprotese, der kræver kronisk antikoagulationsbehandling, er udsat for større risiko for blødning.
• Den ikke-sterile yderside af klapbeholderen må ikke anbringes i det sterile felt.
• Avalus-størrelsesmålere model 7400S eller Medtronic-klaphåndtag model 7420 må ikke anvendes, før de er blevet grundigt
renset og steriliseret. Se i de relevante instruktioner for at få flere oplysninger.
• Når der vælges en klapstørrelse, er det nødvendigt at tage patientens anatomi i betragtning og vælge en klap, som
opfylder patientens hæmodynamiske krav tilstrækkeligt.
• En klap må ikke implanteres, før de korrekte skylleprocedurer er blevet udført.
• Vend stentposterne, og anbring klappen, så koronarostierne ikke blokeres.
• Det skal undgås, at klappen eller skylleopløsningen kommer i kontakt med håndklæder, linned eller andre kilder, der kan overføre
partikler til fligvævet.
• Identificér klappens indløb og udløb, inden der sutureres.
• Der skal udvises forsigtighed, når suturerne anbringes gennem suturringe, for at undgå rifter i fligvævet. Klappen skal
eksplanteres og skiftes ud, hvis fligvævet er beskadiget.
• Undgå at bruge skærende nåle, ubeskyttede tænger eller skarpe instrumenter, der kan beskadige klappens struktur.
• Overvej risikoen for beskadigelser, inden der føres katetre, kirurgiske instrumenter og transvenøse stimuleringselektroder
igennem klappen.
• Når der anvendes knudesuturer, er det vigtigt, at suturerne klippes tæt ved knuderne. Sørg for, at fritlagte suturender ikke kan
komme i kontakt med fligvævet.
• Bioprotesens kommissurer må ikke bøjes, når knuderne bindes.
• Fligvævet må ikke berøres.
• Undgå længerevarende kontakt med klappens opbevaringsvæske. Længerevarende udsættelse for glutaraldehyd kan forårsage
øjen-, næse-, hud- og halsirritation. Undgå længerevarende udsættelse for, eller indånding af, de kemiske dampe. Må kun bruges
med tilstrækkelig udluftning. Hvis der opstår hudkontakt, skal det berørte område straks skylles med rigelige mængder vand i 10
til 15 minutter. I tilfælde af øjenkontakt skal øjet skylles med vand i 15 minutter, og der skal straks søges lægehjælp.
5 Mulige bivirkninger
Mulige komplikationer i forbindelse med anvendelse af bioprotese-hjerteklapper inkluderer:
• Angina
• Uregelmæssig hjerterytme
• Endocarditis
• Hjerteinsufficiens
• Hæmolyse
• Hæmolytisk anæmi
• Blødning, relateret til antikoagulant/antiplatelet
• Lækage, transvalvulær eller paravalvulær
• Myokardieinfarkt
28Dansk
Page 29

• Ikke-strukturel dysfunktion (fastklemning/berøring af flig, obstruktiv pannus indvækst, sutur-rupturer, forkert opmåling af størrelse
mv.)
• Proteseregurgitation
• Apopleksi
• Strukturel forringelse (forkalkning, afrivning af flig, stenose mv.)
• Tromboemboli
• Klaptrombose
Disse komplikationer kan føre til:
• Reoperation
• Eksplantering af bioprotesen
• Permanent invaliditet
• Død
6 Brugsanvisning
6.1 Instruktioner for håndtering og forberedelse
Korrekt udvælgelse af størrelse er en meget vigtig del af hjerteklapudskiftningen. Brug Avalus-størrelsesmålere model 7400S til at
vælge en Avalus-bioprotese i den korrekte størrelse. Se yderligere information i brugsanvisningen.
Beholderens yderside og låg er ikke-sterile. Klappen og alle indvendige emballagedele i beholderen er sterile og skal behandles i det
sterile operationsfelt.
1. Klargør to skylleskåle, der hver indeholder 500 ml steril, normal saltvandsopløsning.
2. Undersøg forseglingerne, og kontrollér, at beholderen ikke er beskadiget eller har været åbnet. Klappen må ikke bruges, hvis alle
forseglingerne er beskadigede.
3. Skru låget i retning mod uret, og åbn beholderen (Figur 2).
4. Hold den indvendige holder med tommel- og pegefinger. Løft langsomt klappen ud af beholderen, så glutaraldehydopløsningen
til opbevaring kan løbe af (Figur 3).
5. Kontrollér, at serienummeret på den indvendige holder stemmer overens med det, der er angivet på beholderens låg,
opbevaringsæsken og patientens registreringsformular. Opbevar serienummeret i patientens journal ved hjælp af de
klistermærker, der findes på patientregistreringsformularen.
6. Hold den indvendige holder lodret/opad. Tag den indvendige holders hætte af ved at dreje den i retning mod uret ved hjælp af
tommel- og pegefingeren (Figur 4). Holderen er nu synlig.
7. Sæt et sterilt håndtag i holderen. Drej håndtaget med uret ind i den gevindskårne åbning i holderen, indtil der mødes modstand
Figur 5.
8. Fjern klappen fra den indvendige holder ved at trække opad i håndtaget (Figur 6).
6.2 Skylleprocedure
1. Læg hele klappen og holderen i en af skylleskålene (Figur 6).
2. Brug håndtåget til at skylle klappen konstant i mindst 30 sekunder.
3. Klem forsigtigt på syringen for at fjerne enhver rest af glutaraldehyd. Rør ikke ved klappens vævsdel.
4. Anbring klappen i den anden skål. Opbevar klappen i skylleskålen, indtil kirurgen har brug for den.
6.3 Implantering af aortaklap
Avalus-bioprotesen er beregnet til implantering i den supra-annulære position. Brug Avalus-størrelsesmålere model 7400S til at
visualisere anbringelsen af suturmanchetten over annulus og til at bekræfte placering og tilpasning af klappen i det supra-annulære
rum.
Det er op til kirurgen at vælge kirurgisk teknik ved implantering i den supra-annulære position. Enhver modificeret teknik skal være i
overensstemmelse med Kapitel 4, Advarsler og forholdsregler, side 27. Overordnet set skal disse trin følges:
1. Drej klappen, så stenten og suturringen ikke obstruerer de koronare ostia.
2. Oversprøjt klappen regelmæssigt med normal, steril saltvandsopløsning for at forhindre udtørring af det skrøbelige væv.
3. Anbring klappen i annulus, og læg suturerne i suturringen.
4. Suturér klappen på plads ved hjælp af en passende suturteknik. Se Kapitel 4, Advarsler og forholdsregler, side 27 for at undgå
potentielle problemer.
5. Frigør holderen ved at klippe suturerne på det sted for et enkelt snit, der er angivet af den hvide pil (Figur 7). Fjern holderen ved
at trække håndtaget forsigtigt væk fra klappen.
29 Dansk
Page 30

6. Fjern holderen fra håndtaget, og bortskaf holderen.
7. Bind alle knuder, og klip suturenderne af. Kontrollér, at der ikke er nogen rester af sutur tilbage. Hvis der er suturrester tilbage,
skal de fjernes, inden klapimplanteringen gennemføres.
7 Individualiseret behandling
Patienter, der får en bioprotese-hjerteklap, skal forblive i antikoagulationsbehandling i den første tid efter implanteringen, medmindre
det er kontraindikeret.
Overvej langvarig antikoagulationsbehandling eller trombocytfunktionshæmmende behandling hos patienter med dilateret venstre
atrie, tidligere tromboemboliske hændelser eller en hjerterytme med atrieflimren eller -flagren.
8 Rådgivning af patienten
Fortsat lægelig opfølgning (mindst én gang årligt) anbefales, så komplikationer i forbindelse med klappen kan diagnosticeres og
behandles korrekt.
Patienter med en bioprotese-klap har risiko for bakteriæmi (f.eks. ved tandlægebehandling). Informer patienten om profylaktisk
behandling med antibiotika.
Sørg for at opfordre patienterne til altid at medbringe det identitetskort vedrørende den implanterede enhed, som Medtronic leverer.
9 Levering
9.1 Emballage
Avalus-bioprotesen er kemisk steriliseret og leveres steril i en bufferet 0,2% glutaraldehydopløsning. Steriliteten ophører, hvis
glasbeholderen og lågbeholderen åbnes eller beskadiges. Ydersiden af beholderen er ikke steril. Undlad at placere den i det sterile
felt.
9.2 Opbevaring
Opbevar Avalus-bioprotesen ved mellem 5°C og 25°C (41°F og 77°F). Nedkøling er ikke nødvendig, og frysning kan beskadige
klappen. Opbevaring ved stuetemperatur op til 25°C (77°F) er tilstrækkeligt. Klappen må ikke udsættes for sollys eller andre
ultraviolette lyskilder eller anbringes på steder, hvor der kan forekomme signifikante temperaturudsving.
Oprethold hensigtsmæssig lagerkontrol, således at bioproteser med tidligereliggende udløbsdato implanteres først, så overskridelse
af holdbarhedsdatoen undgås.
9.3 Returnering af eksplanterede bioproteser
Kontakt en repræsentant fra Medtronic for at anmode om et produktreturneringssæt for at returnere eksplanterede bioproteser med
henblik på analyse og bortskaffelse. Hvis der ikke er et sæt ledigt, så anbring den eksplanterede bioprotese i en beholder fyldt med
glutaraldehyd eller 10% bufferjusteret formalin umiddelbart efter eksplantering. For yderligere oplysninger om returnering kontaktes
en lokal repræsentant fra Medtronic.
10 Patientoplysninger
10.1 Registreringsoplysninger
Bemærk: Registrering af patienter er ikke påkrævet i lande, hvor lovgivningen om databeskyttelse ikke tillader, at der indhentes
oplysninger om patienter. Dette gælder også for lande i EU.
Der medfølger en patientregistreringsblanket sammen med hver enhed. Udfyld alle de påkrævede oplysninger efter implantationen.
Returner originalen til den Medtronic-adresse, der står på blanketten. Udlever det midlertidige identifikationskort til patienten inden
udskrivelsen.
Patienten vil få udleveret et identifikationskort for implanterede enheder. Kortet indeholder navn og telefonnummer på patientens
læge samt andre oplysninger, som sundhedspersonalet kan have brug for i en nødsituation.
11 Postoperativ information
11.1 Kompatibilitet med MR-scanning
Avalus-bioprotese model 400 er MR-sikker (magnetisk resonans). Klappen indeholder ingen metaller og udgør derfor ingen kendt
risiko i et MR-scanningsmiljø.
MR-scanning ved 3,0 T og 1,5 T kan udføres umiddelbart efter implanteringen. Klappen vil ikke på nogen måde skade patienten ved
udsættelse for MR-scanning.
30Dansk
Page 31

11.2 Billedartefakt
MR-billedkvaliteten kan påvirkes ved scanning på eller i nærheden af klappens position. Om nødvendigt kan parametrene for
MR-scanning optimeres på grund af tilstedeværelsen af klappen.
12 Tilbehør
Anvend kun Avalus-størrelsesmålere model 7400S og Medtronic klaphåndtag model 7420 til bestemmelse af den korrekte størrelse
af Avalus-bioprotesen.
Forsigtig: Størrelsesmålerne og håndtagene må ikke anvendes, før de er blevet omhyggeligt rengjort og steriliseret. Se i de relevante
instruktioner for at få flere oplysninger.
Forsigtig: Der må ikke anvendes klapstørrelsesmålere fra andre producenter eller størrelsesmålere fra andre Medtronic-proteser til
måling af Avalus-bioprotesen.
13 Ansvarsfraskrivelse
FØLGENDE ANSVARSFRASKRIVELSE GÆLDER FOR KUNDER UDEN FOR USA:
SELVOM AVALUS-BIOPROTESEN MODEL 400, I DET FØLGENDE KALDET "PRODUKTET", ER OMHYGGELIGT DESIGNET,
FREMSTILLET OG AFPRØVET FØR SALG, KAN DER AF MANGE GRUNDE VÆRE EN RISIKO FOR, AT PRODUKTET IKKE
FUNGERER TILFREDSSTILLENDE EFTER HENSIGTEN. ADVARSLERNE, SOM FREMGÅR AF PRODUKTETS MÆRKATER,
GIVER NÆRMERE OPLYSNINGER OG BETRAGTES SOM EN INTEGRERET DEL AF DENNE ANSVARSFRASKRIVELSE.
MEDTRONIC FRASKRIVER SIG DERFOR ALLE GARANTIER, UDTRYKKELIGE SÅVEL SOM STILTIENDE, I FORHOLD TIL
PRODUKTET. MEDTRONIC KAN IKKE HOLDES ANSVARLIG FOR TILFÆLDIGE SKADER ELLER FØLGESKADER SOM
FØLGE AF BRUG AF PRODUKTET ELLER DETS DEFEKT ELLER FEJLFUNKTION, UANSET OM KRAVET BASERES PÅ
GARANTIRET, AFTALERET, ERSTATNINGSRET ELLER ANDET.
Ovennævnte undtagelser og begrænsninger har ikke til hensigt at være, og må ikke fortolkes som værende, i modstrid med
ufravigelige bestemmelser i gældende lov. Hvis nogen del af eller betingelse i denne ANSVARSFRASKRIVELSE af en kompetent
retsinstans anses for ulovlig, uden retskraft eller i konflikt med gældende lovgivning, berøres den resterende del af
ANSVARSFRASKRIVELSEN ikke, og alle rettigheder og forpligtelser skal tolkes og håndhæves, som om denne
ANSVARSFRASKRIVELSE ikke indeholdt det pågældende afsnit eller vilkår, der anses for ugyldigt.
31 Dansk
Page 32

1 Beschreibung
3
2
1
4
5
Die Avalus Bioprothese Modell 400 besteht aus einem polyesterbeschichteten Basisgerüst und einem dreisegeligen Stützgerüst, das
entsprechend der Geometrie einer dreisegeligen Klappe geformt ist. Das Basisgerüst und das dreisegelige Stützgerüst werden unter
Verwendung von Polyetheretherketon (PEEK) im Spritzgussverfahren hergestellt. Zur Erleichterung der Visualisierung unter
Durchleuchtung wird das PEEK-Material des Basisgerüsts mit Bariumsulfat imprägniert. Die Segel werden mithilfe eines Lasers aus
bovinem Gewebe zugeschnitten und in gepufferter Glutaraldehydlösung vernetzt. Die Klappensegel werden zwischen das
dreisegelige Stützgerüst und das Basisgerüst eingeführt und anschließend werden alle Komponenten sicher zusammen vernäht. In
die Einlass-Basisgerüstbeschichtung wurde ein Nahtring aus Polyestergewebe integriert, um das Vernähen und das Ausrichten der
Avalus Bioprothese in der supraanulären Position zu ermöglichen. Auf dem Nahtring befinden sich im mittleren Sinusbereich jedes
Herzklappensegels Nahtmarkierungen, die beim Anlegen der Implantationsnähte in gleichmäßigem Abstand als Anhaltspunkt
dienen können (Abbildung 1). Am Auslass der Herzklappe ist ein Einweghalter angebracht, um die Implantation zu erleichtern. Die
aortale Bioprothese (Herzklappe) wird im AOA-Verfahren einem α-Amino-Ölsäuren-Antimineralisationsprozess unterzogen. Dieser
Prozess führt im Tierversuch nachweislich zu einer reduzierten Kalzifizierung von Schweineklappensegeln.
Der Einweghalter ist für den wiederverwendbaren Medtronic Herzklappenhandgriff Modell 7420 vorgesehen. Der Halter weist einen
einzigen Durchtrennungspunkt zum Lösen des Halters von der Herzklappe auf. Zur Bestimmung der geeigneten Größe der
Herzklappe werden doppelköpfige Obturatoren verwendet. Der Kolbenkopf stellt die Klappenöffnung dar. Der Klappenkopf bildet die
Geometrie der Prothese nach.
Tabelle 1. Verfügbare Größen und Nahtringdurchmesser (Nominalwerte in Millimeter)
Größe 19 mm 21 mm 23 mm 25 mm 27 mm 29 mm
(1) Durchmesser des Stents (TAD) 19 21 23 25 27 29
(2) Innendurchmesser der Öffnung 17,5 19,5 21,5 23,5 25,5 27,5
(2a) Innendurchmesser der Öffnung
(3) Außendurchmesser des Nahtrings 27,0 29,0 31,0 33,0 36,0 38,0
(4) Klappenprofilhöhe 13,0 14,0 15,0 16,0 17,0 18,0
(5) Protrusion (Aorta) 11,0 12,0 13,0 14,0 15,0 16,0
a
18 20 22 24 26 28
Hinweis: TAD (tissue annulus diameter) – Durchmesser des Gewebeanulus
a
Die Maße entsprechen dem Stentrahmen einschließlich Gewebe (2) bzw. dem Stentrahmen ohne Gewebe (2a)
2 Indikationen
Die Avalus Bioprothese ist als Ersatz einer erkrankten, beschädigten oder fehlfunktionierenden nativen oder prothetischen
Aortenklappe indiziert.
3 Kontraindikationen
Verwenden Sie die Klappe nicht, wenn dies nicht im Interesse des Patienten ist. Beurteilen Sie alle assoziierten Risiken, einschließlich
der Anatomie und Pathologie, wie sie sich zum Zeitpunkt der Operation darstellen.
4 Warnhinweise und Vorsichtsmaßnahmen
4.1 Warnhinweise
• Dieses Produkt ist für die einmalige Verwendung bestimmt. Dieses Produkt nicht wiederverwenden, erneut aufbereiten oder
erneut sterilisieren. Wiederverwendung, Aufbereitung oder Resterilisation können die strukturelle Integrität des Produkts
beeinträchtigen oder eine Kontamination bewirken, die zu Verletzung, Erkrankung oder zum Tod des Patienten führen kann.
• Die Klappe darf auf keinen Fall resterilisiert werden. Die Klappe darf nicht mehr verwendet werden, wenn sie selbst oder ihr
Behälter Strahlung, Dampf, Ethylenoxid oder anderen chemischen Sterilisationsmitteln ausgesetzt wurde.
• Überprüfen Sie die Versandtemperaturanzeige in der Verpackung. Wenn das Indikatorfenster der Versandtemperaturanzeige
schwarz ist, darf die Herzklappe nicht mehr verwendet werden.
• In den folgenden Fällen darf die Klappe nicht verwendet werden:
– Die Klappe ist zu Boden gefallen, wurde beschädigt oder falsch behandelt.
– Das Verwendbarkeitsdatum ist abgelaufen.
– Alle Siegelstreifen sind beschädigt.
32Deutsch
Page 33

– Die Seriennummer auf dem Anhänger stimmt nicht mit der Nummer auf der Auszeichnung des Behälters überein.
– Die Glutaraldehyd-Aufbewahrungslösung bedeckt die Klappe nicht vollständig oder es tritt Flüssigkeit aus der Verpackung
aus.
– Die Klappe zeigt Anzeichen einer Qualitätsminderung.
• Handhaben Sie den Gewebeteil der Klappe nicht mit Instrumenten. Das empfindliche Klappengewebe muss mit äußerster
Sorgfalt vor Beschädigungen geschützt werden. Selbst eine minimale Perforation kann sich im Laufe der Zeit erweitern und zu
einer substanziellen Beeinträchtigung der Klappenfunktion führen.
• Versuchen Sie nicht, eine beschädigte Klappe zu reparieren. Eine beschädigte Klappe darf nicht verwendet werden.
• Setzen Sie der Aufbewahrungs- und der Spüllösung keine Antibiotika oder andere Substanzen zu.
• Versuchen Sie nicht, eine Herzklappe einzusetzen, die zu groß für den Anulus ist. Wählen Sie eine Klappe, die sicher in die
Aortenwurzel passt, ohne dass die native Anatomie oder die Avalus Bioprothese verformt wird.
• Verwenden Sie keine Obturatoren anderer Hersteller oder für andere Medtronic Prothesen vorgesehene Obturatoren, um die
geeignete Größe der Klappe zu bestimmen.
• Lassen Sie die Klappe nicht austrocknen. Um ein Austrocknen des Klappengewebes zu verhindern, spülen Sie die Klappe
während der Implantation regelmäßig mit steriler physiologischer Kochsalzlösung.
4.2 Vorsichtsmaßnahmen
• Berücksichtigen Sie diese Risiken bei der Auswahl einer passenden Klappenprothese:
– Bei Patienten mit verändertem Kalziumstoffwechsel (z. B. chronische Niereninsuffizienz, Hyperparathyreoidismus) kann die
Verkalkung eine Klappenschädigung beschleunigen.
– Eine Kalzifizierung kann bei Kindern, Jugendlichen und jüngeren Erwachsenen früher auftreten.
– Eine vorzeitige Kalzifizierung kann auch bei älteren Erwachsenen auftreten, die sich für eine Bioprothese entscheiden.
– Bei Patienten mit einer Bioprothese, für die eine chronische Antikoagulation erforderlich ist, besteht ein zusätzliches
Blutungsrisiko.
• Die Außenseite des Klappenbehälters ist unsteril. Legen Sie den Behälter nicht im Sterilbereich ab.
• Verwenden Sie den Avalus Obturator Modell 7400S und den Medtronic Herzklappenhandgriff Modell 7420 erst, nachdem beide
gründlich gereinigt und sterilisiert worden sind. Weitere Anweisungen finden Sie in den entsprechenden
Gebrauchsanweisungen.
• Bei der Auswahl der Klappengröße müssen die anatomischen Gegebenheiten des Herzens berücksichtigt werden.
Zudem muss darauf geachtet werden, dass die gewählte Klappe den hämodynamischen Anforderungen des
Patienten gerecht wird.
• Implantieren Sie die Klappe erst, wenn sie zuvor in geeigneter Weise gespült wurde.
• Richten Sie die Stentstreben und die Herzklappe so aus, dass die Koronarostien dadurch nicht blockiert werden.
• Vermeiden Sie den Kontakt der Klappe oder der Spüllösung mit Handtüchern, Textilien oder anderen Quellen, durch die Partikel
auf das Klappensegelgewebe übertragen werden könnten.
• Bestimmen Sie vor dem Vernähen den Einfluss und den Ausfluss der Klappe.
• Platzieren Sie Nähte mit großer Vorsicht im Nahtring, um mögliche Verletzungen des Klappensegelgewebes zu vermeiden. Sollte
das Klappensegelgewebe beschädigt sein, muss die Herzklappe explantiert und ausgetauscht werden.
• Verwenden Sie keine schneidenden Nadeln, ungeschützten Zangen oder scharfen Instrumente, da diese die Klappe
beschädigen könnten.
• Beachten Sie unbedingt, dass das Durchführen von Kathetern, chirurgischen Instrumenten oder transvenösen
Stimulationselektroden durch die Bioprothese stets die Gefahr einer Beschädigung birgt.
• Wenn Sie eine Einzelstichnaht verwenden, schneiden Sie die Nahtfäden dicht am Knoten ab. Achten Sie darauf, dass die
freiliegenden Fadenenden das Gewebe der Klappensegel nicht berühren.
• Biegen Sie die Kommissuren der Bioprothese beim Festziehen der Knoten nicht.
• Fassen Sie die Klappensegel nicht mit der Hand oder mit Instrumenten an.
• Vermeiden Sie längeren Kontakt mit der Aufbewahrungslösung für die Klappe. Glutaraldehyd kann bei längerem Kontakt zur
Reizung von Augen, Nase, Haut und Hals führen. Vermeiden Sie länger andauernden Kontakt mit oder Inhalation des
chemischen Dampfs. Achten Sie stets auf ausreichende Lüftung. Bei Hautkontakt den betroffenen Bereich sofort
10 bis 15 Minuten lang mit reichlich Wasser abspülen. Spülen Sie bei Augenkontakt das Auge 15 Minuten lang mit Wasser und
holen Sie sofort ärztlichen Rat ein.
5 Mögliche Nebenwirkungen
Zu den möglichen Nebenwirkungen bei der Verwendung biologischer Herzklappenprothesen gehören:
33 Deutsch
Page 34

• Angina pectoris
• Herzrhythmusstörungen
• Endokarditis
• Herzversagen
• Hämolyse
• hämolytische Anämie
• Hämorrhagien (ausgelöst durch Antikoagulanzien/Thrombozytenaggregationshemmer)
• Lecks (transvalvulär oder paravalvulär)
• Myokardinfarkt
• nichtstrukturelle Dysfunktion (Behinderung des Klappenschlusses durch Segelreste, obstruktives Einwachsen des Pannus,
Klaffen einer Naht, falsche Größe usw.)
• Protheseninsuffizienz
• Schlaganfall
• strukturelle Degeneration (Kalzifizierung, Klappensegelriss, Stenosierung usw.)
• Thromboembolie
• Klappenthrombose
Diese Komplikationen können zur Folge haben:
• Reoperation
• Explantation der Bioprothese
• Dauerinvalidität
• Tod
6 Gebrauchsanweisung
6.1 Handhabung und Vorbereitung
Die Auswahl der richtigen Prothesengröße ist beim Herzklappenersatz von größter Bedeutung. Verwenden Sie zur Auswahl der
geeigneten Größe für die Avalus Bioprothese die Avalus Obturatoren Modell 7400S. Weitere Informationen hierzu finden Sie in der
entsprechenden Gebrauchsanweisung.
Die Außenflächen des Behälters und des Deckels sind unsteril. Die Klappe und alle im Inneren des Behälters befindlichen
Verpackungskomponenten sind steril und müssen im Sterilbereich gehandhabt werden.
1. Bereiten Sie 2 Spülbäder mit jeweils 500 ml steriler physiologischer Kochsalzlösung vor.
2. Untersuchen Sie die Siegelstreifen, um sicherzustellen, dass der Behälter unbeschädigt und bislang ungeöffnet ist. Verwenden
Sie die Klappe nicht, wenn alle Siegelstreifen beschädigt sind.
3. Drehen Sie den Deckel gegen den Uhrzeigersinn und öffnen Sie den Behälter (Abbildung 2).
4. Halten Sie den Träger mit Daumen und Zeigefinger. Heben Sie die Herzklappe langsam aus dem Behälter, damit die
Glutaraldehyd-Aufbewahrungslösung abfließen kann (Abbildung 3).
5. Vergewissern Sie sich, dass die Seriennummer am Träger mit der Seriennummer auf dem Deckel des Behälters, dem Umkarton
und dem Patientenregistrierungsformular übereinstimmt. Vermerken Sie die Seriennummer in der Patientenakte. Verwenden
Sie dafür die Aufkleber auf dem Patientenregistrierungsformular.
6. Halten Sie den Träger aufrecht. Drehen Sie den Trägerdeckel mit Daumen und Zeigefinger entgegen dem Uhrzeigersinn und
nehmen Sie den Trägerdeckel ab (Abbildung 4). Jetzt ist der Halter zu sehen.
7. Setzen Sie einen sterilen Handgriff in den Halter ein. Schrauben Sie den Handgriff im Uhrzeigersinn in die Gewindeöffnung des
Halters, bis Sie Widerstand verspüren (Abbildung 5).
8. Ziehen Sie die Klappe mit dem Handgriff senkrecht nach oben aus dem Träger (Abbildung 6).
6.2 Spülverfahren
1. Geben Sie die ganze Herzklappe samt Halter in eines der Spülbecken (Abbildung 6).
2. Schwenken Sie die Herzklappe mithilfe des Handgriffs kontinuierlich mindestens 30 Sekunden lang.
3. Drücken Sie dabei behutsam den Nahtring, um die Glutaraldehyd-Aufbewahrungslösung vollständig zu entfernen. Berühren Sie
den Gewebeteil der Herzklappe dabei nicht.
4. Legen Sie die Herzklappe in das zweite Spülbad. Lassen Sie die Klappe im Spülbad, bis der Operateur sie anfordert.
34Deutsch
Page 35

6.3 Implantation der Aortenklappen-Bioprothese
Die Avalus Bioprothese ist für die Implantation in der supraanulären Position ausgelegt. Verwenden Sie die Avalus Obturatoren
Modell 7400S, um die Platzierung des Nahtrings über dem Anulus zu visualisieren und sich zu vergewissern, dass die Klappe in den
supraanulären Raum passt und dort gut sitzt.
Die Wahl der chirurgischen Technik für die Implantation in der supraanulären Position liegt im Ermessen des Operateurs. Jede
Abweichung der Operationstechnik sollte mit Kapitel 4, Warnhinweise und Vorsichtsmaßnahmen, Seite 32 in Einklang stehen.
Allgemein formuliert befolgen Sie diese Schritte:
1. Richten Sie die Herzklappe so aus, dass Stent oder Nahtring keine Obstruktion der Koronarostien verursachen.
2. Spülen Sie die Herzklappe regelmäßig mit steriler physiologischer Kochsalzlösung, um ein Austrocknen des empfindlichen
Klappengewebes zu verhindern.
3. Positionieren Sie die Herzklappe im Anulus und setzen Sie die Nähte im Nahtring.
4. Befestigen Sie die Herzklappe an der vorgesehenen Position mit einer geeigneten Nahttechnik. Beachten Sie Kapitel 4,
Warnhinweise und Vorsichtsmaßnahmen, Seite 32, um mögliche Probleme zu vermeiden.
5. Trennen Sie das Nahtmaterial an dem mit dem weißen Pfeil gekennzeichneten Durchtrennungspunkt, um den Halter zu lösen
(Abbildung 7). Ziehen Sie den Handgriff vorsichtig von der Herzklappe ab, um den Halter abzunehmen.
6. Entfernen Sie den Handgriff vom Halter und entsorgen Sie den Halter.
7. Ziehen Sie alle Knoten fest und schneiden Sie die Fadenenden ab. Vergewissern Sie sich, dass keine Fadenreste mehr
vorhanden sind. Eventuell vorhandene Fadenreste müssen vor Abschluss der Klappenimplantation entfernt werden.
7 Individuelle Gestaltung der Behandlung
Sofern keine Kontraindikation vorliegt, sind Patienten, die eine Herzklappen-Bioprothese erhalten, in der ersten Zeit nach der
Implantation unter Antikoagulationstherapie zu halten.
Eine Langzeit-Antikoagulations- oder Thrombozytenaggregationshemmer-Therapie sollte bei Patienten mit dilatiertem linkem
Vorhof, früheren thromboembolischen Ereignissen oder Vorhofflimmern oder -flattern erwogen werden.
8 Beratung und Aufklärung des Patienten
Es wird eine fortgesetzte medizinische Nachsorgeuntersuchung (mindestens jährlich) empfohlen, damit durch die Herzklappe
bedingte Komplikationen diagnostiziert und angemessen behandelt werden können.
Patienten mit Herzklappen-Bioprothesen sind dem Risiko einer Bakteriämie ausgesetzt (z. B. bei zahnärztlichen Eingriffen). Erklären
Sie dem Patienten die prophylaktische Antibiotikatherapie.
Instruieren Sie die Patienten dahingehend, dass sie die Implantat-Identifikationskarte von Medtronic jederzeit mit sich führen müssen.
9 Lieferform
9.1 Verpackung
Die Avalus Bioprothese wird einem chemischen Sterilisationsverfahren unterzogen und steril in einer gepufferten 0,2-prozentigen
Glutaraldehyd-Aufbewahrungslösung geliefert. Wenn der Glasbehälter oder der Deckel geöffnet oder beschädigt ist, ist die Sterilität
beeinträchtigt. Die Außenseite des Behälters ist nicht steril. Legen Sie den Behälter deshalb nicht im Sterilbereich ab.
9.2 Lagerung
Lagern Sie die Avalus Bioprothese zwischen 5°C und 25°C (41°F und 77°F). Kühlung ist nicht erforderlich. Einfrieren kann die
Herzklappe beschädigen. Eine Lagerung bei Raumtemperaturen bis zu 25°C (77°F) ist ausreichend. Schützen Sie die Herzklappe
vor Sonnenlicht oder anderen UV-Lichtquellen und lagern Sie sie nicht, wo sie erheblichen Temperaturschwankungen ausgesetzt
wäre.
Führen Sie eine ausreichende Bestandskontrolle durch, damit Bioprothesen mit früherem Verfallsdatum zuerst implantiert werden
und das Erreichen von Verfallsdaten vermieden wird.
9.3 Rücksendung explantierter Bioprothesen
Sets für die Einsendung explantierter Bioprothesen zur Untersuchung und Entsorgung erhalten Sie von Ihrem Medtronic
Repräsentanten. Sollte kein Set verfügbar sein, legen Sie die explantierte Bioprothese unmittelbar nach der Explantation in einen mit
Glutaraldehydlösung oder gepufferter Formalinlösung (10 %) gefüllten Behälter. Weitere Anweisungen zum Einsenden erhalten Sie
von Ihrem Medtronic Repräsentanten.
35 Deutsch
Page 36

10 Patientendaten
10.1 Informationen zur Registrierung
Hinweis: In Ländern wie denen der Europäischen Union, in denen die Datenschutzrichtlinien die Erfassung der Patientendaten
untersagen, erfolgt keine Registrierung des Patienten.
Der Verpackung des Produkts liegt ein Formular zur Registrierung des Patienten bei. Bitte tragen Sie nach der Implantation alle
benötigten Angaben ein. Senden Sie das Original des Formulars an die darauf angegebene Anschrift von Medtronic. Überreichen Sie
dem Patienten vor der Entlassung die temporäre Identifikationskarte.
Dem Patienten wird eine Implantat-Identifikationskarte ausgehändigt. Diese Karte enthält den Namen und die Telefonnummer des
behandelnden Arztes sowie alle Daten, die medizinisches Personal in einem Notfall benötigen könnte.
11 Nach dem Eingriff zu beachten
11.1 Sicherheit bei Magnetresonanztomografie (MRT)
Die Avalus Bioprothese Modell 400 ist MR-sicher. Die Herzklappe enthält kein Metall und kann daher nach aktuellem Wissensstand
ohne Bedenken MRT-Systemen aller Art ausgesetzt werden.
MRT-Aufnahmen bei 3,0 T und 1,5 T können unmittelbar nach der Implantation gemacht werden. Die Klappe schädigt den Patienten
während einer MRT-Aufnahme nicht.
11.2 Bildartefakte
Bei Aufnahmen in Klappenposition oder in ihrer Nähe kann die MRT-Bildqualität beeinträchtigt sein. Falls erforderlich, optimieren Sie
die MR-Bildgebungsparameter unter Berücksichtigung der Klappe.
12 Zubehörteile
Verwenden Sie ausschließlich Avalus Obturatoren Modell 7400S und den Medtronic Herzklappenhandgriff Modell 7420, um die
geeignete Größe der Avalus Bioprothese zu bestimmen.
Vorsicht: Verwenden Sie die Obturatoren oder Handgriffe erst, nachdem sie gründlich gereinigt und sterilisiert wurden. Weitere
Anweisungen finden Sie in den entsprechenden Gebrauchsanweisungen.
Vorsicht: Verwenden Sie keine Obturatoren anderer Hersteller oder für andere Medtronic Prothesen vorgesehene Obturatoren, um
die geeignete Größe der Avalus Bioprothese zu bestimmen.
13 Haftungsausschluss
DER FOLGENDE HAFTUNGSAUSSCHLUSS GILT FÜR KUNDEN AUSSERHALB DER USA:
TROTZ SORGFÄLTIGER KONSTRUKTION, HERSTELLUNG UND VOR VERKAUF DURCHGEFÜHRTER TESTDURCHLÄUFE
IST ES MÖGLICH, DASS DIE AVALUS BIOPROTHESE MODELL 400 – IM NACHFOLGENDEN ALS
„PRODUKT“ BEZEICHNET – AUS VERSCHIEDENSTEN GRÜNDEN NICHT ZUFRIEDENSTELLEND FUNKTIONIERT. DIE
WARNHINWEISE IN DER PRODUKTINFORMATION ENTHALTEN WEITERE DETAILLIERTE INFORMATIONEN UND SIND
ALS BESTANDTEIL DIESES HAFTUNGSAUSSCHLUSSES ANZUSEHEN. MEDTRONIC SCHLIESST DAHER JEDE
AUSDRÜCKLICHE ODER STILLSCHWEIGENDE GARANTIE IN BEZUG AUF DAS PRODUKT AUS. MEDTRONIC HAFTET
WEDER FÜR UNMITTELBARE NOCH MITTELBARE FOLGESCHÄDEN, DIE DURCH DEN GEBRAUCH, DURCH
STÖRUNGEN ODER FEHLFUNKTIONEN DES PRODUKTS ENTSTEHEN, UNABHÄNGIG DAVON, OB SICH DER ANSPRUCH
AUF SCHADENSERSATZ AUF EINE GARANTIE, EINEN VERTRAG, EINE UNERLAUBTE HANDLUNG ODER EINE ANDERE
ANSPRUCHSGRUNDLAGE STÜTZT.
Die hier aufgeführten Haftungsausschlüsse und -beschränkungen sollen nicht gegen geltendes Recht verstoßen und sind nicht
dahingehend auszulegen. Sollte ein zuständiges Gericht feststellen, dass dieser HAFTUNGSAUSSCHLUSS ganz oder teilweise
unwirksam, nicht durchsetzbar oder im Widerspruch zu geltendem Recht ist, berührt dies die Gültigkeit der restlichen Klauseln nicht.
Alle Rechte und Pflichten aus diesem HAFTUNGSAUSSCHLUSS sind so auszulegen und durchzuführen, als sei der für ungültig
erklärte Teil oder die ungültige Vorschrift in dem HAFTUNGSAUSSCHLUSS nicht enthalten.
36Deutsch
Page 37

1 Περιγραφή της συσκευής
3
2
1
4
5
Η βιοπρόσθεση Avalus, Μοντέλο 400, αποτελείται από μια δομή πλαισίου βάσης καλυμμένου με πολυεστέρα και τρίπτυχου
πλαισίου στήριξης με σχήμα αντίστοιχο της γεωμετρίας μιας τριγλώχινας βαλβίδας. Το πλαίσιο βάσης και το τρίπτυχο πλαίσιο
στήριξης έχουν διαμορφωθεί με έγχυση, με χρήση υλικού πολυαιθερικής αιθερικής κετόνης (PEEK: Polyetheretherketone). Το
υλικό PEEK του πλαισίου βάσης είναι εμποτισμένο με θειικό βάριο ώστε να είναι δυνατή η ακτινογραφική απεικόνιση. Οι γλωχίνες
έχουν κοπεί με λέιζερ από βόειο ιστό και έχουν σταυροσυνδεθεί σε ρυθμιστικό διάλυμα γλουταραλδεΰδης. Οι γλωχίνες έχουν
εισαχθεί μεταξύ του τρίπτυχου πλαισίου στήριξης και του πλαισίου βάσης, και όλα τα τμήματα έχουν συρραφθεί σταθερά μεταξύ
τους. Ένας δακτύλιος συρραφής, κατασκευασμένος από πολυεστερικό ύφασμα, είναι ενσωματωμένος στο κάλυμμα της πλευράς
εισροής του πλαισίου βάσης ώστε να επιτρέψει στον χρήστη να συρράψει και να τοποθετήσει τη βιοπρόσθεση Avalus στην επί του
δακτυλίου (supra-annular) θέση. Στον δακτύλιο συρραφής υπάρχουν δείκτες συρραφής στο μέσον της περιοχής του κόλπου κάθε
γλωχίνας, ώστε να παρέχουν καθοδήγηση για ομοιόμορφες αποστάσεις των ραμμάτων εμφύτευσης (Εικ. 1). Στην πλευρά εκροής
της βαλβίδας έχει προσαρτηθεί ένας συγκρατητήρας μίας χρήσης για να διευκολύνει την εμφύτευση. Η αορτική βιοπρόσθεση
(βαλβίδα) υποβάλλεται σε επεξεργασία με μια αντιμεταλλοποιητική διαδικασία άλφα-αμινοελαϊκού οξέος (AOA), η οποία, σε
μελέτες που έχουν γίνει σε ζώα, έχει επιδειχθεί ότι μετριάζει την αποτιτάνωση των χοίρειων γλωχίνων.
Ο συγκρατητήρας μίας χρήσης είναι σχεδιασμένος να εφαρμόζει στην επαναχρησιμοποιούμενη λαβή βαλβίδας της Medtronic,
Μοντέλο 7420. Ο συγκρατητήρας διαθέτει ένα μοναδικό σημείο κοπής για την αφαίρεση του συγκρατητήρα από τη βαλβίδα. Για
την επιλογή του κατάλληλου μεγέθους βαλβίδας χρησιμοποιούνται αμφίπλευροι μετρητές μεγέθους. Το κυλινδρικό άκρο
αντιπροσωπεύει το στόμιο της βαλβίδας. Το άκρο-αντίγραφο μιμείται τη γεωμετρία της πρόσθεσης.
Πίνακας 1. Διαθέσιμα μεγέθη και διάμετροι του δακτυλίου συρραφής (ονομαστικές τιμές σε χιλιοστά)
Μέγεθος 19 mm 21 mm 23 mm 25 mm 27 mm 29 mm
(1) Διάμετρος στεντ (TAD) 19 21 23 25 27 29
(2) Εσωτερική διάμετρος στομίου 17,5 19,5 21,5 23,5 25,5 27,5
(2α) Εσωτερική διάμετρος στομίου
(3) Εξωτερική διάμετρος δακτυλίου συρραφής 27,0 29,0 31,0 33,0 36,0 38,0
(4) Ύψος προφίλ βαλβίδας 13,0 14,0 15,0 16,0 17,0 18,0
(5) Αορτική προεξοχή 11,0 12,0 13,0 14,0 15,0 16,0
a
18 20 22 24 26 28
Σημείωση: TAD—διάμετρος ιστικού δακτυλίου
a
Η μέτρηση δείχνει το πλαίσιο του στεντ συμπεριλαμβανομένου του ιστού (2) και το πλαίσιο του στεντ χωρίς τον ιστό (2α)
2 Ενδείξεις χρήσης
Η βιοπρόσθεση Avalus ενδείκνυται για την αντικατάσταση φυσικής ή προσθετικής αορτικής βαλβίδας που είναι πάσχουσα, έχει
υποστεί βλάβη ή δυσλειτουργεί.
3 Αντενδείξεις
Μη χρησιμοποιείτε τη βαλβίδα εάν η χρήση της δεν είναι προς όφελος του ασθενούς. Αξιολογήστε όλους τους ενεχόμενους
κινδύνους, καθώς και την ανατομία και την παθολογία που παρατηρούνται κατά τη χρονική στιγμή της χειρουργικής επέμβασης.
4 Προειδοποιήσεις και προφυλάξεις
4.1 Προειδοποιήσεις
• Το παρόν προϊόν έχει σχεδιαστεί για μία μόνο χρήση. Μην επαναχρησιμοποιείτε, μην επανεπεξεργάζεστε και μην
επαναποστειρώνετε αυτό το προϊόν. Η επαναχρησιμοποίηση, η επανεπεξεργασία ή η επαναποστείρωση ενδέχεται να
διακυβεύσουν τη δομική ακεραιότητα του προϊόντος ή να δημιουργήσουν κίνδυνο μόλυνσης, που μπορεί να οδηγήσει σε
τραυματισμό, ασθένεια ή θάνατο του ασθενούς.
• Μην επαναποστειρώνετε τη βαλβίδα με καμία μέθοδο. Η έκθεση της βαλβίδας και του περιέκτη σε ακτινοβολία, ατμό,
οξείδιο του αιθυλενίου ή άλλα χημικά μέσα αποστείρωσης θα καταστήσει τη βαλβίδα ακατάλληλη για χρήση.
• Ελέγξτε την ένδειξη θερμοκρασίας αποστολής στο εσωτερικό του χάρτινου κουτιού. Εάν το παράθυρο της ένδειξης
θερμοκρασίας αποστολής είναι μαύρο, η βαλβίδα δεν είναι κατάλληλη για κλινική χρήση.
37 Ελληνικά
Page 38

• Μη χρησιμοποιείτε τη βαλβίδα σε οποιαδήποτε από τις ακόλουθες καταστάσεις:
– Η βαλβίδα έχει πέσει κάτω, έχει υποστεί ζημία ή κακό χειρισμό με οποιονδήποτε τρόπο
– Η ημερομηνία «Χρήση έως» έχει παρέλθει
– Όλες οι προστατευτικές ταινίες έχουν υποστεί ζημία
– Η ετικέτα με τον αριθμό σειράς δεν αντιστοιχεί στον αριθμό που βρίσκεται στην ετικέτα του περιέκτη
– Το διάλυμα φύλαξης γλουταραλδεΰδης δεν καλύπτει πλήρως τη βαλβίδα ή εάν διαρρέει υγρό από τη συσκευασία
– Η βαλβίδα παρουσιάζει ενδείξεις φθοράς/αλλοίωσης
• Μη χειρίζεστε το τμήμα ιστού της βαλβίδας με εργαλεία. Πρέπει να είστε άκρως προσεχτικοί για την αποτροπή βλάβης στον
ευαίσθητο ιστό της βαλβίδας. Ακόμα και μια μικρή διάτρηση θα μπορούσε να διευρυνθεί με την πάροδο του χρόνου,
προκαλώντας σημαντική εξασθένιση της λειτουργίας της βαλβίδας.
• Μην επιχειρήσετε να επιδιορθώσετε μια βαλβίδα η οποία έχει υποστεί ζημία. Μια βαλβίδα που έχει υποστεί ζημία δεν πρέπει
να χρησιμοποιηθεί.
• Μην προσθέτετε αντιβιοτικά ή οποιαδήποτε άλλη ουσία στο διάλυμα φύλαξης ή στο διάλυμα έκπλυσης.
• Μην επιχειρήσετε να εισαγάγετε μια βαλβίδα που είναι υπερβολικά μεγάλη για τον δακτύλιο. Επιλέξτε μια βαλβίδα που θα
εφαρμόζει με ασφάλεια στην αορτική ρίζα χωρίς να παραμορφώνετε την αυτόχθονη ανατομία ή τη βιοπρόσθεση Avalus.
• Μη χρησιμοποιείτε μετρητές μεγέθους βαλβίδας άλλων κατασκευαστών ή μετρητές μεγέθους για άλλη πρόσθεση της
Medtronic για να υπολογίσετε το μέγεθος της βαλβίδας.
• Μην αφήσετε τον ιστό της βαλβίδας να ξηρανθεί. Για να αποτρέψετε ξήρανση του ιστού της βαλβίδας, περιοδικά να
πραγματοποιείτε καταιονισμό της βαλβίδας με στείρο φυσιολογικό ορό κατά την εμφύτευση.
4.2 Προφυλάξεις
• Λάβετε προσεκτικά υπόψη αυτούς τους ενδεχόμενους κινδύνους όταν επιλέγετε ένα κατάλληλο υποκατάστατο βαλβίδας:
– Η εκφύλιση από αποτιτάνωση μπορεί να προκαλέσει επιταχυνόμενη φθορά/αλλοίωση της βαλβίδας σε ασθενείς με
τροποποιημένο μεταβολισμό ασβεστίου (για παράδειγμα, χρόνια νεφρική ανεπάρκεια, υπερπαραθυρεοειδισμός).
– Η αποτιτάνωση ενδέχεται να παρουσιαστεί νωρίτερα σε παιδιά, εφήβους και νεαρούς ενήλικες.
– Πρόωρη αποτιτάνωση ενδέχεται επίσης να παρουσιαστεί σε μεγαλύτερης ηλικίας ενήλικες που λαμβάνουν μια βιολογική
πρόσθεση.
– Οι ασθενείς με βιοπρόσθεση που χρειάζονται χρόνια αντιπηκτική θεραπεία διατρέχουν πρόσθετο κίνδυνο αιμορραγίας.
• Μην τοποθετείτε το μη στείρο εξωτερικό του περιέκτη της βαλβίδας στο στείρο πεδίο.
• Μη χρησιμοποιείτε τους μετρητές μεγέθους Avalus Μοντέλο 7400S ή τη λαβή βαλβίδας Μοντέλο 7420 της Medtronic πριν
καθαριστούν σχολαστικά και αποστειρωθούν. Ανατρέξτε στις κατάλληλες οδηγίες χρήσης για περαιτέρω οδηγίες.
• Κατά την επιλογή μεγέθους βαλβίδας, λάβετε υπόψη την ανατομία του ασθενούς και επιλέξτε βαλβίδα η οποία να
ανταποκρίνεται επαρκώς στις αιμοδυναμικές απαιτήσεις του ασθενούς.
• Μην εμφυτεύετε μια βαλβίδα χωρίς να ολοκληρώσετε τις κατάλληλες διαδικασίες έκπλυσης.
• Προσανατολίστε τις ράβδους του στεντ και τοποθετήστε τη βαλβίδα έτσι ώστε να μην παρεμποδίζονται τα στεφανιαία στόμια.
• Αποφύγετε την επαφή της βαλβίδας ή του διαλύματος έκπλυσης με πετσέτες, υφάσματα ή άλλες πηγές που μπορεί να
μεταφέρουν σωματιδιακό υλικό στον ιστό των γλωχίνων.
• Ταυτοποιήστε τα σημεία εισροής και εκροής της βαλβίδας πριν από τη συρραφή.
• Δείξτε προσοχή όταν τοποθετείτε τα ράμματα μέσω του δακτυλίου συρραφής προκειμένου να αποφύγετε ρήξη του ιστού των
γλωχίνων. Εάν ο ιστός των γλωχίνων υποστεί βλάβη, η βαλβίδα πρέπει να εκφυτευτεί και να αντικατασταθεί.
• Μη χρησιμοποιείτε κόπτουσες βελόνες, ακάλυπτη λαβίδα ή αιχμηρά εργαλεία που θα μπορούσαν να προκαλέσουν δομική
βλάβη στη βαλβίδα.
• Πριν τη διέλευση καθετήρων, χειρουργικών εργαλείων και διαφλέβιων ηλεκτροδίων βηματοδότησης μέσω της βαλβίδας,
λάβετε υπόψη την πιθανότητα πρόκλησης βλάβης.
• Όταν χρησιμοποιείτε διακεκομμένα ράμματα, είναι σημαντικό να κόβετε τα ράμματα κοντά στους κόμπους. Διασφαλίστε ότι
οι εκτεθειμένες άκρες των ραμμάτων δεν πρόκειται να έρθουν σε επαφή με τον ιστό της γλωχίνας.
• Μην κάμπτετε τις συνενώσεις της βιοπρόσθεσης όταν δένετε κόμπους.
• Μη χειρίζεστε τον ιστό των γλωχίνων.
• Αποφύγετε την παρατεταμένη επαφή με το διάλυμα φύλαξης της βαλβίδας. Η γλουταραλδεΰδη μπορεί να προκαλέσει
ερεθισμό των οφθαλμών, της μύτης, του δέρματος και του λάρυγγα, εάν υπάρξει παρατεταμένη έκθεση. Αποφύγετε την
παρατεταμένη έκθεση στις χημικές αναθυμιάσεις ή την εισπνοή τους. Χρησιμοποιήστε μόνο εάν υπάρχει επαρκής
εξαερισμός. Εάν έλθει σε επαφή με το δέρμα, εκπλύνετε αμέσως την προσβεβλημένη περιοχή με άφθονη ποσότητα νερού
επί 10 έως 15 λεπτά. Εάν έλθει σε επαφή με τους οφθαλμούς, εκπλύνετε τον οφθαλμό με νερό επί 15 λεπτά και ζητήστε
άμεση ιατρική βοήθεια.
38Ελληνικά
Page 39

5 Πιθανά ανεπιθύμητα συμβάντα
Στα ανεπιθύμητα συμβάντα που πιθανώς σχετίζονται με τη χρήση βιοπροσθετικών καρδιακών βαλβίδων περιλαμβάνονται:
• Στηθάγχη
• Καρδιακές δυσρυθμίες
• Ενδοκαρδίτιδα
• Καρδιακή ανεπάρκεια
• Αιμόλυση
• Αιμολυτική αναιμία
• Αιμορραγία, σχετιζόμενη με την αντιπηκτική/αντιαιμοπεταλιακή αγωγή
• Διαφυγή, διαβαλβιδική ή παραβαλβιδική
• Έμφραγμα του μυοκαρδίου
• Μη δομική δυσλειτουργία (παγίδευση/παρεμπόδιση γλωχίνας, αποφρακτικός εσωτερικός σχηματισμός πάννου, διάνοιξη
ράμματος, ακατάλληλο μέγεθος, άλλο)
• Παλινδρόμηση στην πρόσθεση
• Εγκεφαλικό επεισόδιο
• Δομική επιδείνωση (ασβεστοποίηση, σχάση γλωχίνας, στένωση, άλλο)
• Θρομβοεμβολή
• Θρόμβωση βαλβίδας
Αυτές οι επιπλοκές μπορούν να οδηγήσουν σε:
• Επανεγχείρηση
• Εκφύτευση της βιοπρόσθεσης
• Μόνιμη αναπηρία
• Θάνατος
6 Οδηγίες χρήσης
6.1 Οδηγίες χειρισμού και προετοιμασίας
Η σωστή επιλογή μεγέθους είναι κρίσιμη για την αντικατάσταση της καρδιακής βαλβίδας. Χρησιμοποιήστε μετρητές μεγέθους
Avalus Μοντέλο 7400S για να επιλέξετε βιοπρόσθεση Avalus κατάλληλου μεγέθους. Για περισσότερες πληροφορίες, ανατρέξτε
στις οδηγίες χρήσης.
Το εξωτερικό του περιέκτη και το πώμα δεν είναι στείρα. Η βαλβίδα και όλα τα υλικά συσκευασίας μέσα στον περιέκτη είναι στείρα
και πρέπει να τα χειρίζεστε εντός του στείρου χειρουργικού πεδίου.
1. Προετοιμάστε 2 λεκάνες έκπλυσης, η καθεμία από τις οποίες θα περιέχει 500 mL στείρου διαλύματος φυσιολογικού ορού.
2. Εξετάστε τις προστατευτικές ταινίες για να επαληθεύσετε ότι ο περιέκτης δεν έχει υποστεί ζημία ή ότι δεν ανοίχθηκε
προηγουμένως. Μην χρησιμοποιείτε τη βαλβίδα, εάν όλες οι προστατευτικές ταινίες έχουν υποστεί ζημία.
3. Στρέψτε το πώμα αριστερόστροφα και ανοίξτε τον περιέκτη (Εικ. 2).
4. Κρατήστε το υποστήριγμα με τον αντίχειρα και τον δείκτη. Σηκώστε αργά τη βαλβίδα βγάζοντάς τη από τον περιέκτη,
αφήνοντας να στραγγίσει το διάλυμα φύλαξης γλουταραλδεΰδης (Εικ. 3).
5. Επαληθεύστε ότι ο αριθμός σειράς που αναγράφεται στο υποστήριγμα ταιριάζει με τον αριθμό σειράς στο πώμα του
περιέκτη, στο χάρτινο κουτί αποθήκευσης και στο Έντυπο εγγραφής ασθενούς. Καταγράψτε τον αριθμό σειράς στον φάκελο
του ασθενούς χρησιμοποιώντας τα αυτοκόλλητα που παρέχονται στο «Έντυπο εγγραφής ασθενούς».
6. Κρατήστε το υποστήριγμα όρθιο. Αφαιρέστε το πώμα του υποστηρίγματος στρέφοντάς το αριστερόστροφα
χρησιμοποιώντας τον αντίχειρα και τον δείκτη (Εικ. 4). Ο συγκρατητήρας θα είναι ορατός.
7. Εισαγάγετε μια στείρα λαβή στον συγκρατητήρα. Περιστρέψτε τη λαβή δεξιόστροφα μέσα στο σπειρωμένο στόμιο του
συγκρατητήρα μέχρι να αισθανθείτε αντίσταση (Εικ. 5).
8. Τραβήξτε τη λαβή προς τα επάνω για να αφαιρέσετε τη βαλβίδα από το υποστήριγμα (Εικ. 6).
6.2 Διαδικασία έκπλυσης
1. Τοποθετήστε ολόκληρη τη βαλβίδα και τον συγκρατητήρα σε 1 από τις λεκάνες έκπλυσης (Εικ. 6).
2. Χρησιμοποιήστε τη λαβή για να αναδεύετε συνεχώς τη βαλβίδα επί τουλάχιστον 30 δευτερόλεπτα.
3. Συμπιέστε απαλά το δακτύλιο συρραφής για να αφαιρέσετε τυχόν υπολείμματα γλουταραλδεΰδης. Μην αγγίζετε το τμήμα
ιστού της βαλβίδας.
4. Τοποθετήστε τη βαλβίδα στη δεύτερη λεκάνη. Αφήστε τη βαλβίδα στη λεκάνη μέχρι να τη χρειαστεί ο χειρουργός.
39 Ελληνικά
Page 40

6.3 Εμφύτευση αορτικής βαλβίδας
Η βιοπρόσθεση Avalus είναι σχεδιασμένη για εμφύτευση στην επί του δακτυλίου (supra-annular) θέση. Χρησιμοποιήστε τους
μετρητές μεγέθους Avalus Μοντέλο 7400S για να αναπαραστήσετε οπτικά την τοποθέτηση του κολάρου (cuff) συρραφής επάνω
από τον δακτύλιο και να επιβεβαιώσετε την τοποθέτηση και εφαρμογή της βαλβίδας στον επί του δακτυλίου (supra-annular)
χώρο.
Η επιλογή χειρουργικής τεχνικής εναπόκειται στην κρίση του εκάστοτε χειρουργού όταν πραγματοποιεί εμφύτευση στην επί του
δακτυλίου (supra-annular) θέση. Κάθε τροποποιημένη τεχνική θα πρέπει να συμμορφώνεται με το Kεφ. 4, Προειδοποιήσεις και
προφυλάξεις, σελ. 37. Γενικά, ακολουθήστε αυτά τα βήματα:
1. Προσανατολίστε τη βαλβίδα έτσι ώστε τα στεφανιαία στόμια να μην παρεμποδίζονται από το στεντ και τον δακτύλιο
συρραφής.
2. Περιοδικά να πραγματοποιείτε καταιονισμό της βαλβίδας με στείρο φυσιολογικό ορό, ώστε να αποτραπεί ξήρανση του
ευαίσθητου ιστού.
3. Τοποθετήστε τη βαλβίδα στον δακτύλιο και τοποθετήστε τα ράμματα στον δακτύλιο συρραφής.
4. Συρράψτε τη βαλβίδα στη θέση της χρησιμοποιώντας μια κατάλληλη τεχνική συρραφής. Ανατρέξτε στο Kεφ. 4,
Προειδοποιήσεις και προφυλάξεις, σελ. 37 για να αποφύγετε ενδεχόμενα προβλήματα.
5. Κόψτε τα ράμματα στο μοναδικό σημείο κοπής που υποδεικνύεται από το λευκό βέλος για να απελευθερώσετε τον
συγκρατητήρα (Εικ. 7). Τραβήξτε απαλά τη λαβή μακριά από τη βαλβίδα για να αφαιρέσετε τον συγκρατητήρα.
6. Αφαιρέστε τον συγκρατητήρα από τη λαβή και απορρίψτε τον συγκρατητήρα.
7. Δέστε όλους τους κόμπους και περικόψτε τις άκρες των ραμμάτων. Επαληθεύστε ότι δεν υπάρχουν υπολείμματα ραμμάτων.
Εάν υπάρχουν υπολείμματα ραμμάτων, αφαιρέστε τα πριν ολοκληρώσετε την εμφύτευση της βαλβίδας.
7 Εξατομίκευση θεραπείας
Εξαιρούμενων των περιπτώσεων όπου αντενδείκνυται, κατά τη διάρκεια των αρχικών φάσεων μετά την εμφύτευση, οι ασθενείς
που έλαβαν βιοπροσθετική καρδιακή βαλβίδα θα πρέπει να ακολουθήσουν αντιπηκτική θεραπεία.
Εξετάστε το ενδεχόμενο μακροπρόθεσμης χορήγησης αντιπηκτικής ή αντιαιμοπεταλιακής θεραπείας σε ασθενείς με διάταση
αριστερού κόλπου, ιστορικό θρομβοεμβολικών επεισοδίων ή καρδιακό ρυθμό κολπικής μαρμαρυγής ή κολπικού πτερυγισμού.
8 Πληροφορίες συμβουλευτικής ασθενούς
Συνιστάται συνεχής ιατρική μετέπειτα παρακολούθηση (τουλάχιστον ετησίως) ώστε επιπλοκές που σχετίζονται με τη βαλβίδα να
μπορούν να διαγνωστούν και να αντιμετωπιστούν καταλλήλως.
Οι ασθενείς με βιοπροσθετική βαλβίδα διατρέχουν κίνδυνο βακτηριαιμίας (για παράδειγμα, κατά τη διάρκεια οδοντιατρικών
διαδικασιών). Συμβουλεύστε τον ασθενή σχετικά με την προφυλακτική αντιβιοτική θεραπεία.
Προτρέψτε τους ασθενείς να έχουν την «Κάρτα ταυτότητας εμφυτευμένου προϊόντος», που παρέχει η Medtronic, πάντα μαζί
τους.
9 Τρόπος διάθεσης
9.1 Συσκευασία
Η βιοπρόσθεση Avalus αποστειρώνεται χημικά και παρέχεται στείρα σε ρυθμιστικό διάλυμα γλουταραλδεΰδης 0,2%. Η στειρότητα
υποβαθμίζεται εάν ο γυάλινος περιέκτης-δοχείο με πώμα έχει ανοιχτεί ή υποστεί ζημία. Το εξωτερικό του περιέκτη δεν είναι
στείρο. Μην τον τοποθετείτε στο στείρο πεδίο.
9.2 Αποθήκευση
Αποθηκεύστε τη βιοπρόσθεση Avalus σε θερμοκρασία μεταξύ 5°C και 25°C (41°F και 77°F). Δεν απαιτείται ψύξη, και η κατάψυξη
ενδέχεται να προκαλέσει ζημία στη βαλβίδα. Η αποθήκευση σε θερμοκρασία δωματίου έως 25°C (77°F) είναι ικανοποιητική. Μην
εκθέτετε τη βαλβίδα σε ηλιακό φως ή άλλες πηγές υπεριώδους ακτινοβολίας και μην την τοποθετείτε σε σημείο όπου μπορεί να
υπάρξουν σημαντικές διακυμάνσεις της θερμοκρασίας.
Διατηρήστε τον κατάλληλο έλεγχο των αποθεμάτων, ούτως ώστε οι βιοπροσθέσεις με τις πλησιέστερες ημερομηνίες «Χρήση
έως» να εμφυτεύονται πρώτες, και να μην παρέρχονται οι ημερομηνίες λήξης.
9.3 Επιστροφή των εκφυτευμένων βιοπροσθέσεων
Επικοινωνήστε με έναν εμπορικό αντιπρόσωπο της Medtronic για να ζητήσετε ένα κιτ επιστροφής προϊόντος προκειμένου να
επιστρέψετε εκφυτευμένες βιοπροσθέσεις για ανάλυση και απόρριψη. Εάν δεν υπάρχει διαθέσιμο κιτ, τοποθετήστε την
εκφυτευμένη βιοπρόσθεση σε έναν περιέκτη με γλουταραλδεΰδη ή ρυθμιστικό διάλυμα φορμαλίνης 10%, αμέσως μετά την
εκφύτευση. Για περισσότερες οδηγίες σχετικά με την επιστροφή, επικοινωνήστε με έναν εμπορικό αντιπρόσωπο της Medtronic.
40Ελληνικά
Page 41

10 Πληροφορίες ασθενούς
10.1 Πληροφορίες εγγραφής
Σημείωση: Η εγγραφή ασθενούς δεν ισχύει για χώρες όπου οι νόμοι περί απορρήτου ασθενούς συγκρούονται με την παροχή
πληροφοριών ασθενούς, συμπεριλαμβανομένων των χωρών της Ευρωπαϊκής Ένωσης.
Σε κάθε συσκευασία του προϊόντος περιλαμβάνεται ένα «Έντυπο εγγραφής ασθενούς». Μετά την εμφύτευση, παρακαλούμε
συμπληρώστε όλες τις απαιτούμενες πληροφορίες. Επιστρέψτε το πρωτότυπο έντυπο στη Medtronic στη διεύθυνση που
υποδεικνύεται στο έντυπο. Δώστε στον ασθενή την προσωρινή κάρτα ταυτότητας πριν του δοθεί εξιτήριο.
Στον ασθενή δίνεται μια «Κάρτα ταυτότητας εμφυτευμένου προϊόντος». Αυτή η κάρτα περιέχει το όνομα και τον αριθμό
τηλεφώνου του ιατρού του ασθενούς, καθώς και πληροφορίες που χρειάζεται το ιατρικό προσωπικό σε περίπτωση κατάστασης
επείγουσας ανάγκης.
11 Μετεγχειρητικές πληροφορίες
11.1 Συμβατότητα με απεικόνιση μαγνητικού συντονισμού (MRI)
Η βιοπρόσθεση Avalus Μοντέλο 400 είναι ασφαλής για μαγνητικό συντονισμό (MR). Η βαλβίδα δεν περιέχει μέταλλα και συνεπώς
δεν θέτει κανένα γνωστό κίνδυνο σε όλα τα περιβάλλοντα μαγνητικού συντονισμού (MR).
Σάρωση μαγνητικού συντονισμού (MR) στα 3,0 T και 1,5 T μπορεί να πραγματοποιηθεί αμέσως μετά την εμφύτευση. Η βαλβίδα
δεν θα προκαλέσει καμία βλάβη στον ασθενή όταν εκτεθεί σε σάρωση μαγνητικού συντονισμού (MR).
11.2 Τεχνήματα απεικόνισης
Η ποιότητα της εικόνας μαγνητικού συντονισμού (MR) μπορεί να υποβαθμιστεί εάν η σάρωση γίνει πάνω ή κοντά στη θέση της
βαλβίδας. Εάν χρειαστεί, βελτιστοποιήστε τις παραμέτρους απεικόνισης του μαγνητικού συντονισμού (MR) για την παρουσία της
βαλβίδας.
12 Παρελκόμενα
Χρησιμοποιήστε μόνο τους μετρητές μεγέθους Avalus Μοντέλο 7400S και τη λαβή βαλβίδας Μοντέλο 7420 της Medtronic για να
προσδιορίσετε το κατάλληλο μέγεθος βιοπρόσθεσης Avalus.
Προσοχή: Μη χρησιμοποιείτε τους μετρητές μεγέθους ή τις λαβές μέχρι να έχουν καθαριστεί σχολαστικά και να έχουν
αποστειρωθεί. Ανατρέξτε στις κατάλληλες οδηγίες χρήσης για περαιτέρω οδηγίες.
Προσοχή: Μη χρησιμοποιείτε μετρητές μεγέθους βαλβίδας άλλων κατασκευαστών ή μετρητές μεγέθους από άλλη πρόσθεση
της Medtronic για να υπολογίσετε το μέγεθος της βιοπρόσθεσης Avalus.
13 Αποποιητική δήλωση εγγύησης
Η ΑΚΟΛΟΥΘΗ ΑΠΟΠΟΙΗΤΙΚΗ ΔΗΛΩΣΗ ΤΗΣ ΕΓΓΥΗΣΗΣ ΙΣΧΥΕΙ ΓΙΑ ΠΕΛΑΤΕΣ ΕΚΤΟΣ ΤΩΝ ΗΝΩΜΕΝΩΝ ΠΟΛΙΤΕΙΩΝ ΤΗΣ
ΑΜΕΡΙΚΗΣ:
ΠΑΡΟΤΙ Η ΒΙΟΠΡΟΣΘΕΣΗ AVALUS ΜΟΝΤΕΛΟ 400, ΕΦΕΞΗΣ ΑΝΑΦΕΡΟΜΕΝΗ ΩΣ «ΠΡΟΪΟΝ», ΕΧΕΙ ΣΧΕΔΙΑΣΤΕΙ,
ΚΑΤΑΣΚΕΥΑΣΤΕΙ ΚΑΙ ΔΟΚΙΜΑΣΤΕΙ ΠΡΟΣΕΚΤΙΚΑ ΠΡΙΝ ΤΗΝ ΠΩΛΗΣΗ ΤΗΣ, ΤΟ ΠΡΟΪΟΝ ΕΝΔΕΧΕΤΑΙ ΝΑ ΑΠΟΤΥΧΕΙ ΣΤΗΝ
ΙΚΑΝΟΠΟΙΗΤΙΚΗ ΕΚΤΕΛΕΣΗ ΤΗΣ ΠΡΟΟΡΙΖΟΜΕΝΗΣ ΛΕΙΤΟΥΡΓΙΑΣ ΤΟΥ ΛΟΓΩ ΠΟΙΚΙΛΩΝ ΑΙΤΙΩΝ. ΟΙ ΠΡΟΕΙΔΟΠΟΙΗΣΕΙΣ
ΠΟΥ ΠΕΡΙΕΧΟΝΤΑΙ ΣΤΗ ΣΗΜΑΝΣΗ ΤΟΥ ΠΡΟΪΟΝΤΟΣ ΠΑΡΕΧΟΥΝ ΛΕΠΤΟΜΕΡΕΣΤΕΡΕΣ ΠΛΗΡΟΦΟΡΙΕΣ ΚΑΙ ΘΕΩΡΟΥΝΤΑΙ
ΑΝΑΠΟΣΠΑΣΤΟ ΤΜΗΜΑ ΤΗΣ ΠΑΡΟΥΣΑΣ ΑΠΟΠΟΙΗΤΙΚΗΣ ΔΗΛΩΣΗΣ ΤΗΣ ΕΓΓΥΗΣΗΣ. ΣΥΝΕΠΩΣ, Η MEDTRONIC
ΑΠΟΠΟΙΕΙΤΑΙ ΟΛΕΣ ΤΙΣ ΕΓΓΥΗΣΕΙΣ, ΡΗΤΕΣ ΚΑΙ ΣΙΩΠΗΡΕΣ, ΣΕ ΣΧΕΣΗ ΜΕ ΤΟ ΠΡΟΪΟΝ. H MEDTRONIC ΔΕΝ ΘΑ ΕΙΝΑΙ
ΥΠΕΥΘΥΝΗ ΓΙΑ ΟΠΟΙΕΣΔΗΠΟΤΕ ΘΕΤΙΚΕΣ Ή ΑΠΟΘΕΤΙΚΕΣ ΖΗΜΙΕΣ ΠΡΟΚΑΛΟΥΜΕΝΕΣ ΑΠΟ ΟΠΟΙΑΔΗΠΟΤΕ ΧΡΗΣΗ,
ΕΛΑΤΤΩΜΑ Ή ΑΣΤΟΧΙΑ ΤΟΥ ΠΡΟΪΟΝΤΟΣ, ΕΙΤΕ Η ΑΞΙΩΣΗ ΒΑΣΙΖΕΤΑΙ ΣΕ ΕΓΓΥΗΣΗ, ΣΥΜΒΑΣΗ, ΑΔΙΚΟΠΡΑΞΙΑ ΕΙΤΕ ΣΕ
ΟΤΙΔΗΠΟΤΕ ΑΛΛΟ.
Οι εξαιρέσεις και οι περιορισμοί που ορίζονται ανωτέρω δεν έχουν ως σκοπό και δεν θα πρέπει να ερμηνεύονται κατά τέτοιο τρόπο
ώστε να αντιβαίνουν στις υποχρεωτικές διατάξεις της ισχύουσας νομοθεσίας. Εάν οποιοδήποτε τμήμα ή όρος της παρούσας
ΑΠΟΠΟΙΗΤΙΚΗΣ ΔΗΛΩΣΗΣ ΤΗΣ ΕΓΓΥΗΣΗΣ κριθεί από οποιοδήποτε δικαστήριο αρμόδιας δικαιοδοσίας παράνομο(ς), μη
εφαρμόσιμο(ς) ή συγκρουόμενο(ς) με την ισχύουσα νομοθεσία, η εγκυρότητα του υπολοίπου τμήματος της ΑΠΟΠΟΙΗΤΙΚΗΣ
ΔΗΛΩΣΗΣ ΤΗΣ ΕΓΓΥΗΣΗΣ δεν θα επηρεαστεί και όλα τα δικαιώματα και οι υποχρεώσεις θα ερμηνεύονται και θα εφαρμόζονται
ως εάν η παρούσα ΑΠΟΠΟΙΗΤΙΚΗ ΔΗΛΩΣΗ ΤΗΣ ΕΓΓΥΗΣΗΣ να μην περιείχε το συγκεκριμένο τμήμα ή όρο που κρίθηκε άκυρο(ς).
41 Ελληνικά
Page 42

1 Descripción del dispositivo
3
2
1
4
5
La bioprótesis Avalus, Modelo 400, consta de una estructura de armazón de base cubierto de poliéster y de armazón de soporte de
tres valvas conformada con arreglo a la geometría de una válvula de tres valvas. El armazón de base y el armazón de soporte de tres
valvas están moldeados por inyección utilizando material de polieteretercetona (PEEK). El material de PEEK del armazón de base
está impregnado con sulfato de bario para permitir su visualización radiográfica. Las valvas están cortadas con láser a partir de tejido
bovino y reticuladas en glutaraldehído amortiguado. Las valvas se insertan entre el armazón de soporte de tres valvas y el armazón
de base y, a continuación, todos los componentes se suturan juntos firmemente. En la tapa del lado de entrada del armazón de base
se integra un anillo de sutura, fabricado con tejido de poliéster, que permite al usuario suturar y asentar la bioprótesis Avalus en
posición supraanular. El anillo de sutura presenta marcas de sutura en el área mediosinusal de cada cúspide para proporcionar una
guía para una separación uniforme de las suturas de implantación (Figura 1). Un soporte desechable unido al lado de salida de la
válvula facilita la implantación. La bioprótesis (válvula) aórtica está tratada con un proceso de antimineralización con ácido
alfa-amino-oleico (AOA) que ha demostrado reducir la calcificación de las valvas porcinas en estudios con animales.
El soporte desechable está diseñado para encajar en él el mango para válvulas de Medtronic reutilizable, Modelo 7420. El soporte
dispone de un único punto de corte para extraerlo de la válvula. Se utilizan medidores de doble extremo para seleccionar el tamaño
adecuado de la válvula. El extremo cilíndrico representa el orificio de la válvula. El extremo de réplica imita la geometría de la prótesis.
Tabla 1. Tamaños y diámetros del anillo de sutura disponibles (valores nominales en milímetros)
Tamaño 19 mm 21 mm 23 mm 25 mm 27 mm 29 mm
(1) Diámetro del stent (DAT) 19 21 23 25 27 29
(2) Diámetro interno del orificio 17,5 19,5 21,5 23,5 25,5 27,5
(2a) Diámetro interno del orificio
(3) Diámetro externo del anillo de sutura 27,0 29,0 31,0 33,0 36,0 38,0
(4) Altura del perfil de la válvula 13,0 14,0 15,0 16,0 17,0 18,0
(5) Protrusión aórtica 11,0 12,0 13,0 14,0 15,0 16,0
a
18 20 22 24 26 28
Nota: DAT: diámetro del anillo tisular
a
La medición muestra el armazón del stent incluido el tejido (2) y el armazón del stent excluido el tejido (2a)
2 Indicaciones de uso
La bioprótesis Avalus está indicada para la sustitución de una válvula aórtica nativa o protésica enferma, dañada o disfuncional.
3 Contraindicaciones
No utilice la válvula si su uso no es lo más conveniente para el paciente. Evalúe todos los riesgos implicados, incluidas la anatomía
y la patología observadas en el momento de la cirugía.
4 Advertencias y medidas preventivas
4.1 Advertencias
• El dispositivo es válido para un solo uso. No reutilice, reprocese ni reesterilice este dispositivo. La reutilización, el
reprocesamiento o la reesterilización del dispositivo pueden poner en peligro su integridad estructural o generar riesgos de
contaminación que podrían provocar al paciente lesiones, enfermedades o incluso la muerte.
• No reesterilice la válvula mediante ningún método. La exposición de la válvula y de su envase a radiación, vapor, óxido de
etileno u otros esterilizantes químicos la dejará inutilizable.
• Compruebe el indicador de temperatura de transporte que se encuentra en el interior de la caja de cartón. Si la ventana del
indicador de temperatura de transporte está negra, la válvula no es apta para uso clínico.
• No utilice la válvula en ninguna de las siguientes circunstancias:
– La válvula se ha caído, dañado o manipulado indebidamente de cualquier forma.
– Ha vencido la fecha de caducidad.
– Todas las cintas de precinto están dañadas.
– El número de serie indicado en la etiqueta no coincide con el número indicado en la etiqueta del envase.
42Español
Page 43

– La solución conservante de glutaraldehído no cubre completamente la válvula o hay un escape de líquido del envase.
– La válvula muestra signos de deterioro.
• No manipule con instrumentos la parte de tejido de la válvula. Debe tenerse un cuidado extremo en evitar dañar el delicado tejido
de la válvula. Incluso una pequeña perforación podría aumentar de tamaño con el tiempo y producir una insuficiencia valvular
significativa.
• No intente reparar una válvula dañada. No debe usarse una válvula dañada.
• No añada antibióticos ni ninguna otra sustancia a la solución conservante ni a la solución de enjuague.
• No intente insertar una válvula demasiado grande para el anillo anatómico. Seleccione una válvula que encaje de forma segura
en la raíz aórtica sin deformar la anatomía nativa ni la bioprótesis Avalus.
• No utilice para determinar el tamaño adecuado de la válvula medidores valvulares de otros fabricantes ni medidores diseñados
para otras prótesis de Medtronic.
• No deje que la válvula se seque. Para evitar que se seque el tejido de la válvula, irrigue periódicamente la válvula con solución
salina fisiológica estéril durante la implantación.
4.2 Medidas preventivas
• Considere detenidamente estos posibles riesgos al seleccionar una válvula de sustitución apropiada:
– La degeneración cálcica podría causar un deterioro acelerado de la válvula en pacientes que presenten una alteración del
metabolismo del calcio (por ejemplo, insuficiencia renal crónica, hiperparatiroidismo).
– La calcificación puede producirse de forma más temprana en niños, adolescentes o adultos jóvenes.
– También puede producirse una calcificación prematura en adultos de mayor edad que aceptan una bioprótesis.
– Los pacientes con bioprótesis que requieren tratamiento anticoagulante crónico presentan un riesgo adicional de hemorragia.
• No coloque la parte exterior no estéril del envase de la válvula en el campo estéril.
• No utilice los medidores Avalus, Modelo 7400S, ni el mango para válvulas de Medtronic, Modelo 7420, hasta que se hayan
limpiado y esterilizado meticulosamente. Consulte las instrucciones de uso correspondientes para obtener más información.
• Al seleccionar el tamaño de una válvula, tenga en cuenta la anatomía del paciente y seleccione una válvula que
satisfaga adecuadamente sus necesidades hemodinámicas.
• No implante una válvula sin completar los procedimientos de enjuague apropiados.
• Oriente las patas del stent y asiente la válvula de manera que los ostiums coronarios no estén obstruidos.
• Evite el contacto de la válvula o de la solución de enjuague con toallas, sábanas u otras fuentes que puedan transferir partículas
sólidas al tejido de las valvas.
• Identifique los lados de entrada y de salida de la válvula antes de suturarla.
• Tenga cuidado al realizar las suturas a través del anillo de sutura para evitar posibles desgarros del tejido de las valvas. Si el tejido
de las valvas está dañado, extraiga y sustituya la válvula.
• No utilice agujas cortantes, pinzas no protegidas ni instrumentos afilados que puedan causar daños estructurales en la válvula.
• Tenga en cuenta los posibles daños antes de hacer pasar catéteres, instrumentos quirúrgicos y cables de estimulación
transvenosa a través de la válvula.
• Si se utilizan suturas interrumpidas, es importante cortarlas cerca de los nudos. Asegúrese de que los extremos expuestos de
las suturas no entran en contacto con el tejido de las valvas.
• No doble las comisuras de la bioprótesis al atar nudos.
• No manipule el tejido de las valvas.
• Evite un contacto prolongado con la solución conservante de la válvula. El glutaraldehído podría causar irritación de los ojos, la
nariz, la piel y la garganta en exposiciones prolongadas. Evite una exposición prolongada al vapor químico o su inhalación. Utilice
el producto únicamente con una ventilación adecuada. En caso de contacto con la piel, lave de inmediato la zona afectada con
agua abundante durante 10 a 15 minutos. En caso de contacto con los ojos, lávelos con agua durante 15 minutos y solicite
atención médica inmediata.
5 Posibles eventos adversos
Algunos de los posibles efectos adversos asociados al uso de válvulas cardíacas bioprotésicas son:
• Angina
• Disritmias cardíacas
• Endocarditis
• Insuficiencia cardíaca
• Hemólisis
• Anemia hemolítica
43 Español
Page 44

• Hemorragia relacionada con el tratamiento anticoagulante o antiagregante plaquetario
• Fuga transvalvular o paravalvular
• Infarto de miocardio
• Disfunción no estructural (atrapamiento/pinzamiento de las valvas, crecimiento hacia dentro obstructivo de tejido de granulación,
dehiscencia de las suturas, tamaño inapropiado, etc.)
• Insuficiencia de la prótesis
• Accidente cerebrovascular
• Deterioro estructural (calcificación, desgarro de las valvas, estenosis, etc.)
• Tromboembolia
• Trombosis valvular
Estas complicaciones podrían causar:
• Reintervención quirúrgica
• Explantación de la bioprótesis
• Discapacidad permanente
• Muerte
6 Instrucciones de uso
6.1 Instrucciones de manipulación y preparación
La elección del tamaño apropiado de la válvula es esencial para la sustitución de válvulas cardíacas. Utilice medidores Avalus,
Modelo 7400S, para elegir el tamaño apropiado de la bioprótesis Avalus. Si desea obtener más información, consulte las
instrucciones de uso.
La parte exterior del envase y la tapa no son estériles. La válvula y todos los componentes de acondicionamiento incluidos en el
interior del envase son estériles y deben manipularse dentro del campo quirúrgico estéril.
1. Prepare 2 cubetas de enjuague, cada una con 500 mL de solución salina fisiológica estéril.
2. Inspeccione las cintas de precinto para verificar que el envase no presenta daños ni se ha abierto con anterioridad. No utilice
la válvula si todas las cintas de precinto están dañadas.
3. Gire la tapa en sentido contrario al de las agujas del reloj y abra el envase (Figura 2).
4. Sujete el recipiente de retención con el pulgar y el dedo índice. Extraiga la válvula lentamente del envase dejando que escurra
la solución conservante de glutaraldehído (Figura 3).
5. Compruebe que el número de serie indicado en el recipiente de retención coincide con el indicado en la tapa del envase, la caja
de cartón y el formulario de registro del paciente. Anote el número de serie en la historia clínica del paciente utilizando las
pegatinas proporcionadas en el formulario de registro del paciente.
6. Sujete el recipiente de retención en posición vertical. Quite la tapa del recipiente de retención girándola en sentido contrario al
de las agujas del reloj con los dedos pulgar e índice (Figura 4). Se verá el soporte.
7. Introduzca un mango estéril en el soporte. Gire el mango en el sentido de las agujas del reloj para introducirlo en la abertura
roscada del soporte hasta que note resistencia (Figura 5).
8. Tire hacia arriba del mango para extraer la válvula del recipiente de retención (Figura 6).
6.2 Procedimiento de enjuague
1. Coloque la válvula y el soporte en bloque en una de las cubetas de enjuague (Figura 6).
2. Utilizando el mango, agite continuamente la válvula durante al menos 30 segundos.
3. Apriete suavemente el anillo de sutura para eliminar los restos de glutaraldehído. No toque la parte de tejido de la válvula.
4. Ponga la válvula en la segunda cubeta. Mantenga la válvula en la cubeta hasta que el cirujano la precise.
6.3 Implantación de una válvula aórtica
La bioprótesis Avalus está diseñada para implantarse en posición supraanular. Utilice medidores Avalus, Modelo 7400S, para
visualizar la colocación del anillo de sutura sobre el anillo anatómico y confirmar la colocación y el encaje de la válvula en el espacio
supraanular.
La elección de la técnica quirúrgica queda a criterio de cada cirujano para la implantación en posición supraanular. Cualquier técnica
modificada debe realizarse de conformidad con el Capítulo 4, Advertencias y medidas preventivas, página 42. En general, siga estos
pasos:
1. Oriente la válvula de manera que el stent y el anillo de sutura no obstruyan los ostiums coronarios.
2. Irrigue periódicamente la válvula con solución salina fisiológica estéril para evitar que se seque su delicado tejido.
44Español
Page 45

3. Coloque la válvula en el anillo anatómico y aplique las suturas en el anillo de sutura.
4. Suture la válvula en su posición utilizando una técnica de sutura adecuada. Consulte el Capítulo 4, Advertencias y medidas
preventivas, página 42 para evitar posibles problemas.
5. Corte las suturas en el punto de corte único indicado por la flecha blanca para liberar el soporte (Figura 7). Tire suavemente del
mango para extraer el soporte de la válvula.
6. Extraiga el soporte del mango y deseche el soporte.
7. Ate todos los nudos y corte los extremos de las suturas. Compruebe que no queden restos de hilo de sutura. Si se encuentran
restos de las suturas, extráigalos antes de finalizar la implantación de la válvula.
7 Individualización del tratamiento
Salvo que esté contraindicado, los pacientes que reciban una válvula cardíaca bioprotésica deben recibir tratamiento anticoagulante
durante las fases iniciales tras la implantación.
Considere la aplicación de tratamiento anticoagulante o antiagregante plaquetario prolongado en pacientes con dilatación de la
aurícula izquierda, antecedentes de episodios trombóticos, o fibrilación o flúter (aleteo) auriculares.
8 Información sobre consejos al paciente
Se recomienda realizar un seguimiento médico continuo (al menos una vez al año) para poder diagnosticar y tratar debidamente las
posibles complicaciones relacionadas con la válvula.
Los pacientes que tienen una válvula bioprotésica presentan riesgo de bacteriemia (por ejemplo, al someterse a intervenciones
dentales). Aconseje al paciente en relación con el tratamiento antibiótico profiláctico.
Recomiende a los pacientes que lleven consigo la tarjeta de identificación del dispositivo implantado, facilitada por Medtronic, en
todo momento.
9 Presentación
9.1 Envasado
La bioprótesis Avalus se ha sometido a esterilización química y se suministra estéril en una solución de glutaraldehído al 0,2 %
amortiguada. La esterilidad se pone en peligro si el envase compuesto por el frasco de vidrio y la tapa se abre o se daña. El exterior
del envase no está esterilizado. No coloque el envase en el campo estéril.
9.2 Almacenamiento
Conserve la bioprótesis Avalus a una temperatura entre 5°C y 25°C (41°F y 77°F). No se precisa de refrigeración y la congelación
podría dañar la válvula. La conservación a temperatura ambiente hasta 25°C (77°F) es satisfactoria. No exponga la válvula a la luz
del sol ni a fuentes de luz ultravioleta ni la coloque en lugares en los que puedan producirse fluctuaciones importantes de la
temperatura.
Mantenga un control adecuado del inventario de manera que se implanten antes aquellas bioprótesis cuya fecha de caducidad sea
más temprana, con objeto de evitar la caducidad de las mismas.
9.3 Devolución de bioprótesis explantadas
Póngase en contacto con el representante de ventas de Medtronic para solicitar un kit de devolución de producto destinado a
devolver las bioprótesis explantadas para su análisis y eliminación. Si no dispone de un kit de devolución, coloque la bioprótesis
explantada en un recipiente lleno de glutaraldehído o formalina al 10 % amortiguada inmediatamente después de la explantación. Si
desea obtener más instrucciones sobre la devolución, póngase en contacto con el representante de ventas de Medtronic.
10 Datos del paciente
10.1 Información de registro
Nota: El registro de pacientes no es aplicable en países en los que las leyes de privacidad de los pacientes entran en conflicto con
la provisión de información del paciente, incluidos los países de la Unión Europea.
Todos los envases de los dispositivos incluyen un formulario de registro del paciente. Después de la implantación, rellene todos los
datos solicitados. Devuelva el formulario original a la dirección de Medtronic indicada en él. Entregue al paciente la tarjeta de
identificación temporal antes de darle el alta.
Se proporciona al paciente una tarjeta de identificación del dispositivo implantado. Esta tarjeta contiene el nombre y el número de
teléfono del médico del paciente, así como aquella información que el personal médico requeriría en una situación de urgencia.
45 Español
Page 46

11 Información posoperatoria
11.1 Compatibilidad con exploración por resonancia magnética (RM)
La bioprótesis Avalus Modelo 400 es segura para la resonancia magnética (RM). La válvula no contiene metales y, por tanto, no
plantea riesgos conocidos en ningún entorno de resonancia magnética.
Puede realizarse una exploración por resonancia magnética a 3,0 T y 1,5 T justo después de la implantación. La válvula no causará
ningún daño al paciente si se somete a una exploración por resonancia magnética.
11.2 Artefactos en las imágenes
La calidad de las imágenes de resonancia magnética podría verse afectada si la exploración se realiza sobre la válvula o cerca de
ella. En caso necesario, optimice los parámetros de exploración por resonancia magnética en relación con la presencia de la válvula.
12 Accesorios
Utilice exclusivamente los medidores Avalus, Modelo 7400S, y el mango para válvulas de Medtronic, Modelo 7420, para determinar
el tamaño adecuado de la bioprótesis Avalus.
Precaución: No utilice los medidores ni los mangos hasta que se hayan limpiado y esterilizado minuciosamente. Consulte las
instrucciones de uso correspondientes para obtener más información.
Precaución: No utilice para determinar el tamaño adecuado de la bioprótesis Avalus medidores valvulares de otros fabricantes ni
medidores diseñados para otras prótesis de Medtronic.
13 Renuncia de responsabilidad
LA SIGUIENTE RENUNCIA DE RESPONSABILIDAD SE APLICA SÓLO A LOS CLIENTES DE FUERA DE LOS ESTADOS
UNIDOS:
AUNQUE LA BIOPRÓTESIS AVALUS, MODELO 400, A LA QUE NOS REFERIREMOS DE AHORA EN ADELANTE COMO
"PRODUCTO", HA SIDO DISEÑADA, FABRICADA Y PROBADA CUIDADOSAMENTE ANTES DE PONERLA A LA VENTA, EL
PRODUCTO PUEDE NO CUMPLIR SUS FUNCIONES SATISFACTORIAMENTE POR DIVERSAS RAZONES. LAS
ADVERTENCIAS QUE CONTIENE LA DOCUMENTACIÓN DEL PRODUCTO PROPORCIONAN INFORMACIÓN MÁS
DETALLADA Y SE CONSIDERAN COMO PARTE INTEGRANTE DE ESTA RENUNCIA DE RESPONSABILIDAD. POR TANTO,
MEDTRONIC RENUNCIA A CUALQUIER RESPONSABILIDAD, TANTO EXPRESA COMO IMPLÍCITA, CON RESPECTO AL
PRODUCTO. MEDTRONIC NO SERÁ RESPONSABLE DE LOS DAÑOS INDIRECTOS O DIRECTOS CAUSADOS POR
CUALQUIER USO, DEFECTO O FALLO DEL PRODUCTO, AUN CUANDO LA RECLAMACIÓN SE BASE EN UNA GARANTÍA,
CONTRATO, RESPONSABILIDAD EXTRACONTRACTUAL U OTROS FUNDAMENTOS LEGALES.
Las exclusiones y limitaciones detalladas anteriormente no pretenden contravenir las disposiciones obligatorias establecidas por la
legislación vigente ni deben interpretarse de dicha forma. En el supuesto de que cualquier parte o condición de la presente
RENUNCIA DE RESPONSABILIDAD sea declarada por cualquier tribunal competente como ilegal, inaplicable o contraria a la ley,
ello no afectará a la validez del resto de la RENUNCIA DE RESPONSABILIDAD, interpretándose y aplicándose cuantos derechos
y obligaciones se incluyen en ella como si la presente RENUNCIA DE RESPONSABILIDAD no contuviera la parte o condición
considerada no válida.
46Español
Page 47

1 Seadme kirjeldus
3
2
1
4
5
Bioprotees Avalus, mudel 400, koosneb polüestriga kaetud põhiraami ja kolmehõlmalise tugiraami struktuurist, mis on
kolmehõlmalise klapi kujuga. Põhiraam ja kolmehõlmaline tugiraam on valmistatud survevalu meetodil polüeetereeterketoonist
(PEEK). Põhiraami PEEK-materjal on immutatud baariumsulfaadiga, et võimaldada radiograafilist visualiseerimist. Klapihõlmad on
laseriga lõigatud veise koest ja ristseotud puhverdatud glutaaraldehüüdis. Klapihõlmad on sisestatud kolmehõlmalise tugiraami ja
põhiraami vahele, misjärel kõik komponendid on kindlalt kokku õmmeldud. Polüesterkangast õmblusrõngas on integreeritud
põhiraami sissevooluava kattesse, et võimaldada kasutajal õmmelda ja asetada bioprotees Avalus supraannulaarsesse asendisse.
Õmblusmarkerid asuvad õmblusrõngal iga hõlma siinuse keskosas, et hõlbustada implantaadi õmbluste paigutamist ühtlase
vahekaugusega (joonis 1). Klapi väljavooluavale on kinnitatud ühekordselt kasutatav hoidik, et hõlbustada implanteerimist. Aordi
bioproteesi (klappi) on töödeldud alfa-aminoolehappe (AOA) antimineralisatsiooni meetodiga. Loomuuringutes on näidatud, et see
leevendab sea koest klapihõlmade kaltsifikatsiooni.
Ühekordselt kasutatav hoidik sobitub ettevõtte Medtronic korduskasutatava klapikäepidemega, mudel 7420. Hoidikul on üks
lõikekoht, mis on mõeldud hoidiku eemaldamiseks klapi küljest. Sobiva suurusega klapi valimiseks kasutatakse kaheotsalisi
kalibraatoreid. Silinderots väljendab klapi avaust. Koopiapoolne ots jäljendab proteesi kuju.
Tabel 1. Saadaolevad suurused ja õmblusrõnga läbimõõdud (nimiväärtused millimeetrites)
Suurus 19 mm 21 mm 23 mm 25 mm 27 mm 29 mm
(1) Stendi läbimõõt (TAD) 19 21 23 25 27 29
(2) Avause siseläbimõõt 17,5 19,5 21,5 23,5 25,5 27,5
(2a) Avause siseläbimõõt
(3) Õmblusrõnga välisläbimõõt 27,0 29,0 31,0 33,0 36,0 38,0
(4) Klapi profiili kõrgus 13,0 14,0 15,0 16,0 17,0 18,0
(5) Aordi eenduv osa 11,0 12,0 13,0 14,0 15,0 16,0
a
18 20 22 24 26 28
Märkus. TAD – koevõru läbimõõt
a
Mõõtmed viitavad stendi raamile koos koega (2) ja stendi raamile ilma koeta (2a)
2 Kasutusnäidustused
Bioprotees Avalus on näidustatud haige, kahjustatud või mittefunktsioneeriva natiivse või proteetilise aordiklapi asendamiseks.
3 Vastunäidustused
Ärge kasutage klappi, kui see ei ole patsiendi parimates huvides. Hinnake kõiki kaasuvaid riske, sh operatsiooni käigus vaadeldavat
anatoomiat ja patoloogiat.
4 Hoiatused ja ettevaatusabinõud
4.1 Hoiatused
• Seade on mõeldud vaid ühekordseks kasutamiseks. Ärge korduskasutage, taastöödelge ega resteriliseerige seadet.
Korduskasutamine, taastöötlemine või resteriliseerimine võib rikkuda seadme konstruktsiooni või tekitada saastumise riski, mis
võib põhjustada patsiendi vigastuse, haiguse või surma.
• Ärge resteriliseerige klappi ühegi meetodiga. Klapi ja selle mahuti kokkupuude kiirguse, auru, etüleenoksiidi või muude
keemiliste steriliseerimisvahenditega muudab klapi kasutuskõlbmatuks.
• Kontrollige karbi sees olevat tarnimistemperatuuri indikaatorit. Kui tarnimistemperatuuri indikaatori aken on must, ei sobi klapp
kliiniliseks kasutamiseks.
• Ärge kasutage klappi järgmistel juhtudel:
– klapp on maha pillatud, kahjustatud või muul viisil valesti käsitsetud;
– kõlblikkusaeg on möödunud;
– kõik sulgurribad on kahjustatud;
– seerianumbri silt ei vasta mahuti sildile;
– glutaaraldehüüdist säilituslahus ei kata klappi täielikult või vedelik lekib pakendist;
– klapil on kulumise märke.
47 Eesti
Page 48

• Ärge puudutage klapi koeosa instrumentidega. Olge äärmiselt hoolikas, et õrna klapikude mitte kahjustada. Ka väike
perforatsioon võib aja jooksul suureneda ning klapifunktsiooni märkimisväärselt kahjustada.
• Ärge üritage kahjustunud klappi parandada. Kahjustunud klappi ei tohi kasutada.
• Ärge lisage säilituslahusele ega loputuslahusele antibiootikume ega muid aineid.
• Ärge üritage sisestada võru jaoks liiga suurt klappi. Valige klapp, mis sobitub kindlalt aordijuure sisse natiivset anatoomiat või
bioproteesi Avalus deformeerimata.
• Ärge kasutage klapi suuruse määramiseks teiste tootjate klapi kalibraatoreid ega ettevõtte Medtronic muude proteeside
kalibraatoreid.
• Ärge laske klapil kuivada. Klapikoe kuivamise vältimiseks loputage klappi implanteerimise ajal korrapäraselt steriilse
füsioloogilise lahusega.
4.2 Ettevaatusabinõud
• Kaaluge sobiva klapiasendaja valimisel hoolikalt järgmisi potentsiaalseid ohte.
– Kaltsifitseeruv degeneratsioon võib põhjustada klapi kiirenenud kulumist muutunud kaltsiumi metabolismiga (nt kroonilise
neerupuudulikkusega või hüperparatüreoidismiga) patsientidel.
– Lastel, noorukitel või noortel täiskasvanutel võib kaltsifikatsioon tekkida varem.
– Enneaegset kaltsifikatsiooni võib esineda ka vanematel täiskasvanutel, kellele paigaldatakse bioprotees.
– Bioproteesiga patsientidel, kes vajavad kroonilist ravi antikoagulantidega, on suurem veritsuse tekke oht.
• Ärge asetage klappi sisaldava mahuti mittesteriilset välispinda steriilsesse alasse.
• Ärge kasutage kalibraatoreid Avalus (mudel 7400S) ega ettevõtte Medtronic klapi käepidet (mudel 7420) enne, kui need on
põhjalikult puhastatud ja steriliseeritud. Lisajuhiseid lugege vastavatest kasutusjuhenditest.
• Klapi suuruse valimisel arvestage patsiendi anatoomiaga ja valige klapp, mis vastab adekvaatselt patsiendi
hemodünaamilistele nõuetele.
• Ärge implanteerige klappi ilma vajalikke loputusprotseduure tegemata.
• Paigutage stendipostid ja paigaldage klapp nii, et koronaarsuistik ei oleks blokeeritud.
• Vältige klapi ja loputuslahuse kokkupuudet rätikute, linade ja muude allikatega, millelt tahked osakesed võivad kanduda
klapihõlma koele.
• Enne õmblemist tuvastage klapi sisse- ja väljavooluots.
• Õmbluste tegemisel läbi õmblusrõnga olge ettevaatlik, et vältida klapihõlma koe kahjustamist. Juhul kui klapihõlma kude on
kahjustatud, tuleb klapp eksplanteerida ja asendada.
• Ärge kasutage lõikenõelu, kaitsmeta pintsette ega teravaid instrumente, mis võiksid klapi ehitust kahjustada.
• Enne kateetrite, kirurgiliste instrumentide ja transvenoossete stimulatsiooni elektroodijuhtmete sisestamist läbi klapi tuleb
arvestada potentsiaalse kahjustamisega.
• Katkestatud õmbluste kasutamisel on oluline lõigata niidiotsad ära sõlmede lähedalt. Veenduge, et niidiotsad ei puutuks kokku
klapihõlma koega.
• Ärge painutage sõlmede sidumisel bioproteesi kommissuure.
• Ärge puudutage klapihõlma kude.
• Vältige pikaajalist kokkupuudet klapi säilituslahusega. Glutaaraldehüüd võib silmade, nina, naha ja kurguga pideval
kokkupuutumisel põhjustada ärritust. Vältige pikaajalist kokkupuudet kemikaaliaurudega ja nende sissehingamist. Kasutage vaid
piisava ventilatsiooni korral. Kokkupuutel nahaga loputage mõjutatud piirkonda kohe rohke veega 10–15 minutit. Silma sattumisel
loputage silma 15 minuti jooksul veega ja pöörduge kohe arsti poole.
5 Võimalikud kõrvaltoimed
Südame bioproteesklappidega seotud võimalikud kõrvaltoimed hõlmavad järgmisi:
• stenokardia
• südame rütmihäired
• endokardiit;
• südamepuudulikkus
• hemolüüs;
• hemolüütiline aneemia;
• hemorraagia, antikoagulandi/antitrombotsüütilise toimega seotud
• transvalvulaarne või paravalvulaarne leke
• müokardiinfarkt
48Eesti
Page 49

• mittestrukturaalne düsfunktsioon (klapihõlmade kinnikiilumine/pitsumine, obstruktiivne pannuse sissekasv, õmbluse avanemine,
valesti valitud suurus, muu)
• proteesi regurgitatsioon
• insult
• strukturaalne kahjustus (kaltsifikatsioon, klapihõlma rebenemine, stenoos, muu)
• trombemboolia
• klapi tromboos
Need tüsistused võivad põhjustada järgmist:
• kordusoperatsioon;
• bioproteesi eksplanteerimine
• püsiv invaliidsus
• Surm
6 Kasutusjuhend
6.1 Käsitsemise ja ettevalmistamise juhised
Südameklapi asendamisel on kriitilise tähtsusega õige suuruse valimine. Kasutage bioproteesi Avalus õige suuruse valimiseks
kalibraatoreid Avalus (mudel 7400S). Lisateavet lugege kasutusjuhendist.
Mahuti väliskülg ja kaas ei ole steriilsed. Mahutis olev klapp ja kõik mahutisisesed pakendi komponendid on steriilsed ning neid tuleb
käsitseda steriilses operatsiooniväljas.
1. Valmistage ette 2 loputusvanni, kummaski 500 ml steriilset füsioloogilist lahust.
2. Kontrollige sulgurribasid veendumaks, et mahuti ei ole kahjustatud ega eelnevalt avatud. Ärge kasutage klappi, kui kõik
sulgurribad on kahjustatud.
3. Pöörake kaant vastupäeva ja avage mahuti (joonis 2).
4. Hoidke fiksaatorit pöidla ja nimetissõrmega. Tõstke klapp aeglaselt mahutist välja, võimaldades glutaaraldehüüdist
säilituslahusel ära voolata (joonis 3).
5. Kontrollige, et fiksaatoril olev seerianumber ühtiks mahuti kaanel, pakendil ja patsiendi registreerimisvormil oleva
seerianumbriga. Jäädvustage seerianumber patsiendi haigusloosse, kasutades patsiendi registreerimisvormil olevaid
kleebiseid.
6. Hoidke fiksaatorit püsti. Eemaldage fiksaatori kork, pöörates seda pöidla ja nimetissõrme abil vastupäeva (joonis 4). Hoidik tuleb
nähtavale.
7. Sisestage steriilne käepide hoidikusse. Pöörake käepide päripäeva hoidiku keermestatud avausse, kuni tunnete takistust
(joonis 5).
8. Klapi fiksaatorist eemaldamiseks tõmmake käepidet ülespoole (joonis 6).
6.2 Loputamine
1. Asetage kogu klapp koos hoidikuga ühte loputusvannidest (joonis 6).
2. Loksutage klappi käepideme abil pidevalt vähemalt 30 sekundi jooksul.
3. Pigistage õrnalt õmblusrõngast, et järelejäänud glutaaraldehüüd eemaldada. Ärge puudutage klapi koeosa.
4. Asetage klapp teise vanni. Hoidke klappi vannis, kuni kirurg seda vajab.
6.3 Aordiklapi implanteerimine
Bioprotees Avalus on mõeldud implanteerimiseks supraannulaarsesse asendisse. Kasutage kalibraatoreid Avalus (mudel 7400S), et
visualiseerida õmblusmanseti paigutust võru kohal, kinnitada paigutust ja paigaldada klapp supraannulaarsesse ruumi.
Kirurgilise tehnika valik supraannulaarsesse asendisse implanteerimisel jääb kirurgi teha. Mis tahes modifitseeritud tehnika peab
vastama jaotisele Peatükk 4, Hoiatused ja ettevaatusabinõud, lk 47. Üldiselt tuleb järgida järgmisi samme.
1. Suunake klapp nii, et stent ega õmblusrõngas ei blokeeriks koronaarsuistikku.
2. Niisutage klappi korrapäraselt steriilse füsioloogilise lahusega, et vältida õrna koe kuivamist.
3. Paigutage klapp võrusse ja paigaldage õmblused õmblusrõngale.
4. Kinnitage klapp sobiva õmblustehnikaga. Võimalike probleemide vältimiseks lugege jaotist Peatükk 4, Hoiatused ja
ettevaatusabinõud, lk 47.
5. Hoidiku vabastamiseks lõigake õmblused läbi ainsas lõikekohas, mis on tähistatud valge noolega (joonis 7). Hoidiku
eemaldamiseks tõmmake käepide õrnalt klapist eemale.
6. Eemaldage hoidik käepideme küljest ja visake hoidik ära.
49 Eesti
Page 50

7. Siduge kõik sõlmed ja lõigake niidiotsad. Veenduge, et implanteerimiskohta ei jääks õmblusmaterjali jäänuseid.
Õmblusmaterjali jäänuste olemasolul eemaldage need enne klapi implanteerimise lõpuleviimist.
7 Ravi individualiseerimine
Esmaste implanteerimisjärgsete etappide käigus tuleb südameklapi bioproteesiga patsiente hoida antikoagulantravil, välja arvatud
juhul, kui see on vastunäidustatud.
Laienenud vasaku kojaga, anamneesis trombemboolia tekkega või koja fibrillatsiooni või koja laperdusega südame rütmihäiretega
patsientidel kaaluge pikaajalist antikoagulant- ja/või trombotsüütidevastast ravi.
8 Patsiendi nõustamise teave
Soovitatav on pidev meditsiiniline järelkontroll (vähemalt üks kord aastas), et klapiga seotud tüsistusi saaks diagnoosida ja õigesti
ravida.
Klapi bioproteesiga patsientidel on risk baktereemia tekkeks (nt hambaravi ajal). Nõustage neid profülaktilise antibiootikumravi osas.
Soovitage patsientidel alati kaasas kanda ettevõtte Medtronic pakutavat implanteeritud seadme tunnuskaarti.
9 Tarnimine
9.1 Pakendamine
Bioprotees Avalus on keemiliselt steriliseeritud ja tarnitakse steriilsena puhverdatud 0,2% glutaaraldehüüdi lahuses. Steriilsus on
rikutud, kui klaasist anumast ja kaanest koosnev mahuti on avatud või kahjustatud. Mahuti väliskülg ei ole steriilne. Ärge asetage seda
steriilsesse alasse.
9.2 Hoiustamine
Hoidke bioproteesi Avalus temperatuuril 5°C kuni 25°C (41°F kuni 77°F). Külmutamine ei ole vajalik ja sügavkülmutamine võib klappi
kahjustada. Hoidmine toatemperatuuril kuni 25°C (77°F) on rahuldav. Hoidke klappi päikesevalguse või muude ultraviolettkiirguse
allikate eest ning ärge hoidke seda kohtades, kus võivad esineda olulised temperatuurikõikumised.
Korraldage inventari haldus nii, et varasemate kõlblikkusaja kuupäevadega bioproteesid implanteeritaks esimesena vältimaks
aegumistähtaegade ületamist.
9.3 Eksplanteeritud bioproteeside tagastamine
Küsige ettevõtte Medtronic esindajalt toote tagastuskomplekti, et eksplanteeritud bioproteesid analüüsimiseks ja kõrvaldamiseks
tagasi saata. Kui komplekt ei ole saadaval, asetage eksplanteeritud bioprotees kohe pärast eksplanteerimist glutaaraldehüüdi või
10% puhverdatud formaliini sisaldavasse anumasse. Lisajuhiste saamiseks seadme tagastamise kohta pöörduge ettevõtte
Medtronic müügiesindaja poole.
10 Patsienditeave
10.1 Registreerimisteave
Märkus. Patsiendi registreerimine ei kehti riikides, kus patsiendi andmete väljastamine on vastuolus patsiendi isikukaitse seadustega
(kaasa arvatud Euroopa Liidu riigid).
Patsiendi registreerimisvormi leiate igast seadme pakendist. Pärast implanteerimist täitke kõik vajaliku teabe väljad. Tagastage
originaalvorm vormil märgitud ettevõtte Medtronic aadressile. Enne patsiendi välja kirjutamist andke talle ajutine tunnuskaart.
Patsiendile antakse implanteeritud seadme tunnuskaart. Sellel kaardil on patsiendi raviarsti nimi ja telefoninumber ning teave, mida
meditsiinipersonal erakorralisel juhul vajada võib.
11 Operatsioonijärgne teave
11.1 Magnetresonantsuuringuga (MRT) sobivus
Bioproteesi Avalus mudel 400 on magnetresonantskeskkonnas (MR) ohutu. Klapp ei sisalda metalli ega ole seetõttu
magnetresonantskeskkondades ühelgi teadaoleval viisil ohtlik.
MR-skanne magnetvälja tugevusega 3,0 T ja 1,5 T võib teha vahetult pärast implanteerimist. Klapp ei põhjusta patsiendile mingeid
vigastusi, kui teda skannitakse MRT-seadmega.
11.2 Kujutise artefakt
MR-kujutise kvaliteet võib halveneda, kui skannitakse klapi asukohas või selle lähedal. Vajaduse korral optimeerige MR-uuringu
parameetrid vastavalt klapi olemasolule.
50Eesti
Page 51

12 Tarvikud
Kasutage bioproteesi Avalus sobiva suuruse määramiseks vaid kalibraatoreid Avalus (mudel 7400S) ja ettevõtte Medtronic klapi
käepidet (mudel 7420).
Ettevaatust! Ärge kasutage kalibraatoreid ega käepidemeid enne, kui need on põhjalikult puhastatud ja steriliseeritud. Lisajuhiseid
lugege vastavatest kasutusjuhenditest.
Ettevaatust! Ärge kasutage bioproteesi Avalus suuruse määramiseks teiste tootjate klapi kalibraatoreid ega ettevõtte Medtronic
muude proteeside kalibraatoreid.
13 Garantiist lahtiütlemine
JÄRGMINE GARANTIIST LAHTIÜTLEMINE KEHTIB VÄLJASPOOL AMEERIKA ÜHENDRIIKE ASUVATELE KLIENTIDELE.
KUIGI BIOPROTEES AVALUS, MUDEL 400, EDASPIDI „TOODE“, ON HOOLIKALT VÄLJA TÖÖTATUD, TOODETUD JA ENNE
MÜÜKI KATSETATUD, VÕIB TOOTEL MITMESUGUSTEL PÕHJUSTEL OMA ETTENÄHTUD FUNKTSIOONI RAHULDAV
TÄITMINE EBAÕNNESTUDA. TOOTEDOKUMENTATSIOONIS TOODUD HOIATUSED ANNAVAD ÜKSIKASJALIKUMAT
TEAVET JA NEID LOETAKSE SELLE GARANTIIST LAHTIÜTLEMISE LAHUTAMATUKS OSAKS. SEEGA ÜTLEB MEDTRONIC
LAHTI KÕIGIST OTSESTEST JA KAUDSETEST TOOTEGA SEOTUD GARANTIIDEST. MEDTRONIC EI VASTUTA MITTE
MINGITE JUHUSLIKE EGA KAASNEVATE KAHJUDE EEST, MIDA PÕHJUSTAB TOOTE MIS TAHES KASUTAMINE, DEFEKT
VÕI TÕRGE, OLENEMATA SELLEST, KAS KAHJUNÕUE PÕHINEB GARANTIIL, LEPINGUL, LEPINGUVÄLISEL KAHJUL VÕI
MUUL.
Ülaltoodud välistamised ja piirangud ei ole mõeldud kohaldatavate seaduste kohustuslike sätetega vastuollu sattuma ning neid ei tohi
sellisena käsitada. Kui mis tahes pädeva jurisdiktsiooni kohus peab selle GARANTIIST LAHTIÜTLEMISE mis tahes osa või tingimust
ebaseaduslikuks, jõustamatuks või kohaldatavate seadustega vastuolus olevaks, ei mõjuta see GARANTIIST LAHTIÜTLEMISE
ülejäänud osa kehtivust ning kõiki õigusi ja kohustusi tuleb mõista ning rakendada nii, nagu poleks GARANTIIST LAHTIÜTLEMINE
kehtetuks kuulutatud osa või tingimust sisaldanud.
51 Eesti
Page 52

1 Laitteen kuvaus
3
2
1
4
5
Avalus-bioproteesin mallissa 400 on polyesterillä päällystetty pohjakehys ja kolmiliuskainen tukikehysrakenne, joka on muotoiltu
kolmiliuskaläpän muotoiseksi. Pohjakehys ja kolmiliuskainen tukikehys on ruiskuvalettu polyeetterieetteriketoni- eli
PEEK-materiaalista. Pohjakehyksen PEEK-materiaali on kyllästetty bariumsulfaatilla, jotta se näkyy röntgenkuvauksessa. Liuskat on
laserleikattu naudan kudoksesta ja ristisidottu puskuroidussa glutaarialdehydissa. Liuskat on asetettu kolmiliuskaisen tukikehyksen
ja pohjakehyksen väliin, minkä jälkeen kaikki osat on ommeltu tukevasti yhteen. Pohjakehyksen sisäänvirtauspuolen päällykseen on
integroitu polyesterikankaasta valmistettu ommelrengas, jonka avulla käyttäjä voi ommella ja asettaa Avalus-bioproteesin
supra-anulaarisesti. Ommelrenkaassa on kunkin liuskan keskipoukama-alueella ommelmerkit, joiden avulla implantointiompeleet on
helppo asettaa tasaisin välein (Kuva 1). Läpän ulosvirtauspuolelle on kiinnitetty kertakäyttöinen pidin, joka helpottaa implantointia.
Aorttaläppäbioproteesi (läppä) on käsitelty mineralisoitumista estävällä alfa-aminoöljyhappo- eli AOA-prosessilla, jonka on
eläinkokeissa todettu vähentävän sian läpän liuskojen kalkkiutumista.
Kertakäyttöinen pidin sopii kestokäyttöisen Medtronic-läppäkahvan malliin 7420. Pitimessä on yksi katkaisukohta, josta leikkaamalla
pidin irrotetaan läpästä. Oikea läppäkoko valitaan kaksipäisillä sovittimilla. Lieriöpää vastaa läpän aukkoa. Replikapää jäljittelee
proteesin muotoa.
Taulukko 1. Saatavilla olevat koot ja ommelrenkaan läpimitat (nimellisarvot millimetreinä)
Koko 19 mm 21 mm 23 mm 25 mm 27 mm 29 mm
(1) Kehyksen läpimitta (TAD) 19 21 23 25 27 29
(2) Sisäaukon läpimitta 17,5 19,5 21,5 23,5 25,5 27,5
(2a) Sisäaukon läpimitta
(3) Ulkoisen ommelrenkaan läpimitta 27,0 29,0 31,0 33,0 36,0 38,0
(4) Läpän profiilin korkeus 13,0 14,0 15,0 16,0 17,0 18,0
(5) Työntyminen aorttaan 11,0 12,0 13,0 14,0 15,0 16,0
a
18 20 22 24 26 28
Huomautus: TAD – kudosanuluksen läpimitta
a
Arvo on kehyksen mitta kudoksen kanssa (2) ja kehyksen mitta ilman kudosta (2a)
2 Käyttöaiheet
Avalus-bioproteesi on tarkoitettu korvaamaan sairas, vaurioitunut tai vajaasti toimiva synnynnäinen tai proteettinen aorttaläppä.
3 Vasta-aiheet
Älä käytä läppää, jos sen käyttö ei ole potilaan parhaan edun mukaista. Arvioi kaikki toimenpiteeseen liittyvät riskit ja myös anatomiset
ja patologiset seikat leikkaushetkellä.
4 Vaarat ja varotoimet
4.1 Vaarat
• Laite on tarkoitettu kertakäyttöiseksi. Älä käytä, käsittele tai steriloi tätä laitetta uudelleen. Uudelleenkäyttö, -käsittely tai -sterilointi
voi heikentää laitteen rakennetta tai aiheuttaa kontaminaatiovaaran, mikä voi johtaa potilaan vammaan, sairauteen tai
kuolemaan.
• Älä steriloi läppää uudelleen millään tavalla. Läpän ja sen säilytysastian altistuminen säteilylle, höyrylle, etyleenioksidille tai
muille kemiallisille sterilointiaineille tekee läpästä käyttökelvottoman.
• Tarkista pahvipakkauksen sisällä oleva kuljetuslämpötilailmaisin. Jos kuljetuslämpötilailmaisimen ikkuna on musta, läppä ei
sovellu kliiniseen käyttöön.
• Älä käytä läppää seuraavissa olosuhteissa:
– Läppä on pudonnut tai vaurioitunut, tai sitä on käsitelty jollain tavalla väärin.
– Viimeinen käyttöpäivämäärä on umpeutunut.
– Kaikki sinettiliuskat ovat vaurioituneet.
– Sarjanumerolappu ei vastaa säilytysastian etiketin numeroa.
– Glutaarialdehydisäilytysliuos ei peitä läppää kokonaan, tai pakkauksesta vuotaa nestettä.
– Läpässä näkyy heikentymisen merkkejä.
52Suomi
Page 53

• Älä käsittele läpän kudososaa instrumenteilla. Läppää on käsiteltävä erittäin huolellisesti, jotta herkkä läppäkudos ei vaurioituisi.
Pienikin reikä voi ajan kuluessa suurentua ja heikentää läpän toimintaa merkittävästi.
• Älä yritä korjata vaurioitunutta läppää. Vaurioitunutta läppää ei saa käyttää.
• Älä lisää antibiootteja tai mitään muuta ainetta säilytys- tai huuhteluliuokseen.
• Älä yritä asettaa paikalleen läppää, joka on liian suuri anulukseen nähden. Valitse läppä, joka istuu hyvin aortan tyveen
muuttamatta anatomisten natiivirakenteiden tai Avalus-bioproteesin muotoa.
• Älä käytä muiden valmistajien läppäsovittimia tai muille Medtronic-proteeseille tarkoitettuja sovittimia läpän koon
määrittämiseen.
• Älä anna läpän kuivua. Estä läppäkudoksen kuivuminen kostuttamalla läppää steriilillä normaalilla keittosuolaliuoksella
säännöllisesti implantoinnin aikana.
4.2 Varotoimet
• Harkitse näitä mahdollisia riskitekijöitä huolellisesti valitessasi sopivaa läpän korviketta:
– Kalkkiutumisesta johtuva rappeutuminen voi nopeuttaa läpän heikkenemistä, jos potilaalla on kalsiumaineenvaihdunnan
muutoksia (esimerkiksi krooninen munuaisten vajaatoiminta, lisäkilpirauhasen liikatoiminta).
– Kalkkiutumista voi esiintyä aikaisemmin lapsilla, nuorilla tai nuorilla aikuisilla.
– Ennenaikaista kalkkiutumista voi esiintyä myös vanhemmilla aikuisilla, jotka valitsevat biologisen proteesin.
– Bioproteesipotilailla, jotka tarvitsevat pysyvää antikoagulaatiota, on ylimääräinen verenvuotoriski.
• Älä aseta läpän säilytysastian epästeriiliä ulkopuolta steriilille alueelle.
• Älä käytä Avalus-sovittimien mallia 7400S tai Medtronic-läppäkahvan mallia 7420, ennen kuin ne on puhdistettu ja steriloitu
perusteellisesti. Katso lisäohjeita vastaavista käyttöohjeista.
• Kun valitset läppäkokoa, ota huomioon potilaan anatomia ja valitse läppä, joka vastaa potilaan hemodynaamisia
vaatimuksia.
• Älä implantoi läppää, jos sitä ei ole huuhdeltu asianmukaisesti.
• Suuntaa kehystuet ja aseta läppä niin, että sepelvaltimoiden aukot eivät tukkeudu.
• Vältä koskettamasta läppää tai huuhteluliuosta pyyhkeillä, liinoilla tai muilla esineillä, joista voi siirtyä hiukkasia liuskakudokseen.
• Tarkista ennen ompelua, mikä on läpän sisäänvirtaus- ja mikä ulosvirtauspuoli.
• Aseta ompeleet varovasti ommelrenkaan läpi, jotta et vahingossa repäise liuskakudosta. Jos liuskakudos vaurioituu, läppä on
poistettava ja vaihdettava uuteen.
• Älä käytä leikkaavia neuloja, suojaamattomia pihtejä tai teräviä instrumentteja, jotka voivat vaurioittaa läpän rakennetta.
• Huomioi läpän mahdollinen vaurioitumisvaara, ennen kuin viet katetreja, kirurgisia instrumentteja ja laskimoteitse asennettavia
tahdistusjohtimia läpän läpi.
• Jos käytät katko-ompeleita, on tärkeää, että leikkaat langat läheltä solmuja. Varmista, että lankojen näkyvät päät eivät kosketa
liuskakudosta.
• Älä taivuta bioproteesin kommissuuria, kun sidot solmuja.
• Älä käsittele liuskakudosta.
• Vältä pitkäaikaista kosketusta läpän säilytysliuoksen kanssa. Glutaarialdehydi voi aiheuttaa ärsytystä silmissä, nenässä, iholla ja
kurkussa, jos altistus on jatkuva. Vältä pitkäaikaista altistumista kemikaalihöyryille tai niiden hengittämistä. Käytä laitetta vain
tiloissa, joissa on riittävä ilmanvaihto. Jos ainetta joutuu iholle, huuhdo kyseistä aluetta heti runsaalla vedellä 10–15 minuutin ajan.
Jos ainetta joutuu silmään, huuhdo silmää vedellä 15 minuutin ajan ja hakeudu heti lääkärin hoitoon.
5 Mahdolliset haittatapahtumat
Biologisten läppäproteesien käyttöön liittyy seuraavia mahdollisia haittatapahtumia:
• rasitusrintakipu
• sydämen rytmihäiriöt
• endokardiitti
• sydämen vajaatoiminta
• hemolyysi
• hemolyyttinen anemia
• verenvuoto, antikoagulanteista ja verihiutaleiden estäjistä johtuva
• vuoto, trans- tai paravalvulaarinen
• sydäninfarkti
• muu kuin rakenteellinen toimintahäiriö (liuskan takertuminen tai puristuminen, obstruktiivinen pannuksen sisäänkasvu, ompeleen
avautuminen, väärä koko, muu syy)
53 Suomi
Page 54

• proteesin käänteisvirtaus
• aivohalvaus
• rakenteellinen rappeutuminen (kalkkiutuminen, liuskan repeäminen, stenoosi, muu syy)
• tromboembolia
• läpän tromboosi
Näiden komplikaatioiden seurauksia voivat olla
• uusi leikkaus
• bioproteesin eksplantointi
• pysyvä vammautuminen
• kuolema
6 Käyttöohjeet
6.1 Käsittely- ja esivalmisteluohjeet
Sydänläpän korvausleikkauksen onnistumiseen vaikuttaa merkittävästi oikean koon valinta. Valitse oikeankokoinen
Avalus-bioproteesi Avalus-sovittimien mallin 7400S avulla. Lisätietoja on käyttöohjeissa.
Säilytysastian ja kannen ulkopuoli on epästeriili. Läppä ja kaikki säilytysastiassa olevat pakkausosat ovat steriilejä, ja niitä on
käsiteltävä steriilillä leikkausalueella.
1. Valmista kaksi huuhteluastiaa, joista kumpikin sisältää 500 ml steriiliä normaalia keittosuolaliuosta.
2. Tarkista, että sinettiliuskat ovat ehjiä. Näin varmistat, ettei säilytysastia ole vaurioitunut ja ettei sitä ole avattu aikaisemmin. Älä
käytä läppää, jos kaikki sinettiliuskat ovat vaurioituneet.
3. Käännä kantta vastapäivään ja avaa säilytysastia (Kuva 2).
4. Tartu koteloon peukalolla ja etusormella. Nosta läppä hitaasti säilytysastiasta niin, että glutaarialdehydisäilytysliuos valuu pois
(Kuva 3).
5. Tarkista, että kotelon sarjanumero on sama kuin sarjanumero säilytysastian kannessa, pahvipakkauksessa ja
potilasrekisteröintilomakkeessa. Kirjaa sarjanumero potilastietoihin käyttämällä potilasrekisteröintilomakkeessa olevia tarroja.
6. Pidä läppäkoteloa pystysuorassa. Irrota kotelon kansi kääntämällä sitä vastapäivään peukalolla ja etusormella (Kuva 4). Pidin
tulee näkyviin.
7. Aseta pitimeen steriili kahva. Kierrä kahvaa myötäpäivään pitimen kierreaukkoon, kunnes tunnet vastusta (Kuva 5).
8. Poista läppä kotelosta vetämällä kahvaa ylöspäin (Kuva 6).
6.2 Huuhtelutoimenpide
1. Aseta koko läppä ja pidin ensimmäiseen huuhteluastiaan (Kuva 6).
2. Heiluta läppää kahvan avulla yhtäjaksoisesti vähintään 30 sekunnin ajan.
3. Poista mahdolliset glutaarialdehydijäämät puristamalla ommelrengasta varovasti. Älä koske läpän kudososaa.
4. Aseta läppä toiseen astiaan. Jätä läppä astiaan, kunnes kirurgi tarvitsee sitä.
6.3 Aorttaläpän implantointi
Avalus-bioproteesi on tarkoitettu supra-anulaariseen implantointiin. Avalus-sovittimien mallin 7400S avulla voit visualisoida
ommelrenkaan asettamisen anuluksen yläpuolelle sekä varmistaa läpän asennon ja istuvuuden supra-anulaarisessa tilassa.
Supra-anulaarisessa implantoinnissa leikkausmenetelmän valinta on yksittäisen kirurgin harkinnassa. Jos käytetään jotakin
muunneltua menetelmää, sen on vastattava seuraavaa kohtaa: Luku 4, Vaarat ja varotoimet, sivu 52. Noudata seuraavia yleisohjeita:
1. Suuntaa läppä siten, että kehys ja ommelrengas eivät tuki sepelvaltimoiden aukkoja.
2. Kostuta läppää säännöllisesti steriilillä normaalilla keittosuolaliuoksella, jotta herkkä läppäkudos ei kuivu.
3. Aseta läppä anulukseen ja aseta ompeleet ommelrenkaaseen.
4. Ompele läppä paikalleen asianmukaisella ommeltekniikalla. Estä mahdolliset ongelmat seuraavan kohdan mukaisesti: Luku 4,
Vaarat ja varotoimet, sivu 52.
5. Irrota pidin katkaisemalla ompeleet yhdessä katkaisukohdassa, joka on merkitty valkoisella nuolella (Kuva 7). Irrota pidin
vetämällä kahvaa varovasti läpästä poispäin.
6. Irrota pidin kahvasta ja hävitä pidin.
7. Sido kaikki solmut ja katkaise lankojen päät. Tarkista, ettei ommeljäämiä näy. Jos ommeljäämiä näkyy, poista ne ennen läpän
implantoinnin päättämistä.
54Suomi
Page 55

7 Hoidon yksilöllistäminen
Biologisen sydänläppäproteesin saaneille potilaille on annettava antikoagulanttihoitoa implantoinnin jälkeisissä ensivaiheissa, paitsi
jos se on vasta-aiheista.
Harkitse pitkäaikaista antikoagulanttihoitoa tai verihiutaleiden estäjähoitoa potilaille, joilla on laajentunut vasen eteinen, aikaisempia
tromboemboliatapahtumia tai sydämen rytmissä eteisvärinää tai eteislepatusta.
8 Potilaan ohjaukseen liittyviä tietoja
Jatkuvaa lääketieteellistä seurantaa (vähintään vuosittain) suositellaan, jotta läppään liittyvät komplikaatiot pystytään diagnosoimaan
ja hoitamaan asianmukaisesti.
Biologisen läppäproteesin saaneilla potilailla on bakteremian riski (esimerkiksi hammashoitotoimenpiteissä). Anna potilaalle ohjeita
profylaktisesta antibioottihoidosta.
Kehota potilaita pitämään Medtronic-yhtiön antama implantoidun laitteen tunnistekortti jatkuvasti mukana.
9 Toimitustapa
9.1 Pakkaus
Avalus-bioproteesi on steriloitu kemiallisesti, ja se toimitetaan steriilinä puskuroidussa 0,2-prosenttisessa
glutaarialdehydiliuoksessa. Steriiliys on heikentynyt, jos lasipurkista ja kannesta koostuva säilytysastia on auennut tai vaurioitunut.
Säilytysastian ulkopuoli ei ole steriili. Älä aseta sitä steriilille alueelle.
9.2 Säilyttäminen
Säilytä Avalus-bioproteesi 5°C–25°C:ssa (41°F–77°F:ssa). Jääkaappilämpötilaa ei tarvita, ja jäätyminen voi vaurioittaa läppää.
Säilytys huoneenlämmössä enintään 25°C:ssa (77°F:ssa) riittää. Älä altista läppää auringonvalolle tai muille ultraviolettivalon lähteille
äläkä sijoita sitä paikkaan, jossa voi esiintyä huomattavia lämpötilanvaihteluita.
Hoida varastoa asianmukaisesti niin, että ensin implantoidaan bioproteesit, joiden viimeinen käyttöpäivä umpeutuu aikaisemmin.
Näin vältetään viimeisen käyttöpäivän ylittyminen.
9.3 Poistettujen bioproteesien palautus
Ota yhteys Medtronic-myyntiedustajaan ja pyydä tuotepalautuspakkaus, jotta voit palauttaa poistetut bioproteesit analysointia ja
hävittämistä varten. Jos sinulla ei ole pakkausta, laita potilaasta poistettu bioproteesi heti poiston jälkeen astiaan, jossa on
glutaarialdehydia tai 10-prosenttista puskuroitua formaliinia. Saat lisäohjeita palauttamisesta Medtronic-myyntiedustajalta.
10 Potilastiedot
10.1 Rekisteröintitiedot
Huomautus: potilasrekisteröinti ei koske maita, joissa potilaan yksityisyyttä koskevat lait estävät potilastietojen antamisen, kuten
Euroopan unionin maita.
Jokaisen laitteen pakkauksessa on potilasrekisteröintilomake. Täytä kaikki pyydetyt tiedot implantoinnin jälkeen. Palauta
alkuperäinen lomake siinä mainittuun Medtronic-yhtiön osoitteeseen. Anna potilaalle väliaikainen tunnistekortti ennen kotiuttamista.
Potilaalle toimitetaan implantoidun laitteen tunnistekortti. Tähän korttiin on merkitty potilasta hoitavan lääkärin nimi ja puhelinnumero
sekä tietoja, joita hoitohenkilökunta tarvitsee hätätilanteissa.
11 Leikkauksen jälkeistä hoitoa koskevia tietoja
11.1 Yhteensopivuus magneettikuvauksen (MRI) kanssa
Avalus-bioproteesin malli 400 on turvallinen magneettikuvauksessa (MR Safe). Läppä ei sisällä metallia, joten sillä ei ole tunnettuja
riskejä magneettikuvausympäristöissä.
Magneettikuvaus 3,0 T:lla ja 1,5 T:lla voidaan tehdä heti implantoinnin jälkeen. Läpästä ei ole haittaa potilaalle magneettikuvauksen
aikana.
11.2 Kuva-artefaktit
Magneettikuvan laatu voi heiketä, jos kuvattava kohde on läpän kohdalla tai lähellä sitä. Optimoi magneettikuvausparametrit
tarvittaessa läpän kohtaa kuvattaessa.
55 Suomi
Page 56

12 Lisävarusteet
Käytä Avalus-bioproteesin oikean koon määrittämiseen ainoastaan Avalus-sovittimien mallia 7400S ja Medtronic-läppäkahvan
mallia 7420.
Varoitus: Älä käytä sovittimia tai kahvoja, ennen kuin ne on puhdistettu ja steriloitu perusteellisesti. Katso lisäohjeita vastaavista
käyttöohjeista.
Varoitus: Älä käytä muiden valmistajien läppäsovittimia tai muille Medtronic-proteeseille tarkoitettuja sovittimia Avalus-bioproteesin
koon määrittämiseen.
13 Takuuta koskeva vastuuvapauslauseke
SEURAAVA TAKUUTA KOSKEVA VASTUUVAPAUSLAUSEKE KOSKEE YHDYSVALTOJEN ULKOPUOLISIA ASIAKKAITA:
VAIKKA AVALUS-BIOPROTEESI (MALLI 400), JÄLJEMPÄNÄ ”TUOTE”, ON SUUNNITELTU, VALMISTETTU JA TESTATTU
HUOLELLISESTI ENNEN MYYNTIÄ, USEISTA ERI SYISTÄ SAATTAA JOHTUA, ETTÄ TUOTE EI TOIMI TARKOITETULLA
TAVALLA. TUOTEDOKUMENTAATIOSSA OLEVAT VAROITUKSET SISÄLTÄVÄT TARKEMPIA LISÄTIETOJA JA KUULUVAT
OLENNAISENA OSANA TÄHÄN TAKUUTA KOSKEVAAN VASTUUVAPAUSLAUSEKKEESEEN. MEDTRONIC SANOUTUU
SITEN IRTI KAIKISTA TUOTTEESEEN LIITTYVISTÄ NIMENOMAISISTA JA KONKLUDENTTISISTA TAKUISTA. MEDTRONIC
EI OLE VASTUUSSA MISTÄÄN SATUNNAISESTA TAI VÄLILLISESTÄ VAHINGOSTA, JOKA ON AIHEUTUNUT TUOTTEEN
KÄYTÖSTÄ, VIASTA TAI TOIMINNAN LAKKAAMISESTA, RIIPPUMATTA SIITÄ, PERUSTUUKO VAATIMUS TAKUUSEEN,
SOPIMUKSEEN, OIKEUDENLOUKKAUKSEEN TAI MUUHUN SEIKKAAN.
Yllä mainittuja rajoituksia ei ole tarkoitettu voimassa olevan pakottavan lainsäädännön vastaisiksi, eikä niitä pidä tällä tavoin tulkita.
Mikäli toimivaltainen tuomioistuin katsoo, että jokin tämän TAKUUTA KOSKEVAN VASTUUVAPAUSLAUSEKKEEN osa tai ehto on
laiton, täytäntöönpanokelvoton tai ristiriidassa tapaukseen sovellettavan lainsäädännön kanssa, TAKUUTA KOSKEVA
VASTUUVAPAUSLAUSEKE säilyy kuitenkin muilta osin voimassa, ja kaikkia oikeuksia ja velvollisuuksia on tulkittava ja pantava
täytäntöön ikään kuin tämä TAKUUTA KOSKEVA VASTUUVAPAUSLAUSEKE ei sisältäisi sitä erityistä osaa tai ehtoa, joka katsotaan
pätemättömäksi.
56Suomi
Page 57

1 Description du dispositif
3
2
1
4
5
La bioprothèse Avalus Modèle 400 est une structure constituée d’une armature de base recouverte de polyester et d’une armature
de support à trois feuillets, préformée selon la géométrie d’une valve à trois feuillets. L’armature de base et l’armature de support à trois
feuillets sont moulées par injection à partir de polyétheréthercétone (PEEK). Le PEEK de l’armature de base est imprégné de sulfate
de baryum afin de permettre la visualisation radiographique. Les feuillets sont découpés au laser à partir de tissus bovins réticulés
dans du glutaraldéhyde tamponné. Les feuillets sont insérés entre l’armature de support à trois feuillets et l’armature de base, puis
tous les composants sont solidement suturés ensemble. Un anneau de suture en polyester est intégré dans la gaine de protection de
l’armature de base côté entrant pour permettre à l’utilisateur de suturer et de positionner la bioprothèse Avalus en position
supra-annulaire. Des repères de suture sont placés sur l’anneau de suture dans la zone sinusale médiane de chaque cusp afin de
servir de guides pour l’espacement régulier des sutures de l’implant (Figure 1). Un support jetable est fixé au côté sortant de la valve
afin de faciliter l’implantation. La bioprothèse aortique (valve) est traitée selon un processus d’antiminéralisation qui fait appel à de
l’acide alpha-amino oléique (AOA) et atténue la calcification des feuillets des valves porcines, comme l’ont démontré des études sur
les animaux.
Le support jetable est conçu pour s’adapter au manche pour valve réutilisable Modèle 7420 de Medtronic. Le support comporte un
point de coupe unique afin d’être retiré de la valve. Des calibreurs à double extrémité sont utilisés pour sélectionner la taille appropriée
de la valve. L’extrémité cylindrique correspond à l’orifice de la valve. À l’autre extrémité, la réplique reproduit la géométrie de la
prothèse.
Tableau 1. Tailles et diamètres de l’anneau de suture disponibles (valeurs nominales en millimètres)
Taille 19 mm 21 mm 23 mm 25 mm 27 mm 29 mm
(1) Diamètre du stent (TAD) 19 21 23 25 27 29
(2) Diamètre de l’orifice interne 17,5 19,5 21,5 23,5 25,5 27,5
(2a) Diamètre interne de l’orifice
(3) Diamètre externe de l’anneau de suture 27,0 29,0 31,0 33,0 36,0 38,0
(4) Hauteur du profil de la valve 13,0 14,0 15,0 16,0 17,0 18,0
(5) Saillie aortique 11,0 12,0 13,0 14,0 15,0 16,0
a
18 20 22 24 26 28
Remarque : TAD - diamètre de l’anneau tissulaire
a
Les mesures correspondent à l’armature du stent avec les tissus (2) et à l’armature du stent sans les tissus (2a)
2 Indications
La bioprothèse Avalus est indiquée pour le remplacement d’une valve aortique native ou prothétique malade, endommagée ou
présentant un dysfonctionnement.
3 Contre-indications
Ne pas utiliser la valve si son utilisation n’est pas dans l’intérêt du patient. Évaluer tous les risques associés, y compris l’anatomie et
la pathologie observées au moment de l’intervention chirurgicale.
4 Avertissements et précautions
4.1 Avertissements
• Ce dispositif est destiné à un usage unique. Ne pas réutiliser, retraiter ou restériliser ce dispositif. La réutilisation, le retraitement
ou la restérilisation risque de compromettre l’intégrité de la structure du dispositif ou de le contaminer, ce qui pourrait entraîner
des blessures, une maladie ou le décès du patient.
• Ne pas restériliser la valve par quelque méthode que ce soit. L’exposition de la valve et du conteneur aux rayons X, à la
vapeur, à l’oxyde d’éthylène ou à d’autres agents chimiques stérilisants rendra la valve totalement inutilisable.
• Vérifier l’indicateur de température d’expédition à l’intérieur du carton. Si la fenêtre de cet indicateur est noire, la valve ne convient
pas à un usage clinique.
• N’utiliser la valve dans aucune des circonstances suivantes :
– La valve est tombée, endommagée ou utilisée de manière incorrecte.
– La date de péremption est dépassée.
– Toutes les bandes du sceau de fermeture sont endommagées.
57 Français
Page 58

– Le numéro de série mentionné sur l’étiquette ne correspond pas au numéro figurant sur l’étiquette du conteneur.
– La solution de conservation à base de glutaraldéhyde ne recouvre pas complètement la valve ou l’emballage comporte des
fuites.
– La valve présente des signes de détérioration.
• Ne pas manipuler la partie tissulaire de la valve avec des instruments. Il importe de procéder avec une extrême prudence pour
ne pas endommager les tissus délicats de la valve. Même la plus petite des perforations pourrait s’élargir avec le temps et affecter
la fonction de la valve de manière significative.
• Ne pas essayer de réparer une valve endommagée. Une valve endommagée ne doit pas être utilisée.
• Ne pas ajouter d’antibiotiques ni aucune autre substance aux solutions de conservation ou de rinçage.
• Ne pas tenter d’insérer une valve trop grande pour l’anneau. Sélectionner une valve s’adaptant parfaitement à la racine aortique
sans déformer l’anatomie native ou la bioprothèse Avalus.
• Ne pas utiliser de calibreurs de valves d’autres fabricants ou des calibreurs spécifiques à d’autres prothèses de Medtronic pour
dimensionner la valve.
• Ne pas laisser la valve sécher. Pour empêcher la dessiccation des tissus de la valve, irriguer régulièrement celle-ci avec une
solution saline normale stérile lors de l’implantation.
4.2 Précautions
• Prendre ces risques potentiels en compte lors du choix d’un produit de remplacement de valve approprié :
– Une dégénérescence calcifiée pourrait entraîner une détérioration accélérée de la valve chez les patients dont le métabolisme
du calcium est altéré (par exemple, insuffisance rénale chronique, hyperparathyroïdie).
– Une calcification peut survenir plus tôt chez les enfants, les adolescents ou les jeunes adultes.
– Une calcification prématurée peut également se produire chez les adultes plus âgés qui acceptent une prothèse biologique.
– Les patients ayant une bioprothèse qui nécessitent un traitement chronique par anticoagulants présentent un risque
supplémentaire de saignement.
• Ne pas placer l’extérieur non stérile du conteneur de la valve dans le champ stérile.
• Ne pas utiliser les calibreurs Avalus Modèle 7400S ou le manche pour valve Modèle 7420 de Medtronic tant qu’ils n’ont pas été
soigneusement nettoyés et stérilisés. Consulter le mode d’emploi approprié pour de plus amples instructions.
• La taille de la valve doit être sélectionnée en fonction de l’anatomie du patient et de ses exigences hémodynamiques.
• Ne pas implanter de valve sans effectuer les procédures de rinçage appropriées.
• Orienter les montants du stent et positionner la valve de sorte à ne pas obstruer les orifices coronaires.
• Éviter tout contact de la valve ou de la solution de rinçage avec des serviettes, des tissus ou d’autres sources susceptibles de
transférer des particules de matière sur les tissus des feuillets.
• Identifier les orifices de débit entrant et sortant de la valve avant de suturer.
• Réaliser très soigneusement les sutures sur l’anneau de suture pour éviter de lacérer les tissus des feuillets. Si les tissus des
feuillets sont endommagés, la valve doit être explantée et remplacée.
• Ne pas utiliser d’aiguilles coupantes, de pinces non protégées ou d’instruments tranchants qui pourraient entraîner des
dommages structurels de la valve.
• Les risques d’endommagement doivent être soupesés avant l’insertion des cathéters, des instruments chirurgicaux et des
sondes de stimulation endocavitaires dans la valve.
• Si les sutures sont discontinues, il est important de les couper près des nœuds. Veiller à ce que les fils de suture exposés n’entrent
pas en contact avec les tissus des feuillets.
• Ne pas plier les commissures de la bioprothèse pour réaliser les nœuds.
• Ne pas manipuler les tissus des feuillets.
• Éviter tout contact prolongé avec la solution de conservation de la valve. Le glutaraldéhyde pourrait provoquer une irritation
oculaire, nasale, cutanée et pharyngée en cas d’exposition continue. Éviter une exposition prolongée à la vapeur chimique ou une
inhalation de cette dernière. Ce dispositif doit être utilisé uniquement dans un lieu suffisamment aéré. En cas de contact cutané,
rincer immédiatement la zone touchée avec de grandes quantités d’eau pendant 10 à 15 minutes. En cas de contact oculaire,
rincer à l’eau pendant 15 minutes et consulter immédiatement un médecin.
5 Événements indésirables potentiels
Les effets indésirables potentiellement associés à l’utilisation de bioprothèses cardiaques incluent :
• Angine
• Dysrythmies cardiaques
• Endocardite
• Insuffisance cardiaque
58Français
Page 59

• Hémolyse
• Anémie hémolytique
• Hémorragie liée à la prise d’anticoagulants/d’antiplaquettaires
• Fuite transvalvulaire ou paravalvulaire
• Infarctus du myocarde
• Dysfonction non structurelle (blocage/gêne des feuillets, croissance obstructive du pannus, déhiscence des sutures,
dimensionnement inadapté, autre)
• Régurgitation de la prothèse
• Accident vasculaire cérébral
• Détérioration structurelle (calcification, déchirure du feuillet, sténose, autre)
• Thrombo-embolie
• Thrombose valvulaire
Ces complications peuvent aboutir à :
• Nouvelle opération
• Explantation de la bioprothèse
• Infirmité permanente
• Décès
6 Mode d’emploi
6.1 Instructions de manipulation et de préparation
Le choix de la taille adéquate est essentiel au remplacement de la valve cardiaque. Utiliser les calibreurs Avalus Modèle 7400S pour
sélectionner la bioprothèse Avalus de taille appropriée. Pour des informations complémentaires, se reporter au mode d’emploi.
L’extérieur du conteneur et son couvercle ne sont pas stériles. La valve et tous les composants d’emballage situés dans le conteneur
sont stériles et doivent être manipulés dans le champ opératoire stérile.
1. Préparer 2 bacs de rinçage contenant chacun 500 ml de solution saline normale stérile.
2. Examiner les bandes du sceau de fermeture pour s’assurer que le conteneur n’a pas été endommagé, ni précédemment ouvert.
Ne pas utiliser la valve si toutes les bandes du sceau de fermeture sont endommagées.
3. Tourner le couvercle dans le sens inverse des aiguilles d’une montre et ouvrir le conteneur (Figure 2).
4. Saisir le récipient entre le pouce et l’index. Soulever lentement la valve hors du conteneur en permettant l’égouttement de la
solution de conservation au glutaraldéhyde (Figure 3).
5. Vérifier que le numéro de série apposé sur le récipient correspond à celui placé sur le couvercle du conteneur, l’emballage de
stockage et la fiche d’enregistrement du patient. Consigner le numéro de série dans le dossier du patient en utilisant les
autocollants de la fiche d’enregistrement du patient.
6. Tenir le récipient en position verticale. Retirer le capuchon du récipient en le tournant dans le sens inverse des aiguilles d’une
montre à l’aide du pouce et de l’index (Figure 4). Le support devient visible.
7. Insérer un manche stérile dans le support. Faire pivoter le manche dans le sens des aiguilles d’une montre dans l’ouverture
filetée du support jusqu’à sentir une résistance (Figure 5).
8. Tirer le manche vers le haut pour retirer la valve du récipient (Figure 6).
6.2 Procédure de rinçage
1. Placer l’intégralité de la valve et du support dans 1 des bacs de rinçage (Figure 6).
2. Utiliser le manche pour remuer sans discontinuer la valve pendant au minimum 30 secondes.
3. Presser doucement l’anneau de suture pour retirer tout résidu de glutaraldéhyde. Ne pas toucher les tissus de la valve.
4. Placer la valve dans le deuxième bac. Maintenir la valve dans le bac jusqu’à ce que le chirurgien la demande.
6.3 Implantation de la valve aortique
La bioprothèse Avalus est conçue pour être implantée en position supra-annulaire. Utiliser les calibreurs Avalus Modèle 7400S pour
visualiser la mise en place de la collerette de suture au-dessus de l’anneau et pour confirmer la mise en place et l’adéquation de la
valve dans l’espace supra-annulaire.
Le choix de la technique chirurgicale est laissé à la discrétion du chirurgien lors de l’implantation en position supra-annulaire. Toute
technique modifiée doit être conforme au Chapitre 4, Avertissements et précautions, page 57. De manière générale, procéder comme
suit :
59 Français
Page 60

1. Orienter la valve de telle sorte que les orifices coronaires ne soient pas obstrués par le stent et l’anneau de suture.
2. Irriguer régulièrement la valve avec une solution physiologique stérile normale pour éviter la dessiccation des tissus fragiles.
3. Positionner la valve dans l’anneau et placer les sutures dans l’anneau de suture.
4. Suturer la valve en place à l’aide d’une technique de suture appropriée. Consulter le Chapitre 4, Avertissements et précautions,
page 57 afin d’éviter tout problème potentiel.
5. Couper les sutures au niveau du point de coupe unique indiqué par la flèche blanche afin de dégager le support (Figure 7).
Écarter doucement le manche de la valve pour retirer le support.
6. Retirer le support du manche et jeter le support.
7. Faire tous les nœuds et couper les extrémités des sutures. Veiller à ce qu’aucun résidu de suture ne soit présent. Si des résidus
des sutures sont présents, les enlever avant de terminer l’implantation de la valve.
7 Personnalisation du traitement
Sauf en cas de contre-indication, dans les premiers temps suivant l’implantation, les patients recevant une bioprothèse cardiaque
doivent être maintenus sous anticoagulothérapie.
Un traitement anticoagulant ou antiplaquettaire à long terme doit être envisagé chez les patients présentant une oreillette gauche
dilatée, des antécédents d’événements thromboemboliques ou des troubles du rythme cardiaque (fibrillation ou flutter atrial).
8 Conseils à l’usage du patient
Un suivi médical continu (au moins annuel) est recommandé de sorte que les complications liées à la valve puissent être
diagnostiquées et prises en charge de manière adéquate.
Les patients porteurs d’une bioprothèse présentent un risque de bactériémie (par exemple, en cas d’interventions dentaires).
Informer le patient sur le traitement prophylactique par antibiotiques.
Encourager les patients à porter systématiquement sur eux la carte d’identification du dispositif implanté fournie par Medtronic.
9 Conditionnement
9.1 Conditionnement
La bioprothèse Avalus est stérilisée par un procédé chimique et est fournie stérile dans une solution au glutaraldéhyde tamponnée
à 0,2%. La stérilité est compromise si le conteneur (bocal en verre et couvercle) est ouvert ou endommagé. L’extérieur du conteneur
n’est pas stérile. Ne pas le placer dans le champ stérile.
9.2 Stockage
Stocker la bioprothèse Avalus à une température comprise entre 5°C et 25°C (41°F et 77°F). La réfrigération n’est pas requise et la
congélation risquerait d’endommager la valve. Le stockage à température ambiante jusqu’à 25°C (77°F) est satisfaisant. Ne pas
exposer la valve à la lumière du soleil ou à d’autres sources de lumière ultraviolette, ni la placer dans un endroit où de grands écarts
de température risqueraient de se produire.
Gérer correctement les stocks de manière à implanter en premier les bioprothèses dont la date de péremption est la plus proche pour
éviter de dépasser les dates d’expiration.
9.3 Renvoi de bioprothèses explantées
Contacter un représentant commercial de Medtronic pour demander un kit de renvoi de produit afin de renvoyer les bioprothèses
explantées pour analyse et élimination. Si aucun kit n’est disponible, placer la bioprothèse explantée dans un conteneur rempli de
glutaraldéhyde ou de formol tamponné à 10% juste après l’explantation. Pour des instructions de renvoi complémentaires, contacter
un représentant commercial de Medtronic.
10 Informations patient
10.1 Informations sur l’enregistrement
Remarque : L’enregistrement des patients ne s’applique pas dans les pays dans lesquels les lois relatives à la vie privée des patients
entrent en conflit avec la divulgation d’informations sur les patients, y compris les pays de l’Union européenne.
L’emballage de chaque dispositif contient une fiche d’enregistrement du patient. Après l’implantation, compléter toutes les
informations demandées. Renvoyer le formulaire original à l’adresse de Medtronic mentionnée sur le formulaire. Remettre au patient
la carte d’identification temporaire avant la sortie de l’hôpital.
Une carte d’identification du dispositif implanté est fournie au patient. Cette carte contient le nom et le numéro de téléphone du
médecin du patient ainsi que des informations utiles au personnel médical en cas d’urgence.
60Français
Page 61

11 Informations post-opératoires
11.1 Compatibilité avec l’imagerie par résonance magnétique (IRM)
La bioprothèse Avalus Modèle 400 ne présente pas de risques dans les environnements à résonance magnétique (RM). La valve ne
contient aucune partie métallique et ne présente donc aucun risque connu dans tous les environnements à RM.
Un examen IRM à 3,0 T et 1,5 T peut être réalisé juste après l’implantation. La valve n’occasionnera aucune blessure pour le patient
lors d’un examen IRM.
11.2 Artéfact d’image
La qualité des images RM pourrait être compromise en cas d’examen dans la même zone ou dans une zone relativement proche de
l’emplacement de la valve. Si nécessaire, optimiser les paramètres d’IRM en raison de la présence de la valve.
12 Accessoires
Utiliser uniquement des calibreurs Avalus Modèle 7400S et le manche pour valve Modèle 7420 de Medtronic pour déterminer la taille
appropriée de la bioprothèse Avalus.
Attention : Ne pas utiliser les calibreurs ou les manches tant qu’ils n’ont pas été soigneusement nettoyés et stérilisés. Consulter le
mode d’emploi approprié pour de plus amples instructions.
Attention : Ne pas utiliser de calibreurs de valves d’autres fabricants ou des calibreurs spécifiques à d’autres prothèses de Medtronic
pour dimensionner la bioprothèse Avalus.
13 Limitation de garantie
LE DÉNI DE GARANTIE SUIVANT S’APPLIQUE AUX CLIENTS SITUÉS HORS DES ÉTATS-UNIS :
BIEN QUE LA BIOPROTHÈSE AVALUS, MODÈLE 400, CI-APRÈS LE "PRODUIT", AIT ÉTÉ SOIGNEUSEMENT CONÇUE,
FABRIQUÉE ET TESTÉE AVANT SA MISE EN VENTE, LE PRODUIT PEUT, POUR DIVERSES RAISONS, CONNAÎTRE DES
DÉFAILLANCES. LES AVERTISSEMENTS FIGURANT SUR LES ÉTIQUETTES DU PRODUIT FOURNISSENT DES
INFORMATIONS PLUS DÉTAILLÉES ET SONT CONSIDÉRÉS COMME FAISANT PARTIE INTÉGRANTE DE LA PRÉSENTE
LIMITATION DE GARANTIE. EN CONSÉQUENCE, MEDTRONIC DÉCLINE TOUTE GARANTIE, EXPRESSE ET IMPLICITE,
RELATIVE AU PRODUIT. MEDTRONIC NE SERA PAS TENU RESPONSABLE DE TOUS DOMMAGES FORTUITS OU
INDIRECTS PROVOQUÉS PAR TOUS USAGES, DÉFECTUOSITÉS OU DÉFAILLANCES DU PRODUIT, QUE LA PLAINTE
SOIT FONDÉE SUR UNE GARANTIE, UNE RESPONSABILITÉ CONTRACTUELLE, DÉLICTUEUSE OU AUTRE.
Les exclusions et les limitations mentionnées ci-dessus ne sont pas, et ne doivent pas être, interprétées comme contraires aux
dispositions obligatoires des lois applicables. Si une partie ou une disposition de la présente LIMITATION DE GARANTIE devait être
considérée comme illégale, non applicable ou contraire à la loi en vigueur par un tribunal compétent, la validité des dispositions
restantes de la LIMITATION DE GARANTIE n’en sera pas affectée, et tous les droits et obligations seront interprétés et appliqués
comme si la présente LIMITATION DE GARANTIE ne contenait pas la partie ou la disposition considérée comme non valide.
61 Français
Page 62

1 Opis uređaja
3
2
1
4
5
Bioproteza Avalus, model 400, sastoji se od osnovnog okvira prekrivenog poliesterom i trolisne strukture potpornog okvira oblikovane
prema geometriji trolisnog zaliska. Osnovni okvir i trolisni potporni okvir oblikovani su ubrizgavanjem u kalup upotrebom materijala
polietereterketona (PEEK). Materijal PEEK osnovnog okvira impregniran je barijevim sulfatom kako bi se omogućila radiografska
vizualizacija. Listovi su laserom izrezani iz goveđeg tkiva i međusobno su povezani puferiranim glutaraldehidom. Listovi su umetnuti
između trolisnog potpornog okvira i osnovnog okvira, a zatim su sve komponente sigurno zašivene zajedno. U ulazni pokrov osnovnog
okvira ugrađen je prsten za šivanje, izrađen od poliesterske tkanine, kako bi korisnik mogao zašiti i umetnuti bioprotezu Avalus u
supraanularni položaj. Na prstenu za šivanje u srednjem području sinusa svakog vrha nalaze se oznake za šivanje kao vodilice za
jednoliko raspoređivanje šavova implantata (sl. 1). Na izlaz zaliska pričvršćen je držač za jednokratnu upotrebu radi lakše
implantacije. Aortna bioproteza (zalistak) obrađena je postupkom demineralizacije alfa-amino-oleinskom kiselinom (AOA), za koji je
u pokusima na životinjama dokazano da smanjuje kalcifikaciju svinjskog listića.
Jednokratni držač dizajniran je kako bi odgovarao višekratnoj ručki zaliska tvrtke Medtronic, model 7420. Ručka sadrži točku s jednim
urezom s pomoću koje je moguće odvojiti držač od zaliska. Za određivanje prikladne veličine zaliska upotrebljavaju se alati za
određivanje veličine s dva kraja. Kraj s valjkom predstavlja otvor zaliska. Kraj s replikom oponaša geometriju proteze.
Tabl. 1. Dostupne veličine i promjeri prstena za šivanje (nazivne vrijednosti u milimetrima)
Veličina 19 mm 21 mm 23 mm 25 mm 27 mm 29 mm
(1) Promjer stenta (TAD) 19 21 23 25 27 29
(2) Unutarnji promjer otvora 17,5 19,5 21,5 23,5 25,5 27,5
(2a) Unutarnji promjer otvora
(3) Vanjski promjer prstena za šivanje 27,0 29,0 31,0 33,0 36,0 38,0
(4) Visina profila zaliska 13,0 14,0 15,0 16,0 17,0 18,0
(5) Izbočina aorte 11,0 12,0 13,0 14,0 15,0 16,0
a
18 20 22 24 26 28
Napomena: TAD – promjer prstena tkiva
a
Mjerenja pokazuju okvir stenta uključujući tkivo (2) i okvir stenta bez tkiva (2a)
2 Indikacije za upotrebu
Bioproteza Avalus indicirana je za zamjenu oboljelog, oštećenog ili neispravnog nativnog ili protetskog aortnog zaliska.
3 Kontraindikacije
Nemojte upotrebljavati zalistak ako njegova upotreba nije u najboljem interesu bolesnika. Procijenite sve uključene rizike, uključujući
anatomiju i patologiju primijećenu tijekom kirurškog zahvata.
4 Upozorenja i mjere opreza
4.1 Upozorenja
• Ovaj uređaj namijenjen je samo jednokratnoj upotrebi. Nemojte ponovno upotrebljavati, obrađivati ni ponovno sterilizirati ovaj
proizvod. Ponovna upotreba, prerada ili ponovna sterilizacija mogu ugroziti strukturalnu cjelovitost uređaja ili izazvati rizik od
kontaminacije uređaja, što može prouzročiti ozljeđivanje bolesnika, bolest ili smrt.
• Nemojte ponovo sterilizirati zalistak ni na koji način. Ako izložite zalistak i spremnik zračenju, pari, etilenskom oksidu ili nekim
drugim kemijskim sredstvima za sterilizaciju, zalistak će postati potpuno neupotrebljiv.
• Pogledajte pokazatelj temperature transporta unutar ambalaže. Ako je prozor pokazatelja temperature transporta crn, zalistak
nije prikladan za kliničku upotrebu.
• Nemojte upotrebljavati zalistak ako primijetite nešto od sljedećeg:
– zalistak je pao na pod, oštećen je ili se njime na bilo koji način pogrešno rukovalo
– datum isteka valjanosti je istekao
– sve su trake oštećene
– oznaka serijskog broja razlikuje se od serijskog broja na etiketi na posudi
– otopina glutaraldehida za pohranu ne pokriva zalistak potpuno ili tekućina curi iz pakiranja
– na zalisku ima znakova propadanja
62Hrvatski
Page 63

• Nemojte hvatati dio zaliska s tkivom instrumentima. Posebnu pozornost morate obratiti na sprječavanje oštećenja osjetljivog tkiva
zaliska. Čak i mala perforacija može se s vremenom povećati i time izazvati osjetno pogoršanje funkcije zaliska.
• Nemojte pokušavati popraviti oštećeni zalistak. Oštećeni zalistak ne smije se upotrebljavati.
• Nemojte dodavati antibiotike niti bilo kakve druge tvari u otopinu za čuvanje ili ispiranje.
• Nemojte pokušavati implantirati zalistak koji je prevelik za prsten. Odaberite zalistak koji će sigurno prianjati u aortni korijen bez
deformiranja prirodne anatomije ili bioproteze Avalus.
• Za određivanje veličine zaliska nemojte upotrebljavati alate za određivanje veličine zalistaka drugih proizvođača, kao ni alate za
određivanje veličine drugih proteza tvrtke Medtronic.
• Pazite da se zalistak ne isuši. Kako bi se spriječilo isušivanje tkiva zaliska, tijekom implantacije povremeno isperite zalistak
sterilnom normalnom fiziološkom otopinom.
4.2 Mjere opreza
• Pažljivo razmotrite ove potencijalne opasnosti pri odabiru odgovarajuće zamjene zalistaka:
– degeneracija kalcifikacijom može uzrokovati ubrzano propadanje zaliska u bolesnika s izmijenjenim metabolizmom kalcija
(npr. kroničnom insuficijencijom bubrega, hiperparatireoidizmom).
– kalcifikacija se može javiti ranije u djece, adolescenata ili mlađih odraslih osoba.
– prerana kalcifikacija također se može javiti u starijih osoba koje primaju biološku protezu.
– bolesnici s bioprotezom koji zahtijevaju kroničnu antikoagulacijsku terapiju nalaze se u dodatnoj opasnosti od krvarenja.
• Nemojte stavljati nesterilnu vanjsku površinu spremnika zaliska u sterilno polje.
• Nemojte upotrebljavati alate za određivanje veličine Avalus, model 7400S, ni dršku zaliska tvrtke Medtronic, model 7420, dok nisu
temeljito očišćeni i sterilizirani. Dodatne upute potražite u odgovarajućim uputama za upotrebu.
• Pri odabiru veličine zaliska potrebno je razmotriti bolesnikovu anatomiju i odabrati zalistak koji na odgovarajući način
ispunjava hemodinamičke potrebe bolesnika.
• Nemojte implantirati zalistak bez obavljanja pravilnih postupaka ispiranja.
• Orijentirajte nosače stenta i umetnite zalistak tako da koronarno ušće ne bude zapriječeno.
• Izbjegavajte dodir zaliska ili otopine za ispiranje s ručnicima, tkaninom ili drugim izvorima koji bi mogli prenijeti čestice tvari na tkivo
listića.
• Prije šivanja odredite ulaznu i izlaznu stranu zaliska.
• Budite pažljivi pri provlačenju konca kroz prsten za šivanje kako biste izbjegli razdiranje tkiva listića. Ako se tkivo listića ošteti,
zalistak se mora eksplantirati i zamijeniti.
• Nemojte upotrebljavati rezne iglie, nezaštićene pincete ili oštre instrumente koji bi mogli uzrokovati strukturalno oštećenje zaliska.
• Prije uvođenja katetera, kirurških instrumenata i transvenskih elektrodnih katetera za poticanje rada srca kroz zalistak razmotrite
moguće opasnosti od oštećenja.
• Ako upotrebljavate prekinute šavove, važno je da odrežete šavove u blizini čvorova. Provjerite da izloženi repovi šavova ne dođu
u kontakt s tkivom listića.
• Nemojte savijati komisure bioproteze kada vežete čvorove.
• Nemojte rukovati tkivom listića.
• Izbjegavajte produženi kontakt s otopinom za čuvanje zaliska. Glutaraldehid može nadražiti oči, nos, kožu i grlo uslijed duljeg
izlaganja. Izbjegavajte produljenu izloženost kemijskim parama ili njihovo udisanje. Upotrebljavajte samo uz odgovarajuće
prozračivanje. Ako dođe u dodir s kožom, odmah ispirite zahvaćeno područje obilnom količinom vode tijekom 10 do 15 minuta.
U slučaju kontakta s očima, ispirite oči vodom najmanje 15 minuta i odmah zatražite liječničku pomoć.
5 Moguće nuspojave
Neke su od mogućih nuspojava koje se povezuju s primjenom bioprotetičkih srčanih zalistaka uključuju:
• anginu
• srčane disritmije
• endokarditis
• zatajenje srca
• hemoliza
• hemolitična anemija
• krvarenje povezano s antikoagulacijskim/antitrombocitnim sredstvom
• istjecanje, transvalvularno ili paravalvularno
• infarkt miokarda
63 Hrvatski
Page 64

• nestrukturna disfunkcija (zaglavljenje/sudar listića, opstruktivno urašćivanje panusa, pucanje šavova, neodgovarajuća veličina
implantata i drugo)
• regurgitaciju usatka
• moždani udar
• strukturno propadanje (kalcifikacija, razdiranje listića, stenoza i drugo)
• tromboemboliju
• trombozu zaliska
Te komplikacije mogu dovesti do:
• ponovne operacije
• eksplantacije bioproteze
• trajni invaliditet
• smrt
6 Upute za upotrebu
6.1 Upute za rukovanje i pripremu
Pravilan odabir veličine ključan je dio postupka zamjene srčanog zaliska. Upotrebljavajte alate za određivanje veličine Avalus,
model 7400S, za odabir prikladne veličine bioproteze Avalus. Dodatne upute potražite u uputama za upotrebu.
Spremnik i poklopac izvana nisu sterilni. Zalistak i svi materijali za pakiranje unutar spremnika su sterilni pa njima morate rukovati
unutar sterilnog radnoj područja.
1. Pripremite 2 posude za ispiranje s po 500 ml sterilne normalne fiziološke otopine.
2. Provjerite sigurnosne trake kako biste bili sigurni da spremnik nije oštećen ili otvaran. Nemojte upotrebljavati zalistak ako su sve
trake oštećene.
3. Okrenite poklopac u smjeru suprotnom od kretanja kazaljki na satu i otvorite spremnik (sl. 2).
4. Primite držač palcem i kažiprstom. Polako podignite zalistak iz spremnika i pustite da otopina glutaraldehida iscuri (sl. 3).
5. Provjerite odgovara li serijski broj na držaču broju na poklopcu spremnika, kutiji za čuvanje i registracijskom obrascu bolesnika.
Zabilježite serijski broj u karton bolesnika s pomoću naljepnice iz obrasca za registraciju bolesnika.
6. Držač mora biti u uspravnom položaju. Uhvatite poklopac držača palcem i kažiprstom, a zatim ga okrenite u smjeru suprotnom
od kazaljke na satu i skinite (sl. 4). Vidjet ćete držač.
7. Umetnite sterilnu dršku u držač. Zavrćite dršku u smjeru kazaljki na satu u otvor na držaču s navojem dok ne osjetite otpor (sl. 5).
8. Povucite dršku prema gore kako biste izvadili zalistak iz držača (sl. 6).
6.2 Postupak ispiranja
1. Stavite čitav zalistak i držač u jednu od posuda za ispiranje (sl. 6).
2. S pomoću drške neprekidno miješajte zalistak najmanje 30 sekundi.
3. Pažljivo stisnite prsten za šivanje kako biste uklonili ostatke glutaraldehida. Nemojte dodirivati dio zaliska s tkivom.
4. Stavite zalistak u drugu posudu. Držite zalistak u posudi dok ga kirurg ne zatraži.
6.3 Implantacija aortnog zaliska
Bioproteza Avalus dizajnirana je za implantaciju u supraanularnom položaju. Upotrebljavajte alate za određivanje veličine Avalus,
model 7400S, za vizualizaciju postavljanja nastavka za šivanje iznad prstena i za potvrdu postavljanja i prianjanja zaliska u
supraanularnom prostoru.
Odabir kirurške tehnike prepušten je odluci pojedinog kirurga prilikom implantacije u supraanularni položaj. Sve modificirane tehnike
trebaju biti u skladu s poglavlje 4, Upozorenja i mjere opreza, stranica 62. Općenito, slijedite ove korake:
1. Okrenite zalistak tako da stent i prsten za šivanje ne zatvaraju koronarno ušće.
2. Povremeno isperite zalistak sterilnom normalnom fiziološkom otopinom kako biste spriječili isušivanje osjetljivog tkiva.
3. Postavite zalistak u prsten i konac u prsten za šivanje.
4. Zašijte zalistak na mjesto s pomoću odgovarajuće tehnike šivanja. Pogledajte poglavlje 4, Upozorenja i mjere opreza, stranica 62
kako biste izbjegli moguće probleme.
5. Odrežite konce na točki za jedan rez prikazanoj bijelom strelicom kako biste oslobodili držač (sl. 7). Lagano povucite dršku dalje
od zaliska kako biste uklonili držač.
6. Odvojite držač od drške te bacite držač.
7. Zavežite sve čvorove i podrežite konce iz šavova. Provjerite da nema ostataka konca. Ako ima ostataka konca, uklonite ih prije
dovršetka implantacije zaliska.
64Hrvatski
Page 65

7 Individualizacija liječenja
Osim ako nije kontraindicirano, bolesnike kojima se ugrađuje bioprotetski srčani zalistak treba tijekom početnih faza nakon
implantacije držati na terapiji antikoagulansima.
Razmotrite dugotrajnu primjenu antikoagulacijske ili antitrombocitne terapije u bolesnika s proširenom lijevom pretklijetkom,
prethodnim tromboembolijskim incidentima te fibrilacijom ili undulacijom atrija.
8 Informacije o savjetovanju bolesnika
Preporučuju se kontinuirani kontrolni medicinski pregledi (najmanje jednom godišnje) kako bi se komplikacije vezane uz zalistak
mogle dijagnosticirati i pravilno ukloniti.
U bolesnika s bioprotetskim zaliskom postoji rizik od bakteriemije (npr. ako se podvrgavaju stomatološkim zahvatima). Savjetujte
bolesnika o profilaktičkoj terapiji antibioticima.
Preporučite bolesnicima da uvijek sa sobom nose identifikacijsku karticu implantiranog uređaja tvrtke Medtronic.
9 Isporuka
9.1 Ambalaža
Bioproteza Avalus kemijski je sterilizirana i isporučuje se sterilna u puferiranoj 0,2-postotnoj otopini glutaraldehida. Sterilnost postaje
upitna ako se spremnik sa staklenkom i poklopcem otvori ili ošteti. Vanjski dio spremnika nije sterilan. Nemojte ga stavljati u sterilno
polje.
9.2 Skladištenje
Čuvajte bioprotezu Avalus pri temperaturi od 5°C do 25°C (od 41°F do 77°F). Nije potrebno hlađenje, a zamrzavanje može izazvati
oštećenje zaliska. Skladištenje na sobnoj temperaturi do 25°C (77°F) je zadovoljavajuće. Nemojte izlagati zalistak sunčevom svjetlu
ni drugim izvorima ultraljubičastog svjetla niti mjestima gdje može doći do znatnih promjena temperature.
Provodite odgovarajuću kontrolu zaliha kako bi se najprije implantirale bioproteze s ranijim datumom isteka roka valjanosti kako bi se
izbjeglo njegovo istjecanje.
9.3 Povrat izvađenih bioproteza
Kontaktirajte prodajnog zastupnika tvrtke Medtronic kako biste zatražili komplet za povrat proizvoda za povrat izvađene bioproteze
radi analize i zbrinjavanja. Ako ne možete nabaviti komplet za povrat, odmah nakon vađenja bioprotezu stavite u spremnik napunjen
glutaraldehidom ili u 10-postotni puferirani formalin. Daljnje upute za povrat zatražite od prodajnog predstavnika tvrtke Medtronic.
10 Podaci o bolesniku
10.1 Informacije o registraciji
Napomena: registracija bolesnika ne odnosi se na zemlje u kojima zakoni o zaštiti privatnosti bolesnika onemogućuju navođenje
informacija o bolesniku, uključujući zemlje članice Europske unije.
U svakom pakiranju uređaja nalazi se obrazac za registraciju bolesnika. Nakon implantacije ispunite sve potrebne informacije. Vratite
originalni obrazac na adresu tvrtke Medtronic navedenu na obrascu. Prije otpuštanja bolesniku dajte privremenu identifikacijsku
karticu.
Bolesnik dobiva identifikacijsku karticu implantiranog uređaja. Na toj kartici nalaze se ime i telefonski broj liječnika te informacije koje
su medicinskom osoblju potrebne u hitnim slučajevima.
11 Postoperativne informacije
11.1 Kompatibilnost s postupcima snimanja uređajima za magnetsku rezonanciju (MR)
Bioproteza Avalus, model 400, sigurna je za snimanje magnetskom rezonancijom (MR). Zalistak ne sadrži metale te stoga ne
predstavlja opasnost ni u kojem okruženju magnetske rezonancije.
Skeniranje MR-om pri 3,0 T i 1,5 T može se obaviti odmah nakon implantacije. Zalistak neće naškoditi bolesniku podvrgnutom
snimanju magnetskom rezonancijom.
11.2 Artefakt slike
Kvaliteta slike magnetske rezonancije može biti smanjena ako se skenira na položaju zaliska ili blizu njega. Ako je potrebno,
optimizirajte parametre snimanja magnetskom rezonancijom zbog postojanja zaliska.
65 Hrvatski
Page 66

12 Dodatna oprema
Za određivanje odgovarajuće veličine bioproteze Avalus upotrebljavajte samo alate za određivanje veličine Avalus, model 7400S, i
dršku zaliska tvrtke Medtronic, model 7420.
Oprez: Nemojte upotrebljavati alate za određivanje veličine ili drške dok ih temeljito ne očistite i sterilizirate. Dodatne upute potražite
u odgovarajućim uputama za upotrebu.
Oprez: za određivanje veličine bioproteze Avalus nemojte upotrebljavati alate za određivanje veličine zaliska drugih proizvođača niti
alate za određivanje veličine namijenjene drugim protezama tvrtke Medtronic.
13 Isključenje jamstva
SLJEDEĆE ISKLJUČENJE JAMSTVA PRIMJENJUJE SE NA KORISNIKE IZVAN SAD-A:
IAKO JE BIOPROTEZA AVALUS, MODEL 400, U DALJNJEM TEKSTU OZNAČENA KAO "PROIZVOD", PAŽLJIVO
OSMIŠLJENA, PROIZVEDENA I TESTIRANA PRIJE PRODAJE, POSTOJI NIZ RAZLOGA ZBOG KOJIH BI SE MOGLO
DOGODITI DA PROIZVOD NE IZVRŠAVA SVOJU FUNKCIJU NA ZADOVOLJAVAJUĆI NAČIN. UPOZORENJA NA OZNACI
PROIZVODA SADRŽE DETALJNIJE INFORMACIJE I SMATRAJU SE SASTAVNIM DIJELOM OVOG ISKLJUČENJA JAMSTVA.
MEDTRONIC STOGA ISKLJUČUJE SVA IZRIČITA I PODRAZUMIJEVANA JAMSTVA ZA PROIZVOD. MEDTRONIC NIJE
ODGOVORAN NI ZA KAKVE SLUČAJNE NI POSLJEDIČNE ŠTETE NASTALE ZBOG KORIŠTENJA, POGREŠKE,
NEISPRAVNOSTI ILI KVARA PROIZVODA, BILO DA SE ZAHTJEV TEMELJI NA JAMSTVU, UGOVORU, KAZNENOM DJELU
ILI NEKOJ DRUGOJ OSNOVI.
Prethodno opisana isključenja i ograničenja nisu zamišljena kao opreka obveznim odredbama mjerodavnog prava te ih se tako ne
smije tumačiti. Ako bilo koji dio ovog ISKLJUČENJA JAMSTVA nadležni sud proglasi nezakonitim, neprovedivim ili u sukobu s
mjerodavnim zakonom, to ne utječe na valjanost preostalog dijela ISKLJUČENJA JAMSTVA te se sva prava i obveze moraju tumačiti
i provoditi kao da ovo ISKLJUČENJE JAMSTVA ne sadrži opisani dio ili uvjet koji se smatra nezakonitim.
66Hrvatski
Page 67

1 Az eszköz ismertetése
3
2
1
4
5
A 400-as típusú Avalus biológiai műbillentyű egy poliészterrel bevont alapkeretből és egy háromvitorlás billentyűből, és annak a
geometriájához alakított tartókeret-szerkezetből áll. Az alapkeret és a háromvitorlás tartókeret-szerkezetet poliéter-éterketon (PEEK)
anyagból állítják elő fröccsentéssel. Az alapkeret PEEK anyagát bárium-szulfáttal impregnálják a radiográfiás felvételekhez. A
vitorlákat lézerrel metszik ki szarvasmarha szövetből, melyeket pufferelt glutáraldehidben keresztkötöttek. A vitorlák beillesztése a
háromvitorlás tartókeret és az alapkeret közé történik, majd minden alkotórészt stabilan össze kell ölteni. A poliészter szövetből
készült varrókeret a beáramlás oldali alapkeret-borításba integrálódik, hogy lehetővé tegye a felhasználó számára az öltés
elvégzését, továbbá az Avalus biológiai billentyű szupraanuláris pozícióban tartását. A varrókereten, az egyes lemezek
szinuszterületének közepén öltésjelzők helyezkednek el a beültetéshez végzett öltések egyenletes térközű elhelyezésének segítése
érdekében (1. ábra). A beültetést segíti még a billentyű kiáramlási oldalához csatlakozó, egyszer használatos tartó. Az aortai biológiai
műbillentyűt (billentyűt) alfa-amino-oleinsavval (AOA) végzett antimineralizációs beavatkozás során kezelik, amelyről
állatkísérletekben kimutatták, hogy csökkenti a sertés-billentyűvitorla meszesedését.
Az eldobható tartót a többször használható, 7420-as típusú Medtronic billentyűnyélhez tervezték. A tartón egyetlen metszési pont
található, ahol a tartó leválasztható a billentyűről. A duplavégű méretezőkkel válaszható ki a megfelelő billentyűméret. A hengeres vég
jelenti a tulajdonképpeni billentyűszájadékot. A replika vége a műbillentyű geometriáját követi.
1. táblázat. Kapható méretek és varrókeret-átmérők (névleges értékek milliméterben) Méret 19 mm 21 mm 23 mm 25 mm 27 mm 29 mm
(1) Sztent átmérője (TAD) 19 21 23 25 27 29
(2) Szájadék belső átmérője 17,5 19,5 21,5 23,5 25,5 27,5
(2a) Szájadék belső átmérője
(3) A varrókeret külső átmérője 27,0 29,0 31,0 33,0 36,0 38,0
(4) Billentyűprofil magassága 13,0 14,0 15,0 16,0 17,0 18,0
(5) Aortai kiemelkedés 11,0 12,0 13,0 14,0 15,0 16,0
a
18 20 22 24 26 28
Megjegyzés: TAD – szövetanulus átmérője
a
A mérés a sztentkeret méretét mutatja a szövettel együtt (2), illetve a szövet nélkül (2a)
2 Alkalmazási terület
Az Avalus biológiai műbillentyű a beteg, sérült vagy hibás működésű, saját vagy mesterséges aortabillentyű cseréjére szolgál.
3 Ellenjavallatok
A billentyűt csak akkor alkalmazza, ha az feltétlenül a beteg érdekét szolgálja. Értékelje az összes vonatkozó kockázatot, ideértve a
sebészeti beavatkozás időpontjában fennálló anatómiai és patológiai jellemzőket.
4 Figyelmeztetések és előírások
4.1 Figyelmeztetések
• Az eszközt egyszeri használatra tervezték. Az eszközt tilos ismételten felhasználni, felújítani vagy újrasterilizálni. Az ismételt
felhasználás, az újrafeldolgozás vagy az újrasterilizálás károsíthatja az eszköz szerkezeti épségét, illetve a fertőződés kockázatát
hordozhatja magában, ami a beteg sérülését, megbetegedését vagy halálát okozhatja.
• A billentyűt tilos bármilyen módon újrasterilizálni. Ha a billentyűt vagy a tartályt sugárzás, gőz, etilén-oxid vagy egyéb kémiai
sterilizáló anyag hatása éri, a billentyű teljes mértékben használhatatlanná válik.
• Ellenőrizze a kartondobozban lévő szállítási hőmérsékletjelzőt. Ha a szállítási hőmérsékletjelző ablaka fekete, akkor a billentyű
klinikai felhasználásra alkalmatlan.
• Ne használja a billentyűt, ha az alábbi körülmények közül bármelyik bekövetkezett:
– A billentyű leesett, megsérült vagy azt nem megfelelően kezelték.
– A lejárati dátum elmúlt.
– Az összes zárszalag sérült.
– Az azonosító cédulán és a tartály címkéjén lévő sorozatszám nem egyezik meg.
67 Magyar
Page 68

– A glutáraldehides tárolóoldat nem borítja teljesen a billentyűt, vagy a folyadék szivárog a csomagolásból.
– A billentyű elváltozás jeleit mutatja.
• Tilos a billentyű biológiai szöveteit bármilyen eszközzel érinteni. Fokozott figyelmet kell fordítani arra, hogy ne károsodjon a
billentyű finom biológiai szövete. Idővel a legkisebb perforáció is nagyobbá válhat és a billentyű működésének jelentős változását
okozhatja.
• Ne kísérelje meg a sérült billentyű javítását. A sérült billentyűt tilos felhasználni.
• Ne adjon antibiotikumot vagy bármely más anyagot se a tárolóoldathoz, se az öblítőoldathoz.
• Ne próbáljon az anulushoz mérten túl nagy billentyűt beültetni. Az aortagyökbe stabilan illeszkedő, a beteg saját anatómiáját vagy
az Avalus műbillentyűt nem deformáló billentyűt válasszon.
• Ne használjon a műbillentyű méretezéséhez más cég által gyártott billentyűméretezőket, se más Medtronic műbillentyűhöz valót.
• A billentyűt állandóan nedvesen kell tartani. A billentyűszövet kiszáradásának megelőzésére steril fiziológiás sóoldattal
rendszeresen öblögesse a billentyűt a beültetés alatt.
4.2 Előírások
• A megfelelő műbillentyű kiválasztásakor alaposan fontolóra kell venni a lehetséges veszélyeket:
– A meszesedés a billentyű felgyorsult állapotromlását eredményezheti megváltozott kalciummetabolizmusban (például
krónikus veseelégtelenségben, mellékpajzsmirigy-túltengésben) szenvedő betegek esetén.
– Gyermekeknél, serdülőkorban és fiatal felnőtteknél a meszesedés korábban jelentkezhet.
– Az idő előtti meszesedés olyan, idősebb felnőtteknél is előfordulhat, akiknél biológiai műbillentyűt ültettek be.
– A folyamatosan véralvadásgátlást igénylő, biológiai műbillentyűvel rendelkező betegeknél a vérzés további kockázatot jelent.
• A nem steril külsejű billentyűtartályt ne vigye steril területre.
• Csak azt követően használja a 7400S típusú Avalus méretezőket vagy a 7420-as típusú Medtronic billentyűnyelet, hogy azokat
alaposan megtisztította és sterilizálta. További információkat a megfelelő használati utasításban talál.
• A billentyűméret kiválasztásakor számításba kell venni a beteg anatómiáját, és olyan billentyűt kell választani, mely
a beteg hemodinamikai szükségleteinek megfelel.
• Ne ültesse be a billentyűt a megfelelő öblítési eljárások elvégzése előtt.
• A sztentlábakat irányítása és a billentyű behelyezése úgy történjen, hogy az a coronariaszájadéknál elzáródást ne okozzon.
• Kerülje a törölközőknek, törlőkendőknek vagy más olyan anyagoknak a billentyűvel vagy az öblítőoldattal való érintkezését,
melyekről szemcsés anyag kerülhet a vitorla szövetére.
• Az öltések elhelyezése előtt azonosítsa a billentyű ki- és beáramlási irányát.
• A varrókereten át behelyezett öltéseknél körültekintően járjon el, hogy a vitorlaszövet ne sérüljön meg. Ha a vitorlaszövet
megsérül, el kell távolítani és ki kell cserélni.
• Ne alkalmazzon vágótűket, védőborítás nélküli fogókat vagy más éles eszközöket, melyek megsérthetik a billentyű szerkezetét.
• Vegye számításba, hogy katéterek, sebészi műszerek és intravénás pacemaker-vezetékek átvezetésekor a műbillentyű
károsodhat.
• Csomós öltések használatakor fontos, hogy az öltéseket a csomóhoz közel vágja el. Gondoskodjon róla, hogy a kitett hosszú
varratvégek ne érintkezhessenek a vitorlaszövettel.
• A csomók elkötésekor ne hajlítsa meg a műbillentyű commissuralis lábait.
• Ne fogja meg a vitorlaszövetet.
• Kerülje a billentyűtároló oldattal való tartós érintkezést. Tartós expozíció esetén a glutáraldehid a szem, az orr, a bőr és a torok
irritációját okozhatja. Kerülje a vegyszergőznek való hosszan tartó kitettséget és annak belégzését. Gondoskodjon a megfelelő
szellőzésről. Ha az anyag bőrre kerül, azonnal mossa le az érintett területet bő vízzel 10-15 percig. Ha az anyag szembe kerül,
legalább 15 percig mossa a szemet vízzel, és azonnal forduljon orvoshoz.
5 Lehetséges nemkívánatos események
A műbillentyűk használatához társuló lehetséges szövődmények a következők:
• angina
• szívritmuszavarok
• Endokarditisz
• szívelégtelenség
• vörösvérsejt-oldódás
• hemolitikus anémia
• antikoaguláns vagy thrombocytagátló kezelés okozta vérzés
• transvalvuláris vagy paravalvuláris regurgitáció
68Magyar
Page 69

• szívinfarktus
• nem szerkezeti eredetű működési zavar (vitorla beszorulása/becsípődése, obstruktív pannus benövés, öltéselégtelenség, nem
megfelelő méretválasztás, egyéb)
• Visszáramlás a beültetett eszköznél
• stroke
• strukturális állagromlás (kalcifikáció, vitorlaszakadás, szűkület, egyéb)
• thromboembolia
• billentyűtrombózis
Ezek a komplikációk az alábbiakhoz vezethetnek:
• Megismételt műtét
• műbillentyű explantációja
• Tartós egészségkárosodás
• Halál
6 Használati utasítás
6.1 Kezelési és előkészítési utasítások
A megfelelő méret kiválasztása a szívbillentyűcsere sarkalatos pontja. A megfelelő méretű Avalus biológiai műbillentyű
kiválasztásához a 7400S típusú Avalus méretezőket használja. További felvilágosítást a használati útmutatókban talál.
A tartály külseje és fedele nem steril. A tartályon belül a billentyű és az összes csomagolóelem steril, ezért a steril műveleti operációs
területen belül kezelendő.
1. Készítsen elő 2 áztatótálat, mindkettőben 500 ml steril fiziológiás sóoldattal.
2. A zárszalagok megvizsgálásával ellenőrizze, hogy a tartály nem sérült-e meg, vagy korábban nem nyitották-e fel. Ne használja
fel a billentyűt, ha az összes zárszalag sérült.
3. Forgassa el a fedelet az óramutató járásával ellentétes irányba, és nyissa fel a tartályt (2. ábra).
4. Hüvelyk- és mutatóujjával fogja meg a tégelyt. Lassan emelje ki a billentyűt a tartályból, közben pedig hagyja lecsöpögni a
glutáraldehid tárolóoldatot (3. ábra).
5. Ellenőrizze, hogy a tartón a sorozatszám egyezik-e a tartály fedelén, a tároló kartondobozon és a beteg regisztrációs lapján
(Patient Registration Form) szereplő sorozatszámmal. A betegregisztrációs laphoz mellékelt öntapadós címkével rögzítse a
sorozatszámot a beteg kórlapján.
6. Tartsa egyenesen a tégelyt. Hüvelyk- és mutatóujjával forgassa el a tégely fedelét az óramutató járásával ellentétes irányba, és
emelje le a fedelet a tégelyről (4. ábra). A tartó láthatóvá válik.
7. Illessze be a steril nyelet a tartóba. Forgassa a nyelet a tartó csavarmenetes nyílásába az óramutató járásával megegyező
irányba, amíg ellenállásba nem ütközik (5. ábra).
8. Húzza felfelé a nyelet, és vegye ki a tégelyből a billentyűt (6. ábra).
6.2 Öblítési művelet
1. Helyezze a billentyűt és nyelet egyben az egyik áztatótálba (6. ábra).
2. A nyél segítségével legalább 30 másodpercig folyamatosan rázza a billentyűt.
3. A maradék glutáraldehid eltávolításához finoman nyomja meg a varrókeretet. Tilos a billentyű biológiai szöveteihez érni.
4. Helyezze a billentyűt a második tálba. Tartsa a billentyűt tálban, míg a sebésznek szüksége lesz rá.
6.3 Aortabillentyű beültetése
Az Avalus műbillentyű kialakítása a szupraanuláris pozícióban történő beültetést tesz lehetővé. A 7400S típusú Avalus méretezők
segítségével határozza meg a varrómandzsetta elhelyezését az anulus felett, majd rögzítse az elhelyezést, és illessze be a billentyűt
a szupraanuláris térbe.
A szupraanuláris helyzetben történő beültetéskor a megfelelő sebészeti eljárás megválasztása az adott sebész döntése. Az eljárás
bármilyen módosítása az itt leírtak szerint történjen: 4. fejezet, Figyelmeztetések és előírások, 67. oldal. Általánosságban véve az
alábbi lépéseket kövesse:
1. Az aortabillentyűt úgy kell irányítani, hogy a láb vagy a varrókeret ne zárja el a coronariaszájadékokat.
2. A finom szövet kiszáradásának elkerülése végett steril fiziológiás sóoldattal rendszeresen öblögesse a billentyűt.
3. A billentyűt az anulusban pozícionálja, majd az öltéseket a varrókereten helyezze el.
4. A billentyűt a helyén a megfelelő öltési technika alkalmazásával öltse le. Az esetleges problémák elkerülése érdekében vegye
figyelembe a 4. fejezet, Figyelmeztetések és előírások, 67. oldal részben leírtakat.
69 Magyar
Page 70

5. A nyél kivételéhez a fehér nyíllal jelzett metszési ponton vágja el az öltéseket (7. ábra). Óvatosan húzza ki a nyelet a billentyűből
a nyél eltávolítása érdekében.
6. Válassza le le a tartót a nyélről, és a tartót dobja el.
7. Kössön el minden csomót, és a varratvégeket vágja le. Ellenőrizze, hogy nincsenek öltésmaradványok. Ha öltésmaradványokat
lát, távolítsa el azokat a billentyű beültetése befejezése előtt.
7 A kezelés egyénre szabása
Amennyiben az nem ellenjavallt, a beültetést követő első időkben a műbillentyűt kapó betegek kezeljék antikoaguláns terápiával.
Ha a beteg kórelőzményében balpitvari tágulat, tromboembóliás esemény, illetve pitvarfibrilláció vagy pitvari lebegés szerepel, vegye
fontolóra a tartós antikoagulálást vagy a trombocitagátló kezelést.
8 Betegtájékoztatás
Folyamatos (legalább évenkénti) orvosi felülvizsgálat javasolt, hogy a billentyűhöz kapcsolódó szövődményeket diagnosztizálni és
megfelelően kezelni lehessen.
A biológiai műbillentyűs betegek ki vannak téve bakterémia kockázatának (például fogászati eljárások igénybevétele révén). A
betegeket tájékoztatni kell a profilaktikus antibiotikus terápiáról.
A beteget meg kell kérni arra, hogy a beültetett eszközhöz a Medtronic által biztosított azonosító kártyát (Implanted Device
Identification Card) mindig tartsa magánál.
9 Kiszerelés
9.1 Csomagolás
Az Avalus biológiai műbillentyű kémiai sterilizálást követően, sterilen, 0,2%-os pufferelt glutáraldehid tárolóoldatban kerül
forgalomba. Ha a fedeles üvegtartály fel van nyitva vagy sérült, akkor a sterilitás kétséges. A tartály külseje nem steril. Ne tegye azt
a steril mezőbe.
9.2 Tárolás
Az Avalus biológiai műbillentyűt 5°C és 25°C (41°F és 77°F) közötti hőmérsékleten tárolja. Hűtőben tárolni nem szükséges, a
fagyasztás pedig károsíthatja a billentyűt. Kielégítő megoldás a legfeljebb 25°C-os (77°F) szobahőmérsékleten történő tárolás. Ne
tegye ki a billentyűt közvetlen napfénynek vagy más ultraibolya fényforrásnak, illetve a billentyűt ne tárolja olyan helyen, ahol
számottevő hőmérséklet-ingadozások jelentkezhetnek.
Végezzen megfelelő készletgazdálkodást, hogy a legkorábbi lejárati idővel rendelkező biológiai műbillentyűket használja fel először,
így elkerülhető a szavatosság elvesztése.
9.3 Az eltávolított biológiai műbillentyűk visszaszolgáltatása
Az explantált biológiai műbillentyű elemzés és ártalmatlanítás céljából történő visszaküldésére szolgáló csomagért forduljon egy
Medtronic értékesítési képviselőhöz. Ha nem áll rendelkezésére ilyen csomag, helyezze az explantált biológiai műbillentyűt
glutáraldehiddel vagy 10%-os pufferelt formalinnal feltöltött tartályba közvetlenül a műbillentyű explantációját követően. További
visszaküldési utasításokért forduljon a Medtronic értékesítési képviselőjéhez.
10 Beteg adatai
10.1 Regisztrációs adatok
Megjegyzés: A beteg regisztrálását nem kell elvégezni olyan országokban, ahol az adatvédelmi törvények nem engedik a beteg
adatainak felvételét, például az Európai Unió tagországaiban.
Mindegyik eszköz csomagolása tartalmazza a Patient Registration Form nevű betegregisztrációs űrlapot. Kérjük, hogy a beültetést
követően adja meg az összes kért adatot. Az eredeti formanyomtatványt küldje vissza a Medtronic formanyomtatványon feltüntetett
címére. A betegnek elbocsátás előtt adja át az ideiglenes azonosító kártyát.
A beültetett eszköz végleges azonosító kártyáját a beteg kapja meg. Ez a kártya a beteg orvosának nevét és telefonszámát
tartalmazza azokkal az adatokkal együtt, melyekre az egészségügyi személyzetnek vészhelyzetben szüksége lehet.
11 Posztoperatív tudnivalók
11.1 Kompatibilitás a mágnesesrezonancia-vizsgálattal (MRI)
A 400-as típusú Avalus biológiai műbillentyű biztonságos mágneses rezonanciás (MR) környezetben. A műbillentyű nem tartalmaz
fémet, így nem jelent ismert veszélyt semmilyen MR-környezetben.
70Magyar
Page 71

Közvetlenül a beültetés után végezhető 3,0 T és 1,5 T erősségű MR-vizsgálat. A billentyű semmilyen ártalmas hatással nincs az
MR-vizsgálatnak kitett betegre.
11.2 Képen megjelenő műtermékek
Az MR-kép minősége rosszabb lehet, ha a vizsgálat a billentyű helyén vagy annak közelében történik. Billentyű jelenlétében ezért
szükség lehet az MR képalkotási paraméterek optimalizálására.
12 Kiegészítők
A megfelelő méretű Avalus biológiai műbillentyű kiválasztásához kizárólag 7400S típusú Avalus méretezőket és 7420 típusú
Medtronic billentyűnyelet használjon.
Figyelem! Ne használja egyik méretezőt és nyelet sem, amíg alapos tisztításuk és sterilizálásuk meg nem történt! További
információkat a megfelelő használati utasításban talál.
Figyelem! Ne használjon az Avalus biológiai műbillentyű méretezéséhez más cég által gyártott billentyűméretezőt, sem más
Medtronic műbillentyűhöz mellékelt eszközt.
13 Szavatossági nyilatkozat
AZ ALÁBBI FELELŐSSÉGKIZÁRÁS AZ EGYESÜLT ÁLLOMOKON KÍVÜLI VÁSÁRLÓKRA VONATKOZIK:
BÁR A 400-AS TÍPUSÚ AVALUS BIOLÓGIAI MŰBILLENTYŰ (A TOVÁBBIAKBAN „TERMÉK”) TERVEZÉSE, GYÁRTÁSA ÉS
ÉRTÉKESÍTÉS ELŐTTI ELLENŐRZÉSE KÖRÜLTEKINTŐ MÓDON TÖRTÉNT, ELŐFORDULHAT, HOGY A TERMÉK
KÜLÖNBÖZŐ OKOKBÓL ESETLEG NEM LÁTJA EL KIELÉGÍTŐEN A FELADATÁT. A TERMÉK CÍMKÉIN FELTÜNTETETT
FIGYELMEZTETÉSEK TOVÁBBI INFORMÁCIÓKKAL SZOLGÁLNAK, ÉS JELEN SZAVATOSSÁGI NYILATKOZAT SZERVES
RÉSZÉNEK TEKINTENDŐEK. A MEDTRONIC ENNEK MEGFELELŐEN A TERMÉKKEL KAPCSOLATBAN SEM KIFEJEZETT,
SEM VÉLELMEZETT SZAVATOSSÁGOT NEM VÁLLAL. MEDTRONIC NEM FELEL A TERMÉK HASZNÁLATÁBÓL,
HIBÁJÁBÓL VAGY MŰKÖDÉSKÉPTELENSÉGÉBŐL EREDŐ SEMMILYEN VÉLETLEN VAGY KÖVETKEZMÉNYES KÁRÉRT,
LEGYEN A KÁRIGÉNY ALAPJA AKÁR SZAVATOSSÁG, AKÁR SZERZŐDÉS, AKÁR SZERZŐDÉSEN KÍVÜLI KÁROKOZÁS,
AKÁR VALAMI MÁS.
A fenti kizárásoknak és korlátozásoknak nem célja a vonatkozó jogszabályok kötelező előírásait megkerülni, és olyan értelmezésnek
nincs helye. Ha a jelen SZAVATOSSÁGI NYILATKOZAT bármely részét vagy pontját illetékes bíróság jogellenesnek,
érvényesíthetetlennek vagy a vonatkozó jogszabályokkal ellentétesnek mondja ki, a SZAVATOSSÁGI NYILATKOZAT fennmaradó
részét az nem érinti; minden jog és kötelezettség úgy értelmezendő és érvényesítendő, mintha a jelen SZAVATOSSÁGI
NYILATKOZAT nem tartalmazná az érvénytelennek minősített részt vagy feltételt.
71 Magyar
Page 72

1 Descrizione del dispositivo
3
2
1
4
5
La bioprotesi Avalus modello 400 è costituita da una base rivestita in poliestere e da una struttura di supporto a tre lembi, modellata
in base alla conformazione geometrica di una valvola a tre lembi. La base e la struttura di supporto a tre lembi sono realizzate in PEEK
(polietereterchetone) stampato a iniezione. Il PEEK della base è impregnato con solfato di bario per consentirne la visualizzazione
radiografica. I lembi sono tagliati a laser da tessuto bovino sottoposto a reticolazione in glutaraldeide tamponata. I lembi sono inseriti
fra la base e il supporto della bioprotesi, e tutti i componenti sono saldamente suturati insieme. Un anello di sutura, realizzato in tessuto
di poliestere, è integrato nella base, dal lato di afflusso, per consentire la sutura e il posizionamento della bioprotesi Avalus in sede
sovranulare. Sull’anello di sutura, in corrispondenza della zona mediana di ciascuna cuspide, si trovano dei marker che fungono da
indicatori per la distribuzione uniforme delle suture durante l’impianto (Figura 1). Dal lato di efflusso della valvola si trova un supporto
monouso per facilitare l’impianto. La bioprotesi valvolare aortica è stata trattata con un processo antimineralizzante a base di acido
alfa-ammino-oleico (AOA) che si è rivelato efficace nel ridurre la calcificazione dei lembi porcini in studi condotti su animali.
Il supporto monouso è progettato per essere applicato al manico riutilizzabile per valvole Medtronic modello 7420. Il supporto
presenta un singolo punto di taglio che ne consente la rimozione dalla valvola. Per la scelta delle dimensioni adeguate della valvola
vengono utilizzati dei misuratori con doppia estremità. L’estremità a cilindro corrisponde all’orifizio della valvola. L’estremità a valvola
riproduce la conformazione geometrica della protesi.
Tabella 1. Dimensioni e diametri disponibili dell’anello di sutura (valori nominali in millimetri)
Dimensioni 19 mm 21 mm 23 mm 25 mm 27 mm 29 mm
(1) Diametro dello stent (TAD) 19 21 23 25 27 29
(2) Diametro interno dell’orifizio 17,5 19,5 21,5 23,5 25,5 27,5
(2a) Diametro interno dell’orifizio
(3) Diametro esterno dell’anello di sutura 27,0 29,0 31,0 33,0 36,0 38,0
(4) Altezza del profilo della valvola 13,0 14,0 15,0 16,0 17,0 18,0
(5) Protrusione aortica 11,0 12,0 13,0 14,0 15,0 16,0
a
18 20 22 24 26 28
Nota: TAD (Tissue Annulus Diameter): diametro dell’annulus tissutale
a
I valori rappresentano lo stent con il tessuto (2) e lo stent senza il tessuto (2a)
2 Istruzioni per l’uso
La bioprotesi Avalus è indicata per la sostituzione di valvole aortiche naturali o protesiche patologiche, danneggiate o malfunzionanti.
3 Controindicazioni
Non utilizzare la valvola se il suo uso non è nel migliore degli interessi del paziente. Valutare tutti i tipi di rischi presenti, come l’anatomia
e lo stato patologico osservati al momento dell’intervento.
4 Avvertenze e precauzioni
4.1 Avvertenze
• Il dispositivo è esclusivamente monouso. Non riutilizzare, ricondizionare o risterilizzare questo dispositivo. Il riutilizzo, il
ricondizionamento o la risterilizzazione possono compromettere l’integrità strutturale del dispositivo o comportare un rischio di
contaminazione con conseguenti lesioni, insorgenza di malattie o decesso del paziente.
• Non risterilizzare la valvola in alcun modo. L’esposizione della valvola e del relativo contenitore a irradiazione, vapore, ossido
di etilene o altri sterilizzanti chimici rendono la valvola non più idonea all’uso.
• Controllare l’indicatore di temperatura di spedizione all’interno della scatola. Se la finestra dell’indicatore di temperatura di
spedizione è nera, la valvola non può essere utilizzata per uso clinico.
• Non utilizzare la valvola in presenza di una o più delle seguenti condizioni:
– La valvola viene fatta cadere, risulta danneggiata o viene utilizzata in modo improprio
– La data di scadenza è stata superata
– Tutti i sigilli di sicurezza sono danneggiati
– Il numero di serie riportato sull’etichetta non corrisponde a quello indicato sull’etichetta del contenitore
72Italiano
Page 73

– La soluzione di conservazione di glutaraldeide non ricopre completamente la valvola o del liquido fuoriesce dalla confezione
– La valvola mostra segni di deterioramento
• Non maneggiare le parti di tessuto della valvola con gli strumenti. Prestare particolare attenzione per evitare di danneggiare i
tessuti delicati delle valvole. Anche una piccola perforazione potrebbe allargarsi nel tempo, compromettendo significativamente
il funzionamento della valvola.
• Non tentare di riparare una valvola danneggiata. Nessuna valvola danneggiata dovrà essere utilizzata.
• Non aggiungere antibiotici né qualsiasi altra sostanza alla soluzione di conservazione o alla soluzione di risciacquo.
• Non tentare di inserire una valvola troppo grande per l’annulus. Selezionare una valvola che si inserisca in modo perfetto nella
radice aortica senza deformare l’anatomia naturale né la bioprotesi Avalus.
• Non utilizzare misuratori per valvole di altri fabbricanti, né misuratori per protesi Medtronic di altro tipo per definire le dimensioni
della valvola.
• Non lasciare che la valvola si asciughi. Per evitare l’essiccamento del tessuto della valvola, irrigare periodicamente la valvola con
soluzione fisiologica normale sterile durante l’impianto.
4.2 Precauzioni
• È necessario prendere in seria considerazione questi rischi potenziali nella scelta di una valvola sostitutiva appropriata:
– La calcificazione può causare il deterioramento accelerato della valvola nei pazienti con anomalie del metabolismo del calcio
(ad esempio, insufficienza renale cronica, iperparatiroidismo).
– La calcificazione può verificarsi in fase più precoce nei pazienti in età pediatrica, negli adolescenti o nei giovani adulti.
– Può inoltre verificarsi una calcificazione prematura negli adulti di età più avanzata che ricevono una protesi biologica.
– I pazienti con bioprotesi che richiedono una terapia anticoagulante cronica sono a maggior rischio di emorragia.
• Non immettere in campo sterile la parte esterna, non sterile, del contenitore della valvola.
• Utilizzare i misuratori Avalus modello 7400S o il manico per valvola Medtronic modello 7420 soltanto dopo accurata pulizia e
sterilizzazione. Per ulteriori istruzioni, fare riferimento alle istruzioni per l’uso appropriate.
• Nella scelta delle dimensioni della valvola, tenere presente l’anatomia del paziente e scegliere una valvola capace di
rispondere adeguatamente alle esigenze emodinamiche del paziente stesso.
• Non impiantare una valvola senza aver prima eseguito le corrette procedure di risciacquo.
• Orientare i sostegni dello stent e posizionare la valvola in modo da evitare qualsiasi ostruzione degli osti coronarici.
• Evitare che la valvola o la soluzione di risciacquo vengano a contatto con salviette, teli o altre possibili fonti di materiale particolato
che potrebbe essere trasferito sul tessuto dei lembi.
• Individuare il lato di afflusso e il lato di efflusso della valvola prima di applicare la sutura.
• Prestare attenzione durante l’applicazione delle suture attraverso l’anello di sutura, onde evitare la lacerazione del tessuto dei
lembi. Se il tessuto dei lembi viene danneggiato, è necessario espiantare la valvola e sostituirla.
• Non utilizzare aghi taglienti, pinze senza protezione o strumenti acuminati in quanto potrebbero causare danni strutturali alla
valvola.
• Considerare il rischio di potenziali danni prima di introdurre cateteri, strumenti chirurgici e elettrocateteri per la stimolazione
transvenosa attraverso la valvola.
• Quando si utilizzano le suture a punti staccati, è importante tagliare le suture in prossimità dei nodi. Assicurarsi che le code di
sutura esposte non entrino in contatto con il tessuto dei lembi.
• Non piegare le commissure della bioprotesi durante l’annodatura delle suture.
• Non maneggiare il tessuto dei lembi.
• Evitare il contatto prolungato con la soluzione di conservazione della valvola. L’esposizione prolungata alla glutaraldeide può
causare irritazione agli occhi, al naso, alla pelle e alla gola. Evitare l’esposizione prolungata e l’inspirazione dei vapori di questa
sostanza. Utilizzare soltanto in presenza di un’adeguata ventilazione. In caso di contatto con la pelle, lavare immediatamente
l’area interessata con abbondante acqua per 10–15 minuti. In caso di contatto con gli occhi, sciacquarli con acqua per 15 minuti
e rivolgersi immediatamente a un medico.
5 Possibili effetti indesiderati
Gli effetti indesiderati potenzialmente associati all’uso di valvole cardiache bioprotesiche comprendono:
• Angina
• Disritmie cardiache
• Endocardite
• Scompenso cardiaco
• Emolisi
• Anemia emolitica
73 Italiano
Page 74

• Emorragia connessa all’uso di farmaci anticoagulanti/antipiastrinici
• Perdita transvalvolare o paravalvolare
• Infarto miocardico
• Disfunzioni non strutturali (conflitto/interferenza dei lembi, accrescimento ostruttivo del panno, deiscenza della sutura,
dimensioni inadeguate, altro)
• Rigurgito della protesi
• Ictus
• Deterioramento strutturale (calcificazione, lacerazione dei lembi, stenosi, altro)
• Tromboembolia
• Trombosi valvolare
Queste complicanze possono comportare:
• Nuovo intervento
• Espianto della bioprotesi
• Disabilità permanente
• Decesso
6 Istruzioni per l’uso
6.1 Istruzioni per la manipolazione e la preparazione
Nella sostituzione della valvola è di grande importanza l’adeguata dimensione della bioprotesi. Utilizzare i misuratori Avalus modello
7400S per scegliere la bioprotesi Avalus delle dimensioni adeguate. Per ulteriori informazioni, consultare le istruzioni per l’uso.
La parte esterna del contenitore e il coperchio non sono sterili. La valvola e tutti i componenti della confezione all’interno del
contenitore sono sterili e vanno maneggiati all’interno del campo operatorio sterile.
1. Preparare 2 bacinelle per risciacquo contenenti ognuna 500 ml di soluzione fisiologica normale sterile.
2. Esaminare i sigilli di sicurezza della confezione esterna per assicurarsi che il contenitore non sia stato danneggiato o
precedentemente aperto. Non utilizzare la valvola se tutti i sigilli di sicurezza sono danneggiati.
3. Ruotare il coperchio in senso antiorario e aprire il contenitore (Figura 2).
4. Tenere il dispositivo di ritenuta con il pollice e l’indice. Estrarre la bioprotesi delicatamente dal contenitore, lasciando gocciolare
la soluzione di conservazione di glutaraldeide (Figura 3).
5. Verificare che il numero di serie presente sul dispositivo di ritenuta corrisponda al numero di serie riportato sul coperchio del
contenitore, sulla scatola e sul modulo di registrazione del paziente. Registrare il numero di serie nella cartella del paziente
utilizzando gli adesivi forniti nel modulo di registrazione del paziente.
6. Tenere il dispositivo di ritenuta in posizione verticale. Rimuovere il coperchio del dispositivo di ritenuta ruotandolo in senso
antiorario con il pollice e l’indice (Figura 4). Il supporto della valvola diventerà visibile.
7. Inserire un manico sterile nel supporto. Ruotare il manico in senso orario nell’apertura filettata del supporto finché non si avverte
una certa resistenza (Figura 5).
8. Sollevare il manico per rimuovere la valvola dal dispositivo di ritenuta (Figura 6).
6.2 Procedura di risciacquo
1. Collocare l’intera valvola e il supporto in una delle bacinelle di risciacquo (Figura 6).
2. Utilizzare il manico per agitare ininterrottamente la valvola per almeno 30 secondi.
3. Premere delicatamente l’anello di sutura per rimuovere ogni residuo di glutaraldeide. Non toccare le parti di tessuto della valvola.
4. Collocare la valvola nella seconda bacinella. Lasciare la valvola nella bacinella finché non verrà utilizzata dal chirurgo.
6.3 Impianto della valvola aortica
La bioprotesi Avalus è progettata per l’impianto in posizione sovranulare. Utilizzare i misuratori Avalus modello 7400S per visualizzare
il posizionamento della cuffia di sutura sopra l’annulus e per confermare il posizionamento e l’inserimento della valvola nello spazio
sovranulare.
Per l’impianto in posizione sovranulare, la scelta della tecnica chirurgica è lasciata alla discrezione di ciascun chirurgo. Ogni modifica
alla tecnica chirurgica deve essere conforme con il contenuto del Capitolo 4, Avvertenze e precauzioni, pagina 72. In linea di massima,
procedere nel modo seguente:
1. Orientare la valvola in modo che gli osti coronarici non siano ostruiti dallo stent e dall’anello di sutura.
2. Per evitare l’essiccamento del tessuto valvolare delicato, irrigare periodicamente la valvola con soluzione fisiologica normale
sterile.
74Italiano
Page 75

3. Posizionare la valvola nell’annulus e applicare le suture all’anello di sutura.
4. Suturare la valvola in posizione utilizzando un’adeguata tecnica di sutura. Per evitare eventuali problemi, fare riferimento al
Capitolo 4, Avvertenze e precauzioni, pagina 72.
5. Per rilasciare il supporto, tagliare le suture in corrispondenza del singolo punto di taglio indicato dalla freccia bianca (Figura 7).
Per rimuovere il supporto, tirare delicatamente il manico, allontanandolo dalla valvola.
6. Rimuovere il supporto dal manico e provvedere al suo smaltimento.
7. Annodare tutti i fili e tagliare le code di sutura. Verificare che non vi siano residui di sutura. Se fossero ancora presenti dei residui,
eliminarli prima di completare la procedura di impianto della valvola.
7 Personalizzazione del trattamento
Salvo controindicazioni, durante l’immediata fase postoperatoria i pazienti sottoposti a impianto di bioprotesi valvolare cardiaca
devono seguire una terapia anticoagulante.
Per i pazienti che presentano una dilatazione dell’atrio sinistro, precedenti tromboembolici o un ritmo cardiaco con fibrillazione o flutter
atriali, prendere in considerazione una terapia a lungo termine a base di anticoagulanti o antipiastrinici.
8 Consigli ai pazienti
Si raccomanda un follow-up medico periodico (almeno annuale) in modo da diagnosticare e trattare in modo adeguato eventuali
complicanze correlate alla valvola.
I pazienti portatori di bioprotesi valvolari sono a rischio di batteriemia (ad esempio, quando si sottopongono a procedure
odontoiatriche). Consigliare pertanto al paziente una terapia antibiotica di profilassi.
Raccomandare ai pazienti di portare sempre con sé la scheda di identificazione del dispositivo impiantato fornita da Medtronic.
9 Modalità di fornitura
9.1 Confezione
La bioprotesi Avalus è sterilizzata chimicamente ed è fornita sterile in una soluzione di glutaraldeide tamponata allo 0,2%. Se il
contenitore di vetro e il coperchio sono aperti o danneggiati, la sterilità è compromessa. L’esterno del contenitore non è sterile. Non
riporlo nel campo sterile.
9.2 Conservazione
Conservare la bioprotesi Avalus a una temperatura compresa tra 5°C e 25°C (41°F e 77°F). La refrigerazione non è necessaria e il
congelamento potrebbe danneggiare la valvola. È sufficiente una temperatura ambiente di conservazione non superiore a 25°C
(77°F). Non esporre la valvola alla luce solare o ad altre sorgenti di luce ultravioletta, né collocarla in ambienti soggetti a significativi
sbalzi di temperatura.
Applicare una gestione d’inventario adeguata in modo da impiantare prima le bioprotesi con date di scadenza più vicine ed evitare
così che la data di scadenza venga superata.
9.3 Restituzione delle bioprotesi espiantate
Per la restituzione delle bioprotesi espiantate ai fini dell’analisi e dello smaltimento, contattare un rappresentante Medtronic per
ottenere i kit di restituzione del prodotto. Se un kit specifico non è disponibile, collocare la bioprotesi espiantata in un contenitore
riempito di glutaraldeide o formalina tamponata al 10% subito dopo l’espianto. Per ulteriori istruzioni sulla restituzione, contattare un
rappresentante Medtronic.
10 Dati sul paziente
10.1 Informazioni sulla registrazione
Nota: la registrazione dei pazienti non è richiesta nei Paesi in cui la legge sulla privacy è in conflitto con l’acquisizione dei dati personali
dei pazienti, compresi alcuni Paesi dell’Unione Europea.
Nella confezione di ogni dispositivo è contenuto un modulo di registrazione del paziente. Dopo l’impianto, inserire tutte le informazioni
richieste. Rispedire il modulo originale all’indirizzo di Medtronic riportato sul modulo stesso. Prima di dimettere il paziente,
consegnargli la scheda di identificazione temporanea.
Al paziente viene consegnata una scheda di identificazione del dispositivo impiantato. Questa scheda contiene il nome e il numero
di telefono del medico del paziente, nonché informazioni utili per il personale medico in caso di emergenza.
75 Italiano
Page 76

11 Informazioni postoperatorie
11.1 Compatibilità con la risonanza magnetica (RM)
La bioprotesi Avalus modello 400 è sicura per la risonanza magnetica (RM). La valvola non contiene metalli e non presenta, perciò,
rischi noti in alcun ambiente di risonanza magnetica.
È possibile effettuare una scansione RM a 3,0 T e 1,5 T subito dopo l’impianto. La valvola non provoca alcun danno al paziente quando
viene esposta a risonanza magnetica.
11.2 Artefatti delle immagini
La qualità delle immagini ottenute tramite risonanza magnetica potrebbe risultare compromessa se l’area esaminata corrisponde o
è vicina al punto in cui si trova la valvola. Se necessario, ottimizzare i parametri RM in base alla presenza della valvola.
12 Accessori
Per definire le dimensioni adeguate di una bioprotesi Avalus, utilizzare esclusivamente i misuratori Avalus modello 7400S e il manico
per valvola Medtronic modello 7420.
Attenzione: utilizzare i misuratori o i manici solo dopo accurata pulizia e sterilizzazione. Per ulteriori istruzioni, fare riferimento alle
istruzioni per l’uso appropriate.
Attenzione: non utilizzare misuratori per valvole di altri fabbricanti, né misuratori per protesi Medtronic di altro tipo per definire le
dimensioni della bioprotesi Avalus.
13 Esclusione dalla garanzia
LA SEGUENTE ESCLUSIONE DALLA GARANZIA È VALIDA SOLO PER I CLIENTI AL DI FUORI DEGLI STATI UNITI:
PER QUANTO LA BIOPROTESI AVALUS, MODELLO 400 (DI SEGUITO DENOMINATA "PRODOTTO") SIA STATA
ACCURATAMENTE PROGETTATA, REALIZZATA E TESTATA PRIMA DELLA SUA COMMERCIALIZZAZIONE, IL PRODOTTO
POTREBBE NON FUNZIONARE IN MANIERA SODDISFACENTE PER SVARIATE RAGIONI. LE AVVERTENZE INDICATE
NELLA DOCUMENTAZIONE DEL PRODOTTO FORNISCONO INFORMAZIONI PIÙ DETTAGLIATE A TALE RIGUARDO E
SONO DA CONSIDERARSI PARTE INTEGRANTE DELLA PRESENTE ESCLUSIONE DALLA GARANZIA. DI CONSEGUENZA,
MEDTRONIC NON RILASCIA ALCUNA GARANZIA, NÉ ESPRESSA NÉ TACITA, IN MERITO AL PRODOTTO. MEDTRONIC
NON PUÒ IN ALCUN CASO ESSERE RITENUTA RESPONSABILE PER DANNI INCIDENTALI O CONSEQUENZIALI CAUSATI
DALL’USO, DA DIFETTI O DA IMPERFEZIONI DEL PRODOTTO, INDIPENDENTEMENTE DAL FATTO CHE LA RICHIESTA DI
RISARCIMENTO DI TALI DANNI SIA BASATA SU GARANZIA, CONTRATTO, FATTO ILLECITO O ALTRO.
Le esclusioni e le restrizioni di cui sopra non sono intese, né devono essere interpretate in quanto tali, come contravvenenti a norme
ritenute inderogabili dalla legislazione vigente. Nel caso in cui una parte o un termine della presente ESCLUSIONE DALLA
GARANZIA venga giudicato illegale, inefficace o in conflitto con il diritto applicabile da un organo giudiziario, la validità delle rimanenti
parti della presente ESCLUSIONE DALLA GARANZIA non verrà compromessa e tutti i diritti e gli obblighi verranno interpretati ed
applicati come se la presente ESCLUSIONE DALLA GARANZIA non contenesse la parte o i termini ritenuti non validi.
76Italiano
Page 77

1 Prietaiso aprašymas
3
2
1
4
5
400 modelio „Avalus“ bioprotezą sudaro poliesteriu padengtas pagrindo rėmelis ir triburio vožtuvo atraminio rėmelio struktūra, kuriai
suteikta triburio vožtuvo forma. Pagrindo rėmelis ir triburio vožtuvo atraminis rėmelis yra išlieti įpurškiant ir naudojant
polietereterketono (PEEK) medžiagą. Pagrindo rėmelio PEEK medžiaga impregnuota bario sulfatu, kad būtų galima vizualizuoti
atliekant radiologinį tyrimą. Lapeliai išpjauti lazeriu iš jaučio audinių, kurie buvo susiūti buferiniame glutaraldehido tirpale. Lapeliai
įterpiami tarp triburio vožtuvo atraminio rėmelio ir pagrindo rėmelio, o po to visi komponentai tvirtai susiuvami vienas su kitu. Siuvimo
žiedas, pagamintas iš poliesterio audinio, integruotas į įtekėjimo pagrindo rėmelio dangą, kad naudotojas galėtų susiūti ir
„Avalus“ bioprotezą įdėti į padėtį virš žiedo. Siuvimo žymekliai yra ant siuvimo žiedo kiekvienos burės sinuso srities viduryje, kad būtų
kaip orientyras vienodiems tarpams tarp implanto siūlių (1 pav.). Kad būtų lengviau implantuoti, prie vožtuvo ištekėjimo dalies
pritvirtintas vienkartinis laikiklis. Aortos bioprotezas (vožtuvas) apdorojamas, atliekant alfa amino oleino rūgšties (AOA)
antimineralizacijos procesą, kuris, kaip įrodyta tyrimuose su gyvūnais, sumažina kiaulės vožtuvo lapelių kalcifikaciją.
Vienkartinis laikiklis sukurtas, kad tiktų daugkartinei 7420 Modelio „Medtronic“ vožtuvo rankenai. Laikiklyje yra atskiras pjovimo
taškas, kad būtų galima laikiklį nuimti nuo vožtuvo. Kalibratoriai dviem galais naudojami parinkti atitinkamo dydžio vožtuvą. Cilindrinė
dalis atitinka vožtuvo angą. Kopijos galas imituoja protezo geometriją.
1 lentelė. Tiekiami dydžiai ir siuvimo žiedo skersmenys (nominalios reikšmės milimetrais)
Dydis 19 mm 21 mm 23 mm 25 mm 27 mm 29 mm
(1) Stento skersmuo (TAD) 19 21 23 25 27 29
(2) Vidinis angos skersmuo 17,5 19,5 21,5 23,5 25,5 27,5
(2a) Vidinis angos skersmuo
(3) Išorinis siuvimo žiedo skersmuo 27,0 29,0 31,0 33,0 36,0 38,0
(4) Vožtuvo profilio aukštis 13,0 14,0 15,0 16,0 17,0 18,0
(5) Aortos išstūmimas 11,0 12,0 13,0 14,0 15,0 16,0
a
18 20 22 24 26 28
Pastaba. TAD – audinių žiedo skersmuo
a
Matavimuose nurodytas stento rėmelis, įskaitant audinius (2) ir stento rėmelis be audinių (2a)
2 Naudojimo indikacijos
„Avalus“ bioprotezas yra skirtas ligos apimtam, pažeistam ar blogai funkcionuojančiam natūraliam ar protezuotam aortos vožtuvui
pakeisti.
3 Kontraindikacijos
Vožtuvo nenaudokite, jeigu tai nėra naudinga pacientui. Įvertinkite visus susijusius pavojus, įskaitant anatomiją ir operacijos metu
stebimą patologiją.
4 Įspėjimai ir atsargumo priemonės
4.1 Įspėjimai
• Įtaisas skirtas naudoti tik vieną kartą. Nenaudokite, neapdorokite ir nesterilizuokite pakartotinai šio įtaiso. Pakartotinai naudojant,
apdorojant ar sterilizuojant gali būti pažeistas prietaiso struktūrinis vientisumas arba kilti užteršimo pavojus, dėl ko pacientas gali
būti sužalotas, susirgti arba gali mirti.
• Draudžiama pakartotinai sterilizuoti vožtuvą bet kokiu metodu. Jei vožtuvas su konteineriu paveikiamas spinduliuote,
garais, etileno oksidu ar kitais cheminio sterilizavimo tirpalais, jis gali būti netinkamas naudoti.
• Patikrinkite transportavimo temperatūros indikatorių dėžėje. Jeigu transportavimo temperatūros indikatoriaus langelis yra juodas,
vožtuvas netinkamas naudoti medicininiais tikslais.
• Nenaudokite vožtuvo, esant šioms aplinkybėms:
– vožtuvas buvo numestas, pažeistas ar netinkamai naudojamas;
– baigėsi tinkamumo laikas;
– visos fiksavimo juostelės yra pažeistos;
– serijos numerio kortelė skiriasi nuo konteinerio etiketės numerio;
77 Lietuviškai
Page 78

– glutaraldehido laikymo tirpalas visiškai neapsemia vožtuvo arba jeigu iš pakuotės teka skystis;
– yra vožtuvo susidėvėjimo požymių.
• Nelieskite vožtuvo audinių instrumentais. Kad nepažeistumėte jautraus vožtuvo audinio, su juo reikia elgtis ypač atsargiai. Net ir
pati mažiausia skylutė laikui bėgant gali padidėti ir reikšmingai pabloginti vožtuvo funkciją.
• Nemėginkite taisyti pažeisto vožtuvo. Pažeisto vožtuvo naudoti negalima.
• Į saugojimo tirpalą ar skalavimo tirpalą nedėkite antibiotikų ar kitų medžiagų.
• Nemėginkite įterpti į žiedą per didelio vožtuvo. Pasirinkite vožtuvą, kuris tvirtai įsistatys į aortos šaknį nedeformuojant natyvinės
anatomijos ar „Avalus“ bioprotezo.
• Vožtuvo dydžiui parinkti nenaudokite kitų gamintojų vožtuvų kalibratorių ar su kitais „Medtronic“ protezais naudojamų kalibratorių.
• Neleiskite vožtuvo audiniams išdžiūti. Kad vožtuvo audinys neišdžiūtų, implantuodami nuolat drėkinkite vožtuvą steriliu
fiziologiniu tirpalu.
4.2 Atsargumo priemonės
• Parinkdami tinkamą vožtuvo pakaitalą, atsižvelkite į šiuos potencialius pavojus:
– Užkalkėjimas gali pagreitinti vožtuvo irimą pacientams, kurių kalcio apykaita pakitusi (pavyzdžiui, serga lėtiniu inkstų
nepakankamumu, hiperparatiroidizmu).
– Kalcifikacija gali anksčiau atsirasti vaikams, paaugliams ar jauniems suaugusiesiems.
– Ankstyva kalcifikacija taip pat gali atsirasti vyresniems suaugusiesiems, kuriems implantuotas biologinis protezas.
– Pacientams su biologiniais protezais, kuriems reikia ilgalaikės antikoaguliacijos, kyla papildomas kraujavimo pavojus.
• Vožtuvo konteinerio nesteriliu paviršiumi nedėkite į sterilų lauką.
• Nenaudokite 7400S modelio „Avalus“ kalibratorių ar „Medtronic“ 7420 modelio vožtuvo rankenos, kol jie nebus kruopščiai nuvalyti
ir sterilizuoti. Išsamesnių nurodymų žr. atitinkamose naudojimo instrukcijose.
• Parinkdami vožtuvo dydį atsižvelkite į paciento anatomiją ir parinkite vožtuvą, kuris atitiks hemodinaminius paciento
poreikius.
• Vožtuvo neimplantuokite neatlikę tinkamų skalavimo procedūrų.
• Stentų kaiščius pakreipkite ir vožtuvą įdėkite taip, kad vainikinės arterijos anga nebūtų uždengta.
• Stenkitės vožtuvo ar skalavimo tirpalo neliesti su rankšluosčiais, drobėmis ar kitais šaltiniais, kurie ant lapelio audinių gali pernešti
dalelių.
• Prieš siūdami nustatykite vožtuvo pritekėjimo ir ištekėjimo puses.
• Verdami siūlus per siuvimo žiedą būkite atsargūs, kad neįtrūktų lapelio audinys. Jeigu lapelio audinys pažeistas, vožtuvą reikia
išimti ir pakeisti.
• Nenaudokite pjovimo adatų, neapsaugotų spaustukų ar aštrių instrumentų, kurie galėtų pažeisti vožtuvo struktūrą.
• Prieš perkišdami per vožtuvą kateterius, chirurginius instrumentus ir transveninius stimuliavimo elektrodus, atsižvelkite į žalą,
kurią jie gali sukelti.
• Naudojant atskirąsias siūles svarbu nukirpti siūlą arti mazgo. Pasirūpinkite, kad laisvi siūlo galai neliestų lapelio audinio.
• Rišdami mazgus nelenkite bioprotezo komisūrų.
• Lapelio audinio neimkite rankomis.
• Venkite ilgo kontakto su vožtuvo saugojimo tirpalu. Dėl ilgalaikio poveikio glutaraldehidas gali pradėti dirginti akis, nosį, odą ir
gerklę. Venkite ilgai būti ten, kur kaupiasi cheminių medžiagų garai, ar ilgai jais kvėpuoti. Naudokite, tik jei yra tinkama ventiliacija.
Jei skysčio patenka ant odos, pažeistą vietą nedelsdami plaukite dideliu kiekiu vandens 10 – 15 minučių. Patekus į akis, plaukite
jas vandeniu 15 minučių ir nedelsdami kreipkitės į medikus.
5 Galimi šalutiniai poveikiai
Naudojant širdies vožtuvo bioprotezą gali atsirasti šie šalutiniai poveikiai:
• Krūtinės angina
• Širdies ritmo sutrikimai
• Endokarditas
• Širdies nepakankamumas
• hemolizė
• hemolizinė anemija
• Kraujavimas, susijęs su antikoaguliantų / antiagregantų vartojimu
• Pratekėjimas per vožtuvą ar šalia jo
• Miokardo infarktas
78Lietuviškai
Page 79

• Nestruktūrinė disfunkcija (lapelio užstrigimas / trankymasis, obstrukcinės drumsties įaugimas, siūlės išsiplėtimas, netinkamas
dydis, kita)
• Protezo regurgitacija
• Insultas
• Struktūrinis gedimas (kalcifikacija, lapelio plyšimas, stenozė, kita)
• Tromboembolija
• Vožtuvo trombozė
Galimi šie komplikacijų padariniai:
• Pakartotinė operacija
• Bioprotezo eksplantavimas
• Nuolatinis nedarbingumas
• Mirtis
6 Naudojimo instrukcijos
6.1 Laikymo ir parengimo instrukcijos
Tinkamai parinkti dydį itin svarbu keičiant širdies vožtuvą. Tinkamo dydžio „Avalus“ bioprotezui parinkti naudokite 7400S modelio
„Avalus“ kalibratorius. Išsamesnių nurodymų žr. naudojimo instrukcijose.
Konteinerio išorė ir dangtelis yra nesterilūs. Vožtuvas ir visos konteineryje esančios vidinės pakuotės dalys yra sterilios ir steriliame
operaciniame lauke su jomis reikia elgtis atitinkamai.
1. Paruoškite 2 plovimo voneles, į kurias pripilkite po 500 ml sterilaus fiziologinio tirpalo.
2. Apžiūrėkite fiksavimo juosteles ir įsitikinkite, kad pakuotė nebuvo pažeista ar anksčiau atidaryta. Vožtuvo nenaudokite, jei visos
fiksavimo juostelės yra pažeistos.
3. Pasukite dangtelį prieš laikrodžio rodyklę ir atidarykite konteinerį (2 pav.).
4. Fiksatorių laikykite nykščiu ir rodomuoju pirštu. Vožtuvą lėtai išimkite iš konteinerio, leisdami tekėti gliutaraldehido tirpalui
(3 pav.).
5. Įsitikinkite, kad fiksatoriaus serijos numeris sutampa su konteinerio dangtelio, kartoninės dėžutės ir paciento registracijos formos
serijos numeriu. Įrašykite serijos numerį į paciento duomenis naudodami lipdukus, kurie yra paciento registracijos formoje.
6. Fiksatorių laikykite vertikaliai. Suėmę fiksatoriaus gaubtą nykščiu ir rodomuoju pirštu pasukite jį prieš laikrodžio rodyklę ir
nuimkite (4 pav.). Pamatysite laikiklį.
7. Sterilią rankenėlę įkiškite į laikiklį. Rankenėlę sukite pagal laikrodžio rodyklę iki galo laikiklio atidarymo angoje su
sriegiais (5 pav.).
8. Išimkite vožtuvą iš fiksatoriaus patraukdami į viršų rankenėlę (6 pav.).
6.2 Skalavimo procedūra
1. Visą vožtuvą ir laikiklį įdėkite į 1 iš skalavimo vonelių (6 pav.).
2. Naudodami vožtuvo rankenėlę skalaukite vožtuvą mažiausiai 30 sek.
3. Švelniai suspauskite siuvimo žiedą ir pašalinkite gliutaraldehido likutį. Nelieskite vožtuvo audinio.
4. Įdėkite vožtuvą į antrąją vonelę. Vožtuvą vonelėje palikite tol, kol jo prireiks chirurgui.
6.3 Aortos vožtuvo implantavimas
„Avalus“ bioprotezas skirtas implantuoti padėtyje virš žiedo. 7400S modelio „Avalus“ kalibratorius naudokite siuvimo atlanko įdėjimui
virš žiedo vizualizuoti ir patvirtinti vožtuvo įdėjimą bei tikimą ertmėje virš žiedo.
Implantuojant padėtyje virš žiedo dėl chirurginio metodo pasirinkimo sprendžia kiekvienas chirurgas. Visi modifikuoti metodai turi
atitikti reikalavimus, pateiktus 4 skyr., Įspėjimai ir atsargumo priemonės, p. 77. Apskritai, laikykitės šių etapų:
1. Vožtuvą pakreipkite taip, kad vainikinės arterijos angos nebūtų uždengtos stentu ar siuvimo žiedu.
2. Drėkinkite vožtuvą steriliu fiziologiniu tirpalu, kad neišdžiūtų gležnas audinys.
3. Vožtuvą įdėkite į žiedą ir susiūkite siūles siuvimo žiede.
4. Taikydami atitinkamą siuvimo metodą įsiūkite vožtuvą į vietą. Kad išvengtumėte galimų problemų, žr. 4 skyr., Įspėjimai ir
atsargumo priemonės, p. 77.
5. Siūles nupjaukite atskirame pjovimo taške, nurodytame balta rodykle, ir atlaisvinkite laikiklį (7 pav.). Švelniai patraukite rankeną
nuo vožtuvo ir nuimkite laikiklį.
6. Laikiklį išimkite iš rankenos ir jį išmeskite.
79 Lietuviškai
Page 80

7. Suriškite visus mazgus ir nukirpkite siūlų galus. Patikrinkite, ar neliko siūlų likučių. Jei yra siūlų likučių, prieš baigdami implantuoti
vožtuvą juos pašalinkite.
7 Gydymo individualizavimas
Pradinių etapų po implantavimo metu pacientai, kuriems buvo implantuotas širdies vožtuvo bioprotezas, turėtų toliau būti gydomi
antikoaguliantais, išskyrus tuos atvejus, kai tai kontraindikuotina.
Ilgalaikis gydymas antikoaguliantais arba antiagregantais skiriamas pacientams, kuriems nustatytas išsiplėtęs kairysis prieširdis,
buvo tromboembolinių komplikacijų, prieširdžių plazdėjimas ar virpėjimas.
8 Informacija apie pacientų konsultavimą
Rekomenduojama nuolat stebėti sveikatos būklę (mažiausiai kas metus), kad būtų diagnozuotos ir tinkamai gydomos su vožtuvu
susijusios komplikacijos.
Pacientams su vožtuvo bioprotezu yra padidėjusi bakteremijos rizika (pavyzdžiui, atliekant odontologines procedūras). Pacientams
rekomenduokite profilaktinį gydymą antibiotikais.
Pacientus paraginkite visada su savimi nešiotis implantuoto įrenginio identifikavimo kortelę, kurią pateikė „Medtronic“.
9 Kaip pristatomas
9.1 Pakuotė
„Avalus“ bioprotezas yra chemiškai sterilizuotas ir tiekiamas sterilus buferiniame 0,2 % glutaraldehido tirpale. Sterilumas yra
pažeistas, jeigu stiklinio indo su dangteliu konteineris atidarytas arba sugadintas. Talpyklės išorė yra nesterili. Nedėkite į sterilų lauką.
9.2 Laikymas
Laikykite „Avalus“ bioprotezą temperatūroje nuo 5°C iki 25°C (nuo 41°F iki 77°F). Šaldyti nebūtina, o užšaldžius galima pažeisti
vožtuvą. Kambario laikymo temperatūra iki 25°C (77°F) yra tinkama. Vožtuvą saugokite nuo saulės šviesos ar kitų ultravioletinės
šviesos šaltinių ir nedėkite ten, kur galimi reikšmingi temperatūros svyravimai.
Turi būti tinkamai kontroliuojamas inventorius, kad bioprotezai, kurių galiojimo laikas baigiasi anksčiau, būtų implantuojami pirmiau,
kad būtų išvengta galiojimo laiko pabaigos.
9.3 Išimtų bioprotezų grąžinimas
Kreipkitės į „Medtronic“ pardavimų atstovą ir užsakykite gaminio grąžinimo komplektą, jei norite grąžinti eksplantuotus bioprotezus
analizei ir utilizavimui. Jei komplekto negausite, eksplantavę bioprotezą iš karto įdėkite į indą su gliutaraldehido arba 10 % buferinio
formalino tirpalu. Norėdami gauti daugiau nurodymų dėl grąžinimo, kreipkitės į „Medtronic“ pardavimų atstovą.
10 Paciento informacija
10.1 Registracijos informacija
Pastaba. paciento registracija nevykdoma tose šalyse, kuriose paciento privatumą ginančiuose įstatymuose draudžiama teikti
informaciją apie pacientą (taip pat Europos Sąjungoje).
Paciento registracijos forma įdedama į kiekvieną prietaiso pakuotę. Implantavę įrašykite visus reikiamus duomenis. Formos originalą
grąžinkite „Medtronic“ formoje nurodytu adresu. Prieš išrašydami pacientui įteikite laikiną identifikavimo kortelę.
Pacientui įteikiama implantuoto prietaiso tapatybės kortelė. Šioje kortelėje nurodytas paciento gydytojo vardas, pavardė, telefono
numeris, taip pat informacija, kuri gali būti naudinga skubią pagalbą teikiančiam medicinos personalui.
11 Pooperacinė informacija
11.1 Magnetinio rezonanso tyrimo (MRT) suderinamumas
400 modelio „Avalus“ bioprotezas yra saugus atliekant magnetinio rezonanso (MR) tyrimą. Vožtuvo sudėtyje nėra metalo, todėl jis
nekelia grėsmės bet kurioje MR aplinkoje.
3,0 T ir 1,5 T MR skenavimą galima atlikti iš karto po implantavimo. Vožtuvas nesukels jokio pavojaus pacientui atliekant MR
skenavimą.
11.2 Vaizdo artefaktas
MR vaizdo kokybė gali pablogėti, jeigu skenuojama vožtuvo padėtis ar šalia jo. Jeigu reikia, dėl vožtuvo optimizuokite MR vaizdo
gavimo parametrus.
80Lietuviškai
Page 81

12 Priedai
Tinkamam „Avalus“ bioprotezo dydžiui nustatyti naudokite tik 7400S modelio „Avalus“ kalibratorius ir 7420 modelio
„Medtronic“ vožtuvo rankenėlę.
Dėmesio! kalibratorių ar rankenų nenaudokite, kol jie nebus tinkamai išvalyti ir sterilizuoti. Išsamesnių nurodymų žr. atitinkamose
naudojimo instrukcijose.
Dėmesio! „Avalus“ bioprotezo dydžiui parinkti nenaudokite kitų gamintojų vožtuvų kalibratorių ar su kitais „Medtronic“ protezais
naudojamų kalibratorių.
13 Atsisakymas suteikti garantiją
ŠIS ATSISAKYMAS SUTEIKTI GARANTIJĄ TAIKOMAS NE JUNGTINIŲ AMERIKOS VALSTIJŲ PIRKĖJAMS:
NORS 400 MODELIO „AVALUS“ BIOPROTEZAS, TOLIAU VADINAMAS „GAMINIU“, PRIEŠ JĮ PARDUODANT BUVO ATIDŽIAI
SUKURTAS, PAGAMINTAS IR IŠBANDYTAS, DĖL ĮVAIRIŲ PRIEŽASČIŲ NUMATYTĄ FUNKCIJĄ GAMINYS GALI ATLIKTI
NEPATENKINAMAI. GAMINIO ETIKETĖSE NURODYTUOSE ĮSPĖJIMUOSE PATEIKIAMA DAUGIAU INFORMACIJOS IR JIE
YRA LAIKOMI SUDĖTINE ŠIO ATSISAKYMO SUTEIKTI GARANTIJĄ DALIMI. TODĖL „MEDTRONIC“ NESUTEIKIA JOKIŲ
AIŠKIAI IŠREIKŠTŲ AR NUMANOMŲ GARANTIJŲ DĖL ŠIO GAMINIO. „MEDTRONIC“ NĖRA ATSAKINGA UŽ
ATSITIKTINIUS AR PASEKMINIUS GEDIMUS, ATSIRADUSIUS DĖL GAMINIO NAUDOJIMO, DEFEKTO AR NEVEIKIMO,
NEATSIŽVELGIANT Į TAI, AR PRETENZIJOS DĖL GEDIMŲ PAREMTOS GARANTIJA, SUTARTIMI, CIVILINĖS TEISĖS
PAŽEIDIMU AR KT.
Anksčiau išdėstytos išimtys bei apribojimai nėra ir nelaikytini prieštaraujančiais privalomosioms taikomo įstatymo nuostatoms. Jei
kurią nors šio ATSISAKYMO SUTEIKTI GARANTIJĄ dalį arba sąlygą kompetentingos jurisdikcijos teismas paskelbtų neteisėta,
neįgyvendinama arba prieštaraujančia galiojantiems įstatymams, tai neturės poveikio likusių ATSISAKYMO SUTEIKTI GARANTIJĄ
dalių galiojimui, o visos teisės ir įsipareigojimai bus aiškinami ir įgyvendinami taip, lyg šiame ATSISAKYME SUTEIKTI GARANTIJĄ
nebūtų negaliojančia paskelbtos dalies arba sąlygos.
81 Lietuviškai
Page 82

1 Ierīces apraksts
3
2
1
4
5
Avalus bioprotēzi (modelis 400) veido pamatkarkass ar poliestera pārklājumu un trīslapiņu atbalsta karkasa konstrukcija, kuras forma
veidota atbilstoši trīslapiņu vārstuļa ģeometrijai. Pamatkarkass un trīslapiņu atbalsta karkass ir izgatavots no poliēterēterketona
(PEEK), izmantojot spiedienliešanas metodi. Pamatkarkasa PEEK materiāls ir impregnēts ar bārija sulfātu, kas padara iespējamu
radiogrāfisko vizualizāciju. Lapiņas ir ar lāzeru izgrieztas no liellopa audiem, kas savstarpēji saistīti buferētā glutāraldehīdā. Lapiņas
ir ievietotas starp trīslapiņu atbalsta karkasu un pamatkarkasu, un visas sastāvdaļas pēc tam ir droši nostiprinātas ar šuvēm. No
poliestera auduma izgatavotais šūšanas gredzens ir iestrādāts pamatkarkasa ieejas pārsegā, lai lietotājs varētu ar šuvēm nostiprināt
un novietot Avalus bioprotēzi gredzena ārpusē. Šūšanas marķieri atrodas uz šūšanas gredzena katra izvirzījuma sinusa viduszonā,
lai palīdzētu nodrošināt vienmērīgas atstarpes starp implantāta šuvēm (1. att.). Vārstuļa izejas daļai ir pievienots vienreizlietojams
turētājs, kas atvieglo vārstuļa implantāciju. Aortas bioprotēze (vārstulis) ir apstrādāta ar alfa aminooleīnskābes (alpha amino oleic
acid — AOA) antimineralizācijas metodi. Šī apstrāde pētījumos ar dzīvniekiem ir ļāvusi samazināt cūku vārstuļu viru pārkaļķošanos.
Vienreizlietojamais turētājs ir veidots tā, lai tas atbilstu Medtronic vārstuļa rokturim (modelis 7420). Turētājam ir viens griešanas
punkts, kas paredzēts turētāja noņemšanai no vārstuļa. Atbilstošai vārstuļa izmēra izvēlei tiek izmantoti izmēra noteicēji ar diviem
galiem. Cilindrveida gals atveido vārstuļa atveri. Imitācijas gals atveido protēzes ģeometriju.
1. tab. Pieejamie izmēri un šūšanas gredzenu diametri (nominālvērtības milimetros) Izmērs 19 mm 21 mm 23 mm 25 mm 27 mm 29 mm
(1) Stenta diametrs (TAD) 19 21 23 25 27 29
(2) Iekšējās atveres diametrs 17,5 19,5 21,5 23,5 25,5 27,5
(2a) Iekšējās atveres diametrs
(3) Ārējā šūšanas gredzena diametrs 27,0 29,0 31,0 33,0 36,0 38,0
(4) Vārstuļa profila augstums 13,0 14,0 15,0 16,0 17,0 18,0
(5) Aortas izvirzījums 11,0 12,0 13,0 14,0 15,0 16,0
a
18 20 22 24 26 28
Piezīme: TAD — audu gredzena diametrs.
a
Mērījums rāda stenta karkasu, kas ietver audus (2), un stenta karkasu, kas neietver audus (2a)
2 Lietošanas indikācijas
Avalus bioprotēze ir paredzēta slimu, bojātu vai disfunkcionālu dabisko vai mākslīgo aortas vārstuļu aizstāšanai.
3 Kontrindikācijas
Nelietojiet vārstuli, ja tā lietošana nav pacienta interesēs. Novērtējiet visus saistītos riskus, tostarp operācijas laikā novēroto
anatomiju un patoloģijas.
4 Brīdinājumi un piesardzības pasākumi
4.1 Brīdinājumi
• Šī ierīce ir paredzēta tikai vienreizējai lietošanai. Šo izstrādājumu nedrīkst lietot, apstrādāt un sterilizēt atkārtoti. Atkārtota
lietošana, apstrāde vai sterilizēšana var ietekmēt ierīces strukturālo veselumu vai radīt kontaminācijas risku, kas var izraisīt
pacienta ievainojumus, slimību vai nāvi.
• Nesterilizējiet vārstuli atkārtoti neatkarīgi no izmantotās metodes. Vārstuļa un tvertnes pakļaušana starojuma, tvaika,
etilēnoksīda vai citu ķīmiskās sterilizācijas līdzekļu iedarbībai padara vārstuli nederīgu lietošanai.
• Pārbaudiet transportēšanas temperatūras indikatoru, kas atrodas kastes iekšpusē. Ja transportēšanas temperatūras indikatora
logs ir melnā krāsā, vārstuli klīniskajā praksē izmantot nedrīkst.
• Nelietojiet vārstuli, ja pastāv kāds no šiem apstākļiem:
– vārstulis ir nomests, sabojāts vai arī citādi nepareizi izmantots;
– beidzies derīguma termiņš;
– visas aizsargstrēmeles ir bojātas;
– sērijas numurs uz marķējuma neatbilst sērijas numuram uz tvertnes marķējuma;
– glutāraldehīda uzglabāšanas šķīdums pilnībā nenosedz vārstuli vai no iepakojuma sūcas šķidrums;
– ir redzamas vārstuļa bojājumu pazīmes.
82Latviski
Page 83

• Vārstuļa audu daļas nedrīkst nonākt saskarē ar instrumentiem. Rīkojieties ļoti piesardzīgi, lai nesabojātu vārstuļa smalkos audus.
Pat niecīgākā perforācija ar laiku var paplašināties, būtiski pasliktinot vārstuļa darbību.
• Nemēģiniet labot bojātu vārstuli. Bojātu vārstuli nedrīkst izmantot.
• Uzglabāšanas un skalošanas šķīdumam nedrīkst pievienot antibiotikas vai citas vielas.
• Nemēģiniet ievietot pārāk lielu vārstuli, kas neatbilst gredzenam. Izvēlieties vārstuli, kas droši iegulst aortas saknē, nedeformējot
natīvo anatomiju vai Avalus bioprotēzi.
• Lai noteiktu vārstuļa izmēru, nelietojiet citu ražotāju vārstuļu izmēra noteicējus vai citām Medtronic protēzēm paredzētus izmēra
noteicējus.
• Nepieļaujiet vārstuļa audu izžūšanu. Lai nepieļautu vārstuļa audu izžūšanu, implantēšanas laikā periodiski apskalojiet vārstuli ar
sterilu parasto fizioloģisko šķīdumu.
4.2 Piesardzības pasākumi
• Izvēloties piemērotus vārstuļu aizstājējus ir rūpīgi jāizvērtē iespējamie riski:
– Deģenerācija pārkaļķošanās dēļ pacientiem ar kalcija metabolisma traucējumiem (piemēram, hronisku nieru mazspēju,
hiperparatireoīdismu) var izraisīt paātrinātu vārstuļa nolietošanos.
– Pārkaļķošanās ātrāk var veidoties bērniem, pusaudžiem un jauniešiem.
– Priekšlaicīga pārkaļķošanās var veidoties vecākiem pieaugušajiem, kuriem implantēta bioprotēze.
– Pacientiem, kuriem ir implantēta bioprotēze un kuriem ir nepieciešama ilgstoša antikoagulācija, ir papildu asiņošanas risks.
• Nenovietojiet vārstuļa tvertnes nesterilo ārējo virsmu sterilajā laukā.
• Nelietojiet Avalus izmēra noteicējus (modelis 7400S) vai Medtronic vārstuļa rokturi (modelis 7420), kamēr tie nav rūpīgi notīrīti un
sterilizēti. Papildu norādījumus skatiet attiecīgajās lietošanas pamācībās.
• Izvēloties vārstuļa izmēru, ir jāņem vērā pacienta anatomija, kā arī jāizvēlas tāds vārstulis, kas atbilst pacienta
hemodinamiskajām vajadzībām.
• Neimplantējiet vārstuli, ja nav veiktas atbilstošas skalošanas procedūras.
• Pavērsiet stenta balstus un ievietojiet vārstuli tā, lai netiktu nosprostota koronārās artērijas atvere.
• Nepieļaujiet vārstuļa vai skalošanas šķīduma nonākšanu saskarē ar dvieļiem, audumu vai citiem objektiem, kuru materiāla
daļiņas var nonākt uz lapiņu audiem.
• Pirms piešūšanas identificējiet vārstuļa ieeju un izeju.
• Uzliekot šuves caur šūšanas gredzenu, uzmanieties, lai nesabojātu lapiņu audus. Ja lapiņu audi ir bojāti, vārstulis ir jāizņem un
jāaizstāj.
• Nelietojiet griezējadatas, ķirurģiskās knaibles bez aizsardzības vai asus instrumentus, kas var izraisīt vārstuļa strukturālus
bojājumus.
• Pirms katetru, ķirurģisko instrumentu un transvenozā kardiostimulatora elektrodu izvadīšanas cauri vārstulim ņemiet vērā
iespējamo bioprotēzes sabojāšanas risku.
• Izmantojot pārtrauktās šuves, ir svarīgi nogriezt šuves diegu tuvu pie mezgla. Nodrošiniet, lai liekie šuves diega gali nesaskartos
ar lapiņu audiem.
• Sienot mezglus, nesalieciet bioprotēzes komisūras.
• Nepieskarieties vārstuļa lapiņu audiem.
• Nepieļaujiet ilgstošu saskari ar vārstuļa uzglabāšanas šķīdumu. Ilgstošas saskares gadījumā glutāraldehīds var izraisīt acu,
deguna, ādas un rīkles kairinājumu. Nepieļaujiet ilgstošu ķīmisko tvaiku iedarbību vai ieelpošanu. Lietojiet tikai tad, ja ir
nodrošināta pietiekama ventilācija. Ja viela nonāk uz ādas, nekavējoties skalojiet skarto vietu ar lielu daudzumu ūdens
10–15 minūtes. Ja viela nokļuvusi acīs, skalojiet tās ar ūdeni 15 minūtes un nekavējoties vērsieties pie ārsta.
5 Iespējamās nevēlamās blakusparādības
Ar sirds vārstuļu bioprotēžu lietošanu tiek saistītas šādas iespējamās blakusparādības:
• stenokardija;
• sirds aritmija (ritma traucējumi);
• endokardīts;
• sirds mazspēja;
• hemolīze
• hemolītiskā anēmija
• asiņošana, kas saistīta ar antikoagulantu/trombocītu agregāciju kavējošu līdzekļu lietošanu;
• transvalvulāra vai paravalvulāra noplūde;
• miokarda infarkts;
83 Latviski
Page 84

• ar struktūru nesaistīta disfunkcija (lapiņu iesprūšana/atdure, obstruktīva lieko audu ieaugšana, šuvju atvēršanās, nepareiza
izmēra noteikšana, cita);
• protēzes regurgitācija;
• insults;
• struktūru bojājums (kalcifikācija, lapiņu bojājums, stenoze, cits);
• Trombembolija
• vārstuļa tromboze;
Minētās komplikācijas var izraisīt šādas blakusparādības:
• atkārtota operācija;
• bioprotēzes eksplantācija;
• neatgriezeniska invaliditāte;
• nāve;
6 Lietošanas norādījumi
6.1 Norādījumi par rīkošanos un sagatavošanos darbam
Sirds vārstuļa aizstāšanā ļoti svarīgi ir izvēlēties pareizu izmēru. Lai izvēlētos atbilstoša izmēra Avalus bioprotēzi, izmantojiet Avalus
izmēra noteicējus (modelis 7400S). Papildinformāciju skatiet lietošanas pamācībās.
Tvertnes un vāka ārpuse nav sterila. Vārstulis un visas iepakojuma sastāvdaļas, kas atrodas tvertnē, ir sterilas, un ar tām ir jārīkojas
operācijas sterilajā laukā.
1. Sagatavojiet 2 skalošanas traukus un katrā ielejiet 500 ml sterila parastā fizioloģiskā šķīduma.
2. Pārbaudiet aizsargstrēmeles, lai pārliecinātos, vai tvertne nav bojāta vai iepriekš atvērta. Ja visas aizsargstrēmeles ir bojātas,
nelietojiet vārstuli.
3. Pagrieziet vāciņu pretēji pulksteņrādītāju kustības virzienam un atveriet tvertni (2. att.).
4. Turiet aizsargu ar īkšķi un rādītājpirkstu. Lēni izceliet vārstuli no tvertnes, ļaujot notecēt glutāraldehīda šķīdumam (3. att.).
5. Pārbaudiet, vai uz aizsarga esošais sērijas numurs ir vienāds ar sērijas numuru, kas norādīts uz tvertnes vāka, kartona kārbas
un pacienta reģistrācijas veidlapā. Izmantojot uzlīmes, kas ir nodrošinātas kopā ar pacienta reģistrācijas veidlapu, atzīmējiet
sērijas numuru pacienta medicīnas kartē.
6. Turiet aizsargu taisni. Noņemiet aizsargvāciņu, ar īkšķi un rādītājpirkstu pagriežot to pretēji pulksteņrādītāju kustības virzienam
(4. att.). Kļūst redzams turētājs.
7. Ievietojiet turētājā sterilu rokturi. Grieziet rokturi pulksteņrādītāju kustības virzienā, virzot to turētāja vītņotajā atverē, līdz sajūtat
pretestību (5. att.).
8. Lai izņemtu vārstuli no aizsarga, celiet rokturi uz augšu (6. att.).
6.2 Skalošanas procedūra
1. Ievietojiet visu vārstuli un turētāju vienā no skalošanas traukiem (6. att.).
2. Izmantojot rokturi, nepārtraukti maisiet vārstuli vismaz 30 sekundes.
3. Viegli saspiediet šūšanas gredzenu, lai izspiestu lieko glutāraldehīdu. Nepieskarieties vārstuļa audiem.
4. Ielieciet vārstuli otrajā traukā. Turiet vārstuli traukā tik ilgi, līdz to pieprasīs ķirurgs.
6.3 Aortas vārstuļa implantēšana
Avalus bioprotēze ir paredzēta implantēšanai gredzena ārpusē. Lai vizualizētu šūšanas uzmavas novietojumu virs gredzena un
pārbaudītu vārstuļa novietojumu un atbilstību gredzena ārējā telpā, izmantojiet Avalus izmēra noteicējus (modelis 7400S).
Veicot implantāciju gredzena ārpusē, ķirurģiskās metodes izvēle ir ķirurga ziņā. Visām modificētajām metodēm ir jāatbilst
norādījumiem, kas sniegti 4. nod., Brīdinājumi un piesardzības pasākumi, 82. lapa. Vispārīgi ir jāveic šādas darbības:
1. Pavērsiet vārstuli tā, lai stents vai šūšanas gredzens neaizsegtu koronārās artērijas atveri.
2. Vārstulis ir periodiski jāskalo ar sterilu parasto fizioloģisko šķīdumu, lai nepieļautu vārstuļa smalko audu izžūšanu.
3. Novietojiet vārstuli aortas gredzenā un izveidojiet šuves šūšanas gredzenā.
4. Nostipriniet vārstuli ar šuvēm, izmantojot atbilstošu šuvju uzlikšanas metodi. Lai nepieļautu iespējamu problēmu rašanos, skatiet
sadaļu 4. nod., Brīdinājumi un piesardzības pasākumi, 82. lapa.
5. Pārgrieziet šuves griešanas punktā, kas norādīts ar balto bultiņu, lai atbrīvotu turētāju (7. att.). Uzmanīgi atvelciet rokturi no
vārstuļa, lai noņemtu turētāju.
6. Noņemiet turētāju no roktura un izmetiet turētāju.
84Latviski
Page 85

7. Sasieniet visus mezglus un apgrieziet šuvju diegu galus. Pārliecinieties, vai nav palikuši šuvju diegi. Ja šuvju diegi ir palikuši,
izņemiet tos pirms vārstuļa implantēšanas pabeigšanas.
7 Ārstēšanas individualizācija
Izņemot gadījumus, kad tas ir kontrindicēts, sākotnējā periodā pēc sirds vārstuļa bioprotēzes implantācijas pacientiem ir jāsaņem
antikoagulantu terapija.
Ja pacientam ir paplašināts kreisais priekškambaris, ir agrāk konstatētas trombemboliskas izpausmes vai ir priekškambaru fibrilācija
vai mirgošana, ir jāapsver ilgstošas antikoagulantu vai trombocītu agregāciju kavējošu līdzekļu terapijas iespēja.
8 Informācija pacientu konsultēšanai
Ieteicama pastāvīga medicīniskā apsekošana (vismaz reizi gadā), lai būtu iespējama ar vārstuli saistītu komplikāciju diagnostika un
atbilstoša novēršana.
Pacienti ar vārstuļa bioprotēzi ir pakļauti bakteriēmijas riskam (piemēram, veicot zobārstniecības procedūras). Šiem pacientiem var
būt nepieciešama profilaktiska antibiotiku terapija.
Iesakiet pacientiem vienmēr nēsāt līdzi Medtronic nodrošināto implantētās ierīces identifikācijas karti.
9 Piegādes informācija
9.1 Iepakojums
Avalus bioprotēze ir ķīmiski sterilizēta un tiek piegādāta sterila buferētā 0,2% glutāraldehīda šķīdumā. Izstrādājums nav sterils, ja
stikla trauks un tvertne ar vāku ir atvērta vai bojāta. Tvertnes ārpuse nav sterila. Nenovietojiet to uz sterilas virsmas.
9.2 Uzglabāšana
Avalus bioprotēze ir jāglabā vietā, kur temperatūra ir no 5°C līdz 25°C (no 41°F līdz 77°F). Uzglabāšana ledusskapī nav nepieciešama,
un sasaldēšana var sabojāt vārstuli. Uzglabāšana istabas temperatūrā līdz 25°C (77°F) ir pietiekama. Nepakļaujiet vārstuli tiešu
saules staru vai citu ultravioleto staru iedarbībai un nenovietojiet to vietā, kur iespējamas krasas temperatūras svārstības.
Veiciet atbilstošu krājumu kontroli tā, lai vispirms tiek implantētas bioprotēzes, kuru derīguma termiņš beidzas ātrāk, tādējādi
izvairoties no derīguma termiņa noilguma.
9.3 Izņemto bioprotēžu atdošana atpakaļ
Ja vēlaties pieprasīt izstrādājuma atpakaļatgriešanas komplektu un atgriezt izņemto bioprotēzi, lai veiktu tās analīzi vai atbrīvotos no
tās, sazinieties ar uzņēmuma Medtronic tirdzniecības pārstāvi. Ja komplekts nav pieejams, eksplantētā bioprotēze tūdaļ pēc
izņemšanas ir jāievieto tvertnē ar glutāraldehīdu vai 10% buferētu formalīnu. Lai iegūtu papildu norādījumus par ierīces
atpakaļatgriešanu, sazinieties ar Medtronic tirdzniecības pārstāvi.
10 Informācija par pacientu
10.1 Informācija par reģistrāciju
Piezīme: pacientu reģistrācija neattiecas uz valstīm, tostarp arī uz Eiropas Savienības valstīm, kurās likumi par pacienta privātās
dzīves aizsardzību neļauj sniegt informāciju par pacientu.
Katrā izstrādājuma iepakojumā ir iekļauta pacienta reģistrācijas veidlapa. Pēc implantēšanas, lūdzu, ierakstiet visu pieprasīto
informāciju. Nosūtiet oriģinālo veidlapu uz uzņēmuma Medtronic adresi, kas norādīta veidlapā. Pacientam pirms izrakstīšanas
izsniedziet pagaidu identifikācijas karti.
Pacientam ir paredzēta implantētās ierīces identifikācijas karte. Šajā kartē ir norādīts pacienta ārsta vārds un tālruņa numurs, kā arī
informācija, kas medicīnas darbiniekiem varētu būt nepieciešama ārkārtas gadījumā.
11 Informācija par pēcoperācijas periodu
11.1 Savietojamība ar magnētiskās rezonanses attēlveidošanas (MRI) iekārtām
Avalus bioprotēze (modelis 400) ir droša lietošanai magnētiskās rezonanses (MR) vidē. Vārstulis nesatur metālu, tāpēc nerada
apdraudējumu MR vidē.
MR attēldiagnostikas izmeklējumus ar 3,0 T un 1,5 T var veikt tūlīt pēc implantēšanas. Ja vārstulis tiek pakļauts MR attēldiagnostikas
izmeklējumam, tas nerada apdraudējumu pacientam.
85 Latviski
Page 86

11.2 Attēla artefakti
Ja izmeklējuma apgabals sakrīt ar vārstuļa novietojumu vai atrodas tuvu tam, ir iespējama MR attēla kvalitātes pasliktināšanās. Ja
nepieciešams, optimizējiet MR attēldiagnostikas parametrus atbilstoši vārstuļa klātbūtnei.
12 Piederumi
Lai noteiktu atbilstošo Avalus bioprotēzes izmēru, izmantojiet tikai Avalus izmēra noteicējus (modelis 7400S) un Medtronic vārstuļa
rokturi (modelis 7420).
Uzmanību! Nelietojiet izmēra noteicējus vai turētājus, kamēr tie nav rūpīgi notīrīti un sterilizēti. Papildu norādījumus skatiet
attiecīgajās lietošanas pamācībās.
Uzmanību! Lai noteiktu Avalus bioprotēzes izmēru, nelietojiet citu ražotāju vārstuļu izmēra noteicējus vai citām Medtronic protēzēm
paredzētus izmēra noteicējus.
13 Garantijas atruna
TURPMĀK APRAKSTĪTĀ GARANTIJAS ATRUNA ATTIECAS UZ PIRCĒJIEM ĀRPUS AMERIKAS SAVIENOTĀJĀM VALSTĪM.
KAUT ARĪ AVALUS BIOPROTĒZES MODELIS 400 (TURPMĀK TEKSTĀ — “IZSTRĀDĀJUMS”), IR RŪPĪGI IZSTRĀDĀTS,
RAŽOTS UN PIRMS PĀRDOŠANAS TESTĒTS, ŠIS IZSTRĀDĀJUMS DAŽĀDU IEMESLU DĒĻ SAVAS FUNKCIJAS VAR
NEVEIKT PIETIEKAMI LABI. BRĪDINĀJUMI UZ IZSTRĀDĀJUMA MARĶĒJUMA SNIEDZ PLAŠĀKU INFORMĀCIJU UN IR
UZSKATĀMI PAR ŠĪS GARANTIJAS ATRUNAS NEATŅEMAMU DAĻU. TĀDĒĻ UZŅĒMUMS MEDTRONIC NESNIEDZ NE
TIEŠAS, NE ARĪ NETIEŠAS GARANTIJAS ATTIECĪBĀ UZ ŠO IZSTRĀDĀJUMU. UZŅĒMUMS MEDTRONIC NAV ATBILDĪGS
PAR JEBKĀDIEM NEJAUŠIEM VAI IZRIETOŠIEM KAITĒJUMIEM, KO IR IZRAISĪJUSI IZSTRĀDĀJUMA IZMANTOŠANA, TĀ
DEFEKTS VAI KĻŪME NEATKARĪGI NO TĀ, VAI PRASĪBA KOMPENSĒT KAITĒJUMU IZRIET NO GARANTIJAS, LĪGUMA,
LIKUMĀ NOTEIKTAJIEM ATLĪDZINĀMAJIEM KAITĒJUMIEM VAI CITIEM APSTĀKĻIEM.
Iepriekš minētie izņēmumi un ierobežojumi nav domāti un nav tulkojami tā, lai būtu pretrunā ar atbilstošās likumdošanas obligātajām
prasībām. Ja kāda kompetentas jurisdikcijas tiesa nosaka, ka kāda šīs GARANTIJAS ATRUNAS daļa vai noteikums ir pretlikumīgs,
neīstenojams vai pretrunā ar piemērojamo likumu, tas neietekmē pārējās šīs GARANTIJAS ATRUNAS daļas, un visas tiesības un
saistības ir jāskaidro un jāīsteno tā, it kā GARANTIJAS ATRUNĀ nebūtu par nederīgu uzskatītās daļas vai noteikuma.
86Latviski
Page 87

1 Опис на помагалото
3
2
1
4
5
Биопротезата Avalus, модел 400, се состои од основна рамка покриена со полиестер и структура на трилисна потпорна
рамка обликувана според геометријата на трилистен залисток. Основната рамка и трилисната потпирна рамка се
обликувани со инјектирање на материјал полиетеретеркетон (ПЕЕК). Материјалот ПЕЕК на основната рамка е
импрегниран со бариум сулфат за да може да се прави радиографска визуелизација. Листовите се ласерски исечени од
говедско ткиво и се вкрстени во пуфериран глутаралдехид. Листовите се вметнати помеѓу трилисната потпорна рамка и
основната рамка, а потоа компонентите се цврсто сошиени заедно. Прстен за сошивање направен од полиестерско платно
е интегриран во навлаката на делот за дотек на основната рамка за да може корисникот да ја сошие и смести биопротезата
Avalus во позиција над прстенот. Маркерите за шиење се наоѓаат на прстенот за сошивање во средишниот синусен дел од
секој врв за да се обележи еднакво растојание за шевовите на имплантот (Сл. 1). Држач за еднократна употреба е закачен
за делот за истек на залистокот за да се олесни имплантацијата. Аортната биопротеза (залисток) е третирана со процес на
антиминерализација со алфа амино олеинска киселина (AOA) што покажа дека се олеснува калцификацијата на свински
листови во студии правени врз животни.
Држачот за еднократна употреба е дизајниран да одговара на рачката за залистоци за повеќекратна употреба на Medtronic,
модел 7420. Држачот има една точка за сечење за отстранување на држачот од залистокот. Мерила со два краја се
користат за да се избере соодветната големина на залистокот. Крајот на цилиндарот ја претставува шуплината на
залистокот. Крајот на копијата ја имитира геометријата на протезата.
Табела 1. Достапни големини и дијаметри на прстенот за сошивање (номинални вредности во милиметри)
Големина 19 mm 21 mm 23 mm 25 mm 27 mm 29 mm
(1) Дијаметар на стентот - ДПТ (TAD) 19 21 23 25 27 29
(2) Внатрешен дијаметар на шуплината 17,5 19,5 21,5 23,5 25,5 27,5
(2a) Внатрешен дијаметар на шуплината
(3) Надворешен дијаметар на прстенот за сошивање 27,0 29,0 31,0 33,0 36,0 38,0
(4) Висина на профилот на залистокот 13,0 14,0 15,0 16,0 17,0 18,0
(5) Испакнат дел на аортата 11,0 12,0 13,0 14,0 15,0 16,0
a
18 20 22 24 26 28
Забелешка: ДПТ—дијаметар на прстенот од ткиво
a
Мерењата покажуваат рамка на стент вклучително ткиво (2) и рамка на стент без ткиво (2a)
2 Индикации за употреба
Биопротезата Avalus е наменета за замена на заболен, оштетен или нефункционален природен или протетички аортен
залисток.
3 Контраиндикации
Не користете го залистокот ако неговaта употреба не е во најдобар интерес на пациентот. Проценете ги сите можни ризици,
вклучувајќи ги и анатомијата и патологијата забележани за време на операцијата.
4 Предупредувања и мерки на претпазливост
4.1 Предупредувања
• Ова помагало е наменето само за еднократна употреба. Уредот не треба да се употребува, обработува или стерилизира
повторно. Повторната употреба, подготовка или стерилизација може да го загрозат структурниот интегритет на уредот
или може да создадат ризик од контаминација на помагалото, што пак може да предизвика повреда, болест или смрт
на пациентот.
• Не стерилизирајте го повторно залистокот со каков било метод. Изложувањето на залистокот и на кутијата на
зрачење, на пареа, етилен оксид или друго хемиско средство за стерилизација ќе го направи залистокот несоодветен
за употреба.
• Проверете го показателот на температурата на превоз во картонската кутија. Ако прозорецот на показателот на
температурата е црн, залистокот не е соодветен за клиничка употреба.
87 Македонски
Page 88

• Не користете го залистокот во кои било од следниве околности:
– Залистокот бил испуштен, оштетен или неправилно се ракувало со него на кој било начин
– Поминал датумот до кој требало да се искористи
– Оштетени се сите ленти за заштита од оштетување
– Ознаката на серискиот број не одговара на бројот на етикетата на кутијата
– Растворот за чување од глутаралдехид не го покрива целосно залистокот или од амбалажата истекува течност
– Залистокот покажува знаци на распаѓање
• Не користете инструменти на делот на залистокот со ткиво. Треба да се води особена грижа да се спречи оштетување
на деликатното ткиво на залистокот. Дури и најмала перфорација може да се зголеми со тек на време и значително да
ја загрози функцијата на залистокот.
• Не обидувајте се да поправите оштетен залисток. Не смее да се користи оштетен залисток.
• Не додавајте антибиотици или други средства во растворот за чување или во растворот за плакнење.
• Не обидувајте се да вметнете залисток што е преголем за прстенот. Изберете залисток што ќе се вклопи безбедно во
аортниот корен без да ја деформира изворната анатомија на биопротезата Avalus.
• Не користете калибратори за залисток од други производители или калибратори од друга протеза на Medtronic за да ја
определите големината на залистокот.
• Не дозволувајте да се исуши залистокот. Во текот на имплантирањето, за да не се исуши ткивото на залистокот,
периодично влажнете го залистокот со стерилен нормален физиолошки раствор.
4.2 Мерки на претпазливост
• Внимателно размислете за потенцијалните опасности кога избирате соодветна замена за залистокот:
– Калцификацијата може да предизвика забрзано дегенерирање на залистокот кај пациенти со изменет метаболизам
за калциум (на пример, хронична бубрежна инсуфициенција, хиперпаратироидизам).
– Калцификација може да настане порано кај деца, адолесценти или помлади возрасни лица.
– Прерана калцификација може да настане и кај постари возрасни лица кои прифаќаат биолошка протеза.
– Кај пациенти со биопротеза, на кои им е потребна хронична антикоагулација, има поголем ризик од крвавење.
• Не ставајте ја нестерилната надворешност на кутијата на залистокот во стерилното поле.
• Не користете ги калибраторите Avalus, модел 7400S или рачката за залисток на Medtronic, модел 7420, додека не ги
исчистите и стерилизирате темелно. Прочитајте го соодветното упатство за употреба за дополнителни упатства.
• Кога избирате големина на залисток, земете ја предвид анатомијата на пациентот и изберете залисток што
адекватно ги задоволува хемодинамичките барања на пациентот.
• Не имплантирајте залисток без да ги завршите соодветните постапки за плакнење.
• Насочете ги местата за стентот и сместете го залистокот така што нема да ги попречува срцевите отвори.
• Избегнувајате да дојде до контакт на залисокот или на растворот за плакнење со крпи, платно или други извори што
може да пренесат честички на ткивото на листовите.
• Пред да ставите шев, идентификувајте го делот за дотек и за истек на залистокот.
• Внимавајте кога ги правите шевовите низ прстенот за шиење за да не дојде до повреда на ткивото на листовите. Ако се
оштети ткивото на листовите, залистокот мора да се извади и да се замени.
• Не користете игли за сечење, незаштитена пинцета или остри инструменти што може да предизвикаат структурално
оштетување на залистокот.
• Земете го предвид потенцијалот за оштетување пред да ги вметнувате преку залистокот катетерите, хируршките
инструменти и трансвенските водови за стимулација.
• Кога користите прекинати шевови, важно е да ги пресечете шевовите близу до јазлите. Внимавајте изложените краеви
на шевовите да не дојдат во контакт со ткивото на листовите.
• Не виткајте ги порабите на биопротезата кога ги врзувате јазлите.
• Не ракувајте со ткивото на листовите.
• Избегнувајте подолг контакт со растворот за чување на залистокот. Глутаралдехидот може да ги иритира очите, носот,
кожата и грлото при подолготрајна изложеност. Избегнувајте долготрајна изложеност или вдишување на хемиското
испарување. Да се користи само со соодветна вентилација. Ако дојде до контакт со кожата, веднаш измијте ја
зафатената област со обилен млаз вода во времетраење од 10 до 15 минути. Ако дојде до контакт со очите, измијте го
окото со млаз вода во времетраење од 15 минути и побарајте итна медицинска помош.
5 Потенцијални несакани појави
Несаканите појави потенцијално поврзани со користењето биопротетички срцеви залистоци опфаќаат:
88Македонски
Page 89

• Ангина
• Срцеви дисритмии
• Ендокардит
• Срцева инсуфициенција
• Хемолиза
• Хемолитична анемија
• Крвавење, поврзано со антикоагуланти/антитромботици
• Течење, трансзалисно или паразалисно
• Миокарден инфаркт
• Неструктурална дисфункција (противречност/нарушување на листовите, опструктивен раст на панус, дехисценција на
шевовите, несоодветно одредување на големината, како и друго)
• Исфрлање на протезата
• Мозочен удар
• Структурално опаѓање (калцификација, кинење на листовите, стеноза, како и друго)
• Тромбоемболија
• Тромбоза на залистокот
Овие компликации може да доведат до:
• Повторна операција
• Вадење на имплантираната биопротеза
• Трајна онеспособеност
• Смрт
6 Упатство за употреба
6.1 Упатство за ракување и подготвување
Изборот на соодветна големина е од клучно значење при замена на срцевиот залисток. Користете калибратори Avalus,
модел 7400S за да изберете биопротеза Avalus со соодветна големина. За дополнителни информации, прочитајте го
упатството за употреба.
Надворешноста на кутијата и на капакот се нестерилни. Залистокот и сите компоненти од пакувањето во кутијата се
стерилни и мора со нив да се ракува во рамките на стерилното поле за работа.
1. Подгответе 2 сада за плакнење со по 500 ml стерилен нормален физиолошки раствор.
2. Проверете ги лентите за заштита од оштетување за да бидете сигурни дека кутијата не е оштетена или дека не била
претходно отворена. Не користете го залистокот ако се оштетени сите ленти за заштита од оштетување.
3. Завртете го капакот налево и отворете ја кутијата (Сл. 2).
4. Држете го прицврстувачот со палецот и со показалецот. Подигнете го залистокот од кутијата овозможувајќи да се
процедува глутаралдехидниот раствор за складирање (Сл. 3).
5. Проверете дали серискиот број на прицврстувачот се совпаѓа со серискиот број на капакот на кутијата, картонската
кутија и Образецот за регистрација на пациенти. Забележете го серискиот број во медицинскиот картон на пациентот
користејќи ги налепниците што се наоѓаат на Образецот за регистрација на пациенти.
6. Држете го прицврстувачот исправен. Држејќи го со палецот и показалецот, извадете го капакот на прицврстувачот
вртејќи го налево (Сл. 4). Држачот ќе биде видлив.
7. Вметнете стерилна рачка во држачот. Вртете ја рачката надесно во направениот отвор за држачот додека не се
почувствува отпор (Сл. 5).
8. Повлечете ја нагоре рачката за да го извадите залистокот од прицврстувачот (Сл. 6).
6.2 Постапка за плакнење
1. Ставете го целиот залисток со држач во садовите за плакнење (Сл. 6).
2. Користете ја рачката за постојано да го агитирате залистокот во времетраење од најмалку 30 секунди.
3. Нежно стиснете го прстенот за шиење за да го отстраните остатокот од глутаралдехид. Не допирајте го делот на
залистокот со ткиво.
4. Ставете го залистокот во вториот сад. Чувајте го залистокот во садот додека не го побара хирургот.
89 Македонски
Page 90

6.3 Имплантирање на аортниот залисток
Бипротезата Avalus е наменета за имплантирање во позиција над прстенот. Користете калибратори Avalus, модел 7400S,
за да го визуелизирате ставањето на ракавот за шиење над прстенот и за да го потврдите ставањето и сместувањето на
залистокот во просторот над прстенот.
Изборот на хируршката техника ја прави хирургот кога ќе го имплантира залистокот во просторот над прстенот. Секоја
модификувана техника треба да е во согласност со Поглавје 4, Предупредувања и мерки на претпазливост, страница 87.
Општо земено, следете ги овие чекори:
1. Насочете го залистокот така што стентот и прстенот за шиење нема да ги попречуваат срцевите отвори.
2. Периодично влажнете го залистокот со стерилен нормален физиолошки раствор за да не се исуши деликатното ткиво.
3. Позиционирајте го залистокот во прстенот и ставете ги шевовите во прстенот за шиење.
4. Зашијте го залистокот на конкретната позиција користејќи соодветна техника за ставање шевови. Земете ги предвид
Поглавје 4, Предупредувања и мерки на претпазливост, страница 87 за да избегнете потенцијални проблеми.
5. Исечете ги шевовите на единственото место за сечење назначено со белата стрелка за да го отпуштите држачот
(Сл. 7). Полека повлечете оддалечувајќи ја рачката од залистокот за да го извадите држачот.
6. Извадете го држачот од рачката и фрлете го држачот.
7. Врзете ги сите јазли и поткастрете ги краевите на шевовите. Погрижете се да нема остатоци од шевовите. Ако има
остатоци од шевовите, извадете ги пред да го завршите имплантирањето на залистокот.
7 Индивидуализација на третман
Освен кога постојат контраиндикации, во текот на почетните фази по имплантацијата, пациентите што добиваат
биопротетички срцев залисток треба да примаат терапија со антикоагуланси.
Имајте предвид да им давате долгорочна антикоагулантна или антитромбоцитна терапија на пациентите со проширена
лева преткомора, историја на тромбоемболитични настани или срцев ритам на преткоморна фибрилација или треперење.
8 Информации за советување на пациентот
Се препорачува постојано медицинско следење на состојбата (најмалку еднаш годишно) за да може да се дијагностицираат
и соодветно да се лекуваат компликациите во врска со залистокот.
Пациентите со биопротетички залисток се изложени на ризик од бактеремија (на пример, кога им се прават стоматолошки
интервенции). Советувајте го пациентот за примање профилактичка антибиотска терапија.
Охрабрете ги пациентите постојано да ја носат со себе Картичката за идентификација на вградено помагало што ја
добиваат од Medtronic.
9 Начин на испорака
9.1 Пакување
Биопротезата Avalus е хемиски стерилизирана и се доставува стерилизирана во пуфериран раствор на глутаралдехид од
0,2%. Стерилноста е загрозена ако кутијата со стаклен сад и капак е отворена или оштетена. Надворешноста на кутијата
не е стерилна. Не ставајте ја во стерилното поле.
9.2 Чување
Чувајте ја биопротезата Avalus меѓу 5°C и 25°C (41°F и 77°F). Нема потреба да се чува во фрижидер, а со замрзнување може
да дојде до оштетување на залистокот. Доволно е да се складира на собна температура од 25°C (77°F). Залистокот не треба
да се изложува на сончева светлина или на други извори на ултравиолетова светлина или да се става онаму каде што има
значителни промени во температурата.
Одржувајте соодветна контрола на залихите за да може да се имплантираат прво биопротезите чиј рок на употреба
истекува побрзо за да се избегне истекување на рокот на траење.
9.3 Враќање на експлантирани биопротези
Контактирајте со претставник за продажба на Medtronic за да побарате враќање на комплет за производ за да ја вратите
експлантираната биопротеза за анализа и фрлање. Ако немате на располагање комплет, ставете ја експлантираната
биопротеза во сад исполнет со глутаралдехид или пуфериран формалин од 10% веднаш по експлантацијата. За
дополнителни упатства, контактирајте со претставникот за продажба на Medtronic.
90Македонски
Page 91

10 Информации за пациентот
10.1 Информации за регистрација
Забелешка: Регистрацијата на пациенти не важи за земји во кои законите за приватноста на пациентите се во конфликт
со давањето информации за пациентот, вклучувајќи и земји од Европската унија.
Во секое пакување на помагалото е вклучен и образец за регистрација на пациенти. По вградувањето, пополнете ги сите
потребни информации. Вратете го изворниот образец на адресата на Medtronic наведена на образецот. Пред да го
отпуштите, дајте му на пациентот привремена идентификациска картичка.
На пациентот му се дава Идентификациска картичка за имплантирано помагало. На картичката се наведени името и
телефонскиот број на лекарот на пациентот, како и информации што би му биле потребни на медицинскиот персонал во
итен случај.
11 Постоперативни информации
11.1 Компатибилност со томографијата со магнетна резонанција
Биопротезата Avalus, модел 400, е безбедна за правење томографија со магнетна резонанција. Залистокот не содржи
метал и затоа не се познати опасности во врска со него што би се појавиле при правење магнента резонанција.
Скенирањето со магнетна резонанција на 3,0 T и 1,5 T може да се прави веднаш по имплантацијата. Залистокот нема да му
предизвика штета на пациентот кога е изложен на скенирање со магнентна резонанција.
11.2 Томографски артефакт
Квалитетот на томографијата со магнетна резонанција може да биде намален ако се скенира на или во близина на
позицијата на залистокот. Ако има потреба, оптимизирајте ги параметрите за правење томографија со магнетна
резонанција поради присуството на залисток.
12 Дополнителна опрема
Користете ги само калибраторите Avalus, модел 7400S, и рачката на залистокот Medtronic, модел 7420, за да ја утврдите
соодветната големина на биопротезата Avalus.
Опомена: Не користете ги калибраторите или рачките пред да се исчистат темелно и да се стерилизираат. Прочитајте го
соодветното упатство за употреба за дополнителни упатства.
Опомена: Не користете калибратори за залисток од други производители или калибратори од друга протеза на Medtronic
за да ја определите големината на биопротезата Avalus.
13 Одрекување од одговорност во однос на гаранцијата
СЛЕДНОТО ОГРАНИЧУВАЊЕ НА ГАРАНЦИЈАТА ВАЖИ ЗА КОРИСНИЦИ НАДВОР ОД СОЕДИНЕТИТЕ
АМЕРИКАНСКИ ДРЖАВИ:
ИАКО БИОПРОТЕЗАТА AVALUS, МОДЕЛ 400, ПОНАТАМУ ВО ТЕКСТОТ НАРЕЧЕНА „ПРОИЗВОДОТ“, Е ВНИМАТЕЛНО
ДИЗАЈНИРАНА, ПРОИЗВЕДЕНА И ТЕСТИРАНА ПРЕД ПРОДАЖБАТА, СЕПАК, ОД РАЗЛИЧНИ ПРИЧИНИ, МОЖЕ ДА
СЕ СЛУЧИ ПРОИЗВОДОТ ДА НЕ ЈА ИЗВРШИ ЗАДОВОЛИТЕЛНО ПРЕДВИДЕНАТА ФУНКЦИЈА.
ПРЕДУПРЕДУВАЊАТА ОЗНАЧЕНИ НА ЕТИКЕТАТА НА ПРОИЗВОДОТ СОДРЖАТ ПОДЕТАЛНИ ИНФОРМАЦИИ И СЕ
СМЕТААТ ЗА СОСТАВЕН ДЕЛ ОД ОВА ОГРАНИЧУВАЊЕ НА ГАРАНЦИЈАТА. MEDTRONIC, ПОРАДИ ОВА, СЕ
ОТКАЖУВА ОД СИТЕ ИЗРЕЧНИ И ИМПЛИЦИРАНИ ГАРАНЦИИ ВО ОДНОС НА ОВОЈ ПРОИЗВОД. MEDTRONIC НЕМА
ДА БИДЕ ОДГОВОРНА ЗА КАКВИ БИЛО СЛУЧАЈНИ ИЛИ ПОСЛЕДИЧНИ ОШТЕТУВАЊА ПРЕДИЗВИКАНИ ОД
УПОТРЕБА, ДЕФЕКТ ИЛИ НЕФУНКЦИОНИРАЊЕ НА ПРОИЗВОДОТ, БЕЗ ОГЛЕД НА ТОА ДАЛИ БАРАЊЕТО СЕ
ЗАСНОВА НА ГАРАНЦИЈА, ДОГОВОР, ПРЕКРШОК ИЛИ НА НЕШТО ДРУГО.
Горенаведените исклучоци и ограничувања немаат за цел и не треба да се толкуваат како спротивни на задолжителните
законски одредби на важечкиот закон. Доколку надлежен суд смета дека некој дел од ова ОГРАНИЧУВАЊЕ НА
ГАРАНЦИЈАТА е незаконски, неспроведлив или спротивен на законските одредби, тоа нема да влијае врз останатите
делови од ова ОГРАНИЧУВАЊЕ НА ГАРАНЦИЈАТА, а сите права и обврски ќе се толкуваат и ќе се спроведуваат како ова
ОГРАНИЧУВАЊЕ НА ГАРАНЦИЈАТА да не го содржело конкретниот дел или термин кој се смета за неважечки.
91 Македонски
Page 92

1 Productbeschrijving
3
2
1
4
5
De Avalus-bioprothese, Model 400, bestaat uit een met polyester bedekt basisframe en een driebladige draagframeconstructie, die
is gevormd naar de geometrie van een driebladige klep. Het basisframe en het driebladige draagframe zijn spuitgegoten met gebruik
van polyetheretherketon (PEEK). Het PEEK-materiaal van het basisframe wordt geïmpregneerd met bariumsulfaat om radiografische
visualisatie mogelijk te maken. De bladen zijn met laser gesneden van bovine weefsel en zijn gecrosslinkt in gebufferde
glutaaraldehyde. De bladen zijn tussen het driebladig draagframe en het basisframe ingevoegd. Vervolgens zijn alle componenten
goed aan elkaar gehecht. In het omhulsel van het instroombasisframe is een inhechtingsring, vervaardigd van polyester doek,
geïntegreerd zodat de gebruiker de Avalus-bioprothese kan hechten en deze in de supra-annulaire positie kan plaatsen. Op de
inhechtingsring zijn in het midden van het sinusgebied van elk klepblad hechtmarkeringen aangebracht als hulp om een gelijkmatige
afstand te houden tussen de implantaathechtdraden (Afbeelding 1). Bij de uitstroom van de klep is een wegwerphouder bevestigd om
implantatie te vergemakkelijken. De aortabioprothese (klep) heeft een antimineralisatieproces met een alfa-amino-oliezuur (AOA)
ondergaan waarvan in dierproeven aangetoond is dat het verkalking van porcine klepbladen tegengaat.
De wegwerphouder is zodanig ontworpen dat deze op het herbruikbare klephandvat Model 7420 van Medtronic past. De houder heeft
een enkel snijpunt om de houder van de klep te scheiden. Om de juiste maat klep te kiezen, worden sizers met dubbel uiteinde
gebruikt. Het cilinderuiteinde is gelijk aan de klepopening. Het replica-uiteinde heeft dezelfde vorm als de prothese.
Tabel 1. Verkrijgbare maten en inhechtingsringdiameters (nominale waarden in millimeter)
Maat 19 mm 21 mm 23 mm 25 mm 27 mm 29 mm
(1) Stentdiameter (TAD) 19 21 23 25 27 29
(2) Diameter binnenopening 17,5 19,5 21,5 23,5 25,5 27,5
(2a) Diameter binnenopening
(3) Diameter externe inhechtingsring 27,0 29,0 31,0 33,0 36,0 38,0
(4) Profielhoogte klep 13,0 14,0 15,0 16,0 17,0 18,0
(5) Aorta-uitstulping 11,0 12,0 13,0 14,0 15,0 16,0
a
18 20 22 24 26 28
Opmerking: TAD—Weefselannulusdiameter
a
De metingen tonen een stentframe inclusief weefsel (2) een stentframe exclusief weefsel (2a)
2 Indicaties voor gebruik
De Avalus-bioprothese is geïndiceerd voor de vervanging van een zieke, beschadigde of slecht functionerende natieve aortaklep of
klepprothese.
3 Contra-indicaties
De klep mag niet worden gebruikt als dit niet in het belang van de patiënt is. Beoordeel alle risico’s, waaronder de tijdens de operatie
waargenomen anatomie en pathologie.
4 Waarschuwingen en voorzorgsmaatregelen
4.1 Waarschuwingen
• Dit product is uitsluitend bedoeld voor eenmalig gebruik. Dit product niet hergebruiken, herverwerken of hersteriliseren. Door
hergebruik, herverwerking of hersterilisatie kan de structuur van het product worden aangetast of kan besmettingsgevaar
optreden, hetgeen kan resulteren in letsel, ziekte of overlijden van de patiënt.
• De klep mag op geen enkele wijze worden gehersteriliseerd. Blootstelling van de klep en de container aan straling, stoom,
ethyleenoxide of andere chemische sterilisatiemiddelen maakt de klep ongeschikt voor gebruik.
• Controleer de transport-temperatuurindicator binnenin de kartonnen verpakking. Als de transport-temperatuurindicator
zwartgekleurd is, is de klep ongeschikt voor klinisch gebruik.
• Gebruik de klep niet in volgende gevallen:
– De klep is gevallen, beschadigd of op andere wijze verkeerd gebruikt
– De uiterste gebruiksdatum is verstreken
– Alle verzegelingen zijn beschadigd
– Het label met het serienummer komt niet overeen met het nummer op het etiket van de container
92Nederlands
Page 93

– De glutaaraldehydeoplossing bedekt de klep niet volledig of er lekt vloeistof uit de verpakking
– De klep vertoont tekenen van achteruitgang
• Het weefselgedeelte van de klep mag niet met instrumenten worden gehanteerd. Er dient buitengewoon zorgvuldig te worden
gewerkt om te voorkomen dat het kwetsbare klepweefsel beschadigd raakt. Zelfs een kleine perforatie kan na verloop van tijd
groter worden, waardoor het functioneren van de klep aanzienlijk verslechtert.
• Probeer een beschadigde klep niet te repareren. Een beschadigde klep mag niet worden gebruikt.
• Voeg geen antibiotica of andere stoffen toe aan de bewaaroplossing of de spoeloplossing.
• Implanteer nooit een klep die te groot is voor de annulus. Kies een klep die goed past in de aortawortel zonder dat de natieve
anatomie of de Avalus-bioprothese vervormd raakt.
• Gebruik geen klepsizers van andere fabrikanten of sizers voor andere prothesen van Medtronic om de maat van de klep te
bepalen.
• Laat de klep niet uitdrogen. Om uitdroging van het klepweefsel te voorkomen, dient de klep tijdens de implantatie regelmatig met
steriele normale zoutoplossing te worden natgemaakt.
4.2 Voorzorgsmaatregelen
• Neem deze potentiële gevaren dan ook zorgvuldig in overweging bij het kiezen van een geschikte klepprothese:
– Door verkalking kan de klep sneller slijten bij patiënten met een veranderde calciumstofwisseling (bijvoorbeeld chronisch
nierfalen, hyperparathyreoïdie).
– Verkalking kan vroeger optreden bij kinderen, tieners of jonge volwassenen.
– Vroegtijdige verkalking kan ook optreden bij oudere patiënten met een biologische prothese.
– Patiënten met een bioprothese die chronische antistolling nodig hebben, lopen een verhoogd risico op bloedingen.
• Plaats de niet-steriele buitenkant van de klepcontainer niet in het steriele veld.
• Gebruik de Avalus-sizers, Model 7400S, of de het klephandvat, Model 7420, van Medtronic niet voordat ze grondig zijn gereinigd
en gesteriliseerd. Raadpleeg de desbetreffende gebruiksaanwijzing voor meer informatie.
• Bij de keuze van de maat van de klep is het noodzakelijk de anatomie van de patiënt in overweging te nemen en een
klep te kiezen die aan de hemodynamische eisen van de patiënt voldoet.
• Implanteer een klep niet zonder de gepaste spoelprocedures te voltooien.
• Oriënteer de stentposten en plaats de klep op een dergelijke manier dat de coronaire ostia niet worden geblokkeerd.
• Vermijd aanraking met de klep of de spoeloplossing met doeken, linnen of andere bronnen die deeltjes op het bladweefsel kunnen
overbrengen.
• Stel voorafgaand aan het vasthechten de in- en uitstroom van de klep vast.
• Ga voorzichtig te werk bij het plaatsen van hechtingen door de inhechtingsring teneinde scheuren in het bladweefsel te
voorkomen. Als het bladweefsel beschadigd is, moet dit worden geëxplanteerd en vervangen.
• Gebruik geen snijnaalden, onbeschermde klemmen of scherpe instrumenten die structurele schade aan de klep kunnen
veroorzaken.
• Houd rekening met het risico van beschadiging voordat u katheters, chirurgische instrumenten en transveneuze
stimulatiegeleidingsdraden door de klep opvoert.
• Bij geknoopte hechtingen is het belangrijk om de hechtingen dicht bij de knoop door te snijden. Let erop dat de uiteinden van de
hechtdraden het klepweefsel niet raken.
• Buig de bioprothesecommissuren niet als u knopen maakt.
• Hanteer het klepweefsel niet.
• Vermijd langdurig contact met de bewaaroplossing voor de klep. Langdurige blootstelling aan glutaaraldehyde kan leiden tot
irritatie van huid, ogen, neus en keel. Vermijd langdurige blootstelling aan of inademing van de chemische damp. Zorg tijdens
gebruik steeds voor voldoende ventilatie. In geval van huidcontact moet het desbetreffende huidoppervlak onmiddellijk
gedurende 10 tot 15 minuten overvloedig met water worden gespoeld. Bij aanraking met de ogen moet het oog 15 minuten lang
met water worden gespoeld en moet onmiddellijk medische hulp worden ingeroepen.
5 Potentiële ongewenste neveneffecten
Bijwerkingen die bij het gebruik van bioprothesehartkleppen kunnen optreden, zijn onder meer:
• Angina
• Hartdysritmieën
• Endocarditis
• Hartfalen
• Hemolyse
• Hemolytische anemie
93 Nederlands
Page 94

• Bloeding, verband houdend met antistollingstherapie/trombocytenaggregatieremmers
• Lekkage, transvalvulair of paravalvulair
• Myocardinfarct
• Niet-structurele disfunctie (bekneld raken/inklemming van de klepbladen, obstructieve pannusingroei, loslating van hechtingen,
verkeerde maat, andere oorzaken)
• Protheseregurgitatie
• Beroerte
• Structurele achteruitgang (bijvoorbeeld verkalking, scheuren in de klepbladen, stenose, andere oorzaken)
• Trombo-embolie
• Kleptrombose
Deze complicaties kunnen leiden tot:
• Nieuwe operatie
• Explantatie van de bioprothese
• Chronische handicap
• Overlijden
6 Gebruiksinstructies
6.1 Instructies voor hantering en voorbereiding
Selectie van de juiste maat is van cruciaal belang bij hartklepvervanging. Selecteer met Avalus-sizers, Model 7400S, de
Avalus-bioprothese van de juiste maat. Raadpleeg de gebruiksaanwijzing voor meer informatie.
De buitenkant van de container en het deksel zijn niet steriel. De klep en alle verpakkingsonderdelen in de container zijn steriel en
moeten binnen het steriele veld worden gehanteerd.
1. Zet 2 spoelbaden klaar, elk met 500 ml steriele fysiologische zoutoplossing.
2. Onderzoek de verzegeling om te controleren of de container niet beschadigd is of al eerder geopend is. Gebruik de klep niet als
alle verzegelingen beschadigd zijn.
3. Draai het deksel linksom en open de container (Afbeelding 2).
4. Houd de koker vast tussen duim en wijsvinger. Til de klep langzaam uit de container, zodat de glutaaraldehyde-oplossing kan
weglopen (Afbeelding 3).
5. Controleer of het serienummer op de koker overeenkomt met het serienummer op het deksel van de container, de doos en het
patiëntenregistratieformulier. Gebruik de stickers op het patiëntenregistratieformulier om het serienummer in het dossier van de
patiënt te registreren.
6. Houd de koker rechtop. Haal de dop van de koker door deze met duim en wijsvinger linksom te draaien (Afbeelding 4). De houder
is nu zichtbaar.
7. Breng een steriel handvat de houder in. Draai het handvat rechtsom de schroefholte van de houder in tot weerstand wordt
gevoeld (Afbeelding 5).
8. Haal de klepprothese uit de koker door het handvat naar boven te trekken (Afbeelding 6).
6.2 Spoelprocedure
1. Plaats de klep en houder helemaal in 1 van de spoelbaden (Afbeelding 6).
2. Gebruik het handvat om de klep gedurende minimaal 30 seconden continu te schudden.
3. Knijp voorzichtig in de inhechtingsring om restanten glutaaraldehyde te verwijderen. Het weefselgedeelte van de klep mag niet
worden aangeraakt.
4. Spoel de klep in het tweede spoelbad. Laat de klep in het spoelbad totdat de chirurg de klep nodig heeft.
6.3 Implantatie van de aortaklep
De Avalus-bioprothese is bedoeld voor implantatie in supra-annulaire positie. Gebruik Avalus-sizers, Model 7400S, om plaatsing van
de inhechtingsring boven de annulus te visualiseren en om plaatsing en pasvorm van de klep in de supra-annulaire ruimte te
controleren.
De keus van de chirurgische techniek is ter beoordeling van de individuele chirurg bij het implanteren in de supra-annulaire positie.
Als u een aangepaste techniek toepast, moet deze in overeenstemming zijn met Hoofdstuk 4, Waarschuwingen en
voorzorgsmaatregelen, blz. 92. In het algemeen dient u deze stappen nemen:
94Nederlands
Page 95

1. Oriënteer de klepprothese zodanig dat de coronaire ostia niet worden geblokkeerd door de stent of de inhechtingsring.
2. Maak de klep dient regelmatig met steriele fysiologische zoutoplossing nat om uitdroging van het kwetsbare weefsel te
voorkomen.
3. Plaats de klep in de annulus en leg de hechtdraden in de inhechtingsring.
4. Hecht de klep op de beoogde locatie vast met een gepaste hechttechniek. Raadpleeg Hoofdstuk 4, Waarschuwingen en
voorzorgsmaatregelen, blz. 92 om potentiële problemen te vermijden.
5. Knip de hechtdraden af bij het enkele snijpunt, dat wordt aangegeven door de witte pijl, om de houder los te laten (Afbeelding 7).
Trek het handvat voorzichtig weg van de klep om de houder te verwijderen.
6. Haal de houder van het handvat af en gooi deze weg.
7. Maak alle knopen vast en kort de uiteinden van de hechtdraden in. Vergewis u ervan dat er geen hechtdraadresten aanwezig zijn.
Verwijder eventuele resten van de hechtingen alvorens de implantatie van de klep af te ronden.
7 Persoonlijke afstemming van de behandeling
Tenzij dit wordt gecontra-indiceerd, dienen patiënten die een bioprothesehartklep ontvangen gedurende de eerste stadia na
implantatie met antistollingsmiddelen te worden behandeld.
Langdurige antistollingsbehandeling of trombocytenaggregatieremmers moeten worden overwogen voor patiënten met een vergroot
linkeratrium, een voorgeschiedenis van trombo-embolische voorvallen of een hartritme met atriumfibrilleren of atriumflutter.
8 Informatie voor patiëntbegeleiding
Een continue medische follow-up (ten minste jaarlijks) wordt aanbevolen zodat complicaties die verband houden met de klep kunnen
worden gediagnosticeerd en goed worden behandeld.
Patiënten met een bioprotheseklep zijn kwetsbaar voor bacteriëmie (bijvoorbeeld door tandheelkundige ingrepen). Informeer de
patiënt over antibioticaprofylaxe.
Raad de patiënt sterk aan om de implantaat-identificatiekaart van Medtronic altijd bij zich te dragen.
9 Leveringswijze
9.1 Verpakking
De Avalus-bioprothese heeft een chemisch sterilisatieproces ondergaan en wordt steriel geleverd in een gebufferde
glutaaraldehyde-oplossing van 0,2%. De steriliteit is niet gewaarborgd als de glazen container met deksel geopend of beschadigd is.
De buitenkant van de container is niet steriel. Niet in het steriele veld plaatsen.
9.2 Opslag
Bewaar de Avalus-bioprothese tussen 5°C en 25°C (41°F en 77°F). Koeling is niet noodzakelijk en door bevriezing kan de klep
beschadigd raken. Opslag bij een kamertemperatuur tot max. 25°C (77°F) is voldoende. Stel de klep niet bloot aan zonlicht of andere
UV-lichtbronnen of aanzienlijke temperatuurschommelingen.
Er dient goed voorraadbeheer te worden toegepast zodat bioprothesen met een eerdere vervaldatum als eerste worden
geïmplanteerd en overschrijding van de vervaldatum wordt voorkomen.
9.3 Retourneren van geëxplanteerde bioprothesen
U kunt bij een Medtronic-vertegenwoordiger een set aanvragen voor het terugzenden van geëxplanteerde bioprotheses voor analyse
en verwerking. Als er geen set beschikbaar is, plaatst u de bioprothese onmiddellijk na explantatie in een bak gevuld met
glutaaraldehyde of 10% gebufferde formaline. Voor nadere instructies over het retourneren kunt u contact opnemen met uw
Medtronic-vertegenwoordiger.
10 Patiëntgegevens
10.1 Informatie over registratie
Opmerking: Patiëntenregistratie is niet van toepassing in landen waar de wetten met betrekking tot privacy van patiënten in conflict
zijn met het verstrekken van patiëntinformatie, inclusief landen binnen de Europese Unie.
In elke verpakking is een patiëntenregistratieformulier ingesloten. Gelieve na implantatie alle gevraagde informatie in te vullen. Stuur
het oorspronkelijke formulier terug naar het adres van Medtronic, dat op het formulier staat vermeld. Geef de patiënt de voorlopige
identificatiekaart mee voordat hij/zij wordt ontslagen.
De patiënt ontvangt een identificatiekaart voor het geïmplanteerde product. Op deze kaart staan de naam en het telefoonnummer van
de arts alsmede andere gegevens die medisch personeel bij noodgevallen nodig kunnen hebben.
95 Nederlands
Page 96

11 Postoperatieve informatie
11.1 Compatibiliteit met MRI (Magnetic Resonance Imaging)
De Avalus-bioprothese, Model 400, is Magnetic Resonance (MR)-veilig. De klep bevat geen metalen en vormt dus geen bekende
risico’s in alle MR-omgevingen.
Meteen na implantatie kan een MR-scan worden uitgevoerd op 3,0 T en 1,5 T. De klep zal geen letsel bij de patiënt veroorzaken als
er een MRI-scan wordt uitgevoerd.
11.2 Beeldartefacten
De kwaliteit van het MR-beeld kan worden aangetast als er wordt gescand op of in de buurt van de kleplocatie. Stem de
MR-scanparameters zo mogelijk fijn af bij deze klep.
12 Toebehoren
Gebruik uitsluitend Avalus-sizers, Model 7400S, en het klephandvat, Model 7420, van Medtronic om de juiste maat voor de
Avalus-bioprothese te bepalen.
Let op: Gebruik de sizers of handvatten niet voordat ze grondig zijn gereinigd en gesteriliseerd. Raadpleeg de desbetreffende
gebruiksaanwijzing voor meer informatie.
Let op: Gebruik geen klepsizers van een andere fabrikant of sizers voor een andere prothese van Medtronic voor het vaststellen van
de maat van een Avalus-bioprothese.
13 Uitsluiting van garantie
DE VOLGENDE UITSLUITING VAN GARANTIE GELDT VOOR KLANTEN BUITEN DE VERENIGDE STATEN:
HOEWEL DE AVALUS-BIOPROTHESE MODEL 400, HIERNA HET "PRODUCT" GENOEMD, MET VEEL ZORG IS
ONTWORPEN, VERVAARDIGD EN VÓÓR DE VERKOOP GETEST, KUNNEN ER VERSCHILLENDE REDENEN ZIJN WAAROM
HET PRODUCT NIET VOLGENS DE SPECIFICATIES WERKT. DE WAARSCHUWINGEN IN DE PRODUCTDOCUMENTATIE
BIEDEN MEER GEDETAILLEERDE INFORMATIE EN VORMEN EEN INTEGRAAL ONDERDEEL VAN DEZE UITSLUITING VAN
GARANTIE. MEDTRONIC VERLEENT DAAROM GEEN ENKELE GARANTIE, NOCH EXPLICIET NOCH IMPLICIET, MET
BETREKKING TOT HET PRODUCT. MEDTRONIC IS NIET AANSPRAKELIJK VOOR ENIGE INCIDENTELE OF
GEVOLGSCHADE, VEROORZAAKT DOOR OM HET EVEN WELK GEBRUIK, DEFECT OF FALEN VAN HET PRODUCT,
ONGEACHT OF DE VORDERING IS GEBASEERD OP EEN GARANTIE, CONTRACT, ONRECHTMATIGE DAAD OF
ANDERSZINS.
De uitsluitingen en beperkingen die hierboven uiteengezet zijn, zijn niet bedoeld, en moeten niet geïnterpreteerd worden als een
inbreuk op dwingende bepalingen van de van toepassing zijnde wet. Indien enig onderdeel of enige bepaling van deze UITSLUITING
VAN GARANTIE door een daartoe bevoegde rechtbank als onrechtmatig, onuitvoerbaar of in strijd met de van toepassing zijnde wet
beschouwd wordt, zal dit de geldigheid van het overige deel van de UITSLUITING VAN GARANTIE niet aantasten en zullen alle
rechten en verplichtingen worden uitgelegd en ten uitvoer worden gebracht alsof deze UITSLUITING VAN GARANTIE het betreffende
ongeldig verklaarde gedeelte niet bevatte.
96Nederlands
Page 97

1 Beskrivelse av ledningen
3
2
1
4
5
Avalus biologisk protese, modell 400, består av en baseramme dekket med polyester og en støtterammestruktur med tre seil formet
etter geometrien til en klaff med tre seil. Baserammen og støtterammen med tre seil er injeksjonsstøpt med materiale av
polyetereterketon (PEEK). PEEK-materialet i baserammen er impregnert med bariumsulfat for radiografisk visualisering. Seilene er
laserkuttet fra bovint vev som er kryssbundet i bufret glutaraldehyd. Seilene settes inn mellom støtterammen med tre seil og
baserammen, og deretter sutureres alle komponentene godt sammen. En syring laget av polyesterstoff er integrert i dekslet på
innløpssiden av baserammen slik at brukeren kan suturere og plassere Avalus biologisk protese i supraannulær posisjon.
Suturmarkører er plassert på syringen i det midtre sinusområdet på hver cusp som en veiledning for å oppnå jevn avstand mellom
implantasjonssuturene (Figur 1). En engangsholder er festet til klaffens utløp for å gjøre implantasjonen enklere. Den biologiske
aortaprotesen (klaffen) er behandlet ved bruk av en antimineraliseringsmetode med alfa-amino-oleinsyre (AOA), som har vist seg å
redusere forkalkning av klaffeseil fra gris i dyrestudier.
Engangsholderen er utformet slik at den passer til det gjenbrukbare klaffehåndtaket, modell 7420, fra Medtronic. Holderen har et
enkelt skjærepunkt for fjerning av holderen fra klaffen. Målere med to ender brukes til å velge riktig klaffestørrelse. Sylinderenden
representerer klaffeåpningen. Kopienden har samme geometri som protesen.
Tabell 1. Tilgjengelige størrelser og syringdiametere (nominelle verdier i millimeter)
Størrelse 19 mm 21 mm 23 mm 25 mm 27 mm 29 mm
(1) Stentdiameter (TAD) 19 21 23 25 27 29
(2) Åpningens innvendige diameter 17,5 19,5 21,5 23,5 25,5 27,5
(2a) Åpningens innvendige diameter
(3) Utvendig diameter på syring 27,0 29,0 31,0 33,0 36,0 38,0
(4) Klaffeprofilhøyde 13,0 14,0 15,0 16,0 17,0 18,0
(5) Aortafremspring 11,0 12,0 13,0 14,0 15,0 16,0
a
18 20 22 24 26 28
Merk! TAD — diameter på vevsannulus
a
Målene gjelder for en stentramme med vev (2) og en stentramme uten vev (2a)
2 Indikasjoner for bruk
Avalus biologisk protese brukes til å erstatte syke, skadede eller defekte native eller prostetiske aortaklaffer.
3 Kontraindikasjoner
Bruk ikke klaffen hvis dette ikke er til det beste for pasienten. Vurder alle risikoene som er involvert, inkludert anatomien og patologien
som observeres på operasjonstidspunktet.
4 Advarsler og forholdsregler
4.1 Advarsler
• Denne enheten er kun beregnet på engangsbruk. Enheten må ikke brukes, bearbeides eller steriliseres flere ganger. Hvis
enheten brukes, bearbeides eller steriliseres flere ganger, kan det påvirke enhetens strukturelle integritet eller skape en risiko for
kontaminering, som kan føre til at pasienten skades, blir syk eller dør.
• Klaffen skal ikke resteriliseres på noen som helst måte. Hvis klaffen og beholderen eksponeres for stråling, damp,
etylenoksid eller andre kjemiske steriliseringsmidler, blir klaffen ubrukelig.
• Kontroller frakttemperaturindikatoren inne i kartongen. Hvis vinduet for frakttemperaturindikatoren er svart, er ikke klaffen egnet
for klinisk bruk.
• Bruk ikke klaffen under noen av følgende forhold:
– Klaffen har falt i gulvet, er skadet eller har blitt håndtert feil
– Siste forbruksdag er passert
– Alle forseglingsremsene er skadet
– Serienummermerket stemmer ikke overens med serienummeret på etiketten på beholderen
– Glutaraldehydløsningen dekker ikke klaffen fullstendig, eller det lekker væske fra pakningen
– Klaffen viser tegn til forringelse
97 Norsk
Page 98

• Vevsdelen av klaffen skal ikke håndteres med instrumenter. Vær svært forsiktig slik at det ømfintlige klaffevevet ikke skades. Selv
den minste perforering kan forstørres med tiden og svekke klaffens funksjon betydelig.
• Forsøk ikke å reparere en skadet klaff. En skadet klaff skal ikke brukes.
• Tilsett ikke antibiotika eller andre stoffer til oppbevaringsløsningen eller skylleløsningen.
• Forsøk ikke å sette inn en klaff som er for stor i forhold til annulus. Velg en klaff som passer godt i aortaroten uten å deformere den
naturlige anatomien eller Avalus biologisk protese.
• Bruk ikke klaffemålere fra andre produsenter, eller målere for andre Medtronic-proteser, til å bestemme størrelsen på klaffen.
• Klaffen må ikke få tørke ut. For å hindre uttørking av klaffevevet, skal klaffen skylles regelmessig med vanlig sterilt saltvann under
implantasjonen.
4.2 Forholdsregler
• Disse mulige risikomomentene bør overveies nøye ved valg av en egnet klaffeerstatning:
– Degenerativ forkalkning kan føre til raskere forringelse av klaffen hos pasienter med endret kalsiummetabolisme (for eksempel
kronisk nyresvikt, hyperparatyreoidisme).
– Forkalkning kan forekomme tidligere hos barn, ungdommer eller unge voksne.
– Prematur forkalkning kan også forekomme hos eldre voksne som får en biologisk protese.
– Pasienter som har en biologisk protese og krever kronisk antikoagulasjon, har økt risiko for blødning.
• Den usterile yttersiden av klaffebeholderen skal ikke plasseres i det sterile området.
• Bruk ikke Avalus-målerne, modell 7400S, eller klaffehåndtaket, modell 7420, fra Medtronic før de er grundig rengjort og sterilisert.
Du finner flere instruksjoner i den aktuelle bruksanvisningen.
• Ved valg av klaffestørrelse må det tas hensyn til pasientens anatomi, og du må velge en klaff som oppfyller pasientens
hemodynamiske behov på en tilfredsstillende måte.
• Implanter ikke en klaff uten å gjennomføre riktige skylleprosedyrer.
• Orienter stentbena og plasser klaffen slik at koronarostiene ikke blokkeres.
• Unngå å komme i kontakt med klaffen eller skylleløsningen med håndklær, tøy eller andre kilder som kan overføre fast materie til
klaffeseilvevet.
• Fastslå klaffens innløp og utløp før den sutureres.
• Vær forsiktig når du plasserer suturene gjennom syringen, for å unngå rifter i klaffeseilvevet. Hvis klaffeseilvevet er skadet, må
klaffen eksplanteres og erstattes.
• Bruk ikke skjærende nåler, ubeskyttede pinsetter eller skarpe instrumenter som kan gi strukturelle skader på klaffen.
• Vurder muligheten for skade før katetre, kirurgiske instrumenter og transvenøse paceledninger føres gjennom klaffen.
• Ved bruk av enkelt-suturer er det viktig å kutte suturene nær knutene. Kontroller at eksponerte suturender ikke kommer i kontakt
med klaffeseilvevet.
• Bøy ikke den biologiske protesens kommissurer ved knytting av knuter.
• Håndter ikke klaffeseilvevet.
• Unngå langvarig kontakt med oppbevaringsløsningen for klaffen. Glutaraldehyd kan føre til irritasjon i øyne, nese, hud og hals ved
langvarig eksponering. Unngå langvarig eksponering for, eller innånding av, kjemisk damp. Skal kun brukes med tilstrekkelig
ventilasjon. Ved hudkontakt skal du umiddelbart skylle det berørte området med rikelige mengder vann i 10 til 15 minutter. Ved
øyekontakt skal du skylle øyet med vann i 15 minutter og oppsøke medisinsk hjelp umiddelbart.
5 Mulige bivirkninger
Bivirkningene som kan være forbundet med bruk av biologiske hjerteklaffproteser, omfatter:
• angina
• hjerterytmeforstyrrelser
• Endokarditt
• hjertesvikt
• hemolyse
• hemolytisk anemi
• blødning, relatert til antikoagulasjonsmidler / blodplatehemmende midler
• lekkasje, transvalvulær eller paravalvulær
• hjerteinfarkt
• ikke-strukturell dysfunksjon (fasthektet klaffeseil (entrapment/impingement), obstruktiv pannusinnvekst, suturruptur, uheldig valg
av størrelse, annet)
• proteseregurgitasjon
98Norsk
Page 99

• slag
• strukturell forringelse (forkalkning, rift i klaffeseilene, stenose, annet)
• tromboembolisme
• klaffetrombose
Disse komplikasjonene kan føre til:
• reoperasjon
• eksplantering av den biologiske protesen
• permanent invaliditet
• Død
6 Instruksjoner for bruk
6.1 Instruksjoner for håndtering og klargjøring
Valg av riktig størrelse er avgjørende ved utskifting av hjerteklaff. Bruk Avalus-målerne, modell 7400S, til å velge riktig størrelse på
Avalus biologisk protese. Du finner mer informasjon i bruksanvisningen.
Yttersiden av beholderen og lokket er ikke sterile. Klaffen og alle emballasjekomponenter inne i beholderen er sterile og må håndteres
innenfor det sterile operasjonsområdet.
1. Klargjør 2 skylleskåler som hver inneholder 500 ml med vanlig steril saltløsning.
2. Undersøk forseglingsremsene for å kontrollere at beholderen ikke er skadet eller har vært åpnet tidligere. Klaffen skal ikke brukes
hvis alle forseglingsremsene er skadet.
3. Drei lokket mot klokken og åpne beholderen (Figur 2).
4. Hold den indre beholderen mellom tommel og pekefinger. Løft klaffen sakte ut av beholderen slik at glutaraldehydløsningen kan
renne av (Figur 3).
5. Kontroller at serienummeret på den indre beholderen stemmer overens med serienummeret på lokket på beholderen,
ytterkartongen og pasientregistreringsskjemaet. Noter serienummeret i pasientens journal ved hjelp av de selvheftende
etikettene på pasientregistreringsskjemaet.
6. Hold den indre beholderen rett opp og ned. Fjern lokket på den indre beholderen ved å dreie det mot klokken med tommelen og
pekefingeren (Figur 4). Holderen blir da synlig.
7. Sett et sterilt håndtak inn i holderen. Drei håndtaket med klokken i holderens gjengede åpning til du kjenner motstand (Figur 5).
8. Ta klaffen ut av den indre beholderen ved å trekke håndtaket oppover (Figur 6).
6.2 Skylling
1. Legg hele klaffen og holderen i 1 av skylleskålene (Figur 6).
2. Bruk håndtaket og rør klaffen rundt i minst 30 sekunder.
3. Klem forsiktig på syringen for å fjerne eventuelle rester av glutaraldehyd. Berør ikke vevsdelen av klaffen.
4. Legg klaffen i den andre skylleskålen. La klaffen ligge i skålen til kirurgen trenger den.
6.3 Implantasjon av aortaklaff
Avalus biologisk protese er utformet for implantasjon i supraannulær posisjon. Bruk Avalus-målerne, modell 7400S, til å visualisere
plassering av symansjetten over annulus, og til å bekrefte plassering og tilpasning av klaffen i det supraannulære rommet.
Valg av kirurgisk teknikk gjøres av hver enkelt kirurg ved implantasjon i supraannulær posisjon. Alle modifiserte teknikker skal være
i samsvar med Kapittel 4, Advarsler og forholdsregler, side 97. Generelt skal disse trinnene følges:
1. Klaffen skal orienteres slik at stenten og syringen ikke hindrer koronarostiene.
2. Klaffen skal skylles regelmessig med vanlig sterilt saltvann for å hindre at det ømfintlige vevet tørker ut.
3. Klaffen skal posisjoneres i annulus, og suturene skal plasseres i syringen.
4. Suturer klaffen på plass med en egnet suturteknikk. Se Kapittel 4, Advarsler og forholdsregler, side 97 for å unngå mulige
problemer.
5. Løsne holderen (Figur 7) ved å kutte suturene ved det enkle skjærepunktet som angis av den hvite pilen. Dra håndtaket forsiktig
bort fra klaffen for å fjerne holderen.
6. Fjern holderen fra håndtaket og kast den.
7. Knytt alle knuter og kutt suturender. Kontroller at det ikke gjenstår noen suturrester. Hvis det finnes suturrester, skal de fjernes
før klaffeimplantasjonen avsluttes.
99 Norsk
Page 100

7 Tilpasning av behandlingen
Pasienter som mottar en biologisk hjerteklaffprotese, skal stå på antikoagulerende behandling i den første tiden etter implantasjonen,
bortsett fra når det er kontraindisert.
Vurder langtidsbehandling med antikoagulasjonsmidler eller blodplatehemmende midler hos pasienter med dilatert venstre atrium,
tidligere tromboemboliske hendelser eller en hjerterytme med atrieflimmer eller atrieflutter.
8 Pasientveiledningsinformasjon
Det anbefales kontinuerlig medisinsk oppfølging (minst årlig), slik at komplikasjoner knyttet til klaffen kan diagnostiseres og håndteres
riktig.
Pasienter med en biologisk protese har en risiko for bakteriemi (for eksempel hvis de skal behandles av tannlege). Gi pasienten råd
om profylaktisk behandling med antibiotika.
Oppfordre pasientene til alltid å ha med seg identifikasjonskortet for den implanterte enheten, som leveres av Medtronic.
9 Leveringsform
9.1 Pakning
Avalus biologisk protese har gjennomgått kjemisk sterilisering og leveres steril i en bufret 0,2 % glutaraldehydløsning. Steriliteten
svekkes hvis glasset og lokket til beholderen er åpnet eller skadet. Utsiden av beholderen er ikke steril. Den må ikke plasseres i det
sterile området.
9.2 Oppbevaring
Avalus biologisk protese skal oppbevares mellom 5°C og 25°C (41°F og 77°F). Nedkjøling er ikke nødvendig, og nedfrysing kan skade
klaffen. Oppbevaring ved romtemperatur opptil 25°C (77°F) er tilstrekkelig. Klaffen må ikke utsettes for sollys eller andre ultrafiolette
lyskilder, eller plasseres på et sted der det kan forekomme betydelige temperatursvingninger.
Før tilstrekkelig kontroll med lagerbeholdningen slik at biologiske proteser med tidligst utløpsdato implanteres først. Dermed unngår
du at klaffene går ut på dato.
9.3 Retur av eksplanterte biologiske proteser
Kontakt en Medtronic-representant for å be om et produktretursett for å returnere eksplanterte biologiske proteser til analyse og
kassering. Hvis et retursett ikke er tilgjengelig, plasseres den eksplanterte biologiske protesen i en beholder fylt med glutaraldehyd
eller 10 % bufret formalin umiddelbart etter eksplantering. Kontakt en Medtronic-representant hvis du ønsker mer informasjon om
retur.
10 Pasientinformasjon
10.1 Registreringsinformasjon
Merk! Pasientregistrering gjelder ikke i land der registrering av pasientinformasjon strider mot personvernlover, inkludert land i Den
europeiske union.
Det følger et pasientregistreringsskjema med i pakningen med hver enhet. Fyll ut samtlig forespurt informasjon etter implantasjonen.
Send det originale skjemaet tilbake til Medtronic på den adressen som står på skjemaet. Gi pasienten det midlertidige
identifikasjonskortet før utskrivningen.
Pasienten får et identifikasjonskort for den implanterte enheten. Dette kortet inneholder navnet og telefonnummeret til pasientens
lege, samt annen informasjon som helsepersonell kan ha behov for i en akuttsituasjon.
11 Postoperativ informasjon
11.1 Kompatibilitet med magnetisk resonanstomografi (MR)
Avalus biologisk protese, modell 400, er MR-sikker. Klaffen inneholder ikke metaller og utgjør derfor ingen kjent risiko i MR-miljøer.
MR-skanning ved 3,0 T og 1,5 T kan utføres umiddelbart etter implantasjonen. Klaffen er ikke skadelig for pasienten når den
eksponeres for MR-skanning.
11.2 Bildeartefakt
Kvaliteten på MR-bildet kan bli dårligere dersom skanningen gjøres på eller nær posisjonen til klaffen. Om nødvendig kan
MR-bildeparameterne optimaliseres hvis pasienten har klaffen.
100Norsk
 Loading...
Loading...