Page 1

Instructions for Use / Brugsa nvisning / Gebruiksa anwijzing / Mode d’emploi / Gebrauchsa nweisung /
ΟΔΗΓIΕΣ ΧΡHΣΗΣ / Használati utasítás / Istruzioni per l’uso / Brugsanvisning / Instrukcja użytkowania /
Instruções de utilização / Instrucciones de uso / Bruksanvisning / Kull anma Talİmati
Delta® Shunt Kit
Delta shuntsæt
Delta-shuntkit
Kit de dérivation Delta
Delta Shunt Kit
ΚIT ANAΣTOMΩΣHΣ Delta
Delta söntkészlet
Kit di derivazione Delta
Delta shuntsett
Zestaw sztucznej przetoki Delta
Kit de derivação Delta
Kit de derivación Delta
Delta shuntkit
Delta Şant Kİtİ
Page 2

EN Symbols DA Symboler NL Symbolen FR Symboles DE Symbole EL Σύβολα HU Jelölések IT Simboli NO Symboler PL Symbole PT-PT Sìmbolos ES Simbolos SV Symboler
TR Semboller
EN Conformité européenne (European Conformity). This symbol means that the device fully complies with European Directive 93/42/EEC. DA Conformité
européenne (europæisk overensstemmelse). Dette symbol angiver, at enheden overholder kravene i EU-direktiv 93/42/EØF. NL Conformité européenne
(Europese conformiteit). Dit symbool betekent dat het instrument volledig voldoet aan de Europese richtlijn 93/42/EEG. FR Conformité européenne. Ce
symbole signie que le dispositif est conforme à la directive européenne 93/42/CEE. DE Conformité européenne (Europäische Konformität). Dieses Symbol
besagt, dass das Gerät allen Vorschriften der europäischen Richtlinie 93/42/EWG entspricht. EL Conformité européenne (Συόρφωση ε τι ευρωπαϊκέ
οδηγίε). Αυτό το σύβολο υποδεικνύει ότι η συσκευή συορφώνεται πλήρω ε την Ευρωπαϊκή Οδηγία 93/42/ΕΟΚ. HU Conformité européenne (Európai
megfelelőség). Ez a szimbólum azt jelzi, hogy az eszköz teljes mértékben megfelel a 93/42/EGK jelű európai irányelvnek. IT Conformité européenne
(Conformità europea). Questo simbolo indica che il dispositivo si conforma a quanto previsto dalla direttiva europea 93/42/CEE. NO Conformité européenne
(europeisk samsvar). Dette symbolet angir at enheten oppfyller europeisk direktiv 93/42/EØF. PL Conformité européenne (Zgodność Europejska). Znak
zgodności z wymogami Dyrektywy Rady Europy 93/42/EWG. PT-PT Conformité européenne (Conformidade Europeia). Este símbolo signica que o
dispositivo cumpre na íntegra a Directiva Europeia 93/42/CEE. ES Conformité européenne (Conformidad europea). Este símbolo signica que el dispositivo
cumple plenamente con la directiva europea 93/42/CEE. SV Conformité européenne (Europeisk konformitet). Denna symbol betyder att anordningen
uppfyller kraven i EU-direktiv 93/42/EEG. TR Conformité européenne (Avrupa Uyumu). Bu işaret cihazın Avrupa Direkti 93/42/EEC ile tam uyumlu olduğunu
göstermektedir.
EN Caution DA Forsigtig NL Let op FR Mise en garde DE Vorsicht EL Προσοχή HU Vigyázat IT Attenzione NO Forsiktig PL Przestroga PT-PT Atenção
ESPrecaución SVVar försiktig TR Dikkat
EN Consult Instructions for Use DA Se brugsanvisningen NL Raadpleeg de gebruiksaanwijzing FR Consulter le mode d’emploi DEGebrauchsanweisung
beachten EL Συβουλευτείτε τι οδηγίε χρήση HU Olvassa el a használati utasítást IT Consultare le istruzioni per l’uso NO Se bruksanvisningen
PLSprawdzić w instrukcji obsługi PT-PT Consulte as instruções de utilização ES Consulte las instrucciones de uso SV Se bruksanvisning TR Kullanma
Talmatlarına Bakın
EN Use by DA Anvendes inden NL Te gebruiken vóóri FR Utiliser avant le DE Verwendbar bis EL Ηεροηνία λήξη HU Szavatossági idő lejár IT Da utilizzare
entro NO Brukes før PL Termin ważności PT-PT Usar até ES Fecha de caducidad SV Användes före TR Son Kullanma Tarihi
EN Reference Number DA Referencenummer NL Referentienummer FR Numéro de référence DE Referenznummer EL Αριθό αναφορά HU Referenciaszám
IT Numero di riferimento NO Referansenummer PL Nr referencyjny PT-PT Número de referência ES Número de referencia SV Referensnummer TR Referans
Numarası
EN Lot Number DA Partinummer NL Partijnummer FR Numéro de lot DE Chargen-Nr. EL Αριθό παρτίδα HU Tételszám IT Numero di partita
NOPartinummer PL Nr partii PT-PT Número de lote ES Número de lote SV Lotnr TR Lot Numarası
EN Manufacturer DA Producent NL Fabrikant FR Fabricant DE Hersteller EL Κατασκευαστή HU Gyártó IT Produttore NO Produsent PL Wytwórca
PT-PT Fabricante ES Fabricante SV Tillverkare TR Üretici
EN Sterilization: Ethylene-Oxide Gas DA Sterilisering: Ethylenoxid NL Sterilisatie: ethyleenoxidegas FR Stérilisation : oxyde d’éthylène DE Sterilisation:
Ethylenoxid EL Αποστείρωση: Αέριο αιθυλενοξείδιο HU Sterilizálás: Etilén-oxid gáz IT Sterilizzazione: ossido di etilene NO Sterilisering: Etylenoksidgass
PLSterylizacja: gazowy tlenek etylenu PT-PT Esterilização: Gás Óxido de Etileno ES Esterilización: gas de óxido de etileno SV Steriliseringsmetod: Etylenoxid
TRSterilizasyon: Etilen Oksit Gazı
EN Do Not Reuse DA Må ikke genbruges NL Niet opnieuw gebruiken FR Ne pas réutiliser DE Nicht wiederverwenden EL Μην επαναχρησιοποιείτε HU Nem
használható újra IT Non riutilizzare NO Må ikke gjenbrukes PL Nie używać powtórnie PT-PT Não reutilizar ES No volver a utilizar SV Får ej återanvändas
TRTekrar Kullanmayın
EN Do not open if package is damaged DA Må ikke åbnes, hvis pakningen er beskadiget NL Niet gebruiken als de verpakking geopend of beschadigd is
FR Ne pas ouvrir si l’emballage est endommagé DE Nicht önen, wenn die Verpackung beschädigt ist EL Μην το ανοίγετε, εάν η συσκευασία έχει υποστεί
ζηιά HU Ne nyissa ki, ha a csomagolás sérült IT Non aprire se la confezione è danneggiata NO Skal ikke åpnes hvis pakken er skadet PL Nie otwierać,
jeśli opakowanie jest uszkodzone PT-PT Não utilizar se a embalagem estiver danicada ES No lo abra si el envase está dañado SV Får ej öppnas om
förpackningen är skadad TR Ambalaj hasarlıysa kullanmayın
EN CAUTION: U. S. federal law restricts this device to sale by or on the order of a physician. DA FORSIGTIG: Ifølge amerikansk lov må dette udstyr kun
forhandles eller ordineres af en læge. NL LET OP: Krachtens de federale wet van de VS mag dit instrument uitsluitend door of op voorschrift van een arts
worden verkocht. FR MISE EN GARDE : La législation fédérale américaine n’autorise la vente de ce dispositif que sur prescription médicale. DE VORSICHT:
Gemäß US-Bundesgesetzen ist der Verkauf dieses Geräts nur an oder im Auftrag von Ärzten zulässig. EL ΠΡΟΣΟΧΉ: Η οοσπονδιακή νοοθεσία των Η.Π.Α.
περιορίζει την πώληση αυτή τη συσκευή όνον από ιατρό ή κατόπιν εντολή ιατρού. HU VIGYÁZAT: Az USA szövetségi törvények értelmében ez az eszköz
kizárólag orvosoktól vagy orvosi rendelvényre szerezhető be. IT ATTENZIONE: la legge federale statunitense limita la vendita di questo dispositivo ai medici
o su prescrizione medica. NO FORSIKTIG: Føderal lov (USA) begrenser salget av denne enheten til leger eller etter legers bestilling. PL PRZESTROGA: Zgodnie
z przepisami prawa federalnego USA sprzedaż opisywanego urządzenia może być realizowana wyłącznie na zlecenie lub zamówienie wydane przez lekarza.
PT-PT ATENÇÃO: A lei federal dos E.U.A. limita a venda deste dispositivo a médicos ou mediante receita médica. ES PRECAUCIÓN: La ley federal de los EE.UU.
restringe la venta de este dispositivo a un médico o a una orden facultativa. SV VAR FÖRSIKTIG: Enligt amerikansk federal lag får denna anordning endast
säljas av eller på ordination av läkare. TR DİKKAT: A.B.D. federal kanunlarına göre bu cihaz sadece bir doktor tarafından veya emriyle satılabilir.
EN Package Contents DA Pakkeindhold NL Inhoud van de verpakking FR Contenu de l’emballage DE Packungsinhalt EL Περιεχόενα συσκευασία.
HUCsomag tartalma IT Contenuto della confezione NO Pakkeinnhold PL Zawartość opakowania PT-PT Conteúdo da embalagem ES Contenido del envase
SVFörpackningens innehåll TR Paket İçeriği
EN Magnetic Resonance Safe DA Sikker til anvendelse ved MR-skanning NL MR-veilig FR Compatible avec la résonance magnétique DE
Magnetresonanzsicher EL Ασφαλέ για απεικόνιση αγνητικού συντονισού HU MR-vizsgálat szempontjából biztonságos IT Compatibile con risonanza
magnetica NO Trygt å bruke magnetresonanstomogra PL Bezpieczne stosowanie rezonansu magnetycznego PT-PT Seguro para utilização com ressonância
magnética ES Seguro para resonancias magnéticas SV MR-säker TR Manyetik Rezonansla Güvenli
EN Delta i s a register ed tradem arks of Me dtronic, I nc. DA Delt a er et regis treret va remærke, de r tilhører M edtroni c, Inc. NL Del ta is een ged eponeerd h andelsme rk van Medt ronic,Inc .
FR Delta es t une marqu e déposée d e Medtron ic,Inc. DE Del ta ist ein ei ngetrage nes Warenz eichen von Me dtronic , Inc. EL Η ονο ασία Delta α ποτελεί σ ήα κατατ εθέν τη Me dtronic ,Inc.
HU A Delta a Me dtronic I nc. bejegy zett véd jegye. IT Del ta è un marchi o commerci ale deposi tato di Med tronic, In c. NO Delta er e t regist rert vare merke for Me dtronic , Inc. PL Delt a
jest za rejestr owanym znak iem towaro wym fir my Medtro nic, Inc. PT-PT Del ta é uma marca c omercial r egistad a da Medtro nic, Inc. ES De lta es una ma rca regis trada de Me dtronic , Inc.
SVDelta är e tt regis trerat va rumärke so m tillhör Me dtronic , Inc. TR Delta , Medtron c, Inc.’ın tes cll br t car mark asıdır.
Page 3

Delta™ Shunt Kit
14
12
10
52030
40 50
14
12
10
52030
140
40 50
Description
Each Med tronic Neur osurgery D elta™ Valve incor porates a memb rane pressu re valve in seri es with a norma lly closed sip hon control
mechanism. This combination enables the Valve to maintain intraventricular pressure (IVP) within a normal physiological range, regardless
of the pat ient’s CSF fl ow requireme nts or body po sition. Flow co ntrol is accom plished by comb ined resist ance of the memb rane and sipho n
contro l diaphragms . Degree of res istance dete rmines the pe rformanc e character istics of t he valve. Retro grade flow i s prevented by th e
membrane. The siphon effect is controlled by the two normally closed silicone elastomer diaphragms of the Delta siphon control. The
diaphra gms open in res ponse to posit ive upstrea m IVP.
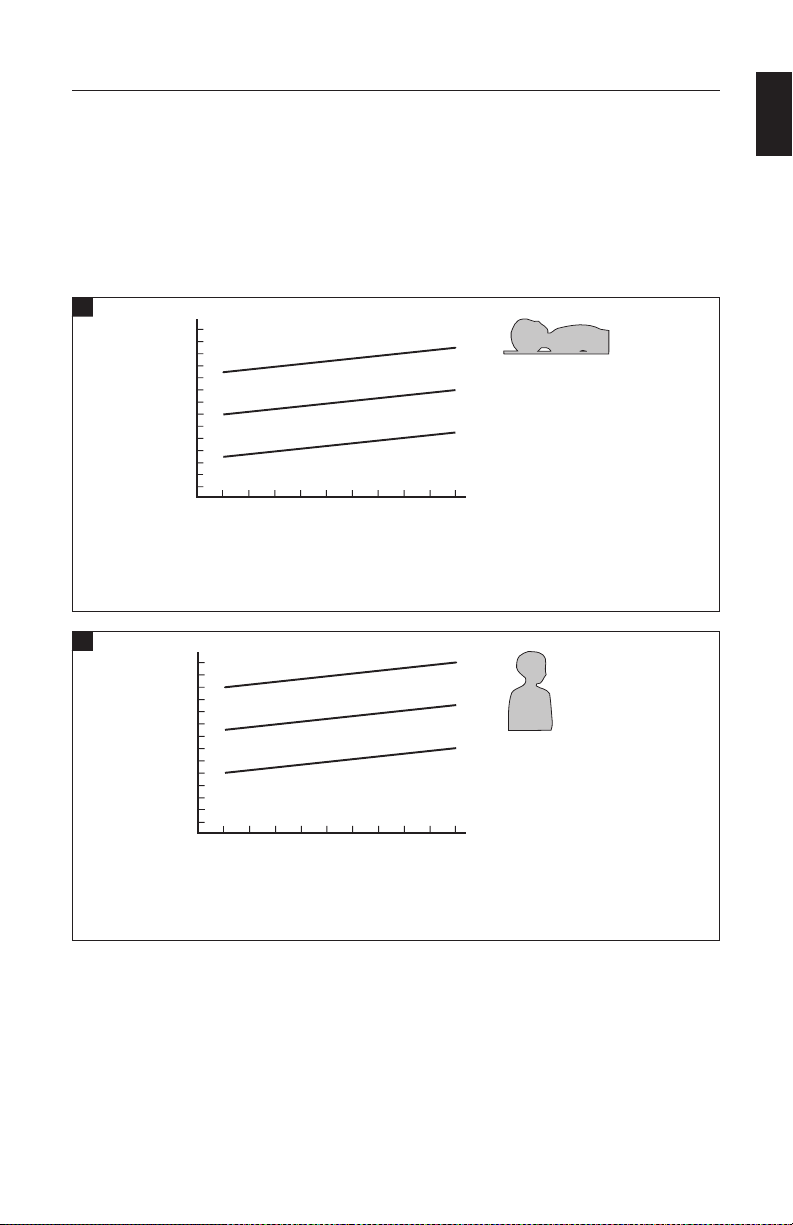
The Valve is av ailable in two s izes, Small and R egular. Each size i s available in th ree pressur e ranges: Per formance Lev el 1, 1.5, and 2. The
perf ormance char acterist ics of the Valve ar e shown in the gra phs (Fig. 1a-b).
The small s ize kit compri ses a Delta Valve , Small, in Perfo rmance Level 1, 1.5 or 2. T he regular size k it comprise s a Delta Valve, Re gular, in
Perfo rmance Level 1, 1.5, or 2. Bo th kits inclu de a 23 cm Ventric ular Cathete r, Standard Diame ter, Barium Impr egnated, and a 9 0 cm Cardiac/
Peritoneal Catheter, Standard Diameter, Barium Impregnated.
1a
0
0
O)
2
0
80
60
40
PRESSURE (mm H
20
105
70
35
Performance Level 2.0
Performance Level 1.5
Performance Level 1.0
FLOW RATE (mL/ hr)
Every M edtron ic Neuro surger y valve is te sted fo r its per forma nce char acter istic s using a wat er-fill ed test s ystem at t he time of m anufac ture. Al l valves co nform t o
labeling specifications in these tests. Subsequent testing of the valve may give different results depending on test conditions and condition of the valve. Testing
at the time of manufacture serves to assure consistent, high quality of every Medtronic Neurosurgery valve.
125
0 cm H2O HP*
90
NOTE: Levels de picted ar e median
values. The tolerance range of these
median v alues is +/- 25 mm H20.
55
*Hydrostatic Pressure
English
1b
0
0
O)
2
0
80
60
40
PRESSURE (mm H
20
120
85
50
Performance Level 2.0
Performance Level 1.5
Performance Level 1.0
105
70
- 50 cm H2O HP*
NOTE: Levels d epicted a re median
values. The tolerance range of these
median v alues is +/- 40 mm H20.
*Hydrostatic Pressure
FLOW RATE (mL/ hr)
Every M edtron ic Neuro surger y valve i s tested f or its p erfor mance ch aract erist ics usin g a water-f illed t est sys tem at the t ime of man ufac ture. All v alves co nform to
labeling specifications in these tests. Subsequent testing of the valve may give different results depending on test conditions and condition of the valve. Testing
at the time of manufacture serves to assure consistent, high quality of every Medtronic Neurosurgery valve.
Cerebro spinal flui d exits the c atheter thro ugh four slit op enings, place d 90° apart a round the cat heter circum ference near t he distal tip
(Fig. 8). These openings are designed to provide protection from retrograde flow. They are not designed as pressure/flow control valves, but
add sligh t resistanc e to flow. Maximu m resistanc e to flow at a cons tant flow ra te of 20 ml/hour is 2 .0 cm H2O. The slit op enings are coa ted
with graphite during manufacture to minimize the possibility of slitted surface adhesion during storage.
The valve s are fabric ated with a pre cision molde d firm poly propylene ba se invested i n a smooth, fle xible silico ne elastomer h ousing with
contour ed bottom (Fi g. 2). The base contr ibutes to st ructural i ntegrity, pr essure/f low, and siphon con trol reliabi lity, prevent ing distor tion
and sticking of the valve seat and membrane, and siphon control ports and diaphragms. The dome is marked with radiopaque tantalumimpreg nated indica tors showing P erforman ce Level and flo w directio n.
Delta Valves incorporate connectors designed to decrease the possibility of catheter disconnection. One encircling ligature is required to
secure e ach cathete r to the valve. Rad iopaque mark ers at the base o f each connec tor (Fig. 2) allow th e physician X-r ay visualizat ion of the
relativ e positions of c atheters a nd valve in vivo when radiopaque catheters are used.
1
Page 4
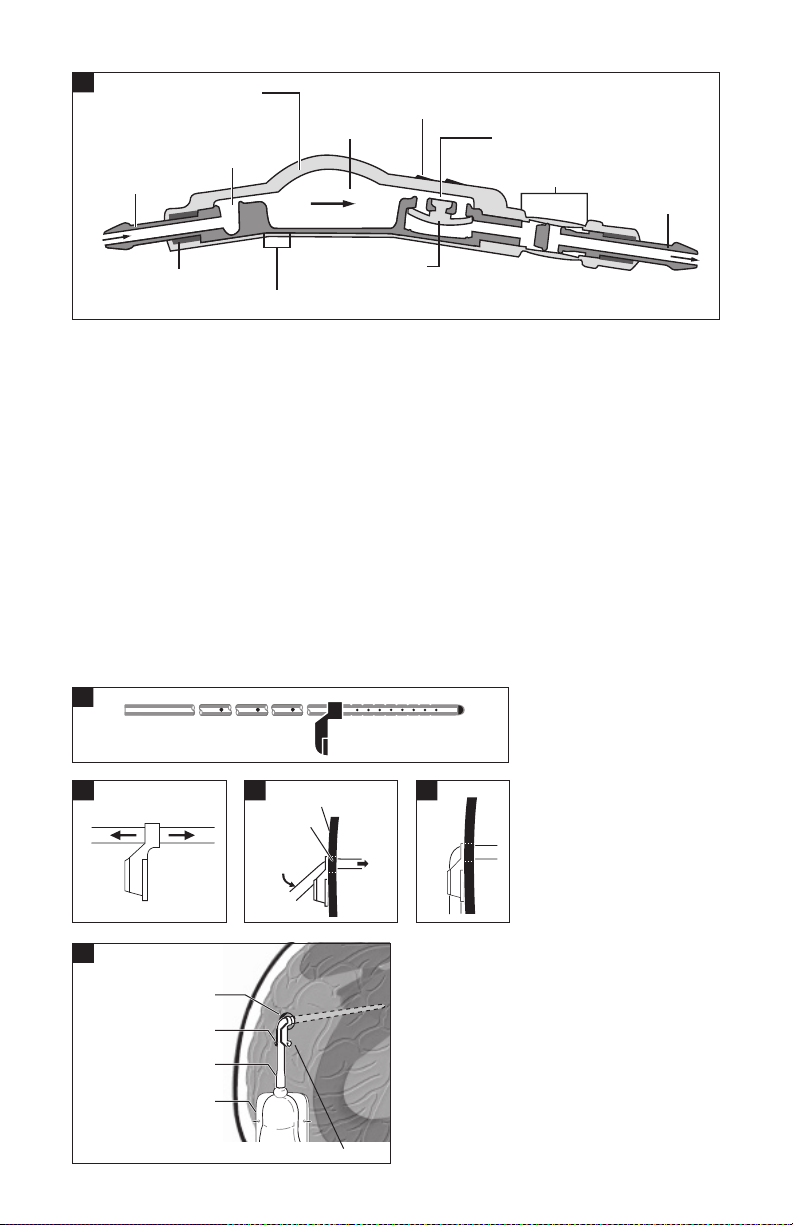
2
Integral Inlet Connector
Silicone Dome
Proximal Occluder
Reservoir
Radiopaque Performance/Flow Direction Indicators
Distal Occluder
Delta Chamber
Integral Outlet
Connector
Radiopaque Marker
Firm Polypropylene Plastic Base
The radiopaque 5code on the va lve indicate s the pressure /flow char acterist ics of the dev ice; 5corresponds to Performance Level 1,6to
Performance Level 1.5, and7to Perfo rmance Level 2. T he dome is desig ned to allow inje ction or CS F sampling via a 2 5-gauge or sm aller
non-co ring needle ( Fig. 9). Complete val ve penetrat ion by the needl e is prevented by t he firm pol ypropylene b ase. Delta Valv es can be flus hed
in eithe r the distal or p roximal dire ction by perc utaneous f inger pres sure. Occlude rs are locate d proximal and d istal to the ce ntral reser voir to
facilitate selective flushing.
The flo w character istics of th e device are not a ffecte d by MR examinat ion. The device d oes not need to b e tested or rea djusted af ter MR
examination.
Silicone Membrane Valve
Indications
The Medt ronic Neuro surgery Del ta Shunt Kit s are designed f or use in shunti ng CSF from th e lateral ventr icle of the bra in into the right a trium
of the hear t or perito neal cavity. Ad ditionally, the D elta Valve mini mizes the exce ssive reduc tion of IVP and vo lume due to exces sive drainage
of CSF whi ch may be cause d by the siphonin g effec t of hydrostat ic pressure o f the distal ca theter. The siph on effec t is a phenomen on that may
be creat ed by the elevat ion of the ventr icular cathe ter with resp ect to the dis tal cathete r (i.e., when the pat ient sits, st ands, or is hel d erect).
Instruc tions for Use
Surgical Technique
A variety of surgical techniques may be used in placing the Delta Shunt. The surgical technique to be used is at the discretion of the surgeon.
It is sugge sted that the v alve be placed in a s urgically c reated loose s ubgaleal poc ket which avoid s compressi on by the overlyi ng scalp, and no t
under th e scalp incisi on. The valve may b e secured to ad jacent tissue b y suturing thr ough its pol yester-fabr ic reinforce d flange.
Placemen t location of a M edtronic Ne urosurger y Delta Valve wil l have an impact o n overall shunt p erforman ce. The forame n of Monro is one
estab lished zero lev el reference p oint for intr acranial pre ssure monito ring. Placem ent of the valve ab ove this refer ence point wil l result in
an overall i ncrease in th e resistanc e to flow of the shu nt system. Pl acement of the va lve below the re ference poin t will result in a n overall
3
10
decrea se in the resis tance to flow o f the
shunt sy stem when the p atient is sit ting,
standi ng or held erec t. These cha nges are
direc tly propor tional to the li near distan ce
(mm) above or bel ow the refere nce point.
Surgical Procedure
4
7
2
Twist Drill or Burr Hole
Right Angle Clip
Ventricular Catheter
CSF-Flow Control
Valve, Contoured
5
Burr hole
Bend catheter,
push into tab
groove
Skull
To ventricles
Suture
6
4). This can be d one with the st ylet in the ca theter. The st ainless stee l
styl et is designed t o facilitat e introduct ion of the cath eter into the
lateral ve ntricle. The c atheter is pa ckaged with t he stylet i nserted in
the lumen.
After t he catheter is l ocated in the p roper posit ion in the ventr icle and
the st ylet is removed , the extra cranial por tion of the cat heter is pres sed
into the sp lit tubular se gment of the cl ip to form the ri ght angle bend
(Fig. 5 and 6). Wh en pressed in to the clip, the ca theter shoul d not be
stretc hed. If the cat heter is to be pla ced in the ventr icle through a
tubular i ntroducer, the c lip must be rem oved prior to in sertion of t he
catheter through the introducer. The right angle clip should be secured
to adjacen t tissue by pass ing sutures t hrough the tw o suture hole s on
the side s of the clip (Fig. 7 ).
To connec t the Delta Valve to t he ventricu lar catheter, ins ert the
integral polypropylene connector into the ventricular catheter tubing.
Ventricular Catheter Placement
The right angle clip assembled on the
ventric ular cathet er (Fig. 3) may be used
to bend th e catheter to an a pproximate
90° angl e at the point whe re the cathet er
exits t he twist dr ill or burr hole (F ig. 6). The
clip may be u sed as a marker fo r planned
depth of catheter insertion when slid the
appropriate distance from the proximal
tip of the c atheter pri or to inserti on (Fig.
Page 5

The conne ctor shoul d be completel y covered by tubi ng. Secure tu bing to the conn ector with a n encircling li gature. Care s hould be taken to
ensure that the ligature results in a secure connection but does not cut tubing.
A subgale al pocket mus t be formed wi th appropri ate depth to accep t the
extr acranial por tion of the ve ntricular c atheter and th e Delta Valve comp onent
of the shun t kit. It is reco mmended that i mplantatio n of the ventric ular cathete r
be the las t step in the shun ting proced ure. This will mi nimize loss of C SF during
surgery.
Peritoneal Catheter Placement
A variet y of surgica l techniques m ay be used in plac ing the dista l catheter in to the periton eal cavity. Th e site of placeme nt is at the discr etion
of the sur geon. The cat heter length i s 90 cm with wall s lits at the dis tal end (Fig. 8). The c atheters have s uffic ient length fo r cardiac or
perito neal placemen t in most adult s. The surgeo n may trim the pro ximal end for th e selecte d placement site a t the time of sur gery. Or, if
cathet er wall slits ar e not desired, t he distal end m ay be trimmed. T he catheter s hould be chec ked for patenc y at the time of su rgery (see
Shunt Patency Check).
CAUTION: IF TH E DISTAL END OF THE CARDIAC /PERITONEAL C ATHETER IS TRIMMED, DO NOT PL ACE THE CATHETER ATRIALLY.
If a subcutaneous tunneling device is needed for placement of the distal catheter, the Medtronic Neurosurgery Disposable Subcutaneous
Catheter Passer is recommended.
NOTE: A disp osable cath eter passer i s not included w ith
the Medtronic Neurosurgery Delta Shunt Kit.
CAUTION: LOW T EAR STRENGTH IS A
CHARACTERISTIC OF MOST UNREINFORCED SILICONE
ELASTO MER MATERIALS. CARE M UST BE TAKEN WITH
THE HANDLING AND P LACEMENT OF THE SILICO NE
ELASTO MER CATHETER TUBING TO AVOID C UTS,
NICKS, OR TE ARS.
25-gauge or smaller needle
Injec tion into the Valve
The Medtronic Neurosurgery Delta Valve is designed to
allow inje ction or CS F sampling thr ough the dome by u se of a 25-gaug e or smaller non -coring nee dle (Fig. 9).
CAUTION: LOW T EAR STRENGTH IS A CHAR ACTERISTIC OF UNR EINFORCED SILICONE EL ASTOMER MATERIAL S. CARE MUST BE TAKEN
ON INSERTIO N AND REMOVAL OF THE NEEDLE .
The need le should be ins erted at an ang le no greater th an 45° from the sc alp or base of th e valve. If the val ve will be punc tured severa l times,
it is reco mmended that t he needle be in serted at var ious locat ions to avoid mult iple punct ures at a single p oint on the dome. T he catheter
tubing, occluders and siphon control diaphragms are not to be use d as injecti on sites.
CAUTION: TH E SIPHON CONTROL PORT ION OF THIS DEVICE IS NO T DESIGNED TO ALLOW NEED LE PENETRATION. DUE TO IT S LOCATION,
IT IS VERY UNLIK ELY THAT THE NEEDLE WOULD BE INSERTE D SO THAT IT WOULD PUNCTURE T HE PRESSURE/FLOW ME MBRANE
OR SIPHON CONT ROL DIAPHRAGMS. C ARE SHOULD BE TAKEN NOT TO ALLOW T HIS SINCE PUNCTURE O F THE MEMBRANE OR
DIAPHRAGM S MAY AFFECT THE PERFORMA NCE CHARACTERIS TICS OF THE VALVE AND COMPROM ISE THE SHUNT SYSTEM .
Valve Flushing
Percut aneous depr ession of the v alve dome with t he finger w ill force CSF o ut of the valve in b oth proxima l and distal di rection s. To selectiv ely flush,
depres s and occlude e ither the prox imal or dist al occluder
sections of the valve by percutaneous finger pressure,
then depress the valve dome (Fig. 10). This action will
cause th e fluid to f low in the dire ction oppo site the
occlud ed side of the val ve. If there is no ticeable res istance
to dome com pression, t he catheter t o be flushed m ay be
occluded.
CAUTION: SH UNT OBSTRUCTION M AY OCCUR IN ANY
COMPONENT O F A SHUNT SYSTEM AND SHO ULD BE
DIAGNOSED BY CLINICAL FINDINGS AND DIAGNOSTIC
TESTING. VALVE FLUSHI NG CHARACTERIS TICS MAY
NOT BE ADEQUATE TO DIAG NOSE OCCLUSION OF
CATHETERS. SEE WARNINGS SECTION.
Direction of flush
Depress
Valve Dome
Depress
Occluder
10
Shunt Pate ncy Check
Valve:
a. Place the in let connec tor of the valve in to sterile
isotonic saline.
b. Depress an d release the va lve central re servoir
repeate dly until fl uid flows ou t of the outlet
connec tor. If fluid f lows from th e outlet
connec tor each time t he central res ervoir is
depres sed, the valve i s patent (Fig. 11).
CAUTION: ADDITION OF PARTICULATE MATTER TO
TEST SOLUTI ON MAY AFFECT TEST RESULTS AN D
PRODUCT PERFORMANCE.
CAUTION: D O NOT ASPIRATE FLUID THROUG H THE
SHUNT FROM THE DIS TAL CATHETER END. DAMAGE
TO THE MEDTRONIC NEUROSURGERY DELTA VALVE
MAY RESU LT.
Inlet
Pump Dome
Fluid Level
Sterile Isotonic Fluid
Outlet
11
8
9
3
Page 6

CAUTION: E XCESSIVE FLUSHING PRE SSURE MAY CAUSE TEMP ORARY DEFORMATIO N OF THE FLOW CONTROL VALVE MEMBR ANE AND
F
F
O
-3
-2
-1
0
0 cm
1
2
3
33
34
35
510152025
30
1/4
1/2
3/4
1oz
B-D
RESULT IN ABNORM ALLY LOW PRESSURE/FLOW TE ST RESULTS.
CAUTION: IF H ANDLING THE DELTA CHAMBER IS NECE SSARY, THE DEVICE SHOU LD BE HELD BY THE DIAPHRA MS WITH GLOVED FINGER S
ONLY. NO PRESSURE SHOUL D BE PLACED ON THE OUTER R IM. IMPROPER HANDLIN G OF THE DELTA CHAMBER MAY COMPROM ISE THE
INTEGRITY OF THE SHUNT SYSTEM.
Cardiac/Peritoneal Catheter:
The cath eter should be c hecked for pa tency at the ti me of surger y. The patency ch eck include s a visual deter mination tha t all slit openin gs
allow fl ow of CSF.
1. Insert a 17-gau ge blunt need le into the open, p roximal end of t he catheter an d flush with s terile phys iological s aline using gen tle
syringe pressure.
2. Observ e the slit openi ngs near the dis tal end. All ope nings should a llow fluid f low and appear to o pen for their c omplete leng th.
3. Gently ro lling the slit op ening area of th e catheter be tween the thu mb and foref inger will fr ee the slits i f they do not appe ar to open
completely.
4. Smoot h the cathete r wall with the t humb and fore finger so t he slit openi ngs are in the clo sed positi on after com pletion of t he patency te st.
Preimplantation Test
Each Del ta Valve is indiv idually tes ted to insure
conformance with its labeled performance
characteristics. Although verification of a
valve’s dynamic performance characteristics
using a st atic test tha t can be perf ormed
in the ope rating room is n ot possible, t he
surgeo n may wish to verif y that the Del ta
Valve conforms to Medtronic Neurosurgery
specifications prior to implantation. The
followi ng preimplan tation test m ay be
perf ormed in the op erating roo m:
CAUTION: TAKE C ARE TO MAINTAIN
STERILIT Y AND TO AVOID PARTICULATE
CONTAMINATION.
NOTE: The De lta Valve should b e tested alon e,
not conne cted to the ca theters in th e kit.
Test Method
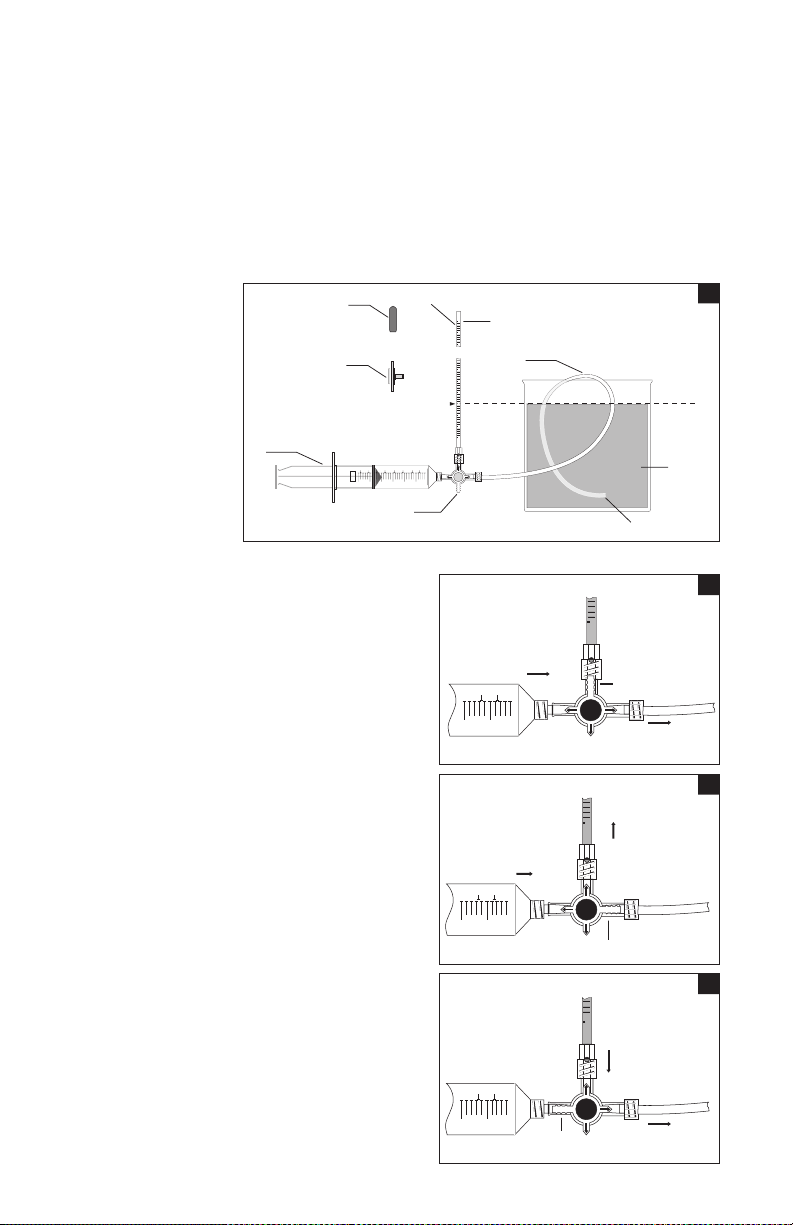
I. Equipment required for test
1. S terile flui d reservoi r or sterile wat er bath
2. One sterile 30 cm water manometer, graduated in centimeters
3. O ne three-w ay stopcock (to b e used with man ometer)
4. O ne sterile s yringe, 30 cc
5. O ne sterile 5 µ s yringe fil ter
6. O ne sterile ma le Luer connec tor
7. Sterile silicone tubing
Manometer cap
(detached)
Syringe filter
Syringe
Stopcock
Manometer
From syringe
10
(Correct
manometer
alignment)
1/4
5
30 cm
Silicone
tubing
Connect product here
-3
F
F
Off
O
To valve
II. Equipme nt setup
1. R emove cap fro m manometer. Set u p manometer, sto pcock,
and water b ath so that the ze ro level on the man ometer and
the flu id level in the wat er bath are the s ame height (Fig . 12).
(Fix mano meter to an I.V. stand.)
2. F ill syringe w ith sterile w ater using 5 µ sy ringe filte r. (When
refi lling syring e, always use 5 µ sy ringe fil ter.) After fill ing syringe,
detach syringe filter.
3. Connect syringe, manometer, and silicone tubing as shown in Figure 12.
4. To purge all air f rom the assem bled steril e test appara tus, turn
stopco ck as shown in Fig ure 13.
5. Submerge s ilicone tubi ng in the steril e water bath and f lush with
sterile water from syringe.
III. Equipment calibration
1. Turn stopco ck as shown in Fig ure 14 and fill man ometer to at leas t
5 cm H2O.
2. W ith silicone t ubing submer ged in the water b ath, turn sto pcock
to isolate syringe from the manometer (Fig. 15).
3. Allow water c olumn in the mano meter to fall.
4. Water column s hould stop at ze ro level of the man ometer, as
shown in Figure 12. If not, raise or lower manometer accordingly.
5. Man ometer is now c alibrated to t he zero level of t he water bath. F ix or
mount th e manometer to m aintain ref erence posit ion with wate r bath.
IV. Test procedure
NOTE: Durin g testing, th e valve must be su bmerged in th e sterile wate r
bath. For c orrect re sults, the zer o level of the man ometer must b e properly
aligned w ith the flu id level of the wat er bath.
4
1. C onnect the s terile valve to b e tested to the a ssembled s terile test
apparatus.
From syringe
1/4
5
10
1/4
5
10
F
F
Off
-3
-3
O
To manometer
F
F
O
Off
From manometer
To valve
Constant
level
water
bath
12
13
14
15
Page 7

2. Tur n stopcock as s hown in Figure 14 an d fill manome ter to at least 30 c m H2O.
3. Tur n stopcock to i solate manome ter from fl ow path as shown i n Figure 13.
4. P urge all air fr om the valve and th e assembled t est apparat us by gently f lushing with s terile water f rom syring e.
5. G ently esta blish flow th rough the valv e with steril e water from the s yringe.
6. S ubmerge ste rile valve in the s terile wate r bath. The outl et connect or of the valve mus t be under wate r to obtain corr ect test re sults.
7. W hile gently ma intaining f low through th e valve, turn st opcock to iso late syringe f rom flow pa th as shown in Fig ure 15. After
stopco ck is placed in pr oper positi on, the water col umn in the manom eter should st art to fall. T he syringe is n ow isolated fr om the
valve and c ontinuing f low with the sy ringe is no long er necessar y. If water colum n does not fall, r epeat steps 2 t hrough 7.
NOTE: Allow w ater level in the m anometer to fa ll for 2 to 2 ½ minute s. Read the resu ltant press ure from the ma nometer.
Test Result s — Preimplanta tion Test
The resu ltant pressu re reading obt ained by this m ethod may be com pared with th e following ch aracteris tics:
Valve Per formance L evel Acceptable Pressure Ranges
Level 1 1 to 60 mm H2O at 0 HP
Level 1.5 35 to 95 mm H2O at 0 HP
Level 2 70 to 130 mm H2O at 0 HP
How Supplied
Medtronic Neurosurgery Delta Shunt Kits are packaged STERILE and NON-PYROGENIC and ar e intended for single (one-time) use only. DO
NOT RESTERILIZE.
The encl osed produc t is designe d for single pat ient use only. Do no t re-use, re -process, or r e-steril ize this produ ct. Re-us e, re-proces sing or
re-st erilizatio n may compromi se the struc tural integ rity of the de vice and/or cre ate a risk of conta mination of th e device, which c ould result in
patien t injury, illnes s, or death. Do no t use if packag e has been prev iously opene d or damaged. Me dtronic Neu rosurger y is not respons ible for
the per formance of a ny product th at has been res terilized.
A comple te shunt requir es a Ventricula r Catheter, a Medt ronic Neuro surgery De lta Valve, and a Car diac/Peri toneal Cathe ter or Peritone al
Cat heter.
Special Order Products
If this Ins tructio ns for Use accom panies a spec ial order prod uct, there w ill possibly b e differe nces in the physi cal charac teristic s between th e
produc t enclosed a nd the produc t descript ion in this pro duct packa ge insert. T hese diff erences will n ot affec t the safet y or effic acy of the
special order product.
Specia l order produc ts may be supp lied steril e or non-ster ile as indicat ed on the produ ct package l abel. Non-s terile produ cts must be c leaned
and ster ilized prior t o use.
Contraindications
Shuntin g of CSF into the ri ght atrium, pe ritoneal cav ity or other a reas of the bod y should not be c arried out if t here is infec tion in any are as in
which th e various comp onents of the s hunt system w ill be implante d. These incl ude infect ions of the sca lp and other ski n area through w hich
the shunt s ystem will pa ss, the mening es and cerebra l ventricle s, peritoneu m and intraper itoneal and re troperit oneal organs, p leura and
blood s tream. CSF shun ting is contr aindicated i f there is infe ction pres ent in any area of th e body. An additi onal contrai ndication i s shunting
into the atrium of patients with congenital heart disease or other serious cardiopulmonary abnormalities.
Patient Education
It is the re sponsibili ty of the phys ician to educ ate the patien t and/or their re presenta tive(s) regardi ng CSF shunti ng. This shoul d include a
description of the complications associated with implantable shunt systems, and an explanation of potential alternative products and treatments.
Warnings and Precautions
The appr opriate prod uct, size, pr essure or per formance ra nge must be cho sen for the spe cific pat ient’s needs , based on diagn ostic test s and
physician experience. Product labeling specifies applicable produc t performance levels or ranges.
Avoid cont acting imp lantable pro ducts wit h lint, glove talc , oily residu e from the skin, o il based soa ps, synthet ic detergent s, or other sur face
contami nants. Lint , fingerpr ints, talc, o ther surfa ce contaminan ts, or residu es from latex g loves can caus e foreign bod y or allergic re actions.
Care mus t be taken to ensu re that parti culate conta minants are no t introduce d into shunt comp onents duri ng preimplant ation testi ng or
handlin g. Introduc tion of conta minants coul d result in impr oper perfo rmance (over- or und erdrainage) o f the shunt sys tem. Partic ulate
matter w hich enters t he shunt syst em may also hold pr essure/f low controll ing mechanis ms open, resul ting in overdra inage.
In secur ing cathete rs to connec tors, the enc ircling ligat ures should b e securely, but n ot too tightly, f astened les t they eventual ly cut throug h
the silicone tubing.
Care mus t be taken in the ro uting of cath eters to prev ent kinking an d needless ab rasion along t heir course. T he rim of the tw ist drill or bu rr
hole may be t rimmed to prov ide a beveled n otch where the ve ntricular c atheter emer ges and is cur ved to lie adjace nt to the skull.
Patient s with hydroce phalus shunt s ystems must b e kept under clo se observ ation in the pos toperativ e period for si gns and sympto ms that
suggest shunt malfunction. The clinical findings may indicate shunt malfunction. The clinical findings may indicate shunt infection, or underor overdr ainage of CSF.
Shunt obs tructio n may occur in any of t he component s of the shunt sy stem. The sys tem may become i nternally oc cluded due to ti ssue
fragm ents, blood c lots, tumor ce ll aggregate s, bacteria l colonizati on or other deb ris. Cathete rs which cont act intern al body stru ctures can
become k inked, or bloc ked at their tip s (e.g.: investmen t of a ventricul ar catheter ti p into the choro id plexus or of a d istal cath eter tip into th e
greater o mentum or loop s of the bowel). Fin ally, shunt obst ruction may o ccur due to grow th of an infan t or child, or phys ical activ ities which
result in disconnection of the shunt components or withdrawal of a distal catheter from its intended drainage site.
Clott ing around the a trial port ion of a cathet er may lead to embo lization of th e pulmonar y arterial tr ee with resul ting cor pulmo nale and
pulmonary hypertension.
Disconnected shunt components may further migrate into the heart, or into the peritoneal cavity.
Shunt systems may fail due to mechanical malfunction, leading to under- or overdrainage.
5
Page 8

“Small” s ize catheter s have thinner w alls and lower over all strengt h as compared w ith “Standar d” size cathe ters.
“Small” s ize peritone al catheter s have been repo rted to have a hig her rate of fra cture when c ompared to “St andard” size p eritoneal c atheters.
Physici ans who implant “ Small” size per itoneal cat heters for an y reason (i.e. cosm etic) should we igh the benef it against t he potentiall y
higher rate of peritoneal catheter revision.
Malfun ction or obs tructio n of the shunt sys tem may lead to sig ns and sympto ms of increase d intracran ial pressur e if the hydrocep halus is not
compensated. In the infant, the common symptoms are increased tension of the anterior fontanelle, congestion of scalp veins, listlessness,
drowsiness and irritability, vomiting and nuchal rigidity. In older children and adults, the common symptoms are headaches, vomiting,
blurring of vision, memory loss, nuchal rigidity, deterioration of consciousness, and various abnormal neurological findings.
Overdr ainage of CSF may p redispose d evelopment o f a subdural hem atoma or hydroma o r collapse of th e lateral ventr icular walls le ading to
obstruction of the ventricular catheter.
If the vent ricular cat heter become s bound to the ch oroid plexu s or adjacent br ain tissue by f ibrous tissu e adhesions, i t is suggeste d that it
should no t be forcibly r emoved. It is sug gested that gentle ro tation of the c atheter may hel p to free it. It is a dvised that t he catheter b e left in
place rat her than risk in traventric ular hemorrh age which may be c aused by forc ible removal .
Subcut aneous cath eter passer s can break at we lds or compone nt assembly po ints, or due to e xtreme def ormation of t he malleable sh aft.
Sudden br eakage can le ad to trauma of ti ssues or organ s, and damage to th e shunt syste m. Instrume nts must be ins pected pri or to use to
ensure co ntinued inte grity and f unctional ity. Disposa ble instrum ents must nev er be reused, or i njury to the p atient or physi cian is possib le.
Complications
Complic ations asso ciated with ve ntriculoa trial and vent riculoper itoneal CSF shu nting syst ems may be similar t o those exper ienced in any
surgical procedure carried out under local and/or general anesthesia. These include reactions to drugs and anesthetic agents, electrolyte
imbalan ce, and excessi ve blood loss, p articular ly in infant s. The patient m ay rarely exhi bit a reacti on due to sensit ivity to the im plant.
Use of non -filtered o r non-contr olled flui ds for preimp lantation te sting may resu lt in improper v alve perfo rmance and nec essitate val ve
revisio n. Devices mus t be handled in c ontrolled ho spital envir onments onl y to prevent the in troducti on of partic les, fiber s or other
contaminants into the valve.
Use of shar p instrumen ts while hand ling these dev ices can nick o r cut the silico ne elastomer, re sulting in leak age and neces sitating val ve
revisio n. Care must al so be taken when c losing incis ions to ensure th at the valves ar e not cut or nicke d by suture nee dles.
In all CSF sh unting proce dures, the mo st common comp lications ar e due to obstru ction of the s ystem as des cribed unde r “Warnings an d
Precau tions” in thi s product pa ckage inser t. Obstru ction may occ ur in any compone nt of the syst em due to pluggin g by brain frag ments,
blood cl ots and/or tumo r cell aggrega tes at some poi nt along its cou rse. Obstr uction may al so occur bec ause of separa tion of the comp onents
of the sys tem or kinkin g and/or coiling o f the cathete r. This may predisp ose migrati on of the ventri cular cathe ter into the later al ventricl e and
the dist al catheter i nto the heart a nd pulmonar y arterial t ree, the perit oneum, or other s tructur e in which the c atheter is impl anted. Grow th
of the inf ant or child may c ause the dist al catheter to b e withdrawn f rom the atri um into the inter nal jugular vei n or from the pe ritoneum into
tissue p lanes where th e fluid cann ot be absorbe d.
In addit ion to the type s of shunt obst ruction d escribed ab ove, there are ot her potentia lly serious co mplication s. Local and sy stemic infe ctions
are not unc ommon with any s hunting proc edure. They are m ost usually du e to organisms t hat inhabit the s kin, parti cularly Staphylococcus
epidermidis. However, other p athogens ci rculating in t he blood stre am may colonize t he shunt and, in th e majority o f patients, re quire its
removal.
In 1973, Rober tson et al summ arized the inc idence of infe ction in ven triculoat rial and ventr iculoperi toneal shunt s reported u p to that time.
The incidence of infection in ventriculoatrial shunting varied from 7 to 31%. Infection in ventriculoperitoneal shunting occurred in 5 to 10%
of the pat ients in most o f the report s. Becaus e ventriculo atrial shunt ing predispo ses to the spre ad of bacter ia into other org ans of the body,
ventriculoperitoneal shunting is considered less devastating.
Recentl y, (1993) Kes tle et al repor ted signif icant red uctions in i nfectio n (less than 4%) wit h the use of anti biotics, sh ort durat ion of surger y (surgical
exper ience) and contr ol of the oper ating room env ironment (e.g., d esignated op erating ro om, limited pe rsonnel and t raffi c, covered sk in surface s).
The art icle state s that result s can also be ob tained with out the use of a ntibiotic s, but with ri gorous peri operative c ontrol of the e nvironmen t.
The use of p rophylact ic antibioti cs in shunted p atients is so mewhat contr oversial bec ause their us e may predispo se infecti on by more
resist ant organism s. Therefor e, the decisio n to use antibiot ics prophy lacticall y rests with t he attendin g physician an d/or surgeon.
Overdr ainage of CSF may r esult in exces sive reduc tion of CSF pres sure and pred ispose the dev elopment of a su bdural hemat oma or hydroma,
and exces sive reduc tion of ventri cular size lead ing to obstru ction bec ause of imping ement of the vent ricular wall s on the inlet hol es in the
cathet er. In the infant, t his excessiv e reduction o f pressure wi ll cause marke d depressio n of the anterio r fontanelle, o verriding of c ranial bone s
and may conve rt communic ating into ob structi ve hydrocepha lus.
The inci dence of epilep sy after ven tricular shu nting proced ures has been r eported. T his study als o indicated th at the inciden ce of seizure s
increased with multiple catheter revisions.
Shuntin g into the perit oneum may fail b ecause of inve stments of t he catheter i n loops of bowel o r in the greater om entum. Perf orations of
the bowel b y the peritone al catheter w ith subsequ ent developme nt of periton itis has been de scribed.
Complications for Instruments
Complications directly associated with the use of the Subcutaneous Catheter Passer include difficult y in passing the instrument through
scarred areas and the possible formation of hematomas.
Returned Goods Policy
Produc ts must be re turned in uno pened packa ges, with manu facture r’s seals intac t, to be accepte d for replacem ent or credit , unless
return ed due to a compla int of produc t defect or m islabeling. D eterminat ion of a produc t defect or m islabeling wi ll be made by Medt ronic
Neurosu rgery, which d eterminati on will be fin al. Product s will not be acce pted for repla cement or cre dit if they have be en in posses sion of the
custom er for more tha n 90 days.
6
Page 9

Warra nty
A. Stand ard Limited Wa rranty. Medtronic Neurosurgery warrants to the original end user purchaser (“Purchaser”) that the enclosed single
use impl antable prod uct (“Produ ct”) pur chased by Purc haser, at the time o f delivery to P urchaser, shall b e substanti ally free fr om defect s
in materi al and workman ship. Medtro nic Neurosur gery makes no w arranty (exp ress, implie d, or statut ory) for Prod ucts that ar e modified
(except as ex pressly con templated her ein) or subjec ted to unusual ph ysical stre ss, misuse, imp roper opera tion, neglec t, imprope r testing, us e
in combin ation with ot her product s or componen ts other than t hose for whic h the Produc ts were design ed, or use in any ma nner or medic al
proced ure for which t he Product s are not indic ated.
B. Remedy. Pu rchaser’s exc lusive remed y and Medtron ic Neurosurg ery’s sole lia bility for b reach of the for egoing warr anty shall be, a t
Medtro nic Neurosur gery’s sole o ption and elec tion, to repl ace the Produc t or credit Pu rchaser for t he net amount ac tually paid f or any such
Produc t; provided t hat (i) Medtro nic Neurosur gery is noti fied in writ ing within ni nety (90) days af ter Purchas er’s receipt of t he Product t hat
such Pro duct faile d to conform, in cluding a deta iled explan ation in Englis h of any alleged no nconformi ty; (ii) such Pr oduct is ret urned to
Medtro nic Neurosur gery withi n ninety (90) day s after Purch aser’s receip t of the Produc t F.O.B. 125 Cremona Drive, G oleta, Cali fornia 93117,
U.S.A. or as otherwise designated by Medtronic Neurosurgery; and (iii) Medtronic Neurosurgery is reasonably satisfied that the claimed
nonconf ormities ac tually exi st. Except as e xpressly p rovided in thi s paragraph, P urchaser shal l not have the righ t to return Pro ducts to
Medtronic Neurosurgery without Medtronic Neurosurgery’s prior written consent.
C. Excl usion of Oth er Warranti es. EXCEPT FOR THE LI MITED WARRANTY PR OVIDED IN (A) ABOVE, MEDTR ONIC NEUROSURGERY
GRANTS NO O THER WARRANTIES OR CON DITIONS, EXPRES S OR IMPLIED, AND MANUFACTUR ER SPECIFICALLY DISCLA IMS
THE IMPLIED WARR ANTIES AND CONDITION S OF MERCHANTABILITY AN D FITNESS FOR A PARTICULAR P URPOSE. MEDTRONI C
NEUROSURGER Y NEITHER ASSUMES NO R AUTHORIZES ANY OTHE R PERSON TO ASSUME AN Y OTHER LIABILITIES ARI SING OUT OF OR
IN CONNECTI ON WITH THE SALE OR USE OF ANY P RODUCT.
789
Page 10

Page 11
Delta shuntsæt
140
120
100
80
60
40
20
52030
105
70
35
125
90
55
40 50
140
120
100
80
60
40
20
52030
120
85
50
140
105
70
40 50
Beskrivelse
Hver Medtronic Neurosurgery Delta ventil omfatter en trykreguleringsmembran i forlængelse af en normal lukket hævertkontrolmekanisme.
Med denn e kombination e r ventilen i sta nd til at opret holde det intr aventrikul ære tryk (IVP) i nden for et nor malt fysio logisk områd e,
uanset patientens flowkrav til cerebrospinalvæske (CSV) eller kropsposition. Flowkontrol opnås med kombineret modstand fra membranen
og hævertkontroldiafragmen. Graden af modstand afgør ventilens præstationskarakteristika. Membranen forhindrer tilbageløb.
Hæverteffekten styres af Delta hævertkontroldelens to normalt lukkede silikone-elastomer-diafragmer. Diafragmerne åbner som reaktion på
positiv opstrøms IVP.
Ventilen f ås i to større lser, lille og stan dard. Hver st ørrelse fås t il tre tryko mråder: Funk tionsnive au 1, 1,5 og 2. Ventilens præ stationsk arakteri
stika er v ist i grafer ne (fig. 1a-b).
Sætte t med den lille s tørrelse in deholder en De lta ventil, lil le størrels e til funkti onsniveau 1, 1,5 eller 2 . Sættet med s tandards tørrelsen
indeho lder en Delta ve ntil, standa rd størrels e til funkt ionsniveau 1, 1,5 elle r 2. Begge sæt in deholder et 23 c m bariumimp rægneret
ventrikelkateter med standarddiameter og et 90 cm bariumimprægneret kardialt/peritonealt kateter med standarddiameter.
1a
Funktionsniveau 2,0
O)
2
TRYK (mm H
Funktionsniveau 1,5
Funktionsniveau 1,0
FLOWHASTIGHED (mL/ t)
Hver enkelt Medtronic Neurosurgery ventil er på fremstillingstidspunktet afprøvet for driftsegenskaber ved hjælp af et vandfyldt system. Alle ventiler skal overholde
etiketternes specifikationer i disse tests. Efterfølgende tests af ventilen kan give andre resultater afhængigt af testforholdene og ventilens tilstand. Afprøvning på
fremstillingstidspunktet tjener til at sikre stabil, høj kvalitet i hver Medtronic Neurosurgery ventil.
1b
Funktionsniveau 2,0
0 cm H2O HP*
BEMÆRK: De afbildede niveauer er
medianværdier. Tolerancespændet for disse
medianværdier er +/- 25 mm H20.
*Hydrostatisk tryk
Dansk
O)
2
TRYK (m m H
Funktionsniveau 1,5
Funktionsniveau 1,0
- 50 cm H2O HP*
BEMÆRK: De afbildede niveauer er
medianværdier. Tolerancespændet for disse
medianværdier er +/- 40 mm H20.
*Hydrostatisk tryk
FLOWHASTIGHED (mL/ t)
Hver enkelt Medtronic Neurosurgery ventil er på fremstillingstidspunktet afprøvet for driftsegenskaber ved hjælp af et vandfyldt system. Alle ventiler skal overholde
etiketternes specifikationer i disse tests. Efterfølgende tests af ventilen kan give andre resultater afhængigt af testforholdene og ventilens tilstand. Afprøvning på
fremstillingstidspunktet tjener til at sikre stabil, høj kvalitet i hver Medtronic Neurosurgery ventil.
Cerebrospinalvæsken løber ud af katetret gennem fire spalteåbninger, der er placeret 90° fra hinanden omkring katetrets omkreds
i nærhed en af den dista le spids (fig. 8). Dis se åbninger e r udformet, s å de forhind rer tilbagel øb. De er ikke udf ormet som tr yk-/
flowko ntrolventi ler, men tilføje r let modstan d til flowet . Den maksimal e modstand m od flowet ved e n konstant f lowhastigh ed på 20 ml/time
er 2,0 cm H2O. Spalteåbningerne er behandlet med grafit under fremstillingen for at minimere risikoen for spaltet overfladeadhæsion under
opbevaring.
Ventilerne er fremstillet med en præcisionsformet, fast polypropylensokkel som sidder i et glat, fleksibelt silikoneelastomerhylster med
kontureret bund (fig. 2). Soklen bidrager til den strukturelle integritet, trykket/flowet samt hævertkontroldelens pålidelighed og forhindrer
forvridning og fastklæbning af ventilsædet og membranen, hævertkontrolportene og diafragmerne. Kuplen er markeret med røntgenfaste,
tantalimprægnerede retningspile, der viser funktionsniveau og flowretning.
Delta ve ntiler omfat ter konnek torer, der er desig net til at form indske muligh eden for kate terfrakob ling. En cirke lligatur er påk rævet for at
fastg øre hvert kate ter til ventil en. Røntgenf aste markør er på hver konnek tors sokke l (fig. 2) giver læg en mulighed f or røntgenvis ualisering a f
katetr es og ventiler s relative pos itioner in vi vo, når der benyt tes røntgen faste katet re.
Page 12
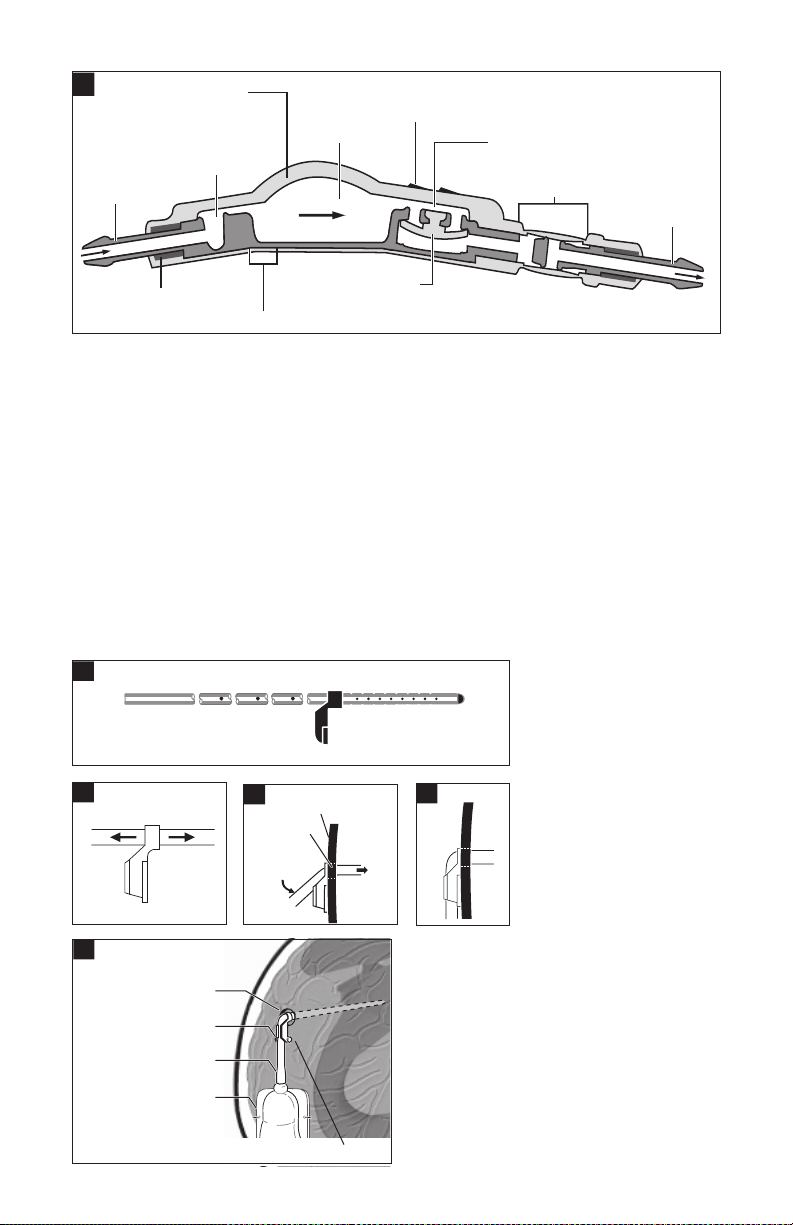
2
Indbygget
indløbskonnektor
Silikonekuppel
Proksimal aflukker
Røntgenfaste indikatorer til funktions/flowretning
Reservoir
Distal aflukker
Delta-kammer
Indbygget udløbskonnektor
Røntgenfast markør
Fast polypropylen-plastiksokkel
Den røntgenfaste kode5på ventilen angiver enhedens tryk-/flowegenskaber:5svarer til funktionsniveau 1,6til funk tionsniv eau 1,5, og
7
til funk tionsniv eau 2. Kuplen er de signet til at l ette injek tion eller pr øvetagni ng af CSV via en 25 G e ller mindre ik ke-udker nende kanyle (f ig. 9).
Den faste polypropylensokkel forhindrer, at kanylen trænger fuldstændigt gennem ventilen. Delta ventiler kan gennemskylles enten i distal eller
proks imal retnin g ved et perkut ant finge rtryk . Der er afluk kere proks imalt og dist alt for det cen trale rese rvoir for at l ette selek tiv gennem skylning.
Silikonemembranventil
Anordningens flowegenskaber påvirkes ikke ved MR-undersøgelse. Anordningen behøver ikke at blive testet eller justeret efter MR-undersøgelse.
Indikationer
Medtro nic Neurosur gery Delt a shuntsæt tene er bereg net til brug ved s hunting af cer ebrospinal væske (CSV) fr a den laterale hj erneventri kel til
højre hjerteforkammer eller bughulen. Desuden minimerer Delta ventilen reduktion af intraventrikulært tryk og volumen, der skyldes kraftig
drænin g af CSV, hvilket kan væ re resultate t af hæverte ffekten i d et distale ka teters hydro statiske tr yk. Hævert effekt en er et fænome n, der
kan skab es ved, at ventri kelkatetre t løftes i fo rhold til det d istale kate ter (dvs. når pati enten sidder, st år eller holde s oprejst).
Brugsanvisning
Kirurgisk teknik
En lang række kirurgiske teknikker kan anvendes til placering af denne Delta-shunt. Kirurgen afgør hvilken metode, der skal anvendes.
Det foreslås, at ventilen placeres i en kirurgisk dannet, løs subgaleal lomme, således at komprimering via den overliggende hovedbund
undgås, og ikke under hovedbundsincisionen. Ventilen kan fastgøres til nærtliggende væv ved at suturere gennem flangen af
polyesterforst ærket materiale.
Anbringelse af en Medtronic Neurosurgery Delta-ventil vil have indflydelse på den generelle shunt-funktion. Foramen Monroi er et godkendt
nulreferencepunkt for overvågning af intrakranielt tryk. Anbringelse af ventilen over disse referencepunkter resulterer i en generel øgning i
3
10
4
7
10
Spiralbor eller borehul
Retvinklet klemme
Ventrikelkateter
CSV-flowkontrolventil,
kontureret
5
Kranium
Borehul
Bøj kateter;
skub det ind i
tapfordybningen
Til ventrikler
Sutur
6
Dette k an gøres, men s stilett en sidder i kate teret. Den ru stfri s tålstile t
er desig net til at let te indførin gen af katetr et i den latera le ventrikel.
Stilet ten er indsat i k atetrets l umen.
Når katet ret er placere t korrekt i ven triklen og s tiletten er f jernet,
tryk kes den ekst rakraniale d el af katetre t ind i den retvi nklede clip s’
spalter ørssegme nt for at danne en r etvinkle t bøjning (fig . 5 og 6).
Katere t må ikke stræk kes, når det tr ykkes ind i clip sen. Hvis kate tret
skal placeres i ventriklen gennem et indføringsrør, skal clipsen fjernes
før katetrets indføring gennem indføringsenheden. Den retvinklede
clips skal fastgøres til det omkringliggende væv ved at suturere
igennem d e to suturhull er på clipsen s sider (fig. 7).
Delta ventilen tilsluttes ventrikelkatetret ved at indsætte den integrerede
polypropylenkonnektor i ventrikelkatetrets slange. Konnektoren skal
være fuldstændigt dækket af kateterslangen. Sæt slangen fast til
konnektoren med en cirkelligatur. Der skal udvises forsigtighed for at
sikre, at li gaturen giv er en sikker til slutning, ud en at der skære s i slangen.
shuntsystemets flowmods tand. Anbringelse
af ventilen under disse referencepunkter vil
resulte re i et generel t fald i shunts ystemets
flowm odstand, nå r patienten sid der,
står ell er holdes opr ejst. Disse æn dringer
er direkte proportionelle med den
lineære a fstand (mm) over e ller under
referencepunktet.
Kirurgisk procedure
Placering af ventrikelkateter
Den retvinklede clips på ventrikelkatetret
(fig. 3) kan b ruges til at bø je katetret t il en
omtren tlig vinkel på 9 0°, ved punktet , hvor
katetret går ud af spiralboret eller borehullet
(fig. 6). Cli psen kan brug es som markø r for den
planlagte dybde af kateterindføringen, når
den inden indføringen skubbes den passende
afst and fra katet rets prok simale spid s (fig. 4).
Page 13
Der skal f ormes en subg aleal lomme me d en passend e dybde til den e kstrak raniale del af v entrikelka tetret og shu ntsætte ts Delta ven tilkompone nt.
Det anbe fales, at imp lantation a f ventrikelk atetret er de t sidste trin i s huntingpr oceduren. D ette minim erer tab af CSV u nder operat ionen.
Placering af peritonealkateter
Der kan be nyttes en la ng række kirur giske teknik ker til placeri ng af
distal katetret i bu ghulen. Kiru rgen afgør, hvor k atetret skal p laceres.
Katetr ets længde er 9 0 cm med vægsp alter ved den dis tale ende (fi g. 8).
Katetr ene er tilstr ækkeligt lang e til placerin g i hjerte- el ler bughule hos
de fles te voksne. Ki rurgen kan kl ippe den prok simale ende af e fter det
valgte anbringelsessted på operationstidspunktet. Den distale ende kan
også kli ppes, hvis der i kke ønskes kate tervægsp alter. Passage n gennem katet ret skal kontr olleres før o perationen (s e Shuntpass agecheck).
FORSIGTIG : HVIS DEN DISTALE ENDE AF DET K ARDIALE/PER ITONEALE KATETER K LIPPES, MÅ DET IKKE ANBR INGES ATRIALT.
Hvis der er behov for et subkutant tunnelinginstrument til placering af det distale kateter, anbefales Medtronic Neurosurgery subkutan
kateterindfører til engangsbrug.
BEMÆRK: Medtronic Neurosurgery Delta shuntsæt leveres ikke med en kateterindfører til engangsbrug.
FORSIGTIG : LAV RIVESTYR KE ER EN AF DE KARAK TERISTISKE EGEN SKABER VED UFORS TÆRKEDE SILIKONE-EL ASTOMER-MATERIALE R.
DER SKAL UDV ISES STOR OMHU VED HÅN DTERING OG PLACERIN G AF KATETERSYSTE MET AF SILIKONE-ELA STOMER FOR AT UNDGÅ
SNIT, RIDSER ELLER OVERRIVNINGER.
Injek tion i ventilen
Medtro nic Neurosur gery Delt a ventil er desig net til at let te injektio n eller prøvet agning af CSV g ennem kuplen v ed hjælp af en 25 G ell er
mindre ikke-udkernende kanyle (fig. 9).
FORSIGTIG : LAV RIVESTYR KE ER EN AF DE KARAK TERISTISKE EGEN SKABER VED UFORS TÆRKEDE SILIKONE-EL ASTOMER-MATERIALE R.
VÆR FORSIGTI G VED INDFØRING OG UDTAGNING A F KANYLEN.
Kanylen s kal indføre s under en vin kel på højst 45° f ra kraniet e ller bunden af v entilen. Hvi s ventilen ska l punktere s flere gang e, anbefale s det, at
kanylen indsættes flere steder for at undgå mange punkturer på et enkelt sted på kuplen. Kateterslanger, aflukkere og hævertkontroldiafragmer
må ikke anvendes som indsprøjtningssteder.
FORSIGTIG: DENNE ENHEDS HÆVERTKONTROLDEL
ER IKKE BEREG NET TIL AT TILLADE
KANYLE PENETRERING. PÅ GRUND AF D ENS
PLACERING ER D ET MEGET USANDSY NLIGT,
AT KANYLEN V ILLE BLIVE INDSAT SÅLEDES, AT
DEN PUNKTERER TRYK-/FLOWMEMBRANEN
ELLER HÆVERTKONTROLDIAFRAGMER. VÆR
FORSIGTIG S Å DETTE UNDGÅS , DA PUNKTUR AF
MEMBRAN ELLER DIAFRAGMER KAN PÅVIRKE
VENTILENS PRÆSTATIONSKARAKTERISTIK A OG
KOMPROMITTERE SHUNTSYSTEMET.
Kanyle 25 G eller derunder
Ventilgennemskylning
Perkutan nedtrykning af ventilkuplen med fingeren
tvinger cerebrospinalvæske ud af ventilen i både
proks imal og dista l retning. Fo r at skylle se lektiv t
trykkes og aflukkes enten den proksimale eller distale
aflukkerdel på ventilen med perkutant fingertryk,
hvoref ter ventilk uplen tryk kes ned (fig . 10). Dette
vil forå rsage væsk eflow i den mo dsatte re tning af
den afl ukkede side af v entilen. Hvi s der er mærkb ar
modstand overfor kompressionen på kuplen, kan det
gennemskyllede kateter være aflukket.
FORSIGTIG: SHUNTOKKLUSION KAN OPSTÅ
I EN HVILKEN S OM HELST KOMPONEN T AF
SHUNTSYSTEMET OG BØR DIAGNOSTICERES VHA.
KLINISKE FUND O G DIAGNOSTISK TES T.
VENTILGENNEMSKYLNINGSEGENSKABERNE
ER MULIGVIS IKKE TILSTRÆKKELIGE TIL AT
DIAGNOSTICERE, HVORVIDT KATETRENE ER
AFLUKKEDE ELLER EJ. SE AFSNITTET MED ADVARSLER.
Tryk ned på ventilkuplen Tryk ned på aflukkeren
Gennemskylningsretning
Udløb
10
11
Shuntpassagecheck
Ventil:
a. Anbring ventilens indløbskonnektor i sterilt,
isotonisk saltvand.
b. Tryk på ventilens centrale reservoir og slip
det igen f lere gange, ti l væsken flyd er ud af
udløbskonnektoren. Hvis der flyder væske ud
af udløbskonnektoren, hver gang det centrale
reser voir tryk kes ned, er venti len i god og
passab el tilstand (f ig. 11).
FORSIGTIG: TILFØRSEL AF PARTIKULÆRE
STOFFER TIL TES TOPLØSNINGEN KAN PÅVIR KE
TESTRESULTATERNE OG PRODUKTETS YDEEVNE.
Indløb
Pump kuppel
Væskeniveau
Steril isotonisk væske
8
9
11
Page 14
FORSIGTIG : DER MÅ IKKE ASPIRERE S VÆSKE GENNEM SHUNTE N FRA DEN DISTALE KATETERE NDE. DETTE KAN F ØRE TIL
BESKADIGELSE AF MEDTRONIC NEUROSURGERY DELTA VENTILEN.
FORSIGTIG: OVERDREVENT SKYLNINGSTRY K KAN FORÅRSAGE MIDLERTIDIG DEFORMERING AF FLOWKONTROL VENTILMEMBRANEN
OG RESULTERE I UNORMALT LAVE TRYK-/FLOWTESTRESULTATER.
FORSIGTIG : HVIS HÅNDTERING AF DELTA KA MMERET ER NØDVENDI G, MÅ ENHEDEN KUN LØF TES VED DIAFRAGMER NE MED
BEHANDSKED E FINGRE. DER MÅ IKKE TR YKKES PÅ DEN YDRE K ANT. UKORREKT HÅNDTERI NG AF DELTA KAMMERET KAN
KOMPROMITTERE INTEGRITETEN AF SHUNTSYSTEMET.
Kardialt/peritonealt kateter:
Kateterpassagen skal kontrolleres på operationstidspunktet. Kateterpassagekontrollen omfatter en visuel sikring af, at der kan passere
cerebrospinalvæske gennem alle spalteåbninger.
1. Ved katetre ts proksi male ende inds ættes en 17 G stum p kanyle i indgan gshullet, og d er gennemsk ylles med ste rilt, fysi ologisk
saltvand under anvendelse af forsigtigt sprøjtetryk.
2. Hold øje med
spalteåbningerne nær
den dist ale ende. Der
skal kunn e passere
væske gen nem alle
åbninge r, og de skal
være åbn e i deres fulde
længde.
3. Ved forsig tigt at
rulle katetrets
spalteåbningsområde
mellem to mmel- og
pegef inger kan man
åbne spal terne, hvis de
ikke ser u d til at være
helt åbne.
4. Udglat katetervæggen
med tomm el- og
pegefinger, så
spalteåbningerne er i
lukket po sition, ef ter at passag etesten er af sluttet.
Manometerhætte
(afmonteret)
Sprøjtefilter
Sprøjte
B-D
1oz
30
Stophane
3/4
Manometer
1/4
1/2
510152025
0 cm
35
34
33
Silikoneslange
3
2
1
0
-1
(Korrekt
-2
justering af
-3
manometer)
O
F
F
30 cm
Tilslut produkt her
Testning inden implantation
Hver Delta ventil er individuelt afprøvet for at sikre overensstemmelse med
de drif tsegensk aber, der er angiv et på mærkaten . Selvom bekr æftelse af
en ventil s dynamiske dri ftsege nskaber med en s tatisk tes t, der kan udfø res
i operat ionsstuen, i kke er mulig, vil k irurgen mul igvis kontro llere, at Delt a
ventilen er i overensstemmelse med Medtronic Neurosurgery specifikationer
inden implantation. Følgende testning inden implantation kan udføres på
operationsstuen.
FORSIGTIG : SØRG FOR AT OPRETHOLDE ST ERILITET OG AT UNDGÅ
KONTAMINERING MED PARTIKLER.
BEMÆRK: Delta ve ntilen skal af prøves alen e og ikke tilslut tet til kate trene
i sætte t.
Testningsmetode
I. Påkrævet udstyr til testning
1. Sterilt væskereservoir eller sterilt vandbad
2. Et sterilt 30 cm vandmanometer, med måleinddelinger i centimeter
3. E n tre-vejs st ophane (til bru g med manomete ret)
4. E n steril sprø jte, 30 ml
5. E t sterilt spr øjtefilte r, 5 µ
6. E n steril hanlu erkonnekt or
7. Sterile silikoneslanger
II. Opstilling af udstyret
1. Tag hæ tten af manom eteret. Plac er manometer, sto phane og
vandba d sådan, at nulni veauet på manom eteret og væs kestanden i
vandba det har samme hø jde (fig. 12). (Sæt mano meteret fas t på et
drop-stativ.)
2. F yld sprøjten m ed sterilt va nd under anvend else af 5 µ
sprøjte filteret . (Ved genfy ldning af sprøj ten skal 5 µ sprøj tefilter et
altid anvendes.) Efter fyldning af sprøjten tages sprøjtefilteret af.
3. Forbind sprøjte, manometer og silikoneslanger som vist i figur 12.
4. For at tømme a l luft ud fra d et samlede s terile test apparatur sk al
stopha nen drejes som v ist i figur 13.
5. Nedsænk s ilikoneslang erne i det ste rile vandbad , og skyl dem
igennem med sterilt vand fra sprøjten.
Fra sprøjte
10
Fra sprøjte
1/4
10
1/4
10
1/4
5
5
5
F
Slået fra
O
F
-3
F
F
Slået fra
O
Til ventil
-3
Til manometer
F
F
O
Slået fra
-3
Fra manometer
Til ventil
Vandbad
med
konstant
niveau
12
13
14
15
12
Page 15

III. Kalibre ring af udstyre t
1. Drej stop hanen som vist i f igur 14, og fy ld manometere t til mindst 5 c m H2O.
2. Med silikoneslangerne nedsænket i vandbadet drejes stophanen for at isolere sprøjten fra manometeret (fig. 15).
3. Lad vands øjlen i manome teret dale.
4. Vandsøjle n bør stoppe ve d nulpunkte t på manometer et, som vist i f igur 12. Hvis den ik ke gør det, hæve s eller sænkes m anometeret
tilsvarende.
5. Manometeret er nu kalibreret til vandbadets nulpunkt. Fastsæt eller montér manometeret for at opretholde referencepunktet med
vandbadet.
IV. Testprocedure
BEMÆRK: Under tes tning skal ve ntilen være ne dsænket i det s terile vandb ad. For korrek t resultat s kal nulpunk tet på manomet eret være
rettet rigtigt ind med vandbadets væskestand.
1. S lut den steri le ventil, der ska l afprøves, t il det montere de sterile te stappara tur.
2. D rej stophan en som vist i fi gur 14, og fyld ma nometeret ti l mindst 30 cm H2O.
3. D rej stophan en for at isoler e manometere t fra flowb anen som vist i f igur 13.
4. Tøm a l luft ud af vent ilen og det mon terede test apparatur ve d forsigti gt at skylle de t igennem med s terilt vand f ra sprøjten.
5. E tabler for sigtigt fl owet gennem ven tilen med ster ilt vand fra s prøjten.
6. N edsænk den s terile ventil i d et sterile va ndbad. Ventile ns udløbskonn ektor skal v ære under vand f or at opnå korre kte testre sultater.
7. M ens flowet f orsigtigt o pretholde s gennem venti len, drejes st ophanen for at i solere sprøj ten fra flow banen som vis t i figur 15. Når
stopha nen er placeret i k orrekt st illing, bør van dsøjlen i mano meteret beg ynde at falde. S prøjten er nu is oleret fra ve ntilen, og for tsat
flow me d sprøjten er ik ke længere nød vendigt. Hvi s vandsøjlen i kke falder, gent ages punkt 2 t il 7.
BEMÆRK: Lad vand niveauet i man ometeret fal de i 2 til 2 ½ minut. Af læs det resu lterende tr yk på manomet eret.
Testresultater – Testning inden implantation
Den resulterende trykaflæsning, der opnås ved denne metode, kan sammenlignes med følgende egenskaber:
Ventilfunktionsniveau Acceptable trykområder
Niveau 1 1 til 60 mm H2O ved 0 HP
Niveau 1,5 35 til 95 mm H2O ved 0 HP
Niveau 2 70 til 130 mm H2O ved 0 HP
Levering
Medtronic Neurosurgery Delta shuntsæt leveres STERILE og IKKE-PYROGENE og er udelu kkende bereg net til engangsbrug. MÅ IKKE
RESTERILISERES.
Det vedla gte produk t er kun bestem t til brug på en en kelt patient. D ette produ kt må ikke genb ruges, genb earbejdes el ler resteri liseres.
Genbru g, genbearbe jdning eller r esterilis ation kan for ringe produ ktets str ukturelle i ntegritet o g/eller skabe r isiko for konta minering af
anordni ngen, hvilket k an medføre pe rsonskade , sygdom eller d ødsfald fo r patienten. Må i kke anvendes, hv is emballage n har været åbne t
eller er beskadiget. Medtronic Neurosurgery er ikke ansvarlig for ydeevnen af noget produkt, der er blevet resteriliseret.
En komple t shunt kræver e t ventrikelka teter, en Medtro nic Neurosur gery Delta v entil og et kar dialt/peri tonealt kate ter eller peri tonealt
kateter.
Specialprodukter
Hvis denn e brugsanvi sning følger m ed et special produkt, k an der være for skel på de fys iske egenskab er hos det bes tilte produk t og det
produkt, der er beskrevet i brugsanvisningen. Disse forskelle har ingen betydning for sikkerheden eller effek tiviteten af specialproduktet.
Specia lprodukt er kan leveres s terile elle r usterile so m angivet på pr oduktet s pakkeeti ket. Usteril e produkte r skal rengør es og sterili seres før br ug.
Kontraindikationer
Shuntin g af CSV til højr e hjertefo rkammer, bughu len eller andre s teder i krop pen bør ikke gen nemføres, hv is der forekom mer infekti on i et
af de områder, hvor shunt-systemets komponenter skal implanteres. Det gælder bl.a. infektioner i hovedbunden og andre hudområder, som
shunt-systemet skal passere, meninges og cerebralventriklerne, peritoneum og intraperitoneale og retroperitoneale organer, pleura og
blodbanerne. CSV-shunting er kontraindiceret, hvis der er infektion i nogen som helst del af kroppen. En anden kontraindikation er shunting
til atrium hos patienter med arvelige hjertesygdomme eller andre alvorlige kardiopulmonære abnormaliteter.
Patientinformation
Det er læg ens ansvar at or ientere pati enten og/eller d ennes pårør ende om CSV-shu nting. Det te indebærer e n beskrivels e af de
komplikationer, der er knyttet til implanterbare shuntsystemer, og en forklaring af mulige alternative produkter og behandlinger.
Advarsler og forholdsregler
Passend e produkt, s tørrelse, t ryk eller anv endelsesom råde skal vælg es efter pa tientens spe cifikke be hov på baggru nd af diagnost iske tests
og lægens erfaring. Produktetiketten specificerer det relevante produkts ydeevne eller anvendelsesområder.
Undgå kont akt med impl anterbare pr odukter me d fnug, talku m, oliereste r fra hud, olieb aserede sæ ber, syntetiske v askemidler el ler
andre overfladekontaminanter. Fnug, fingeraftryk, talkum, andre overfladekontaminanter eller rester fra latexhandsker kan resultere i
fremmedlegemer eller allergiske reaktioner.
Vær omhyggelig for at sikre, at der ikke trænger partikelkontaminanter ind i shuntens komponenter under testning eller håndtering inden
implantationen. Indtrængen af kontaminanter kan resultere i nedsat ydeevne (over- eller underdrænage) af shuntsystemet. Par tikler, der
trænger ind i shunt-systemet, kan desuden holde tryk-/flydekontrolmekanismerne åbne, hvilket kan føre til overdrænage.
Ved fastg ørelse af kate trene til konn ektorern e skal de omligg ende ligature r fastgøre s sikkert, me n ikke for stra mt, for at de ikke e fterhånd en
skærer igennem silikoneslangerne.
Undgå at ka tetrene dann er knæk eller sk rabes unødi gt langs indfø ringsveje n. Kanten af spir alboret elle r borehullet k an klippes fo r at opnå en
skråt skåret kant, hv or ventrikelk atetret komm er til syne og bu er for at ligge t æt ved kranie t.
13
Page 16

Patient er med hydrocep halus-shunt systemer s kal holdes und er skarp obse rvation i de n postopera tive period e, så man kan konst atere
eventue lle tegn og sym ptomer på fejl i s hunten. De klin iske fund kan in dikere fejl i shu nten. De klinis ke fund kan ind ikere shunt-inf ektion ell er
under- eller overdrænage af CSV.
Shuntok klusion kan f orekomme i en hvi lken som helst ko mponent i shunt systeme t. Systemet ka n blive okklud eret internt p å grund af
vævsfragmenter, blodklumper, tumorcelleaggregater, bakteriel kolonisering og anden debris. Katetre, der berører indre kropsstrukturer, kan
danne knæ k eller blive blo kerede i spids en (f.eks. omri ngning af en vent rikelkatet erspids i cho roidea plex us eller af en dis tal kateter spids i
omentu m majus eller sly ngninger på ta rmen). Endelig ka n der hos børn el ler spædbør n opstå shunt okklusion p å grund af væks t eller fys isk
aktivitet, hvilket kan resultere i løsrivning af shuntkomponenterne eller tilbagetrækning af et distalt kateter fra dets påtænkte drænagested.
Størkning omkring atriedelen af et kateter kan føre til embolisering af lungepulsåren med deraf følgende cor pulmonale og pulmonal hypertension.
Desuden kan løsrevne shuntkomponenter vandre ind i hjertet eller bughulen.
Shunts ystemer kan s vigte på grun d af mekanisk f ejlfunkt ion, hvilket kan f øre til under- el ler overdræna ge.
Katetr e i ”lille” stør relse har ty ndere vægge o g generelt lave re styrke s ammenlignet m ed katetre i ”st andard” stø rrelse.
Periton eale katetre i ” lille” stør relse er bleve t rapporte ret at have en høje re fejlhyppig hed (frakt ur) sammenlig net med perit oneale katet re
i ”standar d” størrel se. Læger, som imp lanterer per itoneale kate tre i ”lille” s tørrelse ua nset årsag en (dvs. kosmeti sk), bør afveje f ordelen i
forhold til den potentielt højere hyppighed af revision af et peritonealt kateter.
Fejlfu nktion elle r okklusion af s huntsyst emet kan føre t il tegn og symp tomer på øget i ntrakrania lt tryk, hv is der ikke kompe nseres for
hydrocephalus. Hos spædbørn er de almindelige symptomer øget spænding i den anteriore fontanel, blodophobning i kranievenerne, apati,
omtågethed og irritabilitet, opkastning og nakkestivhed. Hos større børn og voksne er de almindelige symptomer hovedpine, opkastning,
synssløring, hukommelsestab, nakkestivhed, svækket bevidsthedsniveau og forskellige anormale neurologiske symptomer.
Overdr ænage af CSV ka n prædispone re for udvik ling af et subdu ralt hæmatom, hy drom eller koll aps af de lateral e ventrikelvæ gge, hvilket ka n
føre til o kklusion af ve ntrikelkat etret.
Hvis vent rikelkatet ret bliver bun det til choro idea plexus e ller det tilst ødende hjer nevæv med fi brøse vævsa dhæsioner, anb efales det, a t det
ikke fj ernes med mag t. Det foresl ås, at katetre t drejes forsigtigt for at hj ælpe med at fri gøre det. Det t ilrådes, at k atetret ef terlades på p lads
fremfor at risikere intraventrikulær blødning som resultat af fjernelse med magt.
Subkutane kateterindførere kan knække ved sammensvejsninger eller komponentsamlepunkter, eller som følge af ekstrem deformation
af det bøj elige skaf t. Pludselige b rud kan medf øre traume på v æv eller organ er og beskadig else af shunt systemet. I nstrument erne skal
undersøges før brug for at sikre fortsat integritet og funktionalitet. Engangsinstrumenter må aldrig genbruges, da dette vil kunne medføre
patient- eller personskader.
Komplikationer
Komplikationer, der er knyttet til ventrikuloatriale og ventrikuloperitoneale CSV-shuntsystemer, kan ligne dem, man møder inden for
alle kirurgiske procedurer, der gennemføres under lokal og/eller fuld bedøvelse. Blandt disse komplikationer indgår reaktioner over for
medici n og bedøvels esmidler, elek trolytu balance og kra ftigt blo dtab, specie lt hos spædbø rn. Patienten k an i sjældne til fælde vise te gn på
overfølsomhed mod implantatet.
Brug af ikke-filtrerede eller ikke-kontrollerede væsker til testning inden implantation kan resultere i dårlig ventilydeevne og nødvendiggøre
ventilr evision. Anor dningerne m å kun håndtere s i kontrollere de hospital smiljøer, så der ik ke indføres p artikle r, fibre eller and re
kontaminanter i ventilen.
Anvendel se af skarpe in strumente r ved håndteri ng af disse enhe der kan ridse e ller snitte si likoneelas tomeren, hvil ket kan medfør e lækage og
kræve ven tilrevisio n. Der skal også u dvises for sigtighed , når incision er lukkes for at si kre, at ventile r ikke snitte s eller ridse s af suturnåle.
Årsagen til de mest almindelige komplikationer ved alle CSV-shuntingprocedurer er okklusion af systemet som beskrevet under ”Advarsler
og forho ldsregler ” i dette pro dukts indl ægsseddel . Okklusion k an forekomme i en h vilken som hels t komponent i s ystemet på gr und af
tilstopning med hjernefragmenter, blodklumper og/eller tumorcelleophobninger et eller andet sted i systemet. Der kan også forekomme
okklusion på grund af separation af systemkomponenter eller bøjning og/eller snoning af katetret. Dette kan prædisponere for vandring
af ventri kelkatetre t til den latera le ventrikel og a f det distale k ateter til hje rte- og lung epulsåren, p eritoneum el ler andre str ukturer,
som kate tret er implan teret i. Et spæd barns eller ba rns vækst k an medføre, at d et distale ka teter trække s tilbage fr a atrium til den i ndre
jugular vene eller fr a peritoneu m til vævsplan er, hvorfra væ sken ikke kan abs orberes.
Udover ovennævnte typer shuntokklusion, findes der andre mulige alvorlige komplikationer. Lokale og systemiske infektioner er ikke
ualmind elige i alle ty per shunting -procedur er. De skyldes no rmalt organ ismer der fin des i huden, isæ r Staphylococcus epidermidis. Dog kan
andre patogener, der cirkulerer rundt i blodet, kolonisere shunten, og hos størstedelen af patienterne kræver det fjernelse af shunten.
I 1973 opsummerede Robertson et al. forekomsten af infektioner i ventrikuloatriale og ventrikuloperitoneale shunts, der var blevet
rapporteret indtil dette tidspunkt. Forekomsten af infektioner i ventrikuloatrial shunting varierede fra 7% til 31%. Infektion i
ventrik uloperito neal shunting f orekom hos 5 % ti l 10 % af patientern e i de fleste r apporter. Da ve ntrikuloat rial shuntin g prædispon erer for
spredn ing af bakter ier i andre af kro ppens organ er, anses ventri kuloperito neal shuntin g for at være mind re kritisk.
Senere (i 1993) rapporterede Kestle et al. om signifikante reduktioner i infektionerne (mindre end 4%) i forbindelse med brugen
af antibiotika, kort operationsvarighed (kirurgisk erfaring) og kontrol med miljøet i operationsstuerne (f.eks. specielt dedikerede
operationsstuer, begrænset personale og persontrafik, tildækkede hudoverflader). Artiklen oplyser, at disse resultater også kan opnås uden
brug af antibiotika, men med omfattende perioperativ kontrol af miljøet.
Brug af profylaktiske antibiotika til shuntede patienter er temmelig kontroversiel, idet dette kan prædisponere for infektioner af mere
resistente organismer. Derfor hviler beslutningen om at bruge antibiotika profylaktisk hos den behandlende læge og/eller kirurg.
CSV-ove rdrænage kan r esultere i be tydelig red uktion af CS V-trykket o g kan prædisp onere for udv ikling af et sub duralt hæmat om eller
hydrom og i b etydelig re duktion af v entrikelst ørrelsen me d okklusion t il følge på gru nd af indtræn gning i ventri kelvæggene i k atetrets
indgangshuller. Hos spædbørn vil denne store trykreduktion medføre markant sænkning af den anteriore fontanel, overskydning af
kranieknoglerne og eventuelt ændret overførsel til obstruktiv hydrocephalus.
Der er rapporteret om tilfælde af epilepsi efter ventrikulære shuntingprocedurer. Denne undersøgelse indikerede, at forekomsten af anfald
steg i tak t med antall et af kateterr evisioner.
Shuntin g til periton eum kan mislyk kes, hvis katet ret indeslu ttes i tarms lyngninger e ller i omentum ma jus. Perfor eringer af ta rmen af
peritonealkatetret med efterfølgende udvikling af peritonitis er beskrevet.
14
Page 17

Instrumentkomplikationer
Komplikationer, der er direkte forbundet med anvendelse af den subkutane kateterpassage, er bl.a. besvær med at passere instrumenter
gennem cikatrice-områder og mulig dannelse af hæmatomer.
Returnering af varer
Produk ter skal retu rneres i uanb rudt paknin g med intakt p roducentf orseglin g for at blive ers tattet el ler krediter et, medmind re produkte rne
return eres på grun d af en klage vedr ørende en prod uktfejl e ller forker t mærkning. Af gørelsen ve drørende en pr oduktf ejl eller forke rt
mærkni ng træffe s af Medtroni c Neurosurg ery, og denne afg ørelse er end elig. Produk ter vil ikke bli ve accepteret t il erstatn ing eller
kredit ering, hvis de h ar været i kunde ns besiddels e i mere end 90 dag e.
Garanti
A. Almindelig begrænset garanti. Medtronic Neu rosurger y garanterer ov er for den opri ndelige køb er (”Køber” ), at vedlagte
implant erbare prod ukt til engan gsbrug (”Prod ukt”), de r er købt af Købe r, på tidspunkt et for leverin g til Køber er f ri for defek ter i material e og
udførelse. Medtronic Neurosurgery giver ingen garanti (udtrykkelig, underfor stået eller lovmæssig) for Produkter, der er ændret (undtagen
som udtr ykkelig på tænkt heri) e ller udsat fo r usædvanlig f ysisk bela stning, for kert brug el ler ukorrek t betjening, f orsømmels e, ukorrekt
testni ng, brug i forb indelse med a ndre produk ter eller andr e komponenter e nd dem, hvorti l Produkte rne blev konst rueret, ell er brug på
nogen anden måde eller til et medicinsk indgreb, hvortil Produkterne ikke er indicerede.
B. Retsm iddel. Købe rs eneste re tsmiddel og M edtronic Neu rosurger y’s eneste ans var for brud på o venstående g aranti er, på Medt ronic
Neurosu rgery’s ege t valg, at erst atte Produ ktet eller kr editere Køb er for det net tobeløb, der b lev betalt fo r et sådant Pro dukt, foru dsat at (i)
Medtro nic Neurosur gery blive r skriftli gt underre ttet inden fo r halvfems (90) d age efter K øbers modt agelse af Prod uktet, at Pro duktet ikke v ar
i konformitet, herunder en detaljeret forklaring på engelsk af enhver påstået manglende konformitet, (ii) Produktet returneres til Medtronic
Neurosu rgery inde n for halvfe ms (90) dage efte r Købers mod tagelse af Pr oduktet F.O.B. (fri t om bord) til 125 Cre mona Drive, Go leta,
California 93117, U.S.A. eller ifølge Medtronic Neurosurgery’s anden angivelse og (iii) Medtronic Neurosurgery er rimeligt tilfreds med, at de
påstå ede manglend e konformite ter rent fakt isk eksist erer. Borts et fra, hvad der e r udtrykke ligt fasts at i dette af snit, har Køb er ikke ret til at
returnere Produkter til Medtronic Neurosurgery uden Medtronic Neurosurgery’s forudgående skriftlige tilladelse.
C. Udelu kkelse af an dre garant ier. BORTSET FRA DE N BEGRÆNSEDE GAR ANTI NÆVNT UNDER ( A) HEROVER GIVER MEDTR ONIC
NEUROSURGERY INGEN ANDRE GARANTIER ELLER BETINGELSER, HVERKEN UDTRYKKELIGE ELLER UNDERFORSTÅEDE, OG
PRODUCENTE N FRALÆGGER SIG IS ÆR ANSVAR FOR UNDERFOR STÅEDE GARANTIER O G BETINGELSER FOR SALG BARHED OG EGNETHED
TIL ET BESTEMT F ORMÅL. MEDTRON IC NEUROSURGERY PÅTAGER SIG IKKE O G BEMYNDIGER IKKE NO GEN ANDEN PERSON T IL AT
PÅTAGE SIG NOGET ANDET AN SVAR SOM RESULTAT AF ELLER I FORBINDEL SE MED SALGET ELLER BRUG EN AF ET PRODUKT.
15
Page 18

16
Page 19

Delta-shuntkit
14
12
10
52030
40 50
14
12
10
52030
140
40 50
Beschrijving
Iedere Medtronic Neurosurgery Delta-klep heeft een membraandrukklep die in serie geplaatst is met een normaal gesloten
sifonregelmechanisme. Dankzij deze combinatie kan de klep de intraventriculaire druk (IVD) binnen een normaal fysiologisch bereik houden,
ongeacht de behoefte aan flow van cerebrospinaal vocht (CSV) of de lichaamspositie van de patiënt. Regeling van de flow geschiedt via de
gecombineerde weerstand van het membraan en de sifonregeldiafragma’s. De mate van weerstand bepaalt de prestatiekarakteristieken
van de klep. Het membraan verhindert retrograde flow. Het sifon-effec t wordt geregeld door de twee normaal gesloten siliconenelastomeer
diafragma’s van de Delta-sifonregeling. De diafragma’s openen zich in respons op positieve stroomopwaarts e intraventriculaire druk.
De klep is ve rkrijgbaa r in twee afme tingen, klei n en normaal. Be ide afmetin gen zijn verkr ijgbaar in dr ie drukbere iken: presta tieniveau 1, 1,5
en 2. De prestatiekarakteristieken van de klep worden in de afbeeldingen weergegeven (fig. 1a-b).
In de kit me t de kleine klep z it een Delta -klep, klein, m et prestat ieniveau 1, 1,5 of 2. In de ki t met de normal e klep zit een De lta-klep,
normaa l, met presta tieniveau 1, 1,5 of 2. Bei de kits bevat ten een ventr iculaire kat heter van 23 cm m et standaar d diameter en me t barium
geïmpregneerd en een cardiale/peritoneale katheter van 90 cm met standaard diameter en met barium geïmpregneerd.
1a
0
0
O)
0
2
80
60
DRUK (mm H
40
20
105
70
35
Prestatieniveau 2,0
Prestatieniveau 1,5
Prestatieniveau 1,0
FLOWSNELHEID (ml/uur)
De prestatiekenmerken van alle Medtronic Neurosurgery klep zijn ten tijde van de fabricage getest met behulp van een met water gevuld testsysteem. Alle kleppen
voldoen aan de labeling specificaties van deze tests. Latere tests van de klep kunnen een verschillend resultaat opleveren, afhankelijk van de testomstandigheden en
de conditie van de klep. Het testen ten tijde van de fabricage gebeurt teneinde de consistente hoge kwaliteit van elke Medtronic Neurosurgery klep te verzekeren.
125
0 cm H2O HP*
90
OPMERKING: De afgebeelde niveaus zijn
mediaanwaarden. Het tolerantiebereik van
deze gemiddelde waarden is +/- 25 mm H20.
55
*Hydrostatische druk
Nederlands
1b
0
0
O)
0
2
80
60
DRUK (mm H
40
20
120
85
50
Prestatieniveau 2,0
Prestatieniveau 1,5
Prestatieniveau 1,0
105
70
- 50 cm H2O HP*
OPMERKING: De afgebeelde niveaus zijn
mediaanwaarden. Het tolerantiebereik van
deze gemiddelde waarden is +/- 40 mm H20.
*Hydrostatische druk
FLOWSNELHEID (ml/uur)
De prestatiekenmerken van alle Medtronic Neurosurgery klep zijn ten tijde van de fabricage getest met behulp van een met water gevuld testsysteem. Alle kleppen
voldoen aan de labeling specificaties van deze tests. Latere tests van de klep kunnen een verschillend resultaat opleveren, afhankelijk van de testomstandigheden en
de conditie van de klep. Het testen ten tijde van de fabricage gebeurt teneinde de consistente hoge kwaliteit van elke Medtronic Neurosurgery klep te verzekeren.
Cerebro spinaal voch t verlaat de kath eter via vier sp leten die telke ns op 90˚ van elkaa r dicht bij de dis tale tip op de ka theteromt rek zijn
aangebr acht (fig. 8). Dez e spleten zijn be doeld om ret rograde fl ow te voorkomen . Ze zijn niet ont worpen als kl eppen voor dr uk- en
flowr egeling, maa r voegen een ger inge flow weerstan d toe. Maximal e weerstand t egen flow bij e en constant e flowsnelh eid van 20 ml/uur is
2,0 cm H2O. De splete n zijn tijdens d e vervaardi ging bedek t met grafie t om de kans op aank leving van het g espleten op pervlak tij dens opslag
te minimaliseren.
De kleppen zijn vervaardigd met een precisiegeperste basis van stevig polypropyleen die in een gladde, flexibele siliconenelastomeer
behuizing met gecontoureerde bodem zit (fig. 2). De basis draagt bij aan de structurele integriteit, druk/f low, en betrouwbaarheid van de
sifonr egeling, waa rdoor vervo rming en het vas tkleven van d e klep aan het mem braan en de sifo nregelpoo rten aan de dia fragma’s worde n
voorkomen. De koepel is gemarkeerd met radiopake, met tantaal geïmpregneerde indicators die het prestatieniveau en de richting van de
flow aanduiden.
17
Page 20

2
Ingebouwde inlaatconnector
Siliconen koepel
Proximale afsluiter
Reservoir
Radiopake prestatie-/flowrichting-indicators
Distale afsluiter
Delta-kamer
Ingebouwde
uitlaatconnector
Radiopake markering
Stevige polypropyleen kunststof basis
De Delta-kleppen zijn voorzien van connectors die de kans op loskoppeling van de katheter verminderen. Eén omcirkelende ligatuur is vereist om
elke kath eter aan de klep v ast te maken. Ra diopake mar keringen aan d e basis van elke co nnector (f ig. 2) maken het de a rts mogel ijk de relatie ve
positi e van de kathet ers en de klep in v ivo door middel van röntgendoorlichting te visualiseren wanneer radiopake katheters worden gebruikt.
De radiopake5code op de klep is een aanduiding van de druk/flowkarakteristieken van het apparaat;5correspondeert met prestatieniveau
1,6met pres tatienive au 1,5 en7met pres tatienive au 2. De koepel is sp eciaal ontw orpen om inje cties of mon sterafnam e van CSV door
middel v an een 25 gauge of k leinere niet- borende (non- coring) naal d mogelijk te make n (fig. 9). De stevi ge polypropy leen basis vo orkomt
volledige penetratie van de klep door de naald. Delta-kleppen kunnen zowel in distale als proximale richting met percutane vingerdruk
gespoe ld worden. Om se lectief sp oelen te verge makkelijken zi jn proximaal e n distaal van he t centrale re servoir af sluiters ge plaatst.
De flow karakter istieken van h et apparaat wo rden niet beïnv loed door ee n MR-onderz oek. Het appa raat hoef t niet getest o f opnieuw
afges teld te worden na e en MR-onder zoek.
Siliconen membraanklep
Indicaties
De Medtronic Neurosurgery Delta-shuntkits zijn bedoeld voor gebruik bij het shunten van CSV van de laterale ventrikels van de hersenen
naar het re chteratri um van het har t of de peritone ale ruimte. De De lta-klep m inimaliseer t bovendien o vermatige ver laging van de
intraventriculaire druk en het volume, die door overmatige drainage van CSV veroorzaakt wordt, en die teweeggebracht kan worden door
het sifoneffect van de hydrostatische druk van de distale katheter. Het sifon-ef fect kan worden veroorzaakt door het hoger plaatsen van de
ventric ulaire kathe ter ten opzich te van de distal e katheter (bi jv. wanneer de pat iënt zit, ops taat of recht op wordt gehou den).
Gebruiksaanwijzing
Operatietechniek
Verscheidene operatieve technieken kunnen worden aangewend voor het plaatsen van de Delta-shunt. De chirurgische techniek is naar keuze
van de chirurg.
Het verdient aanbeveling de klep in een chirurgisch geprepareerde ruime subgaleale holte te plaatsen en niet onder de hoofdhuidincisie,
3
4
7
Clip met rechte hoek
Ventriculaire katheter
CSV-flowregelingsklep,
Spiraalboorgat of
boorgat
gecontoureerd
10
5
Boorgat
Verbuig
katheter, druk
in gleuf van het
lipje
Schedel
Naar
ventrikels
Sutuur
6
Deze veranderingen zijn direct evenredig met de lineaire afstand (mm)
waarover d e klep hoger o f lager dan het re ferentiep unt geplaat st is.
Chirurgische procedure
De ventriculaire katheter plaatsen
De clip met rechte hoek die op de ventriculaire katheter gemonteerd
is (fig. 3) kan w orden gebru ikt om de vent riculaire k atheter een h oek
van ongev eer 90º te doe n vormen op de pl aats waar de ka theter uit
het spir aalboorgat o f uit het boor gat komt (fig. 6). De c lip kan worde n
gebruikt als merkteken voor de geplande inbrengdiepte van de katheter
door dez e tot op de gewens te afstan d van de proxima le katheter tip te
schuiv en alvorens de k atheter in te br engen (fig. 4). Di t kan gebeure n met
het stil et in de kathe ter. Het roest vrijsta len stilet is o ntworpen o m het
inbrengen van de katheter in het laterale ventrikel te vergemakkelijken.
De kathe ter wordt gel everd met het s tilet reed s in het lumen ing ebracht.
zodat compressie door de overliggende
hoofdh uid wordt verm eden. De klep k an aan
het aanliggende weefsel worden vastgemaakt
door mid del van een sutu ur door de met
polyesterweefsel versterk te flens.
De plaatsing van een Medtronic Neurosurgery
Delta-klep beïnvloedt de algemene prestatie van
de shunt. Het ventriculaire foramen (foramen
van Monro) is een gevestigd nulreferentiepunt
voor het b ewaken van de int racranië le druk. Als
de klep hoger dan dit referentiepunt geplaatst
wordt, resulteert dit in een algemeen verhoogde
flow weersta nd van het shunt systeem . De klep
lager dan dit referentiepunt plaatsen resulteert
in een algemeen verminderde weerstand
van het shu ntsyste em aan flow wa nneer de
patiënt zit, staat of rechtop wordt gehouden.
18
Page 21

Nadat de ka theter in de jui ste positie i n het ventrikel g eplaatst is e n het stilet ve rwijderd is , drukt u het e xtracran iale gedeelt e van de kathete r
in het ges pleten slangs egment van de c lip om de kathet er een rechte ho ek te doen aanne men (fig. 5 en 6). Wanne er de katheter i n de clip
gedruk t wordt, mag d e katheter nie t uitgerekt w orden. Als de kat heter door ee n buisvormi ge introduce r in het ventrik el moet worden
geplaat st, moet de cl ip worden ver wijderd voor dat de kathete r door de intro ducer wordt in gebracht. De c lip met recht e hoek moet aan he t
aanliggende weefsel worden vastgemaakt door middel van suturen door de twee sutuurgaatjes op de zijkanten van de clip (fig. 7).
Om de Delt a-klep op de ve ntriculair e katheter aan t e sluiten, stee kt u de gehele p olypropyle en connect or in de slang van de v entriculai re
katheter. De connector moet volledig bedekt worden door de slang. Zet de slang met een omcirkelende ligatuur aan de connector vast. Zorg
dat de liga tuur tot een ste vig resulta at leidt, maar ni et in de slang snij dt.
Een subgaleale holte moet worden geprepareerd met een geschikte diepte om het extracraniale gedeelte van de ventriculaire katheter en de
Delta- klep van de shun tkit te kunne n bevatten. H et verdient aan beveling de ven triculaire k atheter als laa tste stap va n de shuntingp rocedure
te implanteren. Hierdoor gaat tijdens de ingreep zo min mogelijk CSV verloren.
De peritoneale katheter plaatsen
Verscheidene operatieve technieken kunnen worden aangewend om de distale katheter in de peritoneale holte te plaatsen. De plaats
van aanbr enging is naar ke uze van de chiru rg. De kathete rlengte is 90 c m met wandspl eten aan het dis tale uiteind e (fig. 8). Bij de mees te
volwass enen is de leng te van de kathete rs voldoend e voor een card iale of perito neale plaats ing. De chirur g kan het proxi male uiteinde v oor
de geselecteerde locatie ten tijde van de ingreep bijknippen. Als de wandspleten niet nodig zijn, kan het distale uiteinde afgeknipt worden.
De katheter moet ten tijde van de operatie op doorgankelijkheid worden getest (zie “Doorgankelijkheidscontrole van de shunt”).
LET OP: ALS HET D ISTALE UITEINDE VAN DE CARD IALE/PERITONE ALE KATHETER AFGEKNI PT IS, MAG DE KATHETER NIE T ATRIAAL
GEPLAATS T WORDEN.
Als voor de p laatsing van d e distale kat heter een subc utaan tunne linstrume nt
nodig is, wordt het gebruik van de Medtronic Neurosurgery disposable subcutane
katheterinplanter aanbevolen.
OPMERKING: Bij de Medtronic Neurosurgery Delta-shuntkit is geen disposable
katheterinplanter inbegrepen.
LET OP: HET MER ENDEEL VAN NIET-VERSTERK TE MATERIALEN UIT
SILICONENELASTOMEER HEEFT SLECHTS EEN
GERINGE SCH EURVASTHEID. GA MET ZORG T E
WERK BIJ HET HA NTEREN EN PLAATSEN VAN D E
KATHETERSLANG UIT SILICONENELASTOMEER
OM INSNIJDIN GEN, KNIKKEN OF SCH EUREN TE
VOORKOMEN.
25-gauge of kleinere naald
In de klep i njecteren
De Medtronic Neurosurgery Delta-klep werd speciaal
ontworpen om injecties of monsterafname van CSV door
de koepel m ogelijk te mak en met behulp va n een 25
gauge of kleinere niet-borende (non-coring) naald (fig. 9).
LET OP: NIET-VERS TERKTE MATERIALEN UI T
SILICONENELASTOMEER HEBBEN SLECHTS EEN
GERINGE SCHEURVASTHEID. GA VOORZICHTIG TE
WERK BIJ HET INB RENGEN EN HET VERWI JDEREN
VAN DE NAALD.
De naald moet worden ingebracht onder een hoek die niet
groter is d an 45° ten opzich te van de hoofdh uid of van de
basis van d e klep. Indien de kl ep meerdere mal en wordt
aangepr ikt, k an de naal d het bes t in vers chille nde loc aties
gestok en worden, zod at meerder e punctie s op eenzelf de
plaats v an de koep el word en verm eden. D e kath eter slang,
de afsluiters en de diafragma’s voor de regeling van de
sifon mogen niet als injectieplaatsen worden gebruikt.
LET OP: HET OND ERDEEL VAN DIT APPARAAT
DAT VERANTWO ORDELIJK IS VOOR DE R EGELING
VAN DE SIFON, IS NIET B EDOELD OM PENETRATIE
DOOR EEN NA ALD TE WEERSTAAN. VANWE GE DE
LOCATIE IS HET ER G ONWAARSCHIJNL IJK DAT DE
NAALD ZO INGE BRACHT WORDT DAT DE DRUK /
FLOWMEMBRAAN OF DE SIFONREGELDIA FRAGMA’S
GEPUNCTE ERD KUNNEN WORDEN. ZO RG DAT DIT
NIET GEBEURT. PUNCTIE VAN DE MEMBRANEN
OF DIAFRAGMA’S KAN DE PRESTATIEKARAKTERISTIEK EN VAN DE KLEP BEÏNVLOEDEN E N HET
SHUNTSYSTEEM IN GEVAAR BRENGEN.
De klep spoelen
Door percutane vingerdruk op de klepkoepel wordt CSV
uit de kle p in proximal e en distale r ichting ge duwd. Om de
klep sel ectief te s poelen, moe t u de proxima le of distal e afsluiters van de klep indrukken en afsluiten door middel van
percutane vingerdruk en vervolgens de klepkoepel indrukken (fig. 10). Hie rdoor vloe it de vloeis tof in de tegen overgesteld e richting v an de afgeslo ten kant van de k lep.
Inlaat
Druk de klepkoepel in
Spoelrichting
Druk de afsluiter in
Uitlaat
Pomp koepel
Vloeistofniveau
Steriele isotonische vloeistof
10
11
8
9
19
Page 22

Als u merkbare weerstand ondervindt bij het indrukken, is het mogelijk dat de katheter geobstrueerd is.
LET OP: OBSTRU CTIE VAN DE SHUNT KAN IN I EDER ONDERDEEL VAN HET SH UNTSYSTEEM VOO RKOMEN EN MOET DOOR M IDDEL VAN
KLINISCHE BE VINDINGEN EN DIAGNO STISCHE TESTS GE CONSTATEERD WORDEN. DE KA RAKTERISTIEK EN DIE DE KLEP VERTOO NT
BIJ HET SPOE LEN, ZIJN WELLICHT NIE T VOLDOENDE OM KATHET EROCCLUSIE TE KUNNEN VAS TSTELLEN. ZIE HET H OOFDSTUK
WAARSCHUWINGEN.
Doorgankelijkheidscontrole van de shunt
Klep:
a. Plaats de i nlaatconnec tor van de kle p in een sterie le, isotone fy siologisc he zoutoplos sing.
b. Het central e reservoi r van de klep her haaldelijk in drukken en los laten totdat vlo eistof uit de u itlaatconne ctor vloeit . Als bij het
indruk ken van de koepel t elkens vloeis tof uit de uitl aatconnect or vloeit, is d e klep doorgan kelijk (fig. 11).
LET OP: TOEVO EGING VAN VASTE DEELTJES AAN DE T ESTOPLOSSING KA N DE TESTRESULTATEN EN DE WERKING VAN HE T PRODUCT
BEÏNVLOEDEN.
LET OP: ASPIR EER GEEN
VLOEISTOF VAN AF HET
DISTALE UITEINDE D OOR DE
SHUNT. HIERDOOR K AN DE
MEDTRONIC NEUROSURGERY
DELTA-KLEP BESCHADIGD
RAKEN.
LET OP: EEN TE HO GE
SPOELDRUK K AN EEN
TIJDELIJKE VERVORMING VAN
HET FLOWREGELINGSKLEPMEMBRAAN VEROORZAKEN
EN TOT ABNORM AAL LAGE
DRUK-/FLOWTESTRESULTATEN
LEIDEN.
LET OP: ALS DE DE LTAKAMER GEMANIPULEERD
MOET WORDEN , MAG HET
APPARAAT UITSLU ITEND MET
GEHANDSCH OENDE VINGERS BIJ D E DIAFRAGMA’S VASTGE HOUDEN
WORDEN. OEFEN G EEN DRUK UIT OP DE BUITENR AND. ONJUISTE
HANTERING VAN DE D ELTA-K AMER KAN DE INTEGR ITEIT VAN HET
SHUNTSYSTEEM NADELIG BEÏNVLOEDEN.
Dop van de
manometer (los)
Injectiespuitfilter
Injectiespuit
Cardiale/peritoneale katheter:
De katheter moet ten tijde van de operatie op doorgankelijkheid worden
getest. Tijdens de doorgankelijkheidscontrole moet visueel gecontroleerd
worden of h et cerebros pinale vocht d oor alle sple ten afgevoer d kan worden.
1. Steek een st ompe naald van 17 G in he t open, proxim ale uiteinde
van de kat heter en spoel h em onder zacht e druk met een s teriele
fysiologische zoutoplossing door.
2. Obs erveer de sp leten bij het di stale uite inde. Vocht dien t uit alle
openingen te komen en deze dienen zich over de hele lengte te openen.
3. Door het de el van de kathe ter met de splet en voorzicht ig tussen
duim en wij svinger te ro llen, gaan de sple ten volledig o pen.
4. Strijk d e katheter wand met duim e n wijsvinge r glad, zodat de
spleten gesloten zijn nadat de doorgankelijkheidscontrole is
uitgevoerd.
Pre-implantatietest
Elke Delt a-klep word t getest om con formiteit m et de op het label
opgegeven prestatiekarakteristieken te verzekeren. Hoewel de dynamische
prestatiekarakteristieken van een klep niet gecontroleerd kunnen worden
door mid del van een sta tische test d ie in de operat iezaal uitge voerd kan
worden, k an de chirurg vó ór het implant eren nagaan of de D elta-kle p
voldoet aan de specificaties van Medtronic Neurosurgery. De volgende preimplantatietests kunnen in de operatiekamer worden uitgevoerd.
LET OP: ZORG DAT DE STE RILITEIT BEHOUDEN BLI JFT EN VERMIJD
VERONTREINIGING DOOR VUILE DEELTJES.
OPMERKING: De Delta- klep dient af zonderlij k getest te word en, en niet
terwi jl hij verbonde n is met de kathe ters in de kit.
Testmethode
I. Benodig dheden voor de te st
1. Steriel vloeistofreser voir of een steriel waterbad
2. E én steriele w atermanome ter van 30 cm, gegr adueerd in
centimeters
3. Eén driewegsafsluitkraan (te gebruiken met de manometer)
4. E én steriele i njectiesp uit, 30 ml
1oz
B-D
30
Afsluitkraan
3/4
Manometer
1/4
1/2
510152025
35
34
33
3
2
1
0
0 cm
-1
(Correcte
-2
uitlijning
-3
van de
manometer)
O
F
F
Van injectiespuit
10
Van injectiespuit
10
10
Siliconen
slang
1/4
5
1/4
5
1/4
5
30 cm
Sluit het product hier aan
-3
F
F
O
Naar klep
-3
Naar manometer
O
Uit
-3
Van manometer
O
F
F
Uit
Uit
F
F
Naar klep
Waterbad
met constant
waterniveau
12
13
14
15
20
Page 23

5. E én steriele i njectiesp uitfil ter van 5 µm
6. Eén steriele mannelijke luerconnector
7. S teriele silic onen slang
II. Opstelling van de uitrusting
1. Verwijder de dop van de manometer. Plaats de manometer, de afsluitkraan en het waterbad zodanig dat het nulniveau van de manometer
en het vlo eistofni veau in het water bad zich op de zelfde hoo gte bevinde n (fig. 12). (Bevesti g de manometer a an een infuu sstandaar d.)
2. Vu l de injecti espuit met st eriel water en g ebruik een inj ectiesp uitfilt er van 5 µm. (Gebru ik steeds de inj ectiespu itfilte r van 5 µm bij
het opnieuw vullen van de spuit.) Koppel de injectiespuitfilter telkens nadat de spuit gevuld is, los.
3. Verbind de injectiespuit, de manometer en de siliconen slang zoals afgebeeld in figuur 12.
4. Om alle luch t uit de gemonte erde sterie le testappa ratuur te verd rijven, de afs luitkraan dr aaien zoals af gebeeld in f iguur 13.
5. Dompel de si liconen slang i n het steriel e waterbad ond er en spoel hem me t steriel wat er uit de injec tiespuit do or.
III. Kalibratie van de uitrusting
1. Draai de af sluitkraa n zoals afgebe eld in figuu r 14 en vul de manomet er tot ten minste 5 c m H2O.
2. Draai de afsluitkraan, met de siliconenslang ondergedompeld in het waterbad, om de injectiespuit van de manometer te isoleren (fig. 15).
3. Laat de wate rkolom in de mano meter dalen.
4. De waterko lom moet op het nu lniveau van de ma nometer sto ppen, zoals afg ebeeld in fi guur 12. Indien di t niet het geval i s, moet u de
manometer naar behoefte hoger of lager bevestigen.
5. De manomet er is nu gekalib reerd ten opzi chte van het nuln iveau van het wa terbad. Maak de m anometer vas t of monteer he m om de
refere ntieposit ie ten opzichte v an het waterba d te handhaven.
IV. Testprocedure
OPMERKING: Geduren de de tests mo et de klep onder gedompeld z ijn in het ster iele waterba d. Om correc te resultate n te waarborg en, moet
het nulniveau van de manometer juist zijn uitgelijnd met het vloeistofniveau van het waterbad.
1. Sluit de steriele klep die getest moet worden op de gemonteerde steriele testapparatuur aan.
2. D raai de afslu itkraan zoa ls afgebeeld i n figuur 14 en vul d e manometer to t ten minste 30 cm H2O.
3. D raai de afslu itkraan om de m anometer van h et flowpad te i soleren, zoa ls afgebeel d in figuur 13.
4. Ve rwijder all e lucht uit de kle p en de gemontee rde testapp aratuur doo r voorzicht ig met sterie l water uit de inj ectiespu it te spoelen.
5. B reng de flow d oor de klep lang zaam met het s teriele water v an de inject iespuit, op ga ng.
6. D ompel de ster iele klep ond er in het steri ele waterbad . De uitlaatcon nector van de k lep moet onde r water blijven o m correcte
testresultaten te verkrijgen.
7. D raai, terwi jl de flow doo r de klep wordt ge handhaafd, de a fsluitkr aan om de injec tiespuit va n het flowpa d te isoleren, zo als
afgebe eld in figuu r 15. Nadat de afslui tkraan in de jui ste positie i s geplaatst , moet de waterk olom in de manome ter beginne n
te dalen. D e injectie spuit is nu van de k lep geïsolee rd, en de flow ho eft niet me er te worden geh andhaafd doo r middel van de
injec tiespuit. Al s de waterkolom n iet daalt, st appen 2 tot en met 7 h erhalen.
OPMERKING: Laat het wa terpeil in de ma nometer gedu rende 2 tot 2 ½ minu ten dalen. Lees d e resulteren de druk van de man ometer af.
Testresultaten – Pre-implantatietest
De resulterende drukuitslag die met deze methode verkregen is, kan vergeleken worden met de volgende karakteristieken:
Prestatieniveau van de klep Aanvaarbare drukbereik
Niveau 1 1 tot 60 mm H2O bij 0 HD
Niveau 1,5 35 tot 95 mm H2O bij 0 HD
Niveau 2 70 tot 130 mm H2O bij 0 HD
Leveringswijze
De Medtronic Neurosurgery Delta-shuntkits zijn STERIEL en NIET-PYROGEEN verpakt e n zijn uitslui tend voor eenmalig gebruik beste md.
NIET OPNIEUW STERILISEREN.
Het bijg evoegde prod uct is uitsl uitend bedo eld voor gebru ik bij één pati ënt. Dit produ ct niet opni euw gebruike n, opnieuw voor g ebruik
gereed maken of opnieuw steriliseren. Hergebruik, opnieuw voor gebruik gereed maken of opnieuw steriliseren kan de structurele integriteit
van het hulpmiddel in gevaar brengen en/of besmettingsgevaar voor het hulpmiddel veroorzaken, hetgeen letsel, ziekte of de dood van de
patiënt tot gevolg kan hebben. Niet gebruiken als de verpakking geopend of beschadigd is. Medtronic Neurosurgery is niet aansprakelijk voor
de werki ng van een produ ct dat opnieu w gesterili seerd is.
Voor een com plete shunt zij n een ventric ulaire kathe ter, een Medtro nic Neurosurg ery Delta -klep en een ca rdiale/per itoneale kat heter of een
peritoneale katheter benodigd.
Speciaal te bestellen producten
Indien de ze gebruik saanwijzin g bij een specia al te bestelle n product is g evoegd, is het m ogelijk dat er ve rschillen z ijn tussen de ui twendige
karak teristieke n van het bijgevo egde produ ct en het prod uct dat in deze b ijsluiter is be schreven. De ze verschil len hebben gee n invloed op de
veiligheid en de effectiviteit van het speciaal bestelde product.
Specia al te bestelle n producten k unnen steri el of niet-ster iel worden ge leverd, zoals aa ngegeven op he t verpakkin gslabel van he t product.
Niet-steriele producten moeten vóór gebruik worden gereinigd en gesteriliseerd.
Contra-indicaties
Het shunt en van CSV in het r echter atri um, de periton eale holte of and ere delen van he t lichaam mag nie t worden uitge voerd indien e en
infectie aanwezig is in een van de delen waarin de verscheidene onderdelen van het shuntsysteem geïmplanteerd worden. Dit omvat
infecties van de hoofdhuid en andere delen van de huid waar het shuntsysteem doorkomt, de meninges en de hersenventrikels, het
peritoneum en de intraperitoneale en retroperitoneale organen, de pleura en de bloedstroom. Het shunten van CSV is gecontraïndiceerd
indien er in enig lichaamsdeel een infectie aanwezig is. Shunten naar het atrium van patiënten met congenitale hartkwalen of andere
ernstige cardiopulmonale afwijkingen is eveneens gecontraïndiceerd.
21
Page 24

Informatie voor de patiënt
Het behoort tot de verantwoordelijkheid van de arts om de patiënt en/of zijn/haar vertegenwoordiger(s) te informeren over het shunten van
CSV. Dit die nt een beschr ijving te omvat ten van de comp licaties van i mplanteerb are shunts ystemen en een u itleg over mog elijke altern atieve
producten en behandelingen.
Waarschuwingen en voorzorgsmaatregelen
Het juiste product, de juiste maat, de juiste druk of het juiste prestatiebereik moeten worden gekozen volgens de specifieke behoeften van
de patië nt, op basis van di agnostisc he tests en de e rvaring va n de arts. Het l abel van het pro duct spec ificeer t de prestat ieniveaus of he t
prestatiebereik die van toepassing zijn.
Vermijd aanraking van de implanteerbare producten met pluksel, handschoentalk, olieachtig huidresidu, zeep op oliebasis, synthetische
detergenten of andere verontreinigende deeltjes op de oppervlakte. Pluksel, vingerafdrukken, talk, andere verontreinigingen op het
oppervlak of residu van latex handschoenen kunnen vreemdlichaam- of andere allergische reacties veroorzaken.
Zorg dat verontreinigende deeltjes niet in de shuntonderdelen worden geïntroduceerd gedurende de preïmplantatietests of bij het hanteren.
Introd uctie van ver ontreinige nde deeltje s kan een slecht e werking (te veel o f te weinig drai nage) van het shunt systeem to t gevolg hebbe n.
Verontreinigende deeltjes die het shuntsysteem binnendringen kunnen ook de mechanismen voor druk- en flowregeling open houden, wat
overmatige drainage tot gevolg kan hebben.
Bij het vastzetten van de katheters op de connectors moeten de omringende ligaturen rond de slang goed maar niet te strak worden
vastgemaakt, zodat ze uiteindelijk niet door de siliconenslang snijden.
Ga zorgv uldig te werk bij h et leiden van ka theters om k nikken en onnod ig schuren lan gs het trajec t te voorkome n. De rand van het
spiraal boorgat of bo orgat kan word en bijgesned en om een schui ne inkeping te ver krijgen op de p laats waar de ve ntriculair e katheter uit komt
en gebogen is om tegen de schedel aan te liggen.
Patiënt en met een shunt systeem vo or hydrocefa lus moeten ged urende de pos toperatie ve periode van n abij worden gev olgd op tekenen e n
symptomen die op defecten van de shunt wijzen. De klinische bevindingen kunnen erop wijzen dat de shunt slecht functioneert. De klinische
bevind ingen kunnen e rop wijzen dat de s hunt geïnfec teerd is of dat e r te weinig of te vee l CSV afgevoe rd wordt.
Obstr uctie van de sh unt kan zich voo rdoen in iede r onderdeel v an het shunts ysteem. Het s ysteem kan in tern versto pt raken tengev olge
van weefselfragmenten, bloedklonters, opeenhopingen van tumorcellen, bacteriële kolonisatie of ander debris. Katheters die in aanraking
komen met inwendige lichaamsstructuren kunnen geknikt of geblokkeerd raken bij de tip (bijv. insluiting van een ventriculaire kathetertip
in de plex us choroide us of van een dist ale kathete rtip in het om entum majus of de d armlussen). Obs tructie v an de shunt kan zi ch ten slotte
ook voordoen ten gevolge van de groei van de zuigeling of van het kind, of ten gevolge van lichamelijke activiteiten die ontkoppeling van de
shuntonderdelen of terugtrekking van een distale katheter uit de gewenste drainageplaats tot gevolg hebben.
Stolling rond het atriale gedeelte van de katheter kan leiden tot embolisatie van de pulmonale arteriële bloedbaan en de eruit voortvloeiende
cor pulmonale en pulmonale hypertensie.
Ontkoppelde shuntonderdelen kunnen zich tot in het hart of de peritoneale holte verplaatsen.
Shuntsystemen kunnen falen tengevolge van mechanische defecten wat tot te weinig of te veel drainage kan leiden.
“Kleine” katheters hebben dunnere wanden en een geringere algemene sterkte dan de katheters van “standaard” grootte.
Van “klein e” peritone ale katheter s is gemeld dat ze v aker breken dan “st andaard” pe ritoneale ka theters. Ar tsen die om e nige reden een
“klein e” peritonea le katheter im planteren (d.w.z. co smetisch) die nen de voordel en af te wegen teg en een mogelij k hogere kans op r evisie van
de peritoneale katheter.
Defecten of obstructie van het shuntsysteem kunnen leiden tot tekenen en symptomen van verhoogde intracraniële druk indien de
hydrocephalus niet wordt gecompenseerd. Bij de zuigeling zijn vaak voorkomende symptomen verhoogde druk van de fontanella anterior,
congestie van de venen van de hoofdhuid, lusteloosheid, slaperigheid en prikkelbaarheid, braken en nekstijf heid. Bij oudere kinderen en
volwassenen zijn de meest voorkomende symptomen hoofdpijn, braken, wazig zien, geheugenverlies, nekstijfheid, bewustzijnsverlaging en
verscheidene abnormale neurologische bevindingen.
Overma tige drainag e van CSV kan de pa tiënt vatbaa r maken voor een su bduraal hema toom of hydroma o f inzakken van d e laterale
ventrik elwanden, wat o bstruct ie van de ventri culaire kath eter tot gevolg h eeft.
Indien de ventriculaire katheter aan de choroïd plexus of het belendende hersenweefsel komt vast te zitten door middel van
bindwe efseladhe sies, wordt aa nbevolen de ka theter niet me t kracht te ver wijderen. He t wordt aanbe volen de kathe ter met behulp va n
voorzichtige rotati e los te maken. Het v erdient aanb eveling de kath eter op zijn plaa ts te laten, tene inde het risic o op intraventr iculaire
bloeding als gevolg van een krachtdadige verwijdering te vermijden.
Subcutane kathetergeleiders kunnen breken bij de lasnaden of op plaatsen waar de componenten geassembleerd zijn, ofwel ten gevolge van
extr eme deforma tie van de plooi bare schach t. Het plotse linge breken k an leiden tot tra uma van organe n of weefsels e n het shuntsy steem
beschadigen. De instrumenten moeten vóór gebruik worden geïnspecteerd om een ononderbroken integriteit en functionaliteit te
verzekeren. Disposable instrumenten mogen nooit opnieuw worden gebruikt, aangezien dit letsel zou kunnen toebrengen aan de patiënt of
aan de ar ts.
Complicaties
Complicaties van ventriculoatriale en ventriculoperitoneale shuntsystemen voor CSV kunnen lijken op de complicaties van andere
operatieve ingrepen die onder plaatselijke en/of algemene anesthesie worden uitgevoerd. Deze complicaties zijn onder andere reacties
op geneesmiddelen en anesthetische middelen, elektrolyten-onevenwicht en overmatig bloedverlies, vooral bij zuigelingen. In zeldzame
gevalle n kan de patiënt e en sensitiv iteitsreac tie verto nen op het impla ntaat.
Het gebruik van ongefilterd of ongecontroleerde vloeistoffen voor de pre-implantatietest kan leiden tot een onjuist prestatieniveau van de
klep en een revisie van de klep noodzakelijk maken. De apparaten mogen uitsluitend in gereguleerde ziekenhuisomgevingen gehanteerd
worden om de introductie van deeltjes, vezels of andere verontreiniging in de klep te voorkomen.
Wanneer scherpe instrumenten worden gebruikt tijdens het hanteren van deze hulpmiddelen, kan de siliconenelastomeer worden
ingesn eden of geknip t, wat tot lekken l eidt en een rev isie van de klep n oodzakelij k maakt. Ga zor gvuldig te wer k bij het hechte n van de
incisies om te voorkomen dat de kleppen gesneden of geknikt worden door de hechtnaalden.
22
22
Page 25

Bij alle pr ocedures voo r CSV-shunti ng zijn de mees t voorkomend e complicati es te wijten aan ob struct ie van het syst eem, zoals bes chreven
in de sec tie “Waarsc huwingen en vo orzorgmaa tregelen” in d e bijsluiter v an dit produc t. De obstru ctie kan zic h in ieder onder deel van het
systeem voordoen tengevolge van hersenfragmenten, bloedklonters en/of ophopingen van tumorcellen in de katheter. De obstructie kan zich
ook voor doen ten gevolg e van het losrak en van systee monderdele n of van het knik ken en/of kronkel en van de kathe ter. Dit kan de pati ënt
vatbaar m aken voor migr atie van de ventr iculaire kat heter in het lat erale ventri kel en van de dist ale katheter i n het hart, de p ulmonale ader s,
het peri toneum of een an dere struc tuur waarin d e katheter is g eïmplanteer d. De groei van de z uigeling of va n het kind kan er d e oorzaak van
zijn dat de d istale kath eter uit het atr ium en in de v. jugula ris interna wo rdt terugge trokken of uit h et peritone um wordt terug getrokken en i n
weefs ellagen tere chtkomt waar de v loeistof nie t kan worden ge absorbeer d.
Naast de hierboven beschreven soorten shuntobstructies zijn er andere potentieel ernstige complicaties. Lokale en systemische infecties zijn
niet ongewoon bij shuntingprocedures. Zij zijn meestal te wijten aan organismen die zich op de huid bevinden, meer bepaald Staphylococcus
epidermidis. Andere pat hogenen die in d e bloedstr oom circule ren, kunnen ec hter de shunt ook k oloniseren e n bij het merend eel van de
patiënten de verwijdering ervan noodzakelijk maken.
In 1973 vatte n Roberts on et al. de incid entie samen va n infectie s in ventricu loatriale en ve ntriculop eritoneale s hunts die tot da n toe waren
gerapporteerd. De incidentie van infecties bij ventriculoatriale shunts varieerde van 7 tot 31 %. Infecties bij ventriculoperitoneale shunts
kwame n in de meeste ra pporten voo r bij 5 tot 10 % van de pati ënten. Aange zien ventric uloatriale s hunts de pati ënt vatbaar ma ken voor de
verspreiding van bacteriën in andere lichaamsorganen, worden ventriculoperitoneale shunts als minder verwoestend gezien.
Onlangs (1993) mel dden Kestle et a l. een aanzien lijke daling van d e infectie s (minder dan 4 %) dank zij het gebru ik van antibiot ica, korte
duur van de o peratieve in greep (chirur gische erv aring) en cont role van de omge ving in de opera tiezaal (nl. ee n speciaal daa rtoe beste mde
operat iezaal, bepe rkt perso neel en heen en we er geloop, hui doppervl ak bedekt). Het a rtikel verm eldt dat de resu ltaten ook ku nnen worden
bereikt zonder gebruik van antibiotica, maar met een strenge perioperatieve controle van de omgeving.
Het gebruik van profylactische antibiotica bij patiënten met shunts is enigszins controversieel, omdat het gebruik ervan de patiënt vatbaar
kan maken vo or infect ie door organi smen die resis tenter zijn. Da arom berust d e beslissing o m antibiotic a profylac tisch te geb ruiken bij de
behandelende arts en/of chirurg.
Overma tige drainag e van CSV kan te gro te verlaging v an de CSV-druk t ot gevolg hebb en en de patiënt v atbaar maken vo or de ontwik keling
van een subduraal hematoom of hydroma, en overmatige vermindering van de afmetingen van het ventrikel, wat tot obstructie leidt ten
gevolge van botsing van de ventriculaire wanden met de inlaatgaten van de katheter. Bij de zuigeling zal deze overmatige drukvermindering
een uitgesproken depressie van de fontanella anterior en overhelling van de schedelbeenderen veroorzaken, en kan de hydrocephalus
communicans worden omgezet in obstructieve hydrocephalus.
Er zijn meldingen van epilepsie na ventriculaire shunting. Dit onderzoek gaf ook aan dat het aantal epileptische aanvallen toenam bij
meervoudige katheterrevisies.
Shunten in het peritoneum kan mislukken vanwege insluiting van de katheter in de darmlussen of het omentum majus. Perforatie van de
darm doo r de peritonea le katheter en e en daaropvol gende ontwi kkeling van pe ritonitis is b eschreven.
Complicaties voor Instrumenten
Complicaties die rechtstreeks geassocieerd worden met het gebruik van de subcutane katheterinplanter omvatten het ervaren van
moeilijkheden bij het doorvoeren van het instrument door littekenweefsel en de mogelijke vorming van hematomen.
Teruggezonden goederen
De producten moeten in de ongeopende verpakking worden teruggestuurd, met de zegels van de fabrikant ongeschonden, om in aanmerking
te komen voor vervanging of krediet, behalve indien zij worden teruggestuurd tengevolge van een klacht in verband met een defect aan of
verkeer de etikette ring van het pr oduct. Med tronic Neuro surgery z al bepalen of ee n product al d an niet defec t of verkeerd g elabeld is. De ze
beslissing is definitief. Producten komen niet voor vervanging of krediet in aanmerking als de klant deze gedurende meer dan 90 dagen in zijn
bezit heeft gehad.
Garantie
A. Standaard beperkte garantie. Medtronic Neurosurgery garandeert de oorspronkelijke koper-eindgebruiker (hierna genaamd de
koper) dat h et bijgeslote n implanteer baar produc t voor eenmal ig gebruik (hi erna genaamd h et product) d at door de koper is a angekocht, o p
het ogen blik van afle vering aan de kop er in wezen vrij z al zijn van def ecten in mate riaal en afwe rking. Medt ronic Neuros urgery gee ft geen
enkele garantie (hetzij uitdrukkelijk, stilzwijgend of statutair) voor producten die zijn gewijzigd (behalve zoals uitdrukkelijk hierin voorzien)
of zijn onderworpen aan uitzonderlijke spanning, verkeerd gebruik, onjuist gebruik, onachtzaamheid, onjuist testen, gebruik in combinatie
met ande re producte n of met onderd elen waarvo or de produc ten niet speci aal zijn ontw orpen, of gebr uik op een wijze o f in een medisc he
procedure waarvoor de producten niet zijn aangewezen.
B. Verh aal. Het uitsluitende verhaal van de koper en de uitsluitende aansprakelijkheid van Medtronic Neurosurgery wegens schending van
de hierboven vermelde garantie bestaat - naar de uitsluitende keus van Medtronic Neurosurgery - uit het vervangen van het product of het
credit eren van de kope r voor het nett o, feitelijk vo or het produc t betaalde b edrag, op voor waarde dat (i) M edtronic Neu rosurger y schrift elijk
in kennis wo rdt gesteld , binnen negen tig (90) dagen na ont vangst van h et product d oor de koper, dat dit p roduct nie t conform was; d e
kennisgeving moet een gedetailleerde uitleg in het Engels omvatten van de beweerde non-conformiteit; (ii) het product binnen de negentig
(90) dagen na ontvangst door koper van het product F.O.B. wordt teruggestuurd naar Medtronic Neurosurgery, 125 Cremona Drive, Goleta,
California 93117, USA of zoals aangewezen door Medtronic Neurosurgery; en (iii) dat Medtronic Neurosurgery er redelijk van overtuigd is dat
deze non -conformi teit werkelij k bestaat. B ehalve zoals ui tdrukkelijk i n deze paragr aaf is voorzie n, beschik t de koper niet ove r het recht om
producten naar Medtronic Neurosurgery terug te sturen zonder voorafgaande schrif telijke toestemming van Medtronic Neurosurgery.
C. Uits luiting van a ndere gara nties. BUITEN DE HI ERBOVEN IN (A) BESCHRE VEN BEPERKTE GAR ANTIE BIEDT MEDTRON IC
NEUROSURGER Y GEEN ENKELE ANDERE G ARANTIE, HETZI J UITDRUKKELIJK OF S TILZWIJGEND, EN D E FABRIKANT WIJST
INZONDERHEID DE STILZWIJGE NDE GARANTIES EN CONDITIES VAN VERKOOPBAARHEID EN GESCHIKTHEID VOO R EEN BEPAALD DOEL
AF. MEDTRONIC NEUROSURGERY NEEMT GEEN ENKELE ANDERE AANSPRAKELIJKHEID OP ZICH EN GEEFT EVENMIN AAN ANDEREN
TOESTEMM ING OM ANDERE AANSPR AKELIJKHEDEN, VO ORTVLOEIENDE U IT OF IN VERBAND MET DE VER KOOP OF HET GEBRUIK VAN
EEN PRODUC T, OP ZICH TE NEMEN.
23
Page 26

24
Page 27

Kit de dérivation Delta
14
12
10
52030
140
40 50
14
12
10
52030
40 50
Description
Toutes les valves Delta Medtronic Neurosurgery se composent d’une valve de pression à membrane en série avec un mécanisme anti-siphon
normalement fermé. Cette combinaison permet à la valve de maintenir la pression intraventriculaire dans une plage physiologique normale,
quels que s oient les imp ératifs de dé bit du liquide c éphalorach idien (LCR) ou la pos ition corpo relle du patie nt. Le débit es t contrôlé par l a
résistance combinée de la membrane et des diaphragmes anti-siphon. Le degré de résistance détermine les caractéristiques de performance
de la valve. L a membrane em pêche le ref lux. L’effet de siph on est contrô lé par les deux d iaphragmes e n élastomère d e silicone nor malement
fermés du mécanisme anti-siphon Delta. Les diaphragmes s’ouvrent en réponse à une pression positive intraventriculaire en amont.
La valve e st disponib le en deux taille s, petite et no rmale. Chaque t aille est dis ponible en tro is plages de pr ession : niveau d e perform ance 1,
1,5 et 2. Les car actéris tiques de per formance de l a valve sont ind iquées sur les g raphiques (F ig. 1a-b).
Le kit pou r la petite tail le comprend un e valve Delta de t aille petite , pour un niveau de p erforma nce 1, 1,5 ou 2. Le kit pour la t aille normale
compren d une valve Delt a de taille nor male, pour un niv eau de perfo rmance 1, 1,5 ou 2. Les deu x kits compre nnent un cathé ter ventric ulaire
de 23 cm, de d iamètre sta ndard et impré gné de bary um, ainsi qu’un cat héter intra cardiaque/p éritonéal d e 90 cm, de diamèt re standard e t
imprégné de baryum.
Français
1a
0
0
O)
2
0
80
60
40
PRESSION (mm H
20
Niveau de performance 2,0
105
Niveau de performance 1,5
70
Niveau de performance 1,0
35
125
0 cm H2O HP*
90
REMARQUE : les niveaux décrits
représentent des valeurs moyennes.
La plage de tolérance des valeurs
55
moyennes est ± 25 mm H2O.
*Pression hydrostatique
DÉBIT (ml/ hr)
Chaque valve Medtronic Neurosurgery a été éprouvée à l’aide d’un dispositif de test rempli d’eau afin de vérifier ses caractéristiques de performance au moment
de sa fab ricatio n. Toutes les v alves sou mises au tes t sont con formes au x spécif icatio ns décrit es sur l’étiq uette. Il e st possi ble que des ép reuves ul térieur es d’une
valve do nnent des rés ultats dif férent s selon les con ditions du t est et de la valv e. Cette épr euve au moment d e la fabrica tion a pour fo nction d’as surer la haut e
qualité systématique de chaque valve Medtronic Neurosurgery.
1b
0
0
O)
0
2
80
60
40
PRESSION (mm H
20
120
85
50
Niveau de performance 2,0
Niveau de performance 1,5
Niveau de performance 1,0
105
70
- 50 cm H2O HP*
REMARQUE : les niveaux décrits
représentent des valeurs moyennes.
La plage de tolérance des valeurs
moyennes est ± 40 mm H2O.
*Pression hydrostatique
DÉBIT (ml/ hr)
Chaque valve Medtronic Neurosurgery a été éprouvée à l’aide d’un dispositif de test rempli d’eau afin de vérifier ses caractéristiques de performance au moment
de sa fab ricatio n. Toutes les v alves soum ises au tes t sont conf ormes aux s pécifi cations d écrites s ur l’étique tte. Il est p ossible q ue des épreu ves ultér ieures d’un e
valve do nnent des rés ultats dif férents s elon les cond itions du te st et de la valve. C ette épreu ve au moment de la f abricati on a pour fonc tion d’assu rer la haute
qualité systématique de chaque valve Medtronic Neurosurgery.
Le liquid e céphalorac hidien s’écoule d u cathéter par q uatre fente s espacées à 90 º autour du cat héter à proxim ité de l’extrém ité distale (F ig. 8).
Ces fente s sont conçue s de manière à emp êcher tout f lux rétrogr ade. Il ne s’agit pa s de valves de con trôle de débit o u de pression, m ais elles
oppose nt une légère ré sistance au d ébit. La rési stance au débi t maximale es t de 2,0 cm H2O à un débit co nstant de 20 mL /heure. Les f entes
sont revê tues de graph ite lors de la fa brication p our éviter au ma ximum le risq ue d’adhésion de l a surface fe ndue pendant l e stockage.
Les valves sont constituées d’une base en polypropylène rigide moulé avec précision, logée dans un boîtier en élastomère de silicone souple
et lisse av ec une parti e inférieure p rofilée (F ig. 2). La base, tout e n contribuan t à l’intégri té struct urale, au rappo rt pressio n/débit et à la
fiabi lité du systèm e anti-siph on, est conçue p our empêche r la distorsi on et le grippa ge du siège et de la m embrane de la va lve, ainsi que des
orifices et des diaphragmes anti-siphon. Le dôme comporte des indicateurs radio-opaques imprégnés de tantale qui indiquent le niveau de
performance et la direction du débit.
25
Page 28

2
Connecteur d’entrée
intégral
Dôme en silicone
Obturateur proximal
Indicateurs radio-opaques de la performance et de la direction du débit
Réservoir
Obturateur distal
Chambre Delta
Connecteur de
sortie intégral
Repère radio-opaque
Les valves Delta sont pourvues de connecteurs conçus pour réduire le risque de déconnexion des cathéters. La fixation de chaque cathéter
à la valve né cessite une lig ature encerc lante. Des repè res radio- opaques sit ués sur la base d e chaque conne cteur (Fig. 2) pe rmettent un e
radios copie de la posi tion relativ e des cathéter s et de la valve in vi vo si des cathéters radio-opaques sont utilisés.
Le code radio-opaque5figurant sur la valve indique les caractéristiques de pression/débit du dispositif ;5correspo nd au niveau de
performance 1,6au niveau d e performa nce 1,5 et7au niveau d e performa nce 2. Le dôme est c onçu pour per mettre une i njection o u un
prélève ment de LCR au moyen d ’une aiguille no n déchirante d e calibre 25 ou p lus petite (Fig . 9). La base en poly propylène ri gide empêch e la
pénétr ation complè te de la valve par l ’aiguille. Les val ves Delta peu vent être rinc ées en direc tion distal e ou proximale p ar pression d igitale
percut anée. Des obt urateurs se si tuent proxi male et dista le du réservo ir central af in de facilit er un rinçage s électif.
Les cara ctéristi ques de débit d u dispositif n e sont pas af fectées p ar l’examenRM. Il n’es t pas nécessa ire de tester ni d e réajuster le d ispositif
après un e xamenRM.
Valve avec membrane en silicone
Base en plastique polypropylène rigide
Indications
Les kits de dérivation Delta Medtronic Neurosurgery sont conçus pour être utilisés dans la dérivation du LCR depuis le ventricule latéral
du cerve au jusque dans l ’oreillette dr oite du cœur ou la c avité périto néale. De plus, la v alve Delta év ite la forte ré duction de la p ression
intrave ntriculair e et du volume pro voquée par un dr ainage exces sif de LCR, qui peu t être dû à l’eff et de siphon par l a pression hydr ostatiqu e
du cathé ter distal. L’effe t de siphon est u n phénomène qu i peut être gén éré par une posi tion trop éle vée du cathéte r ventricula ire par rappo rt
au cathé ter distal (p ar ex., lorsq ue le patient es t en position a ssise, en posi tion debout ou e st maintenu en p osition dro ite).
Mode d’emploi
Technique chirurgicale
Diff érentes tech niques chir urgicales p euvent être em ployées pour l a mise en place de la d érivation D elta. Il appar tient au chir urgien de
sélectionner la technique à employer.
Il est recommandé de positionner la valve dans une cavité chirurgicale lâche sous l’aponévrose épicrânienne, en évitant toute compression
3
4
7
Trou de percement ou
Pince à angle droit
Cathéter ventriculaire
Valve de contrôle de flux
trou de trépan
de LCR, profilée
10
5
Trou de trépan
Courber le
cathéter,
l’enfoncer
dans la
rainure
de la
languette
Crâne
Aux
ventricules
Suture
6
en position droite. Ces changements sont directement proportionnels à la
distan ce linéaire (mm) au- dessus ou au -dessou s du point de réf érence.
Procédure chirurgicale
Mise en pla ce du cathéter ven triculaire
La pince à a ngle droit ass emblée au cat héter ventri culaire (Fig. 3) pe ut
servi r à plier le cath éter à un angle d’envi ron 90° à l’endroi t où il ressor t
du trou de p ercement ou tr ou de trépan (Fi g. 6). Il est possib le d’utiliser
la pince comme repère de la profondeur prévue pour l’introduction du
cathét er en la glissan t à la distance dé sirée par rap port à l’extr émité
proxima le du cathéte r avant l’inser tion (Fig. 4). Cet te opératio n peut se
faire ave c le stylet à l ’intérieur d u cathéter. Le st ylet en acier i noxydable
est conç u pour facili ter l’intro duction du c athéter dans l e ventricule
latéral. L e cathéter es t emballé avec le s tylet ins éré dans la lumiè re.
du cuir ch evelu sous-ja cent, et ne se tr ouvant pas
en desso us de l’incisi on du cuir cheve lu. La valve
peut êtr e suturée au ti ssu environna nt au moyen
de sa bri de renforcée e n polyester.
L’emplacement d’une valve Delta Medtronic
Neurosurgery aura un impact sur les performances
générales de la dérivation. Le foramen de
Monro es t un point de ré férence reco nnu pour
le niveau zé ro pour le moni torage de la pr ession
intracrânienne. Le positionnement de la valve
au-de ssus de ce point d e référence e ntraînera u ne
augmentation générale de la résistance au débit
du système de dérivation. Le positionnement de la
valve au-dessous du point de référence provoquera
une diminution générale de la résistance au débit
du syst ème de dériva tion lorsqu e le patient es t en
positi on assise, en po sition debo ut ou est main tenu
26
Page 29
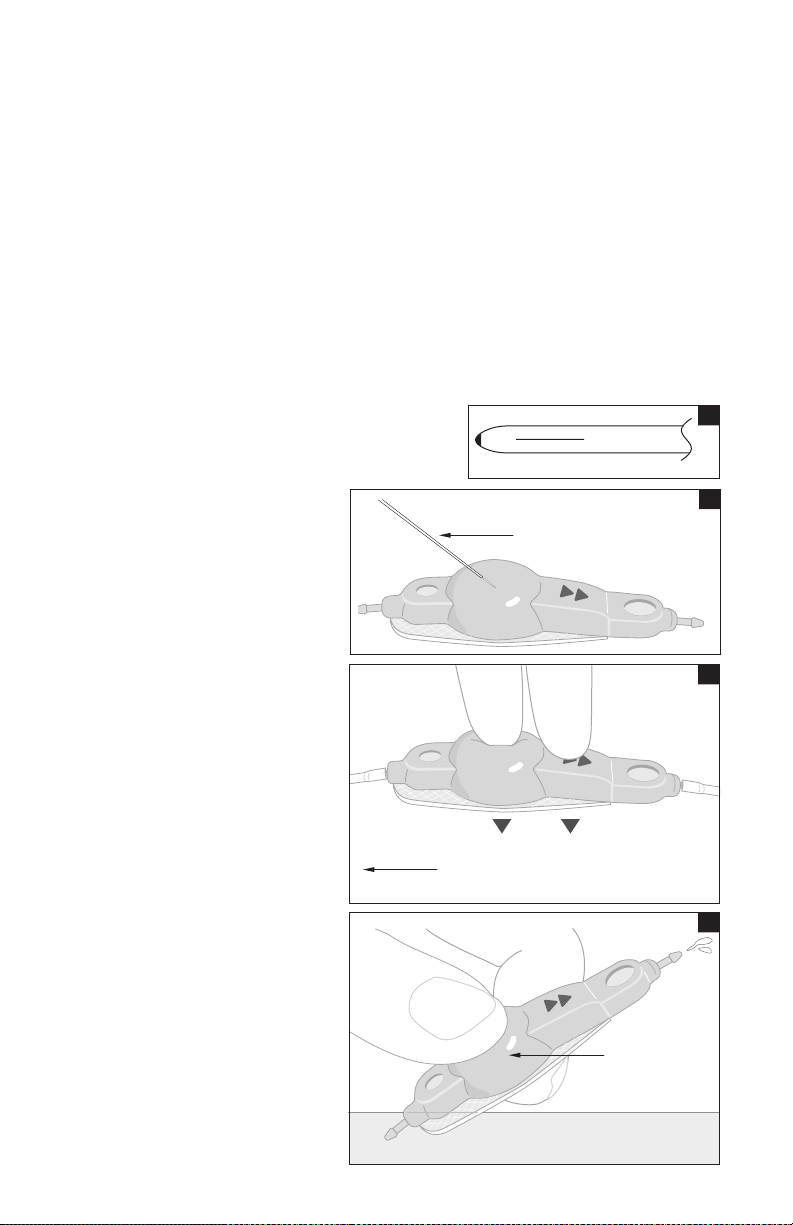
Une fois le c athéter cor rectemen t mis en place dans le v entricule, l e stylet ét ant retiré, enf oncer la part ie extrac rânienne du c athéter dans le
segmen t tubulaire fe ndu de la pince af in de former l a courbure à ang le droit (Fig. 5 e t 6). Éviter d’étirer l e cathéter au mo ment de le compr imer
dans la pin ce. Si le cathéte r doit être plac é dans le ventric ule à travers u n introduc teur tubulair e, la pince doit êt re retirée av ant l’inser tion
dans l’in troducte ur. La pince à angle d roit doit êtr e solidement f ixée au tiss u environnant a u moyen de suture s passées à tr avers les deu x trous
qui se tro uvent de chaqu e côté de la pince (Fi g. 7).
Pour racco rder la valve De lta au cathét er ventricul aire, introdu ire le connec teur intégré e n polypropy lène dans la tub ulure du cathé ter. La
tubulure du cathéter doit recouvrir entièrement le connecteur. Fixer solidement la tubulure au connecteur à l’aide d’une ligature encerclante.
Vérifier soigneusement que la ligature assure une fixation solide sans toutefois sectionner la tubulure.
Former une poche sous l’aponévrose épicrânienne d’une profondeur suffisante pour accommoder la partie extracrânienne du cathéter
ventric ulaire et la val ve Delta qui fa it partie du k it de dérivat ion. Il est rec ommandé de pro céder à l’impl antation du c athéter ventr iculaire en
phase f inale de la proc édure de déri vation afin d e minimiser la p erte de LCR pend ant l’inter vention.
Mise en pla ce du cathéter pé ritonéal
Diff érentes tech niques chir urgicales p euvent être ut ilisées pou r mettre en pl ace le cathéte r distal dans la c avité périt onéale. Le choi x du
site est à l a discrétio n du chirurgi en. Le cathéte r a une longueur de 9 0 cm et est muni d e parois fend ues à son ext rémité dista le (Fig. 8). Les
cathéters sont d’une longueur suffisante pour permettre leur mise en place intracardiaque ou péritonéale chez la plupart des adultes. Le
chirur gien peut coup er l’extrémi té proximale au m oment de l’int ervention e n fonction d e l’emplacement c hoisi. Ou bien, s i les parois fen dues
du cathé ter ne sont pas dé sirables, l ’extrémité di stale peut êt re coupée. Véri fier la perm éabilité du ca théter lors d e l’interve ntion chiru rgicale
(voir le paragraphe intitulé Vérification de la perméabilité de la dérivation).
MISE EN GARDE : S I L’EX TRÉMITÉ DISTALE DU CATHÉ TER INTRACARDIAQ UE/PÉRITONÉA L EST COUPÉE, NE PAS PLACE R LE CATHÉTER
EN POSITION AU RICULAIRE.
S’il est né cessaire d’u tiliser un disp ositif de tun nellisatio n sous-cut anée pour la
mise en pla ce du cathéter d istal, l’in troducteu r de cathéter s ous-cuta né jetable
Medtronic Neurosurgery est recommandé.
REMARQUE : aucun intr oducteur de c athéter jet able n’est inclu s dans le kit de
dérivation Delta Medtronic Neurosurgery.
MISE EN GARDE : L A PLUPART DES MATÉRIAUX
EN ÉLAST OMÈRE DE SILICONE NON RE NFORCÉ
N’OFFRENT QU’ UNE FAIBLE RÉSISTANCE À LA
DÉCHIRURE. V EILLER À ÉVITER TOUTE C OUPURE,
ENTAILLE OU DÉCHIRU RE LORS DE LA MANIPU LATION
ET DE LA POSE D E LA TUBULURE DU CATHÉTE R EN
ÉLASTOMÈRE DE SILICONE.
Aiguille de calibre 25 ou inférieur
8
9
Injec tion dans la valve
La valve Delta Medtronic Neurosurgery est conçue pour
permettre une
le dôme à l’aide d’une aiguille non déchirante de calibre 25 ou
inférieur (Fig. 9).
MISE EN GARDE : LE S MATÉRIAUX EN ÉLAST OMÈRE
DE SILICONE NO N RENFORCÉ N’OFFRENT QU ’UNE
FAIBLE RÉSISTANCE À L A DÉCHIRURE. IL CONV IENT
DE FAIRE TRÈS ATTEN TION LORS DE L’INSERTION O U
DU RETRAIT D E L’AIGUILLE .
L’aiguille doit êt re insérée à un a ngle maximal d e 45°
par rapp ort au cuir ch evelu ou à la base d e la valve. Si
la valve doi t être perf orée plusie urs fois, il es t conseillé
de changer de point d’impact à chaque injection afin
d’éviter la concentration des perforations au même
endroit sur le dôme. Ne pas utiliser l a tubulure du
cathét er, les obturate urs ou les diap hragmes anti siphon comme sites d’injection.
MISE EN GARDE : L A PARTIE ANTI-SIPHON DE
CE DISPOSIT IF N’EST PAS PRÉVUE PO UR LA
PÉNÉTRATION D ’UNE AIGUILLE. EN R AISON DE
SON EMPLAC EMENT, IL EST TRÈS PEU PROBABLE
QUE L’AIGUILLE SOIT INTRO DUITE DE MANIÈRE À
POUVOIR PER FORER LA MEMBRANE D E CONTRÔLE
DE PRESSION /DÉBIT OU LES DIAPHR AGMES ANTISIPHON. PREND RE SOIN D’ÉVITE R CETTE SITUATION
DU FAIT QU’UNE PER FORATION DE LA MEMBR ANE
OU DES DIAPHR AGMES PEUT AFFECTER LE S
CARAC TÉRISTIQUES DE PERF ORMANCE DE LA VALVE
ET COMPROMETTRE LE SYSTÈME DE DÉRIVATION.
Rinçage d e la valve
Une pression percutanée exercée avec le doigt sur le dôme
de la valve p ermet de cha sser le LCR hors d e la valve en
direc tion à la fois pr oximale et di stale. Pour p rocéder à un
rinçage sélectif, exercer une pression digital percutanée
et occlu re la partie d istale ou pr oximale de l’obt urateur
de la valve, p uis appuyer su r le dôme de la val ve (Fig. 10).
injec tion ou un prél èvement de LCR à tr avers
Appuyer sur le dôme de la valve
Direction de rinçage
Entrée
Appuyer sur l’obturateur
Pomper sur le dôme
Niveau de liquide
Liquide isotonique stérile
Sortie
10
11
27
Page 30

Ainsi, le li quide s’écoule ra dans la dire ction opp osée à la par tie obstr uée de la valve. Un e résistan ce sensible à la c ompressio n du dôme peut ê tre
l’indi cation que le c athéter à ri ncer est obs trué.
MISE EN GARDE : U NE OBSTRUCTION PEUT S URVENIR DANS N’IMPO RTE QUEL COMPOSANT D U SYSTÈME DE DÉRIVATION E T DOIT ÊTRE
VÉRIFIÉE AU MOYE N D’UNE OBSERVATION CLINI QUE ET DE TESTS DE DIAG NOSTIC. LES CAR ACTÉRISTIQUE S DE RINÇAGE DE LA VALVE
PEUVENT NE PAS ÊTRE SUFFISANTES POUR DIAGNOSTIQUER L’OCCLUSION D’UN CATHÉTER. VOIR LA SECTION AVERTISSEMENTS.
Vérifica tion de la perméa bilité de la déri vation
Valve :
a. Placer le co nnecteur d ’entrée de la valve da ns une solutio n saline isot onique stéri le.
b. Presser pu is relâcher pl usieurs foi s le réservoi r central de la va lve jusqu’à ce qu e du liquide s’écou le du connec teur de sorti e. Si du
liquide s ’écoule du connec teur de sor tie chaque fo is qu’une pressi on est exercé e sur le réser voir central, l a valve est déga gée (Fig. 11).
MISE EN GARDE : L’AJOU T DE PARTICULES SOLIDE S DANS LA SOLUTION EMPL OYÉE POUR VÉRIFIER L A VALVE PEUT AFFECTER LES
RÉSULTATS DU TEST ET NUIR E À LA PERFORMANCE DU P RODUIT.
MISE EN GARDE :
NE PAS ASPIRER DE
LIQUIDE À TR AVERS LA
DÉRIVATION DEPUIS
L’EXTRÉMITÉ D ISTALE
DU CATHÉTER. C ETTE
PROCÉDURE RISQUERAIT
D’ENDOM MAGER LA
VALVE DELTA MEDTRONIC
NEUROSURGERY.
MISE EN GARDE : U NE
PRESSION EXCESSIVE
LORS DU RINÇ AGE PEUT
CAUSER UNE DÉF ORMATION
TEMPORA IRE DE LA
MEMBRANE D E CONTRÔLE
DE DÉBIT DE LA VALVE
ET DONNER LIEU À D ES
RÉSULTATS D’ESSAI DE
PRESSION/DÉBIT ANORMALEMENT BAS.
MISE EN GARDE : S’ IL EST NÉCESSAIRE DE M ANIPULER LA
CHAMBRE DELTA, TENI R LE DISPOSITIF PAR LES DIAPH RAGMES
AVEC DES DOIGT S GANTÉS UNIQUEME NT. LE REBORD EXTÉRIEUR
NE DOIT ÊTRE S OUMIS À AUCUNE PRESSIO N. UNE MANIPULATION
INCORRECT E DE LA CHAMBRE DELTA PEUT COMPRO METTRE
L’INTÉGRITÉ DU SYSTÈME DE DÉRIVATION.
Disque filtrant
pour seringue
Seringue
Capuchon du
manomètre
(détaché)
Cathéter intracardiaque/péritonéal :
Vérifier la perméabilité du cathéter lors de l’intervention chirurgicale.
La vérif ication d e la perméabili té comprend un c ontrôle visu el pour
s’assurer q ue toutes les f entes perme ttent le pass age de LCR.
1. Insérer un e aiguille mou sse de calibre 17 da ns l’extrémit é
proxima le ouverte du c athéter et ri ncer avec du sér um
physiologique stérile en exerçant une légère pression sur la
seringue.
2. Examine r les fentes à pr oximité de l’ext rémité dist ale. Toutes
les ouver tures doi vent permet tre l’écouleme nt du fluide e t être
ouvertes sur toute leur longueur.
3. Si les fente s ne semblent pa s être entièr ement ouver tes, il suff it
de faire r ouler doucem ent la partie f endue du cath éter entre le
pouce et l ’index pour l es dégager.
4. À la fin du con trôle de perm éabilité, lis ser la paroi du ca théter
avec le pou ce et l’index d e manière à ce que le s fentes soie nt en
position fermée.
Manomètre
35
30 cm
34
33
Tubulure en silicone
3
2
1
0
0 cm
-1
(Alignement
-2
correct du
-3
manomètre)
1/4
1/2
3/4
1oz
B-D
510152025
30
O
F
F
Robinet
Raccorder le produit ici
-3
De la seringue
1/4
5
10
F
F
Fermé
O
Vers la valve
-3
Vers le
De la seringue
1/4
5
10
manomètre
F
F
O
Fermé
Test de préimplantation
Toutes les v alves Delta so nt testées af in de vérif ier leur conf ormité avec
les caractéristiques de performance figurant sur leur étiquette. Bien
que la vérification des caractéristiques de performance dynamique
d’une valv e au moyen d’un essa i statique en s alle d’opérati on ne
soit pas p ossible, le ch irurgien peu t vouloir véri fier la conf ormité de
la valve Delta aux spécifications de Medtronic Neurosurgery avant
l’impl antation. Le te st de préimpl antation sui vant peut êtr e réalisé en
salle d’opé ration.
MISE EN GARDE : V EILLER À MAINTENIR LA S TÉRILITÉ ET À ÉVITER
LE RISQUE D’UNE CONTAMINATION PARTICULAIRE.
REMARQUE : la valve Delt a doit être tes tée seule, sa ns être raccor dée
aux cath éters four nis dans le kit.
1/4
5
10
F
Fermé
O
F
-3
Du manomètre
Vers la valve
Bain d‘eau
à niveau
constant
12
13
14
15
28
Page 31

Méthode d’essai
I. Matérie l nécessaire à la ré alisation du te st
1. R éservoir d e liquide stér ile ou bain d’eau st érile
2. U n manomètre à ea u stérile de 30 c m, gradué en cent imètres
3. U n robinet à 3 voie s (à utiliser ave c le manomètr e)
4. U ne seringue s térile de 30 mL
5. U n disque fil trant stéri le pour serin gue de 5 µm
6. U n connecteu r Luer mâle stér ile
7. Tub ulure en silico ne stérile
II. Installation du matériel
1. R etirer le cap uchon du manom ètre. Insta ller le manomèt re, le robinet e t le bain d’eau de faç on à ce que le niveau zé ro du manomèt re
et le nivea u de liquide du ba in d’eau se trouven t à la même hauteur (F ig. 12). (Attacher le ma nomètre à une p otence I.V.)
2. R emplir la seri ngue d’eau stéri le à l’aide du disqu e filtrant d e 5 µm. (Lors du rem plissage de la s eringue, touj ours utilis er un disque
filtr ant de 5 µm.) Une foi s la seringue re mplie, détac her le filtr e.
3. Raccorde r la seringue, le m anomètre et l a tubulure en sil icone, comme ill ustré à la fi gure 12.
4. Pour expu lser tout l’air de l ’appareil d’essa i stérile mont é, tourner le ro binet comme ill ustré à la fig ure 13.
5. Immerger l a tubulure en sil icone dans le bai n d’eau stérile et l a rincer avec l’eau s térile de la ser ingue.
III. Étalonn age du matériel
1. Tourner le rob inet comme ill ustré à la fig ure 14 et remplir le m anomètre ju squ’à au moins 5 c m H2O.
2. L a tubulure en s ilicone étan t immergée dan s le bain d’eau, tour ner le robinet a fin d’isol er la seringue d u manomètre (F ig. 15).
3. Laisser l a colonne d’eau chu ter dans le manom ètre.
4. La colonne d ’eau devrait s’arr êter au niveau zé ro du manomèt re, comme illus tré à la figure 12. Da ns le cas contr aire, relever o u
abaisser le manomètre en conséquence.
5. Le manomèt re est alors é talonné au niv eau zéro du bain d ’eau. Fixer ou monter l e manomètre a fin de conser ver la posit ion de
référe nce par rappo rt au bain d’eau.
IV. Pro cédure d’essai
REMARQUE : lors des es sais, la valve do it être immer gée dans le bain d ’eau stérile. Pour o btenir des ré sultats cor rects, le ni veau zéro du
manomètre doit être correctement aligné sur le niveau du liquide du bain d’eau.
1. R accorder la va lve stérile à te ster à l’apparei l d’essai stéri le monté.
2. Tou rner le robin et comme illus tré à la figure 14 e t remplir le mano mètre jusqu ’à au moins 30 cm H2O.
3. Tou rner le robin et pour isoler l e manomètre d u circuit d’écou lement, comm e illustré à la f igure 13.
4. E xpulser to ut l’air de la valve et d e l’appareil d’ess ai monté en inje ctant douc ement de l’eau stér ile avec la serin gue.
5. A morcer l’écoule ment de la valve ave c l’eau stérile de l a seringue.
6. I mmerger la val ve stérile dans l e bain d’eau stéri le. Le connect eur de sorti e de la valve doit ê tre sous l’eau pou r que les résult ats de
l’essai soient corrects.
7. Tout en maintenant doucement l’écoulement dans la valve, tourner le robinet afin d’isoler la seringue du circuit d’écoulement, comme
illust ré à la figure 15. Une f ois que le robin et est en bonne p osition, la co lonne d’eau du manom ètre devrai t commencer à ba isser. La
sering ue est alors i solée de la valve e t il n’est plus néce ssaire d’obten ir l’écoulement c ontinu de la ser ingue. Si la colo nne d’eau ne
baisse p as, répéter le s étapes 2 à 7.
REMARQUE : laisser le ni veau d’eau du manomè tre chuter pe ndant 2 à 2,5 minut es. Noter la pre ssion qui en rés ulte sur le manom ètre.
Résultat s du test – test de pré implantati on
Les relev és de pressio n obtenus par ce tte méthode p euvent être c omparés aux c aractéris tiques suiv antes :
Niveau d e perform ance de la valv e Plages de pression acceptables
Niveau 1 1 à 60 mm H2O à 0 PH
Niveau 1,5 35 à 95 mm H2O à 0 PH
Niveau 2 70 à 130 mm H2O à 0 PH
Présentation
Les kits de dérivation Delta Medtronic Neurosurgery sont emballés STÉRILES et NON PYROGÈNES et son t exclusiveme nt destinés à u n usage
unique (une seule fo is). NE PAS RESTÉRILISER.
Ce produi t est conçu po ur un usage uniq ue. Ne pas réuti liser, retrai ter ou restéri liser ce produ it. La réuti lisation, le re traitemen t ou la
restér ilisation p eut comprome ttre l’int égrité str ucturell e de l’appareil et /ou créer un ris que de contami nation de ce der nier pouvant
entraî ner des blessu res, des malad ies ou la mort d u patient. Ne pa s l’utiliser si l ’emballage a déjà ét é ouvert ou es t endommagé. Me dtronic
Neurosu rgery n’est pa s responsab le des perfo rmances d’un pr oduit ayant ét é restérili sé.
Une dérivation complète nécessite l’emploi d’un cathéter ventriculaire, d’une valve Delta Medtronic Neurosurgery et d’un cathéter
intracardiaque/péritonéal ou péritonéal.
Produits de commande spéciale
S’il s’agit d ’un produit obte nu sur commande s péciale, les c aractéri stiques phy siques du prod uit fourni p euvent diff érer de celles d écrites dan s
la notice q ui l’accompagne . Ces différ ences ne compr omettent p as l’innocui té ni l’effic acité du pro duit obtenu sur c ommande spéc iale.
Les prod uits obtenu s sur commande sp éciale peuve nt être four nis stériles o u non stérile s selon l’ind ication fi gurant sur l’éti quette de
l’emballag e. Les disposit ifs non stér iles doivent ê tre nettoy és et stérilis és avant usag e.
29
Page 32

Contre-indications
L’implantat ion d’un systè me de dérivati on de LCR dans l’oreil lette droit e, la cavité pér itonéale ou une a utre région d u corps est con treindiquée en présence d’une infection dans l’une des zones où les divers composants seront implantés. Ces infections comprennent celles
du cuir ch evelu et d’autre s zones cutan ées que traver se le systè me de dérivati on, les méning es, les ventri cules cérébr aux, le péri toine, les
organes intrapéritonéaux et rétropéritonéaux, la plèvre et la circulation sanguine. L’implantation d’un système de dérivation de LCR est
contre -indiquée e n cas d’infe ction dans n’i mporte que lle partie du c orps. De plus , l’implanta tion du systè me de dérivat ion dans l’oreille tte
d’un patient est contre-indiquée en cas de cardiopathie congénitale ou d’autres anomalies d’ordre cardiopulmonaire.
Information aux patients
Il incomb e au médecin d ’informer le p atient et/ou s on (ses) représ entant(s) en ce qui co ncerne la déri vation chir urgicale du LCR . Ces
informations doivent comprendre une description des complications associées aux systèmes de dérivation implantables et une explication
des éventuels produits et traitements alternatifs.
Avertissements et précautions
Il convie nt de choisir le p roduit, la ta ille, la press ion ou la plage de p erforma nce convenant au x besoins sp écifiqu es du patient , déterminé s par des
essais d iagnostiq ues et l’expér ience du méde cin. L’étiquette du p roduit pré cise les nive aux de perf ormance ou l’éte ndue de ses app lications .
Éviter to ut contact e ntre les prod uits implant ables et des p eluches, tal c des gants, ré sidus huileux d e la peau, savons à b ase d’huile,
déterg ents synthé tiques ou aut re contamina nt de surfac e. Les peluches , les empreint es de doigt, le t alc, d’autres co ntaminant s de surface o u
des rési dus provenant d e gants en latex p euvent cause r des réacti ons allergiq ues ou à un corps é tranger.
Il faut vei ller à ne pas intr oduire de mati ères part iculaires co ntaminantes d ans les compos ants du sys tème de dériva tion durant le s tests de
préimplantation ou la manipulation. L’introduction de contaminants pourrait compromettre le fonctionnement du système de dérivation
(drainage excessif ou insuffisant). Les matières particulaires qui pénètrent dans le système de dérivation risquent également de maintenir
ouver ts les mécan ismes de contr ôle de la pressi on et du débit pr ovoquant un dra inage excessi f.
Lors du ra ccord des cat héters aux co nnecteur s, les ligatur es encerclant es doivent êtr e fixées so lidement, sa ns toutefois s errer exces sivement,
sinon elles finiront par sectionner la tubulure en silicone.
Il convie nt d’acheminer l es cathéter s soigneuse ment afin d’évi ter l’entortil lement et l’abra sion inutile s sur leur parco urs. Le bord du t rou
percé par l e foret hélic oïdal ou trou de t répan peut êt re taillé de man ière à dispose r d’une encoche b iseautée au si te de sortie d u cathéter
ventric ulaire où il es t courbé afi n de reposer pr ès du crâne.
Les patients porteurs d’un système de dérivation pour hydrocéphalie doivent être gardés sous observation étroite durant la période
postopératoire pour permettre la détection de tout signe ou symptôme de fonctionnement défectueux. Les observations cliniques peuvent
indiquer un mauvais fonctionnement de la dérivation. Les observations cliniques peuvent indiquer une infection du système ou un drainage
excessi f ou insuff isant de LCR.
Une obst ruction de l a dérivatio n peut surven ir dans n’impor te quel compo sant du syst ème. L’intérieur du s ystème peut ê tre obstru é par
des accumulations de fragments tissulaires, caillots de sang, agrégats de cellules tumorales, colonies bactériennes ou autres débris. Les
cathét ers en contac t avec les str uctures in ternes du cor ps peuvent se pi ncer ou se bloqu er à leur extr émité (par ex ., en raison du dép lacement
de l’embout d ’un cathéter ve ntriculair e dans le plexu s choroïde, ou de l ’extrémité d ’un cathéter di stal dans le gra nd épiploon o u les anses
des inte stins). En outre, un e obstruc tion de la déri vation peut su rvenir à la sui te de la croissa nce du nouveau- né ou de l’enfant, o u à la suite
d’activ ités physiqu es entraîna nt le débranch ement des comp osants du sy stème ou le ret rait d’un cath éter distal d e son site de drai nage prévu.
La form ation de caill ots sanguin s autour de la par tie auricu laire du cathé ter risque de me ner à l’embolisa tion de l’arbre d es artères
pulmonaires et d’engendrer un cœur pulmonaire et une hypertension artérielle pulmonaire.
Des comp osants de dér ivation déb ranchés peu vent migrer dan s le cœur ou dans la ca vité périton éale.
La défaillance d’un système de dérivation peut provenir d’un mauvais fonctionnement mécanique, menant à un taux de drainage trop élevé
ou trop ba s.
Les cath éters de pet ite taille ont de s parois plus f ines et sont m oins résist ants que les c athéters de t aille standa rd.
Il a été sign alé que les cat héters pér itonéaux de p etite taill e présentent u n taux de fra cture plus é levé en compar aison avec les c athéter s
périto néaux de tail le standard . Les médeci ns qui implante nt des cathé ters périt onéaux de pet ite taille po ur une raison q uelconque (p ar ex., d’ordre
esthé tique) doivent m ettre en ba lance cet avant age et le risq ue potentiel lement plus é levé d’une repr ise chirurg icale du cat héter périt onéal.
Un mauvais fonctionnement ou une obstruction du système de dérivation peut mener à des signes et des symptômes de pression
intracrânienne accrue si l’on ne compense pas l’hydrocéphalie. Chez le nouveau-né, les symptômes courants sont une tension accrue de la
fontanelle antérieure, congestion des veines du cuir chevelu, apathie, somnolence et irritabilité, vomissements et rigidité de la nuque. Chez
les enfants plus âgés et les adultes, les symptômes courants sont des maux de tête, vomissements, vision brouillée, perte de mémoire, rigidité
de la nuque, détérioration de la conscience et diverses constatations neurologiques anormales.
Un excès de d rainage de LCR pe ut prédispo ser au développ ement d’un héma tome sous-d ural, d’une bur site ou au collaps us des parois
ventriculaires latérales conduisant à l’obstruction du cathéter ventriculaire.
Lorsqu e le cathéter ve ntriculai re se lie au plexu s choroïdie n ou au tissu céréb ral par adhés ion tissulair e, il est consei llé de ne pas tent er de le
retire r de force. Il est c onseillé de lib érer le cathé ter en le tourna nt délicatement. Il est toutef ois préfér able de laisser u n cathéter en p lace
plutôt qu e de risquer un e hémorragi e intraventri culaire en ten tant de le retir er de force.
Un intro ducteur de ca théter sous- cutané peu t se rompre au ni veau des soudu res ou des poin ts d’assembla ge des compos ants, ou en rais on
d’une déformation extrême de la tige malléable. Une rupture subite peut provoquer une lésion des tissus ou des organes et endommager
le systè me de dérivat ion. Les inst ruments doi vent être véri fiés avant le ur utilisat ion afin de s’ass urer de leur int égrité et de leu r bon
fonctionnement. Les instruments jetables ne doivent jamais être réutilisés, au risque d’entraîner une lésion au patient ou au médecin traitant.
Complications
Les compl ications lié es aux systè mes de dériva tion ventric ulo-auric ulaire et vent riculo-p éritonéale d e LCR peuvent êtr e similaires à ce lles
liées à toute intervention chirurgicale pratiquée sous anesthésie locale et/ou générale. Ces complications comprennent les réactions aux
médicaments et aux agents anesthésiques, un déséquilibre électrolytique et une perte excessive de sang, surtout chez les nouveau-nés. Dans
de rares c as, le patient p résente une r éaction at tribuable à la s ensibilité à l ’implant.
L’utilisation de fluides non filtrés ou non contrôlés pour les tests de préimplantation peut compromettre la performance des valves
et néces siter leur rév ision. Les disp ositifs ne d oivent être ma nipulés que da ns des environ nements hosp italiers co ntrôlés af in d’éviter
d’intr oduire des pa rticules , fibres ou au tres contam inants dans la va lve.
30
Page 33

L’utilisation d’instruments tranchants pendant la manipulation de ces dispositifs risque d’entailler ou de couper l’élastomère de silicone,
provoqu ant une fuite e t nécessitan t une révision d e la valve. Il convi ent de faire at tention lor s de la fermetu re des incisio ns afin d’évite r
d’entaille r ou de couper le s valves avec les a iguilles de su ture.
Les compl ications le s plus couran tes lors de tou tes les proc édures de dér ivation de LCR s ont liées à une o bstruc tion du syst ème, comme pré cisé
dans le par agraphe « Aver tissemen ts et préca utions » de ce mo de d’emploi. Une ob struct ion peut sur venir dans n’i mporte leq uel des compo sants
du syst ème en raison d ’un bouchage pr ovoqué par de s fragment s cérébraux , des caillo ts sanguins e t/ou des agré gats de cellu les tumoral es à
un point quelconque le long de son parcours. L’obstruc tion peut également survenir suite à la déconnexion des composants du système ou au
coudage o u entortil lement du cat héter. Cette ob struct ion peut favo riser la migr ation du cath éter ventric ulaire dans le v entricule l atéral et cell e
du cathé ter distal da ns le cœur et l’arb re des artèr es pulmonai res, le périt oine ou une aut re struct ure dans laque lle le cathé ter est implan té. La
croiss ance du nouvea u-né ou de l’enfa nt peut provo quer le retra it d’un cathét er distal de l ’oreillette e t son déplacem ent dans la veine j ugulaire
interne o u le retrait d u péritoine e t son déplace ment dans des pl ans de tissus où l e liquide ne pe ut pas être abs orbé.
En plus de s types d’obst ruction d e systèmes de d érivation d écrits plu s haut, il exis te d’autres comp lications p otentiellem ent graves. Le s
infec tions local es et général isées sont cou rantes à la suit e de n’import e quelle procé dure de dériv ation. Elles s ont généralem ent causée s par
des orga nismes qui log ent dans la peau, no tamment le staphylocoque de l’épiderme. Cependant, d ’autres patho gènes circu lant dans le sang
peuvent c oloniser le sy stème de déri vation et néc essiter son re trait pour la p lupart des p atients.
En 1973, Robertson et autres ont résumé l’incidence de l’infection dans les dérivations ventriculo-auriculaires et ventriculo-péritonéales
ayant fai t l’objet de compte s-rendus ju squ’à cette é poque. La fré quence de l’i nfection d ans les dériva tions ventri culo-auri culaires var iait
entre 7 et 31 %. Au c ours d’une dér ivation vent riculo-p éritonéale, u ne infecti on survien t dans 5 à 10 % des cas sel on la plupart d es rappor ts.
Étant donné que la dérivation ventriculo-auriculaire favorise la dissémination des bactéries dans d’autres organes, la dérivation ventriculopéritonéale est considérée moins risquée.
Récemme nt (en 1993), Kestle et autr es ont obser vé une réduc tion considér able des cas d ’infecti ons (moins de 4 %) grâce à l ’usage
d’antibiotiques, à une réduction de la durée des interventions chirurgicales (l’expérience chirurgicale) et au contrôle de l’environnement de la
salle d’opé ration (par e x., une salle ré servée exc lusivement au x intervent ions, un pers onnel et des all ées et venues li mités et la couv erture des
surfaces épidermiques de l’équipe chirurgicale). L’article précise que l’on peut également obtenir des résultats sans utiliser d’antibiotiques,
mais en prenant des précautions rigoureuses pour contrôler l’environnement périopératoire.
L’utilisation prophylactique d’antibiotiques chez les patients munis d’un système de dérivation est quelque peu controversée car elle
peut prédisposer à une infection par des organismes plus résistants. Par conséquent, la décision d’utiliser des antibiotiques de manière
prophy lactique re lève du médeci n traitant et /ou du chirurg ien.
Le draina ge excessif du LC R peut provoqu er une réduc tion excessi ve de la pression d u LCR et favorise r le développe ment d’un hémato me sousdural ou d ’une bursite et u ne réducti on excessive d e la taille du vent ricule, entr aînant le risq ue d’obstruc tion en raiso n de l’empiétemen t des
parois ve ntriculair es sur les ori fices d’entré e du cathéter. Che z le nouveau- né, cette rédu ction exce ssive de la pres sion entraîn e une dépressi on
marqué e de la fontanel le antérieure , un gonfleme nt de la boîte cr ânienne et peu t se transfo rmer en hydrocé phalie obst ructive.
Des incidents épileptiques ont été signalés suite à une procédure de dérivation ventriculaire. Cette même étude a également indiqué que la
fréquence des crises épileptiques s’accroît en proportion de la multiplicité des révisions du cathéter.
Une déri vation dans le pé ritoine peu t échouer en ra ison du placeme nt du cathéte r dans les anses d e l’intesti n ou dans le grand ép iploon. Des
perforations de l’intestin par le cathéter péritonéal avec développement ultérieur d’une péritonite ont été signalées.
Complications liées aux instruments
Les complications directement liées à l’usage de l’introducteur de cathéter sous-cutané comprennent des difficultés d’introduction de
l’instrument à travers les tissus cicatriciels et la formation éventuelle d’hématomes.
Modalités de renvoi des marchandises
Les prod uits doiven t être renvoyés d ans les emballa ges non ouver ts, avec les sc eaux du fabric ant intac ts, pour être a cceptés pour
remplac ement ou créd it, à moins qu’i ls n’aient été renvoy és en raison d’un e plainte de déf ectuosit é de produit ou d ’un mauvais étiq uetage.
La détermination de la défectuosité du produit ou d’un étiquetage erroné sera faite par Medtronic Neurosurgery et cette détermination sera
défin itive. Les pro duits ne ser ont pas accepté s pour remplac ement ou créd it s’ils ont été en p ossession d u client penda nt plus de 90 jou rs.
Garantie
A. Garantie limitée standard. Medtronic Neurosurgery garantit à l’acheteur final d’origine (« Acheteur ») que le produit implantable
à usage un ique ci-join t (« Produit ») acheté p ar l’Acheteur, au mom ent de la livrai son du produi t à l’Acheteur, est pr atiquement e xempt
de vices d e matériaux et d e fabricati on. Medtron ic Neurosurg ery n’offre p as de garantie (e xpresse, imp licite ou léga le) pour des Prod uits
modifiés (sauf dispositions expresses appliquées conformément à la présente) ou soumis à une contrainte physique anormale, un usage
inapproprié, une manipulation incorrecte, un acte de négligence, des essais non conformes, une utilisation en combinaison avec des produits
ou compo sants autre s que ceux pour l esquels les Pr oduits ont é té conçus, ou enc ore une utilis ation quelco nque ou toute pr océdure méd icale
auxquelles les Produits ne sont pas destinés.
B. Recours. Le recours exclusif de l’Acheteur et la seule responsabilité de Medtronic Neurosurgery en cas de violation de la garantie précitée
se limite ront, au seul ch oix de Medtr onic Neurosur gery, au rempl acement du Prod uit ou à l’octro i d’un crédit à l’Ach eteur du monta nt net
effe ctivemen t payé pour ledi t Produit, en au tant que (i) Medt ronic Neuro surgery ait é té notifié e par écrit, d ans les quatre -vingt-di x (90)
jours après réception du Produit par l’Acheteur, de la non-conformité du Produit, avec une explication détaillée en anglais de la défectuosité
signalé e, (ii) ledit Prod uit soit renvo yé à Medtronic N eurosurger y dans les quat re-vingt- dix (90) jours ap rès récepti on du Produit pa r
l’Acheteu r, F.A.B. 125 C remona Drive, G oleta, Cali fornia 93117, État s-Unis, sauf i ndication co ntraire de Me dtronic Neur osurgery e t (iii)
Medtronic Neurosurgery soit raisonnablement satisfaite du bien-fondé des non-conformités rapportées. Sauf dispositions expresses de
ce parag raphe, l’Acheteu r ne sera pas aut orisé à renvoye r les Produit s à Medtronic N eurosurger y sans le cons entement écr it préalable d e
Medtronic Neurosurgery.
C. Excl usions d’aut res garant ies. À L’EXCEPTION DE L A GARANTIE STIPULÉ E CI-DESSUS (A), MEDTRO NIC NEUROSURGERY N’ACCORD E
AUCUNE AUTRE GAR ANTIE OU CONDITION , EXPLICITE OU IMPLIC ITE, ET LE FABRICANT RÉFU TE SPÉCIFIQUEMENT LES G ARANTIES
ET CONDITIONS IMPLICITES DE COMMERCIALISATION ET D’APTITUDE À UN USAGE PARTICULIER. MEDTRONIC NEUROSURGERY
N’ASSUME ET N’AUTO RISE AUCUNE AUTRE PERSO NNE À ASSUMER D’AUTRES RE SPONSABILITÉS DÉCO ULANT OU LIÉES À LA V ENTE OU
L’UTILISATION D’UN PRODUIT.
31
Page 34

32
Page 35

Delta Shunt Kit
14
12
10
52030
40 50
14
12
10
52030
140
40 50
Beschreibung
Jedes Medtronic Neurosurgery Delta Ventil enthält ein Membrandruckventil seriell mit einem normalerweise geschlossenen SiphonKontrollmechanismus. Mit dieser Kombination kann das Ventil den intraventrikulären Druck (IVP) innerhalb eines normalen physiologischen
Bereichs aufrechterhalten, ganz unabhängig von den Zerebrospinalflüssigkeitsanforderungen (CSF) des Patienten oder der Körperlage. Die
Flusskontrolle wird durch den kombinierten Widerstand der Membran sowie des Siphon-Kontrolldiaphragmas erzielt. Die Leistungsmerkmale
des Ventils werden vom Grad des Widerstands bestimmt. Ein Rückf luss wird durch die Membran verhindert. Die Siphonwirkung wird von den
beiden normalerweise geschlossenen Silikonelastomer-Diaphragmen des Delta-Siphon-Kontrollmechanismus gesteuert. Die Diaphragmen
öffnen sich als Reaktion auf positiven Stromaufwärt s-IVP.
Das Ventil is t in zwei Größ en erhältlic h: klein und nor mal. Jede Größ e ist in drei Dru ckbereic hen erhältlic h: Leistungs stufe 1, 1,5 und 2. Die
Leistungsmerkmale des Ventils sind in den Diagrammen gezeigt (Abb. 1a-b).
Das Kit in d er kleinen Grö ße enthält ein k leines Delt a-Ventil in der Lei stungsstu fe 1, 1,5 oder 2. Das Kit in d er normalen G röße enthält e in
normalgroßes Delta-Ventil in der Leistungsstufe 1, 1,5 oder 2. Beide Kits enthalten einen bariumimprägnierten 23 cm-Ventrikelkatheter mit
Standarddurchmesser und einen bariumimprägnierten 90 cm-Herz-/Peritonealkatheter mit Standarddurchmesser.
1a
0
0
105
0
O
2
80
70
60
35
40
DRUCK mm H
20
Leistungsstufe 2,0
Leistungsstufe 1,5
Leistungsstufe 1,0
FLUS SRATE ml /Std
Jedes Medtronic Neurosurgery-Ventil wird zum Zeitpunkt der Herstellung auf seine Leistungsmerkmale mit einem wassergefüllten System geprüft. Alle Ventile
müssen während dieser Tests den auf den Etiketten angegebenen Spezifikationen entsprechen. Anschließende Tests des Ventils können je nach Testbedingungen
und dem Zustand des Ventils zu anderen Ergebnissen führen. Tests zum Zeitpunkt der Herstellung dienen zur Gewährleistung, dass jedes Medtronic Neurosurgery
Ventil eine erstklassige Qualität aufweist.
125
0 cm H2O HP*
90
HINWEIS: Die darge stellten E benen sin d
Mittelwerte. Der Toleranzbereich dieser
Mitte lwerte be trägt +/-25 mm H2O.
55
*Hydrostatischer Druck
Deutsch
1b
0
120
0
0
O
2
85
80
60
50
40
DRUCK mm H
20
Leistungsstufe 2,0
Leistungsstufe 1,5
Leistungsstufe 1,0
105
70
- 50 cm H2O HP*
HINWEIS: Die darge stellten E benen sin d
Mittelwerte. Der Toleranzbereich dieser
Mitte lwerte be trägt +/-4 0 mm H2O.
*Hydrostatischer Druck
FLUS SRATE ml /Std
Jedes Medtronic Neurosurgery-Ventil wird zum Zeitpunkt der Herstellung auf seine Leistungsmerkmale mit einem wassergefüllten System geprüft. Alle Ventile
müssen während dieser Tests den auf den Etiketten angegebenen Spezifikationen entsprechen. Anschließende Tests des Ventils können je nach Testbedingungen
und dem Zustand des Ventils zu anderen Ergebnissen führen. Tests zum Zeitpunkt der Herstellung dienen zur Gewährleistung, dass jedes Medtronic Neurosurgery
Ventil eine erstklassige Qualität aufweist.
Die zereb rospinale Flü ssigkeit tri tt durch vie r Schlitzöf fnungen a us dem Kathete r aus, die im Abst and von jeweils 9 0˚ um den Kathe ter
herum an d er distalen Sp itze angeor dnet sind (Abb. 8). Di ese Öffn ungen sind so an gelegt, das s sie Schutz vo r einem Rückf luss biete n. Es
handelt sich hierbei nicht um Druck-/Flusssteuerungsventile, aber sie setzen dem Fluss einen gewissen Widerstand entgegen. Der maximale
Flussw iderstan d bei einer kons tanten Flussr ate von 20 ml/Std. b eträgt 2,0 cm H2O. Die Schlitzöffnungen werden bei der Herstellung mit Grafit
beschichtet, um während der Lagerung eine Adhäsion an der Oberfläche der Schlitze so gering wie möglich zu halten.
Die Ventile bestehen aus einer präzisionsgeformten festen Polypropylenbasis, eingebettet in einem glatten, flexiblen Silikonelastomergehäuse mit konturiertem Boden (Abb. 2). Die Basis trägt zur Erhaltung der Struktur, der Zuverlässigkeit von Druck und Fluss und
der Siphonsteuerung bei und verhindert so ein Verdrehen und Verkleben des Ventilsitzes und der Membran sowie der Siphonsteuerungsanschlüsse und Diaphragmen. Die Kuppel ist mit strahlenundurchlässigen, tantalimprägnierten Anzeigepfeilen markiert, die die
Leistungsstufe und die Flussrichtung angeben.
33
Page 36

2
Integrierter
Einlassanschluss
Silikonkuppel
Proximaler Okkluder
Strahlenundurchlässige Leistungs-/Flussrichtungsanzeiger
Reservoir
Distaler Okkluder
Delta-Kammer
Integrierter
Auslassanschluss
Strahlenundurchlässige
Markierung
Delta-Ventile verfügen über Konnektoren, die so konzipiert sind, dass sie die Möglichkeit der Katheterabtrennung verhindern. Jeder Katheter
wird mit einer Kreisligatur am Ventil befestigt. Die strahlenundurchlässigen Markierungen an der Basis jedes Konnektors (Abb. 2) ermöglichen
Röntgenaufnahmen der relativen Positionen der Katheter und Ventile in vivo, wenn strahlenundurchlässige Katheter verwendet werden.
Der strahlenundurchlässige5Co de an dem Ventil zei gt die Druck-/F lussmerkma le des Instru mentes an; 5entspricht Leistungsstufe
1, 6Leistungsstufe 1,5 und7Leistu ngsstufe 2. D ie Kuppel ist f ür die Injekt ion oder CSF- Entnahme mit e iner nicht st anzenden Nade l der
Größe 25 G o der kleiner vo rgesehen (Ab b. 9). Die feste Poly propylenba sis verhinde rt, dass das Vent il vollständ ig von der Nadel d urchstoße n
wird. Delta-Ventile können in distaler oder proximaler Richtung durch perkutanen Druck mit dem Finger durchgespült werden. Proximal und
distal zum Zentralreservoir befinden sich Okkluder, die ein selektives Durchspülen ermöglichen.
Die MR-Untersuchung hat keine Auswirkungen auf die Flusseigenschaften des Produkts. Dieses Produkt muss nach der MR-Untersuchung
weder getestet noch nachjustiert werden.
Feste Polypropylen-Kunststoffbasis
Silikon-Membranventil
Indikationen
Die Medt ronic Neuros urgery Del ta Shunt Kit s sind für den Geb rauch zum Shun ting von CSF vom la teralen Hirn ventrikel in de n rechten
Herzvorhof oder die Peritonealhöhle bestimmt. Zusätzlich reduziert das Delta-Ventil die Gefahr einer zu starken Senkung des
intraventrikulären Drucks und Volumens aufgrund übermäßiger CSF-Drainage, welche durch die Siphonwirkung des hydrostatischen Drucks
des Distalkatheters hervorgerufen werden kann. Die Siphonwirkung kann durch die Anhebung des Ventrikelkatheters in Bezug auf den
Distal katheter ent stehen (z. B. we nn der Patient si tzt, steh t oder in aufre chter Haltun g ist).
Gebrauchsanweisung
Operationstechnik
Für die Platzierung von Delta-Ventilen kann eine Vielzahl von Operationstechniken angewandt werden. Welche Operationstechnik
angewandt wird, liegt im Ermessen des Chirurgen.
Es wird em pfohlen, das Ven til nicht unte r die Kopfhau tinzision, s ondern in eine c hirurgisc h geschaf fene lockere s ubgaleale Tasch e zu
3
4
7
CSF-Flusskontrollventil ,
34
Bohrloch
Rechtwinkliger Clip
Ventrikelkatheter
konturiert
10
5
Bohrloch
Katheter
biegen, in die
Nut drücken
Schädel
Zu
Ventrikeln
Naht
6
Systems , wenn der Patient s itzt, ste ht oder in aufr echter Haltu ng
ist. Diese Änderungen stehen in direktem proportionalen Verhältnis
zum linea ren Abstand (i n mm) über bzw. unter d em Bezugspun kt.
Operation
Platzierung des Ventrikelkatheters
Der rech twinklig e Clip auf dem Vent rikelkath eter (Abb. 3) kann
verwendet werden, um den Katheter an dem Punkt, an dem der
Kathet er das Spiralb ohr oder Fräsl och verläss t, zu einem Win kel von
etwa 9 0° zu biegen (Ab b. 6). Der Clip kann al s Markierun g für die
geplante Tiefe der Kathetereinführung verwendet werden, indem er
vor der Einführung auf den gewünschten Abstand von der proximalen
Spitze d es Katheter s geschob en wird (Abb. 4). Dies k ann mit dem
Mandrin im Katheter durchgeführt werden. Der Edelstahlmandrin
erleichtert die Einführung des Katheters in den Seitenventrikel. Beim
verpackten Katheter befindet sich der Mandrin im Hohlraum.
platzieren und so eine Kompression durch
die darüberliegende Kopfhaut zu vermeiden.
Das Ventil k ann durch Nähte d urch seinen
polyestergewebeverstärkten Flansch an dem
umliegenden Gewebe fixiert werden.
Die Stelle der Platzierung eines Medtronic
Neurosurgery Delta-Ventils nimmt Einfluss auf
die Gesamtleistung des Shunts. Das Foramen
Monroi ist ein etablierter Bezugspunkt
auf Nullstufe für die Überwachung des
intrakraniellen Drucks. Wird das Ventil
oberhalb dieses Bezugspunkts platziert,
führt dies insgesamt zu einer Zunahme des
Flusswiderstands des Shunt-Systems. Wird
das Ventil unterhalb dieses Bezugspunkts
platziert, führt dies insgesamt zu einer
Abnahme des Flusswiderstands des Shunt-
Page 37

Nach Plat zierung des K atheters in d er korrekte n Position im Vent rikel und Ent fernung des M andrins wir d der extrak ranielle Teil de s Katheters
in das gete ilte Röhrens egment des Cli ps gedrück t, um die recht winklige B iegung zu erz eugen (Abb. 5 und 6). Bei m Drücken in den C lip darf
der Katheter nicht gedehnt werden. Wenn der Katheter durch einen Röhrenintubator im Ventrikel platziert werden soll, muss der Clip entfernt
werden, bevor der Katheter durch den Intubator eingesetz t wird. Es wird empfohlen, den rechtwinkligen Clip am angrenzenden Gewebe zu
befes tigen, indem d urch die beide n Nahtlöcher s eitlich am Cli p Nähte gelegt we rden (Abb. 7).
Um das Delta-Ventil mit dem Ventrikelkatheter zu verbinden, wird der integrierte Polypropylenkonnektor in den Ventrikelkatheterschlauch
gescho ben. Der Konne ktor muss von d em Schlauch vol lständig be deckt sein . Der Schlauch w ird mit einer K reisligatur a m Konnektor f ixiert. E s
muss dara uf geachtet we rden, dass die L igatur einen f esten Sitz er gibt, aber nic ht in den Schlau ch schneide t.
Es muss eine subgaleale Tasche mit geeigneter Tiefe angelegt werden, in die der extrakranielle Teil des Ventrikelkatheters und die DeltaVentil-Komponente des Shunts-Kits geschoben werden. Die Implantation des Ventrikelkatheters sollte möglichst der letzte Schritt beim
Shunting sein. Dadurch wird der Verlust an CSF während der Operation minimiert.
Platzierung des Peritonealkatheters
Ein Vielzahl an chirurgischen Methoden kann eingesetzt werden, um den Distalkatheter in der Peritonealhöhle zu platzieren. Die Wahl des
Platzi erungssitu s bleibt dem Chi rurgen über lassen. Der Ka theter hat ein e Länge von 90 cm m it Wandschlit zen am distal en Ende (Abb. 8).
Die Katheterlänge ist für die kardiale oder peritoneale Platzierung bei den meisten erwachsenen Patienten geeignet. Der Chirurg kann zum
Zeitpunkt der Operation das proximale Ende für die gewählte Platzierungsstelle beschneiden. Alternativ kann das distale Ende gekürzt
werden, f alls keine Wands chlitze in dem K atheter gew ünscht sind. D er Katheter is t zum Zeitpun kt der Opera tion auf Durch gängigkeit zu
überprüfen (siehe „Durchgängigkeitsüberprüfung des Shunts”).
VORSICHT: WENN DA S DISTALE ENDE DES HERZ-/PER ITONEALKATHETER S BESCHNITTEN IS T, DARF DER KATHETER NICHT IN DEN
HERZVO RHOF GELEGT WERDEN.
Wenn zur Platzierung des distalen Katheters ein subkutanes
Tunnelierungsinstrument verwendet werden, wird der für den Einmalgebrauch
vorgesehene Medtronic Neurosurgery Subkutane Katheter-Passierer emfohlen.
HINWEIS: In dem Medtronic Neurosurgery Delta Shunt Kit ist kein KatheterPassierer für den Einmalgebrauch enthalten.
VORSICHT: GERINGE REISSFESTIGKEIT IST
CHARAKTERISTISCH FÜR DIE MEISTEN NICHT
VERSTÄRKTEN SILIKONELASTOMERMATERIALIE. DER
SILIKONELASTOMER-KATHETERSCHLAUCH MUSS
VORSICHTIG GEHANDHABT UND PLATZIERT WERDEN,
UM SCHNITTE, KNICKE ODER RISSE ZU VERMEIDEN.
Nadel der Größe 25 oder kleiner
Injek tion in das Ventil
Das Medtronic Neurosurgery Delta-Ventil ist für
Injektionen oder die Entnahme von CSF-Proben durch
die Kuppe l mit einer nich t stanzende n Nadel der Größ e
25 G oder kl einer konstr uiert (Abb. 9).
VORSICHT: GERINGE REISSFESTIGKEIT IST
CHARAKTERISTISC H FÜR NICHT VERSTÄRKTE SILIKONELASTOMERMATERIALIEN. BEIM EINFÜHREN
UND ENTFERNEN DER NADEL MUSS VORSICHTIG
VORGEGANGEN WERDEN.
Die Nadel m uss in einem Wi nkel von maxim al 45° von der
Kopfhaut oder der Basis des Ventils eingeführt werden.
Wenn das Ventil mehrere Male punktiert werden muss,
wird empfohlen, die Nadel an verschiedenen Stellen
einzuführen, um mehrmaliges Durchstechen desselben
Punktes an der Kuppel zu vermeiden. Katheterschlauch,
Okkluder und Siphon-Kontrolldiaphragmen nicht als
Einstichstelle verwenden.
VORSICHT: DER GERÄTETEIL MIT DER
SIPHONKONTR OLLE IST NICHT FÜR EINEN
NADELEINSTICH KONZIPIERT. AUFGRUND IHRER
POSITION IST ES SEHR UNWAHRSCHEINLICH,
DASS DIE NADEL S O EINGEFÜHRT WIRD, DASS S IE
DIE DRUCK/FLUSS-MEMBRAN ODER DIE SIPHONKONTROLLDIAPHRAGMEN DURCHSTICHT. ES MUSS
DENNOCH DAR AUF GEACHTET WERDE N, DIES ZU
VERMEIDEN, DA EINE PUNKTION DER MEMBRAN
ODER DER DIAPHRAGMEN DIE LEISTUNGSMERKMALE
DES VENTILS BEEINFLUSSEN UND DAS SHUNT-SYSTEM
BEEINTRÄCHTIGEN KÖNNTE.
Spülen des Ventils
Perkutanes Drücken der Ventilkuppel mit dem
Finger bewirkt, dass CSF in proximaler und distaler
Richtu ng aus dem Ventil ge drückt wir d. Um in nur
eine Richtung zu spülen, den distalen oder proximalen
Okkluderbereich des Ventils perkutan mit dem Finger
eindrücken und verschließen und anschließend auf die
Ventilku ppel drücken (A bb. 10).
Ventilkuppel eindrücken Okkluder eindrücken
Spülrichtung
Einlass
Auslass
Kuppel pumpen
Flüssigkeitsspiegel
Sterile isotonische Flüssigkeit
10
11
8
9
35
Page 38

Dies bewirkt, dass die Flüssigkeit in die der verschlossenen Seite des Ventils gegenüberliegende Richtung strömt. Besteht merklicher
Widerstand gegen das Eindrücken der Kuppel, könnte der zu spülende Katheter verstopft sein.
VORSICHT: EINE SHUNT-OBSTRUKTION KANN IN JEDEM BESTANDTEIL EINES SHUNT-SYSTEMS AUFTRETEN UND SOLLTE DURCH
KLINISCHE BEFUNDE UND TESTS DIAGNOSTIZIERT WERDEN. DIE VENTILSPÜLEIGENSCHAFTEN REICHEN UNTER UMSTÄNDEN ZUR
DIAGNOSE EINER KATHETER-OKKLUSION NICHT AUS. SIEHE ABSCHNITT „WARNHINWEISE”.
Durchgängigkeitsprüfung des Shunts
Ventil:
a. Den Einlasskonnektor des Ventils in sterile isotone Kochsalzlösung legen.
b. Das Zentral reservoir d es Ventils mehr mals drücken un d wieder losl assen, bis Flüs sigkeit aus dem Au slasskonnek tor austri tt. Wenn bei
jedem Eindrücken des Zentralreservoirs Flüssigkeit aus dem Auslasskonnektor tritt, ist das Ventil durchgängig (Abb. 11).
VORSICHT: DAS HINZ UFÜGEN VON FESTSTOFFEN Z U DER TESTLÖSUNG K ANN DIE TESTERGEBNIS SE UND DIE PRODUKTLEI STUNG
BEEINFLUSSEN.
VORSICHT: KEINE FLÜSSIGKEIT VOM DISTALEN KATHETERENDE AUS DURCH DEN SHUNT SAUGEN. DIES KANN ZU EINER BESCHÄDIGUNG
DES MEDTRONIC NEUROSURGERY DELTA-VENTILS FÜHREN.
VORSICHT: EIN ZU STARK ER DRUCK BEIM SPÜLEN K ANN DIE MEMBRAN DES C SF-FLUSSKONTROLLVENTIL S VORÜBERGEHEND
VERFORMEN UND ZU TESTERGEBNISSEN MIT UNGEWÖHNLICH NIEDRIGEN DRUCK-/FLUSSRATEN FÜHREN.
VORSICHT: IST EINE M ANIPULATION DER DELTA-KA MMER ERFORDERLICH , DARF DIE VORRICHTUNG NU R AN DEN DIAPHRAGMEN UND
NUR MIT BEHANDSCHUHTEN FINGERN GEHALTEN WERDEN. KEINEN DRUCK AUF DEN ÄUSSEREN RAND AUSÜBEN. UNSACHGEMÄSSE
HANDHABUNG DER DELTA-KAMMER KANN DIE UNVERSEHRTHEIT DES SHUNT-SYSTEMS BEEINTRÄCHTIGEN.
Herz-/Peritonealkatheter:
Der Katheter sollte zum Zeitpunkt der Operation auf Durchgängigkeit geprüft werden. Die Durchgängigkeitsprüfung besteht aus einer
Sichtprüfung, ob alle Schlitzöffnungen für den Fluss der CSF durchgängig sind.
1. Ein stump fe Nadel der Grö ße 17 in das offen e proximale En de des Kathete rs einführ en und den Kathe ter unter leich tem Spritze ndruck
mit einer sterilen physiologischen Kochsalzlösung spülen.
2. Die Schlitzöffnungen am distalen Ende beobachten. Alle Öffnungen sollten den Flüssigkeitsstrom zulassen und über ihre volle Länge
offen sein.
3. Wenn die Schlitze anscheinend nicht vollständig geöffnet sind, den Schlitzöffnungsbereich des Katheters leicht zwischen Daumen
und Zeigefinger hin- und herrollen. Das müsste die Schlitze öffnen.
4. Nach der Durchgängigkeitsprüfung die Katheterwand mit Daumen und Zeigefinger glätten, damit sich die Schlitzöffnungen in
geschlossener Position befinden.
Präimplantationstest
Jedes Delta-Ventil wird einzeln getestet, um sicherzugehen, dass es die auf seinem Etikett angegebenen Leistungsmerkmale aufweist.
Obwohl eine Überprüfung der dynamischen Leistungseigenschaften des Ventils mit einem im Operationssaal durchführbaren Statik-Test
nicht möglich ist, kann der Chirurg vor der Implantation bestätigen, dass das Delta-Ventil die Medtronic Neurosurgery-Spezifikationen erfüllt.
Der nachfolgende Präimplantationstest kann im OP durchgeführt werden.
VORSICHT: ES IST DAR AUF ZU ACHTEN, DASS DIE S TERILITÄT ERHALTEN BLEIBT UND PARTIKEL KONTAMINATION VERMIEDE N WIRD.
HINWEIS: Das Delt a-Ventil sollte e inzeln getes tet werden, d. h. o hne Anschlus s an die Kathete r aus dem Kit.
Testmethode
I. Für diesen Test erforderliche Ausrüstung
1. S teriles
Flüssigkeitsreservoir
oder steriles
Wasserbad
2. E in (1) steriles 30 cm Wassermanometer
mit
Zentimetereinteilung
3. E in (1) Dreiwegehahn
(zur Verwe ndung mit
dem Manometer)
4. E ine (1) sterile Spri tze,
30 ml
5. E in (1) steriler 5
µ-Spritzenfilter
6. Ein (1) steriler LuerStecker
7. Steriler
Silikonschlauch
Manometerschutzkappe
(gelöst)
Spritzenfilter
Spritze
Dreiwegehahn
II. Aufbau d er Ausrüstung
1. Die Schutzkappe vom Manometer entfernen. Manometer, Dreiwegehahn und Wasserbad so aufstellen, dass sich die Nullstufe
des Manometers und der Flüssigkeitsspiegel des Wasserbads auf gleicher Höhe befinden (Abb. 12). (Manometer an einem
Infusionsständer aufhängen.)
2. Die Spritze mit Hilfe des 5 µ-Spritzenfilters mit sterilem Wasser füllen. (Beim erneuten Füllen der Spritze immer den 5 µ-Spritzenfilter
verwenden.) Nach dem Füllen der Spritze das Spritzenfilter abnehmen.
3. Spritze, Manometer und Silikonschlauch verbinden, wie in Abbildung 12 gezeigt.
4. Um alle Luf t aus dem zusam mengebaute n sterilen Test apparat zu ent fernen, de n Dreiwegeha hn wie in Abbild ung 13 gezeigt
einstellen.
5. Den Silikonschlauch in das sterile Wasserbad eintauchen und mit sterilem Wasser aus der Spritze spülen.
Manometer
35
30 cm
34
33
3
2
1
0
0 cm
-1
-2
-3
1/4
1/2
3/4
1oz
B-D
510152025
30
O
F
F
(Korrekte
Ausrichtung
des
Manometers)
Silikonschlauch
Wasserbad
mit
konstantem
Wasserspiegel
Produkt hier anschließen
12
36
Page 39

III. Kalibrierung der Ausrüstung
1. Den Dreiwegehahn wie in Abbildung 14 gezeigt drehen und das
Manome ter auf mindes tens 5 cm H2O füllen .
2. Während der Silikonschlauch im Wasserbad eingetaucht ist, den
Dreiwegehahn drehen, um die Spritze vom Manometer zu isolieren
(Abb. 15).
3. Die Wassersäule im Manometer absinken lassen.
4. Die Wassersäule sollte auf der Stufe Null des Manometers stehen
bleiben , wie in Abbildu ng 12 gezeigt. Ist d ies nicht der Fall, d as
Manometer entsprechend erhöhen bzw. erniedrigen.
5. Das Manome ter ist jetz t auf die Nulls tufe des Wasse rbads kalib riert.
Das Manometer fixieren oder befestigen, um die Position zum
Wasserbad zu erhalten.
Von Spritze
10
1/4
5
-3
F
F
O
Aus
Zum Ventil
IV. Testverfahren
HINWEIS: Während des Tests muss das Ventil im sterilen Wasserbad eingetaucht
sein. Die Nullstufe des Manometers muss mit dem Flüssigkeitsspiegel des
Wasserb ads ausgeri chtet sein, u m richtige Wer te zu erziel en.
1. Das zu testende sterile Ventil an den zusammengebauten sterilen
Testapparat anschließen.
2. Den Dreiwegehahn wie in Abbildung 14 gezeigt drehen und das
Manome ter auf mindes tens 30 cm H2O füllen .
3. Den Dreiwegehahn wie in Abbildung 13 gezeigt drehen, um das
Manometer vom Flusspfad zu isolieren.
4. Durc h vorsichti ges Spülen mi t sterilem Was ser von der Spri tze alle Luf t
aus dem Ventil und dem zusammengebauten Testapparat entfernen.
5. M it sterilem Wa sser von der Spr itze vorsic htig den Fluss d urch das
Ventil herstellen.
6. Das sterile Ventil in das sterile Wasserbad eintauchen. Der
Auslassk onnektor de s Ventils muss sic h unter Wasser be finden,
damit die Richtigkeit der Testergebnisse gewährleistet ist.
7. U nter Beibeha ltung des Flus ses durch das Ven til den Dreiwe gehahn
wie in Abbildung 15 gezeigt drehen, um die Spritze vom Flusspfad
zu isolieren. Nachdem der Dreiwegehahn in die richtige Stellung
gebracht worden ist, sollte die Wassersäule im Manometer
anfang en zu fallen. Di e Spritze ist j etzt vom Vent il isoliert , und der
Fluss mus s nicht mehr mit e iner Spritz e fortgese tzt werde n. Falls die
Wassersäule nicht fällt, die Schritte 2-7 wiederholen.
HINWEIS: Den Wasser spiegel im M anometer 2 bis 2 ½ Mi nuten lang
abfallen lassen. Den resultierenden Druck vom Manometer ablesen.
Von Spritze
1/4
10
1/4
10
5
5
-3
Zum Manometer
F
F
O
Aus
-3
Vom Manometer
O
F
F
Aus
Zum Ventil
Testergebnisse – Präimplantationstest
Die mit dieser Methode erhaltenen Druckwerte können mit den folgenden Merkmalen verglichen werden:
Ventilleistungsstufe Akzeptable Druckbereiche
Stufe 1 1-6 0 mm H2O bei 0 HP
Stufe 1,5 35-95 mm H2O bei 0 HP
Stufe 2 70-130 mm H2O bei 0 HP
Lieferart
Die Medtronic Neurosurgery Delta Shunt Kits werden STERIL und NICHTPYROGEN verpac kt und sind nu r für den einmaligen Gebrauch
bestimmt. NICHT RESTERILISIEREN.
Das beigefügte Produkt ist nur für die Verwendung bei einem einzelnen Patienten gedacht. Dieses Produkt nicht wiederverwenden,
wiederverarbeiten oder resterilisieren. Wiederverwendung, Wiederverarbeitung oder Resterilisation kann die strukturelle Beschaffenheit
des Instruments beschädigen und/oder mit einem Risiko der Kontaminierung einhergehen, die zu Verletzung, Erkrankung oder Tod des
Patienten führen kann. Nicht verwenden, wenn die Packung bereits geöffnet wurde oder beschädigt ist. Medtronic Neurosurgery ist nicht für
die Leistung resterilisier ter Produkte verantwortlich.
Für einen kompletten Shunt sind ein Ventrikelkatheter, ein Medtronic Neurosurgery Delta-Ventil und ein Herz-/Peritonealkatheter oder
Peritonealkatheter erforderlich.
Spezialanfertigungen
Wenn diese Gebrauchsanweisung einer Spezialanfertigung beiliegt, bestehen möglicherweise Unterschiede zwischen den physikalischen
Eigenschaften des beiliegenden Produktes und der Produktbeschreibung in dieser Packungsbeilage. Diese Unterschiede haben keinen
Einfluss auf die Sicherheit oder Wirksamkeit der Spezialanfertigung.
Spezialanfertigungen werden steril oder unsteril geliefert, wie aus dem Verpackungsetikett hervorgeht. Unsterile Produkte müssen vor
Gebrauch gereinigt und sterilisiert werden.
13
14
15
37
Page 40

Kontraindikationen
Das Shunten von CSF in den rechten Herzvorhof, die Peritonealhöhle oder andere Körperbereiche sollte nicht durchgeführt werden, wenn an
irgendeiner Stelle, an der die verschiedenen Komponenten des Shuntsystems zu implantieren sind, eine Infektion vorhanden ist. Dies gilt
auch für Infektionen der Kopfhaut und anderer Hautstellen, die das Shuntsystem durchqueren wird, für die Meningen und die Hirnventrikel,
für das Peritoneum, für intra- und retroperitoneale Organe, die Pleura und den Blutkreislauf. Im Allgemeinen ist das Shunten von CSF
kontraindiziert, wenn in irgendeinem Teil des Körpers eine Infektion vorliegt. Weiterhin kontraindiziert ist das Shunten in den Vorhof von
Patienten mit kongenitalem Herzleiden oder anderen schwerwiegenden kardiopulmonalen Anomalien.
Aufklärung des Patienten
Der Arz t ist dafür ver antwort lich, dass der Pa tient und/oder s ein(e) Stellvert reter über das C SF-Shunten auf geklärt wi rd (werden). Dazu
gehören eine Beschreibung der mit implantierbaren Shuntsystemen verbundenen Komplikationen und eine Erklärung möglicher alternativer
Produkte und Behandlungsmethoden.
Warnhinweise und Vorsichtsmaßnahmen
Das geeignete Produkt sowie Größe, Druck und Leistungsbereich müssen aufgrund der Diagnose und der Erfahrung des Arztes den
Anforderungen des jeweiligen Patienten entsprechend ausgesucht werden. Die zutreffenden Leistungsstufen oder -bereiche des Produkts
sind auf dem Produktetikett angegeben.
Kontakt der implantierbaren Produkte mit Flusen, Handschuhtalk, Hautfettrückständen, Fetts eifen, synthetischen Reinigungsmitteln und
anderen Oberflächenverunreinigungen ist zu vermeiden. Flusen, Fingerabdrücke, Talk und andere Verunreinigungsstoffe der Oberfläche
sowie Rückstände von Gummihandschuhen können allergische oder Fremdkörperreaktionen hervorrufen.
Es ist be sonders dar auf zu achten, d ass während de s Präimplant ationstes ts oder der Han dhabung keine S chadstof fpartik el in die ShuntKomponenten gelangen. Das Eindringen von Verunreinigungen könnte zu einer Beeinträchtigung der Leistung des Shuntsystems führen
(übermäßige oder mangelhafte Drainage). Schadstoffpart ikel im Shuntsystem können auch die Druck-/Flusskontrollmechanismen offen
halten, was zu übermäßiger Drainage führt.
Beim Befestigen der Katheter an den Konnektoren sollten die Ligaturen, die den Schlauch umschließen, sicher, aber nicht zu fest angezogen
werden, da sie sonst den Silikonschlauch durchtrennen könnten.
Beim Legen der Katheter ist Vorsicht geboten, um Knicke und unnötige Abrasion zu vermeiden. Der Rand des Spiralbohr- oder Fräslochs kann
zugesc hnitten we rden, um dort , wo der Ventrike lkatheter au stritt u nd so gebogen i st, dass er am Sc hädel anlie gt, eine abge schrägte Ke rbe zu forme n.
Patient en mit Hydrozep halus-Shunts ystemen müs sen in der post operativen P hase ständi g auf Anzeichen u nd Symptome hin b eobachtet
werden, die eine Fehlfunktion des Shunts vermuten lassen. Die klinischen Befunde können auf eine Shunt-Fehlfunktion hinweisen. Die
klinischen Befunde können auf eine Shunt-Infektion oder eine Unter- bzw. Überdrainage von CSF hinweisen.
Eine Shuntobstruktion kann in jedem Teil des Shuntsystems auf treten. Das System kann durch Gewebefragmente, Blutgerinnsel,
Anhäufungen von Tumorzellen, bakterielle Ansiedlungen oder andere Zelltrümmer okkludieren. Katheter, die mit internen Körperstrukturen
in Kontak t kommen, könne n an der Spitze a bgeknick t oder blocki ert werden (z . B. Eindringen d er Ventrikelka theterspi tze in den Plex us
choroideus oder Einbettung der Distalkatheterspitze in das Omentum majus oder Darmschlingen). Schließlich kann eine Shuntobstruktion
aufgrund des Wachstums eines Kindes oder Kleinkindes oder infolge körperlicher Aktivitäten eintreten, die zu einer Dekonnektion der
Shuntkomponenten oder zur Entfernung des Distalkatheters vom geplanten Drainagesitus führen.
Koagulation im Bereich des atrialen Kathetersegments kann zur Embolisation des Pulmonalarteriensystems und damit zu einem Cor
pulmonale und zu pulmonaler Hypertonie führen.
Abgetrennte Shunt-Komponenten könnten weiter ins Herz oder in die Peritonealhöhle abwandern.
Shuntsysteme können aufgrund einer mechanischen Fehlfunktion ein Versagen und übermäßige oder mangelhafte Drainage zur Folge
haben.
„Klein e” Katheter ha ben dünnere Wä nde und sind allg emein schwäc her als „norm algroße” Kat heter.
Angaben zufolge haben „kleine” Peritonealkatheter eine höhere Bruchrate im Vergleich zu „normalgroßen” Peritonealkathetern. Ärzte,
die aus einem beliebigen Grund „kleine” Peritonealkatheter implantieren (z. B. aus kosmetischen Gründen) sollten die Vorteile gegen die
möglicherweise höhere Rate der Peritonealkatheterrevision abwägen.
Eine Fehlfunktion oder Obstruktion des Shuntsystems kann zu Anzeichen und Symptomen von zunehmendem intrakraniellen Druck führen,
wenn der Hydrozephalus nicht kompensiert wird. Beim Kleinkind sind häufige Befunde: zunehmender Druck der vorderen Fontanelle,
Stauung der Kopfhautvenen, Teilnahmslosigkeit, Schläfrigkeit und Reizbarkeit, Erbrechen und Nackensteife. Bei älteren Kindern und
Erwachsenen sind die Symptome gewöhnlich Kopfschmerzen, Erbrechen, Schleiersehen, Gedächtnisverlust, Nackensteife, Verschlechterung
der Vigilanz und verschiedene neurologische Störungen.
Die übermäßige Drainage von CSF kann für die Entwicklung eines subduralen Hämatoms oder Hygroms oder für den Kollaps der
Seitenventrikelwände prädisponieren, welches wiederum zu einer Obstruktion des Ventrikelkatheters führt.
Sollte sich der Ventrikelkatheter durch fibröses Gewebe mit dem Plexus choroideus oder mit angrenzendem Hirngewebe verbinden, wird
empfohlen, ihn nicht mit Gewalt zu entfernen. Die vorsichtige Drehung de s Katheters k ann dazu beit ragen, ihn zu lös en. Es wird ang eraten,
den Katheter lieber an seiner Stelle zu belassen, als durch gewaltsames Entfernen eine intraventrikuläre Hämorrhagie zu riskieren.
Subkutane Katheterpassierer können an den Schweißnähten oder Verbindungspunkten der Komponenten oder aufgrund extremer
Deformierung des formbaren Schaftes versagen. Ein plötzlicher Bruch kann zu Gewebs- oder Organverletzungen führen und das Shuntsystem
beschädigen. Alle Instrumente müssen vor Gebrauch inspiziert werden, damit ihre Unversehrtheit und Funktionalität gewährleistet sind.
Instrumente zum Einmalgebrauch dürfen auf keinen Fall wiederverwendet werden, um Verletzungen des Patienten und des Arztes zu
vermeiden.
Komplikationen
Komplikationen im Zusammenhang mit ventrikuloatrialen und ventrikuloperitonealen CSF-Shuntsystemen ähneln möglicherweise denen,
die auch bei anderen operativen Verfahren unter Lokalanästhesie und/oder Vollnarkose auftreten können. Dazu gehören Reaktionen auf
Arzneimittel und Anästhetika, Störungen des Elektrolytgleichgewichts und hoher Blutverlust, insbesondere bei Kleinkindern. In seltenen
Fällen kann beim Patienten eine Reaktion auft reten, die auf eine Überempfindlichkeit dem Implantat gegenüber zurückzuführen ist.
Die Verwendung ungefilterter oder unkontrollierter Flüssigkeiten zur Präimplantationstestung kann zu einer Fehlfunktion des Ventils führen
und eine Revision des Ventils erforder lich machen. Alle Geräte dürfen nur in einem kontrollierten Krankenhausumfeld gehandhabt werden,
damit kein e Partikel, Fas ern oder ander e Schadstof fe in das Venti l gelangen.
38
Page 41

Der Gebrauch scharfer Instrumente bei der Handhabung dieser Medizinprodukte kann zu Kratzern oder Schnitten im Silikonelastomer und
damit zu Le ckagen führ en, die eine Rev ision des Ventil s erforder lich machen. Au ch beim Schli eßen von Wunden m uss vorsicht ig vorgegang en
werden, um sicherzustellen, dass die Ventile nicht durch die Nähnadeln angeschnitten oder eingeritzt werden.
Die meisten Komplikationen bei CSF-Shuntingverfahren lassen sich auf Obstruktion des Systems zurückführen, wie im Abschnitt
„Warnhinwe ise und Vorsich tsmaßnahme n” in der Packung sbeilage des P roduktes b eschriebe n ist. Eine Obs truktio n kann bei allen
Systemkomponenten durch Verstopfung mit Hirngewebsfragmenten, Blutgerinnseln und/oder Anhäufungen von Tumorzellen an irgendeiner
Stelle auftreten. Weiterhin kann es durch eine Trennung der Systemkomponenten sowie durch Abknickung und Aufwicklung des Katheters zu
Obstruktionen kommen. Dies kann die Migration des Ventrikelkatheters in den lateralen Ventrikel und des distalen Katheters in das Herz und
das Pulmonalarteriensystem, das Peritoneum oder andere Körperteile, in welche der Katheter implantiert ist, verursachen. Beim Kleinkind
und Kind k ann das Körper wachstum d azu führen, da ss sich der Dis talkathete r vom Atrium in die Ve na jugularis in terna oder vom Pe ritoneum
in Gewebeflächen verlagert, in denen die Flüssigkeit nicht absorbiert werden kann.
Neben den oben beschriebenen Shuntobstruktionsarten gibt es andere potenziell schwere Komplikationen. Lokale und systemische
Infektionen sind bei Shuntverfahren nicht selten. Infektionen werden meist von Organismen verursacht, die sich in der Haut ansiedeln,
besonders Staphylococcus epidermidis. Es könne n sich jedoch au ch andere im Blu t zirkulier ende Errege r im Shunt ansied eln und bei der
Mehrzahl der Patienten dessen Entfernung erfordern.
1973 fassten Robertson et al. das Auftreten von bis dahin gemeldeten Infektionen bei ventrikuloatrialen und ventrikuloperitonealen
Shunts zusammen. Die Inzidenz von Infektionen bei ventrikuloatrialen Shunts variierte zwischen 7 % und 31 %. Infektionen bei
ventrik uloperito nealen Shunt s traten in den me isten Beric hten bei 5-10 % der Patien ten auf. Da ventr ikuloatria le Shunts die Ver breitung von
Bakterien zu anderen Organen begünstigen, werden ventrikuloperitoneale Shunts als weniger zerstörerisch angesehen.
Kürzlich (1993) berichteten Kestle et al. über eine signifikante Infektionsreduktion (weniger als 4 % Infektionen) durch den Einsatz von
Antibiotika, kurze Operationsdauer (OP-Erfahrung) und kontrollierte Umgebung im Operationssaal (z. B. abgeschlossener Operationssaal,
wenig Per sonal und bes chränkter Ver kehr, abgedec kte Hautf lächen). In diese m Artikel wir d berichtet , dass auch ohne A ntibiotika g ute
Resultate durch rigorose perioperative Kontrolle der Umgebung erzielt werden.
Der Gebrauch prophylaktischer Antibiotika bei Shunt-Patienten ist etwas umstritten, weil er zu Infektionen durch widerstandsfähigere
Organismen führen kann. Daher liegt die Entscheidung, ob Antibiotika prophylaktisch gegeben werden sollten, beim behandelnden Arzt
und/oder Chirurgen.
Übermäßige Drainage von CSF kann eine exzessive Senkung des CSF-Drucks verursachen und zur Entwicklung eines subduralen Hämatoms
oder Hygroms sowie zur übermäßigen Schrumpfung des Ventrikels mit nachfolgender Obstruktion durch Einstürzen der Ventrikelwände
auf die Einlasslöcher des Katheters führen. Beim Kleinkind verursacht diese übermäßige Drucksenkung einen sichtbaren Einfall der großen
Fontanelle sowie eine Kraniostenose; außerdem kann sie dazu führen, dass ein Hydrocephalus communicans zu einem Hydrocephalus
occlusus wird.
In gewiss en Fällen wurd e das Auftre ten von Epileps ie nach ventri kulären Shunt verfahr en festges tellt. In dies er Studie hat sic h auch erwie sen,
dass das Auftreten von Anfällen mit mehrfachen Katheterrevisionen zunahm.
Shunts in das Peritoneum könnten wegen der Einbettung des Katheters in die Darmschlingen oder in das Omentum majus versagen. Eine
Perforation des Darms durch den Peritonealkatheter mit nachfolgender Peritonitis wurde beschrieben.
Komplikationen in Verbindung mit dem Gebrauch der Instrumente
Komplikationen, die unmittelbar mit dem Gebrauch des subkutanen Katheterpassierers für den Einmalgebrauch zusammenhängen,
umfassen Schwierigkeiten bei der Passage des Instruments durch vernarbte Bereiche sowie die Möglichkeit der Hämatombildung.
Warenrücksendungen
Die Produkte müssen in ungeöffneter Verpackung mit unversehrtem Herstellersiegel zurückgesandt werden, um für den Austausch
oder gegen Gutschrift angenommen werden zu können, außer bei Fällen, in welchen sie wegen einer Beschwerde über einen Produktoder Beschriftungsfehler zurückgesandt werden. Medtronic Neurosurgery entscheidet über das Vorliegen eines Produkt- oder
Beschriftungsfehlers, und diese Entscheidung ist endgültig. Produkte, die sich länger als 90 Tage im Besitz des Kunden befinden, können
weder für den Umtausch noch gegen Gutschrift angenommen werden.
Garantie
A. Begrenzte Standardgarantie. Medtronic Neurosurgery gewährleistet dem ursprünglichen Endabnehmer („Käufer“), dass das
beigefügte, vom Käufer gekaufte implantierbare Produkt („Produkt“) für den einmaligen Gebrauch zum Zeitpunkt der Lieferung an den
Käufer im Wesentlichen frei von Material- und Verarbeitungsfehlern ist. Medtronic Neurosurgery leistet keine Garantie (ausdrücklich,
stillschweigend oder gesetzlich) für Produkte, die modifiziert wurden (vorbehaltlich ausdrücklich hierin enthaltener Angaben) oder für
solche, die ungewöhnlicher physischer Belastung, Missbrauch, unsachgemäßer Bedienung, Fahrlässigkeit, unsachgemäßen Tests oder
Verwendung in Verbindung mit anderen Produkten oder Bestandteilen als jenen, für die diese Produkte konzipiert wurden, ausgesetzt
wurden, o der wenn dies e Produkte in e iner Art und Weis e oder in einem m edizinisch en Verfahre n verwendet we rden, für die si e nicht
indiziert sind.
B. Recht smittel. Das ausschließliche Rechtsmittel des Käufers bzw. die einzige Haftung von Medtronic Neurosurgery für eine Verletzung
der vorstehenden Garantie ist, nach freier Wahl von Medtronic Neurosurgery, entweder der Ersatz des Produkts oder eine Gutschrift für den
Käufer des für das Produkt tatsächlich bezahlten Nettobetrags, vorausgesetzt, dass (i) Medtronic Neurosurgery innerhalb von neunzig (90)
Tagen nach Er halt des Produ kts durch de n Käufer schr iftlich d arüber info rmiert wir d, dass das Prod ukt nicht den A nforderun gen entspri cht,
einschließlich einer detaillierten Erklärung der angeblichen Nichtentsprechung in englischer Sprache; (ii) das Produkt innerhalb von neunzig
(90) Tagen nach Er halt an Medtr onic F.O.B. 125 Cremona Dri ve, Goleta, Ca lifornia 93117, U.S.A., oder eine an dere von Medt ronic Neuros urgery
angegebene Adresse zurückgesandt wird; und (iii) Medtronic Neurosurgery auf ausreichende Weise überzeugt ist, dass die beanstandete
Nichtentsprechung tatsächlich besteht. Vorbehaltlich der in diesem Absatz ausdrücklich fes tgelegten Bestimmungen ist der Käufer nicht
berechtigt, Produkte ohne vorheriges schriftliches Einverständnis von Medtronic Neurosurgery an Medtronic Neurosurgery zurückzuschicken.
C. Aussc hluss son stiger Gara ntien. ABGESE HEN VON DER GARANTI EBESCHRÄNKUNG IN A BSCHNITT (A) OBEN MAC HT MEDTRONIC
NEUROSURGERY KEINERLEI GARANTIEN ODER ZUSICHERUNGEN, WEDER AUSDRÜCKLICH NOCH STILLSCHWEIGEND, UND DER
HERSTELLE R ÜBERNIMMT KEINE GAR ANTIE FÜR DIE MARKTE IGNUNG ODER TAUGLICHKEI T FÜR EINEN BESTIMMTEN Z WECK.
MEDTRONIC NEUROSURGERY ÜBERNIMMT KEINERLEI HAFTUNG, DIE DURCH ODER IN VERBINDUNG MIT DEM VERKAUF ODER
GEBRAUCH EI NES PRODUKTES ENT STEHT, NOCH ERMÄCHTIG T MEDTRONIC NEUROSUR GERY EINE ANDERE PERS ON, EINE SOLCHE ZU
ÜBERNEHMEN.
39
Page 42

40
Page 43

Κιτ αναστόωση Delta
14
12
10
14
12
10
52030
140
40 50
Περιγραφή
Κάθε βαλ βίδα Delta Med tronic Neur osurgery ε νσωατώνε ι ια βαλβίδα π ίεση εβρά νη σε σειρά ε η χανισό ε ταγγισ τικού ελέγ χου
που είναι κ λειστό υ πό κανονικέ σ υνθήκε. Αυτό ο συνδυασό επιτρέπε ι στη βαλβί δα να διατηρε ί την ενδοκοι λιακή πίεσ η (IVP) εντό
φυσιολο γικών ορίων, άσχε τα από τι απαι τήσει ροή ε γκεφαλονω τιαίου υγρού (E NY) του ασθε νού ή τη θέση τ ου σώατο . Ο έλεγχο τ η
ροή επι τυγχάνε ται ε τη συνδ υασένη αν τίστασ η τη εβράν η και των διαφρα γάτων του ε ταγγισ τικού ελέ γχου. Ο βαθό α ντίστα ση
καθορίζ ει τα χαρακτη ριστικά από δοση τη βα λβίδα. Η ανάδ ροη ροή αποτρ έπεται από τ η εβράνη. Το φαι νόενο τη εταγγι στική
δράση ε λέγχετ αι από τα δύο διαφρ άγατα από ε λαστοερ έ σιλικόνη τ ου εταγγ ιστικού ε λέγχου Del ta, τα οποία είνα ι κλειστά υ πό κανονικέ
συνθήκ ε. Τα διαφράγα τα ανοίγουν λ όγω τη θετι κή αντίθε τη ροή τη ε νδοκοιλια κή πίεση.
Η βαλβίδ α διατίθετ αι σε δύο εγέθ η, ικρή και κανο νική. Κάθε έγ εθο διατί θεται σε τρία εύ ρη πιέσεων: Επί πεδο απόδοσ η 1, 1,5 και 2. Τα
χαρακτ ηριστικά α πόδοση τη βαλβίδα απε ικονίζονται σ τα γραφήατ α (Εικ. 1α-β).
Το κιτ ικρο ύ εγέθου α ποτελείτα ι από ια βαλβ ίδα Delta, ικ ρή, σε επίπεδο α πόδοση 1, 1,5 ή 2. Το κιτ τυ πικού εγέθ ου αποτελ είται από
ια βαλ βίδα Delta, τυ πικού εγέθ ου, σε επίπ εδο απόδοση 1, 1,5 ή 2. Αφ ότερα τα κιτ πε ριλαβάν ουν έναν κοι λιακό καθετή ρα 23 cm, τυπι κή
διαέ τρου, εποτισ ένο ε βάριο κα ι ένα καρδιακό / πε ριτοναϊκό καθ ετήρα των 90 c m, τυπική δι αέτρου, επ οτισένο ε βάριο.
1a
0
0
O)
0
2
80
60
40
ΠΙΕΣΗ (mm H
20
Επίπεδο απόδοση 2,0
105
Επίπεδο απόδοση 1,5
70
Επίπεδο απόδοση 1,0
35
52030
ΡΥΘΜOΣ ΡΟHΣ (mL/ώρ α)
Κάθε βαλβίδα Medtronic Neurosurgery δοκιάζεται για τα χαρακτηριστικά απόδοσή τη ε ένα σύστηα γεάτο νερό κατά την κατασκευή τη. Όλε οι βαλβίδε πρέπει να
πληρούν τι προδιαγραφέ τη ετικέτα σ’ αυτέ τι δοκιέ. Οι ετέπειτα δοκιέ στη βαλβίδα πορούν να δώσουν διαφορετικά αποτελέσατα ανάλογα ε τι συνθήκε τη
δοκιή και την κατάσταση τη βαλβίδα. Οι δοκιέ κατά την κατασκευή επιτρέπουν τη διασφάλιση τη συνεπού υψηλή ποιότητα κάθε βαλβίδα Medtronic Neurosurgery.
40 50
125
0 cm H2O HP*
90
ΣΗΜΕΙΣΗ: Τα εικονιζόενα επίπεδα είναι
ενδιάεσε τιέ. Το εύρο ανοχή αυτών
των ενδιάεσων τιών είναι +/- 25 mm H20.
55
*Υδροστατική πίεση
Ελληνικά
1b
0
0
O)
2
0
80
60
ΠΙΕΣΗ (m m H
40
20
120
85
50
Επίπεδο απόδοση 2,0
Επίπεδο απόδοση 1,5
Επίπεδο απόδοση 1,0
105
70
- 50 cm H2O HP*
ΣΗΜΕΙΣΗ: Τα εικονιζόενα επίπεδα είναι
ενδιάεσε τιέ. Το εύρο ανοχή αυτών
των ενδιάεσων τιών είναι +/- 40 mm H20.
*Υδροστατική πίεση
ΡΥΘΜOΣ ΡΟHΣ (mL/ώρ α)
Κάθε βαλβίδα Medtronic Neurosurgery δοκιάζεται για τα χαρακτηριστικά απόδοσή τη ε ένα σύστηα γεάτο νερό κατά την κατασκευή τη. Όλε οι βαλβίδε πρέπει να
πληρούν τι προδιαγραφέ τη ετικέτα σ’ αυτέ τι δοκιέ. Οι ετέπειτα δοκιέ στη βαλβίδα πορούν να δώσουν διαφορετικά αποτελέσατα ανάλογα ε τι συνθήκε τη
δοκιή και την κατάσταση τη βαλβίδα. Οι δοκιέ κατά την κατασκευή επιτρέπουν τη διασφάλιση τη συνεπού υψηλή ποιότητα κάθε βαλβίδα Medtronic Neurosurgery.
Το εγκεφα λονωτιαίο υγρ ό εξέρχεται α πό τον καθετήρ α έσω τεσσάρω ν σχισοει δών ανοιγά των, τοποθετη ένων σε γωνί α 90˚ στην
περιφέρ εια του καθετ ήρα κοντά στ ο περιφερικό άκ ρο (Εικ.8). Αυτά τα α νοίγατα εί ναι σχεδιασ ένα για παροχ ή προστασία από ανάδροη
ροή. εν ε ίναι σχεδιασ ένα ω βαλ βίδε ελέγ χου πίεση / ροή , αλλά προ σθέτουν ε λαφρά αντί σταση στ η ροή. Η έγισ τη αντίσ ταση στ η ροή
σε σταθ ερό ρυθό ροή 20 mL/ώρα, είναι 2 ,0 cm H2O. Τα σχισο ειδή ανοίγα τα επικαλύπ τονται ε γ ραφίτη κατά τ ην κατασκευή , για την
ελαχι στοποίησ η τη πιθανότ ητα κόλλησ η τη επιφά νεια ε τα ανοί γατα κατά τη ν αποθήκευση.
Οι βαλβ ίδε κατασκευ άζονται ε τη χ ρήση καλουπω ένη ανθε κτική βάσ η ακριβεία α πό πολυπροπυ λένιο τοποθε τηένη έσα σε ια
λεία, ε λαστική θή κη από ελασ τοερέ σιλ ικόνη ε κυρτό π υθένα (Ει κ. 2). Η βάση συνεισ φέρει στη δ οική ακεραι ότητα, την αξ ιοπιστία
πίεση / ρ οή και εταγ γιστικού ε λέγχου, απ οτρέποντ α τυχόν παραό ρφωση και κόλ ληα τη έδρα τ η βαλβίδα κα ι τη εβράν η και των
θυρών ε λέγχου ε τάγγιση και διαφραγά των. Ο θόλο είναι σ ηειωέν ο ε ακτινο σκιερά ενδ εικτικά βέ λη εποτισ ένα ε ταν τάλιο που
υποδεικ νύουν το επ ίπεδο απόδο ση και την κατε ύθυνση ροή .
41
Page 44

2
Ενιαίο συνδετήρα
εισροή εισόδου
Θόλο από σιλικόνη
Εγγύ αποφρακτήρα
εξαενή
Ακτινοσκιεροί δείκτε απόδοση / κατεύθυνση ροή
Περιφερικό αποφρακτήρα
Θάλαο Delta
Ενιαίο συνδετήρα
εκροή
Ακτινοσκιερό σηαντήρα
Σκληρή πλαστική βάση από πολυπροπυλένιο
Οι βαλβ ίδε Delta ενσ ωατώνουν σ υνδετήρ ε σχεδιασέ νου να ειώνο υν την πιθαν ότητα αποσ ύνδεση του καθ ετήρα. Απα ιτείται ία
κυκλω τική απολίν ωση για να στ ηρίξετε κάθε κα θετήρα σ τη βαλβίδα . Οι ακτινοσ κιερέ ενδε ίξει στη βά ση κάθε συνδε τήρα (Εικ. 2) επ ιτρέπουν
στο γιατρό την απεικόνιση έσω ακτινογραφιών των σχετικών θέσεων των καθετήρων και βαλβίδων in vivo όταν χρησιοποιούνται οι
ακτινοσκιεροί καθετήρε.
Ο ακτινοσκιερό κωδικό5στη βα λβίδα καθορί ζει τα χαρακτ ηριστικά π ίεση / ροή τη σ υσκευή. Ο αρ ιθό 5αντ ιστοιχεί σ το επίπεδο
απόδοσ η 1, ο αριθό6στο επ ίπεδο απόδο ση 1,5 και ο αριθό7στο επ ίπεδο απόδο ση 2. Ο θόλο έχει σ χεδιαστε ί για να επιτρέ πει την
έγχ υση ή τη δειγα τοληψία ENY έσ ω βελόνα η απ οκοπή πυρήνα 2 5-gauge ή ικ ρότερη (Εικ. 9). Η αν θεκτική β άση πολυπροπ υλενίου
αποτρέ πει την πλήρη δι άτρηση τη βα λβίδα από τη β ελόνα. Οι βα λβίδε Delta πορούν να εκπ λυθούν είτε σ ε περιφερική , είτε σε εγ γύ
κατεύθ υνση έσω διαδ ερική πίεσ η ε το δάκτ υλο. Οι αποφράκ τε βρίσκον ται σε εγγύ και περιφερικ ή θέση ω προ τ ην κεντρικ ή δεξαενή,
για τη διε υκόλυνση επ ιλεκτικ ή έκπλυση .
Βαλβίδα εβράνη
από σιλικόνη
Τα χαρακτ ηριστικά ρ οή τη συσκ ευή δεν επ ηρεάζοντα ι από εξέτασ η MR. Η συσκευ ή δεν χρειάζ εται έλε γχο ή επαν αρρύθιση ετά από εξέ ταση MR.
Ενδείξει
Τα κιτ ανασ τόωση Del ta Medtron ic Neurosurg ery είναι σ χεδιασένα γι α χρήση κατά τη ν αναστόω ση ΕΝΥ από την πλ ευρική κοι λία του
εγκεφά λου στο δεξι ό κόλπο τη καρδι ά ή την περιτον αϊκή κοιλότ ητα. Επιπλέ ον, η βαλβίδα Del ta ελαχισ τοποιεί την υ περβολική εί ωση
τη ενδ οκοιλιακή π ίεση και του όγκο υ λόγω υπερβολι κή παροχέτε υση ΕΝΥ, που πορεί να π ροκληθεί α πό τη εταγ γιστικ ή δράση τη
υδροσ τατική πί εση του περιφε ρικού καθετ ήρα. Το εταγ γιστικό φαι νόενο πορ εί να δηιουργ ηθεί από την υπε ρύψωση του κοι λιακού
καθετ ήρα σε σχέση ε τ ον περιφερικό κα θετήρα (δηλ. ό ταν ο ασθενή κάθεται, στ έκεται, ή κρα τείται ανασ ηκωένο).
Οδηγίε χρήση
Χειρουργική τεχνική
Μπορούν ν α χρησιοποι ηθούν διάφορ ε τεχνικέ γ ια την τοποθέ τηση του συσ τήατο α ναστόωσ η Delta. Η χειρ ουργική τεχ νική που θα
χρησιοποιηθεί εναπόκειται στη διάκριση του χειρουργού.
3
4
10
5
Οπή
τρυπανισού
Καθετήρα υπό
κάψη, ωθήστε
στην
εγκοπή
γλωττίδα
Κρανίο
7
Οπή τρυπάνου ή φρέζα
Κλιπ ορθή γωνία
Κοιλιακό καθετήρα
Βαλβίδα ελέγχου ροή
ΕΝΥ, διαορφωένη
Ράα
6
Προ τι
κοιλίε
του συσ τήατο α ναστόω ση. Η τοποθέ τηση τη β αλβίδα κά τω από το
σηείο α ναφορά θα ε πιφέρει συ νολική είω ση τη αντ ίσταση σ τη ροή του
συστ ήατο αν αστόωσ η όταν ο ασθε νή κάθεται , στέκετα ι, ή κρατεί ται
σε αναση κωένη θέσ η. Αυτέ οι αλ λαγέ είναι ά εσα ανάλο γε ω προ τη
γραικ ή απόστασ η (mm) πάνω ή κάτω απ ό το σηείο ανα φορά.
Χειρουργική επέβαση
Τοποθέτηση κοιλιακού καθετήρα
Το κλιπ δεξι ού άκρου που εί ναι συναρο λογηένο σ τον κοιλιακ ό καθετήρα
(Εικ. 3) πορε ί να χρησιοπο ιηθεί για την κά ψη του καθετ ήρα σε γωνία
περίπου 9 0° στο ση είο όπου ο καθετ ήρα εξέρχε ται του τρυπαν ιού
συστρ οφή ή τη οπή τρ υπανισο ύ (Εικ. 6). Μπορείτ ε να χρησιοποι ήσετε
το κλιπ ω δείκτη γι α να καθορίσε τε το βάθο εισ αγωγή του καθ ετήρα,
σύρον τα το κλιπ σ την κατάλ ληλη απόσ ταση από το ε γγύ άκρ ο του
καθετ ήρα πριν από τη ν εισαγωγή (Ε ικ. 4).
Συνισ τάται η τοποθέ τηση τη βα λβίδα σε
χαλαρό υ ποκρανοειδ ή θύλακα επιτε υγένο
ε χειρουργική επέβαση, προ αποφυγή
συπί εση από το υπερ κείενο κρα νίο και όχι
κάτω από τ ην τοή του κρα νίου. Η βαλβίδα
πορεί να σ τερεωθεί σ τον παρακεί ενο ιστό
ε ράα τα έσω των ενι σχυένω ν από
ύφασα πτερυγίων.
Η θέση τοπο θέτηση τ η βαλβίδα Delta
Medtronic Neurosurgery θα έχει επίδραση
στην όλ η απόδοση τ η αναστό ωση. Το
τρήα του Mo nro είναι έν α καθιερωέ νο
ηδενι κό σηείο επι πέδου αναφ ορά για
την παρα κολούθηση τ η ενδοκρα νιακή
πίεση . Η τοποθέτη ση τη βαλ βίδα πάνω
απ’ αυτό το σηείο αναφορά θα προκαλέσει
συνολι κή αύξηση τ η αντίσ ταση στ η ροή
42
Page 45

Αυτό πορ εί να γίνει ε το σ τυλεό έσα σ τον καθετ ήρα. Ο στυλ εό από ανοξ είδωτο χάλυβ α είναι σχεδι ασένο γι α να διευκολύνε ι την εισαγωγ ή του
καθετ ήρα στην πλ άγια κοιλία . Ο καθετήρα είναι συσκε υασένο ε το στυλεό τ οποθετη ένο έσα στ ον αυλό.
Μετά τον ε ντοπισό τ ου καθετήρ α στην κατά λληλη θέση σ την κοιλία κ αι αφού έχει αφα ιρεθεί ο στυ λεό, πιέζε τε το εξωκραν ιακό τήα του
καθετ ήρα στο διαχω ρισένο σωλ ηνοειδέ τή α του κλιπ για ν α σχηατί σετε την ορθή γ ωνία κάψη (Εικ. 5 κα ι 6). Όταν ο καθετ ήρα έχει
πιεστ εί στο κλιπ, δ εν πρέπει να ε κτείνετα ι. Εάν ο καθετ ήρα πρόκειτα ι να τοποθετη θεί στην κοι λία έσω σωλην οειδού εισα γωγέα, πρέπε ι να
αφαιρε θεί το κλιπ πρι ν την εισαγωγ ή του καθετήρ α έσω του εισα γωγέα. Θα πρέπ ει να στερεώσ ετε το κλιπ ο ρθή γωνία στ ον παρακείε νο
ιστό, περ νώντα ρά ατα έσα από τι δύο οπέ ραάτ ων στι πλευ ρέ του κλιπ (Ε ικ. 7).
Για σύνδεση τ η βαλβίδα De lta στον κοι λιακό καθετ ήρα, εισάγε τε τον ενσωα τωένο συ νδετήρα απ ό πολυπροπυλ ένιο στη σω λήνωση
κοιλια κού καθετήρα . Ο συνδετή ρα πρέπει να κα λύπτεται π λήρω από τη σ ωλήνωση. Ασφ αλίστε τη σ ωλήνωση στ ο συνδετή ρα ε κυκλωτ ική
απολίνω ση. Πρέπει να πρ οσέχετε και ν α διασφαλίσ ετε ότι η απολί νωση επιφέ ρει ασφαλή σ ύνδεση αλ λά δεν αποκόπ τει τη σωλήνω ση.
Πρέπει ν α δηιουργηθε ί υποκρανοε ιδή θύλακα ε το κα τάλληλο β άθο για την υπο δοχή του εξωκρ ανιακού τή ατο του κοιλ ιακού καθετή ρα
και του συ γκροτήα το τη βαλβί δα Delta του κι τ αναστό ωση. Συνισ τούε η εφύτ ευση του κοιλ ιακού καθετή ρα να είναι το τε λευταίο βήα
στη διαδικασία αναστόωση. Αυτό θα ελα χιστοποιήσει την απώλεια ΕΝΥ κατά την εγχείρηση.
Τοποθέτηση περιτοναϊκού καθετήρα
Μπορούν ν α χρησιοποι ηθούν διάφορ ε τεχνικέ γ ια την τοποθέ τηση του περιφ ερικού καθετ ήρα στην πε ριτοναϊκή κο ιλότητα. Η θέ ση τη
τοποθέ τηση εναπ όκειται στ ην κρίση του χει ρουργού. Ο καθε τήρα έχει ήκο 90 cm ε σχισ οειδή ανοί γατα στο το ίχωα του περιφ ερικού
άκρου (Ει κ. 8). Οι καθετήρ ε έχουν επαρκ έ ήκο για καρδια κή ή περιτονα ϊκή τοποθέτ ηση στου πε ρισσότερο υ ενήλικου . Ο χειρουργό
πορεί να α ποκόψει το εγ γύ άκρο για τ ην επιλε γένη θέση το ποθέτηση κ ατά την εγχε ίρηση. ιαφορ ετικά, εάν δ εν επιθυε ίτε σχισο ειδή
ανοίγ ατα στα τοιχ ώατα του καθε τήρα, πορε ίτε να αποκόψε τε το περιφερι κό άκρο. Ο καθετ ήρα πρέπει να ε λεγχθ εί για τη βατότ ητά του
κατά τη χρ ονική στι γή τη εγχε ίρηση (δείτε τ η οκιή βατότ ητα συστ ήατο
αναστόωση).
ΠΡΟΣΟΧΗ: ΕΑΝ ΤΟ ΠΕ ΡΙΦΕΡΙΚΟ ΑΚΡΟ ΤΟΥ ΚΑΡΙΑΚΟ Υ / ΠΕΡΙΤΟΝΑΪΚΟΥ
ΚΑΘΕΤΗΡΑ ΕΧ ΕΙ ΨΑΛΙΙΣΤΕΙ, ΜΗΝ ΤΟΠΟΘ ΕΤΕΙΤΕ ΤΟΝ ΚΑΘΕΤΗΡΑ ΚΟΛΠΙΚ Α.
Εάν απαι τείται συσκ ευή διάνοιξη σήραγγα γ ια την τοποθέ τηση του περι φερικού
καθετ ήρα, συνισ τάται η ία χρήσ η συσκευή υ ποδερική δ ιέλευση κα θετήρα
Medtronic Neurosurgery.
ΣΗΜΕΙΣΗ: εν συπεριλαβάνεται συσκευή διέλευση
καθετ ήρα ία χρήση σ το κιτ ανασ τόωση De lta
Medtronic Neurosurgery.
ΠΡΟΣΟΧΗ: ΤΑ ΜΗ ΕΝΙΣΧ ΥΜΕΝΑ ΥΛΙΚΑ ΑΠΟ
ΕΛΑΣΤΟΜΕΡΗ ΣΙΛΙΚΟΝΗ ΧΑΡΑΚΤΗΡΙΖΟΝΤΑΙ ΑΠΟ
ΧΑΜΗΛΗ ΑΝ ΘΕΚΤΙΚΟΤΗΤΑ ΣΤΟ ΣΧΙ ΣΙΜΟ. ΠΡΕΠΕΙ
ΝΑ ΠΡΟΣΕΧΕ ΤΕ ΚΑΤΑ ΤΟ ΧΕΙΡΙΣΜΟ ΚΑΙ ΤΗΝ
ΤΟΠΟΘΕΤΗΣΗ Τ ΗΣ ΣΛΗΝΣΗΣ ΚΑΘ ΕΤΗΡΑ ΑΠΟ
ΕΛΑΣ ΤΟΜΕΡΕΣ ΣΙΛΙΚΟΝΗΣ ΓΙΑ ΤΗΝ ΑΠΟ ΦΥΓΗ
ΤΥΧΟΝ ΕΓ ΚΟΠΝ, ΤΣΑΚΙΣΜΑΤΝ, Ή Σ ΧΙΣΙΜΑΤΝ.
Βελόνα 25-gauge ή ικρότερη
8
9
Έγχυση εντός τ ης βαλβίδας
Η βαλβίδα Delta Medtronic Neurosurgery έχει
σχεδια στεί για να επ ιτρέπει την έ γχυση ή τη
δειγα τοληψία ENY έσ ω θόλου ε τη χρήσ η βελόνα η
αποκοπή πυρήνα 25-g auge ή ικρότε ρη (Εικ. 9).
ΠΡΟΣΟΧΗ: ΤΑ ΜΗ ΕΝΙΣΧ ΥΜΕΝΑ ΥΛΙΚΑ ΑΠΟ
ΕΛΑΣΤΟΜΕΡΕΣ ΣΙΛΙΚΟΝΗΣ ΧΑΡΑΚ ΤΗΡΙΖΟΝΤΑΙ ΑΠΟ
ΧΑΜΗΛΗ ΑΝΘΕΚΤΙΚΟΤΗΤΑ ΣΤΟ ΣΧΙΣΙΜΟ. ΑΠΑΙΤΕΙΤΑΙ
ΜΕΓΑΛΗ ΠΡΟΣΟΧΗ Κ ΑΤΑ ΤΗΝ ΕΙΣΑΓΓΗ ΚΑΙ
ΕΞΑΓΓΗ ΤΗΣ ΒΕ ΛΟΝΑΣ.
Η βελόν α πρέπει να εισα χθεί σε γωνία όχ ι εγαλύ τερη
των 45˚ από το τ ριχωτό τη κεφα λή ή τη βάση τ η
βαλβίδ α. Αν η βαλβίδ α πρόκειται να τρ υπηθεί αρκε τέ
φορέ, σ υνιστάτ αι η εισαγωγή τ η βελόνα σ ε διάφορα
σηεία για να αποφύγετε τι πολλαπλέ παρακε ντήσει
στο ίδιο σ ηείο του θόλ ου. Η καθετηρι ακή σωλήνωσ η, οι
αποφρά κτε, και τα δι αφράγατα εταγγι στικού ε λέγχου
δεν πρέπει να χρησιοποιούνται ω σηεία έγχυσ η.
ΠΡΟΣΟΧΗ: ΤΟ ΤΜΗΜΑ Μ ΕΤΑΓΓΙΣΤΙΚΟΥ ΕΛΕΓΧ ΟΥ
ΑΥΤΗΣ ΤΗΣ ΣΥ ΣΚΕΥΗΣ ΕΝ ΣΧΕ ΙΑΣΤΗΚΕ ΓΙΑ
ΝΑ ΕΠΙΤΡΕΠΕΙ ΙΕΙΣ ΥΣΗ ΒΕΛΟΝΑΣ. ΛΟΓ ΤΗ Σ
ΘΕΣΗΣ ΤΟΥ, ΥΠΑΡΧΕΙ ΠΟΛΥ ΜΙΚ ΡΗ ΠΙΘΑΝΟΤΗΤΑ
ΕΙΣΑΓΓΗΣ ΤΗ Σ ΒΕΛΟΝΑΣ ΣΕ ΤΕΤΟΙΟ ΒΑΘΜΟ
ΣΤΕ ΝΑ ΜΠΟΡΕ Ι ΝΑ ΙΑΤΡΗΣΕΙ ΤΗ ΜΕΜΒΡΑΝΗ
ΠΙΕΣΗΣ / ΡΟΗΣ Ή ΤΑ ΙΑΦΡΑΓΜΑΤΑ ΜΕΤΑΓΓΙΣ ΤΙΚΟΥ
ΕΛΕΓΧΟ Υ. ΘΑ ΠΡΕΠΕΙ ΝΑ ΠΡ ΟΣΕΧΕΤΕ ΣΤΕ ΝΑ ΜΗΝ
ΕΠΙΤΡΕΨΕΤΕ ΤΗ ΙΑΤΡΗΣ Η, ΚΑΘΣ Η ΙΑΤΡΗΣΗ
ΤΗΣ ΜΕΜΒΡΑΝΗΣ Ή ΤΝ ΙΑΦΡΑΓΜ ΑΤΝ ΜΠΟΡΕΙ
ΝΑ ΕΠΗΡΕΑΣΕΙ ΤΑ Χ ΑΡΑΚΤΗΡΙΣΤΙΚΑ ΑΠ ΟΟΣΗΣ
ΤΗΣ ΒΑΛΒΙ ΑΣ ΚΑΙ ΝΑ ΙΑΚΥ ΒΕΥΣΕΙ ΤΟ ΣΥΣΤ ΗΜΑ
ΑΝΑΣΤΟΜΣΗΣ.
Πιέστε το θόλο τη βαλβίδα
Κατεύθυνση έκπλυση
Στόιο εισροή (Είσοδο)
Πιέστε τον αποφρακτήρα
Στόιο εκροή (Έξοδο)
Αντλήστε το θόλο
Στάθη υγρού
Αποστειρωένο ισοτονικό υγρό
10
11
43
Page 46

Έκπλυση της βαλβίδ ας
Η διαδερ ική πίεση του θ όλου τη βαλβ ίδα ε το δάκτ υλο θα εξαναγ κάσει την εξαγω γή ENY από τη βα λβίδα σε αφότ ερη την εγγ ύ και την
περιφερ ική κατεύθυ νση. Για επιλεκ τική έκπλ υση, πιέσ τε και αποφράξτ ε είτε το εγγ ύ είτε το περιφ ερικό τήα του α ποφράκτ η τη βαλβίδα
ε διαδερ ική δακτ υλική πίεση κα ι στη συνέ χεια πιέστε το θ όλο τη βαλβί δα (Εικ. 10). Αυτό θα προ καλέσει τη ρο ή του υγρού προ κ ατεύθυνση
αντί θετη από αυ τήν τη αποφρ αγένη πλ ευρά τη βα λβίδα. Αν διαπ ιστωθεί αισ θητή αντ ίσταση σ τη συπίεσ η του θόλου, ο υπό έκ πλυση
καθετήρα πορεί να είναι αποφραγένο.
ΠΡΟΣΟΧΗ: ΜΠΟΡΕΙ Ν Α ΕΠΕΛΘΕΙ ΑΝΑΣΤΟΜΤ ΙΚΗ ΑΠΟΦΡΑΞΗ ΟΠΟΙΟΥΗΠΟΤΕ ΤΜ ΗΜΑΤΟΣ ΤΟΥ ΣΥΣΤΗΜΑΤΟΣ ΑΝ ΑΣΤΟΜΣΗΣ, Κ ΑΤΙ
ΠΟΥ ΠΡΕΠΕΙ ΝΑ ΙΑΓ ΝΣΤΕΙ ΜΕ ΚΛΙΝΙΚ Α ΕΥΡΗΜΑΤΑ ΚΑΙ ΙΑΓΝΣ ΤΙΚΕΣ ΕΞΕΤΑΣΕΙΣ. ΤΑ ΧΑΡΑΚ ΤΗΡΙΣΤΙΚΑ ΕΚΠΛΥ ΣΗΣ ΤΗΣ ΒΑΛΒΙΑΣ
ΠΙΘΑΝΟΝ ΝΑ ΜΗΝ ΕΙΝΑΙ Ε ΠΑΡΚΗ ΓΙΑ ΙΑΠΙΣΤΣΗ ΑΠ ΟΦΡΑΞΗΣ ΤΝ ΚΑΘΕΤΗΡ Ν. ΕΙΤΕ ΤΗΝ ΕΝΟΤΗΤΑ ΠΡΟΕΙΟΠΟΙ ΗΣΕΝ.
Δοκιμή βατότητας συστήμα τος αναστόμωσης
Βαλβίδα:
α. Τοποθετή στε το συνδ ετήρα εισρ οή τη βαλ βίδα έσα σε απο στειρω ένο ισότονο ο ρό.
β. Πιέστε κα ι
απελευθερώστε
επανειληένα τ ην
κεντρική δεξαενή
τη βαλ βίδα έω ότου
εξέλθε ι υγρό από το
συνδετήρα εκροή.
Αν διαπιστωθεί εκροή
υγρού απ ό το συνδετ ήρα
εκροή κάθ ε φορά που
πιέζε τε την κεντ ρική
δεξαενή, η βαλβίδα
είναι βα τή (Εικ. 11).
ΠΡΟΣΟΧΗ: Η ΥΠΑΡΞ Η
ΣΜΑΤΙΙΑΚΗΣ ΥΛΗΣ ΣΤΟ
ΙΑΛΥΜΑ ΟΚΙΜΗΣ ΜΠΟΡΕΙ ΝΑ
ΕΠΗΡΕΑΣΕΙ ΤΑ ΑΠΟΤΕΛΕΣΜΑΤΑ
ΤΗΣ ΟΚΙΜΗΣ Κ ΑΙ ΤΗΝ
ΑΠΟΟΣΗ ΤΟΥ ΠΡΟΪΟΝΤΟΣ .
ΠΡΟΣΟΧΗ: ΜΗΝ Κ ΑΝΕΤΕ ΑΝΑΡΡΟΦΗΣΗ ΥΓΡ ΟΥ ΜΕΣ ΤΟΥ
ΣΥΣΤΗΜ ΑΤΟΣ ΑΝΑΣΤΟΜΣΗΣ ΑΠΟ ΤΟ ΠΕ ΡΙΦΕΡΙΚΟ ΑΚΡΟ ΤΟΥ
ΚΑΘΕΤΗΡΑ. ΜΠ ΟΡΕΙ ΝΑ ΠΡΟΚΛΗΘΕΙ ΖΗΜ ΙΑ ΣΤΗ ΒΑΛΒΙΑ DELTA
MEDTRONIC NEUROSURGERY.
ΠΡΟΣΟΧΗ: Η ΥΠΕΡΒΟΛ ΙΚΗ ΠΙΕΣΗ ΕΚΠΛΥΣΗΣ ΜΠΟΡΕΙ Ν Α ΠΡΟΚΑΛΕΣΕΙ
ΠΡΟΣΡΙΝΗ ΠΑΡΑΜΟ ΡΦΣΗ ΤΗΣ ΜΕΜΒΡΑΝΗΣ ΤΗΣ ΒΑ ΛΒΙΑΣ ΚΑΙ ΝΑ
ΕΠΙΦΕΡΕΙ ΑΦΥΣΙΚ Α ΧΑΜΗΛΗ ΠΙΕΣΗ / Ρ ΟΗ.
ΠΡΟΣΟΧΗ: ΕΑΝ ΕΙΝ ΑΙ ΑΝΑΓΚΑΙΟΣ Ο ΧΕΙΡΙΣΜ ΟΣ ΤΟΥ ΘΑΛΑΜΟΥ
DELTA, Η ΣΥΣΚΕΥ Η ΠΡΕΠΕΙ ΝΑ ΚΡΑΤΗΘΕΙ ΑΠΟ ΤΑ ΙΑΦΡΑΓΜΑΤΑ ΜΕ
ΓΑΝΤΙΑ ΜΟΝΟ. ΕΝ ΠΡΕΠΕΙ ΝΑ ΕΦ ΑΡΜΟΣΤΕΙ ΠΙΕΣΗ ΣΤΟΝ ΕΞΤΕ ΡΙΚΟ
ΑΚΤ ΥΛΙΟ. Ο ΑΚΑΤΑΛΛΗΛΟΣ ΧΕΙΡΙΣΜ ΟΣ ΤΟΥ ΘΑΛΑΜΟΥ DE LTA
ΜΠΟΡΕΙ ΝΑ ΙΑΚ ΥΒΕΥΣΕΙ ΤΗΝ ΑΚΕΡΑΙΟΤΗ ΤΑ ΤΟΥ ΣΥΣΤΗΜΑΤΟΣ
ΑΝΑΣΤΟΜΣΗΣ.
Καπάκι ανόετρου
(αποσυνδεένο)
Φίλτρο σύριγγα
Σύριγγα
1oz
B-D
30
1/2
3/4
Στρόφιγγα
Μανόετρο
1/4
510152025
0 cm
35
34
33
Σωλήνωση
3
σιλικόνη
2
1
0
-1
(Σωστή
-2
ευθυγράιση
-3
ανόετρου)
O
F
F
Από σύριγγα
1/4
5
10
30 cm
Συνδέστε το προϊόν εδώ
-3
F
F
Κλειστό (Off)
O
Προ βαλβίδα
Καρδιακό / περιτοναϊκό καθετήρα:
Ο καθετ ήρα πρέπει να ε λεγχθε ί για τη βατότ ητά του κατά τη χρ ονική
στιγ ή τη εγχεί ρηση. Ο έλε γχο βατότ ητα συπερ ιλαβάνε ι οπτικό
καθορισ ό του ότι όλα τα σ χισοειδή αν οίγατα επ ιτρέπουν τ η ροή του ΕΝΥ.
1. Εισάγε τε ια αβλεία β ελόνα 17-gauge σ το ανοικτό, ε γγύ άκρο τ ου
καθετ ήρα και εκπλύ νετε ε ικρή π ίεση από σύρι γγα ε τη χρήσ η
αποστειρωένου φυσιολογικού ορού.
2. Παρατηρ ήστε τα σχι σοειδή ανοί γατα κοντά σ το περιφερι κό άκρο.
Όλα τα ανοί γατα πρέπε ι να επιτρέπο υν τη ροή του υγρ ού και να
παρουσ ιάζονται ανο ικτά σε όλο το ήκ ο του.
3. Η απαλή περ ιστροφή τη περιοχή ανο ίγατο σ χισοειδών
εγκοπώ ν του καθετήρ α εταξύ του αν τίχειρα και το υ δείκτη σα , θα
απελε υθερώσει τα σ χισοειδή α νοίγατα εά ν φαίνεται ότ ι δεν έχουν
ανοίξει πλήρω.
4. Οαλύνε τε το τοίχωα το υ καθετήρα ε τον αντίχε ιρα και το δείκτ η
σα έτσι ώ στε τα σχι σοειδή ανοί γατα να είναι σ ε κλειστ ή θέση
ετά τη ν ολοκλήρω ση του ελέγ χου βατότη τα.
οκιή πριν την εφύτευση
Κάθε βαλ βίδα Delta δοκ ιάζεται α τοικά για να διασ φαλιστε ί η
συόρ φωσή τη ε τα χα ρακτηρισ τικά απόδο ση τη ετικ έτα. Μολονό τι
δεν είνα ι εφικτή η επ αλήθευση τω ν δυναικών χαρ ακτηρισ τικών απόδο ση
ια βαλ βίδα ε στα τικό τεστ που να πορεί να πραγ ατοποιηθε ί σε
χειρουρ γείο, ο χειρουργό πορεί, αν ε πιθυεί, να δι απιστώσε ι αν η βαλβίδα
Delta πλ ηροί τι προδ ιαγραφέ Med tronic Neuro surgery πρ ιν από την
εφύτευ ση. Η παρακάτω δ οκιή πριν τη ν εφύτευση πορεί να εκτε λεστεί
στο χειρουργείο.
Από σύριγγα
1/4
5
10
1/4
5
10
F
F
Κλειστό (Off)
-3
-3
O
Προ ανόετρο
F
F
O
Κλειστό (Off)
Από το ανόετρο
Προ βαλβίδα
44
Λουτρό
νερού
σταθερή
στάθη
12
13
14
15
Page 47

ΠΡΟΣΟΧΗ: ΦΡΟΝΤ ΙΣΤΕ ΝΑ ΙΑΤΗΡΕΙΤΕ ΤΗΝ ΑΣΗΨΙΑ Κ ΑΙ ΝΑ ΑΠΟΦΕΥΓΕΤΕ Ο ΠΟΙΑΗΠΟΤΕ ΣΜΑΤΙ ΙΑΚΗ ΜΟΛΥΝΣΗ.
ΣΗΜΕΙΣΗ: Η βαλβίδ α Delta πρέπε ι να δοκιασ τεί όνη τη, χω ρί να είναι συν δεένη στ ου καθετήρ ε του κιτ.
Μέθοδο δοκιή
I. Εξοπλισμός απαιτούμενος για τη δοκιμή
1. εξαενή αποστειρωένου υγρού ή λουτρό αποστειρωένου νερού
2. Έ να αποστει ρωένο αν όετρο νερο ύ 30 cm, διαβαθ ισένο σε εκα τοστά
3. Μ ία τριοδική σ τρόφιγγα (γ ια χρήση ε το α νόετρο)
4. Μ ία αποστει ρωένη σύρ ιγγα, 30 mL
5. Έ να αποστει ρωένο φί λτρο σύριγγα , 5 µm
6. Έ να αποστε ιρωένο αρ σενικό συ νδετήρα (β ύσα) Luer
7. Αποστειρωένη σωλήνωση σιλικόνη
II. Οργάνωση εξοπλισμού
1. Α φαιρέστε το κα πάκι από το αν όετρο. Ρυθ ίστε το αν όετρο, τη σ τρόφιγγα κα ι το λουτρό νερο ύ έτσι ώστε τ ο ηδενικό επ ίπεδο στο
ανόε τρο και η στάθ η υγρού στο λο υτρό νερού να εί ναι στο ίδιο ύψ ο (Εικ. 12). (Στηρίξτε το ανόετρο σ ε ένα στατό ο ρού.)
2. Γείσ τε τη σύριγ γα ε αποσ τειρωένο ν ερό χρησιοπ οιώντα το φί λτρο σύριγ γα 5 µm. (Ότα ν επαναπληρ ώνετε τη σύ ριγγα,
χρησιο ποιείτε πάν τα φίλτρο σύρι γγα των 5 m). Με τά την πλήρωσ η τη σύριγ γα, αποσυ νδέστε το φί λτρο τη σύριγ γα.
3. Συνδέστ ε τη σύριγ γα, το ανόε τρο και τη σωλήν ωση σιλικόν η όπω φαίνε ται στην εικό να 12.
4. Για να εκκενώσε τε όλο τον αέρα α πό τη συναρο λογηένη συ σκευή δοκι ή αποστείρ ωση, γυρί στε τη στρ όφιγγα όπω φαίνεται σ την
εικόνα 13.
5. Βυθίστ ε τη σωλήνωση α πό σιλικόνη έσα στο λουτρ ό αποστειρ ωένου νερ ού και εκπλύνε τε ε αποσ τειρωένο ν ερό από τη σύρι γγα.
III. Βαθμονόμηση εξοπλισμού
1. Γυρίστε τη σ τρόφιγγα ό πω φαίνετα ι στην εικόνα 14 και γ είστε το α νόετρο ε νε ρό (H2O) έω τουλάχ ιστον τη σ τάθη των 5 cm.
2. Μ ε τη σωλήνωσ η από σιλικόνη β υθισένη σ το λουτρό νερ ού, γυρίστε τ η στρόφιγ γα για να αποο νώσετε τη σ ύριγγα από τ ο ανόετρο
(Εικ . 15).
3. Αφήστε τη σ τάθη στ ήλη νερού σ το ανόετρ ο να κατέβει.
4. Η στήλη τ ου νερού θα πρέ πει να σταα τήσει στο ε πίπεδο ηδέν τ ου ανόετρ ου, όπω φαίνε ται στην εικό να 12. Εάν όχι, ανυψ ώστε ή
χαηλώσ τε ανάλογ α το ανόετρ ο.
5. Το ανόετρ ο είναι τώρα βα θονοηέ νο στο ηδεν ικό επίπεδο το υ λουτρού νερο ύ. Στηρίξτε ή προσα ρόστε το α νόετρο για ν α
διατη ρείτε τη σχέσ η αναφορά ε τ ο λουτρό νερού.
IV. Διαδικασία δοκιμής
ΣΗΜΕΙΣΗ: Κατά τη διά ρκεια τη δοκι ή η βαλβίδα πρ έπει να είναι βυ θισένη σ το αποστε ιρωένο λου τρό νερού. Για σωστ ά αποτελέσ ατα,
το ηδεν ικό επίπεδο το υ ανόετρο υ πρέπει να είνα ι σωστά ευθ υγραισέ νο ε τη στάθ η υγρών στο λ ουτρό νερού.
1. Σ υνδέστε τη ν αποστειρ ωένη βαλ βίδα προ δοκι ή ε τη συναρ ολογηένη α ποστειρω ένη συσκε υή δοκιή.
2. Γυρίσ τε τη στρό φιγγα όπω φ αίνεται σ την εικόνα 14 και γεί στε το ανό ετρο ε νερό (H2O) έω τουλάχ ιστον τη σ τάθη των 30 cm.
3. Γυρίσ τε τη στρό φιγγα για να α ποονώσετ ε το ανόετρ ο από τη δίοδο τ η ροή όπω φαί νεται στη ν εικόνα 13.
4. Ε κκενώστ ε όλο τον αέρα από τ η βαλβίδα και τ η συναρολογ ηένη συσ κευή δοκιή ξ επλένον τα απαλά ε απ οστειρω ένο νερό από
τη σύριγγα.
5. Ξ εκινήστ ε σιγά-σιγ ά τη ροή από τη βα λβίδα ε αποσ τειρωέ νο νερό από τη σ ύριγγα.
6. Β υθίστε τη ν αποστειρ ωένη βαλ βίδα στο αποσ τειρωέ νο λουτρό νερο ύ. Ο συνδετήρ α εκροή τη β αλβίδα πρέ πει να είναι κάτω α πό
το νερό για ν α εξασφαλίσε τε σωστά απ οτελέσα τα δοκιή.
7. Κ αθώ διατηρ είτε οαλά τ η ροή έσω τη βα λβίδα, γυρ ίστε τη στ ρόφιγγα γι α να αποονώσε τε τη σύριγ γα από την οδ ό ροή όπω
φαίνε ται στην εικό να 15. Μετά την τοποθ έτηση τη σ τρόφιγγ α στη σωσ τή θέση, η στ άθη τη στ ήλη νερού σ το ανόετρ ο θα
πρέπει ν α αρχίσει να κατε βαίνει. Η σύρι γγα έχει τώρ α αποονωθε ί από τη βαλβίδ α και η συνέχισ η τη ροή ε τη σ ύριγγα δε ν είναι πια
απαραί τητη. Αν η στάθ η νερού δεν κα τέβει, επα ναλάβετε τ α βήατα 2 έχρ ι 7.
ΣΗΜΕΙΣΗ: Αφήστε τ η στάθη νερ ού στο ανό ετρο να κατέβ ει για διάστ ηα 2 έω 2 ½ λεπτ ά. ιαβάστ ε την πίεση που πρ οκύπτει α πό το
ανό ετρο.
Αποτελέσμα τα δοκιμής – Δοκιμή πριν την εμφύτ ευση
Η ένδειξ η πίεση που λα βάνεται απ ’ αυτή τη έθ οδο πορεί να σ υγκριθεί ε τ α εξή χαρακτ ηριστικά:
Επίπεδο απόδοση βαλβίδα Απο δεκτέ κλίακε πίεση
Επίπεδο 1 1 έω 60 mm H2O σε 0 HP
Επίπεδο 1,5 35 έω 95 mm H2O στα 0 HP
Επίπεδο 2 70 έω 130 mm H2O στα 0 HP
Τρόπο ιάθεση
Τα κιτ αναστόωση Delta Medtronic Neurosurgery είναι συσκευασένα ΑΠΟΣΤΕΙΡΜΕΝΑ και ΜΗ ΠΥΡΕΤΟΓΟΝΑ και προορίζο νται για ία
(ια φορ ά) χρήση όνο. ΜΗΝ ΕΠΑΝΑΠΟΣΤΕΙΡΝΕΤΕ.
Το εσώκλει στο προϊόν εί ναι σχεδιασ ένο για χρήση σ ε ένα όνο ασθε νή. Μην επαν αχρησιοπο ιείτε, επαν επεξεργάζε στεa ή επαν αποστειρ ώνετε
αυτό το πρ οϊόν. Η εκ νέου χρήση, ε πεξεργασία ή α ποστείρω ση πορεί να θέσ ει σε κίνδυνο τ η δοική ακερ αιότητα τη σ υσκευή ή/και
να δηιου ργήσει κίνδυ νο όλυνση τη συσκευή που θ α πορούσε να ο δηγήσει σε τραυ ατισό, ασθ ένεια ή θάνα το του ασθενο ύ. Μη
χρησιο ποιείτε το προ ϊόν εάν η συσκευ ασία έχει προη γουένω α νοιχτεί ή έχ ει υποστεί ζ ηιά. Η Medtr onic Neurosur gery δεν εί ναι υπεύθυν η
για την απόδοση οποιουδήποτε προϊόντο το οποίο έχει επαναποστειρωθεί.
Μια πλήρη αναστόω ση απαιτεί έ να κοιλιακό καθε τήρα, ια β αλβίδα Delt a Medtronic N eurosurger y και ένα καρδι ακό / περιτοναϊ κό
καθετήρα, ή ένα περιτοναϊκό καθετήρα.
45
Page 48

Προϊόντα ειδική παρα γγελία
Αν αυτέ οι « Οδηγίε χρήση » συνοδεύ ουν ένα προϊόν ε ιδική παραγ γελία, θ α υπάρχουν πιθα νώ διαφορέ σ τα φυσικά χαρα κτηρισ τικά
ανάεσ α στο εσώκλ ειστο προϊόν κ αι στην περι γραφή του προϊόν το σε αυτό το έ νθετο του πρ οϊόντο. Ο ι διαφορέ αυτέ δεν θα επηρε άσουν
την ασφά λεια ή την απο τελεσατ ικότητα του πρ οϊόντο ειδι κή παραγγ ελία.
Τα προϊόντα ε ιδική παραγ γελία πο ρεί να διατίθ ενται αποσ τειρωέ να ή η αποστε ιρωένα, όπ ω αναγράφε ται στην ε τικέτα του
συσκευ ασένου πρ οϊόντο. Τα η απο στειρωέ να προϊόντ α πρέπει να καθαρ ίζονται και να α ποστειρών ονται πριν α πό τη χρήση.
Αντενδείξει
Η παροχέτ ευση του ΕΝΥ ε α ναστόωσ η στο δεξιό κόλ πο, στην περι τοναϊκή κοι λότητα ή σε άλ λα σηεία του σ ώατο αν τενδείκν υται
αν υπάρχε ι κάποια λοίωξ η σε οποιοδήποτ ε σηείο στο ο ποίο θα εφυτευ θούν τα διάφο ρα εξαρτήατ α του συστή ατο ανασ τόωση.
Στα σηεία αυ τά περιλαβ άνονται ο λύνσει του τρι χωτού τη κεφα λή και άλλων π εριοχών του δέρ ατο τι οποί ε θα διαπεράσ ει το
σύστ ηα αναστ όωση, καθώ και λοιώξει των ηνίγγω ν και των κοιλιών τ ου εγκεφάλο υ, του περιτονα ίου και των ενδοπ εριτοναϊκών κ αι
οπισθο περιτοναϊκώ ν οργάνων, του υπεζ ωκότα και του κυκ λοφορικού. Αν τενδείκ νυται εν γέν ει η αναστό ωση του ΕΝΥ αν υπ άρχει όλυνση
σε οποιοδ ήποτε σηείο το υ σώατο. Αν τενδείκ νυται επίσ η η δηιουργία α ναστόωσ η προ τον κόλπ ο τη καρδιά σε ασ θενεί ε συ γγενή
καρδιοπάθεια ή άλλε σοβαρέ καρδιοπνευονικέ ανωαλίε.
Ενηέρωση του ασθενού
Αποτε λεί ευθύνη του ι ατρού να ενη ερώσει τον ασ θενή ή/και του εκπροσώπο υ του σχετ ικά ε την παροχέ τευση του ΕΝΥ ε αναστόω ση.
Αυτή η εν ηέρωση πρ έπει να περιλ αβάνει την πε ριγραφή των ε πιπλοκών που σ υσχετίζο νται ε τα εφυ τεύσια συσ τήατα αν αστόωση ,
καθώ και την επεξήγηση των πιθανών εναλλακτικών προϊόντων και θεραπειών.
Προειδοποιήσει και προφυλάξει
Πρέπει ν α επιλέγε ται το κατάλ ληλο προϊόν, το κα τάλληλο έγεθο, η κα τάλληλη π ίεση ή το κατάλ ληλο εύρο απόδοση αν άλογα ε τι ειδ ικέ
ανάγκ ε του ασθενού , βάσει των δι αγνωστ ικών δοκιών κα ι τη πείρα του ια τρού. Η ετικέ τα του προϊόν το αναγράφ ει τα επίπεδα ή τ ι
κλίακε απόδοση του προϊόντο.
Τα εφυτεύσ ια προϊόντ α δεν πρέπει να έ ρχονται σε επα φή ε χνουδω τό ύφασα, τα λκ γαντιών, κα τάλοιπα λίπο υ από το δέρα, ε λαιώδη
σαπούν ια, συνθετ ικά απορρυπα ντικά ή άλ λε ολυσατ ικέ ουσίε επ ιφανειών. Χνούδ ι, δακτυλικ ά αποτυπώα τα, ταλκ, ά λλε επιφα νειακέ
ολυσα τικέ ουσίε ή κ ατάλοιπα απ ό γάντια λα τέξ πορούν να πρ οκαλέσουν σ τον ασθεν ή αντίδρασ η σε ξένο σώα ή α λλεργικέ αντιδράσ ει.
Θα πρέπε ι να προσέξετ ε ιδιαίτερα ώσ τε να ην εισαχ θούν σωα τίδια έσα στ α εξαρτήατα τ ου συστή ατο ανασ τόωση κατά τ ι προεφυτευ τικέ δοκι έ και του χειρισ ού. Η εισαγ ωγή ολυσα τικών ουσιών πορεί να προκαλ έσει ελατ τωατικ ή απόδοση (υπερ - ή
υποπαροχ έτευση) του σ υστήα το αναστό ωση. Σωα τίδια που πορ εί να παρεισφρή σουν στο σύσ τηα ανασ τόωση πι θανόν να κρα τήσουν
ανοικ τού του ηχα νισού πίε ση / ελέγ χου ροή και να επι φέρουν έτσ ι υπερβολική πα ροχέτευση .
Κατά τη δι ασφάλιση τω ν καθετήρω ν στoυ συνδ ετήρε, οι κ υκλωτικέ απολινώσει θ α πρέπει να είνα ι στέρεε, α λλά όχι πολύ σ φικτέ, ώσ τε να
ην κόψουν τ ο σωλήνα από σι λικόνη.
Θα πρέπε ι να δοθεί ιδιαί τερη προσοχή σ τη δροολό γηση των καθετ ήρων, ώστε να α ποφευχθεί η σ τρέβλωση κα ι η άσκοπη τριβή καθ ’ όλο
το ήκο του . Το χείλο τη οπ ή τρυπανισ ού πορεί να ψα λιδιστεί για τ η δηιουργία ια λοξή εγκο πή στο σηε ίο όπου ο κοιλια κό
καθετ ήρα εξέρχετα ι και καπυλώνε ται κοντά στ ο κρανίο.
Ασθενε ί στου οποί ου εφυτεύτ ηκαν συστ ήατα ανασ τόωση γι α υδροκεφαλί α, θα πρέπει να ε πιτηρούν ται στενά κ ατά τη ετε γχειρητικ ή
περίοδ ο για τη διαπίσ τωση σηεί ων και συπτ ωάτων τα οποί α υποδεικνύ ουν κάποια δυσ λειτουργία το υ συστήα το. Τα κλινι κά ευρήατα
πορεί να υ ποδεικνύ ουν κάποια δυσλ ειτουργία το υ συστήα το αναστ όωση. Τα κλι νικά ευρήατα πορεί να υποδε ικνύουν ό λυνση του
συστ ήατο ανα στόωση , υπο- ή υπερπα ροχέτευση τ ου ΕΝΥ.
Μπορεί να πρ οκληθεί απ όφραξη τη αν αστόωσ η σε οποιοδήποτ ε από τα εξαρτή ατα του συστ ήατο ανα στόωση . Το σύστηα πορεί να
αποφρα χθεί εσωτερ ικά από συντρ ίατα ιστ ού, θρόβου αί ατο, συσ σώρευση ογκο κυττάρω ν, αποικίε βακ τηρίων ή άλ λα συντρί ατα.
Οι καθετ ήρε που έρχον ται σε επαφή ε εσ ωτερικέ δοέ του σώατο πορεί να στρε βλωθούν ή να συ ναντήσο υν επόδια σ τα άκρα του
(π.χ. περιτύλι ξη του άκρου ε νό κοιλιακού κα θετήρα έσ α στο χοριοει δέ πλέγα ή το υ άκρου ενό πε ριφερικού καθ ετήρα έσα σ το είζον
επίπλ ουν ή στι εν τερικέ έλ ικε). Τέλο, πορ εί να προκλη θεί απόφραξη το υ συστήα το αναστ όωση λόγω τ η φυσιολογικ ή ανάπτυ ξη
ενό νεο γνού ή παιδιού ή λ όγω σωατικώ ν ασκήσεων οι οπ οίε προκαλού ν την αποσύν δεση των εξαρτ ηάτων του συ στήατο ή την απόσυρ ση
του περιφερικού καθετήρα από το σηείο παροχέτευση στο οποίο έχει τοποθετηθεί.
Θρόβο ι αίατο γύρ ω από το τήα εν ό καθετήρ α το οποίο εισέρχε ται στον κόλ πο τη καρδιά π ορεί να προκαλ έσουν εβολή τ ου
πνευ ονικού αρτηρ ιακού δένδρο υ, κάτι που πορεί ν α επιφέρει π νευονική κα ρδιά και πνευ ονική υπέρτ αση.
Αποσυ νδεδεένα εξα ρτήατα του σ υστήα το αναστό ωση πορε ί να ετανασ τεύσουν έσ α στην καρδιά ή έσα στην περ ιτοναϊκή
κοιλότητα.
Τα συστή ατα ανασ τόωση ενδ έχεται να ασ τοχήσουν λόγ ω ηχανική δυ σλειτουργί α, προκαλών τα υπο- ή υπε ρπαροχέτευ ση.
Οι καθετ ήρε «ικρο ύ» εγέθου έχουν λεπ τότερα τοιχώ ατα και ικρό τερη εν γένει α ντοχή συγ κρινόεν οι ε του καθετ ήρε «κανονι κού»
εγέθου.
Οι περιτ οναϊκοί καθετ ήρε «ικρο ύ» εγέθου έχει αναφερθ εί ότι παρουσ ιάζουν υψηλότ ερη συχνότ ητα θραύση σ ε σύγκριση ε του
περιτοναϊκού καθετήρε «τυπικού» εγέθου. Γιατροί οι οποίοι εφυτεύουν περιτοναϊκού καθετήρε «ικρού» εγέθου για οποιοδήποτε
λόγο (π.χ. αισθη τικό) θα πρέπει να ε κτιήσου ν τα οφέλη ένα ντι τη εν δεχοένω εγαλύτε ρη πιθανότ ητα επανα ληπτική ε γχείρηση γ ια
αντικατάσταση του περιτοναϊκού καθετ ήρα.
Η δυσλει τουργία ή η απόφρ αξη του συστ ήατο ανα στόωση πορεί να προκα λέσει σηεία κα ι συπτώ ατα αυξηέ νη ενδοκρα νιακή
πίεση , αν δεν αντ ισταθισ τεί η υδροκεφ αλία. Στο νεογν ό, τα συνήθη συ πτώατα εί ναι: αυξηέ νη τάση τη πρό σθια πηγή , συφόρηση τ ων
φλεβών το υ τριχωτού τη κε φαλή, ατο νία, υπνηλ ία και ευερεθισ τότητα, ε ετό και αυχε νική ακαψία. Σ ε εγαλύτ ερα παιδιά και ε νήλικε, τα
συνήθη σ υπτώα τα είναι: πονο κέφαλο, ε ετό, θάβ ο όραση, α πώλεια νήη , αυχενική α καψία, απώλε ια συνείδηση κα ι διάφορα η
φυσιολογικά νευρολογικά ευρήατα.
Η υπερπαρ οχέτευση το υ ENY πορεί να προ διαθέσει τον ασ θενή σε ανά πτυξη υπο σκληριδίο υ αιατώα το ή υγρώατ ο ή σε σύπτ ωση των
τοιχωά των τη πλάγ ια κοιλία, πρ οκαλώντα α πόφραξη του κοι λιακού καθε τήρα.
Αν ο κοιλια κό καθετήρ α κολλήσει σ το χοριοειδέ π λέγα ή σε παρα κείενο εγ κεφαλικό ισ τό λόγω συφύσ εων ινώδου ισ τού, δεν θα
πρέπει ν α αφαιρεθεί βία ια. Συνιστά ται η απαλή περισ τροφή του καθε τήρα, κάτι π ου πορεί να βοη θήσει στην α πελευθέρ ωσή του. Σα
συβου λεύουε να αφήσ ετε τον καθε τήρα στη θέ ση του παρά να δια κινδυνεύσε τε ενδοκοι λιακή αιορρ αγία την οποί α θα πορούσε να
προκαλ έσει η βίαιη αφαί ρεσή του.
46
Page 49

Τα υποδόρια ε ξαρτήατα πε ράσατο κα θετήρων π ορούν να σπάσ ουν στα ση εία συγκόλλ ηση ή συναρο λόγηση των εξα ρτηάτων ή λό γω
υπερβολ ική παραόρ φωση του εύπ λαστου άξονα -κορού. Η απότο η θραύση πο ρεί να προκαλέ σει τραυατ ισό ιστών ή ορ γάνων και
ζηιά σ το σύστη α αναστό ωση. Τα εργαλε ία πρέπει να επ ιθεωρούντ αι πριν από τη χρ ήση του για να εξα κριβώνετα ι η ακεραιότη τα και η
λειτουργικότητά του. Τα εργαλεία ία χρήση δεν πρέπει να επαναχρησιοποιούνται ποτέ, διαφορετικά υπάρχει ενδεχόε νο τραυατισού
του ασθε νού ή του ιατρ ού.
Επιπλοκέ
Οι επιπ λοκέ που συσ χετίζοντα ι ε τα κοιλιοκολ πικά και τα κοιλι οπεριτοναϊ κά συστήα τα αναστό ωση για την πα ροχέτευση τ ου ΕΝΥ πορεί
να είναι πα ρόοιε ε εκεί νε που εφανίζ ονται σε κάθε χει ρουργική επ έβαση ε τοπι κή ή/και γενικ ή αναισθησ ία. Αυτέ οι επι πλοκέ
περιλα βάνουν αν τιδράσει σ τα φάρακα και σ του αναισ θητικού παρ άγοντε, α νισορροπία τ ων ηλεκτρο λυτών και υπερβ ολική απώλει α
αίατο , ιδιαίτερ α σε νεογνά. Ένα ασθενή σπ άνια θα εφαν ίσει αντίδρ αση που οφεί λεται σε ευαι σθησία στο ε φύτευα.
Η χρήση η φι λτραρισέ νων ή η ελεγ χόενων υγρ ών για τη δοκι ή πριν την εφύ τευση πορεί ν α επιφέρει τ ην ακατάλλ ηλη απόδοσ η τη
βαλβίδ α και να καθιστ ά αναγκαία τη ν αναθεώρηση τ η βαλβίδα . Οι συσκευέ πρ έπει να χρησι οποιούντα ι όνο σε ελε γχόενα πε ριβάλλον τα
σε νοσοκο εία, για την απ οτροπή εισα γωγή σωατ ιδίων, ινών, ή άλλων ολυσατικ ών ουσιών εν τό τη βαλβ ίδα.
Μη χρησι οποιείτε αιχ ηρά εργαλ εία όταν χειρίζ εστε αυτέ τι συσκευέ, γι ατί τα αιχηρ ά εργαλεία πορεί να χαράξου ν ή να κόψουν την
ελασ τοερή σιλι κόνη, πράγα π ου θα προκαλέσ ει διαρροή και ω ε κ τούτου θα απα ιτηθεί αναθ εώρηση τη βα λβίδα. Θα πρέ πει να προσέξε τε
ιδιαίτε ρα όταν κλε ίνετε τι το έ για να εξασφαλ ίσετε ότι οι β αλβίδε δεν έ χουν κοπεί ή τσακ ιστεί από τι β ελόνε ρα άτων.
Σε όλε τι ε πεβάσει α ναστόωσ η ΕΝΥ, οι πιο κοινέ επι πλοκέ οφείλ ονται στ ην απόφραξη του σ υστήα το όπω περι γράφεται σ το
τήα «Πρ οειδοποιήσ ει και Προφυλάξε ι» στο παρό ν ένθετο συ σκευασία. Μ πορεί να εφαν ιστεί απόφ ραξη σε οποιοδή ποτε εξάρτηα τ ου
συστ ήατο λόγω α πόφραξη από ε γκεφαλικού ιστού, θ ρόβου αία το ή και συσσω ρευένα κύ τταρα όγκου σ ε κάποιο σηεί ο καθ’ όλο του
το ήκο. Μπ ορεί επίση ν α εφανιστ εί απόφραξη απ ό διαχωρισό τ ων εξαρτηάτ ων του συστ ήατο ή λόγω σ υστροφή ή και σ υσπείρωσ η
του καθε τήρα. Κάτι τέ τοιο πορεί ν α προδιαθέσει ετανάστ ευση του κοιλ ιακού καθετή ρα έσα στη ν πλάγια κοιλ ία και του περιφερ ικού
καθετ ήρα έσα στη ν καρδιά και στο π νευονικό αρ τηριακό δέν δρο, το περιτόνα ιο ή κάποια άλ λη δοή στη ν οποία έχει εφυ τευθεί ο
καθετ ήρα. Η ανάπ τυξη του νεογ νού ή του παιδιο ύ πορεί να προκα λέσει την από σπαση του περ ιφερικού καθε τήρα από τον κό λπο και να τον
οδηγήσε ι στην εσωτε ρική σφαγί τιδα φλέβα ή απ ό το περιτόναιο σ ε επίπεδα του ι στού όπου το υγ ρό δεν πορεί ν α απορροφηθεί .
Εκτό α πό του τύπου απόφραξη τη αναστόω ση που περιγρ άφονται παρ απάνω, υπάρχο υν και άλλε π ιθανέ σοβαρ έ επιπλοκέ .
Τοπικέ και συ στηατι κέ ολύνσει εί ναι συνήθει κατά τι διαδικα σίε αναστό ωση. Οι ολ ύνσει οφεί λονται συνή θω σε οργανι σού
που υπάρχο υν στο δέρα , ιδιαίτερα σ τον σταφυλόκοκκο της επιδερμίδας. στόσο, άλλα π αθογόνα που κυ κλοφορού ν στο αία πο ρούν να
εγκατα σταθούν σ την ανασ τόωση και, σ την πλειονό τητα των ασθε νών, θα χρειασ τεί να αφαιρεθ εί.
Το 1973, ο Robert son και οι συνερ γάτε του συνό ψισαν τη συχ νότητα εφ άνιση λοί ωξη σε κοιλιο κολπικά και κοιλ ιοπεριτονα ϊκά συστή ατα
ανασ τόωση, σύ φωνα ε τι έω τ ότε σχετικ έ αναφορέ. Η σ υχνότητ α εφάνιση λο ίωξη σε κοιλ ιοκολπικά συ στήατα α ναστόωσ η
κυαιν όταν εταξύ 7 % και 31%. Λοίωξη σε κοι λιοπεριτον αϊκά συστή ατα αναστ όωση εφα νίστηκε σε π οσοστό 5% έω 10 % των ασθενών
στι πε ρισσότερε α ναφορέ. Επε ιδή οι κοιλιοκολ πικέ ανασ τοώσει προ διαθέτουν σ τη διασπο ρά των βακτ ηρίων σε άλλ α όργανα, οι
κοιλιοπεριτοναϊκέ αναστοώσει θεωρούνται ω λιγότερο καταστρεπτικέ.
Πρόσφα τα (1993), ο Kestle και οι συνε ργάτε του ανέ φεραν σηα ντική είω ση των ολύνσε ων (λιγότερ ο από 4%) ε τη χρήση α ντιβιοτι κών, τη
είωση τ ου χρόνου των χει ρουργικών επ εβάσεων (χε ιρουργική πε ίρα) και τον έλε γχο του περιβ άλλοντ ο στο χειρου ργείο (π.χ. καθορισ ένο
χώρο χει ρουργείου, περι ορισένο αριθό και ε τακίνηση πρ οσωπικού, καλ υένε επι φάνειε δέρα το). Το άρθρο αναφ έρει ότι πορ ούν
να επιτ ευχθούν καλ ά αποτελέσ ατα και χωρί τη χ ρήση αντι βιοτικών, αλλ ά ε αυστηρ ό προεγχει ρητικό έλε γχο του περιβά λλοντο στο
χειρουργείο.
Η χρήση πρ οφυλακτικ ή αντιβίω ση σε ασθεν εί ε αναστό ωση είναι κά πω αφιλε γόενη, καθ ώ η χρήση τη πρ οδιαθέτει σ τη όλυνσ η από
πιο ανθε κτικού ορ γανισού. Σ υνεπώ, η απ όφαση για τη χο ρήγηση προφυλ ακτική α ντιβίωση εναπόκειτα ι στο θεράπο ντα ιατρό ή/κα ι το
χειρουργό.
Η υπερπαρ οχέτευση ΕΝ Υ πορεί να προκα λέσει υπέρε τρη είωση πί εση ΕΝΥ, η οποία θα προ διαθέσει στ ην ανάπτυ ξη υποσκλ ηρίδιου
αιατώ ατο ή υγρώ ατο, καθώ και στην υπέρ ετρη είωσ η του κοιλιακού εγέθου πο υ επιφέρει τη ν απόφραξη λόγ ω πρόσκρουσ η
των πλευ ρικών κοιλιακώ ν τοιχωάτων ε πί των οπών εισρ οή στον καθε τήρα. Στο νεογ νό, η υπέρετρη είωση πίεση θα προκαλέσε ι
σηαν τική κατασ τολή τη πρό σθια πηγή , υπερκάλυψη τω ν κρανιακών ο στών και πορ εί να ετατρέ ψει την επικοι νωνούσα υδρο κεφαλία σε
παρακωλυτική.
Έχει αναφε ρθεί εφάνι ση επιληψί α ετά από επέ βαση για κοι λιακή ανασ τόωση. Αυτ ή η ελέτη έ δειξε επίση ότι η συχνότ ητα εφάνισ η
επιλ ηπτικών παρ οξυσών αυξ ήθηκε ε τι πολ λαπλέ αναθ εωρήσει του καθ ετήρα.
Η ανασ τόωση έσα σ το περιτόνα ιο πορεί να απο τύχει λόγω επ λοκή του καθε τήρα στι ε ντερικέ έ λικε ή στο είζ ον επίπλου ν. Έχει γίνει
περιγρ αφή διάτρηση το υ εντέρου α πό τον περιτον αϊκό καθετήρ α ε επακόλουθ η ανάπτυ ξη περιτονί τιδα.
Επιπλοκέ για εργαλεία
Οι επιπ λοκέ που συσ χετίζοντα ι άεσα ε τη χρήσ η υποδερικώ ν εξαρτηάτ ων εισαγωγή κ αθετήρων πε ριλαβάν ουν τη δυσκολί α διέλευσ η
του εργαλείου έσα από ουλοποιηένε περιοχέ και τον πιθανό σχηατισό αιατωάτων.
Πολιτική επιστροφή προϊόντων
Για να γίνουν δεκ τά τα προϊόν τα που επιστ ρέφονται για α ντικατάσ ταση ή παροχ ή πίστωση , θα πρέπει να εί ναι κλεισ τή η συσκευα σία του και
να ην έχου ν ανοιχτεί ο ι σφραγίδε το υ κατασκευασ τή, εκτό αν η επιστρ οφή οφείλε ται σε παράπον ο του πελάτ η για κάποιο ελά ττωα ή για
εσφαλ ένη ετικέ τα. Ο καθορισ ό ελατ τώατο εν ό προϊόντο ή λανθασέ νη επισή ανση θα γίνει τ ελικά και αε τάκλητα απ ό τη Medtroni c
Neurosu rgery. Προϊόν τα τα οποία παρέ ειναν στ ην κατοχή του πε λάτη για διά στηα ε γαλύτερο τω ν 90 ηερών δε ν θα γίνονται α ποδεκτά
προ αν τικατάστ αση ή παροχή πίσ τωση.
Εγγύηση
A. Τυπική Π εριορισένη Ε γγύηση. Η Med tronic Neuro surgery ε γγυάται σ τον αρχικό τε λικό αγορασ τή (εφεξή «ο Αγορα στή») ότι το
εσώκλ ειστο, ία χρή ση εφυτεύσ ιο προϊόν (εφεξή « το Προϊόν») που α γοράζει ο Αγορ αστή, κα τά τη στιγ ή τη παράδοσή του στον
Αγορασ τή, δεν θα παρ ουσιάζει απο λύτω κανέν α ελάττω α υλικών και εργα σία. Η Medtro nic Neurosur gery δεν πα ρέχει εγγ υήσει (ρητέ ,
υπονοού ενε, ή θεσ οθετηέ νε) για Προϊόν τα που τροποποι ήθηκαν (ε εξαί ρεση τα ρητώ προ βλεπόε να στο παρόν) ή υπο βλήθηκαν σε
ασυνήθ ιστη κατα πόνηση, κακή χ ρήση, ακατά λληλο χειρι σό, αέλει α, ακατάλλ ηλε δοκιέ , χρήση σε συνδ υασό ε προϊό ντα ή εξαρτή ατα
διαφορε τικά από εκεί να για τα οποία σχ εδιάστηκα ν τα Προϊόντα ή χρ ήση ε οποιονδή ποτε τρόπο ή ιατρ ική διαδικασί α για την οποία τα
Προϊόντα δεν ενδείκ νυνται.
47
Page 50

B. Αποζη ίωση. Η αποκλ ειστική α ποζηίωση τ ου Αγοραστή κ αι η όνη ευθύνη τ η Medtron ic Neurosurg ery για αθέτ ηση τη παρα πάνω
εγγ ύηση θα είναι , κατά την απόλυ τη κρίση και ε πιλογή τη Me dtronic Neu rosurger y, η αντικατάσ ταση του Προϊό ντο ή η πίσ τωση του
λογαρια σού του Αγορασ τή ε το καθαρ ό ποσό που πράγ ατι καταβλ ήθηκε για το εν λόγ ω Προϊόν, ε την προϋ πόθεση ότι (α) η Med tronic
Neurosu rgery θα ειδ οποιηθεί γραπ τώ εντ ό ενενήν τα (90) ηερών ε τά την παραλα βή του Προϊόντ ο από τον Αγορασ τή ότι το εν λ όγω Προϊόν
δεν αν ταποκρίθη κε, καθώ και λε πτοερή εξή γηση στα αγ γλικά σχετ ικά ε την όποια υ ποτιθέεν η η ανταπόκ ριση, (β) το εν λόγ ω Προϊόν
θα επισ τραφεί στ η Medtronic N eurosurger y εντό ε νενήντα (90) η ερών ετά τ ην παραλαβή το υ Προϊόντο α πό τον Αγοραστ ή, F.O.B. (Free
on Board ), στη διεύθυ νση: 125 Cremona D rive, Goleta , Californi a 93117, U.S.A. ή όπω αλ λιώ καθορί σει η Medtron ic Neurosurg ery, και (γ)
η Medtro nic Neurosur gery θα λάβε ι εύλογε και ικανο ποιητικέ απο δείξει ότι οι υ ποτιθέε νε ατέλειε π ράγατι υπ άρχουν. Με εξαίρεσ η τα
ρητώ προ βλεπόεν α στην παρού σα παράγραφ ο, ο Αγοραστή δ εν θα έχει δικαί ωα να επισ τρέψει Προϊόν τα στη Med tronic Neuro surgery
χωρί την προηγούενη έγγραφη συγκατάθεση τη Medtronic Neurosurgery.
Γ. Εξαίρεση άλ λων εγγυήσεω ν. ΕΚΤΟΣ ΑΠΟ ΤΗΝ ΠΕΡΙΟΡΙΣΜΕΝΗ ΕΓ ΓΥΗΣΗ ΠΟΥ ΟΡΙΖΕΤΑΙ ΣΤΟ ΤΜ ΗΜΑ (Α) ΠΑΡΑΠΑΝ, Η MEDTRON IC
NEUROSURGER Y ΕΝ ΠΑΡΕΧΕΙ ΚΑΜ ΙΑ ΑΛΛΗ ΕΓΓΥ ΗΣΗ Ή ΣΥΝΘΗΚΗ, ΡΗΤΗ Ή ΥΠΟΝΟ ΟΥΜΕΝΗ, Ο Ε ΚΑΤΑΣΚΕΥΑΣΤ ΗΣ ΑΡΝΕΙΤΑΙ
ΚΑΤΗΓΟΡΗΜΑΤΙΚ Α ΤΙΣ ΥΠΟΝΟΟΥΜΕΝΕ Σ ΕΓΓΥΗΣΕΙΣ ΚΑΙ Σ ΥΝΘΗΚΕΣ ΕΜΠΟΡΕΥ ΣΙΜΟΤΗΤΑΣ ΚΑΙ ΚΑΤΑΛ ΛΗΛΟΤΗΤΑΣ ΓΙΑ ΚΑΠΟ ΙΟ
ΣΥΓΚΕΚΡΙΜΕΝΟ ΣΚΟΠΟ. Η MEDTRONIC NEUROSURGERY ΕΝ ΑΝΑΛΑ ΜΒΑΝΕΙ ΚΑΙ ΟΥΤΕ ΕΞΟΥΣΙΟΟΤΕΙ ΟΠΟΙΟΗΠΟΤΕ ΑΛΛΟ
ΠΡΟΣΠΟ ΝΑ ΑΝΑ ΛΑΒΕΙ ΟΠΟΙΕΣΗ ΠΟΤΕ ΑΛΛΕΣ ΕΥ ΘΥΝΕΣ ΠΟΥ ΑΠΟΡΡΕΟΥΝ Ή ΠΡ ΟΚΥΠΤΟΥΝ ΣΕ ΣΧ ΕΣΗ ΜΕ ΤΗΝ ΠΛΗΣΗ Ή ΤΗ
ΧΡΗΣΗ ΟΠΟΙΟΥΗΠΟΤΕ ΠΡΟΪΟΝΤΟΣ.
48
Page 51

Delta söntkészlet
14
12
10
52030
40 50
14
12
10
52030
140
40 50
Leírás
Minden Medtronic Neurosurgery Delta szelep egy normál állapotban zárt szifonvezérlő szerkezettel összekapcsolt membrán nyomásszelepet
tart almaz. Ez a kom bináció leh etővé teszi , hogy a szelep a n ormális él ettani ta rtományb an tarts a az intrave ntricular is nyomást (I VP) a beteg CSFáramlási igényeitől vagy testhelyzetétől függetlenül. Az áramlásszabályozást a membrán ellenállása és a szifon szabályozólemezei együtt végzik. Az
ellenáll ás mértéke h atározz a meg a szelep te ljesítmé nyének jelle mzőit. A retr ográd áram lást a membr án akadályoz za meg. A sz ifonzár- effek tust a
Delta ka mra két, nor mál állapotb an zárt sz ilikon-e lasztome r rekesze sz abályozz a. A rekesze k pozitív fe lfelé irány uló IVP hatás ára nyíln ak.
A szelep ké t - kis és normál - m éretben áll re ndelkezésr e. Minden méret h árom nyomást artománny al érhető el, eze k: 1-es, 1,5-es é s 2-es
teljesítményszint. A szelep teljesítményi jellemzőit a grafikonok mutatják (1a-b. ábra).
A kis mére tű készlet eg y 1-es, 1,5-es va gy 2-es teljesí tményszin tű kis Delta sz elepet tar talmaz. A nor mál méretű kés zlet egy 1-es , 1,5-es vagy
2-es teljesítményszintű normál Delta szelepet tartalmaz. Mindkét készlet tartalmaz egy 23 cm- es standard átmérőjű, báriumimpregnált
ventrikuláris katétert, valamint egy 90 cm hosszú, standard átmérőjű, báriumimpregnált kardiális/peritoneális katétert.
1a
0
0
0
O mm)
2
80
60
40
NYOMÁS (H
20
105
70
35
Teljesítményszint 2,0
Teljesítményszint 1,5
Teljesítményszint 1,0
ÁRAMLÁSI SEBESSÉG (ml /ó)
Gyártáskor valamennyi Medtronic Neurosurgery szelep teljesítményi jellemzőit megvizsgáljuk egy vízzel töltött ellenőrzőrendszer segítségével. Ezekben a tesztekben
minden szelepnek meg kell felelnie a címkén található specifikációknak. A szelep további vizsgálata eltérő eredményeket adhat, a vizsgálati feltételektől és a szelep
állapotától függően. A gyártáskor végrehajtott tesztelés célja minden Medtronic Neurosurgery szelep következetesen kiváló minőségének biztosítása.
1b
0
0
0
O mm)
2
80
60
40
NYOMÁS (H
20
120
85
50
Teljesítményszint 2,0
Teljesítményszint 1,5
Teljesítményszint 1,0
125
0 cm H2O HP*
90
MEGJEGYZÉS: A megjelenített szintek
átlagértékek. Ezen átlagértékek
toleranciatartománya +/- 25 H2O mm.
55
*Hidrosztatikus nyomás
105
70
- 50 cm H2O HP*
MEGJEGYZÉS: A megjelenített szintek
átlagértékek. Ezen átlagértékek
toleranciatartománya +/- 40 H2O mm.
*Hidrosztatikus nyomás
Magyar
ÁRAMLÁSI SEBESSÉG (ml /ó)
Gyártáskor valamennyi Medtronic Neurosurgery szelep teljesítményi jellemzőit megvizsgáljuk egy vízzel töltött ellenőrzőrendszer segítségével. Ezekben a tesztekben
minden szelepnek meg kell felelnie a címkén található specifikációknak. A szelep további vizsgálata eltérő eredményeket adhat, a vizsgálati feltételektől és a szelep
állapotától függően. A gyártáskor végrehajtott tesztelés célja minden Medtronic Neurosurgery szelep következetesen kiváló minőségének biztosítása.
A cerebro spinális fol yadék a katéte rből négy has ított nyíl áson át lép ki, me lyek a katéter ke rületén a dist alis véghez köz el, egymást ól 90°ra találh atók (8. ábra). E nyíl ások a retrog rád áramláss al szemben bi ztosítana k védelmet. A ny ílások nem nyo más- / áramláss zabályozó
szelep ekként szolgá lnak, hanem ki s ellenállást a dnak az áramlá shoz. Az áraml ással szemb en mutatott l egnagyobb e llenállás 20 ml/ór a
folyam atos áramlási s ebesség mel lett 2,0 H2O cm. A hasít ott nyílás okat a gyár tás során gra fittal vo nják be, így csö kkentik a hasí tott felsz ínek
tárolás alatti összetapadásának lehetőségét.
A szelepek körvonalazott alappal rendelkező sima, flexibilis szilikonelasztomer házba precíziós technikával öntött kemény polipropilén
alapzat ból készülne k (2. ábra). Az alapza t hozzájáru l a szerkezet i integritá shoz, a nyomási/ár amlási és a szi fonvezérlé si megbízhat ósághoz,
valamin t megakadályo zza a szelep perem és a membr án, illetve a s zifonvezér lő nyílások é s rekeszek def ormálódás át és ragadás át. A kupolán
sugár fogó, tantáli mpregnált j elzők mutatj ák a teljesítm ényszintet é s az áramlási ir ányt.
A Delta s zelepekbe n található c satlakozóka t úgy tervez ték, hogy c sökkent sék a katéter s zétválás ának lehetős égét. Csa k egyetlen kö rkörös kötés
szüks éges az egye s katéterek s zelephez rö gzítéséh ez. Az egyes c satlakozó k alapján lévő su gárfogó j elzések (2. ábr a) lehetővé tes zik, hogy az
orvos – s ugárfogó k atéterek ha sználata es etén – röntgen nel in vivo ellen őrizze a katé terek és a szel ep egymásh oz viszonyít ott helyze tét.
49
Page 52

2
Beépített bemeneti
csatlakozó
Szilikonkupola
Proximalis elzáró
Sugárfogó teljesítményi/áramlási irányjelzések
Rezervoár
Distalis elzáró
Delta kamra
Beépített kimeneti
csatlakozó
Sugárfogó jelzés
A szelepen lévő sugárfogó5je lzés az eszköz ny omási/áramlá si jellemzőit m utatja: az5az 1-es teljesítményszintnek, a6a 1,5 -es
teljesítményszintnek, a7pedig a 2- es teljesítm ényszintne k felel meg. A ku pola úgy van ki vitelezve, h ogy lehetővé te gye a befec skendezést
vagy a CSF -mintavéte lt legfeljeb b 25G méretű, no n-coring t űvel (9. ábra). Az erős po lipropilén al apzat megaka dályozza a sz elep tűvel
törté nő teljes átlyu kasztás át. A Delta sze lepek bőrön ke resztüli u jjbegynyo mással dist alis, illet ve proximális i rányba átöblí thetők. A sze lektív
átöblít és egyszer űsítése céljá ból a központi r ezervoár hoz képest prox imalis és dis talis helyze tben dugasz olók vannak elh elyezve.
A készülé k áramlási jel lemzőit nem be folyásolja a z MR-vizsgá lat. MR-vizs gálatot követő en nincs szü kség az esz köz ellenőrzé sére vagy
megigazítására.
Kemény polipropilén műanyag alapzat
Szilikon membránszelep
Javallatok
A Medtro nic Neurosur gery Delt a söntkészle tek szabály ozott CSF-ár amlást biz tosítanak az a gy oldalkamr ájából a szív j obb pitvar ába vagy a
perito neális térbe. Tová bbá a Delta sze lep minimaliz álja az IVP és a tér fogat túlz ott csökk enését túlzo tt CSF-dr enázs követke ztében, ame lyet
a distalis katéter hidrosztatikus nyomásának szifoneffektusa okozhat. A szifoneffektus egy olyan jelenség, amely létrejöhet a ventrikuláris
katéter d istalis katé terhez vis zonyított f elemelkedés e miatt (azaz h a a beteg ül, áll vag y függőleg es helyzetb en tartot t).
Használati utasítás
Sebészeti technika
Többfé le sebészet i technika has ználható a Del ta sönt behel yezésére. Az a lkalmazot t műtéti techn ika kiválas ztása a sebé sz feladata .
Javasol t, hogy a szele p sebészil eg létrehoz ott, laza f ejbőr alatt i tasakba le gyen helyez ve, a beborí tó fejbőr öss zenyomásána k elkerülés e végett, és
ne a fejbő rbemetsz és alá kerüljö n. A szelep a körn yező szöveth ez megerősí tett polié szterbo rítássa l ellátott pe remein keres ztül kiöl thető.
A Medtronic Neurosurgery Delta szelep behelyezésének pozíciója befolyásolja a sönt általános teljesítményét. Intracranialis nyomásmonitorizálásra az
egyik el fogadot t nulla refe renciapon t a Monro-ny ílás. A sze lep e refere nciapont f ölött tör ténő elhely ezése a sönt rendszer t eljes áramlá si ellenállá sának
növelését eredményezi. A szelepnek a referenciapont alatt történő elhelyezése a söntrendszer teljes áramlási ellenállásának csökkenését eredményezi,
3
10
ha a beteg ü l, áll, illetv e függőleg es helyze tben
tartott. E változások egyenesen arányosak
a referenciaponttól felfelé vagy lefelé mért
lineáris távolsággal (mm).
Műtéti eljárás
A ventrikuláris katéte r behelyezése
4
7
Spirálfúrt vagy burr lyuk
Derékszögű kapocs
Ventrikuláris katéterek
CSF-áramlásszabályozó
szelep, körvonalazott
5
Burr lyuk
Hajlítsa meg
a katétert;
nyomja be a
fülmélyedésbe
Koponya
A
kamrákhoz
Varrat
6
katéter ben van. A rozs damentes acé lszonda kiala kítása elő segíti a
katéter oldalkamrába történő bevezetését. A katéter csomagolásában a
szonda a lu menbe helyez ve található.
Miután a k atéter megf elelő helyze tbe került a kam rában, és a szo ndát
eltávol ították, a d erékszög ű hajlat kialak ításához be ke ll nyomni a
katéter ko ponyán kívü li részét a kap ocs oszto tt cső alakú s zakaszáb a
(5. és 6. ábra). A kap ocsba való p réseléskor n em szabad meg nyújtani a
katéter t. Ha a katéter k amrába helye zése tubulá ris bevezetőn k eresztül
törté nik, akkor a katé ter bevezető n keresztül i behelyezés e előtt el kell
távolít ani a kapcso t. A derékszö gű kapcsot a s zomszédos s zövethez
kell rögz íteni, a kapoc s oldalain lévő k ét varratly ukon átvezet ett
varrat okkal (7. ábra).
A Delta s zelep ventrik uláris katét erhez csat lakoztatá sához illess ze
az integrált polipropilén csatlakozót a ventrikuláris katétercsőbe.
A csővez etékeknek te ljes mérték ben takarni uk kell a csatl akozót.
A ventrikuláris katéterre szerelt derékszögű
kapoc s segítség ével (3. ábra) a katé ter
körülbe lül 90 fokos sz ögbe hajlíth ató ott,
ahol kil ép a csigafúr óból, illet ve a fúrt
lyukbó l (6. ábra). A kapocs h asználható a
katéterbevezetés tervezett mélységének
jelzőjeként is, amikor bevezetés előtt
elcsús ztatják az t a proximali s végtől
való meg felelő távols ágra (4. ábra). Ez
elvége zhető úgy is, ho gy a szonda a
50
Page 53

Körkörö s lekötésekke l rögzítse a c satlakozót a c sőhöz. Ügye lni kell arra, ho gy a lekötés biz tos rögzít ést adjon, de ne v ágja át a csöve t.
Egy, a ventrikuláris katéter extracraniális része és a söntkészlet Delta szelep részének befogadására alkalmas mélységű szubgaleális tasakot
kell képezni. A ventrikuláris katéter beültetését a söntbeültetés utolsó lépéseként ajánlott elvégezni. Ez minimálisra csökkenti a műtét alatti
CSF-veszteséget.
Peritonealis katéter felhelyezése
Többfé le sebészet i technika has ználható a dis talis katéte r peritoneal is üregbe való b ehelyezésé re. A behelyez és helyét a sebé sz legjobb
belátá sa szerint vál aszthatja k i. A katéter hos sza 90 cm, és di stalis végé n fali hasítéko k találhatók (8. áb ra). A katéterek ho ssza a legtö bb
felnőt t esetén alka lmas kardiáli s, illetve pe ritoneális b ehelyezésr e. A sebész a műté t során méret re vághatja a pr oximális vége t a kiválasz tott
behelye zési helyne k megfelelő en. Vagy ha nincs s zükség a ka téter fali hasí tékaira, a dis talis vég levá gható. A műtét so rán ellenőri zni kell a
katéter átjárhatóságát (lásd A sönt nyitottságának ellenőrzése rész t).
VIGYÁZAT: AMENN YIBEN A KARDIÁLIS /PERITONEÁLIS K ATÉTER VÉGE LEVÁGÁSR A KERÜL, TILOS A KATÉ TER PITVARBA HELYEZÉS E!
Ha a dista lis katéter elh elyezéséhe z bőr alatti al agútkészí tő eszköz szük séges, akko r erre a Medtr onic Neurosu rgery eldo bható bőr alat ti
katéterbevezető használata ajánlott.
MEGJEGYZÉS: A Medtronic Neurosurgery Delta söntkészlethez nem tartozik eldobható katéterbevezető.
VIGYÁZAT: A MEGERŐ SÍTÉS NÉLKÜLI SZILIKO N-ELASZTO MER ANYAGOK TÖBBSÉGE AL ACSONY SZAKÍ TÓSZILÁRDSÁGG AL
RENDELKE ZIK. A SZILIKON-EL ASZTOMER K ATÉTERCSŐ KEZELÉ SE ÉS BEHELYEZÉSE KÖZBE N ÓVATOSAN KELL ELJÁRNI A BE VÁGÁSOK,
REPEDÉSEK, ÉS SZAKADÁSOK ELKERÜLÉSE ÉRDEKÉBEN.
Befecskendezés a szelepbe
A Medtro nic Neuros urgery De lta szelep ú gy van kiképe zve, hogy le hetővé tegye a b efecskendez ést vagy a CSF -mintavét elt 25G vagy k isebb mére tű, non-co ring tűvel (9. ábra).
VIGYÁZAT: A MEGERŐSÍTÉS NÉLKÜLI SZILIKON-ELASZTOMER ANYAGOK
ALACSON Y SZAKÍTÓSZIL ÁRDSÁGGAL RENDE LKEZNEK. A TŰ BEHELYE ZÉSEKOR
ÉS KIVÉTE LEKOR GONDOSAN KELL E LJÁRNI.
A tűt a skal phoz, illet ve a szelep alap jához képest n em szabad 45°- nál nagyobb
szögbe n behelyezn i. Ha a szelep át szúrásár a több
alkalommal is sor kerül, ajánlatos a tűt különböző
helyeken b evezetni, a k upolán egye tlen ponton va ló
többsz örös beszú rás elkerülé se végett . A katétercsővezetékek, dugaszolók és szifonszabályzó membránok
nem használhatók befecskendezési helyként.
VIGYÁZAT: EZEN E SZKÖZ SZIFONSZA BÁLYZÓ RÉSZE
TERVEZÉ SE SZERINT NEM TESZI L EHETŐVÉ TŰ
BEHATOLÁSÁT. ELHELYEZKEDÉSE MIATT IGEN
VALÓSZÍNŰTLE N, HOGY A TŰ BEHELYEZÉ SEKOR AZ
MEGSZÚR JA A NYOMÁS-/ÁRAML ÁSMEMBRÁNT,
ILLETVE A S ZIFONVEZÉRLŐ ME MBRÁNOKAT.
ÜGYELNI KELL ENNEK ELKERÜLÉSÉRE, MIVEL A
MEMBRÁN, ILLETVE A MEMBRÁN OK KILYUKADÁSA
BEFOLYÁSOLHATJA A SZELEP T ELJESÍTMÉNY ÉT, ÉS
VESZÉLYEZTETHETI A SÖNTRENDSZER MŰKÖDÉSÉT.
25G-s vagy kisebb lyukat nem hagyó tű
Szelep átöblítése
A szelep kupolára a bőr ön kereszt ül gyakorolt ny omás
hatására a CSF mind proximális, mind distalis irányban
kilép a sz elepből. A sze lektív átöb lítéséhez ny omja le
és dugas zolja el a proxi malis vagy dis talis dugasz oló
szakaszokat percutan ujjnyomással, majd nyomja le
a szelep kupolát (10. ábra). Ez a mű velet azt id ézi elő,
hogy a fo lyadék a szele p elzárt old alával ellenté tes
irányba f og áramlani. H a a kupolalenyo mással szemb en
észrevehető ellenállás tapasztalható, lehetséges, hogy
az átöblí tendő katéte r el van dugulva.
VIGYÁZAT: SÖNTE LZÁRÓDÁS BEKÖVE TKEZHET A
SÖNTRENDS ZER BÁRMELY ALKATRÉSZ ÉBEN, ÉS AZT
KLINIKAI MEGFIGYELÉS EK, ILLETVE DIAGNOSZTIKAI
VIZSGÁLATOK ALAPJÁN KELL MEGÁLLAPÍTANI.
LEHETSÉGE S, HOGY A SZELEP ÁTÖBLÍT ÉSI JELLEMZŐI
NEM MEGFELELŐEK A KATÉTEREK ELDUGULÁSÁNAK
MEGÁLLAPÍTÁSÁRA! LÁSD A FIGYELMEZTETÉSEK
SZAKASZT.
Nyomja le a szelepkupolát Nyomja le az elzárót
Az öblítés iránya
Kimenet
Nyitottság ellenőrzése
Szele p:
a. Helyez ze a szelep beme neti csatl akozóját ster il
izotóniás sóoldatba.
b. Nyomja le és en gedje fel egy más után több ször
a központ i rezervoár t addig, amíg a f olyadék
ki nem lép a k imeneti cs atlakozóból. H a a
kimeneti csatlakozóból folyadék folyik minden
alkalommal, amikor lenyomja a kupolát, a
szelep ny itott (11. ábra).
Bemenet
Steril izotóniás folyadék
Pumpálja a
kupolát
Folyadékszint
8
9
10
11
51
Page 54

VIGYÁZAT: HA A TESZ TOLDATHOZ RÉSZECSK ESZERŰ ANYAGOT ADNAK , AZ BEFOLYÁSOLHATJA A TESZT E REDMÉNYÉT ÉS A TER MÉK
-3
5
10
1/4
O
F
F
MŰKÖDÉSÉT.
VIGYÁZAT: NE SZÍVJO N KERESZTÜL A SÖ NTÖN FOLYADÉKOT A DISTALIS KATÉTERV ÉGBŐL. EZ A MEDTRONIC NEUROSURGERY DELTA
SZELEP KÁROSODÁSÁT EREDMÉNYEZHETI.
VIGYÁZAT: A TÚL MAG AS ÖBLÍTÉSI NYOMÁ S AZ ÁRAMLÁ SSZABÁLYOZÓ SZELEP MEMB RÁNJÁNAK ÁTMENETI AL AKVÁLTOZÁSÁT
OKOZHATJA, AMELY RENDELLENESEN ALACSONY NYOMÁSI/ÁRAMLÁSI TESZ TEREDMÉNYEKHEZ VEZETHET.
VIGYÁZAT: HA A DELTA KAMR A ÉRINTÉSÉRE VAN SZÜK SÉG, AKKOR AZ ESZ KÖZT CSAK A REKESZ EKNÉL, KESZT YŰS KÉZZEL S ZABAD
MEGFOGNI. A K ÜLSŐ PEREMRE TILOS N YOMÁST GYAKOROLNI. A D ELTA KAMRA NEM MEGFELELŐ K EZELÉSE VESZÉLYE ZTETHETI A
SÖNTRENDSZER ÉPSÉGÉT.
Szív/peritoneális katéter:
A katéter n yitotts ágát a műtétkor e llenőrizni ke ll. A nyitott sági vizsg álat során az t is meg kell teki nteni, hogy val amennyi hasít ott nyílás
átengedi-e a CSF-et.
1. Il lesszen eg y 17G-s tompa
2. Vizsgál ja meg a distal is
3. Ha a hasítéko k nem
4. A nyito ttsági v izsgálat
Beültetés előtti vizsgálat
Minden D elta szelep eg yedi vizsg álaton megy ker esztül, me ly során
meggyőződünk róla, hogy megfelel-e a jelölt teljesítményi jellemzőinek.
Noha a szelepek dinamikus teljesítményjellemzőinek ellenőrzése a műtőben
végrehajtható statikus teszttel nem lehetséges, a sebésznek szándékában
állhat me ggyőződni ar ról, hogy impla ntálás előt t a Delta szele p megfelel a
Medtronic Neurosurgery specif ikációknak. Az alábbi implantálás előtti teszt
hajthat ó végre a műtőbe n:
VIGYÁZAT: GONDO SAN VIGYÁZZON A ST ERILITÁS FENNTARTÁSÁRA ÉS A
SZEMCSÉS SZENNYEZŐDÉS ELKERÜLÉSÉRE!
MEGJEGYZÉS: A D elta szelep et önmagában ke ll vizsgálni , nem pedig a
készle tben lévő katét erekhez cs atlakozta tva.
Ellenőrzési módszer
I. A teszthe z szükséges e szközök
1. Steril folyadékrezervoár vagy steril vízf ürdő
2. E gy db. steril, 30 c m-es vízma nométer, centim éter-beosz tással
3. Egy db. háromállású elzárócsap (a manométerrel használandó)
4. E gy db. steril f ecskendő, 30 ml
5. E gy db. steril, 5 µ m-es fecs kendőszűrő
6. E gy db. steril „ apa” luercs atlakozó
7. S teril sziliko n csővezeté k
II. A berendezés konfigurációja
1. Ve gye le a kupakot a ma nométerrő l. Állítsa fe l a manométer t, az
2. T öltse meg a f ecskendőt s teril vízz el, az 5 µm-es f ecskendő szűrőt
3. Csatlako ztassa a fe cskendőt, a ma nométert , valamint a szil ikon
4. Ahhoz, ho gy az összeá llított st eril teszt berendezé sből az öss zes
5. Meríts e be a szilikon c sővezetéket a s teril vízf ürdőbe, és öb lítse át
52
sóoldattal.
vég közelé ben lévő
hasított nyílásokat.
Minden ny ílásnak át kell
engednie a folyadékot,
és teljes h osszában
nyitva kell lennie.
nyílna k ki teljesen,
azok a katé ter hasítot t
nyílásokat tartalmazó
terüle tének hüvelyk- é s
mutató ujj közötti
finom forgatásával
felszabadíthatók.
elvégzé se után hüve lyk- és
mutatóujja segítségével
simíts a végig a katét er
falát, ho gy zárt he lyzetbe ker üljenek a hasí tott nyíl ások.
elzáró csapot és a v ízfürdőt ú gy, hogy a manomé teren látható nu lla
szint és a vízfürdő folyadékszintje azonos magasságban legyenek
(12. ábra). (Rögzítse a manométert az infúziós állványhoz.)
használva. (A fecskendő újratöltésekor mindig használjon 5 µm-es
fecskendőszűrőt.) A fecskendő feltöltése után vegye le a fecskendőszűrőt.
csőre ndszert a 12. ábr án látható módo n.
levegőt e ltávolítha ssa, fordí tsa el a csa pot a 13. ábrán láthat ó módon.
steril v ízzel a fec skendőből.
tűt a katé ter nyitott , proximális v égébe, majd mo ssa át gyenge
1oz
B-D
30
Manométer
3/4
Elzárócsap
1/4
1/2
Manométersapka
(leválasztva)
Fecskendőszűrő
Fecskendő
0 cm
510152025
fecskendőnyomás mellett steril, fiziológiás
35
30 cm
34
33
Szilikon csővezeték
3
2
1
0
-1
(Helyes
-2
manométer-
-3
elhelyezés)
O
F
F
A fecskendő felől
A fecskendő felől
1/4
5
10
1/4
5
10
Itt csatlakoztassa a terméket
Ki
A szelephez
-3
A manométerhez
F
F
O
Ki
-3
A manométer felől
O
F
F
Ki
A szelephez
Állandó
szintű
vízfürdő
12
13
14
15
Page 55

III. A berendezés kalibrálása
1. Fordíts a el a csapot a 14. áb rán látható mó don, és tölts e fel a manométe rt legalább 5 H2O cm nyomás ra.
2. Amiko r a szilikon cs ővezeték be va n merítve a ví zfürdő be, fordíts a el a csapot , hogy levála ssza a fec skendőt a manom éterről (15. ábra).
3. Engedje a manométer vízoszlopát leesni.
4. A vízoszl opnak a 12. ábrán láth ató módon a mano méter nulla sz intjénél kell me gállnia. Ha nem í gy van, emelje me g vagy süllyes sze le
a manométert szükség szerint.
5. A manométe r most kalibr álva van a vízf ürdő nulla sz intjére. Rögz ítse vagy sz erelje fel a man ométert a ví zfürdőhö z viszonyíto tt
referenciahelyzet megtartása céljából.
IV. Ellenőrzési eljárás
MEGJEGYZÉS: Tes ztelés alat t a szelepet be k ell meríteni a s teril vízf ürdőbe. A hel yes eredménye k érdekében a man ométer nulla s zintjét
megfelelően be kell állítani a vízfürdő folyadékszintjéhez.
1. Csatlakozt assa az ellenőrzendő steril szelepet a megfelelően összeállított tesz tberendezéshez.
2. F ordítsa el a c sapot a 14. ábrá n látható módon , és töltse fel a m anométer t legalább 30 H2O cm nyomás ra.
3. F ordítsa el a c sapot, hog y a manométer t leválassz a az áramlásút ról, a 13. ábrán látha tó módon.
4. Távo lítson el min den levegőt a sz elepből és a tes ztberend ezésből oly m ódon, hogy az okat fecske ndőből óvato san átöblíti s teril vízz el.
5. Ó vatosan hoz za létre az ár amlást a szel epen keresz tül a fecsken dőből szár mazó steril v ízzel.
6. Merí tse be a ster il szelepet a s teril víz fürdőbe. A he lyes teszt eredmények é rdekében a sz elep kimene ti csatlako zójának víz ala tt kell lenni e.
7. A s zelepen kere sztüli ára mlás óvatos fen ntartás a mellett fo rdítsa el a c sapot a fecs kendő áramlás útjának elkül önítésére, a hogyan
a 15. ábrán látha tó. A csap meg felelő hely zetbe tételé t követően a mano méter vízosz lopának esni e kell. A fecske ndő most le van
válasz tva a szelep ről, és nem szü kséges az ár amlás továbbf olytatá sa a fecskend ővel. Ha a vízos zlop nem csök ken, ismételj e meg a
2.-7. lépéseket.
MEGJEGYZÉS: Engedje a manométer vízszintjét csökkenni 2-2,5 percig. Olvassa le az eredményként kapott nyomást a manométeren.
Vizsgál ati eredménye k — beültetés el őtti vizsgála t
Az ily mó don nyert nyomá seredmény a köv etkező jellem zőkkel hason lítható össz e:
Szelep teljesítményszint Elfogadható nyomástartományok
1. szi nt 1 - 60 H2O mm 0 HP eset én
1,5. szint 35 - 95 H2O mm, 0 HP ese tén
2. szint 70 - 130 H2O mm 0 HP eset én
Kiszerelés
A Medtronic Neurosurgery Delta söntkészletek csomagoláskor STERILEK és NEM PIROGÉNEK, kizáró lag egyszer (egy alkalommal)
használhatók fel. ÚJRASTERILIZÁLÁ SUK TILOS!
A mellékelt termék kizárólag egyetlen betegnél való használathoz rendeltetett. A terméket tilos ismételten felhasználni, felújítani vagy
újrast erilizálni . Az ismételt ha sználat, a fe lújítás vagy a z újrasteri lizálás az es zköz szerkeze ti integrit ását veszél yeztethet i és/vagy az e szköz
szennye ződésének ko ckázatát ok ozhatja, ami a be teg sérülés ét, megbete gedését vag y halálát idéz heti elő. Tilos h asználni, ha a c somagot
előzőleg felnyitották vagy az megsérült. A Medtronic Neurosurgery nem felelős egyetlen újrasterilizált termék teljesítményéért sem.
Egy komplett sönt készítéséhez szükséges egy ventrikuláris katéter, egy Medtronic Neurosurgery Delta szelep és egy kardiális/peritoneális
katéter vagy egy peritonealis katéter.
Külön megrendelhető termékek
Ha ezt a Használati utasítást külön megrendelt termékkel kapta, lehetséges, hogy a mellékelt termék fizikai tulajdonságai különböznek a
csomagolásban található termékleírástól. Ezek a különbségek nincsenek kihatással a külön megrendelt termék biztonságosságára vagy
hatékonyságára.
A külön me grendelt ter mékek szállí tása steri l vagy nem ster il állapotban t örténik, a te rmék csoma golásán jel zettek szer int. A nem ster il
terméke ket használat e lőtt tisz títani és ste rilizálni ke ll.
Ellenjavallatok
Tilos a CS F söntölése a j obb pitvar ba, a peritone alis üregbe va gy a test más tér ségébe, ha fe rtőzés van je len bármely ol yan térségb en, ahová
a söntrendszer különböző komponensei beültetésre kerülnek. Ezek többek között magukba foglalják a következő területek fertőzéseit: a
fejbőr, ill etve más olya n bőrfelül et, ahol a söntr endszer átha lad, az agyhár tyák és agy kamrák, ill etve a perito neum, az intr aperitonea lis
és retr operitonea lis szervek , a pleura, és a vér áram. A CSF-s öntölés ellen javallt, ha a tes t bármely rés zében fert őzés van jelen. E zenkívül
congenitalis szívbetegségben vagy más súlyos cardiopulmonalis elváltozásban szenvedők esetén is ellenjavallt a pitvarba söntölés.
Betegtájékoztatás
Az orv os felelőss ége a betege t és/vagy a be teg képvisel őjét/képv iselőit táj ékoztatni a C SF söntölé sére vonatkoz óan. A tájékoz tatónak ki ke ll térnie
az implantálható söntrendszerekkel kapcsolatos komplikációk ismertetésére és a lehetséges alternatív termékek és kezelések elmagyarázására.
Figyelmeztetések és óvintézkedések
A megfelelő terméket, méretet, nyomást vagy teljesítményjellemzőt az adott beteg igényeinek megfelelően kell kiválasztani, diagnosztikai
teszt ek és az orvos t apasztal ata alapján. A te rmék címkéje m egadja a vonatko zó termékte ljesítménye ket, illetv e tartományo kat.
Kerülni ke ll a beültethe tő termékek ér intkezését k ötszerrel, k esztyűp orral, a bőrr ől származ ó olajmaradvá nyokkal, olaja lapú szappa nokkal,
szinte tikus deterg ensekkel, ill etve más fels zíni szennye zőanyagokk al. Kötszer, ujjl enyomatok, hi ntőpor, más felü leti szennyez ődés vagy late x
kesztyű reziduumok idegentest- vagy allergiás reakciót okozhatnak.
Vigyáz ni kell arra, ho gy szemcsé s szennyeződé s ne kerüljön be a s öntalkatr észekbe az im plantációt m egelőző tesz telés vagy ke zelés alatt .
Szennyeződés bevitele a söntrendszer nem megfelelő teljesítményét eredményezheti (túlzott vagy nem elegendő drenázs). A söntrendszerbe
bekerülő szemcsék nyitva tarthatják a nyomás- / áramláskontrolláló mechanizmust, amely túlzott drenázst eredményez.
A katéter ek csatlako zókhoz rögzí tésekor a körkö rös kötéseke t erősen, de nem t úl szorosan ke ll rögzíteni, m ert esetl eg átvághat ják a szilikon
csővezetéket.
53
Page 56

A katéter ek vezetések or körülteki ntően kell eljár ni, hogy pály ájuk során ne le gyenek kitév e hajlításnak é s szükség telen dörzs ölődésnek . A
spirálf úróval kész ített vagy b urr lyuk pere me körülvágh ató, hogy lesar kított hor ony keletkez zen ott, ahol a k atéter kilép é s el van hajlít va,
hogy az köz vetlenül rá feküdjön a kop onyára.
A hydroce phalus söntr endszerek kel ellátott be tegeket alap os megfig yelés alatt ke ll tartani a m űtétet követő i dőszakban , hogy nem lépne k-e
fel a sönt n em megfelel ő működésére u taló jelek és t ünetek. A kli nikai megf igyelések je lezhetik a sö nt hibás működ ését. A klini kai tünetek
söntf ertőzést , illetve a CSF e légtelen vag y túlzott lev ezetését je lezhetik.
Söntelzáródás a söntrendszer bármely részében előfordulhat. A rendszer belsőleg elzáródhat szövettörmelék, vérrögök, tumorsejtaggregátumok, baktériumok megtelepedése vagy más szennyezés miatt. A belső testszerkezetekkel érintkezésbe lépő katéterek meghajolhatnak,
vagy eldugulhatnak a hegyüknél (pl. ventrikuláris katétercsúcs behatolása a plexus choroideusba vagy a distalis katétercsúcsé az omentum
majorb a vagy a belek köz é). Végül elzáró dás történh et akkor is, ha a g yermek vagy c secsemő n övekszik , illetve ol yan fizika i tevékenysé gek
következ tében, amel yek a söntalk atrészek s zétválás át vagy a dista lis katéter a re ndeltetés szerű drená zs helyérő l való vissz ahúzását ok ozhatják.
Vérrögképződés a katéter pitvari része körül a pulmonalis artériák embolisatiojához vezethet, amelynek eredménye cor pulmonale vagy
hypertensio pulmonalis lehet.
Levált söntalkatrészek bevándorolhatnak a szívbe vagy a peritonealis üregbe.
A söntrendszerek nem megfelelő működése mechanikai hiba miatt is bekövetkezhet, amely nem elegendő vagy túlzott drenázshoz vezethet.
A „kis” m éretű katéte rek vékonyabb f alúak és átf ogó szilárds águk kisebb a „ standard ” méretű katé terekénél.
Vizsg álatok szerin t a „kis” mére tű peritone ális katétere k a „standard ” méretű per itoneális kat éterekhez h asonlítva m agasabb töré si
gyakori ságot mutat nak. A „kis” m éretű perit oneális katé tert – bármil yen (pl. kozmet ikai) okból – be ültető orvo soknak öss ze kell vetniük
ennek előnyét a peritoneális katéterrevízió esetlegesen magasabb előfordulásával.
A söntrendszer nem megfelelő működése vagy elzáródása megnövekedett intracranialis nyomás jeleihez vagy tüneteihez vezethet, ha a
hydrocephalus nem kompenzált. Csecsemőkben a szokásos tünetek: a fontanella anterior megnövekedett feszülése, a fejbőr ereinek vérbősége,
figyelmetlenség, álmosság, ingerlékenység, hányás, és tarkómerevség. Idősebb gyermekek és felnőttek esetén a szokásos tünetek: fejfájás,
hányás, homályos látás, emlékezetvesztés, tarkómerevség, a tudatosság csökkenése, és különböző kóros neurológiai tünetek.
A túlzot t CSF-dren ázs predis zponálja a subd uralis haemat oma vagy hydro ma kialakulás át, illetve o kozhatja az old alsó kamraf alak
kollaps zusát, amely a v entrikulár is katéter elz áródásáho z vezethet.
Ha a ventri cularis katé ter a rostos sz övetek össze növése révén köt ődik a plexus c horoideush oz vagy a szoms zédos agysz övethez, akko r nem
javasoljuk erőszakos eltávolítását. Javaslatunk szerint a katéter óvatos elforga tása segít heti annak kis zabadítá sát. Tanácsos abb a katéter t a
helyén ha gyni, mert a z erőszakos el távolítás az i ntraventri cularis haem orrhagia koc kázatát hoz za magával.
A subcutan katéterbevezetők eltörhetnek a hegesztéseknél vagy a részek összeszerelési pontjainál, vagy pedig a hajlékony tengely túlzott
deformációjának eredményeképpen. A hirtelen törés a szövetek vagy szervek sérüléséhez vezethet, vagy megkárosíthatja a söntrendszert. A
műszer eket meg kell viz sgálni hasz nálat előtt, a z integritá s és a működőkép esség foly amatosságá nak biztosít ása érdekéb en. Az eldobh ató
műszer eket sohasem s zabad újrah asználni, mer t az a beteg vag y az orvos sé rülését okoz hatja.
Komplikációk
A ventriculoatrialis és ventriculoperitonealis CSF-söntrendszerekkel kapcs olatos komplikációk hasonlatosak lehetnek bármilyen, helyi
és/vag y általános an aesthesia al att elvégze tt sebész i eljárás sorá n tapaszt altakhoz. E zek többek közöt t: gyógys zerekkel és ér zéstelení tő
szerekkel szembeni reakciók, elektrolit-kiegyensúlyozatlanság vagy túlzott vérveszteség, különösen csecsemők esetén. Ritka esetben a
betegben az implantátummal szembeni érzékenység miatt léphet fel reakció.
Ha a beülte tés előtti v izsgálatho z nem szűrt va gy nem ellenőr zött folya dékot haszná lnak, az hely telen szelep működéshez v ezethet, és a
szelep e llenőrzésé t teheti szük ségessé. A z eszközöket a zért is ellen őrzött kór házi körülmén yek között kell ha sználni, neh ogy részec skék,
rostok, illetve egyéb szennyező anyagok kerüljenek a szelepbe.
Az eszközök kezelésekor alkalmazott éles műszerek megkarcolhatják vagy bevághatják a szilikon-elasztomert, amely szivárgást okozhat,
és a szele p ellenőrzés ének szüks égességé t vonhatja maga u tán. A metsz ések zárás akor ügyelni kel l arra, nehogy a v arrótűk bev ágják vagy
megsértsék a szelepeket.
Minden CSF-söntölő eljárás során a leggyakoribb komplikációk a jelen terméktájékoztatóban lévő „Figyelmeztetések és óvintézkedések”
szakaszban leírt rendszerelzáródásból adódnak. Az elzáródás bekövetkezhet a rendszer bármely részében bárhol, agytörmelékek, vérrögök
és/vagy tumorsejt-aggregátumok tömítő hatásának következtében. Elzáródás történhet a rendszer alkatrészeinek szétválása, illetve a
katéter meghurkolódása és/vagy feltekeredése miatt is. Ez elősegítheti a ventrikuláris katéter bevándorlását a lateralis kamrába, a distalis
katéter ét a szívbe és a p ulmonalis ar tériarends zerbe, a peri toneumba, vag y más olyan sze rkezetbe, ame lybe a katéter b e van ültetve . A
csec semő vagy gye rmek növekedé se okozhatja a zt, hogy a dis talis katéte r visszahúz ásra kerül a pi tvarból a ven a iugularis int eriorba, va gy
pedig a peritoneumból olyan szövetsíkokba, ahol folyadék nem abszorbeálható.
A fent leírt söntelzáródási típusok mellett más, potenciálisan súlyos szövődmények is bekövetkezhetnek. A helyi vagy általános fertőzések
nem szok atlanok bárm ilyen söntelj árás esetén. E z leginkáb b a bőrben élő or ganizmusok , legtöbbsz ör Staphylococcus epidermidis miatt van. A
véráram ban keringő má s patogének is ko lonizálhat ják azonban a sö ntöt, és ez a bete gek nagy rés zénél annak elt ávolítását i gényli.
1973-ban Robertson és munkatársai az addigi jelentések alapján összefoglalták a ventriculoatrialis és ventriculoperitonealis söntökben
előfor duló fertőz éseket. Ventr iculoatria lis söntölés e setén a fer tőzés előfor dulási aránya 7-31% között v áltozott. A le gtöbb besz ámoló
szerint a ventriculoperitonealis söntölésben a betegek 5-10%-a esetén fordult elő fertőzés. Mivel a ventriculoatrialis söntölés elősegíti a
baktériumok továbbterjedését a test más szervei felé, a ventriculoperitonealis söntölés kevésbé káros hatású.
A közelmúl tban (1993-ban) Kestl e és munkatár sai a fertőz ések jelentő s csökkené sét (4%-nál alac sonyabb szi ntet) érték el a ntibiotiku m
haszná latával, rövid m űtéti idővel (s ebészeti ta pasztala t) és a műtőbeli kö rnyezet kontr ollálásával ( pl. erre a célra k ijelölt műtő, ko rlátozott
számú s zemélyzet és c sökkent fo rgalom, lefe dett bőr felületek). A ci kk azt állítj a, hogy eredmé nyek antibiot ikumok hasz nálata nélkü l is
elérhe tők, de csak a kö rnyezet szi gorú operác ió előtti kon trolljával.
A söntölt betegek profilaktikus antibiotikum-kezelése valamelyest ellentmondásos, mert alkalmazásuk prediszponálhatja az ellenállóbb
organizmusokkal történő fertőzést. Ezért a profilaktikus antibiotikumok használatáról a kezelőorvosnak és/vagy a sebésznek kell döntenie.
Túlzott CSF-drenázs a CSF-nyomás túlzott csökkenését okozhatja, és ez elősegítheti subduralis haematoma vagy hydroma kialakulását, illetve
a kamra mé retének túlz ott csökke nését okozha tja, amely elz áródáshoz vez et, mert a kamr afalak ráz árulnak a katé ter bemeneti ny ílásaira .
Csec semőben ez a tú lzott nyomás csökkené s a fontanella a nterior kif ejezett dep ressziójá t, a koponyacs ontok egymá sra fekvés ét okozhatja, és
átalakulhat obstrukciós hydrocephalussá.
54
Page 57

Jelente tték epilep szia előfor dulását is vent rikuláris s öntölési elj árások után. E z a tanulmány a zt is jelezt e, hogy a rohamo k gyakoriság a
növekedett többszörös katéterrevízió esetén.
A perito neumba tör ténő söntölés s ikertelen l ehet, mert a k atéter behato lhat a belek közé va gy az omentum m ajorba. Leír ták a bél
perforációit peritonealis katéter esetében, amelyet peritonitis kialakulása követett.
Eszközökkel kapcsolatos szövődmények
A subcut an katéterb evezető hasz nálatához köz vetlenül kap csolódó kom plikációk tö bbek között : nehézség a z eszköz átvez etésekor a he ges
területeken, illetve haematomák esetleges kialakulása.
Visszaküldött árukkal kapcsolatos irányelv
A terméke ket fel nem nyit ott csomag olásban, éri ntetlen gyár tói zárópe cséttel k ell visszak üldeni, egyéb ként azok nem el fogadhatók
cserére vagy jóváírásra. Ez alól csak a termékhiba vagy címkézési hiba panaszával visszaküldött termékek képeznek kivételt. A Medtronic
Neurosu rgery fog ja eldönteni, h ogy fennáll- e termékhi ba vagy címkéz ési hiba, és a dön tés végleges l esz. Csere v agy jóváírá s céljából cs ak
akkor fo gadhatók el a ter mékek, ha azok 9 0 napnál rövid ebb ideig volt ak a vevő birto kában.
Garancia
A. Stand ard korláto zott garan cia. A Medtronic Neurosurgery garantálja az eredeti végfelhasználónak („Vevő”), hogy a Vevő által
megvásárolt, mellékelt egyszer használható beültetendő termék („Termék”) a Vevőnek való kiszállítás időpontjában anyag- és gyártási
hibák tól alapvetően m entes lesz. A M edtronic Ne urosurger y semmilyen ga ranciát (kif ejezett, b eleértet t vagy kötele ző) sem vállal o lyan
Termékekért, amelyeket módosítottak (kivéve az itt kifejezetten említetteket) vagy szokatlan mértékű fizikai terhelésnek, nem megfelelő
használatnak vagy üzemeltetésnek, hanyagságnak, nem megfelelő teszteknek tettek ki, vagy a Termék tervezésétől eltérő más termékekkel
vagy alkatrészekkel együtt használtak, vagy a Termék rendeltetésének nem megfelelő bármi más módot vagy orvosi eljárást alkalmaztak.
B. Jogorvoslat. A fenti garanc ia be nem tart ása esetén a Vev ő egyetlen jo gorvoslat a és a Medtroni c Neurosurge ry egyetle n felelőssé ge,
a Medtronic Neurosurgery kizárólagos döntése és választása alapján, ezen Termék cseréje vagy az ilyen Termékért ténylegesen kifizetet t
nettó ö sszeg jóváír ása lesz, fe ltéve, hogy (i) a Me dtronic Neur osurgery í rásos érte sítést kap a Term ék hibás működ éséről, a felt ételezet t hibás
működés a ngol nyelvű ré szletes mag yarázatáv al, attól szá mított kile ncven (90) napon b elül, hogy a Vevő át vette a Terméke t; (ii) az átvét eltől
számí tott 90 napon b elül az ilyen Term éket visszak üldik a Medtr onic Neurosu rgery F.O.B. 125 Cremon a Drive, Golet a, Californ ia 93117, U.S.A.,
címére, vagy más, a Medtronic Neurosurgery által megadott címre; és (iii) a Medtronic Neurosurgery kielégítően meggyőződött arról, hogy a
panasz ban említet t hiba tényleg esen létezi k. Az ebben a par agrafusb an kifejezet ten leírt ak kivételév el a Vevőnek ninc s joga a Termékeket a
Medtronic Neurosurgery vállalatnak visszaküldeni, a Medtronic Neurosurgery előzetes írásos engedélye nélkül.
C. Egyéb g aranciák k izárása. A FE NTI (A) PONTBAN LEÍRT KOR LÁTOZOTT GARANC IA KIVÉTELÉVEL A ME DTRONIC NEUROSURGER Y
SEMMILYEN MÁ S, KIFEJEZETT VAG Y BELEÉRTETT GAR ANCIÁT VAGY KIKÖTÉST SEM N YÚJT, ÉS A GYÁRTÓ KIFEJE ZETTEN ELHÁRÍTJA
AZ ELADH ATÓSÁGRA ÉS EGY ADOT T CÉLRA VALÓ ALKALM ASSÁGRA VONATKOZÓ BE LEÉRTETT GAR ANCIÁKAT ÉS KIKÖTÉSE KET. A
MEDTRONIC NEU ROSURGERY A TERMÉK E LADÁSÁVAL KAPCS OLATOSAN VAGY ABBÓL SZ ÁRMAZÓAN NEM VÁLL AL SEMMILYEN MÁS
FELELŐSSÉGE T, ÉS ENNEK VÁLLALÁSÁVAL SEMM ILYEN MÁS SZEMÉLYT SE M HATALMAZOTT FEL.
55
Page 58

56
Page 59

Kit di derivazione Delta
14
12
10
52030
40 50
14
12
10
52030
140
40 50
Descrizione
In ciascuna valvola Delta Medtronic Neurosurgery è incorporata una valvola a membrana per la regolazione della pressione collegata in
serie a un meccanismo di controllo con sifone normalmente chiuso. Questa combinazione consente alla valvola di mantenere la pressione
intrave ntricolare (P IV) entro un ran ge fisiolo gico normale, a p rescinder e dai requisit i di flusso de l paziente in te rmini di liqui do cerebrosp inale
(LCS) o dalla p osizione cor porea. Il cont rollo del fl usso viene ra ggiunto media nte la resiste nza combinat a fornita da lla membrana e da i
diafra mmi di control lo con sifone. Le c aratteri stiche pre stazionali d ella valvola so no determina te dal grado di re sistenza. I l flusso inver so
viene impedito dalla membrana. L’effetto aspirante viene regolato dai due diaframmi in elastomero siliconico normalmente chiusi della
camera d i controllo co n sifone Delt a. I diaframmi s i aprono in risp osta a una PIV po sitiva a monte .
La valvo la è disponibil e in due misure, ov vero piccola e r egolare. Cias cuna misura è di sponibile in t re diversi ra nge di pressio ne: livello di
prest azione 1, 1,5 e 2. Le carat teristic he presta zionali della va lvola sono mos trate nei gra fici (Fig. 1a-b).
Il kit di mi sura piccola è co stituito da u na valvola Delt a, piccola, con li vello di pres tazione 1, 1,5 o 2. Il kit d i misura regol are è costitu ito da
una valvo la Delta, rego lare, con livell o di prestaz ione 1, 1,5 o 2. In entramb i i kit sono inclu si un catetere v entricolar e da 23 cm, con diame tro
standa rd e impregnat o di bario, e un cat etere cardia co/peritone ale da 90 cm, con dia metro stan dard e impregn ato di bario.
1a
0
0
O)
2
0
80
60
40
PRESSIONE (mm H
20
105
70
35
Livello di prestazione 2,0
Livello di prestazione 1,5
Livello di prestazione 1,0
POR TATA (ml/ora)
Ogni valvola Medtronic Neurosurgery viene testata, al momento della produzione, per valutare le caratteristiche di prestazione tramite l’uso di un sistema di prova a riempimento
d’acqua. Tutte le valvole sono conformi alle specifiche di etichettatura per questi test. Test successivi della valvola possono indicare diversi risultati che dipendono dalle condizioni del
test e dalle condizioni della valvola. Il test effettuato al momento della produzione ha la funzione di assicurare la costante qualità superiore di ogni valvola Medtronic Neurosurgery.
125
0 cm H2O HP*
90
NOTA: i livelli indicati sono valori medi.
La gamma di tolleranza di questi valori
medi è di +/- 25 mm H2O.
55
*Pressione idrostatica
Italiano
1b
0
0
O)
2
0
80
60
40
PRESSIONE (mm H
20
120
85
50
Livello di prestazione 2,0
Livello di prestazione 1,5
Livello di prestazione 1,0
105
70
- 50 cm H2O HP*
NOTA: i livelli indicati sono valori medi.
La gamma di tolleranza di questi valori
medi è di +/- 40 mm H2O.
*Pressione idrostatica
POR TATA (ml/ora)
Ogni valvola Medtronic Neurosurgery viene testata, al momento della produzione, per valutare le caratteristiche di prestazione tramite l’uso di un sistema di prova a riempimento
d’acqua. Tutte le valvole sono conformi alle specifiche di etichettatura per questi test. Test successivi della valvola possono indicare diversi risultati che dipendono dalle condizioni del
test e dalle condizioni della valvola. Il test effettuato al momento della produzione ha la funzione di assicurare la costante qualità superiore di ogni valvola Medtronic Neurosurgery.
Il liquid o cerebrospi nale fuorie sce dal catete re attraver so quattro f essure, dis tanziate a inte rvalli di 90° l ungo la circon ferenza del c atetere, in
prossi mità della pun ta distale (Fi g. 8). Le suddette f essure sono i ntese a preveni re il flusso i nverso. Sebb ene queste ul time causino u na lieve
resist enza al flus so, esse non son o intese quali v alvole per il con trollo della p ressione/f lusso. La ma ssima resis tenza al flu sso, a una port ata di
fluss o costante di 20 m l/ora, è di 2,0 cm di H2O. Le fessu re di cui sopra s ono rivesti te di grafit e durante il pro cesso di fabb ricazione a llo scopo di
ridurre al minimo il rischio di adesione della superficie fessurata durante la conservazione.
Le valvol e sono fabbr icate con una ba se rigida st ampata a pre cisione in po lipropilen e inserita i n un involucro i n elastomer o siliconico f lessibil e
e liscio co n base prof ilata (Fig. 2). La b ase promuove l ’integri tà strut turale e l’af fidabili tà della pres sione/fl usso e dei diaf rammi di cont rollo con
sifone, impedendo la distorsione e l’inceppamento dell’alloggiamento della valvola e della membrana e delle porte di controllo e dei diaframmi
con sifone. La cupola è marcata con indicatori impregnati di tantalio radiopaco indicanti il livello prestazionale e la direzione del flusso.
57
Page 60

2
Connettore di entrata
integrale
Cupola in silicone
Occlusore prossimale
Serbatoio
Indicatori radiopachi della prestazione/direzione del flusso
Occlusore distale
Camera Delta
Connettore di uscita
integrale
Marcatore radiopaco
Base di plastica rigida in polipropilene
Le valvole Delta sono dotate di connettori appositamente progettati ai fini della riduzione del rischio di distacco del catetere. Ogni catetere deve essere
fiss ato alla rispe ttiva val vola median te una legatu ra circolar e. I marcator i radiopac hi situati al la base di cias cun connet tore (Fig. 2) co nsentono al
medico d i visualizz are radio grafica mente le posi zioni risp ettive dei c ateteri e de lla valvola in vi vo quando vengono utilizzati cateteri radiopachi.
Il codice radiopaco5r iportato s ulla valvola ind ica le carat teristic he della pressi one/flus so del dispos itivo; 5corr isponde al live llo di
prestazione 1,6al livello di pres tazione 1,5, e7al live llo di prest azione 2. La cup ola è stata pr ogettat a per consenti re l’iniezio ne o il prelievo
di LCS per me zzo di un ago non c arotante di c alibro pari o i nferiore a 25 (F ig. 9). La base rigi da in poliprop ilene imped isce la complet a
penetrazione della valvola da parte dell’ago. Le valvole Delta possono essere irrigate in direzione distale o prossimale mediante pressione
digita le percutan ea. Per facilit are l’irri gazione sele ttiva, gli o cclusori so no situati a live llo prossima le e distale ris petto al ser batoio centr ale.
Le carat teristic he del fluss o del disposit ivo non sono int eressate dal l’esame RM. Il dis positivo non d eve essere tes tato o nuovam ente regolato
dopo l’esa me RM.
Valvola con membrana
in silicone
Indicazioni d’uso
I kit di derivazione Delta Medtronic Neurosurgery sono progettati per l’uso durante gli interventi con shunt per il controllo del flusso di LCS
dal ventr icolo lateral e del cervell o all’atrio des tro del cuore o a lla cavità per itoneale. La v alvola Delta m inimizza in oltre la ridu zione eccess iva
di PIV e del vo lume provoca ta dal drenagg io eccessivo di LC S, che potreb be essere ca usato dall’ef fetto aspir ante della pre ssione idros tatica
del cate tere distale . L’effe tto aspira nte è un fenomeno c he potrebb e presentar si per via dell ’elev azione del ca tetere ventr icolare risp etto al
catetere distale (ad esempio, quando il paziente è in posizione seduta, in piedi o viene mantenuto in posizione eretta).
Istruzioni per l’uso
Tecnica chirurgica
Si possono usare varie tecniche chirurgiche per il posizionamento dello shunt Delta. La scelta della tecnica chirurgica da impiegare va lasciata
alla discrezione del chirurgo.
Si sugger isce di inser ire la valvola i n una tasca su bgaleale lib era, pratic ata chirurg icamente, ev itando in ta l modo la compre ssione da par te del
3
4
7
Trapano a punta elicoidale o
foro di trapano
Clip ad angolo retto
Catetere ventricolare
Valvola di regolazione del
flusso di LCS, profilata
10
5
Foro di
trapano
Piegare il
catetere,
spingere nella
scanalatura del
collare
di sutura
Cranio
Ai ventricoli
Sutura
6
al flus so dello shunt q uando il pazi ente è in posizi one seduta , in piedi o
viene mantenuto in posizione eretta. Dette variazioni sono direttamente
propor zionali alla d istanza li neare (mm) al di sopr a o al di sotto de l punto
di riferimento.
Procedura chirurgica
Posizionamento del catetere ventricolare
La clip ad a ngolo retto r invenibile su l catetere ven tricolare (Fi g. 3) può
essere u sata per pie gare il catete re a un angolo di 90 ° circa nel pun to in
cui esso f uoriesce d al foro prati cato dal trapa no a punta elico idale o dal
trapan o normale (Fig. 6). L a clip può anche f ungere da mar catore per la
profondità programmata di inserimento del catetere facendola scorrere
sino alla di stanza app ropriata da lla punta pros simale del cate tere prima
dell’inserimento (Fig. 4). Questa operazione può essere eseguita con il
mandrino alloggiato all’interno del catetere.
58
sovras tante cuoio c apelluto, e no n al di sotto
dell’incisione nel medesimo. La valvola può
essere f issata ai t essuti adia centi esegu endo
una sutu ra attraver so la flang ia rinforz ata con
tessuto in poliestere.
Il sito di posizionamento di una valvola Delta
Medtronic Neurosurgery influenzerà le
prestazioni generali dello shunt. Il forame di
Monro costituisce un punto di riferimento del
livello ze ro standar d ai fini del mo nitoraggi o
della pressione intracranica. Il posizionamento
della val vola al di sopra d el suddet to punto
di riferimento comporterà un aumento
generale della resistenza al flusso dello shunt.
Il posizionamento della valvola al di sotto del
suddetto punto di riferimento comporterà
una diminuzione generale della resistenza
Page 61

Il mandri no in acciaio in ossidabile è in teso a facili tare l’inse rimento del c atetere nel ven tricolo later ale. Il cateter e è fornito con i l mandrino
inserito nel lume.
In seguito al debito posizionamento del catetere nel ventricolo e all’estrazione del mandrino, la sezione extracranica del catetere va spinta
entro il s egmento tubo lare scisso d ella clip per fo rmare la piega a d angolo ret to (Fig. 5 e 6). Non diste ndere il cate tere durante l ’inserimen to
all’int erno della cli p. Se si intende in serire il cate tere nel ventr icolo attr averso un intr oduttore t ubolare, la cli p deve essere r imossa prim a
dell’i nserimento d el catetere at traverso l ’introdut tore. La clip a d angolo ret to va fissat a al tessuto adi acente facend o passare i pun ti di sutura
attra verso i due for i di sutura pre senti sui lati d ella clip stes sa (Fig. 7).
Per colle gare la valvola De lta al catete re ventricol are, inserire i l connettor e integrale in p olipropil ene all’inter no del tubo del c atetere
ventric olare. Il conne ttore deve es sere complet amente coper to dal tubo. Fi ssare il tubo a l connettor e mediante leg atura circol are. Presta re
attenz ione aff inché la legat ura circolar e garantisc a un fissagg io saldo senz a però tagliar e il tubo.
Per accogl iere la sezion e extracr anica del cat etere ventri colare e la valvo la Delta del ki t di derivazio ne si deve prati care un tasc a subgaleale
di profondità adeguata. Si raccomanda di eseguire l’impianto del catetere ventricolare quale fase finale della procedura di derivazione. Ciò
consent e di ridurre al m inimo la perdi ta di LCS durant e l’interven to chirurgi co.
Posizionamento del catetere peritoneale
Si posso no adottar e svariate tec niche chiru rgiche per po sizionare il c atetere dist ale nella cavi tà peritone ale. La scelta d el sito di
posizi onamento è a disc rezione del c hirurgo. Il ca tetere è lungo 9 0 cm e present a delle fessur e parietali i n prossimit à dell’estremi tà distale
(Fig. 8). I cateteri presentano una lunghezza sufficiente ai fini del posizionamento in sede cardiaca o peritoneale nella maggior parte dei
pazienti adulti. Il chirurgo può tagliare l’estremità prossimale del catetere per adeguarne la lunghezza al sito di posizionamento selezionato
al momento dell’intervento chirurgico, oppure, qualora non si desiderino le fessure parietali, potrà tagliare l’estremità distale. Al momento
dell’i ntervento co ntrollare ch e il catetere sia p ervio (vede re Test di pervi età dello
shunt).
ATTENZIONE: S E SI TAGLIA L’ESTREMITÀ DISTALE DEL CATETE RE CARDIACO/
PERITONEAL E, NON INSERIRE IL CATET ERE ATTRAVERSO L’ATRIO.
Qualora si renda necessario l’uso di un dispositivo per tunnellizzazione
sotto cutanea per i l posizionam ento del catet ere distale, si r accomanda l’us o
dell’introduttore per cateteri sottocutaneo monouso
Medtronic Neurosurgery.
NOTA: nel kit di derivazione Delta Medtronic
Neurosu rgery non è ac cluso un intro duttore pe r cateteri
monouso.
ATTENZIONE: I MATERIALI IN ELASTOMERO
SILICONICO PRE SENTANO DI NORMA UNA BA SSA
RESISTENZ A ALLA LACERA ZIONE. DURANT E LA
MANIPOL AZIONE E IL POSIZI ONAMENTO DEL
TUBO DEL CATET ERE IN ELASTOMER O SILICONICO
ESERCITARE LA D EBITA CAUTELA ONDE PRE VENIRE
TAGLI, AMMACCATUR E O LACERAZION I ACCIDENTALI.
Ago di calibro pari o inferiore a 25
Iniezione nella valvola
La valvola Delta Medtronic Neurosurgery è stata
progettata per consentire l’iniezione o il prelievo di
campio ni di LCS attra verso la cupo la mediante l’aus ilio
di un ago non c arotante di c alibro pari o i nferiore a 25
(Fig . 9).
ATTENZIONE: I MATERIALI IN ELASTOMERO
SILICONICO PRE SENTANO DI NORMA UNA BA SSA
RESISTENZ A ALLA LACERA ZIONE. OCCORRE
PRESTARE ATTENZIONE DURANTE L’INSERIMENTO E
LA RIMOZIONE DELL’AGO.
L’ago deve essere i nserito a un an golo non supe riore a
45° rispe tto al livell o del cuoio cap elluto o della b ase
della val vola. Se la valvo la viene per forata var ie volte,
si consig lia di inserir e l’ago in vari pu nti per evita re
perforazioni multiple in un singolo punto della cupola. Il
tubo del c atetere, gli o cclusori e i di aframmi di co ntrollo
con sifone non devono essere usati come siti d’iniezione.
ATTENZIONE: L A SEZIONE DOTATA DEL MECCAN ISMO
DI CONTROLLO CO N SIFONE DEL PRESENTE
DISPOSITI VO NON È STATA PROGETTATA PER
CONSENTIRNE LA PENETRAZIONE MEDIANTE AGO.
IN CONSIDER AZIONE DEL SUO SITO D ’UBICAZIO NE, È
ALQUANTO IMPROB ABILE CHE L’AGO POSSA ESSERE
INSERITO IN MOD O TALE DA FORARE LA MEMBR ANA
DI REGOLA ZIONE DELLA PRE SSIONE/FLUSSO O I
DIAFRAMMI DI CONTROLLO CON SIFONE. ADOTTARE
LE DEBITE PREC AUZIONI ONDE PREVEN IRE
DETTO RIS CHIO IN QUANTO LA PERFOR AZIONE
DELLA MEMB RANA O DEI DIAFRAM MI POTREBBE
INTACCARE LE CAR ATTERISTICHE PRE STAZIONALI
DELLA VALVOLA E CO MPROMETTERE LA
FUNZIONALITÀ DEL SISTEMA DI SHUNT.
Entrata
Premere la cupola della
valvola
Direzione dell’irrigazione
Premere l’occlusore
Pompare la cupola
Livello del liquido
Liquido isotonico
sterile
Uscita
8
9
10
11
59
Page 62

Irrigazione della valvola
Per fare f uoriuscir e il LCS dalla valvo la in direzion e sia prossima le che distal e esercitar e una pression e digitale pe rcutanea sul la cupola della
valvola. Per eseguire un’irrigazione selettiva, premere e occludere la sezione occlusiva prossimale o distale della valvola mediante pressione
digitale percutanea, quindi premere la cupola della valvola (Fig. 10). Ciò consentirà al liquido di fluire nella direzione opposta rispetto al lato
occlus o della valvola. N el caso in cui si n otasse resi stenza alla co mpression e della cupola, i l catetere ir rigato potre bbe essere oc cluso.
ATTENZIONE: T UTTI I COMPONENT I DI UNO SHUNT SONO SO GGETTI A UN POTEN ZIALE RISCHIO DI OCC LUSIONE CHE VA DIAGNOST ICATO
MEDIANTE REPERTI CLINICI E TEST DIAGNOSTICI. LE CARATTERISTICHE D’IRRIGAZIONE DELLA VALVOLA POTREBBERO NON ESSERE
ADEGUATE PER DIAGNO STICARE L’OCCLUSIONE DE I CATETERI. VEDERE L A SEZIONE RELATIVA AL LE AVVERTENZE .
Test di perv ietà dello shun t
Valvola
a. Immerg ere il connet tore
di entra ta della valvol a
in una soluzione salina
isotonica sterile.
b. Premere e ri lasciare
ripetutamente il
serbatoio centrale
della val vola finché i l
liquido non fuoriesce
dal conne ttore di usc ita.
Se il liquido fuoriesce
dal conne ttore di usc ita
ogni volt a che si preme
il serbatoio centrale, ciò
signif ica che la valv ola è
pervi a (Fig. 11).
ATTENZIONE: L’AGGIUNTA DI
MATERIALE PARTICELLARE
ALLA SOLUZI ONE DI PROVA
POTREBBE INTACC ARE I RISULTATI DEL TEST E LE PRESTAZIO NI DEL
PRODOT TO.
ATTENZIONE: N ON ASPIRARE IL LIQU IDO ATTRAVERSO LO SH UNT
DALL’ESTREMITÀ DISTALE DEL C ATETERE IN QUANTO CIÒ POT REBBE
CAUSARE IL DANN EGGIAMENTO DELL A VALVOLA DELTA MEDTRONIC
NEUROSURGERY.
ATTENZIONE: UN’ECCESSIVA PRESSIONE DURANTE L’IRRIGAZIONE
POTREBBE C AUSARE LA DEFORMA ZIONE TEMPOR ANEA DELLA
MEMBRANA D ELLA VALVOLA DI REGOL AZIONE DEL FLUSSO, CON
CONSEGUENTI RISULTATI DEL TEST DI CONTROLLO DELLA PRESSIONE/
FLUSSO INSOLITAMENTE BASSI.
ATTENZIONE: QUALORA DOVESSE RENDERSI NECESSARIA LA
MANIPOL AZIONE DELLA C AMERA DELTA, AFFERRARE IL D ISPOSITIVO
DAI DIAFRAM MI INDOSSANDO SEMPR E DEI GUANTI. NON SOTT OPORRE
A PRESSIONE I L BORDO ESTERNO. LA M ANIPOLAZIO NE IMPROPRIA
DELLA CAMERA DELTA POTREBBE COMPROMETTERE L’INTEGRITÀ DEL
SISTEMA DI SHUNT.
Filtro per siringa
Siringa
Tappo del
manometro
(staccato)
Rubinetto d’arresto
Catetere cardiaco/peritoneale
Al moment o dell’inter vento contr ollare che il ca tetere sia per vio. Durante
il test di p ervietà o ccorre eseg uire un contro llo visivo ond e accertar si che
tutte l e fessure cons entano il fl usso di LCS.
1. Inse rire un ago con p unta smussa d i calibro 17 all’ interno dell ’estremità
prossi male apert a del cateter e e irrigare co n una soluzio ne salina
fisiologica sterile esercitando una lieve pressione sulla siringa.
2. Osserv are le fessur e in prossimit à dell’estrem ità distale. Tut te le
fessur e devono conse ntire il flus so del liquido e a pparire ape rte per
la loro intera lunghezza.
3. Qualora le f essure non dov essero appa rire complet amente aper te,
per libe rarle si può arr otolare delic atamente tr a il pollice e l’i ndice
la sezione del catetere ospitante le fessure.
4. Lis ciare la pare te del catet ere con il polli ce e l’indice i n modo tale ch e le
fessur e si trovino ne lla posizio ne chiusa al t ermine del te st di perv ietà.
Test pre-impianto
Ciascuna valvola Delta viene individualmente testata per garantirne la
conformità alle caratteristiche prestazionali indicate nell’etichetta. Nonostante
non sia possibile eseguire un accertamento delle caratteristiche prestazionali
dinamic he di una valvol a per mezzo di u n test stat ico in sala ope ratoria,
si consig lia al chirur go di accert arsi che la val vola Delta si a conforme a lle
specifiche della Medtronic Neurosurgery prima di eseguire l’impianto. Il
seguente test pre-impianto può essere eseguito in sala operatoria.
Manometro
35
30 cm
34
33
Tubo in silicone
3
2
1
0
0 cm
-1
(
Allineamento
corretto del
manometro)
-2
-3
1/4
1/2
3/4
1oz
B-D
510152025
30
O
F
F
Collegare il prodotto in questo punto
-3
Dalla siringa
1/4
10
5
F
F
O
-3
Chiuso
Alla valvola
Al manometro
Dalla siringa
1/4
F
F
5
10
O
Chiuso
-3
Dal manometro
1/4
O
F
5
10
F
Chiuso
Alla valvola
Bacinella
d’acqua
a livello
costante
12
13
14
15
60
Page 63

ATTENZIONE: AC CERTARSI DI MANTENERE L A STERILITÀ ED EVITARE LA CO NTAMINAZIONE CON M ATERIALE PARTICELLARE .
NOTA: la valvola Del ta va testat a quale compone nte a sé stante e n on mentre è colle gata ai catet eri contenut i nel kit.
Metodo per il test
I. Strumen tazione occorre nte per la condu zione del test
1. S erbatoio di l iquido steri le o bacinella d ’acqua sterile
2. U n manometro d ’acqua sterile d a 30 cm, graduato i n centimetri
3. U n rubinett o d’arresto a tr e vie (da utilizz arsi con il man ometro)
4. U na siringa ste rile da 30 ml
5. U n filtro per s iringa ster ile da 5 µ
6. U n connettor e Luer maschio s terile
7. Tub o sterile in sil icone
II. Preparaz ione della str umentazione
1. Rimuo vere il tappo d al manometr o. Preparare i l manometro, i l rubinet to d’arresto e la b acinella d’acq ua in modo che il l ivello zero su l
manome tro e il livello d el liquido nel la bacinella d ’acqua siano alla s tessa alte zza (Fig. 12). Fissa re il manomet ro a un’asta per f leboclis i.
2. R iempire la sir inga con acqua s terile usand o un filtro p er siringa da 5 µ. D urante il riemp imento della si ringa, usar e sempre un fi ltro
per siri nga da 5 µ. Dopo aver r iempito la sir inga, scolleg are il filtr o per siringa.
3. Collegare l a siringa, il man ometro e il tub o in silicone, com e illustrat o nella figur a 12.
4. Per espelle re completa mente l’aria dall ’apparecchia tura steril e assemblat a per il test, gir are il rubine tto d’arres to come illust rato
nella figura 13.
5. Immerger e il tubo in silic one nella bacin ella d’acqua ste rile, irriga ndolo con acqua s terile tram ite una siring a.
III. Calibrazione della strumentazione
1. Girare il r ubinetto d ’arresto come il lustrato ne lla figura 14 e rie mpire il manom etro almeno f ino a 5 cm di H2O.
2. C on il tubo in sili cone immers o nella bacinel la d’acqua, girar e il rubinet to d’arresto p er isolare la sir inga dal manom etro (Fig. 15).
3. Attender e che scenda la co lonnina d’acqua n el manometr o.
4. La colonni na d’acqua si dovr ebbe arres tare al livello z ero del manome tro, come illus trato nella f igura 12. In caso co ntrario, sol levare o
abbassare il manometro.
5. A questo pu nto il manomet ro è calibrato a l livello zero de lla bacinella d ’acqua. Fissar e o montare il man ometro al f ine di conser vare la
posizione di riferimento con la bacinella d’acqua.
IV. Pro cedura per il tes t
NOTA: durante il tes t la valvola deve e ssere immer sa nella baci nella d’acqua st erile. Il livell o zero del manom etro deve esse re allineato
esattamente con il livello del liquido della bacinella per ottenere risultati corretti.
1. C ollegare la val vola sterile d a testare all ’apparecchia tura steril e assemblata p er il test.
2. G irare il rubi netto d’arre sto come illus trato nella f igura 14 e riemp ire il manomet ro almeno fin o a 30 cm di H2O.
3. G irare il rubi netto d’arre sto in modo da is olare il manom etro dal perco rso del flu sso, come illus trato nella f igura 13.
4. E spellere co mpletament e ogni residuo d ’aria dalla valvo la e dall’appare cchiatura as semblata per i l test facend ovi scorrer e con
delicatezza l’acqua sterile della siringa.
5. C on delicatez za, far scor rere il flus so d’acqua ster ile attraver so la valvola, s ervendosi d ella siringa.
6. I mmergere la va lvola steril e nella bacine lla d’acqua steri le. Il connet tore di uscit a della valvola de ve essere sot to il livello de ll’acqua
per ottenere risultati corretti.
7. C ontinuando a f ar scorrere c on delicatez za l’acqua att raverso la va lvola, girare i l rubinetto d ’arresto in mo do da isolare la si ringa
dal perco rso del flu sso, come illus trato nella f igura 15. In segui to al debito posi zionamento d el rubinet to d’arresto, la c olonnina
d’acqua del m anometro dov rebbe inizi are a scendere. A q uesto punto, qu indi, la sirin ga è isolata dall a valvola e non è più n ecessario
continu are a far scorr ere il liquido c on l’ausilio della s iringa. Se la co lonnina d’acqua n on scende, rip etere la proce dura dal punto 2 a l 7.
NOTA: attender e che il livello d ’acqua nel manome tro scenda per 2 m inuti o 2 minuti e m ezzo. Legge re il valore di pr essione che a ppare sul
manometro.
Risulta ti del test – Test pre-i mpianto
I valori di pressione ottenuti mediante questo metodo possono essere confrontati con le seguenti caratteristiche:
Livello prestazionale della valvola Range dei valori pressori accettabili
Livello 1 da 1 a 60 mm H2O a AP 0
Livello 1,5 da 35 a 95 mm H2O a AP 0
Livello 2 da 70 a 130 mm H2O a AP 0
Confezioni
I kit di derivazione Delta Medtronic Neurosurgery sono confezionati STERILI e NON PIROGENICI e sono esclusivamente monouso. NON
RISTERILIZZARE.
Il prese nte prodott o è esclusiva mente monous o. Non riutiliz zare, ripr ocessare o ri steriliz zare questo p rodotto. Ri utilizzar e, riproces sare
o rister ilizzare i l dispositiv o potrebbe com promette re l’integr ità strut turale e/o crea re un rischio d i contaminaz ione dello ste sso, con
conseguenti lesioni, malattie o decesso del paziente. Non utilizzare se la confezione è stata precedentemente aperta o danneggiata.
Medtronic Neurosurgery non è responsabile delle prestazioni di un prodotto risterilizzato.
Uno shunt completo richiede l’uso di un catetere ventricolare, di una valvola Delta Medtronic Neurosurgery e di un catetere cardiaco/
peritoneale o di un catetere peritoneale.
Prodotti a ordinazione speciale
Se ques te Istruzio ni per l’uso sono a llegate a un pro dotto a ordin azione spec iale, vi potreb bero essere d elle diff erenze nelle c aratteris tiche
fisic he tra il prodo tto accluso e l a descrizio ne del prodot to riport ata in questo f oglietto i llustrati vo allegato alla c onfezione. Q ueste dif ferenze
non influiranno sulla sicurezza o sull’eff icacia del prodotto a ordinazione speciale.
61
Page 64

I prodotti a ordinazione speciale possono essere forniti sterili o non sterili secondo quanto indicato nell’etichettatura della confezione del
prodot to. I prodot ti non steril i devono esser e puliti e ster ilizzati pr ima dell’uso.
Controindicazioni
Astenersi dall’eseguire la derivazione di LCS nell’atrio destro, nella cavità peritoneale o in altre parti del corpo in presenza di infezioni in una
qualsiasi area in cui vanno impiantati i vari componenti dello shunt. Nelle suddette infezioni rientrano le infezioni a carico del cuoio capelluto e in
altri pu nti della cute a ttraver sati dallo shu nt, infezio ni a carico del le meningi e dei ve ntricoli ce rebrali, del p eritoneo e d egli organi in traperito neali
e retrop eritoneal i, della pleur a e del circolo em atico. La der ivazione di LC S è in defini tiva da evit are se è presen te un’infez ione in qualsia si area del
corpo. La derivazione è inoltre controindicata nell’atrio di pazienti affetti da cardiopatie congenite o da altri gravi disturbi cardiopolmonari.
Informazioni per il paziente
È respon sabilità de l medico infor mare il pazie nte e/o chi lo rappr esenta in mer ito alla deriv azione di LCS. Il m edico dovrà d escrivere l e
complic azioni asso ciate ai siste mi di shunt impia ntabili e illus trare poss ibili prodot ti e tratt amenti altern ativi.
Avvertenze e precauzioni
È necessario scegliere prodotto, misura, pressione o livello di prestazione adeguati a seconda delle necessità specifiche del paziente e in base
ai test di agnostici e a ll’esperienz a del medico. L’etichet ta del prodo tto specif ica i livelli e l e caratter istiche di re ndimento del p rodotto st esso.
Evitar e di mettere a co ntatto i pro dotti impia ntabili con f ilaccia, talc o per guanti, re sidui oleosi p rodotti dal l’epidermide, s aponi oleos i,
deterg enti sintetic i o altri conta minanti di sup erficie. F ilaccia, impr onte digital i, talco e altri m ateriali cont aminanti di su perfici e o residui di
guanti in l attice poss ono provoca re reazioni all ergiche o dov ute a corpi est ranei.
Prestare attenzione affinché contaminanti particellari non vengano introdotti nei componenti del sistema di shunt durante il test preimpianto o la manipolazione del sistema. L’introduzione di contaminanti potrebbe causare una prestazione inadeguata (iperdrenaggio
oppure i podrenaggi o) del sistema di sh unt. La prese nza di materia le partice llare nel siste ma di shunt può in oltre mantene re aperti i
meccanismi di controllo della pressione/flusso causando iperdrenaggio.
Nel fis sare i catete ri ai connett ori, le legatu re circolari d evono essere a llacciate in man iera salda, ma n on eccessiva mente stret ta, in modo ch e
non taglino il tubo in silicone.
Fare atte nzione a dispo rre i cateter i in modo tale da im pedirne lo st rozzamen to e l’abrasione l ungo il percor so. Il bordo del f oro di trapa no
regola re o praticato p er mezzo di un t rapano con pun ta elicoidale p uò essere ri filato ott enendo in tal mo do un intaglio s mussato nel pu nto in
cui il cat etere ventri colare fuor iesce e viene cu rvato per gi acere in posizi one adiacente a l cranio.
I pazien ti con i sistemi d i shunt per idro cefalo devon o essere tenut i sotto str etta osser vazione ne l periodo pos t-interve nto per rileva re
la prese nza di eventua li segni o sintom i che suggeri scano il malf unzionamen to dello shunt. I r eperti cli nici potrebb ero indicar e un
malfunzionamento dello shunt. I reperti clinici potrebbero indicare infezioni dello shunt, ipodrenaggio o iperdrenaggio di LCS.
L’occlusione può v erificar si in uno qualsi asi dei compone nti del siste ma di shunt. Il sis tema potrebb e occluders i internamen te a causa di
framme nti tessuta li, coaguli emat ici, aggrega ti di cellule tu morali, colon izzazion e batteric a o altri residu i. I cateteri c he entrano in co ntatto
con str utture cor poree inter ne possono st rozzarsi o o tturars i in prossimit à della punta (ad e sempio, coper tura della p unta di un catet ere
ventric olare nel ples so coroideo, o ppure coper tura della pu nta distale d i un catetere ne l grande omen to o nelle anse del l’intesti no). Infine,
l’occlusi one dello shunt p uò verific arsi a causa d ella cresci ta di un neonato o d i un bambino, o a ca usa di attiv ità fisich e risultanti n el distacco
dei componenti del sistema o nel ritiro di un catetere distale dal punto di drenaggio stabilito.
La coagulazione intorno alla sezione atriale del catetere potrebbe dar luogo a embolizzazione nell’albero arterioso polmonare provocando
cuore polmonare e ipertensione polmonare.
I componenti dello shunt distaccatisi potrebbero migrare e spostarsi ulteriormente nel cuore o nella cavità peritoneale.
I sistemi di shunt possono diventare inoperanti a seguito di malfunzionamento meccanico, causando iperdrenaggio o ipodrenaggio.
I catete ri di dimensio ne “piccola” hann o pareti più so ttili e minor e resistenz a complessiv a rispetto a i cateteri di di mensione “sta ndard”.
Sono stati segnalati dei casi in cui l’uso di cateteri peritoneali di dimensione “piccola” è risultato essere associato a un maggior tasso di
frattura rispetto ai cateteri peritoneali di dimensione “standard”. I medici che optino per l’impianto di cateteri peritoneali di dimensione
“piccola”, a pres cindere dal mo tivo (ad esempi o, per motivi es tetici), devono v agliare att entamente i be nefici in ra pporto al ri schio
potenzialmente superiore di necessità di revisione del catetere peritoneale.
Il malfunzionamento o l’occlusione del sistema di shunt può causare segni o sintomi indicativi di una aumentata pressione intracranica se
l’idrocefalo non riceve compensazione. Nei neonati, i sintomi più comuni sono un’aumentata tensione della fontanella anteriore, congestione
delle vene del cuoio capelluto, disattenzione, sonnolenza e irritabilità, vomito e rigidità della nuca. Nei bambini più grandi e negli adulti, i
sintomi comuni sono cefalea, vomito, offuscamento della vista, perdita di memoria, rigidità della nuca, deterioramento della coscienza e varie
manifestazioni neurologiche anomale.
L’iperdrena ggio di LCS può f avorire lo svi luppo di ematom a o igroma subdu rale o collass o delle pareti d ei ventricol i laterali con co nseguente
occlusi one del catet ere ventricol are.
Se il cate tere ventric olare si lega al pl esso coroid eo o al tessuto ce rebrale adiac ente mediante a desione al tes suto fibro so, si consiglia d i non
rimuove rlo con forz a. Si suggeris ce invece di ruot are delicatamente il cateter e per agevolar ne lo sblocco. Si r accomanda tut tavia di lasc iare
in posizione il catetere piuttosto di rischiare un’emorragia intraventricolare che potrebbe insorgere a causa della rimozione forzata.
Gli intr oduttori p er cateteri s ottocuta nei possono r ompersi sui pu nti di saldat ura o sui punti di a ssemblaggi o dei componen ti, oppure a cau sa
dell’est rema deform azione della gu ida flessi bile. Improv vise rottu re possono c ausare il trau ma di tessuti o d i organi e danneg giare il siste ma
di shunt. Occorre ispezionare gli strumenti prima dell’uso per assicurare integrità e funzionalità continue. Gli strumenti monouso non devono
essere m ai riutiliz zati in quanto c iò potrebbe c ausare lesi oni a carico de l paziente o del m edico.
Complicazioni
Le complicazioni associate alle derivazioni ventricoloatriali e ventricoloperitoneali di LCS potrebbero essere analoghe a quelle riscontrate
durante un qualsiasi intervento chirurgico eseguito sotto anestesia locale e/o generale. Tali complicazioni includono eventuali reazioni a
farmac i e agenti anes tetici, squi librio elet trolitico e u n’eccessiva per dita di sangu e, soprattu tto nel cas o di neonati. Mo lto raramente s i è
verif icato il caso i n cui il pazien te abbia una reaz ione dovuta a s ensibilità a ll’impiant o.
L’uso di liquidi non filtrati o non controllati per l’esecuzione dei test pre-impianto può causare il funzionamento anomalo della valvola con
conseguente necessità di revisione della medesima. I dispositivi devono essere manipolati esclusivamente in ambienti ospedalieri controllati
onde prevenire l’introduzione nella valvola di particelle, fibre o altri contaminanti.
62
Page 65

L’uso di strumenti affilati durante la manipolazione di questi dispositivi può incidere o tagliare l’elastomero siliconico causando perdite con
conseguente necessità di revisione della valvola. Occorre prestare attenzione quando si chiudono le incisioni per accertarsi che le valvole non
vengano ammaccate o tagliate dagli aghi da sutura.
In tutte le procedure di derivazione di LCS, le complicazioni osservate con maggior frequenza sono di norma imputabili all’occlusione
del sistema di shunt stesso, conformemente a quanto descritto nella sezione intitolata “Avvertenze e precauzioni” del presente foglietto
illustrativo accluso nella confezione del prodotto. L’occlusione può avvenire in qualsiasi componente del sistema, causata da frammenti
cerebr ali, coaguli di s angue e/o aggreg ati di cellule tu morali, in un pu nto qualunque d el percorso. L’occlus ione può verif icarsi an che a seguito
della separazione dei componenti del sistema o dello strozzamento e/o attorcigliamento del catetere. Ciò potrebbe facilitare lo spostamento
del cate tere ventrico lare nel ventr icolo lateral e e del cateter e distale nel c uore o nell’albe ro arterios o polmonare, n el peritone o o in altre
strut ture in cui il c atetere vien e impiantato. L a crescit a del neonato o de l bambino può f ar sì che il catet ere distale ve nga ritirato d all’atrio
nella vena giugulare interna oppure dal peritoneo negli strati dei tessuti dove il liquido non può essere assorbito.
Oltre ai tipi di occlusione dello shunt descritti in precedenza, sussistono ulteriori rischi di insorgenza di complicanze di entità potenzialmente
grave. Infezioni locali e sistemiche non sono infrequenti negli interventi di derivazione. Le infezioni sono causate il più delle volte da
organismi che abitano l’epidermide, in particolare lo Staphylococcus epidermidis. Tuttavia, altr i agenti patog eni present i nel circolo em atico
posson o formare col onie nello shun t; in tal caso, ne lla maggior par te dei pazie nti, lo shunt deve e ssere rimo sso.
Nel 1973 Robertson et al. riepilogarono l’incidenza di infezioni negli shunt ventricoloatriali e ventricoloperitoneali manifestatesi
fino a quel momento. L’incidenza di infezione negli shunt ventricoloatriali variava tra il 7 e il 31%. L’incidenza di infezioni negli shunt
ventricoloperitoneali si è verificata nel 5-10% dei pazienti nella maggior parte dei casi documentati. Dal momento che lo shunt
ventric oloatriale f avorisce la pr oliferazi one di batter i in altri orga ni del corpo, lo sh unt ventrico loperitone ale viene cons iderato meno
rischioso.
Recente mente (nel 1993) Kestle e t al. hanno ripor tato una rid uzione rilev ante delle inf ezioni (al di sot to del 4%) mediante l ’uso di antibio tici,
breve dur ata dell’in tervento chi rurgico (per e sperienz a del chirurg o) e controllo dell ’ambiente oper atorio (ad esem pio, sale oper atorie
dedica te, personal e e traffi co limitati, su perfic i cutanee cop erte). In tale ar ticolo gli aut ori affer mano che si poss ono ottene re gli stessi
risultati senza l’impiego di antibiotici, ma con un rigoroso controllo perioperatorio dell’ambiente.
La sommi nistrazio ne di antibiot ici a scopo pro filatti co ai pazienti c on shunt impian tato è un provv edimento piu ttosto cont roverso, in qua nto
tali farmaci possono far insorgere infezioni causate da organismi più resistenti. Pertanto la decisione di somministrare antibiotici profilattici
viene lasciata alla discrezione del medico e/o del chirurgo che ha in cura il paziente.
L’iperdrenaggio di LCS può comportare un’eccessiva riduzione della pressione di LCS e predisporre il paziente allo sviluppo di ematoma o
igroma subdurale, e un’eccessiva riduzione del volume ventricolare con conseguente occlusione causata dal ridossarsi delle pareti ventricolari
sui fori d’ingresso del catetere. Nei neonati, l’eccessiva riduzione della pressione causa una marcata depressione della fontanella anteriore, la
sovrapposizione delle ossa del cranio, con probabilità di trasformarsi in un idrocefalo ostruttivo.
Sono stati riportati casi di epilessia manifestatisi dopo l’esecuzione di procedure di derivazione ventricolare. Secondo quanto riportato,
l’incidenza degli attacchi epilettici aumenta in associazione a revisioni multiple di cateteri.
La deri vazione nel pe ritoneo può f allire a caus a di copertu re del cateter e nelle anse int estinali o nel g rande omento. È s tato docum entato un
caso di perforazione dell’intestino da parte del catetere peritoneale con conseguente sviluppo di peritonite.
Complicazioni associate agli strumenti
Fra le complicazioni direttamente associate all’uso dell’introduttore per cateteri sottocutaneo sono comprese la difficoltà di passaggio dello
strumento attraverso aree affet te da cicatrici e l’eventuale formazione di ematomi.
Restituzione
Ai fini dell’accettazione per la sostituzione o la concessione di un credito, i prodotti devono essere resi nella confezione originale chiusa,
con i sigil li della casa pr oduttri ce ancora intat ti, salvo la re stituzio ne sia dovuta al r eclamo di un dif etto del pro dotto o della s ua errata
etichettatura. La determinazione di difetto o errata etichettatura di un prodotto sarà stabilita dalla Medtronic Neurosurgery, la cui decisione
sarà da co nsiderarsi d efiniti va. I prodott i che siano rima sti in posse sso dell’acqui rente per un per iodo superi ore a 90 giorni n on saranno
accettati ai fini della sostituzione o della concessione di un credito.
Garanzia
A. Garanzia standard limitata. La Medtronic Neurosurgery garantisce all’utente finale/acquirente originale (“Acquirente”) che, al
momento della consegna all’Acquirente, il prodotto monouso impiantabile accluso (“Prodotto” ) acquistato dall’Acquirente è essenzialmente
esente da d ifetti ri spetto ai mat eriali e alla lavor azione. La Me dtronic Neu rosurgery n on rilascia a lcuna garanz ia (esplicita, i mplicita o
di legge) pe r Prodotti c he siano stat i modific ati (tranne i cas i espressam ente contempl ati nel prese nte documento) o ppure sotto posti a
eccezio nale stres s fisico, uso sc orretto o im proprio, neg ligenza, coll audo impropr io, uso insieme a p rodotti o co mponenti di versi da quelli
designa ti per l’uso con i Pr odotti, us o in qualsiasi man iera o proced ura medica no n indicata pe r i Prodotti.
B. Rimed io. In caso di violazione della garanzia sopra menzionata, l’unica ed esclusiva responsabilità a carico della Medtronic Neurosurgery
e l’unico ed esclusivo rimedio per l’Acquirente saranno, a scelta e discrezione esclusiva della Medtronic Neurosurgery, la sostituzione del
Prodot to, oppure la co ncessione all ’Acquirente di un c redito d’im porto equi valente alla so mma effet tivamente p agata per il Pro dotto,
ammess o che (i) la Medtro nic Neurosur gery venga av visata, pe r iscritto e d entro novant a (90) giorni dalla d ata di ricevi mento del Prod otto
da parte dell’Acquirente, che tale Prodotto non soddisfa i requisiti di garanzia, includendo una spiegazione particolareggiata in lingua
ingles e di tutti i dif etti asse riti; (ii) tale Pr odotto venga r eso alla Medt ronic Neuros urgery ent ro novanta (90) gi orni dal ricev imento F.O.B.
del Prod otto da part e dell’Acquiren te, all’indir izzo 125 Cremon a Drive, Golet a, Californ ia 93117, U.S.A. o secon do quanto altr imenti stab ilito
dalla Medtronic Neurosurgery; e (iii) la Medtronic Neurosurgery si ritenga ragionevolmente convinta dell’esistenza effet tiva della mancata
confor mità asseri ta. Fatto sal vo quanto espre ssamente pre visto in ques to paragraf o, l’Acquirente no n avrà dirit to alla resa dei P rodotti all a
Medtronic Neurosurgery senza la preventiva approvazione rilasciata per iscritto dalla Medtronic Neurosurgery.
C. Escl usione di al tre garanz ie. OLTRE ALLA GARANZ IA LIMITATA DI CUI ALLA SEZIONE (A) S OPRA RIPORTATA, LA MEDTRO NIC
NEUROSURGERY NON OFFRE ALCUN ALTRO TIPO DI GARANZIA O CONDIZIONE, ESPLICITA O IMPLICITA. LA MEDTRONIC
NEUROSURGER Y DISCONOSCE SPECIFI CATAMENTE LE GARANZIE I MPLICITE DI COMMERCIA BILITÀ O IDONEITÀ A UN UTILIZZO
PARTICOLARE . LA MEDTRONIC NEUR OSURGERY NON SI ASSUM E NESSUN’ALTRA RESPONS ABILITÀ, NÉ AUTORIZZ A NESSUN’ALTRA
PERSONA AD A SSUMERSELA A NOM E DELLA MEDTRONIC NE UROSURGERY, CHE INSORGA O S IA CONNESSA ALLA VE NDITA O ALL’USO DI
QUALSIASI PRODOTTO.
63
Page 66

64
Page 67

Delta shuntsett
14
12
10
52030
40 50
14
12
10
52030
140
40 50
Beskrivelse
Alle Medtronic Neurosurgery Delta-ventiler består av en membrantrykkventil i serie med en vannlåskontrollmekanisme som vanligvis er lukket.
Med denne kombinasjonen kan ventilen opprettholde det intraventrikulære trykket (IVP) innenfor et normalt fysiologisk område uavhengig av
kravene til pasientens CSV-flow eller kroppsposisjon. Flowkontrollen utføres ved kombinert motstand fra membranen og vannlåsmembranen.
Ventilens funksjonsegenskaper bestemmes av motstandsgraden. Retrograd flow forhindres av membranen. Vannlåseffekten kontrolleres av de to
vanligvis lukkede silikonelastomer-membranene i kontrollmekanismen i Delta-kammeret. Membranene åpnes ved positiv oppstrøms IVP.
Ventilen er tilgjengelig i størrelse liten og vanlig. Hver størrelse er tilgjengelig innen tre trykkområder: Funksjonsnivå 1, 1,5 og 2. Ventilens
funksjonsegenskaper vises i diagrammene (fig. 1a-b).
Sette t med større lse liten bes tår av en Delta -ventil, liten, m ed funksjo nsnivå 1, 1,5 eller 2. Se ttet med st ørrelse vanl ig består av en D eltaventil, va nlig, med funk sjonsnivå 1, 1,5 ell er 2. Begge set tene inklud erer et 23 cm vent rikulært b ariumimpr egnert kate ter med stan dard
diameter, samt et 90 cm kardialt/peritonealt bariumimpregnert kateter med standard diameter.
1a
0
0
0)
0
2
80
60
40
TRYKK (mm H
20
105
70
35
Funksjonsnivå 2,0
Funksjonsnivå 1,5
Funksjonsnivå 1,0
FLOWHASTIGHET (ml/t)
Alle Medtronic Neurosurgery-ventiler er testet for funksjonsegenskaper ved hjelp av et vannfylt testsystem på fremstillingstidspunktet. Alle ventiler må samsvare
med etikettspesifikasjonene for disse testene. Påfølgende testing av ventilen kan gi andre resultater, avhengig av testforholdene og ventilens tilstand. Testing på
fremstillingstidspunktet sikrer konsistent, høy kvalitet på alle Medtronic Neurosurgery-ventiler.
1b
0
0
0)
2
0
80
60
TRYKK (mm H
40
20
120
85
50
Funksjonsnivå 2,0
Funksjonsnivå 1,5
Funksjonsnivå 1,0
125
0 cm H2O HP*
90
MERKNAD: De angitte nivåene er
middelnivåer. Toleranseområdet for disse
middelverdiene er +/- 25 mm H20.
55
*Væsketrykk
105
70
- 50 cm H2O HP*
MERKNAD: De angitte nivåene er
middelnivåer. Toleranseområdet for disse
middelverdiene er +/- 40 mm H20.
*Væsketrykk
Norsk
FLOWHASTIGHET (ml/t)
Alle Medtronic Neurosurgery-ventiler er testet for funksjonsegenskaper ved hjelp av et vannfylt testsystem på fremstillingstidspunktet. Alle ventiler må samsvare
med etikettspesifikasjonene for disse testene. Påfølgende testing av ventilen kan gi andre resultater, avhengig av testforholdene og ventilens tilstand. Testing på
fremstillingstidspunktet sikrer konsistent, høy kvalitet på alle Medtronic Neurosurgery-ventiler.
Cerebro spinalvæske n flyter ut a v kateteret gj ennom fire s palteåpning er som er plass ert 90˚ fra hv erandre rund t kateteret s omkrets næ r den
distal e spissen (fi g. 8). Disse åpning ene er fremst ilt for å hindr e retrograd f low. De er ikke fr emstilt som t rykk/f low-kontr ollventiler, me n
gir en vis s motstand mo t flow. Maksim um motstan d mot flow med ko nstant fl owhastighe t på 20 ml/time er 2 ,0 cm H2O. Slisseåpningene er
belagt med grafitt under produksjonen for å minimere muligheten for sammenklebing av overflatene under oppbevaring.
Ventilene er fremstilt med en presisjonsformet, hard plastsokkel av polypropylen, innsatt i en myk, fleksibel silikonelastomerramme
med prof ilert bun n (fig 2). Sokkelen g ir strukt urintegri tet, pålitel ig trykk /flow og vann lås som forhi ndrer forv rengning og ve dheftin g av
ventilens sete og membran og vannlåsporter og membraner. Kuppelen er merket med radioopake tantal-impregnerte indikatorer som viser
funksjonsnivået og flowretningen.
Delta- ventilene har ko blinger som r eduserer mul igheten for lø sriving av ka teteret. Et t omsluttend e ligatur kre ves for å feste hv ert kateter t il
ventile n. Radioopake m arkører på hv er koblingsso kkel (fig. 2) gj ør det mulig for l egen å bruke rø ntgen til se kate trenes og ven tilenes rela tive
posisjoner in vivo når det brukes radioopake katetre.
65
Page 68

2
Innebygd inngangskobling
Silikonkuppel
Proksimal okkluder
Radioopake indikatorer for funksjon/flowretning
Reservoar
Distal okkluder
Delta-kammer
Innebygd
utgangskobling
Radioopak markør
Den radioopake koden 5på ventilen angir enhetens trykk/f low-egenskaper. 5tilsvarer funksjonsnivå 1,6tils varer 1,5 og7tilsvarer
funks jonsnivå 2. Kup pelen er konst ruert for i njisering el ler CSV-prøv etaking via e n 25 gauge nål elle r en mindre Hube r-nål (fig. 9). Det fa ste
underl aget av polypr opylen hindr er at ventil gje nnombores f ullstendig av n ålen. Delta -ventilen kan s kylles i både d istal og pro ksimal retn ing
med perk utant fin gertryk k. Okklude re finnes pr oksimalt og d istalt for d et sentrale re servoare t for å gjøre de t mulig å velge sk yllingsret ning.
Hard polypropylenplastsokkel
Ventil med silikonmembran
Flow-ytelsen til enheten påvirkes ikke av MR-undersøkelsen. Enheten trenger ikke testes eller justeres etter en MR-undersøkelse.
Indikasjoner
Medtro nic Neurosur gery Delt a-shuntse ttet er konst ruert for b ruk til shunti ng av CSV fra hje rnens latera le ventrikke l til hjertet s høyre
forkam mer eller peri tonealhule n. Delta-ven tilen minimer er også den bet ydelige re duksjonen i IV P og volum som kan o ppstå på gr unn av stor
CSV-dr enasje som igj en kan være et re sultat av vannl åseffek ten fra væsk etrykket i d et distale ka teteret. Vann låseffek ten er et feno men som
kan opps tå på grunn av hø yden på ventri kkelkatete ret i forhold t il distalka teteret (det vil s i om pasienten s itter, står ell er holdes opp e).
Bruksanvisning
Kirurgisk teknikk
Flere kirurgiske teknikker kan brukes ved plasseringen av Delta-ventilen. Den kirurgiske teknikken bestemmes av kirurgen.
Det anbe fales å plass ere ventilen i en k irurgisk op prettet lø s lomme under ga lea mens kompre sjon av overlig gende kraniu m unngås og ikke
under kranieincisjonen. Ventilen kan festes til tilliggende vev ved å legge en sutur gjennom den polyesterforsterkede kragen.
Plasseringen av en Medtronic Neurosurgery Delta-ventil har innvirkning på den generelle shuntfunksjonen. Foramen Monroi er ett av de
etablerte null-referansepunktene for intrakranial trykkovervåk ning. Plassering av ventilen over dette referansepunktet vil gi generell økning
i flowmotstanden i shuntsystemet. Plassering av ventilen under dette referansepunktet vil gi en generell reduksjon i flowmotstanden i
3
10
shuntsystemet når pasienten sitter, står eller
holdes oppe. Disse endringene er direkte
proporsjonale med den lineære avstanden
(mm) over eller under referansepunktet.
Kirurgisk prosedyre
Plassering av ventrikke lkateter
Den rettvinklede klemmen på
4
7
CSV-flowkontrollventil,
Spiralborr- eller
trepanasjonshull
Rettvinklet klemme
Ventrikkelkateter
profilert
5
Borehull
Bøy kateteret,
skyv inn i
spalten på
fliken
Kranium
Til
ventrikler
Sutur
6
i den later ale ventrik kelen. Katete ret er pakket m ed stilet ten isatt i lu men.
Når katet eret er plasse rt i rikti g posisjon i vent rikkelen og s tiletten
er fjer net, tryk kes den ekst rakraniale d elen av kateter et inn i spalten
på rørs egmentet på k lemmen for å op pnå en rettv inklet bøy ing (fig.
5 og 6). Katete ret skal ikke st rekkes når de t trykkes in n i klemmen.
Hvis kate teret skal pla sseres i vent rikkelen gje nnom en rørf ormet
innsettingskanyle, må klemmen fjernes før kateteret settes inn
gjennom innføringskanylen. Den rettvinklede klemmen skal festes
til omlig gende vev ved å fø re suturer gj ennom de to sutu rhullene på
sidene av k lemmen (fig. 7 ).
Delta- ventilen kob les til det vent rikulære k ateteret ved å s ette den
innebygde polypropylenkoblingen inn i den ventrikulære kateterslangen.
Koblingen må være fullstendig dekket av slangen. Fest slangen til
koblingen med omsluttende ligatur. Forsiktighet må utvises slik at
ligatur en sørger fo r en godt fest et kobling, me n ikke kutter s langen.
ventrik kelkateter et (fig. 3) kan br ukes til å bøye
ventrikkelkateteret i en omtrent 90° vinkel
ved punk tet det komme r ut av spiralbo r- eller
trepan asjonshulle t (fig. 6). Klemm en kan brukes
som mark ør for den plan lagte dybde n for
kateterinnsettingen ved å skyve den i passende
lengde f ra den prok simale spiss en på kateter et
før inns ettingen (f ig. 4). Dette k an gjøres me d
stilet ten i katete ret. Stilet ten i rustf ritt st ål er
utfo rmet for å for enkle innfø ringen av kate teret
66
Page 69

En lomme må l ages un der gal ea med p assen de dyb de som v il romm e den ek str akra niale de len av ven trik kelka teter et og De lta-v entil en i shun tset tet .
Det anbe fales at imp lantasjon av de t ventrikul ære katetere t er det siste t rinnet i shun tingprose dyren. Det te reduser er tap av CSV un der kirurgi .
Plassere peritonealkateteret
Flere kirurgiske teknikker kan brukes ved plasseringen av distalkateteret i peritonealhulen. Plasseringsstedet velges etter kirurgens skjønn.
Kateter et er 90 cm langt m ed veggsliss er på den dist ale enden (fig . 8). Katetrene er ti lstrekkeli g lange til kard ial eller peri toneal plass ering
hos de fleste voksne personer. Kirurgen kan trimme den proksimale enden etter det valgte plasseringsstedet på operasjonstidspunktet.
Hvis slis sene i kateter veggen ikke ø nskes, kan den d istale enden b eskjæres. Å pningen i kate teret må kontr olleres før op erasjonen s tarter (se
Kontrollere shuntåpningen).
FORSIKT IG: DET KARDIALE /PERITONEALE K ATETERET SKAL IK KE PLASSERES ATRI ALT HVIS DISTALENDEN PÅ KATETER ET ER BESKJÆRT.
Medtronic Neurosurgery subkutane kateterinnfører til engangsbruk anbefales hvis en subkutant tunneleringsenhet er nødvendig for
plassering av det distale kateteret.
MERK: En kateterinnfører til engangsbruk følger ikke med Medtronic Neurosurgery Delta-shuntsettet.
FORSIKT IG: DÅRLIG RIVEFASTHE T ER EN KARAKT ERISTIKK FOR DE FLESTE IK KE-FORSTERKE DE SILIKONELASTO MER-MATERIALENE.
HÅNDTERING EN OG PLASSERING EN AV KATETERSLANGE N AV SILIKONELASTOM ER MÅ UTFØRES MED FOR SIKTIGHET FOR Å UNN GÅ
KUTT, HAKK ELLER R EVNER.
Injeks jon i ventilen
Medtro nic Neurosur gery Delt a-ventilen er f remstilt f or injiserin g eller CSV-pr øvetaking g jennom kupp elen med bruk av e n 25 gauge nål elle r
mindre Hu ber-nål (fig. 9).
FORSIKT IG: DÅRLIG RIVEFASTHE T ER EN KARAKT ERISTIKK FOR IKKEFORSTERKEDE SILIKONELASTOMER-MATERIALENE. UTVIS FORSIKTIGHET VED
INNSETTI NG OG FJERNING AV NÅLEN.
Nålen må in nsettes i en v inkel som ikke er s tørre enn 45° i fo rhold til kr aniet eller
ventilsokkelen. Hvis ventilen skal punkteres flere ganger, anbefales det at nålen
sette s inn på forsk jellige sted er for å unngå f lere
punkt urer på samme s ted på kuppel en. Kateter slangen,
okkludere og vannlåsmembraner skal ikke brukes som
injeksjonssteder.
FORSIKTIG: VANNLÅSDELEN AV DENNE ENHETEN
ER IKKE BEREG NET PÅ NÅLGJENNOMTREN GING.
PÅ GRUNN AV PLASSE RINGEN ER DET
USANNSYN LIG AT NÅLEN SETTES INN SLIK AT DEN
GJENNOMBORER TRYKK/FLOW-MEMBRANEN
ELLER VANNLÅSMEMBRANEN. GJENNOMBORING
AV MEMBRANEN PÅVIR KER VENTILENS
FUNKSJONSEGENSKAPER OG ØDELEGGER
SHUNTSYSTEMET. FORSIKTIGHET MÅ UTVISES SLIK
AT DETTE IKKE SK JER.
Skylle ventilen
Et perku tant tryk k på ventilkupp elen med fi ngeren
vil tvinge cerebrospinalvæske ut av ventilen både i
proksimal og distal retning. Hvis skylleretning velges,
må man tr ykke ned og okk ludere enten d en proksima le
eller distale okklusjonsdelen på ventilen med perkutant
fingertryk k og deretter trykke inn ventilkuppelen
(fig. 10). Det te gjør at væs ken renner i mot satt retni ng
av den okk luderte sid en av ventilen. Hv is det ikke er
merkbar motstand mot kuppelkompresjonen, kan
kateter et som skyll es være blokke rt.
FORSIKTIG: DET KAN OPPSTÅ SHUNTOBSTRUKSJON
I ALLE KOMPONEN TENE I ET SHUNTSYS TEM. DETTE
BØR DIAGNOS TISERES VED KLINISK E FUNN OG
DIAGNOSTISK TESTING. DET ER MULIG AT VENTILENS
SKYLLE EGENSKAPER IKKE E R TILSTREKKELIG E TIL
Å DIAGNOSTIS ERE OKKLUSJON AV K ATETRENE. SE
AVSNITTET ADVARSLER.
Trykk ned ventilkuppelen
Skylleretning
25 gauge eller mindre nål
Trykk ned okkluder
Utgang
10
11
Kontrollere shuntåpningen
Ventil:
a. Legg inngangskoblingen på ventilen i sterilt,
isotonisk saltvann.
b. Trykk ned og sl ipp opp ventil ens sentrale
reservoardel gjentatte ganger inntil
væske st rømmer ut av utg angskoblinge n.
Ventilen er å pen hvis væske n renner ut av
utgangs koblingen hver g ang det sentr ale
reservoaret trykkes ned (fig. 11).
FORSIKTIG: HVIS PARTIKLER TILFØRES
TESTOPPLØ SNINGEN, KAN DET TE INNVIRKE PÅ
TESTRESULTATENE OG PRODUKTFUNKSJONEN.
Inngang
Pump kuppel
Væskenivå
Steril isotonisk væske
8
9
67
Page 70

FORSIKT IG: VÆSKE SKAL IKKE A SPIRERES GJENNO M SHUNTEN FRA DEN DISTALE K ATETERENDEN. DET TE KAN FØRE TIL SK ADE PÅ
MEDTRONIC NEUROSURGERY DELTA-VENTILEN.
FORSIKT IG: STORT SKYL LETRYKK KAN FØR E TIL MIDLERTIDIG MISDAN NELSE AV FLOWKONTROLLVENTILE NS MEMBRAN OG GI
UNORMALT LAVE TRYKK/FLOW-TESTRESULTATER.
FORSIKT IG: HVIS HÅNDTERING AV DELTA-K AMMERET ER NØDVEN DIG, MÅ HANSKER BRUK ES OG ENHETEN MÅ KUN H OLDES I
MEMBRANE NE MED FINGRENE. TRYK K MÅ IKKE TILFØRES DEN Y TRE KANTEN. UKO RREKT HÅNDTERIN G AV DELTAK AMMERET KAN
ØDELEGGE SHUNTSYSTEMETS INTEGRITET.
Kardialt/peritonealt kateter:
Åpninge n i kateteret må k ontrollere s før operasj onen start er. Kontroll av åpn ingen inklud erer en visuell k ontroll for å b ekrefte at a lle
slisseåpningene tillater CSV-flow.
1. Sett inn e n butt 17 gauge nål i de n åpne proks imale enden på k ateteret og sk yll det med et l ett sprøy tetrykk m ed sterilt, f ysiologi sk
saltvann.
2. Hold øye me d
slisseåpningene
nær den dis tale
enden. Væs ken skal
passer e gjennom alle
åpninge ne, og de skal
være åpn e i sin fulle
lengde.
3. Rull katete rveggen
forsiktig mellom
tommel og pekefinger
for å åpne s lissene hvis
de ser ut ti l ikke å være
helt åpne.
4. Jevn ut kate tervegge n
med tomm el og
pekef inger slik at
slisseåpningene er i
lukket po sisjon ette r
passeringstesten.
Manometerdeksel
(frakoblet)
Sprøytefilter
Sprøyte
Førimplantasjonstest
Alle Delt a-ventiler e r individuel t testet for å si kre at de sams varer
med fun ksjonsege nskapene på e tiketten. Se lv om det ikke er mu lig å
kontrollere ventilens dynamiske funksjonsegenskaper med en statisk test i
operasjonsrommet kan kirurgen kontrollere at Delta-ventilen samsvarer med
Medtronic Neurosurgerys spesifikasjoner før implantasjon. Følgende test kan
utføres før implantasjonen i operasjonsrommet.
FORSIKT IG: PÅSE AT STERILITETEN OPPR ETTHOLDES OG AT MAN
UNNGÅR PARTIKKELKONTAMINERING.
MERK: Delta- ventilen skal t estes alene. D en skal ikke kobl es til katetr ene
i settet.
1oz
B-D
30
Stoppekran
3/4
Manometer
1/4
1/2
35
30 cm
34
33
Silikonslange
3
2
1
0
0 cm
-1
(Korrekt
-2
manometer-
-3
innstilling)
510152025
O
F
F
Koble til produktet her
-3
Fra sprøyte
10
1/4
5
F
F
O
Av
Til ventil
Testmetode
I. Nødvendig testutstyr
1. Sterilt væskereservoar eller sterilt vannbad
2. 1 s terilt 30 cm va nnmanometer, gr adert i centi meter
3. 1 t reveis stop pekran (skal br ukes med mano meteret)
4. 1 s teril sprø yte, 30 ml
5. 1 s terilt 5 µ sprø ytefil ter
6. 1 steril hann-luerkobling
7. Steril silikonslange
II. Oppset t av utstyr
1. F jern kuppel en fra manome teret. Set t opp manomete r, stoppekran
og vannb ad slik at nullniv ået på manome teret og væske nivået i
vannbad et har samme hø yde (fig. 12). (Fest ma nometeret ti l et
IV-stativ.)
2. F yll sprøyt en med steril t vann ved å bruke 5 µ sp røytef ilter. (Bruk 5 µ
sprøy tefilter hv er gang sprøy ten fylles .) Når sprøyte n er fylt, fj ernes
sprøytef ilteret.
3. Koble til sp røyten, mano meteret og si likonslangen s om vist i
figur 12.
4. Tøm all luft f ra det monter te, sterile te stappara tet ved å vri
stoppe kranen som vi st i figur 13.
5. Legg siliko nslangen i det s terile vannb adet og skyl l med sterilt v ann
fra sprøyten.
III. Kalibrere utstyret
1. Vri stoppe kranen som vi st i figur 14 og f yll manomet eret til minst
5 cm H2O.
Fra sprøyte
1/4
10
1/4
10
5
5
-3
Til manometer
F
F
O
Av
-3
Fra manometer
O
F
F
Av
Til ventil
Regulator
for
konstant
vannbad
12
13
14
15
68
Page 71

2. M ens silikonsla ngen ligger i va nnbadet, vr is stoppekr anen for å isol ere sprøyt en fra manome teret (fig. 15).
3. La vannsø ylen i manomet eret falle.
4. Vannsøyle n skal stoppe p å nullnivået p å manometere t, som vist i f igur 12. Hvis den ikk e gjør det, må ma nometeret he ves eller senke s
til det passer.
5. Manomete ret er nå kalibr ert til nulln ivået i vannba det. Fest ell er monter manom eteret for å ho lde referan seposisjon en i forhold ti l
vannbadet.
IV. Testprosedyre
MERK: Under tes ting må ventil en ligge i det ste rile vannbad et. For å oppnå r iktige res ultater må null nivået på mano meteret vær e riktig
innstilt mot væskenivået i vannbadet.
1. K oble den steri le ventilen so m skal testes t il det sammenk oblede, ster ile testapp aratet.
2. Vr i stoppekr anen som vist i f igur 14 og fyl l manometere t til minst 30 cm H2O.
3. Vr i stoppekr anen for å isol ere manomete ret fra flow banen som vis t i figur 13.
4. Tøm a ll luft fra ve ntilen og det m onterte tes tapparate t ved å skylle fo rsiktig me d sterilt van n fra sprøy ten.
5. S ett i gang en fo rsiktig f low gjennom v entilen med s terilt vann fr a sprøyten .
6. L egg den steri le ventilen i de t sterile vann badet. For å opp nå riktige t estresult ater må utgang skoblingen på v entilen ligge u nder
vann.
7. M ens man forsi ktig oppre ttholder f low gjenno m ventilen, vri s stoppekra nen for å isole re sprøyte n fra flowb anen som vist i f igur 15.
Når stop pekranen er s att i rikti g posisjon, ska l vannsøyle n i manometere t begynne å fal le. Sprøyte n er nå isolert f ra ventilen o g det er
ikke leng er nødvendig å o pprettho lde kontinue rlig flow me d sprøyten. H vis vannsøy len ikke faller, må t rinnene 2 til og m ed 7 gjentas .
MERK: La vanni vået i manomete ret falle i 2 til 2 ½ minutter. Les t rykkres ultatet på man ometeret.
Testresultater – Før-implantasjonstest
Resultatene fra trykkavlesningen fra denne metoden kan sammenlignes med følgende egenskaper:
Ventilens funksjonsnivå Ak septable trykkområder
Nivå 1 1 til 60 mm H2O ved 0 HP
Nivå 1,5 35 til 95 mm H2O ved 0 HP
Nivå 2 70 til 130 mm H2O ved 0 HP
Levering
Medtronic Neurosurgery Delta-shuntsett er pakket STERILE og IKKE-PYROGENE og er ber egnet på engangsbruk. MÅ IKK E
RESTERILISERES.
Det vedla gte produk tet er utfor met for bruk p å kun én pasient . Dette prod uktet skal i kke gjenbruk es, reprose sseres eller r esterilis eres.
Hvis pro duktet gje nbrukes, rep rosessere s eller reste riliseres, k an produkt ets struk turelle inte gritet ødel egges og/elle r utgjøre en
kontami nasjonsrisi ko som kan føre t il skade, sykdo m eller død for p asienten. Må ik ke brukes hvis em ballasjen tid ligere har vær t åpnet eller e r
skadet. Medtronic Neurosurgery er ikke ansvarlig for funksjonen til noe produkt som har blitt resterilisert.
En komple tt shunt skal b estå av et vent rikkelkate ter, en Medtroni c Neurosurge ry Delta-v entil og et kard ial-/perito nealkateter e ller et
peritonealkateter.
Spesialbestilte produkter
Hvis denn e bruksanv isningen leve res med et spe sialbestil t produkt, k an det være fy siske forsk jeller mellom d et vedlagte pr oduktet
og produ ktbeskr ivelsen i det te paknings vedlegget. D isse forsk jellene vil ik ke ha innvirkni ng på sikkerhe ten eller ef fektivi teten i det
spesialbestilte produk tet.
Spesial bestilte pr odukter kan l everes ster ile eller ikke -sterile. De tte angis på pr oduktet s pakkeetike tt. Ikke-s terile prod ukter må reng jøres og
steril iseres før br uk.
Kontraindikasjoner
Shuntin g av CSV inn i høyr e atrium, per itonealhule n eller andre omr åder i kroppe n må ikke utfø res hvis det er in feksjon de r de ulike
komponentene i shuntsystemet skal implanteres. Dette inkluderer infeksjoner i kraniet eller andre hudområder der shuntsystemet skal
passere, hjernehinne og cerebrale ventrikler, peritoneum og intraperitoneale og retroperitoneale organer, plevra og blodstrøm. CSV-shunting
er kontra indisert hv is det er infek sjon noe ste d i kroppen. De ssuten er shunt ing kontrain disert i for kammeret ho s pasienter me d medfødt
hjertesykdom eller andre alvorlige kardiopulmonære abnormaliteter.
Pasientinformasjon
Det er leg ens ansvar å inf ormere pasi enten og/eller r epresenta nten(e) deres om CS V-shunting. De tte må inklud ere en beskr ivelse av
komplikasjonene i forbindelse med implanterbare shuntsystemer og en beskrivelse av mulige alternative produkter og behandlingsformer.
Advarsler og forholdsregler
Passende produkt, størrelse, trykk eller bruksområde må velges i henhold til hver enkelt pasients behov basert på diagnosestillende
undersøkelser og legens erfaring. Produktetiketten spesifiserer det aktuelle produk tets funksjonsnivåer eller -områder.
Implanterbare produkter må ikke komme i kontakt med lo, hansketalkum, oljerester fra hud, oljebaserte såper, syntetiske rengjøringsmidler
eller andre kontamineringsmidler. Lo, fingeravtrykk, talkum, andre overf latekontaminanter eller rester fra latekshansker kan danne
fremmedlegemer eller allergiske reaksjoner.
Påse at partikkelkontaminanter ikke kommer inn i shuntkomponentene under førimplantasjonstesting eller -håndtering. Tilførsel av
kontaminanter kan forstyrre systemfunksjonen (over- eller underdrenasje) i shuntsystemet. Par tikler som kommer inn i shuntsystemet, kan
også holde trykk-/flow-kontrollmekanismene åpne og medføre overdrenering.
Når katet eret festes t il koblingen e, må ligaturen s om omgir katet eret festes g odt, men ikke f or stramt, el lers kan det ku tte gjenno m
silikonslangen.
Påse at inn føringen fo regår på en måte s om hindrer kn ekker og unødi g slitasje på k atetrene. Kan ten på spiralb or- eller trepa nasjonshulle t kan
trimme s til et skråka ntet hakk der ve ntrikkelka teteret komme r ut og det bøye s slik at det kan lig ge tett inn til k raniet.
69
Page 72

Pasienter med hydeocephalus-shuntsystemer må observeres nøye i den postoperative perioden for tegn eller symptomer som antyder shuntsvikt.
De kliniske funnene kan indikere shuntsvikt. Kliniske funn kan være indikasjon på shuntinfeksjon eller under- eller overdrenasje av CSV.
Shuntobstruksjon kan forekomme i alle komponenter i shuntsystemet. Systemet kan tilstoppes internt på grunn av vevfragmenter, blodklumper,
tumorcelleaggregater, bakteriekolonisering eller annet avfall. Katetre som kommer i kontakt med indre kroppsstrukturer, kan knekke eller
spisse ne kan bli blok kert (for ek sempel, kan sp issen på et ven trikkelka teter sett es inn i choroi dea plexus el ler spissen p å et distalt k ateter kan
sette s inn i bukhinn enettet el ler tarmsly ngene). Dessut en kan shuntob struksj on oppstå p å grunn av et spe dbarns eller e t barns vek st eller fy siske
aktiviteter som kan medføre frakobling av shuntkomponenter eller uttrekking av et distalt kateter fra det tiltenkte drenasjestedet.
Koagule ring rundt de n atriale dele n av kateteret ka n føre til embo lisering av de n atriale dele n av pulmonalar terietre et og føre til co r
pulmonale og lungehypertensjon.
Frakoblede shuntkomponenter kan migrere inn i hjertet eller inn i peritonealhulrommet.
Shunts ystemer kan s vikte på gru nn av mekanisk s vikt og føre t il under- eller ov erdrenasje.
Katetr e med “små” størr elser har ty nnere vegger o g lavere genere ll styrke, sa mmenlignet m ed katetre av s tandardst ørrelse.
Det er rap portert a t peritoneal e katetre i st ørrelse “lit en” har en høyer e fraktur rate sammenl ignet med per itoneale kate tre i større lse
“standar d”. Leger som av gru nner implante rer peritone ale katetre i s tørrelse “små” (f.e ks. kosmet isk), bør oppveie f ordelene mot d en
potensielt høyere andelen av peritoneal kateterrevisjon.
Svikt el ler blokkeri ng i shuntsys temet kan før e til tegn eller s ymptomer på ø kt intrakr anialt try kk hvis hydroke fali ikke blir b ehandlet. Ho s
spedba rn er det vanlig å f inne økt sp enning i anter ior fontanel l, økt blodan samling i kran ievener, sløvh et, døsighet , irritabi litet, oppka st og
nakkestivhet. Hos eldre barn og voksne er de vanlige symptomene hodepine, oppkast, synsforstyrrelser, hukommelsestap, nakkestivhet,
bevissthetssvikt og varierende unormale nevrolo giske funn.
Overdr enasje av CSV ka n føre til pred isponering f or utvikli ng av subdural t hematom eller hy grom eller sam menfall av late rale
ventrikkelvegger som fører til blokkering av ventrikkelkateteret.
Hvis ventrikkelkateteret blir bundet til choroidea plexus eller tilleggende hjernevev ved sammenklebing av fibrøst vev, må ikke kateteret
fjern es med makt. Forsik tig rotasjon av kate teret kan være e n hjelp til å fje rne det. Det t ilrådes å la kate teret sitt e på plass i sted et for å
risiker e intraventr ikulær blødn ing som kan opps tå hvis katet eret fjern es med makt.
Subkutane kateterinnførere kan brekke i sammensveisinger eller koblingspunkter, eller på grunn av ekstrem deformering av det formbare
skaft et. Plutsel ig brudd kan me dføre traum e i vev eller organ er og skade på sh untsystem et. Instru menter må inspi seres før br uk for å sikre
kontinuerlig integritet og funksjonalitet. Engangsinstrumenter må aldri gjenbrukes. Dette kan potensielt skade pasienten eller legen.
Komplikasjoner
Komplikasjoner assosiert med ventrikuloatriale og ventrikuloperiotoneale CSV-shuntingsystemer kan ligne på komplikasjoner som kan
forekomme ved kirurgiske prosedyrer utført under lokal og/eller generell anestesi. Disse inkluderer reaksjoner mot medikamenter og
aneste simidler, elek trolyt tubalanse og s tort blod tap, spesielt h os spedbarn . En pasient vil s jelden ha reak sjoner på gru nn av sensitiv itet
overfor implantatet.
Bruk av uf iltrer te eller ukontr ollerte væ sker til før-i mplantasjo nstestin g kan medfør e ukorrekt v entilfunk sjon og kan nø dvendiggj øre revisjo n av
ventilen. Enhetene må bare brukes i kontrollerte sykehusmiljøer for å hindre inntrekking av partikler, fibrer eller andre kontaminanter i ventilen.
Bruken av sk arpe instr umenter ved hå ndtering av enh etene kan før e til hakk eller k utt i silikone lastomere t med lekkasje o g mulig
ventilr evisjon. Det m å også påses at v entilene ikke k uttes elle r skjæres av sut urnåler unde r sårlukning .
Ved CSV-shuntingprosedyrer er de vanligste komplikasjonene et resultat av obstruksjon av systemet som beskrevet under ”Advarsler og
forholdsregler” i dette produktets pakningsvedlegg. Obstruksjon kan forekomme i alle komponentene i systemet på grunn av blokkering av
hjernefragmenter, blodklumper og/eller tumorcelleaggregater i innføringsbanen. Obstruksjoner kan også oppstå på grunn av separasjon i
syste mkomponente ne eller knekk o g/eller kveil ing av katetere t. Dette kan p redisponer e for migreri ng av ventrikke lkateteret i nn i den laterale
ventrik kelen og det di stale katete ret inn i hjer tet og pulmonal arteriet reet, peito neum eller andr e struktu rer der katete ret implante res.
Spedba rnets eller b arnets vek st kan føre ti l at det distal e kateteret tr ekkes ut av atr ium og inn i den inte rne halsblod åren eller fr a peritoneum
og inn i vevp lan der væsken ik ke kan absorb eres.
I tillegg til shuntobstruksjonene nevnt ovenfor kan det forekomme andre potensielt alvorlige komplikasjoner. Lokale og systemiske
infek sjoner er ikke u vanlig i shunti ngsprosed yrer. De oppst år vanligvis p å grunn av organi smer som angri per huden, spe sielt staphylococcus
epidermidis. Andre pato gener som sir kulerer i blod strømmen ka n kolonisere s hunten og må fj ernes hos de f leste pasie nter.
I 1973 oppsummerte Robertson et al. insidensraten for infeksjoner i ventrikuloatriale og ventrikuloperitoneale shunter frem til den tid.
Insidensraten for infeksjoner i ventrikuloatrial shunting varierte fra 7 til 31 %. De fleste rapportene viste infeksjoner i ventrikuloperitoneal
shuntin g hos 5 til 10 % av pasien tene. Siden vent riculoatr ial shunting p redisponer er for spredn ing av bakter ier til andre or ganer, er
ventriculoperitoneal shunting betraktet som mindre farlig.
Kestle e t al. rappor terte nylig (1993) signi fikant red uksjon i inf eksjoner (und er 4 %) ved bruk av antib iotika, kor t operasjons tid (kirur gisk
erfaring) og kontroll av miljøet i operasjonsrommet (for eksempel designerte operasjonsrom, begrenset personell og trafikk, tildekking av
hudfl ater). Artikke len hevder at dis se resultat ene også kan op pnås uten bruk a v antibiotik a, men med stre ng perioper ativ kontroll a v miljøet.
Bruk av profylaktisk antibiotika på shuntpasienter er noe kontroversielt fordi bruken kan predisponere for infeksjon av mer motstandige
organismer. Bestemmelsen om bruk av profylaktisk antibiotika hviler derfor på praktiserende lege og/eller kirurg.
Overdr enasje av CSV ka n medføre sto r reduksjo n i CSV-tryk ket og predisp onere for ut vikling av sub duralt hemato m eller hygrom, i t illegg til
stor red uksjon av vent rikkelstø rrelse som f ører til obst ruksjon fo rdi ventrik kelveggene st øter mot innga ngshullene i k ateteret. Ho s spedbarn
kan stor trykkreduksjon medføre påvisbar fordypning i anterior fontanell, dominerende kranieben og kan endre kommuniserende hydrokefali
til obstruktiv hydrokefali.
Det har vært rapportert insidens av epilepsi etter ventrikulære shuntingprosedyrer. Denne studien indikerte også at anfallsinsidensen økte
ved flere kateterrevisjoner.
Shuntin g til periton eum kan mislyk kes fordi kate teret innfø res i sløyfe r i tarmer elle r i tarmnett et. Perfore ring av tarme n av
peritonealkateteret med påfølgende peritonitt har blitt beskrevet.
70
Page 73

Instrumentkomplikasjoner
Komplikasjoner assosiert med bruk av den subkutane kateterinnføreren inkluderer vanskeligheten med å sette inn instrumentet gjennom
arrvev samt mulig hematomdannelse.
Retningslinjer for retur av varer
For å få god kjent utsk ifting ell er kreditt m å produkte t returnere s i uåpnede pak ker med produs entens fors eglinger int akte, med min dre
det retu rneres for di produkte t er defekt e ller har feil eti kettering . Bestemmel sen om et produ kt er defek t eller har feil e tikett skal t as av
Medtro nic Neurosur gery, og den avg jørelsen vil v ære den endeli ge. Produkt er vil ikke bli go dtatt for ut skifti ng eller kredi tt hvis de har væ rt i
kunden s eie i over 90 dager.
Garanti
A. Standard begrenset garanti. Medtronic Neurosurgery garanterer overfor den opprinnelige kjøperen (”Kjøperen”) at det vedlagte
implant erbare prod uktet til eng angsbruk (”Pr odukt” ) som er kjøpt av K jøperen, er ve sentlig fri tt for defe kter i materia le og utføre lse på det
tidspu nktet det ble l evert til Kjø peren. Medt ronic Neuro surgery gir i ngen garanti er (uttryk te, underf orstått e eller lovbes temte) for Prod ukter
som er mod ifiser te (bortse tt fra de som e r uttryk kelig beskr evet heri) eller h ar gjennomgå tt uvanlig b elastning, m isbruk, fei l bruk, vanst ell,
feil tes ting, bruk t i kombinasjon m ed andre prod ukter eller ko mponenter enn d e Produkten e var beregne t på eller bruk t på en måte eller i e n
medisinsk prosedyre der Produktene ikke er indisert.
B. Rettsmiddel. Kjøperen s eksklusiv e rettsmid del, og Medtr onic Neurosu rgerys ene ste ansvar, for br udd på ovenst ående garant i skal være
at Medtr onic Neurosu rgerys kan i h enhold til sit t eget skjø nn, velge å erst atte Produ ktet eller kr editere Kjø peren for net tobeløpe t som faktis k
ble beta lt for et slik t Produkt, f orutsat t at (i) Medtroni c Neurosurge ry har fåt t skriftli g melding inne n nitti (90) dage r etter Kjøp eren har
motta tt Produk tet om at Produk tet ikke var i s amsvar med spe sifikasj onene, inklu dert en deta ljert fork laring på enge lsk om eventuel l påstått
manglende samsvar, (ii) skal dette Produktet returneres til Medtronic Neurosurgery innen nitti (90) dager etter Kjøperen mottok Produktet,
sendt F.O.B. til 125 Cr emona Drive, G oleta, Calif ornia 93117, USA eller e tter annen an visning av Medt ronic Neuro surgery, og (iii ) Medtronic
Neurosurgery er rimelig overbevist om at de påståtte manglende samsvarene faktisk eksisterer. Bortset t fra det som er uttryk kelig fremsatt
i dette av snittet, sk al Kjøperen i kke ha rett ti l å returnere P roduktene t il Medtroni c Neurosurge ry uten foru tgående skr iftlig sam tykke fra
Medtronic Neurosurgery.
C. Eksk lusjon av an dre garanti er. BORTSETT FRA D EN BEGRENSEDE GAR ANTIEN GITT I (A) OVENFO R, GIR MEDTRONIC
NEUROSURGERY INGEN ANDRE GARANTIER ELLER BETINGELSER, UTTRYKTE ELLER UNDERFORSTÅTTE, OG PRODUSENTEN FRASIER
SEG SPESIELT DE UNDE RFORSTÅTTE GARANTI ENE OG BETINGELSEN E FOR SALGBARHET OG EGN ETHET TIL ET SPESIELT FORM ÅL.
MEDTRONIC NEU ROSURGERY VERKEN PÅTAR SEG, ELLE R AUTORISERER NOEN ANN EN PERSON TIL Å PÅTA SEG NOE ANNET ANS VAR
SOM OPPSTÅR FR A ELLER I FORBINDELSE ME D SALG ELLER BRUK AV NOE PRODUK T.
71
Page 74

72
Page 75

Zestaw sztucznej przetoki Delta
14
12
10
52030
40 50
14
12
10
Opis
Każda zastawka Delta Medtronic Neurosurgery wyposażona jest w ciśnieniową zastawkę membranową ustawioną szeregowo z syfonowym
mechan izmem kontro lnym, któr y w prawidło wych warun kach znajdu je się w położe niu zamknię tym. Dzię ki takiemu po łączeni u możliwe jes t
utrzymanie stałego ciśnienia śródkomorowego (Intraventricular pressure, IVP) w zakresie wartości fizjolo gicznych niezależnie od wymagań
przep ływu p łynu mózgow o-rdzeni owego lub poz ycji ciała p acjenta. Kon trolę przep ływu z apewnia łąc zny opór mem branowej i sy fonowej
przes łony mechan izmu reguluj ącego. Chara kterys tyka wyda jności zas tawki zale żna jest od s topnia opor u. Membrana z apobiega pr zepły wowi
wstec znemu. Dzia łanie sy fonu regulu ją dwie przes łony z silikon u elastomer owego syst emu Delta, k tóre w prawid łowych war unkach znaj dują się
w położeniu zamkniętym. Przesłony otwierają się pod wpływem dodatniego, skierowanego wstecznie ciśnienia śródkomorowego.
Zasta wka dostępna j est w dwóch ro zmiarach: mał ym i standa rdowym. Ka żdy rozmiar za stawki dos tępny jest w tr zech zakre sach ciśnie ń:
poziom w ydajności 1, 1,5 i 2. Cha raktery stykę funkc ji zastawk i obrazują sc hematy (Ry s. 1a-b).
Zestaw o r ozmiarze mał ym zawier a małą zast awkę Delta o pozi omach wydaj ności 1, 1,5 i 2. Zestaw o r ozmiarze st andardowy m zawiera
standa rdową zast awkę Delta o pozi omach wydaj ności 1, 1,5 i 2. Obydwa ze stawy zawi erają impre gnowany barem c ewnik komorow y
o długo ści 23 cm o stan dardowej śred nicy oraz im pregnowany b arem cewnik se rcowo-otr zewnowy o dł ugości 90 c m o standardow ej średnicy.
1a
0
0
105
O)
2
0
80
60
40
CIŚNIENIE (mm H
20
70
35
Poziom wydajności 2,0
Poziom wydajności 1,5
Poziom wydajności 1,0
NATĘŻENIE PRZEPŁYWU (ml/go dz.)
Charakterystyka każdej zastawki produkcji Medtronic Neurosurgery testowana jest na etapie produkcji przy użyciu systemu wypełnionego wodą. Wszystkie zastawki
spełniają warunki specyfikacji weryfikowane przez te testy. Kolejne testy zastawki mogą dawać różne wyniki w zależności od warunków testu i stanu zastawki.
Testowanie na etapie produkcji służy zapewnieniu jednolitej, wysokiej jakości każdej zastawki produkcji Medtronic Neurosurgery.
125
0 cm H2O HP*
90
UWAGA: Pokazane poziomy stanowią
55
wartości środkowe. Zakres tolerancji wartości
środkowych wynosi +/- 25 mm H20.
*Ciśnienie hydrostatyczne
Polski
1b
40 50
140
105
70
- 50 cm H2O HP*
UWAGA: Pokazane poziomy stanowią
wartości środkowe. Zakres tolerancji wartości
środkowych wynosi +/- 40 mm H20.
*Ciśnienie hydrostatyczne
0
0
O)
2
0
80
60
40
CIŚNIENIE (mm H
20
Poziom wydajności 2,0
120
Poziom wydajności 1,5
85
Poziom wydajności 1,0
50
52030
NATĘŻENIE PRZEPŁYWU (ml/go dz.)
Charakterystyka każdej zastawki produkcji Medtronic Neurosurgery testowana jest na etapie produkcji przy użyciu systemu wypełnionego wodą. Wszystkie zastawki
spełniają warunki specyfikacji weryfikowane przez te testy. Kolejne testy zastawki mogą dawać różne wyniki w zależności od warunków testu i stanu zastawki.
Testowanie na etapie produkcji służy zapewnieniu jednolitej, wysokiej jakości każdej zastawki produkcji Medtronic Neurosurgery.
Płyn mó zgowo-rdze niowy wyp ływa z cew nika przez c ztery ot wory szcz elinowe, rozmi eszczone co 9 0˚ na obwodzie ce wnika w pobli żu
końcówk i dalszej (Rys. 8). Z adaniem otwo rów jest zabe zpieczen ie przed prz epływe m wsteczny m. Nie służą o ne jako zawory c iśnieniowe,
ani do kont roli przep ływu, st awiają natomia st niewielk i opór przep ływowi. Ma ksymalny o pór przepł ywu prz y stałej prę dkości prze pływu
wynos zącej 20 ml/godz . wynosi 2,0 c m H2O. W czasi e produkcji ot wory szc zelinowe są pok rywane g rafitem, co m inimalizuje s klejanie się
naciętych powierzchni podczas przechowywania.
Zastawki wyposażone są fabrycznie w precyz yjnie formowaną, twardą polipropylenową podstawę osadzoną w osłonie z gładkiego, giętkiego
elastomeru silikonowego z wypukłym dnem (Rys. 2). Podstawa zapewnia systemowi integralność strukturalną, stałość parametrów ciśnienia,
przep ływu i reg ulacji syf onu, zabezp iecza prz ed wygięci em lub zlepieni em się zastaw ki i membrany o raz portów i p rzesłon sy fonowego
mechanizmu regulującego. Kopuła oznakowana jest radiocieniującymi znacznikami impregnowanymi tantalem, które wskazują poziom
działania i kierunek przepływu.
73
Page 76

2
Zintegrowany łącznik
wlotowy
Silikonowa kopuła
Zaciskacz proksymalny
Cieniujące promienie rentgenowskie wskaźniki wydajności i
kierunku przepływu
Pojemnik
Zaciskacz dystalny
Komora Delta
Zintegrowany łącznik
wylotowy
Znacznik cieniujący w rtg
Twarda podstawa plastikowa z
polipropylenu
Zasta wki Delta zaw ierają złąc za ogranic zające możliw ość rozłąc zenia cewnika . Zabezpiec zenie poł ączenia każ dego cewnika z z astawką
wymag a założenia je dnej podwią zki okrężn ej. Radiocie niujące znac zniki na pods tawie każde go złącza (R ys. 2) pozwalaj ą na wizualiza cję
rentgen owską położ enia cewników i z astawki wz ględem innych s truktur w w arunkach in viv o, gdy używan e są radioci eniujące cewn iki.
Radiocieniujący kod5umi eszczony n a zastawce i nformuje o je j charakte rystyc e dotycz ącej ciśnień i p rzepły wu; liczb a5odpowiada poziomowi
dział ania 1, liczba6- poziomo wi działan ia 1,5, a liczba7- poziomowi działania 2. Kopuła umożliwia wykonywanie iniekcji lub pobieranie płynu
mózgowo -rdzeniowe go przy uż yciu cienk iej, niedrą żącej igł y o rozmiarz e 25 G lub mniejs zym (Rys. 9). Tward a podstawa w ykonana z po lipropylen u
zapobi ega całkow itemu wkłu ciu igły w z astawkę. Za stawkę Del ta można prze płukiw ać w kierunku p roksym alnym lub dys talnym stos ując ucisk
skóry palcem. Zaciskacze umożliwiające selektywne przepłukiwanie umieszczone są proksymalnie i dystalnie w stosunku do zbiornika środkowego.
Badanie m etodą rezon ansu magnet ycznego (RM) ni e wpływ a na parametr y przepł ywu urzą dzenia. Urz ądzenie nie wy maga testow ania ani
ponownej regulacji po przeprowadzeniu badania metodą rezonansu magnetycznego (RM).
Zastawka z membraną
silikonową
Wskazania
Zestaw sztucznej przetoki Delta Medtronic Neurosurgery został zaprojektowany do drenowania płynu mózgowo-rdzeniowego z komory
boczn ej mózgu do prawe go przedsio nka serca lub j amy otrzewne j. Ponadto zas tawka Delta m inimalizuje n admierną red ukcję ciśnien ia
iobjętości śródkomorowej wynikających z nadmiernego drenażu płynu mózgowo-rdzeniowego wywo łanego efektem syfonowym ciśnienia
hydrostatycznego w cewniku dystalnym. Efekt syfonowy może powstać pod wpływem uniesienia poziomu cewnika komorowego względem
cewnik a dystalneg o (np. gdy pacjent s iada, wstaje lu b pozostaje w p ozycji wyp rostowane j).
Instrukcja użytkowania
Technika chirurgiczna
Implant ację syste mu sztuc znej przeto ki Delta możn a osiągnąć sto sując szere g technik chi rurgiczn ych. Wybór te chniki zabi egu należy d o chirurga.
Zalec a się umieszc zenie zasta wki w wytw orzonej chi rurgiczn ie luźnej loży p od czepcem ś cięgnist ym, a nie pod naci ęciem w skórze , co
3
4
7
Otwór nawiercony lub
Zacisk prostopadły
Cewnik komorowy
Zastawka regulująca
mózgowo-rdzeniowego,
trepanacyjny
przepływ płynu
konturowana
10
5
Otwór
trepanacyjny
Zgiąć cewnik;
wprowadzić do
rowka zakładki
Czaszka
Do komór
serca
Szew
6
sztuc znej prze toki gdy pacj ent siedzi, s toi lub pozos taje w pozycj i
wyprostowanej. Zmiany te są wprost proporcjonalne do liniowej odległości
(mm) powyżej lub poniżej punktu odniesienia.
Procedura chirurgiczna
Umieszczanie cewnika komorowego
Zacisk p rostopad ły, znajdując y się na cewniku k omorowym (R ys. 3),
można wy korzyst ać do zagięc ia cewnika pod k ątem około 90 °
wmiejsc u jego wyjśc ia z otworu nawi erconego lub t repanacy jnego
(Rys. 6). Zac isk może być stos owany jako znac znik planowa nej
głębo kości umiesz czenia cewni ka. Funkcję tę uz yskuje się pr zez
przesu nięcie zaci sku o pożądaną o dległość o d proksym alnego
końca cew nika przed je go wprowadz eniem (Rys. 4). Możn a to robić
zmandr ynem umieszc zonym w cewni ku. Mandry n, wyprodu kowany
znierdze wnej stali, ma u łatwić wp rowadzenie ce wnika do komor y
boczn ej. Cewnik jes t pakowany z mand rynem umie szczonym w św ietle.
74
zabez pieczy pr zed uciskie m pokryw ającej
skóry g łowy. Zastaw kę można prz yszyć do
otaczającej tkanki pr zeprowadzając szwy
przez w zmacniany tk aniną polies trową
kołnier z.
Lokalizacja zastawki Delta Medtronic
Neurosurgery wywiera wpły w na ogólne
funkcjonowanie sztucznej przetoki. Otwór
Monro je st jednym z pr zyjętyc h zerowych
punktów odniesienia przy monitorowaniu
ciśnienia śródczaszkowego. Umieszczenie
zastawki powyżej tego punktu odniesienia
doprowadzi do sumarycznego wzrostu oporu
przep ływu w sy stemie sz tucznej pr zetoki.
Umieszczenie zastawki poniżej punktu
odniesienia doprowadzi do sumarycznego
obniżenia oporu przepływu w systemie
Page 77

Po umiesz czeniu cewn ika w odpowied niej pozycj i w komorze i usun ięciu mandr ynu, część ce wnika znajdu jącą się na zewn ątrz czas zki
należy w prowadzić w r ozdwojoną rur kowatą częś ć zacisku fo rmując zagię cie pod kątem p rostym (R ys. 5 i 6). Nie należy n aciągać cewni ka
po wprow adzeniu go w zac isk. Jeśli cew nik ma być umies zczony w komor ze przy uż yciu cylind ryczneg o intubatora, z acisk musi być w yjęty
przed w prowadzenie m cewnika pop rzez intuba tor. Zaleca się, by z acisk pros topadły by ł przymo cowany do prz ylegającyc h tkanek szw ami
prowad zonymi przez d wa otwory n a szwy znajd ujące się na bok ach zacisku (R ys. 7).
Aby poł ączyć zas tawkę Delta z ce wnikiem komo rowym, nale ży wprowad zić polipropy lenowy łąc znik zast awki do przewo du cewnika
komorowe go. Łączni k powinien znal eźć się całko wicie w obręb ie przewodu ce wnika. Połą czenia prze wodu z łączni kiem dokonać z a pomocą
podwią zki okrężn ej. Należy się u pewnić, że sze w stabilnie ł ączy eleme nty, ale nie prz ecina przewo dów.
Zewnątrzczaszkowy odcinek cewnika komorowego i zastawkę Delta należy umieścić w odpowiednio głębokiej loży pod czepcem ścięgnistym.
Zalec a się, aby wszcze pienie cewni ka komoroweg o było ostatn im etapem za biegu zakła dania sztuc znej przet oki. Postępo wanie takie
minimalizuje straty płynu mózgowo-rdzeniowego związane z zabiegiem.
Umieszczanie cewnika otrzewnowego
Umieszc zenie cewni ka dystalne go w jamie otr zewnej można uz yskać za pom ocą różnych me tod chirurg icznych. De cyzja o miej scu
umiesz czenia należ y do chirurg a. Cewnik ma 90 cm d ługości i z aopatrzony j est w szczel iny w ścianie koń cówki dysta lnej (Rys. 8). Dł ugość
cewnik a jest wyst arczając a do umieszcz enia go w sercu lu b otrzewnej u w iększośc i dorosłyc h pacjentów. Pod czas zabie gu chirurg mo że
przyc iąć bliższe z akończenie s tosownie do w ybranego m iejsca impl antacji. Jeś li szczeliny ni e są potrzeb ne, można prz yciąć dysta lną
końcówkę. W t rakcie zabie gu należy sko ntrolować dr ożność cewni ka (patrz: Ko ntrola drożn ości sztuc znej przet oki).
PRZESTR OGA: JEŚLI DYSTALNA KOŃCÓW KA CEWNIKA SER COWO/OTRZEWNOWEG O ZOSTAŁA PRZYCIĘ TA, NIE NALEŻY UMIES ZCZAĆ JEJ
W PRZEDSIO NKU.
Jeśli umi eszczenie c ewnika dys talnego wy maga zastos owania urzą dzenia
wyt warzające go podskórn e przejście, z aleca się uż ycie podskór nego prowad nika
jednorazowego użytku do cewników Medtronic Neurosurgery firmy Medtronic
Neurosurgery.
UWAGA: Pr owadnik jedn orazowego uż ytku nie je st dołąc zony do zestaw u
sztucznej przetoki Delta Medtronic Neurosurgery.
PRZESTROGA: CHARAKTERYSTYC ZNĄ CECHĄ
WIĘKSZOŚ CI MATERIAŁÓW WY KONANYCH Z
NIEWZMACNIANYCH ELASTOMERÓW SILIKONOWYCH
JEST MAŁ A WYTRZ YMAŁOŚĆ NA ROZDAR CIE.
PODCZ AS UŻYWANIA I UMI ESZCZANIA RURK I
CEWNIKA Z E LASTOMERU SILIKO NOWEGO NALEŻY
UWAŻAĆ, ABY N IE SPOWODOWAĆ PRZECIĘĆ , NACIĘĆ
LUB ROZERWANIA.
Igła o wymiarze 25 G lub mniejsza
Wstrzyknięcia do zastawki
Zastawka Delta Medtronic Neurosurgery pozwala na
wykonywanie iniekcji lub pobieranie płynu mózgowordzenio wego przez kop ułę przy u życiu cienk iej
niedrą żącej igły o r ozmiarze 25 G lu b mniejszej (R ys. 9).
PRZESTROGA: CHARAKTERYSTYC ZNĄ CECHĄ
MATERIAŁÓW W YKONANYCH Z NIEWZ MACNIANYCH
ELASTO MERÓW SILIKONOWYCH J EST MAŁA
WYTR ZYMAŁOŚĆ N A ROZDARCIE. IGŁĘ NALE ŻY
WPROWADZAĆ I W YKŁUWAĆ OSTROŻNIE.
Igłę nal eży wprowa dzać pod kątem n ie większ ym niż
45° w stosu nku do skóry gł owy lub pods tawy zast awki.
Jeżeli zastawka będzie nakłuwana kilkakrotnie, zaleca
się wprow adzanie ig ły w różne miej sca tak, aby un iknąć
kolejnyc h nakłuć w tym s amym punkcie. Nie należ y
wykony wać iniekcji d o przewodów ce wnika, zaci skaczy
ani w prze słony kontro lne syfon u.
PRZESTR OGA: NIE NALEŻ Y PRZEKŁUWAĆ IGŁĄ
SYFONOWEGO MECHANIZMU KONTR OLNEGO.
WPROWADZENIE IG ŁY DO SYFONU JEST MA ŁO
PRAWDOPO DOBNE ZE WZGLĘDU NA J EGO
UMIEJSCOWIENIE, NAKŁUCIE ZATEM MOŻE NASTĄPIĆ
W OBRĘBIE BŁONY REGULUJĄCEJ CIŚNIENIE/
PRZEPŁYW LUB K ONTROLNYCH PRZE SŁON SYFONU.
NALEŻY T EGO UNIKAĆ, PONIE WAŻ NAKŁUCIE BŁON Y
LUB PRZES ŁON MOŻE DOPROWADZIĆ D O ZABURZENIA
FUNKCJI ZA STAWKI I UKŁADU DRENU JĄCEGO.
Ucisnąć kopułę zastawki Ucisnąć zaciskacz
Kierunek przepłukiwania
Otwór wylotowy
10
11
Przepłukiwanie zastawki
Uciśnię cie kopuł y zastawki p alcem przez skó rę pacjenta
wymus i wypły w płynu mó zgowo-rdze niowego
zzasta wki zarówno w k ierunku pro ksymalny m, jak
i dysta lnym. Aby selek tywnie p rzepłuk ać zastawkę,
należy z amknąć czę ść zastawk i od strony zac iskacza
proks ymalnego lu b dystalneg o, stosując uci sk palcem
przez sk órę pacjenta , a następnie uc isnąć kopułę
zasta wki (Rys. 10).
Otwór wlotowy
Sterylny płyn izotoniczny
Uciskać wielokrotnie
(„pompować”) kopułę
Poziom płynu
8
9
75
Page 78

Spowodu je to przepł yw pły nu w kierunku p rzeciwnym d o zamknięte j części zas tawki. Znac zny opór napo tykany podc zas ucisku k opuły może
świadczyć o niedrożności przepłukiwanego cewnika.
PRZESTR OGA: ZABLOKOWANIE S YSTEMU SZTUCZ NEJ PRZETOKI MO ŻE NASTĄPIĆ NA KTÓRYM KOLWIEK JEJ ODCINKU. DI AGNOSTYK A
POLEGA NA ROZ POZNANIU OBJAWÓW KLIN ICZNYCH I WYKO NANIU TESTÓW DIAGNOS TYCZNYCH. PRÓ BA PRZEPŁUKIWANIA
ZASTAWKI NIE Z AWSZE WYSTARCZ A DO ROZPOZNANIA NIE DROŻNOŚCI CEWNIKÓW. ZOB ACZ CZĘŚĆ „OST RZEŻENIA”.
Kontrola drożności sztucznej przetoki
Zast awka:
a. Umieśc ić łącznik wl otowy zast awki w ster ylnym, izotoni cznym roz tworze soli f izjologi cznej.
b. Uciskać i zw alniać środko wy zbiorni k zastawki k ilkakrotni e aż do uzyska nia wypł ywu przez ł ącznik wy lotowy. Jeżel i każdemu
uciśnię ciu kopuł y towarzys zy wypł yw ciecz y z łącznik a wylotoweg o, świadcz y to o drożności z astawki (R ys. 11).
PRZESTR OGA: OBECNOŚĆ CZ ĄSTEK STAŁYCH W ROZT WORACH STOSOWANYCH D O TESTOWANIA MOŻE MIEĆ WPŁY W NA WYNIKI TES TU
I NA SPRAWNOŚ Ć PRODUKTU.
PRZESTR OGA: NIE ZASYS AĆ
PŁYNU POPRZE Z SZTUCZNĄ
PRZETOK Ę Z DYSTALNEGO
KOŃCA CEWN IKA. MOŻE
TO DOPROWADZIĆ D O
USZKODZENIA Z ASTAWKI
DELTA MEDTRONIC
NEUROSURGERY.
PRZESTROGA: NADMIERNE
CIŚNIENIE PODCZAS
PRZEPŁUKIWANIA
MOŻE SPOWODOWAĆ
CZAS OWE ODKSZTAŁCENIE
MEMBRAN Y ZASTAWKI
KONTROLUJĄCE J PRZEPŁYW
I PRZYC ZYNIĆ SIĘ DO
UZYSKANIA NIENORM ALNIE
NISKIEGO CIŚNIENIA LUB
NIEPRAWIDŁOWYCH
WYNIKÓW BADANIA PRZEPŁYWU.
PRZESTR OGA: JEŚLI NIE MOŻNA UN IKNĄĆ MANIPULOWANIA
KOMORAM I DELTA, NALEŻY JE TRZ YMAĆ TYLKO PALCA MI W
RĘKAWIC ZKACH W MIEJSCU, G DZIE UMIEJSCOWION E SĄ PRZESŁONY.
NIE UCISKAĆ Z EWNĘTRZNYCH KR AWĘDZI. NIEDOPOWI EDNIE
OBCHODZEN IE SIĘ Z KOMORAMI DELTA MOŻE SP OWODOWAĆ
USZKODZENIE SZTUCZNEJ PRZETOKI.
Zatyczka
manometru (odłączona)
Filtr do strzykawki
Strzykawka
B-D
Cewnik sercowy/otrzewnowy:
Podcz as zabiegu im plantacji nal eży sprawdz ić drożność ce wnika. Kontr ola
drożnoś ci obejmuje r ównież wzro kową ocenę wy pływu p łynu mózgo wordzeniowego przez wsz ystkie otwory szc zelin.
1. Wsunąć tępą ig łę, 17 G, w otwar te zakończen ie bliższe ce wnika i
przep łukać ster ylną solą f izjologic zną podawaną ze s trzykaw ki pod
małym ciśnieniem.
2. Obserw ować otwor y szczelin w po bliżu zakońc zenia dalsze go.
Wszys tkie otwor y powinny pr zepuszcza ć płyn i być ot warte na
całym swoim przebiegu.
3. Ostrożn e obracanie o bszaru ot worów szczel in cewnika mię dzy
kciukie m a palcem wskaz ującym uwol ni szczeliny, je śli wydają się
być nie ca łkowicie ot warte.
4. Po zakończ eniu sprawdz ania drożnoś ci, przetr zeć ściankę cew nika
kciukie m i palcem wskaz ującym, aby ot wory szc zelin zosta ły
zamkni ęte.
Ocena przed wszczepieniem
Każda za stawka Delt a jest indy widualnie te stowana, aby za pewnić
zgodność z charakterystyką wydajności przedstawioną w dokumentacji.
Weryfikacja dynamicznych parametrów wydajności zastawki przy użyciu
testu s tatyczn ego możliwego d o przeprowa dzenia w warun kach sali
operacyjnej nie jest możliwa. Niemniej jednak przed przystąpieniem
do implan tacji chiru rg może zwer yfikować zg odność zas tawki Delt a z
charak teryst yką podaną p rzez firm ę Medtronic N eurosurge ry. W warunkac h
sali ope racyjnej, p rzed implant acją, można pr zeprowadz ić następując y test.
UWAGA: NALEŻ Y DBAĆ O UTRZYM ANIE STERYLNOŚCI I U NIKAĆ
ZANIECZYSZCZEŃ CZ ĄSTKAMI STAŁYMI.
UWAGA: Na leży wykony wać kontro lę zastawki D elta, gdy nie j est ona
połąc zona z cewnik ami zestawu.
Manometr
35
30 cm
34
33
Przewód
3
silikonowy
2
1
0
0 cm
-1
(Prawidłowe
-2
wyrównanie
-3
poziomu
manometru)
1/4
1/2
3/4
1oz
510152025
30
O
F
F
Kranik
W tym miejscu podłączyć produkt
-3
Kierunek: od
strzykawki
1/4
5
10
Kierunek: od
strzykawki
1/4
5
10
F
F
Wył.
O
Kierunek: do zastawki
-3
Kierunek: do
manometru
F
F
O
Wył.
-3
Kierunek: od
manometru
1/4
O
F
5
10
F
Wył.
Kierunek: do zastawki
Kąpiel
wodna
o stałym
poziomie
12
13
14
15
76
Page 79

Opis testu
I. Wyposażenie wymagane do przeprowadzenia testu
1. S terylny poje mnik z płyn em lub stery lna kąpiel wod na
2. J eden ster ylny 30 cm manome tr wodny, wyska lowany w cm
3. J eden kranik t rójdrożny (do st osowania z man ometrem)
4. J edna stery lna strzy kawka, 30 ml
5. J eden ster ylny filtr 5 µm d o strzyk awki
6. J eden ster ylny łącznik m ęski typu L uer
7. S terylne pr zewody silikon owe
II. Konfiguracja sprzętu
1. Zdjąć zatyczkę manometru. Skonfigurować manometr, kranik i kąpiel wodną tak, aby poziom zerowy na manometrze i poziom płynu
w kąpiel i wodnej znajdo wały się na tej s amej wysok ości (Rys. 12). (Prz ymocować man ometr do stoj aka na płyn y dożylne).
2. N apełnić s trzykawk ę sterylną wo dą przez 5 µm f iltr do strz ykawki. (Pod czas ponow nego napeł niania str zykawki nal eży zawsze
stosow ać filtr 5 µm). Po nap ełnieniu s trzykaw ki, odłącz yć filtr.
3. Podłąc zyć strz ykawkę, manome tr i przewody s ilikonowe zgod nie ze schemat em na rysunku 12.
4. Aby odpowi etrzyć ur ządzenie tes tujące, należ y przekrę cić kranik zgo dnie ze schema tem na rysunk u 13.
5. Zanurz yć przewody si likonowe w ster ylnej kąpi eli wodnej i prz epłukać s terylną wodą z e strzyka wki.
III. Kalibracja urządzenia
1. Przekrę cić kranik zg odnie z rycin ą 14 i napełnić man ometr co najmn iej do 5 cm H2O.
2. U trzymuj ąc przewody si likonowe w peł nym zanurze niu w kąpieli wo dnej, przek ręcić krani k tak, aby odizo lować strz ykawkę od
manometru (Rys. 15).
3. Odczek ać, aż słup wod y w manometr ze opadnie.
4. Słup wod y powinien się z atrzyma ć na poziomie zer owym manome tru, zgodni e ze schematem na r ysunku 12. W prze ciwnym wy padku
należy odpowiednio unieść lub obniżyć manometr.
5. Na tym eta pie manomet r został skal ibrowany na poz iom zerowy ką pieli wodnej. U mocować manom etr tak, by zos tało utr zymane
położenie odniesienia względem kąpieli wodnej.
IV. Sp osób wykonan ia testu
UWAGA: Po dczas test owania zast awka musi pozos tawać zanur zona w stery lnej kąpiel i wodnej. Warunk iem uzyska nia prawidło wych
wyników jest właściwe ustawienie zerowego poziomu manometru względem poziomu wody w kąpieli wodnej.
1. Podłącz yć testowaną sterylną zastawkę do zmontowanego sterylnego urządzenia testującego.
2. P rzekręci ć kranik zgodn ie ze schemate m na rysunku 14 i nap ełnić mano metr co najmnie j do 30 cm H2O.
3. P rzekręci ć kranik tak, b y odizolować ma nometr od dro gi przepł ywu ciec zy, zgodnie ze sc hematem na ry sunku 13.
4. U sunąć całe pow ietrze z zas tawki i zmon towanego urz ądzenia tes tującego, ost rożnie prze płukując s terylną wod ą ze strzyk awki.
5. O strożnie w strzyki wać steryl ną wodę ze strz ykawki tak , by nastąpi ł przepł yw przez za stawkę.
6. Z anurzyć s terylną za stawkę w ster ylnej kąpie li wodnej. Warun kiem uzysk ania prawidł owych wyn ików testu jes t pełne za nurzenie
łącznika wylotowe go zastawki.
7. P odtrzym ując łagodny p rzepły w przez zas tawkę, przek ręcić krani k, by odizolowa ć strzyk awkę od drogi pr zepły wu cieczy, zg odnie ze
schema tem na rysunk u 15. Po ustawieniu k raniku we właś ciwym po łożeniu słu p wody w manomet rze powinie n zacząć opa dać. Na
tym et apie strz ykawka jest o dizolowana o d zastawki — ko ntynuacja p odawania cie czy ze str zykawki ni e jest już konie czna. Jeżel i
słup wo dy nie opadnie, n ależy powt órzyć eta py 2-7.
UWAGA: Na leży odcze kać 2-2,5 min, aż słu p wody w manomet rze opadnie. O dczyt ać wartość ci śnienia z manom etru.
Wyniki testu – Kontrola przed wszczepieniem
Otrzymane wartości ciśnienia można porównać z poniższ ymi parametrami:
Poziom wydajności zastawki Dopuszczalne zakresy wartości ciśnień
Poziom 1 1 do 60 mm H2O przy c iśnieniu hydr ostatyc znym równym 0
Poziom 1,5 35 do 95 mm H2O przy c iśnieniu hydr ostatyc znym równym 0
Poziom 2 70 do 130 mm H2O przy c iśnieniu hydr ostatyc znym równym 0
Sposób dostarczania
Zestaw y sztucz nej przetok i Delta Medt ronic Neuros urgery pako wane są w warun kach STERYLN YCH i NIEPIROGENNYCH i przezn aczone są
wyłą cznie do jednorazowego (tylko je den raz) użytku. NIE PO DDAWAĆ PONOWNEJ STERY LIZACJI.
Załąc zony produk t przeznac zony jest w yłącznie d o jednorazow ego użytk u. Tego produk tu nie należy p onownie uży wać, prz ystosowy wać
do ponownego użytku ani sterylizować. Ponowne użycie, ponowne przystosowanie do użytku lub ponowna sterylizacja mogą naruszyć
integr alność stru kturalną ur ządzenia i/ lub stwor zyć zagroże nie zaniecz yszczen ia urządzen ia, co może doprow adzić do obra żeń, choroby lu b
zgonu pac jenta. Nie st osować produ ktu, jeśli op akowanie nosi ś lady otwarc ia lub uszkodz enia. Firma Me dtronic Neur osurgery n ie ponosi
odpowiedzialności za funkcjonowanie jakiegokolwiek produktu, który został poddany ponownej sterylizacji.
W skład pe łnego zes tawu sztuc znej przet oki wchodzi c ewnik komorow y, zastawka D elta Medtro nic Neurosur gery i cewni k sercowy/
otrzewnowy lub otrzewnowy.
77
Page 80

Produkty dostarczane na specjalne zamówienie
Jeżeli ni niejsza Ins trukcja uży tkowania zos tała zał ączona do pro duktu wyk onywanego n a specjalne za mówienie, f izyczne pa rametry
produk tu zawart ego w opakowani u mogą różnić si ę od opisywa nych w tym doku mencie. Różni ce te nie wpły wają na bezp ieczeńst wo i
skuteczność produktu dostarczanego na specjalne zamówienie.
Produk ty na specja lne zamówien ie są dostar czane w pos taci stery lnej lub niest erylnej — st osowna infor macja znajdu je się na etyk iecie
informacyjnej produktu. Produkty niesterylne muszą zostać wycz yszczone i wyjałowione przed użyciem.
Przeciwwskazania
Nie należ y stosować d renażu pł ynu mózgowo- rdzenioweg o do prawego prz edsionka, ja my otrzewnej a ni innych okolic a natomicznyc h, jeśli
jest za każenie w któ rymkolwie k z obszarów, w k tóry zosta ną wszczepi one element y systemu sz tucznej pr zetoki. Dot yczy to np. z akażenia
skóry g łowy i innych ok olic skóry, prz ez które prz ebiega sys tem sztucz nej przetok i, opon mózgow ych, komory m ózgu, otrzew nej, narząd ów
położ onych wewnątr zotrzewno wo i pozaotrz ewnowo, opłu cnej i krwi. D renaż pły nu mózgowo- rdzeniowego j est przeci wwskaza ny w
przy padku zakaż enia w który mkolwiek mie jscu organiz mu. Ponadto, pr zeciwwsk azania obej mują drenaż do p rzedsionk a serca u pacje ntów z
wrodzo ną wadą serca lu b innymi poważ nymi zaburz eniami układ u krążenia i od dychania.
Edukacja pacjenta
Lekarz o dpowiada za u dzielenie pa cjentowi i/l ub przedst awicielowi(om) p acjenta info rmacji na tema t zabiegów z wiązanych z dr enażem
pły nu mózgowo-r dzeniowego. In formacja ta p owinna zawie rać opis powik łań związ anych z wszcze pianymi sys temami sztu cznej prze toki, a
także omówienie alternatywnych produktów i metod terapeutycznych.
Ostrzeżenia i środki ostrożności
Rodzaj p roduktu, r ozmiar, wartoś ci ciśnienia o raz zakres w ydajności m uszą być dopa sowane do potr zeb poszcz ególnych pac jentów
określanych na podstawie testów diagnostycznych i doświadczenia lekarza. Odpowiednie poziomy i zakresy wydajności produktu
wyszczególniono na etykiecie informacyjnej.
Należy u nikać kontak tu wszcze pialnych eleme ntów z włókie nkami tkanin, t alkiem z ręka wiczek, ole istą wydzi eliną grucz ołów skóry,
mydłami na bazie olejów, syntetycznymi detergentami lub innymi zanieczyszczeniami powierzchni. Włókienka tkanin, odciski palców, talk
i inne zan ieczysz czenia powie rzchniowe lu b pozostał ości z lateks owych rękaw iczek chir urgicznych m ogą wywo ływać rea kcje alergic zne lub
związ ane z obecno ścią ciała ob cego.
Należy d opilnować, b y podczas te stowania pr zed implanta cją lub manipul owania do eleme ntów systemu s ztuczn ej przetoki ni e dostał y
się cząsteczki stałe. Wprowadzenie takich zanieczyszczeń może doprowadzić do nieprawidłowego funkcjonowania (nadmiernego
lub niedo statecz nego drenażu) s ystemu sz tucznej pr zetoki. Cz ąstki sta łe wprowadzo ne do systemu s ztuczne j przetoki mo gą również
utrz ymywać w sta nie otwar tym jej eleme nty, które re gulują ciśnie nie i przepł yw, powodują c nadmierny dre naż.
Podwią zki okrężne m ocujące cewn iki do łączni ków należy za cisnąć mocno, a le nie nadmiern ie ciasno, aby z c zasem nie dos zło do przec ięcia
silikonowych rurek.
Cewniki n ależy ukła dać ostrożn ie, unikając za łamań i niepot rzebnych ot arć na ich przeb iegu. Na krawę dzi otworu n awierconego l ub otworu
trepan acyjnego, w mi ejscu gdzie ce wnik komorow y wyłania s ię i zagina, moż na naciąć skośny r owek, aby cewni k przylega ł ściśle do cz aszki.
Pacjenc i z systemami o dpływo wymi prz y wodogłowi u muszą podle gać ścisłej o bserwacj i w okresie poo peracyjn ym w celu rozpozn ania
oznak i obj awów wskazując ych na wadliw e działanie s ystemu. Obja wy klinic zne mogą wskaz ywać na złe f unkcjonowan ie systemu s ztucznej
przeto ki. Objawy k liniczne mo gą wskazy wać na obecno ść zakażenia l ub niedosta teczny lub nad mierny drena ż płynu móz gowo-rdzen iowego.
Niedroż ność może wy stąpić w każd ym z elementów s ystemu sz tucznej pr zetoki. Wnęt rze systemu m oże zostać za blokowane fr agmentami
tkanek, skrzepami krwi, skupiskami komórek nowotworowych, w wyniku kolonizacji bakteryjnej lub innymi zanieczyszc zeniami.
Wprzy padku cewnik ów pozostając ych w kontakc ie z wewnętrz nymi struk turami tkan kowymi może na stąpić zagi ęcie lub nied rożność
końcówek (np. g dy końcówka cew nika komorow ego zostani e wprowadzon a w splot nacz yniówkowy lu b końcówka obwo dowa uwięźni e w
sieci wi ększej lub pę tlach jelit a). Ponadto, niedroż ność syste mu sztucz nej przetok i może nastąp ić z powodu wzro stu dzieck a lub niemowlę cia
bądź na sk utek akty wności fi zycznej pr owadzącej do r ozłączenia e lementów lub pr zemieszc zenia dalszej c zęści cewn ika z zamierz onego
miejsca drenażu.
Obecn ość zakrzep ów wokół końc a cewnika znajd ującego się w pr zedsionku m oże prowadzić d o zatorowośc i tętnicy p łucnej, roz woju serca
płucnego i nadciśnienia w krążeniu płucnym.
Jeżeli do jdzie do rozłą czenia elem entów przeto ki, może nastą pić przemie szczenie el ementów do serc a lub jamy otrze wnowej.
Systemy sztucznej przetoki mogą działać wadliwie na skutek uszkodzenia mechanicznego, co prowadzi do niedostatecznego lub
nadmiernego drenażu.
Cewniki mniejszych rozmiarów mają cieńsze ścianki i niższą odporność mechaniczną w porównaniu z cewnikami standardowymi.
Cewniki o trzewnowe m niejszych r ozmiarów czę ściej ulegaj ą uszkodzeni om niż cewniki s tandardowe . Podejmując de cyzję o wszc zepieniu
cewnik a otrzewnowe go mniejszy ch rozmiarów (np. z p owodów kosmet ycznych) nale ży wziąć pod u wagę spodzi ewane korzy ści oraz
zagrożenie częstszymi rewizjami tych cewników.
Uszkodzenie lub niedrożność układu drenującego może wywoł ywać objawy wzmożonego ciśnienia wewnątrzczaszkowego, jeżeli
wodogłowie nie jest kompensowane. U niemowląt do częstych objawów zalicza się zwiększone napięcie ciemiączka przedniego, zastój
wżyła ch skóry głow y, spowolnieni e, senność, dr ażliwość, w ymioty i sz tywno ść karku. U sta rszych dz ieci i osób dor osłych c zęsto stwi erdza
się bóle głowy, wymioty, zaburzenia ostrości wzroku, zaburzenia pamięci, sztywność karku, zaburzenia świadomości oraz różnorodne
patologiczne objawy neurologiczne.
Zdrenowanie zbyt dużej ilości płynu mózgowo-rdzeniowego może predysponować do wystąpienia krwiaka lub wodniaka
podtwardówkowego bądź zapadnięcia bocznych ścian komory, prowadząc do niedrożności cewnika komorowego.
Jeżeli ce wnik komorow y uwięźnie w sp locie nacz yniówkowy m lub tkance móz gu przez zros ty łączn otkankowe, nie na leży wycią gać
cewnik a siłą. Ostrożne obróceni e cewnika może p omóc w uwolnie niu go. Jeżeli usu nięcie cewn ika wymaga uż ycia pewnej s iły, zalec a się
pozost awienie cewn ika na miejscu; w p rzeciwny m wypadku moż e dojść do krw otoku do komór mó zgu.
Podskór ne prowadnik i mogą ulec usz kodzeniu na zgr zewkach, w mie jscach poł ączeń podz espołów lub n a skutek znac znej deform acji
elast ycznego kor pusu. Nagłe z łamanie może sp owodować ura z tkanek lub org anów oraz uszk odzenie sys temu sztuc znej przeto ki. Przed
użyciem należy dokładnie skontrolować sprawność i integralność instrumentów. Nie wolno nigdy ponownie używać narzędzi jednorazowych;
w przec iwnym przy padku może doj ść do zagrożen ia dla zdrowia p acjenta lub lek arza.
78
Page 81

Powikłania
Powikła nia związa ne z użytkow aniem syste mów sztuc znych przeto k komorowo-p rzedsionko wych i komorow o-otrzew nowych mog ą być
podobn e do powikłań k ażdej operac ji przeprow adzanej w znie czuleniu mi ejscowym i/ lub ogólnym . Do powikłań t ych zalicz a się reakcje
na leki i sub stancje zni eczulając e, zaburzeni a równowagi el ektrolito wej i znaczną ut ratę krwi, z właszc za u niemowląt . W sporadycz nych
przy padkach może d ojść do reakcji n adwrażliwo ści na wszcz ep.
Używa nie niefil trowanych lub n ie skontrolow anych pły nów do testów pr zed implant acją może spowod ować niepraw idłową pracę z astawki
i koniec zność jej rew izji. Aby zapo biec wprowad zeniu do zast awki cząs teczek, w łókien lub inny ch zaniecz yszczeń, u rządzeń nal eży używ ać
tylko w kontrolowanym środowisku szpitalnym.
Używanie ostrych instrumentów w czasie posługiwania się elementami zestawu może spowodować nacięcie lub przecięcie silikonowego
elasto meru, w wynik u czego może na stąpić prz eciek wyma gający rewi zji zastawk i. Należy rów nież zachow ywać ost rożność prz y zszyw aniu
rany, aby nie pr zeciąć ani nie n aciąć zasta wek igłą.
Wśród wsz ystkich z abiegów wy twarz ania przetok p łynu mózg owo-rdzeni owego najczę strzym i powikłania mi są powikła nia spowodowa ne
niedroż nością sys temu, co opisa ne jest w częś ci „Ostrze żenia i środki o strożnoś ci” tej ulotki . Niedrożnoś ć, która może d otyczyć k ażdego
z element ów systemu, mo że nastąpić n a skutek zacz opowania fr agmentami tk anki mózgowej s krzepami kr wi i/lub sku piskami komór ek
nowotw orowych w kt órymś miejs cu na jego prz ebiegu. Nied rożność może r ównież być skut kiem rozłąc zenia elemen tów układu i/l ub
załam ania lub skręc enia cewnika. M oże to predysp onować do prze mieszcze nia cewnika kom orowego do świ atła komor y bocznej móz gu i
cewnik a dystalneg o do jam serca i od gałęzień tę tnicy płu cnej, otrzew nej lub innych s truktur zn ajdujących s ię w sąsiedz twie wszc zepionego
cewnik a. Wzrost niem owlęcia lub dz iecka może dop rowadzić do w ysunięcia d ystalnego c ewnika z prze dsionka ser ca do żyły s zyjnej
wewnęt rznej lub z otr zewnej do prz estrzeni t kankowych, w k tórych nie m a możliwości wc hłaniania p łynów.
Poza wyżej wymienionymi rodzajami niedrożności przetoki istnieją również inne, potencjalnie poważne komplikacje. Nierzadkim
powikł aniem proced ur z wytwo rzeniem ukł adu sztuc znej przeto ki są miejscow e i układowe zak ażenia. Najc zęściej są on e wywoł ywane prz ez
drobnoustroje kolonizujące skórę, zwłaszcza Staphylococcus epidermidis. Tym niemniej, istnieje możliwość kolonizacji innymi patogenami
obecny mi we krwi. W wi ększości p rzypadkó w konieczne j est wówcza s usunięcie ws zczepu.
W 1973 r. Robert son i wsp. pod sumowali cz ęstość wy stępowan ia wszyst kich opisa nych zakaże ń przetok kom orowo-pr zedsionko wych i komoro wootrzewnowych. Częstość występowania zakażeń przetok komorowo-przedsionkowych wynosiła 7–31%. W większości prac zakażenie przetok
komorowo-otrzewnowych stwierdzano u 5-10% pacjentów. Ponieważ wytworzenie systemu sztuc znej przetoki komorowo-przedsionkowej
zwięk sza ry zyko rozsi ewu bakter ii do innych nar ządów, uważ a się, że przeto ki komorowo -otrzew nowe są obarc zone mniej szym ry zykiem po wikłań.
Niedawn o (w 1993 r.) Kestle i wsp. wyk azali znac zący spade k zakażeń (pon iżej 4%) dzięki za stosowaniu a ntybioty ków, skróceniu c zasu
zabiegu chirurgicznego (doświadczenie chirurga) i kontroli środowiska sali operacyjnej (np. wyznaczenie specjalnej sali operacyjnej,
ograni czenie iloś ci ruchu i pers onelu, osła nianie powie rzchni skór y). W artykule s twierdzo no, że podobne w yniki można u zyskać bez u życia
antybiotyków, jedynie ściśle kontrolując otoczenie pacjenta w okresie okołooperacyjnym.
Celowoś ć profilak tyki anty biotykowej u p acjentów z sy stemami szt ucznych pr zetok jest dy skusyjna z uw agi na możliwoś ć rozwoju zak ażenia
szczep ami o zwięk szonej lekoo porności. W z wiązku z ty m decyzja o p rofilakt ycznym uż yciu antyb iotyków leż y w gestii lek arza prowad zącego
i/lub chirurga.
Nadmierny drenaż płynu mózgowo-rdzeniowego może powodować zbyt duże zmniejszenie ciśnienia płynu mózgowo-rdzeniowego i ryzyko
powst ania krwiak a lub wodniaka p odtwardó wkowego oraz zn acznego zm niejszenia w ymiarów komo ry i niedroż ności układ u w wyniku
zamkni ęcia otwor ów wlotowych c ewnika prze z ściany komor y. U niemowląt nad mierne obniż enie ciśnieni a powoduje wy raźne zapa dnięcie
ciemiączka przedniego oraz zachodzenie na siebie kości czaszki i może doprowadzić do przekształcenia się wodogłowia komunikującego
wwodogłowie niekomunikujące.
Opisy wano równie ż występow anie padacz ki po zabiega ch wytwo rzenia prze toki komorow ej. Wyniki wsp omnianego ba dania wskazu ją
równie ż, że częstoś ć występow ania napadów p adaczkowy ch rośnie w prz ypadku wie lokrotnych r ewizji cewni ka.
Wytw orzenie sys temu sztuc znej przet oki do otrzew nej może się nie p owieść na skut ek uwięźnię cia cewnika w pę tlach jelito wych lub siec i
więks zej. Istniej ą opisy perf oracji jeli ta, wywoł anej przez ce wnik otrzew nowy, prowadz ącej do rozwo ju zapalenia ot rzewnej.
Powikłania związ ane ze stosowanym sprzętem
Powikłania bezpośrednio związane ze stosowaniem jednorazowego podskórnego prowadnika cewnika obejmują utrudnione wprowadzanie
przy rządu prze z tkanki zmie nione blizno wato i ryzy ko wystąpi enia krwia ków.
Zasady z wrotu produk tów
Warunki em przyjęc ia reklamacj i i uzyskani a zamiany produ ktu lub zwr otu należno ści jest dos tarczenie p roduktu w ni eotwart ym opakowan iu
z nienaru szonymi plom bami produce nta. Nie dot yczy to prz ypadków rek lamacji z powod u wad wyrobu l ub błędneg o oznakowania pr oduktu.
Stwier dzenie wad wy robu lub błę dnego oznakow ania produk tu należy do f irmy Medtr onic Neurosu rgery. Dec yzja firmy m a charakter
ostate czny. Produk ty będące w po siadaniu klie nta przez po nad 90 dni nie pod legają wym ianie ani zwr otowi należno ści.
Gwarancja
A. Standardowa ograniczona gwarancja. Firma Medtronic Neurosurgery udziela gwarancji użytkownikowi końcowemu, nabywcy
produktu („Nabywcy”), że załączony produkt wszczepialny jednorazowego użytku („Produkt ”) zakupiony przez Nabywcę, w momencie
jego dos tarczenia d o Nabywcy je st zasadni czo wolny od wad m ateriałow ych i związ anych z wykonan iem. Gwaranc ja firmy Med tronic
Neurosurgery nie obejmuje (w formie wyrażonej, domniemanej ani ustawowej) Produktów, które zostały zmodyfikowane (z wyjątkiem
przypadków wyraźnie określonych w niniejszym dokumencie), poddane nadzwyczajnym obciążeniom fizycznym, były użytkowane
niezgo dnie z przezna czeniem, nie prawidłow o, bez zachowan ia należyt ej ostrożno ści, były ni eprawidłow o testowane, uż ytkowane w
połąc zeniu z produ ktami lub ele mentami inny mi niż te, do któr ych Produk t został pr zeznaczon y, lub w sposób niez godny ze wskaz aniami
bądź do procedur medycznych niezgodnych ze wskazaniami.
B. Środk i zaradcz e. Jedyne pra wo Nabywcy i w yłączn a odpowiedz ialność fi rmy Medtro nic Neurosur gery ogra nicza się do n aruszenia w arunków
niniejs zej gwaranc ji i skutkuje, zg odnie z wolą i de cyzją fi rmy Medtro nic Neurosur gery, wymi aną Produk tu lub zwrot em kosztów ne tto
poniesionych przez Nabywcę Produktu przy zachowaniu następujących warunków: (i) firma Medtronic Neurosurgery zostanie powiadomiona
pisemni e przed upł ywem dzi ewięćdzie sięciu (90) dni o d daty otrz ymania Prod uktu prze z Nabywcę, że Pr odukt jes t niezgodny z de klaracją, o raz
otrzyma szczegółowy opis domniemanych niezgodności sporządzony w języku angielskim, (ii) Produkt zostanie zwrócony do firmy Medtronic
Neurosu rgery w cią gu dziewięć dziesięci u (90) dni od daty o trzymani a Produkt u przez Naby wcę F.O.B. 125 Cremona Driv e, Goleta, Ca lifornia 93117,
U.S.A. lub inny adres wskazany przez Medtronic Neurosurgery; oraz (iii) Medtronic Neurosurgery stwierdzi i zaakceptuje, że opisane w reklamacji
niezgodności rzeczywiście istnieją. Za wyjątkiem sytuacji wyrażonych w postanowieniach powyższego paragrafu Nabywcy nie przysługuje prawo
do zwrotu Produktu do firmy Medtronic Neurosurgery bez uprzedniej pisemnej zgody firmy Medtronic Neurosurgery.
79
Page 82

C. Wykl uczenie in nych gwaran cji. Z WYJĄTKIEM OG RANICZONEJ G WARANCJI OPISANE J W PUNKCIE (A) FIRMA MEDTR ONIC
NEUROSURGER Y NIE UDZIELA ŻADN YCH INNYCH GWARANC JI LUB WARUNKÓW WYRA ŻONYCH LUB DOROZUMI ANYCH. PRODUCENT
ODRZUC A W SZCZEGÓLNOŚ CI GWARANCJE I WARUNK I PRZYDATNOŚCI HA NDLOWEJ I PRZY DATNOŚCI DO OKREŚLO NEGO CELU.
FIRMA MEDTRO NIC NEUROSURGERY NIE P ONOSI ODPOWIEDZI ALNOŚCI ANI NIE UPOWAŻ NIA ŻADNEJ INNE J STRONY DO PRZ YJĘCIA
ODPOWIEDZI ALNOŚCI Z TY TUŁU ALBO W ZWIĄZK U ZE SPRZEDAŻĄ LUB UŻ YTKOWANIEM JAKIE GOKOLWIEK PRODUKTU.
80
Page 83

Kit de derivação Delta
14
12
10
14
12
10
52030
140
40 50
Descrição
Cada válvula Delta Medtronic Neurosurgery contém incorporada uma válvula de pressão com uma membrana, colocada em série com um
mecani smo de contro lo com sifão no rmalmente fe chado. Est a combinaçã o permite que a v álvula mante nha a pressã o intraventr icular (PIV)
dentro d os valores f isiológic os normais, in dependent emente das nec essidades d e fluxo de LCR ou da p osição do co rpo do pacien te. O controlo
do flux o é conseguid o através da res istência co mbinada da mem brana e dos diaf ragmas de co ntrolo do sif ão. O grau de res istência de termina as
carac terístic as de desemp enho da válvul a. O fluxo ret rógrado é ev itado pela me mbrana. O efe ito de sifão é co ntrolado pe los dois diaf ragmas de
elastómero de silicone, normalmente fechados, do controlo com sifão Delta. Os diafragmas abrem em resposta a PIV ascendente positiva.
A válvula e ncontra-s e disponível e m dois tamanho s, o pequeno e o reg ular. Cada taman ho está dispo nível em três in tervalos de p ressão: Níve l
de desem penho 1, 1,5 e 2. As carac terístic as de desemp enho da válvula s ão apresent adas nos gráf icos (Fig. 1a-b).
O kit de tam anho pequeno é c omposto pel a válvula Delt a, de tamanho pe queno, com um nív el de desempen ho 1, 1,5 ou 2. O kit de taman ho
regular é c omposto pel a válvula Delt a, de tamanho re gular, com um nível d e desempenho 1, 1,5 ou 2. A mbos os kits i ncluem um cate ter
ventric ular com 23 cm, de d iâmetro pad rão, impregna do de bário e um ca teter cardía co/peritone al com 90 cm, de diâ metro padrã o,
impregnado de bário.
1a
0
0
105
O)
2
0
80
60
40
PRESSÃO (mm H
20
Nível de desempenho 2,0
Nível de desempenho 1,5
70
Nível de desempenho 1,0
35
52030
DÉBITO (m L/hr)
Na altura do fabrico, todas as válvulas Medtronic Neurosurgery são testadas relativamente às suas características de desempenho, utilizando um sistema de teste cheio
de água. Nestes testes, todas as válvulas cumprem as especificações da respectiva documentação. Os testes subsequentes efectuados à válvula podem fornecer resultados
diferentes, dependendo das condições dos mesmos e do estado da válvula. O teste efectuado na altura de fabrico serve para garantir uma qualidade consistente e elevada
de todas as válvulas Medtronic Neurosurgery.
40 50
125
0 cm H2O HP*
90
NOTA: Os níveis descritos são valores medianos.
O intervalo de tolerância dos valores medianos
é de +/- 25 mm H20.
55
*Pressão hidrostática
Português
1b
0
120
0
O)
2
0
80
60
40
PRESSÃO (mm H
20
85
50
Nível de desempenho 2,0
Nível de desempenho 1,5
Nível de desempenho 1,0
105
70
50 cm H2O HP*
NOTA: Os níveis descritos são valores medianos.
O intervalo de tolerância dos valores medianos
é de +/- 40 mm H20.
*Pressão hidrostática
DÉBITO (m L/hr)
Na altura do fabrico, todas as válvulas Medtronic Neurosurgery são testadas relativamente às suas características de desempenho, utilizando um sistema de teste cheio
de água. Nestes testes, todas as válvulas cumprem as especificações da respectiva documentação. Os testes subsequentes efectuados à válvula podem fornecer resultados
diferentes, dependendo das condições dos mesmos e do estado da válvula. O teste efectuado na altura de fabrico serve para garantir uma qualidade consistente e elevada
de todas as válvulas Medtronic Neurosurgery.
O líquido c efalorraq uidiano sai do c ateter atrav és de quatro abe rturas de r anhuras, sep aradas a uma dis tância de 90° e m volta da
circun ferência do c ateter pert o da ponta dist al (Fig. 8). Estas a berturas f oram concebi das para forn ecer protecç ão contra f luxo retróg rado.
Não fora m concebidas co mo válvulas de co ntrolo/pre ssão de flux o, mas oferecem u ma ligeira res istência ao f luxo. A resist ência máxim a ao
fluxo c om um débito cons tante de 20 mL /hora é de 2,0 cm H2O. As aber turas de ranh uras são reve stidas com gra fite duran te o fabrico pa ra
minimizar a possibilidade de adesão das superfícies das ranhuras durante o armazenamento.
As válvulas são fabricadas com uma base firme de polipropileno, moldada com precisão, envolvida num revestimento de elastómero de silicone,
macio e f lexível com u ma parte inf erior contor nada (Fig. 2). A base c ontribui pa ra a integrida de estrut ural, e fiabi lidade no cont rolo da press ão/
fluxo e d o sifão, evita ndo a distorç ão e a aderênci a do local da vál vula e da membra na, e das port as de controlo d o sifão e dos dia fragmas. A
cúpula e stá marcada c om indicado res impregn ados de tânta lo radiopaco, i ndicando o ní vel de desemp enho e a direcç ão do fluxo.
81
Page 84

2
Conector de entrada integral
As válvu las Delta cont êm conecto res concebido s para reduzi r a possibilid ade de separa ção do cateter. Pa ra fixar ca da um dos catete res à
válvula é n ecessária u ma ligadura ci rcundante. Os m arcadores r adiopacos e xistentes na b ase de cada con ector (Fig. 2) pe rmitem ao méd ico
visualizar in vivo, por int ermédio de ra diografi a, as posições r elativas dos c ateteres e da vá lvula, quando s ão utilizad os catetere s radiopacos .
O código radiopaco5exi stente na válvu la indica as ca racterís ticas de pre ssão/flu xo do dispositi vo;5corresponde a o nível de desem penho
1, 6ao nível de d esempenho 1,5 e7ao nível de d esempenho 2. A c úpula foi conc ebida para pe rmitir a injec ção ou a colheit a de amostra s de
LCR com uma ag ulha de calibr e 25 ou inferio r, não cortante (F ig. 9). A base de polip ropileno fi rme impede a p enetração c ompleta da vál vula
pela agul ha. As válvula s Delta podem s er irrigada s na direcção d istal ou prox imal através de p ressão perc utânea com os d edos. Os disp ositivos
de oclus ão localiza m-se numa pos ição proxima l e distal em rel ação ao reser vatório cen tral para fac ilitar a irr igação sele ctiva.
As cara cterísti cas de fluxo d o dispositiv o não são afeta das pelo exam e de RM. O disposi tivo não neces sita de ser tes tado ou reaju stado após o
exame de R M.
Cúpula de silicone
Dispositivo de oclusão proximal
Marcador radiopaco
Base firme em plástico de polipropileno
Indicadores radiopacos de desempenho/direcção do fluxo
Reservatório
Válvula da membrana de
silicone
Dispositivo de oclusão distal
Câmara Delta
Conector de saída integral
Indicações
Os kits de derivação Delta Medtronic Neurosurgery foram concebidos para serem utilizados na derivação de LCR do ventrículo lateral do
cérebro p ara a aurícul a direita do cor ação ou cavid ade periton eal. Adicional mente, a válvul a Delta minimi za a diminuiç ão excessiva d a PIV e do
volume em c onsequênci a de uma drenage m excessiva de LC R, o que pode ser p rovocado pel o efeito de sif ão da pressão h idrostáti ca do cateter
distal . O efeito de sif ão constitu i um fenómeno qu e pode ser cri ado pela elevaç ão do cateter v entricular r elativamen te ao cateter dis tal (ou
seja, quan do o paciente s e senta, levant a ou permane ce de pé).
Instruções de utilização
Técnica cirúrgica
Na coloc ação da deriv ação Delta po dem ser utili zadas várias t écnicas cir úrgicas. A e scolha da técn ica cirúrgi ca a ser utiliz ada deverá ser f eita
pelo cirurgião.
3
4
7
Orifício da broca de torção
Clipe em ângulo recto
Válvula de controlo do
fluxo de LCR com contorno
82
ou do trépano
Cateter ventricular
10
5
Crânio
Orifício de
trépano
Dobrar o cateter;
empurrar para
dentro
do sulco
da aba
Aos
ventrículos
Sutura
6
numa redu ção global da r esistência a o fluxo do sis tema de deriva ção
quando o pa ciente est á sentado, leva ntado ou perma nece de pé. Est as
alterações são directamente proporcionais à distância linear (mm)
acima ou ab aixo do ponto de r eferência .
Procedimento cirúrgico
Colocação do cateter ventricular
O grampo e m ângulo rec to montado no c ateter ventr icular (Fig. 3) po de
ser util izado para do brar o catet er a um ângulo de ap roximadame nte 90°
no ponto em q ue o cateter s ai do orifíc io da broca de to rção ou do tré pano
(Fig. 6). O gram po pode ser us ado como marc ador da profu ndidade de
inserção do cateter planeada, bastando deslizá-lo a distância adequada
em relaç ão à ponta prox imal do catet er, antes da intro dução (Fig. 4). Ist o
pode ser e fectuad o com o estile te no cateter. O es tilete em aço in oxidável
foi conce bido para fa cilitar a int rodução do c ateter no inte rior do
ventríc ulo lateral. O c ateter é emba lado com o esti lete inseri do no lúmen.
Sugere -se a coloca ção da válvu la numa bolsa
subgaleal folgada, criada cirurgicamente,
para evi tar a compre ssão gerad a pelo couro
cabelu do sobrejac ente, e que não se l ocalize sob
a incisã o do couro cab eludo. A válvu la pode ser
fixa ao t ecido adjac ente sutura ndo através d o
seu rebo rdo de estr utura de pol iéster ref orçada.
O local de c olocação da v álvula Delta
Medtronic Neurosurgery terá influência no
desemp enho global da d erivação. O f orame
de Monro é u m ponto de refer ência de nível
zero def inido para m onitorizaç ão da pressã o
intracraniana. A colocação da válvula acima
deste po nto de referê ncia resulta rá num
aumento g lobal da resis tência ao fl uxo do
sistema d e derivação . A colocação d a válvula
abaixo de ste ponto de re ferência re sultará
Page 85

Quando o c ateter esti ver correc tamente posic ionado dent ro do ventrícu lo e o estilete t iver sido remov ido, a porção e xtracran iana do cateter
é encaix ada no segment o tubular aber to do grampo, d e forma a criar u ma curvatu ra em ângulo rec to (Fig. 5 e 6). Quand o pressionar o c ateter
para es te encaixar no g rampo, não deve e sticar o cate ter. Se o cateter s e destinar a col ocação no ven trículo atr avés de um intro dutor tubula r,
o grampo te m de ser removi do antes da inser ção do catete r através do int rodutor. O gramp o em ângulo rec to deve ser fi xado aos teci dos
adjacen tes com sutura s, passadas at ravés dos dois o rifícios d e sutura loca lizados late ralmente no gra mpo (Fig. 7).
Para liga r a válvula Delt a ao cateter ven tricular, intr oduza o conec tor de polipr opileno inte gral na tubag em do cateter ven tricular. O cone ctor
deve fic ar totalmen te coberto pe la tubagem. Fi xe a tubagem ao co nector com um a ligadura cir cundante. Dev erá ter cuidad o para se cert ificar
que a ligad ura proporc iona uma ligaç ão segura, sem , no entanto, cor tar a tubage m.
Deverá s er formada uma b olsa subgale al com uma prof undidade ade quada, de form a a receber a porç ão extrac raniana do ca teter ventric ular
e do compo nente da Válvula De lta do kit de de rivação. A imp lantação de um c ateter ventr icular é o pass o final reco mendado do pro cedimento
de criaç ão de derivaç ões. Este pr ocesso minim izará a perda d e LCR durante a cir urgia.
Colocação do cateter peritoneal
Poderão s er aplicada s diferentes t écnicas cir úrgicas na co locação do c ateter dist al dentro da cav idade perito neal. A escolha d o local de
posici onamento deve rá ser feita pe lo cirurgiã o. O cateter pos sui um comprim ento de 90 cm apre sentando ra nhuras de par ede na extre midade
distal ( Fig. 8). Os cateter es dispõem de co mprimento su ficiente p ara uma coloc ação cardíac a ou periton eal na maioria do s pacientes a dultos.
O cirurg ião pode apar ar a extremi dade proximal p ara o local de co locação es colhido na hor a da cirurgia. O u, nos casos em q ue as ranhuras d e
parede d o cateter não s ão necessár ias, a extre midade dista l pode ser apar ada. No momento d a cirurgia, a p ermeabilida de do cateter d everá
ser testada (ver Verificação da permeabilidade da derivação).
CUIDADO: SE A E XTREMIDADE DISTAL DO C ATETER CARDÍACO/PER ITONEAL FOR APARADA, N ÃO PROCEDA A UMA COLOC AÇÃO
AURICULAR DO CATETER.
Se for nec essário ut ilizar um disp ositivo subc utâneo de tun elização p ara proceder à
coloca ção do catete r distal, reco menda-se a ut ilização do i ntrodutor su bcutâneo d e
cateter descartável Medtronic Neurosurgery.
NOTA: o introduto r de cateter de scartável n ão está inclu ído no kit de der ivação
Delta Medtronic Neurosurgery.
CUIDADO: A MAI ORIA DOS MATERIAIS DE
ELASTÓ MERO DE SILICONE NÃO REFO RÇADOS
APRESENTA COMO C ARACTERÍSTIC A UMA BAIXA
RESISTÊNC IA A RUPTURAS. DE VERÁ TER CUIDADO
QUANDO MANUSE AR E POSICIONAR A TUB AGEM DO
CATETER DE EL ASTÓMERO DE SILICO NE PARA EVITAR
CORTES, INCISÕES OU RUPTURAS.
Agulha de calibre 25 ou inferior
Injecçã o dentro da válvul a
A válvula Delta Medtronic Neurosurgery foi concebida
para per mitir a injecç ão ou a colheit a de amostras d e
LCR atravé s da cúpula, uti lizando uma ag ulha de calibr e
25 ou infe rior, não cort ante (Fig. 9).
CUIDADO: OS MATER IAIS DE ELASTÓME RO DE
SILICONE NÃO REF ORÇADOS APRESEN TAM COMO
CARAC TERÍSTICA UMA BAI XA RESISTÊNCIA A
RUPTURAS. DEVE-SE TER CUIDADO DURANTE A
INTRODUÇ ÃO E REMOÇÃO DA AGULHA.
A agulha de ve ser introdu zida num ângul o inferior a
45º em relaçã o ao couro cabe ludo ou à base da vá lvula.
Se a válvu la for perf urada várias ve zes, recomen da-se
que as agul has sejam intr oduzidas em lo cais difere ntes
para evitar punções múltiplas num único ponto da
cúpula. A t ubagem do cat eter, os disposi tivos de oclus ão
e os diafr agmas de contr olo do sifão não dev em ser
utilizados como locais de injecção.
CUIDADO: O COMP ONENTE DE CONTROLO DO S IFÃO
DESTE DISP OSITIVO NÃO FOI CONCEBID O PARA
PERMITIR A PENE TRAÇÃO POR AGULHA S. DEVIDO
À SUA LOCALIZ AÇÃO, É ALTAMENTE IMPROVÁVEL
QUE A AGULHA SE JA INTRODUZIDA DE UMA FOR MA
QUE CONDUZIRI A À PERFURAÇÃO DA MEMBR ANA
DE PRESSÃO/FLU XO OU DOS DIAFRAGMA S DE
CONTROLO DO SI FÃO. DEVERÁ TER CUIDADO
PARA NÃO PERMIT IR QUE ISTO SUCEDA, DADO
QUE A PERFURAÇ ÃO DA MEMBRANA OU DOS
DIAFRAGMA S PODE AFECTAR AS CAR ACTERÍSTICA S
DE DESEMPEN HO DA VÁLVULA E COMPROMETER O
SISTEMA DE DERIVAÇÃO.
Purga da válv ula
A aplica ção percutâ nea de pressã o com os dedos so bre a
cúpula da v álvula forç ará o LCR a sair da vál vula tanto na
direcç ão proximal co mo distal.
Entrada
Prima a cúpula da válvula Prima o dispositivo de oclusão
Direcção do fluxo
Bombeie a
cúpula
Nível do líquido
Líquido isotónico estéril
Saída
10
11
8
9
83
Page 86

Para pro ceder a uma irri gação selec tiva, prim a e oclua as secçõ es do disposi tivo de oclus ão proximal ou d istal da válvu la, através da ap licação
F
F
O
-3
-2
-1
0
0 cm
1
2
3
33
34
35
510152025
30
1/4
1/2
3/4
1oz
B-D
de uma pre ssão percut ânea, com os ded os; em seguida, p rima a cúpula da v álvula (Fig. 10). Es ta acção provo cará o flux o do líquido na dir ecção
opost a ao lado obstr uído da válvul a. Se for detec tada alguma r esistência à p ressão na cúp ula, o cateter a s er irrigado p oderá esta r ocluído.
CUIDADO: A OBST RUÇÃO DA DERIVAÇÃO POD E OCORRER EM QUALQUER UM D OS COMPONENTES DE UM SI STEMA DE DERIVAÇÃO;
ESTA SITUAÇÃO DE VE SER DIAGNOSTIC ADA PELOS ACHADOS CLÍNICO S E PELOS TESTES DE DIAGN ÓSTICO. AS CARAC TERÍSTICAS
DE IRRIGAÇ ÃO DA VÁLVULA PODEM NÃO SER ADEQUA DAS PARA DIAGNOSTIC AR A OCLUSÃO DE CATETERE S. CONSULTE A SECÇÃO
ADVERTÊNCIAS.
Verificação da permeabilidade da derivação
Válvul a:
a. Coloque o c onector de e ntrada da válv ula em soro fis iológico iso tónico estér il.
b. Prima e solte , repetidame nte, o reserv atório centr al da válvula até o l íquido sair pa ra fora do cone ctor de saíd a. Se o líquido f luir pelo
conec tor de saída de c ada vez que o rese rvatório ce ntral for pre mido, a válvula e stá permeáv el (Fig. 11).
CUIDADO: A ADIÇ ÃO DE PARTÍCULAS À S OLUÇÃO DE TESTE POD ERÁ AFECTAR OS RESULTADOS DO T ESTE E O DESEMPENHO D O PRODUTO.
CUIDADO: NÃO A SPIRE O LÍQUIDO ATRAVÉS DA D ERIVAÇÃO DA EXTR EMIDADE DO CATETER D ISTAL. PODERÃO O CORRER DANOS NA VÁLVULA
DELTA MEDTRONIC NEUROSURGERY.
CUIDADO: UMA PR ESSÃO DE IRRIGAÇÃO
EXCESSIVA P ODE CAUSAR UMA
DEFORMAÇÃO TEMPORÁRIA DA MEMBRANA
DE CONTROLO DO FLU XO DA VÁLVULA E
PROVOCAR RE SULTADOS DO TESTE DE
FLUXO/PRESSÃO ANORMALMENTE BAIXOS.
CUIDADO: SE FOR N ECESSÁRIO MANUSE AR
A CÂMAR A DELTA, DEVERÁ SEGUR AR
NO DISPOSITIVO PELOS DIAFRAGMAS
E UTILIZAND O SEMPRE LUVAS. NÃO SE
DEVERÁ E XERCER QUALQUER PRE SSÃO NO
REBORDO EXTERIOR. O MANUSEAMENTO
INDEVIDO DA C ÂMARA DELTA PODE
COMPROMETE R A INTEGRIDADE DO
SISTEMA DE DERIVAÇÃO.
Tampa do
manómetro (separada)
Filtro de seringa
Seringa
Torneira de passagem
Manómetro
30 cm
Tubagem de silicone
(Alinhamento
correcto do
manómetro)
Ligar o produto aqui
Banho
de água
de nível
constante
Cateter cardíaco/peritoneal:
No moment o da cirurgia, a p ermeabilid ade do cateter d everá ser tes tada. A
verificação de permeabilidade inclui uma avaliação visual para determinar
se as aber turas de tod as as ranhuras p ermitem o fl uxo de LCR.
1. Insira uma a gulha romba de c alibre 17 na extr emidade prox imal
abert a do cateter e ir rigue com uma pr essão suave da s eringa
usando s oro fisiol ógico estér il.
2. Observ e as abertur as de ranhuras p erto da ex tremidade dis tal.
Todas as aber turas deve m permitir o f luxo do líquid o e apresenta r-se
abertas em todo o comprimento.
3. Rolando sua vemente a área de a bertura da r anhura do cate ter entre
o polega r e o indicador ir á soltar as ran huras, se est as não estive rem
completamente abertas.
4. Amacie a par ede do catete r com o polegar e o in dicador par a que as
abert uras das ranhu ras se apres entem na posiç ão fechada dep ois do
teste de permeabilidade.
Teste antes da implantação
Cada válvula Delta é testada individualmente para garantir a conformidade
com as car acterís ticas de des empenho esp ecifica das no rótulo. A pesar de não
ser possível verificar as características de desempenho dinâmico da válvula
no bloco o peratório u tilizando u m teste está tico, o cirurg ião poderá qu erer
verif icar se a válv ula Delta se en contra em con formidade c om as especif icaçõe s
da Medtr onic Neuros urgery ant es da implanta ção. O teste a ef ectuar an tes da
implant ação, a segui r descrito, p ode ser exec utado no bloc o operatóri o.
CUIDADO: TENHA CUIDADO PARA MANTER A ESTERILIDADE E PARA
EVITAR A CONTAMINAÇ ÃO COM PARTÍCULAS.
NOTA: a válvula Del ta deve ser test ada isoladam ente, sem est ar ligada aos
catete res do kit.
Método do teste
I. Equipamento necessário para o teste
1. R eservató rio de líquido e stéril ou ban ho de água estér il
2. U m manómetro d e água de 30 cm, esté ril, graduad o em centímetr os
3. U ma torneira de p assagem de t rês vias (para s er utilizad a com o
manómetro)
4. U ma seringa es téril, 30 mL
5. U m filtro de se ringa de 5 µ, est éril
6. U m conector Lu er macho esté ril
7. Tub agem de silicon e estéril
84
10
Da seringa
10
10
Da seringa
1/4
5
1/4
5
1/4
5
F
Fechada
O
F
-3
F
F
Fechada
O
Para a válvula
-3
Para o manómetro
F
F
O
Fechada
-3
Do manómetro
Para a válvula
12
13
14
15
Page 87

II. Prepara ção do equipam ento
1. R etire a tampa d o manómetro. R egule o manóme tro, a torneir a de passagem e o b anho de água, de fo rma que o nível ze ro no
manóme tro e o nível de líqu ido no banho de ág ua fiquem à me sma altura (Fig . 12). (Fixe o manómetro a u m suporte de s oros.)
2. E ncha a sering a com água estér il, utilizan do o filtro de s eringa de 5 µ. (Qua ndo voltar a enc her a seringa, u tilize sempr e o filtro de
sering a de 5 µ.) Depois de enc her a seringa, r etire o respe ctivo fi ltro.
3. Ligue a seringa, o manómetro e a tubagem de silicone, conforme mostrado na figura 12.
4. Para purga r todo o ar do apare lho de teste es téril montad o, rode a tornei ra de passage m conforme mo strado na f igura 13.
5. Mergulhe a t ubagem de sili cone no banho de ág ua estéril e ir rigue com águ a estéril da se ringa.
III. Calibração do equipamento
1. Rode a torn eira de passa gem conforme m ostrado na f igura 14 e encha o ma nómetro com 5 c m de H2O, no mínimo.
2. C om a tubagem de si licone mergu lhada no banho de á gua, rode a torn eira de passa gem para isola r a seringa do man ómetro (Fig. 15).
3. Aguarde que a c oluna de água do ma nómetro des ça.
4. A coluna de águ a deve parar no ní vel zero do manóm etro, confor me mostrad o na figura 12. Se t al não ocorrer, ele ve ou baixe o
manómetro, conforme o caso.
5. O manómetr o encontra- se agora cali brado no nível z ero do banho de ág ua. Fixe ou monte o m anómetro par a manter a posiç ão de
referê ncia com o banho d e água.
IV. Pro cedimento do te ste
NOTA: durante o tes te, a válvula deve e star mergul hada no banho de á gua estéril. P ara obter resu ltados corr ectos, o níve l zero do manóme tro
deve est ar correct amente alinh ado com o nível do lí quido do banho d e água.
1. L igue a válvula e stéril que va i ser testada a o aparelho de te ste estéril m ontado.
2. R ode a torneir a de passagem c onforme mos trado na fig ura 14 e encha o manóm etro com 30 cm de H2O, no mínimo.
3. R ode a torneir a de passagem p ara isolar o man ómetro da via de f luxo, confo rme mostra do na figura 13.
4. P urgue todo o ar da v álvula e do apar elho de teste mo ntado, irrig ando suavement e com água estér il da seringa .
5. E stabele ça suavemente o f luxo atravé s da válvula com ág ua estéril da s eringa.
6. M ergulhe a válv ula estéril n o banho de água es téril. Para ob ter resultad os correc tos no teste, o con ector de saí da da válvula dev e estar
debaixo de água.
7. E nquanto manté m, com cuidado, o f luxo através d a válvula, rod e a torneira de pa ssagem para i solar a serin ga da via de flux o,
confor me mostrad o na figura 15. Depo is de a torneira d e passagem s e encontrar na p osição corr ecta, a colun a de água do manóme tro
deve come çar a descer. Agor a, a seringa es tá isolada da vá lvula e não é nece ssário cont inuar o fluxo c om a seringa. Se a c oluna de água
não desc er, repita os pass os 2 a 7.
NOTA: aguarde 2 a 2,5 mi nutos para que o n ível de água no man ómetro des ça. Leia a press ão resultan te no manómetr o.
Resulta dos do teste — Teste ante s da implantaçã o
A leitur a da pressão re sultante obt ida através de ste método po de ser compar ada com as segui ntes carac terística s:
Nível de desempenho da válvula Intervalos de pressão aceitáveis
Nível 1 1 a 60 mm H2O a uma PH igual a 0
Nível 1,5 35 a 95 mm H2O a uma PH igual a 0
Nível 2 70 a 130 mm H2O a uma PH igual a 0
Apresentação
Os kits de derivação Delta Medtronic Neurosurgery são embalados ESTÉREIS e APIROGÉNICOS e dest inam-se a ser u tilizados uma única vez
(utilização única). NÃO REESTERILIZE.
O produt o embalado des tina-se a ser a plicado ape nas num único pac iente. Não volte a u tilizar, proc essar ou a este rilizar es te produto. Volt ar
a utiliz ar, processar o u esteriliz ar pode compr ometer a integ ridade estr utural do dis positivo e/ou c riar risco de co ntaminação d o dispositi vo, o
que pode p rovocar fer imentos, doen ças ou a mort e do paciente. Não u tilize caso a e mbalagem tenh a sido previam ente abert a ou se encontre
danificada. A Medtronic Neurosurgery não é responsável pelo desempenho de qualquer produto que tenha sido reesterilizado.
Para uma derivação completa é necessário um cateter ventricular, uma válvula Delta Medtronic Neurosurgery e um cateter cardíaco/
peritoneal ou um cateter peritoneal.
Produtos com encomenda especial
Se esta s “Instruçõ es de utiliza ção” acompan harem um prod uto com encomen da especial, p oderão exis tir diferen ças nas carac terísti cas físicas
entre o pr oduto embala do e a descriç ão do produto co ntida no folhe to informat ivo. Estas di ferenças nã o afectarã o a segurança n em a eficác ia
do produ to com encomend a especial.
Os produ tos com encome nda especial p odem ser for necidos es téreis ou não es téreis, confo rme indicad o no rótulo da emb alagem do pro duto.
Os produtos não estéreis devem ser limpos e esterilizados, antes de serem utilizados.
Contra-indicações
A criaç ão de derivaçõ es de LCR para a aur ícula direit a, cavidade pe ritoneal ou ou tras zonas do co rpo não deverá s er executa da se existi r
infecção em alguma das áreas onde os vários componentes do sistema de derivação irão ser implantados. Estas incluem infecções do
couro ca beludo e de out ras áreas da pel e por onde o siste ma de derivaç ão irá passar, me ninges e ventr ículos cereb rais, perito neu e órgãos
intrap eritoneais e r etroperit oneais, pleur a e corrente sa nguínea. A cr iação de deriv ações de LCR est á contra-i ndicada se ex istir infec ção em
qualque r parte do cor po. Uma contra- indicaçã o adicional é a cr iação de uma der ivação par a dentro da aurí cula em pacien tes com doenç a
cardíaca congénita ou outras anomalias cardiopulmonares graves.
Educação do paciente
É da respo nsabilidad e do médico educ ar o paciente e /ou o(s) seu(s) represen tante(s) relati vamente à cria ção de deriva ções de LCR. Es ta
educaç ão deverá inc luir uma descr ição das comp licações ass ociadas a sis temas de deriv ações implan táveis e uma exp licação dos p rodutos e
tratamentos alternativos possíveis.
85
Page 88

Advertências e precauções
O produt o, o tamanho e a pres são apropr iados ou a variab ilidade de des empenho deve m ser escolhid os de acordo com a s necessidad es
especí ficas do pa ciente, com bas e em testes de di agnóstico e na e xperiênc ia do médico. O rót ulo do produt o especif ica os níveis ou i ntervalos
de desempenho do produto aplicáveis.
Evite o con tacto dos pr odutos impla ntáveis com tec idos com fio s, pó de talco de lu vas, resíduos o leosos da pel e, sabonete s com base oleos a,
deterg entes sintéti cos ou outros c ontaminante s de superf ície. A presen ça de fios, im pressões di gitais, tal co, outros cont aminantes de
super fície ou resí duos de luvas de l átex poderá p rovocar reacç ões a corpo es tranho ou rea cções alérgic as.
Durante o m anuseament o ou teste exec utado antes da i mplantação, d everá ter o cuid ado de garanti r que não sejam int roduzidas p artículas
contaminantes dentro dos componentes da derivação. A introdução de contaminantes poderá resultar no desempenho inapropriado
(drenagem e xcessiva ou in suficien te) do sistema de de rivação. As p artícula s que entram no si stema de deri vação podem ig ualmente mant er
os mecanismos de controlo da pressão/fluxo abertos originando uma drenagem excessiva.
Ao fixa r os cateteres a os conecto res, as ligadu ras circunda ntes devem ser f ixadas de fo rma segura, m as não excessiv amente aper tadas, para
não cor tarem a tubage m de silicone.
Deverá av ançar os cate teres com cuid ado para evit ar a formação d e dobras e abra sões desnec essárias ao l ongo do percur so dos mesmo s. O
rebord o do orifíci o da broca de torç ão ou do orif ício de trépan o pode ser apar ado para se obt er uma incisão e m forma de bise l, por onde o
catete r ventricular e merge e forma u ma curva, de f orma a fica r adjacente ao cr ânio.
Os pacientes com sistemas de derivação para tratamento de hidrocefalia devem ser mantidos sob rigorosa vigilância no período pósoperat ório, verif icando-se s e existem sin ais e sintomas qu e sugiram um mau f uncioname nto da derivaç ão. Os achados c línicos pode m indicar
um mau fun cionamento da d erivação. O s achados clín icos podem ind icar uma infe cção na zona da de rivação, ou uma d renagem insu ficiente
ou excess iva de LCR.
A obstr ução da deriv ação pode oco rrer em qualqu er um dos compon entes do siste ma de derivaç ão. O interior do s istema pode f icar ocluí do
devido a fragmentos de tecidos, coágulos sanguíneos, agregados de células tumorais, colonização bacteriana ou outros detritos. Os cateteres
que entr am em contact o com as estru turas corpo rais interna s podem dobrar- se ou ficar b loqueados na s respecti vas pontas (p or exemplo,
contac to da ponta de um c ateter ventr icular com o ple xo coróide ou da p onta de um cate ter distal com o g rande epípl oo ou ansas inte stinais).
Por últim o, a obstruçã o da derivaçã o pode ocorre r devido ao cre scimento de um b ebé ou crianç a, ou a activi dades físic as que desenc adeiem a
separa ção dos compo nentes da deri vação ou à remo ção de um catet er distal do se u local de drena gem pretendi do.
A coagula ção em volta do s egmento auri cular de um cate ter pode condu zir à emboliz ação da árvo re arterial p ulmonar, result ando em core
pulmonale e hipertensão pulmonar.
Os compo nentes da deri vação que se se param podem m igrar para o int erior do coraç ão ou da cavida de peritonea l.
Os sistemas de derivação podem falhar devido a avaria mecânica conduzindo a uma drenagem insuficiente ou excessiva.
Os catet eres de tamanh o “pequeno” po ssuem parede s mais finas e um a resistênc ia total mais re duzida, quand o comparados c om os catetere s
de tamanho “padrão”.
Tem sido referido que os cateteres peritoneais de tamanho “pequeno” evidenciam uma taxa mais elevada de fractura, quando comparados
com os cat eteres peri toneais de tama nho “padrão”. Os méd icos que implan tam os cateter es peritone ais de tamanho “p equeno” por qu alquer
razão (p or exemplo, po r razões cosmé ticas) devem po nderar o bene fício cosmé tico em relaçã o à maior probab ilidade de nec essidade de
revisã o do cateter.
O mau func ionamento ou a o bstrução d o sistema de der ivação pode c onduzir a sinai s e sintomas de aum ento da press ão intracra niana se a
hidroce falia não for c ompensada. E m bebés, os sint omas mais fre quentes são o au mento da tensã o na fontanela a nterior, conges tão das veias
do couro c abeludo, inqu ietação, son olência e irr itabilidad e, vómitos e rigi dez da nuca. Em c rianças mais v elhas e em adulto s, os sintomas ma is
frequentes são cefaleias, vómitos, visão turva, perda de memória, rigidez da nuca, deterioração da consciência e vários achados neurológicos
anormais.
A drenage m excessiva de LC R pode predis por ao desenvo lvimento de hem atoma subdur al ou hidroma, o u ao colapso das p aredes ventr iculares
laterai s, conduzindo à o bstrução d o cateter vent ricular.
Se o catet er ventricul ar ficar ade rente ao plexo co róide ou ao tec ido cerebral a djacente por ad esão de tecid o fibroso, su gere-se que n ão se
tente rem over o cateter ut ilizando a fo rça. Em vez diss o, a rotação suave do cate ter poderá aju dar a libert á-lo. É prefe rível que o cate ter
perman eça nessa po sição, em vez do r isco de hemorr agia intraven tricular, que po derá ser prov ocada pela rem oção força da.
Os intro dutores sub cutâneos do c ateter pode m partir nas ju nções solda das ou nos ponto s de união dos comp onentes, ou de vido à defor mação
extr ema da haste male ável. A ruptur a súbita pode co nduzir a um tra umatismo dos te cidos ou órgã os e danific ar o sistema de de rivação. Os
instrumentos devem ser inspeccionados antes de serem utilizados para garantir a integridade e funcionalidade contínuas dos mesmos. Os
instr umentos desc artáveis nu nca devem ser re utilizado s; caso contr ário existe a p ossibilidad e de ocorrênc ia de lesões no p aciente ou no
médico.
Complicações
As complicações associadas aos sistemas de derivações de LCR ventrículo-auriculares e ventrículo-peritoneais podem ser semelhantes às
complic ações que pod em ocorrer em q ualquer proc edimento cir úrgico exec utado sob ane stesia loca l e/ou geral. Est as incluem as r eacções
aos fár macos e agentes a nestésicos , desequilí brio elec trolítico e p erda excessi va de sangue, pa rticularm ente em bebés . Em raras ocas iões, o
paciente pode exibir uma reacção devido a hipersensibilidade ao implante.
A utiliz ação de líquid os não filtr ados ou não cont rolados par a teste antes da i mplantação p ode resulta r num desempe nho inadequad o da
válvula e n ecessitar d e uma revisão da v álvula. Os dis positivos de vem ser manuse ados somente e m ambientes hos pitalares c ontrolados p ara
evitar a i ntrodução d e partícul as, fibras o u outros cont aminantes na vá lvula.
A utiliz ação de instr umentos af iados durant e o manuseament o destes disp ositivos po de causar inc isões ou cor tes no elastóm ero de silicon e,
result ando em fugas e na n ecessidade d e revisão da vá lvula. Deverá t er também cui dado ao fechar a s incisões pa ra assegura r-se que as
agulhas de sutura não causem golpes ou cortes nas válvulas.
86
Page 89

Em todos o s procedimen tos de criaçã o de derivaçõe s de LCR, as compli cações mais f requentes s ão provocad as pela obstr ução do siste ma,
confor me descrit o na secção “Adver tências e pre cauções” no f olheto info rmativo do pro duto que acomp anha a embalage m. A obstruç ão pode
ocorrer em qualquer componente do sistema devido a bloqueio causado por fragmentos cerebrais, coágulos sanguíneos e/ou agregados
de célula s tumorais, em q ualquer ponto d o seu percur so. A obstruç ão poderá igu almente ocor rer devido à sep aração dos co mponentes do
sistema o u a dobras e/ou enr olamento do ca teter. Estas co ndições pod em predispo r à migração do c ateter ventri cular para o ven trículo
lateral e d o cateter dist al para o inter ior do coraçã o e árvore art erial pulmon ar, peritoneu ou p ara outras es truturas n as quais o catet er esteja
implant ado. O cresci mento de um bebé o u criança po derá provoca r a deslocaç ão do cateter di stal da auríc ula para dentr o da veia jugular
interna ou do peritoneu para planos de tecidos onde o líquido não pode ser absorvido.
Além dos ti pos de obstr uções da deri vação acima de scritos, e xistem outr as complicaç ões potenci almente graves . As infecçõ es locais e
sistémi cas não são rar as nos proced imentos de cr iação de deri vações. As in fecções são, n ormalmente, p rovocadas po r organismos q ue
habitam a pele, particularmente o Staphylococcus epidermidis. Contudo, ou tros agente s patogénico s que circulem n a corrente san guínea
poderã o colonizar a de rivação, sen do necessá ria a sua remoçã o na maioria dos p acientes.
Em 1973, Robert son e colaboradores resumiram a incidência de infecção nas derivações ventrículo-auriculares e ventrículo-peritoneais
descr itas até à data. A i ncidência de i nfecções nas d erivações v entrículo -auricular es variou ent re 7 e 31%. Na maior part e dos casos, a inf ecção
nas deri vações ventr ículo-pe ritoneais oc orreu em 5 a 10% dos pa cientes. Dev ido ao facto d e a derivação v entrículo -auricular p redispor à
disseminação de bactérias para outros órgãos do corpo, a derivação ventrículo-peritoneal é considerada como sendo menos lesiva.
Recente mente (1993), Kestle e colab oradores re feriram re duções signi ficativa s na infecção (i nferior a 4%) com a ut ilização de a ntibióticos ,
diminui ção do tempo de c irurgia (expe riência cir úrgica) e contr olo do ambient e do bloco opera tório (por ex emplo, bloco op eratório exc lusivo,
limitaç ão da permanê ncia e passag em de pessoal d o bloco, cober tura das supe rfícies d a pele). O artigo af irma que os re sultados po dem ser
obtidos igualmente sem a utilização de antibióticos, mas com um controlo rigoroso do ambiente no período perioperatório.
A utiliz ação prof iláctica de a ntibiótico s em pacientes c om derivaçõ es é, de certa fo rma, controve rsa, porqu e a sua utilizaç ão pode pred ispor a
infecç ões por organi smos mais resi stentes. As sim, a decisão d e utilizar an tibióticos p rofilac ticamente é tom ada pelo médi co assistente e /ou
cirurgião.
A drenage m excessiva de LC R pode result ar numa diminui ção excessi va da pressão d o LCR e predispor a o desenvolvi mento de um hidr oma ou
hematom a subdural e à red ução excess iva do tamanho ve ntricular, o que c onduz à obstr ução devido a o contacto da s paredes ven triculare s
com os ori fícios de ent rada do catet er. Em bebés, est a redução exce ssiva da pres são origina rá uma depres são marcada da f ontanela ant erior e
o cavalgamento dos ossos cranianos, podendo converter-se numa hidrocefalia obstrutiva (em vez de comunicante).
Foi refe rida a incidên cia de epileps ia após proce dimentos de cr iação de deri vações ventr iculares. E ste estudo i ndicou igualm ente que a
incidência de convulsões aumentou com revisões múltiplas do cateter.
A criaç ão de derivaçõ es para o perit oneu pode fal har devido ao con tacto do cat eter com as ansa s intestina is ou com o grande e píploo. Foi
descrita a perfuração do intestino por cateteres peritoneais, com subsequente desenvolvimento de peritonite.
Complicações relacionadas com instrumentos
As compl icações dir ectamente a ssociadas à u tilização d o introduto r subcutâne o de cateteres d escart ável incluem di ficuldade e m introduzi r o
instrumento através de áreas cicatriciais e a possibilidade de formação de hematomas.
Normas para a devoluç ão dos produtos
A fim de po derem ser acei tes para subs tituição o u crédito, os pr odutos devem s er devolvido s em embalagens n ão abertas c om o selo
do fabri cante intac to, excepto se ti verem sido devo lvidos devi do a uma reclama ção por defei to do produto o u rotulagem inc orrecta . A
determ inação do def eito de um produ to ou de uma rotul agem incorre cta será ef ectuada pe la Medtroni c Neurosurge ry, cuja decis ão será fin al.
Os produ tos não serão ac eites para sub stituiçã o ou crédito se e stiverem na p osse do clien te durante um per íodo superi or a 90 dias.
Garantia
A. Garantia limitada padrão. A Medtronic Neur osurgery g arante ao comp rador e utiliz ador final o riginal (“Comp rador”) qu e o produto
para implantação, de utilização única, embalado (“Produto”) adquirido pelo Comprador se encontrará, na altura em que é entregue ao
Comprad or, substanci almente livre d e defeitos de m aterial e de fab rico. A Medtro nic Neurosur gery não ofe rece qualque r garantia (expr essa,
implíci ta ou estab elecida por le gislação) par a os Produtos qu e sejam altera dos (excepto nos c asos expre ssamente ref eridos nes te documento)
ou subme tidos a esfo rços físicos p ouco habituai s, utilizaç ão incorrec ta, funcio namento incor recto, neg ligência, inco rrecções n os testes,
utiliz ação em combin ação com outr os produtos o u componente s para além daqu eles para os qua is os Produto s foram conceb idos, ou
utiliz ação de maneir as ou em proced imentos médi cos para os quai s os Produtos nã o estão indi cados.
B. Recur so. O único recu rso oferec ido ao Comprad or e a única obri gação da Medt ronic Neuros urgery em ca so de violaçã o da garantia se rá,
por opç ão única e esco lha da Medtron ic Neurosurg ery, a substit uição do Prod uto ou a atribu ição de um créd ito ao Comprad or no valor
líquido p ago pelo refe rido Produt o, sob a condição d e (i) a Medtroni c Neurosurge ry ser notif icada por e scrito, num per íodo de novent a (90)
dias após o C omprador ter r ecebido o Pro duto, de que tal Pr oduto não cump riu as especi ficaçõe s, incluindo u ma explicaç ão detalhada e m
Inglês sobre qualquer inconformidade alegada; (ii) tal Produto ser devolvido à Medtronic Neurosurgery num período de noventa (90) dias
após o Comp rador ter rece bido o Produt o, F.O.B., par a o seguinte en dereço: 125 Cremo na Drive, Gole ta, Califor nia 93117, E.U.A., ou par a um
endereço alternativo indicado pela Medtronic Neurosurgery; e (iii) a Medtronic Neurosurgery ficar razoavelmente satisfeita sobre a realidade
da existência de inconformidades. Exceptuando as situações expressamente referidas neste parágrafo, o Comprador não poderá devolver
Produtos à Medtronic Neurosurgery sem o consentimento prévio, por escrito, da Medtronic Neurosurgery.
C. Excl usão de outr as garantia s. COM A EXCEPÇÃO DA G ARANTIA LIMITADA ACIMA RE FERIDA EM (A), A MEDTRONIC NEURO SURGERY
NÃO OFERECE QUAIS QUER OUTRAS GAR ANTIAS OU CONDIÇÕE S, EXPRESSAS OU I MPLÍCITAS, E O FABRICANTE REN UNCIA
ESPECIFICA MENTE AS GARANT IAS E CONDIÇÕES IMPLÍC ITAS DE COMERCIALIZAÇ ÃO E ADEQUAÇÃO PARA UM DETER MINADO
PROPÓSITO. A ME DTRONIC NEUROSURGER Y NÃO ASSUME NEM AUTORIZ A QUALQUER OUTRA PES SOA A ASSUMIR QUAISQUE R OUTRAS
RESPONSA BILIDADES DERIVADAS OU RE LACIONADAS COM A VE NDA OU A UTILIZAÇÃO DE QUALQ UER PRODUTO.
87
Page 90

88
Page 91

Kit de derivación Delta
14
12
10
52030
40 50
14
12
10
52030
140
40 50
Descripción
La válvula Delta Medtronic Neurosurgery incorpora una válvula de presión de membrana colocada en serie con un mecanismo para el control
del efe cto sifón que n ormalmente e stá cerrad o. Esta combi nación permi te a la válvula man tener la presi ón intraventr icular (PIV) d entro de
límites fisiológicos normales, independientemente del flujo de líquido cefalorraquídeo (LCR) que necesite el paciente o de la posición de su
cuerp o. El control del f lujo se logr a mediante el ef ecto combi nado de la resis tencia de la memb rana y diafra gmas de contro l del efect o sifón.
El grado d e resistenci a determina la s caracter ísticas de re ndimiento de la v álvula. La me mbrana impid e el flujo ret rógrado. El ef ecto sifón l o
controlan los dos diafragmas de elastómero de silicona normalmente cerrados del control del efecto de sifón Delta. Los diafragmas se abren
en respu esta a una PIV po sitiva en sent ido ascenden te.
La válvu la se present a en dos tamaños : pequeño y nor mal. Cada tama ño está dispo nible en tres r angos de presi ón: nivel de rend imiento 1, 1,5
y 2. Las car acteríst icas de rendi miento de las vál vulas se mues tran en los grá ficos (Fig. 1a- b).
El kit de ta maño pequeño e stá integr ado por la válvu la Delta pequ eña en el nivel de re ndimiento 1, 1,5 ó 2. El ki t de tamaño nor mal está
integr ado por la válvu la Delta norma l en el nivel de ren dimiento 1, 1,5 ó 2. Ambos k its contie nen un catéter ve ntricular d e 23 cm, de diámet ro
están dar e impregna do en bario, y un cat éter cardia co-perito neal de 90 cm, de di ámetro est ándar e impreg nado en bario.
1a
0
0
O)
2
0
80
60
40
PRESIÓN (mm H
20
Nivel de rendimiento 2,0
105
Nivel de rendimiento 1,5
70
Nivel de rendimiento 1,0
35
VELOC IDAD DE FLUJO (mL /h)
Las características de rendimiento de toda válvula Medtronic Neurosurgery se someten a prueba en la fábrica, utilizándose al efecto un sistema de prueba relleno de agua.
En estas pruebas, todas las válvulas deben estar conforme a las especificaciones de su rótulo. Las pruebas ulteriores de las válvulas pueden dar resultados distintos, según
las condiciones de prueba y el estado de las válvulas. Las pruebas en fábrica sirven para asegurar la calidad uniformemente alta de toda válvula Medtronic Neurosurgery.
125
0 cm H2O HP*
90
NOTA: los niveles ilustrados corresponden
a medianas. El rango de tolerancia de los
valores de estas medianas es +/-25 mm H2O.
55
*Presión hidrostática
Español
1b
0
0
O)
2
0
80
60
40
PRESIÓN (mm H
20
Nivel de rendimiento 2,0
120
Nivel de rendimiento 1,5
85
Nivel de rendimiento 1,0
50
105
70
- 50 cm H2O HP*
NOTA: los niveles ilustrados corresponden
a medianas. El rango de tolerancia de los
valores de estas medianas es +/-40 mm H2O.
*Presión hidrostática
VELOC IDAD DE FLUJO (mL /h)
Las características de rendimiento de toda válvula Medtronic Neurosurgery se someten a prueba en la fábrica, utilizándose al efecto un sistema de prueba relleno de agua.
En estas pruebas, todas las válvulas deben estar conforme a las especificaciones de su rótulo. Las pruebas ulteriores de las válvulas pueden dar resultados distintos, según
las condiciones de prueba y el estado de las válvulas. Las pruebas en fábrica sirven para asegurar la calidad uniformemente alta de toda válvula Medtronic Neurosurgery.
El líquido cefalorraquídeo sale del catéter a través de cuatro hendiduras abiertas, situadas a intervalos de 90° alrededor de la circunferencia
del caté ter, cerca de la punt a distal (Fig. 8). E stas aber turas está n diseñadas par a ofrecer pr otección fr ente al retrof lujo. No est án diseñadas
como válv ulas de contro l del flujo o la p resión, pero a ñaden resist encia al fluj o. La resisten cia máxima al f lujo a una velo cidad de fluj o
consta nte de 20 mL/h es d e 2,0 cm H2O. Las hend iduras abier tas se recu bren con graf ito durante e l proceso de fa bricación p ara impedir e n lo
posible que la superficie hendida se adhiera durante el almacenamiento.
Las válv ulas están f abricadas co n una base fir me de polipro pileno, molde ada con precis ión, que se inse rta en un aloja miento blando y f lexible
de elast ómero de silico na con un fondo co ntorneado (Fi g. 2). La base contr ibuye a la fiab ilidad de la inte gridad est ructural, a l as caracte rísticas
de presi ón-flujo y al c ontrol del ef ecto sifón , e impide la dist orsión y adher encia del asie nto y la membran a de la válvula, y de lo s orifici os
y los diafragmas de control del efecto sifón. La cúpula contiene indicadores radiopacos impregnados en tantalio que muestran el nivel de
rendimiento y la dirección del flujo.
89
Page 92

2
Conector de entrada integral
Las válvulas Delta incorporan conectores diseñados para reducir la posibilidad de una desconexión del catéter. Se necesita una circunligadura
para suj etar cada cat éter a la válvula . Marcadore s radiopacos e n la base de cada co nector (Fig . 2) permiten al mé dico visuali zar
radiológicamente las posiciones relativas de los catéteres y de la válvula in vivo cuando s e usan catéter es radiopac os.
El código radiopaco 5e n la válvula ind ica las carac terístic as de flujo -presión del d ispositivo; 5corresponde al nivel de rendimiento 1,6al
nivel de re ndimiento 1,5, y7al nivel de r endimiento 2. L a cúpula est á diseñada par a permitir la i nyección o la ex tracción de m uestras de LCR
por medi o de una aguja no cor tante de cal ibre 25 o menor (F ig. 9). La base fir me de polipro pileno impid e que la aguja pene tre complet amente
en la válvu la. Las válvul as Delta se pue den irrigar e n la dirección d istal o proxi mal ejercien do presión per cutánea con e l dedo. Para fac ilitar la
irriga ción selec tiva, hay oclu sores en posic ión proxima l y distal con re specto al re servorio ce ntral.
Las exp loracione s mediante RM no a fectan a las c aracterí sticas de f lujo del dispo sitivo. No es ne cesario pro bar ni reajust ar el disposi tivo tras
una exploración mediante RM.
Cúpula de silicona
Oclusor proximal
Marcador radiopaco
Base firme de plástico polipropileno
Indicadores radiopacos de rendimiento/dirección del flujo
Reservorio
Válvula con membrana
de silicona
Oclusor distal
Cámara Delta
Conector de salida
integral
Indicaciones
Los kits de derivación Delta Medtronic Neurosurgery están diseñados para utilizarse en la derivación de LCR desde el ventrículo lateral del
cerebro h asta la auríc ula derecha d el corazón o has ta la cavidad p eritoneal. Ad emás, la válvul a Delta minimi za la reducci ón excesiva de la
presió n y el volumen intr aventricul ares como cons ecuencia de u n drenaje exces ivo de LCR, que pue de estar oca sionado por el e fecto sif ón
de la presión hidrostática del catéter distal. El efecto sifón es un fenómeno que puede originarse por la elevación del catéter ventricular con
respec to al catéter d istal (esto es , cuando el pac iente se sient a, está de pie o se l e mantiene ergu ido).
Instrucciones de uso
Técnica quirúrgica
Se pueden emplear diversas técnicas quirúrgicas para colocar la derivación Delta. La técnica quirúrgica a utilizar se deja a discreción del cirujano.
En lugar de c olocar la válv ula debajo de la in cisión del cu ero cabellud o, se sugiere hac erlo en un bolsi llo subgaleal h olgado cread o
3
4
7
Taladro helicoidal u
Sujetador en escuadra
Válvula contorneada de
control de flujo de LCR
orificio de trépano
Catéter ventricular
10
5
Orificio de
trépano
Doblar el
catéter, empujar
en la ranura
de la
lengüeta
Cráneo
A los
ventrículos
Sutura
6
un disminución general de la resistencia al flujo del sistema de derivación.
Estos c ambios son di rectame nte proporc ionales a la dis tancia lin eal (mm)
por enci ma o por debajo d el punto de ref erencia.
Procedimiento quirúrgico
Colocación del catéter ventricular
El sujet ador en escuad ra montado en e l catéter vent ricular (Fig. 3)
puede ut ilizarse p ara doblar el c atéter a un ángul o aproximado d e 90°
en el punto d onde el catét er sale del ori ficio de tré pano o del talad ro
helicoi dal (Fig. 6). Cuando, an tes de inser tarse, el suje tador se desl iza
a la dista ncia adecuad a desde la punt a proximal del c atéter, puede
utiliz arse para mar car la profu ndidad a la que se de sea inser tar este
último (F ig. 4). Esto puede h acerse con el e stilete en el c atéter. El
estile te de acero inox idable está d iseñado para f acilitar la i ntroducció n
del caté ter en el ventrí culo lateral. E l catéter se pre senta con el es tilete
insertado en la luz.
90
quirúrgicamente, lo que contribuirá a
evitar q ue el cuero cab elludo compr ima la
válvula. La válvula puede sujetarse al tejido
adyacen te pasando una s utura a travé s de su
brida re forzada co n tela de poliés ter.
El lugar donde se coloque una válvula Delta
Medtronic Neurosurgery tendrá un impacto
en el rendimiento general de la derivación. El
forame n de Monro es un pu nto de refere ncia
del nivel cero establecido para monitorizar
la presión intracraneal. La colocación de
la válvul a por encima de e ste punto de
referencia producirá un aumento general de la
resistencia al flujo del sistema de derivación.
Cuando el p aciente est á sentado, de p ie o se
mantiene erguido, la colocación de la válvula
por deba jo del punto de re ferencia p roducirá
Page 93

Una vez col ocado el caté ter en la posici ón correct a dentro del ven trículo y ex traído el es tilete, la par te extrac raneal del ca téter se intro duce a
presió n en el segmento t ubular hendi do del sujetad or para form ar un codo en ángul o recto (Figs . 5 y 6). El catéter no deb erá estira rse cuando
se intro duzca a presi ón en el sujetad or. Si el catéter se v a a colocar en el v entrículo a t ravés de un intro ductor tub ular, el sujetad or debe
quitar se antes de ins ertar el cat éter en el intro ductor. El suje tador en esc uadra debe ase gurarse al t ejido adyacen te por medio de su turas a
través de l os dos orif icios para ta l fin en los lado s del sujetad or (Fig. 7).
Para cone ctar la válv ula Delta al ca téter ventric ular, inserte e l conector d e polipropil eno integral e n el tubo del cat éter ventric ular. Los
conec tores deben qu edar cubier tos en su total idad por el tubo . Sujete el tubo a l conector me diante una cir cunligadur a. Deberá tene rse
cuidado para asegurar que se obtiene una conexión segura con la ligadura, pero sin cortar el tubo.
Es nece sario crear u n bolsillo subg aleal de una pro fundidad tal q ue pueda aloja r la parte ex tracranea l del catéter ve ntricular y la v álvula Delta
integr ante del kit de de rivación. S e recomienda d ejar la implant ación del caté ter ventricu lar para el fi nal en el proces o de derivaci ón. Esto
minimizará la pérdida de LCR durante la intervención quirúrgica.
Colocación del catéter peritoneal
Pueden u tilizarse d iversas té cnicas quir úrgicas par a colocar el ca téter dista l en la cavidad per itoneal. El lu gar de colocac ión se deja a la
discreción del cirujano. El catéter tiene una longitud de 90 cm, con hendiduras parietales en el extremo distal (Fig. 8). La longitud de los
catéte res es sufic iente para su co locación c ardíaca o peri toneal en la mayo ría de los adult os. El cirujan o puede recor tar el ext remo proxima l
para col ocarlo en el si tio seleccio nado en el momen to de la interve nción. O, si no se qu ieren las hendi duras parie tales del cat éter, puede
corta rse el ext remo distal. D ebe comprob arse la perme abilidad del c atéter en el mom ento de la inter vención (véase C omprobaci ón de la
permeabilidad de la derivación).
PRECAUCIÓ N: SI SE CORTA EL EXTREMO D ISTAL DEL CATÉTER CARDÍ ACO-PERITONEAL , NO COLOQUE EL CATÉTER AUR ICULARMENTE.
Si se nece sita un dispos itivo de tunel ización sub cutáneo par a colocar el c atéter
distal, se recomienda el pasador de catéter subcutáneo desechable Medtronic
Neurosurgery.
NOTA: el kit de derivación Delta Medtronic Neurosurgery no contiene un pasador
de catéter desechable.
PRECAUCIÓ N: LA BAJA RESISTE NCIA AL DESGARRE
ES CARAC TERÍSTICA DE L A MAYORÍA DE LOS
MATERIALES DE ELASTÓMERO DE SILICONA
NO REFORZ ADOS. SE DEBE TENER CU IDADO AL
MANIPULAR O C OLOCAR EL TUBO DEL C ATÉTER DE
ELASTÓ MERO DE SILICONA PARA EV ITAR CORTES,
MELLAS O DESGARROS.
Aguja de calibre 25 o menor
Inyección e n la válvula
La válvula Delta Medtronic Neurosurgery permite la
inyecci ón o la toma de mues tras de LCR a travé s de la
cúpula m ediante una agu ja no cortant e de calibre 25 o
menor (Fig. 9).
PRECAUCIÓ N: LA BAJA RESIST ENCIA AL DESGARRE
ES UNA CAR ACTERÍSTICA D E LOS MATERIALES DE
ELASTÓMERO DE SILICONA NO REFORZADOS. SE DEBE
TENER CUIDADO A L INSERTAR O RETIRAR L A AGUJA.
La aguja d ebe insert arse a un ángu lo no superio r a los 45°
con resp ecto al cuer o cabelludo o a l a base de la válv ula.
Si la válvu la se va a perf orar varias ve ces, se recom ienda
introducir la aguja en puntos distintos, para evitar
punciones múltiples en un solo punto de la cúpula. El tubo
del caté ter, los oclusor es y los diafr agmas de cont rol del
efecto sifón no deben utilizarse como sitios de inyección.
PRECAUCIÓ N: LA SECCIÓN DE CONTRO L DEL EFECTO
SIFÓN DE ESTE D ISPOSITIVO NO ESTÁ DISE ÑADA
PARA QUE LA AGUJA P ENETRE EN ELLA. DEB IDO A
SU POSICIÓN , LA PROBABILIDAD DE QUE L A AGUJA
SE INSERTE DE M ANERA TAL QUE PERFORE LA
MEMBRANA D E PRESIÓN-FLUJO O LOS DI AFRAGMAS
DE CONTROL DEL E FECTO SIFÓN ES MÍNIM A. SE DEBE
TENER CUIDADO PAR A IMPEDIR QUE ESTO OC URRA,
YA QUE LA PERFOR ACIÓN DE LA MEMBR ANA
O DE LOS DIAFRAG MAS PUEDE AFECTAR A LA S
CARAC TERÍSTICAS DE RE NDIMIENTO DE LA VÁLVULA
Y COMPROMETE R EL SISTEMA DE DERIVACI ÓN.
Oprima la cúpula de la válvula Oprima el oclusor
Dirección de irrigación
Salida
Lavado po r irrigación de la vá lvula
Al oprimir la cúpula de la válvula mediante presión
percut ánea co n el ded o, el LCR sal drá de la v álvul a en amba s
direcciones, proximal y distal. Para una irrigación selectiva,
oprima y o cluya med iante pres ión percu tánea con el d edo
la secci ón prox imal o la se cción d ista l de la válv ula don de se
encuent ran lo s oclu sore s y, a contin uació n, opri ma la cú pula
de la válvu la (Fig. 10). Esta a cción hará q ue el líquid o fluya
en la direc ción opuest a al lado ocluid o de la válvula. Si se
nota res istencia al comp rimir la cúpula, e l catéter que se
va a lavar podría estar ocluido.
Entrada
Solución isotónica estéril
Bombee la cúpula
Nivel del líquido
8
9
10
11
91
Page 94

PRECAUCIÓ N: PUEDEN PRODUCIRSE O BSTRUCCIONES EN CUALQ UIERA DE LOS COMPONE NTES DEL SISTEMA DE D ERIVACIÓN,
OBSTRUCCIO NES QUE DEBEN DIAGNOS TICARSE CON AYUDA DE LO S RESULTADOS CLÍNICOS Y DE PRUEBA S DE DIAGNÓSTICO. LA S
CARAC TERÍSTICAS DE L AVADO DE LA VÁLVULA PODRÍA N NO SER SUFICIENTES PARA D IAGNOSTICAR LA O CLUSIÓN DE LOS CATÉTER ES.
VÉASE LA SECCIÓN DE ADVERTENCIAS.
Comprobación de la permeabilidad de la derivación
Válvul a:
a. Coloque e l conector d e entrada de la vá lvula en la soluc ión salina is otónica esté ril.
b. Oprima y sue lte repetida mente el reser vorio cent ral de la válvula h asta que salg a líquido por el c onector de s alida. Si cada ve z que se
oprime e l reservor io central sa le líquido por e l conector de s alida, la válvu la es permeab le (Fig. 11).
PRECAUCIÓ N: LA ADICIÓN DE PARTÍCU LAS MATERIALES A LA S OLUCIÓN DE PRUEBA PUED E AFECTAR A LOS RESULTADOS DE LA
PRUEBA Y AL RENDI MIENTO DEL PRODUCT O.
PRECAUCIÓ N: NO ASPIRE LÍQUIDO A TR AVÉS DE LA DERIVACIÓN D ESDE EL EXTREM O DEL CATÉTER DISTAL. LA VÁLVUL A DELTA
MEDTRONIC NEUROSURGERY
PODRÍA SUFRIR DAÑOS.
PRECAUCIÓN: UNA PRESIÓN
DE LAVADO EXCE SIVA PODRÍA
CAUSAR UNA DE FORMACIÓN
TEMPORAL DE LA MEMBRANA
DE LA VÁLVULA DE CO NTROL
DEL FLUJO Y DAR LUGAR A
RESULTADOS ANORMALMENTE
BAJOS EN L AS PRUEBAS DE
PRESIÓN-FLUJO.
PRECAUCIÓ N: SI ES
NECESARIO MANIPULAR
LA CÁM ARA DELTA, EL
DISPOSITIVO DEBERÁ
SUJETARSE POR L OS
DIAFRAGMA S CON LOS DEDOS
PROTEGIDOS CON GUANTES.
NO DEBERÁ EJERCERSE
NINGUNA PRES IÓN EN EL BORDE EX TERNO. LA MANIPULAC IÓN
INCORRECTA DE L A CÁMARA DELTA PODRÍ A COMPROMETER LA
INTEGRIDAD DEL S ISTEMA DE DERIVACIÓ N.
manómetro (quitada)
Filtro para jeringa
Jeringa
Tapa del
B-D
3/4
1oz
30
Llave de paso
1/2
Manómetro
0 cm
1/4
510152025
35
30 cm
34
33
Tubo de silicona
3
2
1
0
-1
(Alineación
-2
correcta del
-3
manómetro)
O
F
F
Conecte el producto aquí
-3
Catéter cardíaco-peritoneal:
Debe com probarse la p ermeabilid ad del catéter e n el momento de la
intervención. La prueba de permeabilidad incluye la determinación visual
de que el LCR fluye por todas las hendiduras abiertas.
1. Inserte u na aguja roma de c alibre 17 en el ex tremo proxim al y
abier to del catéter y, eje rciendo una pr esión suave en la j eringa,
irrigue con suero fisiológico estéril.
2. Observ e las abertur as cerca del ex tremo dis tal. Todas las aber turas
deberí an permitir e l flujo de líqu ido y abrirse e n toda su longit ud.
3. Si las hendid uras no parec en abrirse co mpletamen te, gire esa
secció n del catéter en tre el pulgar y el í ndice para ab rirlas.
4. Pase el pulg ar y el índice por l a pared del caté ter para cerr ar las
hendiduras después de realizar la prueba de permeabilidad.
Prueba de preimplantación
Cada válvula Delta se prueba individualmente para garantizar su conformidad
con las características de rendimiento especificadas en su etiqueta. Si bien
no es posi ble verifi car el rendi miento dinámi co de la válvula m ediante
una prue ba estátic a practic able en el quir ófano, el cir ujano tal vez de see
verif icar que la vál vula Delta se a justa a las es pecific aciones de M edtronic
Neurosurgery antes de proceder a su implantación. La siguiente prueba de
preimplantación puede realizarse en el quirófano.
PRECAUCIÓ N: TENGA CUIDADO DE MAN TENER LA ESTERILIDAD Y
EVITAR LA CONTAMI NACIÓN CON MATERIAS PARTI CULADAS.
NOTA: la válvula Delta deberá someterse a prueba independientemente,
esto es, s in estar cone ctada a los c atéteres del k it.
Método de prueba
I. Equipo ne cesario para la pr ueba
1. R eservori o de líquido es téril o baño de ag ua estéril
2. U n manómetro d e agua estéril d e 30 cm, graduad o en centímetr os
3. U na llave de paso de t res vías (par a utilizarla c on el manómet ro)
4. U na jeringa es téril de 30 mL
5. U n filtro de 5 µ es téril para je ringa
6. U n conector lu er macho esté ril
7. U n tubo de silico na estéril
De la jeringa
1/4
5
10
De la jeringa
1/4
5
10
1/4
5
10
F
F
Cerrada
O
F
F
Cerrada
O
-3
Al manómetro
F
F
O
Cerrada
-3
Del manómetro
A la válvula
A la válvula
Baño
de agua
de nivel
constante
12
13
14
15
92
Page 95

II. Montaje del equipo
1. Q uite la tapa de l manómetro. In stale el manó metro, la llave de p aso y el baño de agu a de manera que el c ero del manóme tro y el
líquido e n el baño de agua es tén al mismo niv el (Fig. 12). (Fije el manóm etro a una perc ha de suero I.V.)
2. L lene la jering a con agua estér il utilizan do un filtro d e 5 µ para jering a. (Al volver a llena r la jeringa, ut ilice siempre e l filtro de 5 µ pa ra
jeringa.) Una vez llena la jeringa, quite el filtro.
3. Conecte l a jeringa, el man ómetro y el tub o flexibl e de silicona, ta l como se indica e n la figura 12.
4. Para evacu ar el aire del apa rato de prueba e stéril rec ién montado, gi re la llave de paso a l a posición que s e indica en la f igura 13.
5. Sumerja el t ubo de silicona e n el baño de agua e stéril e irrí guelo con el agu a estéril de la je ringa.
III. Calibración del equipo
1. Gire la llave de p aso a la posici ón que se indic a en la figura 14 y lle ne el manómetr o por lo menos has ta 5 cm de H2O.
2. C on el tubo fle xible de silic ona sumergid o en el baño de agua, g ire la llave de pas o de manera que la je ringa quede a islada del
manómetro (Fig. 15).
3. Espere a qu e descienda la c olumna de agua de l manómetro.
4. El descens o de la columna de ag ua debe detene rse en el cero de l manómetro, t al como se mues tra en la figu ra 12. Si no es así,
aumente o d isminuya el ni vel del cero seg ún correspo nda.
5. El manómet ro estará c alibrado ahor a al nivel cero de l baño de agua. Fi je o monte el manóm etro de modo qu e se mantenga la po sición
de refer encia respe cto del baño de a gua.
IV. Procedimiento de prueba
NOTA: durante la pru eba, la válvul a debe estar su mergida en el ba ño de agua estér il. Para obten er resultado s correct os, el nivel cero d el
manóme tro debe est ar alineado cor rectamen te con el nivel de l líquido en el bañ o de agua.
1. C onecte la vál vula estéri l que se probar á al aparato de pr ueba estéri l previament e montado.
2. G ire la llave de pas o a la posición qu e se indica en la f igura 14 y llene el m anómetro po r lo menos hast a 30 cm de H2O.
3. A juste la llave de p aso para que el ma nómetro que de aislado del t rayecto del f lujo, como se il ustra en la fi gura 13.
4. E limine el aire r estante de la vá lvula y del apar ato de prueba i rrigándolo s suavemente co n agua estéril d e la jeringa.
5. C on cuidado es tablezca el f lujo a través d e la válvula con ag ua estéril de l a jeringa.
6. S umerja la válv ula estéril en e l baño de agua es téril. Para ob tener result ados correc tos, es prec iso que el cone ctor de salid a de la
válvula esté sumergido en el agua.
7. M anteniendo su avemente el f lujo a través de la v álvula, gire la ll ave de paso para q ue la jeringa qu ede aislada del t rayecto de f lujo,
tal como s e indica en la f igura 15. Una vez ajus tada la llave de pa so en la posició n correct a, la columna de agu a del manómetr o debe
empeza r a descender. La j eringa est á aislada ahora d e la válvula y ya no e s necesario s eguir usánd ola para mante ner el flujo. Si l a
columna d e agua no descie nde, repita lo s pasos 2 a 7.
NOTA: deje que el nive l del agua en el man ómetro desc ienda entre 2 y 2 ½ mi nutos. Obse rve la presió n resultante e n el manómetr o.
Resulta dos de la prueba– Prueba de preimp lantación
La lectura de la presión resultante obtenida mediante este método puede compararse con las características siguientes:
Nivel de rendimiento de la válvula Rangos de presión aceptables
Nivel 1 1 a 60 mm H2O a PH=0
Nivel 1,5 35 a 95 mm H2O a PH=0
Nivel 2 70 a 130 mm H2O a PH=0
Presentación
Los kits de derivación Delta Medtronic Neurosurgery se presentan envasados en condiciones ESTÉRILES y NO-PIROGÉNICAS y est án
indica dos para un único uso (una sola vez). NO LO VUE LVA A ESTERILIZAR.
Este pr oducto se ha di señado para u so exclusivo en u n único pacien te. No vuelva a ut ilizar, proces ar o esterili zar este pro ducto. Volver a
utiliz ar, procesar o es terilizar p odría compr ometer la integ ridad estr uctural de l dispositiv o o crear un ries go de contamin ación del mism o,
lo que pod ría causar le siones, enfe rmedades o la m uerte al paci ente. No utilic e este produc to si el envase s e ha abierto pr eviamente o es tá
dañado. Medtronic Neurosurgery no se responsabiliza del funcionamiento de ningún producto que haya sido reesterilizado.
Una derivación completa requiere un catéter ventricular, una válvula Delta Medtronic Neurosurgery y un catéter cardíaco-peritoneal o uno
peritoneal.
Productos que requieren pedido especial
Si esta s instrucci ones acompañ an a un product o que requiere p edido espe cial, es posibl e que observ e diferencia s entre las car acteríst icas
física s del produc to que se adjunt a y la descrip ción que apare ce en este pros pecto. Es tas diferen cias no afec tan a la seguri dad o eficac ia del
producto que requiere pedido especial.
Los prod uctos que re quieren pedi do especial p ueden sumini strarse en f orma estér il o no estéril, s egún se indiq ue en la etiquet a del envase.
Los prod uctos no est ériles deben l impiarse y es terilizar se antes de ut ilizarse.
Contraindicaciones
La deri vación del LCR a la au rícula dere cha, a la cavidad p eritoneal o a ot ras zonas del c uerpo no se deb e llevar a cabo si h ay infección e n
alguna de las zonas en las que se van a implantar los distintos componentes del sistema de derivación. Estas infecciones abarcan las del cuero
cabelludo y las de otras zonas cutáneas por las que pasará el sistema de derivación, de las meninges y los ventrículos cerebrales, del peritoneo
y los órgan os intraper itoneales y re troperit oneales, de la pl eura y del torr ente sanguín eo. La derivac ión de LCR está c ontraindic ada si hay
infección presente en cualquier parte del cuerpo. Una contraindicación adicional es la derivación a la aurícula en el caso de pacientes con
cardiopatía congénita u otras anomalías cardiopulmonares graves.
Educación del paciente
Es la responsabilidad del médico informar al paciente y a sus representantes acerca de las derivaciones de líquido cefalorraquídeo. Esto
deberá incluir una descripción de las complicaciones asociadas con los sistemas de derivación implantables y una explicación de los posibles
productos y tratamientos alternativos.
93
Page 96

Advertencias y precauciones
Se debe el egir el produ cto, tamaño, pr esión o margen d e rendimiento a decuado a las ne cesidades e specífi cas del pacie nte, basándos e en las
prueba s de diagnóst ico y en la exper iencia del méd ico. La etique ta del produc to indica lo s rangos o nivel es de rendimie nto aplicabl es.
Evite el co ntacto de lo s productos i mplantable s con pelusa, t alco para guant es, residuo gr aso de la piel, jab ones de base o leosa, deter gentes
sintéti cos u otros cont aminantes de s uperfic ie. La pelusa , huellas digit ales, talco, ot ros contamin antes super ficiales o r esiduos de lo s guantes
de látex pueden producir reacciones a cuerpos extraños o alérgicas.
Se deben tomar medidas para evitar que entren partículas contaminantes en los componentes de la derivación durante las pruebas o su
manipulación previa a la implantación. La introducción de partículas contaminantes podría provocar un rendimiento inadecuado (drenaje
excesivo o insuficiente) del sistema de derivación. Las partículas que entren en el sistema de derivación podrían también mantener abiertos
los meca nismos de cont rol del fluj o y la presión, pr ovocando un dr enaje excesiv o.
Al fijar l os catétere s a los conecto res, las ligad uras que rodea n al tubo deber án sujetars e bien, pero sin a pretarlas de masiado, para q ue no
lleguen a c ortar el tub o de silicona.
Debe tene rse cuidad o al inserta r los catétere s para evitar q ue se doble y la abr asión innece saria a lo larg o de su trayect o. El borde de la bro ca
helicoi dal o del orif icio de trépa no podrá reco rtarse pa ra proporci onar una muesc a biselada po r donde salga el c atéter ventr icular y se cur ve
para permanecer adyacente al cráneo.
Los paci entes port adores de der ivación con hi drocéfalo d eben mantener se bajo est recha obser vación en el p ostoperato rio por si ex terioriza n
signos o síntomas de funcionamiento defectuos o de la derivación. Los signos clínicos suelen indicar tal funcionamiento defectuos o. Los signos
clínico s podrían ind icar infecc ión de la deriva ción, o drenaje e xcesivo o insu ficiente de LC R.
Se pueden producir obstrucciones en cualquiera de los componentes de la derivación. El sistema puede ocluirse internamente debido a
fragmentos de tejido, coágulos de sangre, agregados de células tumorales, colonización bacteriana u otros detritos. Los catéteres que entran
en contac to con estr ucturas co rporales in ternas se pue den acodar o blo quear en la punta ( por ejemplo, co n el alojamient o de la punta de
un catét er ventricula r en el plexo coro ideo o de la punt a de un catéter di stal en el epip lón mayor o en las as as intestin ales). Por último, la
derivación puede obstruirse como consecuencia del proceso de crecimiento del bebé o del niño pequeño, o de actividades físicas que provocan
la desconexión de sus componentes, o la extracción del catéter distal del sitio de drenaje previsto.
La coagulación en torno al segmento auricular de un catéter podría provocar embolización del árbol arterial pulmonar con hipertensión
pulmonar y cor pulmonale como consecuencia.
Los componentes de la derivación desconectados podrían migrar al corazón o a la cavidad peritoneal.
Las derivaciones pueden fallar debido a un fallo mecánico, con la posibilidad de drenaje insuficiente o excesivo.
Los catéteres de diámetro “pequeño” tienen paredes más delgadas y menor resistencia general que los catéteres de diámetro “normal”.
Se ha info rmado del mayor í ndice de fis uras en los caté teres perit oneales de tam año “pequeño” e n comparació n con los catéte res periton eales
de tamaño “n ormal”. Los médic os que implante n catéteres p eritoneale s de tamaño “pequ eño” por algun a razón (por eje mplo, cosméti ca)
deben so pesar las vent ajas frente al í ndice potenc ialmente más al to de necesida d de revisar el c atéter.
El mal funcionamiento de la derivación, o su obstrucción, pueden producir signos y síntomas de aumento de la presión intracraneal en
circun stancias en q ue no sea posibl e compensar el h idrocéfal o. En los bebés, l os síntomas más c omunes son el au mento de la tensi ón en la
fontanela anterior, congestión de las venas del cuero cabelludo, apatía, somnolencia e irritabilidad, vómitos y rigidez de la nuca. En los niños
de mayor ed ad y en los adultos , los síntomas má s comunes son ce falea, vómit os, visión bor rosa, pérdi da de memoria, r igidez de la nuc a y
deterioro del nivel de conciencia, además de diversos signos neurológicos anormales.
El drenaje excesivo de LCR puede predisponer a la formación de hematomas o hidromas subdurales o al colapso de las paredes del ventrículo
lateral d el cerebro, con la p osible obst rucción del c atéter ventr icular.
Si el caté ter ventricu lar se fija al pl exo coroideo o a l tejido cerebr al adyacente p or adherenci as de tejido fi broso, no se deb e despegar con
fuerz a. La rotaci ón suave del catéter pue de ser sufic iente para de sprenderlo. S e aconseja dej ar el catéter en su s itio antes que c orrer el ries go
de que se pr oduzca una hem orragia int raventricu lar al extra erlo por la fue rza.
Los intr oductores o p asadores s ubcutáneo s de catétere s pueden romp erse en las junt as soldadas o e n los puntos de mo ntaje de los
componentes, o bien por deformación extrema del eje o vástago maleable. La ruptura súbita puede traumatizar los tejidos u órganos y dañar
el siste ma de derivaci ón. Se deben ins peccionar lo s instrume ntos antes de uti lizarlos, p ara comprob ar su integrida d y funcional idad. Los
instr umentos dese chables no se d eben usar de nu evo, ya que hacerl o puede causa r lesiones al pa ciente o al médi co.
Complicaciones
Las complicaciones asociadas con sistemas ventriculoperitoneales y ventriculoauriculares de derivación de LCR son a menudo análogas a las
experimentadas en toda otra intervención quirúrgica practicada bajo anestesia local y/o general. Estas complicaciones incluyen reacciones a
los medi camentos y ane stésicos, de sequilibr ios electr olíticos y pé rdida excesiv a de sangre, esp ecialmente e n los bebés. Ra ra vez el pacie nte
presentará una reacción debida a sensibilidad al implante.
El empleo de líquidos no filtrados o no controlados en las pruebas de preimplatación puede ocasionar un rendimiento incorrecto de la válvula
y necesi dad de revisión d e la válvula. Los d ispositivo s únicamente d eben manipul arse en salas c ontroladas d el hospital p ara que no entre n
partí culas, fib ras u otros cont aminantes en la v álvula.
El uso de ins trumento s afilados mi entras se mani pulan estos d ispositivo s puede causa r mellas o cort es en el elastóm ero de silicona , con la
consiguiente pérdida de líquido y necesidad de revisión de la válvula. Se debe tener también cuidado al cerrar las incisiones para no cortar ni
mellar las válvulas con las agujas de sutura.
En todos los procedimientos de implantación de derivaciones de LCR, las complicaciones más comunes se deben a la obstrucción del sistema
según se d escribe en e l apartado “Adv ertencias y p recaucion es” de esta ho ja de informa ción del produ cto. Se pued en producir ob struccio nes
en cualquiera de los componentes de la derivación por taponamiento debido a fragmentos de tejido cerebral, coágulos sanguíneos y/o
agregados de células tumorales en el catéter. Asimismo, se pueden producir obstrucciones debido a la separación de los componentes del
sistema o a l doblamiento o e nrollamient o del catéter. Es to puede pre disponer a la mig ración del ca téter ventri cular al ventrí culo lateral y d el
catéte r distal al cora zón y al árbol ar terial pulm onar, al periton eo o a otra estr uctura en la q ue se haya implan tado el catéte r. El crecimien to
del bebé o d el niño puede ha cer que el catét er distal se s alga de la aurícu la y se desplace a la v ena yugular int erna, o que emig re del periton eo
a planos de tejido donde no se pueda absorber el líquido.
94
Page 97

Además de los tipos de obstrucción de las derivaciones descritos anteriormente, existen otras complicaciones potencialmente graves.
Las infecciones locales y sistémicas no son infrecuentes en los procedimientos de derivación. Estas infecciones se deben generalmente a
microo rganismos qu e habitan en la pi el, sobre todo al Staphylococcus epidermidis. Sin embargo, ot ros patógeno s que circulan e n el torrente
sanguíneo también pueden colonizar la derivación y, en la mayoría de los casos, exigir su extracción.
En 1973, Robertson y cols. resumieron la incidencia de infecciones en las derivaciones ventriculoauriculares y ventriculoperitoneales de las
que se tení a noticia has ta la fecha. La i ncidencia de i nfeccione s de las derivac iones ventr iculoauric ulares osci laba entre el 7 y el 31 po r ciento.
Las infe cciones en de rivacione s ventriculo peritonea les se produje ron en el 5 al 10 por cie nto de los pacie ntes en la mayorí a de los inform es.
Dado que las derivaciones ventriculoauriculares predisponen a la propagación de bacterias a otros órganos del cuerpo, las derivaciones
ventriculoperitoneales se consideran menos devastadoras.
Recientemente (1993) Kestle y cols. informaron acerca de reducciones significativas (menos del 4%) en las cifras de infecciones con el uso
de antibióticos, con la corta duración de la intervención quirúrgica (gran experiencia quirúrgica) y con el control del medio ambiente del
quirófano (p. ej., previa designación del quirófano, limitación del personal y del tránsito, cobertura de superfic ie cutáneas). El artículo
citado sostiene que también se pueden obtener resultados sin el uso de antibióticos, siempre que se controle rigurosamente el ambiente
perioperatorio.
El uso profiláctico de antibióticos en pacientes con derivaciones es algo controvertido ya que su empleo puede predisponer a infección por
microorganismos más resistentes. Por consiguiente, la decisión de emplear antibióticos profilácticamente queda en manos del facultativo
respon sable o del cir ujano.
El exceso d e drenaje de LCR pu ede provocar u na reducció n excesiva de la pr esión del LCR y pre disponer a la ap arición de he matomas o
hidromas subdurales y a una reducción excesiva del tamaño ventricular que puede ocasionar obstrucción debido a la intrusión de las paredes
ventric ulares en los o rificios d e entrada del c atéter. En los beb és, la reducci ón excesiva de la p resión provo cará una marc ada depresió n de la
fontanela anterior, el cabalgamiento de los huesos del cráneo y la posible conversión del hidrocéfalo comunicante en hidrocéfalo obstruc tivo.
Se ha informado de la incidencia de epilepsia tras la implantación de derivaciones ventriculares. El estudio en cuestión también señalaba que
la incidencia de episodios convulsivos aumenta con las revisiones múltiples del catéter.
La deri vación al peri toneo puede f allar si el caté ter se clava o que da envuelto en la s asas intest inales o en el epi plón mayor. Se han de scrito
casos de perforaciones intestinales por el catéter peritoneal, con la aparición subsiguiente de peritonitis.
Complicaciones relacionadas con los instrumentos
Las complicaciones directamente asociadas con el uso del introductor de catéteres subcutáneos incluyen la dificultad de pasar el instrumento
por zonas con cicatrices y la posible formación de hematomas.
Normas para la devolución de productos
Los prod uctos deben d evolverse e n sus envases sin a brir y con los pr ecintos del f abricante in tactos par a que se acepte su r eemplazo o cré dito,
a menos que se devuelvan por una queja debido a un defecto del producto o un etiquetado incorrecto. Medtronic Neurosurgery determinará si
un produ cto es defec tuoso o si lle va un rotulado e rróneo, y su dec isión será de finitiva. N o se aceptará n el reemplazo o c rédito de los p roductos
si han est ado en posesi ón del cliente d urante más de 90 d ías.
Garantía
A. Garantía limitada estándar. Medtronic Neurosurgery garantiza al comprador y usuario final original (“Comprador”) que el producto
implant able de un sólo u so que se adjunt a (“Product o”) y que ha sido ad quirido por e l Comprador, en el mo mento de la entr ega al
Comprad or, carecerá es encialment e de defecto s de material y man o de obra. Medt ronic Neuros urgery no of rece garant ía alguna (expre sa,
implíci ta o estable cida por legi slación) para Pr oductos qu e sufran modi ficacio nes (salvo en los c asos contem plados expr esamente en el
presen te documento), o que s e sometan a ten sión física p oco común, uso i nadecuado, ma nejo incorre cto, neglige ncia, o que se los p ruebe
incorr ectamente o u tilice en comb inación con ot ros produc tos o componen tes ajenos a los d estinados p ara los Produc tos, o que se ut ilicen de
una maner a o en un procedi miento médico d istinto al ind icado para lo s Producto s.
B. Recurs o. El recurso exclusivo del Comprador y la responsabilidad única de Medtronic Neurosurgery en el caso de incumplimiento de la
garantí a precedente s erá, según cr iterio único d e Medtronic N eurosurger y, el reemplaz o del Produc to o la emisión de un c rédito a nomb re del
Comprad or por el impor te neto pagad o por dicho Pro ducto. Est o último se apli ca siempre que : (i) Medtronic N eurosurger y reciba no tificaci ón
por esc rito dentro de l os noventa (90) día s de la recepció n del Produc to por parte d el Comprador d e que dicho Prod ucto no cump le con las
especificaciones, inclusive una explicación detallada en inglés de cualquier disconformidad; (ii) dicho Producto sea devuelto a Medtronic
Neurosu rgery dent ro de noventa (90) dí as a partir de l a fecha de rece pción del Pro ducto fran co a bordo por par te del Compr ador, a la siguiente
direcc ión: 125 Cremona Dr ive, Goleta, C alifornia 93117, EE.UU. o a otro domic ilio alternat ivo designad o por Medtron ic Neurosurg ery; y que (iii)
Medtronic Neurosurgery quede justificadamente satisfecho de que las disconformidades reclamadas efectivamente existen. Salvo disposición
en contr ario en este pá rrafo, el Compr ador no tendr á derecho a devo lver Produc tos a Medtron ic Neurosurg ery sin el prev io consenti miento
por escrito de Medtronic Neurosurgery.
C. Excl usión de otra s garantía s. SALVO LA GARANTÍA LI MITADA PROVISTA EN EL APARTADO (A) ANTERIO R, MEDTRONIC
NEUROSURGER Y NO OTORGA NINGUNA OTR A GARANTÍA O COND ICIÓN, EXPRESA O IM PLÍCITA, Y EL FABRICANTE DES CONOCE
ESPECÍFICA MENTE LAS GAR ANTÍAS Y CONDICIONE S IMPLÍCITAS DE COMERCIAB ILIDAD Y APTITUD PARA UN PRO PÓSITO
EN PARTICULA R. MEDTRONIC NEUROSU RGERY NO ASUME NI AUTORI ZA A PERSONA ALGUNA A A SUMIR NINGUNA OTR A
RESPONSA BILIDAD DERIVADA DE LA VEN TA O UTILIZACIÓN DE PRODUC TO ALGUNO, O RELACION ADA CON DICHA VENTA O
UTILIZACIÓN.
95
Page 98

96
Page 99

Delta shuntkit
14
12
10
14
12
10
52030
140
40 50
Beskrivning
Varje Medtronic Neurosurgery Delta-ventil från omfattar en membrantryckventil i serie med en normalt sluten hävertkontrollmekanism. Tack
vare denna kombination kan ventilen bibehålla det intraventrikulära trycket (IVP) inom ett normalt fysiologiskt intervall, oavsett patientens
krav på cerebrospinalvätskeflöde (CSV) eller kroppsställning. Flödeskontroll uppnås genom kombinerat motstånd i detta membran och
hävertkontrollmembranet. Motståndets omfattning bestämmer ventilens prestandaegenskaper. Backf löde förhindras av membranet.
Häverteffekten styrs av de två normalt slutna silikonelastomermembranen i Delta-hävertkontrollen. Membranen öppnas vid positivt
intraventrikulärt tryck uppströms.
Ventilen f inns i liten oc h standard s torlek. Varje s torlek fin ns i tre trycko mråden: pres tandanivå 1, 1,5 oc h 2. Ventilens pre standaege nskaper
framgår av diagrammen (figur 1a-b).
Det lilla k itet bestå r av en Delta-ve ntil, Liten med p restandan ivå 1, 1,5 eller 2. Standa rdkitet bes tår av en Delta -ventil, Stan dard med
prest andanivå 1, 1,5 eller 2. B åda kiten omf attar en 23 cm b ariumimpr egnerad vent rikulär kate ter med stand arddiamete r och en 90 cm
bariumimpregnerad kardiell/peritoneal kateter med standarddiameter.
1a
0
0
105
O)
2
0
80
70
60
TRYCK (m m H
35
40
20
52030
Prestandanivå 2,0
Prestandanivå 1,5
Prestandanivå 1,0
FLÖDESHASTIGHET (ml /h)
Varje Medtronic Neurosurgery-ventils prestandaegenskaper testas med hjälp av ett vattenfyllt system vid tillverkningen. Samtliga ventiler måste vid dessa tester
uppfylla specifikationerna i produktinformationen. Efterföljande testning av ventilen kan ge andra resultat beroende på testförhållanden och ventilens tillstånd.
Testningen vid tidpunkten för tillverkning är avsedd att säkerställa en jämn och hög kvalitet hos varje Medtronic Neurosurgery-ventil.
1b
0
120
0
O)
2
0
85
80
60
50
TRYCK (m m H
40
20
Prestandanivå 2,0
Prestandanivå 1,5
Prestandanivå 1,0
40 50
125
0 cm H2O HP*
90
OBS! Angivna nivåer utgör medianvärden.
Toleransområden kring dessa medianvärden är
+/- 25 mm H2O.
55
*Hydrostatiskt tryck
105
70
- 50 cm H2O HP*
OBS! Angivna nivåer utgör medianvärden.
Toleransområden kring dessa medianvärden är
+/- 40 mm H2O.
*Hydrostatiskt tryck
Svenska
FLÖDESHASTIGHET (ml /h)
Varje Medtronic Neurosurgery-ventils prestandaegenskaper testas med hjälp av ett vattenfyllt system vid tillverkningen. Samtliga ventiler måste vid dessa tester
uppfylla specifikationerna i produktinformationen. Efterföljande testning av ventilen kan ge andra resultat beroende på testförhållanden och ventilens tillstånd.
Testningen vid tidpunkten för tillverkning är avsedd att säkerställa en jämn och hög kvalitet hos varje Medtronic Neurosurgery-ventil.
Cerebro spinalväts kan lämnar kate tern via fy ra slitsöpp ningar, placera de med 90° mell anrum runt kat eterns omkr ets i närhete n av den distala
spets en (figur 8). Dess a öppningar är u tformade f ör att skyd da mot backf löde. De är int e utformad e som tryck /flödes kontrollven tiler, men
ger ett v isst flöd esmotstå nd. Maximalt f lödesmot stånd vid en ko nstant fl ödeshasti ghet på 20 ml/ti mme är 2,0 cm H2O. Slitsö ppningarna
beläggs med grafit under tillverkningen för att minimera risken för vidhäftning i slitsytan under förvaring.
Ventiler na tillverka s med en precis ionsgjuten f ast bas av pol ypropylen so m är införd i et t smidigt, f lexibelt h ölje av silikone lastomer med
konturerad botten (figur 2). Basen bidrar till strukturens integritet, tillförlitligt tryck/f löde och hävertkontroll, förhindrar vridning och
att ventilbasen och membranet, hävertkontrollportarna och membranen fastnar. Kupolen är märkt med röntgentäta tantalimpregnerade
indikatorpilar som visar prestandanivå och fl ödesriktning.
Delta- ventiler omf attar koppl ingar som har ut formats f ör att minsk a risken för at t katetrar na lossnar. En omslu tande ligat ur krävs för at t
fästa varje kateter vid ventilen. Röntgentäta markeringar vid basen på varje koppling (figur 2) ger läkaren möjlighet till röntgenvisualisering
av katetr arnas och ven tilens relati va placering i n vivo, när röntgentäta katetrar används.
97
Page 100

2
Integrerad inloppsanslutning
Proximal tillslutare
Silikonkupol
Reservoar
Röntgentäta indikatorer för prestanda/flödesriktning
Distal tillslutare
Delta-kammare
Integrerad
utloppsanslutning
Röntgentät markering
Den röntgentäta koden5på ventilen visar enhetens tryck/ flödesegenskaper. 5motsvarar prestandanivå 1,6motsvarar prestandanivå 1,5
och7motsv arar presta ndanivå 2. Kupo len är utfor mad för medg e injektion e ller provt agning på cereb rospinalvä tskan via en ic ke-stans ande
25 G eller f inare nål (fi gur 9). Den fasta po pylpropyle nbasen för hindrar ful lständig nål penetrati on av ventilen. De lta-ventil erna kan spol as
i distal e ller proxima l riktning g enom perkut ant finger tryck. Ti llslutare si tter proxim alt och dista lt från den cen trala reser voaren för a tt
underlätta selektiv spolning.
Fast bas av polypropylenplast
Silikonmembranventil
Enhetens flödesegenskaper påverkas inte av MR-undersökningar. Enheten behöver inte testas eller justeras om efter en MR-undersökning.
Indikationer
Medtro nic Neurosu rgery Delt a shuntkit ä r utforma de för att anv ändas vid shun tning av cereb rospinalv ätskan frå n hjärnans late rala ventri kel till
höger förmak eller till peritonealhålan. Delta-ventilen minimerar också den uttalade sänkning av det intraventrikulära trycket och volymen som
kan upps tå vid allt för kraf tig dräneri ng av cerebros pinalväts ka, vilket kan o rsakas av häve rteff ekten vid hyd rostatis kt tryck i de n distala kat etern.
Häverte ffekt en kan uppst å om ventrikel katetern höj s i förhållan de till den dis tala katete rn (dvs. när pati enten sitte r, står eller hål ls upprätt).
Bruksanvisning
Operationsteknik
Ett antal olika operationstekniker kan användas för placering av Delta-shunten. Kirurgen avgör vilken operationsteknik som ska användas.
Det rekom menderas at t ventilen pla ceras i en kiru rgiskt skap ad, lös subgale al ficka så a tt kompress ion från den öve rliggande sk alpen undvik s,
och inte under skalpsnittet. Ventilen kan säkras i intilliggande vävnad genom suturer genom den polyesterförstärkt a flänsen.
Var en Medtronic Neurosurgery Delta-ventil placeras påverkar shuntens allmänna prestanda. Monro-foramen är en etablerad
referensnollpunkt för intrakraniell tryckövervakning. Om ventilen placeras över denna referenspunkt ökar det övergripande
flödesmotståndet i shuntsystemet. Om ventilen placeras under denna referenspunkt minskar det övergripande flödesmotståndet i
shunts ystemet när p atienten sit ter, står eller h ålls upprät t. Dessa för ändringar är d irekt prop ortionel la mot det linjär a avståndet (mm) öve r
3
4
7
Skruvborr- eller borrhål
Rätvinklig klämma
Ventrikulär kateter
CSV-flödeskontrollventil,
konturerad
10
5
Borrhål
Böj katetern
och skjut in den i
fåran på fliken
Skallben
Till
ventriklerna
Sutur
6
sonden införd i lumen.
När katet ern har placer ats i korrek t position i ven trikeln och so nden har
avlägsna ts tryck s den extrak raniella del en av katetern i n i det delade
slangse gmentet på kl ämman så att en r ätvinkli g böj bildas (fi gur 5 och
6). Kateter n får inte strä ckas när den tr ycks in i kläm man. Om katete rn
ska place ras i ventrike ln genom en slang ledare måste k lämman
avlägsnas innan katetern förs in genom ledaren. Den rätvinkliga
klämman bör fästas vid intilliggande vävnad genom att suturer förs
igenom de båda suturhålen på klämmans sidor (figur 7).
För att ansluta Delta-ventilen till den ventrikulära katetern ska den
integrerade anslutningen av polypropylen föras in i den ventrikulära
kateterslangen. Anslutningen ska täckas helt av slangen. Säkra slangen
i anslutn ingen med en oms lutande liga tur. Var försik tig så att lig aturen
leder ti ll en säker anslu tning, men inte s kär av slangen.
eller under referenspunkten.
Kirurgisk procedur
Placera ventrikulär kateter
Den rätvinkliga klämman på den ventrikulära
kateter n (figur 3) kan anvä ndas för att b öja
kateter n till cirka 9 0° vinkel där den ko mmer
ut ur skru vborren ell er borrhåle t (figur 6).
Klämman k an användas som m arkör för
det planerade införingsdjupet för katetern,
genom at t man före inf öringen skj uter fram
klämman till önskat avstånd från kateterns
proxima la spets (fig ur 4). Detta kan g öras
medan so nden sitter i k atetern. Son den av
rost fritt st ål är utform ad för att und erlätta
inför andet av katete rn i den laterala
ventrik eln. Kateter n är förpack ad med
98
 Loading...
Loading...