Page 1

NUS-009
Instructions for Use
Instrucciones de uso
Gebrauchsanweisung
Istruzioni per l’uso
Mode d’emploi
Instruções de uso
Bruksanvisning
Bruksanvisning
Käyttöohjeet
Brugsanvisning
Οδηγίες χρήσης
תוארוה שומיש
Kullanma Talimatı
Инструкция по применению
800-12 Capitola Drive
Durham, NC 27713 USA
www.hyperbranch.com
0050
MedPass International Limited
Windsor House
Bretforton
EVESHAM
Worcestershire
WR11 7JJ
United Kingdom
Page 2

Explanation of Symbols
The following table shows symbols used in this manual, on system components and on packaging labels. The
table gives the corresponding meaning of each symbol. Pay attention to these symbols as they may relate to
important safety precautions and warnings.
Symbol
Meaning
Consult Instructions For Use for additional information
Single use only; Do not reuse
Do not re-sterilize
Sterilized using irradiation
Use by date; Expiration date – year and last day of month
Do not use if package is damaged
Keep away from sunlight
Not for general waste
Authorized representative in the European Community
0050
CE mark and identification number of Notified Body
Lot number
Catalog Number
Quantity
Manufacturer
Type BF equipment (Non-cardiac Floating—Applied Part)
Direct Current
Temperature Limitations (store below)
Biohazard
“On”/”Off” (push-push)
Page 3

Table of Contents
Device Description ............................................................................................................... 4
Indication ............................................................................................................................. 4
Contraindications ................................................................................................................. 5
Warnings .............................................................................................................................. 5
Precautions .......................................................................................................................... 5
Adverse Events .................................................................................................................... 5
Clinical Information .............................................................................................................. 6
Adherus AutoSpray ET Dural Sealant Sterilization Method and Device Disposal .............. 9
Environmental Operating Conditions .................................................................................. 9
How Supplied ....................................................................................................................... 9
Adherus AutoSpray ET Dural Sealant Operations ............................................................... 9
Reconstituting the Crosslinking Components .......................................................................... 9
Turning the Adherus AutoSpray ET Dural Sealant Device On ............................................... 10
Device and Treatment Site Preparation ................................................................................. 10
Treatment Delivery ................................................................................................................ 10
Stopping a Spray Application ................................................................................................ 11
Finishing a Delivery ............................................................................................................... 11
Adherus AutoSpray ET Dural Sealant Disposal.................................................................. 12
Adherus AutoSpray ET Dural Sealant Electrical Specifications ......................................... 12
Guidance & Manufacturer’s Declaration – Electromagnetic Emissions .................................. 12
Guidance and Manufacturer’s Declaration – Electromagnetic Immunity for all
Equipment and Systems ....................................................................................................... 13
Guidance and Manufacturer’s Declaration – Electromagnetic Immunity ................................ 14
Recommended Separation Distances Between Portable and Mobile RF
Communications and Adherus AutoSpray ET Dural Sealant ................................................. 15
EN
Page 4
4
Device Description
Adherus AutoSpray Extended Tip (ET) Dural Sealant is a sterile, single-use, electromechanical, battery operated
device with internal system components that provide air flow to aid in the delivery of a synthetic, absorbable, twocomponent hydrogel sealant system and allow delivery to be interrupted without clogging.
The device is supplied as a pre-assembled applicator and two separate glass vials. The two glass vials contain
either an activated polyethylene glycol (PEG) ester powder or a polyethyleneimine (PEI) dissolved in sterile water.
The crosslinking components are reconstituted prior to use by their respective reconstitution buffers which are
housed within the applicator. The resulting solutions mix within the extended applicator tip and quickly crosslink to
form the hydrogel sealant soon after exiting the applicator tip. The delivered solution immediately crosslinks to
form a hydrogel sealant which is absorbed over approximately 90 days, sufficient time to allow for healing.
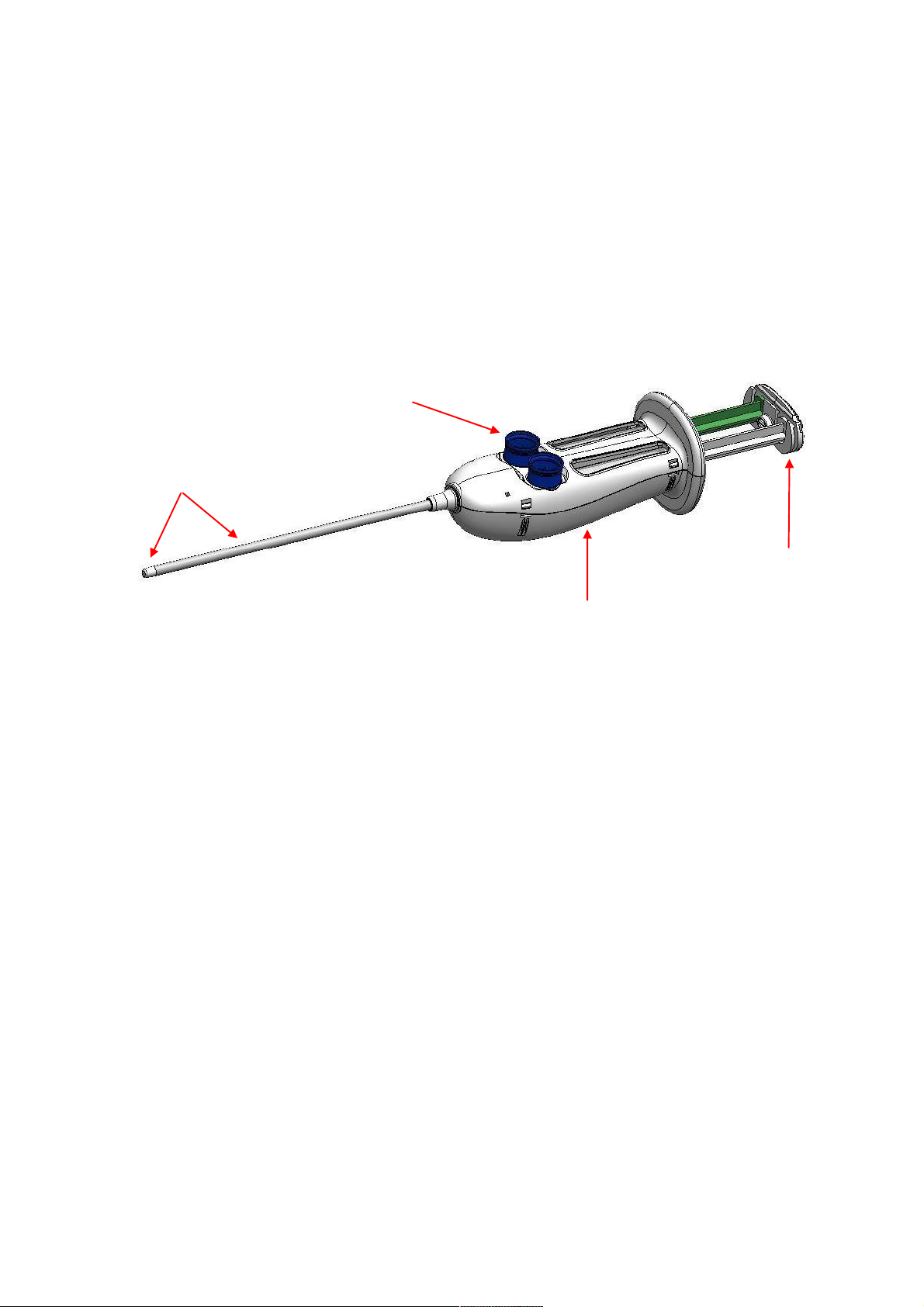
The Adherus AutoSpray ET Dural Sealant device is comprised of the following primary components:
Extended Tip Nozzle
The integrated extended tip nozzle is malleable and may be bent or shaped to preference. The extended tip
nozzle thoroughly mixes the two sealant solutions and delivers the mixed solution to the target site through a tight
spray pattern. The spray nozzle is integral to the system and is not removable.
Vial Adapter Hubs
The vial adapter hubs accept the vials containing the crosslinking components. During the reconstitution phase,
the vials are attached to the vial adapter hubs. After reconstitution is completed, the hubs are removed from the
Adherus AutoSpray ET Dural Sealant device by rotating them counterclockwise. Removing the hubs opens the
pathways for the solutions to flow through the nozzle.
On/Off Push Button Switch
The On/Off switch turns the battery powered air pump on and off. The device is shipped with the switch in the off
position which isolates the air pump from the battery power source. Before removing the vial adapter hubs, push
the On/Off switch to On and the air pump will be engaged.
Battery Door
A door on the underside of the housing allows the operating room (OR) staff to remove the batteries for
appropriate disposal at the end of the device use. The battery door is glued shut. Use a flat instrument to pry the
battery door open and remove the batteries for disposal.
Syringe Pusher Assembly
The syringe pusher assembly mechanically locks the two syringe plungers such that advancement of both syringe
plungers occurs simultaneously.
Indication
Adherus AutoSpray ET Dural Sealant is intended for use as an adjunct to standard methods of dural repair, such
as sutures, to provide watertight closure during cranial and spinal procedures.
Syringe Pusher
Assembly
Vial Adapter Hubs
Extended Tip Nozzle
On/Off Push Button
Page 5

5
Contraindications
Adherus AutoSpray ET Dural Sealant should not be used in confined anatomical spaces where nerve
compression is of concern. The hydrogel may swell by up to 13% of its size in any dimension.
Warnings
Adherus AutoSpray ET Dural Sealant has not been studied in:
Subjects who require a procedure involving a translabyrinthine, transsphenoidal, or transoral approach, or any
procedure that penetrates the air sinus or mastoid air cells;
Subjects whose dural edge gaps are larger than 2 mm;
Subjects with severely altered renal or hepatic function;
Subjects with an active infection present at the surgical site;
Subjects who have treated or untreated hydrocephalus (e.g., those with devices designed to evacuate
cerebrospinal fluid (CSF) or altered CSF dynamics);
Subjects who have an underlying medical co-morbidity or are on a medication known to interfere with wound
healing (e.g., those with previous intracranial neurosurgical procedure in the same anatomical location,
radiation and chemotherapy treatment, known malignancy, diabetes, steroid toxicity and chronic corticosteroid
use, compromised immune system, or on an anticoagulant agent, aspirin or non-steroid anti-inflammatory
agent);
Subjects with a known allergy to FD&C Blue #1 Dye or FD&C Yellow #5 Dye; or
Subjects who are pregnant or lactating.
Adherus AutoSpray ET Dural Sealant is intended for use as an adjunct to standard methods of dural repair. The
effectiveness of Adherus AutoSpray ET Dural Sealant on other tissue types has not been studied.
Precautions
The Adherus AutoSpray ET Dural Sealant is packaged sterile. Do not use if the trays have been damaged or
opened. Do not re-sterilize.
The Adherus AutoSpray ET Dural Sealant package is intended for single patient use only. Discard all unused and
/ or opened product. Reuse of the device may result in cross contamination which may lead to injury, illness or
death of the patient.
Keep away from sunlight. Do not use if the PEG ester powder is not free flowing.
Use Adherus AutoSpray ET Dural Sealant within 2 hours of reconstituting the crosslinking components. When
tested 8 hours after reconstitution, the resulting sealant swelled a small but statistically significant amount more
when compared to samples reconstituted for 1, 2, or 4 hours.
The extended applicator tip has been designed to conform to the surgical need by the introduction of bends along
the tip length. Apply careful pressure when bending the tip. Do not bend to angles of greater than 90°. Ensure
hydrogel flow once the applicator has been contoured for the surgical need.
The applicator system has a battery life of approximately 2 hours of continuous use.
Prior to application of the Adherus hydrogel, ensure that fluid (cerebrospinal fluid, blood etc.) outflow has been
suspended.
Do not use the Adherus AutoSpray ET Dural Sealant in the presence of flammable anesthetics or flammable
anesthetics with oxidants.
Keep the Adherus AutoSpray ET Dural Sealant device away from strong magnetic fields to avoid possible
interference of RF communication. Magnetic resonance equipment may generate interference with pump
operations.
Do not remove system covers other than the battery door.
Adverse Events
A similar device, Adherus AutoSpray Dural Sealant, containing the same sealant formulation, Adherus Dural
Sealant, was evaluated in 124 investigational patients in a prospective, controlled, multicenter pivotal clinical
study. The incidence and nature of adverse events observed in this patient population was consistent with the
type and complexity of the neurosurgical procedures performed and the co-morbid state of the treated patients.
There were 4 patient deaths among Adherus AutoSpray Dural Sealant subjects and five deaths among control
subjects. The deaths were attributed to the subjects’ prior condition. The adverse events occurring at a rate of 1%
or higher among the adverse events reported for the subjects treated with Adherus AutoSpray Dural Sealant are
summarized in the table below. There were no unanticipated adverse device effects.
Page 6

6
Table 1. Summary of Adherus AutoSpray Dural Sealant Adverse Events
Adverse Event
Patients (n (%))
N=124
Anaemia
3 (2.4)
Leukocytosis
2 (1.6)
Deafness Unilateral
2 (1.6)
Tinnitus
4 (3.2)
Diplopia
5 (4.0)
Eyelid Ptosis
2 (1.6)
Periorbital Oedema
6 (4.8)
Vision Blurred
7 (5.6)
Dysphagia
4 (3.2)
Nausea
2 (1.6)
Adverse Reaction
6 (4.8)
Chest Pain
3 (2.4)
Disease Progression
3 (2.4)
Fatigue
2 (1.6)
Pneumonia
2 (1.6)
Urinary Tract Infection
2 (1.6)
Wound Infection
2 (1.6)
Incision Site Hypoaesthesia
3 (2.4)
Incision Site Pain
4 (3.2)
Periorbital Haemorrhage
3 (2.4)
Post Procedural Oedema
2 (1.6)
Pseudomeningocele
9 (7.3)
Seroma
3 (2.4)
Subdural Haematoma
3 (2.4)
Wound Dehiscence
2 (1.6)
Muscular Weakness
2 (1.6)
Aphasia
4 (3.2)
Balance Disorder
2 (1.6)
Convulsion
5 (4.0)
Cranial Nerve Palsies Multiple
2 (1.6)
Dizziness
7 (5.6)
Embolic Stroke
2 (1.6)
Headache
14 (11.3)
Hemiparesis
2 (1.6)
Hypoaesthesia
4 (3.2)
Hypoglossal Nerve Paralysis
2 (1.6)
Memory Impairment
2 (1.6)
Nystagmus
3 (2.4)
Paraesthesia
5 (4.0)
Sensory Loss
3 (2.4)
Tremor
2 (1.6)
VIIth Nerve Paralysis
3 (2.4)
Vocal Cord Paralysis
2 (1.6)
Atelectasis
2 (1.6)
Respiratory Failure
2 (1.6)
Alopecia
2 (1.6)
Rash
2 (1.6)
Swelling Face
4 (3.2)
Clinical Information
A prospective, randomized, controlled, multicenter pivotal trial has been conducted to evaluate the use of Adherus
Dural Sealant, delivered using the Adherus AutoSpray applicator, as an adjunct to standard methods of dural
repair, such as sutures, to provide watertight closure during cranial surgery. The primary endpoint of this study
was a composite evaluation of the safety and effectiveness of Adherus AutoSpray Dural Sealant (n=124 subjects)
when compared to an active control (n=126 subjects). The endpoint results were based on the number of subjects
who were free from intra-operative CSF leakage from dural repair after up to two applications of sealant during
the Valsalva maneuver, CSF leak/pseudomeningocele during the 120-day follow-up period and unplanned
Page 7

7
retreatment of the original surgical site within 120 days post-surgery. The overall success rate for the complete
case analysis was 91.2% in the Adherus group compared to 90.6% in the control group. Adherus was found to be
non-inferior to the control with the non-inferiority margin of 10% (p = 0.005). In the early post-surgical period when
the sealants are expected to function, the overall success rate at the 14-day follow-up on subjects who completed
the visit was 99.1% in the Adherus group compared to 95.0% in the control group. In addition, the overall success
rate at the 45-day follow-up on subjects who completed the visit was 96.6% in the Adherus group compared to
91.9% in the control group. The freedom from primary endpoint failure analysis also showed that the primary
endpoint failures in the control group tended to occur early in the follow-up period while a majority of Adherus
endpoint failures were identified through protocol-required radiographic imaging at the 120-day follow-up visit.
Safety was assessed based on evaluation of wound healing, surgical site infections, meningitis, worsening
Modified Rankin Score, surgical site swelling and adverse events through the 120 day follow-up period. One
hundred (80.6%) subjects in the Adherus group and 98 (77.8%) subjects in the control group experienced at least
one adverse event within the 120 day follow-up period. There were no unanticipated adverse device effects.
Among the subjects treated with Adherus AutoSpray Dural Sealant, there were no device related deep wound
infections and no cases of meningitis. The type and rate of adverse events observed in this study are consistent
with the complexity of the surgical procedure and the co-morbid condition of the treated subjects.
Key Inclusion/Exclusion criteria for the study included the following:
Pre-Operative Inclusion Criteria:
Subject was ≥ 18 and ≤ 75 years of age.
Subject was scheduled for an elective cranial procedure involving a dural incision using any of the
following surgical locations / approaches (or combination): frontal, temporal, occipital and parietal (i.e.
supratentorial), and/or midline or lateral suboccipital (i.e. infratentorial).
Subject required a procedure involving a Class I/clean wound (uninfected surgical wound in which no
inflammation was encountered).
Pre-Operative Exclusion Criteria:
Subject required a procedure involving a translabyrinthine, transsphenoidal, transoral approach, or any
procedure that penetrates the air sinus or mastoid air cells. Note: Superficial penetration of mastoid air
cells was not an exclusion if cells were appropriately sealed (e.g. bone wax).
Subject had a CSF shunt such as; ventriculo-peritoneal, ventriculo-pleural, ventriculo-atrial or lumbo-
peritoneal shunts.
Subject had an external ventricular or lumbar CSF drain that must be left in place after surgery.
Subject had clinically significant hydrocephalus or clinical evidence of altered CSF dynamics.
Subject had undergone a previous intracranial neurosurgical procedure in the same anatomical location.
(Note: stereotactic biopsy was not exclusionary).
Subject experienced previous CSF leak (secondary to trauma, neoplasm, surgery or other etiology).
Subject had radiation treatment to the surgical site, or standard fractionated radiation therapy was
planned within ten days post index-procedure. (Note: stereotactic radiosurgery prior to the planned index
procedure was not an exclusion criterion).
Subject had experienced a traumatic injury to the head within 30 days prior to the planned index
procedure resulting in basilar skull fracture or fractures involving the paranasal sinuses.
Subject had a known malignancy or another condition with anticipated survival shorter than six months.
Subject had undergone chemotherapy treatment, excluding hormonal therapy, within three weeks prior to
the planned index procedure, or use of intracavitary chemotherapy wafer (BCNU) was planned, or
chemotherapy treatment was planned within two weeks after the index procedure was performed.
Standard use of peri-operative steroids (i.e., corticosteroids) was permitted. Chronic steroid use (defined
as daily use of corticosteroids for >/= 8 weeks) for the purposes of reducing the side effects of
chemotherapy and/or radiation therapy for cancer was not exclusionary unless the patient was deemed
by the investigator to be suffering from steroid toxicity. Use of corticosteroids on a chronic basis (as
defined previously) for purposes other than decreasing the symptoms of systemic chemotherapy was
exclusionary unless those steroids were discontinued 4 weeks prior to the planned index procedure.
Subject received warfarin, heparin, other anticoagulant agents, aspirin or non-steroid anti-inflammatory
agents on a daily basis and pre-surgical, standard of care drug wash-out did not occur.
Subject had a documented clinically significant coagulopathy with a PTT > 37 seconds, or INR > 1.3 INR
units.
Subject had a compromised immune system or autoimmune disease, or was on chronic
immunosuppressant agents at baseline.
Subject had a systemic infection or evidence of any infection near planned operative site.
Subject had a serum creatinine level > 2.0 mg/dL.
Subject had a serum total bilirubin > 2.5 mg/dL at baseline.
Page 8

8
Subject had uncontrolled diabetes as evidenced by the Institution’s standard of care (HbA1c >7%, blood
glucose, etc) at baseline.
Intra-Operative Inclusion Criteria:
Subject’s linear extent of durotomy was ≥ 2 cm.
Subject’s dural margins from the edges of bony defect were ≥ 3 mm throughout.
Subject’s CSF leak was present intra-operatively following completion of primary dural closure (with or
without non-autologous duraplasty or autologous tissue), either spontaneously or upon Valsalva
maneuver, at up to 20 cm H2O for up to five (5) seconds.
Intra-Operative Exclusion Criteria:
Subject had an Incidental finding that met any pre-operative exclusion criterion listed above.
Subject required the intra-operative placement of a CSF diversion device (e.g. ventricular catheter,
subdural catheter, lumbar drain, or other device designed to externally evacuate CSF) that was left in
place after the procedure. Note: Subgaleal drains used for acute post-operative management of the
incision site were permitted.
Subject had a gap > 2 mm present between dural edges, or between the edge of dura and duraplasty
material, based on visual estimate by surgeon before application of the surgical sealant.
Table 2. Summary of Demographic Information for Study Patients
Characteristics
Adherus AutoSpray
Dural Sealant
Population
Control Population
Number of Subjects
124
126
Men/Women
41/83
40/86
Median Age (years)
54.2
51.1
Subject ASA score (N (%))
I
2 (1.6)
8 (6.3)
II
47 (37.9)
50 (39.7)
III
69 (55.6)
62 (49.2)
IV
6 (4.8)
6 (4.8)
V
0 (0.0)
0 (0.0)
Primary indication for surgery (N (%))
Tumor
56 (45.2)
53 (42.1)
Epilepsy
1 (0.8)
1 (0.8)
Nerve decompression
17 (13.7)
21 (16.7)
AVM
3 (2.4)
5 (4.0)
Aneurysm
28 (22.6)
26 (21.3)
Chiari malformation
17 (13.7)
18 (14.3)
Cyst
2 (1.6)
1 (0.8)
Other
0 (0.0)
1 (0.8)
Approach (N (%))
Infratentorial
53 (42.7)
52 (41.3)
Supratentorial
71 (57.3)
74 (58.7)
Primary technique for dural closure (N (%))
Suture
48 (38.7)
48 (38.1)
Suture + autologous dural material
29 (23.4)
34 (27.0)
Suture + non-autologous dural material
45 (36.3)
39 (31.0)
AEs reported at a rate of great than 1% in the intent to treat (ITT) subject population are summarized in Table 1,
above.
Page 9

9
Adherus AutoSpray ET Dural Sealant Sterilization Method and Device Disposal
The following table details the method of sterilization and disposal of the Adherus AutoSpray ET Dural Sealant
device.
Description
Part Number
Sterilization
Method
Frequency of
Use
Method of Disposal
Adherus
AutoSpray
ET Dural
Sealant
NUS-009
Radiation
Single Use Only
Dispose of the Adherus
AutoSpray ET Dural Sealant
device in a hospital approved
biohazard container.
Do not place in the trash!
Environmental Operating Conditions
Storage Temperature
Store below 30oC
Operating Temperature
5oC to 35oC
Noise Level
≤60 db
How Supplied
The components of the Adherus AutoSpray ET Dural Sealant package are:
Adherus AutoSpray ET Dural Sealant kit tray (1)
Pre-Assembled applicator (1)
Activated PEG powder in green capped vial (1)
PEI solution in silver capped vial (1)
Adherus AutoSpray ET Dural Sealant Operations
The following sections give instructions for preparing and powering Adherus AutoSpray ET Dural Sealant.
Reconstituting the Crosslinking Components
1) Using aseptic technique, introduce the contents of the outer tray labeled Adherus AutoSpray ET Dural
Sealant into the sterile field.
2) Remove the lid from the Adherus AutoSpray ET Dural Sealant kit tray.
3) Remove the pre-assembled Adherus AutoSpray ET Dural Sealant applicator.
4) With the device oriented such that the extended tip nozzle is pointing up, remove and discard the red caps
covering the spikes on the blue vial adapter hubs on the applicator (Fig. A-1).
Note: It may be necessary to use hemostats or a similar tool to remove the caps. A twisting motion while
removing the cap is also recommended.
5) Remove the vial containing PEI solution (silver capped vial) from the tray and seat the capped end into the
blue vial adapter hub of the applicator corresponding to the white syringe plunger by grasping the applicator
and fully depressing the vial so that the spike penetrates the septa and the silver aluminum seal bottoms out
in the vial adapter hub (Fig. A-2).
6) Remove the vial containing the PEG ester powder (green capped vial) from the tray and seat the capped
end into the blue vial adapter hub of the applicator corresponding to the green syringe plunger by grasping
the applicator and fully depressing the vial so that the spike penetrates the septa and the green aluminum
seal bottoms out in the vial adapter hub (Fig. A-2).
7) With the vials oriented upward, depress the syringe pusher assembly to transfer the liquids into the vials.
Continue to depress the syringe pusher assembly (Fig. A-3).
Note: Use two hands to depress the syringe pusher assembly if necessary.
8) With the syringe pusher assembly still depressed, gently shake the device intermittently until the powder is
completely dissolved (Fig. A-3).
Note: The PEG ester powder will continue to dissolve in between periods of gentle shaking; overly
aggressive shaking can cause excessive entrapped air bubbles.
9) Release the syringe pusher assembly to allow it to rebound backwards and depress a second time to ensure
both solutions are homogeneous.
Page 10

10
10) Allow the syringe pusher assembly to rebound backwards again and pull the syringe pusher assembly
backwards until all of the reconstituted ingredients are transferred from the vials (overhead view in Fig. A-4).
Note: If the On/Off Push Button is accidentally engaged during the reconstitution phase, the device may be
turned off with no detrimental effects. Use must be completed within two hours of reconstitution for optimal
results.
Turning the Adherus AutoSpray ET Dural Sealant Device On
11) Push the On/Off button on the bottom of the device to “activate” the system prior to hydrogel spray
application (Fig. B-1).
Note: The Adherus AutoSpray ET Dural Sealant applicator should be activated prior to removal of the vial
adapter hubs, just prior to spray application, to avoid inadvertently clogging the nozzle.
Device and Treatment Site Preparation
12) If not already on, push the On/Off button to turn on the Adherus AutoSpray ET Dural Sealant applicator (Fig.
B-1).
Note: The internal air pump is activated by pushing the On/Off button, providing an audible sound that the
system has been activated. If the audible sound from the pump is not present, discontinue use of the current
Adherus AutoSpray ET Dural Sealant unit and follow instructions in the Troubleshooting section.
13) Prior to treatment delivery, orient the device so that the vials are pointed upwards and remove and discard
both vial adapter hubs by rotating the blue hubs counterclockwise until the hubs are ejected from the device
(overhead view in Fig. B-2).
14) For optimal tissue adherence at the treatment site, ensure that 2 to 3 millimeter margins around the defect
are clear of blood, hemostatic agents or other loose tissues and that cerebrospinal fluid outflow is minimized.
15) If necessary, bend or shape the extended tip nozzle to improve access to and/or visualization of the
treatment site.
Treatment Delivery
16) To apply the prepared product, if not already on, push the On/Off button in to turn on the device.
17) Orient the device such that the body of the applicator is pointed up and hold a piece of gauze approximately
5 to 10 centimeters above the nozzle (Fig. B-3).
18) Apply firm even pressure to the center of the syringe pusher assembly until product begins to spray out of
the nozzle (Fig. B-3).
19) Once a green sealant begins to form on the piece of gauze, stop depressing the syringe pusher assembly.
Adherus AutoSpray ET Dural Sealant is now ready for the treatment delivery.
Page 11

11
20) While aiming at the treatment site and holding the device nozzle approximately 2 to 4 centimeters away,
apply firm even pressure to the center of the syringe pusher assembly to dispense the mixed solution (Fig.
B-4).
21) Continue applying the Adherus sealant system until a thin coating (approximately 1 – 2 mm) is formed.
Note: Gauging Thickness:
Sutured dural closure: Ensure that all suture knots are completely covered with hydrogel
sealant. Typically, size 4-0, size 3-0 and size 2-0 sutures are used for dural closure. The
smallest of these is size 4-0 which has a diameter of 0.15 mm to 0.2 mm. A knot of size 4-0
suture will have at least four widths of suture or approximately 0.6 to 0.8 mm of thickness.
Complete knot coverage ensures that the minimum thickness of application is achieved.
Onlay duraplasty closure: Ensure that enough hydrogel sealant is applied to cover the
duraplasty onlay and at least 3-4 mm of surrounding native dura with 1-2 mm of hydrogel
using the height of the onlay material as a depth reference. Note that when moistened with
saline, two common onlay duraplasty materials, DuraGen® Dural Graft Matrix and
Durepair® Dura Regeneration Matrix are approximately 3 mm and 1 mm thick respectively.
Stopping a Spray Application
22) The application may be interrupted at any time during a treatment by halting the pressure applied to the
pusher assembly. However, to prevent clogging, do not turn off the pump until the final sealant application
has been completed.
Note: If excess hydrogel forms on the spray nozzle during an application, it may be removed by gently
wiping with a piece of gauze.
Finishing a Delivery
23) If necessary, excess sealant beyond the edges of the dural margin may be removed with a Penfield probe,
scissors or mechanical disruption.
Page 12

12
Adherus AutoSpray ET Dural Sealant Disposal
When the final spray application is complete, turn off the device, open the battery door to break the internal seal
and remove the batteries for appropriate disposal. The following table relays important information regarding
disposal of the Adherus AutoSpray ET Dural Sealant components.
Device
Disposal Instructions
Adherus AutoSpray ET
Dural Sealant
Adherus AutoSpray ET Dural Sealant consists of a plastic
enclosure and electrical components. This device must be taken
to separate collection at the product end of life. Do not dispose
of this product as unsorted municipal waste.
Troubleshooting Adherus AutoSpray ET Dural Sealant
The following potential failure modes for Adherus AutoSpray ET Dural Sealant have been identified. Each of the
failure modes includes a safeguard (as listed below) to control for the results of such malfunctions.
Potential Failure Modes
Safeguard
1. Air-pump not activated
1. On/Off switch not depressed
2. Spray nozzle blocked
2. Do not remove vial adapter hubs prior to turning
on air pump, wipe off nozzle after use.
To avoid complications, follow exactly the Adherus AutoSpray ET Dural Sealant Troubleshooting Flow Chart in
the above table. During a procedure, the user’s efforts to troubleshoot Adherus AutoSpray ET Dural Sealant
should be strictly limited to the steps described above. If troubleshooting is not successful, discontinue use of the
current Adherus AutoSpray ET Dural Sealant unit immediately and open a new Adherus AutoSpray ET Dural
Sealant unit.
Adherus AutoSpray ET Dural Sealant Electrical Specifications
The Adherus AutoSpray ET Dural Sealant meets the following standards:
IEC 60601-1 3rd edition Electrical safety standard requirements
IEC 60601-1-2 3rd edition Immunity requirements
Guidance & Manufacturer’s Declaration – Electromagnetic Emissions
Adherus AutoSpray ET Dural Sealant is intended for use in the electromagnetic environment specified below. The
customer or user of Adherus AutoSpray ET Dural Sealant should assure that it is only used in such an
environment.
Emissions Test
Compliance
Electromagnetic Environment Guidance
RF emissions CISPR 11
Group 1
Adherus AutoSpray ET Dural Sealant uses RF energy only for its
internal function. Therefore, its RF emissions are very low and are
not likely to cause interference in nearby electronic equipment.
RF emissions
CISPR 11
Class B
Adherus AutoSpray ET Dural Sealant is suitable for use in all
establishments, including domestic establishments and those
directly connected to the public low-voltage power supply network
that supplies buildings used for domestic purposes.
Harmonic emissions IEC
61000-3-2
Not applicable
Voltage fluctuations /Flicker
emissions IEC 61000-3-3
Not applicable
Page 13

13
Guidance and Manufacturer’s Declaration – Electromagnetic Immunity for all Equipment and Systems
Adherus AutoSpray ET Dural Sealant is a battery operated system and is intended for use in the electromagnetic
environment specified below. The customer or user of Adherus AutoSpray ET Dural Sealant should assure that it
is used in such an environment.
Immunity Test
IEC 60601
Test Level
Compliance Level
Electromagnetic Environment-
Guidance
Electrostatic
discharge (ESD)
IEC 61000-4-2
±6 kV contact
±8 kV air
Not Applicable Battery
Operated System with
no Digital Circuitry
Floors should be wood, concrete or
ceramic tile. If floors are covered with
synthetic material, the relative humidity
should be at least 30%
Electrical fast
transient/burst
IEC 61000-4-4
±2 kV for power
supply lines
±1 kV for input/output
lines
Not Applicable Battery
Operated System
Main power quality should be that of a
typical commercial or hospital
environment
Surge
IEC 61000-4-5
±1 kV differential
mode
±2 kV common mode
Not Applicable Battery
Operated System
Main power quality should be that of a
typical commercial or hospital
environment.
Voltage dips, short
interruptions and
voltage variations on
power supply input
lines
IEC 61000-4-11
<5 % U
T
(>95 % dip in UT) for
0,5 cycle
40 % U
T
(60 % dip in UT)
for 5 cycles
70% U
T
(30% dip in UT)
for 25 cycles
<5% U
T
(>95 % dip in UT)
for 5 sec
Not Applicable Battery
Operated System
Main power quality should be that of a
typical commercial or hospital
environment. If the user of the
equipment requires continued operation
during power main interruptions, it is
recommended that the equipment be
powered from an uninterruptible power
supply or battery.
Power frequency
(50/60 Hz)
magnetic field
IEC 61000-4-8
3 A/m
Not Applicable Battery
Operated System with
no Magnetically
Sensitive Components
Power frequency magnetic fields should
be at levels characteristic of a typical
location in a typical commercial or
hospital environment.
*NOTE: UT is the a.c. main voltage prior to application of the test level.
Page 14

14
Guidance and Manufacturer’s Declaration – Electromagnetic Immunity
Adherus AutoSpray ET Dural Sealant is intended for use in the electromagnetic environment specified below. The
customer or user of Adherus AutoSpray ET Dural Sealant should assure that it is used in such an environment.
Immunity Test
IEC 60601 Test
Level
Compliance
Level
Electromagnetic Environment-Guidance
Conducted RF
IEC 61000-4-6
Radiated RF
IEC 61000-4-3
3 Vrms
150 kHz to 80
MHz
3 V/m
80MHz to 2.5GHz
Not Applicable
Battery
Operated
System with no
Digital Circuitry
Not Applicable
Battery
Operated
System with no
Digital Circuitry
Portable and mobile RF communications equipment
should be used no closer to any part of Adherus
AutoSpray ET Dural Sealant, including cables, than the
recommended separation distance calculated from the
equation applicable to the frequency of the transmitter.
Recommended Separation Distance
d = 1.2√P
d = 1.2√P 80MHz to 800MHz
d = 2.3√P 800MHz to 2.5GHz
Where P is the maximum output power rating of the
transmitter in watts (W) according to the transmitter
manufacturer and d is the recommended separation
distance in meters (m).
Field strengths from fixed RF transmitters, as
determined by an electromagnetic site survey a, should
be less than the compliance level in each frequency
range.
b
Interference may occur in the vicinity of equipment
marked with the following symbol:
Note 1 At 80 MHz and 800 MHz, the higher frequency range applies.
Note 2 These guidelines may not apply in all situations. Electromagnetic propagation is affected by absorption and reflection
from structures, objects and people.
a Field strengths from fixed transmitters, such as base stations for radio (cellular/cordless) telephones and land mobile
radios, amateur radio, AM and FM radio broadcast and TV broadcast cannot be predicated theoretically with
accuracy. To assess the electromagnetic environment due to fixed RF transmitters, an electromagnetic site
survey should be considered. If the measured field strength in the location in which Adherus AutoSpray ET Dural
Sealant is used exceeds the applicable RF compliance level above, the Adherus AutoSpray ET Dural Sealant
device should be observed to verify normal operation. If abnormal performance is observed, additional measures
may be necessary, such as re-orienting or relocating the Adherus AutoSpray ET Dural Sealant device.
b Over the frequency range 150 kHz to 80 MHz, field strengths should be less the 3V/m
Page 15

15
Recommended Separation Distances Between Portable and Mobile RF
Communications and Adherus AutoSpray ET Dural Sealant
Adherus AutoSpray ET Dural Sealant is intended for use in an electromagnetic environment in which radiated RF
disturbances are controlled. The customer or user of the Adherus AutoSpray ET Dural Sealant device can help
prevent electromagnetic interference by maintaining a minimum distance between portable and mobile RF
communications equipment (transmitters) and the Adherus AutoSpray ET Dural Sealant device as recommended
below, according to the maximum output power of the communications equipment.
Rated maximum
output power of
transmitter
W
Separation distance according to frequency of transmitter
m
150 kHz to 80 MHz
d = 1.2√P
80 MHz to
800 MHz
d = 1.2√P
800 MHz to
2.5 GHz
d = 2.3√P
0.01
0.12
0.12
0.23
0.1
0.38
0.38
0.73
1
1.2
1.2
2.3
10
3.8
3.8
7.3
100
12
12
23
For transmitters rated at a maximum output power not listed above, the recommended separation distance d in meters (m) can
be estimated using the equation applicable to the frequency of the transmitter, where P is the maximum output power rating of
the transmitter in watts (W) according to the transmitter manufacturer.
NOTE 1: At 80 MHz and 800 MHz, the separation distance for the higher frequency range applies.
NOTE 2: These guidelines may not apply in all situations. Electromagnetic propagation is affected by absorption and reflection
from structures, objects and people.
Page 16

16
Explicación de los símbolos
La tabla siguiente muestra los símbolos utilizados en este manual, en los componentes del sistema y en las
etiquetas del envase. La tabla indica el significado correspondiente de cada símbolo. Preste atención a estos
símbolos, ya que pueden relacionarse con precauciones y advertencias importantes de seguridad.
Símbolo
Significado
Consultar las instrucciones de uso para obtener más información
Para un solo uso; no reutilizar
No reesterilizar
Producto esterilizado con radiación
Fecha de caducidad: año y último día del mes
No utilizar si el envase está dañado
Mantener alejado de la luz solar
No desechar con los residuos normales
Representante autorizado en la Comunidad Europea
0050
Marca CE y número de identificación del organismo notificado
Número de lote
Número de catálogo
Cantidad
Fabricante
Equipo de tipo BF (pieza aplicada, flotante no cardíaca)
Corriente continua
Límites de temperatura (almacenar por debajo)
Peligro biológico
Encendido y apagado (botón pulsador)
Page 17

17
Índice
Descripción del dispositivo ............................................................................................... 18
Indicaciones ....................................................................................................................... 19
Contraindicaciones ............................................................................................................ 19
Advertencias: ..................................................................................................................... 19
Precauciones ..................................................................................................................... 19
Efectos adversos ............................................................................................................... 20
Información clínica ............................................................................................................. 21
Método de esterilización del sellador de duramadre Adherus AutoSpray
ET y eliminación del dispositivo ........................................................................................ 24
Condiciones ambientales de funcionamiento ................................................................... 24
Presentación ...................................................................................................................... 24
Operaciones del sellador de duramadre Adherus AutoSpray ET ..................................... 24
Reconstitución de los componentes reticulantes ................................................................... 24
Encendido del dispositivo del sellador de duramadre Adherus AutoSpray ET ....................... 25
Preparación del dispositivo y del lugar del tratamiento .......................................................... 25
Administración del tratamiento .............................................................................................. 26
Detención de la aplicación de pulverización .......................................................................... 26
Finalización de una administración ....................................................................................... 26
Eliminación del sellador de duramadre Adherus AutoSpray ET ........................................ 27
Especificaciones eléctricas del sellador de duramadre Adherus AutoSpray ET .............. 28
Guía y declaración del fabricante: Emisiones electromagnéticas .......................................... 28
Guía y declaración del fabricante: Inmunidad electromagnética de todos los equipos
y sistemas ............................................................................................................................. 29
Guía y declaración del fabricante: Inmunidad electromagnética ............................................ 30
Distancias de separación recomendadas entre los equipos portátiles o móviles
de comunicación por radiofrecuencia y el sellador de duramadre Adherus AutoSpray ET .... 31
ES
Page 18

18
Descripción del dispositivo
El sellador de duramadre de punta extendida Adherus AutoSpray (Extended Tip, ET) es un dispositivo
electromecánico, alimentado por pilas, estéril y de un solo uso con componentes de sistema internos que
proporcionan un flujo de aire para facilitar la administración de un sistema sellador de hidrogel sintético,
absorbible y de dos componentes, y permitir la interrupción de la administración sin que se produzcan
obstrucciones.
El dispositivo se suministra como un aplicador preensamblado y dos frascos de vidrio aparte. Los dos frascos de
vidrio contienen uno polvo de éster de polietilenglicol (PEG) activado y el otro una polietileneimina (PEI) disuelta
en agua estéril. Los componentes reticulantes son reconstituidos antes de su uso por sus tampones de
reconstitución respectivos, contenidos en el interior del aplicador. Las soluciones resultantes se mezclan dentro
de la punta extendida del aplicador y se reticulan rápidamente para formar el sellador de hidrogel poco después
de salir por la punta del aplicador. La solución aplicada se reticula inmediatamente para formar un sellador de
hidrogel que es absorbido en un periodo de unos 90 días, tiempo suficiente para permitir la cicatrización.
El sellador de duramadre Adherus AutoSpray ET está compuesto por los siguiente componentes principales:
Boquilla de punta extendida
La boquilla de punta extendida integrada es maleable y puede doblarse o moldearse como se desee. La boquilla
de punta extendida mezcla bien las dos soluciones selladoras y administra la solución mezclada en el lugar
deseado a través de un estrecho patrón de pulverización. La boquilla pulverizadora está integrada en el sistema
y no es de quita y pon.
Conectores adaptadores para frascos
Los conectores adaptadores para frascos permiten acoplar los frascos que contienen los componentes
reticulantes. Durante la fase de reconstitución, los frascos se acoplan a los conectores adaptadores para frascos.
Una vez finalizada la reconstitución, los conectores se retiran del sellador de duramadre Adherus AutoSpray ET
girándolos en sentido contrario al de las agujas del reloj. Al retirar los conectores se abren las vías que permiten
que las soluciones fluyan a través de la boquilla.
Interruptor de botón pulsador de encendido y apagado
El interruptor de encendido y apagado enciende y apaga la bomba de aire alimentada por pilas. El dispositivo se
suministra con el interruptor en la posición de apagado que aísla la bomba de aire de la fuente de alimentación
por pilas. Antes de retirar los conectores adaptadores para frascos, pulse el interruptor de encendido y apagado
para ponerlo en la posición de encendido y accionar la bomba de aire.
Cubierta de las pilas
Una cubierta situada en la parte inferior de la carcasa permite al personal de quirófano extraer las pilas para la
eliminación adecuada al acabar de utilizar el dispositivo. La cubierta de las pilas está cerrada con pegamento.
Utilice un instrumento plano para abrir la cubierta de las pilas y retirar estas para la eliminación.
Conjunto impulsor de las jeringas
El conjunto impulsor de las jeringas fija mecánicamente los dos émbolos de las jeringas de forma que el avance
de los dos émbolos tiene lugar simultáneamente.
Conjunto impulsor de
las jeringas
Conectores adaptadores
para frascos
Boquilla de punta extendida
Botón pulsador de encendido
y apagado
Page 19

19
Indicaciones
El sellador de duramadre Adherus AutoSpray ET está indicado para utilizarse como complemento de los
métodos habituales de reparación de la duramadre —como, por ejemplo, la sutura— para conseguir un cierre
hermético durante los procedimientos craneales y de columna vertebral.
Contraindicaciones
El sellador de duramadre Adherus AutoSpray ET no deberá utilizarse en espacios anatómicos confinados en los
que exista la posibilidad de que se produzca compresión de nervios. El hidrogel puede hincharse hasta un 13 %
de su tamaño en cualquier dimensión.
Advertencias
El sellador de duramadre Adherus AutoSpray ET no se ha estudiado en:
Pacientes que requieran un procedimiento que incluya un acceso translaberíntico, transesfenoidal o
transoral, o cualquier procedimiento que penetre en el seno aéreo o en las celdillas aéreas mastoideas;
Pacientes cuyos huecos entre los bordes de la duramadre tengan más de 2 mm;
Pacientes con alteraciones graves de la función renal o la hepática;
Pacientes con una infección activa presente en la zona quirúrgica;
Pacientes con hidrocefalia tratada o no tratada (esto es, aquellos que tengan dispositivos diseñados para
evacuar líquido cefalorraquídeo (LCR) o alteraciones de la dinámica del LCR);
Pacientes que tengan una enfermedad concomitante subyacente o que estén tomando una medicación que
se sepa que interfiera en la cicatrización de heridas (p. ej., aquellos en los que se haya realizado un
procedimiento neuroquirúrgico intracraneal previo en el mismo lugar anatómico, que se hayan sometido a
radioterapia o quimioterapia, que se sepa que tienen cáncer, diabetes, toxicidad por esteroides y uso crónico
de corticoesteroides, que tengan afectado el sistema inmunitario o que estén tomando un anticoagulante,
ácido acetilsalicílico o un antiinflamatorio no esteroideo);
Pacientes alérgicos al colorante azul FD&C n.° 1 o al colorante amarillo FD&C n.° 5; o
Pacientes embarazadas o lactantes.
El sellador de duramadre Adherus AutoSpray ET está indicado para utilizarse como complemento de los
métodos habituales de reparación de la duramadre. No se ha estudiado la eficacia del sellador de duramadre
Adherus AutoSpray ET en otros tipos de tejido.
Precauciones
El sellador de duramadre Adherus AutoSpray ET está envasado estéril. No utilice el producto si las bandejas
presentan daños o han sido abiertas. No reesterilice el producto.
El sellador de duramadre Adherus AutoSpray ET está indicado para uso en un solo paciente. Deseche todo el
producto no utilizado o abierto. La reutilización del dispositivo puede producir contaminación cruzada que, a su
vez, puede provocar lesiones, enfermedades o la muerte del paciente.
Mantenga el producto alejado de la luz solar. No utilice el producto si el polvo de éster de PEG no fluye
libremente.
Utilice el sellador de duramadre Adherus AutoSpray ET en las 2 horas posteriores a la reconstitución de los
componentes reticulantes. Cuando se probó 8 horas después de la reconstitución, el sellador resultante se
hinchó más —en un grado pequeño, pero estadísticamente significativo— que los que llevaban reconstituidos 1,
2 o 4 horas.
La punta extendida del aplicador está diseñada para adaptarse a la necesidad quirúrgica mediante la
introducción de curvas a lo largo de la longitud de la punta. Aplique presión con cuidado al doblar la punta. No
doble a ángulos de más de 90°. Asegúrese de que haya flujo de hidrogel una vez que se haya moldeado el
aplicador para la necesidad quirúrgica.
La vida de las pilas del sistema aplicador es de aproximadamente 2 horas de uso continuo.
Antes de la aplicación del hidrogel Adherus, asegúrese de que se haya suspendido el flujo saliente de líquido
(líquido cefalorraquídeo, sangre, etc.).
No utilice el sellador de duramadre Adherus AutoSpray ET en presencia de anestésicos inflamables o
anestésicos inflamables con oxidantes.
Mantenga el dispositivo del sellador de duramadre Adherus AutoSpray ET alejado de campos magnéticos
intensos para evitar posibles interferencias en las comunicaciones por RF. Los equipos de resonancia magnética
pueden interferir en las operaciones de la bomba.
No retire ninguna de las cubiertas del sistema, aparte de la cubierta de las pilas.
Page 20

20
Efectos adversos
Un dispositivo similar, el sellador de duramadre Adherus AutoSpray, que contiene la misma fórmula de sellador,
el sellador de duramadre Adherus, se evaluó en 124 pacientes tratados en el marco de un estudio clínico
fundamental prospectivo, controlado y multicéntrico. La incidencia y la naturaleza de los efectos adversos
observados en esta población de pacientes fueron congruentes con el tipo y la complejidad de los
procedimientos neuroquirúrgicos realizados, así como con las enfermedades concomitantes de los pacientes
tratados. Hubo cuatro muertes de pacientes en el grupo del sellador de duramadre Adherus AutoSpray y cinco en
el grupo de control. Las muertes se atribuyeron al cuadro clínico anterior de los sujetos. Los efectos adversos
que se dieron con una proporción de un 1 % o más entre los efectos adversos documentados en los pacientes
tratados con el sellador de duramadre Adherus AutoSpray se resumen en la tabla siguiente. No se observaron
efectos adversos debidos al dispositivo no esperados.
Tabla 1. Resumen de los efectos adversos del sellador de duramadre Adherus AutoSpray
Efecto adverso
Pacientes (n (%))
N=124
Anemia
3 (2,4)
Leucocitosis
2 (1,6)
Sordera unilateral
2 (1,6)
Acúfenos
4 (3,2)
Diplopía
5 (4,0)
Ptosis palpebral
2 (1,6)
Edema periorbitario
6 (4,8)
Visión borrosa
7 (5,6)
Disfagia
4 (3,2)
Náuseas
2 (1,6)
Reacción adversa
6 (4,8)
Dolor torácico
3 (2,4)
Empeoramiento de la enfermedad
3 (2,4)
Fatiga
2 (1,6)
Neumonía
2 (1,6)
Infección de las vías urinarias
2 (1,6)
Infección de la herida
2 (1,6)
Hipoestesia del lugar de la incisión
3 (2,4)
Dolor en el lugar de la incisión
4 (3,2)
Hemorragia periorbitaria
3 (2,4)
Edema posterior al procedimiento
2 (1,6)
Pseudomeningocele
9 (7,3)
Seroma
3 (2,4)
Hematoma subdural
3 (2,4)
Dehiscencia de la herida
2 (1,6)
Debilidad muscular
2 (1,6)
Afasia
4 (3,2)
Trastorno del equilibrio
2 (1,6)
Convulsión
5 (4,0)
Parálisis múltiples de nervios
craneales
2 (1,6)
Mareo
7 (5,6)
Ictus embólico
2 (1,6)
Dolor de cabeza
14 (11,3)
Hemiparesia
2 (1,6)
Hipoestesia
4 (3,2)
Parálisis del nervio hipogloso
2 (1,6)
Deterioro de la memoria
2 (1,6)
Nistagmo
3 (2,4)
Parestesia
5 (4,0)
Pérdida de sensibilidad
3 (2,4)
Temblor
2 (1,6)
Parálisis del nervio VII
3 (2,4)
Parálisis de las cuerdas vocales
2 (1,6)
Atelectasia
2 (1,6)
Insuficiencia respiratoria
2 (1,6)
Alopecia
2 (1,6)
Erupción cutánea
2 (1,6)
Inflamación facial
4 (3,2)
Page 21

21
Información clínica
Se realizó un estudio clínico fundamental prospectivo, aleatorizado, controlado y multicéntrico para evaluar el uso
del sellador de duramadre Adherus, administrado con el aplicador Adherus AutoSpray, como complemento de los
métodos habituales de reparación de la duramadre —como, por ejemplo, la sutura— para conseguir un cierre
hermético durante intervenciones quirúrgicas craneales. El criterio principal de valoración de este estudio fue una
evaluación compuesta de la seguridad y la eficacia del sellador de duramadre Adherus AutoSpray (n=124
pacientes) comparadas con las de un grupo de control activo (n=126 pacientes). Los resultados del criterio de
valoración se basaron en el número de pacientes que no mostraron fuga intraoperatoria de LCR derivada de la
reparación de la duramadre después de hasta dos aplicaciones de sellador durante la maniobra de Valsava, fuga
de LCR o pseudomeningocele durante el periodo de seguimiento de 120 días y retratamiento no planificado del
lugar quirúrgico original en los 120 primeros días del postoperatorio. La tasa de éxito global del análisis de casos
completos del grupo de Adherus fue del 91,2 %, y la del grupo de control, del 90,6 %. Se observó que el Adherus
no era inferior al control con un margen de no inferioridad del 10 % (p = 0,005). En el postoperatorio inicial,
cuando se espera que los selladores actúen, la tasa de éxito global en el seguimiento de 14 días de los pacientes
que realizaron la visita fue del 99,1 % en el grupo de Adherus, frente al 95,0 % en el grupo de control. Además, la
tasa de éxito global en el seguimiento de 45 días de los pacientes que realizaron la visita fue del 96,6 % en el
grupo de Adherus, frente al 91,9 % en el grupo de control. El análisis de los resultados de los pacientes que no
mostraron fracaso en el criterio principal de valoración también mostró que los fracasos en el criterio principal de
valoración del grupo de control solían producirse al inicio del periodo de seguimiento, mientras que la mayoría de
los fracasos en el criterio de valoración de los pacientes tratados con Adherus se identificaron mediante estudios
radiográficos requeridos por el protocolo en la visita de seguimiento de 120 días.
La seguridad se valoró sobre la base de la evaluación de la cicatrización de la herida, las infecciones del lugar
quirúrgico, la meningitis, el empeoramiento de la puntuación modificada de Rankin, la inflamación del lugar
quirúrgico y los efectos adversos observados durante el periodo de seguimiento de 120 días. Cien (80,6 %)
pacientes del grupo de Adherus y 98 (77,8 %) del grupo de control sufrieron al menos un efecto adverso durante
el periodo de seguimiento de 120 días. No se observaron efectos adversos debidos al dispositivo no esperados.
Entre los pacientes tratados con el sellador de duramadre Adherus AutoSpray no se observaron infecciones
profundas de la herida relacionadas con el dispositivo, ni hubo casos de meningitis. El tipo y la tasa de efectos
adversos observados en este estudio fueron congruentes con la complejidad del procedimiento quirúrgico, así
como con las enfermedades concomitantes de los pacientes tratados.
Los criterios principales de inclusión y exclusión del estudio incluyeron los siguientes:
Criterios de inclusión preoperatorios:
Paciente mayor de 18 años y menor de 75 años.
Paciente que tenía concertado un procedimiento craneal programado que incluía una incisión en la
duramadre utilizando alguno de los siguientes lugares o accesos quirúrgicos (o alguna combinación de
ellos): frontal, temporal, occipital y parietal (esto es, supratentorial), y suboccipital en línea media o lateral
(esto es, infratentorial).
Paciente que requería un procedimiento que incluía una herida de clase I/limpia (herida quirúrgica no
infectada en la que no se encontró inflamación).
Criterios de exclusión preoperatorios:
Paciente que requería un procedimiento que incluía un acceso translaberíntico, transesfenoidal o
transoral, o cualquier procedimiento que penetre en el seno aéreo o en las celdillas aéreas mastoideas.
Nota: La penetración superficial de las celdillas aéreas mastoideas no constituyó un criterio de exclusión
si las celdillas se habían sellado adecuadamente (p. ej., con cera ósea).
Paciente que tenía una derivación de LCR, como derivaciones ventriculoperitoneal, ventriculopleural,
ventriculoauricular o lumboperitoneal.
Paciente que tenía un drenaje de LCR lumbar o ventricular externo que debía dejarse colocado tras la
intervención quirúrgica.
Paciente que tenía hidrocefalia clínicamente considerable o indicios clínicos de alteraciones de la
dinámica del LCR.
Paciente que se había sometido a un procedimiento neuroquirúrgico intracraneal previo en el mismo
lugar anatómico. (Nota: La biopsia estereotáctica no constituyó un criterio de exclusión).
Paciente que había experimentado fugas de LCR previas (derivadas de traumatismo, neoplasia,
intervención quirúrgica u otra causa).
Paciente que se había sometido a radioterapia del lugar quirúrgico, o que tenía programada radioterapia
fraccionada convencional en los diez días posteriores al procedimiento inicial. (Nota: La radiocirugía
estereotáctica previa al procedimiento inicial planificado no constituyó un criterio de exclusión).
Page 22

22
Paciente que había experimentado, en los 30 días anteriores al procedimiento inicial planificado, una
lesión traumática en la cabeza que había provocado una fractura craneal basilar o fracturas que
afectaban a los senos paranasales.
Paciente que se sabía que tenía cáncer u otra afección con una supervivencia prevista de menos de seis
meses.
Paciente que se había sometido a quimioterapia, excluida la terapia hormonal, en las tres semanas
anteriores al procedimiento inicial planificado, que tenía planificada quimioterapia intracavitaria con
wafers (BCNU) o que tenía planificada quimioterapia en las dos semanas posteriores a la realización del
procedimiento inicial.
Estaba permitido el uso habitual de esteroides (esto es, corticoesteroides) perioperatorios. El uso crónico
de esteroides (definido como el uso diario de corticoesteroides durante 8 semanas o más) con el fin de
reducir los efectos colaterales de la quimioterapia y la radioterapia para cáncer no constituyó un criterio
de exclusión, a menos que el investigador considerara que el paciente estaba sufriendo toxicidad por
esteroides. El uso crónico de corticoesteroides (de la manera definida anteriormente) para otros fines
aparte de reducir los síntomas de la quimioterapia sistémica constituyó un criterio de exclusión, a menos
que la administración de los esteroides se interrumpiera 4 semanas antes del procedimiento inicial
planificado.
Paciente que había recibido warfarina, heparina, otros anticoagulantes, ácido acetilsalicílico
o antiinflamatorios no esteroideos diariamente y en los que no había transcurrido el periodo de reposo
farmacológico conforme a la norma asistencial.
Paciente que tenía una coagulopatía clínicamente considerable documentada con un tiempo
de tromboplastina parcial (PTT) >37 segundos o un índice internacional normalizado (INR) >1,3 unidades
de INR.
Paciente que tenía afectado el sistema inmunitario, que tenía una enfermedad autoinmunitaria o que
estaba tomando inmunodepresores crónicos en el momento inicial.
Paciente que tenía una infección sistémica o indicios de alguna infección cerca del lugar planificado de la
intervención quirúrgica.
Paciente que tenía un nivel de creatinina sérica >2,0 mg/dL.
Paciente que tenía una bilirrubina sérica total >2,5 mg/dL en el momento inicial.
Paciente que tenía una diabetes no controlada, indicada por la norma asistencial de la institución
(HbA1c >7 %, glucemia, etc.) en el momento inicial.
Criterios de inclusión intraoperatorios:
Magnitud lineal de la durotomía del paciente ≥2 cm.
Los márgenes durales del paciente desde los bordes del defecto óseo eran ≥3 mm a todo lo largo.
Paciente que presentó fuga intraoperatoria de LCR después de la realización del cierre primario de la
duramadre (con o sin duroplastia no autóloga o tejido autólogo), bien espontáneamente o bien tras la
maniobra de Valsava, a un máximo de 20 cm H2O durante un máximo de cinco (5) segundos.
Criterios de exclusión intraoperatorios:
Paciente en el que se observó casualmente que cumplía alguno de los criterios de exclusión
preoperatorios indicados más arriba.
Paciente que requirió la colocación intraoperatoria de un dispositivo de derivación de LCR (p. ej., un
catéter ventricular, un catéter subdural, un drenaje lumbar u otro dispositivo diseñado para evacuar
externamente el LCR) que se dejó colocado después del procedimiento. Nota: Estaban permitidos los
drenajes subgaleales utilizados para el tratamiento postoperatorio del lugar de la incisión.
Paciente que tenía un hueco de más de 2 mm entre los bordes durales, o entre el borde de la duramadre
y el material de la duroplastia, según lo observado en la inspección visual realizada por el cirujano antes
de la aplicación del sellador quirúrgico.
Page 23

23
Tabla 2. Resumen de la información demográfica de los pacientes del estudio
Características
Población del sellador de
duramadre Adherus AutoSpray
Población de control
Número de pacientes
124
126
Hombres/mujeres
41/83
40/86
Mediana de edad (años)
54,2
51,1
Puntuación ASA de los pacientes (N (%))
I
2 (1,6)
8 (6,3)
II
47 (37,9)
50 (39,7)
III
69 (55,6)
62 (49,2)
IV
6 (4,8)
6 (4,8)
V
0 (0,0)
0 (0,0)
Indicación primaria de la intervención quirúrgica (N (%))
Tumor
56 (45,2)
53 (42,1)
Epilepsia
1 (0,8)
1 (0,8)
Descompresión de nervios
17 (13,7)
21 (16,7)
Malformación arteriovenosa
3 (2,4)
5 (4,0)
Aneurisma
28 (22,6)
26 (21,3)
Malformación de Chiari
17 (13,7)
18 (14,3)
Quiste
2 (1,6)
1 (0,8)
Otra
0 (0,0)
1 (0,8)
Acceso (N (%))
Infratentorial
53 (42,7)
52 (41,3)
Supratentorial
71 (57,3)
74 (58,7)
Técnica primaria para el cierre de la duramadre (N (%))
Sutura
48 (38,7)
48 (38,1)
Suture + material de duramadre autólogo
29 (23,4)
34 (27,0)
Suture + material de duramadre no autólogo
45 (36,3)
39 (31,0)
Los efectos adversos documentados a una tasa superior al 1 % en la población de pacientes por intención de
tratar (intent to treat, ITT) se resumen en la tabla 1.
Page 24

24
Método de esterilización del sellador de duramadre Adherus AutoSpray ET y eliminación del
dispositivo
La tabla siguiente detalla el método de esterilización y eliminación del dispositivo del sellador de duramadre
Adherus AutoSpray ET.
Descripción
Número
de pieza
Método de
esterilización
Frecuencia
de uso
Método de eliminación
Sellador de
duramadre Adherus
AutoSpray ET
NUS-009
Radiación
Para un solo uso
Deseche el dispositivo del
sellador de duramadre
Adherus AutoSpray ET en
un contenedor para
productos biopeligrosos
hospitalario aprobado.
¡No lo ponga en la
basura normal!
Condiciones ambientales de funcionamiento
Temperatura de almacenamiento
Almacene el producto a menos de 30 °C
Temperatura de funcionamiento
De 5 °C a 35 °C
Nivel de ruido
≤60 dB
Presentación
Los componentes del envase del sellador de duramadre Adherus AutoSpray ET son:
Bandeja del kit de sellador de duramadre Adherus AutoSpray ET (1)
Aplicador preensamblado (1)
Polvo de PEG activado en frasco de tapa verde (1)
Solución de PEI en frasco de tapa plateada (1)
Operaciones del sellador de duramadre Adherus AutoSpray ET
Los apartados siguientes contienen instrucciones para la preparación y activación del sellador de duramadre
Adherus AutoSpray ET.
Reconstitución de los componentes reticulantes
1) Empleando una técnica aséptica, introduzca el contenido de la bandeja exterior con el rótulo «Sellador de
duramadre Adherus AutoSpray ET» en el campo estéril.
2) Retire la tapa de la bandeja del kit de sellador de duramadre Adherus AutoSpray ET.
3) Retire el aplicador de sellador de duramadre Adherus AutoSpray ET preensamblado.
4) Con el dispositivo orientado de manera que la boquilla de punta extendida esté apuntando hacia arriba,
retire y deseche las tapas rojas que cubren las púas de los conectores adaptadores para frascos azules del
aplicador (fig. A-1).
Nota: Puede ser necesario utilizar una pinza hemostática o una herramienta similar para retirar las tapas.
También se recomienda realizar un movimiento giratorio mientras se retiran las tapas.
5) Retire el frasco que contiene la solución de PEI (frasco de tapa plateada) de la bandeja y encaje el extremo
tapado en el conector adaptador para frascos azul del aplicador correspondiente al émbolo de la jeringa
blanca agarrando el aplicador y oprimiendo hasta el tope el frasco, de forma que la púa penetre en los
tabiques y el precinto de aluminio plateado entre todo lo posible en el conector adaptador para frascos
(fig. A-2).
6) Retire el frasco con polvo de éster de PEG (frasco de tapa verde) de la bandeja y encaje el extremo tapado
en el conector adaptador para frascos azul del aplicador correspondiente al émbolo de la jeringa verde
agarrando el aplicador y oprimiendo hasta el tope el frasco, de forma que la púa penetre en los tabiques y el
precinto de aluminio verde entre todo lo posible en el conector adaptador para frascos (fig. A-2).
7) Con los frascos orientados hacia arriba, presione el conjunto impulsor de las jeringas para transferir los
líquidos a los frascos. Continúe apretando el conjunto impulsor de las jeringas (fig. A-3).
Nota: Si es necesario, utilice las dos manos para apretar el conjunto impulsor de las jeringas.
Page 25

25
8) Con el conjunto impulsor de las jeringas aún apretado, agite suavemente el dispositivo de manera
intermitente hasta que el polvo se haya disuelto por completo (A-3).
Nota: El polvo de éster de PEG seguirá disolviéndose entre los períodos de agitación suave; una agitación
demasiado enérgica puede hacer que queden demasiadas burbujas de aire atrapadas.
9) Suelte el conjunto impulsor de las jeringas para permitir que «rebote» hacia atrás y presiónelo una segunda
vez para asegurarse de que ambas soluciones sean homogéneas.
10) Deje que el conjunto impulsor de las jeringas «rebote» hacia atrás de nuevo y tire de él hacia atrás hasta
que todos los ingredientes reconstituidos se transfieran de los frascos (vista superior en la fig. A-4).
Nota: Si el botón pulsador de encendido y apagado se acciona sin querer durante la fase de reconstitución,
el dispositivo puede apagarse sin efectos perjudiciales. Para obtener resultados óptimos, el uso debe
llevarse a cabo en las dos horas posteriores a la reconstitución.
Encendido del dispositivo del sellador de duramadre Adherus AutoSpray ET
11) Pulse el botón de encendido y apagado de la parte inferior del dispositivo para «activar» el sistema antes de
la aplicación de pulverización de hidrogel (fig. B-1).
Nota: El aplicador de sellador de duramadre Adherus AutoSpray ET deberá activarse ante de la retirada de
los conectores adaptadores para frascos, justo antes de la aplicación de pulverización, para evitar la
obstrucción accidental de la boquilla.
Preparación del dispositivo y del lugar del tratamiento
12) Si el aplicador del sellador de duramadre Adherus AutoSpray ET no está ya encendido, pulse el botón de
encendido y apagado para encenderlo (fig. B-1).
Nota: La bomba de aire interna se activa al pulsar el botón de encendido y apagado, lo que hará que suene
un ruido audible que indica que el sistema se ha activado. Si el ruido audible de la bomba no está presente,
deje de utilizar esa unidad de sellador de duramadre Adherus AutoSpray ET y siga las instrucciones del
apartado de solución de problemas.
13) Antes de la administración del tratamiento, oriente el dispositivo de forma que los frascos apunten hacia
arriba y retire y deseche ambos conectores adaptadores azules para frascos girándolos en sentido contrario
al de las agujas del reloj hasta que sean expulsados del dispositivo (vista superior en la fig. B-2).
14) Para lograr una adherencia óptima del tejido en el lugar del tratamiento, asegúrese de que alrededor del
defecto haya un margen de 2-3 milímetros libre de sangre, agentes hemostáticos u otros tejidos sueltos y de
que se reduzca al mínimo el flujo saliente de líquido cefalorraquídeo.
15) Si es necesario, doble o moldee la boquilla de punta extendida para mejorar el acceso al lugar del
tratamiento o la visualización de este.
Page 26

26
Administración del tratamiento
16) Para aplicar el producto preparado, pulse el botón de encendido y apagado para encender el dispositivo, si
este no está ya encendido.
17) Oriente el dispositivo de manera que el cuerpo del aplicador esté apuntando hacia arriba y sostenga un
trozo de gasa entre 5 y 10 centímetros por encima de la boquilla (fig. B-3).
18) Presione de manera firme y uniforme el centro del conjunto impulsor de las jeringas hasta que el producto
empiece a salir pulverizado por la boquilla (fig. B-3).
19) Una vez que empiece a formarse sellador verde sobre el trozo de gasa, deje de apretar el conjunto impulsor
de las jeringas. El sellador de duramadre Adherus AutoSpray ET está ahora listo para la administración del
tratamiento.
20) Mientras apunta al lugar del tratamiento y sostiene la boquilla del dispositivo a aproximadamente entre 2 y 4
centímetros, presione de manera firme y uniforme el centro del conjunto de impulsor de las jeringas para
dispensar la solución mezclada (fig. B-4).
21) Continúe aplicando el sistema sellador Adherus hasta que se forme una capa fina
(de aproximadamente 1-2 mm).
Nota: Cálculo del grosor:
Cierre de duramadre suturado: Asegúrese de que todos los nudos de la sutura queden
totalmente cubiertos con sellador de hidrogel. Para el cierre de la duramadre se suele
utilizar sutura de tamaños 4-0, 3-0 y 2-0. El más pequeño de estos es el 4-0, que tiene un
diámetro de 0,15 a 0,2 mm. Un nudo de sutura 4-0 tendrá al menos cuatro anchos de
sutura, o aproximadamente entre 0,6 y 0,8 mm de grosor. La cobertura total de los nudos
asegura la obtención del grosor mínimo de aplicación.
Cierre con duroplastia de recubrimiento: Asegúrese de que se aplique suficiente
sellador de hidrogel para cubrir el recubrimiento de duroplastia y al menos 3-4 mm de
duramadre natural adyacente con 1-2 mm de hidrogel utilizando la altura del material de
recubrimiento como referencia de profundidad. Tenga en cuenta que al humedecerse con
solución salina, dos materiales de duroplastia de recubrimiento de uso frecuente, la matriz
de injerto de duramadre DuraGen® y la matriz de regeneración de duramadre Durepair®
tienen 3 mm y 1 mm de grosor respectivamente.
Detención de la aplicación de pulverización
22) La aplicación puede interrumpirse en cualquier momento durante un tratamiento retirando la presión
aplicada al conjunto impulsor. No obstante, para evitar obstrucciones, no apague la bomba hasta que haya
finalizado la aplicación del sellador final.
Nota: Si durante una aplicación se forma un exceso de hidrogel sobre la boquilla pulverizadora, dicho
exceso puede retirarse con cuidado con un trozo de gasa.
Finalización de una administración
23) Si es necesario, el sellador sobrante que haya más allá de los bordes del margen de la duramadre puede
retirarse con una sonda Penfield, con unas tijeras o mediante alteración mecánica.
Page 27

27
Eliminación del sellador de duramadre Adherus AutoSpray ET
Una vez finalizada la aplicación de pulverización final, apague el dispositivo, abra la cubierta de las pilas para
romper el precinto interno y extraiga las pilas para desecharlas adecuadamente. La tabla siguiente ofrece
información importante sobre la eliminación de los componentes del sellador de duramadre Adherus
AutoSpray ET.
Dispositivo
Instrucciones de eliminación
Sellador de duramadre
Adherus AutoSpray ET
El sellador de duramadre Adherus AutoSpray ET consta de una
carcasa de plástico y componentes eléctricos. Este dispositivo
debe llevarse para su recogida por separado al final de la vida
del producto. No deseche este producto como residuo urbano
sin clasificar.
Solución de problemas del sellador de duramadre Adherus AutoSpray ET
Se han identificado los siguientes modos de fallo posibles del sellador de duramadre Adherus AutoSpray ET.
Cada uno de los modos de fallo incluye una medida preventiva (indicada a continuación) para controlar los
resultados de dichas averías.
Modos de fallo posibles
Medida preventiva
1. La bomba de aire no se activa
1. No se ha pulsado el interruptor de encendido y
apagado
2. La boquilla pulverizadora se bloquea
2. No retire los conectores adaptadores para
frascos antes de encender la bomba de aire,
limpie la boquilla con un paño después del uso.
Page 28

28
Para evitar complicaciones, siga exactamente el diagrama de flujo de solución de problemas del sellador de
duramadre Adherus AutoSpray ET de la tabla anterior. Durante un procedimiento, los intentos del usuario por
resolver problemas del sellador de duramadre Adherus AutoSpray ET deberán limitarse estrictamente a los
pasos descritos más arriba. Si la solución de problemas no da resultado, deje de utilizar la unidad de sellador de
duramadre Adherus AutoSpray ET actual inmediatamente y abra una nueva unidad de sellador de duramadre
Adherus AutoSpray ET.
Especificaciones eléctricas del sellador de duramadre Adherus AutoSpray ET
El sellador de duramadre Adherus AutoSpray ET cumple las normas siguientes:
CEI 60601-1 3.ª edición Requisitos generales de seguridad eléctrica
CEI 60601-1-2 3.ª edición Requisitos de inmunidad
Guía y declaración del fabricante: Emisiones electromagnéticas
El sellador de duramadre Adherus AutoSpray ET está indicado para utilizarse en el entorno electromagnético
especificado a continuación. El cliente o el usuario del sellador de duramadre Adherus AutoSpray ET deberá
asegurarse de que solo se utilice en dicho entorno.
Prueba de emisiones
Cumplimiento
Guía sobre el entorno electromagnético
Emisiones de RF, CISPR 11
Grupo 1
El sellador de duramadre Adherus AutoSpray ET utiliza energía
de RF solamente para su funcionamiento interno. Por lo tanto,
sus emisiones de radiofrecuencia son muy bajas y no es
probable que produzcan interferencias en equipos electrónicos
situados cerca de él.
Emisiones de RF, CISPR 11
Clase B
El sellador de duramadre Adherus AutoSpray ET es adecuado
para utilizarse en todo tipo de establecimientos, incluidos los
domésticos y los conectados directamente a la red pública de
suministro eléctrico de bajo voltaje que abastece a los edificios
utilizados para propósitos domésticos.
Emisiones armónicas,
CEI 61000-3-2
No aplicable
Fluctuaciones de
voltaje/emisiones de
destellos, CEI 61000-3-3
No aplicable
Page 29
29
Guía y declaración del fabricante: Inmunidad electromagnética de todos los equipos y sistemas
El sellador de duramadre Adherus AutoSpray ET es un sistema alimentado por pilas y está indicado para
utilizarse en el entorno electromagnético especificado a continuación. El cliente o el usuario del sellador de
duramadre Adherus AutoSpray ET deberá asegurarse de que se utilice en dicho entorno.
Prueba de
inmunidad
Nivel de prueba
CEI 60601
Nivel de
cumplimiento
Guía sobre el entorno
electromagnético
Descarga
electrostática
CEI 61000-4-2
±6 kV de contacto
±8 kV al aire
No aplicable:
Sistema alimentado
por pilas sin
circuitos digitales
Los suelos deben ser de madera,
cemento o baldosas de cerámica. Si los
suelos están cubiertos con material
sintético, la humedad relativa debe ser
al menos del 30 %.
Perturbaciones
eléctricas transitorias
rápidas/incrementos
repentinos de voltaje
CEI 61000-4-4
±2 kV para líneas del
suministro eléctrico
±1 kV para líneas de
entrada y salida
No aplicable:
Sistema alimentado
por pilas
La calidad de la energía de la red
eléctrica debe ser la normal de un
entorno comercial u hospitalario.
Sobrevoltaje
CEI 61000-4-5
±1 kV en modo
diferencial
±2 kV en modo común
No aplicable:
Sistema alimentado
por pilas
La calidad de la energía de la red
eléctrica debe ser la normal de un
entorno comercial u hospitalario.
Bajadas de voltaje,
interrupciones cortas
y variaciones de
voltaje en las líneas
de entrada del
suministro eléctrico
CEI 61000-4-11
<5 % U
T
(bajada de >95 % en UT)
durante 0,5 ciclos
40 % U
T
(bajada del 60 % en UT)
durante 5 ciclos
70 % U
T
(bajada del 30 % en UT)
durante 25 ciclos
<5 % U
T
(bajada >95 % en UT)
durante 5 s
No aplicable:
Sistema alimentado
por pilas
La calidad de la energía de la red
eléctrica debe ser la normal de un
entorno comercial u hospitalario. Si el
usuario del equipo necesita un
funcionamiento continuado durante las
interrupciones del suministro de la red
eléctrica, se recomienda conectar el
equipo a una batería o a un sistema de
alimentación ininterrumpida (SAI).
Campo magnético
de frecuencia de la
corriente (50/60 Hz)
CEI 61000-4-8
3 A/m
No aplicable:
Sistema alimentado
por pilas sin
componentes
magnéticamente
sensibles
Las intensidades de los campos
magnéticos de frecuencia de la
corriente deben ser las normales de un
entorno comercial u hospitalario.
*NOTA: UT es el voltaje de la red de corriente alterna antes de la aplicación del nivel de la prueba.
Page 30

30
Guía y declaración del fabricante: Inmunidad electromagnética
El sellador de duramadre Adherus AutoSpray ET está indicado para utilizarse en el entorno electromagnético
especificado a continuación. El cliente o el usuario del sellador de duramadre Adherus AutoSpray ET deberá
asegurarse de que se utilice en dicho entorno.
Prueba de
inmunidad
Nivel de prueba
CEI 60601
Nivel de
cumplimiento
Guía sobre el entorno electromagnético
RF conducida
CEI 61000-4-6
RF radiada
CEI 61000-4-3
3 Vrms de
150 kHz a
80 MHz
3 V/m de
80 MHz a
2,5 GHz
No aplicable:
Sistema
alimentado por
pilas sin
circuitos
digitales
No aplicable:
Sistema
alimentado por
pilas sin
circuitos
digitales
Los equipos portátiles o móviles de comunicación por
RF no deben utilizarse a una distancia inferior a la
distancia de separación recomendada de cualquier
parte del sellador de duramadre Adherus AutoSpray
ET (incluidos los cables). La distancia se calcula a partir
de la ecuación aplicable a la frecuencia del transmisor.
Distancia de separación recomendada
d = 1,2√P
d = 1,2√P de 80 MHz a 800 MHz
d = 2,3√P de 800 MHz a 2,5 GHz
Donde P es la potencia de salida nominal máxima del
transmisor en vatios (W) de acuerdo con el fabricante
del transmisor y d es la distancia de separación
recomendada en metros (m).
Las intensidades de campo de transmisores de RF
fijos, determinadas por un estudio electromagnético del
lugar,a deberán ser inferiores al nivel de cumplimiento
de cada intervalo de frecuencia.
b
Es posible que se produzcan interferencias en las
cercanías de los equipos marcados con el siguiente
símbolo:
Nota 1: A 80 MHz y 800 MHz se aplica el intervalo de frecuencia superior.
Nota 2: Estas pautas pueden no ser aplicables en todas las situaciones. La propagación electromagnética se ve afectada por
la absorción y la reflexión de estructuras, objetos y personas.
a Las intensidades de campo generadas por transmisores fijos, como estaciones base de radioteléfonos (móviles
o inalámbricos) y radios móviles terrestres, equipos de radioaficionados, emisoras de radio AM y FM y emisoras
de TV, no pueden predecirse teóricamente con exactitud. Para evaluar el entorno electromagnético producido
por transmisores de RF fijos debe considerarse la posibilidad de realizar un estudio electromagnético del lugar.
Si la intensidad de campo medida en el lugar en el que se utilice el sellador de duramadre Adherus AutoSpray
ET es superior al nivel de cumplimiento aplicable de radiofrecuencia indicado más arriba, el sellador de
duramadre Adherus AutoSpray ET deberá observarse para verificar que funciona normalmente. Si se observa un
funcionamiento anormal, puede que sea necesario tomar medidas adicionales, como reorientar o cambiar de
sitio el dispositivo del sellador de duramadre Adherus AutoSpray ET.
b En el intervalo de frecuencias de 150 kHz a 80 MHz, las intensidades de campo deberán ser inferiores a 3 V/m.
Page 31

31
Distancias de separación recomendadas entre los equipos portátiles o móviles de
comunicación por radiofrecuencia y el sellador de duramadre Adherus AutoSpray ET
El sellador de duramadre Adherus AutoSpray ET está diseñado para utilizarse en un entorno electromagnético
en el que las alteraciones producidas por RF radiada estén controladas. El cliente o el usuario del dispositivo del
sellador de duramadre Adherus AutoSpray ET pueden contribuir a evitar las interferencias electromagnéticas
manteniendo la distancia mínima entre el equipo portátil o móvil de comunicaciones por RF (transmisores) y el
dispositivo del sellador de duramadre Adherus AutoSpray ET recomendada a continuación, según la potencia de
salida máxima del equipo de comunicaciones.
Potencia de
salida nominal
máxima del
transmisor
W
Distancia de separación según la frecuencia del transmisor
m
De 150 kHz a 80 MHz
d = 1,2√P
De 80 MHz a 800 MHz
d = 1,2√P
De 800 MHz a 2,5 GHz
d = 2,3√P
0,01
0,12
0,12
0,23
0,1
0,38
0,38
0,73
1
1,2
1,2
2,3
10
3,8
3,8
7,3
100
12
12
23
En los casos de transmisores con potencias de salida nominales máximas distintas a las especificadas más arriba, la distancia
de separación recomendada d en metros (m) puede calcularse utilizando la ecuación correspondiente a la frecuencia del
transmisor, donde P es la potencia de salida nominal máxima del transmisor en vatios (W) según el fabricante del transmisor.
NOTA 1: A 80 MHz y 800 MHz se aplica la distancia de separación del intervalo de frecuencias superior.
NOTA 2: Estas pautas pueden no ser aplicables en todas las situaciones. La propagación electromagnética se ve afectada por
la absorción y la reflexión de estructuras, objetos y personas.
Page 32

32
Erläuterung der Symbole
In der nachstehenden Tabelle werden die in dieser Gebrauchsanweisung, auf den Systemkomponenten und auf
den Verpackungsetiketten verwendeten Symbole erläutert. Die Tabelle gibt für jedes Symbol die jeweilige
Bedeutung an. Diese Symbole sollten beachtet werden, da sie auf wichtige Sicherheitsmaßnahmen und
Warnungen verweisen können.
Symbol
Bedeutung
Siehe weitere Informationen in der Gebrauchsanweisung
Nur zum einmaligen Gebrauch. Nicht wiederverwenden.
Nicht resterilisieren
Sterilisation durch Bestrahlung
Verwendbarkeitsdatum, Verfallsdatum – Jahr und letzter Tag
des Monats
Inhalt bei beschädigter Verpackung nicht verwenden
Vor Sonnenlicht schützen
Gesondert entsorgen
Bevollmächtigter in der Europäischen Gemeinschaft
0050
CE-Kennzeichnung und Identifikationsnummer der benannten
Stelle
Chargenbezeichnung
Bestellnummer
Menge
Hersteller
Gerät vom Typ BF (Teil mit Patientenkontakt, Nicht-Herz, nicht
geerdet)
Gleichstrom
Temperaturgrenzen (unterhalb von ... aufbewahren)
Biologisch gefährlich
Ein/Aus (Drucktaste)
Page 33

33
Inhaltsverzeichnis
Beschreibung des Geräts ...................................................................................................... 34
Indikation ................................................................................................................................ 35
Kontraindikationen ................................................................................................................. 35
Warnhinweise ......................................................................................................................... 35
Vorsichtsmaßnahmen ............................................................................................................ 35
Unerwünschte Ereignisse ...................................................................................................... 35
Klinische Informationen ......................................................................................................... 36
Sterilisationsmethode und Entsorgungsverfahren für Adherus AutoSpray ET
Dura-Dichtungsmittel ............................................................................................................. 40
Umgebungsbedingungen im Betrieb .................................................................................... 40
Lieferform ................................................................................................................................ 40
Betrieb des Adherus AutoSpray ET Dura-Dichtungsmittels ............................................... 40
Rekonstitution der Vernetzungskomponenten ....................................................................... 40
Einschalten des Adherus AutoSpray ET Dura-Dichtungsmittel Geräts .................................. 41
Vorbereitung des Geräts und der zu behandelnden Stelle .................................................... 41
Abgabe der Behandlung ....................................................................................................... 42
Unterbrechung der Sprühapplikation ..................................................................................... 42
Abschluss der Abgabe .......................................................................................................... 42
Entsorgung des Adherus AutoSpray ET Dura-Dichtungsmittels ........................................ 43
Elektrische Spezifikationen des Adherus AutoSpray ET Dura-Dichtungsmittels .............. 44
Anleitungen und Herstellererklärung – Elektromagnetische Emissionen ............................... 44
Anleitungen und Herstellererklärung – Elektromagnetische Störfestigkeit für alle
Geräte und Systeme ............................................................................................................. 45
Anleitungen und Herstellererklärung – Elektromagnetische Störfestigkeit ............................. 46
Empfohlene Trennabstände zwischen tragbaren und mobilen HF-Kommunikationsgeräten
und dem Adherus AutoSpray ET Dura-Dichtungsmittel ......................................................... 47
DE
Page 34

34
Beschreibung des Geräts
Adherus AutoSpray Dura-Dichtungsmittel mit verlängerter Spitze (Extended Tip, ET) ist ein steriles,
elektromechanisches, batteriebetriebenes Einweggerät mit internen Systemkomponenten, die einen Luftstrom
erzeugen und damit die Abgabe eines synthetischen, resorbierbaren, aus zwei Komponenten bestehenden
Hydrogel-Dichtungsmittels unterstützen und eine Unterbrechung der Abgabe ohne Verstopfungen ermöglichen.
Das Gerät wird in Form eines bereits montierten Applikators sowie zweier separater Glasampullen geliefert. Die
beiden Glasampullen enthalten einen aktivierten, pulverförmigen Polyethylenglykol-Ester (PEG-Ester) bzw. ein in
sterilem Wasser aufgelöstes Polyethylenimin (PEI). Die Vernetzungskomponenten werden vor dem Gebrauch mit
dem jeweiligen, im Applikator enthaltenen Rekonstitutionspuffer rekonstituiert. Die so entstandenen Lösungen
vermischen sich in der verlängerten Applikatorspitze und bilden durch rasche Vernetzung kurz nach dem Austritt
aus der Applikatorspitze das Hydrogel-Dichtungsmittel. Die abgegebene Lösung vernetzt sich sofort und bildet
dadurch ein Hydrogel-Dichtungsmittel, das im Verlauf von ungefähr 90 Tagen resorbiert wird und somit genügend
Zeit für den Heilungsprozess lässt.
Das Adherus AutoSpray ET Dura-Dichtungsmittel Gerät besteht aus den folgenden Hauptkomponenten:
Düse mit verlängerter Spitze
Die integrierte Düse mit verlängerter Spitze ist formbar und kann je nach Präferenz gebogen und umgeformt
werden. Die Düse mit verlängerter Spitze sorgt für die gründliche Vermischung der beiden Lösungen, aus denen
das Dichtungsmittel besteht, und gibt das Lösungsgemisch in einem schmalen Sprühmuster an die zu
behandelnde Stelle ab. Die Sprühdüse ist fest am System angebracht und lässt sich nicht abnehmen.
Ampullenadapterstücke
Die Ampullenadapterstücke dienen als Aufnahmen für die Ampullen, in denen die Vernetzungskomponenten
enthalten sind. Während der Rekonstitution werden die Ampullen auf die Ampullenadapterstücke aufgesetzt.
Nach Abschluss der Rekonstitution werden die Adapterstücke durch Drehen entgegen dem Uhrzeigersinn vom
Adherus AutoSpray ET Dura-Dichtungsmittel Gerät abgenommen. Durch das Abnehmen der Adapterstücke
öffnen sich die Leitungen, sodass die Lösungen zur Düse fließen können.
Drucktaste Ein/Aus
Mit der Ein/Aus-Taste wird die batteriebetriebene Luftpumpe ein- und ausgeschaltet. Im Lieferzustand ist dieser
Schalter in der Aus-Stellung, sodass die Luftpumpe von der Stromversorgung durch die Batterien isoliert ist. Vor
dem Abnehmen der Ampullenadapterstücke den Ein/Aus-Schalter auf „Ein“ stellen, sodass die Luftpumpe
aktiviert wird.
Batteriefachdeckel
Hierbei handelt es sich um eine Klappe an der Unterseite des Gehäuses, über die das Personal im
Operationssaal (OP) nach dem Gebrauch des Geräts die Batterien entfernen kann, um sie sachgemäß zu
entsorgen. Der Batteriefachdeckel ist fest zugeklebt. Der Batteriefachdeckel lässt sich mit einem flachen
Werkzeug aufhebeln, sodass die Batterien zur Entsorgung entnommen werden können.
Druckstange
Die Druckstange koppelt die beiden Spritzenkolben mechanisch aneinander, sodass beide Spritzenkolben
simultan vorgeschoben werden.
Druckstange
Ampullenadapterstücke
Düse mit verlängerter Spitze
Drucktaste Ein/Aus
Page 35

35
Indikation
Adherus AutoSpray ET Dura-Dichtungsmittel ist zusätzlich zu Standardmethoden der Durareparatur, wie z. B.
Nähten, bei Eingriffen an Schädel und Rückenmark bestimmt und sorgt für wasserdichten Verschluss.
Kontraindikationen
Adherus AutoSpray ET Dura-Dichtungsmittel darf nicht in engen anatomischen Räumen verwendet werden, in
denen eine Nervenkompression zu befürchten ist. Das Hydrogel kann sich in allen Dimensionen um bis zu 13 %
ausdehnen.
Warnhinweise
Adherus AutoSpray ET Dura-Dichtungsmittel wurde nicht bei den folgenden Patientengruppen untersucht:
Patienten, bei denen ein Eingriff über einen translabyrinthinen, transsphenoidalen oder transoralen Zugang
erforderlich ist, sowie jeglicher Eingriff, bei dem Nasennebenhöhlen oder pneumatisierte Hohlräume der Pars
mastoidea penetriert werden;
Patienten mit einem Abstand der Duraränder von über 2 mm;
Patienten mit stark veränderter Nieren- oder Leberfunktion;
Patienten mit einer aktiven Infektion am Operationssitus;
Patienten mit einem behandelten oder unbehandelten Hydrocephalus (z. B. Patienten mit Implantaten zur
Ableitung von Liquor cerebrospinalis oder veränderter Liquordynamik);
Patienten mit einer zugrundeliegenden Komorbidität, die bekanntermaßen die Wundheilung stört, oder die ein
entsprechendes Medikament einnehmen (z. B. Patienten nach einem intrakraniellen neurochirurgischen
Eingriff an der gleichen anatomischen Stelle, mit Strahlen- und Chemotherapie, bekannter Malignität,
Diabetes, Steroidtoxizität und chronischer Corticosteroidanwendung, geschwächtem Immunsystem oder
Gabe von Antikoagulanzien, Aspirin oder nichtsteroidalen Antirheumatika);
Patienten mit einer bekannten Allergie gegen die Farbstoffe Brillantblau FCF (E 133) oder Tartrazin (E 102) oder
Patientinnen, die schwanger sind oder stillen.
Adherus AutoSpray ET Dura-Dichtungsmittel ist zur Verwendung als unterstützende Maßnahme zu den
herkömmlichen Methoden der Durareparatur bestimmt. Die Wirksamkeit von Adherus AutoSpray ET DuraDichtungsmittel bei anderen Gewebetypen wurde nicht untersucht.
Vorsichtsmaßnahmen
Adherus AutoSpray ET Dura-Dichtungsmittel ist steril verpackt. Nicht verwenden, wenn die Schalen beschädigt
oder geöffnet wurden. Nicht resterilisieren.
Das Adherus AutoSpray ET Dura-Dichtungsmittel ist für den Gebrauch bei nur einem Patienten bestimmt. Alle
unbenutzten und/oder geöffneten Produktanteile entsorgen. Bei einer Wiederverwendung kann es zu einer
Kreuzkontamination kommen, was eine Verletzung, Erkrankung oder den Tod des Patienten zur Folge haben kann.
Vor Sonnenlicht schützen. Nicht verwenden, wenn das PEG-Ester-Pulver nicht ungehindert fließt.
Adherus AutoSpray ET Dura-Dichtungsmittel muss innerhalb von 2 Stunden nach der Rekonstitution der
Vernetzungskomponenten verwendet werden. In Tests wurde für das entstandene Dichtungsmittel nach 8
Stunden im Vergleich zu Proben, die jeweils 1, 2 und 4 Stunden nach der Rekonstitution verwendet wurden, eine
geringfügig, aber statistisch signifikant höhere Volumenzunahme ermittelt.
Die verlängerte Applikatorspitze wurde im Hinblick auf chirurgische Bedürfnisse konzipiert, indem die gesamte
Länge der Spitze biegsam ausgeführt ist. Beim Biegen der Spitze vorsichtigen Druck ausüben. Nicht schärfer als
90° biegen. Nach dem Konturieren des Applikators für die chirurgischen Bedürfnisse sicherstellen, dass das
Hydrogel fließen kann.
Das Applikatorsystem weist eine Batterielebensdauer von ungefähr 2 Stunden bei kontinuierlichem Gebrauch auf.
Vor der Applikation des Adherus Hydrogels muss sichergestellt werden, dass der Abfluss von Flüssigkeiten
(Liquor cerebrospinalis, Blut usw.) unterbunden wurde.
Das Adherus AutoSpray ET Dura-Dichtungsmittel nicht in Gegenwart von brennbaren Anästhetika bzw.
brennbaren Anästhetika mit Oxidationsmitteln verwenden.
Das Adherus AutoSpray ET Dura-Dichtungsmittel Gerät von starken Magnetfeldern fernhalten, um eine mögliche
Störung der HF-Kommunikation zu verhindern. Magnetresonanzgeräte können die Pumpenfunktion stören.
Abgesehen vom Batteriefachdeckel dürfen keine Abdeckungen vom System abgenommen werden.
Unerwünschte Ereignisse
Ein ähnliches Produkt (das Adherus AutoSpray Dura-Dichtungsmittel), in dem ein Dichtungsmittel gleicher
Zusammensetzung (das Adherus Dura-Dichtungsmittel) enthalten ist, wurde bei 124 Forschungspatienten im
Rahmen einer prospektiven, kontrollierten, multizentrischen, klinischen Schlüsselstudie bewertet. Inzidenz und Art
der in dieser Patientengruppe beobachteten unerwünschten Ereignisse entsprachen der Art und Komplexität der
Page 36

36
durchgeführten neurochirurgischen Eingriffe und dem Komorbiditätsstatus der behandelten Patienten. Es kam zu
4 Todesfällen unter den mit dem Adherus AutoSpray Dura-Dichtungsmittel versorgten Patienten und fünf
Todesfällen in der Kontrollgruppe. Die Todesfälle wurden dem vorbestehenden Zustand der Patienten
zugeschrieben. Diejenigen unerwünschten Ereignisse, die mit einer Häufigkeit von 1 % oder höher unter den mit
dem Adherus AutoSpray Dura-Dichtungsmittel versorgten Patienten auftraten, sind in der nachstehenden Tabelle
zusammengefasst. Unerwartete unerwünschte Wirkungen des Produkts traten nicht auf.
Tabelle 1. Zusammenfassung der unerwünschten Ereignisse für das Adherus AutoSpray Dura-
Dichtungsmittel
Unerwünschtes Ereignis
Patienten (n (%))
N=124
Anämie
3 (2,4)
Leukocytose
2 (1,6)
Taubheit, unilateral
2 (1,6)
Tinnitus
4 (3,2)
Diplopie
5 (4,0)
Ptosis des Augenlides
2 (1,6)
Periorbitales Ödem
6 (4,8)
Verschwommenes Sehen
7 (5,6)
Dysphagie
4 (3,2)
Übelkeit
2 (1,6)
Unerwünschte Reaktion
6 (4,8)
Schmerzen in der Brust
3 (2,4)
Progression der Erkrankung
3 (2,4)
Ermüdung
2 (1,6)
Lungenentzündung
2 (1,6)
Harnwegsinfektion
2 (1,6)
Wundinfektion
2 (1,6)
Hypästhesie an der Inzisionsstelle
3 (2,4)
Schmerzen an der Inzisionsstelle
4 (3,2)
Periorbitale Hämorrhagie
3 (2,4)
Postoperatives Ödem
2 (1,6)
Pseudomeningozele
9 (7,3)
Serom
3 (2,4)
Subdurales Hämatom
3 (2,4)
Wunddehiszenz
2 (1,6)
Muskelschwäche
2 (1,6)
Aphasie
4 (3,2)
Gleichgewichtsstörung
2 (1,6)
Konvulsion
5 (4,0)
Multiple Hirnnervenlähmung
2 (1,6)
Schwindel
7 (5,6)
Embolischer Schlaganfall
2 (1,6)
Kopfschmerzen
14 (11,3)
Hemiparese
2 (1,6)
Hypästhesie
4 (3,2)
Lähmung des N. hypoglossus
2 (1,6)
Gedächtnisstörung
2 (1,6)
Nystagmus
3 (2,4)
Parästhesie
5 (4,0)
Sinnesstörungen
3 (2,4)
Tremor
2 (1,6)
Lähmung des VII. Hirnnerven
3 (2,4)
Stimmbandlähmung
2 (1,6)
Atelektase
2 (1,6)
Ateminsuffizienz
2 (1,6)
Alopezie
2 (1,6)
Ausschlag
2 (1,6)
Gesichtsschwellung
4 (3,2)
Klinische Informationen
Es wurde eine prospektive, randomisierte, kontrollierte, multizentrische, klinische Schlüsselstudie durchgeführt, um
die Anwendung des Adherus Dura-Dichtungsmittels, verabreicht mithilfe des Adherus AutoSpray-Applikators, als
unterstützende Maßnahme zu den herkömmlichen Methoden der Durareparatur (wie z. B. Nähte) für den
Page 37

37
wasserdichten Verschluss bei Schädeloperationen zu bewerten. Der primäre Endpunkt dieser Studie war eine
zusammengesetzte Bewertung der Sicherheit und Wirksamkeit des Adherus AutoSpray Dura-Dichtungsmittels
(n=124 Patienten) im Vergleich zu einer aktiven Kontrollmethode (n=126 Patienten). Die Endpunktergebnisse
beruhten auf der Anzahl der Patienten, bei denen nach bis zu zweimaligem Auftragen des Dichtungsmittels
Folgendes ausblieb: intraoperativer Liquoraustritt an der Durareparatur beim Valsalva-Versuch,
Liquoraustritt/Pseudomeningozele während des Nachverfolgungszeitraums von 120 Tagen sowie ungeplante
erneute Behandlung der ursprünglichen Operationsstelle innerhalb von 120 Tagen nach der Operation. Die
Gesamterfolgsrate für die vollständige Fallanalyse betrug 91,2 % in der Adherus-Gruppe gegenüber 90,6 % in der
Kontrollgruppe. Adherus wurde für nicht der Kontrollmethode unterlegen befunden, wobei die Marge der NichtUnterlegenheit 10 % (p = 0,005) betrug. Im frühen postoperativen Zeitraum, in dem die Funktion der Dichtungsmittel
erwartet wird, betrug die Gesamterfolgsrate zur Nachuntersuchung nach 14 Tagen bei den Patienten, die den
Termin abschlossen, 99,1 % in der Adherus-Gruppe gegenüber 95,0 % in der Kontrollgruppe. Zusätzlich betrug die
Gesamterfolgsrate zur Nachuntersuchung nach 45 Tagen bei den Patienten, die den Termin abschlossen, 96,6 % in
der Adherus-Gruppe gegenüber 91,9 % in der Kontrollgruppe. Außerdem zeigte die Analyse des Ausbleibens von
Fehlschlägen hinsichtlich des primären Endpunkts, dass Fehlschläge hinsichtlich des primären Endpunkts in der
Kontrollgruppe tendenziell frühzeitig im Nachverfolgungszeitraum auftraten, während Fehlschläge hinsichtlich des
primären Endpunkts in der mit Adherus behandelten Gruppe mehrheitlich anlässlich der im Protokoll
vorgeschriebenen Röntgenuntersuchung beim Nachsorgetermin nach 120 Tagen auffielen.
Die Sicherheit wurde anhand einer Bewertung von Wundheilung, Infektion an der Operationsstelle, Meningitis,
verschlechtertem Score auf der modifizierten Rankin-Skala, Schwellung an der Operationsstelle und
unerwünschten Ereignissen bis zum Ende des Nachverfolgungszeitraums von 120 Tagen beurteilt. Bei 100
Patienten (80,6 %) in der Adherus-Gruppe und 98 Patienten (77,8 %) in der Kontrollgruppe kam es zu
mindestens einem unerwünschten Ereignis während des Nachverfolgungszeitraums von 120 Tagen. Unerwartete
unerwünschte Wirkungen des Produkts traten nicht auf. Unter den mit dem Adherus AutoSpray DuraDichtungsmittel behandelten Patienten traten keine Fälle von produktbedingter tiefer Wundinfektion und keine
Fälle von Meningitis auf. Inzidenz und Art der in dieser Patientengruppe beobachteten unerwünschten Ereignisse
entsprachen der Art und Komplexität der durchgeführten neurochirurgischen Eingriffe und dem
Komorbiditätsstatus der behandelten Patienten.
Die wichtigsten Ein- und Ausschlusskriterien für die Studie lauteten wie folgt:
Präoperative Einschlusskriterien:
Patient im Alter von ≥ 18 und ≤ 75 Jahren.
Beim Patienten geplante elektive Schädeloperation mit Durainzision an einer der folgenden
Operationsstellen bzw. über einen der folgenden Zugänge (oder eine Kombination): frontal, temporal,
okzipital und parietal (d. h. supratentorial) und/oder median oder lateral subokzipital (d. h. infratentorial).
Beim Patienten erforderlicher Eingriff der Wundklasse I (sauber) (nicht infizierte Operationswunde, bei der
keine Entzündung angetroffen wurde).
Präoperative Ausschlusskriterien:
Beim Patienten erforderlicher Eingriff über einen translabyrinthinen, transsphenoidalen oder transoralen
Zugang sowie jeglicher Eingriff, bei dem Nasennebenhöhlen oder pneumatisierte Hohlräume der Pars
mastoidea penetriert werden. Hinweis: Eine oberflächliche Penetration von Hohlräumen der Pars
mastoidea galt nicht als Ausschlussgrund, wenn diese angemessen versiegelt wurden (z. B. mit
Knochenwachs).
Bereits mit einem Liquorshunt (z. B. ventrikulo-peritonealer, ventrikulo-pleuraler, ventrikulo-atrialer oder
lumbo-peritonealer Shunt) versorgter Patient.
Bereits mit einer externen ventrikulären oder lumbalen Liquordrainage, die nach dem Eingriff bestehen
bleiben muss, versorgter Patient.
Klinisch signifikanter Hydrocephalus oder klinisch erwiesene veränderte Liquordynamik.
Früherer intrakranieller neurochirurgischer Eingriff an der gleichen anatomischen Stelle. (Hinweis: Eine
stereotaktische Biopsie galt nicht als Ausschlussgrund.)
Früherer Liquoraustritt (im Gefolge von Trauma, Neoplasma, Operation oder anderer Ätiologie).
Frühere Strahlentherapie an der Eingriffsstelle bzw. innerhalb von zehn Tagen nach dem Indexeingriff
geplante übliche fraktionierte Strahlentherapie. (Hinweis: Eine stereotaktische Strahlentherapie vor dem
geplanten Indexeingriff galt nicht als Ausschlussgrund.)
Traumatische Kopfverletzung innerhalb von 30 Tagen vor dem geplanten Indexeingriff, die zu einem
Schädelbasisbruch oder zu Frakturen der Nasennebenhöhlen führte.
Bekannte Malignität oder anderes Leiden mit einer Lebenserwartung von weniger als sechs Monaten.
Frühere Chemotherapie, ausgenommen Hormontherapie, innerhalb von drei Wochen vor dem geplanten
Indexeingriff oder geplanter Einsatz von intrakavitärer Chemotherapie (Carmustin-Wafer) oder geplante
Chemotherapie innerhalb von zwei Wochen nach Durchführung des Indexeingriffs.
Page 38

38
Die übliche Gabe von perioperativen Steroiden (d. h. Corticosteroiden) war zulässig. Chronische
Steroidgabe (definiert als tägliche Corticosteroidgabe für >/= 8 Wochen) zur Linderung der
Nebenwirkungen einer Chemo- und/oder Strahlentherapie bei Krebs galt nicht als Ausschlussgrund,
sofern der Patient nach Ansicht des Prüfarztes nicht an einer Steroidtoxizität litt. Eine chronische
Corticosteroidgabe (entsprechend obiger Definition), die nicht zur Linderung der Nebenwirkungen einer
systemischen Chemotherapie diente, galt hingegen als Ausschlussgrund, sofern die Corticosteroide nicht
4 Wochen vor dem geplanten Indexeingriff abgesetzt wurden.
Tägliche Gabe von Warfarin, Heparin oder anderen Antikoagulanzien, Aspirin oder anderen
nichtsteroidalen Antirheumatika ohne präoperatives Wash-out gemäß dem Versorgungsstandard.
Dokumentierte klinisch signifikante Gerinnungsstörung mit PTT > 37 Sekunden oder INR > 1,3 INR-
Einheiten.
Geschwächtes Immunsystem oder Autoimmunerkrankung oder chronische Immunsuppressivagabe im
Ausgangszustand.
Systemische Infektion oder Anzeichen einer Infektion jeglicher Art in der Nähe der vorgesehenen
Operationsstelle.
Serum-Kreatininspiegel > 2,0 mg/dl.
Serum-Gesamtbilirubin > 2,5 mg/dl im Ausgangszustand.
Nicht eingestellter Diabetes gemäß dem Versorgungsstandard der Einrichtung (HbA1c > 7 %,
Blutzucker usw.) im Ausgangszustand.
Intraoperative Einschlusskriterien:
Lineare Länge der Durotomie ≥ 2 cm.
Abstand der Duraränder von den Rändern des Knochendefekts durchgehend ≥ 3 mm.
Intraoperativ vorhandener Liquoraustritt nach Abschluss des primären Duraverschlusses (mit oder ohne
nicht-autologe Duraplastik oder autologes Gewebe), entweder spontan oder nach Valsalva-Versuch, bei
bis zu 20 cm H2O für bis zu fünf (5) Sekunden.
Intraoperative Ausschlusskriterien:
Zufallsbefund, der eines der oben aufgeführten präoperativen Ausschlusskriterien erfüllt.
Intraoperativ erforderliche Platzierung eines Liquorableitungsimplantats (z. B. Ventrikelkatheter,
Subduralkatheter, Lumbaldrainage oder sonstiges Produkt zur externen Liquorableitung), das nach dem
Eingriff belassen wurde. Hinweis: Subgaleale Drainagen zum akuten postoperativen Management der
Inzisionsstelle waren zulässig.
Abstand von > 2 mm zwischen den Durarändern oder zwischen dem Durarand und dem
Duraplastikmaterial (gemäß optischer Schätzung durch den Chirurgen) vor der Applikation des
chirurgischen Dichtungsmittels.
Page 39

39
Tabelle 2. Zusammenfassung der demografischen Angaben für die Studienpatienten
Eigenschaften
Mit Adherus AutoSpray DuraDichtungsmittel behandelte Population
Kontrollpopulation
Anzahl der Teilnehmer
124
126
Männer/Frauen
41/83
40/86
Medianes Alter (Jahre)
54,2
51,1
ASA-Score der Teilnehmer (N (%))
I
2 (1,6)
8 (6,3)
II
47 (37,9)
50 (39,7)
III
69 (55,6)
62 (49,2)
IV
6 (4,8)
6 (4,8)
V
0 (0,0)
0 (0,0)
Primärindikation für die Operation (N (%))
Tumor
56 (45,2)
53 (42,1)
Epilepsie
1 (0,8)
1 (0,8)
Nervendekompression
17 (13,7)
21 (16,7)
AVM
3 (2,4)
5 (4,0)
Aneurysma
28 (22,6)
26 (21,3)
Chiari-Malformation
17 (13,7)
18 (14,3)
Zyste
2 (1,6)
1 (0,8)
Sonstiges
0 (0,0)
1 (0,8)
Zugang (N (%))
Infratentorial
53 (42,7)
52 (41,3)
Supratentorial
71 (57,3)
74 (58,7)
Primärtechnik für den Duraverschluss (N (%))
Naht
48 (38,7)
48 (38,1)
Naht + autologes Duramaterial
29 (23,4)
34 (27,0)
Naht + nicht-autologes Duramaterial
45 (36,3)
39 (31,0)
UE, die mit einer Häufigkeit von mehr als 1 % in der Intent-to-treat(ITT)-Population auftraten, sind in der
vorstehenden Tabelle 1 zusammengefasst.
Page 40

40
Sterilisationsmethode und Entsorgungsverfahren für Adherus AutoSpray ET DuraDichtungsmittel
Die Sterilisationsmethode und das Entsorgungsverfahren für Adherus AutoSpray ET Dura-Dichtungsmittel Gerät
gehen aus der nachstehenden Tabelle hervor.
Beschreibung
Teilenummer
Sterilisation-
smethode
Häufigkeit der
Anwendung
Entsorgungsverfahren
Adherus
AutoSpray
ET Dura-
Dichtungsmittel
NUS-009
Strahlung
Nur zum
einmaligen
Gebrauch
Das Adherus AutoSpray
ET Dura-Dichtungsmittel
Gerät in einen vom
Krankenhaus genehmigten
Behälter für biologisch
gefährlichen Abfall
entsorgen.
Es darf nicht mit dem
normalen Müll
entsorgt werden.
Umgebungsbedingungen im Betrieb
Lagerungstemperatur
Bei weniger als 30 °C aufbewahren
Betriebstemperatur
5 °C bis 35 °C
Geräuschentwicklung
≤ 60 dB
Lieferform
Die Bestandteile der Adherus AutoSpray ET Dura-Dichtungsmittel Packung sind:
Adherus AutoSpray ET Dura-Dichtungsmittel Kit-Schale (1)
Vormontierter Applikator (1)
Aktiviertes PEG-Pulver in Ampulle mit grüner Kappe (1)
PEI-Lösung in Ampulle mit silberner Kappe (1)
Betrieb des Adherus AutoSpray ET Dura-Dichtungsmittels
Die nachstehenden Abschnitte enthalten Anweisungen für die Vorbereitung und das Einschalten des Adherus
AutoSpray ET Dura-Dichtungsmittels.
Rekonstitution der Vernetzungskomponenten
1) Den Inhalt der Außenschale mit der Aufschrift „Adherus AutoSpray ET Dura-Dichtungsmittel“ unter
Beachtung aseptischer Kautelen in das sterile Feld bringen.
2) Den Deckel von der Adherus AutoSpray ET Dura-Dichtungsmittel Kit-Schale abnehmen.
3) Den vormontierten Adherus AutoSpray ET Dura-Dichtungsmittel Applikator entnehmen.
4) Das Gerät so halten, dass die Sprühdüse mit verlängerter Spitze nach oben zeigt, und die roten Kappen
über den Dornen an den blauen Ampullenadapterstücken des Applikators entfernen und entsorgen
(Abb. A-1).
Hinweis: Eventuell muss zum Abnehmen der Kappen eine Gefäßklemme oder ein ähnliches Werkzeug
benutzt werden. Außerdem empfiehlt sich eine Drehbewegung beim Abnehmen der Kappe.
5) Die Ampulle mit der PEI-Lösung (Ampulle mit silberner Kappe) aus der Schale nehmen und das mit einer
Kappe verschlossene Ende in das zum weißen Spritzenkolben gehörende blaue Ampullenadapterstück des
Applikators setzen, indem der Applikator festgehalten und die Ampulle vollständig eingedrückt wird, sodass
der Dorn die Septa durchbohrt und die silberne Aluminiumversiegelung bis zum Anschlag im
Ampullenadapterstück steckt (Abb. A-2).
6) Die Ampulle mit dem pulverförmigen PEG-Ester (Ampulle mit grüner Kappe) aus der Schale nehmen und
das mit einer Kappe verschlossene Ende in das zum grünen Spritzenkolben gehörende blaue
Ampullenadapterstück des Applikators setzen, indem der Applikator festgehalten und die Ampulle vollständig
eingedrückt wird, sodass der Dorn die Septa durchbohrt und die grüne Aluminiumversiegelung bis zum
Anschlag im Ampullenadapterstück steckt (Abb. A-2).
Page 41

41
7) Den Applikator mit den Ampullen nach oben halten und die Druckstange eindrücken, um die Flüssigkeiten in
die Ampullen zu transferieren. Die Druckstange weiter eindrücken (Abb. A-3).
Hinweis: Falls erforderlich die Druckstange mit beiden Händen eindrücken.
8) Die Druckstange weiterhin gedrückt halten und das Gerät vorsichtig und mit Unterbrechungen schütteln, bis
sich das Pulver vollständig aufgelöst hat (Abb. A-3).
Hinweis: Der pulverförmige PEG-Ester löst sich auch während der Unterbrechungen beim vorsichtigen
Schütteln weiter auf. Zu starkes Schütteln kann zu übermäßiger Luftbläschenbildung führen.
9) Die Druckstange loslassen, sodass sie zurückschnellen kann, und erneut vorschieben, um eine homogene
Vermischung der beiden Lösungen zu gewährleisten.
10) Die Druckstange erneut zurückschnellen lassen und die Druckstange zurückziehen, bis die rekonstituierten
Bestandteile restlos aus den Ampullen transferiert wurden (Ansicht von oben in Abb. A-4).
Hinweis: Falls während der Rekonstitution versehentlich die Drucktaste Ein/Aus betätigt wird, kann das
Gerät ohne nachteilige Auswirkungen abgeschaltet werden. Um optimale Ergebnisse zu erzielen, muss die
Verwendung innerhalb von zwei Stunden nach der Rekonstitution abgeschlossen werden.
Einschalten des Adherus AutoSpray ET Dura-Dichtungsmittel Geräts
11) Die Ein/Aus-Taste an der Unterseite des Geräts drücken, um das Gerät vor der Applikation des
Hydrogelsprays zu „aktivieren“ (Abb. B-1).
Hinweis: Der Adherus AutoSpray ET Dura-Dichtungsmittel Applikator sollte vor dem Abnehmen der
Ampullenadapterstücke erst unmittelbar vor dem Aufsprühen aktiviert werden, um eine versehentliche
Verstopfung der Düse zu verhindern.
Vorbereitung des Geräts und der zu behandelnden Stelle
12) Falls nicht bereits geschehen, den Adherus AutoSpray ET Dura-Dichtungsmittel Applikator durch Druck auf
die Ein/Aus-Taste einschalten (Abb. B-1).
Hinweis: Beim Druck auf die Ein/Aus-Taste wird die interne Luftpumpe aktiviert, wodurch hörbar angezeigt
wird, dass das System nun aktiv ist. Falls die Pumpe nicht zu hören ist, ist das betreffende Adherus
AutoSpray ET Dura-Dichtungsmittel Gerät außer Betrieb zu nehmen. In diesem Fall die Anweisungen im
Abschnitt „Fehlerbehebung“ befolgen.
13) Vor der Abgabe der Behandlung das Gerät so halten, dass die Ampullen nach oben zeigen, und beide
Ampullenadapterstücke entfernen, indem die blauen Adapterstücke entgegen dem Uhrzeigersinn gedreht
werden, bis das Gerät sie freigibt (Ansicht von oben in Abb. B-2).
Page 42

42
14) Im Sinne der optimalen Gewebehaftung an der Behandlungsstelle sicherstellen, dass ein 2 bis 3 Millimeter
breiter Rand rund um den Defekt von Blut, blutstillenden Mitteln oder anderen losen Geweben frei bleibt und
der Abfluss von Liquor cerebrospinalis minimiert wird.
15) Bei Bedarf die Sprühdüse mit verlängerter Spitze biegen bzw. formen, um einen besseren Zugang zur bzw.
bessere Sicht auf die Behandlungsstelle zu erhalten.
Abgabe der Behandlung
16) Um das vorbereitete Produkt zu applizieren, das Gerät durch Druck auf die Ein/Aus-Taste einschalten, falls
nicht bereits geschehen.
17) Den Applikator des Geräts nach oben richten und ein Stück Verbandmull in etwa 5 bis 10 Zentimeter
Abstand über die Düse halten (Abb. B-3).
18) Festen, gleichmäßigen Druck auf die Mitte der Druckstange ausüben, bis das Produkt aus der Düse sprüht
(Abb. B-3).
19) Sobald sich auf dem Verbandmull ein grünes Dichtungsmittel bildet, nicht mehr auf die Druckstange
drücken. Das Adherus AutoSpray ET Dura-Dichtungsmittel ist nun bereit zur Abgabe der Behandlung.
20) Die Düse des Geräts in etwa 2 bis 4 Zentimeter Abstand auf die zu behandelnde Stelle richten und festen,
gleichmäßigen Druck auf die Mitte der Druckstange ausüben, um das Lösungsgemisch abzugeben
(Abb. B-4).
21) Mit dem Auftragen des Adherus Dichtungsmittels fortfahren, bis sich eine dünne Schicht (etwa 1–2 mm)
gebildet hat.
Hinweis: Beurteilung der Dicke:
Duraverschluss mit Nähten: Sicherstellen, dass alle Nahtknoten vollständig mit HydrogelDichtungsmittel bedeckt sind. Normalerweise wird Nahtmaterial der Stärke 4-0, 3-0 und 2-0
zum Verschließen der Dura verwendet. 4-0, die kleinste dieser Stärken, besitzt einen
Durchmesser von 0,15 mm bis 0,2 mm. Ein Knoten der Nahtmaterialstärke 4-0 weist
mindestens vier Nahtmaterialbreiten auf bzw. ist zwischen ca. 0,6 und 0,8 mm dick. Eine
komplette Knotenabdeckung garantiert, dass die Mindestdicke erzielt wird.
Duraverschluss mit Duraplastik-Onlay: Sicherstellen, dass genügend HydrogelDichtungsmittel appliziert wird, um das Duraplastik-Onlay sowie mindestens 3–4 mm der
angrenzenden nativen Dura mit einer 1–2 mm dicken Hydrogelschicht zu bedecken. Dabei
die Höhe des Onlay-Materials zur Beurteilung der Dicke verwenden. Hinweis: Nach
Befeuchtung mit Kochsalzlösung beträgt die Dicke der beiden verbreiteten OnlayDuraplastik-Materialien DuraGen® Dura-Transplantatmatrix und Durepair® DuraRegenerationsmatrix ungefähr 3 mm bzw. 1 mm.
Unterbrechung der Sprühapplikation
22) Die Applikation kann während der Behandlung jederzeit unterbrochen werden, indem der Druck auf die
Druckstange gelöst wird. Um Verstopfungen zu vermeiden, darf die Pumpe jedoch erst abgeschaltet werden,
wenn die Applikation des Dichtungsmittels endgültig abgeschlossen ist.
Hinweis: Falls sich während der Applikation zu viel Hydrogel an der Sprühdüse ansammelt, kann dieses
durch vorsichtiges Abwischen mit einem Stück Mull entfernt werden.
Abschluss der Abgabe
23) Überschüssiges Dichtungsmittel über den Durarand hinaus kann bei Bedarf mit einer Penfield-Sonde, einer
Schere oder mechanisch entfernt werden.
Page 43

43
Entsorgung des Adherus AutoSpray ET Dura-Dichtungsmittels
Wenn die Applikation des Dichtungsmittels endgültig abgeschlossen ist, das Gerät abschalten, den
Batteriefachdeckel öffnen, um die interne Versiegelung zu durchbrechen, und die Batterien zur sachgemäßen
Entsorgung entnehmen. Die nachstehende Tabelle enthält wichtige Informationen zur Entsorgung der
Komponenten des Adherus AutoSpray ET Dura-Dichtungsmittels.
Gerät
Entsorgungsanweisungen
Adherus AutoSpray ET
Dura-Dichtungsmittel
Das Adherus AutoSpray ET Dura-Dichtungsmittel besteht aus
einem Kunststoffgehäuse und elektrischen Bauteilen. Am Ende
der Nutzungsdauer muss dieses Gerät einer separaten
Entsorgung zugeführt werden. Dieses Produkt darf nicht in den
unsortierten Müll gelangen.
Fehlerbehebung beim Adherus AutoSpray ET Dura-Dichtungsmittel
Die folgenden möglichen Ausfallarten wurden für das Adherus AutoSpray ET Dura-Dichtungsmittel ermittelt. Für
jede Ausfallart ist eine Sicherungsvorkehrung vorhanden (siehe nachstehende Liste), um die Auswirkungen
derartiger Fehlfunktionen zu begrenzen.
Mögliche Ausfallarten
Sicherungsvorkehrung
1. Luftpumpe nicht aktiviert
1. Ein/Aus-Taste nicht gedrückt
2. Sprühdüse blockiert
2. Die Ampullenadapterstücke nicht vor dem
Einschalten der Luftpumpe abnehmen; die Düse
nach Gebrauch abwischen.
Page 44

44
Um Komplikationen zu vermeiden, muss die Flusstabelle zur Fehlerbehebung beim Adherus AutoSpray ET DuraDichtungsmittel in der vorstehenden Tabelle genau eingehalten werden. Während eines Eingriffs müssen sich die
Bemühungen des Anwenders zur Fehlerbehebung beim Adherus AutoSpray ET Dura-Dichtungsmittel strikt auf
die oben beschriebenen Schritte beschränken. Wenn die Fehlerbehebung erfolglos bleibt, muss das betreffende
Adherus AutoSpray ET Dura-Dichtungsmittel Gerät umgehend außer Betrieb genommen werden. Anschließend
ein neues Adherus AutoSpray ET Dura-Dichtungsmittel Gerät auspacken.
Elektrische Spezifikationen des Adherus AutoSpray ET Dura-Dichtungsmittels
Das Adherus AutoSpray ET Dura-Dichtungsmittel erfüllt die folgenden Normen:
IEC 60601-1 3. Ausgabe Anforderungen zur elektrischen Sicherheit
IEC 60601-1-2 3. Ausgabe Anforderungen zur Störfestigkeit
Anleitungen und Herstellererklärung – Elektromagnetische Emissionen
Das Adherus AutoSpray ET Dura-Dichtungsmittel ist für den Gebrauch in der nachfolgend spezifizierten
elektromagnetischen Umgebung vorgesehen. Der Kunde oder der Benutzer des Adherus AutoSpray ET DuraDichtungsmittels hat dafür zu sorgen, dass das Produkt nur in einer solchen Umgebung verwendet wird.
Emissionstest
Konformität
Elektromagnetische Umgebung – Anhaltspunkte
HF-Emissionen CISPR 11
Gruppe 1
Das Adherus AutoSpray ET Dura-Dichtungsmittel nutzt HF-Energie
nur für seine interne Funktion. Die HF-Emissionen sind daher sehr
gering, sodass es unwahrscheinlich ist, dass sie sich störend auf in
der Nähe befindliche Geräte auswirken.
HF-Emissionen CISPR 11
Klasse B
Das Adherus AutoSpray ET Dura-Dichtungsmittel eignet sich für
den Gebrauch in allen Einrichtungen, einschließlich
Privatwohnungen und Einrichtungen mit direktem Anschluss an
das öffentliche Niederspannungsstromnetz zur Versorgung von
Wohngebäuden.
Emission von Oberwellen
IEC 61000-3-2
Nicht
zutreffend
Spannungsschwankungen/
Flickeremissionen
IEC 61000-3-3
Nicht
zutreffend
Page 45

45
Anleitungen und Herstellererklärung – Elektromagnetische Störfestigkeit für alle Geräte und Systeme
Das Adherus AutoSpray ET Dura-Dichtungsmittel ist ein batteriebetriebenes System und für den Gebrauch in der
nachfolgend spezifizierten elektromagnetischen Umgebung vorgesehen. Der Kunde oder der Benutzer des
Adherus AutoSpray ET Dura-Dichtungsmittels hat dafür zu sorgen, dass das Produkt in einer solchen Umgebung
verwendet wird.
Test zur Störfestigkeit
IEC 60601 Testpegel
Konformitätsstufe
Elektromagnetische
Umgebung – Anhaltspunkte
Elektrostatische Entladung
(ESE) IEC 61000-4-2
±6 kV Kontakt
±8 kV Luft
Nicht zutreffend –
Batteriebetriebenes
System ohne digitale
Schaltkreise
Der Fußboden sollte aus Holz,
Beton oder Keramikfliesen
bestehen. Bei Fußböden mit
Abdeckung aus
Synthetikmaterial sollte eine
relative Luftfeuchtigkeit von
mindestens 30 % herrschen.
Schnelle transiente
elektrische
Störgrößen/Burst
IEC 61000-4-4
±2 kV für
Stromversorgungsleitungen
±1 kV für Ein-/
Ausgangsleitungen
Nicht zutreffend –
Batteriebetriebenes
System
Die Qualität der
Netzversorgung sollte einer
typischen gewerblichen oder
Krankenhaus-Umgebung
entsprechen.
Spannungsstöße
IEC 61000-4-5
±1 kV Differenzmodus
±2 kV Gleichtaktmodus
Nicht zutreffend –
Batteriebetriebenes
System
Die Qualität der
Netzversorgung sollte einer
typischen gewerblichen oder
Krankenhaus-Umgebung
entsprechen.
Spannungseinbrüche,
Spannungsschwankungen
und kurze
Unterbrechungen in den
Stromversorgungsleitungen
IEC 61000-4-11
<5 % U
T
(>95 % Einbruch in UT)
über 0,5 Zyklen
40 % U
T
(60 % Einbruch in UT)
über 5 Zyklen
70 % U
T
(30 % Einbruch in UT)
über 25 Zyklen
<5 % U
T
(>95 % Einbruch in UT)
über 5 s
Nicht zutreffend –
Batteriebetriebenes
System
Die Qualität der
Netzversorgung sollte einer
typischen gewerblichen oder
Krankenhaus-Umgebung
entsprechen. Wenn der
Benutzer des Geräts auch bei
Stromausfällen einen
fortgesetzten Betrieb benötigt,
wird empfohlen, das Gerät
über eine unterbrechungsfreie
Stromversorgung oder
Batterie zu betreiben.
Magnetfeld aufgrund der
Netzfrequenz (50/60 Hz)
IEC 61000-4-8
3 A/m
Nicht zutreffend –
Batteriebetriebenes
System ohne
magnetisch
empfindliche Bauteile
Die Stärke von Magnetfeldern
aufgrund der Netzfrequenz
sollte die übliche Stärke an
einem typischen Ort in einer
typischen gewerblichen
und/oder Krankenhaus-
Umgebung nicht
überschreiten.
*HINWEIS: UT ist die Netzspannung (Wechselstrom) vor dem Anlegen des Testpegels.
Page 46

46
Anleitungen und Herstellererklärung – Elektromagnetische Störfestigkeit
Das Adherus AutoSpray ET Dura-Dichtungsmittel ist für den Gebrauch in der nachfolgend spezifizierten
elektromagnetischen Umgebung vorgesehen. Der Kunde oder der Benutzer des Adherus AutoSpray ET DuraDichtungsmittels hat dafür zu sorgen, dass das Produkt in einer solchen Umgebung verwendet wird.
Test zur
Störfestigkeit
IEC 60601
Testpegel
Konformitätsstufe
Elektromagnetische Umgebung – Anhaltspunkte
Leitungsgeführte
HF IEC 61000-4-6
Abgestrahlte HF
IEC 61000-4-3
3 Vrms
150 kHz bis
80 MHz
3 V/m
80 MHz bis
2,5 GHz
Nicht zutreffend –
Batteriebetriebenes
System ohne
digitale Schaltkreise
Nicht zutreffend –
Batteriebetriebenes
System ohne
digitale Schaltkreise
Tragbare und mobile HF-Kommunikationsgeräte
sollten nicht näher zu irgendeinem Teil des Adherus
AutoSpray ET Dura-Dichtungsmittel inkl. Kabeln als
im empfohlenen Trennabstand benutzt werden, der
sich anhand der für die Frequenz des Senders
anwendbaren Gleichung errechnet.
Empfohlener Trennabstand
d = 1,2√P
d = 1,2√P 80 MHz bis 800 MHz
d = 2,3√P 800 MHz bis 2,5 GHz
wobei P die maximale Nennausgangsleistung des
Senders in Watt (W) gemäß dem Hersteller des
Senders und d der empfohlene Trennabstand in
Metern (m) ist.
Die Feldstärke fest eingestellter HF-Sender, die
durch eine elektromagnetische
Standortvermessunga bestimmt wurde, sollte unter
der Konformitätsstufe in jedem einzelnen
Frequenzbereich liegen.
b
In der Nähe von Geräten, die mit folgendem Symbol
gekennzeichnet sind, können Störungen auftreten:
Hinweis 1: Bei 80 MHz und 800 MHz gilt der jeweils höhere Frequenzbereich.
Hinweis 2: Diese Richtlinien treffen eventuell nicht in allen Situationen zu. Elektromagnetische Ausbreitung wird durch
Absorption und Reflexion an Gebäuden, Gegenständen und Personen beeinflusst.
a Die Feldstärke von festen Sendern, beispielsweise von Basisstationen für Funktelefone (Mobiltelefone, schnurlose
Telefone) und von ortsfesten Funkstationen, Amateurfunkstationen, MW- und UKW-Radiosendern und
Fernsehsendern kann theoretisch nicht mit Genauigkeit vorhergesagt werden. Um die elektromagnetischen
Umgebungsbedingungen in der Nähe fester HF-Sender zu bewerten, sollte eine elektromagnetische
Standortvermessung durchgeführt werden. Wenn die gemessene Feldstärke an dem Standort, an dem das
Adherus AutoSpray ET Dura-Dichtungsmittel eingesetzt wird, die oben erwähnte HF-Konformitätsstufe übersteigt,
sollte die normale Funktion des Adherus AutoSpray ET Dura-Dichtungsmittel Geräts überprüft werden. Falls ein
anomales Verhalten festgestellt wird, können zusätzliche Maßnahmen erforderlich sein, beispielsweise eine
Neuausrichtung oder Umpositionierung des Adherus AutoSpray ET Dura-Dichtungsmittel Geräts.
b Im Frequenzbereich von 150 kHz bis 80 MHz darf die Feldstärke maximal 3 V/m betragen.
Page 47

47
Empfohlene Trennabstände zwischen tragbaren und mobilen HFKommunikationsgeräten und dem Adherus AutoSpray ET Dura-Dichtungsmittel
Das Adherus AutoSpray ET Dura-Dichtungsmittel ist für den Gebrauch in einer elektromagnetischen Umgebung
vorgesehen, in der Störungen durch abgestrahlte HF unter Kontrolle sind. Der Kunde bzw. der Benutzer des
Adherus AutoSpray ET Dura-Dichtungsmittel Geräts kann dazu beitragen, elektromagnetische Störungen durch
Einhalten eines Mindestabstands zwischen den tragbaren und mobilen HF-Kommunikationsgeräten (Sendern)
und dem Adherus AutoSpray ET Dura-Dichtungsmittel Gerät entsprechend der maximalen Ausgangsleistung der
Kommunikationsgeräte zu vermeiden, wie weiter unten empfohlen wird.
Maximale
Nennausgangslei
stung des
Senders
W
Trennabstand entsprechend der Frequenz des Senders
m
150 kHz bis 80 MHz
d = 1,2√P
80 MHz bis 800 MHz
d = 1,2√P
800 MHz bis 2,5 GHz
d = 2,3√P
0,01
0,12
0,12
0,23
0,1
0,38
0,38
0,73
1
1,2
1,2
2,3
10
3,8
3,8
7,3
100
12
12
23
Bei Sendern mit einer anderen maximalen Nennausgangsleistung als oben angegeben kann der empfohlene Trennabstand d
in Metern (m) anhand der Gleichung für die Frequenz des Senders abgeschätzt werden, wobei P die maximale
Nennausgangsleistung des Senders in Watt (W) gemäß dem Hersteller des Senders ist.
HINWEIS 1: Bei 80 MHz und 800 MHz sollte der Trennabstand für den höheren Frequenzbereich verwendet werden.
HINWEIS 2: Diese Richtlinien treffen eventuell nicht in allen Situationen zu. Elektromagnetische Ausbreitung wird durch
Absorption und Reflexion an Gebäuden, Gegenständen und Personen beeinflusst.
Page 48

48
Definizioni dei simboli
La seguente tabella riporta i simboli utilizzati nel presente manuale, sui componenti del sistema e sulle etichette
delle confezioni, e ne fornisce il significato corrispondente. Questi simboli devono essere considerati con la
dovuta attenzione in quanto possono essere correlati a importanti avvertenze e precauzioni di sicurezza.
Simbolo
Significato
Per ulteriori informazioni, consultare le istruzioni per l’uso
Esclusivamente monouso; non riutilizzare
Non risterilizzare
Sterilizzato mediante irradiazione
Usare entro; data di scadenza: anno e ultimo giorno del mese
Non utilizzare se la confezione è danneggiata
Mantenere al riparo dalla luce solare
Non smaltire nei rifiuti indifferenziati
Rappresentante autorizzato per la Comunità Europea
0050
Marchio CE e numero di identificazione dell’ente notificato
Codice lotto
Numero di catalogo
Quantità
Produttore
Apparecchiatura di tipo BF (parte applicata flottante, non
cardiaca)
Corrente continua
Limitazioni di temperatura (conservare al di sotto)
Rischio biologico
Pulsante ON/OFF (accensione/spegnimento)
Page 49

49
Indice
Descrizione del dispositivo.................................................................................................... 50
Indicazioni ............................................................................................................................... 50
Controindicazioni ................................................................................................................... 51
Avvertenze .............................................................................................................................. 51
Precauzioni ............................................................................................................................. 51
Eventi avversi ......................................................................................................................... 51
Informazioni cliniche .............................................................................................................. 53
Metodo di sterilizzazione e smaltimento del sigillante durale a punta estesa
Adherus AutoSpray ................................................................................................................ 56
Condizioni ambientali di esercizio ........................................................................................ 56
Confezionamento ................................................................................................................... 56
Operazioni per il sigillante durale a punta estesa Adherus AutoSpray .............................. 56
Ricostituzione dei componenti reticolanti ............................................................................... 56
Accensione del dispositivo sigillante durale a punta estesa Adherus AutoSpray ................... 57
Preparazione del dispositivo e del sito da trattare ................................................................. 57
Erogazione dell’idrogel .......................................................................................................... 58
Arresto dell’applicazione spray .............................................................................................. 58
Conclusione dell’erogazione dell’idrogel ................................................................................ 58
Smaltimento del sigillante durale a punta estesa Adherus AutoSpray .............................. 59
Specifiche elettriche del sigillante durale a punta estesa Adherus AutoSpray ................. 60
Informazioni di compatibilità e dichiarazioni del fabbricante – Emissioni
elettromagnetiche ................................................................................................................. 60
Informazioni di compatibilità e dichiarazioni del fabbricante – Immunità elettromagnetica
per tutte le apparecchiature e i sistemi .................................................................................. 61
Informazioni di compatibilità e dichiarazioni del fabbricante – Immunità elettromagnetica ..... 62
Distanze di separazione consigliate tra le apparecchiature di comunicazione in RF portatili
e mobili e il sigillante durale a punta estesa Adherus AutoSpray ........................................... 63
IT
Page 50

50
Descrizione del dispositivo
Il sigillante durale a punta estesa Adherus AutoSpray è un dispositivo monouso, sterile, elettromeccanico,
alimentato a batteria e dotato di componenti interni in grado di fornire un flusso d’aria ausiliario per l’erogazione di
un idrogel sigillante bicomponente sintetico e bioassorbibile; il dispositivo è in grado di gestire l’interruzione
dell’erogazione del sigillante senza ostruirsi.
Il dispositivo è composto da un applicatore preassemblato e da due fiale in vetro separate. Una delle due fiale in
vetro contiene estere di polietilenglicole (PEG) attivato in polvere e l’altra una soluzione di polietilenimmina (PEI)
in acqua sterile. I componenti reticolanti vengono ricostituiti prima dell’uso con i rispettivi tamponi di ricostituzione
che si trovano all’interno dell’applicatore. Le soluzioni così prodotte si miscelano all’interno della punta estesa
dell’applicatore stesso, reticolandosi rapidamente per generare l’idrogel sigillante poco dopo la fuoriuscita dalla
punta dell’applicatore. La soluzione erogata si reticola in modo immediato generando un idrogel sigillante che
verrà successivamente assorbito dall’organismo del paziente nell’arco di 90 giorni circa (tempo sufficiente per
consentire la cicatrizzazione).
La figura seguente illustra i componenti principali del dispositivo sigillante durale a punta estesa Adherus AutoSpray.
Ugello a punta estesa
L’ugello a punta estesa integrato è malleabile e può essere piegato o sagomato come desiderato. L’ugello a
punta estesa miscela a fondo le due soluzioni componenti del sigillante ed eroga la soluzione risultante al sito da
trattare con un getto spray mirato. L’ugello spray è integrato nel sistema e non può essere rimosso.
Connettori per le fiale
I connettori per le fiale sono compatibili con le fiale contenenti i componenti reticolanti. Per la ricostituzione, le
fiale vengono fissate a tali connettori. A ricostituzione completata, i connettori vengono staccati dal dispositivo
sigillante durale a punta estesa Adherus AutoSpray, svitandoli in senso antiorario. La rimozione dei connettori
consente alle soluzioni di fluire attraverso l’ugello.
Pulsante ON/OFF
Il pulsante ON/OFF accende e spegne la pompa dell’aria a batteria. Il dispositivo è fornito con l’interruttore in
posizione OFF (spento), isolando la pompa dell’aria dalla fonte di alimentazione a batteria. Prima di staccare i
connettori per le fiale, portare il pulsante ON/OFF in posizione ON (acceso) per attivare la pompa dell’aria.
Sportello del vano batterie
Uno sportello situato sulla parte inferiore del dispositivo consente al personale di sala operatoria di rimuovere le
batterie per consentirne il corretto smaltimento una volta terminato l’uso del dispositivo. Lo sportello del vano
batterie è incollato. Usare uno strumento a punta piatta per scalzarlo, aprirlo e rimuovere le batterie per lo
smaltimento.
Spingi-stantuffi
Lo spingi-stantuffi blocca meccanicamente insieme i due stantuffi, in modo da consentirne l’azionamento
simultaneo.
Indicazioni
Il sigillante durale a punta estesa Adherus AutoSpray è previsto per l’uso come coadiuvante dei metodi standard
per la riparazione della dura madre (come la sutura), allo scopo di fornire una chiusura a tenuta stagna nel corso
di procedure craniche e spinali.
Spingi-stantuffi
Ugello a punta estesa
Pulsante ON/OFF
Connettori per le fiale
Page 51

51
Controindicazioni
Il sigillante durale a punta estesa Adherus AutoSpray non deve essere usato in spazi anatomici confinati, in cui
desti preoccupazione la compressione dei nervi. L’idrogel può dilatarsi fino al 13% delle sue dimensioni in
qualsiasi direzione.
Avvertenze
Il sigillante durale a punta estesa Adherus AutoSpray non è stato studiato nelle situazioni seguenti:
soggetti che necessitano di procedure che implicano un approccio translabirintico, transfenoidale
o transorale, o qualsiasi procedura che preveda la penetrazione dei seni paranasali o delle celle mastoidee;
soggetti in cui le distanze tra i bordi durali sono superiori a 2 mm;
soggetti con funzionalità renale o epatica gravemente alterata;
soggetti con infezione attiva presente nel sito chirurgico;
soggetti con idrocefalo trattato o non trattato (es. con dispositivi previsti per l’evacuazione del liquido
cerebrospinale (LCS) o in cui la dinamica del liquor è alterata);
soggetti affetti da comorbilità cliniche sottostanti o in trattamento con un farmaco che notoriamente
interferisce con la cicatrizzazione delle ferite (es. sottoposti a precedente intervento neurochirurgico
intracranico nella stessa posizione anatomica, a radioterapia o chemioterapia, affetti da neoplasia nota,
diabete, tossicità da steroidi, uso cronico di corticosteroidi, con sistema immunitario compromesso o in
terapia con anticoagulanti, aspirina o FANS);
soggetti con allergia nota al colorante blu FD&C Blue n. 1 o al colorante giallo FD&C Yellow n. 5;
donne in stato di gravidanza o allattamento.
Il sigillante durale a punta estesa Adherus AutoSpray è previsto per l’uso come coadiuvante dei metodi standard
di riparazione della dura madre. L’efficacia del sigillante durale a punta estesa Adherus AutoSpray su altri tipi di
tessuto non è stata studiata.
Precauzioni
Il sigillante durale a punta estesa Adherus AutoSpray è confezionato sterile. Non utilizzare il prodotto se le
vaschette di confezionamento sono aperte o danneggiate. Non risterilizzare.
Il sigillante durale a punta estesa Adherus AutoSpray è previsto esclusivamente per l’uso monopaziente. Gettare
ogni residuo di prodotto inutilizzato e/o aperto. Il riutilizzo del dispositivo può provocare la contaminazione
crociata che può a sua volta causare lesioni, malattie o il decesso del paziente.
Mantenere al riparo dalla luce solare. Non utilizzare il prodotto se la polvere di estere PEG non è perfettamente
granulare.
Usare il sigillante durale a punta estesa Adherus AutoSpray entro 2 ore dalla ricostituzione dei componenti
reticolanti. Prove eseguite 8 ore dopo la ricostituzione hanno evidenziato un piccolo, ma statisticamente
significativo, aumento del volume del sigillante rispetto ai campioni ricostituiti 1, 2 o 4 ore prima.
La punta estesa dell’applicatore è stata progettata per adattarsi alle esigenze chirurgiche grazie alla possibilità di
piegarla in lunghezza. Applicare pressione con cautela quando si piega la punta. Non piegare con angoli superiori
a 90 gradi. Assicurarsi che l’idrogel fluisca dopo aver sagomato l’applicatore in base alle esigenze chirurgiche.
L’autonomia della batteria per il sistema dell’applicatore è di circa 2 ore di uso continuato.
Prima dell’applicazione dell’idrogel Adherus, accertarsi che l’efflusso del fluido (liquido cerebrospinale, sangue,
ecc.) sia cessato.
Non usare il sigillante durale a punta estesa Adherus AutoSpray in presenza di anestetici infiammabili o di
miscele di anestetici infiammabili con sostanze ossidanti.
Tenere il sigillante durale a punta estesa Adherus AutoSpray lontano da forti campi magnetici per evitare la
possibile interferenza delle comunicazioni RF. Le apparecchiature di risonanza magnetica possono interferire con
il funzionamento della pompa.
Non togliere le coperture del sistema, fatta eccezione per lo sportello del vano batterie.
Eventi avversi
Un dispositivo simile, il sigillante durale Adherus AutoSpray, contenente la stessa formulazione di sigillante
(sigillante durale Adherus), è stato sottoposto a valutazione in 124 soggetti partecipanti a uno studio clinico pilota,
prospettico, multicentrico, con gruppo di controllo. L’incidenza e la natura degli eventi avversi osservati in questa
popolazione di pazienti erano coerenti con il tipo e la complessità delle procedure neurochirurgiche eseguite e lo
stato di comorbilità dei pazienti trattati. Si sono verificati 4 decessi tra i soggetti su cui è stato utilizzato il sigillante
durale Adherus AutoSpray e 5 decessi tra i soggetti del gruppo di controllo. I decessi sono stati attribuiti alle
condizioni precedenti dei soggetti stessi. Nella tabella seguente sono riassunti gli eventi avversi verificatisi con
una frequenza dell’1% o superiore, segnalati per i soggetti trattati con il sigillante durale Adherus AutoSpray.
Non vi sono stati effetti avversi imprevisti causati dal dispositivo.
Page 52

52
Tabella 1. Riassunto degli eventi avversi per il sigillante durale Adherus AutoSpray
Evento avverso
Pazienti (n (%))
N=124
Anemia
3 (2,4)
Leucocitosi
2 (1,6)
Sordità unilaterale
2 (1,6)
Tinnito
4 (3,2)
Diplopia
5 (4,0)
Ptosi palpebrale
2 (1,6)
Edema periorbitale
6 (4,8)
Vista offuscata
7 (5,6)
Disfagia
4 (3,2)
Nausea
2 (1,6)
Reazione avversa
6 (4,8)
Dolore toracico
3 (2,4)
Progressione della malattia
3 (2,4)
Astenia
2 (1,6)
Polmonite
2 (1,6)
Infezione delle vie urinarie
2 (1,6)
Infezione della ferita
2 (1,6)
Ipoestesia del sito di incisione
3 (2,4)
Dolore nel sito di incisione
4 (3,2)
Emorragia periorbitale
3 (2,4)
Edema postoperatorio
2 (1,6)
Pseudomeningocele
9 (7,3)
Sieroma
3 (2,4)
Ematoma subdurale
3 (2,4)
Deiscenza della ferita
2 (1,6)
Debolezza muscolare
2 (1,6)
Afasia
4 (3,2)
Disturbi dell’equilibrio
2 (1,6)
Convulsioni
5 (4,0)
Paralisi multiple dei nervi cranici
2 (1,6)
Vertigini
7 (5,6)
Ictus embolico
2 (1,6)
Cefalea
14 (11,3)
Emiparesi
2 (1,6)
Ipoestesia
4 (3,2)
Paralisi del nervo ipoglosso
2 (1,6)
Perdita di memoria
2 (1,6)
Nistagmo
3 (2,4)
Parestesia
5 (4,0)
Perdita sensoriale
3 (2,4)
Tremore
2 (1,6)
Paralisi del VII nervo cranico
3 (2,4)
Paralisi delle corde vocali
2 (1,6)
Atelettasia
2 (1,6)
Insufficienza respiratoria
2 (1,6)
Alopecia
2 (1,6)
Rash cutaneo
2 (1,6)
Gonfiore del viso
4 (3,2)
Page 53

53
Informazioni cliniche
È stato condotto uno studio pilota prospettico, randomizzato, multicentrico, con gruppo di controllo, per valutare
l’uso del sigillante durale Adherus, erogato con l’applicatore Adherus AutoSpray, come coadiuvante dei metodi
standard di riparazione della dura madre (come le suture), per fornire una chiusura a tenuta stagna durante gli
interventi chirurgici al cranio. L’endpoint primario di questo studio era una valutazione composita della sicurezza e
dell’efficacia del sigillante durale Adherus AutoSpray (n=124 soggetti) confrontato a un gruppo di controllo attivo
(n=126 soggetti). I risultati dell’endpoint erano basati sul numero di soggetti che nella fase intraoperatoria non
presentavano perdite di liquido cerebrospinale causate dalla riparazione della dura madre dopo un massimo di
due applicazioni di sigillante durante la manovra di Valsalva, perdite di liquido cerebrospinale/pseudomeningocele
durante il periodo di follow-up di 120 giorni e la ripetizione non programmata del trattamento nel sito chirurgico
originale entro 120 giorni post-intervento. Il tasso complessivo di successo per l’analisi completa dei casi era del
91,2% nel gruppo Adherus rispetto al 90,6% nel gruppo di controllo. Adherus è stato ritenuto non inferiore al
controllo, con un margine di non inferiorità del 10% (p = 0,005). Nel primo periodo postoperatorio, quando
è prevista l’azione dei sigillanti, il tasso complessivo di successo al follow-up di 14 giorni sui soggetti che avevano
completato la visita era del 99,1% nel gruppo Adherus rispetto al 95,0% nel gruppo di controllo. Inoltre, il tasso
complessivo di successo al follow-up di 45 giorni sui soggetti che avevano completato la visita era del 96,6% nel
gruppo Adherus rispetto al 91,9% nel gruppo di controllo. L’analisi dell’assenza di mancato raggiungimento
dell’endpoint primario ha inoltre evidenziato che nel gruppo di controllo tale mancato raggiungimento tendeva a
verificarsi all’inizio del periodo di follow-up, mentre nel gruppo Adherus, nella maggioranza dei casi, veniva
identificato dalle immagini radiografiche richieste dal protocollo alla visita di follow-up a 120 giorni.
La sicurezza è stata determinata in base alla valutazione della cicatrizzazione delle ferita, infezioni del sito
chirurgico, meningite, peggioramento del punteggio Rankin modificato, gonfiore del sito chirurgico ed eventi
avversi durante il periodo di follow-up di 120 giorni. Cento (80,6%) soggetti del gruppo Adherus e 98 (77,8%)
soggetti del gruppo di controllo hanno avuto almeno un evento avverso nell’arco del periodo di follow-up di
120 giorni. Non vi sono stati effetti avversi imprevisti causati dal dispositivo. Tra i soggetti trattati con il sigillante
durale Adherus AutoSpray non sono state riscontrate infezioni profonde correlate all’uso del dispositivo, né casi di
meningite. Il tipo e la frequenza degli eventi avversi osservati in questo studio sono coerenti con la complessità
della procedura chirurgica e la condizione di comorbilità dei soggetti trattati.
I criteri chiave di inclusione o esclusione dallo studio includevano i seguenti:
Criteri di inclusione preoperatori
Età del soggetto ≥ 18 anni e ≤ 75 anni.
Soggetto per cui era programmata una procedura cranica elettiva con incisione durale, utilizzando una
qualsiasi delle seguenti posizioni e approcci chirurgici (o una loro combinazione): frontale, temporale,
occipitale e parietale (sopratentoriale) e/o suboccipitale mediana o laterale (infratentoriale).
Soggetto che richiedeva una procedura implicante una ferita pulita/di classe I (ferita chirurgica non infetta
in cui non sia stata riscontrata infiammazione).
Criteri di esclusione preoperatori
Soggetto che richiedeva una procedura implicante un approccio translabirintico, transfenoidale
o transorale, o qualsiasi procedura che preveda la penetrazione dei seni paranasali o delle celle
mastoidee. Nota – La penetrazione superficiale delle celle mastoidee non era un criterio di esclusione,
purché le celle fossero opportunamente sigillate (es. cera da osso).
Soggetto con shunt del liquido cerebrospinale (es. shunt ventricolo-peritoneale, ventricolo-pleurico,
ventricolo-atriale o lombo-peritoneale).
Soggetto sottoposto a drenaggio esterno ventricolare o lombare del liquido cerebrospinale, che deve
essere lasciato in sede dopo l’intervento.
Soggetto con idrocefalo clinicamente significativo o con evidenza clinica di alterazione della dinamica
del liquor.
Soggetto sottoposto a precedente procedura neurochirurgica intracranica nella stessa posizione
anatomica (Nota – La biopsia stereotassica non era un criterio di esclusione).
Soggetto con precedente perdita di LCS (secondaria a trauma, neoplasma, intervento chirurgico o di
diversa eziologia).
Soggetto sottoposto a radioterapia nel sito chirurgico o per il quale era programmata una radioterapia
frazionata entro dieci giorni dalla procedura di valutazione (Nota – La radiochirurgia stereotassica prima
della procedura di valutazione programmata non era un criterio di esclusione).
Soggetto colpito da lesione traumatica alla testa entro 30 giorni dalla procedura di valutazione
programmata, comportante una frattura della base del cranio o fratture a carico dei seni paranasali.
Soggetto con neoplasia nota o altra condizione con previsione di sopravvivenza inferiore ai sei mesi.
Page 54

54
Soggetto sottoposto a trattamento chemioterapico, esclusa la terapia ormonale, entro tre settimane prima
della procedura di valutazione programmata, o per il quale era programmato l’uso di wafer
chemioterapico intracavitario (BCNU) o un trattamento chemioterapico entro due settimane
dall’esecuzione della procedura di valutazione.
L’uso standard di steroidi perioperatori (ovvero corticosteroidi) era consentito. L’uso cronico di steroidi
(definito come uso giornaliero di corticosteroidi ≥ 8 settimane) allo scopo di attenuare gli effetti collaterali
della chemioterapia e/o radioterapia non era un criterio di esclusione, a meno che il paziente fosse
ritenuto dal ricercatore affetto da tossicità da steroidi. L’uso di corticosteroidi su base cronica (come
definito in precedenza) per scopi diversi dall’attenuazione dei sintomi della chemioterapia sistemica era
un criterio di esclusione, a meno che tali steroidi fossero interrotti 4 settimane prima della procedura di
valutazione programmata.
Soggetto che assumeva warfarina, eparina, altri anticoagulanti, aspirina o FANS su base giornaliera e in
mancanza di wash-out pre-chirurgico del farmaco assunto secondo lo standard di cura.
Soggetto con coagulopatia documentata clinicamente significativa con PTT > 37 secondi
o INR > 1,3 unità INR.
Soggetto con sistema immunitario compromesso o malattia autoimmune, o in terapia cronica con farmaci
immunosoppressori al basale.
Soggetto con precedente infezione sistemica o qualsiasi infezione in prossimità del sito operatorio
programmato.
Soggetto con livello di creatinina sierica > 2,0 mg/dL.
Soggetto con bilirubina totale sierica > 2,5 mg/dL al basale.
Soggetto con diabete non controllato, come evidenziato dagli standard di cura dell’ospedale
(HbA1c >7%, glicemia, ecc.) al basale.
Criteri di inclusione intraoperatori
Soggetto in cui l’entità lineare della durotomia era ≥ 2 cm.
Soggetto con margini durali dal bordo del difetto osseo ≥ 3 mm ovunque.
Soggetto con perdita di LCS presente a livello intraoperatorio in seguito al completamento della chiusura
durale primaria (con o senza plastica durale non autologa o con tessuto autologo), spontaneamente
o a seguito della manovra di Valsalva, fino a 20 cm H2O per un massimo di cinque (5) secondi.
Criteri di esclusione intraoperatori
Soggetto con risultanza incidentale corrispondente a uno dei criteri di esclusione preoperatori sopra
elencati.
Soggetto con necessità di posizionamento intraoperatorio di un dispositivo di deviazione del liquido
cerebrospinale (es. catetere ventricolare, catetere subdurale, drenaggio lombare o altro dispositivo
progettato per evacuare esternamente il liquor), lasciato in sede dopo la procedura. Nota – Erano
consentiti i drenaggi subgaleali per la gestione postoperatoria acuta del sito di incisione.
Soggetto con apertura > 2 mm presente tra i bordi durali o tra il bordo della dura madre e il materiale
della plastica durale, sulla base della valutazione visiva del chirurgo prima dell’applicazione del sigillante
chirurgico.
Page 55

55
Tabella 2. Riassunto delle informazioni demografiche per i pazienti dello studio
Caratteristiche
Popolazione del sigillante durale
Adherus AutoSpray
Popolazione di
controllo
Numero di soggetti
124
126
Maschi/femmine
41/83
40/86
Età media (anni)
54,2
51,1
Punteggio ASA dei soggetti (N (%))
I
2 (1,6)
8 (6,3)
II
47 (37,9)
50 (39,7)
III
69 (55,6)
62 (49,2)
IV
6 (4,8)
6 (4,8)
V
0 (0,0)
0 (0,0)
Indicazione primaria all’intervento (N (%))
Tumore
56 (45,2)
53 (42,1)
Epilessia
1 (0,8)
1 (0,8)
Decompressione nervosa
17 (13,7)
21 (16,7)
Malformazione artero-venosa
3 (2,4)
5 (4,0)
Aneurisma
28 (22,6)
26 (21,3)
Malformazione di Chiari
17 (13,7)
18 (14,3)
Cisti
2 (1,6)
1 (0,8)
Altro
0 (0,0)
1 (0,8)
Approccio (N (%))
Infratentoriale
53 (42,7)
52 (41,3)
Sopratentoriale
71 (57,3)
74 (58,7)
Tecnica primaria di chiusura durale (N (%))
Sutura
48 (38,7)
48 (38,1)
Sutura + materiale durale autologo
29 (23,4)
34 (27,0)
Sutura + materiale durale non autologo
45 (36,3)
39 (31,0)
Gli eventi avversi segnalati con una frequenza superiore all’1% nella popolazione di soggetti ITT (intent-to-treat)
sono riassunti nella precedente Tabella 1.
Page 56

56
Metodo di sterilizzazione e smaltimento del sigillante durale a punta estesa Adherus AutoSpray
La seguente tabella descrive in dettaglio il metodo di sterilizzazione e di smaltimento del sigillante durale a punta
estesa Adherus AutoSpray.
Descrizione
Numero
di parte
Metodo di
sterilizzazione
Frequenza
di utilizzo
Metodo di smaltimento
Sigillante durale
a punta estesa
Adherus
AutoSpray
NUS-009
Irradiazione
Esclusivament
e monouso
Il dispositivo sigillante durale
a punta estesa Adherus
AutoSpray va eliminato in un
contenitore approvato per
dispositivi a rischio biologico
per uso ospedaliero.
Non gettarlo tra i rifiuti
generici.
Condizioni ambientali di esercizio
Temperatura di conservazione
Conservare a una temperatura inferiore a 30 oC
Temperatura di esercizio
Da 5 oC a 35 oC
Livello di rumore
≤ 60 dB
Confezionamento
La confezione del sigillante durale a punta estesa Adherus AutoSpray contiene i componenti seguenti.
Vassoio del kit di sigillante durale a punta estesa Adherus AutoSpray (1)
Applicatore preassemblato (1)
PEG attivato in polvere in fiala con tappo verde (1)
Soluzione di PEI in fiala con tappo argento (1)
Operazioni per il sigillante durale a punta estesa Adherus AutoSpray
Le seguenti sezioni forniscono le istruzioni relative alla preparazione e all’attivazione del sigillante durale a punta
estesa Adherus AutoSpray.
Ricostituzione dei componenti reticolanti
1) Usando una tecnica asettica, introdurre nel campo sterile il contenuto del vassoio esterno con l’etichetta del
sigillante durale a punta estesa Adherus AutoSpray.
2) Togliere la copertura dal vassoio del kit del sigillante durale a punta estesa Adherus AutoSpray.
3) Estrarre l’applicatore preassemblato del sigillante durale a punta estesa Adherus AutoSpray.
4) Puntando l’ugello a punta estesa del dispositivo verso l’alto, rimuovere e gettare i tappi rossi che coprono i
puntali dei connettori per le fiale blu sull’applicatore (Fig. A-1).
Nota – Per rimuovere questi tappi può essere necessario servirsi di una pinza emostatica o di uno strumento
analogo. Si consiglia inoltre di fare ruotare i tappi durante la rimozione.
5) Estrarre dal vassoio la fiala contenente la soluzione di PEI (fiala con tappo argento) e sistemare l’estremità
con tappo nell’apposito connettore blu dell’applicatore corrispondente allo stantuffo bianco, afferrando
l’applicatore e spingendovi a fondo la fiala in modo che il puntale fori il setto e che il sigillo argento in
alluminio raggiunga il fondo del connettore per la fiala (Fig. A-2).
6) Estrarre dal vassoio la fiala contenente la polvere di estere di PEG (fiala con tappo verde) e sistemare
l’estremità con tappo nell’apposito connettore blu dell’applicatore corrispondente allo stantuffo verde,
afferrando l’applicatore e spingendo a fondo la fiala in modo che il puntale fori il setto e che il sigillo verde in
alluminio raggiunga il fondo del connettore per la fiala (Fig. A-2).
7) Con le fiale orientate verso l’alto, premere lo spingi-stantuffi per trasferire i liquidi alle fiale. Continuare a
premere lo spingi-stantuffi (Fig. A-3).
Nota – Se necessario, usare entrambe le mani per premere lo spingi-stantuffi.
8) Mantenendo premuto lo spingi-stantuffi, agitare il dispositivo delicatamente e in modo intermittente fino alla
completa dissoluzione della polvere (Fig. A-3).
Page 57

57
Nota – La polvere di estere di PEG continua a dissolversi tra una delicata agitazione e quella successiva.
Per evitare l’intrappolamento di bollicine d’aria, non scuotere in modo eccessivamente aggressivo
l’applicatore.
9) Rilasciare lo spingi-stantuffi per consentirne il ritorno, quindi premerlo una seconda volta per garantire
l’omogeneità di entrambe le soluzioni.
10) Consentire nuovamente il ritorno dello spingi-stantuffi, quindi tirarlo fino a trasferire completamente le
soluzioni ricostituite da entrambe le fiale (Fig. A-4, vista dall’alto).
Nota – Se il pulsante ON/OFF viene premuto accidentalmente durante la fase di ricostituzione, è possibile
spegnere il dispositivo senza alcuna conseguenza negativa. Per ottenere i risultati ottimali, il dispositivo deve
essere usato entro due ore dalla ricostituzione delle soluzioni.
Accensione del dispositivo sigillante durale a punta estesa Adherus AutoSpray
11) Premere il pulsante ON/OFF situato nella parte inferiore del dispositivo per attivare il sistema prima
dell’applicazione spray dell’idrogel (Fig. B-1).
Nota – L’applicatore del sigillante durale a punta estesa Adherus AutoSpray deve essere attivato prima della
rimozione dei connettori per le fiale, appena prima dell’applicazione spray, per evitare l’ostruzione
accidentale dell’ugello.
Preparazione del dispositivo e del sito da trattare
12) Se l’applicatore del sigillante durale a punta estesa Adherus AutoSpray non è già acceso, premere il
pulsante ON/OFF per accenderlo (Fig. B-1).
Nota – La pompa interna dell’aria si attiva con la pressione del pulsante ON/OFF; il rumore della pompa
conferma l’avvenuta attivazione del sistema. In assenza di rumore proveniente dalla pompa, interrompere
l’uso dell’unità sigillante durale a punta estesa Adherus AutoSpray e attenersi alle istruzioni fornite nella
sezione “Risoluzione dei problemi”.
13) Prima dell’erogazione del trattamento, orientare il dispositivo in modo che le fiale siano rivolte verso l’alto e
staccare e gettare entrambi i connettori per le fiale blu facendoli ruotare in senso antiorario fino alla loro
espulsione dal dispositivo (Fig. B-2, vista dall’alto).
14) Per garantire l’aderenza ottimale del tessuto in corrispondenza del sito da trattare, accertarsi che un margine
di 2-3 millimetri attorno al difetto sia privo di sangue, agenti emostatici o altri residui tessutali e che l’efflusso
di liquido cerebrospinale sia ridotto al minimo.
15) Se necessario, piegare o sagomare l’ugello a punta estesa per migliorare l’accesso e/o la visualizzazione del
sito di trattamento.
Page 58

58
Erogazione dell’idrogel
16) Per applicare il prodotto preparato, se il dispositivo non è già stato acceso, premere il pulsante ON/OFF.
17) Orientare il dispositivo in modo che il corpo dell’applicatore sia rivolto verso l’alto, tenendo un tampone di
garza a circa 5-10 centimetri sopra l’ugello (Fig. B-3).
18) Applicare una pressione decisa e uniforme sul centro dello spingi-stantuffi fino a notare un getto di prodotto
dall’ugello (Fig. B-3).
19) Quando il sigillante verde comincia a formarsi sul tampone di garza, smettere di premere lo spingi-stantuffi. Il
sigillante durale a punta estesa Adherus AutoSpray è ora pronto per essere usato per l’erogazione del
trattamento.
20) Con l’applicatore puntato verso il sito da trattare e tenendo l’ugello a una distanza di 2-4 centimetri dal sito
stesso, applicare una pressione decisa e uniforme al centro dello spingi-stantuffi per erogare la soluzione
miscelata (Fig. B-4).
21) Continuare ad applicare il sigillante Adherus fino a formare uno strato sottile (di 1-2 mm circa).
Nota – Valutazione dello spessore:
Chiusura durale suturata: accertarsi che tutti i nodi delle suture siano completamente
coperti con l’idrogel sigillante. Tipicamente, per la chiusura della dura madre si utilizzano
suture 4-0, 3-0 e 2-0. La sutura più sottile tra queste è la 4-0, dotata di un diametro
compreso tra 0,15 mm e 0,2 mm. Il nodo di una sutura 4-0 ha almeno quattro strati di
sutura, con uno spessore risultante compreso tra 0,6 e 0,8 mm circa. La completa
copertura dei nodi consente di ottenere lo spessore di applicazione minimo indispensabile.
Chiusura con plastica durale onlay: verificare che sia applicata una quantità sufficiente
di idrogel sigillante per coprire l’onlay della plastica durale e almeno 3-4 mm della dura
madre circostante con 1-2 mm di idrogel, utilizzando l’altezza del materiale di onlay come
riferimento per la profondità. Si osservi che due materiali comuni utilizzati per la plastica
durale onlay ― DuraGen® Dural Graft Matrix e Durepair® Dura Regeneration Matrix ―
quando vengono inumiditi con soluzione salina hanno uno spessore approssimativo,
rispettivamente, di 3 mm e 1 mm.
Arresto dell’applicazione spray
22) L’applicazione può essere interrotta in qualsiasi momento durante un trattamento arrestando la pressione
applicata allo spingi-stantuffi. Tuttavia, per evitare ostruzioni, la pompa non deve comunque essere spenta
se non dopo il completamento dell’ultima applicazione del sigillante.
Nota – Se dell’idrogel in eccesso si forma sull’ugello spray durante un’applicazione, è possibile asportarlo
delicatamente con un tampone di garza.
Conclusione dell’erogazione dell’idrogel
23) Se necessario, gli eccessi di sigillante oltre i bordi del margine della dura madre possono essere asportati
con una sonda Penfield, un paio di forbici o mediante asportazione meccanica.
Page 59

59
Smaltimento del sigillante durale a punta estesa Adherus AutoSpray
Una volta completata l’ultima applicazione spray, spegnere il dispositivo, aprire lo sportello del vano batterie per
rompere il sigillo interno e rimuovere le batterie per smaltirle in modo appropriato. La seguente tabella riporta
importanti informazioni relative allo smaltimento dei componenti del sigillante durale a punta estesa
Adherus AutoSpray.
Dispositivo
Istruzioni per lo smaltimento
Sigillante durale a punta
estesa Adherus AutoSpray
Il sigillante durale a punta estesa Adherus AutoSpray
è composto da un involucro in plastica e da componenti elettrici.
Al termine della sua vita utile, questo dispositivo deve essere
smaltito presso un centro per la raccolta differenziata dei rifiuti.
Non smaltire questo prodotto tra i rifiuti municipali generici.
Risoluzione dei problemi del sigillante durale a punta estesa Adherus AutoSpray
Sono stati segnalati i seguenti possibili problemi con il sigillante durale a punta estesa Adherus AutoSpray.
Ciascuno di questi prevede un sistema di protezione (indicato qui sotto) per contenere i possibili risultati dei
malfunzionamenti.
Possibile problema
Sistema di protezione
1. Pompa dell’aria non attivata
1. Il pulsante ON/OFF non è stato premuto
2. Ugello spray ostruito
2. Non rimuovere i connettori per le fiale prima di
avere acceso la pompa dell’aria; asportare i
residui dall’ugello dopo l’uso.
Page 60

60
Per evitare complicazioni, attenersi rigorosamente alle istruzioni riportate nella tabella per la risoluzione dei
problemi del sigillante durale a punta estesa Adherus AutoSpray riportata qui sopra. Durante una procedura,
l’operatore dovrà limitare i propri tentativi di risoluzione dei problemi con il sigillante durale a punta estesa
Adherus AutoSpray rigorosamente a quanto descritto in tale tabella. Qualora la risoluzione dei problemi non
avesse successo, interrompere immediatamente l’uso dell’attuale unità sigillante durale a punta estesa Adherus
AutoSpray e aprirne una nuova.
Specifiche elettriche del sigillante durale a punta estesa Adherus AutoSpray
Il sigillante durale a punta estesa Adherus AutoSpray è conforme alle seguenti norme.
IEC 60601-1, terza edizione Requisiti standard di sicurezza elettrica
IEC 60601-1-2, terza edizione Requisiti di immunità
Informazioni di compatibilità e dichiarazioni del fabbricante – Emissioni elettromagnetiche
L’uso del sigillante durale a punta estesa Adherus AutoSpray è previsto nell’ambiente elettromagnetico
specificato qui di seguito. Il cliente o l’utilizzatore del sigillante durale a punta estesa Adherus AutoSpray deve
garantire che il dispositivo sia usato esclusivamente in un ambiente dotato di tali caratteristiche.
Prova delle emissioni
Conformità
Informazioni sull’ambiente elettromagnetico
Emissioni di RF CISPR 11
Gruppo 1
Il sigillante durale a punta estesa Adherus AutoSpray utilizza
energia RF solo per le sue funzioni interne. Le sue emissioni
di RF sono quindi molto basse ed è improbabile che
causino interferenze a carico di apparecchiature elettroniche
poste nelle vicinanze.
Emissioni di RF CISPR 11
Classe B
Il sigillante durale a punta estesa Adherus AutoSpray è idoneo
per l’uso in tutte le strutture, incluse quelle abitative e quelle
direttamente collegate alla rete di alimentazione pubblica a bassa
tensione che fornisce corrente elettrica agli edifici residenziali.
Emissioni armoniche
IEC 61000-3-2
Non applicabile
Fluttuazioni di
tensione/emissioni
a intermittenza (flicker)
IEC 61000-3-3
Non applicabile
Page 61

61
Informazioni di compatibilità e dichiarazioni del fabbricante – Immunità elettromagnetica per tutte le
apparecchiature e i sistemi
Il sigillante durale a punta estesa Adherus AutoSpray è un sistema alimentato a batteria; il suo uso è previsto
nell’ambiente elettromagnetico specificato qui di seguito. Il cliente o l’utilizzatore del sigillante durale a punta
estesa Adherus AutoSpray deve garantire che il dispositivo sia usato in un ambiente dotato di tali caratteristiche.
Prova di immunità
Livello di prova
IEC 60601
Livello di conformità
Informazioni sull’ambiente
elettromagnetico
Scariche
elettrostatiche (SES)
IEC 61000-4-2
±6 kV contatto
±8 kV aria
Non applicabile;
sistema alimentato
a batteria, senza
circuiti digitali
Il pavimento deve essere in legno,
cemento o piastrelle di ceramica. Se il
pavimento è ricoperto di materiale
sintetico, l’umidità relativa deve essere
almeno del 30%.
Transitori elettrici
veloci/burst
IEC 61000-4-4
±2 kV per le linee
della rete di
alimentazione
±1 kV per le linee di
ingresso/uscita
Non applicabile;
sistema alimentato
a batteria
La qualità dell’alimentazione di rete
deve essere quella di un ambiente
ospedaliero o commerciale tipico.
Sovracorrente
momentanea
IEC 61000-4-5
±1 kV modalità
differenziale
±2 kV modalità
comune
Non applicabile;
sistema alimentato
a batteria
La qualità dell’alimentazione di rete
deve essere quella di un ambiente
ospedaliero o commerciale tipico.
Cali di tensione,
brevi interruzioni
e variazioni di
tensione sulle linee
di segnale
IEC 61000-4-11
<5% U
T
(>95% calo in UT) per
0,5 cicli
40% U
T
(60% calo in UT)
per 5 cicli
70% U
T
(30% calo in UT)
per 25 cicli
<5% U
T
(>95% calo in UT)
per 5 s
Non applicabile;
sistema alimentato
a batteria
La qualità dell’alimentazione di rete
deve essere quella di un ambiente
ospedaliero o commerciale tipico. Se
l’utente dell’apparecchiatura necessita
del funzionamento continuo durante le
interruzioni dell’alimentazione di rete,
si consiglia di alimentare
l’apparecchiatura con un gruppo di
continuità (UPS) o una batteria.
Campo magnetico
alla frequenza di
alimentazione
(50/60 Hz)
IEC 61000-4-8
3 A/m
Non applicabile;
sistema alimentato
a batteria, senza
componenti sensibili
agli effetti del
magnetismo
I campi magnetici della frequenza
di rete devono essere ai livelli
caratteristici di una installazione tipica
all’interno di un ambiente ospedaliero
o commerciale tipico.
*NOTA – UT è la tensione in c.a. della rete di alimentazione prima dell’applicazione del livello di prova.
Page 62

62
Informazioni di compatibilità e dichiarazioni del fabbricante – Immunità elettromagnetica
L’uso del sigillante durale a punta estesa Adherus AutoSpray è previsto nell’ambiente elettromagnetico
specificato qui di seguito. Il cliente o l’utilizzatore del sigillante durale a punta estesa Adherus AutoSpray deve
garantire che il dispositivo sia usato in un ambiente dotato di tali caratteristiche.
Prova di
immunità
Livello di prova
IEC 60601
Livello di
conformità
Informazioni sull’ambiente elettromagnetico
RF condotta
IEC 61000-4-6
RF irradiata
IEC 61000-4-3
3 Vrms
da 150 kHz a 80 MHz
3 V/m
da 80 MHz a 2,5 GHz
Non applicabile;
sistema alimentato
a batteria, senza
circuiti digitali
Non applicabile;
sistema alimentato
a batteria, senza
circuiti digitali
Le apparecchiature di comunicazione in RF
portatili e mobili non devono essere usate a una
distanza da qualsiasi parte del sigillante durale a
punta estesa Adherus AutoSpray (inclusi i cavi)
inferiore rispetto alla distanza di separazione
consigliata calcolata mediante l’equazione
applicabile alla frequenza del trasmettitore.
Distanza di separazione consigliata
d = 1,2√P
d = 1,2√P da 80 MHz a 800 MHz
d = 2,3√P da 800 MHz a 2,5 GHz
Dove P è la potenza massima nominale in uscita
del trasmettitore espressa in watt (W), in base ai
dati forniti dal produttore del trasmettitore e d è
la distanza di separazione consigliata espressa
in metri (m).
Le intensità dei campi di trasmettitori di RF fissi,
come stabilito da una perizia elettromagnetica
del sito a, devono essere inferiori al livello di
conformità in ciascun intervallo di frequenza.
b
Possono verificarsi interferenze in prossimità
delle apparecchiature contrassegnate con il
seguente simbolo:
Nota 1 – A 80 MHz e 800 MHz si applica l’intervallo di frequenza più elevato.
Nota 2 – È possibile che queste informazioni di compatibilità non siano universalmente applicabili. La propagazione
elettromagnetica è influenzata dall’assorbimento e dalla riflessione provocati da strutture, oggetti e persone.
a Le intensità dei campi di trasmettitori fissi, come le stazioni base di radiotelefoni (cellulari/cordless) e i sistemi
radiomobili di terra, le radio amatoriali, le emittenti radiofoniche in AM e FM e le emittenti televisive non possono
essere previste con precisione teorica. Per valutare l’ambiente elettromagnetico generato dai trasmettitori di RF
fissi è necessario eseguire un perizia elettromagnetica del sito. Se l’intensità di campo misurata nell’ambiente di
utilizzo del sigillante durale a punta estesa Adherus AutoSpray supera il livello di conformità RF applicabile sopra
indicato, il sigillante durale a punta estesa Adherus AutoSpray deve essere osservato allo scopo di verificarne il
normale funzionamento. Se si osserva un funzionamento anomalo, può essere necessario adottare ulteriori
misure, come il riorientamento o lo spostamento del sigillante durale a punta estesa Adherus AutoSpray.
b Nell’intervallo di frequenza compreso tra 150 kHz e 80 MHz, le intensità di campo dovrebbero essere inferiori
a 3 V/m.
Page 63

63
Distanze di separazione consigliate tra le apparecchiature di comunicazione in RF
portatili e mobili e il sigillante durale a punta estesa Adherus AutoSpray
L’uso del sigillante durale a punta estesa Adherus AutoSpray è previsto in un ambiente elettromagnetico con
controllo delle interferenze RF irradiate. Per contribuire a evitare le interferenze elettromagnetiche, il cliente o
l’utilizzatore del sigillante durale a punta estesa Adherus AutoSpray deve assicurarsi di mantenere una distanza
minima tra le apparecchiature di comunicazione RF portatili e mobili (trasmettitori) e il sigillante durale a punta
estesa Adherus AutoSpray come consigliato qui di seguito, a seconda della potenza massima di uscita delle
apparecchiature di comunicazione.
Potenza nominale
massima erogata
dal trasmettitore
(W)
Distanza di separazione in base alla frequenza del trasmettitore
(m)
da 150 kHz a 80 MHz
d = 1,2√P
da 80 MHz a 800 MHz
d = 1,2√P
da 800 MHz a 2,5 GHz
d = 2,3√P
0,01
0,12
0,12
0,23
0,1
0,38
0,38
0,73
1
1,2
1,2
2,3
10
3,8
3,8
7,3
100
12
12
23
Per i trasmettitori con una potenza nominale massima erogata non elencata qui sopra, la distanza di separazione consigliata d
in metri (m) può essere stimata utilizzando l’equazione applicabile alla frequenza del trasmettitore, dove P è la potenza
nominale massima del trasmettitore espressa in watt (W) in base a quanto dichiarato dal suo fabbricante.
NOTA 1 – A 80 MHz e 800 MHz si applica la distanza di separazione relativa all’intervallo di frequenza più elevato.
NOTA 2 – È possibile che queste linee guida non siano universalmente applicabili. La propagazione elettromagnetica
è influenzata dall’assorbimento e dalla riflessione provocati da strutture, oggetti e persone.
Page 64

64
Explication des symboles
Le tableau suivant montre les symboles utilisés dans ce manuel, sur les composants du système et sur les
étiquettes de l’emballage. Le tableau fournit la signification de chaque symbole. Prêter attention à ces symboles,
car ils peuvent être liés à des mises en garde et des avertissements de sécurité importants.
Symbole
Signification
Consulter le mode d’emploi pour plus d’informations
Usage unique exclusivement ; ne pas réutiliser
Ne pas restériliser
Stérilisé par irradiation
Utiliser avant le ; date d’expiration – année et dernier jour du
mois
Ne pas utiliser si l’emballage est endommagé
Maintenir à l’abri de la lumière du soleil
Ne pas jeter avec les ordures ménagères
Représentant autorisé dans la Communauté européenne
0050
Marquage CE et numéro d’identification de l’organisme notifié
Numéro de lot
Numéro de catalogue
Quantité
Fabricant
Équipement de type BF (partie appliquée – type flottant non
cardiaque)
Courant continu
Limites de températures (stocker en dessous)
Risque biologique
Marche/arrêt (poussoir à enclenchement)
Page 65

65
Table des matières
Description du dispositif .................................................................................................... 66
Indication ................................................................................................................................ 66
Contre-indications .................................................................................................................. 67
Avertissements ....................................................................................................................... 67
Mises en garde........................................................................................................................ 67
Effets indésirables .................................................................................................................. 67
Informations cliniques ........................................................................................................... 69
Méthode de stérilisation et de mise au rebut du dispositif de scellement dural
Adherus AutoSpray ET .......................................................................................................... 72
Conditions de fonctionnement environnementales ............................................................. 72
Conditionnement .................................................................................................................... 72
Utilisation du scellement dural Adherus AutoSpray ET ...................................................... 72
Reconstitution des composants de réticulation ...................................................................... 72
Mise sous tension du dispositif de scellement dural Adherus AutoSpray ET ......................... 73
Préparation du dispositif et du site de traitement ................................................................... 73
Administration du traitement .................................................................................................. 74
Arrêt de l’application de la pulvérisation ................................................................................ 74
Achèvement d’une administration ......................................................................................... 74
Mise au rebut du dispositif de scellement dural Adherus AutoSpray ET ........................... 75
Spécifications électriques du dispositif de scellement dural Adherus AutoSpray ET ...... 76
Directives et déclaration du fabricant – Émissions électromagnétiques ................................. 76
Directives et déclaration du fabricant – Immunité électromagnétique pour tous les
équipements et systèmes...................................................................................................... 77
Directives et déclaration du fabricant – Immunité électromagnétique .................................... 78
Distances de séparation recommandées entre les équipements de communication
RF portables et mobiles et le dispositif de scellement dural Adherus AutoSpray ET ............. 79
FR
Page 66
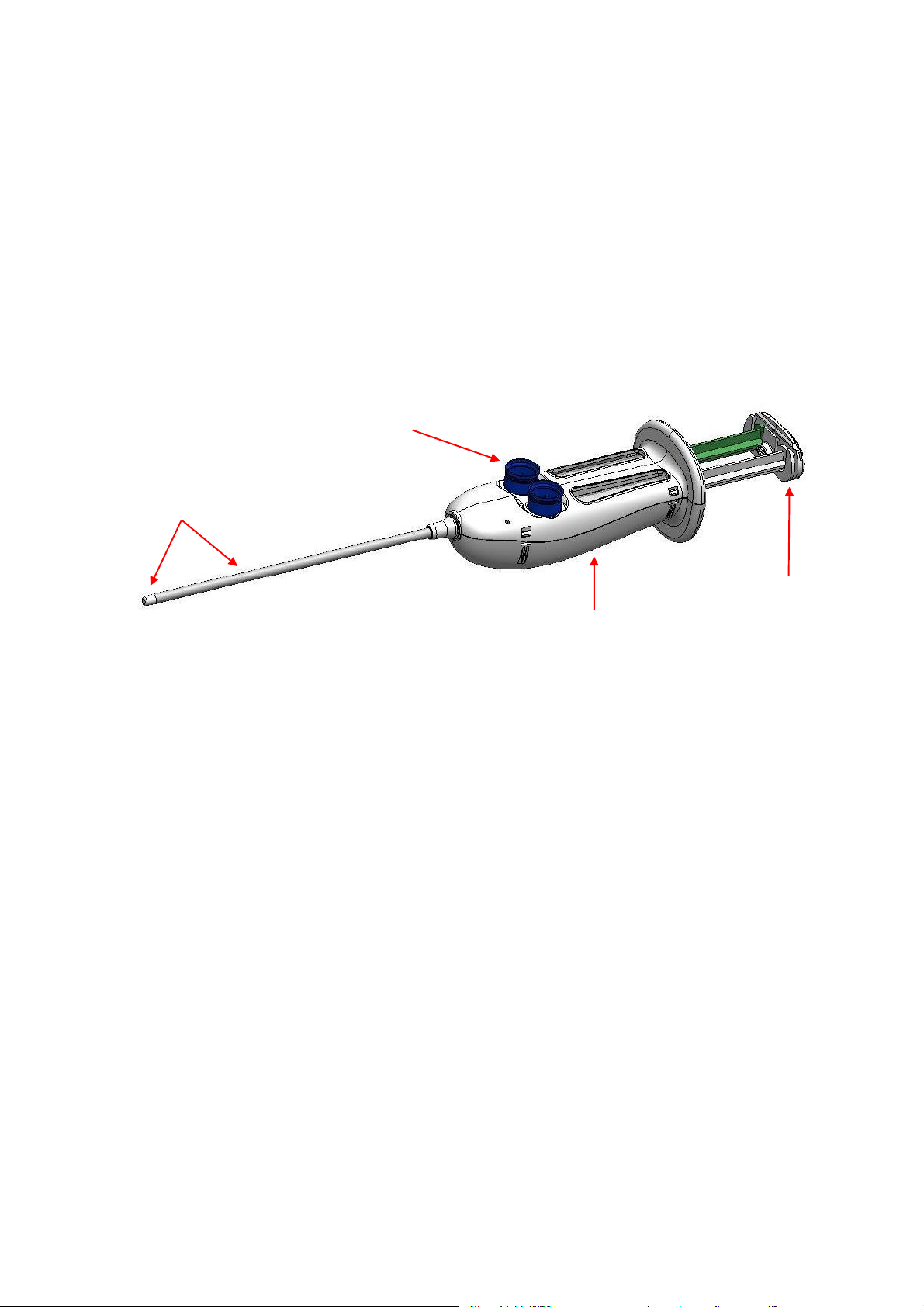
66
Description du dispositif
Le système de scellement dural à extrémité étendue Adherus AutoSpray ET est un dispositif stérile, à usage
unique, électromécanique, fonctionnant sur piles, doté de composants internes qui fournissent un flux d’air pour
faciliter l’administration d’un agent de scellement hydrogel bicomposant synthétique résorbable et qui permettent
de stopper l’administration sans colmatage.
Le dispositif est fourni sous la forme d’un applicateur préassemblé et de deux flacons en verre distincts. Les deux
flacons en verre contiennent soit une poudre d’ester de polyéthylèneglycol (PEG) activé soit un polyéthylènéimine
(PEI) dissous dans de l’eau stérile. Les composants de réticulation sont reconstitués avant utilisation avec leurs
tampons de reconstitution respectifs qui sont enfermés dans l’applicateur. Les solutions obtenues se mélangent
dans l’extrémité étendue de l’applicateur et sont rapidement réticulées pour former le scellement hydrogel juste
après leur sortie de l’extrémité de l’applicateur. La solution administrée est immédiatement réticulée pour créer un
scellement hydrogel qui se résorbe en 90 jours environ, ce qui laisse suffisamment de temps pour la cicatrisation.
Le dispositif de scellement dural Adherus AutoSpray ET est composé des principaux éléments suivants :
Diffuseur à l’extrémité étendue
Le diffuseur à l’extrémité étendue intégré est malléable et peut être courbé ou façonné selon les besoins. Il
mélange minutieusement les deux solutions du scellement et administre la solution mélangée au site cible sous
forme de pulvérisation mince. Le diffuseur de pulvérisation est intégré au système et n’est pas amovible.
Embases adaptatrices pour flacon
Les embases adaptatrices pour flacon acceptent les flacons contenant les composants de réticulation. Pendant la
phase de reconstitution, les flacons sont fixés aux embases adaptatrices pour flacon. Une fois la reconstitution
terminée, les embases sont retirées du dispositif de scellement dural Adherus AutoSpray ET en les faisant
tourner dans le sens antihoraire. Le retrait des embases ouvre les circuits permettant l’écoulement des solutions
par le diffuseur.
Interrupteur à bouton-poussoir marche/arrêt
L’interrupteur marche/arrêt allume et éteint la pompe à air alimentée par piles. Le dispositif est expédié avec
l’interrupteur en position arrêt, ce qui isole la pompe à air de la source d’alimentation par piles. Avant de retirer les
embases adaptatrices pour flacon, pousser l’interrupteur marche/arrêt en position marche ; la pompe à air est
alors enclenchée.
Trappe des piles
Une trappe sur le dessous du boîtier permet au personnel du bloc opératoire de retirer les piles pour leur mise au
rebut appropriée à la fin de l’utilisation du dispositif. La trappe des piles est fermée avec de la colle. Utiliser un
instrument plat pour faire levier et ouvrir la trappe afin de retirer les piles pour les jeter.
Ensemble pousseur de seringue
L’ensemble pousseur de seringue bloque mécaniquement les deux pistons de la seringue afin qu’ils avancent
tous les deux simultanément.
Indication
Le scellement dural Adherus AutoSpray ET est destiné à être utilisé comme complément des méthodes standard
de réparation durale, telles que les sutures, pour assurer une fermeture étanche lors des interventions crâniennes
et rachidiennes.
Ensemble pousseur
de seringue
Embases adaptatrices pour flacon
Diffuseur à l’extrémité étendue
Bouton-poussoir
marche/arrêt
Page 67

67
Contre-indications
Le scellement dural Adherus AutoSpray ET ne doit pas être utilisé dans des espaces anatomiques confinés où il
existe un risque de compression des nerfs. L’hydrogel peut gonfler jusqu’à 13 % de sa taille dans n’importe quelle
dimension.
Avertissements
Le scellement dural Adherus AutoSpray ET n’a pas été étudié chez :
les patients qui nécessitent une intervention impliquant une voie d’abord translabyrinthique, transsphénoïdale,
transorale, ou une intervention qui pénètre dans les sinus paranasaux ou les cellules mastoïdiennes ;
les patients dont l’écart des berges de la dure-mère est supérieur à 2 mm ;
les patients atteints d’une insuffisance rénale ou hépatique sévère ;
les patients ayant une infection active au niveau du site opératoire ;
les patients atteints d’hydrocéphalie traitée ou non traitée (p. ex. patients ayant des dispositifs conçus pour
évacuer le liquide céphalorachidien (LCR) ou présentant une dynamique du LCR perturbée) ;
les patients qui souffrent d’une comorbidité sous-jacente ou qui suivent un traitement connu pour affecter la
cicatrisation des plaies (p. ex. patients ayant subi une intervention neurochirurgicale intracrânienne
précédente au même site anatomique, radiothérapie et chimiothérapie, malignité connue, diabète, toxicité liée
aux stéroïdes et utilisation chronique de corticostéroïdes, système immunitaire compromis, ou prise d’agent
anticoagulant, d’aspirine ou d’anti-inflammatoire non stéroïdien) ;
les patients ayant une allergie connue aux colorants bleu brillant FCF (E133) ou tartrazine (E102) ;
les femmes qui sont enceintes ou allaitantes.
Le scellement dural Adherus AutoSpray ET est destiné à être utilisé comme complément des méthodes standard
de réparation durale. L’efficacité du scellement dural Adherus AutoSpray ET sur d’autres types de tissus n’a pas
été étudiée.
Mises en garde
Le scellement dural Adherus AutoSpray ET est conditionné stérile. Ne pas utiliser si les plateaux ont été
endommagés ou ouverts. Ne pas restériliser.
Le contenu de l’emballage du scellement dural Adherus AutoSpray ET est destiné à une utilisation chez un seul
patient exclusivement. Jeter tout produit inutilisé et/ou ouvert. La réutilisation du dispositif peut entraîner une
contamination croisée pouvant conduire à une blessure, à une maladie ou au décès du patient.
Maintenir à l’abri de la lumière du soleil. Ne pas utiliser si la poudre d’ester de PEG ne s’écoule pas librement.
Utiliser le scellement dural Adherus AutoSpray ET dans les 2 heures suivant la reconstitution des composants de
réticulation. Lorsqu’il a été testé 8 heures après la reconstitution, le scellement obtenu a gonflé dans une
proportion légèrement supérieure, mais statistiquement significative, à celles des échantillons reconstitués depuis
1, 2 ou 4 heures.
L’extrémité étendue de l’applicateur a été conçue pour s’adapter au besoin chirurgical en introduisant des
courbures sur la longueur de l’extrémité. Appliquer une pression délicate lors du fléchissement de l’extrémité. Ne
pas courber à des angles supérieurs à 90°. S’assurer que l’hydrogel s’écoule après que l’applicateur a été
modelé pour les besoins de l’intervention.
La durée de vie des piles du système d’application est d’environ 2 heures d’utilisation continue.
Avant l’application de l’hydrogel Adherus, s’assurer que l’écoulement de liquide (liquide céphalorachidien,
sang, etc.) a cessé.
Ne pas utiliser le scellement dural Adherus AutoSpray ET en présence d’anesthésiques inflammables ou
d’anesthésiques inflammables avec des agents oxydants.
Maintenir le dispositif de scellement dural Adherus AutoSpray ET à distance des champs magnétiques puissants
pour éviter de possibles interférences dans la communication RF. Les équipements de résonance magnétique
peuvent générer des interférences avec le fonctionnement de la pompe.
Ne pas retirer les caches du système autres que la trappe des piles.
Effets indésirables
Un dispositif similaire, le scellement dural Adherus AutoSpray, contenant la même formulation de scellement, le
scellement dural Adherus, a été évalué chez 124 patients recrutés dans une étude clinique pivot, multicentrique,
contrôlée, prospective. L’incidence et la nature des événements indésirables observés dans cette population de
patients étaient cohérentes avec le type et la complexité des interventions neurochirurgiques effectuées et avec
l’état de comorbidité des patients traités. Quatre patients sont décédés dans le groupe traité par scellement dural
Adherus AutoSpray et cinq patients sont décédés dans le groupe témoin. Les décès ont été attribués à l’état de
santé préalable des sujets. Les événements indésirables survenant à une fréquence de 1 % ou plus parmi les
événements indésirables rapportés chez les sujets traités avec le scellement dural Adherus AutoSpray sont
résumés dans le tableau ci-dessous. Il n’y a pas eu d’effets indésirables liés au dispositif inattendus.
Page 68

68
Tableau 1. Résumé des événements indésirables liés au scellement dural Adherus AutoSpray
Effet indésirable
Patients (n (%))
N = 124
Anémie
3 (2,4)
Leucocytose
2 (1,6)
Surdité unilatérale
2 (1,6)
Acouphènes
4 (3,2)
Diplopie
5 (4,0)
Ptosis
2 (1,6)
Œdème périorbitaire
6 (4,8)
Vision floue
7 (5,6)
Dysphagie
4 (3,2)
Nausée
2 (1,6)
Réaction indésirable
6 (4,8)
Douleur thoracique
3 (2,4)
Progression de la maladie
3 (2,4)
Fatigue
2 (1,6)
Pneumonie
2 (1,6)
Infection des voies urinaires
2 (1,6)
Infection de la plaie
2 (1,6)
Hypoesthésie au site d’incision
3 (2,4)
Douleur au site d’incision
4 (3,2)
Hémorragie périorbitaire
3 (2,4)
Œdème postopératoire
2 (1,6)
Pseudo-méningocèle
9 (7,3)
Sérome
3 (2,4)
Hématome sous-dural
3 (2,4)
Déhiscence de la plaie
2 (1,6)
Faiblesse musculaire
2 (1,6)
Aphasie
4 (3,2)
Trouble de l’équilibre
2 (1,6)
Convulsions
5 (4,0)
Atteintes multiples des nerfs crâniens
2 (1,6)
Vertiges
7 (5,6)
AVC emboliques
2 (1,6)
Céphalées
14 (11,3)
Hémiparésie
2 (1,6)
Hypoesthésie
4 (3,2)
Paralysie du nerf hypoglosse
2 (1,6)
Altération de la mémoire
2 (1,6)
Nystagmus
3 (2,4)
Paresthésie
5 (4,0)
Perte sensorielle
3 (2,4)
Tremblements
2 (1,6)
Paralysie du VIIe nerf crânien
3 (2,4)
Paralysie des cordes vocales
2 (1,6)
Atélectasie
2 (1,6)
Insuffisance respiratoire
2 (1,6)
Alopécie
2 (1,6)
Éruption cutanée
2 (1,6)
Œdème du visage
4 (3,2)
Page 69

69
Informations cliniques
Une étude pivot multicentrique, contrôlée, randomisée, prospective a été menée pour évaluer l’utilisation du
scellement dural Adherus, administré à l’aide de l’applicateur Adherus AutoSpray, comme complément des
méthodes standard de réparation durale, telles que les sutures, pour assurer une fermeture étanche lors d’une
intervention crânienne. Le critère de jugement principal de cette étude était une évaluation composite de la
sécurité et de l’efficacité du scellement dural Adherus AutoSpray (n = 124 sujets) par rapport à un traitement
témoin actif (n = 126 sujets). Les résultats du critère de jugement étaient basés sur le nombre de sujets sans fuite
de LCR peropératoire au niveau de la réparation durale après un maximum de deux applications de scellement
pendant la manœuvre de Valsalva, sans fuite de LCR ni pseudo-méningocèle pendant la période de suivi de
120 jours et sans réintervention non planifiée au site opératoire original dans les 120 jours suivant l’opération. Le
taux de réussite global pour l’analyse complète des cas était de 91,2 % dans le groupe Adherus versus 90,6 %
dans le groupe témoin. Adherus s’est avéré être non inférieur au traitement témoin dans la marge de noninfériorité de 10 % (p = 0,005). Au début de la période postopératoire lorsque les scellements sont censés
fonctionner, le taux de réussite global à 14 jours de suivi chez les sujets qui ont effectué la visite était de 99,1 %
dans le groupe Adherus versus 95,0 % dans le groupe témoin. De plus, le taux de réussite global à 45 jours de
suivi chez les sujets qui ont effectué la visite était de 96,6 % dans le groupe Adherus versus 91,9 % dans le
groupe témoin. L’analyse de l’absence d’échec du critère de jugement principal a aussi montré que les échecs du
critère de jugement principal dans le groupe témoin tendaient à apparaître précocement dans la période de suivi
alors que la majorité des échecs du critère de jugement d’Adherus étaient identifiés grâce aux clichés
radiographiques exigés par le protocole lors de la visite à 120 jours de suivi.
La sécurité a été jugée à partir de l’évaluation de la cicatrisation de la plaie, des infections du site opératoire, de
la méningite, de la dégradation du score de Rankin modifié, du gonflement du site opératoire et des événements
indésirables pendant la période de suivi de 120 jours. Cent sujets (80,6 %) dans le groupe Adherus et 98 sujets
(77,8 %) dans le groupe témoin ont présenté au moins un événement indésirable dans la période de suivi de
120 jours. Il n’y a pas eu d’effets indésirables liés au dispositif inattendus. Parmi les sujets traités avec le
scellement dural Adherus AutoSpray, on n’a dénombré aucune infection de plaie profonde liée au dispositif et
aucun cas de méningite. Le type et la fréquence des événements indésirables observés dans cette étude sont
cohérents avec la complexité de l’intervention chirurgicale et l’état de comorbidité des sujets traités.
Les principaux critères d’inclusion/exclusion de l’étude étaient, entre autres :
Critères d’inclusion préopératoires :
Le sujet avait entre 18 et 75 ans.
Le sujet devait subir une intervention crânienne programmée impliquant une incision durale en utilisant l’un
des sites chirurgicaux ou l’une des voies d’abord suivants (ou une association) : frontal, temporal, occipital
et pariétal (c.-à-d. étage sus-tentoriel), et/ou sous-occipital médian ou latéral (c.-à-d. étage sous-tentoriel).
Le sujet avait besoin d’une intervention impliquant une plaie propre/classe 1 (plaie chirurgicale non
infectée ne présentant aucune inflammation).
Critères d’exclusion préopératoires :
Le sujet avait besoin d’une intervention impliquant une voie d’abord translabyrinthique, transsphénoïdale,
transorale, ou une intervention qui pénètre dans les sinus paranasaux ou les cellules mastoïdiennes.
Remarque : La pénétration superficielle des cellules mastoïdiennes n’était pas un critère d’exclusion si
les cellules étaient correctement scellées (p. ex. cire à os).
Le sujet avait une dérivation du LCR, telle que dérivation ventriculo-péritonéale, ventriculo-pleurale,
ventriculo-auriculaire ou lombo-péritonéale.
Le sujet avait un drain de LCR ventriculaire ou lombaire externe qui devait être laissé en place après
l’intervention.
Le sujet avait une hydrocéphalie cliniquement significative ou des signes cliniques de dynamique du LCR
perturbée.
Le sujet avait subi une intervention neurochirurgicale intracrânienne précédente au même site
anatomique. (Remarque : La biopsie stéréotaxique n’était pas un critère d’exclusion.)
Le sujet a souffert d’une fuite de LCR antérieure (consécutive à un traumatisme, un néoplasme, une
chirurgie ou une autre étiologie).
Le sujet a subi une radiothérapie au niveau du site opératoire ou une radiothérapie fractionnée standard
était planifiée dans les dix jours suivant la chirurgie index. (Remarque : La radiochirurgie stéréotaxique
avant la chirurgie index planifiée n’était pas un critère d’exclusion).
Le sujet a souffert d’une blessure traumatique à la tête dans les 30 jours précédant la chirurgie index
planifiée, entraînant une fracture de la base du crâne ou des fractures touchant les sinus paranasaux.
Le sujet avait une malignité ou une autre maladie connue avec une survie estimée inférieure à six mois.
Page 70

70
Le sujet a subi une chimiothérapie, en excluant l’hormonothérapie, dans les trois semaines précédant la
chirurgie index planifiée, ou l’utilisation d’un implant de chimiothérapie intracavitaire (BICNU) était prévue
ou une chimiothérapie était planifiée dans les deux semaines suivant la réalisation de la chirurgie index.
L’utilisation standard de stéroïdes péri-opératoires (c.-à-d. corticostéroïdes) était permise. L’utilisation
chronique de stéroïdes (définie comme une utilisation quotidienne de corticostéroïdes pendant
8 semaines ou plus) dans le but de réduire les effets secondaires de la chimiothérapie et/ou la
radiothérapie contre le cancer n’était pas un critère d’exclusion, à moins que le patient semble, de l’avis
de l’investigateur, souffrir d’une toxicité liée aux stéroïdes. L’utilisation de corticostéroïdes de façon
chronique (comme définie précédemment) à des fins autres que la diminution des symptômes de la
chimiothérapie systémique était un critère d’exclusion, à moins que ces stéroïdes soient interrompus
4 semaines avant la chirurgie index planifiée.
Le sujet a pris de la warfarine, de l’héparine, d’autres agents anticoagulants, de l’aspirine ou des anti-
inflammatoires non stéroïdiens de façon quotidienne et aucun sevrage thérapeutique pré-opératoire selon
la norme de soins n’a eu lieu.
Le sujet avait une coagulopathie cliniquement significative documentée avec un temps de
thromboplastine partielle > 37 secondes ou un INR > 1,3 unités INR.
Le sujet présentait un système immunitaire compromis ou une maladie auto-immune ou prenait des
agents immunosuppresseurs de façon chronique au moment de l’inclusion.
Le sujet avait une infection systémique ou des signes d’infection proches du site opératoire prévu.
Le sujet avait un niveau de créatinine sérique > 2,0 mg/dL.
Le sujet avait une bilirubine totale sérique > 2,5 mg/dL au moment de l’inclusion.
Le sujet présentait un diabète non contrôlé mis en évidence par la norme de soins de l’établissement
(HbA1c > 7 %, glycémie, etc.) au moment de l’inclusion.
Critères d’inclusion peropératoires :
L’étendue linéaire de la durotomie du sujet était ≥ 2 cm.
Chez le sujet, les marges de la dure-mère depuis les bords du défect osseux étaient partout ≥ 3 mm.
Une fuite de LCR chez le sujet était présente en peropératoire suite à la réalisation de la fermeture durale
principale (avec ou sans duroplastie non autologue ou tissus autologues), que ce soit spontanément ou
lors de la manœuvre de Valsalva, jusqu’à 20 cm H2O pendant cinq (5) secondes maximum.
Critères d’exclusion peropératoires :
Le sujet a fait l’objet d’une découverte fortuite qui répondait à l’un des critères d’exclusion pré-opératoires
mentionnés plus haut.
Le sujet nécessitait la mise en place peropératoire d’un dispositif de dérivation du LCR (p. ex. cathéter
ventriculaire, cathéter sous-dural, drain lombaire ou autre dispositif conçu pour évacuer le LCR vers
l’extérieur) qui a été laissé en place après l’intervention. Remarque : Les drains sous-galéaux utilisés
pour la prise en charge postopératoire active du site de l’incision étaient permis.
Le sujet avait un écart > 2 mm entre les berges de la dure-mère ou entre la berge de la dure-mère et le
matériau de duroplastie, selon une estimation visuelle du chirurgien avant application du scellement
chirurgical.
Page 71

71
Tableau 2. Résumé des données démographiques des patients de l’étude
Caractéristiques
Population traitée par
scellement dural
Adherus AutoSpray
Population témoin
Nombre de sujets
124
126
Hommes/femmes
41/83
40/86
Âge médian (ans)
54,2
51,1
Score ASA des sujets (N (%))
I
2 (1,6)
8 (6,3)
II
47 (37,9)
50 (39,7)
III
69 (55,6)
62 (49,2)
IV
6 (4,8)
6 (4,8)
V
0 (0,0)
0 (0,0)
Indication principale de la chirurgie (N (%))
Tumeur
56 (45,2)
53 (42,1)
Épilepsie
1 (0,8)
1 (0,8)
Décompression nerveuse
17 (13,7)
21 (16,7)
Malformation artério-veineuse
3 (2,4)
5 (4,0)
Anévrisme
28 (22,6)
26 (21,3)
Malformation de Chiari
17 (13,7)
18 (14,3)
Kyste
2 (1,6)
1 (0,8)
Autre
0 (0,0)
1 (0,8)
Voie d’abord (N (%))
Sous-tentorielle
53 (42,7)
52 (41,3)
Sus-tentorielle
71 (57,3)
74 (58,7)
Technique principale pour la fermeture durale (N (%))
Suture
48 (38,7)
48 (38,1)
Suture + matériau dural autologue
29 (23,4)
34 (27,0)
Suture + matériau dural non autologue
45 (36,3)
39 (31,0)
Les EI rapportés à une fréquence supérieure à 1 % dans la population de sujets en intention de traiter (ITT) sont
résumés dans le tableau 1, plus haut.
Page 72

72
Méthode de stérilisation et de mise au rebut du dispositif de scellement dural Adherus
AutoSpray ET
Le tableau ci-dessous détaille la méthode de stérilisation et de mise au rebut du dispositif de scellement dural
Adherus AutoSpray ET.
Description
Référence
Méthode de
stérilisation
Fréquence
d’emploi
Méthode de mise au
rebut
Scellement
dural Adherus
AutoSpray ET
NUS-009
Irradiation
Usage unique
exclusivement
Jeter le dispositif de
scellement dural Adherus
AutoSpray ET dans un
conteneur pour produits
contaminés approuvé
par l’hôpital.
Ne pas le jeter à la
poubelle !
Conditions de fonctionnement environnementales
Température de stockage
Stocker en dessous de 30 oC
Température de fonctionnement
5 oC à 35 oC
Niveau sonore
≤ 60 dB
Conditionnement
Les composants de l’emballage du scellement dural Adherus AutoSpray ET sont :
Plateau de kit de scellement dural Adherus AutoSpray ET (1)
Applicateur préassemblé (1)
Poudre de PEG activé dans un flacon à bouchon vert (1)
Solution de PEI dans un flacon à bouchon argent (1)
Utilisation du scellement dural Adherus AutoSpray ET
Les sections suivantes fournissent des instructions pour préparer et alimenter le dispositif de scellement dural
Adherus AutoSpray ET.
Reconstitution des composants de réticulation
1) En utilisant une technique aseptique, introduire le contenu du plateau extérieur étiqueté « Adherus
AutoSpray ET Dural Sealant » (scellement dural Adherus AutoSpray ET) dans le champ stérile.
2) Retirer le couvercle du plateau du kit de scellement dural Adherus AutoSpray ET.
3) Sortir l’applicateur préassemblé du scellement dural Adherus AutoSpray ET.
4) En orientant le dispositif de sorte que le diffuseur à extrémité étendue pointe vers le haut, retirer et jeter les
bouchons rouges couvrant les pointes sur les embases adaptatrices pour flacon bleues sur l’applicateur
(Fig. A-1).
Remarque : Il peut être nécessaire d’utiliser des pinces hémostatiques ou un outil similaire pour retirer les
bouchons. Il est aussi recommandé de retirer le bouchon avec un mouvement de rotation.
5) Retirer le flacon contenant la solution de PEI (flacon à bouchon argent) du plateau et placer l’extrémité
bouchonnée dans l’embase adaptatrice pour flacon bleue de l’applicateur correspondant au piston de
seringue blanc en saisissant l’applicateur et en enfonçant totalement le flacon afin que la pointe pénètre la
membrane et que le joint en aluminium argent s’insère dans l’embase adaptatrice pour flacon (Fig. A-2).
6) Retirer le flacon contenant la poudre d’ester de PEG (flacon à bouchon vert) du plateau et placer l’extrémité
bouchonnée dans l’embase adaptatrice pour flacon bleue de l’applicateur correspondant au piston de
seringue vert en saisissant l’applicateur et en enfonçant totalement le flacon afin que la pointe pénètre la
membrane et que le joint en aluminium vert s’insère dans l’embase adaptatrice pour flacon (Fig. A-2).
7) Avec les flacons orientés vers le haut, enfoncer l’ensemble pousseur de seringue pour transférer les liquides
dans les flacons. Continuer à enfoncer l’ensemble pousseur de seringue (Fig. A-3).
Remarque : Utiliser les deux mains pour appuyer sur l’ensemble pousseur de seringue si nécessaire.
Page 73

73
8) Avec l’ensemble pousseur de seringue encore enfoncé, agiter doucement le dispositif par intermittence
jusqu’à ce que la poudre soit complètement dissoute (Fig. A-3).
Remarque : La poudre d’ester de PEG continuera à se dissoudre entre les périodes d’agitation délicate ;
une agitation trop dynamique peut provoquer une quantité excessive de bulles d’air emprisonnées.
9) Relâcher l’ensemble pousseur de seringue pour lui permettre de repartir en arrière et l’enfoncer une
deuxième fois pour s’assurer que les deux solutions sont homogènes.
10) Laisser l’ensemble pousseur de seringue repartir en arrière à nouveau et le tirer vers l’arrière jusqu’à ce que
tous les ingrédients reconstitués soient transférés depuis les flacons (vue du dessus sur la Fig. A-4).
Remarque : Si le bouton marche/arrêt est engagé par inadvertance pendant la phase de reconstitution, le
dispositif peut s’éteindre sans effet préjudiciable. L’utilisation doit être effectuée dans les deux heures
suivant la reconstitution pour des résultats optimaux.
Mise sous tension du dispositif de scellement dural Adherus AutoSpray ET
11) Appuyer sur le bouton marche/arrêt au bas du dispositif pour « activer » le système avant l’application de la
pulvérisation d’hydrogel (Fig. B-1).
Remarque : L’applicateur de scellement dural Adherus AutoSpray ET doit être activé avant le retrait des
embases adaptatrices pour flacon, juste avant l’application de la pulvérisation, pour éviter de colmater par
inadvertance le diffuseur.
Préparation du dispositif et du site de traitement
12) Si le dispositif n’est pas allumé, appuyer sur le bouton marche/arrêt pour allumer l’applicateur de scellement
dural Adherus AutoSpray ET (Fig. B-1).
Remarque : La pompe à air interne est activée d’une pression sur le bouton marche/arrêt, avec un son qui
indique que le système a été activé. Si le son de la pompe n’est pas audible, cesser d’utiliser le dispositif de
scellement dural Adherus AutoSpray ET actuel et suivre les instructions de la section Dépannage.
13) Avant l’administration du traitement, orienter le dispositif de sorte que les flacons pointent vers le haut puis
retirer et jeter les deux embases adaptatrices pour flacon en faisant pivoter les embases bleues dans le sens
antihoraire jusqu’à ce qu’elles s’éjectent du dispositif (vue du dessus sur la Fig. B-2).
14) Pour une adhérence optimale des tissus au niveau du site de traitement, s’assurer que 2 à 3 millimètres de
marges autour du défect sont exemptes de sang, d’agents hémostatiques ou de tissus libres et que
l’écoulement de liquide céphalorachidien est réduit au minimum.
15) Si nécessaire, courber ou modeler le diffuseur à extrémité étendue pour améliorer l’accès au site de
traitement et/ou sa visualisation.
Page 74

74
Administration du traitement
16) Pour appliquer le produit préparé, si le dispositif n’est pas encore allumé, appuyer sur le bouton marche/arrêt
pour le mettre sous tension.
17) Orienter le dispositif de sorte que le corps de l’applicateur pointe vers le haut et tenir un morceau de gaze à
environ 5 à 10 centimètres au-dessus du diffuseur (Fig. B-3).
18) Appliquer une pression uniforme ferme au centre de l’ensemble pousseur de seringue, jusqu’à ce que le
produit commence à être pulvérisé hors du diffuseur (Fig. B-3).
19) Une fois qu’un scellement vert commence à se former sur la gaze, cesser d’appuyer sur l’ensemble
pousseur de seringue. Le scellement dural Adherus AutoSpray ET est maintenant prêt pour l’administration
du traitement.
20) Tout en visant le site de traitement et en tenant le diffuseur du dispositif à environ 2 à 4 centimètres du site,
appliquer une pression uniforme ferme au centre de l’ensemble pousseur de seringue pour diffuser la
solution mélangée (Fig. B-4).
21) Continuer à appliquer le système de scellement Adherus jusqu’à ce qu’une mince couche
(environ 1 à 2 mm) soit formée.
Remarque : évaluation de l’épaisseur :
Fermeture durale suturée : s’assurer que tous les points de suture sont entièrement
couverts par le scellement hydrogel. En général, des sutures de taille 4-0, 3-0 et 2-0 sont
utilisées pour la fermeture durale. La plus petite de ces tailles est 4-0, avec un diamètre de
0,15 mm à 0,2 mm. Un point de suture de taille 4-0 aura au moins quatre largeurs de
suture ou environ 0,6 à 0,8 mm d’épaisseur. Une couverture totale du point garantit que
l’épaisseur minimale d’application est obtenue.
Fermeture de duroplastie par apposition : s’assurer qu’une quantité suffisante de
scellement hydrogel est appliquée pour couvrir la greffe apposée de duroplastie et au
moins 3-4 mm de dure-mère native environnante avec 1-2 mm d’hydrogel en utilisant la
hauteur du matériau de greffe apposée comme référence de profondeur. Noter que
lorsqu’ils sont humidifiés avec du sérum physiologique, les deux matériaux de duroplastie
par apposition courants, la matrice de greffe durale DuraGen® et la matrice de régénération
durale Durepair®, ont une épaisseur d’environ 3 mm et 1 mm respectivement.
Arrêt de l’application de la pulvérisation
22) L’application peut être interrompue à tout moment pendant un traitement en cessant d’exercer la pression
sur l’ensemble pousseur de seringue. Cependant, pour éviter un colmatage, ne pas éteindre la pompe tant
que l’application de scellement finale n’est pas terminée.
Remarque : Si un excès d’hydrogel se forme sur le diffuseur de pulvérisation pendant une application, il
peut être éliminé en essuyant doucement le diffuseur avec de la gaze.
Achèvement d’une administration
23) Si nécessaire, l’excès de scellement au-delà des berges de la marge durale peut être retiré à l’aide d’un
dissecteur Penfield, de ciseaux ou d’une rupture mécanique.
Page 75

75
Mise au rebut du dispositif de scellement dural Adherus AutoSpray ET
Lorsque l’application de la pulvérisation finale est terminée, éteindre le dispositif, ouvrir la trappe des piles pour
rompre le joint interne et retirer les piles pour leur mise au rebut appropriée. Le tableau suivant fournit des
informations importantes concernant la mise au rebut des composants du dispositif de scellement dural Adherus
AutoSpray ET.
Dispositif
Instructions de mise au rebut
Scellement dural Adherus
AutoSpray ET
Le dispositif de scellement dural Adherus AutoSpray ET
comporte un boîtier en plastique et des composants électriques.
Ce dispositif doit être déposé dans un point de collecte distinct à
la fin de vie du produit. Ne pas jeter ce produit dans les déchets
municipaux non triés.
Dépannage du dispositif de scellement dural Adherus AutoSpray ET
Les modes d’erreur possibles suivants pour le dispositif de scellement dural Adherus AutoSpray ET ont été
identifiés. Chaque mode d’erreur inclut une mesure de sûreté (comme indiqué ci-dessous) pour contrôler les
résultats de ces dysfonctionnements.
Modes d’erreur possibles
Mesure de sûreté
1. Pompe à air non activée
1. Interrupteur marche/arrêt non enfoncé
2. Diffuseur de pulvérisation bloqué
2. Ne pas retirer les embases adaptatrices pour
flacon avant d’allumer la pompe à air, essuyer le
diffuseur après utilisation.
Pour éviter des complications, suivre exactement le diagramme de dépannage du dispositif de scellement dural
Adherus AutoSpray ET dans le tableau ci-dessus. Pendant une intervention, les efforts de l’utilisateur pour
dépanner le dispositif de scellement dural Adherus AutoSpray ET doivent être strictement limités aux étapes
décrites ci-dessus. Si le dépannage n’est pas fructueux, cesser d’utiliser immédiatement le dispositif de
scellement dural Adherus AutoSpray ET actuel et ouvrir un nouvel emballage.
Page 76

76
Spécifications électriques du dispositif de scellement dural Adherus AutoSpray ET
Le dispositif de scellement dural Adherus AutoSpray ET est conforme aux normes suivantes :
CEI 60601-1 3e édition Exigences générales de sécurité électrique
CEI 60601-1-2 3e édition Exigences d’immunité
Directives et déclaration du fabricant – Émissions électromagnétiques
Le dispositif de scellement dural Adherus AutoSpray ET est destiné à être utilisé dans l’environnement
électromagnétique spécifié ci-dessous. Il incombe au client ou à l’utilisateur du dispositif de scellement dural
Adherus AutoSpray ET de s’assurer qu’il est utilisé uniquement dans un tel environnement.
Essai d’émissions
Conformité
Environnement électromagnétique : directives
Émissions RF CISPR 11
Groupe 1
Le dispositif de scellement dural Adherus AutoSpray ET utilise
l’énergie RF uniquement pour son fonctionnement interne. Par
conséquent, ses émissions RF sont très faibles et ne sont pas
susceptibles de causer des interférences avec les équipements
électroniques environnants.
Émissions RF CISPR 11
Classe B
Le dispositif de scellement dural Adherus AutoSpray ET peut être
utilisé dans tous les établissements, y compris les établissements
domestiques et ceux directement raccordés au réseau public de
distribution à basse tension qui alimente en électricité les
bâtiments utilisés à des fins domestiques.
Émissions de courant
harmonique CEI 61000-3-2
Non applicable
Émissions dues aux
fluctuations de tension/au
papillotement CEI 61000-3-3
Non applicable
Page 77

77
Directives et déclaration du fabricant – Immunité électromagnétique pour tous les équipements et
systèmes
Le dispositif de scellement dural Adherus AutoSpray ET fonctionne sur piles et est destiné à être utilisé dans
l’environnement électromagnétique spécifié ci-dessous. Il incombe au client ou à l’utilisateur du dispositif de
scellement dural Adherus AutoSpray ET de s’assurer qu’il est utilisé dans un tel environnement.
Essai d’immunité
Niveau d’essai
CEI 60601
Niveau de conformité
Environnement
électromagnétique : directives
Décharge
électrostatique (DES)
CEI 61000-4-2
±6 kV contact
±8 kV air
Non applicable au système
fonctionnant sur piles sans
circuit numérique
Les sols doivent être en bois, en
béton ou en céramique. Si les
sols sont recouverts de
matériaux synthétiques,
l’humidité relative doit être
d’au moins 30 %.
Transitoires
électriques
rapides/salves
CEI 61000-4-4
±2 kV pour les lignes
d’alimentation
±1 kV pour les lignes
d’entrée/de sortie
Non applicable au système
fonctionnant sur piles
La qualité de l’alimentation
électrique doit être celle d’un
environnement commercial ou
hospitalier typique.
Surtension
CEI 61000-4-5
±1 kV en mode
différentiel
±2 kV en mode commun
Non applicable au système
fonctionnant sur piles
La qualité de l’alimentation
électrique doit être celle d’un
environnement commercial ou
hospitalier typique.
Creux de tension,
coupures brèves et
variations de tension
sur lignes d’entrée de
l’alimentation
CEI 61000-4-11
<5 % U
T
(>95 % de baisse en UT)
pendant 0,5 cycle
40 % U
T
(60 % de baisse en UT)
pendant 5 cycles
70 % U
T
(30 % de baisse en UT)
pendant 25 cycles
<5 % U
T
(>95 % de baisse en UT)
pendant 5 s
Non applicable au système
fonctionnant sur piles
La qualité de l’alimentation
électrique doit être celle d’un
environnement commercial ou
hospitalier typique. Si l’utilisateur
de l’équipement a besoin d’un
fonctionnement en continu au
cours des interruptions
d’alimentation électrique, il est
recommandé d’alimenter
l’équipement avec une
alimentation sans interruption
ou une batterie.
Champ magnétique
à la fréquence du
réseau (50/60 Hz)
CEI 61000-4-8
3 A/m
Non applicable pour un
système fonctionnant sur
piles sans composants
magnétiquement sensibles
Les champs magnétiques à la
fréquence du réseau doivent
être à des niveaux
caractéristiques d’une
installation typique d’un
environnement commercial
ou hospitalier typique.
*REMARQUE : UT représente la tension d’alimentation secteur avant l’application du niveau d’essai.
Page 78

78
Directives et déclaration du fabricant – Immunité électromagnétique
Le dispositif de scellement dural Adherus AutoSpray ET est destiné à être utilisé dans l’environnement
électromagnétique spécifié ci-dessous. Il incombe au client ou à l’utilisateur du dispositif de scellement dural
Adherus AutoSpray ET de s’assurer qu’il est utilisé dans un tel environnement.
Essai
d’immunité
Niveau d’essai
CEI 60601
Niveau de
conformité
Environnement électromagnétique : directives
RF conduite
CEI 61000-4-6
RF rayonnée
CEI 61000-4-3
3 Vrms
150 kHz à 80 MHz
3 V/m
80 MHz à 2,5 GHz
Non applicable
au système
fonctionnant
sur piles
sans circuit
numérique
Non applicable
au système
fonctionnant
sur piles
sans circuit
numérique
Les équipements de communication RF portables et
mobiles ne doivent pas être utilisés à proximité d’une
quelconque partie du dispositif de scellement dural
Adherus AutoSpray ET, câbles y compris, à une
distance inférieure à la distance de séparation
recommandée, calculée sur la base de l’équation
applicable à la fréquence de l’émetteur.
Distance de séparation recommandée
d = 1,2√P
d = 1,2√P 80 MHz à 800 MHz
d = 2,3√P 800 MHz à 2,5 GHz
Où P correspond à la puissance de sortie maximale de
l’émetteur en watts (W) selon le fabricant de l’émetteur
et d correspond à la distance de séparation
recommandée, exprimée en mètres (m).
La puissance des champs provenant d’émetteurs
RF fixes, comme déterminé par une enquête
électromagnétique sur sitea, doit être inférieure
au niveau de conformité pour chaque plage de
fréquences.
b
Des interférences peuvent survenir à proximité des
équipements marqués du symbole suivant :
Remarque 1 : à 80 MHz et 800 MHz, la plage de fréquences la plus élevée s’applique.
Remarque 2 : ces consignes peuvent ne pas s’appliquer dans toutes les situations. La propagation électromagnétique est
affectée par les capacités d’absorption et de réflexion des structures, des objets et des personnes.
a Les puissances des champs générés par les émetteurs fixes, comme les stations de base pour les téléphones
radio (cellulaires/sans fil) et les radios mobiles terrestres, les radios amateur, la diffusion radio AM et FM et TV,
ne peuvent pas être anticipées théoriquement avec précision. Pour évaluer l’environnement électromagnétique
généré par les émetteurs RF fixes, il convient d’envisager de réaliser une étude électromagnétique du site. Si la
puissance de champ mesurée sur le lieu d’utilisation du dispositif de scellement dural Adherus AutoSpray ET
dépasse le niveau de conformité RF applicable ci-dessus, le fonctionnement correct du dispositif de scellement
dural Adherus AutoSpray ET doit être vérifié. En cas de performances anormales, des mesures supplémentaires
peuvent s’avérer nécessaires, comme la réorientation ou le repositionnement du dispositif de scellement dural
Adherus AutoSpray ET.
b Sur la plage de fréquences de 150 kHz à 80 MHz, les puissances des champs doivent être inférieures à 3 V/m.
Page 79

79
Distances de séparation recommandées entre les équipements de communication
RF portables et mobiles et le dispositif de scellement dural Adherus AutoSpray ET
Le dispositif de scellement dural Adherus AutoSpray ET est destiné à être utilisé dans un environnement
électromagnétique dans lequel les perturbations RF rayonnées sont contrôlées. Le client ou l’utilisateur du
dispositif de scellement dural Adherus AutoSpray ET peut contribuer à empêcher les interférences
électromagnétiques en maintenant une distance minimale entre les équipements de communication RF portables
et mobiles (émetteurs) et le dispositif de scellement dural Adherus AutoSpray ET comme recommandé cidessous, conformément à la puissance de sortie maximale des équipements de communication.
Puissance de
sortie maximale
nominale de
l’émetteur
W
Distance de séparation conformément à la fréquence de l’émetteur
m
150 kHz à 80 MHz
d = 1,2√P
80 MHz à 800 MHz
d = 1,2√P
800 MHz à 2,5 GHz
d = 2,3√P
0,01
0,12
0,12
0,23
0,1
0,38
0,38
0,73
1
1,2
1,2
2,3
10
3,8
3,8
7,3
100
12
12
23
Pour les émetteurs ayant une puissance de sortie maximale nominale non mentionnée ci-dessus, la distance de séparation
recommandée d en mètres (m) peut être estimée en utilisant l’équation applicable à la fréquence de l’émetteur, où P est la
puissance de sortie maximale nominale en watts (W) selon le fabricant de l’émetteur.
REMARQUE 1 : à 80 MHz et 800 MHz, la distance de séparation pour la plage de fréquences la plus élevée s’applique.
REMARQUE 2 : ces consignes peuvent ne pas s’appliquer dans toutes les situations. La propagation électromagnétique est
affectée par les capacités d’absorption et de réflexion des structures, des objets et des personnes.
Page 80

80
Explicação dos símbolos
A tabela a seguir mostra os símbolos usados nesse manual, nos componentes do sistema e rótulos da
embalagem. A tabela fornece o significado de cada símbolo. Preste atenção a esses símbolos, pois podem se
relacionar a avisos e precauções de segurança importantes.
Símbolo
Significado
Consulte as instruções de uso para informações adicionais
Apenas para único uso; não reutilize
Não esterilize novamente
Esterilizado por irradiação
Data de vencimento; Data de validade – ano e último dia do mês
Não utilize se a embalagem estiver danificada
Mantenha protegido da luz solar
Não descarte com o lixo comum
Representante autorizado na Comunidade Europeia
0050
Marca CE e número de identificação do órgão notificado
Número do lote
Número de catálogo
Quantidade
Fabricante
Equipamento tipo BF (flutuação não cardíaca—parte aplicada)
Corrente contínua
Limitações de temperatura (armazene abaixo de)
Risco biológico
“Liga”/“desliga” (botão de pressão)
Page 81

81
Índice
Descrição do dispositivo ....................................................................................................... 82
Indicação ................................................................................................................................. 82
Contraindicações ................................................................................................................... 83
Avisos ..................................................................................................................................... 83
Precauções ............................................................................................................................. 83
Eventos adversos ................................................................................................................... 83
Informações clínicas .............................................................................................................. 85
Método de esterilização e de descarte do dispositivo selante dural
Adherus AutoSpray ET .......................................................................................................... 88
Condições ambientais de operação ...................................................................................... 88
Apresentação .......................................................................................................................... 88
Operações com o selante dural Adherus AutoSpray ET ..................................................... 88
Reconstituição dos componentes reticulantes ....................................................................... 88
Como ligar o dispositivo selante dural Adherus AutoSpray ET .............................................. 89
Preparação do dispositivo e do local do tratamento .............................................................. 89
Aplicação do tratamento ....................................................................................................... 90
Interrupção da aplicação do spray ........................................................................................ 90
Finalização da aplicação ....................................................................................................... 90
Descarte do selante dural Adherus AutoSpray ET .............................................................. 91
Especificações elétricas do selante dural Adherus AutoSpray ET ..................................... 92
Orientação e declaração do fabricante – Emissões eletromagnéticas ................................... 92
Orientação e declaração do fabricante – Imunidade eletromagnética para todos
os equipamentos e sistemas ................................................................................................. 93
Orientação e declaração do fabricante – Imunidade eletromagnética ................................... 94
Distâncias de separação recomendadas entre comunicações portáteis e móveis
de RF e o selante dural Adherus AutoSpray ET .................................................................... 95
PT
Page 82

82
Descrição do dispositivo
O selante dural Adherus AutoSpray ET com ponta estendida é um dispositivo estéril, de uso único,
eletromecânico, alimentado por bateria, com componentes de sistema internos que fornecem um fluxo de ar para
ajudar na aplicação de um sistema selante de hidrogel sintético absorvível com dois componentes, permitindo
que a aplicação seja interrompida sem provocar entupimento.
O dispositivo é fornecido como um aplicador pré-montado e dois frascos de vidro separados. Desses dois frascos
de vidro, um contém pó de éster de polietilenoglicol (PEG) ativado e o outro contém polietilenoimina (PEI)
dissolvida em água estéril. Os componentes reticulantes são reconstituídos antes do uso por suas respectivas
soluções tampão de reconstituição, alojadas no interior do aplicador. As soluções resultantes misturam-se no
interior do aplicador de ponta estendida e estruturam-se rapidamente em retículo para formar o selante hidrogel
logo depois de sair da ponta do aplicador. A solução aplicada estrutura-se imediatamente em retículo para formar
um selante hidrogel absorvido em aproximadamente 90 dias, tempo suficiente para permitir a cicatrização.
O dispositivo selante dural Adherus AutoSpray ET é composto pelos seguintes componentes primários:
Bico com ponta estendida
O bico integrado com ponta estendida é maleável e pode ser curvado ou moldado de acordo com sua
preferência. O bico com ponta estendida mistura completamente as duas soluções selantes e aplica a solução
misturada no local desejado por meio de um padrão de spray concentrado. O bico de spray é integrado ao
sistema e não pode ser removido.
Conectores dos adaptadores dos frascos
Os conectores dos adaptadores dos frascos aceitam os frascos contendo os componentes reticulantes. Durante
a fase de reconstituição, os frascos são conectados aos conectores dos adaptadores dos frascos. Após
o término da reconstituição, os conectores são retirados do dispositivo selante dural Adherus AutoSpray ET ao
serem girados no sentido anti-horário. A remoção dos conectores abre o caminho para que as soluções fluam
pelo bico.
Botão liga/desliga
O botão Liga/desliga liga e desliga a bomba de ar alimentada por bateria. O dispositivo é enviado com
o interruptor na posição desligada, o que isola a bomba de ar da fonte de energia da bateria. Antes de remover
os conectores dos adaptadores dos frascos, pressione o interruptor Liga/desliga para a posição liga e a bomba
de ar será ligada.
Porta da bateria
A porta na parte inferior do alojamento permite que a equipe da sala de cirurgia retire as baterias para descarte
adequado ao final do uso do dispositivo. A porta da bateria é colada. Use um instrumento chato para abri-la
e retirar as baterias para descarte.
Conjunto do êmbolo da seringa
O conjunto do êmbolo da seringa trava mecanicamente os dois êmbolos da seringa de forma que o avanço de
ambos os êmbolos ocorra simultaneamente.
Indicação
O selante dural Adherus AutoSpray ET deve ser usado como um adjuvante aos métodos padrão de reparação
dural, como as suturas, oferecendo fechamento estanque durante procedimentos no crânio e medula espinhal.
Conjunto do êmbolo da
seringa
Conectores dos adaptadores
dos frascos
Bico com ponta estendida
Botão Liga/desliga (botão de pressão)
Page 83

83
Contraindicações
O selante dural Adherus AutoSpray ET não deve ser usado em espaços anatômicos confinados nos quais
a compressão nervosa possa ser fonte de preocupação. O hidrogel pode aumentar até 13% de seu tamanho em
qualquer dimensão.
Avisos
O selante dural Adherus AutoSpray ET não foi estudado em:
Indivíduos que precisem de procedimento que envolva abordagem translabiríntica, transesfenoidal ou
transoral ou qualquer procedimento que penetre no seio ou células aéreas mastoides;
Indivíduos nos quais os hiatos da borda dural são maiores que 2 mm;
Indivíduos com função hepática ou renal severamente alterada;
Indivíduos com infecção ativa presente no sítio cirúrgico;
Indivíduos com hidrocefalia tratada ou não (como aqueles com dispositivos para evacuar o líquido
cefalorraquidiano (LCR) ou dinâmica alterada do LCR);
Indivíduos com comorbidade médica subjacente ou que recebem medicamento que sabidamente interfere
com a cicatrização de feridas (como aqueles com procedimento neurocirúrgico intracraniano anterior na
mesma localização anatômica, tratamento radioterápico e quimioterápico, doença oncológica conhecida,
diabetes, toxicidade dos esteroides e uso crônico de corticosteroides, comprometimento do sistema
imunológico ou que utilizam algum agente anticoagulante, aspirina ou anti-inflamatório não esteroide);
Indivíduos com alergia conhecida aos corantes azul n° 1 FD&C ou amarelo n° 5 FD&C ou
Pacientes grávidas ou lactantes.
O selante dural Adherus AutoSpray ET deve ser usado como um adjuvante aos métodos padrão de reparação
dural. A eficácia do selante dural Adherus AutoSpray ET em outros tipos de tecido não foi estudada.
Precauções
O selante dural Adherus AutoSpray ET é embalado estéril. Não utilize caso as bandejas estejam danificadas ou
abertas. Não esterilize novamente.
A embalagem do selante dural Adherus AutoSpray ET foi projetada para uso em um único paciente. Descarte os
produtos abertos e não utilizados. A reutilização do dispositivo pode resultar em contaminação cruzada, o que
pode levar a lesão, doença ou morte do paciente.
Mantenha protegido da luz solar. Não utilize se o pó de éster de PEG formar grumos.
Use o selante dural Adherus AutoSpray ET dentro de até 2 horas após a reconstituição dos componentes
reticulantes. Quando testado 8 horas após a reconstituição, o selante resultante expandiu-se em pequena
proporção, mas de modo estatisticamente significativo quando comparado a amostras reconstituídas há 1, 2 ou 4
horas.
O aplicador de ponta estendida foi projetado para satisfazer às necessidades cirúrgicas pela introdução de
curvas ao longo do comprimento da ponta. Aplique pressão com cuidado ao curvar a ponta. Não faça curvas com
ângulos superiores a 90°. Verifique se o hidrogel está fluindo depois que o aplicador tiver sido moldado de
acordo com a necessidade cirúrgica.
A bateria do sistema do aplicador dura cerca de 2 horas em uso contínuo.
Antes da aplicação do hidrogel Adherus, certifique-se de que o extravasamento do fluido (líquido
cefalorraquidiano, sangue, etc.) foi interrompido.
Não use o selante dural Adherus AutoSpray ET na presença de anestésicos inflamáveis ou anestésicos
inflamáveis com oxidantes.
Mantenha o dispositivo selante dural Adherus AutoSpray ET afastado de campos magnéticos fortes para evitar
possível interferência de comunicação de RF. Equipamentos de ressonância magnética podem gerar
interferência no funcionamento da bomba.
Não retire nenhuma cobertura do sistema, exceto a porta da bateria.
Eventos adversos
Um dispositivo semelhante, o selante dural Adherus AutoSpray, que apresenta a mesma formulação de selante,
o selante dural Adherus, foi avaliado em 124 pacientes experimentais em um estudo clínico fundamental,
prospectivo, controlado e multicêntrico. A incidência e a natureza dos eventos adversos observados nessa
população de pacientes foram compatíveis com o tipo e a complexidade dos procedimentos neurocirúrgicos
realizados e o estado comórbido dos pacientes tratados. Houve quatro óbitos entre os pacientes tratados com
o selante dural Adherus AutoSpray e cinco óbitos entre os pacientes de controle. Os óbitos foram atribuídos
à condição anterior dos pacientes. Os eventos adversos relatados que ocorreram com frequência de 1% ou mais
nos pacientes tratados com o selante dural Adherus AutoSpray foram resumidos na tabela abaixo. Não houve
nenhum efeito adverso imprevisto do dispositivo.
Page 84

84
Tabela 1. Resumo dos eventos adversos do selante dural Adherus AutoSpray
Evento adverso
Pacientes (n (%))
N=124
Anemia
3 (2,4)
Leucocitose
2 (1,6)
Surdez unilateral
2 (1,6)
Zumbido
4 (3,2)
Diplopia
5 (4,0)
Ptose da pálpebra
2 (1,6)
Edema periorbital
6 (4,8)
Visão turva
7 (5,6)
Disfagia
4 (3,2)
Náusea
2 (1,6)
Reação adversa
6 (4,8)
Dor no peito
3 (2,4)
Progressão da doença
3 (2,4)
Fadiga
2 (1,6)
Pneumonia
2 (1,6)
Infecção do trato urinário
2 (1,6)
Infecção da ferida
2 (1,6)
Hipoestesia no local da incisão
3 (2,4)
Dor no local da incisão
4 (3,2)
Hemorragia periorbital
3 (2,4)
Edema pós-procedimento
2 (1,6)
Pseudomeningocele
9 (7,3)
Seroma
3 (2,4)
Hematoma subdural
3 (2,4)
Deiscência da ferida
2 (1,6)
Fraqueza muscular
2 (1,6)
Afasia
4 (3,2)
Distúrbio do equilíbrio
2 (1,6)
Convulsão
5 (4,0)
Paralisia de múltiplos nervos cranianos
2 (1,6)
Tontura
7 (5,6)
AVC embólico
2 (1,6)
Cefaleia
14 (11,3)
Hemiparesia
2 (1,6)
Hipoestesia
4 (3,2)
Paralisia do nervo hipoglosso
2 (1,6)
Perda de memória
2 (1,6)
Nistagmo
3 (2,4)
Parestesia
5 (4,0)
Perda sensorial
3 (2,4)
Tremor
2 (1,6)
Paralisia do sétimo nervo
3 (2,4)
Paralisia das cordas vocais
2 (1,6)
Atelectasia
2 (1,6)
Insuficiência respiratória
2 (1,6)
Alopecia
2 (1,6)
Exantema
2 (1,6)
Inchaço facial
4 (3,2)
Page 85

85
Informações clínicas
Um estudo fundamental, prospectivo, randomizado, controlado e multicêntrico foi conduzido para avaliar o uso do
selante dural Adherus usando o aplicador Adherus AutoSpray como adjuvante aos métodos padrão de reparação
dural, como as suturas, para fornecer fechamento estanque durante cirurgias cranianas. O critério de avaliação
primário deste estudo foi uma avaliação composta da segurança e da eficácia do selante dural Adherus
AutoSpray (n=124 pacientes) em comparação com um controle ativo (n=126 pacientes). Os resultados do critério
de avaliação basearam-se no número de pacientes que não tiveram vazamento de LCR intraoperatório devido à
reparação dural após no máximo duas aplicações do selante durante a manobra de Valsalva, não tiveram
vazamento de LCR/pseudomeningocele durante o período de acompanhamento de 120 dias nem novo
tratamento não planejado do local da cirurgia original dentro de 120 dias após a cirurgia. A taxa de sucesso
global na análise completa dos casos foi de 91,2% no grupo tratado com Adherus e de 90,6% no grupo de
controle. Adherus foi considerado não inferior ao controle, com margem de não inferioridade de 10% (p = 0,005).
No período pós-cirúrgico inicial, quando se espera que os selantes funcionem, a taxa de sucesso global no
acompanhamento de 14 dias dos pacientes que concluíram a consulta foi de 99,1% no grupo de Adherus
comparada a 95,0% no grupo de controle. Além disso, a taxa de sucesso global no acompanhamento de 45 dias
dos pacientes que concluíram a consulta foi de 96,6% no grupo de Adherus comparada a 91,9% no grupo de
controle. A análise de ausência de falha do critério de avaliação primário também demonstrou que as falhas do
critério de avaliação primário no grupo controle tenderam a ocorrer no início do período de acompanhamento,
enquanto a maioria das falhas do critério de avaliação nos pacientes tratados com Adherus foi identificada por
meio de exames radiológicos exigidos pelo protocolo na consulta de acompanhamento de 120 dias.
A segurança foi determinada com base na avaliação da cicatrização da incisão, infecções no local da cirurgia,
meningite, piora na Escala de Rankin modificada, inchaço no local da cirurgia e eventos adversos durante o
período de acompanhamento de 120 dias. Cem (80,6%) pacientes no grupo Adherus e 98 (77,8%) pacientes no
grupo controle apresentaram pelo menos um evento adverso durante o período de acompanhamento de 120
dias. Não houve nenhum efeito adverso imprevisto do dispositivo. Entre os pacientes tratados com o selante
dural Adherus AutoSpray, não houve infecções incisionais profundas relacionadas ao dispositivo e nenhum caso
de meningite. O tipo e a frequência dos eventos adversos observados neste estudo são compatíveis com a
complexidade do procedimento cirúrgico e a condição comórbida dos pacientes tratados.
Os principais critérios de inclusão/exclusão para o estudo foram os seguintes:
Critérios de inclusão pré-operatórios:
Pacientes com ≥ 18 e ≤ 75 anos.
O paciente tinha um procedimento craniano eletivo programado envolvendo uma incisão dural usando
qualquer dos seguintes locais/abordagens cirúrgicas (ou uma combinação): frontal, temporal, occipital e
parietal (ou seja, supratentorial) e/ou suboccipital mediana ou lateral (isto é, infratentorial).
O paciente precisava de um procedimento envolvendo ferida Classe I/limpa (ferida cirúrgica não
infectada na qual não foi encontrada inflamação).
Critérios de exclusão pré-operatórios:
O paciente precisava de procedimento envolvendo uma abordagem translabiríntica, transesfenoidal ou
transoral ou qualquer procedimento que penetrasse no seio ou células aéreas mastoides. Observação:
A penetração superficial de células aéreas mastoides não constituía uma exclusão se as células fossem
adequadamente seladas (por exemplo, cera óssea).
O paciente tinha uma derivação do LCR, por exemplo, uma derivação ventrículo-peritoneal, ventrículo-
pleural, ventrículo-atrial ou lumbo-peritoneal.
O paciente apresentava drenagem ventricular ou lombar externa do LCR, que precisava ser deixada no
local após a cirurgia.
O paciente apresentava hidrocefalia clinicamente significativa ou evidência clínica de dinâmica alterada
do LCR.
O paciente foi submetido a um procedimento neurocirúrgico intracraniano prévio na mesma localização
anatômica. (Observação: a biópsia estereotáxica não foi um fator de exclusão).
O paciente apresentou vazamento prévio de LCR (secundário a trauma, neoplasia, cirurgia ou outra
etiologia).
O paciente foi submetido a radioterapia no local da cirurgia ou radioterapia fracionada padrão foi
planejada dentro de dez dias após o procedimento de referência. (Observação: radiocirurgia
estereotáxica antes do procedimento de referência planejado não foi um critério de exclusão).
O paciente sofreu uma lesão traumática na cabeça dentro de 30 dias antes do procedimento de
referência planejado resultando em fratura craniana basilar ou fraturas envolvendo os seios paranasais.
O paciente tinha uma doença oncológica conhecida ou outra afecção com sobrevida estimada inferior
a seis meses.
Page 86

86
O paciente foi submetido a tratamento quimioterápico, exceto terapia hormonal, dentro de três semanas
antes do procedimento de referência planejado ou o uso de pastilha de quimioterapia intracavitária
(BCNU) foi planejado ou tratamento de quimioterapia foi planejado dentro de duas semanas depois que
o procedimento de referência foi realizado.
Foi permitido o uso padrão de esteroides perioperatórios (ou seja, corticosteroides). O uso crônico de
esteroides (definido como o uso diário de corticosteroides por ≥ 8 semanas) visando reduzir os efeitos
colaterais da quimioterapia e/ou radioterapia para o câncer não foi um fator de exclusão, a menos que o
paciente fosse considerado pelo pesquisador como portador de toxicidade dos esteroides. O uso de
corticosteroides de modo crônico (como definido anteriormente) para fins diferentes da diminuição dos
sintomas da quimioterapia sistêmica foi um fator de exclusão, a menos que esses esteroides tivessem
sido descontinuados 4 semanas antes do procedimento de referência planejado.
O paciente recebeu warfarina, heparina, outros agentes anticoagulantes, aspirina ou anti-inflamatórios
não esteroides diariamente e o repouso farmacológico pré-cirúrgico padrão para o medicamento não foi
realizado.
O paciente tinha coagulopatia clinicamente significativa documentada com TPT (tempo de
tromboplastina parcial) > 37 segundos ou INR (índice internacional normalizado) > 1,3 unidades INR.
O paciente apresentava sistema imunológico comprometido ou doença autoimune ou usava agentes
imunossupressores de modo contínuo no início do estudo.
O paciente apresentava infecção sistêmica ou evidência de qualquer infecção perto do local planejado
para a cirurgia.
O paciente apresentava nível de creatinina sérica > 2,0 mg/dL.
O paciente apresentava bilirrubina total sérica > 2,5 mg/dL no início do estudo.
O paciente apresentava diabetes descontrolada como evidenciado pelo padrão de cuidados da
instituição (HbA1c > 7%, glicose no sangue, etc.) no início do estudo.
Critérios de inclusão intraoperatórios:
A extensão linear da durotomia do paciente foi ≥ 2 cm.
As margens durais das bordas do defeito ósseo do paciente eram ≥ 3 mm em toda a extensão.
O paciente apresentou extravasamento do LCR durante a cirurgia, após a conclusão do fechamento
dural primário (com ou sem duroplastia não autóloga ou tecido autólogo), espontaneamente ou com
manobra de Valsalva, de até 20 cm H2O por até cinco (5) segundos.
Critérios de exclusão intraoperatórios:
O paciente tinha um achado incidental que satisfazia qualquer critério de exclusão pré-operatório listado
acima.
O paciente precisou da colocação intraoperatória de um dispositivo de desvio do LCR (por exemplo,
cateter ventricular, cateter subdural, dreno lombar ou outro dispositivo projetado para evacuar
externamente o LCR) que foi deixado no local após o procedimento. Observação: Os drenos subgaleais
utilizados para o tratamento pós-operatório agudo do local da incisão foram permitidos.
O paciente apresentou um hiato > 2 mm entre as bordas durais ou entre a borda dural e o material da
duroplastia, com base em estimativa visual feita pelo cirurgião antes da aplicação do selante cirúrgico.
Page 87

87
Tabela 2. Resumo das informações demográficas dos pacientes do estudo
Características
População do selante dural
Adherus AutoSpray
População de
controle
Número de pacientes
124
126
Homens/mulheres
41/83
40/86
Idade média (anos)
54,2
51,1
Pontuação ASA do paciente (N (%))
I
2 (1,6)
8 (6,3)
II
47 (37,9)
50 (39,7)
III
69 (55,6)
62 (49,2)
IV
6 (4,8)
6 (4,8)
V
0 (0,0)
0 (0,0)
Indicação primária para cirurgia (N (%))
Tumor
56 (45,2)
53 (42,1)
Epilepsia
1 (0,8)
1 (0,8)
Descompressão de nervo
17 (13,7)
21 (16,7)
Malformação arteriovenosa
3 (2,4)
5 (4,0)
Aneurisma
28 (22,6)
26 (21,3)
Malformação de Chiari
17 (13,7)
18 (14,3)
Cisto
2 (1,6)
1 (0,8)
Outra
0 (0,0)
1 (0,8)
Abordagem (N (%))
Infratentorial
53 (42,7)
52 (41,3)
Supratentorial
71 (57,3)
74 (58,7)
Técnica primária para fechamento dural (N (%))
Sutura
48 (38,7)
48 (38,1)
Sutura + material dural autólogo
29 (23,4)
34 (27,0)
Sutura + material dural não autólogo
45 (36,3)
39 (31,0)
Os EA relatados a uma taxa superior a 1% na população de pacientes com intenção de tratar (ITT) estão
resumidos na Tabela 1, acima.
Page 88

88
Método de esterilização e de descarte do dispositivo selante dural Adherus AutoSpray ET
A tabela a seguir detalha o método de esterilização e de descarte do dispositivo selante dural Adherus
AutoSpray ET.
Descrição
Número
da peça
Método de
esterilização
Frequência
de uso
Método de descarte
Selante dural
Adherus
AutoSpray ET
NUS-009
Radiação
Apenas para
uso único
Descarte o dispositivo selante
dural Adherus AutoSpray
ET em um recipiente de risco
biológico hospitalar aprovado.
Não coloque no lixo!
Condições ambientais de operação
Temperatura de armazenamento
Armazene abaixo de 30 oC
Temperatura operacional
5 oC a 35 oC
Nível de ruído
≤ 60 db
Apresentação
A embalagem do selante dural Adherus AutoSpray ET contém:
Bandeja do kit de selante dural Adherus AutoSpray ET (1)
Aplicador pré-montado (1)
Pó de PEG ativado em um frasco com tampa verde (1)
Solução de PEI em um frasco com tampa prata (1)
Operações com o selante dural Adherus AutoSpray ET
As seções seguintes fornecem instruções para preparação e ativação do selante dural Adherus AutoSpray ET.
Reconstituição dos componentes reticulantes
1) Utilizando técnica asséptica, introduza o conteúdo da bandeja externa rotulada selante dural Adherus
AutoSpray ET no campo estéril.
2) Retire a tampa da bandeja do kit de selante dural Adherus AutoSpray ET.
3) Remova o aplicador pré-montado do selante dural Adherus AutoSpray ET.
4) Com o dispositivo orientado de forma que o bico com ponta estendida esteja apontando para cima, remova
e descarte os protetores vermelhos que cobrem os pinos perfurantes dos conectores azuis dos adaptadores
dos frascos existentes no aplicador (Fig. A-1).
Observação: Poderá ser necessário usar um hemostato ou uma ferramenta similar para remover os
protetores. Recomenda-se também um movimento de torção ao remover o protetor.
5) Retire o frasco contendo a solução de PEI (frasco com tampa prata) da bandeja e encaixe a extremidade
que tem a tampa no conector azul do adaptador de frasco do aplicador correspondente ao êmbolo de
seringa branco segurando o aplicador e pressionando completamente o frasco de modo que o pino
perfurante penetre no septo e o selo de alumínio prata fique no fundo do conector do adaptador de frasco
(Fig. A-2).
6) Remova o frasco contendo o pó de éster de PEG (frasco com tampa verde) da bandeja e encaixe a
extremidade que tem a tampa no conector azul do adaptador de frasco do aplicador correspondente ao
êmbolo de seringa verde segurando o aplicador e pressionando completamente o frasco de forma que o
pino perfurante penetre no septo e o selo de alumínio verde fique no fundo do conector do adaptador de
frasco (Fig. A-2).
7) Com os frascos voltados para cima, empurre o conjunto do êmbolo da seringa para transferir o líquido das
seringas para dentro dos frascos. Continue a pressionar o conjunto de êmbolo da seringa (Fig. A-3).
Observação: Use as duas mãos para pressionar o conjunto do êmbolo da seringa, caso necessário.
8) Com o conjunto do êmbolo da seringa ainda pressionado, agite o dispositivo delicadamente de forma
intermitente até que o pó seja completamente dissolvido (Fig. A-3).
Observação: O pó de éster de PEG continuará a se dissolver entre os períodos de agitação delicada. Agitar
muito agressivamente pode provocar o surgimento de muitas bolhas de ar.
Page 89

89
9) Libere o conjunto do êmbolo da seringa, permitindo que ele recue e empurre-o uma segunda vez, para
garantir que ambas as soluções fiquem homogêneas.
10) Permita que o conjunto do êmbolo da seringa recue novamente e puxe o conjunto do êmbolo da seringa
para trás até que todos os componentes reconstituídos sejam transferidos dos frascos para as seringas
(visão de cima na Fig. A-4).
Observação: Caso o botão Liga/desliga seja acidentalmente acionado durante a fase de reconstituição, o
dispositivo pode ser desligado, sem efeitos danosos. O uso deverá ser concluído em até duas horas da
reconstituição para resultados ideais.
Como ligar o dispositivo selante dural Adherus AutoSpray ET
11) Pressione o botão Liga/desliga na parte inferior do dispositivo para “ativar” o sistema antes da aplicação do
spray de hidrogel (Fig. B-1).
Observação: O aplicador do selante dural Adherus AutoSpray ET deve ser ativado antes da remoção dos
conectores dos adaptadores dos frascos, logo antes da aplicação do spray, para evitar o entupimento
acidental do bico.
Preparação do dispositivo e do local do tratamento
12) Caso ainda não esteja ligado, pressione o botão Liga/desliga para ligar o aplicador do selante dural Adherus
AutoSpray ET (Fig. B-1).
Observação: A bomba de ar interna é ativada quando o botão Liga/desliga é pressionado, e produz um
som audível indicando que o sistema foi ativado. Caso o som audível da bomba não ocorra, interrompa
o uso dessa unidade do selante dural Adherus AutoSpray ET e siga as instruções da seção Solução de
problemas.
13) Antes da aplicação do tratamento, oriente o dispositivo de modo que os frascos apontem para cima
e remova e descarte os dois conectores dos adaptadores dos frascos girando os conectores azuis no
sentido anti-horário até que os conectores sejam ejetados do dispositivo (vista de cima na Fig. B-2).
14) Para aderência ideal do tecido no local de tratamento, certifique-se de que margens de 2 mm a 3 mm ao
redor do defeito estejam sem sangue, agentes hemostáticos ou outros tecidos soltos e que
o extravasamento do líquido cefalorraquidiano foi minimizado.
15) Se necessário, curve ou molde o bico com ponta estendida para melhorar o acesso e/ou a visualização do
local de tratamento.
Page 90

90
Aplicação do tratamento
16) Para aplicar o produto preparado, caso o dispositivo ainda não esteja ligado, pressione o botão Liga/desliga
para ligá-lo.
17) Oriente o dispositivo de forma que o corpo do aplicador fique voltado para cima e segure um pedaço de
gaze aproximadamente 5 cm a 10 cm acima do bico (Fig. B-3).
18) Aplique pressão firme e uniforme no centro do conjunto do êmbolo da seringa até que o produto comece a
sair em um jato de spray do bico (Fig. B-3).
19) Assim que o selante verde começar a se formar no pedaço de gaze, pare de pressionar o conjunto do
êmbolo da seringa. O selante dural Adherus AutoSpray ET agora está pronto para aplicação do tratamento.
20) Apontando para o local do tratamento e mantendo o bico do dispositivo a aproximadamente 2 cm a 4 cm de
distância, aplique pressão firme e uniforme no centro do conjunto do êmbolo da seringa para liberar a
solução misturada (Fig. B-4).
21) Continue aplicando o sistema selante Adherus até que uma fina camada (aproximadamente 1 mm a
2 mm) seja formada.
Observação: Avaliação da espessura:
Fechamento dural com sutura: Certifique-se de que todos os pontos de sutura estejam
completamente cobertos pelo selante hidrogel. Em geral, são usados fios de sutura de
tamanho 4-0, 3-0 e 2-0 para o fechamento dural. O menor desses fios de sutura é o 4-0, que
tem um diâmetro de 0,15 mm a 0,2 mm. Um nó com fio de tamanho 4-0 terá uma espessura
de pelo menos quatro vezes o diâmetro do fio, ou seja, aproximadamente 0,6 mm a 0,8 mm.
A cobertura total do nó garante a obtenção da espessura mínima de aplicação.
Fechamento de duroplastia com material de enxerto: Certifique-se de que foi aplicado
selante de hidrogel suficiente para cobrir a duroplastia com enxerto e pelo menos 3 mm - 4 mm
da dura nativa circundante com 1 mm - 2 mm de hidrogel, usando a altura do material de
enxerto como referência de espessura. Observe que, quando umedecidos com solução salina,
dois materiais comuns de enxerto em duroplastia, a matriz de enxerto dural DuraGen® e a
matriz de regeneração dural Durepair®, têm aproximadamente 3 mm e 1 mm de espessura,
respectivamente.
Interrupção da aplicação do spray
22) A aplicação poderá ser interrompida a qualquer momento durante o tratamento, interrompendo a pressão
aplicada sobre o conjunto do êmbolo. No entanto, para evitar entupimento, não desligue a bomba até que
aplicação final do selante tenha sido concluída.
Observação: Caso haja formação excessiva do hidrogel no bico de spray durante a aplicação, ela poderá
ser removida limpando delicadamente com um pedaço de gaze.
Finalização da aplicação
23) Se necessário, o selante aplicado em excesso além das bordas da margem dural pode ser removido com
uma sonda Penfield, tesouras ou intervenção mecânica.
Page 91

91
Descarte do selante dural Adherus AutoSpray ET
Quando a aplicação final do spray estiver concluída, desligue o dispositivo, abra a porta da bateria para romper o
selo interno e remova as baterias para descarte adequado. A tabela a seguir contém informações importantes
sobre o descarte dos componentes do selante dural Adherus AutoSpray ET.
Dispositivo
Instruções de descarte
Selante dural Adherus
AutoSpray ET
O selante dural Adherus AutoSpray ET consiste de um invólucro
de plástico e componentes elétricos. Esse dispositivo deve ser
descartado em coleta separada após o fim de sua vida útil. Não
descarte esse produto como lixo comum.
Solução de problemas com o selante dural Adherus AutoSpray ET
Os seguintes modos de falha potencial do selante dural Adherus AutoSpray ET foram identificados. Cada um dos
modos de falha inclui uma proteção integrada (conforme listado abaixo) para controlar os resultados desse mau
funcionamento.
Modos de falha potencial
Proteção
1. Bomba de ar não ativada
1. Interruptor Liga/desliga não pressionado
2. Bico do spray bloqueado
2. Não remova os conectores dos adaptadores
dos frascos antes de ligar a bomba de ar e limpe
o bico após o uso.
Para evitar complicações, siga exatamente o fluxograma de solução de problemas do selante dural Adherus
AutoSpray ET da tabela acima. Durante um procedimento, os esforços do usuário para solucionar problemas do
selante dural Adherus AutoSpray ET deverão limitar-se estritamente aos passos descritos acima. Se a solução
de problemas não for bem-sucedida, interrompa imediatamente o uso dessa unidade do selante dural Adherus
AutoSpray ET e abra uma nova unidade do selante dural Adherus AutoSpray ET.
Page 92

92
Especificações elétricas do selante dural Adherus AutoSpray ET
O selante dural Adherus AutoSpray ET atende aos seguintes padrões:
IEC 60601-1 3a edição Requisitos padrão de segurança elétrica
IEC 60601-1-2 3a edição Requisitos de imunidade
Orientação e declaração do fabricante – Emissões eletromagnéticas
O selante dural Adherus AutoSpray ET foi projetado para uso no ambiente eletromagnético especificado abaixo.
O cliente ou usuário do selante dural Adherus AutoSpray ET deve assegurar que o equipamento seja usado
apenas nesse ambiente.
Teste de emissões
Conformidade
Orientação sobre o ambiente eletromagnético
Emissões de RF CISPR 11
Grupo 1
O selante dural Adherus AutoSpray ET usa energia de RF
apenas para suas funções internas. Portanto, as emissões de RF
são muito baixas e não devem causar interferência em
equipamentos eletrônicos próximos.
Emissões de RF CISPR 11
Classe B
O selante dural Adherus AutoSpray ET é adequado para uso em
todos os tipos de estabelecimentos, incluindo estabelecimentos
domésticos e aqueles diretamente conectados à rede pública de
baixa tensão que alimenta prédios com fins domésticos.
Emissões harmônicas
IEC 61000-3-2
Não aplicável
Flutuações de
tensão/Emissão de
vibrações IEC 61000-3-3
Não aplicável
Page 93
93
Orientação e declaração do fabricante – Imunidade eletromagnética para todos os equipamentos e
sistemas
O selante dural Adherus AutoSpray ET é um sistema operado por bateria e foi projetado para uso no ambiente
eletromagnético especificado abaixo. O cliente ou usuário do selante dural Adherus AutoSpray ET deve se
certificar de que este seja usado apenas nesse ambiente.
Teste de imunidade
Nível de teste
IEC 60601
Nível de
conformidade
Orientação sobre o ambiente
eletromagnético
Descarga
eletrostática (ESD)
IEC 61000-4-2
±6 kV por contato
±8 kV por ar
Não aplicável Sistema
operado por bateria
sem circuitos digitais
Os pisos devem ser de madeira,
concreto ou azulejos cerâmicos. Caso
os pisos estejam cobertos com material
sintético, a umidade relativa deverá ser
de, pelo menos, 30%.
Transiente elétrico
rápido/Trem de
Pulso IEC 61000-4-4
±2 kV para linhas
de fornecimento
de energia
±1 kV para linhas
de entrada/saída
Não aplicável Sistema
operado por bateria
O tipo de energia da instalação deve
ser o correspondente a ambientes
comerciais ou hospitalares normais.
Sobretensão
IEC 61000-4-5
±1 kV modo diferencial
±2 kV modo comum
Não aplicável Sistema
operado por bateria
O tipo de energia da instalação deve
ser o correspondente a ambientes
comerciais ou hospitalares normais.
Quedas de tensão,
interrupções breves
e variações de
tensão nas linhas de
entrada de energia
IEC 61000-4-11
<5% U
T
(queda >95% em UT)
durante 0,5 ciclo
40% U
T
(queda de 60% em UT)
durante 5 ciclos
70% U
T
(queda de 30% em UT)
durante 25 ciclos
<5% U
T
(queda >95% em UT)
durante 5 s
Não aplicável Sistema
operado por bateria
O tipo de energia da instalação deve
ser o correspondente a ambientes
comerciais ou hospitalares normais.
Caso o usuário do equipamento precise
continuar a operação durante quedas
na rede elétrica, recomenda-se que o
equipamento seja alimentado a partir
de um no-break ou de uma bateria.
Campo magnético
da frequência da
corrente (50/60 Hz)
IEC 61000-4-8
3 A/m
Não aplicável Sistema
operado por bateria
sem componentes
magneticamente
sensíveis
Os campos magnéticos da frequência
de alimentação devem situar-se em
níveis característicos de um ambiente
comercial ou hospitalar típico.
*OBSERVAÇÃO: UT é a tensão da CA da rede elétrica da instalação antes da aplicação do nível de teste.
Page 94

94
Orientação e declaração do fabricante – Imunidade eletromagnética
O selante dural Adherus AutoSpray ET foi projetado para uso no ambiente eletromagnético especificado abaixo.
O cliente ou usuário do selante dural Adherus AutoSpray ET deve se certificar de que este seja usado apenas
nesse ambiente.
Teste de
imunidade
Nível de teste
IEC 60601
Nível de
conformidade
Orientação sobre o ambiente eletromagnético
RF conduzida
IEC 61000-4-6
RF irradiada
IEC 61000-4-3
3 Vrms
150 kHz a 80 MHz
3 V/m
80 MHz a 2,5 GHz
Não aplicável
Sistema
operado por
bateria sem
circuitos digitais
Não aplicável
Sistema
operado por
bateria sem
circuitos digitais
Equipamentos de comunicação por RF portáteis
e móveis não devem ser usados mais perto de
qualquer parte do selante dural Adherus AutoSpray ET,
incluindo cabos, do que a distância de separação
recomendada, calculada pela equação aplicável
à frequência do transmissor.
Distância de separação recomendada
d = 1,2√P
d = 1,2√P 80 MHz a 800 MHz
d = 2,3√P 800 MHz a 2,5 GHz
Onde P é a potência nominal de saída máxima do
transmissor em Watts (W) de acordo com o fabricante
do transmissor e d é a distância de separação
recomendada em metros (m).
As intensidades de campo provenientes de
transmissores de RF fixos, determinadas por uma
inspeção eletromagnética do locala, devem ser
menores do que o nível de conformidade em cada
faixa de frequência.
b
Poderá ocorrer interferência nas proximidades de
equipamentos marcados com o seguinte símbolo:
Observação 1: A 80 MHz e 800 MHz, o intervalo de frequência mais alto será aplicado.
Observação 2: Essas diretrizes podem não se aplicar a todas as situações. A propagação eletromagnética é afetada por
absorção e reflexão por estruturas, objetos e pessoas.
a As forças de campo de transmissores fixos, como estações de base para telefones por rádio (celular/sem fio)
e rádios móveis terrestres, rádio amador, transmissão de rádio AM e FM e transmissões de TV, não podem ser
previstas teoricamente com precisão. Para avaliar o ambiente eletromagnético devido a transmissores de RF,
uma pesquisa eletromagnética do local deverá ser considerada. Caso a força de campo medida no local em que
o selante dural Adherus AutoSpray ET é usado exceda o nível de conformidade de RF aplicável acima,
o dispositivo selante dural Adherus AutoSpray ET deverá ser observado para verificação da operação normal.
Caso seja observado desempenho anormal, medidas adicionais, como reorientação ou realocação do dispositivo
selante dural Adherus AutoSpray ET, poderão ser necessárias.
b Acima do intervalo de frequência de 150 kHz a 80 MHz, as forças de campo devem ser inferiores a 3 V/m
Page 95

95
Distâncias de separação recomendadas entre comunicações portáteis e móveis de
RF e o selante dural Adherus AutoSpray ET
O selante dural Adherus AutoSpray ET foi projetado para uso em um ambiente eletromagnético no qual as
interferências de RF irradiadas são controladas. O cliente ou usuário do dispositivo selante dural Adherus
AutoSpray ET pode ajudar a evitar interferência eletromagnética ao manter a distância mínima entre
equipamentos de comunicação de RF portáteis e móveis (transmissores) e o dispositivo selante dural Adherus
AutoSpray ET conforme recomendado abaixo, de acordo com a potência de saída máxima do equipamento de
comunicação.
Potência de saída
máxima nominal
do transmissor
W
Distância de separação de acordo com a frequência do transmissor
m
150 kHz a 80 MHz
d = 1,2√P
80 MHz a 800 MHz
d = 1,2√P
800 MHz a 2,5 GHz
d = 2,3√P
0,01
0,12
0,12
0,23
0,1
0,38
0,38
0,73
1
1,2
1,2
2,3
10
3,8
3,8
7,3
100
12
12
23
Para transmissores com potência nominal de saída máxima não listada acima, a distância de separação recomendada d em
metros (m) poderá ser estimada usando a equação aplicável à frequência do transmissor, onde P é a potência nominal de
saída máxima do transmissor em Watts (W), de acordo com o fabricante do transmissor.
OBSERVAÇÃO 1: A 80 MHz e 800 MHz, a distância de separação para o intervalo de frequência mais alto será aplicada.
OBSERVAÇÃO 2: Essas diretrizes poderão não se aplicar a todas as situações. A propagação eletromagnética é afetada por
absorção e reflexão por estruturas, objetos e pessoas.
Page 96

96
Symbolförklaring
I följande tabell visas symboler som används i den här handboken, på systemets komponenter och på
förpackningsmärkningen. I tabellen ges motsvarande innebörd för varje symbol. Var uppmärksam på de här
symbolerna då de kan innebära viktig säkerhetsinformation, försiktighetsåtgärder och varningar.
Symbol
Innebörd
Se bruksanvisningen för ytterligare information
Endast för engångsbruk. Får inte återanvändas.
Får inte omsteriliseras
Steriliserad med strålning
Används före-datum. Utgångsdatum – år och sista dagen på
månaden
Får inte användas om förpackningen är skadad
Skyddas från solljus
Får inte kasseras bland vanligt avfall
Auktoriserad representant inom EG
0050
CE-märke och identifieringsnummer till anmält organ
Satsnummer
Katalognummer
Antal
Tillverkare
Utrustning av BF-typ (ej kontakt med hjärtat – patientansluten del)
Likström
Temperaturbegränsningar (förvara under)
Biorisk
“På”/“Av” (tryck på/tryck av)
Page 97

97
Innehållsförteckning
Beskrivning av enheten ......................................................................................................... 98
Indikation ................................................................................................................................ 99
Kontraindikationer .................................................................................................................. 99
Varningar................................................................................................................................. 99
Försiktighetsåtgärder ............................................................................................................. 99
Biverkningar ........................................................................................................................... 99
Klinisk information ............................................................................................................... 100
Steriliseringsmetod och kassationsmetod för Adherus AutoSpray-tätningsmedel
för dura med FS .................................................................................................................... 103
Driftsförhållanden ................................................................................................................. 103
Leveransform ........................................................................................................................ 103
Användning av Adherus AutoSpray-tätningsmedel för dura med FS............................... 103
Rekonstituera de korslänkande komponenterna ................................................................. 103
Slå på Adherus AutoSpray-tätningsmedelsenheten för dura med FS .................................. 104
Förbereda enheten och behandlingsstället .......................................................................... 104
Avge behandling ................................................................................................................. 104
Stoppa applicering av spray ................................................................................................ 105
Avsluta en utplacering ......................................................................................................... 105
Kassation av Adherus AutoSpray-tätningsmedel för dura med FS .................................. 106
Elektriska specifikationer för Adherus AutoSpray-tätningsmedel för dura med FS ........ 106
Vägledning och tillverkarens deklaration – elektromagnetiska emissioner ........................... 106
Vägledning och tillverkarens deklaration – elektromagnetisk immunitet för alla
utrustningar och system ...................................................................................................... 107
Vägledning och tillverkarens deklaration – elektromagnetisk immunitet .............................. 108
Rekommenderade separationsavstånd mellan bärbar och mobil
RF-kommunikationsutrustning och Adherus AutoSpray-tätningsmedel för dura med FS ..... 109
SV
Page 98

98
Beskrivning av enheten
Adherus AutoSpray ET är en steril, elektromekanisk, batteridriven enhet för engångsbruk med inbyggda
systemkomponenter som skapar ett luftflöde för att hjälpa till vid utplacering av ett syntetiskt, absorberbart,
hydrogeltätningssystem med två komponenter och medge avbruten utplacering utan igensättning.
Enheten levereras som en förmonterad applikator och två separata glasampuller. De två glasampullerna
innehåller antingen ett aktiverat polyetylenglykolesterpulver (PEG) eller en polyetylenimin (PEI) löst i sterilt vatten.
De korslänkade komponenterna är rekonstituerade före användning med sin respektive rekonstitueringsbuffer
som finns inuti applikatorn. De resulterande lösningarna blandas i den förlängda applikatorspetsen och korslänkar
snabbt för att bilda en hydrogel tätning strax efter att de kommit ut ur applikatorns spets. Den tillförda lösningen
korslänkar omedelbart och bildar en hydrogeltätning som absorberas under ungefär 90 dagar, vilket är tillräckligt
för att medge läkning.
Adherus AutoSpray-tätningsenheten för dura med förlängd spets består av följande huvudsakliga delar:
Munstycke med förlängd spets
Det inbyggda munstycket med förlängd spets är formbart och kan böjas eller formas efter preferens. I munstycket
med förlängd spets blandas de två tätningslösningarna noga och den blandade lösningen placeras ut på
målplatsen i ett smalt spraymönster. Spraymunstycket är fäst vid systemet och kan inte tas bort.
Ampulladapterfattningar
Ampulladapterfattningarna håller ampullerna med de korslänkande komponenterna. Under rekonstitueringsfasen
sitter ampullerna på ampulladapterfattningarna. När rekonstitueringen är klar tas fattningarna bort från Adherus
AutoSpray-tätningsenheten för dura med FS genom att rotera dem moturs. När fattningarna tas bort öppnas
vägen för lösningen att flöda genom munstycket.
På/Av-tryckknappsbrytare
På/av-brytaren slår på och stänger av den batteridrivna luftpumpen. Enheten levereras med brytaren i läget Av,
vilket skiljer luftpumpen från batteriströmkällan. Innan ampulladapterfattningarna tas bort ska PÅ/AV-brytaren
ställas i läget PÅ och luftpumpen aktiveras.
Batterilucka
En lucka på höljets undersida för att operationspersonalen efter behov ska kunna ta bort batterierna för lämplig
kassation när de är slutförbrukade. Batteriluckan är limmad i stängt läge. Använd ett plant instrument för att
bända upp luckan och ta bort batterierna för kassation.
Sprutkolvenhet
Sprutkolvenheten låser de två sprutkolvarna mekaniskt så att båda sprutkolvarna förs fram samtidigt.
Sprutkolvenhet
Ampulladapterfattningar
Munstycke med
förlängd spets
På/Av-tryckknapp
Page 99

99
Indikation
Adherus AutoSpray-tätningsmedel för dura med FS är avsett att användas som ett tillägg till standardmetoder för
dural reparation, såsom suturer, vid operationer på kranium eller ryggrad för att skapa en vattentät förslutning.
Kontraindikationer
Adherus AutoSpray-tätningsmedel för dura med FS ska inte användas i begränsade anatomiska utrymmen där
nervkompression kan uppstå. Hydrogelen kan svälla upp till 13 % av dess storlek i alla dimensioner.
Varningar
Adherus AutoSpray-tätningsmedel för dura med FS har inte studerats hos:
Patienter som kräver en operation som involverar en translabyrintär, transsfenoidal eller transoral metod eller
ett ingrepp som penetrerar luftförande sinus eller luftfyllda mastoidceller.
Patienter vars öppningar mellan duras kanter är större än 2 mm.
Patienter med kraftigt förändrad njur- eller leverfunktion.
Patienter med en aktiv infektion vid operationsstället.
Patienter som har behandlad eller obehandlad hydrocefalus (t.ex. de som har enheter utformade för att
dränera cerebrospinalvätska (CSV) eller förändrad CSV-dynamik).
Patienter med en underliggande medicinsk komorbiditet eller som tar ett läkemedel känt för att hämma
sårläkningen (t.ex. de med tidigare intrakraniell neurokirurgisk operation på samma anatomiska område, stråloch cytostatikabehandling, kända tumörer, diabetes, steroidtoxicitet och kronisk användning av
kortikosteroider, nedsatt immunförsvar eller som tar ett antikoagulerande medel, aspirin eller icke-steroid
antiinflammatoriskt medel).
Patienter med en känd känslighet mot blåfärg FD&C nr 1 eller gulfärg FD&C nr 5.
Patienter som är gravida eller ammar.
Adherus AutoSpray-tätningsmedel för dura med FS är avsedd att användas som ett komplement till
standardmetoder för reparation av duran. Effektiviteten hos Adherus AutoSpray-tätningsmedel för dura med FS
på andra vävnadstyper har inte studerats.
Försiktighetsåtgärder
Adherus AutoSpray-tätningsmedel för dura med FS är förpackad steril. Får inte användas om brickorna har
skadats eller öppnats. Får inte omsteriliseras.
Adherus AutoSpray-tätningsmedel för dura med FS är avsedd endast för enpatientbruk. Kassera alla oanvända
och/eller öppnade produkter. Återanvändning av enheten kan leda till korskontaminering som kan orsaka
personskada, sjukdom eller dödsfall hos patienten.
Skyddas från solljus. Får inte användas om PEG-esterpulvret inte flödar fritt.
Använd Adherus AutoSpray-tätningsmedel för dura med FS inom 2 timmar efter att de korslänkande
komponenterna rekonstituerats. Vid tester 8 timmar efter rekonstituering svällde tätningen som bildats i liten men
statistiskt signifikant omfattning mer än jämfört med prover som rekonstitueras 1, 2 eller 4 timmar.
Den förlängda applikatorspetsen har utformats för att kunna anpassas efter det kirurgiska behovet genom
introduktion av böjar utmed spetsens längd. Tryck försiktigt vid böjning av spetsen. Böj inte till vinklar större än
90°. Kontrollera hydrogelens flöde när applikatorn väl har formats för det kirurgiska behovet.
Applikatorsystemet har en batteritid för cirka två timmars kontinuerlig användning.
Före applicering av Adherus hydrogel ska det säkerställas att utflödet av vätska (cerebrospinalvätska, blod m.m.)
har stoppats.
Använd inte Adherus AutoSpray-tätningsmedel för dura med FS i närheten av lättantändliga anestetika eller
lättantändliga anestetika med oxidanter.
Håll Adherus AutoSpray-tätningsmedel för dura med FS borta från starka magnetfält för att undvika eventuell
störning från RF-kommunikation. Magnetresonansutrustning kan störa driften av pumpar.
Ta inte bort något av systemets skydd förutom batteriluckan.
Biverkningar
En liknande produkt, Adherus AutoSpray-tätningsmedel, som innehåller samma tätningsformulering, Adherus
tätningsmedel, utvärderades hos 124 forskningspersoner i en prospektiv, kontrollerad, pivotal, klinisk
multicenterstudie. Incidensen och typen av biverkningar som observerades i den här patientgruppen motsvarade
typen och komplexiteten hos de neurokirurgiska ingrepp som utfördes och de behandlade patienternas komorbida
status. Det förekom fyra dödsfall bland forskningspersonerna som behandlades med Adherus AutoSpraytätningsmedel och fem dödsfall i kontrollgruppen. Dödsfallen hänfördes till patienternas tidigare tillstånd.
Biverkningarna som uppstod vid en frekvens på 1 % eller högre bland de biverkningar som rapporterades för
forskningspersoner som behandlades med Adherus AutoSpray-tätningsmedel sammanfattas i tabellen nedan.
Det förekom inga oväntade biverkningar.
Page 100

100
Tabell 1. Sammanfattning av biverkningar från Adherus AutoSpray-tätningsmedel
Biverkningar
Patienter (n (%))
N=124
Anemi
3 (2,4)
Leukocytos
2 (1,6)
Unilateral hörselnedsättning
2 (1,6)
Tinnitus
4 (3,2)
Diplopi
5 (4,0)
Blefaroptos
2 (1,6)
Periorbitalt ödem
6 (4,8)
Dimsyn
7 (5,6)
Dysfagi
4 (3,2)
Illamående
2 (1,6)
Bieffekter
6 (4,8)
Bröstsmärta
3 (2,4)
Sjukdomsprogress
3 (2,4)
Utmattning
2 (1,6)
Pneumoni
2 (1,6)
Urinvägsinfektion
2 (1,6)
Sårinfektion
2 (1,6)
Hypestesi vid incisionsstället
3 (2,4)
Smärta vid incisionsstället
4 (3,2)
Periorbital blödning
3 (2,4)
Postoperativt ödem
2 (1,6)
Pseudomeningocele
9 (7,3)
Serom
3 (2,4)
Subduralt hematom
3 (2,4)
Såröppning
2 (1,6)
Atoni
2 (1,6)
Afasi
4 (3,2)
Balansrubbning
2 (1,6)
Konvulsion
5 (4,0)
Sjukdomar i multipla kranialnerver
2 (1,6)
Yrsel
7 (5,6)
Embolisk stroke
2 (1,6)
Huvudvärk
14 (11,3)
Pares
2 (1,6)
Hypestesi
4 (3,2)
Hypoglossal nervskada
2 (1,6)
Försämrat minne
2 (1,6)
Nystagmus
3 (2,4)
Parestesi
5 (4,0)
Känselbortfall
3 (2,4)
Tremor
2 (1,6)
Facialispares
3 (2,4)
Stämbandspares
2 (1,6)
Atelektas
2 (1,6)
Andningssvikt
2 (1,6)
Alopeci
2 (1,6)
Utslag
2 (1,6)
Ansiktssvullnad
4 (3,2)
Klinisk information
En prospektiv, randomiserad, kontrollerad, pivotal, klinisk multicenterstudie har utförts för att utvärdera
användningen av Adherus tätningsmedel, utplacerat med Adherus AutoSpray applikator, som ett tillägg till
standardmetoderna vid dural reparation, såsom suturer, för att åstadkomma en vattentät förslutning vid kraniell
kirurgi. Den här studiens primära målsättning var en sammansatt utvärdering av säkerheten och effektiviteten hos
Adherus AutoSpray-tätningsmedel (n = 124 patienter) jämfört med den aktiva kontrollgruppen (n = 126 patienter).
Resultaten av den primära målsättningen baserades på antalet patienter som inte hade något intraoperativt läckage
av cerebrospinalvätska från dural reparation efter upp till två applikationer av tätningsmedel under Valsalvas
 Loading...
Loading...