Page 1

ben utzerhandbuch
Deutsch
Hoefer TE42 und TE62
Übertragen Elektrophoresekammern
b TE42-IM/German/Rev.G0/07-12
Page 2

Inhalt
Wichtige Informationen ..........................................ii
Elektro-und Elektronikgerätegesetz (ElektroG) .........vii
Transfer-Elektrophorese-Einheit Funktion und
Beschreibung ........................................................1
Technische Daten ..................................................2
Bedienungsanleitung .............................................4
Pflege und Wartung .............................................12
Netzenergiemodul ................................................13
Fehlerbehebung ...................................................15
Elektrotransfer Noten ...........................................17
Bibliographie .......................................................24
Bestellinformationen ............................................ 26
pi
•
Page 3

Wichtige Informationen – Deutsch
• Wenn diese Ausrüstung gewissermaßen nicht
angegeben durch Hoefer, Inc. verwendet wird,
kann der durch die Ausrüstung zur Verfügung
gestellte Schutz verschlechtert werden.
• Dieses Instrument wird für den Innenlaborgebrauch nur dafür entworfen.
• Nur Zusätze und Teile genehmigten oder lieferten
durch Hoefer, Inc. kann für das Funktionieren, das
Aufrechterhalten, und die Wartung dieses Produktes verwendet werden.
• Verwenden Sie nur eine Energieversorgung,
die CE gekennzeichnet oder durch ein national
anerkanntes Probelaboratorium bescheinigte
Sicherheit ist.
• Der Sicherheitsdeckel muss im Platz vor dem
Anschließen der Energieversorgung sein führt zu
einer Energieversorgung.
• Alle Energieversorgungssteuerungen abdrehen
und die Macht trennen führt vor dem Entfernen
des Sicherheitsdeckels.
• Nur Wasser oder 50/50 Glykol des Wassers/
Äthylens durch den Wärmeaustauscher, wenn so
ausgestattet, in Umlauf setzen. Verbinden Sie den
Wärmeaustauscher mit einem Wasserklaps oder
jeder Kühlmittel-Quelle nicht, wo der Wasserdruck
ungeregelt wird.
• Führen Sie nie Frostschutzmittel oder jedes
organische Lösungsmittel in jeden Teil des Instrumentes ein. Organische Lösungsmittel werden
nicht wiedergutzumachenden Schaden der Einheit
verursachen!
• Mit Puffertemperaturen über angegebenen
technischen Spezifizierungen des Maximums
nicht funktionieren. Die Überhitzung wird nicht
wiedergutzumachenden Schaden der Einheit
verursachen!
Duležité Informace – Czech
• Pokud by toto zařízení je použito způsobem, který
není podle Hoefer, Inc. ochrana poskytovaná na
základě zařízení může být narušena.
• Tento nástroj je určen pro vnitřní použití v
laboratoři pouze.
• Pouze příslušenství a části schválen, nebo poskyt-
nutých Hoefer, Inc. mohou být použity pro provoz,
údržbu, a údržbě tohoto výrobku.
• zdroj napájení používají jen že je opatřen
označením CE osvědčena nebo bezpečnost
vnitrostátně uznanými zkušebními laboratoř.
• Bezpečnosti lid musí být zavedena před připojením
napájecí zdroj napájení vede k.
• Turn veškeré napájení kontroly vypnuto a odpojit
před odběrem energie vede bezpečnostní víko.
• Rozeslat pouze voda nebo 50/50 voda/ethylenglykolu prostřednictvím výměník tepla je li to vybavena. Nemají připojení výměník tepla s vodními
setřepná nebo jakékoli chladicí kapaliny zdroje, kde
tlak vody je neregulo.
• Nikdy zavést prostředek proti zamrznutí nebo
jakákoli organická rozpouštědla do jakékoli části z
tohoto nástroje. Rozpustidlům způsobí nenapravitelné poškození jednotka!
• Nejsou provozována s pufru teplotách nad
maximální stanovenou technickými specifikacemi. Přehřátí způsobí nenapravitelné poškození
jednotka!
Vigtig Information – Danish
• Hvis dette udstyr bruges i en måde ikke specificeret ved Hoefer, Inc. den beskyttelse, som er blevet
forsynet af udstyret kan måske svækkes.
• Dette instrument er designet for indendørs laboratoriumbrug bare.
• Bare tilbehør og del godkendede eller forsynede
ved Hoefer, Inc. kan måske bruges for drive, funktionsfejl, og betjening dette produkt.
• bruger Bare en strømforsyning, der er CE
markerede eller sikkerhed, som er blevet attesteret
af en, som nationalt er blevet anerkendt prøve
laboratorium.
• Sikkerhedlåget må være på plads før forbinding
strømforsyningsblyet til en strømforsyning.
• Drejer alle strømforsyningskontroller af og afbryder
kraftblyet før fjerning sikkerhedlåget.
• Cirkulerer bare vand eller 50/50 vand/ethylene
glykol gennem varmeveksleren i så fald udrustet.
Forbind ikke varmeveksleren til en vandhane
eller nogen kølemiddelkilde hvor vandtrykket er
unregulated.
pii
•
Page 4

• Introducerer Aldrig antifreeze eller noget organisk
opløsningsmiddel ind i nogen del af instrumentet.
Organiske opløsningsmidler vil forårsage uboelig
skade til enheden!
• Driver ikke med stødpudetemperaturer over
maksimummet specificerede tekniske specifications. Overheding vil forårsage uboelig skade til
enheden!
Belangrijke Informatie – Dutch
• Indien deze uitrusting in een manier wordt
gebruikt die niet door Hoefer, Inc. is gespecificeerd
de bescherming die door de uitrusting is verzorgd
kan worden geschaad.
• Dit instrument is voor binnenlaboratoriumgebruik
enkel ontworpen.
• Enkel onderdelen en delen keurden goed of
leverden door Hoefer, Inc. kan voor het bedienen
worden gebruikt, handhavend en onderhouden
van dit product.
• gebruik Enkel een netvoeding die CE is markeerde
of veiligheid die door een is gecertificeerd die
nationaal is herkend testene laboratorium.
• Het veiligheidsdeksel moet in plaats voor het
verbinden van de netvoeding leidt tot een
netvoeding zijn.
• Doe alle netvoedingscontroles Uit en koppel los
de machtleiding voor het verwijderen van het
veiligheidsdeksel.
• Circuleer enkel water of 50/50 water/ethyleenglycol door de hitte exchanger zo ja uitrust.
Verbind de hitte exchanger naar een waterkraan
of koelmiddelbron niet waar de waterdruk niet
geregulariseerd is.
• Stel Nooit antivriesmiddel of organische oplosmiddelen in deel van het instrument voor. Organische
oplosmiddelen zullen onherstelbare schade aan de
eenheid veroorzaken!
• Bedien niet met buffertemperaturen boven het
maximum specificeerde technische specificaties.
Oververhittend zal onherstelbare schade aan de
eenheid veroorzaken!
Important Information – English
• If this equipment is used in a manner not specified by Hoefer, Inc. the protection provided by the
equipment may be impaired.
• This instrument is designed for indoor laboratory
use only.
• Only accessories and parts approved or supplied
by Hoefer, Inc. may be used for operating, maintaining, and servicing this product.
• Only use a power supply that is CE marked or
safety certified by a nationally recognized testing
laboratory.
• The safety lid must be in place before connecting
the power supply leads to a power supply.
• Turn all power supply controls off and disconnect
the power leads before removing the safety lid.
• Circulate only water or 50/50 water/ethylene glycol
through the heat exchanger if so equipped. Do
not connect the heat exchanger to a water tap or
any coolant source where the water pressure is
unregulated.
• Never introduce antifreeze or any organic solvent
into any part of the instrument. Organic solvents
will cause irreparable damage to the unit!
• Do not operate with buffer temperatures above
the maximum specified technical specifications.
Overheating will cause irreparable damage to
theunit!
Tärkeää Tietoa – Finnish
• Jos tätä varusteita käytetään tavassa ei määritetty
Hoefer, Inc. suojelu ehkäisty varusteille saattaa olla
avuton.
• Tämä väline suunnitellaan sisälaboratoriokäytölle
vain.
• Vain lisävarusteet ja osat hyväksyivät tai toimitti
Hoefer, Inc. oheen ää voi käyttää käyttämiselle,
valvoalle, ja servicing tämä tuote.
• Vain käyttää käyttöjännitettä joka on CE merkitsi
tai turvallisuus joka on todistanut aidoksi ohi joka
on kansallisesti tunnustettnut testaaminen laboratoriota.
• Turvallisuuskansi täytyy olla paikallaan ennen
yhdistäminen käyttöjännitelyijyjä käyttöjännitteeseen.
piii
•
Page 5

• Kiertää kaikki käyttöjännitevalvonnat ja irrottaa
valtalyijyt ennen poistaminen turvallisuuskantta.
• Kiertää vain vesi tai 50/50 vesi/ethyleneä glycol
siinä tapauksessa varustetun lämmönvaihtimen
läpi. Älä yhdistä lämmönvaihdinta vesinapautukseen eikä jäähdytysnestelähteeseen, missä vesipaine on unregulated.
• Pakkasneste eikä orgaaninen liuotin välineen
osassa ei esitele Koskaan. Orgaaniset liuottimet
aiheuttavat korvaamattoman vahingon yksikköön!
• Ei käytä puskuria yllä olevia lämpötiloja enintään
määritetyillä teknisillä täsmennyksillä. Ylikuumeneminen aiheuttaa korvaamattoman vahingon
yksikköön!
Information Importante – French
• Si cet équipement est utilisé dans une manière pas
spécifié par Hoefer, Inc. la protection fourni par
l’équipement pourrait être diminuée.
• Cet instrument est conçu pour l’usage de laboratoire intérieur seulement.
• Seulement les accessoires et les parties ont
approuvé ou ont fourni par Hoefer, Inc. pourrait
être utilisé pour fonctionner, maintenir, et entretenir ce produit.
• utilise Seulement une alimentation qui est CET a
marqué ou la sécurité certifié par un nationalement reconnu essayant le laboratoire.
• Le couvercle de sécurité doit être à sa place avant
connecter l’alimentation mene à une alimentation.
• Tourner tous contrôles d’alimentation de et
débrancher les avances de pouvoir avant enlever le
couvercle de sécurité.
• Circuler seulement de l’eau ou 50/50 glycol d’eau/
éthylène par l’exchanger de chaleur si si équipé. Ne
pas connecter l’exchanger de chaleur à un robinet
d’eau ou à la source d’agent de refroidissement où
la pression d’eau est non régulée.
• Ne Jamais introduire d’antigel ou du dissolvant
organique dans n’importe quelle partie de
l’instrument. Les dissolvants organiques causeront
des dommages irréparables à l’unité!
• Ne pas fonctionner avec les températures de
tampon au-dessus du maximum a spécifié des
spécifications techniques. La surchauffe causera
des dommages irréparables à l’unité !
Informazioni Importanti – Italian
• Se quest’apparecchiatura è usata in un modo
specificato da Hoefer, Inc. la protezione fornito
dall’apparecchiatura potrebbe essere indebolita.
• Questo strumento è disegnato per l’uso di laboratorio interno solo.
• Solo gli accessori e le parti hanno approvato o
hanno fornito da Hoefer, Inc. potrebbe essere
usato per operare, per mantenere, e per revisionare
questo prodotto.
• usa Solo un alimentatore che è CE ha marcato o la
sicurezza certificato da un nazionalmente riconosciuto testando il laboratorio.
• Il coperchio di sicurezza deve essere nel luogo
prima di collegare i piombi di alimentatore a un
alimentatore.
• Spegne tutto i controlli di alimentatore e disinserisce i piombi di potere prima di togliere il coperchio di sicurezza.
• Circola solo l’acqua o 50/50 glicole di acqua/etilene
attraverso lo scambiatore di calore se così equipaggiato. Non collegare lo scambiatore di calore a un
rubinetto di acqua o qualunque fonte di refrigerante dove la pressione di acqua è sregolata.
• Non introduce mai l’antigelo o qualunque solvente
organico in qualunque parte dello strumento. I
solventi organici causeranno il danno irreparabile
all’unità!
• Non opera con le temperature di tampone al di
sopra del massimo ha specificato le descrizioni
tecniche. Il surriscaldamento causerà il danno
irreparabile all’unità!
Viktig Informasjon – Norwegian
• Hvis dette utstyret blir brukt i en måte ikke spesifisert ved Hoefer, Inc. beskyttelsen som ha blitt git
av utstyret kan bli svekket.
• Dette instrumentet er utformet for innendørs laboratoriumbruk bare.
• Bare tilbehør og deler godkjente eller forsynte ved
Hoefer, Inc. kan bli brukt for drive, vedlikeholde, og
betjene dette produktet.
• bruker Bare en kraftforsyning som er CE merket
eller sikkerhet som ha blitt sertifisert av et som
nasjonalt ha blitt anerkjent prøver laboratorium.
piv
•
Page 6

• Sikkerheten lokket må være på plass før forbinding
kraftforsyningene blyene til en kraftforsyning.
• Vender all kraftforsyningsstyring av og frakopler
kreftene blyene før fjerning sikkerheten lokket.
• Sirkulerer bare vann eller 50/50 vann/ethylene
glykol gjennom oppvarmingen veksleren i så fall
utstyrer. Ikke forbind oppvarmingen veksleren
til en vanntapp eller noe kjølemiddelkilde hvor
vannet trykket er unregulated.
• Introduserer Aldri antifreeze eller noe organisk
løsemiddel inn i noe del av instrumentet. Organiske løsemiddler vil forårsake irreparabel skade på
enheten !
• Driver med buffertemperaturer over maksimum
ikke spesifiserte teknisk spesifikasjoner. Å overoppheting vil forårsake irreparabel skade på enheten !
Wazne Informacje – Polish
• Jeżeli ten sprzęt jest wykorz ystywany w sposób nie
określone przez Hoefer, Inc. do ochrony przewidzianej przez urządzenie może zostać obniżony.
• Instrument ten jest przeznaczony do użytku w
laboratoriach kryty tylko.
• Tylko akcesoriów i części zatwierdzone lub dostarczone przez Hoefer, Inc. mogą być wykorzystane do
eksploatacji, utrzymania i obsługi tego produktu.
• korzystać jedynie zasilacza że jest noszące oznakowanie CE lub bezpieczeństwa uwierzytelnione
przez uznane na poziomie krajowym laboratorium
badawcze.
• Bezpieczeństwo lid musi być w miejsce przed
podłączeniem zasilania prowadzi do zasilania.
• Zaś wszystkie źródła zasilania urządzenia sterujące
off i odłączyć moc prowadzi przed odbiorem
bezpieczeństwa lid.
• Krążą tylko wody lub wody 50/50/ethylene glycol
wymiennik ciepła poprzez jeśli tak wyposażone.
Nie należy połączyć wymiennik ciepła woda z
kranu lub jakimkolwiek chłodziwo źródła, jeżeli
ciśnienie wody jest nieuregulowanych.
• Nigdy nie wprowadzać rozpuszczalnika organicznego przeciw zamarzaniu lub jakichkolwiek
na dowolną część dokumentu. Rozpuszczalniki
organiczne spowoduje nieodwracalne szkody dla
jednostki!
• Nie działają w buforze temperatury powyżej
maksymalnego określone specyfikacje techniczne.
Przegrzania spowoduje nieodwracalne szkody dla
jednostki!
Informações Importantes –
Portuguese
• Se este equipamento é usado numa maneira não
especificada por Hoefer, Inc. que a protecção fornecida pelo equipamento pode ser comprometida.
• Este instrumento é projectado para uso de interior
de laboratório só.
• Só acessórios e partes aprovaram ou forneceu por
Hoefer, Inc. pode ser usada para operar, manter, e
servicing este produto.
• Só usa um estoque de poder que é CE marcou ou
segurança registrada por um nacionalmente reconhecido testando laboratório.
• A tampa de segurança deve estar em lugar antes
de ligar o estoque de poder leva a um estoque de
poder.
• Desliga todos controlos de estoque de poder e
desconecta os chumbos de poder antes de retirar a
tampa de segurança.
• Circulam só água ou 50/50 glicol de água/ethylene
pelo exchanger de calor se for assim equiparam.
Não ligue o exchanger de calor a uma torneira de
água nem qualquer fonte de refrigerante onde a
pressão de água é não regulado.
• Nunca introduz anticongelante nem qualquer
orgânico solvente em qualquer parte do instrumento. Orgânico solvente causará agressão
irreparável à unidade!
• Não opera com temperaturas de buffer acima do
máximo especificou especificações técnicas. Superaquecer causará agressão irreparável à unidade!
Información Importante – Spanish
• Si este equipo es utilizado en una manera no especificado por Hoefer, Inc. la protección proporcionado por el equipo puede ser dañada.
• Este instrumento es diseñado para el uso interior
del laboratorio sólo.
• Sólo accesorios y partes aprobaron o suministraron
pv
•
Page 7

por Hoefer, Inc. puede ser utilizado para operar,
para mantener, y para atender a este producto.
• Sólo utiliza una alimentación que es CE marcó o
la seguridad certificada por un nacionalmente
reconocido probando el laboratorio.
• La tapa de la seguridad debe estar en el lugar
antes de conectar la alimentación lleva a una
alimentación.
• Apaga todos controles de alimentación y desconecta los plomos del poder antes de quitar la tapa
de la seguridad.
• Circula sólo agua o 50/50 glicol de agua/etileno
por el intercambiador de calor si ése es el caso
equiparon. No conecte el intercambiador de calor a
un toque de la agua ni cualquier fuente del líquido
refrigerante donde la presión del agua está libre.
• Nunca introduce anticongelante ni algún solvente
orgánico en cualquier parte del instrumento. Los
solventes orgánicos causarán daño irreparable a
la unidad!
• No opera con temperaturas de búfer encima del
máximo especificó especificaciones técnicas. Recalentar causará daño irreparable a la unidad!
Viktig Information – Swedish
• om denna utrustning används i ett sätt som inte
har specificeras av Hoefer, Inc. skyddet tillhandahöll vid utrustningen kan skadas.
• Detta instrument formges för inomhuslaboratorium användning bara.
• Bara medhjälpare och delar godkände eller levererade vid Hoefer, Inc. kan användas för fungera,
underhålla, och servicing denna produkt.
• använder bara en kraft tillgång som är CE
markerade eller säkerhet intygade vid en nationellt
erkänd testande laboratorium.
• Säkerheten locket måste vara på platsen före
koppla kraften tillgången blyen till en kraft tillgång.
• Vänder sig alla kraft tillgång kontroller av och
kopplar bort kraften blyen före flytta säkerheten
locket.
• Cirkulerar bara vatten eller 50/50 vatten/ethylene
glycol genom värmen exchanger i så utrustad fall.
Inte kopplar värmen exchanger till en vatten kran
eller något kylmedel källa där vattnet trycket är
unregulated.
• Inför aldrig kylvätska eller något organiska
lösningsmedel in i någon del av instrumentet.
Organiskt lösningsmedel ska orsaka irreparable
skada till enheten!
• Använd inte med buffert temperaturer över
det högsta angivna tekniska specifikationerna.
Överhettning skulle orsaka irreparabla skador på
enheten!
pvi
•
Page 8

Elektro-und Elektronikgerätegesetz (ElektroG)
Deutsch
English
French
Italian
Spanish
Dieses Symbol kennzeichnet elektrische und elektronische
Geräte, die nicht mit dem gewöhnlichen, unsortierten Hausmüll entsorgt werden dürfen, sondern separat behandelt
werden müssen. Bitte nehmen Sie Kontakt mit einem autorisierten Beauftragten des Herstellers auf, um Informationen
hinsichtlich der Entsorgung Ihres Gerätes zu erhalten.
This symbol indicates that the waste of electrical and electronic equipment must not be disposed as unsorted municipal
waste and must be collected separately. Please contact an
authorized representative of the manufacturer for information
concerning the decommissioning of your equipment.
Ce symbole indique que les déchets relatifs à l’équipement
électrique et électronique ne doivent pas être jetés comme les
ordures ménagères non-triées et doivent être collectés séparément. Contactez un représentant agréé du fabricant pour obtenir des informations sur la mise au rebut de votre équipement.
Questo simbolo indica che i rifiuti derivanti da apparecchiature elettriche ed elettroniche non devono essere smaltiti
come rifiuti municipali indifferenziati e devono invece essere
raccolti separatamente. Per informazioni relative alle modalità
di smantellamento delle apparecchiature fuori uso, contattare
un rappresentante autorizzato del fabbricante.
Este símbolo indica que el equipo eléctrico y electrónico no
debe tirarse con los desechos domésticos y debe tratarse por
separado. Contacte con el representante local del fabricante
para obtener más información sobre la forma de desechar
el equipo.
Swedish
Denna symbol anger att elektriska och elektroniska utrustningar
inte får avyttras som osorterat hushållsavfall och måste samlas
in separat. Var god kontakta en auktoriserad tillverkarrepresentant för information angående avyttring av utrustningen.
pvii
•
Page 9

Transfer-Elektrophorese-Einheit Funktion und Beschreibung
Die Hoefer® TE42 und TE62 Übertragungseinheiten schnell zu übertragen Proteine, DNA,
RNA oder von bis zu vier Polyacrylamid oder
Agarose-Gelen auf eine Membran. Gele und
Membranen in einer Kassette montiert und
eingetaucht in einen Behälter mit Transfer-Puffer
gefüllt. Die Elektroden in dem Tank zu einer
externen Stromversorgung verbunden ist.
Die TE62 enthält einen Wärmetauscher in
der Basis. Der Puffer wird von der Kühlmittel
durch eine wärmeleitende Aluminiumoxidplatte
getrennt. Die TE42 nicht mit einem Puffer Kühlsystem ausgestattet. Wenn die Kühlung benötigt
wird, kann ein elektronischer Wärmetauscher
separat bestellt werden.
Transphor Modelle und Funktionen
Einbau-Wärmetauscher Kompatibel mit
zum Kühlen externem Netzteil
TE42 3
TE62 3 3
Auspacken
Packen Sie alle Pakete sorgfältig und vergleichen
Inhalt mit der Packliste oder Bestellinformationen, machen, dass sich alle angekommen. Wenn
ein Teil fehlt, Inspect Kontakt Hoefer, Inc. Alle
Bauteile auf Beschädigung, die aufgetreten sind,
während das Gerät war auf der Durchreise
haben mag. Sollte eines der Teile beschädigt ist,
setzen sofort den Spediteur. Achten Sie darauf,
das gesamte Verpackungsmaterial für Schadensersatzansprüche oder für Umpacken behalten
sollte es notwendig, das Gerät zurückgeben
zu werden.
p1
•
Page 10

Technische Daten
Alle Tank-Modelle: TE42 TE62 und
Gelgröße bis zu vier
15 × 21 cm Gele oder
bis zu sechzehn
7 × 10 cm Mini-Gele
Max. Wattleistung 200 W
Max. Spannung 100 V
Max. Stromstärke 2 A
Max. Temperatur 45 °C
Puffer erforderlich 4-5 Liter, abhängig
von der Anzahl von
Kassetten anstelle
Umgebungsbedingungen
für den Betrieb:
Verwendung im Innenbereich 4-40 °C
Luftfeuchtigkeit bis zu 80%
Höhe bis zu 2000 m
Installationskategorie II
Verschmutzungsgrad 2
Abmessungen TE42:
(B × T × H) 28 × 13 × 30,5 cm
TE62:
28 × 16,5 × 32 cm
Produkt-Zertifizierungen EN61010–1,
UL3101–1, CSA
C22.2 1010.1, CE
Diese Konformitätserklärung gilt nur für das Instrument,
wenn es:
• in Labor-Standorten eingesetzt werden,
• verwendet wie geliefert von Hoefer, Inc. mit
Ausnahme von Änderungen in der Bedienungsanleitung beschrieben, und
• verbunden zu anderen CE-markierte Instrumente
oder Produkte zu empfehlen oder von Hoefer, Inc.
genehmigt.
p2
•
Page 11
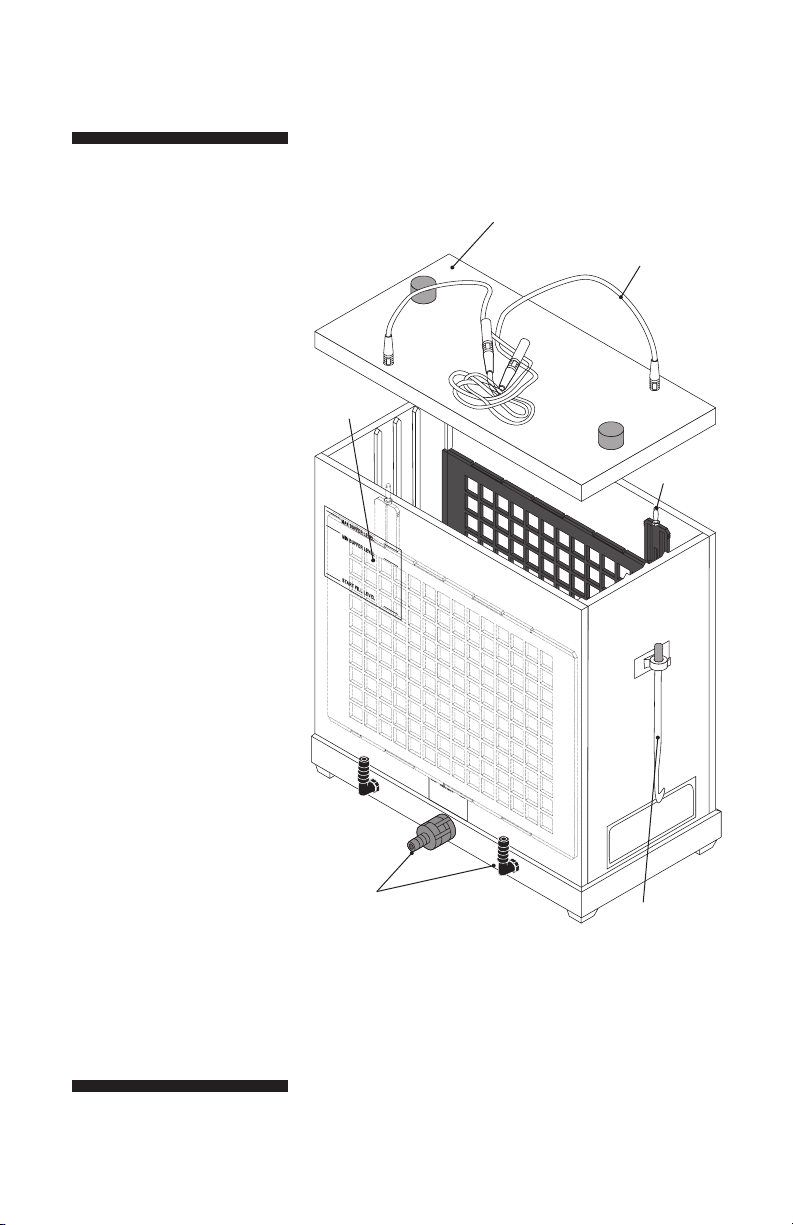
Abb. 1. Transphor
Hauptkomponenten.
Eingeschlossen, aber nicht
abgebildet:
TE42:
Gelkassetten (2)
Schaumstoff-Schwämme,
6 mm dick (2)
Schaumstoff-Schwämme,
3 mm dick (4)
Löschpapier, Bleche (25)
TE62:
Gelkassetten (4)
Schaumstoff-Schwämme,
6 mm dick (4)
Schaumstoff-Schwämme,
3 mm dick (8)
Löschpapier, Bleche (25)
TE42 TE62
und Deckel
farbcodierten
Leitungen
Tank-Füllstände
farbcodierten
Elektrodenplatten (2)
Hinweis: Eine versenkbare
Wärmetauscher (Chiffre Nr.
TE47) kann separat für die
TE42 bestellt werden.
TE62: Kühlmittel
Sicherheitsventil und
Kühlmittel-Anschlüsse (2)
Kassette Haken
und Halter
p3
•
Page 12

Hinweis: Lesen Sie den Abschnitt
Hinweise Elektrotransfer für eine
Diskussion über Membranen
und Puffer.
Bedienungsanleitung
Durchführen der Übertragung so bald wie
möglich nach der Elektrophorese auf Band
Diffusion zu minimieren. Jeder Schritt wird
nachstehend beschrieben.
Bereiten Sie den Puffer
Bereiten Sie ein Minimum von 5 Liter des
entsprechenden Transfer-Puffer. Kühlen Sie den
Puffer vor der Verwendung, wenn möglich.
Bereiten Sie die Einheit
1
Spülen Sie den Tank Transfer und Kassetten mit
destilliertem Wasser.
Hinweis: Für die schnelle und
einfache Verbindungen, installieren Quick-fit-Koppler mit Ventile
Armaturen in der Leitung.
2
Aktive Kühlung ist optional, aber dringend empfohlen.
Wenn keine aktive Kühlung verwendet werden soll,
mit Schritt 3 fortfahren.
Hinweis: Schließen Sie den Wärmetauscher an ein
Thermostatenbad wie die RCB20-PLUS.
Circulate nur Wasser oder 50/50 Wasser/Ethylenglykol,
um Schäden am Gerät zu verhindern.
Die Umwälzpumpe darf nicht erzeugen einen Druck
von mehr als 0,7 bar (10 psi) über dem atmosphärischen Druck.
Stellen Sie die Temperatur auf 10 °C oder höher, wenn
nur Wasser zirkuliert. Bei Verwendung von 50/50
Ethylenglykol/Wasser kann die Temperatur niedriger
eingestellt werden.
Starten Sie den Thermostatenbad zur gleichen Zeit
wie die Übertragung.
p4
•
Page 13

Hinweis: Das Entlastungsventil
öffnet, wenn der Druck in dem
Wärmetauscher über 0,7 bar (10
psi) über Atmosphärendruck.
Hinweis: Für schnelle und einfache
Verbindungen, installieren
Schnellkupplungsbrenner Armaturen mit Ventilen.
Hinweis: Auch wenn keine Kühlung
für Ihr System erforderlich ist,
sollte der Puffer mit einem Rührer,
um Puffer Verarmung an den Elektroden zu vermeiden weiterverbreitet werden.
TE42
Senken Sie den Wärmetauscher (getrennt bestellt,
oder verwenden Sie den Wärmetauscher mit dem
Hoefer SE600-Gel-Elektrophorese-Einheit geliefert,
sofern Sie eine haben) in die untere Kammer, der
Montage der Häfen in die Aussparungen in der Felge.
Bereiten Sie zwei Längen von 10-12 mm i.d. Vinyloder Silikonschlauch für den Kühlkreislauf und fahren
Sie mit “Befestigen Sie Schlauch” weiter unten.
TE62
Zuerst befestigen Sie das Rohr mit dem roten Überdruckventil zwischen dem Wasser-Einlass-und Auslasskanäle und einfügen
das freie Ende in das Bad oder einem anderen
Behälter oder Drain jede Druckentlastung Überlauf
zu fangen. Bereiten Sie zwei Längen von 9 mm
Vinyl-oder Silikonschlauch und sehen “Befestigen
Sie Schlauch” unten für weitere Anweisungen zum
Einsetzen es zu den Häfen des Wärmetauschers in der
Unterseite des Geräts.
Befestigen Sie Schlauch
Schieben Sie Schlauchklemmen (4 insgesamt) auf
jedem Ende zwei Längen von Schläuchen. Befestigen Sie ein Ende jedes Stück Schlauch mit einem
Wärmetauscher-Port. Befestigen der freien Enden
jedes der Schlauchstrecke auf den Thermostatenbad Ports, ein mit dem Einlass und der andere mit
dem Auslaß. Sichern Sie die Verbindungen mit
den Schlauchschellen.
3
Ort (nicht fallen) ein Magnetrührstab im Pufferspeicher. (Drop von Objekten auf der AluminiumoxidPlatte in der TE62 kann dazu führen, die Platte
zu knacken.) Stellen Sie das Gerät auf einen
Magnetrührer. Füllen Sie übertragen Puffer auf die
“Start Füllstand”-Zeile. (Dies erfordert etwa 3,8
Liter.) Stellen Sie den Rührer auf Low-Medium, das
Puffer-Kreislauf erzeugt, ohne dass durch Puffer
montiert Kassetten.
•
p5
Page 14

Bauen Sie die Übertragung Kassette
Hinweis: Tragen Sie immer
Handschuhe beim Umgang mit
Membranen zu vermeiden Sie
Fingerabdrücke auf ihnen.
Wichtig! Seien Sie besonders
vorsichtig bei der Entfernung aller
Luftblasen bei jedem Schritt, weil
das Vorhandensein von Luftblasen,
vor allem zwischen der Membran
und Gel, Blöcke übertragen.
1
Vornässen Nitrocellulose oder Nylon-Membranen mit
destilliertem Wasser. Vornässen PVDF oder andere
hydrophobe Membranen in Methanol. Dann genießen
alle Arten Membran in Transferpuffer für 2-5 Minuten.
2
Öffnen Sie die Kassette durch die Freigabe sowohl
Latch Register an der Kante gegenüber den Scharnieren. Legen Sie die Kassette geöffnet in eine Schale
mit mindestens 3 cm von Transfer-Puffer gefüllt.
3
Montieren Sie den Transfer-Stack, so dass Moleküle
in Richtung der Membran wandern wird. Für negativ
geladene Makromoleküle (z. B. Nukleinsäuren und die
meisten Proteine), Aufbau der Stapel auf dem grauen
Hälfte der Kassette (und später den Deckel zu positionieren, damit der graue Seitenflächen die rote Leitung
oder Anode (+).
Setzen Sie eine 3 mm dickem Schaumstoff Schwamm
auf der Kassette geöffnet getaucht und leicht
andrücken, bis die Luft ausgestoßen wird. Legen Sie
ein Blatt Löschpapier auf den Schwamm, und legen
Sie dann die Membran auf dem Löschpapier. Platzieren Sie das Gel-welche enthält ein Beispiel, wurde
elektrophoretisch getrennt hat und ins Gleichgewicht
gebracht (falls erforderlich) mit Transfer-Puffer-auf der
Membran. Sanft rollen eine Glaspipette oder Reagenzglas über das Gel, um eingeschlossene Luft zwischen
der Membran und Gel zu vertreiben. Decken Sie
das Gel mit einem Blatt Löschpapier und legen Sie
dann einen Schwamm von der richtigen Dicke (siehe
Diagramm unten), wieder mit leichtem Druck, um
eingeschlossene Luft zu vertreiben.
p6
•
Page 15

Abb. 2. Übertragen Stack Montage.
Der Stapel ist so ausgerichtet,
dass negativ geladene Moleküle
in Richtung der grauen Anode (+)
migrieren.
Wichtig! Nicht overstuff die
Kassette.
Hinweis: Versuchen Sie, das Gel
richtig zum ersten Mal statt, weil
Proteine können sofort anfangen,
zu übertragen; einmal Übertragung
begonnen hat, bewegt sich das Gel
werden die Ergebnisse verfälschen
oder zu “fliegenden Schatten” auf
dem Blot.
4
Schließen Sie das Kassettenfach und drücken Sie
leicht auf die Tabs zu sperren. Die zusammengebauten Kassette sollte das Gel in festem Kontakt mit
der Membran ohne Quetschen des Gels zu halten.
Wenn der Stapel loser scheint, fügen Blatt Löschpapier, wenn der Stack scheint eng, ersetzen Sie die
Top-Schwamm (über das Gel) mit einem Blatt Löschpapier. Wenn Sie die untere Schwamm (unterhalb der
Gel) zu entfernen, ersetzen Sie mindestens zwei Blätter Löschpapier auf Raum zwischen der Membran und
der Kassette Panel zu erstellen.
ein 3 mm Schwamm für
Gele > 1,5 mm
-Oderein 6 mm Schwamm für
Gele ≤ 1,5 mm.
Löschpapier
Gel
Membran
Löschpapier
ein 3 mm Schwamm
Die Kassette Platten sind farblich markiert: schwarz (oben) =
Kathodenseite grau (unten) = Anodenseite.
Montieren Sie die Kassette in einem Fach mit Transfer-Puffer ca.
3 cm tief.
p7
•
Page 16

Installieren Sie die Kassette(n)
1
Der Tank fasst bis zu vier Kassetten, wenn die Übertragung nur ein oder zwei Gele, verwenden Sie die
Kassette Positionen am nächsten zum Zentrum.
(Dichtes Wärmetauscher, wenn in der TE42 verwendet, füllt die beiden mittleren Schlitzen, so dass nur
zwei Kassetten in den äußeren Schlitzen angeordnet
werden kann.)
Die Kassetten müssen so ausgerichtet sein, dass die
Scharniere nach oben zeigen und damit die schwarze
Seite jeder Kassette die schwarze Tafel Kathode zugewandt ist.
Arbeiten Sie schnell beim Bewegen der montierten
Kassette(n) in den Tank zu vermeiden, Trockenlegung der Schwämme: Zeigen Sie das Fach hält die
Kassette(n) in der Nähe des Tanks, heben Sie eine
Kassette in einer Zeit, und schieben Sie sie in eine
Reihe von vertikalen Schlitzen. Bewahren Sie die
Puffer in das Fach ein.
2
Einmal im Ort, tippen Sie auf jeder Kassette leicht
gedrückt, bis die meisten Luftblasen verdrängt werden.
(Ein paar kleine Blasen in den Schwämmen es
unwahrscheinlich, dass mit der Übertragung stören.)
3
Untersuchen Sie den Puffer Ebene. Hinzufügen oder
Entfernen-Puffer nach Bedarf, so dass die Ebene
zwischen den minimalen und maximalen Puffer-Ebene
Linien fällt. (Puffer über dem maximalen Niveau Puffer
Linie kann zu Korrosion der elektrischen Kontakte.)
Übertragen
Vorsicht bei der Ausrichtung alle Systemkomponenten so, dass das elektrische Feld angelegt
alle Arten bewirkt, auf die Membran wandern.
Die Migration Richtung hängt sowohl von den
Eigenschaften der Probe und der pH-Wert von
dem Übertragungspuffer. Wenn die Spezies von
Interesse negativ in dem Übertragungspuffer
p8
•
Page 17

berechnet und der Stapel zusammengebaut, so
dass die Membran am nächsten der grauen Seite
der Kassette ist, dann ist diese Seitenflächen die
Anode (+). Die meisten Proteine in Richtung
der Anode in der Towbin Tris/Glycin/MethanolPuffer-System (unabhängig von der Anwesenheit
von SDS) zu migrieren, und unter den meisten
Bedingungen Nukleinsäuren sind negativ geladen
und wandern in Richtung der Anode.
Wichtig! Erlauben Sie niemals die
Puffer Temperatur auf 45 °C überschreiten Übermäßige Hitze führt
dazu, das Gerät zu verziehen.
Die Kühlung wird dringend empfohlen. Jede
Einstellung dazu führt, dass mehr als 5 W
Leistung wird genug Wärme, um aktiv Wärme
erzeugen Steuerung erfordern. Ein Kältethermostat Bad sollte so eingestellt sein, um etwa 10 °C
abkühlen lassen (Bei Verwendung von 50/50
Ethylenglykol/Wasser kann die Temperatur
niedriger eingestellt werden.) Chill-Puffer vor
Gebrauch, wenn möglich.
Empfohlen Energieeinstellungen ändern. Die
meisten Überweisungen sind innerhalb einer
Stunde abgeschlossen, aber größere Moleküle
oder dickere Gele können längere Umsteigezeiten
erfordern; die optimale Transferzeit für jedes
System muss empirisch ermittelt werden. Transfers von links nach über Nacht laufen sollte, um
einen konstanten Strom Einstellung nicht mehr
als 0,1 A eingestellt werden
Typische Übergabeparameter
Parameter für Ihre Probe und Puffer-System muss
empirisch ermittelt werden.
Protein Nukleinsäuren
Puffer Towbin 1X TBE oder 1X TAE
Strom (A) 0,8-1,0 0,9-1,0
Spannung (V) 70-80 50
Transfer-Zeit ~1 Stunde ~1 Stunde
Kühlmitteltemperatur 10 °C 10 °C oder weniger
p9
•
Page 18

TE42 TE62 und
1
Installieren Sie den Sicherheitsdeckel
Die Kassetten und Platten Elektrode sind farblich
gekennzeichnet, um die Leitungen im Deckel passen:
Richten Sie den Deckel, so dass die graue Hälfte der
Kassetten und die graue Anode Panel Gesicht der
Anode (+) oder Mennige, und die schwarze Hälfte
der Kassetten und das schwarze Gesicht der Kathode
Panel Kathode (–), oder schwarze Leitung.
Hinweis: Die beiden roten Kappen
auf dem Deckel Platz für die
Bananenstecker auf dem SE600Modell versenkbar Wärmetauscher
(unabhängig von der Orientierung).
2
Benutzen Sie nur zugelassene Stromversorgung wie
das Hoefer PS2A200, PS200HC oder PS300B. Sicherstellen, dass die Stromversorgung ausgeschaltet
ist und alle Bedienelemente sind auf Null gesetzt.
Stecken Sie das rote Kabel in den roten Ausgang und
das schwarze Kabel in die schwarze Ausgangsbuchse.
In den meisten Systemen ist die rote Leitung die
Anode (+) und das schwarze Kabel ist die Kathode (–).
3
Stellen Sie die Stromversorgung
Konstantstrom-Modus wird empfohlen. Bei konstanter
Spannung ausgewählt wird, sorgfältig überwachen den
Strom (erhöhter Strom erhöht Joulesche Erwärmung).
Überschreitet der Strom 1 A, verringern Sie die Spannung. Falls vorhanden, stellen Sie die Stromversorgung Timer für nicht mehr als zwei Stunden.
•
p10
Page 19

Nachdem die Übertragung abgeschlossen ist
Hinweis: Es ist eine gute Idee,
um das Gel färben, um die Vollständigkeit der Übertragung zu
bestimmen.
Hinweis: Bewahren Sie keine
Puffer verwendet, mit Transfer
Tank. Chill-Puffer auf 10 °C vor
der Wiederverwendung.
1
Drehen Sie die Spannung und die aktuellen Einstellungen auf Null und schalten Sie die Stromversorgung. Klemmen Sie die Leitungen von den
Netzteil-Buchsen.
2
Heben Sie den Deckel. Verwenden Sie den KunststoffHaken (gespeichert in der Halterung an der Seite des
Gerätes) zu erheben, eine Kassette gerade weit genug,
um in der Lage, es zu packen und legen Sie sie in
eine Schale.
3
Öffnen Sie jede Kassette vorsichtig und entfernen Sie
die Gele und Membranen. Beschriften Sie jede Membran
und geben Sie die Probe Seite. Heben Membran(en) mit
stumpfen Pinzette und an der Luft trocknen, oder folgen
Sie den Anweisungen begleiten Ihr Protokoll.
4
Entsorgen Sie das Löschpapier, aber Wiederverwendung der Schwämme.
5
Spülen Sie das Gerät sofort nach Gebrauch. (Siehe den
Abschnitt Pflege und Wartung auf der nächsten Seite.)
•
p11
Page 20

* Verwenden Sie ≤ 20% Methanol
(Methylalkohol) in Transfer-Puffer
ist die einzige Ausnahme.
Pflege und Wartung
Reinigung
• Nicht autoklavieren oder zu erwärmen irgend-
einen Teil über 45 °C
• Nicht zu Alkoholen oder organischen Lösungs-
mitteln ausgesetzt werden!*
• Benutzen Sie niemals Scheuermittel.
• Bei der Verwendung von radioaktiven Reagen-
zien, dekontaminieren Sie das Gerät mit
einem Reinigungsmittel wie Contrad 70™ oder
Decon 90™.
Spülen Sie den Tank, Kassetten, Schwämme und
mit destilliertem Wasser nach jedem Gebrauch
sofort. Lassen Sie das Gerät an der Luft vollständig trocknen. In regelmäßigen Abständen
mit einer verdünnten Lösung von einem milden
Reinigungsmittel waschen.
Wenn Sie das Gerät reinigen, lassen Sie die
Elektrode Platten an Ort und Stelle. Wenn sie
eingeschaltet ist (nicht empfohlen) werden, sind
äußerst bemüht, nicht dehnen oder brechen den
Platindraht: ziehen Sie vorsichtig die Abdeckung
nach vorne, weit genug, um die Haltelippe
löschen (<5 mm). Mit einer Hand greifen die
Bananenstecker Unterstützung (nicht die Bananenstecker) und mit der anderen Hand ergreifen Sie die Platte an einer Stelle weit weg vom
Draht. Klappen Sie den Bildschirm aus.
•
p12
Page 21

Netzenergiemodul
Abb. 3. Die Stromversorgung
Modul basiert auf der Rückseite
befinden.
Wichtig! Sicherungen schützen
Geräte durch Abziehen Belastungen zu groß für des Instruments
Schaltungsdesign, so ist es unerlässlich, dass Sicherungen nur
durch Sicherungen mit der gleichen Bewertung ersetzt werden.
Das Netz-Modul, auf der Rückseite
des Deckels befindet sich die
Macht, enthält zwei Eingangssicherungen:
115 V~ Modell:
T 3A 250 V, 5 × 20 mm
230 V~ Modell:
T 1,6A 250 V, 5 × 20 mm
Schraubendreher
in diese Kerbe,
um die Abdeckung zu öffnen.
Den Schraubendreher Klinge hinter
dem Pfeil, um die
Kassette vollständig
heraus zu ziehen.
Netzschalter
Klappdeckel
1
Achtung: Schalten Sie die Netzspannung ausschalten
und nehmen Sie das Netzkabel, bevor Sie Eingangssicherungen!
2
Öffnen Sie das Sicherungsfach, indem Sie einen
kleinen flachen Schraubenzieher in den Schlitz an der
Spitze des Power-Moduls. Drehen Sie den Schraubendreher 1/8 Umdrehung, um die Abdeckung zu lösen,
ziehen Sie dann das Scharnier Fach, das sich öffnet.
3
Stecken Sie den Schraubendreher über dem Pfeil
auf eine Sicherung Kassette, fangen die Kassette
Ende, und langsam schieben Sie sie vollständig aus
dem Modul.
p13
•
Page 22

4
Ziehen Sie die Sicherung aus der Kassette und
zu inspizieren. Wenn die Sicherung Element wird
verbrannt oder beschädigt wird, ersetzen Sie die
Sicherung mit einem identischen Typs. Wenn die
Sicherung intakt zu sein scheint, überprüfen Sie es
mit einem Multimeter. (Ein Wert von 1 Ω oder weniger
zeigt die Sicherung ist noch brauchbar.)
5
Nach der Platzierung eine gute Sicherung in die
Kassette, schieben Sie sie in das Power-Modul, so
dass Sie sicher, dass der Pfeil auf der Kassette zeigt
nach rechts (in die gleiche Richtung wie die Führung
Pfeile auf der Innenseite des Fachs).
6
Wiederholen Sie die Schritte 3 bis 5 für die
zweite Kassette.
7
Schließen Sie die Sicherung abnehmen und
drücken Sie sie vorsichtig in das Power-Modul, bis
sie einrastet.
8
Schließen Sie das Netzkabel in das Gerät ein und
schalten Sie den Netzschalter auf.
•
p14
Page 23

Fehlerbehebung
Problem Lösung
Unvollständige Übertragung
Leere Bereiche auf Membran Entfernen Sie alle Lufteinschlüsse im Transfer-Stack Montage:
Reduzieren Sie die Rührgeschwindigkeit, um Turbulenzen zu verhindern.
Prozess nur ein Streifen oder eine Membran in den einzelnen Fächern
Verwenden Sie den Puffer mit einer geringeren Ionenstärke.
Prüfen Elektrode Kontinuität. Während der Übertragung wird ein
Wenn Kassetten gebeugt, wenn sie leer sind, zu ersetzen. Übersprit-
Gittermuster auf Membran Weitere Blätter Löschpapier auf den Abstand zwischen der Platte und
Moleküle wandern nicht Gel Erhöhen Sie die Feldstärke.
Steigern Transferperiode. (Versuchen Sie, zu verdoppeln.)
Verwenden Sie keine Färbung oder Fixiermittel auf das Gel vor
Verwenden Sie eine dünnere Gel.
Reduzieren Sie die Gel-Acrylamid-Konzentration.
Prüfen, dass der pH in der Nähe der pH-Wert bestimmt ist. Die meis-
Verwenden 3,5 mM SDS (0,1%) in den Übertragungspuffer.
Vermeiden einschließlich Methanol im Transferpuffer oder reduzieren
Verwenden Sie analysenreine Reagenzien.
Erhöhen Sie die Länge der Zeit Southern-Blots sind depurinated.
Erhöhung der Nettoladung auf dem Protein durch den Wechsel
Montage des Stapels, während es in Transferpuffer getaucht ist,
vorsichtig auf beide Schwamm drücken, wie es auf den Stapel hinzugefügt wird, und rollen eine Glaspipette oder Reagenzglas über der
Membran und Gel zu beseitigen alle Luftblasen.
oder Kassette zu Überschneidungen zu vermeiden.
steter Strom von Gas entlang der gesamten Länge der Elektroden
freigesetzt. Wenn sich Blasen nicht entlang der gesamten Länge der
Elektrode bilden kann, die Elektrode ersetzen.
zen die Kassette bewirkt, dass es zu beugen; sehen die empfohlenen
Montageanleitung auf Seite 6.
Kassette des Gels erhöhen. Achten Sie darauf, um die Kassette overstuff, sollte das Gel fest und gleichmäßig zwischen den Schwämmen
gehalten werden, aber nicht so dicht, dass sie gequetscht wird.
dem Transfer.
ten Puffer sollten nicht titriert werden, machen frischem Puffer.
Sie die Menge auf das absolute Minimum.
zu einer Transfer-Puffer mit einem anderen pH-Wert. Niedrigeren
pH-Wert (<6-7) erhöht die positive Ladung auf Proteine , höheren pH
(>6-7) erhöht die negative Ladung auf Proteine .
•
p15
Page 24

Problem Lösung
Diffuse Bandenmuster Übertragung sofort nach elektrophoretischer Trennung. Wenn Äquilib-
Wenn Transferpuffer enthält Methanol (≥ 10%), äquilibrieren Sie das
Achten Sie darauf, dass das Gel fest an der Membran gehalten und
Wenn eine übermäßige Erwärmung tritt während der Übertragung,
Prüfen, dass die bevorzugte Bindung Oberfläche der Membran (sofern
Ineffiziente Bindung an Membran
Chemische Parameter Fix oder Vernetzung des Moleküls auf die Membran nach den Anfor-
Bereiten Protein Transfer-Puffer ohne SDS.
Überprüfen Sie die optimale Menge Methanol für die Membran-Typ
Membranparameter Tragen Sie Handschuhe beim Umgang mit Membranen.
Shop Membranen bei Raumtemperatur ohne direkte Sonneneinstrah-
Verwenden Sie eine Membran mit einer kleineren Porengröße
Platz eine Membran sowohl über als auch unter dem Gel wenn der
Überprüfen Sie, ob zu viel Probe vorhanden ist für die Bindung
rierung vor der Übertragung, zu verkürzen oder zu beseitigen Gleichgewichtszeit oder bewegen Sie das Gel auf den kalten Raum während
der Äquilibrierung.
Gel in Transferpuffer für 30 Minuten, damit sie vor der Montage des
Stack schrumpfen. Hinweis: Da Methanol bewirkt, dass das Gel etwas
einlaufen, große Moleküle möglicherweise langsamer zu migrieren.
dass es nicht verrutscht einmal Kontakt hergestellt ist.
senken die Temperatur der Kühlflüssigkeit im Wärmeaustauscher.
vorhanden) in Kontakt mit dem Gel.
derungen der Nukleinsäure, ein Protein oder Membrantyp.
benötigt und überprüfen Sie die Pufferlösung. Zugabe von 10-20%
Methanol zu dem Übertragungspuffer zu verbessern Bindung an
Nitrocellulose.
lung zu halten, die Membranen aktiviert.
(0,10 bis 0,20 µm), wenn Proteine durch die Membran passieren,
oder verwenden Sie eine andere Art Membran.
Verdacht besteht ein Protein in der entgegengesetzten Richtung als
in der Mehrzahl der Proteine . Überprüfen Sie beide Membranen
für Protein(e).
Oberfläche, die durch die Anwendung von zwei Membranen anstelle
von einem. Beim Auftreten von “bis zu blasen”, reduzieren Sie die
Probe Last.
•
Weitere Hinweise zur Fehlerbehebung, zu beziehen
Bjerrum, O.J. et al. (1988).
p16
Page 25

Elektrotransfer Noten
Elektrophoretischen Transfer Vorteile
Elektrophoretischen Transfer von Proteinen und
Nukleinsäuren ist viel schneller als die BlottingVerfahren erstmals von Southern für DNA,
Alwine et al. Für die RNA oder Renart et al.
für Proteine.
Der Tank Transfer-Methode verwendet, um
die hohen Strom Umsteigezeit von den meisten
Proben auf 45-60 Minuten zu reduzieren.
Elektrophoretischen Transfer kann Transfereffizienz gegenüber nicht-elektrophoretische Blotting,
insbesondere für Proteine, aber keine quantitative Transfer-Technik wurde noch nicht aufgrund
der Komplexität der Reaktionen entwickelt zu
verbessern. Die quantitative Wiederherstellung
der Praxis nicht für die meisten Zwecke erforderlich, da Bindung Makromoleküle auf eine
Membran erhöht die Empfindlichkeit der Nachweisverfahren wie Autoradiographie und erlaubt
den Nachweis spezifischer Proteine durch Antikörper oder Affinitätsmarkierungen und spezifischer Nukleinsäuren durch Hybridisierung mit
komplementären Strängen von RNA oder DNA.
Der Puffer kann so gewählt werden zu einer
Übertragung in Richtung entweder die Kathode
oder der Anode führt. Der pH muss so beschaffen sein, dass alle Arten von Zinsen berechnet
werden und wandern in die gleiche Richtung.
Die Ionenstärke sollte nicht zu hoch sein, da dies
zu hohen Strom und Wärme produzieren wird.
Aus diesem Grund können die hohen Salzkonzentrationen durch Southern-Blotting für die
Kapillar-DNA verwendet werden, nicht verwendet werden. Die am häufigsten verwendeten
Puffersysteme sind solche von Towbin et al. zum
Übertragen von Proteinen und von Bittner et
p17
•
Page 26

al. für den Transfer von Nukleinsäuren. BufferSysteme für die Übertragung jeder Art von Probe
werden später in diesem Abschnitt aufgeführt.
Faktoren, die die Übertragung
Parameter wie Samplefrequenz Eigenschaften,
Membrantyp, Gel Porengröße und den TransferPuffer verwendet, um all die Übertragbarkeit
der Makromoleküle beitragen und sollte im
Auge behalten werden, wenn die Entwicklung
eines Protokolls. Sehr kleine molekulare Spezies,
zum Beispiel, schnell migrieren, aber oft nicht
wie größere Moleküle binden, große Moleküle
binden effizienter, aber nicht aus dem Gel so
schnell eluieren. Die Elutionsgeschwindigkeit
wird auch durch die Porengröße des Gels und
der Orientierung der Moleküle beeinflusst.
Ferner ist das Ausmaß, in dem die Moleküle
binden an die Membran durch Membraneigenschaften wie Porengröße und-typ, und Puffer,
wie pH-, Salz Art und Konzentration, und die
Gegenwart von Detergenzien, wie Natriumdodecylsulfat (SDS) beeinflusst. Voraussetzungen
für eine effiziente Elution erforderlich möglicherweise nicht mit optimalen Bedingungen für die
Bindung überein. Um die optimalen Bedingungen
für die Übertragung Ihrer Probe zu finden, diese
Effekte auszugleichen: Wenn die Probe Elutionsrate langsam ist, eine längere Übertragung
Zeitraum erforderlich sein. (Nach unserer Erfahrung wissen Kleinspannung Transfers für längere
Zeit nicht bieten viel Verbesserung.) Wenn Probe
binden unzureichend ist, versuchen verschiedene
Pufferbedingungen. Für eine umfassende Übersicht siehe Gershoni und Palade (1983).
•
Wenn der Transfer-Puffer-System unterscheidet
sich von dem Elektrophorese-Puffer-System,
sollte das Gel, äquilibriert mit dem Übertragungspuffer vor der Übertragung zu gewährleis-
p18
Page 27

ten, Quellen oder Schrumpfen auftritt, bevor das
Gel in Kontakt mit der Transfermembran. Wenn
dieser Schritt übersprungen, könnte Band Verzerrung oder Verlust der Auflösung zur Folge haben.
Instrument Richtlinien
Kühlung
Erhebliche Joulesche Wärme wird während einer
Übertragung wegen der hohen Strom angestellt
erzeugt, so aktive Kühlung wird empfohlen,
vor allem für Überweisungen, die mehr als eine
Stunde, Protein-Transfers, bei denen biologische
Aktivität beibehalten werden muss, oder Transfer
von Nukleinsäuren. (Die hohe Leitfähigkeit des
Phosphat-Puffer von Bittner et al. Verwendet
(1980) führt zu einer relativ schnellen Temperaturanstieg.) Buffer Temperatur sollte nicht über
45 °C, weil die Kassetten und Elektrode Träger
können verziehen. Verwenden Sie einen Thermostatenbad auf 10 °C bei Verwendung von Wasser
als Kühlmittel. (Sie können eine niedrigere Einstellung verwenden, wenn das Kühlmittel ist 50/50
Ethylenglykol/Wasser.) Lassen Sie niemals das
Gerät unbeaufsichtigt seit mehr als einer Stunde
unter Bedingungen hoher Leistung (>0.5 A).
Leistungseinstellung
Wenn Sie ein Netzteil, das entweder auf konstantem Strom oder konstanter Spannung eingestellt
werden kann, empfehlen wir, es soll im Konstantstrom-Modus betrieben werden. Puffer Leitfähigkeit mit der Temperatur zunimmt. Während
Blotting in einem ungekühlten Kammer, Joulesche Erwärmung und steigende Leitfähigkeit
kann eine gefährliche Überhitzung führen, wenn
die Stromversorgung ist auf konstante Spannung
aufrecht zu erhalten. Wenn eine konstante Spannungsversorgung verwendet werden, zu überwachen und die Spannung, einen Strom auf oder
unter 1 A zu halten.
p19
•
Page 28

Protein-Transfers
Studienzusammenfassungen
Gershoni und Palade (1982) untersucht Faktoren,
die Protein Erholung von SDS-Gelen auf Nitrocellulose oder DBM-Papier. Nach ihren Erkenntnissen ist Methanol in der Towbin Puffer-System
notwendig, um effiziente Bindung an Nitrozellulose zu erreichen. Methanol verbessert Bindung
zum Teil durch das Entfernen Protein-gebundenen
SDS. In Abwesenheit von Methanol, gekennzeichnet Rinderserumalbumin (BSA) durch mindestens
fünf Schichten von Membranen. Methanol ist ein
Gel zu schrumpfen, aber so die Elution abnimmt.
Durch die Verwendung einer kationischen Membran (wie Nylon), die die Proteine bindet, effizienter, und das Weglassen von Methanol aus dem
Übertragungspuffer, erhalten Gershoni und Palade
eine viel quantitative Überführung. Der Nachteil
ist, dass kationische Membran Proteinfärbungen
binden auch gut, so dass die Färbung Hintergrund sehr hoch sein neigt. Richtig abgeschreckt,
jedoch kann dieses Papier für den Antikörpernachweis oder andere Overlay-Methoden der
Identifizierung von Proteinen verwendet werden.
Eine Zusammenfassung der Membran Typ und
empfohlene Methanolkonzentration folgt:
Membran-Typ Methanol %
Geladene Nylonmembran 0
Nitrocellulose ≤ 20
PVDF ≤ 15
•
Einige Arbeiter haben uns berichtet, dass eine
niedrige Konzentration von SDS (0,1%) den
Transfer von Proteinen aus einem SDS-Gel verbessert. Burnette (1981) und Symington et al. (1981)
untersuchten die Wirkung von dem Molekulargewicht des Proteins. Gibson (1981) beschreibt
ein Verfahren, um das Ausmaß der Übertragung
großer Proteine durch limitierte Spaltung zu erhöhen mit Pronase während der Übertragung.
p20
Page 29

Protein-Transfer-Puffer
Verwenden Sie einen Puffer mit niedriger Ionenstärke, wie die beiden unten aufgeführten, um
Überhitzung zu vermeiden. Verwenden des alternativen CAPS-Puffer, wenn Tris nicht verwendet
werden kann, wie in Peptidsequenzierung. CAPS
können Transfer wegen seiner Wirkung auf die
Ladung des Proteins (siehe Matsudaira, 1987)
zu verbessern. Für native Proteine , empfehlen
wir mit dem Elektrophorese-Puffer für die Übertragung als auch. Verwenden Sie die Towbin
Puffer SDS-denaturierte Proteine in Richtung der
Anode zu übertragen.
Towbin Puffer
(25 mM Tris, 192 mM Glycin, 20% v/v Methanol,
pH 8,3, 2 Liter)
Tris (FW 121,1) 25 mM 6,0 g
Glycin (FW 75,07) 192 mM 28,8 g
SDSa (FW 288,4) 0,1% (3,5 mM) 2,0 g
Man löst in 1,5 Liter destilliertem Wasser. In Methanol als
erforderlichb. Bringt bis 2 Liter mit destilliertem Wasser.
Verstellen Sie nicht den pH-Wert, der zwischen 8,2 und 8,4
sein sollte. Optional: Chill vor dem Gebrauch.
a
Optional: Zugabe von SDS können Transfer Effizienz zu verbessern.
b
Abhängig von der Membran-Typ ausgewählt, Zugabe von Methanol
können die Übertragung Ergebnisse zu verbessern (siehe Diskussion
und Tabelle oben). Weil Puffern, die Methanol kann sich verschlechtern, wenn über längere Zeit gelagert, fügen Methanol nach Bedarf kurz
vor der Übertragung.
CAPS-Puffer, 1X
(10 mM CAPS, pH 11,0, 5 Liter)
CAPS (FW 221,3) 10 mM 11,1 g
[3-(cyclohexylamino)-1-propanesulfonic acid]
Man löst in 4,5 Liter destilliertem Wasser auf pH 11,0
einstellen mit konz. NaOH. Anpassen der Lautstärke auf
5,0 Liter.
•
p21
Page 30

Nucleinsäure Transfers
Nukleinsäuren müssen in der Regel in denaturierter Form für die meisten eine effiziente
Bindung übertragen werden. RNA ist in der
Regel mit Glyoxal denaturiert vor der Trennung
oder getrennt in denaturierenden Gelen, die
Formaldehyd oder Methylquecksilber. Jedoch ist
das doppelsträngige DNA-Regel in dem Gel mit
NaOH denaturiert. Die Alkali müssen neutralisiert und das Gel in Transferpuffer äquilibriert,
bevor Elektrotransfer. Sowohl für die DNA-und
RNA-Gele, muss jede SDS auch entfernt werden,
um eine effiziente Bindung zu gewährleisten.
Bittner et al. (1980) Waschen geliert dreimal je
20 Minuten, um die vollständige Entfernung
der Vergällungsmittel und Reinigungsmittel zu
gewährleisten.
Siehe Bittner et al. für eine Untersuchung der
Transfereffizienz DNA in verschiedenen Größen.
Die Bittner Übertragungspuffer enthält 25 mM
Natriumphosphat, pH 6,5. Ebenfalls beschrieben wird ein Verfahren für die Einführung von
Kerben durch begrenzte Nuklease Maßnahmen,
um eine Übertragung von größeren DNA-Fragmente zu erleichtern.
•
Empfohlen DNA-Puffer sind die Bittner Natriumphosphatpuffer (siehe Referenz) und FSME.
Für die RNA wird TAE empfohlen. TBE und
TAE Lager Rezepte sind unten aufgeführt. Diese
Puffer sind am häufigsten auf 1X verdünnt, aber
die Konzentration kann bis hinunter zu 0,1X.
Die Kühlung wird stark für diese Puffer empfohlen, besonders bei höheren Konzentrationen.
p22
Page 31

EDTA solutiona
a
(0,5 M EDTA, pH 8,0, 100 ml)
Na2EDTA·2H2O (FW 372,2) 0,5 M 18,6 g
Man löst in 70 ml destilliertem Wasser. Passen Sie auf pH
8,0 mit 10 M NaOH (ca. 5 ml), dann mit destilliertem Wasser
auf 100 ml auffüllen.
DNA-Transfer-Puffer, 10X
(10X Tris-Borat-EDTA (TBE)a, pH ~8,2, 1 Liter)
Tris (FW 121,1) 900 mM 109,0 g
Borsäure (FW 61,83) 900 mM 55,6 g
EDTA Lösung (0,5 M, pH 8,0) 20 mM 40,0 ml
Destilliertem Wasser auf 1,0 Liter. Nicht einstellen pH-Wert.
Verdünnen Vor Gebrauch auf 1X 90 mM Tris, 90 mM Borsäure,
2 mM EDTA und nachgeben.
Diese Verdünnung wird im Allgemeinen verwendet,
Verdünnungen bis 0,1X verwendet sollte es notwendig sein,
die Menge des Stroms in dem System zu verringern, um
Überhitzung zu steuern.
RNA-Transfer-Puffer, 10X
(10X Tris-acetat-EDTA (TAE)b, pH ~8,4, 1 Liter)
Tris (FW 121,1) 400 mM 48,4 g
Eisessig (~17,4 M) ~200 mM 11,4 ml
EDTA Lösung (0,5 M, pH 8,0) 10 mM 20,0 ml
Destilliertem Wasser auf 1,0 Liter. Nicht einstellen pH-Wert.
1X verdünnen vor der Verwendung 40 mM Tris zu ergeben,
~20 mM acetat und 1 mM EDTA.
Diese Verdünnung wird im Allgemeinen verwendet,
Verdünnungen bis 0,1X verwendet sollte es notwendig sein,
die Menge des Stroms in dem System zu verringern, um
Überhitzung zu steuern.
a
Current Protocols in Molecular Biology (1993), A.2.1.
b
Sambrook, J., and Russell, D.W. (2001) Molecular Cloning:
A Laboratory Manual, A1.17.
•
p23
Page 32

Bibliographie
Alwine, J.C., Kemp, D.J., and Stark G.R., Method for
detection of specific RNAs in agarose gels by transfer to DBM paper and hybridization with DNA
probes. Proc. Natl. Acad. Sci. USA. 74, 5350–5354
(1977).
Bittner, M., Kupferer, P., and Morris, C.F., Electropho-
retic transfer of proteins and nucleic acids from
slab gels to diazobenzyloxymethyl cellulose or
nitrocellulose sheets. Anal. Biochem. 102, 459–471
(1980).
Bjerrum, O.J., Larsen, K., and Heegaard, N., CRC
Handbook of Immunoblotting of Proteins Vol. 1,
Section 7. CRC Press (1988).
Burnette, W.N., Western blotting electrophoretic
transfer of proteins from sodium dodecyl sulfatepolyacrylamide gels to unmodified nitrocellulose
and radiographic detection with antibody and
radioiodinated protein A. Anal. Biochem. 112, 195
(1981).
Gallagher, S., Winston, S.E., Fuller, S.A. and Hurrell,
J.G.R., Immunoblotting and Immunodetection. In
Current Protocols in Molecular Biology. 10.8.1–
10.8.17. Greene Publishing and Wiley-Interscience,
NY (1993).
Gershoni, J.M., Davis, F.E. and Palade, G.E. Protein
blotting in uniform or gradient electric fields. Anal.
Biochem. 144, 32–40 (1985).
Gershoni, J.M., and Palade, G.E. Electrophoretic
transfer of proteins from sodium dodecyl sulfatepolyacrylamide gels to a positively charged membrane filter. Anal. Biochem. 124, 396–405 (1982).
Gershoni, J.M., and Palade, G.E. Protein Blotting:
Principles and Applications. Anal. Biochem. 131,
1–15 (1983).
Gibson, W. Protease-facilitated transfer of high mole-
cular weight proteins during electrotransfer to
nitrocellulose. Anal. Biochem. 118, 1 (1981).
•
p24
Page 33

Lin, W., and Kasamatsu, H., On the electrotransfer of
polypeptides from gels to nitrocellulose membranes. Anal. Biochem. 128, 302–311 (1983).
Matsudaira, P. Sequence from Picomole Quantities of
Proteins Electroblotted onto Polyvinylidene Difluoride Membranes. J. Biol Chem. 262, 10035 (1987).
Ohmsted, J.B., Affinity purification of antibodies from
diazotized paper blots of heterogeneous protein
samples. J. Biol. Chem. 256, 11955 (1981).
Renart, Reiser, J. and Stark, G.R. Transfer of proteins
from gels to DBM paper and detection with antisera: a method for studying antibody specificity
and structure. Proc. Natl. Acad. Sci. USA 76, 3116
(1979).
Sambrook, J., and Russell, D.W. Molecular Cloning: A
Laboratory Manual, Cold Spring Harbor Laboratory Press, A1.17 (2001).
Southern, E.M. Detection of specific sequences among
DNA fragments separated by gel electrophoresis. J.
Molec. Biol. 98 (3):503–517 (1975).
Stellway, E.J., and Dahlberg, A.E. Electrophoretic
transfer of DNA, RNA, and protein onto DBM
paper. Nucleic Acids Res. 8, 299 (1980).
Symington, J., Green, M., and Brackmann, K., Immu-
nological detection of proteins after electrophoretic transfer from gels to diazo paper: analysis of
adenovirus encoded proteins. Proc. Natl. Acad. Sci.
USA 78, 177–181 (1981).
Towbin, H., Staehelin,T., and Gordon, J., Electro-
phoretic transfer of proteins from polyacrylamide
gels to nitrocellulose sheets: procedure and some
applications. Proc. Natl. Acad. Sci. USA. 76,
4350–4354 (1979).
•
p25
Page 34

Bestellinformationen
Produkt Menge Code
TE42 Transfer-Elektrophorese-Einheit. 1 TE42
Beinhaltet Sicherheitsdeckel mit Stromkabel, 2-Gel-Kassetten,
4 Schaumstoff Schwämme 3-mm dick, 2 Schaumstoff Schwämme
6-mm dick, 25 Blatt Löschpapier.
TE62 gekühlt Transfer-Elektrophorese-Einheit. 1 TE62
Beinhaltet Sicherheitsdeckel mit Stromkabel, 4 Gel-Kassetten,
8 Schaumstoff Schwämme 3-mm dick, 4 Schaumstoff Schwämme
6-mm dick, 25 Blatt Löschpapier.
Zubehör und Ersatzteile
Glass scambiatore di calore per TE42 1 TE47
Elettrodo pannello, nero 1 TE43BK
Elettrodo pannello, grigio 1 TE43GY
Gel cassetta, 2 spugne schiuma di 3 mm di spessore,
1 spugna di schiuma di 6 mm di spessore 1 TE44H
Serbatoio di accumulo inferiore per TE42 1 TE56
Serbatoio di accumulo inferiore con scambiatore di calore per TE62 1 TE67
Spugne, Dacron, 6 mm di spessore 2 TE45
Spugne, schiuma, 6 mm di spessore 4 TE45F
Spugne, schiuma, 3 mm di spessore 4 TE45F-1/8
Coperchio con cavi per TE42 e TE62 1 TE49
Hohe Spannung führt paar SE6056-HV
Schnellmontage-Koppler Körper, weiblich, bis 9,5 mm 2 QF3/8
ID Schlauch passen
Schnellmontage-Koppler Körper, männlich, bis 9,5 mm 2 QFX3/8
ID Schlauch passen
Löschpapier
Löschpapier, Bleche, 9 × 10,5 cm 50 TE26
Löschpapier, Bleche, 14,5 × 21,5 cm 50 TE46
Companion-Produkte
Hoefer PS2A200 Stromversorgung, 200 V, 2A 1 PS2A200
Hoefer PS200HC Stromversorgung, 200 V, 2A 1 PS200HC
Hoefer PS300B Stromversorgung, 300 V, 0,5A 1 PS300B
•
p26
Page 35

Hoefer, Inc.
84 October Hill Road
Holliston, MA 01746
Toll Free: 1-800-227-4750
Telefon: 1-508-893-8999
Fax: 1-508-893-0176
E-mail: support@hoeferinc.com
Web: www.hoeferinc.com
Hoefer ist ein eingetragenes
Warenzeichen von Hoefer, Inc.
Contrad 70 und Decon 90 sind
eingetragene Warenzeichen der
Decon Lab.
© 2012 Hoefer, Inc.
Alle Rechte vorbehalten.
Gedruckt in den USA.
•
p27
 Loading...
Loading...