Page 1

man ual del usuario
Español
Hoefer SE640
Amplia mini-gel de doble unidad de electroforesis
mu SE640-IM/Spanish/Rev.B0/07-12
Page 2

Tabla de contenidos
Información Importante .......................................... ii
Residuos de Aparatos Eléctricos y Electrónicos
(RAEE) ................................................................vii
Electroforesis en gel de la Unidad Función y
descripción ...........................................................1
Especificaciones ....................................................2
Desembalaje e inventario .......................................4
Manual de instrucciones ........................................7
Geles de acrilamida .............................................11
El montaje final ................................................... 17
La separación de la muestra .................................20
Después de la electroforesis .................................22
Cuidado y mantenimiento .....................................23
Información del cliente de servicios ......................24
Apéndice A: Sistema de Laemmli geles .................30
Soluciones ..........................................................32
Recetas de gel ...................................................35
Apéndice B: Bibliografía ......................................37
pi
•
Page 3

Información Importante – Español
• Si este equipo es utilizado en una manera no especicado por Hoefer, Inc. la protección proporcionado por el equipo puede ser dañada.
• Este instrumento es diseñado para el uso interior
del laboratorio sólo.
• Sólo accesorios y partes aprobaron o suministraron
por Hoefer, Inc. puede ser utilizado para operar,
para mantener, y para atender a este producto.
• Sólo utiliza una alimentación que es CE marcó o
la seguridad certicada por un nacionalmente
reconocido probando el laboratorio.
• La tapa de la seguridad debe estar en el lugar
antes de conectar la alimentación lleva a una
alimentación.
• Apaga todos controles de alimentación y desconecta los plomos del poder antes de quitar la tapa
de la seguridad.
• Circula sólo agua o 50/50 glicol de agua/etileno
por el intercambiador de calor si ése es el caso
equiparon. No conecte el intercambiador de calor a
un toque de la agua ni cualquier fuente del líquido
refrigerante donde la presión del agua está libre.
• Nunca introduce anticongelante ni algún solvente
orgánico en cualquier parte del instrumento. Los
solventes orgánicos causarán daño irreparable a
la unidad!
• No opera con temperaturas de búfer encima del
máximo especicó especicaciones técnicas. Recalentar causará daño irreparable a la unidad!
Duležité Informace – Czech
• Pokud by toto zařízení je použito způsobem, který
není podle Hoefer, Inc. ochrana poskytovaná na
základě zařízení může být narušena.
• Tento nástroj je určen pro vnitřní použití v
laboratoři pouze.
• Pouze příslušenství a části schválen, nebo poskytnutých Hoefer, Inc. mohou být použity pro provoz,
údržbu, a údržbě tohoto výrobku.
• zdroj napájení používají jen že je opatřen
označením CE osvědčena nebo bezpečnost
vnitrostátně uznanými zkušebními laboratoř.
• Bezpečnosti lid musí být zavedena před připojením
napájecí zdroj napájení vede k.
• Turn veškeré napájení kontroly vypnuto a odpojit
před odběrem energie vede bezpečnostní víko.
• Rozeslat pouze voda nebo 50/50 voda/ethylenglykolu prostřednictvím výměník tepla je li to vybavena. Nemají připojení výměník tepla s vodními
setřepná nebo jakékoli chladicí kapaliny zdroje, kde
tlak vody je neregulo.
• Nikdy zavést prostředek proti zamrznutí nebo
jakákoli organická rozpouštědla do jakékoli části z
tohoto nástroje. Rozpustidlům způsobí nenapravitelné poškození jednotka!
• Nejsou provozována s pufru teplotách nad
maximální stanovenou technickými specikacemi. Přehřátí způsobí nenapravitelné poškození
jednotka!
Vigtig Information – Danish
• Hvis dette udstyr bruges i en måde ikke speciceret ved Hoefer, Inc. den beskyttelse, som er blevet
forsynet af udstyret kan måske svækkes.
• Dette instrument er designet for indendørs laboratoriumbrug bare.
• Bare tilbehør og del godkendede eller forsynede
ved Hoefer, Inc. kan måske bruges for drive, funktionsfejl, og betjening dette produkt.
• bruger Bare en strømforsyning, der er CE
markerede eller sikkerhed, som er blevet attesteret
af en, som nationalt er blevet anerkendt prøve
laboratorium.
• Sikkerhedlåget må være på plads før forbinding
strømforsyningsblyet til en strømforsyning.
• Drejer alle strømforsyningskontroller af og afbryder
kraftblyet før erning sikkerhedlåget.
• Cirkulerer bare vand eller 50/50 vand/ethylene
glykol gennem varmeveksleren i så fald udrustet.
Forbind ikke varmeveksleren til en vandhane
eller nogen kølemiddelkilde hvor vandtrykket er
unregulated.
• Introducerer Aldrig antifreeze eller noget organisk
opløsningsmiddel ind i nogen del af instrumentet.
Organiske opløsningsmidler vil forårsage uboelig
skade til enheden!
• Driver ikke med stødpudetemperaturer over
maksimummet specicerede tekniske specications. Overheding vil forårsage uboelig skade til
enheden!
pii
•
Page 4

Belangrijke Informatie – Dutch
• Indien deze uitrusting in een manier wordt
gebruikt die niet door Hoefer, Inc. is gespeciceerd
de bescherming die door de uitrusting is verzorgd
kan worden geschaad.
• Dit instrument is voor binnenlaboratoriumgebruik
enkel ontworpen.
• Enkel onderdelen en delen keurden goed of
leverden door Hoefer, Inc. kan voor het bedienen
worden gebruikt, handhavend en onderhouden
van dit product.
• gebruik Enkel een netvoeding die CE is markeerde
of veiligheid die door een is gecerticeerd die
nationaal is herkend testene laboratorium.
• Het veiligheidsdeksel moet in plaats voor het
verbinden van de netvoeding leidt tot een
netvoeding zijn.
• Doe alle netvoedingscontroles Uit en koppel los
de machtleiding voor het verwijderen van het
veiligheidsdeksel.
• Circuleer enkel water of 50/50 water/ethyleenglycol door de hitte exchanger zo ja uitrust.
Verbind de hitte exchanger naar een waterkraan
of koelmiddelbron niet waar de waterdruk niet
geregulariseerd is.
• Stel Nooit antivriesmiddel of organische oplosmiddelen in deel van het instrument voor. Organische
oplosmiddelen zullen onherstelbare schade aan de
eenheid veroorzaken!
• Bedien niet met buertemperaturen boven het
maximum speciceerde technische specicaties.
Oververhittend zal onherstelbare schade aan de
eenheid veroorzaken!
Important Information – English
• If this equipment is used in a manner not specied by Hoefer, Inc. the protection provided by the
equipment may be impaired.
• This instrument is designed for indoor laboratory
use only.
• Only accessories and parts approved or supplied
by Hoefer, Inc. may be used for operating, maintaining, and servicing this product.
• Only use a power supply that is CE marked or
safety certied by a nationally recognized testing
laboratory.
• The safety lid must be in place before connecting
the power supply leads to a power supply.
• Turn all power supply controls o and disconnect
the power leads before removing the safety lid.
• Circulate only water or 50/50 water/ethylene glycol
through the heat exchanger if so equipped. Do
not connect the heat exchanger to a water tap or
any coolant source where the water pressure is
unregulated.
• Never introduce antifreeze or any organic solvent
into any part of the instrument. Organic solvents
will cause irreparable damage to the unit!
• Do not operate with buer temperatures above
the maximum specied technical specications.
Overheating will cause irreparable damage to the
unit!
Tärkeää Tietoa – Finnish
• Jos tätä varusteita käytetään tavassa ei määritetty
Hoefer, Inc. suojelu ehkäisty varusteille saattaa olla
avuton.
• Tämä väline suunnitellaan sisälaboratoriokäytölle
vain.
• Vain lisävarusteet ja osat hyväksyivät tai toimitti
Hoefer, Inc. oheen ää voi käyttää käyttämiselle,
valvoalle, ja servicing tämä tuote.
• Vain käyttää käyttöjännitettä joka on CE merkitsi
tai turvallisuus joka on todistanut aidoksi ohi joka
on kansallisesti tunnustettnut testaaminen laboratoriota.
• Turvallisuuskansi täytyy olla paikallaan ennen
yhdistäminen käyttöjännitelyijyjä käyttöjännitteeseen.
• Kiertää kaikki käyttöjännitevalvonnat ja irrottaa
valtalyijyt ennen poistaminen turvallisuuskantta.
• Kiertää vain vesi tai 50/50 vesi/ethyleneä glycol
siinä tapauksessa varustetun lämmönvaihtimen
läpi. Älä yhdistä lämmönvaihdinta vesinapautukseen eikä jäähdytysnestelähteeseen, missä vesipaine on unregulated.
• Pakkasneste eikä orgaaninen liuotin välineen
osassa ei esitele Koskaan. Orgaaniset liuottimet
aiheuttavat korvaamattoman vahingon yksikköön!
• Ei käytä puskuria yllä olevia lämpötiloja enintään
piii
•
Page 5

määritetyillä teknisillä täsmennyksillä. Ylikuumeneminen aiheuttaa korvaamattoman vahingon
yksikköön!
Information Importante – French
• Si cet équipement est utilisé dans une manière pas
spécié par Hoefer, Inc. la protection fourni par
l’équipement pourrait être diminuée.
• Cet instrument est conçu pour l’usage de laboratoire intérieur seulement.
• Seulement les accessoires et les parties ont
approuvé ou ont fourni par Hoefer, Inc. pourrait
être utilisé pour fonctionner, maintenir, et entretenir ce produit.
• utilise Seulement une alimentation qui est CET a
marqué ou la sécurité certié par un nationalement reconnu essayant le laboratoire.
• Le couvercle de sécurité doit être à sa place avant
connecter l’alimentation mene à une alimentation.
• Tourner tous contrôles d’alimentation de et
débrancher les avances de pouvoir avant enlever le
couvercle de sécurité.
• Circuler seulement de l’eau ou 50/50 glycol d’eau/
éthylène par l’exchanger de chaleur si si équipé. Ne
pas connecter l’exchanger de chaleur à un robinet
d’eau ou à la source d’agent de refroidissement où
la pression d’eau est non régulée.
• Ne Jamais introduire d’antigel ou du dissolvant
organique dans n’importe quelle partie de
l’instrument. Les dissolvants organiques causeront
des dommages irréparables à l’unité!
• Ne pas fonctionner avec les températures de
tampon au-dessus du maximum a spécié des
spécications techniques. La surchaue causera
des dommages irréparables à l’unité !
Wichtige Informationen – German
• Wenn diese Ausrüstung gewissermaßen nicht
angegeben durch Hoefer, Inc. verwendet wird,
kann der durch die Ausrüstung zur Verfügung
gestellte Schutz verschlechtert werden.
• Dieses Instrument wird für den Innenlaborgebrauch nur dafür entworfen.
• Nur Zusätze und Teile genehmigten oder lieferten
durch Hoefer, Inc. kann für das Funktionieren, das
Aufrechterhalten, und die Wartung dieses Produk-
tes verwendet werden.
• Verwenden Sie nur eine Energieversorgung,
die CE gekennzeichnet oder durch ein national
anerkanntes Probelaboratorium bescheinigte
Sicherheit ist.
• Der Sicherheitsdeckel muss im Platz vor dem
Anschließen der Energieversorgung sein führt zu
einer Energieversorgung.
• Alle Energieversorgungssteuerungen abdrehen
und die Macht trennen führt vor dem Entfernen
des Sicherheitsdeckels.
• Nur Wasser oder 50/50 Glykol des Wassers/
Äthylens durch den Wärmeaustauscher, wenn so
ausgestattet, in Umlauf setzen. Verbinden Sie den
Wärmeaustauscher mit einem Wasserklaps oder
jeder Kühlmittel-Quelle nicht, wo der Wasserdruck
ungeregelt wird.
• Führen Sie nie Frostschutzmittel oder jedes
organische Lösungsmittel in jeden Teil des Instrumentes ein. Organische Lösungsmittel werden
nicht wiedergutzumachenden Schaden der Einheit
verursachen!
• Mit Puertemperaturen über angegebenen
technischen Spezizierungen des Maximums
nicht funktionieren. Die Überhitzung wird nicht
wiedergutzumachenden Schaden der Einheit
verursachen!
Informazioni Importanti – Italian
• Se quest’apparecchiatura è usata in un modo
specicato da Hoefer, Inc. la protezione fornito
dall’apparecchiatura potrebbe essere indebolita.
• Questo strumento è disegnato per l’uso di laboratorio interno solo.
• Solo gli accessori e le parti hanno approvato o
hanno fornito da Hoefer, Inc. potrebbe essere
usato per operare, per mantenere, e per revisionare
questo prodotto.
• usa Solo un alimentatore che è CE ha marcato o la
sicurezza certicato da un nazionalmente riconosciuto testando il laboratorio.
• Il coperchio di sicurezza deve essere nel luogo
prima di collegare i piombi di alimentatore a un
alimentatore.
• Spegne tutto i controlli di alimentatore e disinserisce i piombi di potere prima di togliere il coper-
piv
•
Page 6

chio di sicurezza.
• Circola solo l’acqua o 50/50 glicole di acqua/etilene
attraverso lo scambiatore di calore se così equipaggiato. Non collegare lo scambiatore di calore a un
rubinetto di acqua o qualunque fonte di refrigerante dove la pressione di acqua è sregolata.
• Non introduce mai l’antigelo o qualunque solvente
organico in qualunque parte dello strumento. I
solventi organici causeranno il danno irreparabile
all’unità!
• Non opera con le temperature di tampone al di
sopra del massimo ha specicato le descrizioni
tecniche. Il surriscaldamento causerà il danno
irreparabile all’unità!
Viktig Informasjon – Norwegian
• Hvis dette utstyret blir brukt i en måte ikke spesisert ved Hoefer, Inc. beskyttelsen som ha blitt git
av utstyret kan bli svekket.
• Dette instrumentet er utformet for innendørs laboratoriumbruk bare.
• Bare tilbehør og deler godkjente eller forsynte ved
Hoefer, Inc. kan bli brukt for drive, vedlikeholde, og
betjene dette produktet.
• bruker Bare en kraftforsyning som er CE merket
eller sikkerhet som ha blitt sertisert av et som
nasjonalt ha blitt anerkjent prøver laboratorium.
• Sikkerheten lokket må være på plass før forbinding
kraftforsyningene blyene til en kraftforsyning.
• Vender all kraftforsyningsstyring av og frakopler
kreftene blyene før erning sikkerheten lokket.
• Sirkulerer bare vann eller 50/50 vann/ethylene
glykol gjennom oppvarmingen veksleren i så fall
utstyrer. Ikke forbind oppvarmingen veksleren
til en vanntapp eller noe kjølemiddelkilde hvor
vannet trykket er unregulated.
• Introduserer Aldri antifreeze eller noe organisk
løsemiddel inn i noe del av instrumentet. Organiske løsemiddler vil forårsake irreparabel skade på
enheten !
• Driver med buertemperaturer over maksimum
ikke spesiserte teknisk spesikasjoner. Å overoppheting vil forårsake irreparabel skade på enheten !
Wazne Informacje – Polish
• Jeżeli ten sprzęt jest wykorzystywany w sposób nie
określone przez Hoefer, Inc. do ochrony przewidzianej przez urządzenie może zostać obniżony.
• Instrument ten jest przeznaczony do użytku w
laboratoriach kryty tylko.
• Tylko akcesoriów i części zatwierdzone lub dostarczone przez Hoefer, Inc. mogą być wykorzystane do
eksploatacji, utrzymania i obsługi tego produktu.
• korzystać jedynie zasilacza że jest noszące oznakowanie CE lub bezpieczeństwa uwierzytelnione
przez uznane na poziomie krajowym laboratorium
badawcze.
• Bezpieczeństwo lid musi być w miejsce przed
podłączeniem zasilania prowadzi do zasilania.
• Zaś wszystkie źródła zasilania urządzenia sterujące
o i odłączyć moc prowadzi przed odbiorem
bezpieczeństwa lid.
• Krążą tylko wody lub wody 50/50/ethylene glycol
wymiennik ciepła poprzez jeśli tak wyposażone.
Nie należy połączyć wymiennik ciepła woda z
kranu lub jakimkolwiek chłodziwo źródła, jeżeli
ciśnienie wody jest nieuregulowanych.
• Nigdy nie wprowadzać rozpuszczalnika organicznego przeciw zamarzaniu lub jakichkolwiek
na dowolną część dokumentu. Rozpuszczalniki
organiczne spowoduje nieodwracalne szkody dla
jednostki!
• Nie działają w buforze temperatury powyżej
maksymalnego określone specykacje techniczne.
Przegrzania spowoduje nieodwracalne szkody dla
jednostki!
Informações Importantes –
Portuguese
• Se este equipamento é usado numa maneira não
especicada por Hoefer, Inc. que a protecção fornecida pelo equipamento pode ser comprometida.
• Este instrumento é projectado para uso de interior
de laboratório só.
• Só acessórios e partes aprovaram ou forneceu por
Hoefer, Inc. pode ser usada para operar, manter, e
servicing este produto.
• Só usa um estoque de poder que é CE marcou ou
pv
•
Page 7

segurança registrada por um nacionalmente reconhecido testando laboratório.
• A tampa de segurança deve estar em lugar antes
de ligar o estoque de poder leva a um estoque de
poder.
• Desliga todos controlos de estoque de poder e
desconecta os chumbos de poder antes de retirar a
tampa de segurança.
• Circulam só água ou 50/50 glicol de água/ethylene
pelo exchanger de calor se for assim equiparam.
Não ligue o exchanger de calor a uma torneira de
água nem qualquer fonte de refrigerante onde a
pressão de água é não regulado.
• Nunca introduz anticongelante nem qualquer
orgânico solvente em qualquer parte do instrumento. Orgânico solvente causará agressão
irreparável à unidade!
• Não opera com temperaturas de buer acima do
máximo especicou especicações técnicas. Superaquecer causará agressão irreparável à unidade!
Viktig Information – Swedish
• om denna utrustning används i ett sätt som inte
har speciceras av Hoefer, Inc. skyddet tillhandahöll vid utrustningen kan skadas.
• Detta instrument formges för inomhuslaboratorium användning bara.
• Bara medhjälpare och delar godkände eller levererade vid Hoefer, Inc. kan användas för fungera,
underhålla, och servicing denna produkt.
• använder bara en kraft tillgång som är CE
markerade eller säkerhet intygade vid en nationellt
erkänd testande laboratorium.
• Säkerheten locket måste vara på platsen före
koppla kraften tillgången blyen till en kraft tillgång.
• Vänder sig alla kraft tillgång kontroller av och
kopplar bort kraften blyen före ytta säkerheten
locket.
• Cirkulerar bara vatten eller 50/50 vatten/ethylene
glycol genom värmen exchanger i så utrustad fall.
Inte kopplar värmen exchanger till en vatten kran
eller något kylmedel källa där vattnet trycket är
unregulated.
• Inför aldrig kylvätska eller något organiska
lösningsmedel in i någon del av instrumentet.
Organiskt lösningsmedel ska orsaka irreparable
skada till enheten!
• Använd inte med buert temperaturer över
det högsta angivna tekniska specikationerna.
Överhettning skulle orsaka irreparabla skador på
enheten!
pvi
•
Page 8

Residuos de Aparatos Eléctricos y Electrónicos (RAEE)
Español
English
French
German
Italian
Este símbolo indica que el equipo eléctrico y electrónico no
debe tirarse con los desechos domésticos y debe tratarse por
separado. Contacte con el representante local del fabricante
para obtener más información sobre la forma de desechar el
equipo.
This symbol indicates that the waste of electrical and
electronic equipment must not be disposed as unsorted
municipal waste and must be collected separately. Please
contact an authorized representative of the manufacturer
for information concerning the decommissioning of your
equipment.
Ce symbole indique que les déchets relatifs à l’équipement
électrique et électronique ne doivent pas être jetés comme
les ordures ménagères non-triées et doivent être collectés
séparément. Contactez un représentant agréé du fabricant
pour obtenir des informations sur la mise au rebut de votre
équipement.
Dieses Symbol kennzeichnet elektrische und elektronische
Geräte, die nicht mit dem gewöhnlichen, unsortierten
Hausmüll entsorgt werden dürfen, sondern separat
behandelt werden müssen. Bitte nehmen Sie Kontakt mit
einem autorisierten Beauftragten des Herstellers auf, um
Informationen hinsichtlich der Entsorgung Ihres Gerätes zu
erhalten.
Questo simbolo indica che i rifiuti derivanti da
apparecchiature elettriche ed elettroniche non devono essere
smaltiti come rifiuti municipali indifferenziati e devono invece
essere raccolti separatamente. Per informazioni relative alle
modalità di smantellamento delle apparecchiature fuori uso,
contattare un rappresentante autorizzato del fabbricante.
Swedish
Denna symbol anger att elektriska och elektroniska
utrustningar inte får avyttras som osorterat hushållsavfall och
måste samlas in separat. Var god kontakta en auktoriserad
tillverkarrepresentant för information angående avyttring av
utrustningen.
pvii
•
Page 9

Electroforesis en gel de la Unidad Función y descripción
Los Hoefer® SE600 verticales de la serie de
unidades de losa electroforesis en gel (SE600,
SE640 y SE660) están destinados a las proteínas
y electroforesis de ácidos nucleicos en la desnaturalización de uso común y no-desnaturalización
condiciones. Hasta 28 muestras pueden ser comparados en un gel de losa única.
Las aplicaciones incluyen separaciones de proteínas, fraccionamiento de ácido nucleico y la
separación de segunda dimensión de la electroforesis en 2-D. En primer lugar, la dimensión de
separación de 2-D electroforesis de proteínas se
debe realizar en inmovilizados geles de gradiente
de pH. Las tiras se centraron se transfieren fácilmente al gel de segunda dimensión losa para la
separación de tamaño.
Los SE640 placas de gel de 18 cm de ancho y
8 cm de longitud. Hasta cuatro geles se pueden
ejecutar al mismo tiempo si sándwiches están
emparejados en el “club sándwich”.
p1
•
Page 10

Especificaciones
Gel tamaño de la placa 18 × 8 cm (A × A)
Gel de tamaño 14 × 8 cm (A × A)
Potencia máxima 50 W
Tensión máxima 1000 V
Amperaje máximo 500 mA
Temperatura máximo 45 °C
Ambiental condicionesde operación:
Para uso en interiores 4 – 40 °C
Humedad hasta 80%
Altitud hasta 2000 m
Categoría de instalación II
Grado de contaminación II
Dimensiones (A × A × P) 32 × 22,5 × 14 cm
Certificaciones del producto EN 61010-1,
UL 61010A-1,
CSA C22.2 1010.1,
Certificado CE
Esta declaración de conformidad es válida solamente
cuando el instrumento es la siguiente:
• utilizarse en lugares de laboratorio,
• usado como liberado de Hoefer, Inc. a excepción
de las alteraciones descritas en el manual del
usuario, y
• conectado a otros instrumentos de marcado CE o
productos recomendados o aprobados por
Hoefer, Inc.
p2
•
Page 11
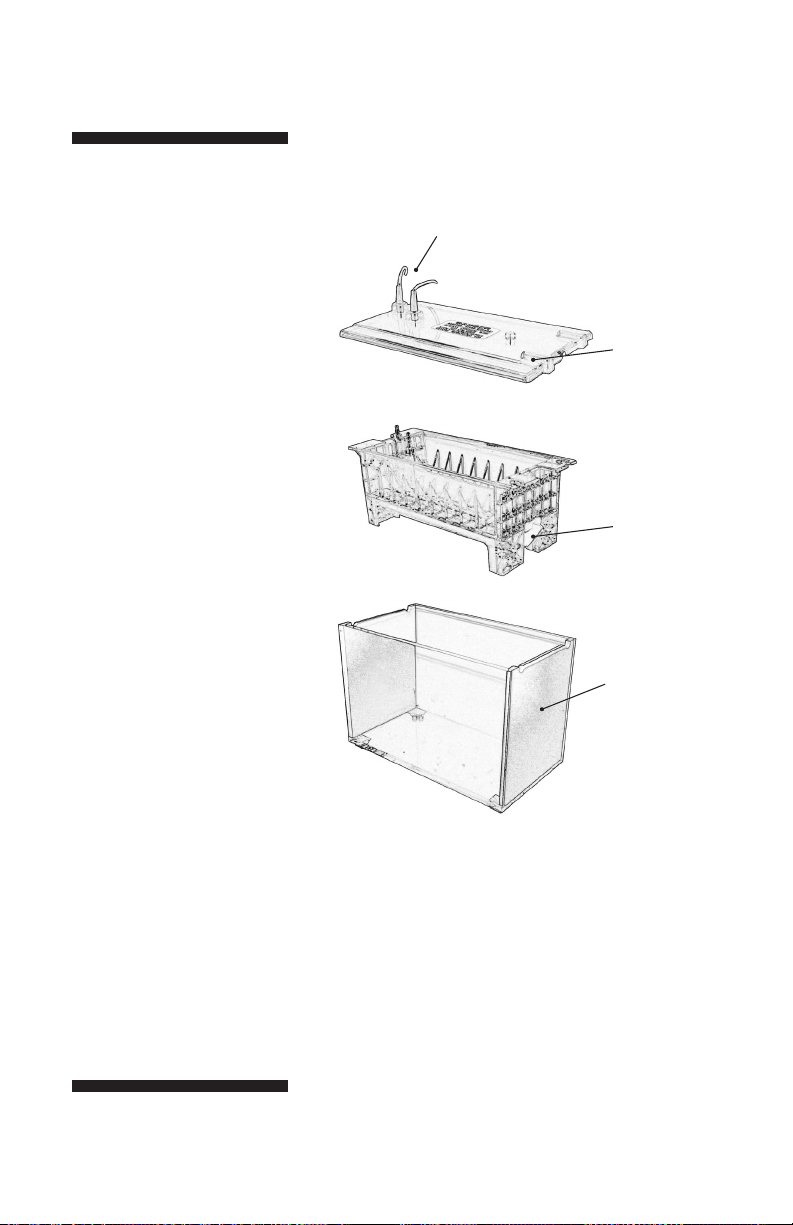
Fig 1. Los principales
componentes de la serie SE640
(véase la Fig. 4 para los
componentes de lanzador).
Incluye pero no se muestran:
• Gel Sello compuesto, 1/4 oz.
• Spacer-Mate alineación de la
plantilla
• Glacas de vidrio (6)
• Wedge Wonder placa de
separación de herramientas
• Presa de búfer
La unidad completa incluye
también separadores (4)
y peines (2).
Necesario, pero no se incluyen:
• Agitador magnético
• Fuente de alimentación con un
calificación mínima de 300 V,
100 mA (constante A o V)
Nota: La sección de ordenar listas
de todos los accesorios y piezas de
repuesto.
cables codificados
por color (2)
seguridad de
la tapa
cámara amortiguadora superior con
electrodo superior
e inferior de la
aleta electrodo
buffer de la
cámara baja
p3
•
Page 12

Desembalaje e inventario
Nota: Antes de usar la primera
vez, desmontar la unidad y se
lava con una solución diluida
de un detergente de laboratorio
y enjuagar primero con agua y
luego con agua destilada.
Quite el envoltorio de los paquetes cuidadosamente y comparar el contenido con la lista de
empaque, asegurándose de que todos los elementos llegaron. Si falta alguna pieza, comuníquese
con su oficina local de ventas. Inspeccione todos
los componentes de los daños que puedan haber
ocurrido mientras la unidad estaba en tránsito.
Si alguna parte está dañada, póngase en contacto de inmediato al transportista. Asegúrese
de guardar todo el material de embalaje para las
reclamaciones por daños o utilizar en caso de ser
necesario devolver la unidad.
Buffer de la cámara baja
La cámara de amortiguación más baja es de
acrílico transparente, que permite el seguimiento
visual del progreso de la electroforesis. La cámara
es químicamente resistente a los tampones
electroforéticos comunes, pero no a los disolventes
orgánicos o ácidos fuertes y alcalinos. Las
temperaturas superiores a 45 °C puede causar la
cámara se deforme.
Cámara de amortiguación superior
La cámara de amortiguación superior se moldea
polisulfona, que es químicamente resistente a los
tampones electroforéticos comunes, pero no a los
disolventes orgánicos o ácidos fuertes y alcalinos.
El electrodo superior (cátodo) corre a lo largo de la
cresta central, y termina en un conector banana. El
electrodo inferior (ánodo) corre a lo largo del borde de
la aleta electrodo en la parte inferior, y termina en un
conector banana segundos.
p4
•
Page 13

Tapa de seguridad
El conector banana en la cámara de amortiguación
superior en el extremo del alambre de cátodo se
conecta al cable negro. El conector banana en la
aleta electrodo inferior en el extremo del cable
se conecta al ánodo del plomo rojo. El hotel de 4
mm cubierto con código de color en el enchufe los
cables codificados por color en tomas de la fuente de
alimentación. Siempre instale la tapa de seguridad
antes de usar!
Las placas de vidrio
Las placas son de 18 cm de ancho y 8 cm de
longitud tres conjuntos de placas de vidrio se incluyen
con cada unidad. Placas con muescas divisorias, pedir
por separado, par dos bocadillos de gel para formar
un “club sándwich”, para que hasta cuatro geles se
pueden ejecutar al mismo tiempo.
Abrazaderas
Abrazaderas se utilizan para asegurar las placas
y los separadores juntos. El bar de presión de la
mordaza, se ajusta con tornillos, distribuye la presión
uniformemente.
Fundición soporte
El soporte de fundición tiene reunidos bocadillos
de gel en posición vertical para la fundición de los
geles. Pies ajustables de nivel del lanzador. Una junta
laminada en la parte inferior de cada cuna sellos
de fundición el fondo del emparedado cuando se
cammed en el soporte.
Cámaras
Cámaras se utilizan dos veces: primero, para asegurar
el sandwich montado en el soporte de fundición
y, segundo, para fijar el sandwich a la cámara de
amortiguación superior.
p5
•
Page 14

Las juntas de goma
Hay dos conjuntos de dos juntas: Las juntas sólidas
laminadas encajan en la parte inferior de la pieza
colada de pie y formar el sello para colar el gel.
Las juntas ranuradas encajar en la cámara de
amortiguación superior y formar el cierre hermético
entre las cámaras superior e inferior. Las crestas en la
junta superior alinear la ranura junta para mantener
un canal abierto entre la parte superior del gel y el
tampón en la cámara superior.
Espaciadores
(Se pueden pedir por separado). Espaciadores
determinar el espesor del gel y están disponibles en
tres espesores (0,75, 1,0 y 1,5 mm).
Spacer-Mate alineación de la plantilla
Alinea los espaciadores de montaje sandwich.
Peines
(Se pueden pedir por separado). Peines están
disponibles en tamaños que forman 10, 12, 15, 20 o
28 pozos, y están disponibles en tres espesores: 0.75,
1.0 y 1.5 mm. Preparativo peines se compone de 1 o
2 pocillos de referencia además de la clave, grande,
así preparativa.
Todos los peines preparativa, y 10, 12, 15 y 20-así
pozos forma peines que son 25 mm de profundidad.
Los pozos de 28 y formas de peine que se encuentran
a tan sólo 15 mm de profundidad por lo que los pozos
no se rompan cuando el peine se retira. El volumen
de muestra a cabo por cada bien depende del espesor
de gel, profundidad del pozo y el número de pozos por
peine. Tabla 1 en la página 16 listas de volúmenes de
muestra de cada bien para todos los peines.
Placa de Wonder Wedge separador de la
herramienta
Se utiliza para desensamblar bocadillos de gel y para
medir espesor del espaciador y peine.
p6
•
Page 15

Manual de instrucciones
Gel de procedimientos de fundición y la electroforesis seguir. Se incluyen instrucciones para
geles de poliacrilamida (usado con sistemas
tampón continuas o discontinuas) y geles de
gradiente.
Los geles se requieren para el SE640 debe ser
auto-yeso. El lanzador de gel de doble (incluido)
contiene dos bocadillos de gel.
Preparar el emparedado de gel
Las placas de vidrio, espaciadores, y los conjuntos de abrazadera están dimensionados de
modo que el sandwich puede ser fácilmente
montado alineado para crear la junta necesaria
para emitir la primera gel y luego a correr. Para
obtener los mejores resultados, tenga especial
cuidado de alinear todos los componentes en el
montaje sándwiches.
p7
•
Page 16

Construir el emparedado de gel y se i
nsertan en rueda
sándwich bordes
superior e inferior
debe quedar a ras
con los bordes de
fijación de guía.
bar de
presión
Fig 2. Sandwich de montaje.
Inspeccione las placas
de vidrio para los apodos.
Utilice únicamente las placas
unchipped para evitar fugas.
Consejo: Utilice la base de
lanzamiento a mantener el
sándwich durante la alineación. Retire la junta laminada de la base y, en lugar
de establecer el sándwich en
posición vertical sobre una
superficie plana, se pone en
la cuna de calidad.
1
Preparar la máquina de colada y abrazaderas
Coloque el nivel de burbuja en el centro de la rueda
y ajuste las patas niveladoras. Afloje todos los
tornillos de fijación y hacer espacio para el bocadillo,
deslizando las placas de presión hacia los tornillos.
2
Construir cada emparedado de gel
Para cada sándwich, elija dos perfectamente limpios
unchipped placas de vidrio y los separadores de dos.
Coloque un plato sobre una superficie plana, ponga el
Mate spacer guía de posicionamiento sobre la placa
(lado ancho en la parte superior de la placa), colocar
un espaciador largo de cada borde, y sentar las
segunda placa de vidrio en la parte superior.
3
Asegurar el sandwich con abrazaderas
Deslice una abrazadera a la vez a lo largo de los lados
del emparedado. Apriete con los dedos un tornillo en
cada abrazadera, fije el sándwich en posición vertical
sobre una superficie plana, y aflojar el tornillo para
ajustar la pila. Tenga mucho cuidado en la alineación
para asegurar la estanqueidad. Apriete con los dedos
todos los tornillos. Retire el espaciador-Mate.
p8
•
Page 17

placas de vidrio
(en los lados
exteriores del
emparedado)
placa
central con
muescas
Fig 3. Asamblea del club sándwich. Abrazaderas de banda sea
dos espaciadores de hasta
1,5 mm de espesor.
Nota: No use grasa de silicona o
vaselina para sellar el sándwich.
Estas sustancias son difíciles de
eliminar y, finalmente, producir
artefactos.
espaciadores
Club sándwich
Una placa central divisor de muescas (pedir por
separado) dos pares de bocadillos para duplicar el
número de geles que se pueden lanzar y correr.
Montar un sándwich de la misma manera como un
sandwich regular, excepto antes de colocar la placa
de vidrio superior, coloque la placa divisora y un
segundo conjunto de espaciadores en la pila. Colocar
la muesca de modo que se situará en la parte superior
de los geles. Es esencial que los separadores y las
placas de alinear perfectamente con el fin de crear
un sello.
4
Quitar el sandwich e inspeccionar la parte inferior
para asegurarse de que los bordes están alineados al
ras con el fin de asegurar un sellado completo. Ajuste
si es necesario.
Opcional: Aplique una capa delgada de compuesto con
sello de gel sólo en las superficies de las esquinas
del fondo creado por los separadores y las placas si
los sándwiches de seguir dejando escapar después de
varios intentos de alineación.
p9
•
Page 18

Nota: Al conectar las cámaras,
es más fácil para mantener la
máquina de colada equilibrada si
a su vez, tanto hacia el centro de
la rueda.
Fig 4. Componentes y la
configuración de Caster.
5
Colocar la junta laminada en el soporte de colada
(Véase la Fig. 4) con la cara hacia abajo espuma.
Coloque el conjunto de la abrazadera en el soporte de
fundición, tornillo lateral mirando hacia fuera.
6
Inserte una leva en el agujero a cada lado de la
bandeja de fundición con el canto (lado corto)
apuntando hacia arriba. Sellar el emparedado de
gel contra la junta de colada girando ambas levas la
medida de lo necesario, por lo general 90° a 150°,
hasta 180°. La acción de leva presiona las placas
hacia abajo en la junta para sellar la parte inferior del
sandwich. El sello se complete una vez que el borde
del vidrio aparece más oscura y casi transparente
contra la junta. No apague la cámara más allá de
este punto.
placa de vidrio
espaciador
junta (lado de
la espuma hacia
abajo)
abrazadera
•
p10
nivel de burbuja
soportes de fundición
patas niveladoras
levas (instalar
finales canto
hacia arriba)
Page 19

Geles de acrilamida
1
Preparar la solución de monómero y verter el gel.
Preparar la cantidad necesaria de solución de
monómero. Purgar y añadir el iniciador y el catalizador justo antes de verter el gel. Pipetear la solución
en una esquina del sándwich, teniendo cuidado de
no introducir burbujas de aire. Véase más abajo para
el nivel de la solución apropiada de acuerdo con la
aplicación.
No gel de apilamiento (sistema continuo).
Solución de llenado hasta justo debajo de la parte
superior del borde de la placa superior. Si las burbujas se encuentran atrapados, retire con una pipeta o
una jeringa. Introducir un peine (con un ligero ángulo)
en cada sándwich, teniendo cuidado de no atrapar
burbujas de aire debajo de los dientes.
Club sándwich.
Pipetear la solución en ambos emparedados, llenando
cada uno al mismo nivel por debajo del borde con
muescas.
Gel de apilamiento.
Completa solución a 3-4 cm por debajo de la parte
superior de la placa de vidrio. Esta altura permite 1 cm
de gel de apilamiento por debajo de los pozos. Verter el
gel y aplicar una plantilla (ver paso 2). Después el gel
se establece, preparar el gel de apilamiento, como se
describe a continuación.
La 2-D electroforesis (sistema de la proteína discontinua).
Completa solución de monómero de aproximadamente
1 cm por debajo de la parte superior de la placa de
cristal para permitir 4 a 5 mm para la tira IPG o gel
de tubo y un sello de agarosa. (Un gel de apilamiento
se requieren espacio adicional). Selle la tira IPG o gel
tubo en su lugar con la agarosa disuelta en la gestión
de memoria intermedia. Tenga cuidado de no atrapar
burbujas de aire entre los geles de primera y segunda
dimensión.
•
p11
Page 20

2
Superponer cada gel con una delgada capa de
agua saturada de n-butanol, agua o tampón de gel
diluida para evitar la exposición al oxígeno de gel.
Lentamente entregar la solución de superposición
de una jeringa de vidrio equipado con una aguja de
calibre 22. Aplicar la solución cerca del espaciador en
el lado del sandwich y permitir que fluya a través de
la superficie sin ayuda.
3
Permitir que el gel se polimeriza durante un mínimo
de una hora.
Preparación de gel de apilamiento
Verter el gel de apilamiento mientras que el sándwich
se encuentra todavía en la máquina de colada de gel.
Apilamiento resolución gel es óptimo cuando se vierte
justo antes de la electroforesis.
1
Eliminar la superposición de un enjuague la parte
superior del gel varias veces con agua destilada.
Invertir el lanzador a la fuga. A fin de garantizar un
contacto perfecto entre la resolución y apilamiento
geles, eliminar el líquido residual secante una esquina
con un paño libre de pelusa.
•
2
Preparar la cantidad necesaria de solución de gel
de apilamiento monómero, que desairear, y añadir
catalizador (APS) y el iniciador (TEMED). Verter el gel
de apilamiento en el gel de resolución con una pipeta
Pasteur desechable o de un nivel de aproximadamente
2 mm desde la parte superior de la placa.
3
Introducir un peine (con un ligero ángulo) en el
emparedado, teniendo cuidado de no atrapar el aire
bajo los dientes. Permita un mínimo de una hora para
que el gel se polimeriza.
p12
Page 21

Fig 5. Verter un gel de gradiente.
La solución de gel pueden ser
introducidos en el emparedado
de gel a través de una punta
de pipeta a una velocidad que
mantiene un flujo continuo.
Opcional: Ajuste la solución de
acrilamida de mayor porcentaje
al 15% (w/v) de sacarosa o
25% (v/v) de glicerol para
mejorar estratificación.
Geles de gradiente
Ambos geles de gradiente lineal y exponencial se
puede verter en la máquina de colada de gel de
doble. Le recomendamos que utilice un Hoefer
SG Creador de la serie de gradiente. Geles de
gradiente se vertió con una cánula de la parte
superior de la máquina de colada de gel de doble
(ver Fig. 5). Un gel de apilamiento se vierte
entonces sobre el gel de gradiente.
Verter un gel de gradiente lineal
1
Ensamble sandwich(s) en la máquina de colada de gel
de doble tal como se describe en la página 8.
2
Establecer la solución de monómero trayectoria de flujo
Ejecutar una longitud de Tygon™ tubo a través de
una bomba peristáltica. Una un extremo del tubo al
puerto de salida gradiente fabricante y el otro extremo
a una cánula de 9 cm. (El diámetro exterior de la
cánula debe ser menor que el espesor del espaciador.)
Coloque la cánula de manera que descansa en la
parte inferior del sandwich, a medio camino entre los
espaciadores.
3
Prepare la solución de monómero
Calcular el volumen de solución de monómero sea
necesario. Divida el volumen total a la mitad y la
preparación de este volumen tanto de las soluciones
de mayor y menor porcentaje de acrilamida.
•
p13
Page 22

4
Verter la “luz” solución en la cámara de depósito
(la cámara más alejada de la entrada). Abra la llave
de paso el tiempo suficiente para desplazar el aire
entre las cámaras y luego cierre. Verter el “pesado”
solución en la cámara de mezcla y colocar una barra
de agitación en esta cámara. Coloque el fabricante
de gradiente sobre un agitador magnético y comenzar
agitación a una velocidad que se mezcla bien, pero no
introducir burbujas en la solución.
5
Mezclar el gradiente y bombear la solución en el sandwich
Mientras que la solución se agita, empezar a bombear
desde la cámara de mezcla y abra la llave de paso a
la cámara de depósito. Levante la cánula que entre
líquido en el sándwich, manteniendo la punta en
la superficie del gel. Preparar más geles según sea
necesario.
6
Superponer cada gel con una delgada capa de
agua saturada de n-butanol, agua o tampón de gel
diluida para evitar la exposición al oxígeno de gel.
Lentamente entregar la solución de superposición
de una jeringa de vidrio equipado con una aguja de
calibre 22. Aplicar la solución cerca del espaciador en
el lado del sandwich y permitir que fluya a través de
la superficie sin ayuda.
•
7
Permitir que los geles para polimerizar durante un
mínimo de una hora. Después de la polimerización, se
vierte la superposición y enjuagar la superficie del gel
varias veces con agua destilada.
8
Preparar la solución de gel de apilamiento monómero,
verter el gel de apilamiento e introducir un peine (con
un ligero ángulo) en el emparedado, teniendo cuidado
de no atrapar el aire bajo los dientes. Permita un
mínimo de una hora para que el gel se polimeriza.
p14
Page 23

Nota: Con Coomassie Blue™
es posible detectar 1 µg de
proteína en una sola banda.
Con las manchas de plata más
sensibles, es posible detectar
tan poco como 10 ng de
proteína.
Preparación de la muestra y carga
La muestra puede ser cargado ya sea mientras
el sandwich está en la máquina de colada o
después de la cámara de amortiguación superior
está unido. Al cargar las muestras durante el uso
de placas divisorias, las muestras deben ser cargados sin la cámara de amortiguación superior
en su lugar.
La cantidad de muestra cargada depende del espesor del gel, la sensibilidad del método de detección
utilizado, y la cantidad de muestra se espera en
cada banda. En un sistema tampón continuo, la
muestra de proteína debe ser relativamente concentrada, porque no se utiliza gel de apilamiento. En
un sistema de tampón discontinuo, la zona en la
que cada especie molecular migra se agudiza por
el gel de apilamiento, de modo que la muestra no
necesita ser tan concentrada.
1
Preparar los pozos
Quite el peine suavemente moviéndola de lado a lado
y luego levantándolo hacia arriba para evitar daños en
las paredes del pozo. Enjuagar cuidadosamente cada
pocillo con agua destilada para eliminar acrilamida no
polimerizada y luego drenar invirtiendo el emparedado
de gel (o lanzador). Llene cada pocillo con el tampón
de electroforesis.
•
p15
Page 24

2
Preparar la muestra
Aumentar la densidad de líquido de muestra con 10%
de glicerol o sacarosa. Añadir un tinte de seguimiento
como el rojo fenol, azul de bromofenol, o Y. pironina
Para geles de proteínas SDS, utilice 2X tampón de
tratamiento para desnaturalizar muestras líquidas y en
seco en un tubo de ensayo.
Para soluciones de proteínas líquidas, añadir un
volumen igual de tampón de 2X.
Para secar las muestras de proteínas, añadir volúmenes
iguales de tampón de muestra 2X y agua de alta
pureza para alcanzar la concentración deseada.
Nota: Una vez que las muestras
se encuentran en los pozos,
tener cuidado de no sacudir
los sándwiches de forma que
las muestras no se derrame o
mezclado.
3
Se calienta el tubo en agua hirviendo durante 90
segundos, luego se deja enfriar a temperatura
ambiente. Las muestras tratadas se pueden almacenar
a -40 a -80 °C durante carreras futuras.
Proteínas de membrana de calor a 60 °C durante 20
minutos. No conserve la muestra utilizada a 4 °C.
4
Sirvieron de base al de la muestra en los pocillos
utilizando una microjeringa de punta fina o un gel de
carga punta de la pipeta.
Tabla 1. Volumen de la muestra para el estándar de
tamaños de peine, volumen de la muestra (µl) por la
profundidad de 1 mm
número espesor de peine (mm)
de pozos 0,75 1,0 1,5
10 6,2 8,3 12,4
12 5,8 7,7 11,5
15 4,3 5,7 8,6
20 3,1 4,1 6,2
28 2,1 2,7 4,1
1/1 (ref/prep) 4/90 6/121 9/183
1/2 (ref/prep) 4/85 6/112 9/171
•
p16
Page 25

Fig 6. Colocación de bocadillos de
gel a la cámara de amortiguación
superior.
Si las fugas de montaje, llévelo
a un fregadero y parcialmente en
libertad a los cámaras de amortiguación para permitir el drenaje
de la cámara alta. Desmontar,
verificar la alineación de todos los
componentes de paneles sándwich, y ajustar si es necesario.
A. Quite las levas de los orificios
inferiores de la leva. Coloque la
cámara alta en los bocadillos y
luego insertar las levas en los
agujeros de levas superior, cresta
(extremo corto) apuntando hacia
abajo.
B. La posición de la leva final (no
mostrado) debe ser vertical, de
manera que el montaje se ajusta
en la cámara de amortiguación
inferior.
Nota: No fuerce las levas.
Si se encuentra con una resistencia inusual, desmontar e inspeccionar la abrazadera y la alineación
de cristal a lo largo de la parte
superior del emparedado. Alinee y
vuelva a instalar.
El montaje final
Cámara de amortiguación superior
1
Enjuague las dos cámaras de amortiguamiento con el
agua y el agua destilada antes de cada uso.
Limpie cualquier gel de adherirse a la parte exterior
de los emparedados de gel.
2
Si se ejecuta un solo gel:
Bloquear la segunda ranura de la cámara superior de
amortiguación mediante la instalación de la represa
de amortiguación de acrílico incluido con la unidad.
Coloque las abrazaderas en la presa, teniendo cuidado
de alinear los extremos de la abrazadera y los bordes
de la presa. Instale los ficticias de gel, tornillos hacia
afuera, en la segunda cuna de la máquina de colada
de gel de doble.
3
Coloque el emparedado de gel a la cámara de
amortiguación superior.
Encienda la cámara de amortiguación superior boca
abajo y colocar una junta con ranuras en ambas
cavidades sándwich titular. Tanto la ranura de la junta
y la ranura en el hueco debe alinear. Ambas juntas
ranuradas debe ser utilizado incluso si se ejecuta sólo
un emparedado de gel. Ranuras a lo largo de cada
ranura de ayudar a mantener la junta en su lugar.
Además, una pequeña cantidad de gel sello puede ser
aplicado a cada extremo de la junta antes de instalar
para ayudar a sujetar la junta contra la cámara de
amortiguación superior.
Suelte los sándwiches de la máquina de colada
mediante la eliminación de todas las cámaras
inferiores (si existe). Baje la cámara de amortiguación
superior en los bocadillos de gel en el soporte de
fundición. Instale las levas, canto apuntando hacia
abajo, en el buffer de la cámara de los agujeros de
la leva. Leva el sándwich en lugar simultáneamente
girando una leva en sentido horario y el otro en
sentido antihorario a 180°.
•
p17
Page 26

4
Utilizar una pipeta para llenar cuidadosamente
cada ranura por encima de los pocillos de muestra
con tampón con el fin de minimizar perturbar las
muestras. A continuación, vierta 100 ml de tampón
en la cámara, dirigiendo el flujo hacia el buffer de la
pared lateral. Compruebe que no se está escapando
de amortiguación alrededor de la junta.
Buffer de la cámara baja
1
Coloque una barra magnética magnético en la cámara
de amortiguación inferior y coloque la unidad sobre
un agitador magnético.
Llenar la cámara inferior con un mínimo de 2,1 litros
de tampón.
Opcional: enfriamiento previo del búfer.
2
Instale el conjunto de búfer en la cámara superior
de la cámara de amortiguación inferior. Utilice una
mano firme para no molestar a las muestras: Sujete
el conjunto en el soporte de fundición por la cámara
de amortiguación superior y bajar con cuidado en la
cámara de amortiguación inferior.
•
3
Inspeccione la instalación y ajustar los niveles de
amortiguación.
La cámara superior. El electrodo a lo largo de la
cresta cámara superior debe estar sumergida a una
profundidad de aproximadamente 1 cm. Este nivel
requiere 450-600 ml de tampón: lo suficiente para
cubrir las costillas de la cámara superior, pero no lo
suficientemente alto para ponerse en contacto con el
conector banana.
Baje la cámara. La cámara de tampón nivel inferior
requiere un mínimo de 2,1 litros y un máximo de
2,8 litros de tampón; suficientes para cubrir el
alambre sobre el electrodo inferior de la aleta, pero
manteniendo una distancia de 1,5 cm desde la parte
inferior de la cámara de amortiguación superior.
p18
Page 27

4
Coloque la tapa de seguridad de la unidad.
5
Conecte los cables codificados por color en las tomas
de una fuente de alimentación aprobada. Conecte
el cable rojo a la salida de conector rojo y el negro
en el enchufe de salida negro. En la mayoría de
los sistemas, el plomo rojo, que está conectado al
electrodo inferior, es el ánodo (+), y el cable negro,
conectado al electrodo superior, es el cátodo (–).
Notas importantes de montaje:
• No llene la cámara superior o inferior por encima
de los niveles recomendados se ilustra en la figura
7. Quitar tampón en contacto con los puestos de
electrodos.
• Verter tampón lentamente y lejos de las ranuras
en la cámara de amortiguación superior para evitar
perturbar las muestras.
Fig 7. Amortiguar los niveles
de la cámara.
cámara superior
nivel de la solución
cámara baja el nivel
de amortiguación
p19
•
Page 28

La separación de la muestra
Nota: Todos los modelos de la
serie SE600 utilizan placas de
18 cm de ancho. El espesor
de gel determina la sección
transversal (y el requisito de
corriente). La longitud de la
placa determina el tiempo de
ejecución.
Tabla 2: Sistema de tampón
de Laemmli partida
directrices punto
Gel de espesor* 1,5 mm
Actual por gel† 25 mA
A partir de tensión‡ 80 – 90 V
Tensión final 220 – 250 V
* Geles más gruesas o más delgada requieren
proporcionalmente más o menos corriente. Por
ejemplo, un gel de 0,75 mm, que es la mitad del
grosor de un gel de 1,5 mm, requiere la mitad
como mucho de corriente, o mA 12,5.
†
La corriente debe ser multiplicado por el número
de geles. Por ejemplo, si dos sándwiches
están instalados, los cuatro geles requieren
cuatro veces más actual. La corriente se puede
aumentar más rápidas carreras si se utiliza
enfriamiento activo y puede ser disminuido por
más lentas carreras durante la noche.
‡
A los 25 mA por gel.
corriente
constante
Parámetros de electroforesis para geles de
poliacrilamida discontinuos
Los geles se pueden ejecutar en contextos de
tensión constante de corrientes o constantes.
Un ajuste de corriente constante se utiliza tradicionalmente con un sistema de tampón discontinuo de modo que la velocidad de migración
electroforética permanece inalterada a lo largo
de la carrera. Bajo estas condiciones, la tensión
aumenta a medida que avanza plazo. Un valor
más bajo en curso se recomienda para una
mayor resolución. El nivel óptimo de corriente se
debe determinar empíricamente; los principales
factores que deben equilibrarse incluyen la concentración del gel y la velocidad de migración, y
el calentamiento Joule y la distorsión resultante
banda. La Tabla 2 lista de salidas directrices
puntuales y ajustes para el espesor de gel, el
número de geles, y tasa de migración.
Corriente
Actos corrientes sobre el total de área de sección
transversal de todos los geles porque los geles están
conectados en paralelo en el circuito eléctrico. Así, la
configuración actual de un gel debe ser multiplicado
por el número de geles del espesor mismo gel que se
ejecutan de forma simultánea. Para un gel de 1,5 mm
de espesor, se aconseja un ajuste de la corriente
de arranque de 25 mA. (Dos de 1,5 mm de geles =
50 mA.)
•
Voltaje
El voltaje de partida para un gel de 1,5 mm de losa
conectado a una fuente de alimentación ajustado a
25 mA es generalmente de 80 a 90 V (utilizando
la SE 600 con un sistema tampón de Laemmli
discontinua para geles de SDS). El voltaje final
típicamente puede variar desde 220 hasta 400 V,
dependiendo de la longitud del gel. (Ver Tabla 2.)
p20
Page 29

¡Atención! Después de monitoreo
inicial, no deje la unidad sin
usar por más de 1 hora antes
de comprobar el progreso
de las bandas y el nivel de
amortiguación.
Tiempo
Una ejecución es completa cuando el colorante de
rastreo alcanza la parte inferior del gel. 1,5 mm de
espesor Laemmli en gel de SDS, que funcionaba a
25 mA/gel sin refrigeración, por lo general requiere de
2.5 horas.
Electroforesis parámetros para ADN /
acrilamida geles
Geles de ADN normalmente son operados a un ajuste
de voltaje constante, y dado que los sistemas de
amortiguación son continuas, ambas lecturas de
corriente y tensión se mantienen constantes a lo
largo de la carrera. Condiciones de funcionamiento se
expresa en unidades de V/cm. Publicado condiciones
de funcionamiento varían ampliamente, pero
tensiones en el rango de 1 a 3 V/cm son comunes
para carreras durante la noche.
Registre cada carrera
Mantenga un registro de la configuración de corriente
o voltaje, el número y el grosor de los geles,
sistema de amortiguación, y las lecturas inicial y
final de corriente o voltaje para cada carrera para
que los resultados pueden ser comparados. Los
resultados inconsistentes para el mismo sistema
y la configuración de indicar posibles problemas
como la filtración de las concentraciones actuales de
búfer incorrecto, las altas concentraciones de sal o
productos químicos de calidad inconsistente.
Comprobar el progreso de la banda después de
5 minutos, y de nuevo después de una hora,
manteniendo un ojo en la tasa de migración del
colorante de seguimiento. La carrera se completa
cuando el colorante de rastreo alcanza la parte
inferior del gel. Ver el nivel de amortiguación y, si es
necesario, reponer según sea necesario para mantener
el electrodo superior sumergido. (Un pequeño
volumen de tampón puede filtrarse pasado una placa
de muescas o junta, o tampón puede pasar a través
del gel.)
•
p21
Page 30

Después de la electroforesis
1
Una vez que el tinte de seguimiento llega a la parte
inferior del gel, apague la fuente de alimentación,
desconecte los cables y retire la tapa de seguridad.
(Levante hacia arriba para evitar que se doblen las
bananas.)
2
Saque el conjunto de buffer de la cámara superior.
Vierta el buffer en un fregadero. Instale el ensamblado
en la máquina de colada de gel de doble y luego
suelte los sándwiches girando y la eliminación de las
levas.
3
Aflojar las abrazaderas de los bocadillos y quitar.
Afloje suavemente y luego deslice lejos ambos
espaciadores. Utilice la Maravilla Hoefer cuña placa
herramienta separador para separar las placas.
Nota: Utilice únicamente
herramientas flexibles de
plástico de palanca para evitar
que se astille las placas de
vidrio.
p22
•
4
Levante con cuidado la placa de vidrio con el gel
adjunta. Manejar el gel con cuidado para evitar
dañarlo. Invertir la placa y la posición del gel a baja
altura sobre la bandeja de tinción. Haga palanca en
una de las esquinas del gel fuera de la copa y la deje
caer en la bandeja, o, si el gel es suficientemente
gruesa como para manejar, levantar y colocar en la
bandeja. Para evitar salpicaduras, manchas o añadir
la solución de fijación a la bandeja después de que el
gel se transfiere.
5
Limpieza de la unidad como se describe en la sección
siguiente.
Page 31

¡Atención! Desconecte siempre la
unidad del tomacorriente antes
de limpiar o secar la unidad.
Cuidado y mantenimiento
Limpieza
Inmediatamente después de cada uso, enjuague
las cámaras de amortiguación superior e inferior con agua y luego enjuague bien con agua
destilada. Manejar la cámara de amortiguación
superior con cuidado para evitar daños a los
enchufes de plátano y la parte inferior de las
aletas de los electrodos. Limpie las juntas con un
detergente suave y enjuague con agua destilada.
Deje secar al aire.
Limpiar las placas de vidrio y los espaciadores
con una solución diluida de un limpiador de laboratorio tales como RBS-35™, después enjuague
con agua del grifo y agua destilada. Las placas
de vidrio también puede ser tratado con (pero
no se almacenan en) soluciones de ácido de
limpieza.
• No esterilizar en autoclave o calentar cualquier
parte por encima de 45 °C.
• No utilice disolventes orgánicos, productos
abrasivos, soluciones de limpieza fuertes o
ácidos o bases fuertes para limpiar las cámaras.
• No se moje el empaque laminado.
•
p23
Page 32

¡Importante! Solicite una copia
de la Hoefer, Inc. “Declaración de Salud y Seguridad”
formulario antes de devolver
el artículo. No hay artículos
pueden ser aceptados para su
reparación o devolución a menos
que este formulario esté debidamente cumplimentado.
Nota: de Autorización de Retorno
(RA) se debe obtener de Hoefer,
Inc, antes de devolver cualquier
artículo que Hoefer, Inc.
Información del cliente de servicios
Servicio técnico y reparación
Hoefer, Inc. ofrece soporte técnico completo
para todos nuestros productos. Si usted tiene
alguna pregunta acerca de cómo utilizar este
producto, o si desea disponer lo necesario para
reparar, por favor llame o envíe por fax su
Hoefer local, Inc. representante.
Visite el sitio web Hoefer, Inc. al
www.hoeferinc.com para el distribuidor en su
área. O contactar directamente con nosotros en:
Hoefer, Inc.
84 October Hill Road
Holliston, MA 01746
Línea gratuita: 1-800-227-4750
Teléfono: 1-508-893-8999
Fax: 1-508-893-0176
support@hoeferinc.com
www.hoeferinc.com
•
p24
Page 33

Solución de problemas
problema posible causa remedio
Las fugas de gel
de tipo sándwich,
mientras fundición
Muestra los
pozos dañados o
irregular
Componentes sucios
o dañados
Mis aliados con
las partes
El exceso
de sujeción
Las burbujas
de aire
Polimerización
incompleta o
retrasada
Escombros en los
pozos
Eliminación de peine Quite el peine con un ligero ángulo y muy lentamente para
Las placas, separadores, y la junta debe estar completamente
limpia. Lavar si es necesario.
Vuelva a colocar las placas con chip (especialmente si están
cascadas cerca de los separadores).
Compruebe la junta de lanzador para cortes o grietas y reemplazar si es necesario.
Verifique la alineación de la placa y el separador, vuelva a
alinear si es necesario.
Gire a la cámara sólo en la medida necesaria para crear un
sello (por lo general 90-150°, pero hasta 180°).
En cada separador aplicar una capa delgada de gel compuesto de sello en la parte inferior esquina exterior solamente. No
utilice grasa de silicona.
Eliminar las burbujas de aire antes de insertar los peines.
Deslice peine en solución en un ángulo. Si el peine se debe
quitar, añadir más solución de monómero antes de volver a
colocar el peine.
Permitir geles de acrilamida para establecer un mínimo
de 1 h.
Enjuague de gel polimerizado con tampón de muestra.
evitar dañar el gel.
Geles de agarosa: Bajar el peine no más de 1 cm en el gel.
Seguimiento de
tinte no afilar en
una zona concentrada en el gel de
apilamiento
Pobre de
apilamiento
Reactivo de
la calidad
Preparación de la
muestra
Vierta un gel más alto de apilamiento. (Para obtener los
mejores resultados, permita una altura de apilamiento de gel
de 2,5 veces la altura de la muestra en el pozo.)
Deshágase de las soluciones de acrilamida obsoletas y usar
sólo el grado más alto de la acrilamida.
En la preparación de muestras, evitar el uso de soluciones
con altas concentraciones de sal.
p25
•
Page 34

problema posible causa remedio
Polimerización de
gel incompleta
Superiores perdidas de buffer de la
cámara
Fuente de alimentación detecta
fugas de corriente
Productos químicos Utilice únicamente las poblaciones de los últimos de los
pH Las soluciones con valores de pH extremos (especialmente
Oxígeno Quitar el oxígeno del medio ambiente en gel: desgasificar la
Temperatura Ajustar la temperatura de la solución de gel a un mínimo de
Mis aliados con las
partes
Componentes sucios
o dañados
Trayectoria eléctrica
a tierra fuera
reactivos de la más alta calidad.
Si el persulfato de amonio seco no crepitan cuando se añade
al agua, sustituir con caldo fresco.
Aumentar TEMED o concentración de APS, o ambos.
ácido) no puede polimerizar.
solución monómero 5-10 min antes de verter y luego superponer la superficie del gel con agua saturada de n-butanol.
20 °C, especialmente para bajos% geles T.
Compruebe que las placas de vidrio, espaciadores, y las
abrazaderas se alinean y encajan perfectamente en la junta
de la cámara superior.
Compruebe que ambas juntas están centrados y que las
crestas de posicionamiento que encajen en las ranuras.
Verifique que el empaque no esté dañado o aplastado.
Reemplace si es necesario. Compruebe que la cámara de
amortiguación superior no está deformado por la exposición
previa a un calor excesivo.
Añadir más grasa de silicona para sellar los ojales del intercambiador de calor.
Compruebe si hay fugas o grietas en el intercambiador de
calor. Vuelva a colocar arandelas desgastadas.
Curvas delanteras
hasta Dye (sonríe)
en los bordes
p26
•
Desigual distribución
del calor
El exceso de calor Circular ext. refrigerante. Disminuya el valor de corriente o
Llenar la cámara de amortiguación inferior al nivel apropiado
para la ejecución en los bordes. (Véase la Fig 7, página 19).
Usar agitador magnético y una barra de agitación para mantener tampón que estén bien mezclados.
voltaje.
Enfriamiento previo del búfer. Ejecutar el gel en la
cámara fría.
Page 35

problema posible causa remedio
Rayas verticales
de proteínas
Inusualmente lento
(o rápido)
de ejecución
Las bandas están
sesgados o distorsionados
Las partículas de la
muestra
La sobrecarga Cargar menos muestra.
Degradación Añadir inhibidor de la proteasa, tales como PMSF.
La fuga de corriente
en torno de gel
Muestra o preparación de los reactivos
Reactivo de la
calidad
Valores de voltaje o
corriente
Preparación del gel
y la polimerización
incompleta
Interfaz de apilamiento irregular entre
en funcionamiento
geles
Centrifugar o filtrar la muestra antes de la carga para eliminar las partículas.
Compruebe si hay fugas, todas las placas y los separadores
debe estar alineada y libre de grasa y las grietas.
Si se utiliza, la presa de almacenamiento intermedio debe
ser seguro.
Si el pH requerido de una solución que se rebase, no valorar
en retroceso. Descartar y preparar tampón nuevo.
Compruebe recetas, las concentraciones de gel, y la dilución
de amortiguación. (Por ejemplo, no utilice Tris-HCl en vez de
Tris para el tampón de Laemmli tanque.)
Disminuir la concentración de sal de las muestras.
Deshágase de las soluciones de acrilamida mayores y utilizar
sólo acciones de la más alta calidad. Use sólo la urea recién
desionizada.
Para aumentar o disminuir la velocidad de migración, ajustar
el. Voltaje o corriente en un 25-50%
Desgasificar el apilamiento-gel de la solución y evitar burbujas de aire bajo los dientes del peine.
Superponer el gel de funcionamiento con agua saturada con
butanol antes de la polimerización comienza, para evitar la
formación de un gel de superficie desigual.
Preparación de la
muestra
Dializar o desalar la muestra.
•
p27
Page 36

problema posible causa remedio
Muestra teñida recoge:
Cerca de la
parte delantera
tampón
Gel de concentración Las moléculas no están lo suficientemente restringido por el
tamaño de poro de gel de resolución de: aumentar la% T.
Degradación Las proteínas pueden ser degradadas por proteasas endóge-
nas: utilizar inhibidores de la proteasa durante la etapa de
aislamiento.
Cerca de la
parte superior
del gel cuando
el frente tampón
ha alcanzado la
parte inferior
En la parte
superior e inferior del gel
Gel de concentración El tamaño de los poros del gel es demasiado pequeño: dis-
minuir la T% de la resolución (o encima) de gel.
Precipitación La proteína ha precipitado. Se calienta la muestra a una
temperatura más baja (70 °C o menos) durante 1-2 min.
Gel de concentración El rango de peso molecular de la muestra requiere un gradi-
ente de concentración de acrilamida para resolver la gama
completa de tamaños de las proteínas.
•
p28
Page 37

problema posible causa remedio
Resolución de la
banda pobre
condiciones de
funcionamiento
reactivo de la calidad Use sólo los reactivos de la más alta calidad.
Pobre de apilamiento Utilice solamente los geles que estaban recién preparado.
Polimerización de gel
incompleta
preparación de la
muestra
Comienza electroforesis tan pronto como la muestra se carga
para evitar las especies de bajo peso molecular a partir de
la difusión.
Llevar a cabo la separación en una posición más baja de corriente o tensión para reducir el calentamiento Joule.
Añadir un gel de apilamiento o aumentar la altura del gel de
apilamiento. Preparar la superficie Resolviendo-gel por primera vez aclarado con monómero de apilamiento de gel antes
de verter el gel de apilamiento para asegurar la continuidad
entre los geles.
Compruebe los valores de pH de las resolución de apilamiento y-gel soluciones. No valorar en retroceso tampones.
Permitir gel para polimerizar completamente.
Almacenar la muestra en hielo antes de que sea desnaturalizada.
Dializar o desalar la muestra.
Muestras de calor en tampón de muestra SDS para no más
de 1-2 minutos a 100 °C para mejorar la disociación de las
subunidades. Almacenar en hielo después del calentamiento.
Ajustar el volumen de muestra o de la concentración.
Añadir más mercaptoetanol o ditiotreitol, revisar el trata-
miento de la muestra.
Añadir inhibidores de proteasa tales como PMSF si es nec-
esario para evitar la degradación proteolítica de la muestra.
Aumentar glicerol o sacarosa para aumentar la densidad de
la muestra.
Almacene las muestras que se congeló en alícuotas para
evitar repetidas congelación-descongelación. Almacenar a
-40 a -80 °C.
•
p29
Page 38

Apéndice A: Sistema de Laemmli geles
El sistema de Laemmli es el protocolo más
común para electroforesis SDS-desnaturalizadas
proteínas. El ion principal en este sistema de
tampón discontinuo es el cloruro y el ion final es
la glicina. En consecuencia, el gel de resolución y
el gel de apilamiento contener tampones Tris-Cl
(de diferente concentración y pH), y el tampón
de electroforesis contiene Tris-glicina. Todos los
tampones contienen 0,1% de SDS.
La composición en gel de poliacrilamida se indica
mediante dos diferentes porcentajes:
% T = total acrilamida = g (acryl + bis) × 100
100 ml
% C = crosslinker = g (bis) × 100
g (acryl + bis)
•
p30
Page 39

El porcentaje total de acrilamida (% T) en el gel
de resolución, que puede variar desde 5 a 20%,
determina el tamaño del poro. Comúnmente, la
cantidad de reticulante utilizado (% de C) es de
2,6%. En el sistema siguiente ejemplo, la composición gel de resolución es de 10% T, 2,6%
de C, que da como resultado un tamaño de poro
medio. La composición de gel de apilamiento es
4% T, 2,6% C. La T% en el gel de apilamiento
es menor debido a un tamaño de poro grande se
requiere.
Las concentraciones finales
Electroforesis de
Separación de gel Gel de apilamiento amortiguación
Acrilamida conc. 10% T*, 2,6% C 4% T, 2,6% C
Tris-Cl 0,375 M 0,125 M
Tris-Glycina 0,025 M Tris base
pH 8,8 6,8 ~8,3
SDS 0,1% 0,1% 0,1%
Persulfato de amonio (APS) 0,05% w/v 0,05 – 0,1% w/v
TEMED† 0,05% v/v 0,05 – 0,1% v/v
* Para lograr cualquier otra concentración final deseada, ajustar el volumen de acciones de acrilamida y el agua. Los
volúmenes para diferentes concentraciones se enumeran en la página 35.
†
Tetramethylethylenediamine
0,192 M glycina
•
p31
Page 40

Nota: Las soluciones de filtro 1
a 4 a través de un filtro de 0,45
micras.
¡Importante! Consulte la ficha de
seguridad (MSDS) que acompaña a cada producto químico
para el manejo de información
detallada y la seguridad.
¡Atención! La acrilamida es
una neurotoxina. Siempre
use guantes al manipular en
cualquier forma y usar una
máscara cuando se pesa el
polvo. Nunca pipetear la boca
de la solución.
Soluciones
1. La acrilamida solución madre
(30,8% T 2,6% de C Bis, 200 ml)
Acrilamida (FW 71.08) 30% w/v 60 g
Bis* (FW 154.2) 0,8% w/v 1.6 g
H2O desionizada a 200,0 ml
Almacenar a 4 °C, protegido de la luz.
*N,N’ Methylenebisacrylamide
2. 1,5 M TrisCl, pH 8,8
(Tampón 4X gel de resolución, 1 litro)
Tris (FW 121,1) 1,5 M 181,6 g
HCl 4 N a pH 8,8
H2O desionizada a 1000 ml
3. 0,5 M TrisCl, pH 6,8
(4X tampón gel de apilamiento, 500 ml)
Tris (FW 121,1) 0,5 M 30,3 g
HCl 4 N a pH 6,8
H2O desionizada a 500 ml
4. 10% de SDS solución
(100 ml)
Dodecilsulfato sódico 0,35 M 10,0 g
(SDS) (FW 288,4)
H2O desionizada a 100 ml
•
5. 10% de APS
(Iniciador, 1 ml)
Persulfato de amonio 0,44 mM 0,1 g
(APS) (FW 228,2)
H2O desionizada a 1,0 ml
APS fresco “crujidos” cuando se añade agua. Si el suyo no lo
hace, reemplazarlo con material fresco. Preparar justo antes
de usar.
p32
Page 41

6. 0,375 M TrisCl, SDS al 0,1%, pH 8,8
(Gel de resolución de superposición, 100 ml)
1,5 M de Tris-Cl, pH 8,8 (Soln. #2) 0.375 M 25,0 ml
10% de SDS (Soln. #4) 3,5 mM 1,0 mL
H2O desionizada a 100,0ml
-O-
El agua saturada de n-butanol
Agitar n-butanol y desionizada H2O en un embudo de separación. Retire la acuosa (inferior) de fase. Repita este procedimiento varias veces. Utilice la fase superior.
-O-
Si una superposición interfiere con el protocolo preferido,
aislar el gel a partir del oxígeno atmosférico mediante la
colocación de un peine en blanco o resolver formador de gel
en el gel.
7. Ejemplo 2X tampón tratamiento
(0,125 M TrisCl, 4% de SDS, 20% de glicerol,
2% de 2-mercaptoetanol, pH 6,8, 10 ml)
0,5 M de Tris-Cl, pH 6,8 (Soln. #3) 0,125 M 2,5 ml
10% de SDS, 0,35 M (Soln. #4) 0,14 M 4,0 ml
Glicerol (FW 92.09) 20% v/v 2,0 ml
2-mercaptoetanol (FW 78.13) 2% v/v 0,2 ml
[-O-ditiotreitol (DTT) 0,2 mM 0,31 g]
(PF 154,2)
Azul de bromofenol (FW 691,9) 0,03 mM 0,2 mg
H2O desionizada a 10,0 ml
Dividir en partes alícuotas de 1,0 ml y se almacena a -40 °C
a -80 °C.
-O-
Ejemplo 6X tampón tratamiento
(0,35 M TrisCl, 10% de SDS, 30% de glicerol, 9,3% DTT,
pH 6,8, ~10 ml)
0,5 M de Tris-Cl, pH 6,8 (Soln. #3) 0,35 M 7,0 ml
SDS (PF 288,4) 0,35 M 1,0 g
Glicerol (FW 92.09) 30% v/v 3,0 ml
TDT (PF 154,2) 0,6 M 0,93 g
Azul de bromofenol (PF 691,9) 0,175 mm 1,2 mg
Dividir en partes alícuotas de 1,0 ml y se almacena a -70 °C.
p33
•
Page 42

8. 0,025 M Tris, 0,192 M de glicina,
0,1% de SDS, pH 8,3
(Tampón de electroforesis, 5,0 litros)
Tris (FW 121,1) 0,025 M 15,1 g
Glicina (FW 75.07) 0,192 M 72,0 g
SDS (PF 288,4) 3,5 mM 5,0 g
H2O desionizada a 5,0 litros
El pH de este tampón es de aproximadamente 8,3. No aju-
star el pH. Hasta 20 litros se pueden preparar y almacenar
durante hasta 2 meses.
9. Coomassie soluciones
Coomassie mancha solución
(0,025% de Coomassie Blue R-250,
40% de metanol, 7% de ácido acético, 2 litros)
Coomassie Blue R-250 (FW 826) 0,3 mM 0,5 g
Metanol
(Agitar hasta que se disuelve) 40% v/v 800,0 ml
Ácido acético glacial (99%) 7% v/v 140.0 ml
H2O desionizada a 2,0 litros
Decoloración de solución que
(40% de metanol, 7% de ácido acético, 1 litro)
El metanol 40% v/v 400,0 ml
Ácido acético glacial (99%) 7% v/v 70,0 ml
H2O desionizada a 1,0 litro
•
Solución decolorante II
(Ácido acético al 7%, 5% de metanol)
Metanol 5% v/v 50,0 ml
Ácido acético glacial (99%) 7% v/v 70,0 ml
H2O desionizada a 1,0 litros
p34
Page 43

Recetas de gel
Las recetas de gel Laemmli son para 30 ml de
una solución única concentración (suficiente
para dos de 1,5 mm, 18 × 8 cm geles). Tabulados son los ingredientes y los volúmenes para los
geles de poros relativamente grandes (7.5-10%
Gama T), así como geles pequeños poros (12.515% Gama T). Un gel de 4% de apilamiento es
común. La receta gradiente lineal es de 100 ml
de solución. El volumen total necesaria depende
del número de fundición geles y el espesor de
gel; ajuste si es necesario. Todos los geles se
reticulado con 2,6% de C.
Laemmli en gel
(por 30 ml de solución gel de resolución, 5 ml de solución de gel de apilamiento)
Gel de
Separación de gel apilamiento
7,5% 10% 12,5% 15% 4%
Acrilamida acciones (Soln, #1) 7,5 ml 10,0 ml 12,5 ml 15,0 ml 0,67 ml
1,5 M TrisCl, pH 8,8 (Soln, #2) 7,5 ml 7,5 ml 7,5 ml 7,5 ml —
0,5 M TrisCl, pH 6,8 (Soln, #3) — — — — 1,25 ml
10% SDS (Solución #4) 0,3 ml 0,3 ml 0,3 ml 0,3 ml 0,05 ml
H2O desionizada 14,6 ml 12,1 ml 9,6 ml 7,1 ml 3,00 ml
10% APS (Solución #5) 150 µl 150 µl 150 µl 150 µl 25 µl
TEMED 10 µl 10 µl 10 µl 10 µl 2,5 µl
Volumen final 30,0 ml 30,0 ml 30,0 ml 30,0 ml 5,0 ml
•
p35
Page 44

Para geles de gradiente lineal, utilice volúmenes
iguales de% de bajo y alto% de acrilamida en
las soluciones de las 2 cámaras del fabricante de
gradiente. Menos de APS se añade a extender el
tiempo de polimerización, y menos aún se añade
a la solución T% superior para permitir que
se produzca la polimerización de arriba hacia
abajo. En nuestra experiencia con las concentraciones en el ejemplo gradiente 10-20% por
debajo de, los geles se puede verter en un caudal
de 5-10 ml/min.
Gel de gradiente lineal
(por 100 ml de solución)
10% T 20% T
Acrilamida acciones (Soln, #1) 33,30 ml 66,70 ml
Sacarosa — 15,00 g
1,5 M TrisCl, pH 8,8 (Soln, #2) 25,00 ml 25,00 ml
10% SDS (Solución #4) 1,00 ml 1,00 ml
H2O desionizada a 100,00 ml a 100,00 ml
10% APS (Solución #5) 0,300 ml 0,060 ml
TEMED 0,036 ml 0,036 ml
•
p36
Page 45

Apéndice B: Bibliografía
General
Gallagher, S. R., and Smith, J. A., Electrophoretic separation
of proteins. In Current Protocols in Molecular Biology.
(Ausubel, F. A., eds.), OSC 10.2.1–10.2.21 (1991).
Hames, B. D., and Rickwood, D., Gel Electrophoresis of
Proteins: A Practical Approach: Second edition, City IRL
Press (1990).
Sambrook, J, Fritsch, E. F., and Maniatis, T., Standard Form-
aldehyde Protocol. Molecular Cloning: A Laboratory
Manual. Cold Spring Harbor Laboratory, Cold Spring
Harbor, NY (1990).
Sasse, J., and Gallagher, S. R., Staining proteins in gels.
Current Protocols in Molecular Biology. (Ausubel, F. A.,
et al., eds.), OSC 10.6.1–10.6.8 (1991).
No desnaturalizantes sistemas de gel
Reisfeld, R. A., et al., Acidic buffer system for resolution of
cationic proteins. Nature. 195, 281 (1962).
McLellan, T. Electrophoresis buffers for polyacrylamide gels at
various pH values. Anal. Biochem. 126, 94 (1982).
Hedrick, J. L. and Smith, A. J., Size and charge isomer separa-
tion and estimation of molecular weights of proteins by
discontinuous gel
126, 155 (1968).
La desnaturalización sistemas de gel
Laemmli, U. K. Cleavage of structural proteins during the
assembly of the head of bacteriophage T. Nature. 227,
680–685 (1970).
Matsudaira, P. T. and Burgess, D. R., SDS microslab linear
gradient polyacrylamide gel electrophoresis. Anal.
Biochem. 87, 386–396 (1978).
Schreier, M. H., Erni, B., and Staehelin, T., Initiation of
mammalian protein synthesis. I. Purification and characterization of seven initiation factors. J. Mol. Biol. Nov;
116(4):727–753 (1977).
Shapiro, A. L., and Maizel J. V. Jr., Molecular weight estima-
tion of polypeptides by SDS-polyacrylamide gel electrophoresis: further data concerning resolving power and general
considerations. Anal. Biochem. Jun; 29(3):505–514 (1969).
Schaegger, H. and Von Jagow, G., Tricine-sodium dodecyl
sulfate-polyacrylamide gel electrophoresis for the separation of proteins in the range from 1 to 100 kDa. Anal.
Biochem. 166, 368–379 (1987).
Weber, K., and Osborn, M., The reliability of molecular
weight determinators by dodecyl sulfate-polyacrylamide gel
electrophoresis. J. Biol. Chem. 224, 4406–4412 (1969).
electrophoresis. Arch. Biochem. Biophys.
•
p37
Page 46

Electroforesis bidimensional
Adams, L. D. and Gallagher, S. R., Two-Dimensional Gel Elec-
trophoresis Using the O’Farrell System. Current Protocols
in Molecular Biology, (Ausubel, F. A., et al, eds.), OSC pp.
10.4.1–10.4.13 (1992).
Anderson, N. G., Anderson, N. L., and Tollaksen, S. L.,
Proteins of human urine. I. Concentration and analysis by
two-dimensional electrophoresis. Clin. Chem. Jul; 25(7):
1199–2210 (1979).
Anderson, Leigh and Anderson, Norman G., High resolution
two-dimensional electrophoresis of human plasma proteins.
Proc. Natl. Acad. Sci. USA. 74:5421–5425 (1977).
Anderson, L. Two-Dimensional Electrophoresis, Operation of
the ISO-DALT® System, Second Edition. Large Scale Biology
Press (1991).
Bravo, R., Schafer, R., Willecke, K., MacDonald-Bravo, H.,
Fey S. J., and Celis J. E., More than one-third of the discernible mouse polypeptides are not expressed in a Chinese
hamster-mouse embryo fibroblast hybrid that retains all
mouse chromosomes. Proc. Natl. Acad. Sci. USA. Apr;
79(7):2281–2285 (1982).
Hurkman, W. J., and Tanaka, C. K., Solubilization of Plant
Membrane Proteins for Analysis by Two-Dimensional Gel
Electrophoresis. Plant Physiology. 81:802–806 (1986).
Mets, L. J. and Bogorad, L. Two-dimensional polyacrylamide
gel electrophoresis: an improved method for ribosomal
proteins. Anal Biochem. Jan; 57(1):200–210 (1974).
O’Farrell, P. H., High resolution two-dimensional electropho-
resis of proteins. J. Biol. Chem. May 25; 250(10):4007–
4021 (1975).
Bjellqvist, B., et al., Isoelectric focusing in immobilized pH
gradients: principle, methodology and some applications. J.
Biochem. Biophys. Methods 6, 317–339 (1982).
Görg, A, et al., The current state of two-dimensional
electrophoresis with immobilized pH gradients. Electropho-
resis 9, 531–546 (1988).
Görg, A. Two-dimensional electrophoresis with immobilized
pH gradients: current state. Biochem. Soc. Trans. 21,
130–132 (1993).
Bjellqvist, B., et al., Micropreparative two-dimensional electro-
phoresis allowing the separation of samples containing milligram amounts of proteins. Electrophoresis 14, 1375–1378
(1993).
Blomberg, A., et al., Interlaboratory reproducibility of yeast
protein patterns analyzed by immobilized pH gradient
two-dimensional gel electrophoresis. Electrophoresis 16,
1935–1945 (1995).
•
p38
Page 47

Orden información
producto cantidad código
SE640 Unidad de doble vertical, de base. 1 SE640
Incluye: 3 juegos de placas de vidrio, cuatro conjuntos
de sujeción 8 cm, 6 cámaras, gel de doble colada soporte
con base de nivelación y el nivel, la presa de amortiguación,
espaciador-Mate plantilla de alineación y una herramienta
de Wonder Wedge placa de separación. (Orden de 2 peines y
2 series de 8 cm de separadores por separado.)
SE640 Unidad de doble vertical, completa. 1 SE640-15-1.5
Incluye: unidad básica más dos de 15 y los peines
y 2 series de 8 cm de separadores de 1,5 mm de espesor.
Las piezas de repuesto
Gel de Wonder Wedge placa de separación de herramientas 1 SE1514
Ranurados juntas de goma de silicona para la cámara
de amortiguación superior 2 SE6008B
Laminadas juntas de goma de silicona para la emisión del soporte 2 SE6009
Tampón de la presa 1 SE6432
Cámara amortiguadora con la aleta superior del electrodo 1 SE6454
Tapa con cables de alta tensión 1 SE6056
De alta tensión de seguridad conjunto de derivaciones 1 SE6056-HV
Buffer de la cámara baja 1 SE6450
Sustitución de la aleta de electrodo para SE6454 1 SE6870
Banana del cable rojo, oro, con 2 arandelas 1 SE6067
Nivel de burbuja 1 SER11
Gel Seal, ¼ oz. tubo 1 SE6070
p39
•
Page 48

producto cantidad código
Gel de ruedas para 1 o 2 geles:
Caster Gel doble, 1-2 geles, de 18 cm de ancho. 1 SE6015
Incluye: 2 juntas en blanco.
(Que se incluye con cada unidad SE640)
Abrazaderas y las levas
Tornillos de repuesto para las abrazaderas 12 SE6003U-2
Cámaras, negro, para bridas con agujeros de leva 4 SE6005L
Conjuntos de abrazadera, 8 cm 2 SE6403U
Las placas de vidrio de 18 × 8 cm
Las placas de vidrio 2 SE6402
Las placas de vidrio, fluorescencia de baja 2 SE6402LF
Placa de vidrio, divisor de sándwich, con muescas 1 SE6402D
•
p40
seguridad la
tapa con los
cables SE6056
cámara amortiguadora superior con
la aleta electrodo
SE6454
buffer de la cámara
baja SE6450
junta
SE6009
abrazadera universal
SE6403U
nivel de burbuja
SER11
lanzador básica
SE6015
leva
SE6005L
Page 49

Peines
número espesor ancho
de pozos (mm) (mm) cantidad código
10 0,75 8,3 1 SE511-10-,75
10 1,00 8,3 1 SE511-10-1,0
10 1,50 8,3 1 SE511-10-1,5
12 0,75 7,6 1 SE511-12-,75
12 1,00 7,6 1 SE511-12-1,0
12 1,50 7,6 1 SE511-12-1,5
15 0,75 5,7 1 SE511-15-,75
15 1,00 5,7 1 SE511-15-1,0
15 1,50 5,7 1 SE511-15-1,5
20 0,75 4,1 1 SE511-20-,75
20 1,00 4,1 1 SE511-20-1,0
20 1,50 4,1 1 SE511-20-1,5
28a 0,75 2,7 1 SE511-28-,75
28a 1,00 2,7 1 SE511-28-1,0
28a 1,50 2,7 1 SE511-28-1,5
a
Peine de profundidad 15 mm, todos los demás de 25 mm.
Peines de preparación
Estos peines son de 25 mm de profundidad, ajustable a 10 o 15 mm.
número espesor ancho (mm)
de pozos prep/ref (mm) prep/ref cantidad código
1/1 0,75 121/6 1 SE511-R-,75
1/1 1,00 121/6 1 SE511-R-1,0
1/1 1,50 121/6 1 SE511-R-1,5
1/2 0,75 113/6 1 SE511-DR-,75
1/2 1,00 113/6 1 SE511-DR-1,0
1/2 1,50 113/6 1 SE511-DR-1,5
Nuevo peine ajustable 1 SE511-BKA
Se requiere para convertir cualquier peine profunda de
25 mm a 10 o 15 mm de profundidad.
•
p41
Page 50

Espaciadores
espesor longitud
(mm) ancho (mm) cantidad código
0,75 8 2 2 SE6419-2-.75
1,00 8 2 2 SE6419-2-1.0
1,50 8 2 2 SE6419-2-1.5
Productos complementarios
Hoefer Plate SE100 mate lavado y unidad de almacenamiento 1 SE100
Hoefer TE62 tanque Unidad de Transferencia 1 TE62
Hoefer TE70XP semi-seco Unidad de Transferencia 1 TE70XP
Hoefer reactivos para la colada de gel y tampones
Acrilamida, MB grado 1 kg GR141-1
bis-acrilamida, MB grado 100 g GR142-100
TEMED 25 g GR151-25
Persulfato de amonio, ACS grado reactivo 10 g GR152-10
Tris-Glicina-SDS amortiguación, solución 10X, MB grado 1 L GR149-1
Tris, grado reactivo 1 kg GR132-1
Glicina 1 kg GR125-1
Dodecilsulfato sódico (SDS) 500 g GR126-500
Dodecilsulfato sódico (SDS), 10% Solución 1 L GR155-1
Hoefer reactivos para carga de muestra y la tinción de gel
Ditiotreitol (DTT), MB grado 5 g GR122-5
EDTA, 0,5 M solución, MB grado 100 ml GR123-100
Azul de bromofenol, sal sodio, grado reactivo ACS 10 g GR120-10
Glicerol, MB grado 1 L GR124-1
Proteína reactivo determinación, 500 ensayos 500 ml GR133-500
Coomassie Brilliant Blue G-250 25 g GR134-25
Coomassie Brilliant Blue R-250 25 g GR135-25
•
p42
Page 51

Hoefer, Inc.
84 October Hill Road
Holliston, MA 01746
Llamada gratuita: 1-800-227-4750
Teléfono: 1-508-893-8999
Fax: 1-508-893-0176
E-mail: support@hoeferinc.com
Web: www.hoeferinc.com
Hoefer es una marca registrada de
Hoefer, Inc.
Coomassie es una marca comercial
de ICI PLC.
RBS-35 es una marca comercial de
Pierce Chemical Co.
Tygon es una marca registrada de
Saint-Gobain Performance Plastics.
© 2012 Hoefer, Inc.
Todos los derechos reservados.
Impreso en los USA.
 Loading...
Loading...