Page 1

man ual del usuario
Español
Hoefer IEF100
Unidad Isoelectroenfoque
mu IEF100-IM/Spanish/Rev.B0/07-12
Page 2

Tabla de contenidos
Información Importante ..............................................................ii
Residuos de Aparatos Eléctricos y Electrónicos (RAEE) ................. v
Función y descripción ................................................................1
Especificaciones ........................................................................2
Componentes del sistema ...........................................................3
Descripciones de los componentes ..............................................5
Programación de la IEF100 ......................................................10
IEF100 Operación ...................................................................20
Conexiones de datos opcionales ................................................35
Cuidado y mantenimiento .........................................................42
Solución de problemas .............................................................43
Orden información ...................................................................45
Apéndice A: Protocolos pre-programados ...................................46
Apéndice B: Reactivos y Soluciones ..........................................51
Recetas ..................................................................................53
Apéndice C: Referencias IEF100 ..............................................57
•
pi
Page 3

Información Importante – Español
• Si este equipo es utilizado en una manera no especicado por Hoefer,
Inc. la protección proporcionado por el equipo puede ser dañada.
• Este instrumento es diseñado para el uso interior del laboratorio sólo.
• Sólo accesorios y partes aprobaron o suministraron por Hoefer, Inc.
puede ser utilizado para operar, para mantener, y para atender a este
producto.
• Sólo utiliza una alimentación que es CE marcó o la seguridad
certicada por un nacionalmente reconocido probando el laboratorio.
• La tapa de la seguridad debe estar en el lugar antes de conectar la
alimentación lleva a una alimentación.
• Apaga todos controles de alimentación y desconecta los plomos del
poder antes de quitar la tapa de la seguridad.
• Circula sólo agua o 50/50 glicol de agua/etileno por el intercambiador
de calor si ése es el caso equiparon. No conecte el intercambiador
de calor a un toque de la agua ni cualquier fuente del líquido
refrigerante donde la presión del agua está libre.
• Nunca introduce anticongelante ni algún solvente orgánico en
cualquier parte del instrumento. Los solventes orgánicos causarán
daño irreparable a la unidad!
• No opera con temperaturas de búfer encima del máximo especicó
especicaciones técnicas. Recalentar causará daño irreparable a la
unidad!
Duležité Informace – Czech
• Pokud by toto zařízení je použito způsobem, který není podle Hoefer,
Inc. ochrana poskytovaná na základě zařízení může být narušena.
• Tento nástroj je určen pro vnitřní použití v laboratoři pouze.
• Pouze příslušenství a části schválen, nebo poskytnutých Hoefer, Inc.
mohou být použity pro provoz, údržbu, a údržbě tohoto výrobku.
• zdroj napájení používají jen že je opatřen označením CE osvědčena
nebo bezpečnost vnitrostátně uznanými zkušebními laboratoř.
• Bezpečnosti lid musí být zavedena před připojením napájecí zdroj
napájení vede k.
• Turn veškeré napájení kontroly vypnuto a odpojit před odběrem
energie vede bezpečnostní víko.
• Rozeslat pouze voda nebo 50/50 voda/ethylenglykolu
prostřednictvím výměník tepla je li to vybavena. Nemají připojení
výměník tepla s vodními setřepná nebo jakékoli chladicí kapaliny
zdroje, kde tlak vody je neregulo.
• Nikdy zavést prostředek proti zamrznutí nebo jakákoli organická
rozpouštědla do jakékoli části z tohoto nástroje. Rozpustidlům
způsobí nenapravitelné poškození jednotka!
• Nejsou provozována s pufru teplotách nad maximální stanovenou
technickými specikacemi. Přehřátí způsobí nenapravitelné poškození
jednotka!
Vigtig Information – Danish
• Hvis dette udstyr bruges i en måde ikke speciceret ved Hoefer,
Inc. den beskyttelse, som er blevet forsynet af udstyret kan måske
svækkes.
• Dette instrument er designet for indendørs laboratoriumbrug bare.
• Bare tilbehør og del godkendede eller forsynede ved Hoefer, Inc. kan
måske bruges for drive, funktionsfejl, og betjening dette produkt.
• bruger Bare en strømforsyning, der er CE markerede eller sikkerhed,
som er blevet attesteret af en, som nationalt er blevet anerkendt
prøve laboratorium.
• Sikkerhedlåget må være på plads før forbinding strømforsyningsblyet
til en strømforsyning.
• Drejer alle strømforsyningskontroller af og afbryder kraftblyet før
erning sikkerhedlåget.
• Cirkulerer bare vand eller 50/50 vand/ethylene glykol gennem
varmeveksleren i så fald udrustet. Forbind ikke varmeveksleren
til en vandhane eller nogen kølemiddelkilde hvor vandtrykket er
unregulated.
• Introducerer Aldrig antifreeze eller noget organisk opløsningsmiddel
ind i nogen del af instrumentet. Organiske opløsningsmidler vil
forårsage uboelig skade til enheden!
• Driver ikke med stødpudetemperaturer over maksimummet
specicerede tekniske specications. Overheding vil forårsage uboelig
skade til enheden!
Belangrijke Informatie – Dutch
• Indien deze uitrusting in een manier wordt gebruikt die niet door
Hoefer, Inc. is gespeciceerd de bescherming die door de uitrusting is
verzorgd kan worden geschaad.
• Dit instrument is voor binnenlaboratoriumgebruik enkel ontworpen.
• Enkel onderdelen en delen keurden goed of leverden door Hoefer,
Inc. kan voor het bedienen worden gebruikt, handhavend en
onderhouden van dit product.
• gebruik Enkel een netvoeding die CE is markeerde of veiligheid
die door een is gecerticeerd die nationaal is herkend testene
laboratorium.
• Het veiligheidsdeksel moet in plaats voor het verbinden van de
netvoeding leidt tot een netvoeding zijn.
• Doe alle netvoedingscontroles Uit en koppel los de machtleiding voor
het verwijderen van het veiligheidsdeksel.
• Circuleer enkel water of 50/50 water/ethyleenglycol door de
hitte exchanger zo ja uitrust. Verbind de hitte exchanger naar
een waterkraan of koelmiddelbron niet waar de waterdruk niet
geregulariseerd is.
• Stel Nooit antivriesmiddel of organische oplosmiddelen in deel van
het instrument voor. Organische oplosmiddelen zullen onherstelbare
schade aan de eenheid veroorzaken!
• Bedien niet met buertemperaturen boven het maximum
speciceerde technische specicaties. Oververhittend zal
onherstelbare schade aan de eenheid veroorzaken!
Important Information – English
• If this equipment is used in a manner not specied by Hoefer, Inc. the
protection provided by the equipment may be impaired.
• This instrument is designed for indoor laboratory use only.
• Only accessories and parts approved or supplied by Hoefer, Inc. may
be used for operating, maintaining, and servicing this product.
• Only use a power supply that is CE marked or safety certied by a
nationally recognized testing laboratory.
• The safety lid must be in place before connecting the power supply
•
pii
Page 4

leads to a power supply.
• Turn all power supply controls o and disconnect the power leads
before removing the safety lid.
• Circulate only water or 50/50 water/ethylene glycol through the
heat exchanger if so equipped. Do not connect the heat exchanger
to a water tap or any coolant source where the water pressure is
unregulated.
• Never introduce antifreeze or any organic solvent into any part of the
instrument. Organic solvents will cause irreparable damage to the
unit!
• Do not operate with buer temperatures above the maximum
specied technical specications. Overheating will cause irreparable
damage to the unit!
Tärkeää Tietoa – Finnish
• Jos tätä varusteita käytetään tavassa ei määritetty Hoefer, Inc. suojelu
ehkäisty varusteille saattaa olla avuton.
• Tämä väline suunnitellaan sisälaboratoriokäytölle vain.
• Vain lisävarusteet ja osat hyväksyivät tai toimitti Hoefer, Inc. oheen ää
voi käyttää käyttämiselle, valvoalle, ja servicing tämä tuote.
• Vain käyttää käyttöjännitettä joka on CE merkitsi tai turvallisuus
joka on todistanut aidoksi ohi joka on kansallisesti tunnustettnut
testaaminen laboratoriota.
• Turvallisuuskansi täytyy olla paikallaan ennen yhdistäminen
käyttöjännitelyijyjä käyttöjännitteeseen.
• Kiertää kaikki käyttöjännitevalvonnat ja irrottaa valtalyijyt ennen
poistaminen turvallisuuskantta.
• Kiertää vain vesi tai 50/50 vesi/ethyleneä glycol siinä tapauksessa
varustetun lämmönvaihtimen läpi. Älä yhdistä lämmönvaihdinta
vesinapautukseen eikä jäähdytysnestelähteeseen, missä vesipaine on
unregulated.
• Pakkasneste eikä orgaaninen liuotin välineen osassa ei esitele
Koskaan. Orgaaniset liuottimet aiheuttavat korvaamattoman
vahingon yksikköön!
• Ei käytä puskuria yllä olevia lämpötiloja enintään määritetyillä
teknisillä täsmennyksillä. Ylikuumeneminen aiheuttaa
korvaamattoman vahingon yksikköön!
l’exchanger de chaleur si si équipé. Ne pas connecter l’exchanger de
chaleur à un robinet d’eau ou à la source d’agent de refroidissement
où la pression d’eau est non régulée.
• Ne Jamais introduire d’antigel ou du dissolvant organique dans
n’importe quelle partie de l’instrument. Les dissolvants organiques
causeront des dommages irréparables à l’unité!
• Ne pas fonctionner avec les températures de tampon au-dessus du
maximum a spécié des spécications techniques. La surchaue
causera des dommages irréparables à l’unité !
Wichtige Informationen – German
• Wenn diese Ausrüstung gewissermaßen nicht angegeben durch
Hoefer, Inc. verwendet wird, kann der durch die Ausrüstung zur
Verfügung gestellte Schutz verschlechtert werden.
• Dieses Instrument wird für den Innenlaborgebrauch nur dafür
entworfen.
• Nur Zusätze und Teile genehmigten oder lieferten durch Hoefer, Inc.
kann für das Funktionieren, das Aufrechterhalten, und die Wartung
dieses Produktes verwendet werden.
• Verwenden Sie nur eine Energieversorgung, die CE gekennzeichnet
oder durch ein national anerkanntes Probelaboratorium bescheinigte
Sicherheit ist.
• Der Sicherheitsdeckel muss im Platz vor dem Anschließen der
Energieversorgung sein führt zu einer Energieversorgung.
• Alle Energieversorgungssteuerungen abdrehen und die Macht
trennen führt vor dem Entfernen des Sicherheitsdeckels.
• Nur Wasser oder 50/50 Glykol des Wassers/Äthylens durch den
Wärmeaustauscher, wenn so ausgestattet, in Umlauf setzen.
Verbinden Sie den Wärmeaustauscher mit einem Wasserklaps oder
jeder Kühlmittel-Quelle nicht, wo der Wasserdruck ungeregelt wird.
• Führen Sie nie Frostschutzmittel oder jedes organische Lösungsmittel
in jeden Teil des Instrumentes ein. Organische Lösungsmittel werden
nicht wiedergutzumachenden Schaden der Einheit verursachen!
• Mit Puertemperaturen über angegebenen technischen
Spezizierungen des Maximums nicht funktionieren. Die Überhitzung
wird nicht wiedergutzumachenden Schaden der Einheit verursachen!
Information Importante – French
• Si cet équipement est utilisé dans une manière pas spécié par
Hoefer, Inc. la protection fourni par l’équipement pourrait être
diminuée.
• Cet instrument est conçu pour l’usage de laboratoire intérieur
seulement.
• Seulement les accessoires et les parties ont approuvé ou ont fourni
par Hoefer, Inc. pourrait être utilisé pour fonctionner, maintenir, et
entretenir ce produit.
• utilise Seulement une alimentation qui est CET a marqué ou la
sécurité certié par un nationalement reconnu essayant le laboratoire.
• Le couvercle de sécurité doit être à sa place avant connecter
l’alimentation mene à une alimentation.
• Tourner tous contrôles d’alimentation de et débrancher les avances
de pouvoir avant enlever le couvercle de sécurité.
• Circuler seulement de l’eau ou 50/50 glycol d’eau/éthylène par
Informazioni Importanti – Italian
• Se quest’apparecchiatura è usata in un modo specicato da Hoefer,
Inc. la protezione fornito dall’apparecchiatura potrebbe essere
indebolita.
• Questo strumento è disegnato per l’uso di laboratorio interno solo.
• Solo gli accessori e le parti hanno approvato o hanno fornito da
Hoefer, Inc. potrebbe essere usato per operare, per mantenere, e per
revisionare questo prodotto.
• usa Solo un alimentatore che è CE ha marcato o la sicurezza certicato
da un nazionalmente riconosciuto testando il laboratorio.
• Il coperchio di sicurezza deve essere nel luogo prima di collegare i
piombi di alimentatore a un alimentatore.
• Spegne tutto i controlli di alimentatore e disinserisce i piombi di
potere prima di togliere il coperchio di sicurezza.
• Circola solo l’acqua o 50/50 glicole di acqua/etilene attraverso
lo scambiatore di calore se così equipaggiato. Non collegare lo
scambiatore di calore a un rubinetto di acqua o qualunque fonte di
refrigerante dove la pressione di acqua è sregolata.
•
piii
Page 5

• Non introduce mai l’antigelo o qualunque solvente organico in
qualunque parte dello strumento. I solventi organici causeranno il
danno irreparabile all’unità!
• Non opera con le temperature di tampone al di sopra del massimo
ha specicato le descrizioni tecniche. Il surriscaldamento causerà il
danno irreparabile all’unità!
Viktig Informasjon – Norwegian
• Hvis dette utstyret blir brukt i en måte ikke spesisert ved Hoefer, Inc.
beskyttelsen som ha blitt git av utstyret kan bli svekket.
• Dette instrumentet er utformet for innendørs laboratoriumbruk bare.
• Bare tilbehør og deler godkjente eller forsynte ved Hoefer, Inc. kan bli
brukt for drive, vedlikeholde, og betjene dette produktet.
• bruker Bare en kraftforsyning som er CE merket eller sikkerhet
som ha blitt sertisert av et som nasjonalt ha blitt anerkjent prøver
laboratorium.
• Sikkerheten lokket må være på plass før forbinding kraftforsyningene
blyene til en kraftforsyning.
• Vender all kraftforsyningsstyring av og frakopler kreftene blyene før
erning sikkerheten lokket.
• Sirkulerer bare vann eller 50/50 vann/ethylene glykol gjennom
oppvarmingen veksleren i så fall utstyrer. Ikke forbind oppvarmingen
veksleren til en vanntapp eller noe kjølemiddelkilde hvor vannet
trykket er unregulated.
• Introduserer Aldri antifreeze eller noe organisk løsemiddel inn i noe
del av instrumentet. Organiske løsemiddler vil forårsake irreparabel
skade på enheten !
• Driver med buertemperaturer over maksimum ikke spesiserte
teknisk spesikasjoner. Å overoppheting vil forårsake irreparabel
skade på enheten !
Wazne Informacje – Polish
• Jeżeli ten sprzęt jest wykorzystywany w sposób nie określone przez
Hoefer, Inc. do ochrony przewidzianej przez urządzenie może zostać
obniżony.
• Instrument ten jest przeznaczony do użytku w laboratoriach kryty
tylko.
• Tylko akcesoriów i części zatwierdzone lub dostarczone przez Hoefer,
Inc. mogą być wykorzystane do eksploatacji, utrzymania i obsługi
tego produktu.
• korzystać jedynie zasilacza że jest noszące oznakowanie CE lub
bezpieczeństwa uwierzytelnione przez uznane na poziomie krajowym
laboratorium badawcze.
• Bezpieczeństwo lid musi być w miejsce przed podłączeniem zasilania
prowadzi do zasilania.
• Zaś wszystkie źródła zasilania urządzenia sterujące o i odłączyć moc
prowadzi przed odbiorem bezpieczeństwa lid.
• Krążą tylko wody lub wody 50/50/ethylene glycol wymiennik ciepła
poprzez jeśli tak wyposażone. Nie należy połączyć wymiennik ciepła
woda z kranu lub jakimkolwiek chłodziwo źródła, jeżeli ciśnienie wody
jest nieuregulowanych.
• Nigdy nie wprowadzać rozpuszczalnika organicznego przeciw
zamarzaniu lub jakichkolwiek na dowolną część dokumentu.
Rozpuszczalniki organiczne spowoduje nieodwracalne szkody dla
jednostki!
• Nie działają w buforze temperatury powyżej maksymalnego
określone specykacje techniczne. Przegrzania spowoduje
nieodwracalne szkody dla jednostki!
Informações Importantes – Portuguese
• Se este equipamento é usado numa maneira não especicada por
Hoefer, Inc. que a protecção fornecida pelo equipamento pode ser
comprometida.
• Este instrumento é projectado para uso de interior de laboratório só.
• Só acessórios e partes aprovaram ou forneceu por Hoefer, Inc. pode
ser usada para operar, manter, e servicing este produto.
• Só usa um estoque de poder que é CE marcou ou segurança
registrada por um nacionalmente reconhecido testando laboratório.
• A tampa de segurança deve estar em lugar antes de ligar o estoque
de poder leva a um estoque de poder.
• Desliga todos controlos de estoque de poder e desconecta os
chumbos de poder antes de retirar a tampa de segurança.
• Circulam só água ou 50/50 glicol de água/ethylene pelo exchanger de
calor se for assim equiparam. Não ligue o exchanger de calor a uma
torneira de água nem qualquer fonte de refrigerante onde a pressão
de água é não regulado.
• Nunca introduz anticongelante nem qualquer orgânico solvente em
qualquer parte do instrumento. Orgânico solvente causará agressão
irreparável à unidade!
• Não opera com temperaturas de buer acima do máximo especicou
especicações técnicas. Superaquecer causará agressão irreparável à
unidade!
Viktig Information – Swedish
• om denna utrustning används i ett sätt som inte har speciceras av
Hoefer, Inc. skyddet tillhandahöll vid utrustningen kan skadas.
• Detta instrument formges för inomhuslaboratorium användning bara.
• Bara medhjälpare och delar godkände eller levererade vid Hoefer, Inc.
kan användas för fungera, underhålla, och servicing denna produkt.
• använder bara en kraft tillgång som är CE markerade eller säkerhet
intygade vid en nationellt erkänd testande laboratorium.
• Säkerheten locket måste vara på platsen före koppla kraften
tillgången blyen till en kraft tillgång.
• Vänder sig alla kraft tillgång kontroller av och kopplar bort kraften
blyen före ytta säkerheten locket.
• Cirkulerar bara vatten eller 50/50 vatten/ethylene glycol genom
värmen exchanger i så utrustad fall. Inte kopplar värmen exchanger
till en vatten kran eller något kylmedel källa där vattnet trycket är
unregulated.
• Inför aldrig kylvätska eller något organiska lösningsmedel in i någon
del av instrumentet. Organiskt lösningsmedel ska orsaka irreparable
skada till enheten!
• Använd inte med buert temperaturer över det högsta angivna
tekniska specikationerna. Överhettning skulle orsaka irreparabla
skador på enheten!
•
piv
Page 6

Español
Residuos de Aparatos Eléctricos y
Electrónicos (RAEE)
Este símbolo indica que el equipo eléctrico y electrónico no debe
tirarse con los desechos domésticos y debe tratarse por separado.
Contacte con el representante local del fabricante para obtener más
información sobre la forma de desechar el equipo.
English
French
German
This symbol indicates that the waste of electrical and electronic
equipment must not be disposed as unsorted municipal waste
and must be collected separately. Please contact an authorized
representative of the manufacturer for information concerning the
decommissioning of your equipment.
Ce symbole indique que les déchets relatifs à l’équipement
électrique et électronique ne doivent pas être jetés comme les
ordures ménagères non-triées et doivent être collectés séparément.
Contactez un représentant agréé du fabricant pour obtenir des
informations sur la mise au rebut de votre équipement.
Dieses Symbol kennzeichnet elektrische und elektronische Geräte,
die nicht mit dem gewöhnlichen, unsortierten Hausmüll entsorgt
werden dürfen, sondern separat behandelt werden müssen. Bitte
nehmen Sie Kontakt mit einem autorisierten Beauftragten des
Herstellers auf, um Informationen hinsichtlich der Entsorgung Ihres
Gerätes zu erhalten.
Italian
Swedish
Questo simbolo indica che i rifiuti derivanti da apparecchiature
elettriche ed elettroniche non devono essere smaltiti come
rifiuti municipali indifferenziati e devono invece essere raccolti
separatamente. Per informazioni relative alle modalità di
smantellamento delle apparecchiature fuori uso, contattare un
rappresentante autorizzato del fabbricante.
Denna symbol anger att elektriska och elektroniska utrustningar
inte får avyttras som osorterat hushållsavfall och måste samlas in
separat. Var god kontakta en auktoriserad tillverkarrepresentant för
information angående avyttring av utrustningen.
•
pv
Page 7

Nota: los estados la ley de Ohm
que el 10 mA de la salida está
disponible en V y 1.000 menos.
Función y descripción
El Hoefer IEF100 instrumento Isoelectroenfoque está diseñado
para realizar el isoelectroenfoque de las proteínas en gradiente de
pH inmovilizado (IPG) tiras. Se trata de un sistema integrado con
una plataforma integrada de temperatura Peltier refrigerado, y un
12.000 V, 10 W de alimentación capaz de suministrar hasta 10 mA.
Hay 30 protocolos totalmente editables, nueve de los cuales son preprogramados con los protocolos recomendados IEF. Una bandeja
de ejecución llevará a cabo todas las tiras de IPG, disponibles en la
actualidad 3.0-3.5 mm de ancho. Las tiras IPG se ejecutan lado gel
de arriba, utilizando mechas de electrodos para ayudar a eliminar las
impurezas que se acumulan en el extremo de los gradientes de pH.
Las muestras pueden ser cargados en las tiras IPG durante la rehidratación, o con copas de muestra.
El IEF100 está completamente probado y certificado a todas las
normas internacionales aplicables.
Características de la IEF100 son:
• Una bandeja de 6 canales que se centra:
Hasta 6, 7-24 cm IPG tiras utilizando el conjunto único electrodo.
Hasta 12, 7 cm IPG tiras utilizando el accesorio de doble
electrodo (incluido).
Fig. 1. El Hoefer IEF100.
• Carga de la muestra durante la rehidratación, o con la taza
de la muestra.
• Monitores de corriente en cada tira IPG.
• Integrado de 12.000 voltios de corriente directa, con capacidad de
10 mA, la capacidad disponible más voltaje y corriente.
• Un gran azul/blanco de la pantalla LCD para una fácil visualización
que soporta una pantalla gráfica de voltaje y corriente.
• La capacidad de programar, editar y almacenar hasta 30 protocolos,
cada uno con 9 pasos.
• El modo de potencia constante.
• Un reloj de tiempo real, ajustables a las zonas horarias locales.
• La plataforma de temperatura controlada.
• Ethernet y RS232 puertos para comunicar los datos o protocolos
de carga.
•
p1
Page 8

Especificaciones
Esta declaración de conformidad es
válida sólo para el instrumento cuando:
• se utiliza en lugares de laboratorio,
• utiliza como liberado de Hoefer, Inc.,
excepto para las alteraciones descritas
en el manual del usuario, y
• conectado a otros instrumentos de
marcado CE o productos recomendados o aprobados por Hoefer, Inc.
Capacidad de uso de
juego solo electrodo 1-6 tiras de IPG 7 a 24 cm de largo
Capacidad de utilizar el
accesorio de doble electrodo 2-12 tiras IPG 7 cm de largo
Salida Voltio 12,000 V
Corriente 10 mA
Poder 10 W
Potenza in 100 – 240 V
50 – 60 Hz
100 W
Interfaccia utente Grande blu/bianco display grafico
Perilla
7 Pulsante tastiera
Piattaforma di temperatura 15 – 25 °C
Protocollo di capacità 30 programmi con 9 punti ciascuno
Ingresso/uscita porte Ethernet, RS232
Dimensioni (L × P × A) 38 cm × 27 cm × 19 cm
Peso 8 kg
Condizioni operative Per uso interno 4 – 40 °C
ambientali Umidità fino a 80%
Altitudine fino a 2000 m
Categoria di installazione II
Grado di inquinamento 2
Certificazioni di prodotto EN61010-1:2001,
EN61326:1998, CE, WEEE, RoHS
•
p2
Page 9

Componentes del sistema
Desembalaje
Quite el envoltorio de los paquetes y comparar cuidadosamente los
contenidos con la lista de embalaje, asegurándose de que todos los
elementos llegaron. Si falta alguna pieza, póngase en contacto con
Hoefer local, Inc. oficina de ventas. Inspeccione todos los componentes de los daños que puedan haber ocurrido mientras la unidad
estaba en tránsito. Si alguna parte está dañada, póngase en contacto
de inmediato al transportista. Asegúrese de guardar todo el material
de embalaje para las reclamaciones por daños o utilizar en caso de ser
necesario devolver la unidad.
Se requiere que no se suministran:
• Gradiente de pH inmovilizado (IPG tiras).
• Reactivos necesarios para la preparación de muestras y la
rehidratación tira.
• Aceite mineral.
Fig. 2. La unidad IEF100.
•
p3
Page 10
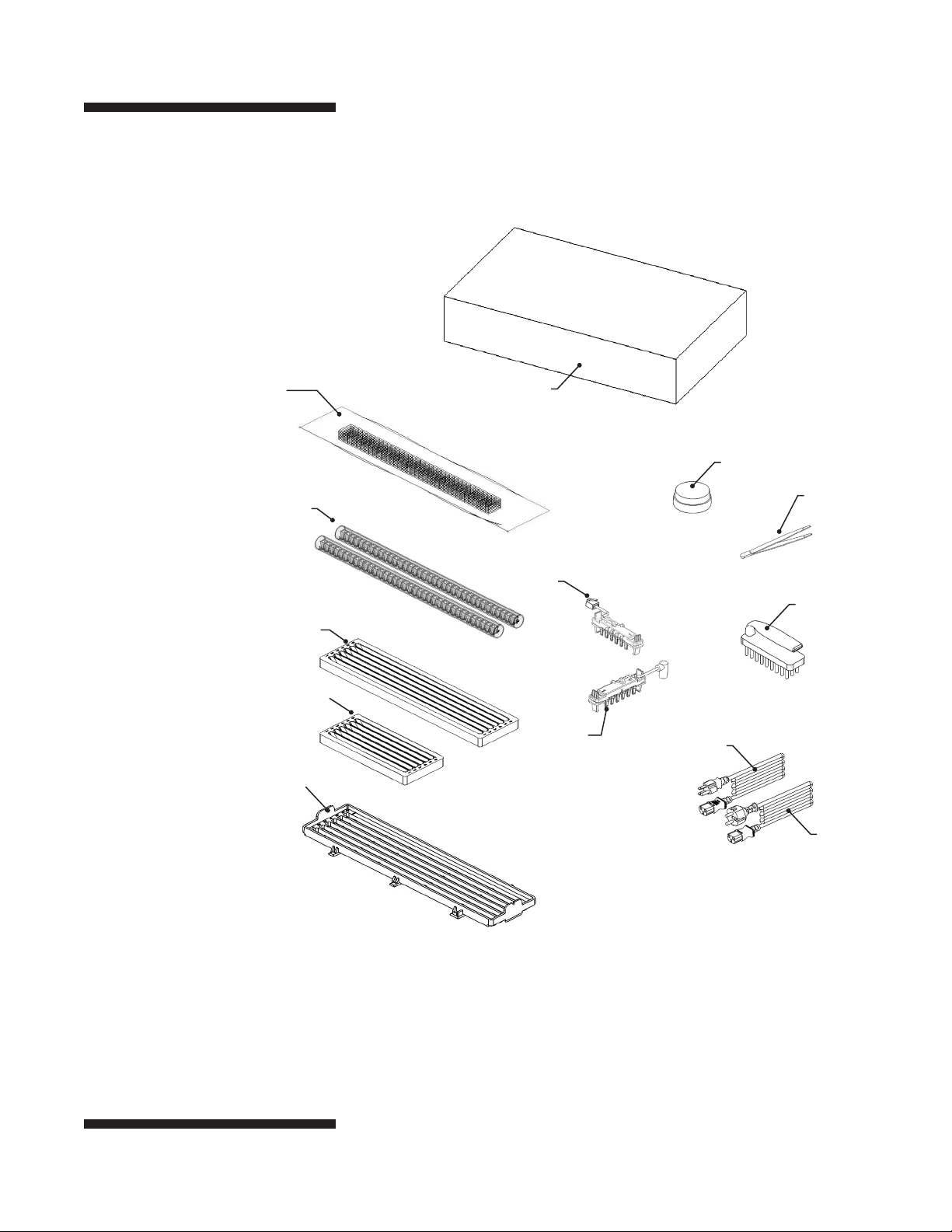
Fig. 3. Componentes del equipo.
Mechas de
electrodos
IEF106
Recipientes para
muestras
IEF108
Gran rehidratación/
Equilibrio bandeja
IEF110
Pequeña rehidratación/
Equilibrio bandeja
IEF109
Enfoque bandeja
IEF105
Caja de accesorios
Nivel
Fórceps
(–) Electrodo
Cepille
115 V cable de alimentación
(+) Electrodo
No en la imagen:
Accesorio de doble
electrodo IEF212.
•
230 V cables de
alimentación (La UE
y el Reino Unido)
p4
Page 11

Descripciones de los componentes
Tapa de seguridad
La tapa de seguridad transparente debe estar cerrada con el fin de
voltaje que se aplica a los electrodos. Los enclavamientos se utiliza
para detener la salida de tensión debe ser abierta la tapa durante la
electroforesis.
Nota: Gire la perilla lentamente para
conseguir el movimiento deseado en la
pantalla. Al girar la perilla demasiado
rápido hace que el parpadeo del cursor,
y permanecer en el lugar. Si esto
sucede, gire la perilla más lento hasta
que el buen comportamiento que se
observa.
Nota: La acción de hacer clic en el
botón es presionar de forma rápida y
en libertad, como un clic del ratón. No
sostenga el botón de in
Fig. 4. Parte frontal del instrumento.
Perilla
La perilla se mueve el cursor o cambia los valores de un campo determinado. Al pulsar el mando hacia el interior para hacer “clic” cambia
entre estas dos funciones. Un LED indica la función activa es de
“MOVE”, o “SET”.
Teclas de flecha horizontal
Las flechas horizontales se utilizan cuando la creación de nombres de
protocolo, y los campos de fecha y hora.
Indicador LED de alta Volt
Este LED se ilumina cuando el voltaje se aplica a los electrodos.
Tapa de seguridad
RS232
Puerto
Puerto
Ethernet
Teclas de
función
Pantalla LCD
Perilla
Teclas de flecha
horizontal
Alto voltaje
LED
Botón STOP
•
p5
Page 12

Botón STOP
Detiene inmediatamente el IEF, y termina el protocolo.
Pantalla LCD
El gran azul/blanco de la pantalla simplifica la interfaz, y muestra los
resultados gráficos del IEF.
Teclas de función
La función de estas teclas se muestra en la pantalla directamente sobre
la tecla. La función varía dependiendo de qué pantalla está activo.
Ethernet Port/RS232 Port
Estos dos puertos se puede utilizar para descargar los datos del IEF de
los protocolos de los instrumentos y la transferencia.
Flujo de Aire
Los aficionados tirar de aire a través de las aberturas laterales, y
expulsar el aire de las rejillas de ventilación traseras. El aire se enfría
los componentes electrónicos, y ayuda a los módulos Peltier mantener
una temperatura constante.
Fuente de alimentación
El módulo de alimentación funciona en todos los voltios y frecuencias.
Fig. 5. Panel trasero.
Nota: Los orificios de ventilación no
deben ser bloqueadas.
Patas/nivel de burbuja
Los pies de nivelación y el nivel de burbuja puede ser utilizado para
nivelar la plataforma IEF. Un instrumento de nivel le ayudará a asegurarse que el aceite cubra completamente las tiras de IPG.
Pies de
nivelación
Salidas de aire
hacia fuera
Salidas de aire
(2X)
Módulo de
entrada ON/OFF
•
p6
Page 13

Enfoque bandeja
La bandeja de canal 6 centrándose acomoda IPG tiras de hasta 24
cm de longitud. Pequeñas ranuras en la bandeja permiten una fácil
extracción de la tira IPG después de enfocar. Detalle de una de estas
características puede verse en la página 24.
Los canales de la bandeja están numerados del 1-6, de adelante hacia
atrás de la IEF100.
La bandeja se ajusta en el instrumento en una sola orientación. Se
fija en su lugar en el lado derecho de la plataforma, y movido lateralmente hacia la izquierda, la bandeja de sujeción hacia abajo contra la
placa fría. El mecanismo de sujeción mejora la transferencia de calor
para las bandejas de plástico.
Hay (+) y (–) marcas en la bandeja y el instrumento para ayudar con
la orientación adecuada.
Fig. 6. Parte superior del instrumento.
(+) Electrodo
Recipientes
para muestras
Alinear las tiras del IEF con esta línea de
(–) Electrodo
Enfoque
bandeja
Abrazaderas
Pestañas de sujeción (6x)
+ –
Frente del instrumento
•
p7
Page 14
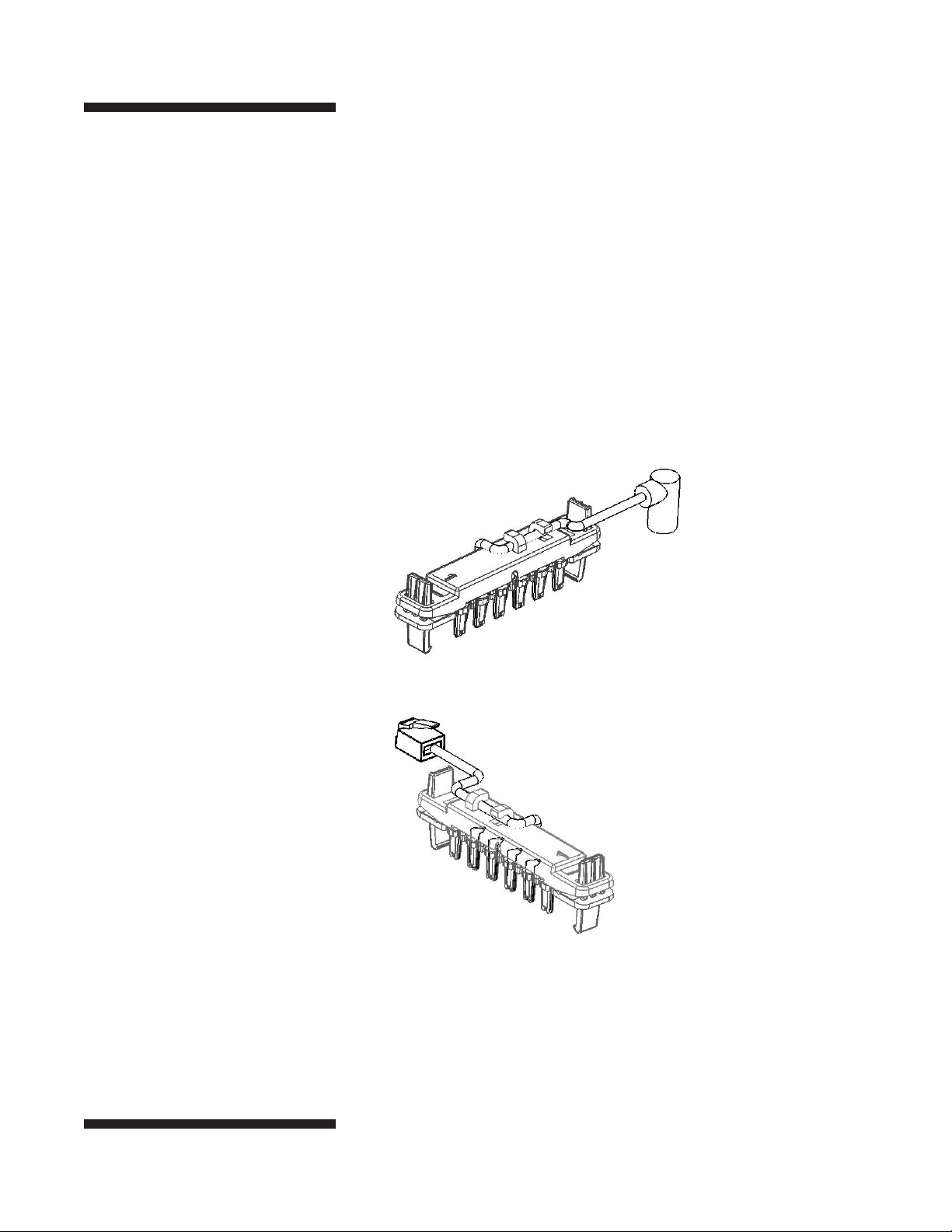
Fig. 7. Electrodo positivo del electrodo
(arriba) y negativo (parte inferior).
Electrodos
Electrodo positivo (ánodo)
Un conector de alta tensión une el positivo (+) electrodo(s) al terminal
de alta tensión. El ánodo tiene un solo hilo blanco y el conector, y
localiza en el lado izquierdo de la bandeja.
Electrodo negativo (cátodo)
Un cable de seis (LAN) conecta el polo negativo (–) electrodo(s) a la
terminal de tierra, el control de la corriente en cada carril. Los cátodos localiza en el lado derecho de la bandeja.
Los electrodos se colocan en la bandeja con el número “1” hacia la
parte delantera de la bandeja, y los electrodos de alambre de platino
frente a la media de las tiras de IPG.
(–) Electrodo negativo
(+) Electrodo positivo
•
p8
Page 15

Nota: Los electrodos no se pondrá en
contacto con las tiras de IPG sin las
mechas de electrodos en su lugar.
Mechas de electrodos
Las mechas de electrodos son pequeños papeles de filtro rectangulares
que se colocan sobre el extremo de las tiras de IPG. Los electrodos hacen
contacto con la parte superior de las mechas. Las mechas de electrodos
de ayudar a eliminar las impurezas que se acumulan en el extremo de las
tiras de IPG, y en general mejorar el contacto de los electrodos.
Las mechas de electrodos vienen en tiras largas, y se debe cortar en
rectángulos aparte individuales a medida que se utilizan. Las mechas
de electrodos deben ser humedecido por la ligera secante con agua
antes de su uso.
Nota: Las copas de muestra se puede
cortar en tazas individuales, si se desea.
Fig. 8. Recipientes para muestras.
Recipientes para muestras
La muestra de proteína tazas de carga en la tira IPG. Recipientes para
muestras con capacidad para 240 μl de muestra. Las copas se puede
aplicar en la mayoría de los lugares a lo largo de la longitud de la tira
IPG, y se aplican normalmente en el ánodo (+) final.
Rehidratación/Equilibrio bandejas
Las bandejas de rehidratación/equilibración se puede utilizar para
ambas funciones. Los carriles son lo suficientemente estrecha como
para la rehidratación adecuada, pero en el fondo suficiente para mantener el volumen de reactivo necesario para el equilibrio. Una pequeña
bandeja se incluye para su uso con 7 cm IPG tiras. La bandeja grande
se puede utilizar con IPG tiras de hasta 24 cm de longitud.
Fig. 9. Rehidratación/
equilibración bandejas.
Cepille
El cepillo de limpieza se utiliza para la limpieza de la bandeja
de enfoque.
Fórceps
Pinzas de facilitar el manejo de las tiras de IPG.
•
p9
Page 16

Programación de la IEF100
Pantalla Principal
Cuando se activa “ON”, la pantalla principal (Fig. 10). La pantalla
principal contiene los siguientes campos.
Fecha y hora
La fecha y hora se configuran en Hora Estándar del Pacífico. Utilice el
botón “OPTION” para establecer la fecha y hora para su ubicación.
(Vea la página de opciones de pantalla de 17).
Lista de los 30 protocolos
Los primeros nueve protocolos se muestran en la pantalla. Uno de
los protocolos siempre se destacó. Utilice el botón para desplazarse a
través de los otros protocolos.
El instrumento se carga con los 9 protocolos para enfocar 7, 18 o 24
cm de IPG. Estas son pautas generales para el enfoque. IPG fabricantes de tiras normalmente dan los tiempos recomendados se centran
en el total de voltios-hora (voltios multiplicado por hora). Tanto por
debajo y sobre el enfoque puede ser problemático. Optimum veces
centrados debe ser determinada por el usuario final considerando la
tira IPG, el tipo de muestra y la carga de proteínas de la muestra.
Todos los protocolos pueden ser sobrescritos, si lo desea.
Fig. 10. Pantalla principal.
Además de estos 9 protocolos, hay 21 protocolos adicionales sin
nombre, sin medidas pre-programados, permitiendo que el espacio de
usuario suficiente para crear protocolos personalizados.
•
p10
Page 17

Nota: Los datos de la última
ejecución se conserva en la
memoria hasta que una nueva
ejecución se ha iniciado. Una vez
que una nueva ejecución se ha
iniciado, los datos de ejecución
últimos ya no está disponible.
Nota: Los gráficos de voltios y la
corriente no se puede imprimir
directamente desde la IEF100. Si
la salida de datos se envían a un
ordenador, los datos pueden ser
transferidos a un programa como
Excel para crear el gráfico.
Los cuatro botones: EDIT, RUN, OPTION y el GRAPH
EDIT
Edita el protocolo resaltado.
RUN
Inicia el protocolo resaltado.
OPTION
Permite el acceso a la configuración del puerto y la fecha y la hora.
GRAPH
Mostrará las corrientes voltios y medido de forma gráfica. Utilice el
botón para desplazarse por la tensión y los perfiles de μA en los
canales 1-6. La carrera activa se mostrará.
Si no se activa un protocolo de funcionamiento, el botón gráfico que
mostrará los datos de la última ejecución.
•
p11
Page 18

Fig. 11. Pantalla de edición de
protocolo. Todos los parámetros
para un protocolo completo que se
pueden ver en una pantalla.
Editar Protocolo de pantalla
En el menú principal, utilice el botón para seleccionar el protocolo
deseado. Oprima el botón debajo de la pantalla EDIT. El IEF100 se
mostrará la pantalla de edición de protocolo (Fig. 11).
Todos los parámetros del IEF se muestran en una pantalla. Cada
protocolo se puede programar con hasta nueve etapas. El protocolo
termina con el primer paso que tiene un tiempo de paso de cero.
Utilice el mando para moverse entre los siguientes campos modificables. Una vez resaltado, haga clic en el botón para cambiar el valor
del campo.
Número de protocolo
Haga clic en el botón. El mando de ahora se moverá entre los 30
protocolos, lo que permite una rápida revisión de cada protocolo.
Nombre del protocolo
Protocolo de nombres pueden tener hasta 16 símbolos alfanuméricos.
Los símbolos disponibles son las siguientes:
A B C D E F G H I J K L M N O P Q R S T U V W X Y Z
% . @ / - + m u n 0 1 2 3 4 5 6 7 8 9
Seleccione el campo del nombre del protocolo, y haga clic en el botón.
Un cursor hará que el primer carácter a parpadear. Gire el botón
para desplazarse por los símbolos anteriores. Una vez que el símbolo
deseado, utilizar las flechas horizontales (las teclas directamente
debajo de la perilla) para mover el cursor a la siguiente posición.
Repita hasta que el nombre de protocolo es correcto.
El “espacio en blanco” se encuentra entre la letra minúscula “n” y los
símbolos “0”.
•
p12
Page 19

La minúscula “m”, “u”, y “n” puede ser utilizado para designar a
mili, micro y nano, si lo desea.
Cuando el nombre es correcto, haga clic en el botón para introducir
el nombre, y pasar al siguiente campo.
Retrasar
La línea de retardo es un paso opcional. Tanto el tiempo y la temperatura se puede introducir una. Enfoque se iniciará después de que el
tiempo de retardo ha transcurrido. Esto puede ser útil para las carreras durante la noche en que el usuario lo desea, puede haber centrado
su fin en algún momento específico del día siguiente. Los módulos
Peltier mantendrá la placa fría a la temperatura establecida.
Nota: Los tiempos para el incremento
minuto más cercano se pueden cargar a
los protocolos de una computadora.
Nota: Se recomienda no exceder
6000 V o superior a 0,5 W/tira para
un IPG de 7 cm. Por favor, siga las
instrucciones del fabricante tira IPG
para los límites recomendados.
Parámetro Unidades Serie Incremento
Time (hour:min) 0:00 – 99:59 0:15
Temperature (°C) 15 – 25 1
Límites del IEF
Máxima tensión, intensidad por tira, y tira de vatio por se aplican al
protocolo. Estos ajustes se anulan los valores de los pasos individuales.
Estos límites generales se puede utilizar para evitar que ciertas condiciones se centran que causan daño o problemas con las tiras de IPG.
La temperatura para la focalización también se establece. Dado que los
puntos isoeléctricos de las proteínas son dependientes de la temperatura, IEF es típicamente a una sola temperatura, usualmente 20 °C. No
se recomienda el uso de temperaturas inferiores a 20 °C, ya que puede
causar problemas con la cristalización de urea en la tira IPG.
Perilla Informáticos
incrementos configurables
Parámetro Unidades Serie ajustables incrementos
Volt (V) 0 – 12,000 250 1
Current/strip (μA) 0 – 999 25 1
Watts/strip (W) 0 – 2,0 0,1 0,1
Temperature (°C) 15 – 25 1 1
•
p13
Page 20

Nota: No se recomienda establecer
una serie de pasos discretos voltios.
Las discontinuidades entre los
pasos causar alzas en los niveles de
energía que tienden a aumentar las
posibilidades de las tiras de la quema.
Nota: En algunos casos, la
configuración de voltios no puede ser
alcanzado.
Nota: Si un paso vatios constante es
seguido por un paso gradiente voltios,
el paso voltios gradiente se iniciará
desde 0, y aumentan linealmente con
la tensión de conjunto.
Pasos
Para modificar cualquier parámetro de paso, gire la perilla para seleccionar el parámetro. Pulse el mando, y gire la perilla para ajustar el
valor deseado. Pulse el botón de nuevo para entrar en el valor, y pasar
al siguiente campo.
Cada paso tiene cuatro campos que se pueden editar: el tipo de paso,
un valor de paso, un paso de tiempo y las unidades de paso:
Step Type Tensión constante, el gradiente de V, W constante.
Step Value Establece el valor máximo de voltios o vatios dependiendo
del tipo de paso.
Step Time El tiempo en horas o voltajes.
Step Units Horario (horas) o voltios horas (Vhrs).
Paso Tipo y Valor de paso
Cada paso puede ser programada en uno de tres modos diferentes,
voltios voltios constante, un degradado o un vatio constante.
• En voltios constante, la tensión se mantiene constante thoughout la
longitud del paso.
• En gradiente voltios, la tensión se iniciará en el voltaje final de la
etapa anterior y aumento (o disminución) linealmente con el tiempo
a la tensión de entrada en el paso de corriente. Si el primer paso
del protocolo es un paso voltios gradiente, la tensión se incrementará de 0.
• Degradado voltios pasos poco a poco aumentar la potencia que se
aplica a las tiras de IPG, dando lugar a un calentamiento más parejo
de la banda con el tiempo.
•
p14
• Pasos vatios constantes se suavizar la generación de calor tanto
como sea posible durante el curso de la separación IEF. Todavía
habrá calentamiento localizado debido a diferentes concentraciones
de iones a lo largo de la longitud de las tiras de IPG.
• Cuándo utilizar el paso de vatios constantes, las unidades para el
valor del paso cambia automáticamente a vatios.
• En los pasos vatios constantes, el IEF100 calcula la resistencia, y se
ajusta el voltaje para mantener el ajuste vatios constante.
Page 21

Paso de tiempo
Nota: Cuando se cambia entre unidades
de tiempo, el IEF100 convertirá entre
las horas y Vhrs automáticamente.
Puede ser útil para establecer las
unidades de tiempo (horas o paso
Vhrs) antes del punto final numérica
se introduce.
Los pasos pueden ser programados para funcionar durante un
periodo de tiempo, Horas (00:00 en horas: minutos), o para una
determinada cantidad de voltios-hora, Vhrs (voltios multiplicado por
el número de horas). La mayoría de los fabricantes de tiras del IEF
recomienda para ejecutar las tiras de IPG a un determinado voltioshora del punto final.
El investigador debe determinar el punto final de la muestra específica. El primer paso con un valor 0 introducido en el paso de tiempo
se trata como el final del protocolo.
Step Value
Perilla Informáticos
incrementos configurables
Step Type Serie ajustables incrementos
Constant Volt 0 – 12,000 250 1
Gradient Volt 0 – 12,000 250 1
Constant Watt 0,1 – 2,0 0,1 0,1
Step Time
Hrs (hours:minutes) 00:00 – 99:59 0:15 0:01
Vhrs (volt-hours) 0 – 300,000 500 1
•
p15
Page 22

Nota: El instrumento IEF100 vigila
la corriente y voltaje en cada tira
individual. Si es necesario, las
condiciones pueden ser ajustados y/o
tiras problemáticos se puede quitar.
Fig. 12. Ejecutar pantalla.
Nota: IEF100 también suena
entre los cambios de paso.
Ejecutar la pantalla
La información en la pantalla de ejecución se describen en detalle en
la sección de operación de IEF.
La pantalla de ejecución no tiene campos editables. Se tiene los
siguientes cuatro teclas de función, MAIN, PAUSE, NEXT y GRAPH
(Fig. 12).
MAIN
Permite al usuario revisar y modificar todos los protocolos, mientras
que el IEF actual todavía se está ejecutando.
PAUSE
La PAUSE interrumpe el botón de la alta tensión a las tiras de IPG,
permitiendo al usuario a la interfaz de forma segura con las tiras.
Después de una pausa, RUN continuará desde donde fue interrumpido, o ABORT se terminará la carrera.
NEXT
El botón NEXT permite al usuario saltar la porción restante de la
etapa activa, e iniciar el siguiente paso en el protocolo.
GRAPH
El botón GRAPH mostrará los resultados de la ejecución actual gráficamente. Utilice el botón para desplazarse por el perfil de tensión, y
los perfiles de mA en los canales 1 a 6.
Presione EXIT para regresar a la pantalla de ejecución.
Al final de la carrera de la IEF100 emitirá un pitido, y apague la
fuente de alimentación de alta tensión. Una pantalla muestra el
número de protocolo, la fecha y hora de finalización, y las condiciones del IEF finales en cada tira IPG.
•
p16
Page 23

Nota: Cuando la pantalla de opciones
se accede, el IEF100 primero
verificará para ver si hay una conexión
ethernet. El IEF100 es inaccesible
hasta que el cheque se ha completado
(aproximadamente 10 segundos). Las
palabras “CHECKING ETHERNET”
parpadeará hasta que el cheque se ha
completado.
Fig. 13. Opciones de pantalla.
Opciones de pantalla
En el menú principal, pulsando la tecla “OPTION” permitirá el
acceso a las siguientes opciones (Fig. 13).
Serial Port and Intvl
Ethernet
Date/Time
Diagnostics
Clear all protocols
Serial Number
Serial Port
El puerto serial ajusta la velocidad a la que los datos son enviados o
recibidos desde un dispositivo externo. La velocidad de transmisión
se puede establecer en 9600, 38400 o 57600, con 38400 es el valor
por defecto. La velocidad de transmisión debe coincidir con la tasa de
notificación de datos del dispositivo externo (puerto de la computadora o la impresora de serie).
Intvl
El intervalo de tiempo entre los puntos de datos enviados a un dispositivo externo de recepción. El IEF100 interna registra puntos de
datos cada minuto. Cuando la descarga de los datos, el intervalo entre
los puntos de datos se puede cambiar desde 1 a 15 minutos. El intervalo predeterminado es de 5 minutos. Para carreras largas, puede ser
deseable tener un menor número de puntos de datos, y por lo tanto
utilizar los valores más altos para el intervalo.
Ethernet
La conexión Ethernet se determina automáticamente. “NO
CONNECTION” se mostrará hasta que un cable se conecta al
puerto. Una vez que una conexión inalámbrica a internet activa se ha
establecido, el servidor local le asignará una dirección IP que se muestra en el formato XXX.XXX.XXX.XXX. Este proceso suele tardar
unos 10 segundos.
•
p17
Page 24

Para establecer la fecha
El campo de fecha es de tres campos separados de “DAY/MONTH/YEAR”.
1 Con el botón para resaltar el campo de fecha. Haga clic en el botón
para ajustar la fecha.
2 Gire la perilla para cambiar la fecha. Usa las flechas horizontales (las
teclas directamente debajo de la perilla) para acceder al “MONTH” y
los campos “YEAR”, si es necesario.
3 Cuándo los tres campos son correctos, pulse el botón para entrar en la
nueva fecha.
Para seleccionar la hora
El campo es de dos campos separados, “HOUR:MINUTE”. La “HOUR” de
campo utiliza el rango de 0 a 24 para indicar la hora del día.
1 Utilice el mando para seleccionar el campo del tiempo. Haga clic en el
botón para ajustar la hora.
2 Gire la perilla para cambiar la “HOUR”. Usa las flechas horizon-
tales (las teclas directamente debajo de la perilla) para acceder al
“MINUTE” de campo, si es necesario.
3 Cuando todos los campos son correctos, haga clic en el botón para
entrar en el nuevo tiempo.
Diagnóstico
1 Resalte Diagnósticos y pulse el botón. La tecla de función “RUN”
aparece en la pantalla. Pulse el botón “RUN” para mostrar una
pantalla emergente con tres opciones:
Run Diags
Manual Vout
Cancel
2 Utilice el botón para seleccionar la opción, y pulse la tecla de
función “OK”.
Run Diags
El diagnóstico de la función tiene el visto IEF100 a través de una serie
de pruebas internas para confirmar la función. Las pruebas incluyen la
salida de voltaje y corriente de la alimentación interna de alta tensión,
la EPROM, y el reloj. Si las pruebas de todo bien, el mensaje “ALL
OK” aparece brevemente en la pantalla.
Si una de las pruebas falla, póngase en contacto con el representante
Hoefer, Inc. para organizar el servicio para el instrumento.
Manual Vout
Pulse Aceptar para mostrar una pantalla de ejecución. Haga clic en el
botón de modo “set”, y la tensión de salida es ajustable en incrementos de 250 V. La ejecución de instrucciones continuará hasta que se
detuvo por el usuario, o hasta 4 horas.
Salir de esta pantalla volverá al menú principal.
•
p18
Page 25

Nota: No se puede recuperar
protocolos programados por
el usuario una vez que se han
restablecido, o borrados.
Clear All Protocols
Esta opción se utiliza para sobrescribir los protocolos existentes en la
memoria. Una pantalla emergente muestra tres opciones:
Defaults
Erase
Cancel
• Seleccione la opción adecuada y pulse “OK”.
• “ DEFAULTS” restablece todos los 30 protocolos de los valores predetermi-
nados de fábrica, es decir, los protocolos de nueve pre-programados y 21
protocolos vacíos.
• “ ERASE” elimina todos los datos de los 30 protocolos en la memoria.
Protocolos vacíos tienen límites predeterminados de 12.000 V, 500 μA/
strip, 2 W/strip y 20 °C.
Serial Number
Muestra el número de serie de la IEF100. Esto no es editable.
•
p19
Page 26

IEF100 Operación
Nota: Empuje hacia adentro la perilla,
y suelte rápidamente a un “clic”. No
hay señales táctiles y auditivas. A los
cambios haga clic en el éxito entre los
“MOVE” y los modos de “SET”.
Fig. 14. La perilla.
Fig. 15. Interruptor ON/OFF.
Usando el mando
El mando tiene dos acciones, se vuelve, y lo empuja a un “clic” (Fig. 14).
Girar: Navega a través de los campos, ajusta los valores.
Haga clic en: Cambios entre “MOVE” y “SET” modos, como se indica
por el LED.
1 En “MOVE” el modo, seleccione el campo que desea cambiar.
2 Haga clic en el botón para cambiar al modo “set”.
3 Girar el mando ahora ajustar el valor del campo. Cuando el valor
correcto se muestra, haga clic en el botón de nuevo para entrar en
el valor, y cambie de nuevo para “mover” el modo. Al girar la perilla
ahora pasará al siguiente campo.
IEF100 configuración
1 Enchufe el IEF100 a una toma de red con el cable de alimentación
adecuado. Un adaptador puede ser necesario en algunos países. El
módulo de entrada de alimentación está en el panel posterior. El interruptor ON/OFF se encuentra en el módulo de entrada de alimentación
(Fig. 15).
2 Deje espacio libre alrededor del instrumento y espacio suficiente arriba
para permitir la apertura de la tapa. Los orificios de ventilación no
deben ser bloqueadas. No permita que los líquidos para entrar en las
entradas laterales.
3 Lave la bandeja de electrodo, enjuague bien con agua desionizada y
dejar secar al aire.
4 Limpie con cuidado los electrodos de platino puntos de contacto de
alambre y deje secar al aire.
5 Cuando la unidad está inactiva durante un periodo de tiempo que
un protector de pantalla se mostrará a prolongar la vida útil de la
pantalla. Pulse cualquier botón para salir del protector de pantalla.
Fig. 16. Conexión Ethernet.
•
p20
Conexiones de impresora y el ordenador
Conectar y configurar una impresora o un ordenador antes de concentrarse, y el IEF100 envía automáticamente los datos de salida en
tiempo real (Fig. 16).
Ver conexiones de datos opcionales, la página 35.
Page 27

Preparación de las tiras de IPG
Los geles de pH inmovilizados (IPG) son ultra delgadas en geles de
poliacrilamida películas de soporte de plástico. Los geles se hacen con
un gradiente de pH unido covalentemente a la matriz de gel. Los geles
son estables y reproducibles. Los geles se suministran deshidratado y
deben almacenarse a temperaturas de -20 °C o menos.
Las tiras de IPG tienen una ácida (+) final y una base end (–). Imágenes 2D de gel son típicamente se muestra con el lado ácido de la
izquierda, y que es la orientación de las tiras de IPG en la IEF100. El
electrodo adecuado debe ser aplicado a cada extremo: anódico (+) del
electrodo al final ácida (izquierda) y la catódica (–) del electrodo al
final de base (derecha).
Las tiras secas requieren rehidratación antes de la carrera. Típicamente, varios reactivos diferentes están incluidos en la solución de
rehidratación para ayudar a solubilizar las proteínas, y permitir con
éxito isoelectroenfoque. La rehidratación se realiza normalmente a
temperatura ambiente, o 20 °C, y necesita un mínimo de 8 horas para
una buena absorción de la solución reswelling. Con frecuencia es más
conveniente para permitir la rehidratación que se produzca durante la
noche. Durante la rehidratación, las tiras IPG están cubiertos en aceite
mineral para evitar la pérdida de humedad, y evitar la cristalización
de urea.
Las tiras IPG se rehidratan con una de las bandejas de rehidratación/
equilibración suministradas con el IEF100. Muestra de proteína se
puede añadir a la tira IPG en este paso. Las tiras IPG se transfieren a
la IEF100 para enfocar.
•
p21
Page 28

Nota: IEF100 es un lugar conveniente
para rehidratar las tiras. La placa fría se
mantenga una temperatura constante, y
la cubierta ayudará a proteger las tiras
IPG de polvo.
La rehidratación de las tiras de IPG
Un breve análisis de los ingredientes de rehidratación y su función
está incluida en el Apéndice B, junto con algunas de las soluciones
recomendadas. Los reactivos se pueden personalizar para muestras
específicas.
El volumen de la solución depende de la longitud de la tira para ser
utilizado. Hoefer recomienda seguir las recomendaciones del fabricante de la tira IPG.
Una tabla de volúmenes típicos se incluye a continuación.
Nota: El uso más que los volúmenes
recomendados pueden contribuir a la
pérdida de la proteína o los resultados
borrosas IEF.
Nota: Las soluciones de rehidratación
típicamente contienen altas
concentraciones de urea que tienden
a cristalizar a temperaturas más bajas.
Por esta razón, la rehidratación no
debe hacerse en cámaras frigoríficas
o en ambientes más fríos de manera
significativa a los 20 °C.
Nota: Las tiras deslizantes en el
tampón de rehidratación se moje
toda la longitud de la tira, y ayuda a
evitar que se pegue. Tiras colocados
directamente contra la parte inferior
de plástico de la bandeja de
rehidratación puede adherirse, y no
rehidratar correctamente.
Longitud de Volumen por
la tira (cm) la Franja de (μl)
7 130
18 340
24 450
Aplicar una solución de rehidratación en un canal de la bandeja de
rehidratación de tamaño apropiado en una línea ligeramente más
corta en longitud que la tira para ser rehidratados.
Muchos fabricantes tira IPG de cubrir las tiras con una cubierta
protectora. Si está presente, retire la capa protectora.
Colocar la tira, el gel hacia abajo, sobre el líquido en el canal. Deslice
suavemente la tira hacia atrás y adelante para humedecer toda la
longitud del gel IPG con solución de rehidratación. A veces, levantar y
bajar la tira IPG puede ayudar a conseguir el contacto adecuado de la
solución sobre toda la longitud de la tira de gel de IPG.
Cubra las tiras con aceite mineral, el número de Hoefer fin GR138-1.
Permitir la rehidratación de un mínimo de 8 horas. Mejor rehidratación se produce si permitiendo tiras para rehidratar durante la noche.
•
p22
Page 29

Fig. 17. Abra la tapa de seguridad.
Fig. 18. Deslice la bandeja de enfoque.
Isoelectroenfoque
(utilizando el conjunto de electrodo)
1
Abrir la tapa de seguridad presionando hacia abajo en la etiqueta de empuje
blanco en el centro de la parte frontal de la tapa (Fig. 17).
2
Inserte la bandeja de IEF105 se centra en el extremo derecho de la placa
fría. La bandeja tiene una única orientación. Hay (+) y (–) marcas en la
bandeja que se alinean con las marcas correspondientes en el IEF100.
La bandeja no se ajustan adecuadamente en el IEF100 en cualquier
otra orientación.
3
Deslice la bandeja de enfoque hacia la izquierda debajo de las pestañas de
sujeción (Fig. 18). Estas pestañas mejorar el contacto y la transferencia de
calor, entre la bandeja y la placa fría.
4
Use unas pinzas para cargar las tiras IPG rehidratadas en el lado de la
bandeja de gel de enfoque hacia arriba. El anódica (+) final de las tiras
deben ser de la izquierda, coincidiendo con el (+) en la bandeja y la
IEF100 (Fig. 19).
Los canales de tira están numerados de modo que el canal 1 es la más
cercana a la parte delantera y el canal 6 está en la parte posterior de
la IEF100.
Fig. 19. Coloque las tiras de IPG.
Nota: En cualquier ejecución una, todas
las tiras IPG deben tener la misma
longitud de los electrodos para hacer un
buen contacto.
•
p23
Page 30

Fig. 20. Allinea strisce.
Nota: Gli stoppini elettrodi assorbono
ioni raccolta in corrispondenza
delle estremità delle strisce IPG, e
generalmente migliorare i risultati IEF.
Fig. 21. Vassoio di messa a
fuoco allargata.
5
Allineare il (+) fine delle strisce con il segno di allineamento nella barra
delle applicazioni (Fig. 20).
Ciò contribuirà in due modi. In primo luogo, le linguette di bloccaggio non
interferisca con il posizionamento degli elettrodi. In secondo luogo, vi sono
scanalature piccoli nel fondo dei canali di pinze per rimuovere strisce IPG
dopo IEF.
6
Applicare stoppini elettrodi su ciascuna estremità delle strisce IPG, sovrapposto al gel di 2-3 mm, e si estende l’estremità del nastro IPG.
• Gli stoppini elettrodi vengono forniti in lunghe strisce perforate. Usare le
forbici per tagliare il numero desiderato di stoppini.
• Inumidire gli stoppini IEF con acqua e asciugare delicatamente l’acqua
in eccesso.
Scanalature per il forcipe per
rimuovere le strisce IPG
Fig. 22. Stoppino di collocamento.
•
p24
IPG tracciato
della linea
strip
Filo di platino
Elettrodo di stoppino
Linguette di
bloccaggio
IPG caratteristiche di
allineamento nastro. Non
utilizzare coppa campione su
queste caratteristiche.
IPG Strip
Page 31

Nota: Gli elettrodi non farà contatto
con le strisce IPG senza lo stoppino
elettrodo in posizione.
Fig. 23. Collegare (+) elettrodo.
7
Collegare il (+) elettrodo al terminale (+) (Fig. 23).
8
Posizionare il (+) elettrodo sopra gli stoppini elettrodi in modo che il filo di
platino è concentrata nella zona di sovrapposizione tra stoppino e la striscia
IPG (Fig. 24).
L’elettrodo dovrebbe leggermente bloccarlo in posizione.
Fig. 24. Bloqueo (+) elettrodo in
posizione.
•
p25
Page 32

Fig. 25. Conecte (–) de los electrodos.
9
Conectar el electrodo (–) para el terminal (–) (Fig. 25).
0
Colocar la (–) electrodo en la parte superior de las mechas de electrodos de
manera que el alambre de platino se centra en el área de solapamiento entre
las mechas y la tira IPG (Fig. 26).
El electrodo de la ligera debe bloquear en su lugar.
!
Cubra las tiras y los canales vacíos con 60 ml de aceite mineral. Usar menos
el aceite correrá el riesgo de que las tiras de IPG no estará completamente
cubierto y podría secarse durante la carrera (Fig. 27).
Fig. 26. Bloqueo de (–)
electrodo en su lugar.
Fig. 27. Cubrir con aceite mineral.
•
p26
Page 33

Fig. 28. IEF100 configurar utilizando el
accesorio de doble electrodo.
Isoelectroenfoque
(utilizando el accesorio de doble electrodo)
El accesorio de doble electrodo aumenta la capacidad de Hoefer
IEF100, lo que permite un máximo de doce, 7 cm IPG tiras que se
ejecutan simultáneamente. Esto se logra mediante la ejecución de
hasta seis pares de tiras de IPG en paralelo. Cada uno de los seis
canales informará la suma de la corriente y potencia de las tiras
emparejadas, por lo tanto, los límites actuales y la potencia debe
fijarse en el doble del valor habitual utilizado cuando se ejecuta tiras
individuales y, como siempre, las tiras IPG se ejecuta simultáneamente
debe ser del mismo pH y conductividad.
1
Abrir la tapa de seguridad presionando hacia abajo en la etiqueta de empuje
en el centro de la parte frontal de la tapa.
2
Inserte la bandeja de IEF105 se centra en el extremo derecho de la placa
fría. La bandeja tiene una única orientación. Hay (+) y (–) marcas en la
bandeja que se alinean con las marcas correspondientes en el IEF100.
La bandeja no se ajustan adecuadamente en el IEF100 en cualquier otra
orientación.
3
Deslice la bandeja de enfoque hacia la izquierda debajo de las pestañas
de sujeción. Estas pestañas mejorar el contacto y la transferencia de calor,
entre la bandeja y la placa fría.
4
Use unas pinzas para cargar los rehidratados 7 cm IPG tiras en la bandeja
de enfoque con la parte del gel de las tiras hacia arriba.
5
El primer conjunto de tiras IPG se deben cargar en el lado izquierdo de la
bandeja con la anódica (+) final de las tiras a la izquierda que coinciden con
el (+) en la bandeja y la IEF100.
•
p27
Page 34

6
El segundo conjunto de tiras IPG se cargan a la derecha de la primera
serie en la orientación opuesta, con el extremo anódico (+) de las tiras que
coinciden con el (–) en la bandeja y la IEF100. El extremo catódico (–) del
conjunto de cada una de las tiras deben ser uno frente al otro en el centro
de la bandeja de centrado, aproximadamente 4 cm de distancia (Fig. 29).
7
IPG tiras paralelas deben estar alineados en la mayor medida posible con el
(+) o (–) impreso en la tira de guía de alineación.
8
Aplicar mechas de electrodos en la parte superior de cada extremo de las
tiras de IPG, la superposición del gel por 2-3 mm, y que se extiende fuera
del extremo de la tira IPG.
• Las mechas de los electrodos se suministran en tiras largas y perforadas.
Utilice unas tijeras para cortar el número deseado de mechas.
• Humedecer las mechas del IEF con agua y secar suavemente el exceso
de agua.
9
Conecte los electrodos del ánodo (+) al positivo (+) del terminal en el lado
izquierdo de la IEF100.
Fig. 29. Colocación de la Franja
de IPG.
0
Los electrodos de ánodo se colocan en cada extremo de la bandeja de
enfoque, el lado izquierdo de la primera serie de tiras de IPG y el lado derecho de la segunda serie de tiras de IPG. Los electrodos deben estar centradas en la parte superior de la zona donde se superpone mecha el gel de la
tira IPG.
!
Conecte los electrodos de cátodo (–) al negativo (–) de la parte derecha
de la IEF100.
@
Los electrodos de cátodo se colocan en el centro de la bandeja de enfoque,
en el lado derecho de la primera serie de tiras de IPG y el lado izquierdo de
la segunda serie de tiras de IPG. Los electrodos deben estar centradas en la
parte superior de la zona donde se superpone mecha el gel de la tira IPG.
en la bandeja
IPG franja IPG franja
en la bandeja
•
p28
Page 35

Recipientes para muestras
Nota: Hay pequeños características
semicirculares en la parte inferior de
los canales de la bandeja que ayudan
a alinear la tira IPG en el centro del
carril. Las patas de la copa de muestra
no debe golpear estas características
o bien la copa de muestras de fugas.
Véase la Fig. 21 en la página 24.
Fig. 30. Coloque recipientes
para muestras.
Tazas de ejemplo se puede utilizar para aplicar la muestra de proteína a
IPG tiras si no se incluyó en el tampón de rehidratación. Las tazas de la
muestra se presenta en tiras de seis tazas. Los recipientes para muestras
se pueden utilizar juntos o se separan y utilizan por separado.
1
Presione hacia abajo las copas de muestra en la parte superior de las tiras
de IPG. Las copas de muestra debe dejar en la parte inferior del canal y el
sello en las tiras IPG (Fig. 30).
En general, la mayoría de carga taza se realiza en el extremo anódico de la
tira IPG. Cada muestra es diferente. En algunas situaciones, las muestras
pueden centrarse mejor cargado en otra parte de una tira. Esto sólo puede
determinarse experimentalmente para diferentes tipos de muestras.
2
Hasta 240 μl de la muestra se puede aplicar a las copas de muestra (Fig. 31).
3
Una vez cargado, confirme la configuración del protocolo.
4
Cerrar la tapa (Fig. 32).
Fig. 31. Aplique la muestra.
Fig. 32. Cierre la tapa de seguridad.
•
p29
Page 36

Nota: Los límites generales del
protocolo de la corriente/tira y vatios/
tira no funcionará correctamente
sin necesidad de introducir el
número correcto de los canales que
contienen tiras.
Nota: Los monitores de la IEF100
actuales y vatios en cada canal. Si
es necesario, las condiciones pueden
ser ajustados y/o tiras problemáticos
puede ser retirado de la carrera.
Inicio IEF
1
Seleccione el protocolo que desee y pulse “RUN”.
2
Confirme el número de canales de centrarse bandeja que contiene tiras de
IPG. Utilice el botón para cambiar el valor.
3
Presione “RUN” para iniciar el IEF.
4
El IEF100 emitirá un sonido para indicar el inicio de una carrera. La alta
tensión se iluminará, y el “RUNNING” parpadeará en la esquina
superior derecha de la pantalla.
La pantalla mostrará largo plazo las condiciones actuales.
•
p30
Page 37

Nota: El IEF100 sólo puede controlar
las condiciones de un canal bandeja
centrándose a la vez. Los IEF100
límites del canal con la más alta
actual, o vatios. IPG tiras preparadas
en las mismas condiciones se
presentan variaciones debido a las
diferencias geométricas en el gel IPG
y las diferencias de contacto bajo los
electrodos. IPG tiras con diferentes
muestras puede mostrar grandes
diferencias en corriente y potencia
debido a conductividades diferentes de
las muestras.
Ejecutar la pantalla
La pantalla de ejecución muestra toda la información sobre la ejecución actual (Fig. 33). No hay campos editables. La información en la
pantalla de ejecución se describen a continuación.
Línea 1
El número de protocolo y el nombre se muestran. La esquina superior derecha indica el estado de ejecución como en funcionamiento (intermitente),
hizo una pausa o terminado.
Línea 2
Muestra el número de tiras IPG se centran (o el número de canales si se usa
el accesorio Electrodo doble).
Línea 3
Describe el paso activo, el número de paso, el valor del paso (voltios o
vatios/tira) y el punto final paso (horas o Vhrs).
Línea 4
Muestra el tiempo total transcurrido y el total de voltios-hora de enfocar
hasta el momento.
Línea 5
Muestra el tiempo total transcurrido y el total de voltios-hora de la etapa
activa.
Línea 6
Muestra las condiciones de salida en tiempo real de todas las bandas,
incluyendo a los voltios de corriente, la corriente total, los vatios totales y la
temperatura de la plataforma.
Línea 8-13
Muestra la corriente tira individual y los vatios.
Fig. 33. Ejecutar pantalla.
•
p31
Page 38

Fig. 34. Ejecutar pantalla.
En el ejemplo debajo de 6 tiras de IPG se centra, según el protocolo
7, un máximo de 0,5 W/tira y 100.000 voltios-hora final del estudio (Fig. 34).
El protocolo es en el tercer paso. El protocolo ha estado funcionando
durante 4 horas y 24 minutos, o 19.108 horas de voltios. En la
actualidad, el protocolo es de 1 hora y 2 minutos y 12.088 horas de
tensión, en el paso 3.
La fuente de alimentación interna está entregando 11.574 voltios, con
un total de 156 μA y 1,8 vatios en seis tiras de IPG.
Durante unas tiras diferentes de ejecución puede controlar el voltaje
en general como la resistencia de los cambios tiras durante la carrera.
•
p32
Page 39

Nota: La sal adicional en la muestra
tiende a aplanar las gráficas (horizontal)
y tomar más tiempo para la muestra
para enfocar.
Nota: Si hay problemas con la quema
de tiras de IPG, establecer el límite de
corriente de 50 μA/tira para garantizar
condiciones seguras de enfoque para
toda la separación.
Nota: La tensión y el μA se escalan y se
representan de forma automática.
Fig. 35. Voltios y perfiles típicos μA.
Típicos isoelectroenfoque
El primer paso se establece normalmente a baja tensión para limitar
la corriente y dejar que los iones se mueven hasta el final de las tiras
IPG sin corrientes excesivas. Si la carga de la muestra con una copa
de muestra, un paso lento adicional puede ser añadido para permitir
la muestra para introducir la tira IPG bajo condiciones suaves.
En los pasos intermedios, las rampas de tensión hacia arriba a una
meseta, y esto es donde la mayor parte de la focalización se produce.
La corriente disminuye hasta un valor mínimo. Los siguientes gráficos
muestran los perfiles de tensión típica y μA (Fig. 35).
Un paso final ha sido añadido a los protocolos pre-programados para
mantener el voltaje a 1000 V durante una hora. Esto evitará que las
bandas se centró en el IEF100 hasta que el siguiente paso. Extender la
longitud de este paso según sea necesario.
•
p33
Page 40

Fig. 36. Poner fin a la pantalla
de ejecución.
Al finalizar el enfoque, la IEF100 emitirá un sonido y una pantalla de
fin de carrera se muestra (Fig. 36).
Línea 1
El número de protocolo y el nombre. La palabra “FINISHED” se muestra en
la esquina superior derecha.
Línea 2
El número de bandas de correr (o el número de canales, si utilizando el
accesorio de doble electrodo).
Línea 3
La fecha y hora que se centra terminado.
Línea 4
El tiempo total y las horas de tensión de enfoque.
Línea 5
El tiempo de último paso y el horario de voltios.
Línea 6
Los voltios, y la corriente total y vatios de todas las tiras IPG al final
de la carrera.
Línea 8-13
Las condiciones en cada tira al final de la carrera.
Nota: Siempre que una nueva IEF
se ha iniciado, los datos anteriores
IEF se pierde permanentemente.
Nota: No se equilibren las tiras
IPG antes de guardar a -20 °C.
•
p34
Los resultados pueden verse gráficamente empujando la función
“GRAPH”. Los datos serán retenidos en la memoria hasta una nueva
ejecución se ha iniciado.
En este punto, las tiras IPG se pueden almacenar a -20 °C.
O bien, si la segunda dimensión consiste en proceder de inmediato, el
buffer debe ser cambiada en un proceso de dos etapas de equilibrio
antes de la página segunda dimensión.
Page 41

Conexiones de datos opcionales
Conexión de la impresora de serie
Use el puerto RS-232 para conectar directamente a una impresora
serie. La impresora y el cable no se suministra. La serie de la impresora debe tener los siguientes valores.
Baud Rate 9600, 38400 o 57600
(deben coincidir con IEF100 velocidad en baudios)
Data Bits 8
Parity None
Stop Bit 1
Flow Control None
La siguiente sección describe la conexión serial de la computadora o
una conexión Ethernet a la IEF100.
Conexión de HyperTerminal
HyperTerminal es un programa de Windows™ que puede comunicarse
con dispositivos externos. Con la creación de una conexión entre un
ordenador y IEF100, el usuario puede:
• Importar y exportar protocolos de la IEF100.
• Captura de datos de salida de la IEF100.
• Controlar la IEF100.
La descripción y las pantallas de abajo son las pantallas de HyperTerminal. Otros programas de emulación de terminal también funciona
utilizando la misma configuración.
Configuración del puerto de comunicaciones
1 Inicie HyperTerminal en Windows.
2 Haga clic en Windows “START” de comandos.
3 Inicie Todos Programs-Accessories-Communications-HyperTerminal.
4 Asigne un nombre a la nueva conexión (Fig. 37).
Fig. 37. Asignar nombre a las nuevas
conexione.
•
p35
Page 42

Fig. 38. Seleccione un COM Port.
Configuración del puerto serie
1 Seleccione un COM Port (Fig. 38). Este es el puerto de la computa-
dora para comunicarse directamente con el IEF100. Seleccione TCP/
IP si se conecta a través de la conexión ethernet.
Fig. 39. Ajuste el baud rate.
2 Ajuste el baud rate de los mismos que los datos IEF100, 9600,
38400 or 57600 o 8 data bits, no parity, 1 stop bit, hardware flow
control (Fig. 39).
•
p36
Page 43

Conexión TCP/IP usando el puerto Ethernet
Utilice el IEF100 puerto Ethernet para conectarse a una red de área
local (LAN).
Conecte un cable Ethernet en vivo en el puerto. La LAN le asignará
automáticamente una dirección de Internet a la IEF100. La dirección
de Internet se muestra en la pantalla IEF100 opciones.
Puerto Ethernet de configuración
1 En la pantalla de propiedades de HyperTerminal, seleccione el proto-
colo TCP/IP (Winsock) opción en el puerto de comunicación ventanas
de propiedades (Fig. 40).
2 Prensa “OPTION” desde la pantalla principal de la IEF100. El servidor
local debe asignar automáticamente una dirección de Internet en el
formato XXX.XXX.XXX.XXX.
Introduzca la dirección IP a la IEF100 en la “HOST ADDRESS” línea
en el formato XXX.XXX.XXX.XXX (Fig. 41).
3 Establecer el “PORT NUMBER” a 10001 (Fig. 41).
Fig. 40. Seleccione la opción TCP/IP. Fig. 41. Introduzca la dirección IP
y número de puerto.
•
p37
Page 44

Fig. 42.
4 Haga clic en la pestaña “Settings” y la “ASCII Setup” botón (Fig. 42).
5 En la sección “ASCII setup section”, marque las casillas
“Send line ends with line feeds”
“Echo typed characters locally” (Fig. 43).
6 Ajuste el “Line delay to 30 milliseconds”
7 Ajuste el “Character delay to 0 milliseconds”
8 En la sección “ASCII receiving section”, marque la casilla
“Wrap lines that exceed terminal width”
Fig. 43.
•
p38
Page 45

Nota: Los datos de la IEF100 es una
serie de campos de texto separados
por comas. Un método para transferir
datos a otros programas es usar el
“Windows clipboard” para copiar y
pegar los datos.
Fig. 44.
La captura de datos IEF100
1 Asegúrese de que hay una buena conexión entre el HyperTerminal y el
IEF100.
2 Abra HyperTerminal. Tipo “AT” y pulse “ENTER”.
“OK” debería aparecer en la ventana de HyperTerminal.
3 Hay dos formas de descargar los datos de la IEF100. Los datos
pueden ser recogidos en tiempo real, o enviados como un archivo de
registro de datos después de enfocar.
Recoge en tiempo real
1 Con el programa HyperTerminal abierto, utilice los menús para acceder
a HyperTerminal “Transfer/Capture” texto (Fig. 44).
2 Un nombre al archivo y el directorio que va a recoger los datos. Utilice
el botón “Browse Button”, si es necesario (Fig. 45).
Los datos de la IEF100 se envía automáticamente a los puertos de
salida cada 5 minutos. Una vez que una carrera se inicia, automáticamente los datos comenzarán a aparecer en la ventana de HyperTerminal.
3 Después de enfocar, para detener la captura de datos, utilizar los
menús “Transfer/Capture Text/Stop” o “Pause” (Fig. 46).
4 Los datos se almacenan en el archivo llamado.
Fig. 45.
Fig. 46.
Nota: Copiar y pegar los datos, por
defecto, poner todos los datos en una
columna en una hoja de cálculo Excel.
Utilice los menús de Excel “Data/Text
to columns command”, establecer el
delimitador como comas, y los datos en
columnas para ordenar los gráficos.
Después de la transferencia del registro de datos IEF
1 Tipo “XDATALOG” en una ventana de HyperTerminal activo.
2 Los datos de la última ejecución será transferido a la ventana
HyperTerminal.
•
p39
Page 46

Comandos HyperTerminal
El programa HyperTerminal se comunica con el IEF100 mediante la
transmisión de una línea de datos a la vez.
Varias líneas se pueden escribir y se envían entre sí. Escriba cada línea
perfectamente la primera vez, y presione Enter, para que el comando
se ha cargado correctamente en el IEF100. Todos los comandos
distinguen entre mayúsculas y minúsculas. Corrección de errores tipográficos en una línea de datos utilizando la barra espaciadora y las
teclas de borrado no dará lugar a una comunicación exitosa.
El primer comando para escribir en el HyperTerminal debe ser “A”
y entrar. Una buena conexión se verifica con la palabra “OK”,
volviendo en la ventana de HyperTerminal.
Ejemplos de protocolos se dan al final del Apéndice A. Estos se
pueden cortar y pegar para ayudar con el formato de línea.
Un subconjunto de comandos útiles HyperTerminal se dan en la
siguiente página.
•
p40
Page 47

Subconjunto de comandos HyperTerminal
Formato
Comando Comando Descripción Expandir Descripción Resultado de un Comando Comandos
AT Compruebe la conexión Compruebe si la conexión entre el HyperTerminal “OK” vuelve con una buena conexión. AT
y IEF100 es buena y configurado correctamente.
XDATALOG Transferencia de datos Transferencia de datos de la memoria De registro de datos se muestra XDATALOG
IEF100 de HyperTerminal. en HyperTerminal.
Formato de salida de datos
Line 1 Header prot#,protname,startdate,starttime,#datapoints
Line 2 datapoints minute,volt,μAC1,μAC2,μAC3,μAC4,μAC5,μAC6,temp
End Line END,enddate,endtime
¿Dónde μAC1 es la corriente en microamperios en el canal 1.
IPROT Importación de protocolo Importar y sobrescribe una de las posiciones Contenido de protocolo en la 2 formatos de la
de protocolo 30: protocolo de transferencia memoria IEF100. línea dependiendo
de la computadora a IEF100. del tipo de paso
Introducción de datos en formato
Delay step – IPROT,prot#,protname,step#,delaytime,delaytemp,runtemp,maxμA,maxA,maxVolt,maxWatt
IPROT,5,18cm const Watt,D,0:00,20,20,500,12000,1.5
Step – IPROT,prot#,protname,step#,steptype,stepvalue,timeunits,timeunits,time
IPROT,5,18cm const Watt,2,W,1.5,V,25000
EPROT,# Protocolo para exportar Copias del número de protocolo # IEF100 Protocolo aparece en la ventana EPROT,#
de HyperTerminal. HyperTerminal. (# es 1–30)
EPROT, Exportación de todos los Copia todos los protocolos de 30 de Protocolo aparece en la ventana EPROT,
protocolos IEF100 a HyperTerminal. HyperTerminal.
PrnRate,# Datos de ajuste del Cambios intervalo entre los puntos de datos INTVL en IEF100 se actualizará. PrnRate,#
intervalo (1–15 minutos). (# es 1–15)
Start,#1,#2 Iniciar el protocolo Inicia el protocolo #1 por #2 tiras de IPG. IEF100 comenzará a concentrarse. Start,#1,#2
(#1 es 1–30)
(#2 es 1–6)
Start Hojas de protocolo Reinicia un protocolo en un estado de pausa. IEF100 se reanudará centrándose. START
Stop Detener el protocolo Detiene un protocolo en curso. IEF100 terminará centrándose. STOP
Pause Pausa el protocolo Hace una pausa de un protocolo en curso. IEF100 hará una pausa centrándose. PAUSE
Report Envía el estado actual. Envía los datos de ejecución actual, REPORT
si se activa el enfoque, envía los datos
de ejecución actual, si está en pausa,
envía una “PAUSE” del mensaje, si no
se ejecuta, muestra “IDLE”.
ID? Envía el número de serie. Transfiere IEF100 número de serie a ID?
la computadora.
•
p41
Page 48

Cuidado y mantenimiento
Gire el interruptor a la red y desconecte el cable de alimentación antes
de limpiarlo.
Instrumento y la tapa
• Utilice un paño suave humedecido con agua o una solución limpiadora suave para limpiar la carcasa y la pantalla.
• Si los líquidos derramados en contacto con las placas de circuito,
desconecte el IEF100 y deje que se seque por completo. Llame
Hoefer, Inc. antes de utilizar.
Limpieza de la bandeja y electrodos
• Un detergente diseñado para eliminar el aceite se recomienda,
seguido de los reactivos de laboratorio leves, no iónicos de limpieza.
Enjuagar bandeja bien con agua desionizada y se seque por
completo antes de su uso.
• El alambre de platino en los electrodos es frágil y se debe limpiar
con mucho cuidado. Los electrodos no deben ser sumergidos en
la solución.
Servicio Técnico y Reparaciones
Hoefer, Inc. ofrece soporte técnico completo para todos nuestros
productos. Si usted tiene alguna pregunta acerca de cómo utilizar este
producto, o si desea disponer lo necesario para reparar, por favor
llame o envíe por fax su Hoefer, Inc. representante.
•
p42
Page 49

Solución de problemas
Problema Solución
El instrumento no se enciende Revise el cable de alimentación está enchufado a una toma de tierra y de
encendido/apagado se gira a la de (l)
La puerta está abierta La unidad no funcionará a menos que la tapa de seguridad esté completa-
mente cerrada. Presione hacia abajo en ambos lados para realizar los cierres.
Unidad lectura 0 μA, 0 W para todas las bandas Asegurarse de que las mechas de los electrodos están en contacto con las
tiras de IPG.
Los electrodos deben ponerse en contacto con las mechas de los electrodos,
y centrada en el área de superposición entre la mecha y las tiras de IPG.
Comprobar que las tiras IPG han sido totalmente hidratado antes de su uso.
Asegurarse de que los electrodos están conectados a los receptáculos
correspondientes.
De baja tensión de partida de pasos de gradiente puede no producir sufici-
ente corriente para registrar al comienzo de la etapa. Ver la corriente en las
tiras de nuevo en unos pocos minutos.
Ejecute el diagnóstico para comprobar la fuente de alimentación interna.
Unidad lectura 0 μA, 0 W para una sola tira de Rehidratación Pobre tira IPG: controlar el espesor (altura) de la tira IPG en
toda su longitud.
Compruebe si hay chispas o llamas que podría romper el circuito eléctrico.
Cable roto en el (–) de los electrodos. Vuelva a colocar los electrodos.
No hay salida de tensión Ejecute los diagnósticos en el menú de opciones.
Póngase en contacto con Hoefer local, Inc. representante.
Pantalla en blanco Apague la unidad y el.
Póngase en contacto con Hoefer local, Inc. representante.
Screen frozen Apague la unidad y el.
Póngase en contacto con Hoefer local, Inc. representante.
Falla el diagnóstico El programa de diagnóstico comprobará la salida voltios y la corriente
de la fuente de alimentación interna, la EPROM y el reloj del sistema.
Comuníquese con su representante local de Hoefer, Inc. si alguna de estas
pruebas dan negativo.
•
p43
Page 50

Problema Solución
Ajuste de tensión no llegó a Continuar con el IEF.
Tira IPG está siendo limitado por μA o W.
La conductividad de la tira es demasiado alto.
Una tira IPG se centrará en su máximo μA o W, y limitar la tensión a todas
las tiras. Esta tira se puede quitar, y las tiras restantes se centrará a voltajes
más altos.
7 cm tiras no deben centrarse en mayor de 6000 voltios y vatios superiores
a 0,5 W por cada tira.
Browning, la quema de arco tiras, Tiras tiene alta conductividad debido a las sales u otros compuestos iónicos.
lecturas erráticas μA
Reducir la fuerza iónica, al limitar la concentración de sal a 10 mM o
por debajo.
Reducir las concentraciones de Tris a 50 mM o por debajo.
Esto indica la potencia, voltios o corriente suministrada a la tira es demasi-
ado alto. Limitar la corriente en las tiras de IPG a 50 μA.
Demasiado poco de aceite y/o tiras no está completamente cubierta de aceite.
Nivelar el instrumento. Asegurarse de aceite mineral cubre completamente
las tiras y los canales vacíos. Si las tiras reactivas no están completamente
cubiertos urea cristalizar y causar calentamiento local/ardor.
El sobrecalentamiento de la bandeja. Compruebe que la bandeja esté bien
se deslizó y bloqueado en su lugar para asegurar el mejor contacto entre la
base de la bandeja y la superficie de la plataforma.
Rehidratación/bandeja tiene el equilibrio El exceso de volumen utilizado. No exceda los volúmenes recomendados por
líquido residual después de la rehidratación el fabricante de la tira IPG.
de las tiras de IPG
Prolongar el tiempo de rehidratación. 8-10 horas mínimo se requiere para la
No hay proteínas presentes en el gel después De carga de las proteínas es demasiado poco para el método de detección.
de la 2 dimensión completa Cargue más proteínas o probar un método más sensible de detección.
Cargue más proteínas o probar un método más sensible de detección.
Franja de accidente rehidratado con la cara hacia arriba o tira de gel de
portada no se elimina.
mejor absorción de solución de rehidratación.
•
p44
Page 51

Orden información
Producto Cantidad Código
IEF100 1 IEF100
Ejecución de la bandeja 1 IEF105
Las mechas de electrodos 504 IEF106
Recipientes para muestras de carga
(10 tiras de 6) 60 IEF108
Pequeña rehidratación/Equilibrio bandeja 1 IEF109
Medio de rehidratación/Equilibrio bandeja 1 IEF111
Gran rehidratación/Equilibrio bandeja 1 IEF110
Cable de alimentación EE.UU., 115 V 1 PSCORD-115V
Euro cable de alimentación, 230 V 1 PSCORD-230V
Unidades de segunda dimensión
Mighty Small II Deluxe Mini Vertical Unidad SE260-10A-1.5
Deluxe doble refrigeración por unidad estándar vertical SE600X-15-1.5
Unidad de formato vertical grande SE900-1.0
Reactivos
Agarosa 500 g GR140-500
Azul de bromofenol, sal de sodio 10 g GR120-10
CHAPS 10 g GR121-10
Ditiotreitol (DTT) 5 g GR122-5
Glicerol 1 L GR124-1
Aceite mineral 1 L GR138-1
Dodecilsulfato sódico 500 g GR126-500
Tiourea 500 g GR130-500
Tris 1 kg GR132-1
Urea 1 kg GR143-1
•
p45
Page 52

Apéndice A: Protocolos pre-programados
Los siguientes 9 protocolos están preprogramados. Son para ser
utilizados como guías.
Cada protocolo tiene una 1 hora, 1.000 V tienen paso para mantener
las bandas de agudos, una vez el enfoque es completa. Este paso no es
necesario y se puede quitar. También puede ser extendido como se desee.
Program 1
Centrándose más de 7 cm de IPG limitando parámetros voltios.
Name: 7 cm broad&basic
Delay 0:00, Delay temp 20 °C, Run temp 20 °C, 500 μA, 6000 V, 0.5 W
Step 1, Gradient volt, 500 V, 0:30 Hrs
Step 2, Gradient volt, 1000 V, 0:30 Hrs
Step 3, Gradient volt, 6000 V, 0:30 Hrs
Step 4, Constant volt, 6000 V, 8000 Vhrs
Step 5, Constant volt, 1000 V, 1:00 Hrs
Program 2
Enfoque de 7 cm de IPG está bajo las condiciones de vatios constantes.
Name: 7 cm const watt
Delay 0:00, Delay temp 20° C, Run temp 20 °C, 500 μA, 6000 V, 0.5 W
Step 1, Constant watt 0.1 W, 1:00 Hrs
Step 2, Constant watt 0.5 W, 8000 Vhrs
Step 3, Constant volt, 1000 V, 1:00 Hrs
•
p46
Program 3
Centrándose de ancho y medio de 18 cm de IPG limitando
parámetros voltios.
Name: 18 cm broad&basic
Delay 0:00, Delay temp 20°C, Run temp 20°C, 500μA, 12000V, 1.5W
Step 1, Gradient volt, 1000V, 1:00 Hrs
Step 2, Gradient volt, 12000V, 1:00 Hrs
Step 3, Constant volt, 12000V, 25000Vhrs
Step 4, Constant volt, 1000V, 1:00 Hrs
Program 4
Enfoque de 18 cm de rango estrecho de pH mediante la limitación de IPG
parámetros voltios.
Name: 18cm narrow
Delay 0:00, Delay temp 20 °C, Run temp 20 °C, 500 μA, 12000 V, 1.5 W
Step 1, Gradient volt, 1000 V, 1:00 Hrs
Step 2, Gradient volt, 12000 V, 1:00 Hrs
Step 3, Constant volt, 12000 V, 50000 Vhrs
Step 4, Constant volt, 1000 V, 1:00 Hrs
Page 53

Program 5
Enfoque de 18 cm de IPG está bajo las condiciones de vatios constantes.
Name: 18 cm const watt
Delay 0:00, Delay temp 20 °C, Run temp 20 °C, 500 μA, 12000 V, 1.5 W
Step 1, Constant watt 0.1 W, 1:00 Hhrs
Step 2, Constant watt 1.5 W, 25000 Vhrs
Step 3, Constant volt, 1000 V, 1:00 Hrs
Program 6
Enfoque de la amplia y de mediano alcance de 24 cm IPG mediante la limitación de los parámetros de voltios.
Name: 24 cm broad&basic
Delay 0:00, Delay temp 20 °C, Run temp 20 °C, 500 μA,
12000 V, 2.0 W
Step 1, Gradient volt, 1000 V, 1:00 Hrs
Step 2, Gradient volt, 12000 V, 1:00 Hrs
Step 3, Constant volt, 12000 V, 45000 Vhrs
Step 4, Constant volt, 1000 V, 1:00 Hrs
Program 7
Enfoque de 24 cm de rango estrecho de pH mediante la limitación de IPG
parámetros voltios.
Name: 24 cm narrow
Delay 0:00, Delay temp 20 °C, Run temp 20 °C, 500 μA, 12000 V, 2.0 W
Step 1, Gradient volt, 1000 V, 1:00 Hrs
Step 2, Gradient volt, 12000 V, 1:00 Hrs
Step 3, Constant volt, 12000 V, 100000 Vhrs
Step 4, Constant volt, 1000 V, 1:00 Hrs
Program 8
Enfoque de 24 cm de IPG está bajo las condiciones de vatios constantes.
Name: 24 cm const watt
Delay 0:00, Delay temp 20 °C, Run temp 20 °C, 500 μA, 12000 V, 2.0 W
Step 1, Constant watt, 0.1 W, 1:00 Hrs
Step 2, Constant watt, 2.0 W, 45000 Vhrs
Step 3, Constant volt, 1000 V, 1:00 Hrs
Program 9
Lento, de enfoque de 24 cm ES IPG con la muestra cargada en una taza.
Aumenta gradualmente la tensión con el tiempo. Fase de entrada de la
muestra se prolonga y diseñado para ser una carrera durante la noche.
Name: 24 cm cup load
Delay 0:00, Delay temp 20 °C, Run temp 20 °C, 500 μA, 12000 V, 2.0 W
Step 1, Gradient volt, 1000 V, 4:00 Hrs
Step 2, Gradient volt, 12000 V, 6:00 Hrs
Step 3, Constant watt, 2.0 W, 64000 Vhrs
Step 4, Constant volt, 1000 V, 10:00 Hrs
•
p47
Page 54

Protocolos pre-programados en formato
de Código de Máquina
Protocol 1
IPROT,1,7cm broad&basic,D,0:00,20,20,500,6000,0.5
IPROT,1,7cm broad&basic,1,G,500,H,0:30
IPROT,1,7cm broad&basic,2,G,1000,H,0:30
IPROT,1,7cm broad&basic,3,G,6000,H,0:30
IPROT,1,7cm broad&basic,4,S,6000,V,8000
IPROT,1,7cm broad&basic,5,S,1000,H,1:00
IPROT,1,7cm broad&basic,6,S,0,H,0:00
IPROT,1,7cm broad&basic,7,S,0,H,0:00
IPROT,1,7cm broad&basic,8,S,0,H,0:00
IPROT,1,7cm broad&basic,9,S,0,H,0:00
Protocol 2
IPROT,2,7cm const Watt,D,0:00,20,20,500,6000,0.5
IPROT,2,7cm const Watt,1,W,0.1,H,1:00
IPROT,2,7cm const Watt,2,W,0.5,V,8000
IPROT,2,7cm const Watt,3,S,1000,H,1:00
IPROT,2,7cm const Watt,4,S,0,H,0:00
IPROT,2,7cm const Watt,5,S,0,H,0:00
IPROT,2,7cm const Watt,6,S,0,H,0:00
IPROT,2,7cm const Watt,7,S,0,H,0:00
IPROT,2,7cm const Watt,8,S,0,H,0:00
IPROT,2,7cm const Watt,9,S,0,H,0:00
Protocol 3
IPROT,3,18cm broad&basic,D,0:00,20,20,500,12000,1.5
IPROT,3,18cm broad&basic,1,G,1000,H,1:00
IPROT,3,18cm broad&basic,2,G,12000,H,1:00
IPROT,3,18cm broad&basic,3,S,12000,V,25000
IPROT,3,18cm broad&basic,4,S,1000,H,1:00
IPROT,3,18cm broad&basic,5,S,0,H,0:00
IPROT,3,18cm broad&basic,6,S,0,H,0:00
IPROT,3,18cm broad&basic,7,S,0,H,0:00
IPROT,3,18cm broad&basic,8,S,0,H,0:00
IPROT,3,18cm broad&basic,9,S,0,H,0:00
•
p48
Page 55

Protocol 4
IPROT,4,18cm narrow,D,0:00,20,20,500,12000,1.5
IPROT,4,18cm narrow,1,G,1000,H,1:00
IPROT,4,18cm narrow,2,G,12000,H,1:00
IPROT,4,18cm narrow,3,S,12000,V,50000
IPROT,4,18cm narrow,4,S,1000,H,1:00
IPROT,4,18cm narrow,5,S,0,H,0:00
IPROT,4,18cm narrow,6,S,0,H,0:00
IPROT,4,18cm narrow,7,S,0,H,0:00
IPROT,4,18cm narrow,8,S,0,H,0:00
IPROT,4,18cm narrow,9,S,0,H,0:00
Protocol 5
IPROT,5,18cm const Watt,D,0:00,20,20,500,12000,1.5
IPROT,5,18cm const Watt,1,W,0.1,H,1:00
IPROT,5,18cm const Watt,2,W,1.5,V,25000
IPROT,5,18cm const Watt,3,S,1000,H,1:00
IPROT,5,18cm const Watt,4,S,0,H,0:00
IPROT,5,18cm const Watt,5,S,0,H,0:00
IPROT,5,18cm const Watt,6,S,0,H,0:00
IPROT,5,18cm const Watt,7,S,0,H,0:00
IPROT,5,18cm const Watt,8,S,0,H,0:00
IPROT,5,18cm const Watt,9,S,0,H,0:00
Protocol 6
IPROT,6,24cm broad&basic,D,0:00,20,20,500,12000,2.0
IPROT,6,24cm broad&basic,1,G,1000,H,1:00
IPROT,6,24cm broad&basic,2,G,12000,H,1:00
IPROT,6,24cm broad&basic,3,S,12000,V,45000
IPROT,6,24cm broad&basic,4,S,1000,H,1:00
IPROT,6,24cm broad&basic,5,S,0,H,0:00
IPROT,6,24cm broad&basic,6,S,0,H,0:00
IPROT,6,24cm broad&basic,7,S,0,H,0:00
IPROT,6,24cm broad&basic,8,S,0,H,0:00
IPROT,6,24cm broad&basic,9,S,0,H,0:00
•
p49
Page 56

Protocol 7
IPROT,7,24cm narrow,D,0:00,20,20,500,12000,2.0
IPROT,7,24cm narrow,1,G,1000,H,1:00
IPROT,7,24cm narrow,2,G,12000,H,1:00
IPROT,7,24cm narrow,3,S,12000,V,100000
IPROT,7,24cm narrow,4,S,1000,H,1:00
IPROT,7,24cm narrow,5,S,0,H,0:00
IPROT,7,24cm narrow,6,S,0,H,0:00
IPROT,7,24cm narrow,7,S,0,H,0:00
IPROT,7,24cm narrow,8,S,0,H,0:00
IPROT,7,24cm narrow,9,S,0,H,0:00
Protocol 8
IPROT,8,24cm const Watt,D,0:00,20,20,500,12000,2.0
IPROT,8,24cm const Watt,1,W,0.1,H,1:00
IPROT,8,24cm const Watt,2,W,2.0,V,45000
IPROT,8,24cm const Watt,3,S,1000,H,1:00
IPROT,8,24cm const Watt,4,S,0,H,0:00
IPROT,8,24cm const Watt,5,S,0,H,0:00
IPROT,8,24cm const Watt,6,S,0,H,0:00
IPROT,8,24cm const Watt,7,S,0,H,0:00
IPROT,8,24cm const Watt,8,S,0,H,0:00
IPROT,8,24cm const Watt,9,S,0,H,0:00
Protocol 9
IPROT,9,24cm cup load,D,0:00,20,20,500,12000,2.0
IPROT,9,24cm cup load,1,G,1000,H,4:00
IPROT,9,24cm cup load,2,G,12000,H,6:00
IPROT,9,24cm cup load,3,W,2.0,V,64000
IPROT,9,24cm cup load,4,S,1000,H,10:00
IPROT,9,24cm cup load,5,S,0,H,0:00
IPROT,9,24cm cup load,6,S,0,H,0:00
IPROT,9,24cm cup load,7,S,0,H,0:00
IPROT,9,24cm cup load,8,S,0,H,0:00
IPROT,9,24cm cup load,9,S,0,H,0:00
•
p50
Page 57

Clases más comunes de los aditivos
Desnaturalizantes
Despliegue de las proteínas para exponer
los cargos internos nativos.
Detergentes no iónicos
Realiza muestras más soluble, sin
alterar la carga de proteínas.
Reductores
Ayuda romper los enlaces disulfuro
internos a desarrollarse aún más las
proteínas, y ayudar a reducir los efectos
negativos de la oxidación de las proteínas durante la rehidratación y el IEF.
Otro
Amphoytes Carrier, proteasas, DNasas,
ARNasas.
Apéndice B: Reactivos y Soluciones
Preparación de la muestra
Las muestras preparadas para 2D debe ser totalmente desnaturalizado, libre de material insoluble, y baja en la fuerza iónica total.
Algunas muestras de proteínas fácilmente solubilizar, mientras que
otros son más difíciles, lo que requiere reactivos adicionales (por
ejemplo, tiourea, detergentes especiales, etc) para fomentar la solubilización. Las clases de aditivos comunes se enumeran a continuación.
Desnaturalizantes
La urea es el reactivo más común usado en IEF para interrumpir la
unión interna de la proteína, permitiendo que se desarrollan. Las
muestras se prepararon utilizando concentraciones de urea 8 a 9,5 M.
En general, cuanto mayor sea la concentración de urea el mejor puede
ser una muestra solubilizada. La urea llega a su punto de saturación
cerca de 10 M a temperatura ambiente.
Tiourea también se utiliza para solubilizar mejor algunas muestras.
Con frecuencia, 2 M tiourea se combina con 5 a 7 M de urea como
un reactivo para la preparación de muestras y la rehidratación IPG.
Detergentes
Varios tipos de detergentes no iónicos o zwitteriónicos se puede utilizar
para solubilizar las muestras (CHAPS, Triton X100, Nonidet NP-40
y detergentes alkylamidosulfobetaine). CHAPS es el detergente más
ampliamente utilizado para la electroforesis 2D. Es estable en solución.
Detergentes tales como SDS no son compatibles con IEF porque se
unen a las proteínas y enmascarar carga de las proteínas nativas.
Reductores
Ditiotreitol (DTT) se utiliza comúnmente para reducir las proteínas de
la FEI. TDT descompone en solución, por lo que se prepara normalmente y se añadió justo antes del uso. Otros agentes reductores tales
como 2-mercaptoetanol, Ditioeritritol (DTE) y tributilfosfina (TBP) se
puede utilizar.
Otro
Anfolitos Carrier o tampones IPG puede ser añadido para ayudar en
la solubilidad de la proteína y ayudar a prevenir la precipitación de la
proteína durante el enfoque. Las concentraciones de 0,5%-2% (v/v)
se utilizan normalmente. Anfolitos Carrier puede interferir con ciertos experimentos de etiquetado. En esos casos, los reactivos debería
entonces ser omitido de la etapa de extracción de la muestra.
•
p51
Page 58

Nota: Las sales son, quizás, el
contaminante más frecuente como causa
de los malos resultados del IEF.
Directrices Generales
• Los procedimientos de preparación de muestras están siendo refinados y estandarizados. Lo mejor es consultar la literatura para
determinar si un buffer de preparación de la muestra en particular
se recomienda para el tipo de muestra.
• IEF funciona mejor con muestras de proteínas puras que se solubilizan y desnaturalizado, y libre de las moléculas que interfieren.
• Retire el material insoluble con centrifugación.
• Mantener el contenido de sal tan bajo como sea posible.
• Utilice recién reactivos preparados de alta calidad, o soluciones de
los reactivos que se han almacenado congelados.
• No deje soluciones de urea a cabo a temperatura ambiente durante
períodos prolongados de tiempo.
• Nunca Calentar las muestras de proteínas en soluciones de urea.
Calentamiento carbamilación causa de las proteínas y se altera la
carga de las proteínas nativas.
• Cumpla con las muestras en hielo para evitar la degradación.
• Añadir inhibidores de la proteasa para prevenir la actividad de la
proteasa. Los inhibidores de proteasa tales como PMSF o Pefabloc
se puede añadir a inhibir la actividad de serina proteasa mientras
pepstatina puede inhibir proteasas aspárticas.
• Algunos protocolos utilizar anfolitos básicos portadores o Tris para
obtener un pH alto en el tampón de muestra. Esto ayuda a solubilizar algunas proteínas y disminuye la actividad enzimática que
atacan las proteínas.
• ADN y ARN con frecuencia se pueden eliminar por ultracentrifugación. La muestra también puede ser tratada con DNasa y RNasa
solución para descomponer los contaminantes.
• Tenga en cuenta que algunos inhibidores de la proteasa, DNasa y
RNasa son proteínas sí mismos y pueden aparecer en un mapa 2D.
• El agua utilizada para la fabricación de los reactivos deben ser de la
más alta calidad disponible. El agua con una resistividad de >5 cm
megaohm es mejor. El agua purificada por ósmosis inversa o agua
desionizada es aceptable.
•
p52
Page 59

Recetas
Muestra IEF tampón de extracción para el 2D
1A. Ejemplo de urea Solución tampón
Prepara 25 ml
9,5 M urea, CHAPS 4%
Concentración final Cantidad
La urea (FW 60.06) 9,5 M 14,26 g
CHAPS 4% (w/v) 1,0 g
El agua desionizada a 25 ml
Almacenar en alícuotas de 1 ml a -20 °C o menos.
Antes de usar, añadir 6 mg/ml de DTT para obtener una composición de la
muestra final de tampón 40 mM de DTT.
Opcional: Añadir anfolitos portadores, tales como SERVALYTS, a una concen-
tración de 2% v/v (20 l por μl de solución tampón de muestra).
-O-
1B. Tiourea + Muestra preparación de la solución de urea
Prepara 25 ml
7 M urea, tiourea 2 M, CHAPS 4%, 40 mM de DTT
Concentración final Cantidad
La urea (FW 60.06) 7 M 10,51 g
Tiourea (FW 76.12) 2 M 3,8 g
CHAPS 4% (w/v) 1,0 g
El agua desionizada a 25 ml
Almacenar en alícuotas de 1 ml a -20 °C o menos.
Antes de usar, añadir 6 mg/ml de DTT para obtener una composición de la
muestra final de tampón 40 mM de DTT.
Opcional: Añadir anfolitos portadores, tales como SERVALYTS, a una concen-
tración de 2% v/v (20 l por μl de solución tampón de muestra).
•
p53
Page 60

Tira IPG Solución de Rehidratación
2A. Rehidratación urea Solución de archivo
Prepara 50 ml
8 M urea, CHAPS 2%, 0,002% de azul de bromofenol
Concentración final Cantidad
La urea (FW 60.06) 8 M 24 g
CHAPS 2% (w/v) 1,0 g
Azul de bromofenol 0,002% 1 mg
El agua desionizada a 50 ml
Almacenar en alícuotas de 3 ml a -20 °C o menos. 3 ml es suficiente para
rehidratar seis tiras de 24 cm IPG.
Justo antes de su uso para la rehidratación tira IPG:
• Añadir 0.5-2.0% (v/v) anfolitos portadores (SERVALYTS).
• Agregar la TDT de 9 mg por 3 ml de alícuota de la solución de
rehidratación almacén 20 mM de DTT.
• Muestra La proteína también se puede añadir a la de 3 ml de solución
de rehidratación.
2B. Rehidratación tiourea solución de archivo
Prepara 50 ml
7 M urea, tiourea 2 M, CHAPS 2%, 0,002% azul de bromofenol
Concentración final Cantidad
La urea (FW 60.06) 7 M 21 g
Tiourea (FW 76.12) 2 M 7,6 g
CHAPS 2% (w/v) 1,0 g
Azul de bromofenol 0,002% 1 mg
El agua desionizada a 50 ml
Almacenar en alícuotas de 3 ml a -20 °C o menos. 3 ml es suficiente para
rehidratar seis tiras de 24 cm IPG.
Justo antes de su uso para la rehidratación tira IPG:
• Añadir 0.5-2.0% (v/v) anfolitos portadores (SERVALYTS).
• Agregar la TDT de 9 mg por 3 ml de alícuota de la solución de
rehidratación almacén 20 mM de DTT.
• Muestra La proteína también se puede añadir a la de 3 ml de solución
de rehidratación.
•
p54
Page 61

Nota: Las tiras de IPG deben
equilibrarse justo antes de la
segunda dimensin PÁGINA. No se
equilibren las tiras IPG antes de
guardar a -20 °C.
3. Equilibrio SDS Solución tampón
Esta solución se utiliza después de IEF, y antes de PAGE segunda dimensión. Las tiras IPG se sumergen en exceso de disolución para elevar el pH
del tampón de tira de modo que sea adecuado para PAGE, y para recubrir
las proteínas en SDS uniformemente de modo que migran correctamente en
el gel de segunda dimensión.
Prepara 200 ml
6 M urea, 75 mM Tris-HCl pH 8,8, 29,3% de glicerol, 2% de SDS, 0,002%
de azul de bromofenol
Concentración final Cantidad
La urea (FW 60.06) 6 M 72,1 g
1,5 M Tris-HCl, pH 8,8 solución madre 75 mM 10,0 ml
El glicerol (87% w/w) 29,3% (v/v) 69 ml
SDS (FW 288.38) 2% (w/v) 4,0 g
Azul de bromofenol 0,002% (w/v) 4 mg
El agua desionizada a 200 ml
Dividir en partes alícuotas en alícuotas de 30 ml y conservar congelada a
-20 °C o menos.
24 cm de IPG requieren 5-10 ml por tira por el paso de equilibrio. Más
cortos pueden utilizar tiras volumen proporcionalmente menos por el paso de
equilibración.
Equilibrio Procedimiento
1 Descongelar dos alícuotas de la solución de equilibración.
2 Añadir 10 mg/ml de DTT a una solución.
3 Coloque las tiras de IPG en la bandeja de rehidratación/equilibrio.
4 Añadir 6,5 ml de solución a cada ranura que contiene una tira IPG.
5 Coloque el rockero de 10-15 minutos.
Después de la equilibración, desechar la solución de equilibración primero
en una forma adecuada.
6 Añadir 25 mg/ml de yodoacetamida (IAA) a la segunda parte alícuota
de la solución de equilibración.
7 Añadir 6,5 ml de solución a cada ranura que contiene una tira IPG.
8 Coloque el rockero de 10-15 minutos.
Después de la equilibración, desechar la solución de equilibración segundos
en una manera apropiada.
Después del equilibrio, las tiras IPG se colocan en la parte superior del
gel de segunda dimensión, y se sella en su lugar con la superposición de
agarosa.
•
p55
Page 62

Superposición de agarosa
1% de agarosa en tampón de electroforesis 1X
Prepara 100 ml
1% de agarosa, 25 mM Tris, 192 mM glicina, 0,1% de SDS
Preparar en un matraz de 500 ml para dejar espacio para la formación
de espuma.
¡Atención! Hoja de Seguridad puede
hacer que la solución a hervir lo tome
precauciones al calor y evitar que se
desborde.
Concentración final Cantidad
Agarosa 1% 1 g
10X tampón de electroforesis 1X 10 ml
(250 mM de Tris, 1,92 m glicina, 1% SDS)
Azul de bromofenol 3 mg
El agua desionizada a 100 ml
Agite suavemente la suspensión de agarosa.
El calor a baja potencia en un horno de microondas hasta que agarosa se
haya disuelto completamente.
Almacenar en alícuotas de 1,5 ml a 4 °C en tubos con tapa de rosca
de plástico.
Recalentamiento alícuotas en bloque de calentamiento.
•
p56
Page 63

Apéndice C: Referencias IEF100
Ames, G. F. L. and Nikaido, K. Two-dimensional gel electrophoresis
of membrane proteins. Biochemistry 15, 616–623 (1976).
Bjellqvist, B., Ek, K., Righetti, P.G., Gianazza, E., Gorg, A.,
Westermeier, R. and Postel, W., Isoelectric focusing in immobilized
pH gradients: principle, methodology and some applications,
J Biochem Biophys Methods 6, 317–339 (1982).
Bjellqvist, B., Pasquali, C., Ravier, F. Sanchez, J.C. and Hochstrasser,
D. A nonlinear wide-range immobilized pH gradient for
two-dimensional electrophoresis and its definition in a relevant pH
scale. Electrophoresis 14, 1357–1365 (1993).
Dunn, M. J. and Corbett, J. M. 2-dimensional polyacrylamide gel
electrophoresis. Methods Enzymol. 271, 177–203 (1996).
Eckerskorn, C., Jungblut, P., Mewes, W., Klose, J. and Lottspeich,
F. Identification of mouse brain proteins after two-dimensional
electrophoresis and electroblotting by microsequence analysis and
amino acid composition analysis, Electrophoresis 9, 830–838
(1988).
Görg, A., Postel, W., Günther, S. The current state of two-dimensional
electrophoresis with immobilized pH gradients. Electrophoresis 9,
531–546 (1988).
Görg, A., Postel, W., Weser, J., Günther, S, Strahler, J.R., Hanash,
S. and Somerlot, L. Elimination of point streaking on silver
stained two-dimensional gels by addition of iodoacetamide to the
equilibration buffer. Electrophoresis 8, 122–124 (1987).
Görg, A. Two-dimensional electrophoresis, Nature 349, 545–546
(1991).
Görg, A. Obermaier, C., Boguth, G., Harder, A., Scheibe, B.,
Wildgruber, R. and Weiss, W. The current state of two-dimensional
electrophoresis with immobilized pH gradients, Electrophoresis 21,
1037–1053 (2000).
Görg, A., Obermaier, C., Boguth, G. and Weiss, W. Recent
developments in two-dimensional gel electrophoresis with
immobilized pH gradients: wide pH gradients up to pH 12, longer
separation distances and simplified procedures, Electrophoresis 20,
712–717 (1999).
Görg A, Postel W, Domscheit A and Günther S, Methodology of
two-dimensional electrophoresis with immobilized pH gradients
for the analysis of cell lysates and tissue proteins, in Endler AT and
Hanash S (eds) Two-Dimensional Electrophoresis. Proceedings of
the International Two-Dimensional. Electrophoresis Conference,
Vienna, Nov. 1988, VCH, Weinheim FRG (1989).
•
p57
Page 64

Görg, A., Obermaier, C., Boguth, G., Posch, A. and Weiss, W.
Two-dimensional polyacrylamide gel electrophoresis with
immobilized pH gradients in the first dimension (IPG-Dalt):
the state of the art and the controversy of vertical vs horizontal
systems. Electrophoresis 16, 1079–1086 (1995).
Görg, A., Obermaier, C., Boguth, G., Csordas, A., Diaz, J.J., Madjar,
J.J. Very alkaline immobilized pH gradients for two dimensional
electrophoresis of ribosomal and nuclear proteins. Electrophoresis
18, 328–337 (1997).
Link, A.J. (ed) 2-D Proteome Analysis Protocols, Methods in
Molecular Biology 112 Humana Press (1998).
O’Farrell, P. H. High resolution two-dimensional electrophoresis of
proteins. J. Biol. Chem. 250, 4007–4021 (1975).
Olsson, I., Larsson, K., Palmgren, R. and Bjellqvist, B. Organic
disulfides as a means to generate streak-free two-dimensional maps
with narrow range basic immobilized pH gradient strips as first
dimension. Proteomics 2, 1630–1632 (2002).
Rabilloud, T., Use of thiourea to increase the solubility of membrane
proteins in two-dimensional electrophoresis. Electrophoresis 19,
758–760 (1998).
Rabilloud, T., Solubilization of proteins for electrophoretic analyses.
Electrophoresis 17, 813–829 (1996).
Rabilloud, T., Valette, C. and Lawrence, J.J. Sample application by
in-gel rehydration improves the resolution of two-dimensional
electrophoresis with immobilized pH gradients in the first
dimension. Electrophoresis 15, 1552–1558 (1994).
Righetti, P.G. Isoelectric Focusing: Theory, Methodology and
Applications, Elsevier, Amsterdam (1983).
Righetti, P.G. Immobilized pH gradients: theory and methodology.
Elsevier, Amsterdam (1990).
Sanchez, J.C., Rouge, V., Pisteur, M., Ravier, F., Tonella, L.,
Moosmayer, M., Wilkins, M.R. and Hochstrasser, D.F., Improved
and simplified in-gel sample application using reswelling of dry
immobilized pH gradients, Electrophoresis 18, 324–327 (1997).
Westermeier, R. and Naven, T. Proteomics in Practice, A Laboratory
Manual of Proteome Analysis, Wiley-VCH Verlag GmbH,
Weinheim (2002).
•
p58
Page 65

Hoefer, Inc.
84 October Hill Road
Holliston, MA 01746
Llamada gratuita: 1-800-227-4750
Teléfono: 1-508-893-8999
Fax: 1-508-893-0176
E-mail: support@hoeferinc.com
Web: www.hoeferinc.com
Hoefer es una marca registrada de
Hoefer, Inc.
Windows y Excel son marcas registradas
de Microsoft Corporation.
© 2012 Hoefer, Inc.
Todos los derechos reservados.
Impreso en el USA.
 Loading...
Loading...