H. pylori-antitest gyorsteszt kazetta
REF IHP-402
Magyar
• Tesztkazetták
• Cseppentők
• Pufferoldat
• Használati útmutató
• Mintagyűjtő tartályok
• Centrifuga
• Lándzsák (csak az ujjbegyből vett teljes vérhez)
• Időmérő
• Heparinnal kezelt kapilláris csövek és kiadagoló gumikörte (csak az ujjbegyből vett teljes vérhez)
Módszer
Biopszia/szövettan/RU
T
Eredmények
összesen
H. pylori-antitest
gyorsteszt kazetta
Eredmények
Pozitív
Negatív
Pozitív
150
15
165
Negatív
5
200
205
Eredmények összesen
155
215
370
Szimbólumindex
Tekintse meg a használati
utasításokat vagy tekintse
meg az elektronikus
használati utasításokat
Elegendő <n>
vizsgálatokhoz
Hőmérséklet-határérték
In vitro diagnosztikai
orvostechnikai eszköz
Tételkód
Catalogue
number
Az Európai
Közösségben/Európai
Unióban meghatalmazott
képviselő
Felhasználási
dátum
Ne használja újra
Ne használja fel, ha a
csomagolás sérült, és
olvassa el a használati
utasításokat
Gyártó
Hangzhou AllTest Biotech Co., Ltd.
(Teljes vér/Szérum/Plazma)
Használati útmutató
A Helicobacter pylori (H. pylori) elleni antitestek teljes vérből, szérumból vagy plazmából történő
kvalitatív kimutatására szolgáló gyorsteszt.
Kizárólag szakemberek általi, in vitro diagnosztikai használatra.
【ALKALMAZÁSI TERÜLET】
A H. pylori-antitest gyorsteszt kazetta (Teljes vér/Szérum/Plazma) a H. pylori elleni antitestek teljes
vérből, szérumból vagy plazmából történő kvalitatív kimutatására szolgáló, a H. pylori-fertőzés
diagnosztizálását elősegítő, gyors kromatográfiás immunológiai próba.
【ÖSSZEGZÉS】
A H. pylori kis méretű, spirál alakú baktérium, amely a gyomor és a nyombél felületén él. Számos
emésztőrendszeri megbetegedés etiológiájában érintett, beleértve a nyombél- és gyomorfekélyt, a nem
fekélyes diszpepsziát és az aktív és krónikus gyomorhurutot.
módszerek használatosak a H. pylori-fertőzés emésztőrendszeri megbetegedés tüneteit mutató
betegekben történő diagnosztizálására. A mintafüggő és költséges invazív diagnosztikai módszerek
közé tartozik a gyomor- vagy nyombélbiopszia, amelyet ureázvizsgálat (valószínűsítés), tenyésztés
és/vagy szövettani festés követ.3 A nem invazív technikák közé tartozik az urea-kilégzési teszt,
amelyhez költséges laboratóriumi felszerelésre és mérsékelt sugárterhelésre, valamint szerológiai
módszerekre van szükség.
korrelációt mutatnak a szövettannal megerősített H. pylori-fertőzéssel.
kazetta (Teljes vér/Szérum/Plazma) egyszerű teszt, amely H. pylori-antigénnel bevont részecskék és
anti-humán IgG kombinációját használja fel a H. pylori-antitestek teljes vérben/szérumban/plazmában
való kvalitatív és szelektív kimutatására.
【ALAPELV】
A H. pylori-antitest gyorsteszt kazetta (Teljes vér/Szérum/Plazma) a H. pylori-antitestek teljes
vérből/szérumból/plazmából történő kimutatására szolgáló kvalitatív, membránalapú immunológiai
próba. A teszt során lefolytatott eljárásban anti-humán IgG-t immobilizálnak a teszt tesztvonal
régiójában. A minta az eszköz mintacellájába cseppentése után reakcióba lép a tesztben található, H.
pylori-antigénnel bevont részecskékkel. Ez a keverék kromatográfiásan megindul a teszt hossza
mentén, és interakcióba lép az immobilizált anti-humán IgG-vel. Ha a minta tartalmaz H. pyloriantitesteket, a tesztvonal régióban megjelenik egy színes vonal, ami pozitív eredményt jelez. Ha a minta
nem tartalmaz H. pylori-antitesteket, nem jelenik meg színes vonal ebben a régióban, ami negatív
eredményt jelez. Az eljárás ellenőrzésére a kontrollvonal területén mindig megjelenik egy színes vonal,
amely azt jelzi, hogy megfelelő mennyiségű minta került a tesztre, és a membrán átitatódott.
【REAGENSEK】
A teszt H. pylori-antigénnel bevont részecskéket és anti-humán IgG-vel bevont membránt tartalmaz.
【ÓVINTÉZKEDÉSEK】
Kizárólag szakemberek általi, in vitro diagnosztikai használatra. A lejárat dátum után ne használja!
Ne egyen, igyon vagy dohányozzon azon a területen, ahol a minták vagy készletek kezelése történik.
Ne használja a tesztet, ha a csomagolás sérült.
Minden mintát úgy kezeljen, mintha fertőző anyagot tartalmazna. A tesztelési eljárás során végig
tartsa be a mikrobiológiai veszélyek ellen előírt óvintézkedéseket, és a minták megfelelő
ártalmatlanításával kapcsolatban kövesse a szokásos eljárást.
A minták vizsgálata közben viseljen védőfelszerelést, például laborköpenyt, eldobható kesztyűt és
védőszemüveget.
A helyi szabályozás szerint kell a használt tesztet kezelni.
A nedvesség és a hőmérséklet hátrányosan befolyásolhatja az eredményeket.
【TÁROLÁS ÉS STABILITÁS】
Tárolja a csomagolt módon a zárt tasakban szobahőmérsékleten vagy hűtve (2–30 °C -on). A teszt a
zárt tasakon szereplő lejárati dátumig stabil. A tesztet felhasználásig a zárt tasakban kell tartani. TILOS
FAGYASZTANI! Ne használja a lejárati dátumon túl.
【MINTAVÉTEL ÉS -ELŐKÉSZÍTÉS】
A H. pylori-antitest gyorsteszt kazetta (vénapunkcióból vagy ujjbegyből vett) teljes vérrel, szérummal
vagy plazmával használható.
Ujjbegyből vett teljesvér-minta levétele:
A beteg kezét mossa meg szappannal és vízzel, vagy alkoholos vattával tisztítsa meg. Hagyja
megszáradni.
Anélkül, hogy a szúrás helyét megérintené, a középső vagy a gyűrűs ujja hegye irányába
masszírozza meg a kezét.
A steril lándzsával szúrja meg a bőrét. Az első vércseppet törölje le.
Finoman dörzsölje a kezét a csuklótól a tenyerén át az ujjáig, hogy a szúrás helyén egy kerek
vércsepp alakuljon ki.
Az ujjbegyből származó teljesvér-mintát egy kapilláris cső segítségével juttassa a tesztre:
Érintse a kapilláris cső végét a vércsepphez, amíg kb. 75 L-t fel nem szív. Kerülje a
légbuborékokat.
Helyezze a gumikörtét a kapilláris cső felső végére, majd a körte összenyomásával juttassa a
teljes vért a tesztkazetta mintaterületére.
Az ujjbegyből származó teljesvér-mintát függő csepp módszerrel juttassa a tesztre:
Tartsa úgy a beteg ujját, hogy a vércsepp pontosan a tesztkazetta mintaterülete felett legyen.
Várja meg, hogy az ujjbegy megszúrásából származó teljes vérből 3 függő csepp cseppenjen
a tesztkazetta mintaterületére, vagy mozgassa úgy a beteg ujját, hogy a függő csepp
hozzáérjen a mintaterület közepéhez. Ügyeljen, nehogy az ujj közvetlenül hozzáérjen a
mintaterülethez.
A hemolízis elkerülése érdekében a lehető leghamarabb szeparálja a szérumot vagy a plazmát.
Csak tiszta nem hemolizált mintákat lehet használni.
A minta levétele után a tesztelést azonnal el kell végezni. Hosszabb ideig ne hagyja a mintát
szobahőmérsékleten. A szérum- és plazmaminták 2–8 °C -on legfeljebb 3 napig tárolhatók. Hosszú
ideig tartó tárolás esetén a mintákat -20 °C alatt kell tartani. A vénapunkcióval levett teljesvér-mintát
2–8 °C -on kell tárolni, ha a tesztet a vér levételétől számított 2 napon belül végzik el. A teljesvérmintákat ne fagyassza. Az ujjbegyből vett teljes vért azonnal meg kell vizsgálni.
A tesztelés előtt várja meg, hogy a minta szobahőmérsékletű legyen. A fagyasztott mintákat teljesen
4,5
A H. pylori-fertőzött személyekben antitestek fejlődnek ki, amelyek erős
1,2
Mind invazív, mind nem invazív
6,7,8
A H. pylori-antitest gyorsteszt
fel kell olvasztani, és alaposan össze kell keverni a tesztelés előtt. A mintákat nem szabad
ismételten lefagyasztani és felolvasztani.
Ha a mintát szállítják, akkor a kórokozók szállítására vonatkozó helyi előírásoknak megfelelően kell
azt becsomagolni.
【ANYAGOK】
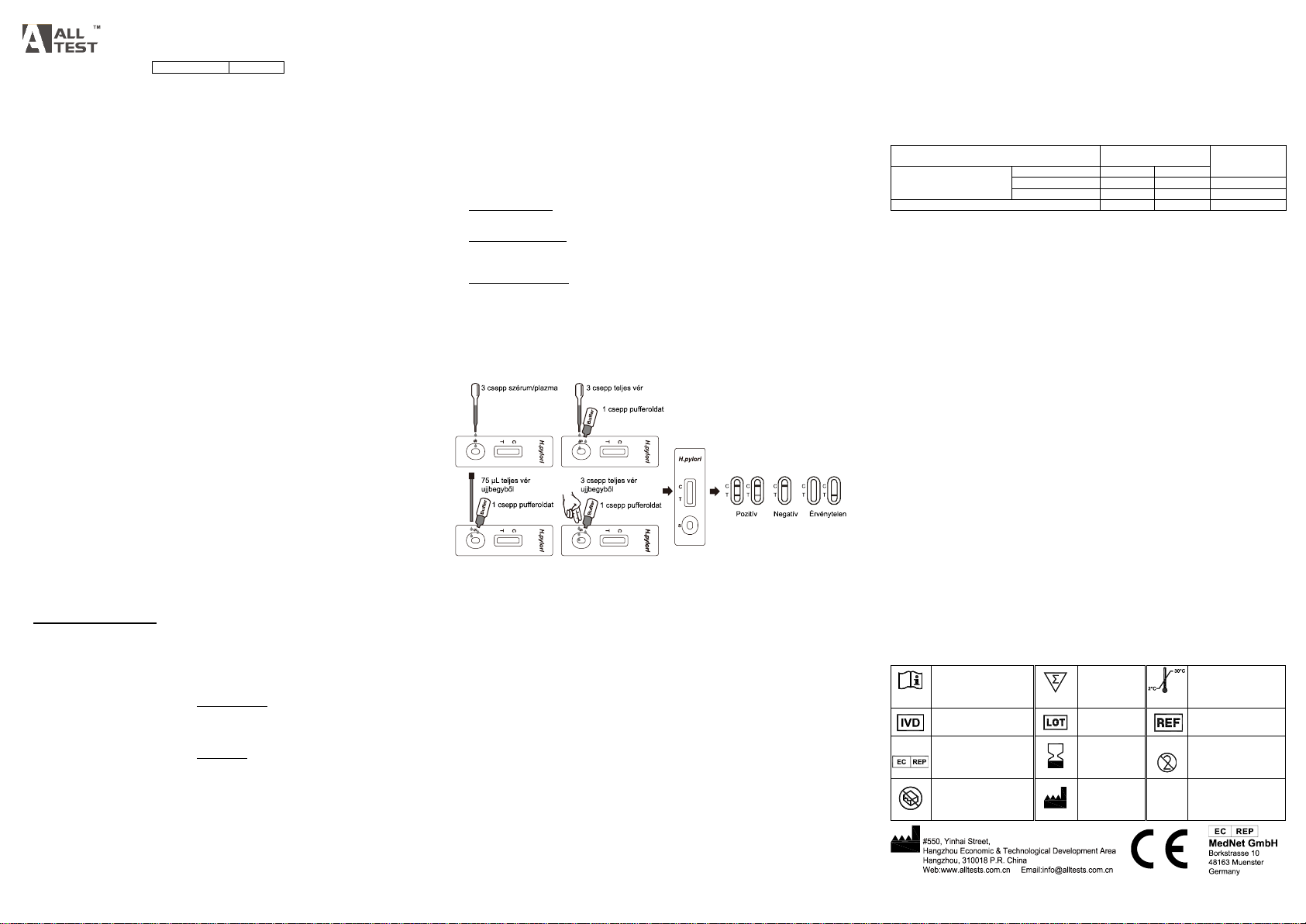
【ÚTMUTATÁSOK A HASZNÁLATHOZ】
A vizsgálat előtt hagyja, hogy a teszt, a minta, a puffer és/vagy a kontrollok elérjék a
szobahőmérsékletet (15–30 °C).
1. A felnyitás előtt tegye ki a tasakot szobahőmérsékletre. Vegye ki a tesztkazettát a lezárt tasakból, és
a lehető leghamarabb használja fel.
2. Helyezze a tesztkazettát egy tiszta, vízszintes felületre.
Szérum vagy plazma minták esetében:
Tartsa függőlegesen a cseppentőt, és cseppentsen 3 csepp szérumot vagy plazmát (körülbelül 75
µL) a tesztkazetta mintacellájába, és indítsa el az időmérőt. Lásd az alábbi ábrát.
Vénapunkciós teljesvér-minta esetében:
Tartsa függőlegesen a cseppentőt, és cseppentsen 3 csepp teljes vért (körülbelül 75 µL ) a
mintacellába, majd adjon hozzá 1 csepp pufferoldatot (körülbelül 40 µL), és indítsa el az
időmérőt. Lásd az alábbi ábrát.
Ujjbegyből vett teljes vér minta esetében:
Kapilláris cső használatához: Töltse meg a kapilláris csövet, és adagoljon körülbelül 75 µL
ujjbegyből vett teljesvér-mintát a tesztkazetta mintaterületére, majd adjon hozzá 1 csepp
pufferoldatot (körülbelül 40 µL), és indítsa el az időmérőt. Lásd az alábbi ábrát.
A függő csepp használatához: Hagyja, hogy az ujjbegyből vett teljesvér-minta 3 függő cseppje
(körülbelül 75 µL) rácseppenjen a tesztkazetta mintaterületére, majd adjon hozzá 1 csepp
pufferoldatot (körülbelül 40 µL), és indítsa el az időmérőt. Lásd az alábbi ábrát.
3. Várja meg, hogy megjelenjen(ek) a színes vonal(ak). Olvassa le az eredményeket 10 perc múlva.
20 perc elteltével az eredmény már nem értelmezhető.
【EREDMÉNYEK ÉRTELMEZÉSE】
POZITÍV:* Két határozott színes vonal jelenik meg. Az egyik színes vonalnak a kontroll régióban (C),
a másik színes vonalnak a teszt régióban (T) kell lennie.
*MEGJEGYZÉS: A tesztvonal (T) régióban megjelenő szín erőssége a mintában lévő H. pylori-
antitestek koncentrációjától függően változik. Ezért a teszt régióban (T) feltűnő bármilyen színárnyalat
pozitív eredményt jelent.
NEGATÍV: Egyetlen színes vonal jelenik meg a kontroll területen (C). A teszt régióban (T) nem
jelenik meg jól látható színes vonal.
ÉRVÉNYTELEN: Nem jelenik meg a kontrollvonal. A kontrollvonal hiányának legvalószínűbb oka az
elégtelen mintamennyiség vagy az eljárás helytelen kivitelezése. Tekintse át újra az eljárást, és
ismételje meg a tesztet egy új tesztkazetta használatával. Ha a probléma továbbra is fennáll, akkor
hagyja abba annak a tesztkészletnek a használatát, és vegye fel a kapcsolatot a helyi forgalmazóval.
【MINŐSÉGELLENŐRZÉS】
A készlet tartalmaz egy eljárási kontrollt. A kontroll régióban (C) megjelenő színes vonal belső eljárási
kontrollként szolgál. Megerősíti, hogy a minta mennyisége elegendő, és az eljárás technikája is helyes.
A készlet nem tartalmaz minőség-ellenőrzési standardokat, azonban a bevált laboratóriumi gyakorlatok
szerint javasolt pozitív és negatív kontrollokat is vizsgálni a teszt során lefolytatott eljárás és a teszt
eredményességének ellenőrzése érdekében.
【KORLÁTOZÁSOK】
1. A H. pylori-antitest gyorsteszt kazetta (Teljes vér/Szérum/Plazma) kizárólag in vitro diagnosztikai
használatra szolgál. A teszt kizárólag H. pylori-antitestek teljes vérből, szérumból vagy plazmából
történő kimutatására használható. Ezzel a kvalitatív teszttel sem a H. pylori-antitestek kvantitatív
értéke, sem a koncentrációjuk nem határozható meg.
2. A H. pylori-antitest gyorsteszt kazetta (Teljes vér/Szérum/Plazma) kizárólag a H. pylori-antitestek
mintában való jelenlétét fogja kimutatni, és nem használható a H. pylori-fertőzés diagnózisának
egyetlen kritériumaként.
3. Mint minden diagnosztikai tesztnél, az összes eredményt az orvos számára elérhető egyéb klinikai
adatokkal együtt kell értelmezni.
4. Ha a teszt eredménye negatív, de a klinikai tünetek továbbra is fennállnak, más klinikai módszereket
használó további vizsgálatokat kell végezni. A negatív eredmény soha nem zárja ki a H. pylorifertőzés lehetőségét.
Biztosított anyagok
Szükséges, de nem biztosított a nyagok
(Kérjük, tekintse meg a fenti ábrát)
【A TELJESÍTMÉNY JELLEMZŐI】
A H. pylori-antitest gyorsteszt kazetta (Teljes vér/Szérum/Plazma) tesztet endoszkópos vizsgálatra
jelentkezett, tüneteket mutató és tünetmentes betegek populációjától gyűjtött mintákkal értékelték ki. A
H. pylori-antitest gyorsteszt kazetta (Teljes vér/Szérum/Plazma) tesztre vonatkozóan biopszia
(tenyésztés) szolgált referenciamódszerként. Minden negatív tenyésztési mintán szövettani vizsgálatot
és ureáz gyorstesztet (Rapid Urease Test, RUT) végeztek. A mintát akkor tekintették pozitívnak, ha a
tenyésztés pozitív volt. A mintát emellett akkor is pozitívnak tekintették, ha a tenyésztés negatív volt, de
mind a szövettani vizsgálat, mind a RUT pozitív volt. Az eredmények azt mutatják, hogy a H. pyloriantitest gyorsteszt kazetta (Teljes vér/Szérum/Plazma) érzékenysége 96,8%-os, a specificitása pedig
93,0%-os a biopsziához/szövettanhoz/RUT-hoz képest.
H. pylori-antitest gyorsteszt kazetta biopsziával/szövettannal/RUT-tal összehasonlításban
Relatív érzékenység: 96,8% (95%CI*: 92,6–98.9%) *Konfidencia-intervallum
Relatív specificitás: 93,0% (95%CI*: 88,8%–96,0%)
Pontosság: 94,6% (95%CI*: 91,8%–96,7%)
A futtatáson belüli precizitást négy minta – egy negatív, egy gyengén pozitív, egy közepesen pozitív és
egy erősen pozitív – 10 párhuzamos mintájával határozták meg. A negatív, a gyengén pozitív, a
közepesen pozitív és az erősen pozitív érékek azonosítása az esetek >99%-ban helyes volt.
A futtatások közötti precizitást négy minta – egy negatív, egy gyengén pozitív, egy közepesen pozitív és
egy erősen pozitív – használatával elvégzett, 10 független próbával határozták meg. A H. pylori-antitest
gyorsteszt kazetta (Teljes vér/Szérum/Plazma) három különböző gyártási tételét vizsgálták meg negatív,
gyengén pozitív, közepesen pozitív és erősen pozitív minták használatával. A minták meghatározása az
esetek >99%-ában helyes volt.
A H. pylori-ellenes antitestek ismert mennyiségét tartalmazó szérumokat Hepatitis A-val, B-vel, C-vel, E-
vel, HIV-vel és szifilisszel is tesztelték. Nem volt megfigyelhető keresztreaktivitás, ami azt jelzi, hogy a H.
pylori-antitest gyorsteszt kazetta (Teljes vér/Szérum/Plazma) nagyfokú specificitást mutat a H. pyloriellenes emberi antitestekre.
A H. pylori-antitest gyorsteszt kazetta (teljes vér szérum/plazma) tesztet vizsgálták a lehetséges
interferenciát okozó mintákra vonatkozóan láthatóan hemolizált és lipémiás mintákkal, valamint magas
bilirubinszinteket tartalmazó szérummintákkal. Emellett nem volt megfigyelhető interferencia a legfeljebb
1000 mg/dL hemoglobint, legfeljebb 1000 mg/dL bilirubint, valamint legfeljebb 2000 mg/dL emberi
szérumalbumint tartalmazó mintákban.
【IRODALOMJEGYZÉK】
1. Marshall, BJ, McGechie, DB, Rogers, PAR and Glancy, RG. Pyloric Campylobacter infection and
gastroduodenal disease. Med. J. Australia. (1985), 149: 439-44.
2. Soll, AH. Pathogenesis of peptic ulcer and implications for therapy. New England J. Med. (1990), 322:
909-16.
3. Hazell, SL, et al. Campylobacter pyloridis and gastritis I: Detection of urease as a marker of bacterial
colonization and gastritis. Amer. J. Gastroenterology. (1987), 82(4): 292-96.
4. Loffeld, RJLF, et al. Usefulness of several commercial enzyme-linked immunoassays for detection of
Helicobacter pylori infection in clinical medicine. Euro. J. Gastroen. Hepa. (1993) 5:333-37.
5. Cutler, AF, et al. Accuracy of invasive and non-invasive tests to diagnose Helicobacter pylori
infection. Gastroenterology.(1995), 109: 136-141.
6. Ansorg, R, Von Recklinghausen, G, Pomarius, R and Schmid, EN. Evaluation of techniques for
isolation, subcultivation and preservation of Helicobacter pylori. J. Clin. Micro. (1991), 29:51 53.
7. Pronovost, AP, Rose, SL, Pawlak, J, Robin, H and Schneider, R. Evaluation of a new
immunodiagnostic assay for Helicobacter pylori antibody detection: Correlation with histopathological
and microbiological results. J. Clin. Micro. (1994), 32: 46-50.
8. Megraud, F, Bassens-Rabbe, MP, Denis, F, Belbouri, A and Hoa, DQ. Seroepidemiology of
Campylobacter pylori infection in various populations. J. Clin. Micro. (1989), 27: 1870-3.
Klinikai érzékenység, specificitás és pontosság
Precíziós
Intra-assay
Inter-assay
Keresztreaktivitás
Interferáló anyagok
Szám: Felülvizsgálat dátuma:
 Loading...
Loading...