Page 1
D-Dimer-Testkassette
REF FI-DDM-402
Deutsch
Konzentration
Klinische Bewertung
< 0,5 mg/L
Gesund
0,5–1,5 mg/L
Niedriges Risiko von DVT und PE
1,5–3 mg/L
Moderates Risiko von DVT und PE
3–5 mg/L
Hohes Risiko von DVT und PE
> 5 mg/L
Hohes Risiko von DVT und PE (erhöhte Mortalität)
Bedeutung der Symbole
Bei beschädigter
verwenden
Hangzhou AllTest Biotech Co., Ltd.
MedNet EC-REP GmbH
Borkstrasse 10
48163 Muenster
Germany
(Vollblut/Plasma)
Packungsbeilage
Ein Schnelltest zum Messen von D-Dimer in Vollblut oder Plasma anhand des
Fluoreszenz-Immunassay-Analysators. Nur zur professionellen In-vitro-Dia gnostik.
【
VERWENDUNGSZWECK】
Die D-Dimer-Testkassette (Vollblut/Plasma) ist ein Fluoreszenz-Immunassay zum Messen von D-Dimer in
Vollblut oder Plasma als Unterstützung zur Diagnose von DVT (Deep Vein Thrombosis, Thrombose tiefer
Venen) und PE (Pulmonary Embolism, Lungenembolie).
【
ZUSAMME NFASSUNG】
D-Dimer ist ein Fibrin-Abbauprodukt (FDP, Fibrin Degradation Product), ein kleines Proteinfragment im
Blut nach dem Abbau eines Blutgerinnsels durch Fibrinolyse. Die Bildung oder Erhöhung von D-Dimer
weist auf eine Aktivierung des Gerinnungs- und Fibrinolysesystems hin. Der Plasmaspiegel von D-Dimer
kann die Produktion von Thrombin-aktivierendem Fibrin in vivo repräsentieren. D-Dimer kann als Indikator
für Thrombosen im Körper genutzt werden. Der D-Dimer-Spiegel ist bei Thrombosepatienten signifikant
1
erhöht.
Darüber hinaus haben Studien gezeigt, dass niedrige D-Dimer-Spiegel (0,1–0,5 mg/L) eng mit dem
Auftreten von Herz-Kreislauf -Erkrankungen zusammenhängen, und hohe D-Dimer-Spiegel können
Frühindikatoren für eine Ausschlussdiagnostik von DVT und PE sein.
【
TESTPRINZIP】
Die D-Dimer-Testkassette (Vollblut/Plasma) ermittelt D-Dimer anhand eines Fluoreszenz-Immunassays.
Die Probe durchwandert den Streifen vom Probenahmefeld zum Absorptionsfeld. In der Probe
vorhandenes D-Dimer bindet mit den Anti-D-Dimer-Antikörpern, mit denen die fluoreszierenden
Mikrosphären markiert sind. Anschließend wird der Komplex von den auf die Nitrozellulosemembran
(Testlinie) aufgebrachten Fänger-Antikörpern erfasst. Die D-Dimer-Konzentration in der Probe korreliert
mit der Intensität des Fluoreszenzsignals der auf der T-Linie „gefangenen“ Mikrosphären. Anhand der
Intensität des Fluoreszenzsignals des Tests und der Kalibrierungskurve kann der Analysator die
D-Dimer-Konzentration in der Probe berechnen.
【
REAGENZIEN】
Der Test enthält mit Anti-D-Dimer-Antikörpern beschichtete Fluorophore und eine mit
Anti-D-Dimer-Antikörpern beschichtete Membran.
【
VORSICHTSMASSNAHMEN】
1. Nur zur professionellen In-vitro-Diagnostik.
2. Nach Ablauf des auf der Verpackung angegebenen Verfallsdatums nicht mehr verwenden. Tests mit
beschädigter Folienverpackung nicht verwenden. Zum Einmalgebrauch.
3. Für jede Probe einen neuen Probensammelbehälter verwenden, um Kreuzkontaminationen zu
vermeiden.
4. In Bereichen, in denen Probenmaterial und/oder Tests gehandhabt werden, nicht trinken, essen oder
rauchen. Sämtliche Probenmaterialien sind als infektiöse Substanzen zu handhaben. Bei allen
Abläufen sind die vorgeschriebenen Vorsichtsmaßnahmen gegen mikrobiologische Gefahren und die
Standardverfahren zur ordnungsgemäßen Entsorgung von Probenmaterialien einzuhalten. Beim
Testen der Proben ist Schutzkleidung, wie Laborkittel, Einmalhandschuhe und Schutzbrille, zu tragen.
5. Reagenzien aus verschiedenen Chargen dürfen nicht untereinander ausgetauscht oder miteinander
vermischt werden.
6. Luftfeuchtigkeit und Temperatur können die Testergebnisse verfälschen.
7. Die Entsorgung sämtlicher Materialien im Zusammenhang mit diesem Test hat entsprechend den
örtlich geltenden Gesetzen und Bestimmungen zu erfolgen.
8. Vor Verwenden von Tests stets die Gebrauchsanweisung aufmerksam und vollständig durchlesen.
9. Die D-Dimer-Testkassette darf nur zusammen mit dem Analysator und ausschließlich von
entsprechend zugelassenen medizinischen Fachkräften verwendet werden.
【
LAGERUNG UND HALTBARKEIT】
1. Das Kit kann bis zum auf der versiegelten Folienverpackung aufgedruckten Verfallsdatum bei 4 bis
30 °C Celsius gelagert werden.
2. Der Test ist bis zum Gebrauch in der versiegelten Folienverpackung aufzubewahren.
3. Nicht tiefkühlen.
4. Es ist sicherzustellen, dass sämtliche Komponenten des Kits vor Kontamination geschützt sind. Kits
mit Anzeichen von mikrobiellen Kontaminationen oder Ausfällungen nicht mehr verwenden.
Biologisch kontaminierte Dispenser, Behälter und Reagenzien können zu falschen Ergebnissen
führen.
【
PROBENAHME UND VORBEREITUNG】
Vorbereitung
Vor der Durchführung des Tests sicherstellen, dass alle Komponenten Raumtemperatur (15–30 °C)
angenommen haben. Eine zu kalte Pufferlösung oder Kondensat von Feuchtigkeit auf der Membran
können zu ungültigen Testergebnissen führen.
Handhabung der Proben
1. Probenmaterial entsprechend den Standardverfahren entnehmen.
So entnehmen Sie Vollblutproben aus der Fingerbeere:
Waschen Sie die Hand des Patienten mit Seife und warmem Wasser oder reinigen Sie sie mit
einem Alkoholtupfer. Trocknen lassen.
Massieren Sie die Hand, ohne die Einstichstelle zu berühren, indem Sie die Hand in Richtung der
Fingerkuppe des Mittel- oder Ringfingers reiben.
Punktieren Sie die Haut mit einer sterilen Lanzette. Wischen Sie die ersten Anzeichen von Blut
weg.
Reiben Sie die Hand sanft vom Handgelenk über die Handfläche bis zum Finger, um einen
abgerundeten Blutstropfen über der Einstichstelle zu bilden.
2. Proben nicht für längere Zeit bei Raumtemperatur stehen lassen. Plasmaproben können bei 2–8 °C
bis zu 12 Stunden lang gelagert werden. Wenn eine längere Lagerung vorgesehen ist, muss die
Probe bei unter -20 °C aufbewahrt werden. Durch Venenpunktion gewonnenes Vollblut muss bei 2–
8 °C gelagert werden, wenn der Test innerhalb von 12 Stunden nach der Probenahme vorgenommen
werden soll. Vollblutproben dürfen nicht eingefroren werden. Aus der Fingerbeere gewonnenes
Vollblut ist unverzüglich zu testen.
3. Die Proben vor dem Test auf Raumtemperatur bringen. Tiefgekühlte Proben müssen vor dem Te st
vollständig aufgetaut und gut durchgemischt werden. Wiederholtes Einfrieren und Auftauen von
Proben ist zu vermeiden.
4. EDTA K2, Heparin-Natrium, Natriumcitrat und Kaliumoxalat können als Antikoagulans für die
Probenentnahme verwendet werden.
Probenverdünnung/Probenstabilität
1. Die Probe kann mittels Mikropipette direkt in den Puffer gegeben werden.
2. Das Röhrchen schließen und die Probe ca. 10 Sekunden lang kräftig schütteln, damit sich Probe und
2
Verdünnungspuffer gut durchmischen.
3. Die verdünnte Probe ca. 1 Minute lang homogenisieren lassen.
4. Die verdünnte Probe am besten auf einen Eisbeutel platzieren und nicht länger als 8 Stunden bei
Raumtemperatur ruhen lassen.
【
MATERIALIEN】
• Testkassetten • Probensammelröhrchen mit Verdünnungspuffer
• ID-Karte • Packungsbeilage
• Tropfpipetten • Lanzetten
• Zeitmesser • Zentrifuge • Fluoreszenz-Immunassay-Analysator
• Pipette • Probensammelbehälter
【
GEBRAUC HSANWEISUNG】
Ausführliche Anweisungen zur Verwendung des Tests finden Sie in der Bedienungsanleitung des
Fluoreszenz-Immunassay-Analysators. Der Test ist bei Raumtemperatur auszuführen.
Warten Sie vor dem Test, bis Test, Probe und/oder Kontrollen Raumtemperatur (15–30 °C) erreicht
haben.
1. Analysator einschalten. Dann je nach Bedarf Modus „Standard test“ (Standardtest) bzw.
„Quick test“ (Schnelltest) auswählen.
2. ID-Karte aus dem Kit entnehmen und in den Kartenschacht am Analysator einführen.
3. Zur Verwendung einer Pipette: 10 μL Probe in das Pufferröhrchen pipettieren; Probe und Puffer
gut mischen.
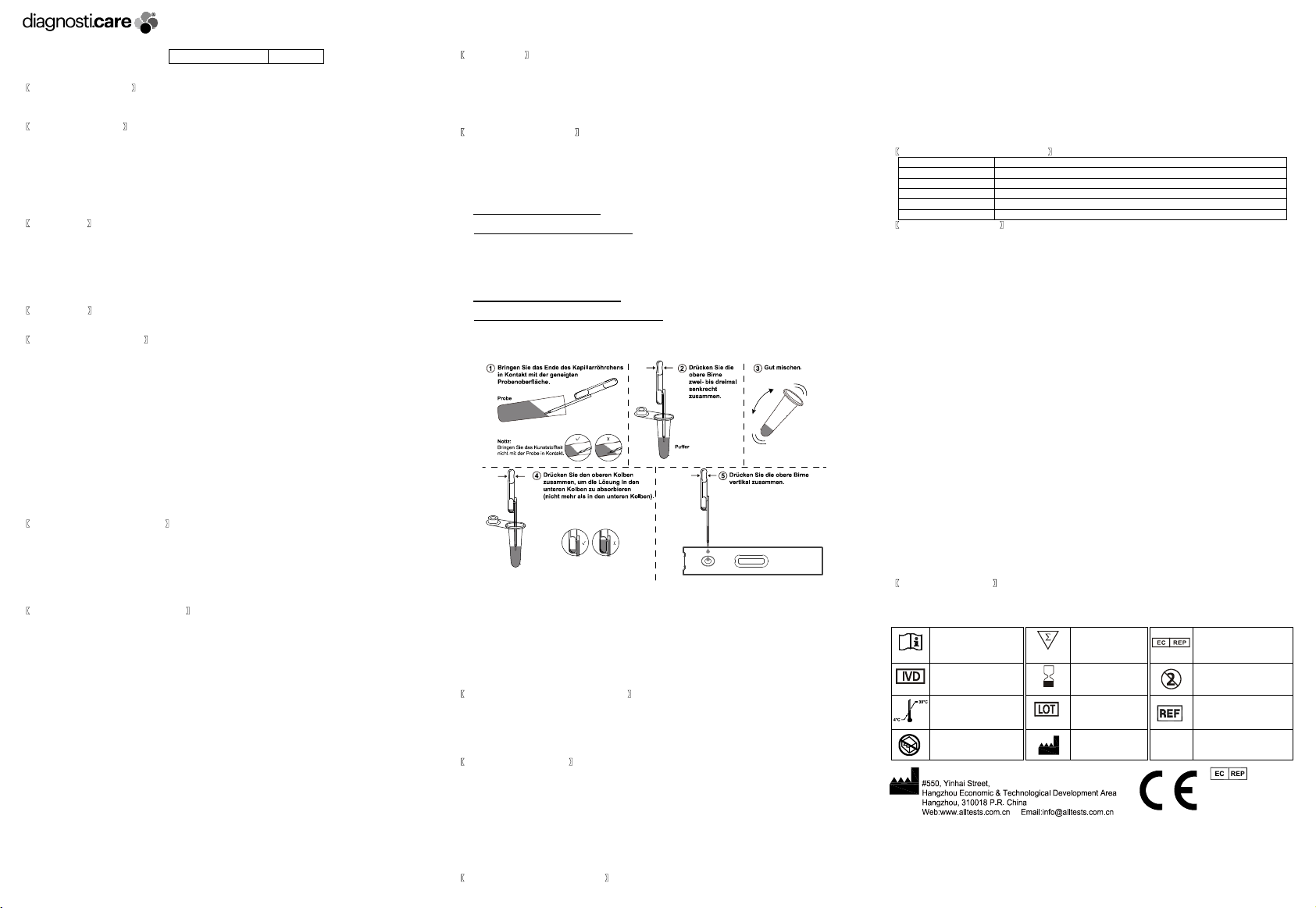
So verwenden Sie einen Tropfpipetten: Bringen Sie das Ende des Glaskapillarröhrchens in Kontakt
mit der Oberfläche der flüssigen Probe, ohne den Tropfer zusammenzudrücken. Die flüssige Probe
wandert automatisch in das Kapillarröhrchen. Hinweis: Stellen Sie sicher, dass der Kunststoffteil des
Tropfers nicht mit der Probe in Kontakt kommt.
Lassen Sie dann die Probe in das Pufferröhrchen frei, indem Sie den Ballon am oberen Ende der
Pipette vertikal zusammendrücken. Waschen Sie das Röhrchen 2-3 Mal, indem Sie den oberen
Kolben zusammendrücken. Probe und Puffer gut mischen.
4. Zur Verwendung einer Pipette: Pipettieren Sie 75 μL der verdünnten Probe in die
Probenvertiefung der Kassette. Starten Sie gleichzeitig den Timer.
So verwenden Sie einen Tropfpipetten: Tauchen Sie das Ende des Röhrchens
(Kunststoffröhrchen) in die verdünnte Probe; Drücken Sie den oberen Kolben zusammen, um die
Lösung in den unteren Kolben zu absorbieren (nicht mehr als in den unteren Kolben).
Drücken Sie den oberen Kolben vertikal zusammen, um die verdünnte Lösung in die
Probenvertiefung der Testkassette freizusetzen, und starten Sie den Timer.
5. Der Fluoreszenz-Immunassay-Analysator verfügt über zwei Testmodi: Modus
„Standard test“ (Standardtest) und Modus „Quick test“ (Schnelltest). Weitere Informationen finden Sie
in der Bedienungsanleitung des Fluoreszenz-Immunassay- Analysators.
Modus „Quick test“ (Schnelltest): 15 Minuten nach Zugabe der Probe Testkassette in den Analysator
legen, auf „QUICK TEST“ (SCHNELLTEST) tippen, Angaben zum Test eingeben und sofort auf
„NEW TEST“ (NEUER TEST) tippen. Nach einigen Sekunden zeigt der Analysator das Testergebnis
automatisch an.
Modus „Standard test“ (Standardtest): Testkassette unmittelbar nach Zugabe der Probe in den
Analysator legen, auf „STANDARD TEST“ (STANDARDTEST) tippen, Angaben zum Test eingeben, und
sofort auf „NEW TEST “ (NEUER TEST) tippen. Der Analysator startet automatisch einen Countdown vo n
15 Minuten. Nach Ablauf des Countdowns zeigt der Analysator das Ergebnis an.
【
INTERPRETATION VON ERGEBNISSEN】
Vom Fluoreszenz-Immunassay-Analysator ermittelte Ergebnisse:
Das Ergebnis der D-Dimer-Tests wird vom Fluoreszenz-Immunassay-Analysator berechnet und auf dem
Display angezeigt. Weitere Informationen finden Sie in der Bedienungsanleitung des
Fluoreszenz-Immunassay-Analysators.
Der Linearitätsbereich des D-Dimer-Tests erstreckt sich von 0,1 bis 10 mg/L.
Referenzbereich: < 0,5 mg/L
【
QUAL ITÄTSKONTROL LE】
Jede D-Dimer-Testkassette enthält eine interne Kontrolle, die den Anforderungen einer routinemäßigen
Qualitätskontrolle entspricht. Diese interne Kontrolle wird bei jedem Test einer Patientenprobe ausgeführt.
Diese Kontrolle zeigt an, dass das Testprodukt korrekt in den Fluoreszenz-Immunassay-Analysator
eingesetzt und von diesem korrekt gemessen wurde. Liefert die interne Kontrolle ein unzulässiges
Ergebnis, zeigt der Fluoreszenz-Immunassay-Analysator eine Meldung an, die darauf hinweist, dass der
Test wiederholt werden sollte. Bei einem unzulässigen Ergebnis der internen Kontrolle zeigt der
Fluoreszenz-Immunassay-Analysator eine Meldung „N/A“ (Nicht verwendbar) an. In den meisten Fällen
liegt dies an einem unzureichenden Volumen der Probe oder an einer nicht korrekten Ausführung des
Tests. Lesen Sie sich die Testanleitung erneut durch, und wiederholen Sie das Verfahren mit einem neuen
Test. Wenn das Problem erneut auftritt, verwenden Sie das Test-Kit nicht weiter, und kontaktieren Sie
Ihren lokalen Händler.
【
EINSCHRÄNKUNGEN DES TESTS】
1. Die D-Dimer-Testkassette (Vollblut/Serum/Plasma) ist ein In-vitro-Diagnostikum zu Händen von
Benötigte Materialien, die nicht im Lieferumfang enthalten sind
Materialien im Lieferumfang
Fachleuten und ausschließlich für den quantitativen Nachweis von D-Dimer vorgesehen.
2. Die D-Dimer-Testkassette (Vollblut/Plasma) gibt nur an, ob in der Probe D-Dimer enthalten ist. Dieser
Test darf daher nicht als alleiniges Kriterium für die Beurteilung von DVT und PE verwendet werden.
3. Wie bei allen anderen Diagnosetests auch, darf eine bestätigte Diagnose nur von einem Arzt unter
Berücksichtigung aller sonstigen klinischen und Laborbefunde gestellt werden.
4. Hohe D-Dimer-Konzentrationen können zu einem High -Dose-Hook-Effekt führen, was zu einer
Fehlinterpretation der D-Dimer-Spiegel führen kann. Bei diesem Test wurde bisher bei
D-Dimer-Spiegeln bis zu 10 mg/L kein High-Dose-Hook-Effekt beobachtet.
5. Der Hämatokrit-Spiegel von Vollblut sollte zwischen 25 % und 65 % liegen.
6. Die Ergebnisse der D-Dimerim Probenmaterial gewonnen. Diese Ergebnisse sollten nicht als alleiniges Kriterium für
Behandlungsentscheidungen herangezogen werden. Bei positiven Ergebnissen wird empfohlen,
weitere klinische Befunde einzuholen und noch andere Tests vorzunehmen, damit eine sachgerechte
medizinische Behandlung gegeben ist.
【
VORAUSSICHTLICHE ERGEBNISSE】
【LEIST UNGSMERKMALE】
1. Genauigkeit
Die Abweichung der Testergebnisse beträgt ≤ ±15 %.
2. Sensitivität
Die D-Dimer-Testkassette (Vollblut/Plasma) kann D-Dimer-Spiegel bis zu 0,1 mg/L in Vollblut oder Plasma
nachweisen.
3. Nachweisbereich
0,1–10 mg/L
4. Linearitätsbereich
0,1–10 mg/L; R ≥ 0,990
5. Präzision
Präzision innerhalb von Proben
Die Präzision bei wiederholter Analyse ein und derselben Proben wurde anhand von 10 Replikaten von
2 Probenmaterialien mit einer D-Dimer-Konzentration von 0,1 mg/L bzw. 0,5 mg/L ermittelt. Es ergab sich
ein Variationskoeffizient von ≤ 15 %.
Präzision über Proben hinweg
Die Präzision bei wiederholter Analyse verschiedener Proben wurde anhand von jeweils 10 Replikaten
dreier Probenchargen von 2 Probenmaterialien mit einer D-Dimer-Konzentration von 0,1 mg/L bz w.
0,5 mg/L ermittelt. Es ergab sich ein Variationskoeffizient von ≤ 15 %.
6. Kreuzreaktivität
Es wurden Studien zu Kreuzreaktivität mit folgenden Analyten durchgeführt:
HBsAg, HBsAb, HBeAg, HBeAb, HBcAb, Anti-Syphilis-IgG, Anti-HIV-IgG, Anti-H.pylori-IgG,
Anti-MONO-IgM, Anti-Röteln-IgG, An ti-Röteln-IgM, Anti-CMV-IgG, Anti-CMV-IgM, Anti-Tox o-IgG und
Anti-Tox o-IgM positive Proben. Die Ergebnisse zeigten keine Kreuzreaktivität.
7. Störsubstanzen
D-Dimer-negativen bzw. D-Dimer-positiven Proben wurden die folgenden potenziellen Störsubstanzen
zugegeben.
Acetaminophen: 20 mg/dL Koffein: 20 mg/dL
Acetylsalicylsäure: 20 mg/dL Gentisinsäure: 20 mg/dL
Ascorbinsäure: 20 mg/dL Albumin: 10.500 mg/dL
Kreatin: 200 mg/dL Hämoglobin: 1.000 mg/dL
Bilirubin: 1.000 m/dL Oxalsäure: 600 mg/dL
Cholesterin: 800 mg/dL Triglyceride: 1.600 mg/dL
Keine der Substanzen verfälschte in der angegebenen Konzentration die Testergebnisse des Assays.
8. Vergleich mit anderen Methoden
Die Ergebnisse des D-Dimer-Assays von 90 Proben wurden mit den Ergebnissen mit ADVIA2400
verglichen. Der Korrelationskoeffizient (R) beträgt 0,983.
【
LITERATURANGABEN】
1. Adam S S, Key N S, Greenberg C S. D-dimer antigen: current concepts and future prospects[J].
Blood, 2009, 113(13):2878.
2. General Practice Notebook > D-dimer. Retrieved September 2011.
Gebrauchsan-
weisung beachten
In-vitro-
Diagnostikum
Bei 4–30 °C
lagern
Verpackung nicht
Hinweis: Informationen zum Hersteller von Lancet befinden sich auf dem Etikett.
Vertrieben in Italien durch PM2 Services Srl, Corso Mazzini 38- Largo Marchi, 36071 Arzignano (VI) info@pm2services.it
Testkassette werden anhand der Messung der D-Dimer-Konzentration
Ausreichend für
<n> Prüfungen
Verwendbar bis
Chargennummer
Nummer: F145107100
Revisionsdatum: 2022-09-22
Hersteller
Bevollmächtigter
Nicht wiederverwenden
Artikelnummer
 Loading...
Loading...