Page 1

使用说明书
2×AllinOneTM Q-PCR Mix ROX+(for ABI)
产品套装编号:D0102A
GeneCopoeia
Expressway to Discovery
GeneCopoeia Inc.
19520 Amaranth Drive
Germantown, Maryland 20874
USA
Tel: 301-515-6982; 1-866-360-9531
Fax: 301-515-6983
Web: www.genecopoeia.com
TM
产品内容
2×AllinOneTM Q-PCR Mix ROX
ddH2O(PCR Grade)
产品编号
+
D01020A
C10030A
包装规格
1 ml×2(20 µl反应×200次)
1 ml×2
储存条件:-20℃保存
产品概述
■
用试剂,产品中包含有DNA聚合酶、反应Buffer、dNTP、SYBR Green I和ROX。使用时只需加入
模板和引物即可在ABI仪器上进行Real-Time PCR 实验,操作非常方便快捷。
产品原理
■
注意事项
■
:
本产品是采用PCR技术结合SYBR Green I嵌合荧光法进行荧光定量PCR(Real-Time PCR)的专
本产品主要适用于市场上需要ROX校正的ABI 公司的 Real-Time PCR仪。
:
1.PCR技术
本产品中的DNA聚合酶是经特殊修饰的 DNA 聚合酶,此热启动酶结合优化的反应Buffer 能
有效地抑制非特异扩增产物的产生,极大地提高了PCR的扩增效率及其检测灵敏度。
2.SYBR Green I 嵌合荧光
SYBR Green I 是一种荧光染料,能特异地掺入到双链DNA分子的小沟部位,发出荧光信
号。在PCR 反应体系中,SYBR Green I 染料与DNA双链分子结合发出荧光,通过检测反应进
程中SYBR Green I的荧光强度,达到检测PCR产物扩增量的目的。同时在PCR结束后可以直接
进行融解曲线分析,从而判断是否存在着变异或非特异性扩增产物。
:
1.此产品应在-20℃避光保存,
2.使用前请缓慢颠倒混匀试剂,避免起泡,并经短暂离心后再使用。
3.配制PCR反应液时请使用PCR级水,同时避免强光照射。
4.为尽可能减少核酸扩增污染,请严格遵守标准的PCR流程。
避免在4℃或室温存放。
操作说明
■
:
1. 取出2×AllinOne
2. PCR反应液配制说明(例)(冰上操作)
TM
Q-PCR Mix ROX+,上下轻缓颠倒混匀,在配制前进行短暂离心。
试剂组分
2×AllinOneTM Q-PCR Mix ROX
PCR Forward Primer(4 µM)
PCR Reverse Primer(4 µM)
ddH2O(PCR Grade)
Template
Total Volume
体积
+
10 µl
2 µl
2 µl
1 µl
5 µl
20 µl
终浓度
1×
0.4 µM
0.4 µM
Page 2
※
将2×AllinOneTM Q-PCR Mix ROX+设定为总反应体积的一半,其它组分请按最适当比例调整。
如果要变更总反应体积,请保持最适条件下各组分的比例。
※
引物是Real-Time PCR的重要因素,在引物设计时,建议使用Oligo、Primer Premier等引物
设计软件。在PCR反应时,引物浓度通常在0.2 µM至0.6 µM范围内调整,一般浓度为0.4 µM
时能得到较好的结果。扩增效率不高时,可适当增加引物用量,但引物太多,可能会导致非特异
性扩增产物增加。
※
DNA模板的添加量通常在100 ng以下,因不同种类的DNA模板中含有的靶基因拷贝数不同,必
要时可以进行梯度稀释,确定最佳的DNA模板添加量。如使用反转录cDNA作为模板,请稀释后
再使用。原液也可以用,但cDNA反转录体系对定量可能会产生影响。
3. 充分混匀PCR反应液,添加至PCR反应管或反应板中,并进行短暂离心
,确保所有试剂流到反应
管底部。
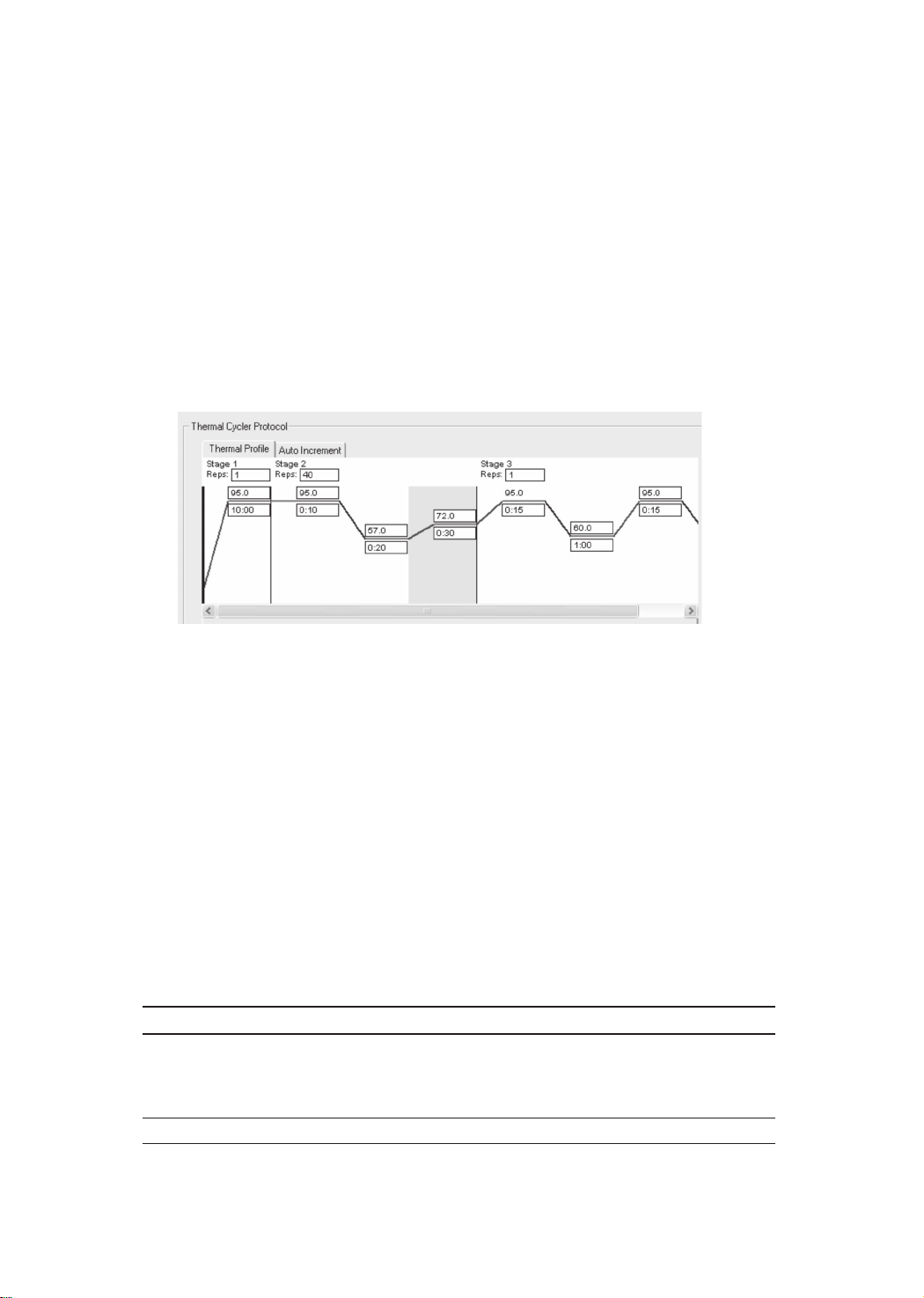
4. PCR反应,建议使用如下图所示的PCR反应程序及其融解曲线分析程序。
※
产品采用的DNA聚合酶为经过特殊修饰的热启动酶,需要95℃ 10 min充分激活酶活性。
※
PCR反应程序建议使用标准的三步法,同时荧光检测建议设定在PCR延伸过程中。
※
退火温度应该结合引物的Tm在55℃~60℃进行调整。引物结合的最佳值可能超出此范围,可以
根据实际情况进行调整。
※
Real-Time PCR扩增的片段最佳长度为80~150 bp,可以适当延长至300 bp。
※
融解曲线分析的起始温度值可以在60~80℃范围内适当调整。
数据分析
■
:
根据实验设计进行必要的数据分析,具体操作参考所使用仪器的说明书。
实验示例
■
:
1. 实验目的:通过梯度稀释质粒DNA,制作标准曲线,来判定2×AllinOne
的扩增效率及其检测灵敏度,其中检测片段长度为102 bp。
2. 使用仪器:ABI PRISM 7300
3. 操作流程:
1) 将质粒按10的倍数稀释成10
5
分子/µl ~ 1分子/µl共6个浓度梯度。
2) 配制PCR反应液(冰上操作)
试剂组分
2×AllinOneTM Q-PCR Mix ROX
PCR Forward Primer(4 µM)
PCR Reverse Primer(4 µM)
O(PCR Grade)
ddH
2
反应液mix
+
体积
10 µl
2 µl
2 µl
1 µl
15 µl
TM
Q-PCR Mix ROX
+
Page 3

3) 充分混匀PCR反应液mix,短暂离心后添加至PCR反应管中。
4) 添加稀释后的质粒模板5µl至各个反应管中,阴性对照使用5µl的灭菌水代替DNA质粒模板。
5) 设置PCR反应条件及其融解曲线读取条件:
循环数
1
40
步骤 温度 时间 检测
预变性
变性
退火
延伸
融解曲线读取
冷却
95℃
95℃
57℃
72℃
60℃~95℃
40℃
6) 实验结束后,分析扩增曲线及其融解曲线:
梯度稀释的质粒DNA扩增曲线
7) 由各扩增曲线所得到的Ct值,进行标准曲线的制作。
10 min
10 sec
20 sec
30 sec
1 min
扩增产物融解曲线峰
off
off
off
on
on
off
标准曲线图
8) 实验结论
从扩增曲线及其融解曲线分析可知,以质粒DNA为模板,可以检测到低至5个分子的拷贝数,
产物单一,说明2×AllinOne
TM
Q-PCR Mix ROX+具有极高的检测灵敏度;同时从标准曲线可以
看出其检测的各个浓度间线性关系良好,说明其具有优良的扩增效率。
Page 4

问题分析
■
:
1. 扩增曲线混乱
※ 荧光检测温度设置不当,请调整到合适的荧光检测温度。
※ 样品位置设定错误,请设定正确的样品位置再进行分析。
※ PCR循环条件、引物浓度、序列等不恰当,请调整引物浓度、退火温度。扩增不好时,应尝试降
低退火温度或提高引物浓度,仍不能改善建议重新设计引物。
※ 样品纯度不好,应对样品进行苯酚抽提或乙醇沉淀等方法进行纯化处理,如果样品为cDNA,最
好稀释后再用,因为反转录体系对PCR有一定的影响。
※ 是否在程序中选择了ROX做参比荧光,而添加的试剂为不含ROX的Q-PCR Mix。
2. 定量值重现性差
※ 仪器故障,因为仪器的不适用,在温度的管理或检测方面重现性差,应根据相应仪器的说明书进
行检测。
※ 样品纯度不好,不纯的样品会导致实验的重复性差,应使用纯化过的DNA样品,并在使用前充
分混匀样品,对于cDNA样品,最好稀释后再用。
※ PCR循环条件、引物浓度、序列
等不恰当,扩增效率差的PCR容易产生重现性差的结果,请调整
引物浓度、退火温度来提高扩增效率,扩增不好时,应尝试降低退火温度或提高引物浓度,仍不
能改善建议重新设计引物。
3. 融解曲线异常
※ 空白样品中有信号
A)如果空白对照所对应融解曲线的Tm与阳性对照一致,说明PCR反应体系可能有污染或其
为阳性样品,为此应首先排除其是否为加样误差,如仍有相同情况,应更换PCR级水、引物或启
用新的Q-PCR Mix。
B)如果空白对照所对应融解曲线的Tm值比阳性对照低,说明可能产生了引物二聚体等的非
特异性扩增,为此建议PCR反应体系应在冰上配置,并提高荧光检测温度,如不能改善,请重新
设计引物。
※ 阳性对照的融解曲线出现双峰或多峰。
阳性对照的融解曲线出现双峰或多峰,说明其有非特异性扩增产生。建议PCR反应体系应在冰上
配置,并提高退火温度,如不能改善,请重新设计引物。
该产品仅限于实验科学研究用,若有任何单位或个人将该产品用于临床诊断、治疗等其他国家专门规定的特殊用途,本公司概不承
担任何责任。
地址:广州高新技术产业开发区广州科学城掬泉路3号广州国际企业孵化器D区8楼,510663
客服电话:020-32068595 电子信箱:support@fulengen.com 网址:www.fulengen.com
 Loading...
Loading...